Способ экстракции белка - RU2733495C2
Код документа: RU2733495C2
Чертежи
Описание
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет австралийской предварительной заявки на патент № 2013903669 «Способ экстракции белка», поданной 24 сентября 2013 г. Полное содержание этой заявки включено в настоящий документ в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам экстракции белков из микроорганизмов.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Микроорганизмы обеспечивают возможность получать рекомбинантные белки на высоком уровне в относительно короткие промежутки времени. Кроме того, многие микроорганизмы могут быть генетически модифицированы для относительно упрощенной экспрессии целевого белка на высоком уровне. Соответственно, микроорганизмы являются одними из типов клеток выбора с целью производства белков для промышленного применения, например, для применения в терапевтических или диагностических или косметических целях.
Для многих областей применения белки, экспрессирующиеся в микроорганизмах, должны быть экстрагированы и очищены, по крайней мере, до некоторой степени. Для очистки этих белков, как правило, необходимо лизировать клетки, используя способы, известные в данной области техники, такие как гомогенизация или химический лизис. Тем не менее, выделение белков этими способами также приводит к выделению большого числа дополнительных белков, а также нуклеиновых кислот, липидов, эндотоксинов и других клеточных компонентов из микроорганизма. В частности, это имеет место в случае очистки белков, которые растворимы в микроорганизме в отличие от белков, входящих в состав агрегатов или телец включения, поскольку многие из посторонних примесей также являются растворимыми в микроорганизме. Эти примесные белки и другие вещества, как правило, экстрагируются вместе с целевым белком. Соответственно, целевой белок должен затем быть очищен для удаления этих примесей. Более высокие концентрации примесей могут потребовать большего числа стадий очистки и/или реагентов, что приводит к увеличению стоимости получения очищенного белка.
В общепринятых способах экстракции белка также, как правило, используют органические растворители, которые являются дорогостоящими и зачастую сильно горючими, что требует специального оборудования для изоляции, обеспечения огнестойкости, взрывозащите и обезвреживания. Соответственно, желательно не использовать такие растворители, в частности, при очистке больших количеств белка.
Использование агрессивных органических растворителей также может потребовать специального оборудования, которое не подвергается повреждению или коррозии во время процесса экстракции. Альтернативно, оборудование, используемое в способе экстракции, необходимо регулярно менять из-за повреждения/коррозии.
В некоторых способах экстракции белка из микроорганизмов также используют ферменты, такие как лизоцим. Однако эти способы трудно использовать для экстракции белков из большого количества клеток, так как добавление лизоцима является неэффективным, и трудно распределить фермент по всему большому осадку клеток.
Специалисту в данной области техники является очевидным из вышеизложенного, что требуются способы, которые обеспечивают возможность экстракции белка из микроорганизма и снижают уровень контаминации нуклеиновыми кислотами и/или липидами и/или эндотоксинами и/или другими клеточными белками из клетки. Желательно, чтобы способ обеспечивал возможность экстрагировать белок в растворимой форме, в то время как контаминирующие вещества оставались бы в осажденной форме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее описание изобретения основано на разработке авторами изобретения способа, который обеспечивает возможность экстракции белков, например, растворимых белков из микроорганизмов, в котором белки остаются растворимыми, в то время как значительное количество эндогенных белков, нуклеиновых кислот и/или липидов из микроорганизма осаждаются. Способ обеспечил возможность авторам изобретения экстрагировать растворимые белки более высокой степени чистоты по сравнению с некоторыми другими способами, при этом экстрагируя такие же уровни белка как в этих способах. Таким образом, способ, разработанный авторами изобретения, облегчает последующие стадии очистки путем выделения белка с высоким выходом белка со сниженным уровнем контаминации. В качестве примера в настоящем документе авторы изобретения использовали несколько карбоновых кислот для экстракции растворимых белков из бактерий, например, Escherichia coli. Эти результаты используются в качестве модели для микроорганизмов в целом.
В одном примере авторы изобретения экстрагировали растворимый белок высокой степени чистоты, используя достаточно низкую концентрацию карбоновой кислоты (например, менее приблизительно 50% карбоновой кислоты), а значит способ может быть осуществлен со стандартным оборудованием. Некоторые примеры способа, разработанного авторами изобретения, позволяют экстрагировать белок, подлежащий нанесению непосредственно на фильтр, например, фильтрационную мембрану, обычно используемую в тангенциальной поточной фильтрации или глубокой фильтрации без необходимости добавления буфера для снижения риска повреждения фильтра. Авторы изобретения также обнаружили, что увеличение концентрации карбоновой кислоты (например, уксусной кислоты) выше приблизительно 37% или 50% или 62% снижает чистоту белка, например, до уровня, меньшего такового, чем при экстракции белка приблизительно 25% кислоты. В связи с этим, применение раствора, содержащего приблизительно 25% карбоновой кислоты, обусловливает высокую степень чистоты. Экстракция с использованием раствора, содержащего карбоновую кислоту, на 100% приводит к получению достаточно чистого белка для дальнейшей очистки, однако этот белок обладал той же степенью чистоты по сравнению с белком, экстрагированным раствором, содержащим карбоновую кислоту в концентрации приблизительно 25%.
В другом примере авторы изобретения обнаружили, что экстракция белка с использованием карбоновой кислоты в концентрации в диапазоне приблизительно от 25% до приблизительно 100% в течение более чем приблизительно, например, 20 минут или 30 минут, мало влияет на количество экстрагируемого белка. Таким образом, авторы изобретения установили, что экстракция может быть выполнена в течение относительно короткого периода времени (при необходимости).
Из вышесказанного очевидно, что авторы изобретения продемонстрировали возможность экстракции растворимого белка карбоновой кислотой, которая является недорогой и которая не требует специального оборудования для обработки, хранения и/или утилизации. Иллюстративной карбоновой кислотой, используемой автором изобретения, является уксусная кислота.
Автор изобретения показал, что этот способ эффективен в широком диапазоне концентраций карбоновой кислоты. Авторами изобретения также было показано, что количество экстрагированного белка и/или чистота экстрагированного белка могут быть улучшены за счет увеличения отношения объема кислоты к массе микроорганизмов.
Способы, разработанные авторами изобретения, не обязательно требуют специализированного оборудования, например, гомогенизаторов или ультразвуковых диспергаторов, или агрессивных органических растворителей или ферментов, таких как лизоцим, для экстракции растворимого белка.
Данные, полученные авторами изобретения, обеспечивают основу для способов экстракции растворимых белков из микроорганизмов, а также способы очистки белков для использования у человека или отличных от человека животных.
На основании вышеизложенного, в настоящем изобретении представлен способ экстракции растворимого белка из популяции микроорганизмов, включающий взаимодействие популяции микроорганизмов, экспрессирующих растворимый белок, с раствором, содержащим количество карбоновой кислоты, эффективное для экстракции растворимого белка из популяции микроорганизмов.
В одном из примеров карбоновая кислота представляет собой уксусную кислоту.
В одном из примеров популяция микроорганизмов взаимодействует с раствором в течение времени, достаточного для экстракции растворимых белков. Например, популяция микроорганизмов взаимодействует в течение менее приблизительно 48 часов или 24 часов или 20 часов, например, менее приблизительно 12 часов, например, менее приблизительно 8 часов или 6 часов. Например, популяция микроорганизмов взаимодействует в течение менее приблизительно 2 часов или 1 часа, например, в течение диапазона приблизительно от 20 минут до 1 часа.
В настоящем изобретении представлен способ экстракции растворимого белка из популяции микроорганизмов, включающий взаимодействие популяции микроорганизмов, экспрессирующей растворимый белок с количеством раствора, содержащим приблизительно от 1% (объем/объем) до приблизительно 100% (объем/объем) карбоновой кислоты, эффективной для экстракции растворимого белка из популяции микроорганизмов. Например, раствор содержит приблизительно от 1% до приблизительно 90% или 80% или 70% или 60% или 50% карбоновой кислоты. Например, раствор содержит приблизительно от 10% до приблизительно 90% или 80% или 70% или 60% или 50% карбоновой кислоты. Например, раствор содержит приблизительно от 20% до приблизительно 90% или 80% или 70% или 60% или 50% карбоновой кислоты. В некоторых примерах способ включает взаимодействие популяции с таким раствором в течение определенного периода времени (например, 1 часа или менее), как описано в настоящем документе.
В настоящем изобретении представлен способ экстракции растворимого белка из популяции микроорганизмов, включающий взаимодействие популяции микроорганизмов, экспрессирующей растворимый белок с количеством раствора, содержащего приблизительно от 1% (объем/объем) до менее 50% (объем/объем) карбоновой кислоты, эффективной для экстракции растворимого белка из популяции микроорганизмов.
В одном из примеров раствор содержит приблизительно от 1% (объем/объем) до приблизительно 40% (объем/объем) карбоновой кислоты.
В одном из примеров раствор содержит приблизительно от 1% (объем/объем) до приблизительно 37,5% (объем/объем) карбоновой кислоты.
В одном из примеров раствор содержит приблизительно от 1% (объем/объем) до приблизительно 30% (объем/объем) карбоновой кислоты.
В одном из примеров раствор содержит приблизительно от 1% (объем/объем) до приблизительно 25% (объем/объем) карбоновой кислоты.
Например, раствор содержит приблизительно от 10% (объем/объем) до приблизительно 40% (объем/объем) карбоновой кислоты.
Например, раствор содержит приблизительно от 10% (объем/объем) до приблизительно 37,5% (объем/объем) карбоновой кислоты.
Например, раствор содержит приблизительно от 10% (объем/объем) до приблизительно 25% (объем/объем) карбоновой кислоты.
Например, раствор содержит приблизительно от 20% (объем/объем) до приблизительно 40% (объем/объем) карбоновой кислоты.
Например, раствор содержит приблизительно от 20% (объем/объем) до приблизительно 37,5% (объем/объем) карбоновой кислоты.
Например, раствор содержит приблизительно от 25% (объем/объем) до приблизительно 37,5% (объем/объем) карбоновой кислоты.
Дополнительные количества уксусной кислоты описаны в настоящем документе и должны быть взяты с целью применения с соответствующими поправками настоящего примера описания изобретения.
Применение раствора, содержащего 40% или 37,5% или 25% карбоновой кислоты или менее, облегчает последующую очистку с меньшим количеством этапов и/или сниженной стоимостью. Это связано с тем, что некоторые фильтры для обработки экстрагированного белка, например, путем тангенциальной поточной фильтрации, могут быть повреждены уровнями концентрации карбоновой кислоты, например, уксусной кислоты с концентрацией более 40%, или 37,5% или 25%. Типичные фильтры, повреждаемые в этих условиях, включают в себя или состоят из преобразованной целлюлозы или полиэфирсульфона.
В настоящем изобретении также представлен способ экстракции растворимого белка из популяции микроорганизмов, включающий взаимодействие популяции микроорганизмов, экспрессирующих растворимый белок с количеством раствора, содержащего карбоновую кислоту, эффективную для экстракции растворимого белка из популяции микроорганизмов в течение менее приблизительно 20 часов или 15 часов или 10 часов или 5 часов или 4 часов или 3 часов или 2 часов или 1 часа. В одном из примеров популяция микроорганизмов взаимодействует с раствором в течение менее приблизительно 1 часа, например, в диапазоне приблизительно от 10 минут до приблизительно 1 часа. В одном из примеров популяция микроорганизмов взаимодействует с раствором в течение диапазона времени приблизительно от 20 минут до приблизительно 1 часа.
Дополнительные времена экстракции описаны в настоящем документе и должны быть взяты с целью применения с соответствующими поправками настоящего примера описания изобретения.
В одном из примеров раствор включает в себя приблизительно от 10% до приблизительно 100% от карбоновой кислоты, например, приблизительно от 10% до 90% или 80% или 75% или 70%, или концентрацию, описанную в настоящем документе.
В одном из примеров осуществления способа по настоящему изобретению карбоновую кислоту добавляют в соотношении растворения приблизительно от 1:1 (миллилитры кислоты: граммы микроорганизмов (влажная масса)) до приблизительно 20: 1 (миллилитры кислоты:граммы микроорганизмов (влажная масса)). Например, карбоновую кислоту добавляют в соотношении растворения приблизительно от 5:1 (миллилитры кислоты: граммы микроорганизмов ((влажная масса)) до приблизительно 20:1 (миллилитры кислоты: граммы микроорганизмов ((влажная масса)), например, приблизительно 10:1 (миллилитры кислоты: граммы микроорганизмов ((влажная масса)). В одном из иллюстративных вариантов раскрытия изобретения карбоновую кислоту добавляют в соотношении растворения приблизительно 9:1 (миллилитры кислоты:граммы микроорганизмов (влажная масса)).
В одном из примеров изобретения карбоновую кислоту добавляют к микроорганизмам, не суспендированные в растворе, таком как среда для культивирования клеток. Например, микроорганизмы были осаждены центрифугированием.
В одном из примеров изобретения карбоновую кислоту добавляют к раствору, содержащему микроорганизмы, например, среде для культивирования клеток или другому раствору, таким образом, чтобы в нем содержалось приблизительно от 1% (объем/объем) до менее 50% (объем/объем) карбоновой кислоты.
Карбоновые кислоты очевидны для специалиста в данной области. Иллюстративные карбоновые кислоты перечислены в Таблице 1.
В одном из примеров карбоновая кислота имеет величину рКа, как минимум, равную приблизительно 3. В качестве примера в настоящем документе пригодные карбоновые кислоты включают уксусную кислоту или муравьиную кислоту. Авторы изобретения продемонстрировали, что уксусная кислота пригодна для экстракции растворимого белка с более высоким выходом и/или степенью чистоты, чем мочевина или гидроксид натрия или изопропанол.
В одном из примеров изобретения и в зависимости от конкретного случая способ, описанный в настоящем документе в соответствии с любым из примеров, включает взаимодействие популяции микроорганизмов с раствором в течение приблизительно пяти часов или менее, например, четырех часов или менее, например, 3 часов или менее, или двух часов или менее. В одном из примеров изобретения способ включает взаимодействие популяции микроорганизмов с раствором в течение приблизительно 1 часа или менее. Специалисту в данной области техники очевидно, что этот способ требует фактического взаимодействия популяции с кислотой. Таким образом, термин «или менее» означает, как минимум, 1 минуту, например, как минимум, 5 или 10 или 15 минут.
В одном из примеров изобретения способ дополнительно включает взаимодействие популяции микроорганизмов с детергентом, таким как Tween (полиоксиэтилен сорбитан моноолеат, например, Tween 20 или Tween 80) или детергент из класса детергентов TritonX (п-(1,1,3,3-тетраметилбутил) фениловый эфир полиэтиленгликоля). В одном из примеров изобретения детергент добавляют вместе с карбоновой кислотой. В одном из примеров изобретения детергент добавляют после карбоновой кислоты. В одном из примеров изобретения детергент добавляют до карбоновой кислоты.
В одном из примеров изобретения растворимый белок рекомбинантно экспрессируется популяцией микроорганизмов.
Иллюстративные микроорганизмы включают бактерии, дрожжи или грибы. Иллюстративные микроорганизмы включают бактерии, такие как грамотрицательные бактерии, такие как Escherichia coli.
В одном из примеров изобретения растворимый белок характеризуется величиной pI, которая обеспечивает возможность белку оставаться растворимым, когда белок экстрагируют из популяции микроорганизмов. В одном из примеров изобретения белок имеет нейтральное значение pI, например, приблизительно от 6 до приблизительно 8, например, приблизительно от 6,5 до приблизительно 7,5.
В другом примере изобретения белок обладает щелочным значением pI. Например, растворимый белок имеет величину pI, равную 7,5 или более. В другом примере изобретения растворимый белок имеет величину pI, равную приблизительно 10,4.
В другом примере изобретения белок имеет кислое значение pI. Например, белок имеет величину pI, равную приблизительно 6,5 или менее. В другом примере изобретения белок имеет величину pI, равную 6 или менее или 5,5 или менее. Например, белок имеет величину pI, равную 5 или менее. Например, белок имеет величину pI, равную приблизительно 4,7 или менее, например, приблизительно 4,65 или 4,6.
В одном из примеров изобретения белок выбран из группы, состоящей из склеропротеина, шаперонина, белка теплового шока, пептида (например, натрийуретического пептида) и белка, содержащего вариабельный домен антитела.
В одном из примеров изобретения белок представляет собой химерный белок. Например, белок содержит несколько копий (например, две или три копии) пептида или полипептида. В другом примере изобретения белок содержит два полипептида, сцепленные друг с другом, например, пептид или полипептид, сцепленный с меткой для облегчения процесса очистки (например, гекса-гистидиновой меткой) или Fc-областью антитела (например, антитела IgG1) .
В одном из примеров изобретения способ дополнительно включает удаление раствора, содержащего растворимый белок, от нерастворимых компонентов популяции микроорганизмов. Например, способ дополнительно включает центрифугирование и/или фильтрование раствора и извлечение растворимой фракции, например, супернатанта после центрифугирования.
В настоящем изобретении также представлен способ очистки растворимого белка из популяции микроорганизмов, включающий выполнение способа для экстракции белка, как описано в настоящем документе, и очистку растворимого белка, экстрагированного данным способом.
В одном из примеров изобретения способ, описанный в настоящем документе, дополнительно включает модификацию очищенного или экстрагированного белка. Например, белок может быть модифицирован путем его конъюгации с другим белком или его расщепления (например, для удаления метки и/или расщепления нескольких копий пептида внутри химерного белка).
В настоящем изобретении дополнительно представлен способ получения модифицированного белка, включающий получение белка, очищенного способом, как описано в настоящем документе, или белка, экстрагированного способом, описанным в настоящем документе, и модификацию белка. В одном из примеров изобретения модифицирование белка включает в себя конъюгирование другого соединения с белком. В другом примере изобретения модифицирование белка включает в себя его взаимодействие с протеазой, чтобы таким образом расщепить белок.
В одном из примеров способ согласно настоящему описанию изобретения дополнительно включает в себя составление рецептуры терапевтического белка в виде фармацевтической композиции или косметической композиции или ветеринарной композиции.
В одном из примеров способ согласно настоящему описанию изобретения дополнительно включает в себя иммобилизацию белка на поверхности или в составе твердого носителя или полутвердого носителя. Иллюстративные носители представляют собой пластыри и/или имплантаты и/или медицинские приборы.
В настоящем изобретении также представлен способ получения фармацевтической композиции или косметической композиции или ветеринарной композиции, включающий получение белка, экстрагированного, очищенного или синтезированного способом, описанным в настоящем документе, и составление рецептуры белка в виде фармацевтической композиции или косметической композиции или ветеринарной композиции.
В настоящем изобретении также представлен способ получения твердого или полутвердого носителя, включающий получение белка, экстрагированного, очищенного или синтезированного спсобом, описанным в настоящем документе в соответствии с любым примером, и иммобилизацию белка на поверхности или в составе твердого носителя или полутвердого носителя.
В одном из примеров изобретения композиция, твердый носитель или полутвердый носитель предназначены для введения или наружного применения у человека или отличного от человека животного.
В одном из примеров изобретения композиция, твердый носитель или полутвердый носитель предназначены для использования в качестве лекарственного средства или в качестве косметического средства.
В одном из примеров изобретения композиция, твердый носитель или полутвердый носитель предназначены для фармацевтического применения, косметического применения, космецевтического применения, использования в ветеринарии или для имплантации.
В одном из примеров изобретения композиция твердый носитель или полутвердый носитель предназначены для введения пероральным способом, путем имплантации, внутрикожно, внутримышечно, подкожно, внутривенно, внутриартериально, в виде аэрозоля или внутрь глаза.
В настоящем изобретении дополнительно предоставлен белок или композиция или твердый носитель или полутвердый носитель, полученные посредством осуществления способа, описанного в настоящем документе.
В одном из примеров изобретения белок (в том числе модифицированный белок), композиция, твердый носитель или полутвердый носитель предназначены для фармацевтического применения, косметического применения, космецевтического применения, использования в ветеринарии или для имплантации. В одном из примеров изобретения композиция представляет собой фармацевтическую композицию. В одном из примеров изобретения композиция представляет собой косметическую композицию. Способы, описанные в настоящем документе, могут быть также использованы для производства матриц для выращивания или иммобилизации клеток, например, стволовых клеток или клеток-предшественников или клеток кожи, или для производства ферментов для промышленного применения, например, в пищевой или текстильной промышленности.
Настоящее изобретение также предоставляет устройство, содержащее белок, композицию, твердый носитель или полутвердый носитель, описанные в настоящем документе. В одном из примеров устройство представляет собой шприц, пластырь или имплантат.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
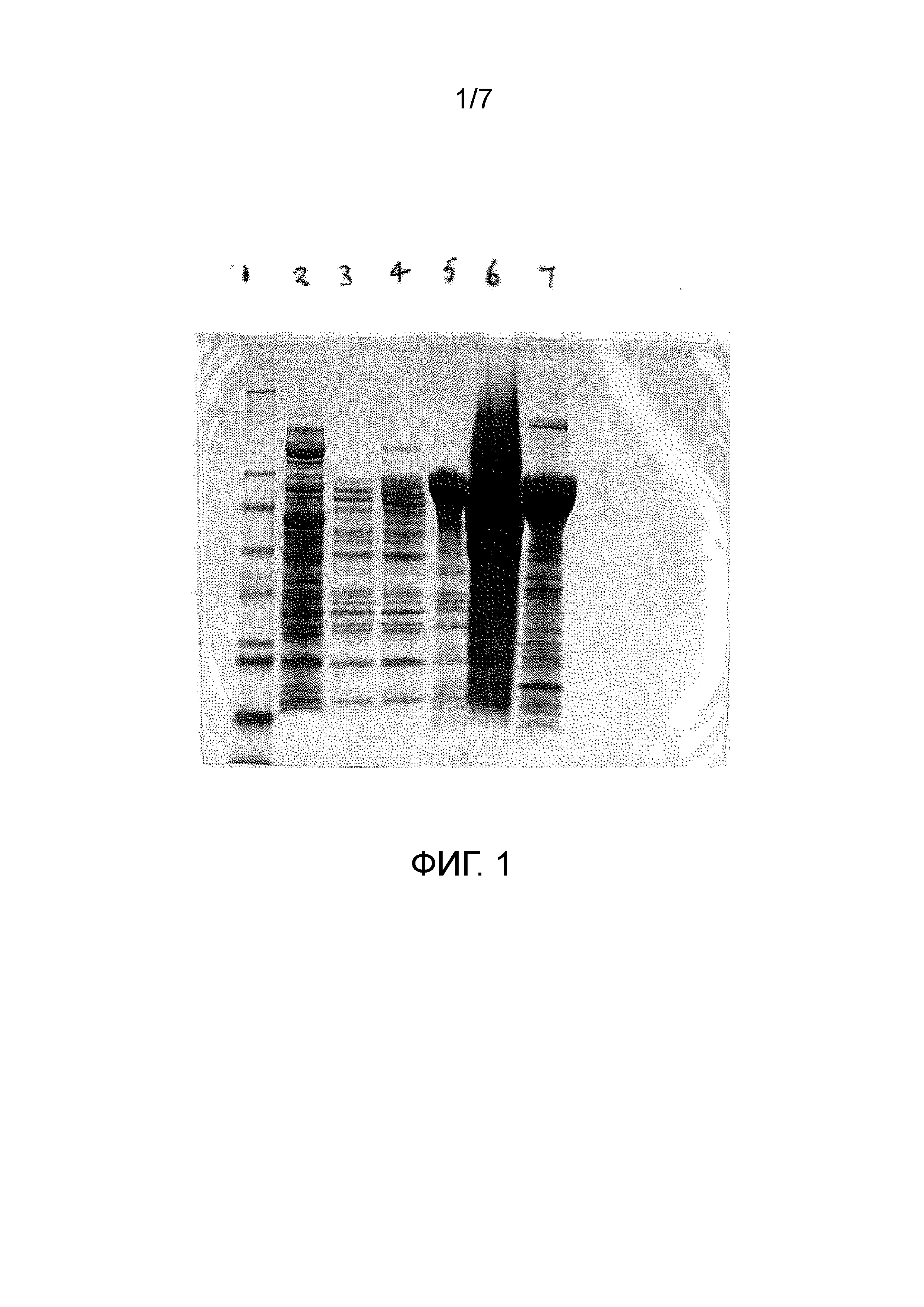
Чертеж 1 представляет собой копию фотографического снимка, демонстрирующего результаты электрофоретического анализа в полиакриламидном геле различных видов обработок для экстракции рекомбинантного белка из E.coli. Дорожка 1, маркеры размера; Дорожка 2, экстракция 15 мМ NaOH; Дорожка 3, экстракция 0,57% (объем/объем) уксусной кислотой (при комнатной температуре); Дорожка 4, экстракция 0,57% (объем/объем) уксусной кислотой (4ºС); Дорожка 5, экстракция 10% (вес/объем) муравьиной кислотой; Дорожка 6, экстракция мочевиной; Дорожка 7, экстракция н-пропанолом.
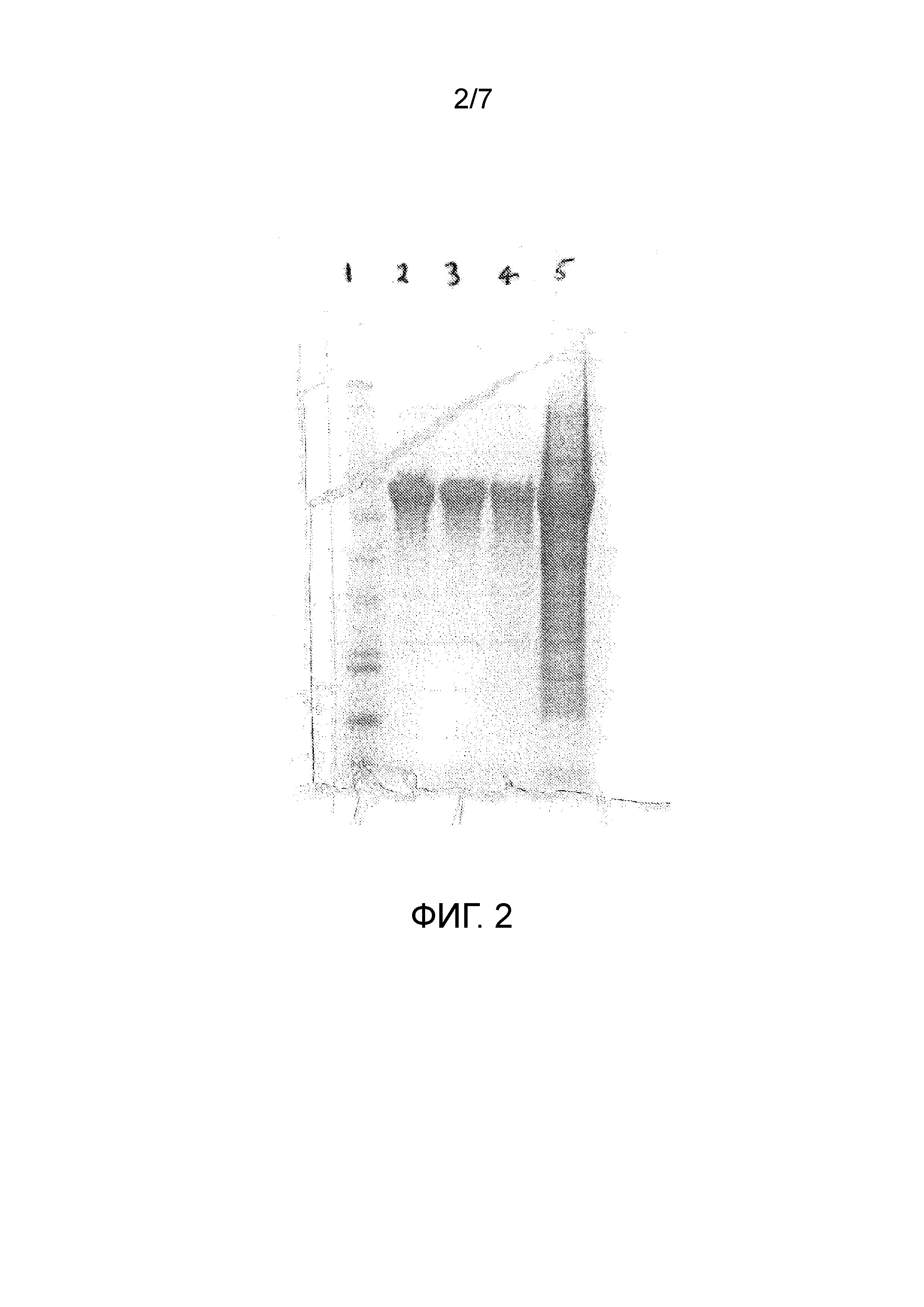
Чертеж 2 представляет собой копию фотографического снимка, демонстрирующего результаты электрофоретического анализа в полиакриламидном геле различных видов обработок для экстракции рекомбинантного белка из E.coli. Дорожка 1, маркеры размера; Дорожка 2, экстракция 10% (объем/объем) уксусной кислотой; Дорожка 3, экстракция 5% (объем/объем) уксусной кислотой; Дорожка 4, экстракция 2% (объем/объем) уксусной кислотой; Дорожка 5, экстракция мочевиной.
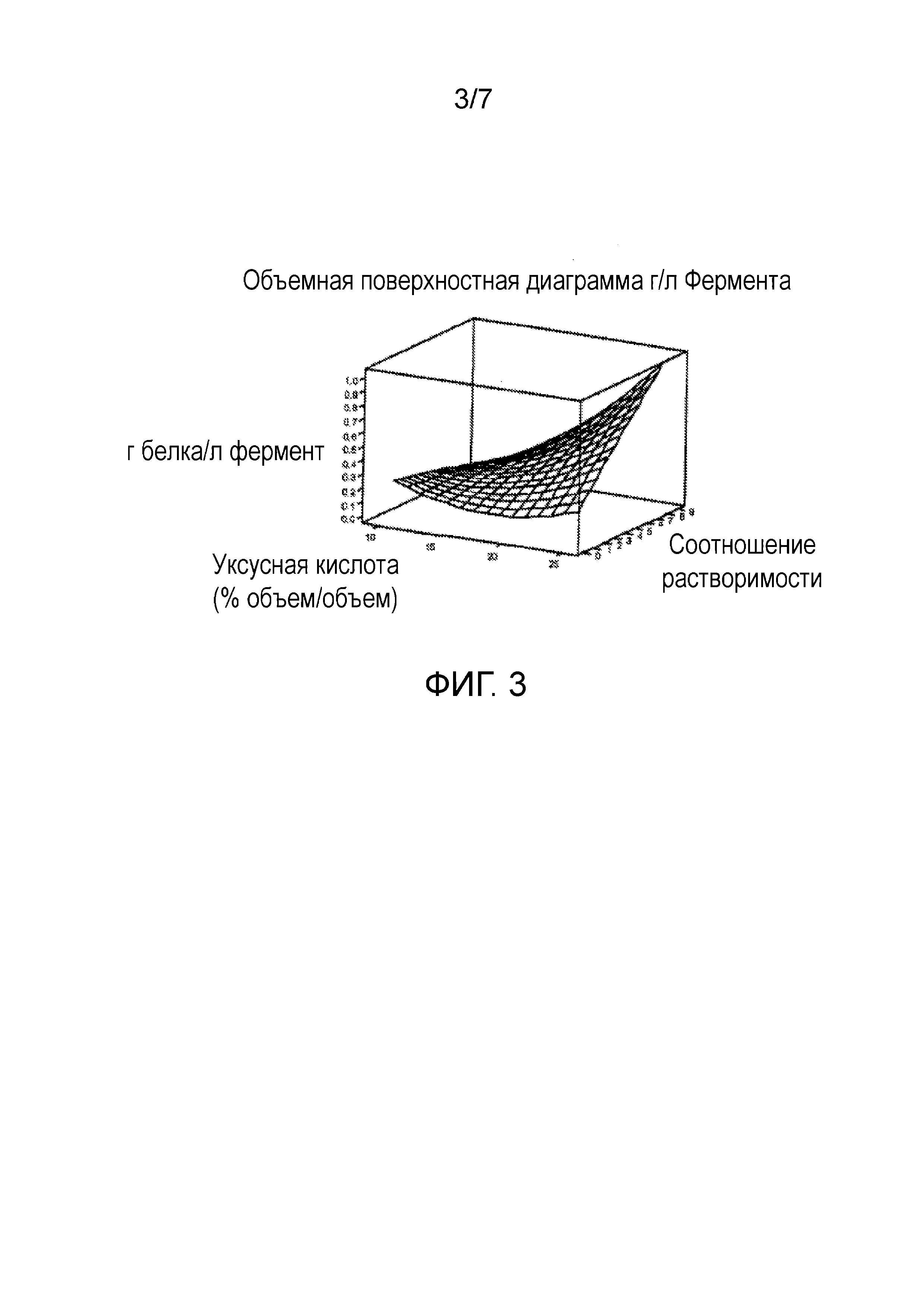
Чертеж 3 представляет собой графическое изображение, демонстрирующее зависимость между концентрацией уксусной кислоты (объем/объем), соотношением растворения и количеством (граммы) рекомбинантного белка, выделенного из литра реакционной смеси.
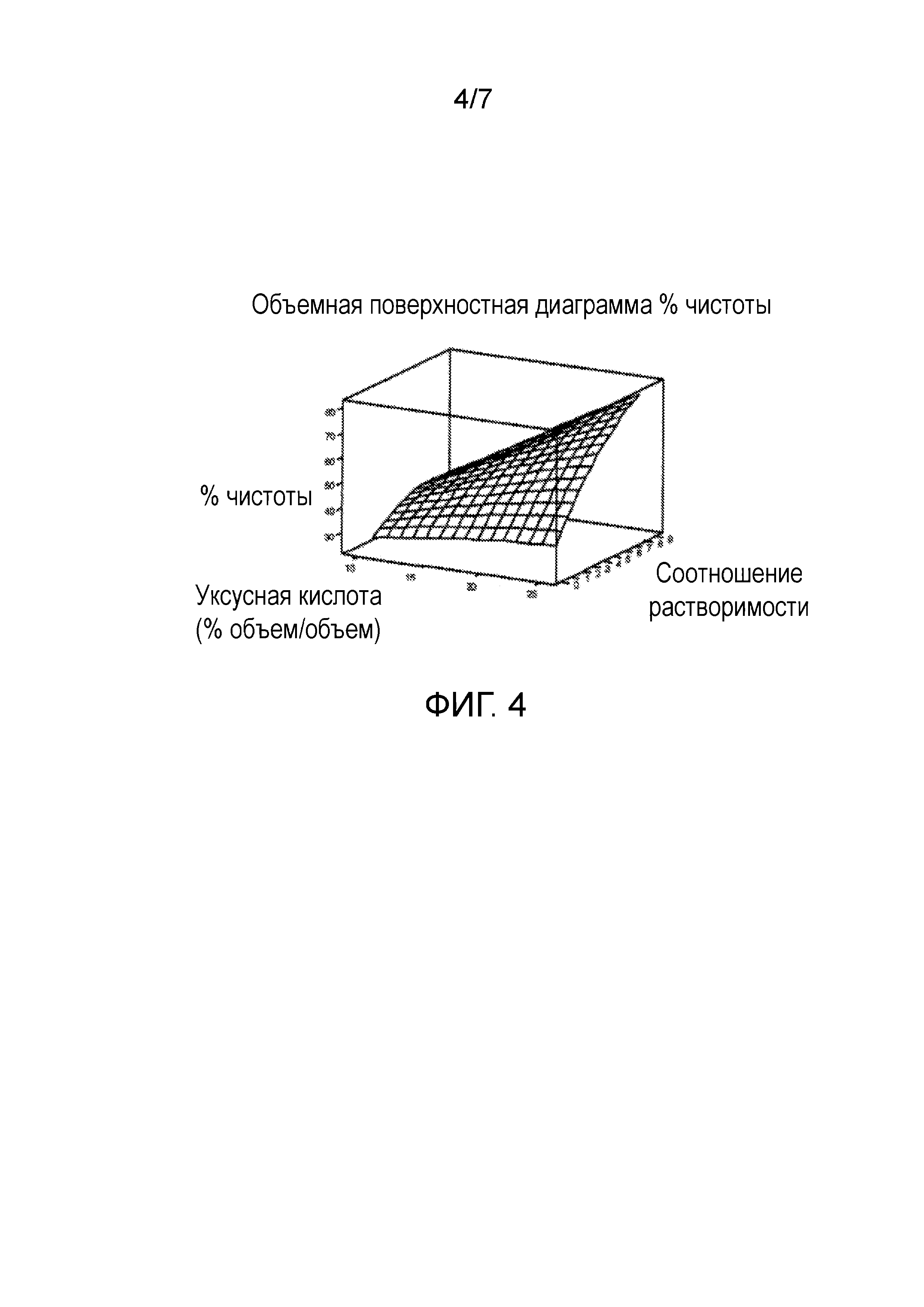
Чертеж 4 представляет собой графическое изображение, демонстрирующее зависимость между концентрацией уксусной кислоты (объем/объем), соотношением растворения и степенью чистоты экстрагированного рекомбинантного белка.
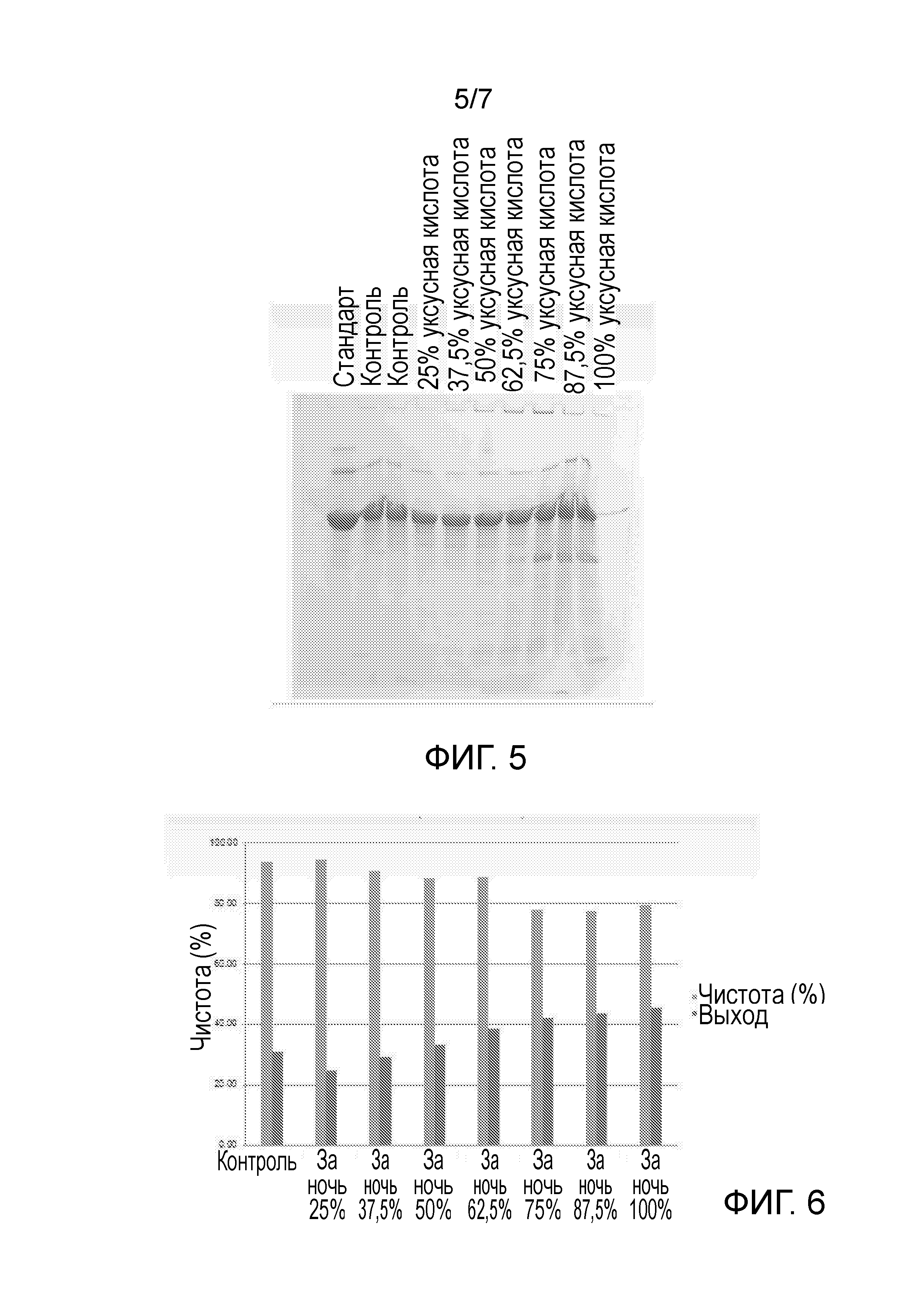
Чертеж 5 представляет собой копию фотографического снимка, демонстрирующего результаты анализа SDS-PAGE экстрактов E.coli, экспрессирующих рекомбинантный белок. Экстракты были получены с использованием различных концентраций уксусной кислоты (объем/объем), как указано в верхней части Чертежа.
Чертеж 6 является графическим изображением, демонстрирующим выход и чистоту рекомбинантного белка в экстрактах E.coli по данным RP-HPLC (обращено-фазовой высокоэффективной жидкостной хроматографии). Экстракты были получены с использованием различных концентраций уксусной кислоты (объем/объем), как указано.
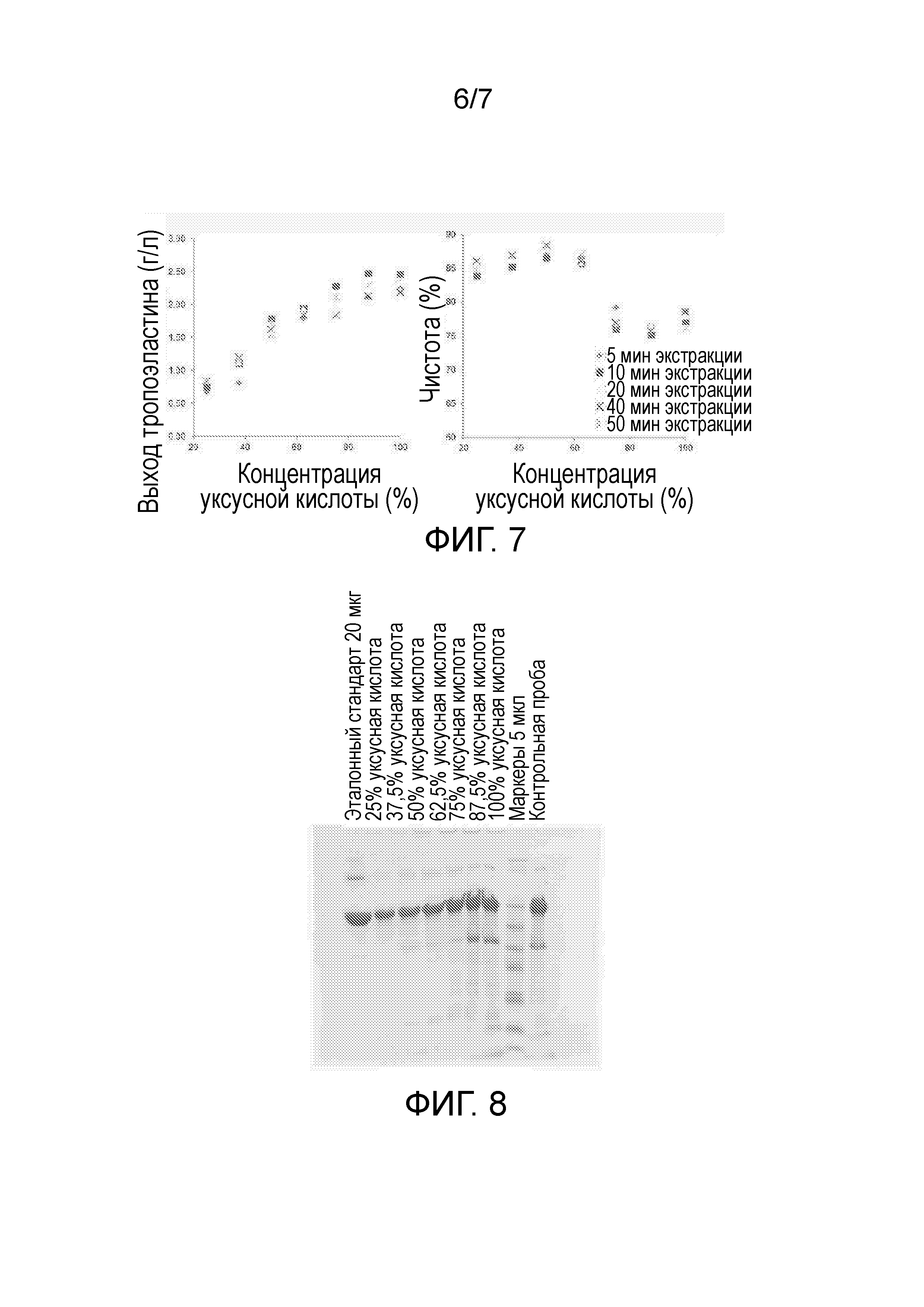
Чертеж 7 включает в себя два графических изображения, демонстрирующие выход (изображение слева) и степень чистоты (изображение справа) рекомбинантного белка в экстрактах E.coli по данным RP-HPLC. Экстракты были получены с использованием различных концентраций уксусной кислоты (объем/объем) и в течение различных периодов времени, как указано.
Чертеж 8 представляет собой копию фотографического снимка, демонстрирующего результаты анализа SDS-PAGE экстрактов E.coli, экспрессирующих рекомбинантный белок. Экстракты были получены с использованием различных концентраций уксусной кислоты (объем/объем), как указано в верхней части Чертежа, в течение 20-минутного периода.
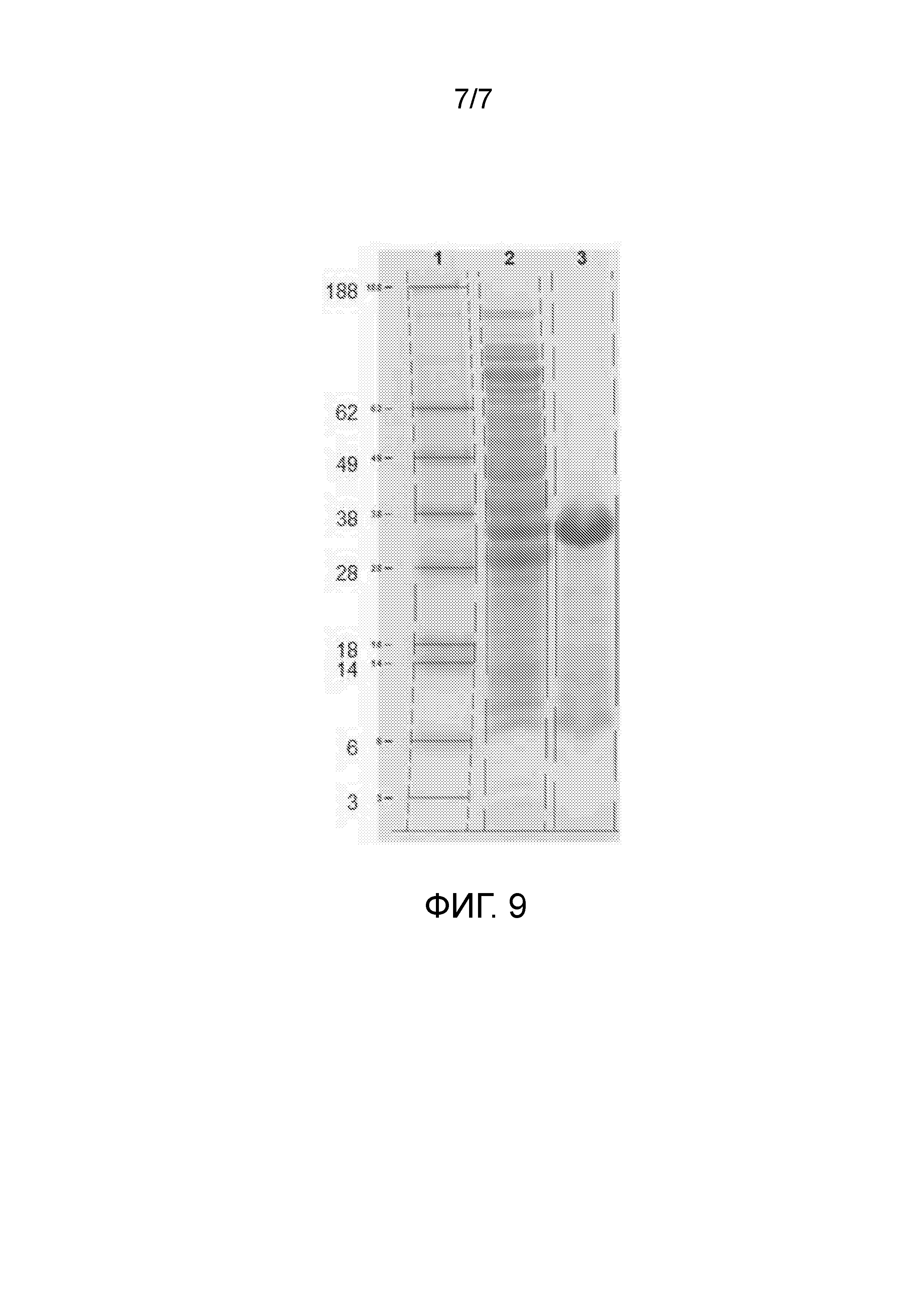
Чертеж 9 представляет собой копию фотографического снимка, демонстрирующего результаты анализа SDS-PAGE экстрактов E.coli, экспрессирующих рекомбинантный химерный белок, содержащий несколько копий пептида. Дорожка 1, маркеры размера; Дорожка 2 клеточный лизат; и Дорожка 3, экстракция 25% (объем/объем) уксусной кислотой.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Общие положения
В данном описании изобретения, если не указано иное или контекст не требует иного, ссылки на одну стадию, состав вещества, совокупность стадий или совокупность композиций вещества должны быть приняты во внимание, чтобы охватить один и несколько (т.е. один или более) тех этапов, композиций вещества, совокупностей этапов или совокупность композиций вещества.
Специалистам в данной области техники очевидно, что настоящее описание изобретения допускает вариации и модификации, отличные от тех, которые частным образом описаны. Следует понимать, что описание изобретения охватывает все такие вариации и модификации. Настоящее описание изобретения также включает все этапы, признаки, композиции и соединения, на которые ссылаются или которые указаны в данном описании, индивидуально или совместно, и любые и все комбинации или любые два или более двух указанных этапов или признаков.
Настоящее изобретение не должно быть ограничено в объеме конкретными примерами, описанными в настоящем документе, которые предназначены только для иллюстративных целей. Представляется совершенно очевидным, что функционально эквивалентные продукты, композиции и способы находятся в рамках настоящего изобретения.
Любой пример в настоящем документе должен быть взят за образец с целью внесения соответствующих поправок в любой другой вариант осуществления изобретения, если не оговорено иное.
Если специально не указано иное, все технические и научные термины, используемые в настоящем документе, должны быть приняты для использования, подразумевая то же значение, как это обычно трактуют специалисты в данной области техники (например, в области культивирования клеток, молекулярной генетики, иммунологии, иммуногистохимии, химии белков и биохимии).
Если не указано иное, технологии получения рекомбинантных белков и клеточных культур, используемых в настоящем изобретении, представляют собой стандартные способики, хорошо известные специалистам в данной области техники. Такие способики описаны и объяснены в литературных источниках, таких как, J. Perbal, A Practical Guide to Molecular Cloning, John Wiley and Sons (1984), J. Sambrook et al. Molecular Cloning: A Laboratory Manual, Cold Spring Harbour Laboratory Press (1989), T.A. Brown (editor), Essential Molecular Biology: A Practical Approach, Volumes 1 and 2, IRL Press (1991), D.M. Glover and B.D. Hames (editors), DNA Cloning: A Practical Approach, Volumes 1-4, IRL Press (1995 and 1996), and F.M. Ausubel et al. (editors), Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience (1988, включая все обновленные варианты до настоящего времени).
Термин «и/или», например, «X и/или Y» должен означать либо «X и Y», либо «X или Y» и должен быть принят для использования, чтобы обеспечить заданный смысл обоим значениями или любому из значений.
В данном описании изобретения под словом «содержать» или вариациями, такими как «содержит» или «содержащий», следует понимать включение указанного элемента, единого целого или стадии, или группы элементов, целых систем или стадий, но не исключение любого другого элемента, целой системы или стадии или группы элементов, целых систем или стадий.
Используемый в данном описании изобретения термин «происходящий из» следует использовать для обозначения того, что указанное единое целое может быть получено из определенного источника, хотя и не обязательно непосредственно из этого источника.
Выбранные Определения
Термин «экстракт» означает удаление растворимого белка из микроорганизма, в котором он экспрессируется. В некоторых примерах, экстрагирование растворимого белка отделяет белок, как минимум, приблизительно от 10%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70% других веществ или составляющих, присутствовавших до экстракции, например, в микроорганизме.
Используемый в данном описании термин «растворимый белок» будет означать, что при экспрессии в микроорганизме (например, в цитозоле или периплазме микроорганизма) белок находится в растворимой форме. Например, белок не образует нерастворимые агрегаты, например, тельца включения, в цитозоле или периплазме клетки.
Термин «микроорганизм» очевиден специалисту в данной области техники, относящийся к любому микроскопическому одноклеточному или многоклеточному организму. Типичные микроорганизмы являются одноклеточными. Примеры микроорганизмов, пригодных для способа по настоящему изобретению, включают дрожжи, грибы и бактерии.
Термин «популяция микроорганизмов» включает микроорганизмы, полученные во время культивирования или ферментации. В одном из примеров изобретения микроорганизмы в культуре возникают из клона, т.е. являются клональными. Например, клетки, по существу, генетически идентичны за исключением мутаций, возникающих в процессе культивирования.
Используемый в данном описании термин «карбоновая кислота» охватывает любую органическую кислоту, содержащую, как минимум, одну карбоксильную группу, включая карбоновые кислоты, перечисленные в Таблице 1. В одном из примеров изобретения карбоновая кислота имеет величину рКа больше 2 или 2,5 или 3 или 3,5 или 3,6 или 3,7 или 3,8 или 3,9 или 4 или 4,1 или 4,2 или 4,3 или 4,4 или 4,5. Например, карбоновая кислота представляет собой уксусную кислоту или муравьиную кислоту или лимонную кислоту или молочную кислоту или мочевую кислоту или бензойную кислоту или хлоруксусную кислоту или пропионовую кислоту. В одном из примеров изобретения карбоновая кислота представляет собой муравьиную кислоту или уксусную кислоту или бензойную кислоту или пропионовую кислоту. В одном из примеров изобретения карбоновая кислота представляет собой уксусную кислоту или бензойную кислоту или пропионовую кислоту. В одном из примеров изобретения карбоновая кислота представляет собой уксусную кислоту.
Специалисту в данной области техники очевидно, что под термином «% (объем/объем)» (синоним «объемный процент» или «объем для объемных процентов») следует понимать значение, вычисленное по формуле ((общий объем растворенного вещества (карбоновая кислота)/общий объем раствора) х 100%).
Термин «влажная масса» попросту означает, что вес популяции микроорганизмов измеряют без предварительного высушивания микроорганизмов. Например, вес микроорганизмов определяют после сбора из клеточной культуры (например, центрифугированием и/или фильтрацией), однако не высушивая клетки.
Значение термина «соотношение растворения» очевидно специалисту в данной области техники из приведенного в настоящем документе описания. В частности, этот термин относится к соотношению объема раствора, содержащего карбоновую кислоту, и влажной массе популяции микроорганизмов.
Карбоновые кислоты
Как обсуждалось в настоящем документе, настоящее изобретение предусматривает применение любой карбоновой кислоты для экстракции растворимого белка из клетки.
В одном из примеров изобретения карбоновая кислота имеет достаточно низкое значение рКа для обеспечения экстракции при использовании в % (объем/объем), обсуждаемое в настоящем документе.
В одном из примеров изобретения карбоновая кислота обладает достаточно высоким значением рКа, что не приводит к повреждению оборудования, используемого для экстракции белка, например, реакционного резервуара при использовании в % (объем/ объем) в диапазоне приблизительно от 1% до менее 50%, в таком как приблизительно от 1% до приблизительно 37,5%.
Иллюстративные карбоновые кислоты и значения их pKa приведены в Таблице 1.
В одном из примеров изобретения карбоновая кислота имеет значение рКа больше 2. Например, карбоновой кислотой являются пентановая кислота, триметилуксусная кислота, лимонная кислота, изолимонная кислота, адипиновая кислота, адипамовая кислота, капроновая кислота, 2-бромбензойная кислота, 3-бромбензойная кислота, 2-хлорбензойная кислота, 3-хлорбензойная кислота, 4-хлорбензойная кислота, 2-йодбензойная кислота, 3-йодбензойная кислота, хинолиновая кислота, бензойная кислота, гептановая кислота, октановая кислота, муравьиная кислота, бромуксусная кислота, хлоруксусная кислота, йодуксусная кислота, тиоуксусная кислота, уксусная кислота, гликолевая кислота, акриловая кислота, пропионовая кислота, молочная кислота, глицериновая кислота, щавелевоуксусная кислота, ацетоуксусная кислота, янтарная кислота, яблочная кислота, бутановая кислота, 2-метилпропановая кислота, 3-гидроксибутановая кислота, 4-гидроксибутановая кислота , 2-аминобутановая кислота, 4-аминобутановая кислота, мочевая кислота, глутаровая кислота или L-глутаминовая кислота.
В одном из примеров изобретения карбоновая кислота имеет значение рКа больше 3. Например, карбоновой кислотой являются муравьиная кислота, йодуксусная кислота, тиоуксусная кислота, уксусная кислота, гликолевая кислота, акриловая кислота, пропионовая кислота, молочная кислота, глицериновая кислота, ацетоуксусная кислота, янтарная кислота, яблочная кислота, бутановая кислота, 2-метилпропановая кислота, 3-гидроксибутановая кислота, 4-гидроксибутановая кислота, 4-аминобутановая кислота, мочевая кислота, глутаровая кислота, пентановая кислота, триметилуксусная кислота, лимонная кислота, изолимонная кислота, адипиновая кислота, адипамовая кислота, капроновая кислота, 3-хлорбензойная кислота, 4-хлорбензойная кислота, 3-йодбензойная кислота, бензойная кислота, гептановая кислота или октановая кислота.
В одном из примеров изобретения карбоновая кислота имеет значение рКа больше 4. Например, карбоновой кислотой являются уксусная кислота, акриловая кислота, пропионовая кислота, янтарная кислота, масляная кислота, 2-метилпропановая кислота, 3-гидроксибутановая кислота, 4-гидроксибутановая кислота , 2-аминобутановая кислота, 4-аминобутановая кислота, глутаровая кислота, валериановая кислота, адипиновая кислота, гексановая кислота, гептановая кислота, октановая кислота или бензойная кислота.
В одном из примеров изобретения карбоновая кислота имеет значение рКа больше 4,5. Например, карбоновой кислотой являются уксусная кислота, пропионовая кислота, масляная кислота, 2-метилпропановая кислота, 3-гидроксибутановая кислота, 4-гидроксибутановая кислота, пентановая кислота, триметилуксусная кислота, адипамовая кислота, капроновая кислота или оксановая кислота.
В одном из примеров изобретения карбоновой кислотой являются уксусная кислота или муравьиная кислота.
В одной из иллюстративных форм раскрытия изобретения карбоновая кислота представляет собой уксусную кислоту. Авторами изобретения было показано, что эта кислота обладает превосходными экстрагирующими свойствами (например, выход продукта и/или степень чистоты) даже при сравнении с другой карбоновой кислотой (муравьиной кислотой). Эта карбоновая кислота также является относительно недорогой (например, по сравнению с некоторыми органическими растворителями) и, как правило, не требует специального оборудования для переработки, хранения или захоронения.
В примерах раскрытия изобретения, в которых популяция микроорганизмов взаимодействует с композицией в течение определенного периода времени, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 1% до менее 100%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 1% до приблизительно 95%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 1% до приблизительно 90%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 1% до приблизительно 85%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 1% до приблизительно 80%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 1% до приблизительно 75%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 1% до приблизительно 70%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 1% до приблизительно 65%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 1% до приблизительно 60%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 1% до приблизительно 55%.
В одном из примеров способа изобретения карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 1% до менее 50%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 1% до приблизительно 45%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 2% до приблизительно 50%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 2% до приблизительно 40%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 2% до приблизительно 37,5%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 3% до приблизительно 37,5%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 3% до приблизительно 30%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 5% до приблизительно 30%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 6% до приблизительно 30%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 7% до приблизительно 30%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 8% до приблизительно 30%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 9% до приблизительно 30%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 10% до приблизительно 37,5%. Например, карбоновую кислоту используют в % (объем/объем) в диапазоне приблизительно от 10% до приблизительно 25%. Например, карбоновую кислоту используют в % (объем/объем) в концентрации 1% или 2% или 5% или 10% или 15% или 17,5% или 25%, или 37,5%. Например, карбоновую кислоту используют в % (объем/объем) в концентрации 25%.
В одном из примеров изобретения карбоновую кислоту разбавляют в растворе, который не имеет значимой или детектируемой буферной емкости.
В одном из примеров изобретения карбоновую кислоту разводят в воде.
В одном из примеров изобретения раствор, содержащий карбоновую кислоту, имеет значение рН в диапазоне от 2 до 6, например, от 2 до 5, в числе которых от 2 до 4. Например, раствор, содержащий карбоновую кислоту, имеет рН в диапазоне от 2 до 3. В одном из примеров изобретения раствор, содержащий карбоновую кислоту, имеет рН в диапазоне от 2 до 2,5.
Экстракция
В одном из примеров изобретения карбоновую кислоту добавляют в соотношении растворения приблизительно от 1:1 (миллилитры кислоты: граммы микроорганизма (влажная масса)) до приблизительно 20:1 (миллилитры кислоты: граммы микроорганизма (влажная масса)). Например, карбоновую кислоту добавляют в соотношении растворения приблизительно 2:1 (миллилитры кислоты: граммы микроорганизма (влажная масса)) до приблизительно 15:1 (миллилитры кислоты: граммы микроорганизма (влажная масса)). Например, карбоновую кислоту добавляют в соотношении растворения приблизительно от 3:1 (миллилитры кислоты: граммы микроорганизма (влажная масса)) до приблизительно 10:1 (миллилитры кислоты: граммы микроорганизма (влажная масса)). Карбоновую кислоту добавляют в соотношении растворения приблизительно от 5:1 (миллилитры кислоты: граммы микроорганизма (влажная масса)) до приблизительно 10:1 (миллилитры кислоты: граммы микроорганизма (влажная масса)). Например, карбоновую кислоту добавляют в соотношении растворения приблизительно 5:1 (миллилитры кислоты: граммы микроорганизма (влажная масса)) или приблизительно 6:1 (миллилитры кислоты: граммы микроорганизма (влажная масса)) или приблизительно 7:1 (миллилитры кислоты: граммы микроорганизма (влажная масса)) или приблизительно 8:1(миллилитры кислоты: граммы микроорганизма (влажная масса)) или приблизительно 9:1 (миллилитры кислоты: граммы микроорганизма (влажная масса)).
В одной из иллюстративных форм раскрытия изобретения карбоновую кислоту добавляют в соотношении растворения приблизительно 9:1 (миллилитры кислоты: граммы микроорганизма (влажная масса)).
Специалисту в данной области техники очевидно, что в некоторых примерах желательно собрать микроорганизмы до определения массы микроорганизмов. Способы сбора микроорганизмов очевидны специалисту в данной области техники и включают, например, центрифугирование в непрерывном потоке (например, используя тарельчатый сепаратор, такой как те, которые доступны в Alfa Laval или GEA Westfalia Separator Group GmbH), микрофильтрацию или тангенциальная поточная фильтрация.
После сбора микроорганизмов нет сложностей в определении их веса. Альтернативно, определяют вес образца микроорганизмов, и этот вес используют для вычисления или оценки веса всей популяции микроорганизмов.
В альтернативном примере осуществляют сбор образца культуры микроорганизмов, взвешивают и этот вес используют для вычисления или оценки веса микроорганизмов в культуре. Требуемое количество раствора, содержащего карбоновую кислоту, может затем быть непосредственно добавлено к культуре.
В другом примере, вес культуры микроорганизмов оценивают на основании известных весов каждого из компонентов, добавленных в культуру (например, среды и питательные вещества), и эти веса используют для вычисления или оценки веса микроорганизмов в культуре. Требуемое количество раствора, содержащего карбоновую кислоту, может затем быть непосредственно добавлено к культуре.
В одном из примеров изобретения популяция микроорганизмов взаимодействует с раствором в течение времени и в условиях, достаточных для экстракции растворимого белка.
Как уже обсуждалось выше в настоящем документе, авторы настоящего изобретения пришли к заключению, что способ, описанный в настоящем документе в соответствии с любым примером, облегчает быструю экстракцию растворимого белка из популяции микроорганизмов. Например, авторы изобретения пришли к выводу, что подобное количество белка было экстрагировано из популяции микроорганизмов при взаимодействии с раствором, содержащим карбоновую кислоту, в течение приблизительно 20 минут или приблизительно 1 часа или приблизительно 20 часов. В одном из примеров изобретения способ включает взаимодействие популяции микроорганизмов с раствором, содержащим карбоновую кислоту, в течение менее пяти часов или четырех часов или трех часов или двух часов. Например, способ включает взаимодействие популяции микроорганизмов с раствором, содержащим карбоновую кислоту, в течение одного часа или менее, например, 45 минут или 30 минут или 20 минут. Настоящее изобретение также предусматривает более длительные периоды экстракции. Например, популяция микроорганизмов взаимодействует с карбоновой кислотой в течение приблизительно от 1 часа до приблизительно 20 часов, например, от 1 до 5 часов, например, от 1 до 3 часов. В одном из примеров изобретения популяция микроорганизмов взаимодействует с карбоновой кислотой в течение приблизительно 1 часа.
Популяция микроорганизмов может взаимодействовать с карбоновой кислотой при температуре в диапазоне от 2°С до 40°С, например, от 4°С до приблизительно 30°С, например, при комнатной температуре. Специалисту в данной области техники очевидно, что комнатная температура будет зависеть от окружающей среды, в которой выполняют экстракцию. Например, в промышленном предприятии температура может быть в диапазоне от 16°С до 26°С, например, от 18°С до 25°С, например, 19°С или 20°С или 21°С или 22°С или 23°С или 24°С.
Раствор, содержащий карбоновую кислоту и популяцию микроорганизмов, можно перемешивать с использованием стандартных способик для смешивания.
После взаимодействия с карбоновой кислотой раствор, содержащий растворимый белок, можно отделить от примесей. Например, раствор, содержащий карбоновую кислоту, популяцию микроорганизмов и растворимый белок, может быть подвергнут центрифугированию и/или микрофильтрации. Затем извлекают растворимую фракцию, которая содержит растворимый белок.
В одном из примеров изобретения, способ экстракции, описанный в настоящем документе, не включает в себя взаимодействие популяции микроорганизмов с неорганической кислотой.
В одном из примеров изобретения способ экстракции, описанный в настоящем документе, не включает в себя взаимодействие популяции микроорганизмов с органическим растворителем, кроме карбоновой кислоты или воды. В одном из примеров изобретения способ не включает в себя взаимодействие популяции микроорганизмов со спиртом, например, бутанолом или пропанолом.
В одном из примеров изобретения способ экстракции, описанный в настоящем документе, не содержит ультразвуковую обработку и/или гомогенизацию.
В одном из примеров изобретения способ экстракции, описанный в настоящем документе, не включает в себя добавление энхансера солюбилизации, такого как полиэтиленимин, сульфат магния (MgSO4), хлорид магния (MgCl2), сульфат кальция (CaSO4) или хлорид кальция (CaCl2).
Микроорганизмы
Микроорганизмы, пригодные для экспрессии растворимого белка для экстракции по настоящему изобретению, очевидны специалисту в данной области техники. Например, микроорганизмом являются дрожжи, грибы или бактерии.
Типичные дрожжи включают Pichia pastoris, Pichia finlandica, Pichia trehalophila, Pichia koclamae, Pichia membranaefaciens, Pichia minuta (Ogataea minuta, Pichia lindneri), Pichia opuntiae, Pichia thermotolerans, Pichia salictaria, Pichia guercuum, Pichia pijperi, Pichia stiptis, Pichia methanolica, Pichia sp., Saccharomyces cerevisiae, Saccharomyces sp., Hansenula polymorpha, Kluyveromyces sp., Kluyveromyces lactis, и Candida albicans.
Типичные мицелиальные грибы включают Aspergillus nidulans, Aspergillus niger, Aspergillus oryzae, Trichoderma reesei, Chrysosporium lucknowense, Fusarium sp., Fusarium gramineum, Fusarium venenatum и Neurospora crassa.
Бактерии, пригодные для использования в настоящем изобретении, включают архебактерии и эубактерии, в первую очередь эубактерии. Например, грамотрицательные бактерии, такие как Enterobacteriaceae, пригодны в способах по настоящему изобретению. Примеры пригодных бактерий включают Escherichia, Enterobacter, Azotobacter, Erwinia, Bacillus, Pseudomonas, Klebsiella, Proteus, Salmonella, Serratia, Shigella, Rhizobia, Vitreoscilla и Paracoccus.
В одном из примеров изобретения микроорганизмом является Escherichia coli. Пригодные E.coli-хозяева включают штамм Е.coli W3110 (ATCC 27,325), E.coli 294 (АТСС 31,446 или 33,625), E.coli В и E.coli X1776 (ATCC 31,537). Эти примеры являются иллюстративными, а не ограничивающими. Также могут быть использованы мутантные клетки любых из указанных выше микроорганизмов. Пригодные микроорганизмы могут быть выбраны с учетом способности реплицировать экспрессионный вектор в микроорганизме в случае преимущества рекомбинантной экспрессии. Например, E.coli, Serratia или виды Salmonella могут быть пригодными для использования в качестве клеток-хозяев, когда используют известные плазмиды, такие как pBR322, pBR325, pACYC177 или pKN410.
При экстракции эндогенного белка важно выбрать микроорганизм, экспрессирующий белок.
Рекомбинантная экспрессия
В одном из примеров изобретения растворимый белок экспрессируется рекомбинантным способом, то есть с использованием рекомбинантных процессов/подходов. Например, нуклеиновая кислота, кодирующая растворимый белок, функционально связана с промотором в экспрессионной конструкции. Экспрессионная конструкция может быть введена в микроорганизм, где она может встраиваться в геном микроорганизма или находящуюся в нем плазмиду, или может оставаться в эписомальной форме. В некоторых примерах изобретения экспрессионная конструкция является вектором экспрессии.
Используемый в настоящем документе термин «промотор» следует трактовать в самом широком контексте и включает транскрипционные регуляторные последовательности гена генома, включая ТАТА-бокс или элемент инициации, который требуется для точной инициации транскрипции с дополнительными регуляторными элементами или без них (например, расположенными против хода транскрипции активирующими последовательностями, сайтами связывания транскрипционных факторов, энхансерами и сайленсерами), которые изменяют экспрессию нуклеиновой кислоты, например, в ответ на стимулы развития и/или внешние стимулы, или тканеспецифичным образом. В настоящем контексте термин «промотор» также используется для описания рекомбинантной, синтетической или химерной нуклеиновой кислоты или производного, которое придает, активирует или усиливает экспрессию нуклеиновой кислоты, с которой оно функционально связано. Предпочтительные промоторы могут содержать дополнительные копии одного или нескольких специфичных регуляторных элементов для дополнительного усиления экспрессии и/или изменения пространственной экспрессии и/или временной экспрессии указанной нуклеиновой кислоты.
Используемый в настоящем документе термин «функционально связан с» означает расположение промотора относительно нуклеиновой кислоты таким образом, чтобы экспрессия нуклеиновой кислоты находилась под контролем промотора.
Термин «экспрессирующая конструкция» должен трактоваться в самом широком контексте и включает в себя нуклеиновую кислоту, содержащую промотор, функционально связанный с нуклеиновой кислотой, кодирующей растворимый белок, и любые другие элементы, необходимые для экспрессии растворимого белка.
Термин «экспрессирующий вектор» относится к нуклеиновой кислоте, содержащей, как минимум, промотор, функционально связанный с нуклеиновой кислотой, кодирующей растворимый белок, и любые другие элементы, необходимые для экспрессии растворимого белка, а также последовательности, которые обеспечивают вектору возможность реплицироваться в микроорганизме и, в некоторых случаях, последовательность, кодирующую селективный маркер. В контексте настоящего изобретения следует понимать, что экспрессирующий вектор может быть плазмидой, бактериофагом, фагмидом, космидой, вирусный суб-геномный или геномный фрагмент или другие нуклеиновые кислоты, способные сохранять и/или реплицировать гетерологичную ДНК в формате способности к экспрессии. Многие экспрессирующие векторы являются коммерчески доступными для экспрессии в различных клетках. Выбор соответствующих векторов находится в пределах знаний специалистов в данной области техники.
Типичные промоторы, пригодные для экспрессии в вирусах бактериальных клеток и бактериальных клетках, таких как, например, бактериальная клетка, выбранная из группы, состоящей из E. coli, Staphylococcus sp, Corynebacterium sp., Salmonella sp., Bacillus sp., и Pseudomonas sp., включают, помимо прочего, промотор lacz, промотор Ipp, температурочувствительные промоторы λL или λR, промотор T7, промотор T3, промотор SP6 или полуискусственные промоторы, такие как IPTG-индуцибельный промотор tac или промотор lacUV5. Ряд других генных конструкторных систем для экспрессии фрагмента нуклеиновой кислоты по изобретению в бактериальных клетках хорошо известны в данной области техники и описаны, например, в Ausubel et al (In: Current Protocols in Molecular Biology. Wiley Interscience, ISBN 047 150338, 1987) и/или (Sambrook et al (In: Molecular Cloning: Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratories, New York, Third Edition 2001).
Многочисленные экспрессирующие векторы для экспрессии рекомбинантных полипептидов в бактериальных клетках и эффективные сайты связывания рибосом были описаны, такие как, например, PKC30 (Shimatake and Rosenberg, Nature 292, 128, 1981); pKK173-3 (Amann and Brosius, Gene 40, 183, 1985), pET-3 (Studier and Moffat, J. Mol. Biol. 189, 113, 1986); набор pCR vector suite (Invitrogen), набор pGEM-T Easy vectors (Promega), набор pL expression vector suite (Invitrogen), pBAD/TOPO или pBAD/thio - TOPO серии векторов, содержащие арабиноза-индуцибельный промотор (Invitrogen, Carlsbad, CA), последняя из которых разработана также для продукции химерных белков с петлей Trx для конформационного ограничения экспрессируемого белка; серии экспрессирующих вектора pFLEX (Pfizer nc., CT,USA); серии экспрессирующих веекторов (QIAGEN, CA, USA), серии экспрессирующих векторов pL (Invitrogen) среди прочих.
Типичные промоторы, пригодные для экспрессии в клетках дрожжей, таких как, например, клетки дрожжей, выбранные из группы, включающей Pichia pastoris, S.cerevisiae и S. pombe, включают в себя, помимо прочего, промотор ADH1, промотор GAL, промотор GAL4, промотор CUP1, промотор PHO5, промотор nmt, промотор RPR1 или промотор TEF1.
Экспрессирующие векторы для экспрессии в клетках дрожжей включают, помимо прочего, вектор pACT (Clontech), вектор pDBleu-X, набор pPIC vector suite (Invitrogen), набор pGAPZ vector suite (Invitrogen), вектор pHYB (Invitrogen), вектор pYD1 (Invitrogen) и векторы TOPO pNMT1, pNMT41, pNMT81 (Invitrogen), вектор pPC86-Y (Invitrogen), серии векторов pRH (Invitrogen), серии векторов pYESTrp (Invitrogen). Ряд других экспрессирующих конструкций и способы их использования известны в данной области техники и описаны, например, в in Giga-Hama and Kumagai (In: Foreign Gene Expression in Fission Yeast: Schizosaccharomyces pombe, Springer Verlag, ISBN 3540632700, 1997) и Guthrie and Fink (In: Guide to Yeast Genetics and Molecular and Cell Biology Academic Press, ISBN 0121822540, 2002).
Экспрессирующие конструкции или экспрессирующие векторы вводят в микроорганизмы, используя стандартные способы, известных в данной области техники. Например, обработку с использованием поливалентных катионов (например, кальция), как описано в книге Sambrook et al., Molecular Cloning : A Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989), как правило, используют для бактериальных клеток, которые содержат прочную клеточную стенку. В другом способе трансформации используют полиэтиленгликоль/ДМСО, как описано в статье Chung and Miller, Nucleic Acids Res., 16: 3580 (1988). Другие способы включают электропорацию, трансфекцию с использованием катионных липидов, вирусную доставку и репродуктивные стратегии для грибов.
После получения рекомбинантного микроорганизма, микроорганизм культивируют в условиях, достаточных для получения популяции микроорганизмов, экспрессирующей растворимый белок. Таким образом, способ по настоящему изобретению также включает производство рекомбинантной клетки и/или экспрессию растворимого белка.
Микроорганизмы, используемые для получения растворимого белка, культивируют в подходящей среде, в которой промоторы могут быть индуцированы, как описано выше в общих чертах в книге Sambrook и др. и/или Ausubel и др., и/или являются коммерчески доступными. Любые другие необходимые добавки, кроме источников углерода, азота и неорганического фосфата, также могут быть включены в соответствующих концентрациях, вводимых по отдельности или в виде смеси с другой добавкой или средой, такой как комплексный источник азота. Значение рН среды может принимать любое значение в диапазоне приблизительно от 5 до 9 в зависимости, главным образом, от организма-хозяина. Для накопления растворимого белка микроорганизм культивируют в условиях, достаточных для накопления растворимого белка. Такие условия включают, например, температуру, питательные вещества и условия накопления клеточной плотности, которые обеспечивают экспрессию белка и накопление микроорганизмом. Кроме того, такие условия являются теми, при которых микроорганизм может выполнять основные клеточные функции транскрипции, трансляции и транспорта белков из одного клеточного компартмента в другой, как известно специалистам в данной области техники.
В случае индуцибельной экспрессии, например, с использованием индуцибельного промотора, как правило, клетки культивируют до достижения определенной оптической плотности, при которой начинают индукцию (например, путем добавления индуктора, истощения репрессора, супрессора или компонента среды и т.д.), чтобы индуцировать экспрессию гена, кодирующего растворимый белок.
Белки
Настоящее изобретение включает в себя экстракцию какого-либо белка, который остается растворимым в микроорганизме, например, не образует тельца включения в бактериях.
В одном примере осуществления изобретения растворимый белок имеет значение pI, обеспечивающее возможность белку оставаться растворимым, когда белок экстрагируют из популяции микроорганизмов.
В одном из примеров изобретения растворимый белок имеет значение pI, равное приблизительно 7,5 или более, или 8 или более, или 8,5 или более, или 9 или более, или 9,5 или более, или 10 или более, или 10,5 или более, или 11 или более, или 11,5 или более, или 12 или более, или 12,5 или более, или 13 или более.
В одном из примеров осуществления изобретения растворимый белок имеет значение pI, равное приблизительно 6,5 или менее, или 6 или менее, или 5,5 или менее, или 5 или менее, или 4,5 или менее, или 4 или менее, или 3,5 или менее, или 3 или менее, или 2,5 или менее, или 2 или менее. Например, белок имеет значение pI в диапазоне приблизительно от 3 до 6, например, в диапазоне приблизительно от 4 до 5, например, приблизительно 4,6.
В одном из примеров осуществления изобретения растворимый белок имеет значение pI, равное приблизительно 7, например, в диапазоне приблизительно от 6 до 7.
Способы определения или оценки pI белка очевидны специалисту в данной области техники. Например, теоретическое значение pI белка может быть предсказано с использованием способа, описанного в Bjellqvist et al., Electrophoresis, 14: 1023-1031, 1993. Алгоритм, описанный Bjellqvist и другими, внедрен в программу Compute pI tool, доступную на сервере ExPasy Proteomics Server, находящемся в швейцарском институте биоинформатики Swiss Institute of Bioinformatics.
Альтернативно pI белка определяют с помощью изоэлектрического фокусирования (IEF). IEF включает в себя добавление раствора амфотерного соединения в гель с иммобилизованным градиентом рН (IPG). IPG представляют собой акриламидный гелевый матрикс, сополимеризующийся с градиентом рН. Электрический ток пропускают через гель, создавая «положительный» анодный конец и «отрицательный» катодный конец. Отрицательно заряженные белки мигрируют через градиент рН в среде по направлению к «положительному» концу, в то время как положительно заряженные белки движутся к «отрицательному» концу. Поскольку белок движется в направлении полюса, противоположному его заряду, он движется через изменяющийся градиент рН до тех пор, пока не достигнет зоны рН, соответствующей изоэлектрической точке белка. В этой точке белок больше не имеет чистого электрического заряда (из-за протонирования или депротонирования соответствующих функциональных групп) и соответственно не будет далее продвигаться в геле.
В одном из примеров осуществления изобретения белок используют в терапевтических целях, например, у людей. Иллюстративные белки включают рекомбинантный человеческий интерлейкин-11 (Opreleukin; pI 11,85), интерферон (alfacon 1; pI 9), интерферон бета (pI 8,9), интерферон гамма, активатора плазминогена тканевого типа (tPA), урокиназа, октреотид (pI 8,29) или фактор роста кератиноцитов (pI 10,42).
В одном из примеров осуществления изобретения белок представляет собой интерферон, например, интерферон бета.
В одном из примеров осуществления изобретения белок представляет собой интерлейкин, например, лимфокин, такой как IL-2.
В одном из примеров осуществления изобретения белок содержит вариабельный домен антитела. Иллюстративные содержащие вариабельный домен белки включают, например, доменные антитела (например, US6248516), фрагмент Fab, фрагмент Fab’, фрагмент F(ab’), scFv (например, как описано в US5260203), диатело, триатело, тетратело или комплекс более высокого порядка (например, как описано в WO98/044001 и/или WO94/007921). Например, белок представляет собой фрагмент Fab антитела. Например, белок представляет собой абциксимаб, ранибизумаб или цертолизумаб (которые могут быть конъюгированы с полиэтиленгликолем для получения Цертолизумаба пегола).
В одном примере осуществления изобретения белок представляет собой склеропротеин. Например, белок представляет собой коллаген (например, коллаген типа I, коллаген типа II, коллаген типа III, коллаген типа IV, коллаген типа V, коллаген типа VI, коллаген типа VII, коллаген типа VIII, коллаген типа IX, коллаген типа X, коллаген типа XI, коллаген типа XII), тенасцина (например, тенасцин C или тенасцин Х), ламинин (например, ламинин альфа, ламинин бета или ламинин гамма), фибриллин, ALCAM, витронектин, декорин, матриксный белок gla, эластин, тропоэластин или текторин.
В одном из примеров осуществления изобретения белок содержит или имеет суперспирализованную структуру. Например, белок выбирают из группы, состоящей из фибриногена, без поперечных сшивок кератин (эпидермин), миозин, тропомиозин и коллаген.
В другом примере осуществления изобретения белок представляет собой шаперонин или белок теплового шока. В одном из примеров осуществления изобретения белок представляет собой шаперонин типа I или шаперонин типа II. Иллюстративные шаперонины описаны, например, в Hill et al., Genome Res. 14:1669-1675, 2004. В одном из примеров осуществления изобретения белок представляет собой шаперонин 10, например, как описано в US7618935.
В другом примере осуществления изобретения растворимый белок представляет собой натрийуретический пептид или его активный фрагмент.
В дополнительном примере осуществления изобретения растворимый белок представляет собой иммуногенный фрагмент белка, например, используемый в вакцине.
В одном из примеров осуществления изобретения белок представляет собой химерный белок.
Например, такой химерный белок может содержать несколько копий пептида или полипептида, например, для облегчения крупномасштабного производства.
В другом примере осуществления изобретения химерный белок содержит метку, например, для облегчения очистки или детекции, например, метку гекса-His.
В дополнительном примере осуществления изобретения химерный белок содержит два пептида или полипептида, сцепленные один с другим. Например, химерный белок содержит пептид или полипептид, сцепленный с Fc-областью антитела, например, антитела IgG. Например, химерный белок содержит один или несколько (например, два) домена связывания рецептора тромбопоэтина, сцепленных с Fc-областью антитела. Например, сцепленный белок представляет собой ромиплостим.
Ссылка на белок в настоящем документе включает в себя мутанты белка, например, содержащие одну или несколько консервативных аминокислотных замен, одну или более делеций и/или одну или несколько инсерций. В одном из примеров осуществления изобретения белок содержит менее 20 замен и/или делеций и/или инсерций.
Модификации белка
Белки, экстрагированные или выделенные способом по настоящему изобретению, могут быть модифицированы, например, путем конъюгации с другим соединением. Например, другое соединение выбирают из группы, состоящей из радиоизотопа, детектируемой метки, терапевтического соединения, коллоида, токсина, нуклеиновой кислоты, пептида, белка, соединения, которое увеличивает время жизни белка в субъекте, и их смесей.
Иллюстративные соединения приведены в Таблице 2.
Очистка белка
В некоторых примерах осуществления изобретения способ по настоящему изобретению дополнительно включает очистку белка. Различные способы очистки белков известны в данной области техники.
Белок, полученный из микроорганизмов, может быть очищен, используя, например, ионообменную хроматографию, гидроксиапатитную хроматографию, фторапатитовую хроматографию, вытеснительную хроматографию, гель-электрофорез, диализ, ультрафильтрацию или аффинную хроматографию. Эти способики известны в данной области техники и описаны, например, в Scopes (In: Protein purification: principles and practice, Third Edition, Springer Verlag, 1994). Другие способы очистки белка, такие как осаждение этанолом, обращенно-фазовая ВЭЖХ, хроматографии на диоксиде кремния, хроматография на гепарине, хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония также существуют в зависимости от белка, подлежащего выделению.
Специалисту также известно, что растворимый белок может быть модифицирован для включения в свой состав метки для облегчения очистки или детекции, например, полигистидиновая метка, например, гексагистидиновая метка, или гемагглютининовая метка (HA) вируса гриппа, или метка вируса обезьяны 5 (V5), или метка FLAG, или метка глутатион-S-трансферазы (GST). Предпочтительно, метка представляет собой метку гекса-his тег. Полученный белок затем очищают с использованием способов, известных в данной области техники, такие как, аффинная очистка. Например, белок, содержащий метку гекса-his, очищают путем взаимодействия образца, содержащего белок, с никель-нитрилтриуксусной кислотой (Ni-NTA), которая специфически связывает метку гекса-his, иммобилизованную на твердой или полутвердой подложке, промывания образца для удаления несвязанного белка, а затем элюирования связанного белка.
Лекарственная форма
Белок, экстрагированный и/или очищенный, как описано в настоящем документе, может быть включен в состав композиции. Например, композиции могут быть для парентерального введения, местного введения, перорального введения, внутримышечного введения, внутриглазного введения, подкожного введения, местного введения, аэрозольного введения, внутрикожного введения или чрескожного введения для профилактики или для терапевтического лечения или для косметического лечения.
Как правило, терапевтически эффективное количество белка будет приготовлено в виде композиции для введения субъекту. Фраза «терапевтически эффективное количество» относится к количеству, достаточному для инициации, индуцирования и/или улучшения лечения или другого терапевтического эффекта у субъекта. Очевидно, что концентрация белка в такой композиции может варьироваться в широких пределах, и будет выбрана, главным образом, руководствуясь объемами жидкости, вязкости, массы тела и тому подобное в соответствии с конкретным выбранным способом введения и потребностями пациента. В зависимости от типа и тяжести заболевания, терапевтически эффективное количество может составлять приблизительно от 1 мкг/кг до 150 мг/кг белка, будь то, например, посредством одного или нескольких отдельных введений или путем непрерывной инфузии. Типичная суточная доза может составлять приблизительно от 1 мкг/кг до 100 мг/кг или более. Приводимая в качестве примера доза белка, подлежащая введению пациенту, составляет приблизительно от 0,1 до приблизительно 10 мг/кг массы тела пациента.
Композиции для введения, как правило, содержат раствор белка, растворенного в фармацевтически приемлемом носителе, предпочтительно в водном носителе. Разнообразие водных носителей может быть использовано, например, буферный солевой раствор и тому подобное. Другие приводимые в качестве примера носители включают воду, физиологический раствор, раствор Рингера, раствор декстрозы и 5% сывороточный альбумин человека. Также могут быть использованы неводные наполнители, такие как смешанные масла и этилолеат. Липосомы могут быть также использованы в качестве носителей. Носители могут содержать незначительные количества добавок, которые увеличивают изотоничность и химическую стабильность, например, буферы и консерванты. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, необходимые для приближения к физиологическим условиям, такие как регуляторы рН и буферные агенты, регуляторы токсичности и тому подобное, например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и тому подобное.
Способики приготовления фармацевтических композиций, в основном, известны в данной области, примером чего является Remington's Pharmaceutical Sciences, 16th Ed. Mack Publishing Company, 1980.
Белки, экстрагированные, выделенные или полученные способом, описанным в настоящем документе, в соответствии с любым примером могут быть иммобилизованы на твердой или полутвердой подложке или внутри нее. Иллюстративные полутвердые подложки обычно представляют собой матрикс, изготовленный из материалов, как правило, полимеров, которые способны деградировать при ферментативном или кислотном/щелочном гидролизе или путем растворения. После попадания в организм матрикс находится под действием ферментов и жидкостей организма. Матрикс с пролонгированным высвобождением предпочтительно выбирают из биологически совместимых материалов, таких как липосомы, полилактиды (полимолочная кислота), полигликолид (полимер гликолевой кислоты), полилактид-ко-гликолид (сополимеры молочной кислоты и гликолевой кислоты), полиангидриды, поли (орто) сложные эфиры, полипротеины, гиалуроновая кислота, коллаген, хондроитинсульфат, карбоновые кислоты, жирные кислоты, фосфолипиды, полисахариды, нуклеиновые кислоты, полиаминокислоты, аминокислоты, такие как фенилаланин, тирозин, изолейцин, полинуклеотиды, поливиниловый пропилен, поливинилпирролидон и силикон.
Примеры твердых подложек включают пластики, бинты, шовные материалы, стенты, водители ритма, кохлеарные имплантаты или костные и/или спинальные имплантаты.
Композиции, полутвердые подложки и твердые подложки, описанные в настоящем документе, могут содержать дополнительные компоненты. Например, дополнительный компонент представляет собой соединение (например, белок), который обеспечивает терапевтический или косметический эффект или усиливает терапевтический или косметический эффект экстрагированного белка или взаимодействует или связывается с экстрагированным белком, например, с образованием комплекса.
Композиции, полутвердые подложки и твердые подложки, описанные в настоящем документе, подходят для различных целей, в том числе фармацевтических, ветеринарных, косметических, космецевтических целей или для имплантации или нанесения на субъект. Полутвердые и твердые носители пригодны для увеличения объема ткани, коррекции дефекта ткани и закрытия раневой поверхности. Аналогичным образом, композиции, которые представляют собой тканевые матрицы, пригодны для увеличения объема ткани, коррекции дефекта ткани и закрытия раневой поверхности.
Композиции, твердые подложки или полутвердые подложки, описанные в настоящем документе, могут быть введены путем инъекции, имплантации, пульверизации, втирания, обливания, намазывания или контактирования.
Настоящее изобретение также включает в себя медицинские устройства, содержащие белок, выделенный, экстрагированный или полученный способом, описанным в настоящем документе. Термин «медицинское устройство» охватывает любую композицию вещества, которую контролирующий орган классифицирует как медицинское устройство. Таким образом, этот термин может включать в себя, бинты и другие перевязочные материалы, шовные материалы, имплантаты, шприцы, стенты, безыгольный инъектор и водители ритма среди прочих.
Наборы реагентов
Настоящее изобретение также предоставляет набор реагентов, содержащий карбоновую кислоту, упакованную с инструкциями для применения в способе, описанном в настоящем документе.
В одном из примеров осуществления изобретения набор реагентов дополнительно содержит микроорганизм для использования в производстве популяции микроорганизмов, экспрессирующих растворимый белок, подлежащий экстрагированию.
В другом примере осуществления изобретения набор реагентов включает в себя микроорганизм для использования в производстве популяции микроорганизмов, экспрессирующих растворимый белок, подлежащий экстрагированию, и инструкции по экстрагированию белка способом, описанным в настоящем документе.
В другом примере осуществления изобретения набор реагентов содержит белок, экстрагированный способом настоящего изобретения.
В другом примере осуществления изобретения набор реагентов содержит твердую подложку или полутвердую подложку или медицинское устройство в соответствии с настоящим изобретением.
ПРИМЕРЫ
Приведенные ниже примеры демонстрируют, что различные карбоновые кислоты пригодны для экстракции растворимого белка (например, рекомбинантного растворимого белка) из микроорганизмов (например, E.coli).
Пример 1:Сравнение различных способов экстракции рекомбинантного белка
Протоколы, использующие карбоновые кислоты, н-пропанол или мочевину, тестировали на способность экстрагировать рекомбинантный белок, имеющий значение pI, равное 7,5 и MW, равный приблизительно 72kDa, из бактериальных клеток.
Тестируемые растворы для экстракции:
1. 100мM (0,57% (объем/объем)) уксусная кислота (комнатная температура);
2. 100 мМ уксусная кислота (0,57% объем/объем)) (при 4°С);
3. 2,2М (10% (вес/объем)) муравьиная кислота (4°С);
4. 60% н-пропанол;
5. 15 мм NaOH; и
6. раствор мочевины для экстракции.
В Таблице 3 приведен вес клеток, обработанных каждым раствором.
5 мл раствора добавляли к 1 г (влажная масса) клеток и перемешивали в течение 1 часа. Растворы затем осаждали центрифугированием и отбирали супернатанты.
Клетки, обработанные 15мМ NaOH, инкубировали в течение 15 мин до добавления 100 мкл 1М бората (рН 8,0), чтобы довести рН приблизительно до 8,0 и получить раствор с концентрацией приблизительно 20 мМ бората.
После обработки 10 мкл экстракта в н-пропаноле сушат с использованием Hetovac и ресуспендируют в 13 мкл додецилсульфатлитиевом (LDS)буфере для образцов для нанесения на 4-12% SDS-полиакриламидный гель для электрофореза. Для всех остальных образцов, 10 мкл супернатанта смешивали с 3 мкл LDS буфера для образцов и наносили на гель. Результаты представлены на Чертеже 1.
Результаты показывают, что раствор NaOH или 0,57% (объем/объем) уксусной кислоты не растворяют рекомбинантный белок в значительной степени. Экстракция муравьиной кислотой растворяла белок специфически, как и н-пропанол. Мочевина растворяла многие клеточные белки, что приводило к перегрузке на Чертеже 1. На результат с мочевиной, также возможно отрицательно влияют большие количества нуклеиновой кислоты, которая, как ожидается, будет растворена.
Пример 2: Экстракция уксусной кислотой рекомбинантного белка
Как показано в Примере 1, муравьиная кислота может быть использована для экстракции рекомбинантного белка из E.coli. Уксусная кислота подобна муравьиной кислоте в том, что она является относительно слабой карбоновой кислотой. Уксусная кислота также является недорогой и безопасной для хранения, обработки и утилизации. Соответственно, уксусная кислота была протестирована на способность экстрагировать рекомбинантный белок, как описано в Примере 1, из E.coli.
Уксусная кислота была протестирована в концентрации 2% (объем/объем); рН 2,71, 5% (объем/объем); рН 2,47 и 10% (объем/объем); рН 2,22.
Клетки растворяли следующим образом:
2% уксусная кислота: 1,12 г (влажная масса) клеточной пасты + 5мл 2% (объем/объем) уксусной кислоты.
5% уксусная кислота: 1,01 г (влажная масса) клеточной пасты + 5мл 5% (объем/объем) уксусной кислоты.
10% уксусная кислота: 1 г (влажная масса) клеточной пасты + 5мл 10% (объем/объем) уксусной кислоты.
Мочевина: 1,08 г (влажная масса) клеточной пасты + 5 мл буфера мочевины.
Образцы перемешивали на вортексе, и клеточную пасту измельчали с помощью шпателя для перемешивания. Затем образцы помещали на вращающейся миксер для перемешивания в течение приблизительно 1,5 часов. Один мл образца отбирали из каждого образца и осаждали центрифугированием при 14000 оборотов в минуту в настольной центрифуге Eppendorf™. Десять мкл супернатанта отбирали для анализа с помощью SDS-PAGE. Результаты показаны на Чертеже 2.
Анализ SDS-PAGE указывает на то, что растворение под действием уксусной кислоты является весьма специфичным для белка, то есть, другие белки из клеток не были растворены в значительной степени. Этот результат противоположен таковому при экстракции с мочевиной.
В условиях уксусной экстракции после центрифугирования осадок был четко сформирован, и супернатант был слегка желтого цвета. В отличие от этого, после экстракции мочевины и центрифугирования супернатант был темно-желтым, а осадок был неплотным или «слизистым».
Анализ HPLC указывает на то, что рекомбинантный белок, экстрагированный с помощью 2% (объем/объем), 5% (объем/объем) или 10% (объем/объем) уксусной кислотой, элюируется в той же точке на хроматограмме, что и контрольный белок (то есть, полученный с использованием другого способа). Эти данные указывают на то, что белок принимает правильную форму и, по всей видимости, не поврежден кислотной экстракцией.
Как HPLC анализ, так и SDS-PAGE анализ указывают на то, что при экстракции 10% уксусной кислотой получают больше рекомбинантного белка по сравнению с экстракцией 5% уксусной кислотой, а при экстракции 5% кислотой выход белка выше по сравнению с экстракцией 2% кислотой. Более того, экстрагированный уксусной кислотой белок был значительно более чистым, чем белок при экстракции мочевиной (70,6% чистоты при экстракции 10% уксусной кислотой по сравнению с 48,6% чистой при экстракции мочевиной по данным HPLC анализа).
Пример 3: Характеристика условий экстракции уксусной кислотой
Для определения влияния концентрации уксусной кислоты, времени инкубации и соотношение растворения (мл кислоты:граммы клеток с влажной массой) был разработан дизайн Box-Behnken. Рассматриваемыми факторами были:
концентрация уксусной кислоты (% объем/объем): Минимум = 10%, максимум = 25%
Время инкубации (часы): Минимум = 1, Максимум = 5
Коэффициент растворения (мл кислоты:граммы клеток с влажной массой): Минимум = 1, Максимум = 9
Переменные были протестированы, как указано в Таблице 4.
Все реакционные смеси перемешивали на вортексе, и любую клеточную массу, прилипшую к реакционной пробирке, перемешивали стеклянной пипеткой Пастера перед ее помещением на вращающейся миксер на время реакции.
Реакционную смесь 1 отбирали, а затем возвращали во вращающийся миксер на дополнительные 19 часов.
Реакционные смеси перемешивали на вортексе до взятия образцов для обеспечения полного перемешивания раствора. В каждый момент времени 1 мл раствора удаляли из реакционной смеси, центрифугировали в течение 4 мин при 14 000 оборотах в минуту в центрифуге Eppendorf™ и отбирали приблизительно 500 мкл супернатанта и хранили до проведения анализа с помощью HPLC. Результаты сведены в Таблицу 5.
Результаты также изображены на Чертежах 3 и 4.
Результаты показывают, что уксусная кислота способна экстрагировать рекомбинантный белок после инкубации в течение различных промежутков времени и время инкубации существенно не влияет на выделение и степень чистоты. Таким образом, эти результаты демонстрируют, что лизис клеток и/или экстракция белка в тестируемых условиях происходит быстро, т.е., уровень лизиса и/или экстракции за один час подобен таковому за 3, 5 или 20 часов. Это кажется парадоксальным, поскольку можно было бы ожидать, что более длительное время инкубации приведет к более высокому уровню лизиса клеток. Результаты также демонстрируют, что концентрация уксусной кислоты и соотношение растворения оказывало самое сильное влияние на выход (концентрация: коэффициент регрессии равен 0,22; р<0,005; соотношение: коэффициент регрессии равен 0,16, р<0,05) и степень чистоты (концентрация: коэффициент регрессии равен 12,05; р<0,005; соотношение: коэффициент регрессии равен 13,65, р<0,005). Как степень чистоты, так и выход увеличиваются с увеличением концентрации и соотношения растворения.
Пример 4: Влияние количества уксусной кислоты на выделение белка и степень чистоты
Эксперименты были выполнены с целью определения влияния различных концентраций уксусной кислоты и влияния времени экстракции на количество рекомбинантного белка и степени чистоты белка, экстрагированного из E.coli. Клетки, экспрессирующие один и тот же белок, как в Примере 1, были проанализированы.
Экстракцию (используя концентрации уксусной кислоты (%): 25, 37,5, 50, 62,5, 75, 87,5, 100) оставляли до завершения (то есть, проводили экстракцию в течение ночи 20±4 ч). Затем супернатант анализировали с помощью RP-HPLC, и количество экстрагированного рекомбинантного белка и получаемую степень чистоты определяли путем сравнения с площадью пика и степенью чистоты эталонного стандарта.
На Чертеже 5 представлены результаты анализа способом SDS-PAGE, демонстрирующие, что возрастающие концентрации уксусной кислоты экстрагировали повышенные уровни рекомбинантного белка, однако повышенные уровни примесей также были экстрагированы.
Результаты анализа экстрактов с использованием RP-HPLC представлены в Таблице 6. Эти данные свидетельствуют о том, что степень чистоты начинает уменьшаться при концентрации свыше приблизительно 62,5%.
Данные, приведенные в Таблице 6, также представлены графически на Чертеже 6, который показывает корреляцию между концентрацией уксусной кислоты и выходом рекомбинантного белка и обратную корреляцию между концентрацией уксусной кислоты и степенью чистоты, как только достигается пороговая концентрация.
Сто мкл реакционных смесей, приготовленных, как описано выше, были отобраны в различные временные точки (5, 10, 20, 40 и 60 минут), без промедления центрифугированы, и супернатант был удален. Супернатант анализировали с помощью RP-HPLC и сравнивали с эталонным стандартом для определения количества и степени чистоты. Результаты этого анализа представлены в Таблицах 7 и 8 и Чертеже 7. Анализ SDS-PAGE был также выполнен для предоставления ортогонального способа сравнения степени чистоты получаемого белка, и результаты представлены на Чертеже 8.
Пример 5: Экстракция химерного белка, используя уксусную кислоту
Бактериальные клетки, экспрессирующие химерный белок, содержащий три копии пептида и имеющий значение pI, равное приблизительно 4,6, были выращены, собраны и заморажены. Затем клетки лизировали или химерный белок экстрагировали путем взаимодействия клеток с раствором 25% уксусной кислоты (объем/объем) в течение одного часа, центрифугировали и собирали супернатант. Анализ полученных композиций способом SDS-PAGE представлен на Чертеже 9. Эти данные демонстрируют, что экстракция уксусной кислотой в значительной степени уменьшает риск контаминирования белками клетки-хозяина. Эти данные также демонстрируют, что способ экстракции, описанный в настоящем документе, применим к химерным белкам и/или белкам, имеющим кислое значение pI.
Реферат
Группа изобретений относится к экстракции растворимого белка из популяции микроорганизмов. Предложен способ экстракции растворимого белка из популяции микроорганизмов, предусматривающий взаимодействие популяции микроорганизмов, экспрессирующих растворимый белок, с количеством раствора, содержащего от 25% (объем/объем) до 37,5% (объем/объем) карбоновой кислоты, эффективной для экстракции растворимого белка из популяции микроорганизмов, где рН раствора составляет от 2 до 6 и где карбоновая кислота представляет собой уксусную кислоту или муравьиную кислоту. При этом растворимый белок представляет собой тропоэластин, взаимодействие проводят при температуре от 4°С до 30°С и взаимодействие приводит к экстракции растворимого белка из микроорганизмов, где растворимый белок растворен в растворе. Тропоэластин, экстрагированный вышеуказанным способом, используют в способе получения композиции и способе получения твердой или полутвердой подложки. Также предложены варианты способа экстракции растворимого белка из популяции микроорганизмов. Изобретение позволяет получить растворимые белки с высокой степенью чистоты. 5 н. и 15 з.п. ф-лы, 8 табл., 5 пр., 9 ил.
Формула
Документы, цитированные в отчёте о поиске
Осаждение и очистка белков полиэлектролитами

Комментарии