Способ получения наночастиц полисахаридов - RU2632019C2
Код документа: RU2632019C2
Чертежи

Описание
Изобретение относится к способу получения наночастиц из полисахаридов и их производных путем специфического окисления полисахаридных цепей и присоединения гидрофобных соединений, в том числе лекарственных средств.
Известны конъюгаты соединений из группы полисахаридов и химических веществ, которые обладают терапевтической активностью и включают аминогруппы. Например, в WO 2012/004007 описаны конъюгаты гидроксиэтилированной производной крахмала и различных медикаментов. В WO 03/000738 описаны антибиотик - крахмал конъюгаты, где антибиотик, прикреплен к восстанавливающей связи полисахарида с помощью пептидного соединения. Прикрепление получают окислением производных крахмала с I2 на ее восстановленном конце в щелочном водном растворе, с последующим сочетанием окисленного производного с антибиотиком в органическом растворе. Кроме того, из международной заявки WO 03/15826 известна фармацевтическая композиция для ингибирования метастазов или предотвращения рецидива злокачественной рака, которая включает в качестве активного начала полисахарид с карбоксильной группой, связанный с активным противоопухолевым веществом с помощью аминокислот или пептидов, содержащих от 2 до 8 аминокислот.
Применение WO 03/074087 относится к соединению белков с модифицировавши производными полисахарида, крахмалам и белкам, включающим ковалентную связь в результате реакции сочетания между концевой альдегидной группой модифицированного полисахарида и функциональной группой белка, способного реагировать с указанной альдегидной группой. Изобретение раскрывает также фармацевтические композиции, которые включают соединения, полученные путем связи и применения указанных соединений для профилактического или терапевтического лечения людей или животных.
Из международной заявки WO 2011/069475 известен процесс для приготовления окисленных производных гиалуроновой кислоты и способ модификации таких производных. В соответствии с данным способом гиалуроновая кислота окисляется с определенным окислителем TEMPO, чтобы получить кислотную производную альдегидных групп. Производная затем используется для соединения с аминами, диаминами, аминокислотами, пептидами и другими аминосодержащими соединениями. Такое связывание осуществляется путем восстановительного аминирования NaBHaCN, в воде или в смеси воды и органического растворителя.
Вышеуказанные изобретения обеспечивают соединения (конъюгаты) из полисахаридов и различных видов терапевтических веществ, однако любое из решений было направлено на получение полисахаридных наночастиц. Между тем, наночастицы в настоящее время интенсивно изучаются в качестве потенциальных носителей для лекарственных препаратов благодаря ряду новых заданных свойств [биоразлагаемые наночастицы являются прекрасным средством для направленой доставки лекарств и вакцин в живых организмах, Махапарто А., Сингх К., журнал Нанобиотехнологии, 9, 2011]. Наночастицы с диаметрами от 50 нм до 200 нм, имеющие подходящие свойства поверхности, могут циркулировать в течение длительного времени в крови, избегая поглощения почками, печенью или фильтрации селезенкой (длинные циркулирующие частицы, стелс-частицы).
Поверхность таких наночастиц не должена вызвать ни ответа иммунной системы, ни агрегации мелких белков плазмы - опсонинов. В этом случае желательно создавать поверхностные свойства гидрогеля высоко гидрофильными полимерами, такими как полиэтиленгликоль, полисахариды, поливиниловый спирт. Полисахариды являются особенно желательными вследствие их часто естественного происхождения, способности к биологическому разложению и подобия веществ, имеющихся в организме. Такие длинные циркулирующие наночастицы имеют тенденцию накапливаться в областях опухолей или воспалений (пассивная адресность) [Терапевтические наночастицы для доставки лекарств при раке, Кванжи Чо, Сюй Ван, Шумминг Рай, Чжо Чен Донг М. Шин, Клин. раковые иссл. 2008 14.; 1310]. Эффект обусловлен тем, что клеточные мембраны эндотелиальных клеток циркуляторной системы плотно обволакиваются с помощью соответствующих белков и зазор между ними составляет несколько нанометров.
В опухоли или в области воспаления зазоры гораздо шире и достигают нескольких сотен нанометров. Это позволяет наночастицам накапливаются в зазорах и "утекать" из кровотока в окружающие пораженные ткани, в том числе в опухоли. Такое пассивное накопление наночастиц в области пораженных болезнью тканей позволяет увеличить концентрацию лекарственного средства в таких областях, повышает эффективность лечения и уменьшает побочные эффекты. Дополнительной особенностью наночастиц является их способность быть поверхностно модифицированными подходящими белками, метаболитами или антителами для проявления активного сродства к специфическим типам клеток, в том числе опухолевым клеткам. Это позволяет доставлять лекарственные средства прежде всего к пораженным клеткам. Желательно подготавливать поверхность наночастиц полисахаридами в связи с тем, что опухолевые клетки обладают значительно повышенной потребностью в глюкозе (эффект Варбурга), который, в свою очередь, позволяет получить повышенное сродство наночастиц полисахаридов с опухолевыми клетками.
Такие полисахаридные наночастицы с лекарством могли бы более эффективно проникать в раковые клетки и убивать их, в то же время частицы, помеченные флуоресцентным маркером, становятся эффективным диагностическим инструментом. Другим важным применением наночастиц является генная терапия. Наночастицы, содержащие РНК или ДНК-фрагмент, способны проникать в клетку и влиять на процессы распознавания генов, происходящие в клетке. В этом случае увеличиваются шансы на исцеление генетических заболеваний.
Есть множество методов для получения наночастиц, но, к сожалению, большинство из них очень сложны и требуют применения специфических условий (УЗИ, высокие температуры), агрессивных химических соединений, токсичных органических растворителей или поверхностно-активных соединений [Биоразлагаемые наночастицы являются прекрасным средством для направленной доставки лекарств и вакцин в живых организмах, Махапарто А., Сингх К., Журнал нанобиотехнологии, 9, 2011]. Наночастицы для терапевтического применения должны быть нетоксичными и предпочтительно биоразлагаемыми. Полисахариды являются очень хорошим материалом для подготовки таких наночастиц благодаря их биосовместимости и способности к биологическому разложению [Лемаршанд С., Р. Греф, П. Куриер, Наночастицы модифицированные полисахаридами, Европейский журнал фармацевтики и биофармации 58, 2004].
Однако, известные способы получения наночастиц из полисахаридов путем присоединения гидрофобных групп являются сложными и требуют использования поверхностно-активных веществ или агрессивных химикатов. [Наночастицы гидрофобно модифицированных декстранов как потенциальной системы доставки лекарств, Омелас А., Серреро А., Дюран, Е., Делашери Е., Леонард М., Коллоиды и поверхности В, 59, 2007]. Полученные наночастицы должны быть дополнительно очищены в течение длительного периода времени, вследствие токсических свойств составляющих их веществ.
Изобретение было направлено на разработку способа приготовления полисахаридных наночастиц в мягких условиях, чтобы обеспечить ковалентные связи терапевтических соединений, которые чувствительны к агрессивной среде.
Способ получения наночастиц из полисахаридов и их производных путем их 5 частичного окисления для получения альдегидных групп и прикрепления аминогрупп или других групп со связью R-NH2, которые реагируют с альдегидными группами в соответствии с изобретением характеризуется тем, что полисахариды с молекулярной массой до 1000 кДа или их производные окисляются до степени окисления 5% до 55% сахарных цепей причем, по крайней мере одно нанообразующее средство, которое 10 представляет собой органическое химическое соединение с R-NH2, соединяется таким образом, что прикрепленная альдегидная группа проявляет гидрофобные свойства, и, по меньшей мере одно нанообразующее средство, которое содержит, по меньшей мере, одну R-NH2 или NH связь, добавляется в раствор окисленного полисахарида в воде или в смеси воды и органического растворителя, причем реакцию проводят при рН раствора от 1 до 9, при температуре от 10 до 100°С, наиболее предпочтительно 20-60°С, где общее молярное соотношение аминных групп к альдегидным группам составляет от 20 до 0,5.
Нанообразующий агент выбирают из группы, включающей: алифатические или ароматические органические амины, содержащий от 4 до 20 атомов углерода, амиды и алифатические гидразиды и ароматические органические кислоты, содержащие от 4 до 20 атомов углерода, гидрофобные аминокислоты, фосфатидилэтаноламин. Активное вещество содержит амино-, амидо- или гидразидную группу.
Нанообразующий агент может быть добавлен одновременно с активным веществом, или после того, как добавлено активное вещество. Предпочтительно сначала добавлять активное вещество, так как реакция происходит медленнее после того, как созданы наночастицы, и в результате возможно неполное использование активного вещества и потери его при очистке продукта. Иногда активное вещество может быть накоплено в наночастицах в нанокристаллических формах, осажденных в гидрофобных областях, созданных путем накопления агента, а затем эти не ковалентно, но физически связанные вещества могут быть добавлены в больших количествах. Это тот случай, когда они плохо растворимы в воде, имеющей рН близкий к нейтральному, и хорошо растворимы при рН менее 7.
Как формирующий агент, так и активное вещество предпочтительно вводить в виде солей, которые легко растворимы в воде, например гидрохлориды. Если амин введен как легкорастворимая соль (например, гидрохлорид), pH снижен в ходе реакции, и раствор затем медленно нейтрализуется водным раствором основания. Оптимальный pH зависит от щелочности используемого амина. Как правило, увеличение концентрации ионов водорода активизирует альдегидную группу, но также приводит к снижению концентрации свободного, не протонированного амина; оптимальный pH реакции первого порядка лежит между 4 и 6, дальнейшее увеличение pH позволяет завершить процесс за счет уменьшения концентрации катионов амина.
Процесс получения наночастиц также может быть проведен в органических или смешанных растворителях, таких как вода/ДМСО, вода/ацетонитрил, вода/эфир. Чтобы увеличить устойчивость полученных наночастиц к гидролизу используется уменьшение сформированных связей с NaBFLt или NaBHsCN в водном растворе, и в мягких условиях.
Предпочтительно в качестве нанообразующих агентов используются: бутиламин, пентиламин, гексиламин, октиламин, дециламин, додециламин, тетрадециламин, гексадециламин, циклогексиламин, бензиламин, этифениламин, сфингозины, амид олеиновая кислота, амид пальмитиновая кислота, гидразид стеариновая кислота, гидразид пальмитиновой кислоты, гидразид олеиновой кислоты, лейцин, изолейцин, валин, метионин, аланин, фенилаланин или цефалин (фосфатидилэтаноламин). Предпочтительно добавлять нанообразующий агент в виде водного раствора соли амина, например, гидрохлорид, нитрат или сульфат, так как соли быстрорастворимых аминов обычно лучше растворимы в воде.
Предпочтительно, когда в качестве активного вещества используются такие, какие включают амино-, амидо- или гидразидные группы препаратов, включая такие как даунорубицин, доксорубицин, аминоакридины и их производные (например, амсакрин), цисплатин и его производные, метотрексат, цитарабин, гемцитабин, дапсон, ацикловир, азидотимидин, 5-флюорурацил, меркаптопурин, иматиниб, сунитиниб, блеомицин, актиномицин, митомицин, дактиномицин, мелфалан, темозоломид, целекоксиб, неларабин, кладрибин, изониазид, или производные лекарственных средств, в которых карбоксильная группа была преобразована в амид или гидразид; РНК или ДНК-фрагменты, пригодные для генной терапии, или их производные; простые и флуоресцентные красители, такие как 9-аминоакридина и другие акридин красители, DAPI, родамин и его производные, нейтральный красный, трипан синий.
Предпочтительно добавлять активное вещество в реакционную среду в виде водного раствора соли амина, например, гидрохлорид, нитрат или сульфат, соли быстрорастворимых аминов обычно лучше растворимы в воде. Если такое активное вещество растворяется в воде в кислой среде, но плохо растворимо в нейтральной среде, указанное вещество может быть связано в наночастицы исключительно путем физических взаимодействий. При увеличении pH это вызовет осаждение в гидрофобных областях наночастиц в виде нанокристаллов.
Предпочтительно, в качестве полисахарида использовать такой, который растворим в воде или других растворителях, и имеет молекулярную массу до 1000 кДа, а именно декстран, крахмал и его производные (гидроксиэтилкрахмал), амилозы и их производные, производные целлюлозы (гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, карбоксиметилцеллюлоза), гликоген, гиалуроновая кислота, гепарин, альгиновая кислота, карраген.
Также предпочтительно осуществлять окисление до степени 0,5% до 80% окисленных цепей сахара в полисахариде.
Предпочтительно осуществлять окисление с участием окислителя, который содержит ионы периодата (например, периодат натрия или калия), соли свинца с числом окисления +4, соединения меди с числом окисления +2 или воды в присутствии подходящих катализаторов, таких как например, оксиды ванадия. Более того, полученные наночастицы могут быть модифицированы с помощью антител или пептидов, или белков, а также с помощью реакции альдегидных групп окисленного полисахарида с аминогруппами пептидов.
Водную суспензию наночастиц, полученную таким образом, очищают диализом, осаждением, центрифугированием или используют непосредственно. Полученный раствор наночастиц может быть лиофилизован. Для лиофилизации может быть добавлено вещество, которое играет роль защитного агента (криопротектора), такое как немодифицированный полисахарид - например, декстран. Полученные наночастицы проявляют возможность самоорганизации, если они лиофилизированы до сухого порошка, после растворения в воде или физиологическом растворе, наночастицы формируются в течение нескольких минут.
В соответствии с данным изобретением, полисахариды предварительно окислены в водном растворе путем добавления заданного количества окислителя. В ходе конкретного окисления моносахарид, например, цепи глюкозы расщепляются, скорее, чем полисахаридные цепи и окисленные цепи образуют альдегидные группы. Это одна из типичных конкретных реакций окисления, используемая в органической химии, например с помощью процесса окисления моно или полисахарида с периодатами. [Джин Аллеи и Вильям С.А. Периодатное окисление декстрана, Журнал Американского химического общества 72,6, (1950): 2655-2657]. В процессе окисления, углерод-углеродная связь расщепляется с образованием -OH группы на соседних атомах углерода и альдегидные группы образуются на обоих концах. Могут быть также использованы другие методы частичного окисления, которые приводят к образованию альдегидных групп вдоль полисахаридной цепи путем расщепления моносахаридов (глюкозы) или происходить без расщепления полисахаридной цепи. Степень окисления - количество альдегидных групп - может быть определена известным способом; например, взаимодействием альдегидов с гидрохлоридом гидроксиламина и титрованием освобожденной соляной кислоты [Цао, Хийру, Хайндел, Нид Д., Определение степени замещения групп в полиальдегиде декстрана в гидрохлориде гидроксиламина. Методика, фармацевтические исследования, 8,3 (1991): 400-402]. На подготовленные полисахаридные молекулы прикрепляется образующий компаунд с помощью реакции альдегидных групп с аминогруппами, что приводит к спонтанному образованию наночастиц.
В соответствии с изобретением, окисленный полисахарид одновременно модифицируется, по меньшей мере двумя видами веществ с природой амина: нанообразующим агентом(ами) гидрофобными по своей природе, с остальными веществами, являющимися терапевтическими агентами или красителями, в то же время возможно использовать на одной наночастице несколько различных активных веществ. Это позволяет получить синергетический эффект от совместного влияния нескольких лекарственных средств. Одновременное использование нескольких лекарств значительно уменьшается возможность развития лекарственной устойчивости опухоли и способствует активному разрушению клеток независимо от фазы клеточного цикла. В способе по настоящему изобретению, благодаря гидрофобно-гидрофильному взаимодействию образуется полисахаридная наночастица, которая содержит активное вещество и гидрофобный агент внутри, а ее наружный слой состоит из гидрофильных компонентов, главным образом полисахарида.
Кроме того, можно одновременно модифицировать полисахарид нанообразующим агентом, медикаментом(ами), и компонент альдегидной группой - реактивным компонентом, который повышает сродство к определенным типам клеток, таких как антитела, нуклеотидные основания или метаболиты, например, фолиевой кислотой. При формировании наночастиц, гидрофобные агенты попадают внутрь, а гидрофильные располагаются за пределами наночастиц.
По изобретению реакция протекает в водной среде, в мягких температурных условиях и без органических растворителей или поверхностно-активных веществ. Полученные наночастицы как таковые являются нетоксичными (если приготовлены без токсического препарата) и могут быть использованы в качестве носителей для лекарственных средств или цветных флуоресцентных индикаторов, в частности для терапии и диагностики опухолей. Наночастицы могут содержать один или более образующих агентов или многочисленные медикаменты в различных комбинациях, и они могут также содержать адъюванты (дииндолилметан), которые способствуют достижению эффективности лекарственных средств.
Стабильность приготовленных макромолекул, обычно достаточна и достигает в водной среде от нескольких до более чем дюжины недель. Стабильность сухих препаратов после лиофилизации заметно выше и превышает в год при правильном хранении. Стабильность связи, образованной между амино- и альдегидными группами может быть дополнительно повышена за счет снижения связи альдегид - амина.
Способ согласно изобретению проиллюстрирован более подробно в рабочих примерах.
Пример 1.
Декстран с молекулярной массой 70 кДа был окислен периодатом натрия для окисления около 5% цепей глюкозы и очищен. Чтобы произвести это был подготовлен водный раствор декстрана и к нему добавлен периодат натрия. Стехиометрия реакции зависит от условий окисления, молекулярной массы и часто от происхождения декстрана, и составляет от 1 до 2 молей периодата на моль окисленной глюкозы (формируются две альдегидные группы), что должно быть проверено экспериментально. Процесс окисления декстрана проводили при комнатной температуре в сосуде из темного стекла в течение одного часа. Затем раствор нейтрализовали и очищали путем диализа с дистиллированной водой, а затем отгонкой воды в вакууме. Количество альдегидных групп определяли по известным методом титрования гидроксиламина. Был подготовлен 5% раствор указанного декстрана в дистиллированной воде. Затем добавлен даунорубицин гидрохлорид из расчета 15 моль% на число молей альдегидных групп в используемом количестве окисленного декстрана. Раствор перемешивали в течение 20 минут при 30°C. Затем 5% водный раствор гидрохлорида додециламина добавляли к используемому количеству окисленного декстрана при 85 моль % по отношению к начальному числу молей альдегидных групп и повышали температуру до 35°С, реакцию продолжали в течение 60 минут. Происходящая реакция вызывала понижение рН реакционной среды. Затем начинали повышение рН добавлением 5% водного раствора NaOH. Добавление проводили таким образом, чтобы повысить рН до рН 9 в течение 30 минут. После достижения рН=9, реакцию продолжали в течение еще 30 минут. Затем добавляли 5 аланин при 15 моль% по отношению к начальному числу молей альдегидых групп в используемом количестве окисленного декстрана, чтобы связать все не прореагировавшие альдегидные группы. После 15 минут перемешивания раствор нейтрализовали 5% хлористоводородной кислотой до рН=7 и очищали путем диализа в течение 24 часов. Затем было добавлено 20% по весу (в расчете на начальный вес окисленного декстрана) чистого, не окисленного декстрана в качестве криопротектора, и раствор лиофилизировали. Порошок суспендировали в воде с получением суспензии наночастиц. Распределение диаметров полученных наночастиц была измерено с помощью устройства Malvern Zeta Sizer, показанного на Фиг. 1. Измерения, проведенные с устройством NanoSight с 405 нм лазером, показали несколько меньший средний диаметр частиц и узкое распределение по диаметрам.
Пример 2.
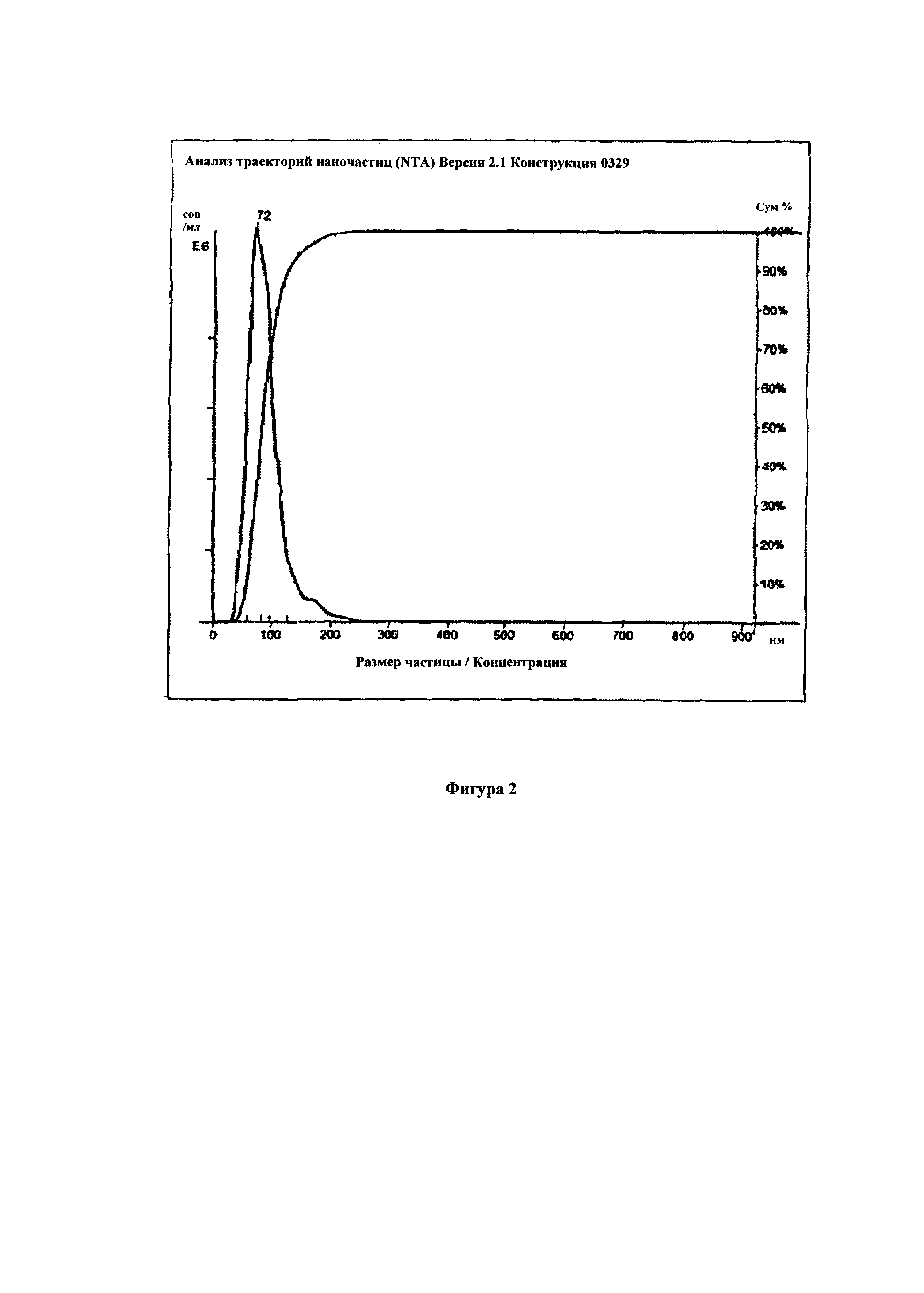
Декстран с молекулярной массой 40 кДа был окислен периодатом натрия для окисления около 20% цепей глюкозы и очищен. Был приготовлен 10% раствор такого декстрана в дистиллированной воде. Затем добавляли гидрохлорид доксорубицина из расчета 20 моль % на число молей альдегидных групп в используемом количестве окисленного декстрана. Раствор перемешивали в течение 20 минут при 30°С. Затем, добавляли 5% водный раствор гидрохлорида октиламина при 80 моль% по отношению к начальному числу молей альдегидных групп в используемом количестве окисленного декстрана и температуру повышали до 40°С, реакцию продолжали в течение 60 минут. Происходящая реакция вызывала снижение рН. Затем начинали повышение рН добавлением 5% водного раствора NaOH. Добавление проводили таким образом, чтобы повысить рН до рН 8 в течение 30 минут. После достижения рН=8 реакцию продолжали в течение еще 30 минут. Затем добавляли аланин при 10 моль% по отношению к начальному числу молей альдегидых групп в используемом количестве окисленного декстрана. После 15 минут перемешивания раствор нейтрализовали 5% хлористоводородной кислотой до рН=7 и добавляли NaBH 3 CN при 10 моль% превышении от исходного количества альдегидных групп. Затем реакцию проводили в течение 12 часов. Раствор нейтрализовали и очищали с помощью глубокого диализа в течение 48 часов, затем добавляли декстран при 50% по массе в расчете на исходный вес декстрана и лиофилизировали раствор. После ресуспендирования в воде распределение диаметров полученных наночастиц было измерено с помощью устройства NanoSight с 405 нм лазером и показано на Фиг. 2.
Пример 3.
Был приготовлен 4% водный раствор карбоксиметилцеллюлозы с молекулярной массой около 100 кДа и степенью окисления 5%, и pH доводили до pH 5. Далее был добавлен 9-аминоакридин в виде водного раствора гидрохлорида в 50 моль%, из расчета на начальное количество альдегидных групп производных целлюлозы. Затем водный октиламин добавляли при 55 моль% по отношению к начальному числу молей альдегидных групп. Реакцию проводили при 40°C в течение одного часа. Затем раствор нейтрализовали путем повышения pH до pH 9 в течение 15 минут, оставляли на 30 минут и подвергали диализу. Флуоресцентные наночастицы были получены со средним диаметром 150 нм.
Пример 4.
Декстран с молекулярной массой 70 кДа, был окислен периодатом натрия для окисления около 15% цепей глюкозы и очищен. Был приготовлен 10% раствор такого декстрана в дистиллированной воде. Затем добавляли гидрохлорид доксорубицина из расчета 25 моль% на число молей альдегидных групп в используемом количестве окисленного декстрана. Раствор перемешивали в течение 20 минут при 35°C. Затем, добавляли фолиевую кислоту при 5 моль% по отношению к исходному количеству альдегидных групп, чтобы повысить сродство наночастиц к опухолевым клеткам. Через 15 минут добавляли 5% водный раствор гидрохлорида изолейцина при 80 моль% по отношению к начальному числу молей альдегидых групп в используемом количестве окисленного декстрана и повышали температуру до 40°C, реакцию проводили в течение 60 минут.
Пример 5.
Натриевую соль карбоксиметилцеллюлозы окисляли в водном растворе перекисью водорода в присутствии тетра-сульфо железо-фталоцианинового катализатора [Вебер, Дж. Эйч и др., Комплексные производные сильных полевых лигандов…, Неорганическая химия, 1965, 4, 469-471]. Процесс проводили в течение 12 часов при 40°C, затем продукт очищали методом фильтрации с последующим диализом. Количество альдегидных групп в полученном производном альдегида карбоксиметилцеллюлозы определяли по известным методом титрования гидроксиламина. Приготавливали 5% раствор полученного производного в дистиллированной воде. Затем добавляли гидрохлорид доксорубицина из расчета 10 моль% на число молей альдегидных групп в используемом количестве окисленного декстрана. Раствор перемешивали в течение 20 минут при 30°С. Затем, 5% водный раствор гидрохлорида додециламина добавляли из расчета 90 моль% по отношению к 5 начальному числу молей альдегидных групп в используемом количестве окисленного декстрана и повышали температуру до 35°С, реакцию продолжали в течение 60 минут. Затем начинали повышение рН добавлением 5% водного раствора NaOH. Добавление проводили таким образом, чтобы повысить рН до рН 9 в течение 30 минут. После достижения рН=9 реакцию продолжали в течение еще 30 минут. Затем добавляли аланин из расчета 30 моль% по отношению к начальному числу молей альдегидных групп в используемом количестве окисленного декстрана, чтобы связать все непрореагировавшие альдегидные группы. После 15 минут перемешивания раствор нейтрализовали 5% хлористоводородной кислотой до рН=7 и очищали путем диализа в течение 24 часов. Средний диаметр полученных наночастиц, как было измерено с помощью устройства Malvern Zeta Sizer составлял 110 нм.
Пример 6.
Был приготовлен 1% водный раствор натриевой соли гиалуроновой кислоты и окислен периодатом натрия со степенью окисления 5%, как в примере 1. рН был доведен до рН 5 и были добавлены гидрохлорид даунорубицина и гидрохлорида цитарабина к каждому препарату, содержащему 10 моль% от всех альдегидных групп окисленной гиалуроновой кислоты, и реакцию проводили в течение 15 минут при 30 градусах. Затем водный раствор гидрохлорида дециламина добавляли при 85 моль% по отношению к начальному числу молей альдегидных групп. Реакцию проводили при 40°С в течение одного часа. Затем рН повышали до рН 9 в течение 20 минут, раствор нейтрализовали и подвергали диализу. Была получена водная суспензия полисахаридных наночастиц, включающая два препарата с различными механизмами действия.
Пример 7.
Декстран с молекулярной массой 70 кДа был окислен периодатом натрия, 30 молекулярное соотношение (см. пример 1) реагентов было направлено на окисление 45% цепей глюкозы. Химический анализ показал степень окисления 52%. Затем он был очищен путем диализа с дистиллированной водой и высушен сублимацией. Был приготовлен 5% раствор воды/ДМСО этого окисленного декстрана и был добавлен водный раствор гидразида тубулизина В в соотношении 20% на основании количества альдегидных групп и затем, по прошествии 1 часа, оставшийся (80%) гидразид пальмитиновой кислоты. Реакцию проводили при 30°С на протяжении 5 часов. Затем добавляли водный раствор борогидрита натрия для восстановления 30% иминных связей, реакцию проводили в течение 6 часов. Полученный раствор был подвергнут диализу с дистиллированной водой в течение ночи и высушен сублимацией.
Пример 8. Декстран с молекулярной массой 40 кДа был окислен периодатом натрия для окисления около 20% цепей глюкозы и очищен. Был приготовлен 10% раствор такого декстрана в дистиллированной воде. Затем добавляли гидрохлорид доксорубицина из расчета 50 моль % на число молей альдегидных групп в используемом количестве окисленного декстрана. Раствор перемешивали в течение 20 минут при 30°С. Затем добавляли раствор фосфатидилэтаноламина при 50 моль% по отношению к начальному числу молей альдегидных групп в используемом количестве окисленного декстрана и температуру повышали до 40°С, реакцию продолжали в течение 60 минут. Затем начинали повышение рН добавлением 5% водного раствора NaOH. Затем реакцию проводили в течение 12 часов. Раствор нейтрализовали и очищали с помощью глубокого диализа в течение 48 часов.
Реферат
Изобретение относится к способу получения наночастиц из полисахаридов и их производных путем специфического окисления полисахаридных цепей и присоединения гидрофобных соединений. Описан способ получения наночастиц полисахаридов и их производных, их частичного окисления для получения альдегидных групп и прикрепления соединений с аминогруппой или другой группой с R-NH, которые реагируют с альдегидной группой, в котором полисахарид с молекулярной массой до 1000 кДа или его производное окисляется, чтобы получить альдегидные группы, пока не будет получена степень окисления 5% до 55% сахарных цепей, и затем по крайней мере одно нанообразующее вещество, которое после прикрепления альдегидной группы проявляет гидрофобные свойства, выбирают из группы, включающей: алифатические или ароматические органические амины, содержащие от 4 до 20 атомов углерода, амиды и гидразиды алифатических и ароматических органических кислот, содержащие от 4 до 20 атомов углерода, гидрофобные аминокислоты, фосфатидилэтаноламин, и по меньшей мере одно действующее вещество, содержащее по крайней мере одну амино-, амидо- или гидразидную группу, добавляется в раствор окисленного полисахарида в воде или в смеси воды и органического растворителя, реакцию проводят при pH раствора от 1 до 9, при температуре от 10 до 100°C, причем общее молярное отношение аминогрупп к альдегидным группам составляет от 20 до 0,5. Также описана наночастица. Технический результат: разработан способ приготовления полисахаридных наночастиц в мягких условиях, чтобы обеспечить ковалентные связи терапевтических соединений, которые чувствительны к агрессивной среде. 2 н. и 18 з.п. ф-лы, 2 ил., 8 пр.

Комментарии