Функциональные плг сополимеры, их наночастицы, их получение и применение для адресной доставки лекарственного средства и получения изображения - RU2631653C2
Код документа: RU2631653C2
Чертежи




Описание
Данное изобретение относится к области адресной доставки лекарственного средства и получения изображения, и, в частности, доставки с помощью нековалентного инкапсулирования или конъюгирования лекарственного средства в поли(лактид-гликолидной) ((ПЛГ)(PEG-PLA)) наночастице.
Синтез ПЛГ наночастиц и их применение для доставки лекарственного средства описаны во множестве источников в литературе. В композиции ПЛГ, ПЛ (полилактид) (PLА)) является гидрофобным и ПЭГ (PEG) является гидрофильным. Из ПЛГ формируют наночастицы в водной среде, где ПЛ образует сердцевину и ПЭГ образует оболочку. Было показано, что при внутривенной инъекции оболочка ПЭГ в ПЛГ наночастицах защищает наночастицу от фагоцитоза ("эффект малозаметности цели") и, тем самым, минимизирует быстрый общий клиренс наночастиц, и, тем самым, повышает их системный период полужизни (в патенте США 5683723 описаны наночастицы на основе блоксополимера полиоксиэтилена и полимолочной кислоты). Более того, такие наночастицы аккумулируются в опухоли через описанный ранее эффект "увеличенной проницаемости и задержания" (УПЗ). В области рака, в частности, желательно специфичное к опухоли лечение из-за сильных побочных эффектов химиотерапии, и в этом контексте, полимерные наночастицы считаются многообещающими системами доставки лекарственного средства. При введении в ПЛГ наночастицы, лекарственные средства приобретают пролонгированную системную циркуляцию и потенциально более высокую концентрацию в опухоли благодаря эффекту УПЗ. Для доставки наночастицы с повышенной специфичностью к опухоли может применяться подход адресности ткани/аккумулирования с применением устройства самонаведения (Pulkkinen et al. Eur J Pharm Biopharm 70 (2008) 66-74, Zhan et al. J Control Rel 143 (2010) 136-142, Farokhzad et al. Cancer Res 64 (2004) 7668-7672, Gao et al. Biomaterials 27 (2006) 3482-3490).
Применение ПЛГ наночастиц далее функционализированных адресным лигандом исследовали авторы данного изобретения.
Применение клик-химии (сочетание Хьюсгена) описано в литературе для синтеза различных полимеров (Lv et al. J Colloid Interface Sci. 356 (2011) 16-23, Jubeli et al. J Polym Sci Part A: Polym Chem. 48 (2010) 3178-3187, Lecomte et al. Macromol Rapid Commun. 29 (2008) 982-997) или металлических наночастиц (Hanson et al. US2010/0260676 A1, 2010).
Клик-химия является особенно интересной, так как данный подход дает высокий выход, простые и масштабируемые условия реакции, так как реакция не чувствительна к кислороду и воде. Основа этой реакции хорошо известна, она включает небольшое количество катализатора и дает высокий совокупный выход.
Недавно Deshayes et al (Pharm. Res. (2011), 28, 1631-1642) описали конъюгирование циклопептида (применяемого в качестве лиганда, связывающегося специфично с нацеливанием на фактор роста эндотелия сосудов (ФРЭС), с наночастицами фторида поливинилидена-поли(акриловой кислоты) методами клик-химии. Клик-химия уже рассматривалась для синтеза макромолекул, содержащих ПЛ и ПЭГ полимеры. Tang et al, Macromolecules 2011, 44, 1491-1499 описывают сочетание ПЭГ-g-ПЛ-алкинильного промежуточного соединения с производным азидо (полиазидопропил-L-глутамата)). Далее, Yu et al. Macromolecules, 2011, 44(12), 4793-4800 недавно описали наночастицы, полученные из макромолекулы ПЛ-g-паклитаксел-ПЭГ, где паклитаксел является мостиком между ПЛ скелетом и ПЭГ боковыми цепями. Однако лекарственное средство физически не инкапсулировано в наночастицы и структура не содержит адресный лиганд. Lu et al Bioconjugate Chem 2009, 20, 87-94 также описывают макромолекулу, содержащую ПЛ и ПЭГ, полученную методами клик-химии, в которую присоединен пептид (RGD = аргинин-глицин-аспартат) для адресного достижения клеток. Структура макромолекулы включает синтез структурно сложных промежуточных соединений: азидного сополимера (поли(2-метил-2-карбокситриметиленкарбонат-со-D,L-лактид)-g-ПЭГ-азид) и алкин-модифицированных KGRGDS пептидов.
Доктор Zhang et al. (Mol. Pharmaceutics 2012, 9, 2228-2236) описывает наночастицы, полученные из макромолекул, содержащих ПЛ и ПЭГ, где поверхность конъюгирована с лигандами с применением методов клик-химии с получением лиганда, присоединенного непосредственно к триазольной группе. Xiao et al (International Journal of nanomedicine 5, 1, 2010, 1057-1065) в основном относится к ПЛГ-содержащим наночастицам. Arutselvan et al (Chemical Communications 7, 2007, 695-697), WO 2011/046946, Steinmetz et al Journal of the American Chemical Society 131, 47, 2009, 17093-17095) и Adibekian et al (Nature Chemical Biology 7, 2011, 469-479) описывают производные алкин-ПЭГ.
Поэтому существует необходимость в создании простого способа получения содержащих ПЛГ наночастиц, способных инкапсулировать лекарственное средство для сайт-специфической доставки, к которому желаемый функциональный лиганд может быть присоединен с применением клик-химии.
Таким образом, данное изобретение относится к получению ПЛГ наночастиц, содержащих легкую в получении ПЛГ цепь, ковалентно связанную с адресным лигандом через линкер, получаемых методами клик-химии.
Согласно данному изобретению, получение наночастиц включает синтез соединения ПЛГ-азида, который может действовать как кликабельная сополимерная платформа, с которой любой функциональный алкин-лиганд, например, устройство самонаведения, визуализирующее средство, отзывчивый на стимулы агент, соединяющий агент, агент, улучшающий проникновение в клетки, антитоксичный агент, лекарственное средство, может быть соединен с применением клик-химии с универсальным подходом.
Согласно первому объекту, данное изобретение относится к соединению формулы (A)
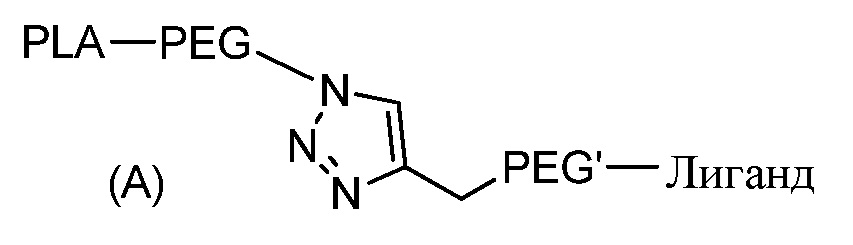
где:
PLA является полилактидным остатком;
PEG является полиэтиленгликолидным остатком;
линкер PEG' является полиэтиленгликолидным остатком; и
Лиганд является остатком функционального лиганда.
В данном описании, термин "остаток" относится к двухвалентному или одновалентному радикалу, в зависимости от молекулы, из которой он получен, или его производному.
В общей формуле (A) выше, могут быть выделены следующие конкретные варианты или любое их сочетание:
- согласно одному варианту, ПЭГ' имеет формулу

где:
n' является числом единиц и равно от 1 до 10,
(1) является присоединением связи к -(CH2)-триазольной группе;
(2) является присоединением связи к лиганду.
- согласно одному из вариантов, ПЛ имеет формулу:
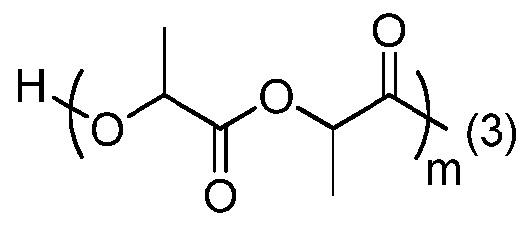
где:
(3) является присоединением связи к ПЭГ части; и
m является числом единиц и равно от 1 до 500, что соответствует молекулярной массе от 144 до 72000. В другом варианте, m в основном равно от 100 до 300, что соответствует молярной массе от около 14400 до 43200 г/моль.
- согласно одному из вариантов, ПЭГ имеет формулу:

где:
(4) является присоединением связи к -ПЛ;
(5) является присоединением связи к атому азота
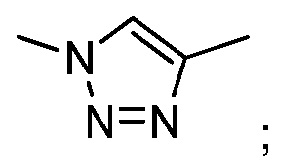
n является числом единиц и равно от 1 до 300, что соответствует молярной массе от около 44 до 13200 г/моль. В другом варианте, n равно от 20 до 70, что соответствует молярной массе от около 880 до 3080 г/моль.
Связывание между ПЛ и ПЭГ (ПЛГ) происходит путем образования сложной эфирной связи между концевой карбоксильной группой ПЛ части и концевой гидроксильной группой ПЭГ части.
Связывание между ПЭГ' и лигандом (ПЭГ'-Лиганд) не проиллюстрировано, но оно происходит путем образования амидной связи, образованной карбоксильной группой лиганда и аминогруппы, получаемой из концевой гидроксигруппы ПЭГ'.
В одном варианте лиганд может быть выбран из остатков устройства самонаведения, диагностического средства, визуализирующего средства, отзывчивого на стимулы агента, соединяющего агента, агента, улучшающего проникновение в клетки, антитоксичного агента, лекарственного средства. В конкретном варианте соединения формулы (A), лиганд может быть выбран из анизамида, фолиевой кислоты и флуорохромов, таких как FP-547.
В контексте данного изобретения:
- атом галогена включает фтор, хлор, бром или иод;
- (С1-С6)алкильная группа означает насыщенную алифатическую группу, которая содержит от 1 до 6 атомов углерода (преимущественно, от 1 до 4 атомов углерода) и которая является линейной или разветвленной. Примеры включают, например, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил и подобные.
Соединения формулы (A) могут быть в форме свободного основания или в форме аддитивных солей с кислотами, что также составляет часть данного изобретения.
Эти соли предпочтительно получают с фармацевтически приемлемыми кислотами, но соли с другими кислотами, применяемыми, например, для очистки или для выделения соединений формулы (A), также являются частью данного изобретения.
Соединения формулы (A) могут образовывать наночастицы. Таким образом, согласно другому объекту, данное изобретение также относится к наночастице, содержащей одно или более идентичные или различные соединения формулы (A).
Выражение "идентичные или различные соединения" в данном описании означает, что указанные соединения могут иметь одинаковые или различные формулы в зависимости от определения их различных ПЭГ, ПЛ, ПЭГ', R, m, n и т.д.
Указанные наночастицы также могут содержать одно или более идентичных или различных соединений формулы (I’):

где PLA, PEG такие, как определены в формуле (A), и R является H или C1-C6 алкилом, таким как метил.
Указанные наночастицы могут необязательно содержать лекарственное средство.
Термин "лекарственное средство" в данном описании относится к терапевтическим веществам, которые могут вводиться пациенту, нуждающемуся в этом. Любое относящееся к теме целевое лекарственное средство (особенно не растворимые в воде лекарственные средства) может быть нековалентно инкапсулировано в наночастицу и/или ковалентно конъюгировано с наночастицей (необязательно, через линкер) для доставки в тело.
Лекарственным средством может быть, в частности, антибиотик, противораковый агент, противовирусный агент, противовоспалительный агент, антиген в вакцине или нутрицевтик.
В частности, лекарственным средством может быть цитотоксический агент, такой как таксоид и, более конкретно, доцетаксел.
Таким образом, в одном варианте, лекарственное средство нековалентно инкапсулировано (например, физически инкапсулировано) в наночастицы. В другом варианте, лекарственное средство ковалентно конъюгировано, необязательно, через линкер, с наночастицами, в частности, где лигандом является лекарственное средство.
В конкретном варианте, лиганд не является лекарственным средством, но лекарственное средство нековалентно инкапсулировано в наночастицу.
В данном описании, термин "наночастицы" относится к частицам, имеющим средний диаметр от 10 нм до 900 нм. В другом варианте, наночастицы в соответствии с данным изобретением имеют средний диаметр от 50 до 300 нм.
Они обычно имеют коэффициент полидисперсности (PdI) от 0,01 до 0,4, более конкретно, от 0,1 до 0,4, и имеют зета потенциал от -30 до + 30 мВ.
С катионным лигандом зета потенциал может быть от 1 до 30 мВ, с анионным лигандом, от -30 до -1 мВ.
Наночастицы в соответствии с данным изобретением показаны на фигурах 2-3.
В соответствии с данным изобретением, указанные наночастицы могут быть получены наноосаждением соединений формулы (A), необязательно в присутствии соединений формулы (I’) выше и/или необязательно с последующим нековалентным инкапсулированием или ковалентным конъюгированием лекарственного средства.
В данном описании, термин "наноосаждение" относится к процессу, включающему осаждение или эмульгирование и снижение размера одного или более соединений в форме наночастиц в суспензии.
Обычно указанный способ включает центрифугирование суспензии. Способ также может включать одну или более стадий, выбранных из:
- получения органической фазы соединений формулы (A) и, необязательно, (I’) в подходящем растворителе или смеси растворителей, таком как метиленхлорид, этилацетат, ацетон, этанол, тетрагидрофуран, и т.д.
- получения водной фазы, необязательно стабилизированной одним или более стабилизирующими агентами, такими как холат натрия, поливиниловый спирт (ПВС), полоксамер, фосфолипиды и т.д.;
- смешивания органической и водной фаз;
- снижения размера частиц суспензии (например, с применением обработки ультразвуком);
- удаления органической фазы, например, выпариванием в вакууме или в потоке воздуха;
- центрифугирования водной фазы, в частности, ультрацентрифугирования вплоть до 50000 g;
- сбора наночастиц; и/или
- повторного суспендирования полученных наночастиц в водной среде.
Обычно наночастицы в соответствии с данным изобретением получают с применением смешиваемого с водой органического растворителя (такого как ацетон) с осаждением органической фазы в водной фазе с необязательным применением стабилизирующего агента, или с применением дихлорметана или этилацетата в качестве органической фазы, содержащей ПВС или полоксамер или холат натрия в качестве стабилизирующего агента. Подходящие полоксамеры для применения для получения наночастиц доступны под торговой маркой Pluronic. Подходящим полоксамером является полоксамер 188 (доступный как Pluronic® F68 или Lutrol® F68, BASF).
В соответствии с данным изобретением, наночастицы, полученные из ПЛГ-функционального лиганда, могут применяться для различных целей, включая доставку терапевтических веществ (лекарственных средств) в тело человека. В одном варианте данного изобретения, наночастицы также содержат лекарственное средство. В этом случае, терапевтическое вещество нековалентно инкапсулировано (физическое инкапсулирование) в матрицу наночастиц, и лучше доставляется в целевую ткань.
В одном варианте, лекарственное средство может быть ковалентно конъюгировано с соединением формулы (A) например, вместо лиганда, необязательно через линкер. Ковалентное конъюгирование может быть интересно для сохранения связи лекарственного средства с носителем in vivo, для доставки лекарственного средства и получения изображений.
Смешиванием различных соединений формулы (A) с различными лигандами получают мультифункциональные наночастицы. Эти мультифункциональные наночастицы могут применяться для комбинированных областей применения (см. фигуру 3).
В соответствии с данным изобретением, наночастицы могут быть получены наноосаждением одного или более соединений формулы (A), и, необязательно, (I’), необязательно, в присутствии лекарственного средства или различных лекарственных средств (для комбинированной терапии).
Выражение "функциональный лиганд" в данном описании в соединении формулы (A) или наночастицах, полученных из него, относится к любому типу соединения, способного воздействовать или обеспечивать доставку лекарственного средства в тело человека, или самому лекарственному средству, в частности, где лекарственное средство является сайт-специфичным, такому как лекарственное средство, специфически связываемое с рецепторами. Функциональные лиганды могут быть, в частности, выбраны из:
- соединений, способных обеспечивать поглощение и распределение наночастиц в клетке, ткани, животном или пациенте, например, через образование метки, которая может давать изображение распределения наночастиц;
- химических или биологических агентов, включая лекарственные средства, которые обеспечивают желаемый конечный эффект наночастиц, такой как запуск смерти клеток или активация или ингибирование рецептора, фермента или гена;
- лигандов рецепторов, таких как антагонист рецептора эстрогена, антагонист рецептора андрогена, фолиевая кислота, анизамид, RGD пептид, антитела, векторы генов под воздействием пептидов, аптамеры и фактор некроза опухоли.
Функциональные лиганды могут включать устройство самонаведения, визуализирующее средство, отзывчивый на стимулы агент (термочувствительный агент, pH-чувствительный агент, фоточувствительный агент, и т.д.), соединяющий агент, агент, улучшающий проникновение в клетки, антитоксичный агент, лекарственное средство и т.д., в зависимости от предполагаемого применения.
Например, устройство наведения, которое распознает и связывается с определенным типом клетки/ткани, может применяться для наведения наночастиц, заполненных лекарственным средством, в целевой определенный орган/болезненную ткань, что также называют 'сайт-специфическим наведением лекарственного средства'. Ожидается, что ПЛГ-устройство наведения наночастиц улучшает доставку инкапсулированного лекарственного средства в целевое болезненное место, повышает местную концентрацию лекарственного средства в целевой ткани и, одновременно, способствует замедленному выделению лекарственного средства. Это дает улучшенное и пролонгированное воздействие лекарственного средства на болезненную ткань/клетки, и, следовательно, улучшенную терапевтическую пользу и пониженные побочные эффекты. Такие наводящие агенты могут быть, в частности, выбраны из мембранных распознающих лигандов, таких как анизамид (имеющий сродство к сигма рецепторам), фолиевая кислота (имеющая сродство к фолатным рецепторам, чрезмерно экспрессирующимся на поверхности некоторых колоний опухолевых клеток), антитела (такие как HER2, трансферрин, анти-РЭФР антитела и т.д.), способные распознавать соответствующий поверхностный антиген, RGD последовательность, которая связывается с ανβ3 интегринами, чрезмерно экспрессирующимися на ангиогенном эндотелии опухоли, гиалуроновая кислота, которая связывается с CD44 рецепторами, трансферрин, который связывается с трансферриновыми рецепторами, и т.д.
В другом примере, лиганды также включают такие, которые распознают и связываются с биологическими соединениями, растворимыми или циркулирующими в биологических жидкостях (например, фактор роста эндотелия сосудов (ФРЭС)), для терапии или детоксикации.
Если функциональным лигандом, сочетающимся с ПЛГ наночастицей, является агент для получения изображений/диагностический агент, то наночастицы могут применяться для получения изображений/диагностики заболевания или нарушения в теле. Такие агенты для получения изображений/диагностики могут быть, в частности, выбраны из оксида железа, комплексов гадолиния, индоцианина зеленого, около инфракрасными флуоресцентными пробами, излучателями позитронов (например,18F,68Ga,64Cu).
Функциональные лиганды, такие как отзывчивые на стимулы агенты, могут применяться для направления ПЛГ наночастиц в предполагаемое место, например, внешнее магнитное поле, создающее местные отзывчивые на стимулы изменения, такие как тепло после излучения около инфракрасного света. Такие отзывчивые на стимулы вещества могут быть выбраны, в частности, из наночастиц оксида железа, наночастиц золота или любых активируемых излучением веществ.
Функциональные лиганды, такие как соединяющие агенты, могут применяться для соединения лекарственного средства (например, по принципу образования ионных пар) для защиты его от разложения и для доставки его в подходящее место тела. В качестве примера, доставка парентеральным путем олигонуклеотидов может быть более эффективной при их соединении с сопряженным с олигопептидом ПЛГ, где олигопептид несет электрический заряд, противоположный заряду олигонуклеотида. Такие соединяющие агенты могут быть, в частности, выбраны из олигопептидов (например, поли-лизина, поли(лейцин-лизина), поли(лейцин-лизин-лизин-лейцина)).
Функциональные лиганды, такие как агенты, улучшающие проникновение в клетку, могут применяться для улучшения поглощения клетками наночастиц и, следовательно, инкапсулированного в него лекарственного средства, что может привести к улучшению эффективности лекарственного средства. Такие агенты, улучшающие проникновение в клетку, могут быть, в частности, выбраны из последовательностей трансактиватора транскрипции (ТАТ), пенетратина, последовательностей полиаргинина, последовательностей белка VP22 и т.д.
Функциональные лиганды, такие как антитоксичный агент, могут применяться для исключения токсичных веществ из системного кровотока. Такие антитоксичные агенты могут быть, в частности, выбраны из множества веществ, например, хелатирующих агентов (для детоксикации металлов), кобаламина, кобинамида, фермента роданаза (для детоксикации цианида), фосфорорганического гидролизующего фермента (для детоксикации фосфорорганических соединений), налоксона, атропина (для детоксикации опиоида), антител/фрагментов антител, распознающих определенный токсин.
Следовательно, как указано выше, Лиганд может быть выбран из:
лигандов, распознающих мембраны, выбранных из антагониста рецептора эстрогена, антагониста рецептора андрогена, фолиевой кислоты, анизамида, антитела, способного распознавать соответствующий поверхностный антиген, такой как HER2, трансферрина или анти-РЭФР антител, RGD последовательности, которая связывается с ανβ3 интегринами, чрезмерно экспрессирующимися на ангиогенном эндотелии опухоли, гиалуроновой кислоты, которая связывается с CD44 рецепторами, трансферрина, который связывается с рецепторами трансферрина, наведенных на пептид векторов гена, аптамеров и агентов для диагностики/получения изображений фактора некроза опухоли, выбранных из оксида железа, комплексов гадолиния, индоцианина зеленого, около инфракрасных флуоресцентных проб или испускателей позитронов (например,18F,68Ga,64Cu),
отзывчивых на стимулы веществ, выбранных из наночастиц оксида железа, наночастиц золота или любых активируемых облучением веществ,
соединяющих агентов, выбранных из олигопептидов (например, поли-лизина, поли(лейцин-лизина), поли(лейцин-лизин-лизин-лейцина),
агента, улучшающего проникновение в клетки, выбранного из последовательностей трансактиватора транскрипции (TAT), пенетратина, полиаргининовых последовательностей или последовательностей VP22 белка,
антитоксичного компонента, выбранного из кобаламина, кобинамида, фермента роданазы, фосфорорганического гидролизующего фермента, налоксона, атропина или антител/фрагментов антител, распознающих определенный токсин; или
лекарственного средства, выбранного из антибиотика, противоракового агента, противовирусного агента, противовоспалительного агента, антигена вакцины или нутрицевтика.
Согласно другому объекту, данное изобретение также относится к способу получения соединения формулы (A) выше.
Указанный способ получения соединения формулы (A) включает сочетание:
- соединения формулы (I):

с
- соединением формулы (XI):

где PLA, PEG, PEG' и Лиганд, такие как определены в формуле (A) выше.
Сочетание может быть проведено так называемой "клик-химией". Этот термин относится к любому способу, в котором соединение азида (N3) подвергают взаимодействию с алкиновой группой с получением 1,2,3-триазола.
Реакция сочетания клик-химии может проводиться с применением реакции Хьюсгена, применяя или адаптируя любую экспериментальную методику Хьюсгена, известную специалисту в данной области техники, в частности, с применением условий, описанных в Chem. Rev. 2008, 108, 2952-3015. Обычно указанную реакцию сочетания клик-химии проводят в соответствии с реакцией Хьюсгена в органических или водных условиях.
Соединения формулы (I) могут быть в форме раствора в органическом растворителе или в форме наночастиц в водной среде, необязательно содержащих соединение формулы (I’), такое, как определено ниже.
В органических условиях указанную реакцию сочетания клик-химии проводят в присутствии бромида меди(I) (CuBr) и Ν,Ν,Ν',Ν',Ν''-пентаметилдиэтилентриамина (PMDETA) (Chem. Rev. 2008, 108, 2952-3015). Эта реакция может быть проведена, кроме прочего, в органическом растворителе, таком как диметилформамид (ДМФА), тетрагидрофуран (ТГФ), толуол, диметилсульфоксид (ДМСО), при температуре от комнатной температуры до температуры кипения с обратным холодильником реакционной смеси, предпочтительно, в безводных условиях. Обычно применяют избыток соединения формулы (XI).
В водных условиях указанную реакцию сочетания клик-химии проводят в соответствии с Chem. Rev. 2008, 108, 2952-3015, в частности, в присутствии воды и производных меди, таких как CuSO4-5H2O. Присутствие восстанавливающего агента для катализатора, такого как аскорбат натрия, может быть предпочтительным. В общем, водные условия применяют, когда соединения формулы (I) имеют форму наночастиц, в частности, в водной суспензии.
В клик-реакции содержащие наночастицы соединения формулы (I) также могут содержать соединения формулы (I’):

где PLA и PEG такие, как определены в формуле (A) и R является H или C1-C6 алкилом, таким как метил.
Соединения формулы (I’), где R является метилом, например, описаны в US 5683723.
При необходимости, суспензия наночастиц также может включать стабилизирующий агент, такой как поливиниловый спирт (ПВС), Pluronic® (например, Pluronic® F68) или холат натрия.
Соединения формулы (I), применяемые в получении соединений формулы (A), являются другим отдельным объектом данного изобретения.
Данное изобретение также относится к соединению формулы (I):

где PLA и PEG такие, как определены для соединения формулы (A).
Соединения формулы (I) могут образовывать наночастицы, которые являются другим объектом данного изобретения.
Указанные наночастицы также могут содержать одно или более одинаковых или разных соединений формулы (I’):

как определено выше.
Указанные наночастицы показаны на фигуре 1.
Указанные наночастицы могут быть получены наноосаждением одного или более одинаковых или разных соединений формулы (I), как определены выше, необязательно в присутствии одного или более одинаковых или разных соединений формулы (I’).
Наноосаждение может проводиться способом, описанным выше для наночастиц, содержащих одно или более соединений формулы (A).
Наночастицы, содержащие соединения формулы (A), также могут быть получены взаимодействием наночастиц, содержащих одно или более соединений формулы (I) в соответствии с данным изобретением, как описаны ниже, с одним или более соединениями формулы (XI), как определены выше, необязательно с последующим нековалентным инкапсулированием или ковалентным конъюгированием лекарственного средства.
Способ в соответствии с данным изобретением является высоко универсальным в том, что он позволяет легко модифицировать функциональные группы наночастиц, полученные соединениями формулы (A).
Способ в соответствии с данным изобретением включает возможность изменения или корректировки, по желанию, плотности лигандов на поверхности наночастиц, смешиванием соединений формулы (I) с ПЛГ сополимером в различных соотношениях с получением наночастиц, содержащих соединения формулы (I) или (A) вместе с ПЛГ сополимерами, которые не функционализированы азидной группой (см. фигуру 1), где указанные наночастицы затем подвергают взаимодействию с соединениями формулы (XI).
Способ в соответствии с данным изобретением позволяет применять соединения формулы (I) или (A) с различными длинами цепей ПЭГ и ПЛ (см. фигуру 2) для различных областей применения. Например, терапевтические вещества, которые чувствительны к разложению в системной полости (например, олигонуклеотиды), могут сочетаться через соединяющий Лиганд с ПЛГ, имеющими короткую цепь ПЭГ, и затем смешиваться с ПЛГ сополимером, имеющим длинную цепь ПЭГ, так, чтобы длинноцепные ПЭГ образовывали кисточковидную поверхность, на которой маскируют терапевтическое вещество, тем самым защищая его от быстрого разложения в системном кровотоке.
Кроме того, способ в соответствии с данным изобретением позволяет сочетать различные типы ПЛГ-функциональных лигандов (например, ПЛГ-устройство наведения + ПЛГ-агент для получения изображений + ПЛГ-отзывчивое на стимул вещество) для образования мультифункциональных наночастиц для комбинированного применения (см. фигуру 3).
Соединения формулы (I) являются основными в соответствии с данным изобретением, так как они действуют как кликабельные биоразлагаемые сополимерные платформы, на которые может быть присоединен любой алкин-функциональный лиганд с применением клик-химии (с помощью соединений формулы (XI)), для множества областей применения в зависимости от типа функционального лиганда, таких как доставка лекарственного средства, получение изображения, детоксикация и т.д. Таким образом, преимущества данного изобретения включают, кроме прочего, гибкость синтеза различных сопряженных с функциональным лигандом сополимерных наночастиц, которые могут вводиться парентеральным путем. Кроме того, плотность функционального лиганда на поверхности наночастиц может быть скорректирована смешиванием подходящих соотношений соединений формулы (I) и соединений формулы (I’). Кроме того, наночастицы могут быть сконструированы так, чтобы иметь группы ПЭГ с различными длинами цепи, чтобы способствовать внутривенной доставке терапевтических веществ, которые являются химически чувствительными в системном кровотоке. Более того, клик-реакция сочетания функционального лиганда может проводиться либо до образования наночастиц, либо на предварительно полученных наночастицах, в зависимости от химической природы лиганда.
Согласно другому объекту, данное изобретение также относится к способу получения соединения формулы (I), включающему стадию взаимодействия соединения формулы (II):
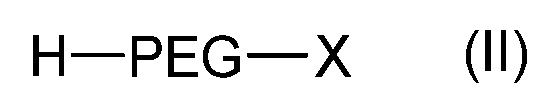
где PEG такой, как определен в формуле (A), и X является азидной (N3) функциональной группой или галогеном, таким как атом Br, с соединением лактида формулы:

с последующим, если X является атомом галогена, взаимодействием полученного соединения формулы (III):

где PLA и PEG такие, как определены в формуле (A), и Hal является атомом галогена, таким как Br, с NaN3.
Эту реакцию с лактидом в основном проводят через полимеризацию с открытием кольца (ПОК). Обычно эту реакцию проводят в присутствии Sn(Oct)2. Она может быть проведена в массе, обычно при нагревании, или в подходящем органическом растворителе с высокой температурой кипения, таком как толуол или ксилол.
Обычно количество соединения лактида зависит от желаемого значения n в соединении формулы (I), зная, что реакция всегда может быть остановлена до завершения. Обычно молярное отношение ПЭГ макро-инициатора и катализатора Sn(Oct)2 составляет от 1 до 10.
Реакцию предпочтительно проводят в безводных условиях и/или при температуре от комнатной температуры до температуры кипения с обратным холодильником реакционной смеси.
Реакцию с NaN3 обычно проводят в апротонном органическом растворителе, таком как ДМФА, диметилацетамид (ДМА), ацетон и т.д., с избытком NaN3.
Соединение формулы (II):

может быть получено из соединения формулы (IV):

где Pg является защитной группой гидроксила, такой как бензил (фенил-CH2-), и PEG такой, как определен в формуле (A),
реакцией замещения с последующей реакцией снятия защиты.
Защитная группа Pg, как указано ниже, соответствует группе, которая позволяет, с одной стороны, защиту реакционноспособной функциональной группы, такой как гидрокси или амин во время стадии синтеза, и, с другой стороны, восстановление реакционноспособной функциональной группы в конце стадии синтеза. Примеры защитных групп, а также способы защиты и снятия защиты различных функциональных групп, даны в P. G. M. Wuts and T. W. Greene, Greene's Protective Groups in Organic Synthesis, 4. ed. (2007), John Wiley & Sons и в J. F. W. McOmie, Protective Groups in Organic Chemistry, Plenum Press, 1973.
Реакция замещения включает замещение OH группы атомом галогена или азидной группой, с помощью подходящего реагента, такого как N-галогенсукцинимид (например, N-бромсукцинимид (NBS)) или азид натрия, соответственно.
Если необходимо заместить галогеновую группу, эту реакцию обычно проводят с подходящим N-галогенсукцинимидным реагентом, с PPh3 в подходящем органическом растворителе, таком как дихлорметан.
Если необходимо защитить азидную группу, исходное замещение уходящей группой может быть проведено следующим образом:
1) замещение OH группы соединения формулы (IV) уходящей группой,
2) замещение уходящей группы полученного соединения на стадии 1) азидной (N3) группой.
В данном описании, "уходящая группа" соответствует группе, которая может быть легко отщеплена от молекулы через разрыв гетеролитической связи (т.е. связи, расщепление которой образует катион и анион), с отрывом электронной пары. Эта группа затем может быть легко замещена другой функциональной группой, во время реакции замещения, например. Такие уходящие группы могут состоять из атомов галогена или активированных гидроксигрупп, таких как мезилат, тозилат, трифлат или ацетильные группы, и т.д. Примеры уходящих групп, а также ссылки на их получение, даны в «Advances in Organic Chemistry», J. March, 3rd Edition, Wiley Interscience, pp.310-316.
Например, на стадии 1), уходящей группой является мезилат и, таким образом, замещение проводят в присутствии мезилхлорида (MsCl). Эту реакцию обычно проводят в присутствии ДМАП, в органическом растворителе, таком как дихлорметан.
Замещение уходящей группы азидной группой на стадии 2) может проводиться в присутствии азида натрия в подходящем органическом растворителе, таком как ДМФA.
Стадия снятия защиты включает гидролиз защитной группы Pg полученного замещенного галогенового или азидного соединения, с получением соединения формулы (II).
Гидролиз обычно проводят в кислых условиях, согласно известным методикам, в частности, с применением концентрированной HCl, если Pg- является фенил-CH2-.
Согласно другому объекту, данное изобретение также относится к соединению формулы (XI):
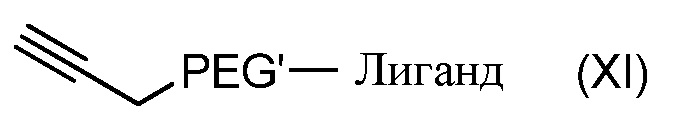
где PEG' и Лиганд такие, как определены в формуле (A).
В частности, данное изобретение относится к соединениям формулы (XI), за исключением

Согласно другому объекту, данное изобретение также относится к способу получения соединения формулы (XI):
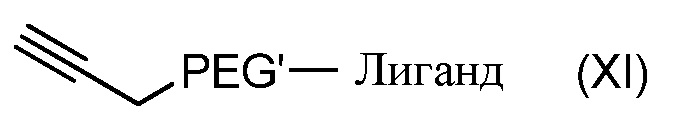
включающему сочетание
- соединения формулы (XII):

с
- предшественником Лиганда,
где PEG' и Лиганд такие, как определены в формуле (A) выше.
"Предшественником Лиганда" является соединение, которое, при взаимодействии с -NH2 группой соединения формулы (XII) дает группу-лиганд, где Лигандом является остаток функционального лиганда, определенного в формуле (A).
Указанное сочетание может проводиться в присутствии пептидного сочетающего реагента, в присутствии основания.
Указанный пептидный сочетающий агент может быть выбран из известных пептидных сочетающих агентов, и более конкретно, из PyBOP (гексафторфосфат бензотиазол-1-илокситрипирролидинофосфония) или EDC/NHS (гидрохлорид (1-этил-3-[3-диметиламинопропил]карбодиимид/N-гидроксисульфосукцинимид).
Основанием может быть любое органическое или минеральное основание, более конкретно, минеральное основание, такие как триэтиламин (ТЭА) или Ν,Ν-диизопропилэтилендиамин (ДИПЭА).
Для конкретных сочетаний, в одном варианте, PyBOP (гексафторфосфат бензотиазол-1-илокситрипирролидинофосфония) применяют с N,N-диизопропилэтилендиамином (ДИПЭА) и, в другом варианте, EDC/NHS (гидрохлорид(1-этил-3-[3-диметиламинопропил]карбодиимид/N-гидроксисульфосукцинимид) применяют с триэтиламином.
Реакцию можно проводить в подходящем органическом растворителе, таком как дихлорметан, ДМФA или диметилсульфоксид (ДМСО).
Типовые предшественники Лиганда включают:
фолиевую кислоту;
FP-547-NHS дает Лиганд- = -NH-C(=O)-(CH2)2-FP547, который является остатком FP547.
Согласно одному из вариантов, соединение формулы (XII) может быть получено:
- взаимодействием соединения формулы (XIII):

с соединением формулы (XIV):

и основанием,
где PEG' такой, как определен в формуле (A) и Hal' является атомом галогена, таким как Br,
с получением соединения формулы (XV):
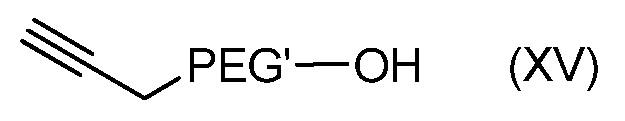
с последующим:
- превращением соединения формулы (XV) в соединение формулы (XII).
Реакцию соединения формулы (XIII) с соединением формулы (XIV) обычно проводят в присутствии сильного основания, такого как NaH, в подходящем органическом растворителе, таком как ДМФA.
Превращение соединения формулы (XV) в соединение формулы (XII) может быть проведено различными способами.
В частности, оно может включать:
- взаимодействие соединения формулы (XV) с фталимидом и PPh3 с получением соединения формулы (XVI):

с последующим:
- взаимодействием соединения формулы (XVI) с гидратом гидразина с получением соединения формулы (XII).
Реакцию соединения формулы (XV) с фталимидом и PPh3 обычно проводят в подходящем органическом растворителе, таком как ТГФ, в присутствии азодикарбоксилата диизопропила (ДИПАД), обычно при комнатной температуре.
Реакция полученного соединения формулы (XVI) с гидратом гидразина (N2H4⋅H2O) может проводиться в этаноле в качестве растворителя.
Альтернативно, превращение соединения формулы (XV) в соединение формулы (XII) включает:
- взаимодействие соединения формулы (XV) с соединением формулы (XVII):

где Lg является уходящей группой и Hal" является атомом галогена,
с получением соединения формулы (XVIII):
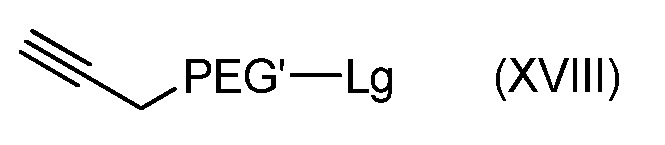
с последующим:
- взаимодействием полученного соединения формулы (XVIII) с гидратом гидразина (N2H4.H2O) и фталатом калия,
с получением соединения формулы (XII).
В формуле (XVII), Lg предпочтительно является метансульфонильной группой (Ms) и Hal" может быть атомом Cl.
Эту реакцию в основном проводят в присутствии основания, такого как органическое основание, например, триэтиламина (Et3N), и, необязательно, катализатора, такого как диметиламинопиридин (ДМАП) и/или подходящего органического растворителя, такого как дихлорметан.
Реакцию полученного соединения формулы (XVIII) обычно проводят сначала добавлением фталата калия и каталитических количеств йодида натрия (NaI) в растворителе, таком как ДМФA, с последующим удалением растворителя и добавлением гидрата гидразина (N2H4.H2O) в растворителе, таком как этанол.
Согласно другому варианту, соединение формулы (XII) также может быть получено:
- взаимодействием соединения формулы (XIX):

с соединением формулы (XIV)

где Hal' является атомом галогена, таким как Br и PEG' такой, как определен в формуле (A), с получением соединения формулы (XX):

с последующим:
- взаимодействием соединения формулы (XX) с трифенилфосфином (PPh3), с получением соединения формулы (XII).
Реакцию соединения формулы (XIX) с соединением формулы (XIV) обычно проводят в присутствии основания, такого как NaH, в органическом растворителе, таком как ДМФA.
Реакцию соединения формулы (XX) с трифенилфосфином (PPh3) обычно проводят в растворителе, таком как тетрагидрофуран (ТГФ), необязательно в присутствии воды.
Соединение формулы (XIX) может быть получено из соединения формулы (XXI):

где Pg такой, как определен в формуле (IV), реакцией замещения с последующим снятием защиты.
Реакции замещения и снятия защиты могут проводиться в отношении соединения (II), как описано выше.
Способ в соответствии с данным изобретением также может включать стадию выделения или очистки полученных соединений после каждой стадии, при желании, или при необходимости и/или проведение желаемых стадий последовательно.
Полученное таким образом соединение может быть восстановлено из реакционной смеси обычными методами. Например, соединения могут быть восстановлены отгонкой растворителя из реакционной смеси или, при необходимости, после отгонки растворителя из реакционной смеси, выливанием остатка в воду с последующей экстракцией с несмешиваемым с водой органическим растворителем и отгонкой растворителя из экстракта. Дополнительно, продукт может быть, при желании, далее очищен различными хорошо известными методами, такими как перекристаллизация, повторное осаждение или различные методы хроматографии, а именно, хроматографией на колонке или препаративной тонкослойной хроматографией.
В описанном выше способе исходные соединения и реагенты, если не указано иначе, коммерчески доступны или описаны в литературе, или могут быть получены способами, описанными в литературе, как описано в примерах ниже или как известно специалисту в данной области техники.
Изменения способа, описанного выше, будут понятны специалисту в данной области техники, при необходимости, и также являются частью данного изобретения. Подходящие модификации и замещения очевидны и хорошо известны специалисту в данной области техники или описаны в научной литературе. В частности, такие способы могут быть найдены в R.C. Larock, Comprehensive Organic Transformations, VCH publishers, 1989.
Соединение формулы (A) или наночастицы, содержащие, по крайней мере, соединение формулы (A) в соответствии с данным изобретением, могут применяться для получения лекарственных средств.
Поэтому другим объектом данного изобретения является лекарственное средство, которое содержит, по крайней мере, одно соединение формулы (A), необязательно в форме наночастиц в соответствии с данным изобретением.
Другим объектом изобретения является фармацевтическая композиция, которая содержит, в качестве активного ингредиента, соединение формулы (A), необязательно в форме наночастиц в соответствии с данным изобретением с одним или более фармацевтически приемлемыми наполнителями.
Эти фармацевтические композиции содержат эффективную дозу, по крайней мере, одного соединения (A) в соответствии с данным изобретением и, по крайней мере, один фармацевтически приемлемый наполнитель.
Такие наполнители выбирают в соответствии с фармацевтической формой и желаемым путем введения, из обычных наполнителей, известных специалистам в данной области техники.
В фармацевтических композициях в соответствии с данным изобретением для перорального, подъязычного, подкожного, внутримышечного, внутривенного, местного, локального, интратрахеального, интраназального, чрезкожного или ректального введения, активный ингредиент может вводиться в виде стандартной лекарственной формы, в смеси с обычными фармацевтическими наполнителями, животным и человеку.
Подходящие стандартные лекарственные формы содержат пероральные формы, такие как таблетки, твердые или мягкие желатиновые капсулы, порошки, гранулы и пероральные растворы или суспензии, подъязычные, буккальные, интратрахеальные, внутриглазные, интраназальные формы, формы для ингаляций, местные, чрезкожные, подкожные, внутримышечные, внутривенные или внутриартериальные формы и имплантаты. Для местного нанесения соединения в соответствии с данным изобретением могут применяться в виде кремов, гелей, мазей или лосьонов.
В качестве примера, стандартная лекарственная форма соединения в соответствии с данным изобретением в форме таблетки может содержать следующие ингредиенты:
В определенных случаях, могут применяться более высокие или более низкие дозы; такие дозы включены в объем данного изобретения. Согласно обычной практике, доза, подходящая для каждого пациента, определяется терапевтом в соответствии со способом введения, массой и реакцией пациента.
Фигуры
На фигуре 1 показана поверхность ПЛГ-N3 кликабельных наночастиц, обработанная с различной плотностью N3. Плотность N3 на поверхности наночастиц может быть изменена при желании смешиванием подходящего соотношения ПЛГ-N3 с ПЛГ сополимером.
На фигуре 2 показаны ПЛГ кликабельные наночастицы, синтезированные с применением различных длин цепи ПЭГ (короче и длиннее) для того, чтобы способствовать загрузке и внутривенной доставке химически чувствительных веществ (например, олигонуклеотидов).
На фигуре 3 показаны мультифункциональные наночастицы, полученные смешиванием множества сополимеров ПЛГ-функциональных лигандов в подходящих соотношениях для комбинированного применения (например, наночастицы, содержащие устройство наведения, агент для получения изображения, отзывчивый на стимулы агент).
На фигуре 4 представлена оценка способности связывания с рецептором наночастиц ПЛГ-фолиевой кислоты с применением экспериментов с поверхностным плазмонным резонансом. График показывает развитие определенного сигнала (единицы резонанса, обозначенной ЕР) по отношению к концентрации фолиевой кислоты в наночастицах ПЛГ-фолиевой кислоты.
На фигуре 5a показана in vitro цитотоксичность наночастиц ПЛГ-фолиевой кислоты (■=S1) по сравнению с наночастицами ПЛГ-OMe (♦=S2) на клетках KB-3-1, чрезмерно экспрессирующих рецепторы фолата.
На фигуре 5b показана in vitro цитотоксичность флуоресцентных наночастиц ПЛГ-анизамида (■=S3) по сравнению с флуоресцентными наночастицами ПЛГ-OMe (♦=S4) на клетках PC-3, экспрессирующих рецепторы сигма.
На фигуре 6a показана способность проникновения в клетки флуоресцентных наночастиц ПЛГ-фолиевой кислоты (■=S3') и флуоресцентных наночастиц ПЛГ-OMe (♦=S4') на клетках KB-3-1, чрезмерно экспрессирующих рецепторы фолата.
На фигуре 6b показана способность проникновения в клетки флуоресцентных наночастиц ПЛГ-фолиевой кислоты (■ = среднее для S1', S3' и S5') и флуоресцентных наночастиц ПЛГ-OMe (♦ = среднее для S2', S4' и S6') на клетках KB-3-1, чрезмерно экспрессирующих рецепторы фолата. Сигналы флуоресценции рационализированы по отношению к каждому образцу до эксперимента.
ПРИМЕРЫ
В представленных ниже примерах описан синтез некоторых соединений в соответствии с данным изобретением. Эти примеры не являются ограничивающими и являются только иллюстративными к данному изобретению. Номера представленных соединений соответствуют номерам, данным в таблице ниже, в которой показаны химические структуры и физические свойства некоторых соединений в соответствии с данным изобретением.
Аббревиатуры:
Пример 1
Получение предшественников для получения наночастиц
Пример получения 1: Синтез соединения формулы (XII)
1. Методика синтеза моно-алкинполиэтиленгликоля (пример получения 1A)

Методика эксперимента:
Триэтиленгликоль (Sigma-Aldrich, 5620 мг, 37,4 ммоль, 1 эквив.) растворяют в безводном ТГФ (50 мл) и полученный раствор охлаждают до 0°C в сухих условиях. Гидрид натрия (988 мг, 1,1 эквив.) медленно добавляют с последующим добавлением по каплям бромида пропаргила (80% масс. в толуоле, 4360 мкл, 1,1 эквив.). Реакционную смесь перемешивают в течение 12 ч при комнатной температуре в инертной атмосфере.
Способ обработки:
ТГФ удаляют при пониженном давлении, и остаток помещают в метиленхлорид (дихлорметан, ДХМ) и промывают несколько раз насыщенным раствором соли. Полученный органический слой сушат над сульфатом магния (MgSO4), фильтруют, концентрируют при пониженном давлении и сушат в вакууме. Неочищенный продукт очищают хроматографией на колонке над силикагелем (элюент: циклогексан (cHex)/этилацетат (AcOEt): 8/2) и выделяют 3,31 г желтого масла (47% выход).
Характеристики ЯМР:
1H ЯМР (300 МГц, CDCl3) δ 4,15 (д, J=2,4 Гц, 2Н), 3,70-3,60 (м, 10Н), 3,57-3,53 (м, 2Н), 2,70 (м, 1Н), 2,41 (т, J=2,4 Гц, 1Н).
2. Синтез соединения фталимид-алкина триэтиленгликоля проводят с применением двух различных путей, либо в одну стадию, либо в две стадии через промежуточный мезилат
2a) Одностадийный синтез фталимид-алкина триэтиленгликоля (пример получения 1B)

Методика эксперимента:
Пример получения 1A (2000 мг, 10,6 ммоль, 1 эквив.), фталимид (2345 мг, 1,5 эквив.), трифенилфосфин (4179 мг, 1,5 эквив.) растворяют в безводном ТГФ (50 мл) в сухих условиях. Диизопропилазодикарбоксилат (ДИАД) (3,14 мл, 1,5 эквив.) медленно добавляют, и реакционную смесь перемешивают в течение 48 часов при комнатной температуре в инертной атмосфере.
Способ обработки:
ТГФ удаляют при пониженном давлении, и остаток помещают в ДХМ и промывают несколько раз насыщенным раствором соли. Полученный органический слой сушат над MgSO4, фильтруют, концентрируют при пониженном давлении и сушат в вакууме. Неочищенный продукт очищают хроматографией на колонке над силикагелем (элюент: cHex/AcOEt: 8/2) и выделяют 3,37 г желтого масла (60% выход).
Характеристики ЯМР:
1H ЯМР (300 МГц, CDCl3) δ 7,76 (дд, J=5,4 Гц, 3,1 Гц, 2H), 7,64 (дд, J=5,4 Гц, 3,1 Гц, 2H), 4,08 (д, J=2,4 Гц, 2H), 3,74 (дт, J=11,4 Гц, 6,0 Гц, 4H), 3,60-3,50 (м, 8H), 2,38 (т, J=2,4 Гц, 1H).
2b) Для двухстадийного синтеза фталимид-алкина триэтиленгликоля, мезилат сначала синтезируют следующим образом:
Методика синтеза мезил-алкина триэтиленгликоля (пример получения 1C)

Методика эксперимента:
К раствору алкина триэтиленгликоля (пример получения 1A, 4 г, 212 ммоль, 1 эквив.) в ДХМ (60 мл) добавляют в инертной атмосфере каталитическое количество ДМАП, хлорида метансульфонила (3,3 мл, 2 эквив.) и триэтиламина (5,9 мл, 2 эквив.) по каплям. Реакционную смесь перемешивают в течение 4 ч при комнатной температуре.
Способ обработки:
Раствор промывают насыщенным раствором соли (три раза по 50 мл), водную фазу затем экстрагируют ДХМ (50 мл) и объединенные органические слои сушат над MgSO4, фильтруют и концентрируют при пониженном давлении.
Конечный продукт сразу же применяют (без получения характеристик) на следующей стадии.
2c) Методика синтеза фталимид-алкина триэтиленгликоля (пример получения 1D)

Методика эксперимента:
К раствору мезил-алкина триэтиленгликоля (пример получения 1C, 5,1 г, 19,2 ммоль, 1 эквив.) в ДМФА (100 мл) добавляют фталат калия (7,87 г, 2,2 эквив.) и каталитическое количество йодида натрия (менее одного эквивалента, например, на кончике шпателя). Раствор перемешивают при 80°C в течение ночи, и растворитель удаляют при пониженном давлении.
Способ обработки:
Полученный остаток очищают хроматографией на колонке над силикагелем (элюент: cHex/AcOEt:2/8 до 4/6). Выделяют 5,7 г желтого масла (94% выход).
Характеристики ЯМР:
1H ЯМР (300 МГц, CDCl3) δ 7,81 (дд, J=5,5 Гц, 3,0 Гц, 2H), 7,69 (дд, J=5,5 Гц, 3,0 Гц, 2H), 4,13 (д, J=2,4 Гц, 2H), 3,80 (дт, J=11,4 Гц, 6,0 Гц, 4H), 3,65-3,56 (м, 8H), 2,40 (т, J=2,4 Гц, 1H).
3) Методика синтеза амино-алкина триэтиленгликоля (пример получения 1E)

Методика эксперимента:
Пример получения 1B (2034 мг, 6,4 ммоль, 1 эквив.) растворяют в этаноле (EtOH) (200 мл) и добавляют гидрат гидразина (3,1 мл, 10 эквив.). Реакционную смесь перемешивают в течение ночи в условиях кипения с обратным холодильником.
Способ обработки:
Реакционную смесь охлаждают до комнатной температуры и к реакции добавляют 8 мл концентрированной хлористоводородной кислоты (pH~2-3). Осадок удаляют фильтрацией, и pH повышают до выше 10 с применением NaOH (2M). Водную фазу трижды экстрагируют ДХМ. Полученный органический слой сушат над MgSO4, фильтруют, концентрируют при пониженном давлении и сушат в вакууме. Выделяют 911 мг желтого масла (76% выход).
Характеристики ЯМР:
1H ЯМР (300 МГц, CDCl3) δ 4,13 (д, J=2,4 Гц, 2H), 3,69-3,50 (м, 8H), 3,43 (т, J=5,2 Гц, 2H), 2,79 (т, J=5,2 Гц, 2H), 2,38 (т, J=2,4 Гц, 1H), 1,33 (c, 2H).13C ЯМР (75 МГц, CDCl3) δ 79,64, 74,53, 73,47, 70,59, 70,40, 70,25, 69,09, 58,37, 41,80.
Пример получения 2: Синтез соединения формулы (XI)
1) Методика синтеза анизамид-алкина триэтиленгликоля (пример получения 2A)

Методика эксперимента:
К раствору примера получения 1E (200 мг, 1,07 ммоль, 1 эквив.) в ДХМ (20 мл) добавляют, в инертной атмосфере, PyBOP (780 мг, 1,4 эквив.), п-метоксибензойную кислоту (229 мг, 1,4 эквив.) и ДИЭА (260 мкл, 1,4 эквив.). Реакционную смесь перемешивают в течение ночи при комнатной температуре.
Способ обработки:
Раствор промывают насыщенным раствором соли (три раза по 20 мл), водную фазу затем экстрагируют ДХМ (20 мл) и объединенные органические слои сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на колонке над силикагелем (элюент: cHex/AcOEt: 5/5 до 7/3) и выделяют 300 мг желтого масла (90% выход).
Характеристики ЯМР:
1H ЯМР (300 МГц, CDCl3) δ 7,74 (д, J=8,8 Гц, 2H), 6,87 (д, J=8,9 Гц, 2H), 6,84 (ушир, 1H), 4,14 (д, J=2,4 Гц, 2H), 3,81 (c, 3H), 3,71-3,53 (м, 12H), 2,42 (т, J=2,4 Гц, 1H).
2) Методика синтеза фолиевой кислоты-алкина триэтиленгликоля (пример получения 2B)

Методика эксперимента:
К раствору примера получения 1E (319 мг, 1,70 ммоль, 1 эквив.) в ДМФА (70 мл) добавляют, в инертной атмосфере, EDC (393 мг, 1,2 эквив.), NHS (236 мг, 1,2 эквив.) и несколько капель триэтиламина (Et3N). Реакционную смесь нагревают до 50°C и добавляют фолиевую кислоту (Sigma-Aldrich, 754 мг, 1 эквив.) к реакционной смеси. Затем реакционную смесь перемешивают в течение ночи при 50°C.
Способ обработки:
Раствор концентрируют при пониженном давлении. Остаток осаждают в ДХМ и ацетоне, фильтруют и сушат в вакууме. Полученный продукт анализируют на колонке с обращенной фазой (C18, Kromasil 10 мкм, 4,6×250 мм), например, с применением градиента от 5 до 95% ацетонитрила в буфере на основе ацетата аммония (доведен до pH 5) 20 мМ за 20 мин, затем 95% ацетонитрила за 5 мин. Продукт солюбилизируют в 20% ДМФА в элюенте. Очистку проводят на Kromasil C18 10 мкм, упакованном в 100 мм колонку (1,5 кг фазы) и элюированием в 85% буфере на основе ацетата аммония pH 5, 20 мМ и 15% ацетонитриле. 200 мг неочищенного продукта элюируют одновременно с пиком инъекции ДМФ.
Процесс очистки (соединение B):
Конечную очистку проводят солюбилизацией 200 мг неочищенного продукта с применением препаративной ВЭЖХ на колонке с обращенной фазой Waters XBridge C18 (30×100 мм), 5 мкм. Продукт сначала растворяют в ДМСО (5 мл) и 5 мл буферного раствора (карбонат аммония 10 мМ, доведенный до pH 9,3 добавлением 28% водного раствора аммиака). 10 инъекций по 1 мл проводят с применением градиента от 95:5 (буферный раствор (карбонат аммония)/ацетонитрил) до 5:95 за 12 мин при 30 мл/мин.
Характеристики ЯМР (соединение B):
1H ЯМР (400 МГц, ДМCO, d6) δ 12,0-11,0 (ушир.c, 1H), 8,61 (c, 1H), 8,29 (ушир.c, 1H), 7,8 (т, J=6,1 Гц, 1H), 7,67 (д, J=8,2 Гц, 2H), 7,03 (ушир.c, 2H), 6,85 (ушир.т, J=6,3 Гц, 1H), 6,62 (д, J=8,2 Гц, 2H), 4,44 (д, J=6,5 Гц, 2H), 4,31 (м, 1H), 4,12 (д, J=2,2 Гц, 2H), 3,57-3,36 (м, 11 H), 3,35-3,1 (м, 2H), 2,23 (т, J=7,2 Гц, 2H), 1,91 (м, 2Н).
Характеристики ЖХМС: 611 [M+H]+.
3) Методика синтеза FP547-алкин триэтиленгликоля (пример получения 2C)

Методика эксперимента:
К раствору FP-547-NHS (Interchim, 2,5 мг, 2,55 мкмоль, 1 эквив.) в ДМСО (356 мкл) добавляют раствор ДМСО (92 мкл), содержащий EDC (0,49 мг, 1 эквив.), NHS (0,29, 1 эквив.), ТЭА (0,35 мкл, 1 эквив.) и пример получения 1E (1,07 мг, 2,2 эквив.). Раствор перемешивают в темноте при комнатной температуре в течение 12 ч.
Способ обработки:
Реакционную смесь концентрируют при пониженном давлении, растворяют в ДХМ и экстрагируют насыщенным раствором соли. Получают масло розового цвета.
Характеристики ультрафиолетовой видимой (УФ/Вид) и флуоресцентной спектроскопии:
Полученный спектр является таким же, как спектр, даваемый коммерческим источником соединения флуорофора.
Пример получения 3: Синтез соединения формулы (II)
1) Методика синтеза бензилокси-азида ПЭГ2500 (пример получения 3A)

Методика эксперимента:
К раствору ПЭГ2500-бензила (источник полимера, Mn=2572 г.моль-1, 2,43 г, 0,94 ммоль, 1 эквив.), ДМАП (58 мг, 0,5 эквив.) и ТЭА (747 мкл, 5,6 эквив.) в ДХМ (65 мл), охлажденному до 0°C, медленно добавляют MsCl (326 мкл, 4,4 эквив.) в течение более 20 мин. Реакционную смесь перемешивают в течение ночи при комнатной температуре и концентрируют при пониженном давлении. Остаток растворяют в ДМФА (20 мл) и азид натрия (330 мг, 5,3 эквив.) добавляют к раствору. Реакционную смесь перемешивают при 50°C в течение 24 ч.
Способ обработки:
Реакционную смесь концентрируют при пониженном давлении, и остаток растворяют в ДХМ (50 мл) и промывают насыщенным раствором соли (три раза по 50 мл). Органический слой сушат над MgSO4, фильтруют и концентрируют при пониженном давлении до минимального объема ДХМ. Последний осаждают в диэтиловом эфире. Получают 2,16 г белого порошка.
Характеристики ЯМР:
1H ЯМР (300 МГц, CDCl3) δ 7,30-7,05 (м, 5Н), 4,43 (с, 2Н), 3,93-3,03 (м, 222Н), 3,27 (т, 2Н).
2) Методика синтеза азида ПЭГ2500 (пример получения 3B)
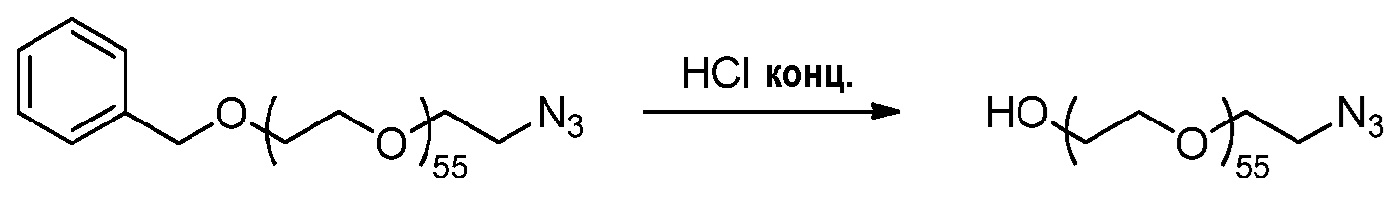
Методика эксперимента:
Пример получения 3A (2,16 г, 0,83 ммоль, 1 эквив.) солюбилизируют в концентрированной HCl (20 мл) и перемешивают при комнатной температуре в течение 2 дней.
Способ обработки:
Раствор подщелачивают до pH 1 раствором конц. NaOH. Водную фазу экстрагируют ДХМ (четыре раза по 50 мл), и объединенные органические слои сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении до минимального объема ДХМ. Последний осаждают в диэтиловом эфире. Получают 1,89 г белого порошка.
Характеристики ЯМР:
1H ЯМР (300 МГц, CDCl3) δ 3,73-3,33 (м, 222H), 3,27 (т, J=5,0 Гц, 2H), 2,75 (c, 1H).
3) Методика синтеза бензилокси-бром ПЭГ2100 (пример получения 3C)

Методика эксперимента:
К смеси ПЭГ2100-бензила, полученного по методике Nicolas et al. Macromol 2008, 41, 8418 (Mn=2176 г.моль-1, 500 мг, 0,23 ммоль, 1 эквив.) и NBS (50 мг, 1,2 эквив.) добавляют холодный раствор трифенилфосфина (PPh3) (75 мг, 1,2 эквив.) в ДХМ (50 мл). Реакционную смесь затем перемешивают в течение ночи при комнатной температуре.
Способ обработки:
Реакционную смесь концентрируют при пониженном давлении до 25 мл и разбавляют гексаном (100 мл). Осадок (оксид трифенилфосфина) удаляют фильтрацией, и полимер дважды осаждают в диэтиловом эфире (200 мл).
Характеристики ЯМР:
1H ЯМР (300 МГц, CDCl3) δ 7,30-7,16 (м, 5H), 4,50 (c, 2H), 3,85-3,15 (м, 188H).
4) Методика синтеза бром ПЭГ2100 (пример получения 3D)
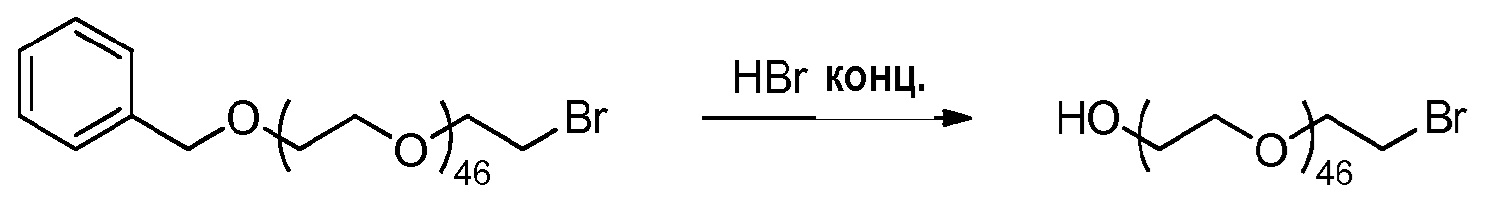
Методика эксперимента:
Пример получения 3C (500 мг, 0,22 ммоль, 1 эквив.) солюбилизируют в концентрированной HBr (20 мл) и перемешивают при комнатной температуре в течение 2 дней.
Способ обработки:
Раствор подщелачивают до pH 1 раствором конц. NaOH. Водную фазу экстрагируют ДХМ (четыре раза по 50 мл), и объединенные органические слои сушат над MgSO4, фильтруют и концентрируют при пониженном давлении до минимального объема ДХМ. Последний осаждают в диэтиловом эфире с получением порошка.
Характеристики ЯМР:
1H ЯМР (300 МГц, CDCl3) δ 3,82-3,13 (м, 188H), 2,79 (c, 1H).
Пример получения 4: Синтез соединения формулы (I)
Соединения формулы (I) синтезируют с применением 2 различных путей. Первый (4A) является одностадийным и второй (4B) является двухстадийным.
Пример получения 4A: Синтез блоксополимера ПЛГ-N3 полимеризацией с открытием кольца (ПОК)

m является числом единиц ПЛ.
Методика эксперимента:
К смеси азидо-поли(этиленгликоля) (3B, Mn=2507 г.моль-1, 293 мг, 0,12 ммоль) и D,L-лактида (7,01 г, 48,62 ммоль) добавляют, в сухих условиях, раствор Sn(Oct)2 (18,7 мг, 46,1 мкмоль) в безводном толуоле (11,2 мл). Реакционную смесь дегазируют барботированием аргона в течение 20 мин и затем перемешивают на предварительно нагретой масляной бане при 120°C в течение 90 мин в инертной атмосфере. Реакцию останавливают при приблизительно 55% превращении.
Способ обработки:
Толуол удаляют при пониженном давлении, и полученный продукт растворяют в минимальном количестве ДХМ и далее осаждают в диэтиловом эфире. Осадок затем растворяют в минимальном количестве ТГФ и затем осаждают в воде с дальнейшей сушкой вымораживанием в течение ночи с получением белого порошка.
Характеристики ЯМР:
1H ЯМР (400 МГц, CDCl3) δ 5,41-4,83 (м, 456H), 4,38-4,15 (м, 3H), 3,84-3,40 (м, 220H), 3,36 (т, J=4,8 Гц, 2H), 1,82-1,21 (м, 1372H).
Пример получения 4B(1): Синтез блоксополимера ПЛГ-Br полимеризацией с открытием кольца (ПОК)

m является числом единиц ПЛ.
Методика эксперимента:
К смеси бром-поли(этиленгликоля) (3D, Mn=2149 г.моль-1, 49 мг, 22,8 мкмоль) и D,L-лактида (0,72 г, 4,97 ммоль) добавляют, в сухих условиях, Sn(Oct)2 (1 мг, 2,5 мкмоль). Реакционную смесь дегазируют аргоном в течение 20 мин и затем перемешивают в объемных условиях на предварительно разогретой масляной бане при 120°C в течение 20 часов в инертной атмосфере. Реакцию останавливают при полном превращении.
Способ обработки:
Полученный раствор растворяют в минимальном количестве ДХМ и затем осаждают в диэтиловом эфире. Затем осадок растворяют в минимальном количестве ТГФ и затем осаждают в воде с последующей сушкой замораживанием в течение ночи с получением белого порошка.
Пример получения 4B(2): Методика синтеза азида-ПЭГ2100-ПЛ

m такой, как в таблице выше.
Методика эксперимента:
К раствору примера получения 4B(1) (200 мг, 5,9 мкмоль, 1 эквив.) в ДМФА (10 мл) добавляют азид натрия (20 мг, 54 эквив.) в инертных условиях. Реакционную смесь затем перемешивают при 50°C в течение 3 дней в инертной атмосфере.
1H ЯМР (400 МГц, CDCl3) δ 5,42-4,83 (м, 440H), 4,38-4,11 (м, 3H), 3,83-3,40 (м, 192H), 3,35 (т, J=4,8 Гц, 2H), 1,73-1,31 (м, 1320H).
Способ обработки:
Раствор концентрируют при пониженном давлении, и остаток солюбилизируют в минимальном количестве ТГФ. Последний затем осаждают в воде.
Пример получения 5: Синтез соединения формулы (A)
Типовая методика реакции Хьюсгена в органических условиях

m является числом единиц ПЛ, варьирующимся для каждой партии.
Пример оптимизированной методики эксперимента:
К заранее дегазированному раствору соединения формулы (I) ПЛГ-N3, полученного способом, описанным в примерах получения 4A (200 мг, молярное количество зависит от партии, в данном случае: 6,7 мкмоль, 1 эквив.) и производного алкина формулы (XI) (0,12 ммоль, 18 эквив.) в безводном ДМФА (2,5 мл) добавляют, с помощью шприца, дегазированный раствор CuBr (5,8 мг, 6,1 эквив.) и PMDETA (16,8 мкл, 17,8 эквив.) в безводном ДМФА (400 мкл). Реакционную смесь перемешивают в течение 15 ч при 50°C в инертной атмосфере. Ту же методику применяют для всех примеров получения.
Пример оптимизированного способа обработки:
Раствор концентрируют при пониженном давлении, и остаток растворяют в минимальном количестве ТГФ и затем осаждают в воде. Осадок сушат замораживанием, снова растворяют в минимальном количестве ТГФ и затем осаждают в воде. Осадок сушат замораживанием с получением белого порошка.
Если производное алкина не растворимо в воде, то может быть добавлена промежуточная стадия растворения высушенного замораживанием остатка в минимальном количестве ДХМ с дальнейшим осаждением в диэтиловом эфире.
Последней стадией должно быть осаждение ТГФ в воде. Также стадии осаждения должны быть добавлены, если после всего остается некоторое количество исходных материалов. Также методика применяется для всех примеров получения при получении соединения формулы (A) (см. таблицу 3 ниже).
Характеристики ЯМР ПЛГ-триазол-ПЭГ’-анизамида
1H ЯМР (500 МГц, CDCl3) δ 8,31 (шир.м, 1H), 8,02 (c, 1H), 7,81 (д, J=8,1 Гц, 2H), 6,98 (д, J=8,1 Гц, 2H), 4,97-5,48 (м, 389H), 4,50 (шир.c, 4H), 4,10-4,26 (м, 3H), 3,80 (шир.c, 5H), 3,30-3,67 (м, 198H), 1,28-1,62 (м, 1164H).
Выход: 90%.
Пример получения 6: Синтез соединения формулы (I’)
Методика синтеза блоксополимера ПЛГ-OMe полимеризацией с открытием кольца (ПОК)

m является числом единиц ПЛ.
Методика эксперимента:
К смеси метоксиполи(этиленгликоля) (Sigma-Aldrich, Mn=2012 г.моль-1, 245 мг, 0,12 ммоль) и D,L-лактида (7,01 г, 48,62 ммоль) добавляют, в сухих условиях, раствор Sn(Oct)2 (18,7 мг, 46,1 мкмоль) в безводном толуоле (11,2 мл). Реакционную смесь дегазируют барботированием аргоном в течение 20 мин и затем перемешивают на предварительно нагретой масляной бане при 120°C в течение 30 мин в инертной атмосфере. Реакцию останавливают при приблизительно 54,2% превращения.
Способ обработки:
Толуол удаляют при пониженном давлении, и полученный продукт растворяют в минимальном количестве ДХМ и затем осаждают в диэтиловом эфире. Осадок затем растворяют в минимальном количестве ТГФ и затем осаждают в воде с последующей сушкой замораживанием в течение ночи с получением белого порошка.
Характеристики ЯМР:
1H ЯМР (500 МГц, CDCl3) δ 5,34-4,85 (м, 434H), 4,40-4,17 (м, 3H), 3,86-3,41 (м, 178H), 3,36 (c,3H), 1,77-1,19 (м, 1302H).
Пример 2: Получение наночастиц
Наночастицы получают согласно следующему протоколу и с применением компонентов и количеств, указанных в следующих таблицах.
Общий протокол
1 - Сополимер или смесь сополимеров растворяют в органическом растворителе (с конечной концентрацией полимера в воде от 1 до 40 мг/мл).
2 - Органическую фазу смешивают с водной фазой (где объемная доля вода/органика варьируется от 2,5 до 5), содержащей стабилизатор (концентрация варьируется от 0,1% до 1% масс./объем). Для получения наночастиц с применением методов эмульгирования и уменьшения размера, где смесь энергично встряхивают с применением вихревого встряхивателя в течение 1 минуты с получением эмульсии. Эмульсию обрабатывают ультразвуком (с применением пробы со временем, варьирующимся от 1 до 10 минут).
3 - Органическую фазу удаляют выпариванием (при пониженном давлении или в потоке воздуха).
4 - Наночастицы ультрацентрифугируют при 30000 g в течение 30 минут.
5 - Наночастицы повторно суспендируют в водной среде.
6 - Наночастицы фильтруют над 1 мкм диском стеклянного фильтра (Acrodisc).
7 - Наночастицы хранят при 4°C до применения.
В качестве примера применяют следующий протокол, где 1,2 мл AcOEt применяют в качестве органического растворителя (см. последние 3 примера в таблице 6 ниже)
1 - Сополимер или смесь сополимеров (общая масса: 30 мг) растворяют в AcOEt (1,2 мл).
2 - Органическую фазу добавляют к 3,3 мл водной фазы, содержащей 1% Pluronic F68.
3 - Смесь энергично встряхивают на вихревом встряхивателе в течение 1 минуты.
4 - Эмульсию облучают ультразвуком (с применением пробы) в течение 3 минут.
5 - Органическую фазу удаляют при пониженном давлении с применением роторного испарителя.
6 - Наночастицы ультрацентрифугируют при 30000 g в течение 30 минут
7 - Наночастицы повторно суспендируют в 3 мл pH 7,4 физиологического раствора с фосфатным буфером (ФРФБ).
8 - Наночастицы фильтруют над 1 мкм диском стеклянного фильтра (Acrodisc).
9 - Наночастицы хранят при 4°C до применения.
Наночастицы характеризуют с применением ДРС (динамического рассеяния света) и в аппарате от Malvern (Zetasizer Nano ZS). Каждый сополимер, указанный в таблицах ниже, имеет среднюю молекулярную массу от 30000 Да до 35000 Да.

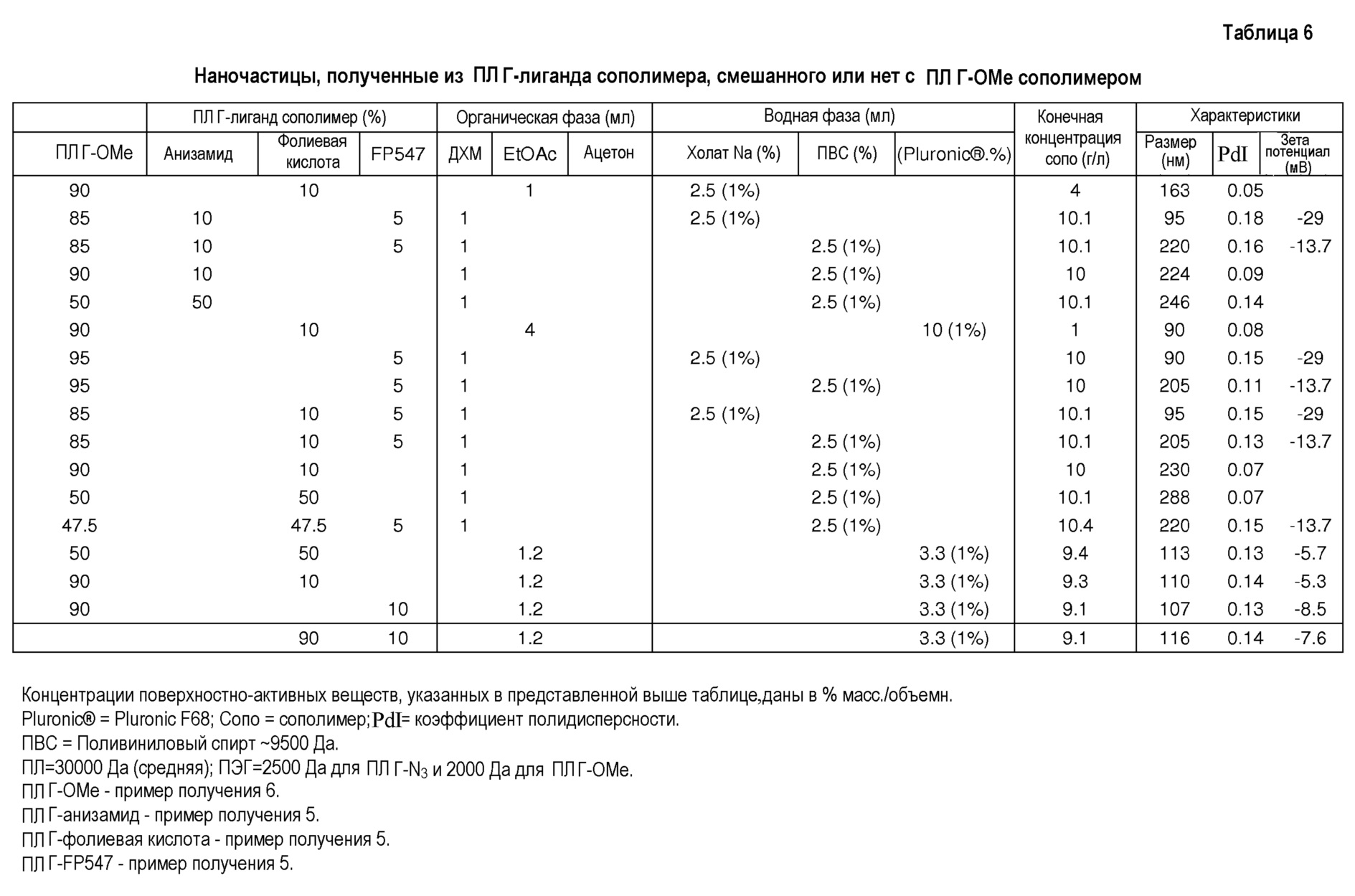
Таблицы выше показывают, что:
- ДХМ/ПВС дает физически стабильные наночастицы со средним интервалом диаметра 230 нм.
- EtOAc/NaCh дает физически стабильные наночастицы со средним интервалом диаметра 160 нм.
- EtOAc/Pluronic® дает физически стабильные наночастицы со средним интервалом диаметра 110 нм.
- Применение ацетона дает мицеллы со средним интервалом диаметра 30 нм.
Количество лигандов на наночастицу:

Np = Количество наночастиц (НЧ.л-1 суспензии),
τ = содержание твердых веществ (г⋅л-1),
D = средний диаметр (см),
dp = плотность полимера (г⋅см-3).
Для ПЛ полимеров средняя плотность часто указывается как 1,24 или 1,27 г⋅см-3.
Средний диаметр составляет около 110 нм (1,1×10-5 см).
Содержание твердого полимера составляет около 10 г⋅л-1 для маточного раствора.
Поэтому: Np~1016 НЧ⋅л-1.
Учитывая, что сополимер имеет молекулярную массу приблизительно 35000 г⋅моль-1. Учитывая, что максимальная концентрация фолиевой кислоты на поверхности наночастиц (для наночастиц, которые будут стабильными в pH 7,4 ФРФБ растворе) составляет около 30%. Число Авогадро составляет NA=6,022×1023 моль-1.
Учитывая представленные выше данные, наночастица содержит:
17000 сополимерных молекул и 5100 молекул фолиевой кислоты (если Μn(сопо)=35000 г.моль-1).
20000 сополимерных молекул и 6000 молекул фолиевой кислоты (если Μn(сопо)=30000 г.моль-1).
Пример 3: Поверхностный плазмонный резонанс (ППР) с применением наночастиц ПЛГ-фолиевой кислоты
Получение сенсорного чипа Series S CM5 (GE Healthcare)
Этот сенсорный чип покрывают матрицей из карбоксиметилированного декстрана, ковалентно присоединенной к золотой поверхности чипа и состоящей из 4 каналов.
Иммобилизация фолат-связывающего белка ((ФСБ), Siqma-Aldrich)
Протокол, применяемый для иммобилизации белка, описан у Johnson (Johnson et al Anal. Biochem. 1991, 198, 268-277). Коротко, после уравновешивания инструмента с pH 7,4, ФРФБ, следующие образцы автоматически и последовательно впрыскивают в BIAcore T100: (i) NHS/EDC в смешанном растворе (1:1, об./об.) в течение 420 с для активации карбоксилированного декстрана; (ii) ФСБ, разведенный в концентрации 125 мкг/мл в ацетатном буфере (pH 5,0) в течение 420 с, (iii) этаноламин в течение 420 с для деактивации остаточных NHS-эфирных групп сенсорного чипа. Каждую стадию прерывают промыванием ФРФБ. Протокол иммобилизации, который проводят со скоростью потока 10 мкл/мин, дает связывание ~6,8 нг/мм2 ФСБ на канал.
Первый канал потока (Кп1) блокируют только этаноламином так, чтобы использовать его в качестве ссылочного канала для проверки того, играет ли декстран роль в адсорбции наночастиц.
Подтверждение структуры и поверхностной регенерации иммобилизованного ФСБ:
Для проверки того, имеет ли иммобилизованный ФСБ правильную структуру, применяют поликлональное антитело анти-ФСБ (IgG анти-ФСБ, Thermo Scientific). Иммуноглобулин G (IgG) впрыскивают при 50 мкг/мл в течение 120 с при 30 мкл/мин.
Специфический сигнал в 4,5 раза больше, чем не специфический сигнал (IgG на ссылочном канале Кп1), который составляет, приблизительно, 22% от общего сигнала.
Считается, что применение глицина и этиленгликоля регенерирует поверхность. Конечно, это возможно после получения определенного специфического сигнала с IgG анти-ФСБ.
Суспензию наночастиц далее тестируют на свежеприготовленном покрытом белком канале сенсорного чипа.
Оценка взаимодействия между наночастицами ПЛГ-фолиевой кислоты и иммобилизованного ФСБ
Анализ поверхностного плазмонного резонанса адсорбции наночастиц ПЛГ-фолиевой кислоты на иммобилизованном ФСБ проводят с применением неконъюгированных наночастиц ПЛГ в качестве контроля. Эти эксперименты проводят со скоростью потока 5 мкл/мин со временем контакта 500 с.
Применяемые наночастицы:
Готовят различные суспензии наночастиц с применением ранее описанного протокола (с pluronic® в качестве стабилизатора), с целью изменения концентрации фолиевой кислоты на поверхности наночастиц. Для этого наночастицы получают из смеси ПЛГ-OMe (Mn(ЯМР)=34820 г.моль-1) и ПЛГ-фолиевой кислоты (Mn(ЯМР)=32880 г.моль-1).
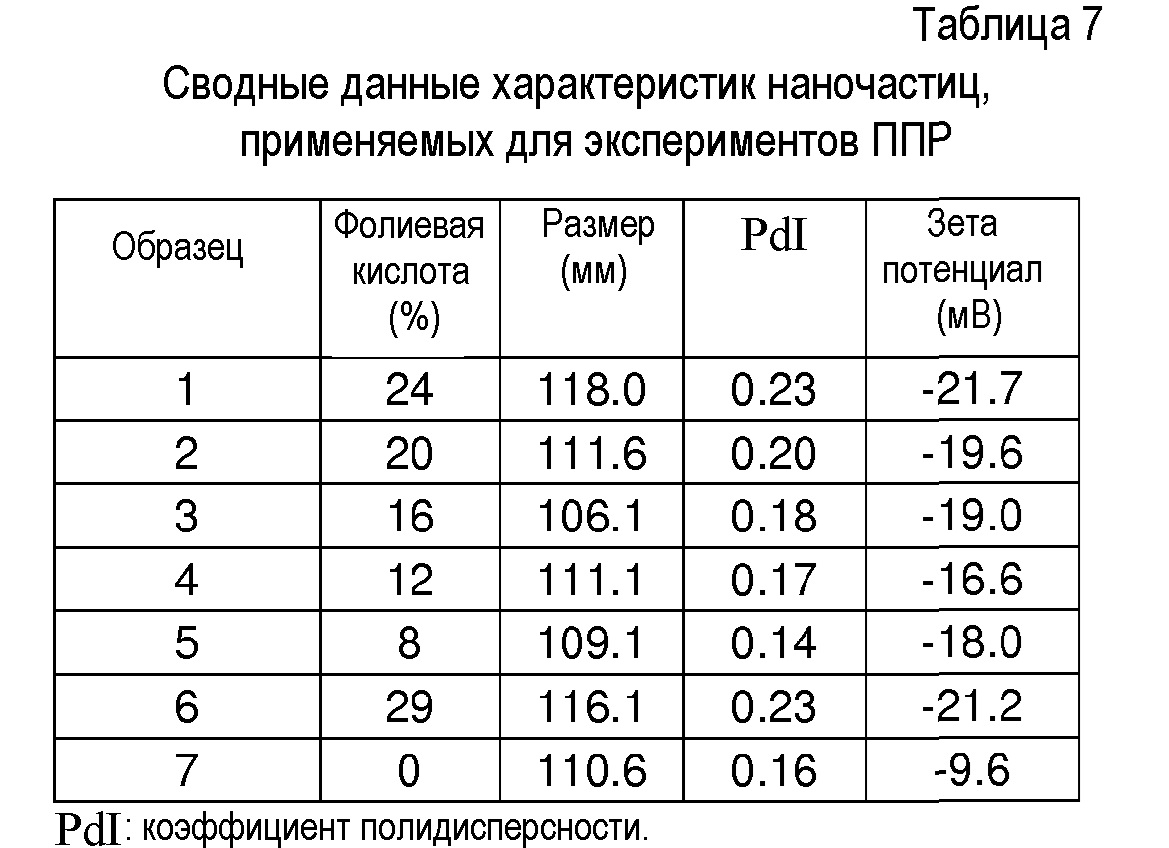
Процент фолиевой кислоты рассчитывают из количества ПЛГ-фолиевой кислоты, применяемой для каждого примера получения и выхода клик-сочетания между алкином-фолиевой кислотой и ПЛГ-N3. Более 30% наночастиц сополимера фолиевой кислоты агломерируются.
Эксперименты с поверхностным плазмонным резонансом:
Каждую суспензию наночастиц тестируют на свежеприготовленном покрытом белком канале сенсорного чипа.

Результаты анализа:
Конечные значения сигналов, полученных из сенсограмм ППР каждого образца, наносят на график по отношению к концентрации фолиевой кислоты на наночастицах (фигура 4). Поэтому на этом графике показано развитие специфического сигнала по отношению к концентрации фолиевой кислоты на поверхности наночастиц. При 12% достигается максимум, где специфический сигнал составляет приблизительно 70% от общего сигнала. За пределами 12% специфический сигнал снижается. Это может происходить из-за некоторого пакетирования между различными группами фолиевой кислоты, что мешает лучшему взаимодействию. Не специфический сигнал дается значением для наночастиц, не имеющих фолиевую кислоту на поверхности.
Как показано в первых 7 строках таблицы, не важно, какие наночастицы впрыскивают в ссылочный канал, сигнал отсутствует. Поэтому исходная покрывающая поверхность (декстран) не вызывает адсорбцию наночастиц.
Неспецифичность возникает определенно из-за ПЭГ покрытия на наночастицах с ФСБ.
Пример 4: Цитотоксичность
Пример 4a: Цитотоксичность наночастиц ПЛГ-фолиевой кислоты
Для тестирования этих наночастиц, колонию клеток KB-3-1 (Human Cervix Carcinoma, DSMZ (Немецкая коллекция микроорганизмов и клеточных культур, каталожный код: ACC 158) применяют, так как они экспрессируют рецепторы фолата.
Клеточная культура:
Она является колонией адгезивных клеток, выращенных в монослоях, и клетки культивируют для того, чтобы вызвать чрезмерную экспрессию рецепторов фолата. Среда, применяемая для чрезмерного экспрессирования рецепторов, представляет собой DMEM 2429 (среду без фолиевой кислоты), в которую добавляют L-глутамин (200 мМ при 0,584 г/л, BioWhittaker, Lonza) и бикарбонат натрия (3,7 г/л, Sigma-Aldrich), с добавлением 1% пенициллина/стрептомицина (Lonza) и 10% фетальной бычьей сыворотки (ФБС, Lonza) в увлажненной 5% CO2 атмосфере при 37°C.
Применяемые наночастицы:
Готовят две разные суспензии наночастиц с применением ранее описанного протокола (с pluronic® в качестве стабилизатора), с целью получения наночастиц фолиевой кислоты и контрольных наночастиц (без фолиевой кислоты).
Для этого наночастицы получают из смеси ПЛГ-OMe (Mn(ЯМР)=34820 г.моль-1; 70% или 100% массовых) и ПЛГ-фолиевой кислоты (Mn(ЯМР)=32880 г.моль-1; 30% или 0% массовых, соответственно).
Методика анализа цитотоксичности:
В 96-луночном планшете в лунку добавляют 5×102 клеток, разведенных в 50 мкл культуральной среды (как описано выше). Через 24 ч в клеточном инкубаторе добавляют 50 мкл ФРФБ буфера, содержащего наночастицы с различными концентрациями сополимера (0,5, 0,1, 0,05, 0,01 мг/мл). Затем планшет выдерживают в клеточном инкубаторе (5% CO2, 37°C) в течение 48 ч. Затем добавляют 20 мкл (3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2H-тетразолия) (MTS, соединение тетразолия, включенное в CellTiter 96® AQueous Non-Radioactive Cell Proliferation Assay, Promega), и планшет анализируют на микропланшетном ридере (Labsystem Multiscan MS, Type 352) при 492 нм через 3 часа инкубирования в клеточном инкубаторе.
Данные сравнивают с ячейкой, содержащей только 5×102 клеток в 50 мкл культуральной среды и 50 мкл ФРФБ буфера, и показывают с 20 мкл MTS. Для всех данных убирают фон, состоящий из наночастиц, в соответствующей концентрации, в 50 мкл культуральной среды и 50 мкл ФРФБ буфера и показывают с 20 мкл MTS. Эксперимент проводят трижды.
График строят как функцию от процента живых клеток, где за 100% принимают лунки, содержащие только клетки и MTS.
Результаты:
Эксперимент, проведенный с CellTiter 96® AQueous One Solution Cell Proliferation Assay (Promega) показан на фигуре 5a.
Было обнаружено, что даже при высоких концентрациях, независимо от присутствия фолиевой кислоты, наночастицы не вызывают какой-либо цитотоксичности на KB-3-1 клетках, чрезмерно экспрессирующих рецепторы фолата.
Пример 4b: Цитотоксичность наночастиц ПЛГ-анизамида
Для тестирования этих наночастиц применяют колонию клеток PC-3 (аденокарцинома простаты человека, ATCC (номер: CRL-1435)), так как они экспрессируют сигма-рецепторы, к которым может привязываться анизамидная группа.
Клеточная культура:
Эту колонию адгезивных клеток культивируют в RPMI 1640 (Fisher Scientific) с добавлением 1% пенициллина/стрептомицина (Lonza) и 10% фетальной бычьей сыворотки (ФБС, Lonza) в увлажненной 5% CO2 атмосфере при 37°C. Эта клетки чрезмерно экспрессируют сигма рецепторы. Культуры с 85-90% конфлюентностью применяют для всех экспериментов. Клетки трипсинизируют (Трипсин-ЭДТК, Invitrogen, Gibco), подсчитывают, субкультивируют в 96-луночных планшетах для исследований жизнеспособности. Клеткам дают слипнуться в течение 24 ч перед применением в экспериментах.
Применяемые наночастицы:
Получают две разные суспензии наночастиц с применением описанного выше протокола (с pluronic® в качестве стабилизатора) для получения флуоресцентных наночастиц анизамида и флуоресцентных контрольных наночастиц (без анизамида).
Для этого наночастицы получают из смеси ПЛГ-FP547 (Mn(ЯМР)=34820 г.моль-1; 10% массовых в обоих примерах получения), ПЛГ-OMe (Mn(ЯМР)=34820 г.моль-1; 45% или 90% массовых) и ПЛГ-анизамида (Mn(ЯМР)=37060 г.моль-1; 45% или 0% массовых, соответственно).
Методика анализа цитотоксичности:
В 96-луночном планшете в лунку добавляют 5×103 клеток, разведенных в 50 мкл культуральной среды (как описано выше). Через 24 ч в клеточном инкубаторе добавляют 50 мкл ФРФБ буфера, содержащего наночастицы с различными концентрациями сополимера (5, 2,5, 0,5, 0,05 мг/мл). Затем планшет выдерживают в клеточном инкубаторе (5% CO2, 37°C) в течение 48 ч. Затем добавляют 20 мкл (3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2H-тетразолия) (MTS, соединение тетразолия, включенное в CellTiter 96® AQueous Non-Radioactive Cell Proliferation Assay, Promega), и планшет анализируют на микропланшетном ридере (Labsystem Multiscan MS, Type 352) при 492 нм через 3 часа инкубирования в клеточном инкубаторе.
Данные сравнивают с ячейкой, содержащей только 5×103 клеток в 50 мкл культуральной среды и 50 мкл ФРФБ буфера, и показывают с 20 мкл MTS. Для всех данных убирают фон, состоящий из наночастиц, в соответствующей концентрации, в 50 мкл культуральной среды и 50 мкл ФРФБ буфера и показывают с 20 мкл MTS. Эксперимент проводят трижды.
График строят как функцию от процента живых клеток, где за 100% принимают лунки, содержащие только клетки и MTS.
Результаты:
Эксперимент, проведенный с CellTiter 96® AQueous One Solution Cell Proliferation Assay (Promega), показан на фигуре 5b.
Было обнаружено, что даже при высоких концентрациях, вплоть до, по крайней мере, 5 мг/мл, независимо от присутствия анизамида, флуоресцентные наночастицы не вызывают какой-либо цитотоксичности у PC-3 клеток, экспрессирующих сигма рецепторы.
Пример 5: Анализ проникновения в клетки наночастиц ПЛГ-фолиевой кислоты
Для тестирования этих наночастиц используют колонию клеток KB-3-1 (карцинома шейки матки человека, DSMZ (немецкая коллекция микроорганизмов и клеточных культур, код по каталогу: ACC 158), так как они экспрессируют рецепторы фолата.
Культура клеток:
Они представляют собой колонию адгезионных клеток, выращенных в монослоях, и их культивируют для того, чтобы вызвать чрезмерную экспрессию рецепторов фолата. Средой, применяемой для чрезмерного экспрессирования рецепторов фолата, является DMEM 2429 (среда без фолиевой кислоты), в которую добавляют L-глутамин (200 мМ при 0,584 г/л, BioWhittaker, Lonza) и бикарбонат натрия (3,7 г/л, Sigma-Aldrich), с добавлением 1% пенициллина/стрептомицина (Lonza) и 10% фетальной бычьей сыворотки (ФБС, Lonza) в увлажненной 5% CO2 атмосфере при 37°C.
Применяемые наночастицы:
Готовят три партии 2 различных суспензий наночастиц, с применением описанного выше протокола (с pluronic® в качестве стабилизатора) для получения наночастиц флуоресцентной фолиевой кислоты и флуоресцентных наночастиц в качестве контроля (без фолиевой кислоты). Для этого наночастицы получают из смеси ПЛГ-FP547 (Mn(ЯМР)=34820 г.моль-1), ПЛГ-OMe (Mn(ЯМР)=34820 г.моль-1) и ПЛГ-фолиевой кислоты (Mn(ЯМР)=32880 г.моль-1).
Первую партию (S1’,S2') получают за 23 дня до второй партии (S3', S4') и за 34 дня до получения третьей партии (S5’, S6').

Методика сортировки клеток с активированной флуоресценцией (СКАФ):
Колонию клеток KB-3-1, культивированных в среде для чрезмерного экспрессирования их рецепторов фолата (как указано выше), выращивают в 24-луночном планшете почти до конфлюентности (~300000 клеток/лунку). Затем культуральную среду удаляют и 1 мл наночастиц разводят в той же культуральной среде с конечной концентрацией сополимера ~60 мкг/мл, инкубируют с клетками в течение разного количества времени (от 10 мин до 24 часов). Затем культуральную среду удаляют, каждую лунку промывают дважды ФРФБ буфером (1 мл), и клетки разделяют трипсином (200 мкл в течение 3 мин). Затем трипсин нейтрализуют культуральной средой (800 мкл) и клетки центрифугируют (5 мин при 1000 g). Надосадочную жидкость удаляют, клетки повторно суспендируют в ФРФБ (1 мл), центрифугируют (5 мин при 1000 g) и, наконец, восстанавливают параформальдегидом (200 мкл, 1% в ФРФБ).
Проточную цитометрию осуществляют с применением анализатора клеток BD LSRFortessa с длиной волны возбуждения 561 нм, и сигнал эмиссии считывают между 575 и 589 нм.
Результаты:
Результаты, полученные в экспериментах СКАФ, показаны на фигурах 6a и 6b. Было обнаружено, что если фолиевая кислота присутствует на поверхности наночастиц (S3'), последние в 115 раз более поглощены, чем наночастицы без фолиевой кислоты (S4'). Также было обнаружено, что плато достигается в период от 6 до 10 часов инкубирования. Также было обнаружено, что те же результаты могут быть получены с партиями через 1 месяц, 10 дней или 1 день. Поэтому можно сделать заключение, что наночастицы фолиевой кислоты являются стабильными в течение времени, и что группы фолиевой кислоты остаются на поверхности наночастиц.
Пример 6: Инкапсулирование доцетаксела (DTX) в наночастицы ПЛГ-анизамида
Для инкапсулирования доцетаксела применяют тот же протокол, описанный выше, который применяют для получения наночастиц. Тритированный доцетаксел применяют во время процесса для оценки содержания лекарственного вещества и эффективности улавливания.
К 30 мг сополимеров (смесь ПЛГ-OMe (Mn(ЯМР)=34820 г.моль-1; 60% массовых) и ПЛГ-анизамида (Mn(ЯМР)=37060 г.моль-1; 40% массовых)), разведенных в 1,2 мл этилацетата, добавляют 2,8 мг DTX (3,24 мкмоль; 861,9 г.моль-1) и 4 нмоль3H-DTX (5,38×105 Бк). Эту органическую фазу смешивают с 3,3 мл водного раствора плуроник F68 (1% масс./об.). Две фазы встряхивают энергично с вихревой мешалкой в течение 1 мин и затем обрабатывают ультразвуком с пробой в течение 3 мин. Затем органическую фазу удаляют при пониженном давлении и полученную водную фазу фильтруют через 1-мкм стеклянный фильтр до ультра-центрифугирования (30 мин при 30000 g). Надосадочную жидкость удаляют, и наночастицы повторно суспендируют в ФРФБ буфере (10 мл) и фильтруют через 1-мкм стеклянный фильтр.
Результаты:
Надосадочную жидкость и раствор НЧ считывают с применением бета-счетчика Beckman, что позволяет рассчитать содержание лекарственного вещества 4,3% и эффективность улавливания 46%.
Пример 7: Типовая методика реакции Хьюсгена в водных условиях для проведения клик-химии с предварительно полученными наночастицами ПЛГ-N3
Методика эксперимента:
К суспензии наночастиц (полученных из ПЛГ-N3 (20% масс./масс.) и ПЛГ-OMe (80% масс./масс.)), полученных по описанному выше протоколу и стабилизированных поливиниловым спиртом) (ПВС) (1% масс./об.) добавляют ПЭГ-алкин (2 эквив. по сравнению с азидогруппой), CuSO4·5H2O и аскорбат натрия (в избытке).
Реакционную смесь перемешивают в течение 24 ч.
Наконец, суспензию диализируют с водой с применением целлюлозной мембраны с 20000 Да отсечкой (SpectrumLabs).
Наблюдения:
Размер суспензии НЧ остается стабильным во время клик-процесса:
Z-средний = 198,5 нм и PdI = 0,09.
Также другие лиганды (экв. флуоресцентные лиганды...) могут быть связаны с наночастицами по описанной выше методике.
Реферат
Настоящее изобретение относится к области адресной доставки лекарственного средства и получения изображения. Описано соединение формулы (А)где: PLA является полилактидным остатком формулы:где: (3) является присоединением связи к PEG группе; и m является числом единиц и равно от 1 до 500; PEG является полиэтиленгликолевым остатком формулы:где: (4) является присоединением связи к -PLA; (5) является присоединением связи к атому азотаи n является числом единиц и равно от 1 и 300; линкер PEG' является полиэтиленгликолевым остатком формулы:где: n' является числом единиц и равно от 1 до 10, (1) является присоединением связи к - (CH)-триазольной группе; (2) является присоединением связи к лиганду; и Лиганд является остатком функционального лиганда, выбранным из лигандов, распознающих мембраны, агентов для диагностики/получения изображений. Также описаны наночастицы, имеющие средний диаметр от 10 нм до 900 нм, содержащие одно или более одинаковых или разных указанных выше соединений формулы (А). Описан способ получения указанного выше соединения формулы (А), включающий сочетание: соединения формулы (I)с соединением формулы (XI)где PLA, PEG, PEG' и Лиганд такие, как определены выше, методом клик-химии. Также описан способ получения указанных выше наночастиц. Описано лекарственное средство для адресной доставки лекарственного средства и получения изображения, которое содержит по меньшей мере одно указанное выше соединение формулы (А), необязательно в форме наночастиц. Описана фармацевтическая композиция для адресной доставки лекарственного средства и получения изображения, которая содержит в качестве активного ингредиента указанное выше соединение формулы (А), необязательно в форме наночастиц, и по меньшей мере один фармацевтически приемлемый наполнитель. 8 н. и 11 з.п. ф-лы, 4 ил., 12 табл., 11 пр.
Формула


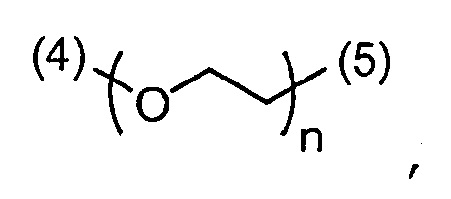









Комментарии