Составы невирусных бескапсидных днк-векторов на основе липидных наночастиц - RU2778407C2
Код документа: RU2778407C2
Чертежи




















Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет согласно разделу 35 Свода законов США §119(e) на основании предварительной заявки на патент США №62/556334, поданной 8 сентября 2017 г., №62/556333, поданной 8 сентября 2017 г., №62/556381, поданной 9 сентября 2017 г., №62/675317, поданной 23 мая 2018 г., №62/675322, поданной 23 мая 2018 г., №62/675324, поданной 23 мая 2018 г., и №62/675327, поданной 23 мая 2018 г., содержание каждой из которых включено в настоящий документ полностью посредством ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Настоящая заявка включает перечень последовательностей, который был подан в электронном виде в формате ASCII и включен в настоящий документ полностью посредством ссылки. Указанная копия в формате ASCII, созданная 7 сентября 2018 г., имеет название 080170-090660WOPT_SL.txt и размер 63790 байтов.
ОБЛАСТЬ ТЕХНИКИ
[0003] Настоящее изобретение относится к составам невирусных бескапсидныых векторов на основе липидных наночастиц (ЛНЧ) и их применению для доставки экзогенных последовательностей ДНК в целевую клетку, ткань, целевой орган или организм.
УРОВЕНЬ ТЕХНИКИ
[0004] Недавно были описаны невирусные бескапсидные ДНК-векторы с ковалентно замкнутыми концами, которые содержат трансгены, фланкированные ITR AAV2. Однако нацеленная доставка указанных ДНК-векторов в клетки, in vitro и in vivo, остается сложной задачей. Соответственно, в данной области техники сохраняется потребность в составах для разрешения указанных сложностей.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0005] Согласно одному аспекту настоящего изобретения предложены новые липидные составы, содержащие ионизируемый липид и бескапсидный невирусный вектор (зкДНК). Описанные в настоящем документе зкДНК-векторы представляют собой бескапсидные линейные дуплексные молекулы ДНК, образованные непрерывной цепью комплементарной ДНК с ковалентно замкнутыми концами (линейную, непрерывную и не заключенную в капсид структуру), которые содержат 5'-последовательность инвертированного концевого повтора (ITR) и 3'-последовательность ITR, которые отличаются друг от друга, или асимметричны друг относительно друга. Согласно одному аспекту невирусные бескапсидные ДНК-векторы с ковалентно замкнутыми концами предпочтительно представляют собой линейные дуплексные молекулы, и могут быть получены из векторного полинуклеотида, который кодирует гетерологичную нуклеиновую кислоту, функционально (т.е. с возможностью функционирования) расположенную между двумя разными последовательностями инвертированных концевых повторов (ITR) (например, ITR AAV), при этом по меньшей мере один из ITR содержит сайт концевого разрешения и сайт связывания белка репликации (RPS) (иногда называемый сайтом связывания репликативного белка), например, сайт связывания Rep, и один из ITR содержит делецию, инсерцию и/или замену относительно другого ITR, то есть один из ITR является асимметричным относительно другого ITR. Согласно одному варианту реализации по меньшей мере один из ITR представляет собой ITR AAV, например, ITR AAV дикого типа или модифицированный ITR AAV. Согласно одному варианту реализации по меньшей мере один из ITR представляет собой ITR, модифицированный относительно другого ITR - то есть указанная зкДНК содержит ITR, асимметричные друг относительно друга.
[0006] Согласно одному варианту реализации по меньшей мере один из ITR представляет собой нефункциональный ITR.
[0007] Согласно некоторым вариантам реализации один или более ITR не представляет собой ITR дикого типа.
[0008] Согласно некоторым вариантам реализации указанный зкДНК-вектор, после расщепления рестрикционным ферментом с одним сайтом распознавания на зкДНК-векторе и анализа как с помощью природного, так и денатурирующего гель-электрофореза, демонстрирует характеристические полосы линейной и непрерывной ДНК, по сравнению с линейными и прерывистыми ДНК-контролями.
[0009] Согласно некоторым вариантам реализации одна или более из последовательностей асимметричных ITR зкДНК-вектора взяты из вируса, выбранного из парвовируса, депендовируса и аденоассоциированного вируса (AAV). Согласно некоторым вариантам реализации указанные асимметричные ITR взяты из разных вирусных серотипов. Например, один или более асимметричных ITR могут быть взяты из серотипа AAV, выбранного из AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11 и AAV12.
[0010] Согласно некоторым вариантам реализации одна или более из последовательностей асимметричных ITR зкДНК-вектора являются синтетическими.
[0011] Согласно некоторым вариантам реализации по меньшей мере один (например, один или оба) из асимметричных ITR модифицирован делецией, инсерцией и/или заменой по меньшей мере в одной из областей ITR, выбранных из А, А', В, В', С, С', D и D'.
[0012] Согласно некоторым вариантам реализации указанный зкДНК-вектор содержит по меньшей мере два асимметричных ITR, выбранных из: (a) SEQ ID NO: 1 и SEQ ID NO:52; и (b) SEQ ID NO: 2 и SEQ ID NO: 51.
[0013] Согласно некоторым вариантам реализации указанный зкДНК-вектор получают способом, включающим следующие этапы: (а) инкубация популяции клеток насекомых, несущих экспрессионную конструкцию зкДНК, в присутствии по меньшей мере одного белка Rep, при этом указанная экспрессионная конструкция зкДНК кодирует указанный зкДНК-вектор, в условиях, эффективных для, и на протяжении времени, достаточного для того чтобы индуцировать продуцирование зкДНК-вектора в указанных клетках насекомых; и (b) выделение указанного зкДНК-вектора из указанных клеток насекомых. Без ограничений, указанная экспрессионная конструкция зкДНК может представлять собой зкДНК-плазмиду, зкДНК-бакмиду или зкДНК-бакуловирус.
[0014] Обычно клетка насекомого экспрессирует по меньшей мере один белок Rep.Указанный по меньшей мере один белок Rep может быть взят из вируса, выбранного из парвовируса, депендовируса и аденоассоциированного вируса (AAV). Например, указанный по меньшей мере один белок Rep может быть взят из серотипа AAV, выбранного из AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11 и AAV12.
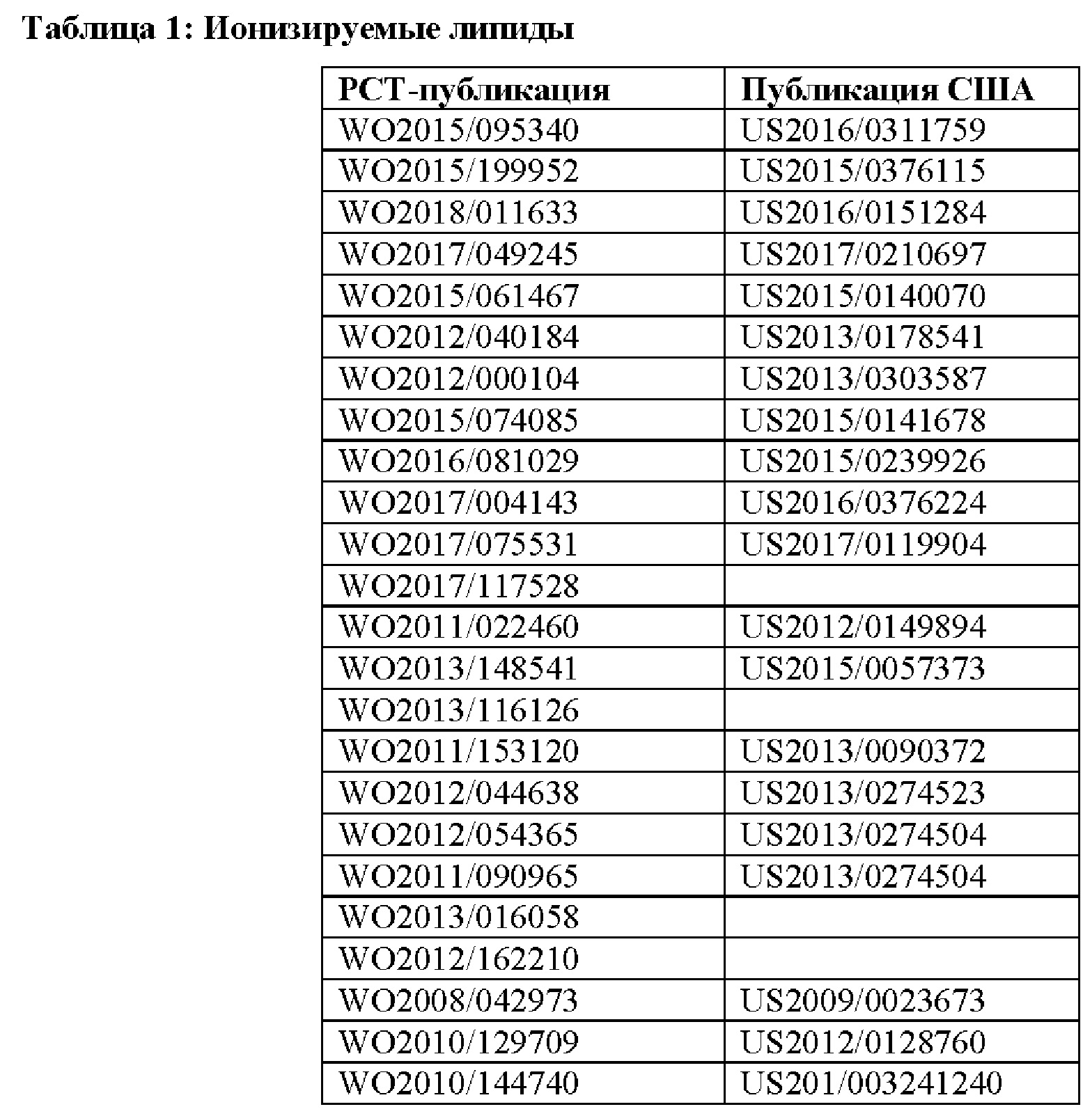
[0015] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой липид, описанный в публикации из перечисленных в таблице 1.
[0016] Согласно некоторым вариантам реализации различных аспектов, описанных в настоящем документе, присутствие зкДНК может быть подтверждено путем расщепления рестрикционным ферментом с одним сайтом распознавания на зкДНК-векторе и анализа расщепленного ДНК-материала на денатурирующих и неденатурирующих гелях для подтверждения присутствия характеристических полос линейной и непрерывной ДНК, по сравнению с линейной и прерывистой ДНК.
[0017] Согласно некоторым вариантам реализации указанный ДНК-вектор получают из векторного полинуклеотида, при этом указанный векторный полинуклеотид кодирует гетерологичную нуклеиновую кислоту, функционально расположенную между двумя последовательностями инвертированных концевых повторов (ITR), причем указанные два ITS отличаются друг от друга (являются асимметричными), и по меньшей мере один из ITR представляет собой функциональный ITR, содержащий функциональный сайт концевого разрешения и сайт связывания Rep, и один из ITR содержит делению, инсерцию или замену относительно функционального ITR; присутствие белка Rep индуцирует репликацию векторного полинуклеотида.
[0018] Согласно некоторым вариантам реализации предложено продуцирование ДНК-вектора в клетке насекомого. Например, указанный ДНК-вектор может быть способом, включающим следующие этапы: (а) инкубация популяции клеток насекомых, несущих указанный векторный полинуклеотид, который не содержит кодирующих последовательностей вирусного капсида, в присутствии белка Rep, в условиях, эффективных для, и на протяжении времени, достаточного для того чтобы индуцировать продуцирование бескапсидного невирусного ДНК-вектора в клетках насекомых, отличающихся тем, что продуцируемая бескапсидная невирусная ДНК не содержится в указанных клетках насекомых в отсутствие указанного вектора; и (b) сбор и выделение бескапсидной невирусной ДНК из клеток насекомых. Согласно некоторым дополнительным вариантами реализации присутствие бескапсидной невирусной ДНК, выделенной из клеток насекомых, может быть подтверждено. Например, присутствие бескапсидной невирусной ДНК, выделенной из клеток насекомых, может быть подтверждено путем расщепления ДНК, выделенной из клеток насекомых, рестрикционным ферментом с одним сайтом распознавания на указанном ДНК-векторе и анализа расщепленного ДНК-материала на неденатурирующем геле для подтверждения присутствия характеристических полос линейной и непрерывной ДНК, по сравнению с линейной и прерывистой ДНК.
[0019] Согласно некоторым вариантам реализации указанный ДНК-вектор получают из векторного полинуклеотида. Например, указанный ДНК-вектор получают из векторного полинуклеотида, кодирующего гетерологичную нуклеиновую кислоту, функционально расположенную между последовательностями ДНК-полинуклеотидов первого и второго инвертированных концевых повторов (ITR) AAV2, при этом по меньшей мере один из ITR содержит по меньшей мере одну полинуклеотидную делецию, инсерцию или замену относительно к соответствующего ITR AAV2 дикого типа SEQ ID NO: 1 или SEQ ID NO:51 для индукции репликации указанного ДНК-вектора в клетке насекомого в присутствии белка Rep. Согласно некоторым дополнительным вариантам реализации указанного ДНК-вектор может быть способом, включающим следующие этапы: (а) инкубация популяции клеток насекомых, несущих указанный векторный полинуклеотид, который не содержит кодирующих последовательностей вирусного капсида, в присутствии белка Rep, в условиях, эффективных для, и на протяжении времени, достаточного для того чтобы индуцировать продуцирование бескапсидной невирусной ДНК в клетках насекомых, причем указанные клетки насекомых не содержат кодирующих вирусный капсид последовательностей; и (b) сбор и выделение бескапсидной невирусной ДНК из клеток насекомых. Согласно некоторым дополнительным вариантами реализации присутствие бескапсидной невирусной ДНК, выделенной из клеток насекомых, может быть подтверждено. Например, присутствие бескапсидной невирусной ДНК, выделенной из клеток насекомых, может быть подтверждено путем расщепления ДНК, выделенной из клеток насекомых, рестрикционным ферментом с одним сайтом распознавания на указанном ДНК-векторе и анализа расщепленного ДНК-материала на неденатурирующем геле для подтверждения присутствия характеристических полос линейной и непрерывной ДНК, по сравнению с линейной и прерывистой ДНК.
[0020] Согласно некоторым вариантам реализации указанная липидная наночастица может дополнительно содержать некатионный липид, конъюгированный с ПЭГ липид, стерол или любую комбинацию перечисленного.
[0021] Согласно некоторым вариантам реализации указанная липидная наночастица дополнительно содержит некатионный липид, где указанный неионогенный липид выбран из группы, состоящей из дистеароил-sn-глицеро-фосфоэтаноламина, дистеароилфосфатидилхолина (DSPC), диолеилфосфатидилхолина (DOPC), дипальмитоилфосфатидилхолина (DPPC), диолеилфосфатидилглицерина (DOPG), дипальмитоилфосфатидилглицерина (DPPG), диолеилфосфатидилэтаноламина (DOPE), пальмитоилолеоилфосфатидилхолина (РОРС), пальмитоилолеоилфосфатидилэтаноламина (POPE), диолеилфосфатидилэтаноламина 4-(N-малеимидометил)-циклогексан-1-карбоксилата (DOPE-mal), дипальмитоилфосфатидилэтаноламина (DPPE), димиристоилфосфоэтаноламина (DMPE), дистеароилфосфатидилэтаноламина (DSPE), монометилфосфатидилэтаноламина (такого как 16-О-монометил-ФЭ), диметилфосфатидилэтаноламина (такого как 16-О-диметил-ФЭ), 18-1-транс-ФЭ, 1-стеароил-2-олеоилфосфатидилэтаноламина (SOPE), гидрогенизированного соевого фосфатидилхолина (HSPC), яичного фосфатидилхолина (ЕРС), диолеилфосфатидилсерина (DOPS), сфингомиелина (SM), димиристоилфосфатидилхолина (DMPC), димиристоилфосфатидилглицерина (DMPG), дистеароилфосфатидилглицерина (DSPG), диерукоилфосфатидилхолина (DEPC), пальмитоилолеоилфосфатидилглицерина (POPG), диэлаидоилфосфатидилэтаноламина (DEPE), лецитина, фосфатидилэтаноламина, лизолецитина, лизофосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозитола, сфингомиелина, яичного сфингомиелина (ESM), кефалина, кардиолипина, фосфатидной кислоты, цереброзидов, дицетилфосфата, лизофосфатидилхолина, дилинолеоилфосфатидилхолина и некатионных липидов, описанных, например, в WO 2017/099823 или US 2018/0028664.
[0022] Согласно некоторым вариантам реализации указанная липидная частица дополнительно содержит конъюгированный липид, причем указанный конъюгированный липид выбран из группы, состоящей из ПЭГ-диацилглицерина (DAG) (такого как 1-(монометокси-полиэтиленгликоль)-2,3-димиристоилглицерол (ПЭГ-ДМГ)), ПЭГ-диалкилоксипропила (DAA), ПЭГ-фосфолипида, ПЭГ-керамида (Cer), пегилированного фосфатидилэтаноламина (ПЭГ-ФЭ), ПЭГ-сукцинатдиацилглицерина (PEGS-DAG) (такого как 4-O-(2',3'-ди(тетрадеканоилокси)пропил-1-O-(w-метокси(полиэтокси)этил) бутандиоат (ПЭГ-S-ДМГ)), ПЭГ диалкоксипропилкарбама, натриевой соли N-(карбонил-метоксиполиэтиленгликоля 2000)-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламина, и тех, которые описаны в таблице 2.
[0023] Согласно некоторым вариантам реализации указанная липидная частица дополнительно содержит холестерин или производное холестерина, описанное в РСТ-публикации WO 2009/127060 или патентной публикации США US 2010/0130588.
[0024] Согласно некоторым вариантам реализации указанная липидная частица содержит ионизируемый липид, некатионный липид, конъюгированный липид, который ингибирует агрегацию частиц, и стерол. Количество ионизируемого липида, некатионного липида, конъюгированного липида, который ингибирует агрегацию частиц, и стерола может независимо варьировать. Согласно некоторым вариантам реализации указанная липидная наночастица содержит ионизируемый липид в количестве от приблизительно 20 мол.% до приблизительно 90 мол.% от общего количества липидов, присутствующих в указанной частице, некатионный липид в количестве от приблизительно 5 мол.% до приблизительно 30 мол.% от общего количества липидов, присутствующих в указанной частице, конъюгированный липид, который ингибирует агрегацию частиц, в количестве от приблизительно 0,5 мол.% до приблизительно 20 мол.% от общего количества липидов, присутствующих в указанной частице, и стерол в количестве от приблизительно 20 мол.% до приблизительно 50 мол.% от общего количества липидов, присутствующих в указанной частице.
[0025] Соотношение общего количества липидов и ДНК-вектора может варьировать по мере необходимости. Например, соотношение общего количества липидов и ДНК-вектора (по массе или весу) может составлять от приблизительно 10:1 до приблизительно 30:1.
[0026] Также согласно настоящему изобретению предложена композиция, содержащая первую липидную наночастицу и дополнительное соединение. Указанная первая липидная наночастица содержит ионизируемый липид и первый бескапсидный невирусный вектор.
Указанный бескапсидный невирусный вектор после расщепления рестрикционным ферментом с одним сайтом распознавания на указанном ДНК-векторе отличается присутствием характеристических полос линейной и непрерывной ДНК, по сравнению с линейной и прерывистой ДНК в анализе на неденатурирующем геле.
[0027] Согласно некоторым вариантам реализации указанное дополнительное соединение включено во вторую липидную нано частицу. Указанная первая и указанная вторая липидные наночастицы могут быть одинаковыми или разными. Согласно некоторым вариантам реализации указанные первая и вторая липидные наночастицы являются разными. Согласно некоторым вариантам реализации указанные первая и вторая липидные наночастицы являются одинаковыми, т.е. дополнительное соединение включено в первую липидную наночастицу.
[0028] В качестве дополнительного соединения может быть использована любая требуемая молекула. Согласно некоторым вариантам реализации указанное дополнительное соединение представляет собой второй бескапсидный невирусный вектор. Указанные первый и второй бескапсидные невирусные векторы могут быть одинаковыми или разными. Согласно некоторым вариантам реализации указанные первый и второй бескапсидные невирусные векторы различаются.
[0029] Согласно некоторым вариантам реализации указанное дополнительное соединение представляет собой терапевтический агент.
[0030] Указанные и другие аспекты настоящего изобретения подробнее описаны ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0031] Материалы настоящего патента или заявки содержат по меньшей мере один выполненный в цвете чертеж. Копии настоящего патента или опубликованной заявки на патент с цветным(и) чертежом (чертежами) будут предоставлены ведомству по запросу и после оплаты необходимой пошлины.
[0032] На фиг. 1А представлен пример структуры зкДНК-вектора. Согласно указанному варианту реализации пример зкДНК-вектора включает экспрессионную кассету, содержащую промотор CAG, WPRE и BGHpA. Открытая рамка считывания (ORF), кодирующая трансген люциферазы, встроена в сайт клонирования (R3/R4) между промотором CAG и WPRE. Экспрессионная кассета фланкирована двумя инвертированными концевыми повторами (ITR) - ITR AAV2 дикого типа в начале (на 5'-конце) и модифицированным ITR в конце (на 3'-конце) экспрессионной кассеты, соответственно, указанные два ITR, фланкирующие экспрессионную кассету, являются асимметричными друг относительно друга.
[0033] На фиг. 1В изображен пример структуры зкДНК-вектора с экспрессионной кассетой, содержащей промотор CAG, WPRE и BGHpA. Открытая рамка считывания (ORF), кодирующая трансген люциферазы, встроена в сайт клонирования между промотором CAG и WPRE. Экспрессионная кассета фланкирована двумя инвертированными концевыми повторами (ITR) - модифицированным ITR в начале (на 5'-конце) и ITR дикого типа в конце (на 3'-конце) экспрессионной кассеты.
[0034] На фиг. 1С изображен пример структуры зкДНК-вектора с экспрессионной кассетой, содержащей энхансер/промотор, открытую рамку считывания (ORF) для инсерции трансгена, посттранскрипционный элемент (WPRE) и поли(А)-сигнал. Открытая рамка считывания (ORF) позволяет инсертировать трансген в сайт клонирования между промотором CAG и WPRE. Экспрессионная кассета фланкирована двумя инвертированными концевыми повторами (ITR), которые являются асимметричными друг относительно друга; модифицированный ITR в начале (на 5'-конце) и модифицированный ITR в конце (на 3'-конце) экспрессионной кассеты, при этом и 5'-ITR, и 3'ITR модифицированы, но содержат разные модификации (т.е. не содержат одинаковые модификации).
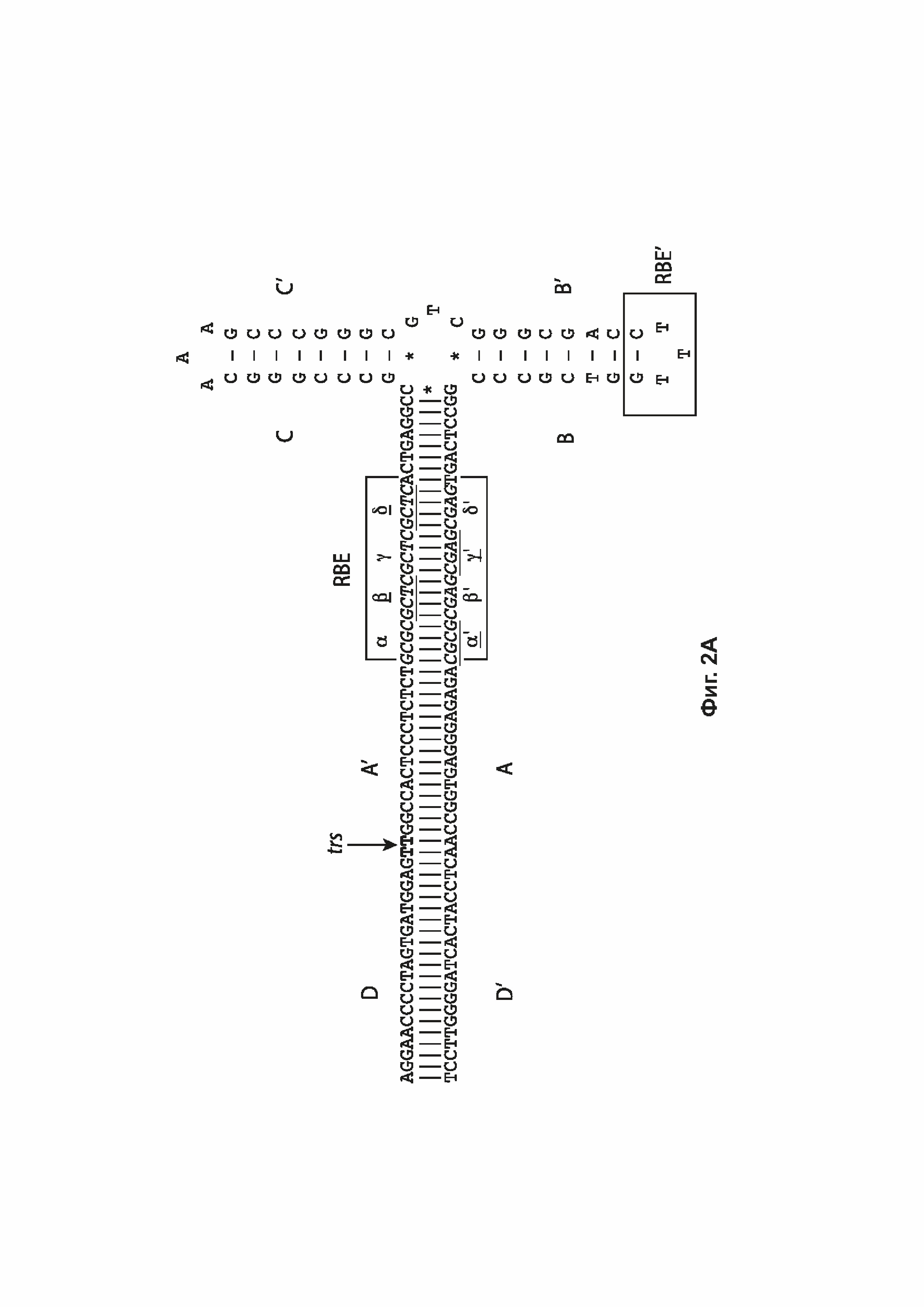
[0035] На фиг. 2А представлена Т-образная структура «петля на стебле» одного ITR дикого типа AAV2 (SEQ ID NO: 538) с идентифицированными плечом А-А', плечом В-В', плечом С-С', двумя сайтами связывания Rep (RBE и RBE') и сайтом концевого разрешения (trs). RBE содержит ряд 4 дуплексных тетрамеров, которые, как полагают, взаимодействуют либо с Rep 78, либо с Rep 68. Кроме того, RBE' также предположительно взаимодействует с комплексом Rep, собранным на ITR дикого типа или мутированном ITR в указанной конструкции. Области D и D' содержат сайты связывания транскрипционных факторов и другие консервативные структуры. На фиг. 2В показана предполагаемая Rep-катализируемая никирующая и лигирующая активность в ITR дикого типа с фиг. 2А, в том числе Т-образная структура типа «петля на стебле» ITR дикого типа AAV2 с идентифицированными плечом А-А', плечом В-В', плечом С-С', двумя сайтами связывания Rep (RBE и RBE'), сайтом концевого разрешения (trs) и областью D и D', содержащей несколько сайтов связывания транскрипционных факторов и другие консервативные структуры.
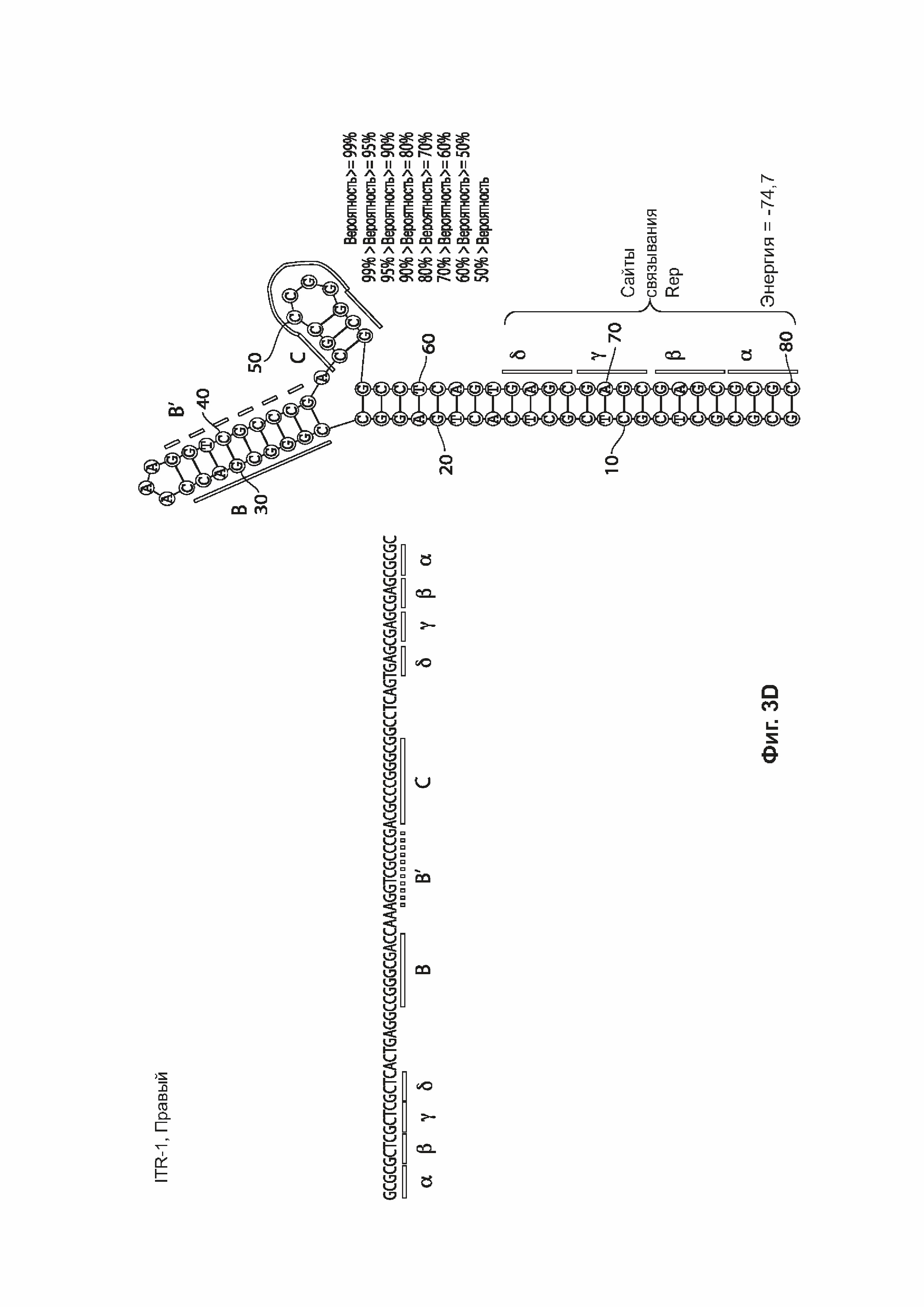
[0036] На фиг. 3А представлена первичная структура (последовательность полинуклеотидов) (слева) и вторичная структура (справа) RBE-содержащих частей плеча А-А', и плечо С-С' и плечо В-В' левого ITR дикого типа AAV2 (SEQ ID NO: 540). На фиг. 3В показан пример последовательности мутированного ITR (также называемого модифицированным ITR) для левого ITR. Показана первичная структура (слева) и предсказанная вторичная структура (справа) RBE-части плеча А-А', плечо С и плечо В-В' из примера мутированного левого ITR (ITR-1, левый) (SEQ ID NO: 113). Показана первичная структура (слева) и предсказанная вторичная структура (справа) RBE-содержащей части плеча А-А', плечо С и плечо В-В' примера мутированного левого ITR (ITR-1, левый) (SEQ ID NO: 113). На фиг. 3С представлена первичная структура (слева) и вторичная структура (справа) RBE-содержащей части петли А-А', и плеч В-В' и С-С' правого ITR AAV2 дикого типа (SEQ ID NO: 541). На фиг. 3D показан пример правого модифицированного ITR. Показана первичная структура (слева) и предсказанная вторичная структура (справа) RBE-содержащей части плеча А-А', В-В' и плеча С примера мутантного правого ITR (ITR-1, правый) (SEQ ID NO: 114). Может применяться любая комбинация левого и правого ITR (например, ITR AAV2 или другого вирусного серотипа, или синтетические ITR), при условии, что левый ITR асимметричен относительно правого ITR или отличается от него. На каждой из фиг. 3А-3D последовательности полинуклеотидов относятся к последовательности, используемой в плазмиде или бакмиде/геноме бакуловируса, использованных для получения зкДНК согласно описанию в настоящем документе. Также на каждой из фиг. 3A-3D приведены соответствующие вторичные структуры зкДНК, полученные на основании конфигураций зкДНК-вектора в плазмиде или бакмиде/геноме бакуловируса и предсказанных значений свободной энергии Гиббса.
[0037] На фиг. 4А приведено схематическое изображение апстрим (предшествующего) - процесса для получения инфицированных бакуловирусом клеток насекомых (ВПС), которые подходят для получения зкДНК способом, схематически представленным на фиг. 4В. На фиг. 4С показан биохимический способ и процесс подтверждения получения зкДНК-вектора. На фиг. 4D и фиг. 4Е приведены схематические изображения, описывающие процесс идентификации присутствия зкДНК в ДНК, собранной из клеточных осадков, полученных в ходе процессов получения зкДНК на фиг. 4В. На фиг. 4Е показана ДНК с прерывистой структурой. ЗкДНК может быть разрезана рестрикционной эндонуклеазой, имеющей один сайт распознавания на зкДНК-векторе, с получением двух фрагментов ДНК разного размера (1 т.п.о. и 2 т.п.о.) как в нейтральных, так и в денатурирующих условиях. На фиг. 4Е также показана зкДНК, имеющая линейную и непрерывную структуру. Указанный зкДНК-вектор может быть разрезан рестрикционной эндонуклеазой с получением двух фрагментов ДНК, мигрирующих в виде отрезков с 1 т.п.о. и 2 т.п.о. в нейтральных условиях, однако в денатурирующих условиях цепи остаются соединенными и продуцируют одиночные цепи, мигрирующие в виде отрезков с 2 т.п.о. и 4 т.п.о. На фиг. 4D схематически представлены ожидаемые полосы для примера зкДНК, нерасщепленной или расщепленной рестрикционной эндонуклеазой, а затем подвергнутой электрофорезу либо на нативном, либо на денатурирующем геле. На самом левом схематическом изображении показан нативный гель с несколькими полосами, предполагающими, что в дуплексной и неразрезанной форме зкДНК существует по меньшей мере в мономерном и димерном состояниях, которые видны в виде более быстро мигрирующего мономера меньшего размера и медленнее мигрирующего димера, размер которого в 2 раза больше размера мономера. На втором слева схематическом изображении показано, что при разрезании зкДНК рестрикционной эндонуклеазой исходные полосы пропадают и появляются полосы более быстро мигрирующих фрагментов (например, меньшего размера), соответствующие ожидаемым размерам фрагментов, остающихся после расщепления. В денатурирующих условиях исходная дуплексная ДНК является одноцепочечной и мигрирует как соединение в два раза большего размера по сравнению с тем, что наблюдается на нативном геле, поскольку комплементарные цепи ковалентно связаны. Соответственно, на втором схематическом изображении справа расщепленная зкДНК демонстрирует аналогичное распределение полос по сравнению с тем, что наблюдается на нативном геле, однако полосы соответствуют миграции фрагментов, размер которых в два раза больше их эквивалентов в нативном геле. На самом правом схематическом изображении показано, что неразрезанная зкДНК в денатурирующих условиях мигрирует в виде одноцепочечного раскрытого кольца, и, соответственно, размер наблюдаемых полос в два раза больше размера наблюдаемых в нативных условиях при нераскрытом кольце. На указанном чертеже «т.п.о.» относится к относительному размеру нуклеотидных молекул, основанному, в зависимости от контекста, либо на длине нуклеотидной цепи (например, для одноцепочечных молекул, наблюдаемых в денатурирующих условиях), либо на числе пар оснований (например, для двуцепочечных молекул, наблюдаемых в нативных условиях).
[0038] На фиг. 5 приведено иллюстративное изображение прогона через денатурирующий гель примеров зкДНК-векторов с (+) или без (-) расщепления эндонуклеазами (EcoRI для зкДНК-конструкций 1 и 2; BamH1 для зкДНК-конструкций 3 и 4; SpeI для зкДНК-конструкций 5 и 6; и XhoI для зкДНК-конструкций 7 и 8). Размеры для полос, выделенных звездочкой, определены и приведены в нижней части чертежа
[0039] На фиг. 6А приведен пример Rep-бакмиды в плазмиде pFBDLSR, содержащей последовательности нуклеиновых кислот для белков Rep Rep52 и Rep78. Указанный пример Rep-бакмиды содержит: фрагмент промотора IE1 (SEQ ID NO.66); нуклеотидную последовательность Rep78, в том числе последовательность Козак (SEQ ID NO:67), последовательность промотора полиэдрина для Rep52 (SEQ ID NO:68) и нуклеотидную последовательность Rep58, начиная с последовательности Козак gccgccacc) (SEQ ID NO:69). На фиг. 8В приведено схематическое изображение примера зкДНК-плазмиды-1, с wt-L ITR, промотором CAG, трансгеном люциферазы, WPRE и последовательностью полиаденилирования; и mod-R (модифицированным правым) ITR.
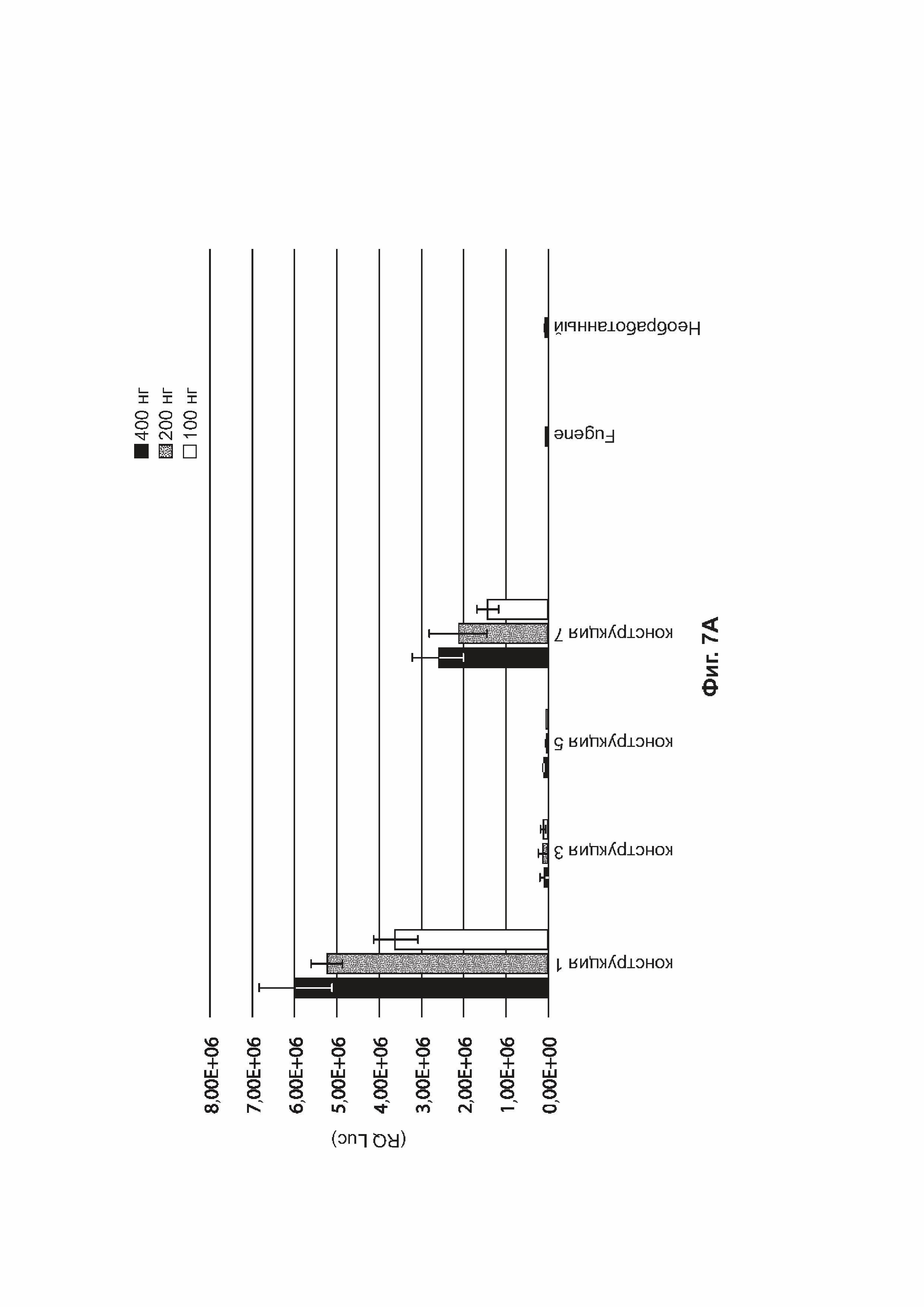
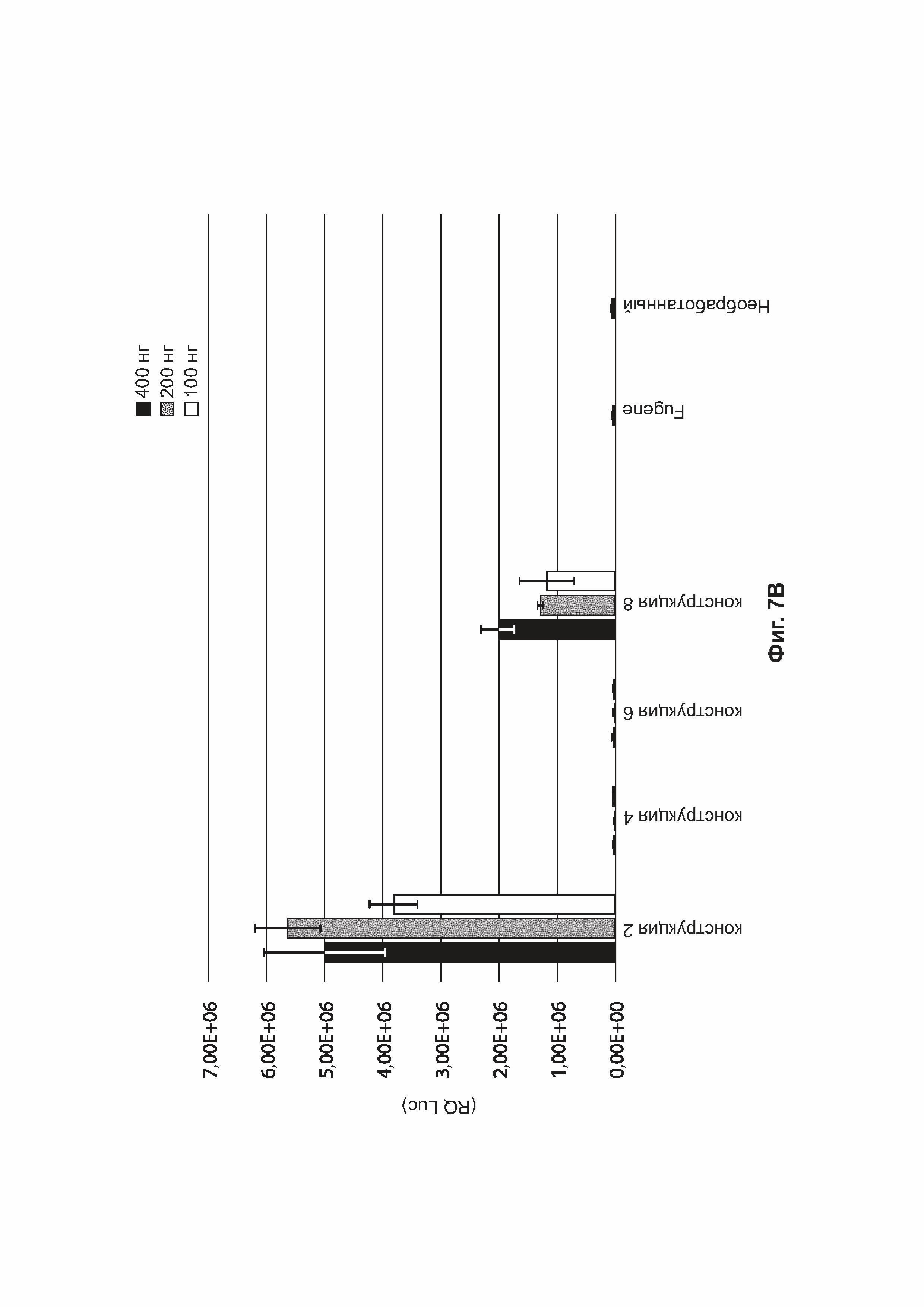
[0040] На фиг. 7А приведены результаты анализа экспрессии белка in vitro, измеряющего активность люциферазы (ось Y, RQ (Luc)) в клетках HEK293 через 48 часов после трансфекции для 400 нг (черный цвет), 200 нг (серый цвет) или 100 нг (белый цвет) конструкций, идентифицированных на оси X (конструкция-1, конструкция-3, конструкция-5, конструкция-7 (таблица 5 в примере 1). На фиг. 7В представлена активность люциферазы (ось Y, RQ (Luc)), измеренная в клетках HEK293 через 48 часов после трансфекции 400 нг (черный цвет), 200 нг (серый цвет) или 100 нг (белый цвет) конструкций, идентифицированных на оси X (конструкция-2, конструкция-4, конструкция-6, конструкция-8) (таблица 5). Также приведена активность люциферазы, измеренная в клетках HEK293, обработанных Fugene без каких-либо плазмид («Fugene»), или в необработанных клетках HEK293 («необработанные»).
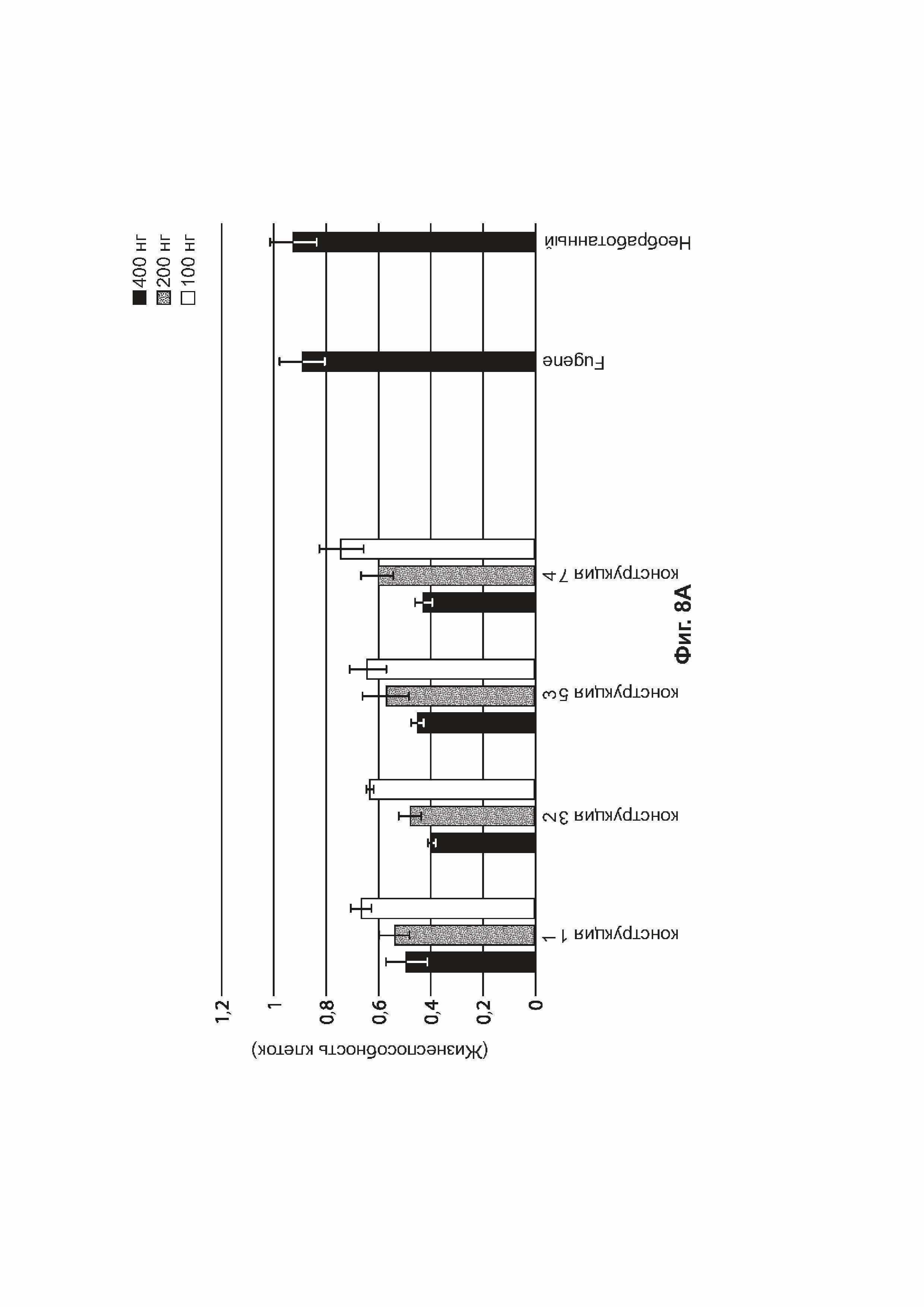
[0041] На фиг. 8А показана жизнеспособность клеток HEK293 (ось Y) через 48 часов после трансфекции 400 нг (черный цвет), 200 нг (серый цвет) или 100 нг (белый цвет) конструкций, идентифицированных на оси X (конструкция-1, конструкция-3, конструкция-5, конструкция-7). На фиг. 8В показана жизнеспособность клеток HEK293 (ось Y) через 48 часов после трансфекции 400 нг (черный цвет), 200 нг (серый цвет) или 100 нг (белый цвет) конструкций, идентифицированных на оси X (конструкция-2, конструкция-4, конструкция-6, конструкция-8).
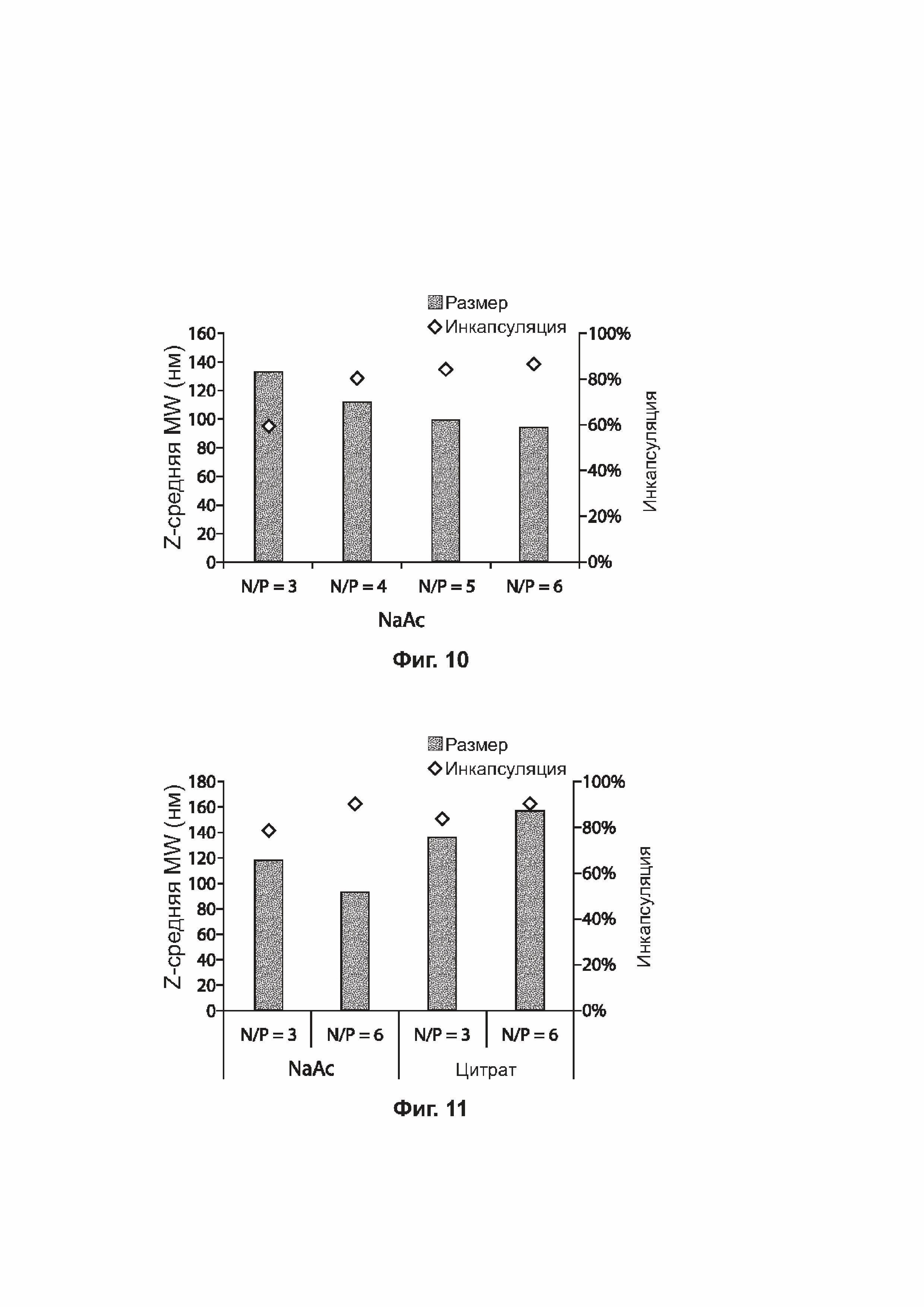
[0042] На фиг. 9-11 представлены столбчатые диаграммы, отражающие средний размер липидных наночастиц и инкапсуляцию зкДНК некоторых примеров липидных наночастиц, приготовленных с буферами, содержащими разные соли при постоянном соотношении N/P (фиг. 9) или варьирующих соотношениях N/P (фиг. 10 и 11).
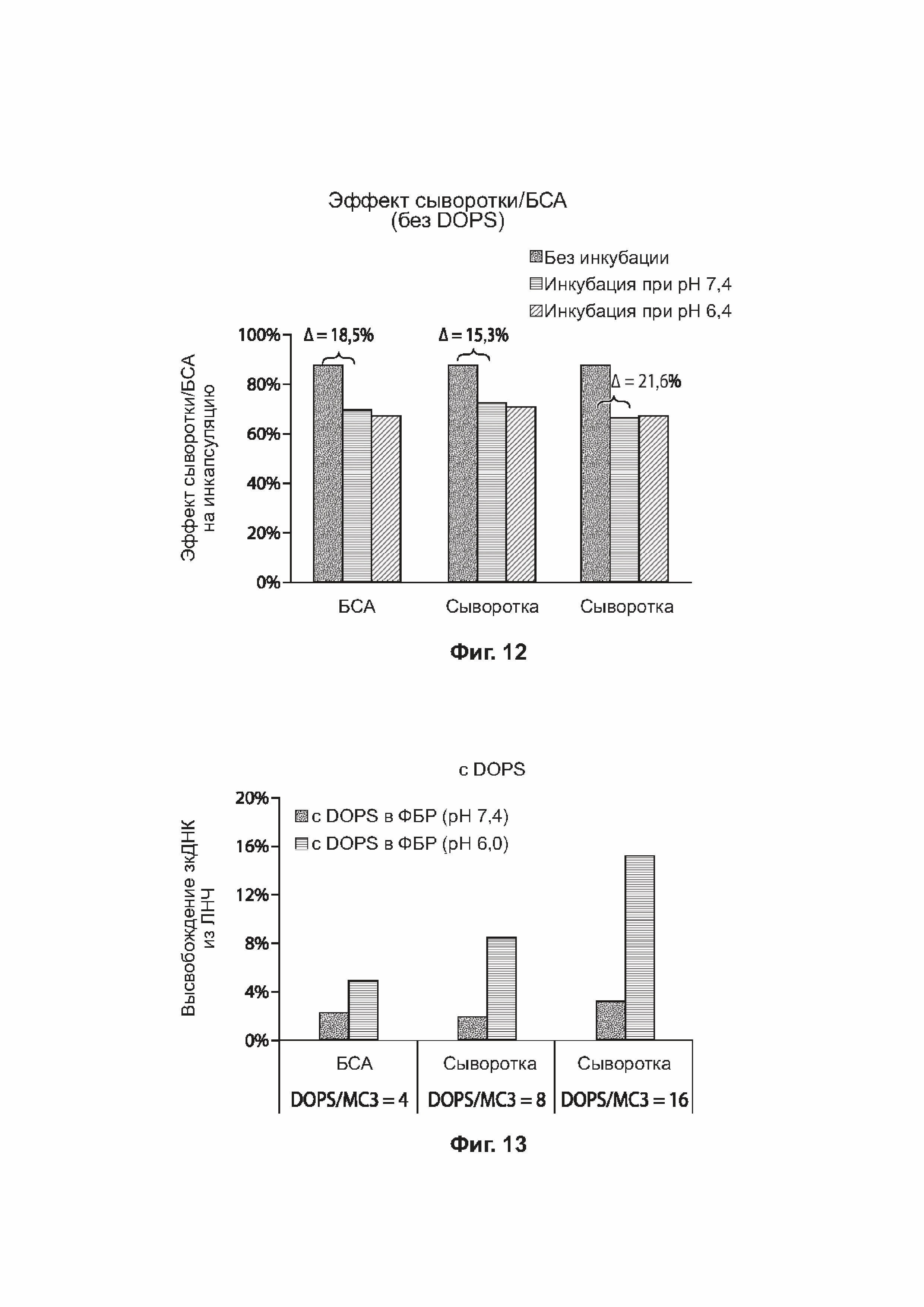
[0043] На фиг. 12 представлена столбчатая диаграмма, отражающая эффект сыворотки/БСА на инкапсулирование в примерах липидных наночастиц.
[0044] На фиг. 13 представлена столбчатая диаграмма, отражающая высвобождение зкДНК из примеров липидных наночастиц в присутствии диолеилфосфатидилсериновых (DOPS) липосом
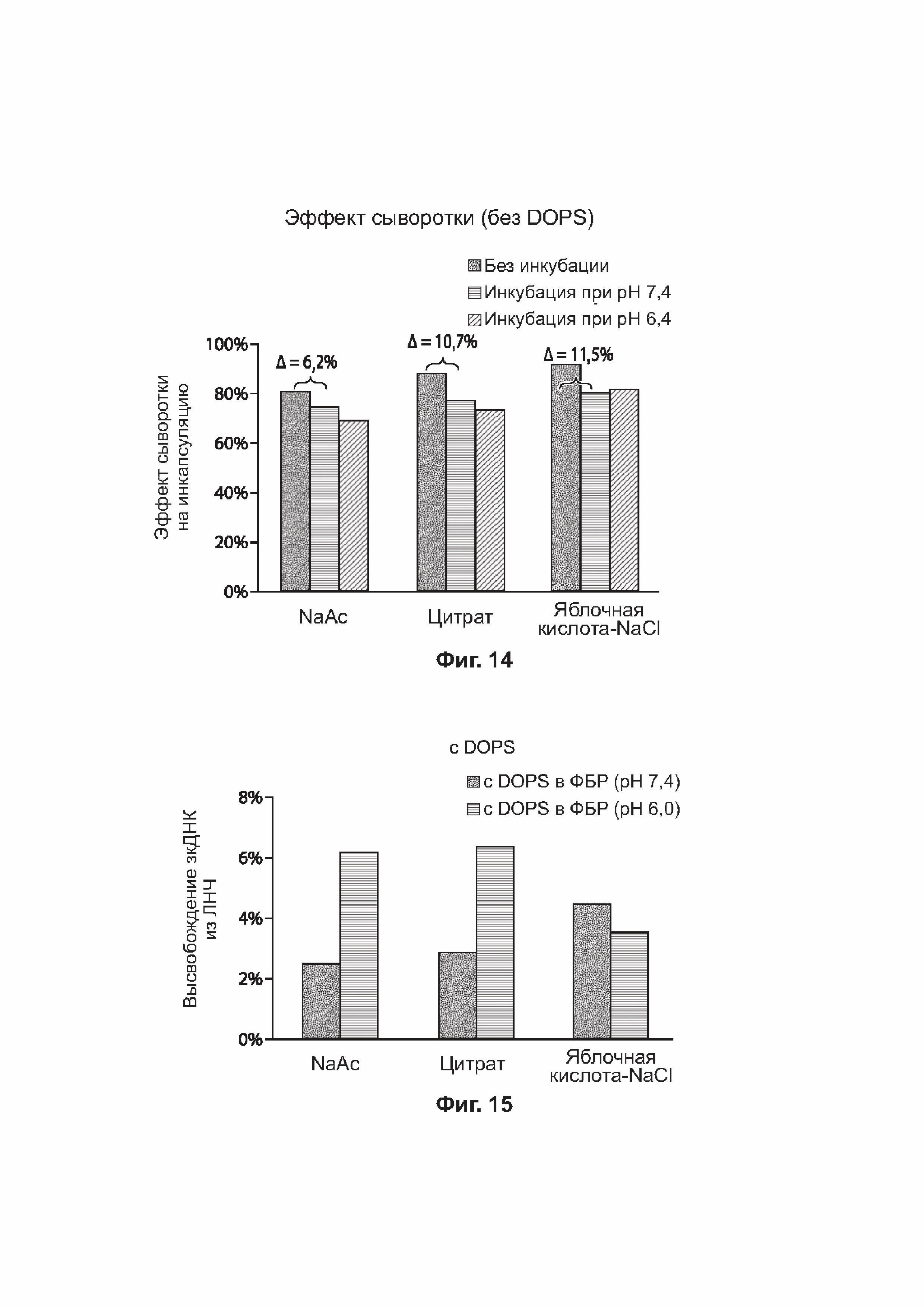
[0045] На фиг. 14 представлена столбчатая диаграмма, отражающая эффект сыворотки/БСА на инкапсулирование в примерах липидных наночастиц.
[0046] На фиг. 15 представлена столбчатая диаграмма, отражающая высвобождение зкДНК из примеров липидных наночастиц в присутствии диолеилфосфатидилсериновых (DOPS) липосом.
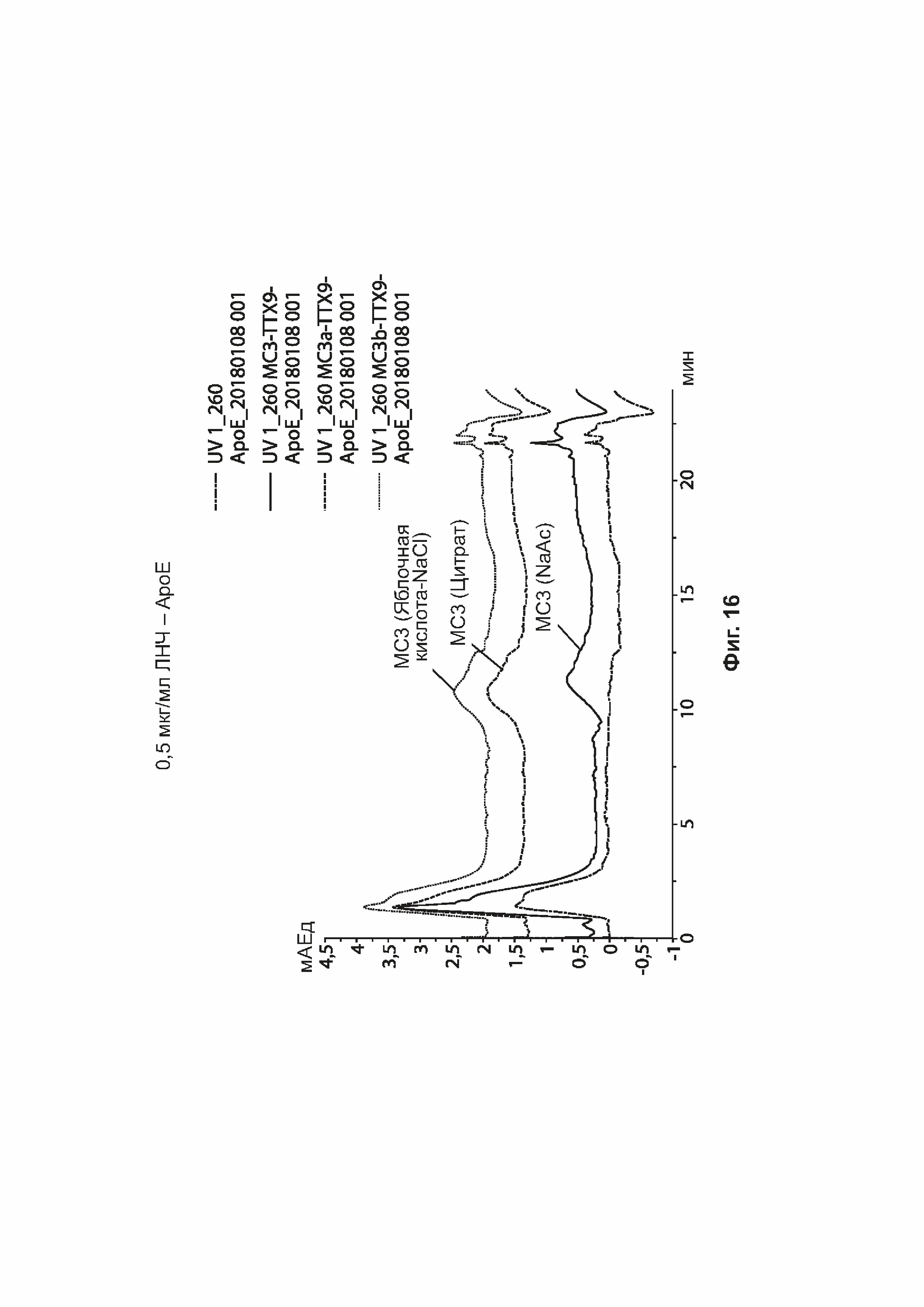
[0047] На фиг. 16 показано связывание АроЕ для некоторых примеров липидных наночастиц.
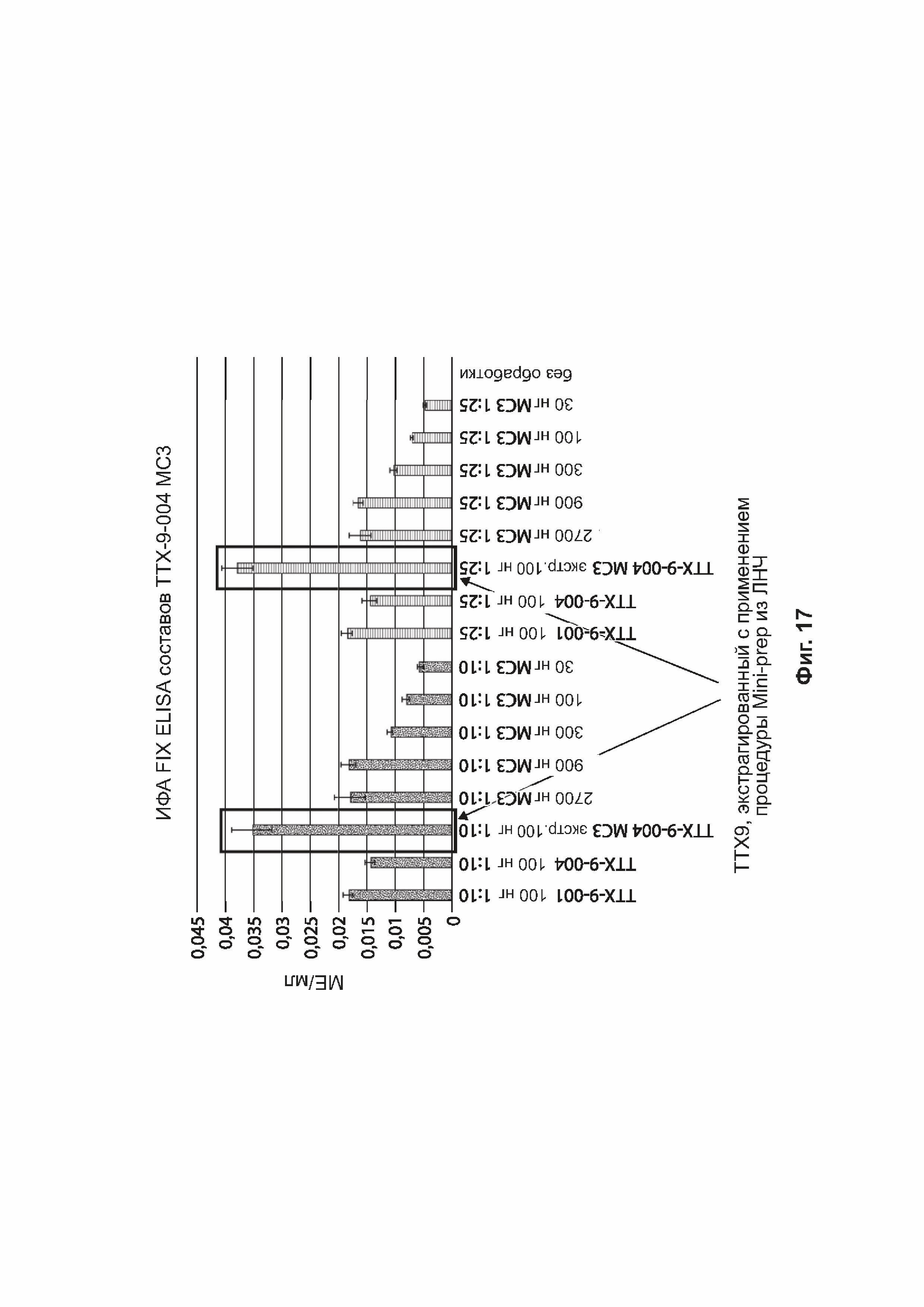
[0048] На фиг. 16 представлена столбчатая диаграмма, отражающая экспрессию в НЕК293 примеров зкДНК.
[0049] На фиг. 18 представлены фотографии гель-электрофореза, демонстрирующие экспрессию в НЕК293 примеров зкДНК.
[0050] На фиг. 19 представлена столбчатая диаграмма, отражающая экспрессию в НЕК293 примеров зкДНК.
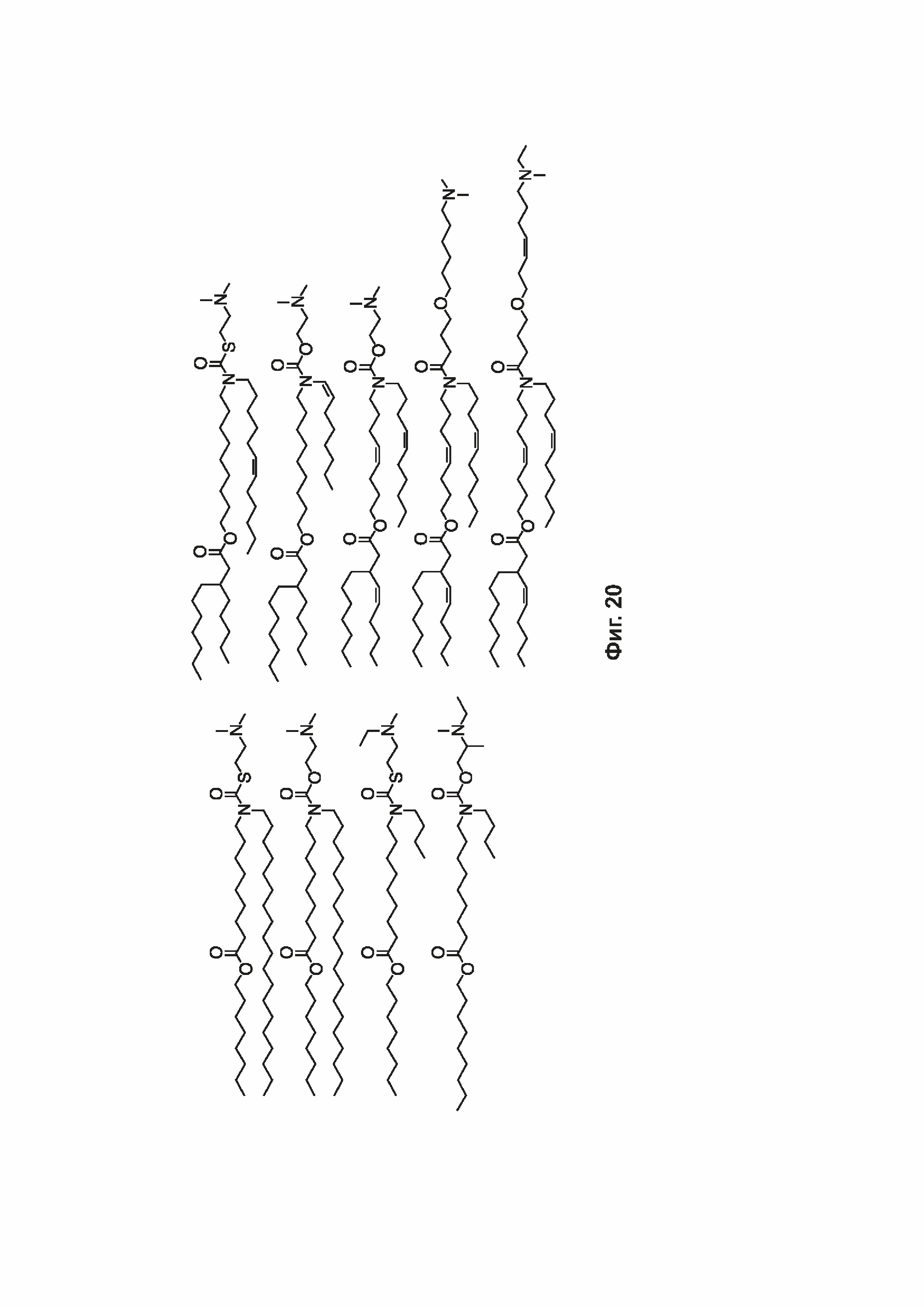
[0051] На фиг. 20 показаны некоторые примеры соединений формулы (I) и формулы (II), описанных в примере 10.
[0052] На фиг. 21 представлена общая схема синтеза соединений формулы (I) и (II), описанных в примере 10.
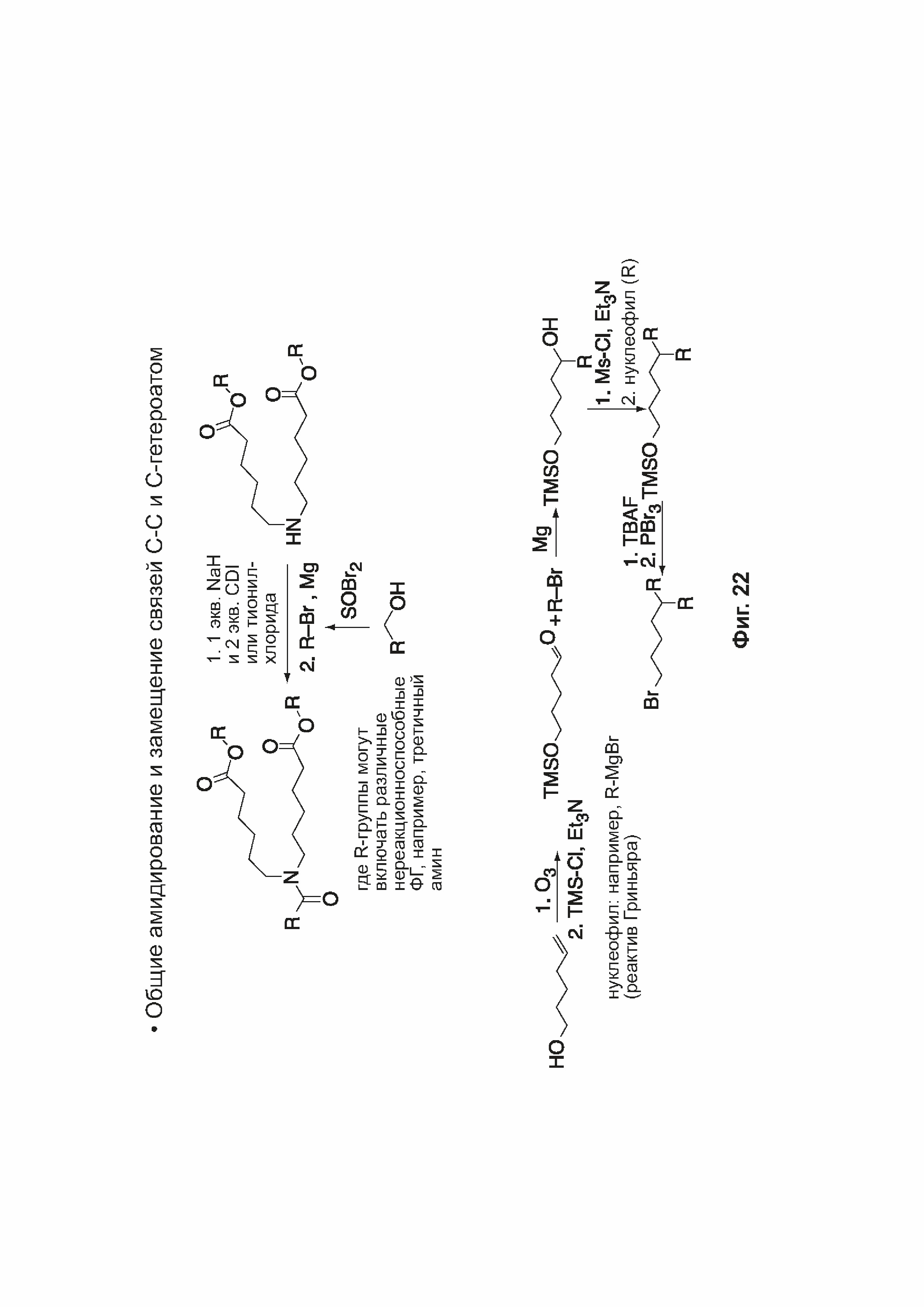
[0053] На фиг. 22 представлена общая схема синтеза соединений формулы (I) и (II), описанных в примере 10.
[0054] На фиг. 23 показаны некоторые примеры соединений формулы (III), описанных в примере 11.
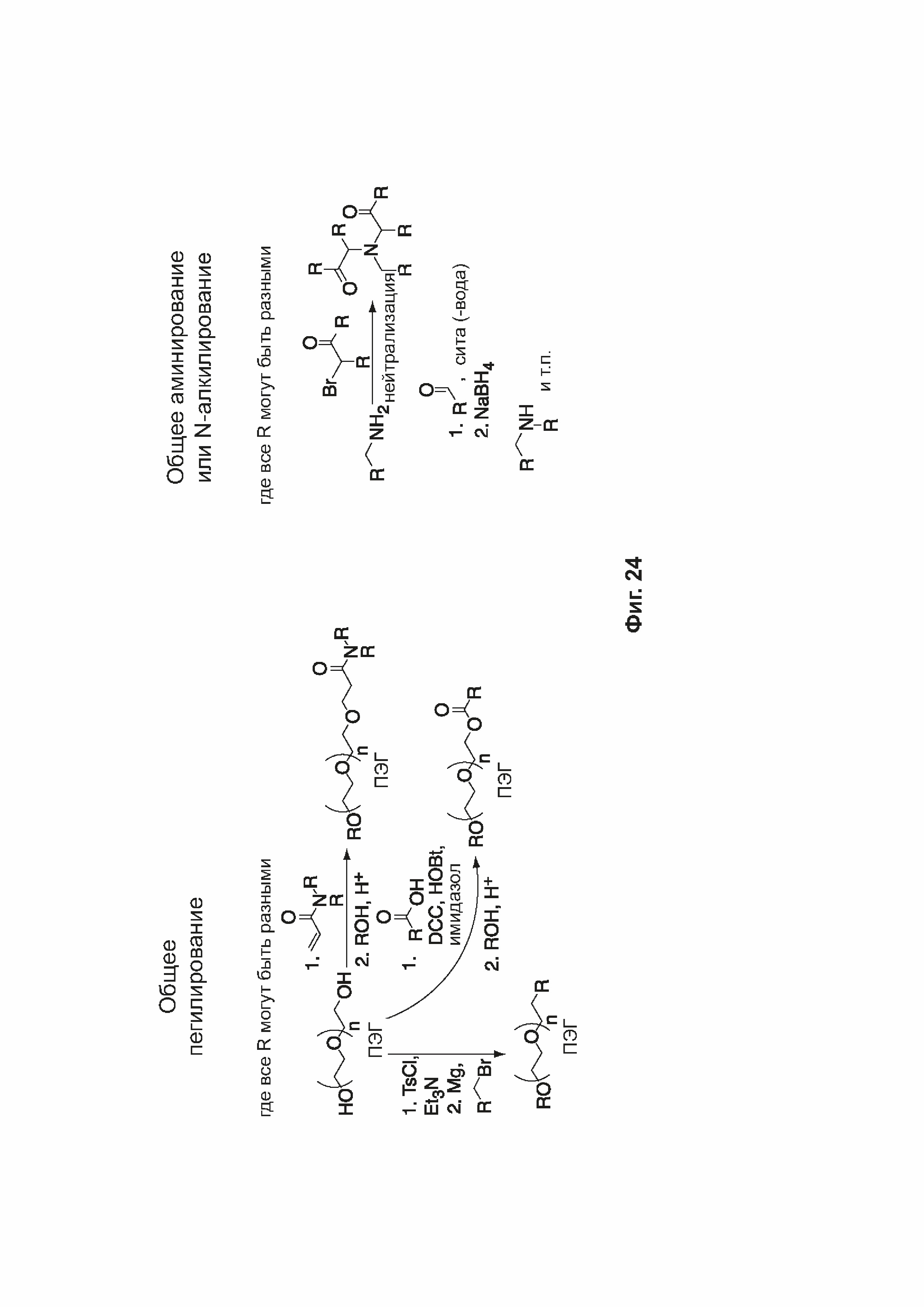
[0055] На фиг. 24 приведены общие схемы синтеза соединений формулы (III), формулы (IV) и формулы (V), описанных в примере 11.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[0056] Если в настоящем документе не указано иное, научные и технические термины, используемые применительно к настоящему изобретению, имеют значения, обычно подразумеваемые специалистами в области техники, к которой относится настоящее изобретение. Следует понимать, что настоящее изобретение не ограничено конкретной методикой, протоколами и реагентами, и т.п., описанными в настоящем документе, и поэтому такие методики, протоколы и реагенты могут варьировать. Используемая в настоящем документе терминология служит только для описания конкретных вариантов реализации, и не предназначена для ограничения объема настоящего изобретения, который определен исключительно формулой изобретения. Определения распространенных терминов иммунологии и молекулярной биологии можно найти в следующих источниках: руководство The Merck Manual of Diagnosis and Therapy, 19e изд., издано Merck Sharp & Dohme Corp., 2011 (ISBN 978-0-911910-19-3); Robert S. Porter et al. (ред.), Fields Virology, 6e изд, издание Lippincott Williams & Wilkins, Philadelphia, PA, USA (2013), Knipe, D.M. and Howley, P.M. (ред.), The Encyclopedia of Molecular Cell Biology and Molecular Medicine, издание Blackwell Science Ltd., 1999-2012 (ISBN 9783527600908); и Robert A. Meyers (ред.), Molecular Biology and Biotechnology: a Comprehensive Desk Reference, издание VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8); Immunology by Werner Luttmann, издание Elsevier, 2006; Janeway's Immunobiology, Kenneth Murphy, Allan Mowat, Casey Weaver (ред.), Taylor & Francis Limited, 2014 (ISBN 0815345305, 9780815345305); Lewin's Genes XI, издание Jones & Bartlett Publishers, 2014 (ISBN-1449659055); Michael Richard Green and Joseph Sambrook, Molecular Cloning: A Laboratory Manual, 4е изд., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., USA (2012) (ISBN 1936113414); Davis et al., Basic Methods in Molecular Biology, Elsevier Science Publishing, Inc., New York, USA (2012) (ISBN 044460149X); Laboratory Methods in Enzymology: DNA, Jon Lorsch (ред.) Elsevier, 2013 (ISBN 0124199542); Current Protocols in Molecular Biology (CPMB), Frederick M. Ausubel (ред.), John Wiley and Sons, 2014 (ISBN 047150338X, 9780471503385), Current Protocols in Protein Science (CPPS), John E. Coligan (ред.), John Wiley and Sons, Inc., 2005; и Current Protocols in Immunology (CPI) (John E. Coligan, ADA M Kruisbeek, David H Margulies, Ethan M Shevach, Warren Strobe, (ред.) John Wiley and Sons, Inc., 2003 (ISBN 0471142735, 9780471142737), содержание которых полностью включено посредством ссылок в настоящий документ.
[0057] В настоящем документе термин «липидная наночастица» относится к везикуле, образованной одним или более липидными компонентами. Липидные наночастицы обычно используют в качестве носителей для доставки нуклеиновых кислот в контексте фармацевтических разработок. Они работают за счет слияния с клеточной мембраной и перегруппировки ее липидной структуры для доставки лекарственного средства или активного фармацевтического ингредиента (АФИ). Обычно, состав липидных наночастиц для такой доставка включает синтетические ионизируемые или катионные липиды, фосфолипиды (в частности, соединения, содержащие фосфатидилхолиновую группу), холестерин и полиэтиленгликоль-липид (ПЭГ-липид); однако указанные композиции могут также включать другие липиды. Итоговая композиция липидов, как правило, определяет поверхностные характеристики и, соответственно, содержание белков (опсонизацию) в биологических системах, и, соответственно, управление биораспределением и характеристиками поглощения клетками.
[0058] В настоящем документе термин «липосома» относится к молекулам липидов, собранным в сферической конфигурации, инкапсулирующей внутренний объем водного раствора, отделенный от внешнего объема водного раствора. Липосомы представляют собой везикулы, имеющие по меньшей мере один липидный бислой. Липосомы обычно используют в качестве носителей для доставки лекарственных/терапевтических средств в контексте фармацевтических разработок. Они работают за счет слияния с клеточной мембраной и перегруппировки ее липидной структуры для доставки лекарственного средства или активного фармацевтического ингредиента. Липосомные композиции для такой доставки состоят, как правило, из фосфолипидов, в частности, соединений, содержащих фосфатидилхолиновую группу, однако указанные композиции могут также включать другие липиды
[0059] В настоящем документе термин «ионизируемый липид» относится к липидам, содержащим по меньшей мере одну протонируемую или депротонируемую группу, таким образом, что указанный липид положительно заряжен при значении рН, равном или меньшем физиологического значения рН (например, рН 7,4), и нейтрален при втором значении рН, предпочтительно равном или превышающем физиологическое значение рН. Специалисту в данной области техники будет понятно, что добавление или удаление протонов, зависящее от рН, представляет собой равновесный процесс, и что указание на заряженный или нейтральный липид относится к природе преобладающего вида липида, и не обязательно все липиды будут находиться в заряженной или нейтральной форме. Как правило, ионизируемые липиды характеризуются pKa протонируемой группы в диапазоне от приблизительно 4 до приблизительно 7. Ионизируемые липиды в настоящем документе также называют катионными липидами.
[0060] В настоящем документе термин «некатионный липид» относится к любому амфипатическому липиду, а также любому другому нейтральному липиду или анионному липиду. Соответственно, указанный некатионный липид может представлять собой нейтральный незаряженный, цвиттерионный или анионный липид.
[0061] В настоящем документе термин «конъюгированный липид» относится к молекуле липида, конъюгированной с нелипидной молекулой, такой как ПЭГ, полиоксазолин, полиамид или полимер (например, катионный полимер).
[0062] В настоящем документе термин «вспомогательное вещество» относится к фармакологически неактивным ингредиентам, которые включены в состав с АФИ, например, зкДНК, и/или липидным наночастицам, для увеличения объема и/или стабилизации состава при получении лекарственной формы. Общие категории вспомогательных веществ включают, например, объемообразующие агенты, наполнители, разбавители, антиадгезивы, связующие вещества, покрытия, разрыхлители, вкусоароматические агенты, красящие агенты, смазывающие вещества, скользящие вещества, сорбенты, консерванты, подсластители и продукты, используемые для облегчения абсорбции или растворимости лекарственного средства или других фармакокинетических характеристик.
[0063] В настоящем документе термины «гетерологичная нуклеотидная последовательность» и «трансген» используются взаимозаменяемо и относятся к представляющей интерес нуклеиновой кислоте (которая не является нуклеиновой кислотой, кодирующей капсидный полипептид), которая включена в зкДНК-вектор и может быть доставлена и экспрессирована зкДНК-вектором согласно описанию в настоящем документе. Представляющие интерес трансгены включают, не ограничиваясь перечисленными, нуклеиновые кислоты, кодирующие полипептиды, предпочтительно терапевтические (например, для медицинского, диагностического или ветеринарного применения) или иммуногенные полипептиды (например, для вакцин). Согласно некоторым вариантам реализации представляющие интерес нуклеиновые кислоты включают нуклеиновые кислоты, транскрибируемые в терапевтическую РНК. Предусмотренные трансгены для применения в зкДНК-векторах согласно настоящему изобретению включают, не ограничиваясь перечисленными, трансгены, которые экспрессируют или кодируют один или более полипептидов, пептидов, рибозимов, аптамеров, пептидных нуклеиновых кислот, киРНК, RNAi (РНК-интерференция), миРНК, днкРНК, антисмысловые олиго- или полинуклеотиды, антитела, антигенсвязывающие фрагменты или любую комбинацию перечисленного.
[0064] В настоящем документе термины «экспрессионная кассета» и «транскрипционная кассета» используются взаимозаменяемо и относятся к линейному отрезку нуклеиновых кислот, который включает трансген, который функционально связан с одним или более промоторами или другими регуляторными последовательностями, достаточными для направления транскрипции указанного трансгена, однако не включает кодирующие капсид последовательности, другие последовательности вектора или области инвертированных концевых повторов. Экспрессионная кассета может, кроме того, содержать один или более цис-действующих последовательностей (например, промоторов, энхансеров или репрессоров), один или более интронов, и один или более посттранскрипционных регуляторных элементов.
[0065] В настоящем документе термин «концевой повтор» или «TR» включает любой вирусный концевой повтор или синтетическую последовательность, которая содержит по меньшей мере одну минимально требуемую точку начала репликации и область, содержащую палиндромную шпилечную структуру. Rep-связывающая последовательность («RBS») и сайт концевого разрешения («TRS») вместе составляют «минимальную требуемую точку начала репликации» и, соответственно, концевой повтор (TR) содержит по меньшей мере одну RBS и по меньшей мере один TRS. Все TR, обратно комплементарные друг другу, в составе заданного отрезка последовательности полинуклеотидов, как правило, называют «инвертированными концевыми повторами», или «ITR». В контексте вируса ITR опосредуют репликацию, упаковку вируса, интеграцию и спасение провируса. Как было неожиданно обнаружено авторами описанного изобретения, TR, не являющиеся обратно комплементарными по всей длине, могут, тем не менее, выполнять традиционные функции ITR, и, соответственно, термин ITR в настоящем документе относится к TR в зкДНК-геноме или зкДНК-векторе, который способен опосредовать репликацию зкДНК-вектора. Специалисту в данной области техники будет понятно, что в комплексных конфигурациях зкДНК могут присутствовать более двух ITR или пар асимметричных ITR. ITR может представлять собой ITR AAV или ITR не из AAV, или может происходить из ITR AAV или ITR не из AAV. Например, ITR может происходить из вируса семейства Parvoviridae, которое охватывает парвовирусы и депендовирусы (например, парвовирус собак, бычий парвовирус, парвовирус мышей, свиной парвовирус, парвовирус человека В-19), или шпилька SV40, которая служит точкой начала репликации SV40, может применяться в качестве ITR, который может дополнительно быть модифицирован путем усечения, замены, делеции, инсерции и/или добавления. Вирусы семейства Parvoviridae состоят из двух подсемейств: Parvovirinae, инфицирующих позвоночных животных, и Densovirinae, инфицирующих беспозвоночных животных. Депендопарвовирусы включают вирусное семейство аденоассоциированных вирусов (AAV), способных к репликации у хозяев - позвоночных животных, в том числе, но не ограничиваясь перечисленными, у человека, видов приматов, бычьих, собачьих, лошадиных и овечьих
[0066] В настоящем документе термин «асимметричные ITR» относится к паре ITR в составе одного зкДНК-генома или зкДНК-вектора, не являющихся обратно комплементарными по всей длине. Различие последовательностей двух ITR может быть обусловлено добавлением нуклеотидов, делецией, усечением или точечной мутацией. Согласно одному варианту реализации один ITR из пары может представлять собой последовательность AAV дикого типа, а другой последовательность не дикого типа или синтетическую. Согласно другому варианту реализации ни один ITR из пары не представляет собой последовательность AAV дикого типа и последовательности указанных двух ITR различаются. Для удобства в настоящем документе ITR, расположенный в направлении 5' относительно экспрессионной кассеты (выше) в зкДНК-векторе, называется «5'-ITR» или «левым ITR», a ITR, расположенный в направлении 3' относительно экспрессионной кассеты (ниже) в зкДНК-векторе, называется «3'-ITR» или «правым ITR».
[0067] В настоящем документе термин «зкДНК-геном» относится к экспрессионной кассете, которая дополнительно включает по меньшей мере одну область инвертированного концевого повтора. ЗкДНК-геном может дополнительно содержать одну или более спейсерных областей. Согласно некоторым вариантам реализации указанный зкДНК-геном включен в виде полинуклеотида ДНК с межмолекулярными дуплексными структурами в плазмиду или вирусный геном.
[0068] В настоящем документе термин «спейсерная область зкДНК» относится к промежуточной последовательности, которая разделяет функциональные элементы в указанном зкДНК-векторе или зкДНК-геноме. Согласно некоторым вариантам реализации спейсерные области зкДНК удерживают два функциональных элемента на требуемом расстоянии для оптимальной функциональности. Согласно некоторым вариантам реализации спейсерные области зкДНК обеспечивают или увеличивают генетическую стабильность зкДНК-генома в составе например, плазмиды или бакуловируса. Согласно некоторым вариантам реализации спейсерные области зкДНК облегчают подготовленную генетическую манипуляцию зкДНК-геномом, обеспечивая удобное расположение сайтов клонирования и т.п. Например, согласно определенным аспектам олигонуклеотидный «полилинкер», содержащий несколько сайтов рестрикции эндонуклеазами или последовательность не из открытой рамки считывания, сконструированный так, чтобы не содержать известных сайтов связывания белка (например, транскрипционный фактор), может быть размещен в зкДНК-геноме для разделения цис-действующих факторов, например, может быть инсертирован 6-мер, 12-мер, 18-мер, 24-мер, 48-мер, 86-мер, 176-мер и т.п., между сайтом концевого разрешения и расположенным в направлении 5' транскрипционным регуляторным элементом. Аналогичным образом, может быть включен спейсер между последовательностью сигнала полиаденилирования и сайтом 3'-концевого разрешения.
[0069] В настоящем документе термины «сайт связывания Rep», «Rep-связывающий элемент», «RBE» и «RBS» используются взаимозаменяемо и относятся к сайту связывания белка Rep (например, Rep 78 AAV или Rep 68 AAV), который при связывании белком Rep позволяет указанному белку Rep проявлять соответствующую сайт-специфическую эндонуклеазную активность на последовательности, включающей RBS. Последовательность RBS и обратно-комплементарная ей последовательность вместе образуют один RBS. Последовательности RBS известны в данной области техники и включают, например, 5'-GCGCGCTCGCTCGCTC-3' (SEQ ID NO: 531), последовательность RBS, идентифицированную в AAV2. Согласно вариантам реализации настоящего изобретения может применяться любая известная последовательность RBS, в том числе другие известные последовательности RBS AAV и другие известные естественные или синтетические последовательности RBS. Без связи с какой-либо теорией считается, что нуклеазный домен белка Rep связывается с дуплексной нуклеотидной последовательностью GCTC, и, соответственно, на дуплексном олигонуклеотиде 5'-(GCGC)(GCTC)(GCTC)(GCTC)-3' (SEQ ID NO: 531) происходит прямое связывание и стабильная сборка двух известных белков Rep AAV. Кроме того, растворимые агрегированные конформеры (т.е. неопределенное число взаимосвязанных белков Rep) диссоциируют и связываются с олигонуклеотидами, которые содержат сайты связывания Rep.Каждый белок Rep взаимодействует и с азотистыми основаниями, и с фосфодиэфирным остовом на каждой цепи. Взаимодействия с азотистыми основаниями обеспечивают специфичность в отношении последовательности, тогда как взаимодействия с фосфодиэфирным остовом являются неспецифическими или менее специфическими в отношении последовательности, и стабилизируют комплекс белка с ДНК.
[0070] В настоящем документе термины «сайт концевого разрешения» и «TRS» используются взаимозаменяемо и относятся к области, в которой Rep образует через тирозин-фосфодиэфирную связь с 5'-тимидином, с получением 3'-ОН, который служит в качестве субстрата для достройки ДНК клеточной ДНК-полимеразой, например, ДНК-полимеразой дельта или ДНК-полимеразой эпсилон. Как вариант, комплекс Rep-тимидин может принимать участие в скоординированной реакции лигирования. Согласно некоторым вариантам реализации TRS охватывает как минимум неспаренный тимидин. Согласно некоторым вариантам реализации эффективность никирования TRS можно контролировать, по меньшей мере отчасти, расстоянием между ним и RBS в пределах одной молекулы. Если акцепторный субстрат представлен комплементарным ITR, итоговый продукт представляет собой внутримолекулярный дуплекс. Последовательности TRS известны в данной области техники и включают, например, 5'-GGTTGA-3' (SEQ ID NO: 45), гексануклеотидную последовательность, идентифицированную в AAV2. Согласно вариантам реализации настоящего изобретения может применяться любая известная последовательность TRS, в том числе другие известные последовательности TRS AAV и другие известные естественные или синтетические последовательности TRS, такие как AGTT (SEQ ID NO: 46), GGTTGG (SEQ ID NO: 47), AGTTGG (SEQ ID NO: 48), AGTTGA (SEQ ID NO: 49); и другие мотивы, такие как RRTTRR (SEQ ID NO: 50).
[0071] В настоящем документе термин «зкДНК-плазмида» относится к плазмиде, которая содержит зкДНК-геном в виде межмолекулярного дуплекса.
[0072] В В настоящем документе термин «зкДНК-бакмида» относится к геному инфекционного бакуловируса, включающему зкДНК-геном в виде межмолекулярного дуплекса, способному размножаться в Е. coli в виде плазмиды и, соответственно, функционировать в качестве челночного вектора для бакуловируса.
[0073] В настоящем документе термин «зкДНК-бакуловирус» относится к бакуловирусу, который содержит зкДНК-геном в виде межмолекулярного дуплекса в составе генома бакуловируса.
[0074] В настоящем документе термины «инфицированная зкДНК-бакуловирусом клетка насекомого» и «зкДНК-ВПС» используются взаимозаменяемо, и относятся к клетке-хозяину из беспозвоночного животного (в том числе, но не ограничиваясь указанным, клетке насекомого (например, клетке Sf9)), инфицированной зкДНК-бакуловирусом.
[0075] В настоящем документе термины «вектор с ДНК с замкнутыми концами», «зкДНК-вектор» и «зкДНК» используются взаимозаменяемо и относятся к невирусному бескапсидному ДНК-вектору по меньшей мере с одним ковалентно-замкнутым концом (т.е. содержащему внутримолекулярный дуплекс). Согласно некоторым вариантам реализации зкДНК содержит два ковалентно-замкнутых конца.
[0076] Согласно определению в настоящем документе «репортеры» относятся к белкам, которые могут применяться для обеспечения детектируемых показаний. Репортеры обычно продуцируют измеряемый сигнал, например, флуоресцентный, цветовой или люминесцентный. Кодирующие последовательности репортерных белков кодируют белки, присутствие которых в клетке или организме легко поддается наблюдению. Например, флуоресцентные белки вызывают флуоресценцию клетки при возбуждении светом с конкретной длиной волны, люциферазы приводят к катализу клеткой реакции, которая генерирует свет, а ферменты, такие как β-галактозидаза, преобразуют субстрат в окрашенный продукт. Примеры репортерных полипептидов, подходящих для экспериментальных или диагностических целей, включают, не ограничиваясь перечисленными, β-лактамазу, β-галактозидазу (LacZ), щелочную фосфатазу (АР), тимидинкиназу (ТК), зеленый флуоресцентный белок (GFP) и другие флуоресцентные белки, хлорамфениколацетилтрансферазу (CAT), люциферазу и другие, хорошо известные в данной области техники.
[0077] В настоящем документе термин «эффекторный белок» относится к полипептиду, который обеспечивает детектируемые показания, либо, например, как репортерный полипептид, либо, более предпочтительно, как полипептид, убивающий клетку, например, токсин, или агент, придающий клетке чувствительность к киллингу (убийству, уничтожению) определенным агентом или при отсутствии определенного агента. Эффекторные белки включают любой белок или пептид, который прямо нацелен на ДНК и/или РНК клетки-хозяина или повреждает ее. Например, эффекторные белки могут включать, не ограничиваясь перечисленными, рестрикционную эндонуклеазу, которая нацелен на последовательность ДНК клетки-хозяина (геномный или внехромосомный элемент), протеазу, разлагающую полипептидную мишень, необходимую для выживания клетки, ингибитор ДНК-гиразы и токсин рибонуклеазного типа. Согласно некоторым вариантам реализации экспрессия эффекторного белка, контролируемая синтетическим биологическим контуром согласно описанию в настоящем документе, может принимать участие в качестве фактора в другом синтетическом биологическом контуре, с расширением таким образом диапазона и сложности отклика системы биологического контура.
[0078] Термин «транскрипционные регуляторы» относится к транскрипционным активаторам и репрессорам, которые либо активируют, либо подавляют транскрипцию гена, представляющего интерес. Промоторы представляют собой области нуклеиновой кислоты, которые инициируют транскрипцию конкретного гена. Транскрипционные активаторы, как правило, связываются поблизости от транскрипционных промоторов и привлекают РНК-полимеразу, чтобы прямо инициировать транскрипцию. Репрессоры связываются с транскрипционными промоторами и стерически затрудняют инициацию транскрипции РНК-полимеразой. Другие транскрипционные регуляторы могут служить либо активатором, либо репрессором в зависимости от места их связывания и условий в клетке и окружающей среде. Неограничивающие примеры классов транскрипционных регуляторов включают, не ограничиваясь перечисленными, гомеодоменные белки, белки с цинковыми пальцами, белки с мотивом «крылатая спираль» (белки Forkhead) и белки с лейциновой застежкой.
[0079] В настоящем документе «белок-репрессор» или «белок-индуктор» представляет собой белок, который связывается с элементом регуляторной последовательности и подавляет или активирует, соответственно, транскрипцию последовательностей, функционально связанных с указанным элементом регуляторной последовательности. Предпочтительные белки-репрессоры и беки-индукторы согласно описанию в настоящем документе чувствительны к присутствию или отсутствию по меньшей мере одного входного агента или входного действия окружающей среды. Предпочтительные белки согласно описанию в настоящем документе являются модульными по форме, содержащими, например, отделяемые ДНК-связывающие, и связывающие или реагирующие на входные агенты элементы или домены.
[0080] В настоящем документе «носитель» включает любые растворители, дисперсионные среды, основы, покрытия, разбавители, антибактериальные и антимикотические агенты, изотонические и замедляющие абсорбцию агенты, буферы, растворы-носители, суспензии, коллоиды и т.п. Применение таких сред и агентов для фармацевтических активных веществ хорошо известно в данной области техники. В указанные композиции могут также быть включены дополнительные активные ингредиенты. Выражение «фармацевтически приемлемые» относится к молекулярным объектам и композициям, которые не приводят к токсической, аллергической или аналогичной нежелательной реакции при введении хозяину.
[0081] В настоящем документе «реагирующий на входной агент домен» представляет собой домен транскрипционного фактора, который связывает или иначе отвечает на условия или входной агент таким образом, чтобы обеспечивать реакцию соединенного с ним ДНК-связывающего слитого домена на наличие указанного условия или входного действия. Согласно одному варианту реализации наличие указанного условия или входного действия приводит к конформационному изменению реагирующего на входной агент домена, или белка, с которым он слит, что модифицирует модулирующую транскрипцию активность транскрипционного фактора.
[0082] Термин «in vivo» относится к анализам или процессам, которые происходят в организме или в пределах организма, например, многоклеточного животного. Согласно некоторым аспектам настоящего изобретения может быть указано, что способ или применение осуществляют «in vivo», если используют одноклеточный организм, такой как бактерия. Термин «ех vivo» относится к способам и применениям, которые осуществляют с использованием живой клетки с интактной мембраной, которая находится вне организма многоклеточного животного или растения, например, эксплантатов, культивированных клеток, в том числе первичных клеток и линий клеток, трансформированных линий клеток и экстрагированных тканей или клеток, в том числе клеток крови, и т.п. Термин «in vitro» относится к анализам и способам, не требующим наличия клетки с интактной мембраной, например, на клеточных экстрактах, и может относиться к введению программируемого синтетического биологического контура в неклеточную систему, такую как среда, не содержащая клеток или клеточных систем, таких как клеточные экстракты.
[0083] Термин «промотор» в настоящем документе относится к любой последовательности нуклеиновой кислоты, которая регулирует экспрессию другой последовательности нуклеиновой кислоты путем управления транскрипцией указанной последовательности нуклеиновой кислоты, которая может представлять собой гетерологичный целевой ген, кодирующий белок, или РНК. Промоторы могут быть конститутивными, индуцируемыми, репрессируемыми, тканеспецифическими, или характеризоваться любой комбинацией перечисленного. Промотор представляет собой контрольную область последовательности нуклеиновой кислоты, в которой осуществляется инициация и определяется уровень транскрипции остальной последовательности нуклеиновой кислоты. Промотор может также содержать генетические элементы, в которых может происходить связывание регуляторных белков и молекул, таких как РНК-полимераза, и других транскрипционных факторов. Согласно некоторым вариантам реализации аспектов настоящего документа промотор может управлять экспрессией транскрипционного фактора, который регулирует экспрессию собственно промотора, или транскрипционного фактора другого промотора, используемого в другом модульном компоненте синтетических биологических контуров, описанных в настоящем документе. В последовательности промотора присутствует сайт инициации транскрипции, а также связывающие белки домены, отвечающие за связывание РНК-полимеразы. Эукариотические промоторы часто, однако не всегда содержат «ТАТА»-боксы и «САТ»-боксы. Для управления экспрессией трансгенов в зкДНК-векторах, описанных в настоящем документе могут применяться различные промоторы, в том числе индуцируемые промоторы.
[0084] Термин «энхансер» в настоящем документе относится к цис-действующей регуляторной последовательности (например, 50-1500 пар оснований), которая связывает один или более белков (например, белков-активаторов или транскрипционного фактора) для повышения транскрипционной активации последовательности нуклеиновой кислоты. Энхансеры могут располагаться на расстоянии до 1000000 пар оснований выше сайта начала гена или ниже сайта начала гена, который они регулируют. Энхансер может располагаться в интронной области или в экзонной области не связанного с ним гена.
[0085] Можно сказать, что промотор управляет экспрессией или управляет транскрипцией последовательности нуклеиновой кислоты, которую он регулирует. Выражения «функционально связанный», «функционально расположенный», «под контролем» и «под транскрипционным контролем» показывают, что промотор находится в корректном функциональном положении и/или ориентации относительно последовательности нуклеиновой кислоты, которую он регулирует, для контроля инициации транскрипции и/или экспрессии указанной последовательности. «Инвертированный промотор» в настоящем документе относится к промотору, последовательность нуклеиновой кислоты которого имеет обратную ориентацию, таким образом, что кодирующая цепь становится некодирующей, и наоборот. Последовательности инвертированных промоторов могут применяться согласно различным вариантам реализации для регуляции состояния переключателя. Кроме того, согласно различным вариантам реализации промотор может применяться в сочетании с энхансером.
[0086] Промотор может представлять собой естественным образом ассоциированный с геном или последовательностью промотор, который может быть получен путем выделения некодирующих 5'-последовательностей, расположенных выше кодирующего сегмента и/или экзона определенного гена или последовательности. Такой промотор может называться «эндогенным». Аналогичным образом, согласно некоторым вариантам реализации энхансер может представлять собой естественным образом ассоциированный с последовательностью нуклеиновой кислоты энхансер, расположенный в направлении либо 3', либо 5' относительно указанной последовательности.
[0087] Согласно некоторым вариантам реализации кодирующий сегмент нуклеиновой кислоты помещен под контроль «рекомбинантного промотора» или «гетерологичного промотора», где оба термина относятся к промотору, который обычно не ассоциирован с кодирующей последовательностью нуклеиновой кислоты, с которой он функционально связан, в естественных условиях среды. Рекомбинантный или гетерологичный энхансер относится к энхансеру, обычно не ассоциированному с определенной последовательностью нуклеиновой кислоты в естественных условиях среды. Такие промоторы или энхансеры могут включать промоторы или энхансеры других генов; промоторы или энхансеры, выделенные из любой другой прокариотической, вирусной или эукариотической клетки; и синтетические промоторы или энхансеры, не «встречающиеся в природе» т.е. содержащие разные элементы разных транскрипционных регуляторных областей, и/или мутации, которые изменяют экспрессию, введенные с применением способов генетического конструирования, известных в данной области техники. Наряду с получением последовательностей нуклеиновых кислот промоторов и энхансером синтетическим путем, последовательности промоторов могут быть получены с использованием рекомбинантного клонирования и/или технологии амплификации нуклеиновых кислот, в том числе ПЦР, применительно к синтетическим биологическим контурам и модулям согласно описанию в настоящем документе (см., например, патент США №4683202, патент США №5928906, каждый из которых включен в настоящий документ посредством ссылки). Кроме того, предусмотрена также возможность применения контрольных последовательностей, которые управляют транскрипцией и/или экспрессией последовательностей в неядерных органеллах, таких как митохондрии, хлоропласты и т.п.
[0088] Согласно описанию в настоящем документе «индуцируемый промотор» представляет собой промотор, который характеризуется инициацией или усилением транскрипционной активности в присутствии, при влиянии или при контакте с индуктором, или индуцирующим агентом. «Индуктор» или «индуцирующий агент» согласно определению в настоящем документе может быть эндогенным или экзогенным в норме соединением или белком, которое или который вводят таким образом, чтобы обеспечивать его активность в смысле индуцирования транскрипционной активности индуцируемого промотора. Согласно некоторым вариантам реализации указанный индуктор или индуцирующий агент, т.е. химическое вещество, соединение или белок, может сам быть получен в результате транскрипции или экспрессии последовательности нуклеиновой кислоты (т.е. индуктор может представлять собой белок-индуктор, экспрессируемый другим компонентом или модулем), который сам может находиться под контролем индуцируемого промотора. Согласно некоторым вариантам реализации индукция индуцируемого промотора происходит в отсутствие определенных агентов, таких как репрессор. Примеры индуцируемых промоторов включают, не ограничиваясь перечисленными, тетрациклин, металлотионин, экдизон, вирусы млекопитающих (например, поздний аденовирусный промотор; и длинный концевой повтор вируса опухоли молочной железы мышей (MMTV-LTR)) и другие реагирующие на стероиды промоторы, реагирующие на рапамицин промоторы и т.п.
[0089] Термин «субъект» в настоящем документе относится к человеку или животному, лечение которого, в том числе профилактическое лечение, проводят с применением зкДНК-вектора в соответствии с настоящим изобретением. Обычно указанное животное представляет собой позвоночное животное, такое как, не ограничиваясь перечисленными, примат, грызун, домашнее животное или промысловое животное. Приматы включают, не ограничиваясь перечисленными, шимпанзе, яванского макака, коат и макаков, например, макака-резус. Грызуны включают мышей, крыс, сурков, хорьков, кроликов и хомяков. Домашние и промысловые животные включают, не ограничиваясь перечисленными, коров, лошадей, свиней, оленей, бизонов, буйволов, кошачьих, например, домашнюю кошку, виды собачьих, например, собаку, лису, волка, виды птиц, например, курицу, эму, страуса, и рыб, таких как форель, сом и лосось. Согласно определенным вариантам реализации аспектов настоящего изобретения указанный субъект представляет собой млекопитающее, например, примата или человека. Субъект может быть мужского или женского пола. Кроме того, субъект может представлять собой младенца или ребенка. Согласно некоторым вариантам реализации указанный субъект может представлять собой новорожденного или нерожденного субъекта, например, субъекта in utero. Предпочтительно, указанный субъект представляет собой млекопитающее. Указанное млекопитающее может представлять собой, не ограничиваясь приведенными примерами, человека, не являющегося человеком примата, мышь, крысу, собаку, кошку, лошадь или корову. Млекопитающие, не являющиеся человеком, могут быть успешно использованы в качестве субъектов для моделей заболеваний и нарушений на животных. Кроме того, способы и композиции, описанные в настоящем документе, могут применяться для одомашненных животных и/или животных-компаньонов. Субъект-человек может быть любого возраста, пола, принадлежать к любой расе или этнической группе, например, может быть европеоидом (белым), азиатом, африканцем, черным, афроамериканцем, афроевропейцем, испаноамериканцем, представителем ближневосточного этноса и т.п. Согласно некоторым вариантам реализации указанный субъект может представлять собой пациента или другого субъекта в клинических условиях. Согласно некоторым вариантам реализации указанный субъект уже проходит лечение.
[0090] В настоящем документе термин «антитело» применяют в самом широком смысле, и он охватывает различные антительные структуры, в том числе, но не ограничиваясь перечисленными, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), и фрагменты антител при условии, что они проявляют требуемую антигенсвязывающую активность. «Фрагмент антитела» относится к молекуле, не являющейся интактным антителом, которая содержит часть интактного антитела, связывающую тот же антиген, с которым связывается указанное интактное антитело. Согласно одному варианту реализации антитело или фрагмент антитела содержит цепь иммуноглобулина или ее фрагмент, и по меньшей мере одну последовательность вариабельного домена иммуноглобулина. Примеры антител или фрагментов антител включают, не ограничиваясь перечисленными, Fv-, scFv-, Fab-фрагмент, Fab'-, F(ab')2, Fab'-SH, однодоменное антитело (dAb), тяжелую цепь, легкую цепь, тяжелую и легкую цепь, полное антитело (например, включающее все из перечисленного: Fc, Fab, тяжелые цепи, легкие цепи, вариабельные области и т.п.), биспецифическое антитело, диатело, линейное антитело, одноцепочечное антитело, интратело, моноклональное антитело, химерное антитело, мультиспецифическое антитело или мультимерное антитело. Антитело или фрагмент антитела может относиться к любому классу, в том числе, но не ограничиваясь перечисленными, IgA, IgD, IgE, IgG и IgM, и к любому их подклассу, в том числе, но не ограничиваясь перечисленными, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Кроме того, антитело может происходить из организма любого млекопитающего, например, приматов, человека, крысы, мыши, лошади, козы и т.п. Согласно одному варианту реализации указанное антитело является антителом человека или гуманизированным антителом. Согласно некоторым вариантам реализации указанное антитело представляет собой модифицированное антитело. Согласно некоторым вариантам реализации компоненты антитела могут быть экспрессированы по отдельности, таким образом, что указанное антитело самособирается после экспрессии белковых компонентов. Согласно некоторым вариантам реализации указанное антитело обладает требуемой функцией, такой как взаимодействие и ингибирование требуемого белка для лечения заболевания или симптома заболевания. Согласно одному варианту реализации указанное антитело или фрагмент антитела содержит каркасную область или Fc-область.
[0091] В настоящем документе термин «антигенсвязывающий домен» молекулы антитела относится к части молекулы антитела, например, молекулы иммуноглобулина (Ig), который принимает участие в связывании антигена. Согласно вариантам реализации сайт связывания антигена образован остатками аминокислот вариабельных (V) областей тяжелых (Н) и легких (L) цепей. Три сильно отличающихся отрезка в составе вариабельных областей тяжелых и легких цепей, называемые гипервариабельными областями, расположены между более консервативными фланкирующими отрезками, называемыми «каркасными областями» (FR). FR представляют собой последовательности аминокислот, которые в естественных условиях обнаруживаются в иммуноглобулинах между гипервариабельными областями и рядом с ними. Согласно вариантам реализации в молекуле антитела три гипервариабельных области легкой цепи и три гипервариабельных области тяжелой цепи расположены друг относительно друга в трехмерном пространстве с образованием антигенсвязывающей поверхности, которая комплементарна трехмерной поверхности связанного антигена. Три гипервариабельных области из каждой из тяжелых и легких цепей называются «определяющими комплементарность областями» или «CDR». Каркасная область и CDR были определены и описаны, например, в источниках: Kabat, Е. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fife изд., U.S. Department of Health and Human Services, NIH Publication No. 91-3242, и Chothia, C. et al. (1987) J. Mol. Biol. 196:901-917. Каждая вариабельная цепь (например, вариабельная тяжелая цепь и вариабельная легкая цепь), как правило, составлена из трех CDR и четырех FR, последовательности аминокислот которых расположены, в направлении от аминоконца к карбоксильному концу, в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4.
[0092] В настоящем документе термин «полноразмерное антитело» относится к молекуле иммуноглобулина (Ig) (например, IgG-антитела), например, встречающейся в природе, и образованной фрагментами генов иммуноглобулинов в ходе нормальных рекомбинаторных процессов.
[0093] В настоящем документе термин «функциональный фрагмент антитела» относится к фрагменту, который связывается с тем же антигеном, который распознает интактное (например, полноразмерное) антитело. Термины «фрагмент антитела» или «функциональный фрагмент» также включают выделенные фрагменты, состоящие из вариабельных областей, такие как «Fv»-фрагменты, состоящие из вариабельных областей тяжелых и легких цепей, или рекомбинантные одноцепочечные полипептидные молекулы, в которых вариабельные области тяжелых и легких цепей соединены пептидным линкером («scFv-белки»). Согласно некоторым вариантам реализации фрагмент антитела не содержит частей антител без антигенсвязывающей активности, таких как Fc-фрагменты или одиночные остатки аминокислот.
[0094] В настоящем документе «последовательность вариабельного домена иммуноглобулина» относится к последовательности аминокислот, которая может образовывать структуру вариабельного домена иммуноглобулина. Например, указанная последовательность может включать всю последовательность аминокислот встречающегося в природе вариабельного домена или ее часть. Например, указанная последовательность может включать или не включать одну, две или более N- или С-концевых аминокислот, или может включать другие изменения, которые совместимы с образованием белковой структуры
[0095] В настоящем документе термин «содержащий» или «содержит» используют в отношении композиций, способов и их соответствующего компонента (или компонентов), имеющего или имеющих существенное значение для указанного способа или указанной композиции, но может включать и не указанные элементы, имеющие существенное значение или нет.
[0096] В настоящем документе термин «состоящий по существу из» относится к элементам, необходимым для определенного варианта реализации. Указанный термин допускает присутствие элементов, которые не оказывают существенного влияния на основную и новую или функциональную характеристику или характеристики указанного варианта реализации.
[0097] Термин «состоящий из» относится к композициям, способам и их соответствующим компонентам согласно описанию в настоящем документе, исключающим какой-либо элемент, не упоминаемый в описании указанного варианта реализации.
[0098] В настоящем описании и прилагаемой формуле изобретения формы единственного числа, в том числе сопровождаемые определением «указанный», включают соответствующие формы множественного числа, если иное явным образом не следует из контекста. Соответственно например, упоминание «указанного способа» включает один или более способов и/или этапов описанного в настоящем документе типа, и/или способов и/или этапов, которые будут очевидными для специалистов в данной области техники после прочтения настоящего описания, и т.д. Аналогичным образом, предполагается, что термин «или» включает «и», если из контекста явным образом не следует иное. Хотя при практической реализации или тестировании настоящего изобретения могут применяться способы и материалы, аналогичные или эквивалентные описанным в настоящем документе, подходящие способы и материалы описаны ниже. Выражение «например» используют в настоящем документе для описания неограничивающего примера.
[0099] За исключением рабочих примеров или иных указанных случаев все числа, отражающие количества ингредиентов или условия реакции согласно настоящему изобретению, во всех случаях должны быть истолкованы как модифицированные термином «приблизительно». Термин «приблизительно» применительно к процентам может означать ±1%. Настоящее изобретение дополнительно более подробно объяснено в приведенных ниже примерах, однако объем настоящего изобретения ими не ограничен.
[00100] Следует понимать, что настоящее изобретение не ограничено конкретной методологией, протоколами и реагентами, и т.п., описанными в настоящем документе, и, таким образом, могут варьировать. Терминология, используемая в настоящем документе, предназначена только для описания конкретных вариантов реализации, и не предназначена для ограничения объема настоящего изобретения, который определен исключительно формулой изобретения.
[00101] Без ограничений, липидная наночастица согласно настоящему изобретению включает липидный состав, который может применяться для доставки бескапсидного невирусного ДНК-вектора в представляющий интерес целевой сайт (например, в клетку, ткань, орган и т.п.). Обычно указанная липидная наночастица содержит бескапсидный невирусный ДНК-вектор и ионизируемый липид или его соль.
[00102] Соответственно, согласно некоторым аспектам настоящего изобретения предложена липидная наночастица, содержащая зкДНК и ионизируемый липид. Например, предложен состав на основе липидных наночастиц, который получают и нагружают зкДНК, полученной с помощью способа из примера 1 или иным образом согласно описанию в настоящем документе. Это может осуществляться путем интенсивного смешивания этанольных растворов липидов с водным раствором зкДНК при низких значениях рН, что обеспечивает протонирование ионизируемого липида и благоприятные энергетические показатели для образования связи зкДНК с липидом и нуклеацию частиц. Указанные частицы могут быть дополнительно стабилизированы разведением водой и удалением органического растворителя. Указанные частицы могут быть сконцентрированы до требуемого уровня.
[00103] Обычно получают липидные частицы с соотношением общего количества липидов и зкДНК (по массе или весу), составляющим от приблизительно 10:1 до 30:1. Согласно некоторым вариантам реализации соотношение липидов и зкДНК (массовое соотношение; соотношение по массе) может находиться в диапазоне от приблизительно 1:1 до приблизительно 25:1, от приблизительно 10:1 до приблизительно 14:1, от приблизительно 3:1 до приблизительно 15:1, от приблизительно 4:1 до приблизительно 10:1, от приблизительно 5:1 до приблизительно 9:1; или от приблизительно 6:1 до приблизительно 9:1. Количества липидов и зкДНК могут быть скорректированы для обеспечения требуемого соотношения N/P, например, соотношения N/P, равного 3, 4, 5, 6, 7, 8, 9, 10 или более. Обычно общее содержание липидов в составе на основе липидных частиц может варьировать от приблизительно 5 мг/мл до приблизительно 30 мг/мл.
[00104] Ионизируемый липид используют, как правило, для конденсации нагруженной нуклеиновой кислоты, например, зкДНК при низких значениях рН, управления связывания с мембраной и фузогенности. Обычно ионизируемые липиды представляют собой липиды, содержащие по меньшей мере одну аминогруппу, которая положительно заряжена или становится протонированной в кислотных условиях, например, при значении рН 6,5 или ниже. Ионизируемые липиды в настоящем документе также называют катионными липидами.
[00105] Примеры ионизируемых липидов описаны в патентных РСТ-публикациях и публикациях США, перечисленных в таблице 1, содержание которых включено в настоящий документ полностью посредством ссылки.

[00106] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (X),
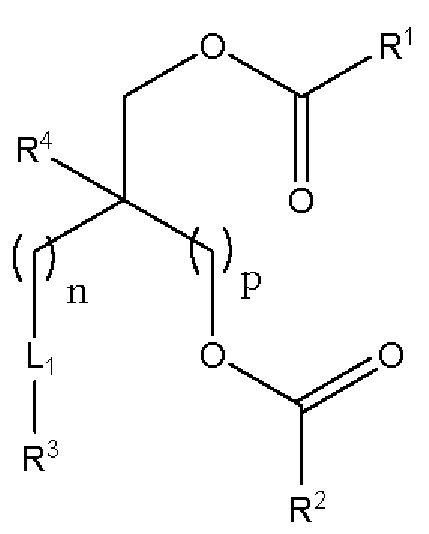
[00107] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),
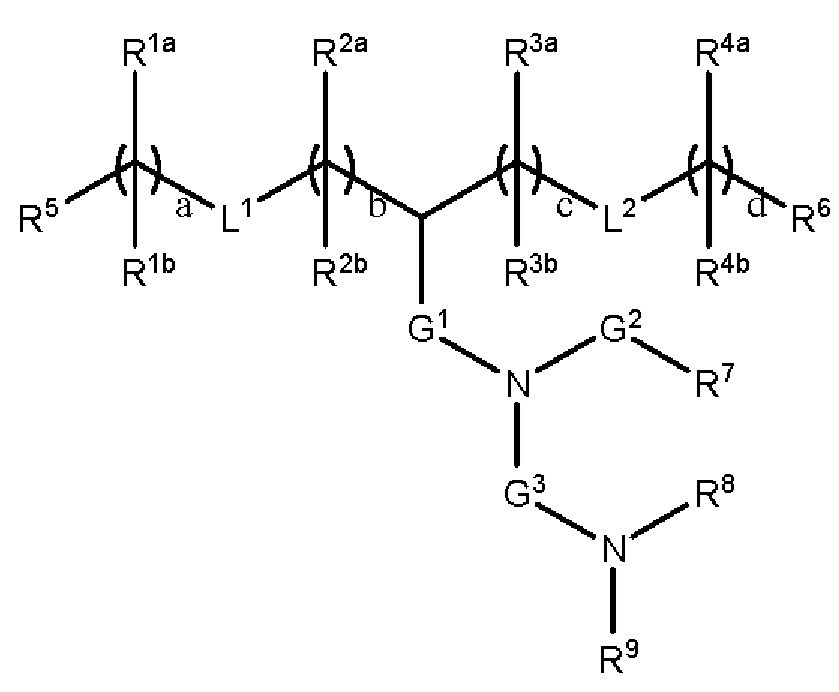
[00108] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),

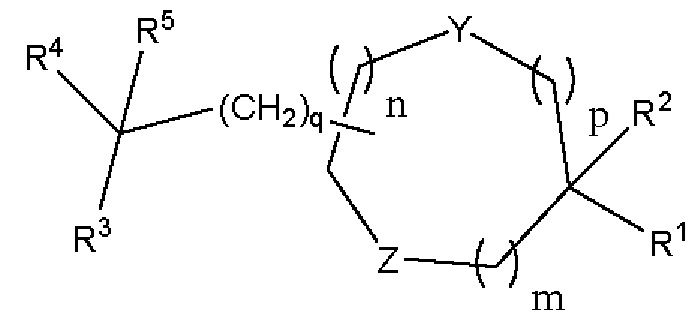

[00109] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),


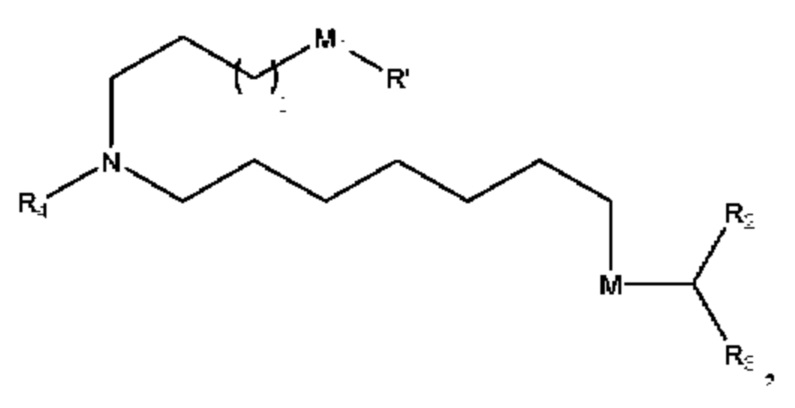
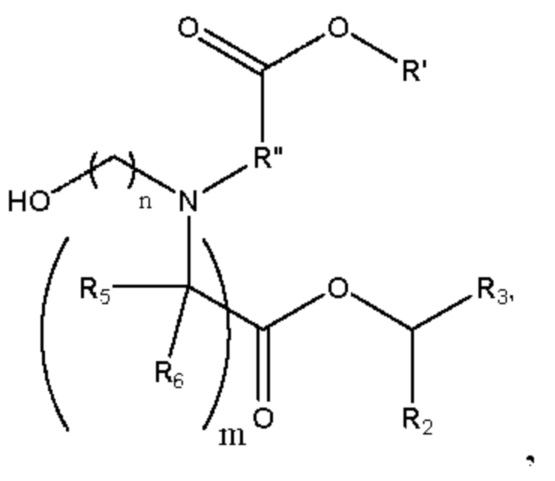
[00110] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы 1-е,

[00111] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы А,
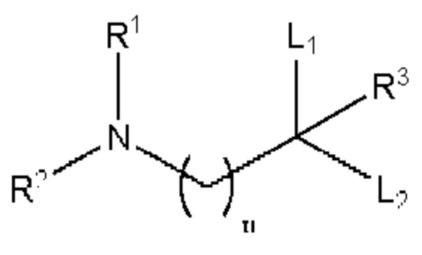
[00112] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),

[00113] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),

[00114] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (II),




[00115] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),
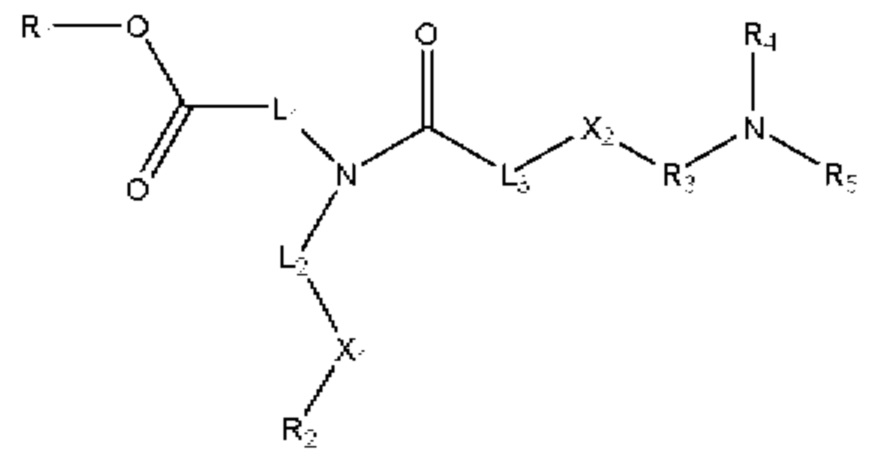
[00116] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I) или формулы (II), каждое из которых имеет структуру:

[00117] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы А,

[00118] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы А,

[00119] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы А,

[00120] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы А,
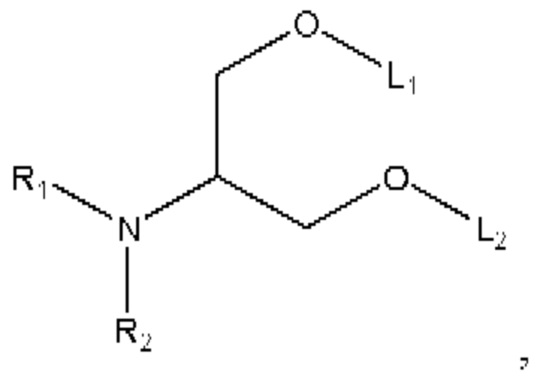
[00121] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы А,

[00122] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы А,

[00123] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы А,
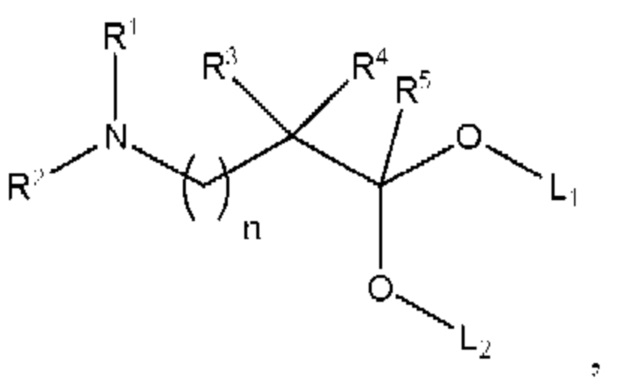
[00124] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы А,

[00125] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы А,

[00126] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),
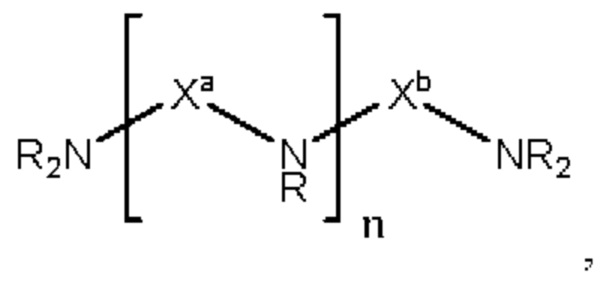
[00127] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),



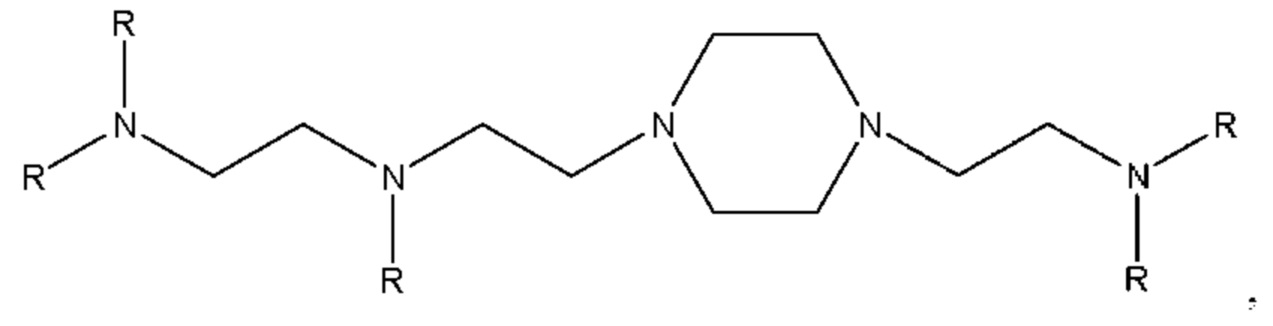
[00128] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I) или формулы (II), каждое из которых имеет структуру:
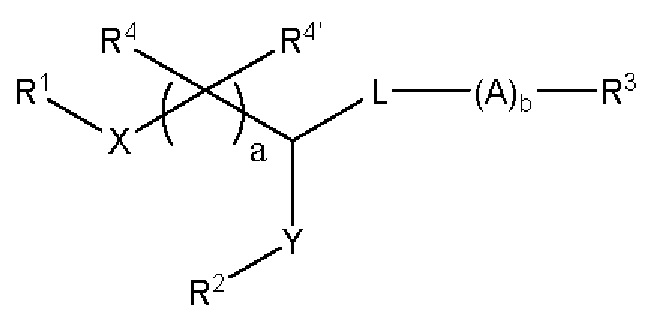
[00129] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I), формулы (II) или формулы (III), каждое из которых имеет структуру:

[00130] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),
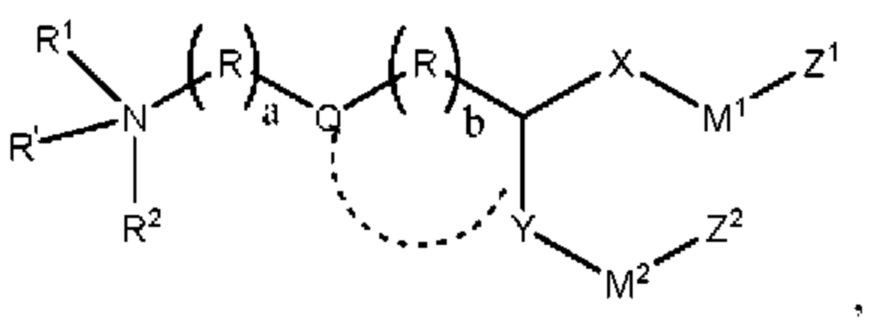
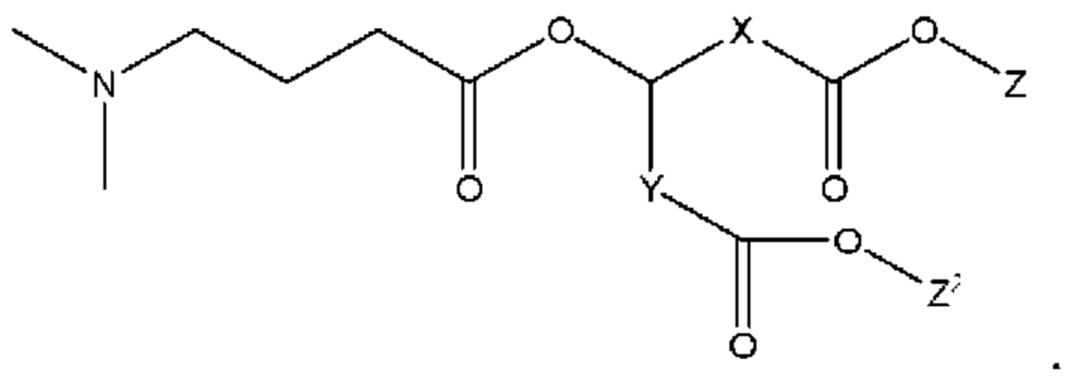
[00131] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы(I),



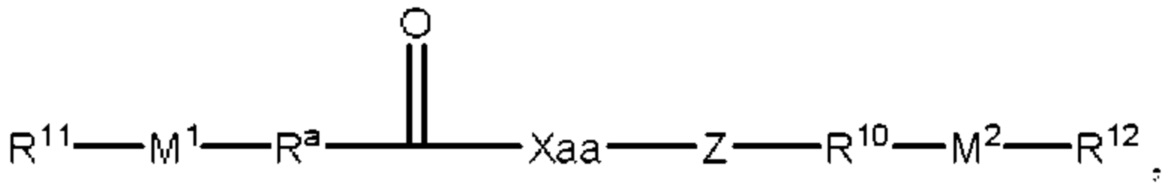


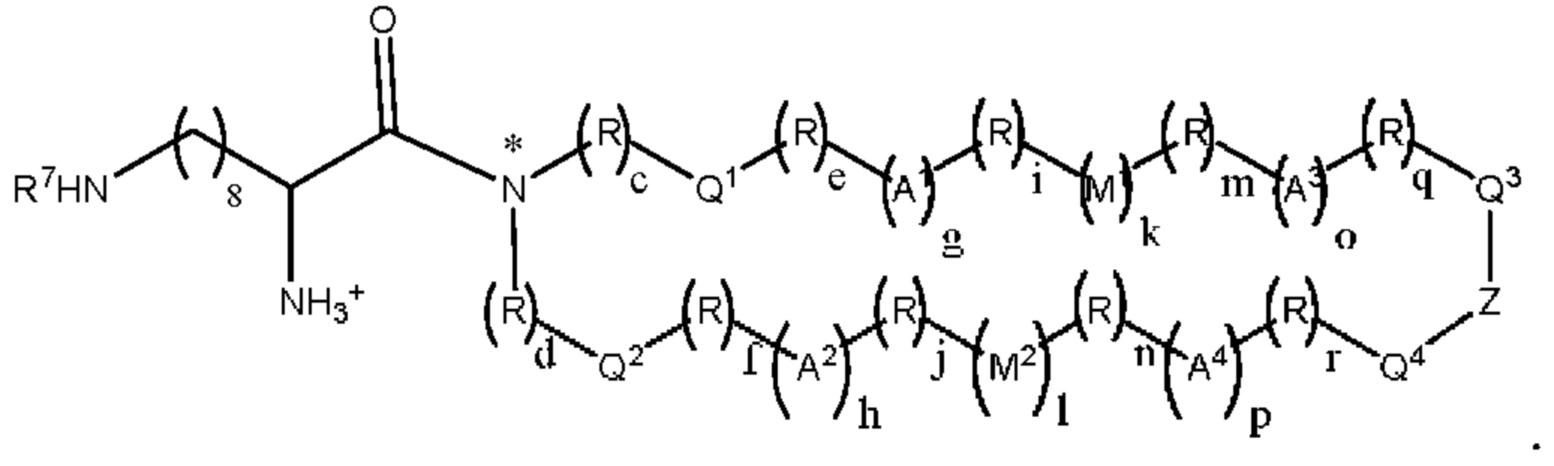

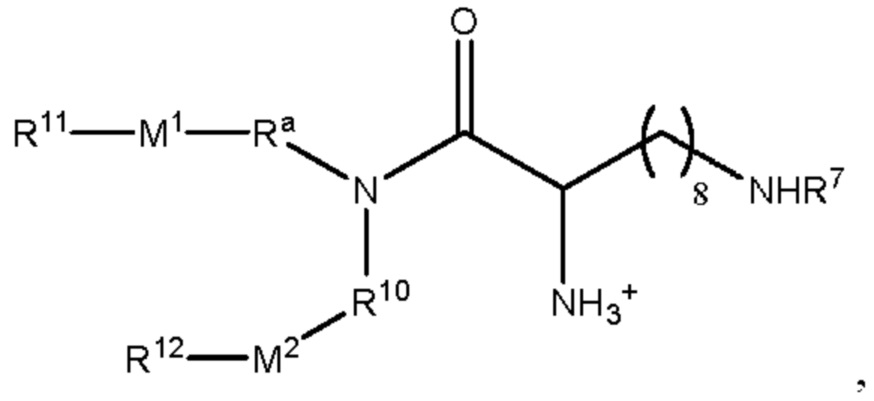
[00132] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы

[00133] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы ((I),

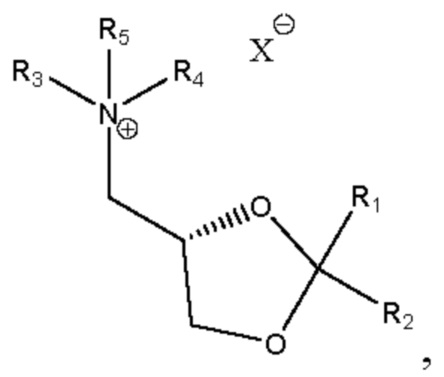
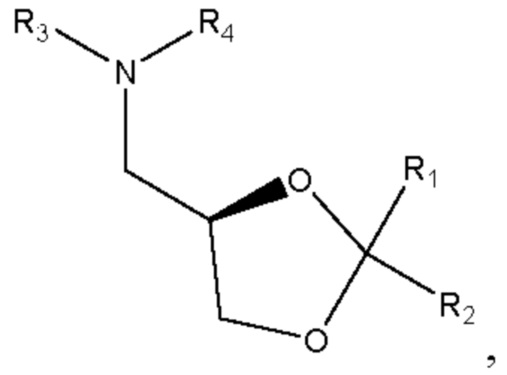

[00134] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы А,

[00135] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),

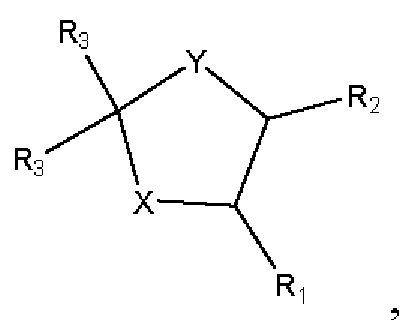
[00136] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (XIV),
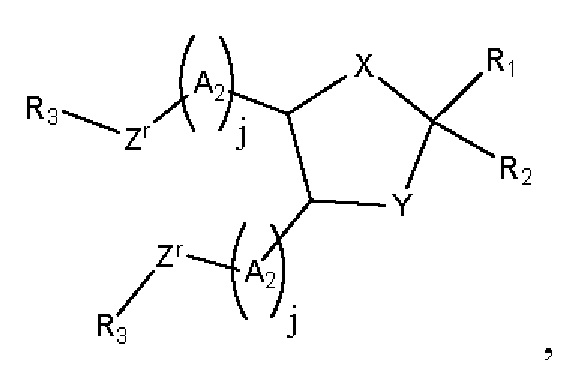

[00137] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы

[00138] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),
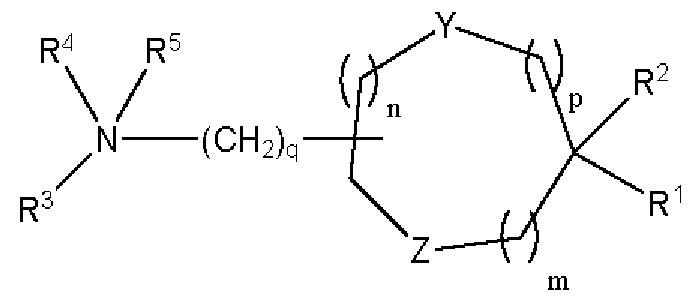
[00139] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),

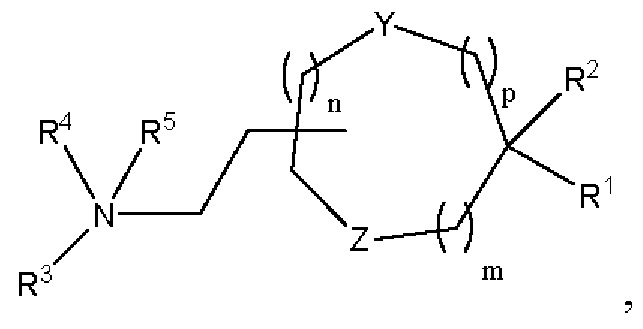

[00140] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),
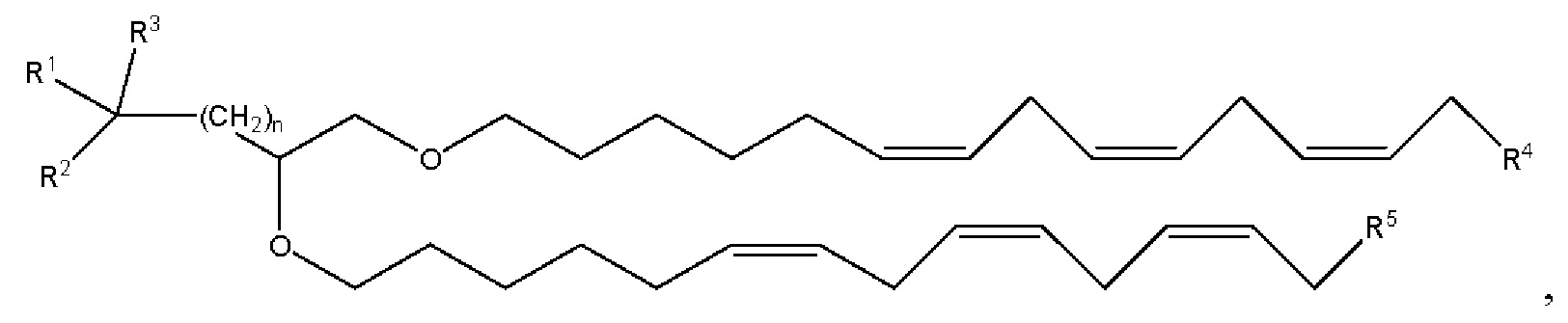
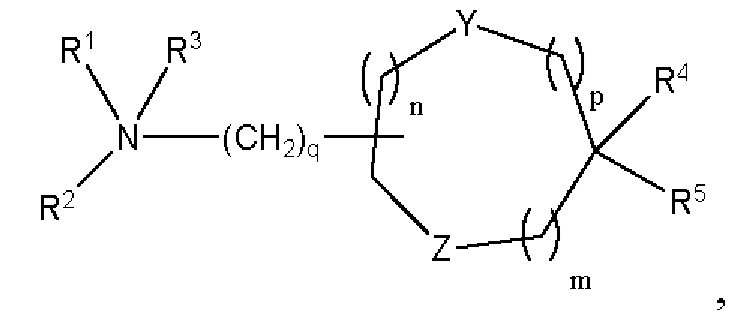




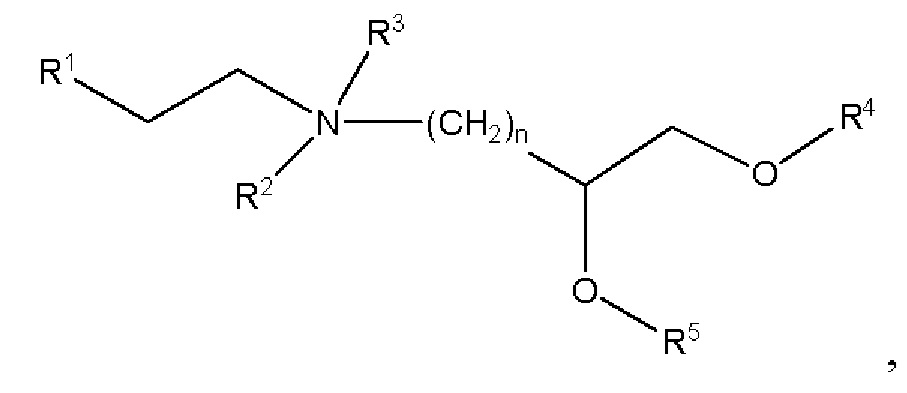


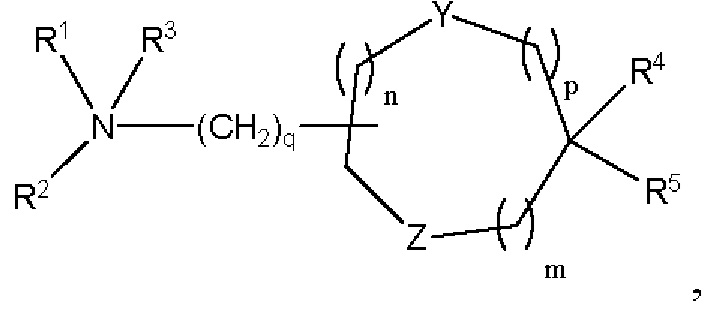


[00141] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),



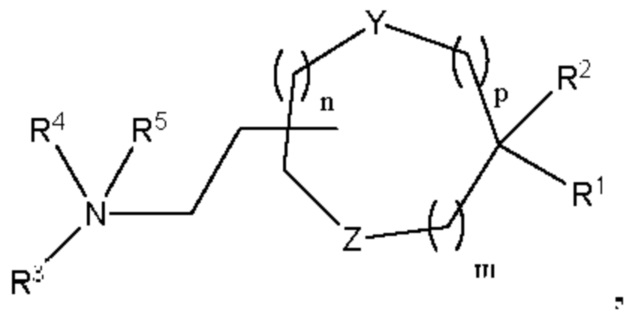


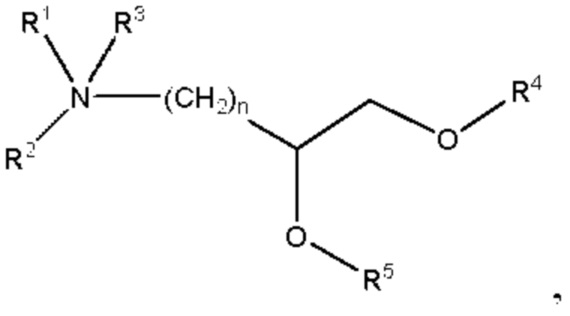

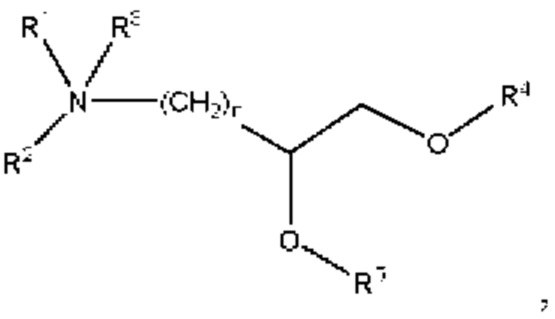




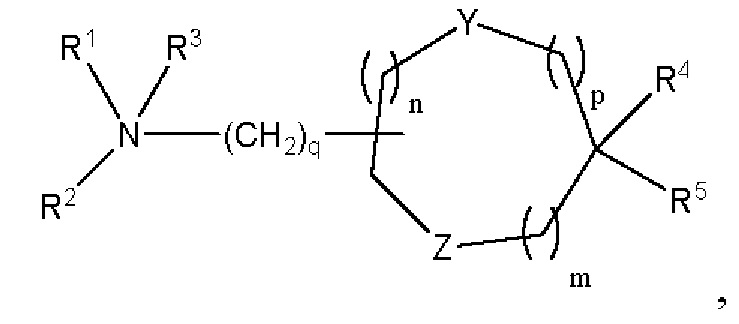


[00142] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),

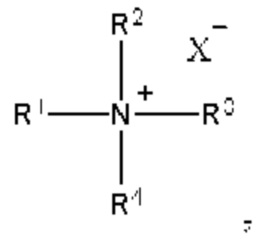
[00143] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),

[00144] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I), X-A-Y-Z согласно определению в US2015/0064242, содержание которого включено в настоящий документ полностью посредством ссылки.
[00145] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (XVLX),



[00146] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),


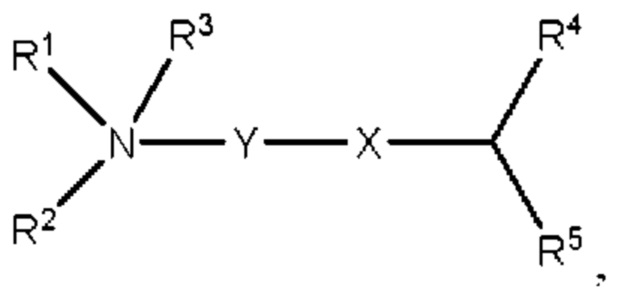
[00147] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),

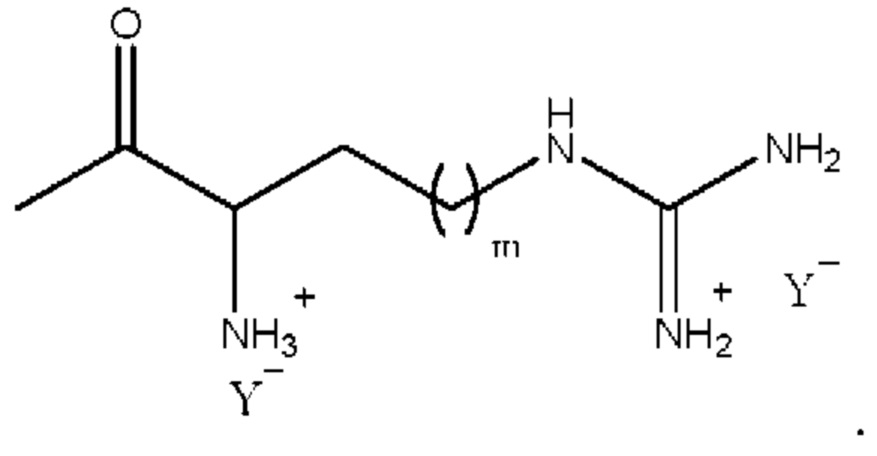
[00148] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (1)-(Х), каждое из которых имеет структуру:

[00149] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),
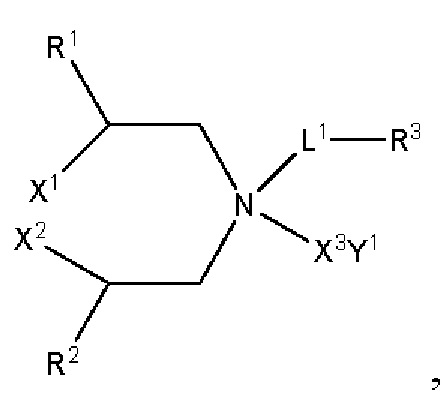
[00150] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (V),

[00151] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),

[00152] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение формулы (I),

[00153] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой МСЗ (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ил-4-(диметиламино)бутаноат (DLin-MC3-DMA или МС3), описанный в примере 9.
[00154] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой липид АТХ-002, описанный в примере 10.
[00155] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой (13Z,16Z)-N,N-диметил-3-нонилдокоза-13,16-диен-1-амин (соединение 32), описанный в примере 11.
[00156] Согласно некоторым вариантам реализации указанный ионизируемый липид представляет собой соединение 6 или соединение 22, описанные в примере 12.
[00157] Без ограничений, ионизируемый липид может составлять 20-90% (мол.) от общего количества липидов, присутствующих в указанной липидной наночастице. Например, молярное содержание ионизируемого липида может составлять 20-70% (мол.), 30-60% (мол.) или 40-50% (мол.) от общего количества липидов, присутствующих в указанной липидной наночастице. Согласно некоторым вариантам реализации ионизируемый липид составляет от приблизительно 50 мол.% до приблизительно 90 мол.% от общего количества липидов, присутствующих в указанной липидной наночастице.
[00158] Согласно некоторым аспектам указанная липидная наночастица может дополнительно содержать некатионный липид. Неионогенные липиды включают амфипатические липиды, нейтральные липиды и анионные липиды. Соответственно, некатионный липид может представлять собой нейтральный незаряженные, цвиттерионный или анионный липид. Некатионные липиды, как правило, применяют для повышения фузогенности.
[00159] Примеры некатионных липидов включают, не ограничиваясь перечисленными, дистеароил-sn-глицеро-фосфоэтаноламин, дистеароилфосфатидилхолин (DSPC), диолеилфосфатидилхолин (DOPC), дипальмитоилфосфатидилхолин (DPPC), диолеилфосфатидилглицерин (DOPG), дипальмитоилфосфатидилглицерин (DPPG), диолеилфосфатидилэтаноламин (DOPE), пальмитоилолеоилфосфатидилхолин (РОРС), пальмитоилолеоилфосфатидилэтаноламин (POPE), диолеилфосфатидилэтаноламин 4-(N-малеимидометил)-циклогексан-1-карбоксилат (DOPE-mal), дипальмитоилфосфатидил этаноламин (DPPE), димиристоилфосфоэтаноламин (DMPE), дистеароилфосфатидил-этаноламин (DSPE), монометилфосфатидилэтаноламин (такой как 16-О-монометил-ФЭ), диметилфосфатидилэтаноламин (такой как 16-О-диметил ФЭ), 18-1-транс ФЭ, 1-стеароил-2-олеоилфосфатидилэтаноламин (SOPE), гидрогенизированный соевый фосфатидилхолин (HSPC), яичный фосфатидилхолин (ЕРС), диолеилфосфатидилсерин (DOPS), сфингомиелин (SM), димиристоилфосфатидилхолин (ТЭМРС), димиристоилфосфатидилглицерин (DMPG), дистеароилфосфатидилглицерин (DSPG), диерукоилфосфатидилхолин (ТЭЕРС), пальмитоилолеоилфосфатидилглицерин (POPG), диэлаидоилфосфатидилэтаноламин (DEPE), лецитин, фосфатидилэтаноламин, лизопецитин, лизофосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, сфингомиелин, яичный сфингомиелин (ESM), кефалин, кардиолипин, фосфатидную кислоту, цереброзиды; дицетилфосфат, лизофосфатидилхопин, дилинолеоилфосфатидилхолин; или их смеси. Следует понимать, что могут также применяться другие диацилфосфатидилхолиновые и диацилфосфатидилэтаноламиновые фосфолипиды. Ацильные группы в указанных липидах предпочтительно представлены ацильными группами, происходящими из жирных кислот с углеродными цепями С10-С24, например, лауроилом; миристоилом, папьмитоилом, стеароиломили олеоилом.
[00160] Другие примеры некатионных липидов, подходящих для применения в липидных наночастицах включают не содержащие фосфора липиды, такие как, например, стеариламин, додециламин, гексадециламин, ацетилпальмитат, глицеролрицинолеат, гексадецилстеарат, изопропилмиристат, амфотерные акриловые полимеры; триэтаноламин-лаурилсульфат, алкил-арилсульфатированные полиэтилоксилированные амиды жирных кислот, диоктадецилдиметиламмония бромид, керамид, сфингомнелин и т.п.
[00161] Согласно некоторым вариантам реализации указанный некатионный липид представляет собой фосфолипид. Согласно некоторым вариантам реализации указанный некатионный липид выбран из DSPC, DPPC, DMPC, DOPC, РОРС, DOPE и SM. Согласно некоторым предпочтительным вариантам реализации указанный некатионный липид представляет собой DPSC.
[00162] Примеры некатионных липидов описаны в PCT-публикации WO2017/099223 и патентной публикации США US 2018/0028664, содержание которых включено в настоящий документ полностью посредством ссыпки.
[00163] Согласно некоторым примерам указанный некатионный липид представляет собой олеиновую кислоту или соединение формулы (I),



[00164] Указанный некатионный липид может составлять 0-30% (мол.) от общего количества липидов, присутствующих в указанной липидной наночастице. Например, содержание указанного некатионного липид а составляет 5-20% (мол.) или 10-15% (мол.) от общего количества липидов, присутствующих в указанной липидной наночастице. Согласно различным вариантам реализации молярное соотношение ионизируемого липида и нейтрального липида варьирует от приблизительно 2:1 до приблизительно 8:1.
[00165] Согласно некоторым вариантам реализации указанные липидные наночастицы не содержат каких-либо фосфолипидов.
[00166] Согласно некоторым аспектам указанная липидная наночастица может дополнительно содержать компонент, такой как стерол, для обеспечения целостности мембраны.
[00167] Одним из примеров стерола, который может применяться в липидной наночастице, является холестерин и его производные. Неограничивающие примеры производных холестерина включают полярные аналоги, такие как 5α-холестанол, 5β-копростанол, холестерил-(2'-гидрокси)-этилэфир, холестерил-(4'-гидрокси)-бутилэфир и 6-кетохолестанол; неполярные аналоги, такие как 5α-холестан, холестенон, 5α-холестанон, 5β-холестанон и холестерилдеканоат; и их смеси. Согласно некоторым вариантам реализации производное холестерина представляет собой полярный аналог, такой как холестерил-(4'-гидрокси)-бутилэфир.
[00168] Примеры производных холестерина описаны в в РСТ-пубпикации WO2009/127060 и патентной публикации США US2010/0130:533, содержание которых включено в настоящий документ полностью посредством ссыпки
[00169] Компонент, обеспечивающий целостность мембраны, такой как стерол, может составлять 0-50% (мол.) от общего количества липидов, присутствующих в указанной липидной наночастице. Согласно некоторым вариантам реализации такой компонент составляет 20-50% (мол.) 30-40% (мол.) от общего содержания липидов в липидной наночастице.
[00170] Согласно некоторым аспектам указанная липидная наночастица может дополнительно содержать полиэтиленгликоль (ПЭГ) или конъюгированную молекулу липид а Обычно их используют для ингибирования агрегации липидных наночастиц и/или обеспечения стерической стабилизации. Примеры конъюгированных липидов включают, не ограничиваясь перечисленными, конъюгаты ПЭГ с липидами, конъюгаты липидов с полиоксазолинами (POZ), конъюгаты полиамидов с липидами (такие как конъюгаты АТТА с липидами), конъюгаты катионных полимеров с липидами (CPL); и смеси перечисленного. Согласно некоторым вариантам реализации конъюгированная молекула липида представляет собой конъюгат ПЭГ с липидом, например, (метоксиполиэтиленгликоль)-конъюгированный липид.
[00171] Примеры конъюгатов ПЭГ с липидами включают, не ограничиваясь перечисленными, ПЭГ-диацилглицерин (DAG) (такой как 1-(монометокси-полиэтиленгликоль)-2,3-димиристоилглицерол (ПЭГ-ДМГ)), ПЭГ-диалкилоксипропил (DAA), ПЭГ-фосфолипид, ПЭГ-керамид (Cer), пегилированный фосфатидилэтаноламин (ПЭГ-ФЭ), ПЭГ-сукцинатдиацилглицерин (PEGS-DAG) (такой как 4-O-(2',3'-ди(тетрадеканоилокси)пропил-1-O-(w-метокси(полиэтокси)этил) бутандиоат (ПЭГ-S-ДМГ)), ПЭГ-диалкоксипропилкарбам, натриевую соль N-(карбонил-метоксиполиэтиленгликоля 2000)-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламина, или их смесь. Дополнительные примеры конъюгатов ПЭГ с липидами описаны, например, в US5,885,613, US6,287,591, US2003/0077829, US2003/0077829, US2005/0175682, US2008/0020058, US2011/0117125, US2010/0130588, US2016/0376224, US2017/0119904 и US/099823, содержание которых включено в настоящий документ полностью посредством ссылки.
[00172] Согласно некоторым вариантам реализации ПЭГ-липид представляет собой соединение формулы (III),
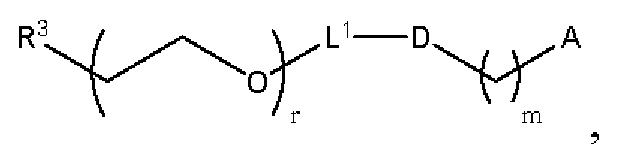


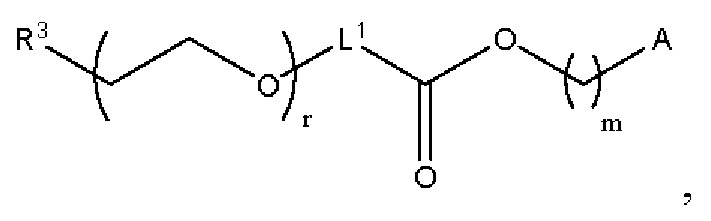


[00173] Согласно некоторым вариантам реализации ПЭГ-липид имеет формулу (II),

[00174] Конъюгат ПЭГ-DAA может представлять собой, например, ПЭГ-дилаурилоксипропил, ПЭГ-димиристилоксипропил, ПЭГ-дипальмитилоксипропил или ПЭГ-дистеарилоксипропил. Указанный ПЭГ-липид может представлять собой что-либо одно или более из ПЭГ-ДМГ, ПЭГ-дилаурилглицерола, ПЭГ-дипальмитоилглицерола, ПЭГ-дистерилглицерола, ПЭГ-дилаурилгликамида, ПЭГ-димиристигликамида, ПЭГ-дипальмитоилгликамида, ПЭГ-дистерилгликамида, ПЭГ-холестерина (1-[8'-(холест-5-ен-3[бета]-окси)карбоксамидо-3',6'-диоксаоктанил]карбамоил-[омега]-метил-поли(этиленгликоля), ПЭГ-DMB (3,4-Дитетрадекоксибензил-[омега]-метил-поли(этиленгликоль)эфира) и 1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоля)-2000]. Согласно некоторым примерам указанный ПЭГ-липид может быть выбран из группы, состоящей из ПЭГ-ДМГ, 1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоля)-2000],
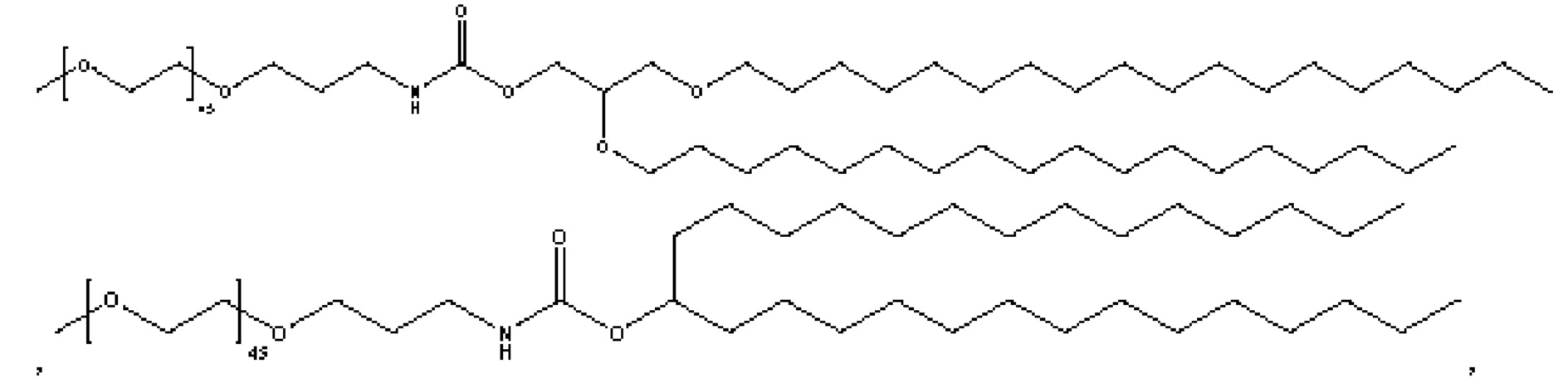
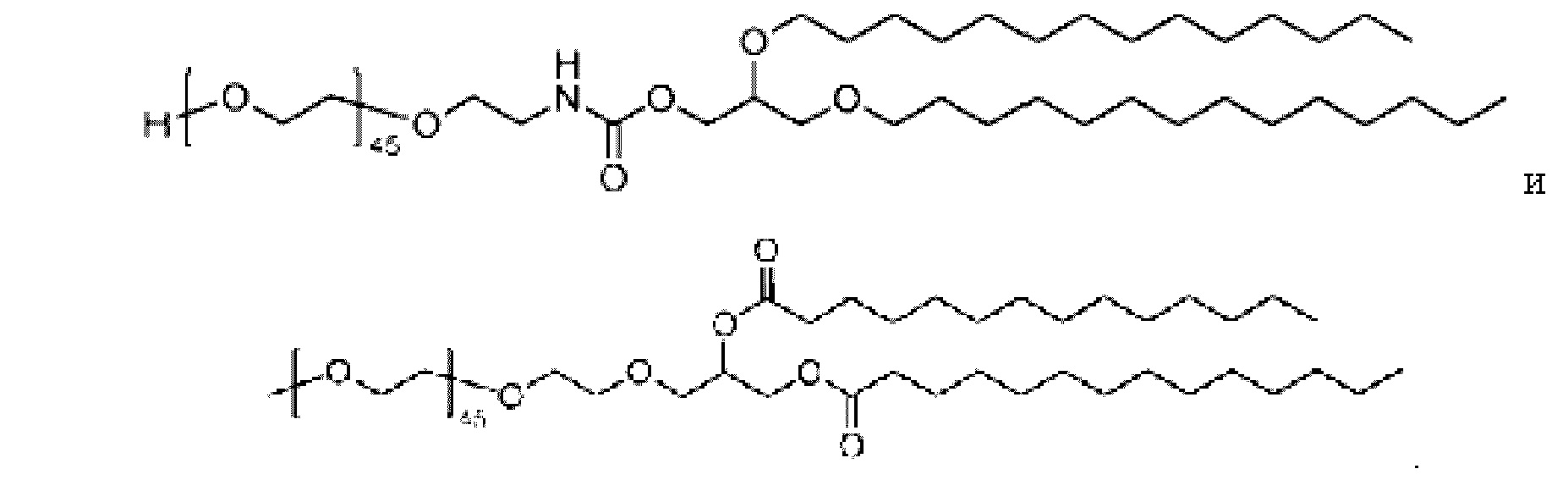
[00175] Липиды, конъюгированные с молекулой, не являющейся ПЭГ, могут также применяться вместо ПЭГ-липида. Например, конъюгаты полиоксазолина (POZ) с липидом, конъюгаты полиамида с липидом (такие как конъюгаты АТТА с липидами) и конъюгаты катионных полимеров с липидами (CPL) могут применяться вместо или наряду с ПЭГ-липидом.
[00176] Примеры конъюгированных липидов, т.е. ПЭГ-липиды, (POZ)-липидные конъюгаты, конъюгаты АТТА с липидами и катионных полимеров с липидами описаны в патентных РСТ-заявках и патентных заявках США, перечисленных в таблице 2, содержание которых включено в настоящий документ полностью посредством ссылки.

[00177] ПЭГ или конъюгированный липид может составлять 0-20% (мол.) от общего количества липидов, присутствующих в указанной липидной наночастице. Согласно некоторым вариантам реализации содержание ПЭГ или конъюгированного липида составляет 0,5-10% или 2-5% (мол.) от общего количества липидов, присутствующих в указанной липидной наночастице.
[00178] Молярные соотношения ионизируемого липида, некатионного липида, стерола и ПЭГ/конъюгированного липида могут варьировать по мере необходимости. Например, указанная липидная частица может содержать 30-70% ионизируемого липида от молярного количества или от общей массы композиции, 0-60% холестерина от молярного количества или от общей массы композиции, 0-30% некатионного липида от молярного количества или от общей массы композиции; и 1-10% конъюгированного липида от молярного количества или от общей массы композиции. Предпочтительно, указанная композиция содержит 30-40% ионизируемого липида от молярного количества или от общей массы композиции, 40-50% холестерина от молярного количества или от общей массы композиции; и 10-20% некатионного липида от молярного количества или от общей массы композиции. Согласно некоторым другим вариантам реализации указанная композиция содержит 50-75% ионизируемого липида от молярного количества или от общей массы композиции, 20-40% холестерина от молярного количества или от общей массы композиции, 5-10% некатионного липида от молярного количества или от общей массы композиции; и 1-10% конъюгированного липида от молярного количества или от общей массы композиции. Указанная композиция может содержать 60-70% ионизируемого липида от молярного количества или от общей массы композиции, 25-35% холестерина от молярного количества или от общей массы композиции; и 5-10% некатионного липида от молярного количества или от общей массы композиции. Указанная композиция может также содержать до 90% ионизируемого липида от молярного количества или от общей массы композиции; и 2-15% некатионного липида от молярного количества или от общей массы композиции. Указанный состав могут также быть представлен составом на основе липидных наночастиц, например, содержащим 8-30% ионизируемого липида от молярного количества или от общей массы композиции, 5-30% некатионного липида от молярного количества или от общей массы композиции; и 0-20% холестерина от молярного количества или от общей массы композиции; 4-25% ионизируемого липида от молярного количества или от общей массы композиции, 4-25% некатионного липида от молярного количества или от общей массы композиции, 2-25% холестерина от молярного количества или от общей массы композиции, 10-35% конъюгата липида от молярного количества или от общей массы композиции; и 5% холестерина от молярного количества или от общей массы композиции; или 2-30% ионизируемого липида от молярного количества или от общей массы композиции, 2-30% некатионного липида от молярного количества или от общей массы композиции, 1-15% холестерина от молярного количества или от общей массы композиции, 2-35% конъюгата липида от молярного количества или от общей массы композиции; и 1-20% холестерина от молярного количества или от общей массы композиции; или даже до 90% ионизируемого липида от молярного количества или от общей массы композиции; и 2-10% некатионных липидов от молярного количества или от общей массы композиции, или даже 100% катионного липида от молярного количества или от общей массы композиции. Согласно некоторым вариантам реализации указанный состав на основе липидных частиц содержит ионизируемый липид, фосфолипид, холестерин и пегилированный липид в молярном соотношении 50:10:38,5:1,5. Согласно некоторым другим вариантам реализации указанный состав на основе липидных частиц содержит ионизируемый липид, холестерин и пегилированный липид в молярном соотношении 60:38,5:1,5.
[00179] Согласно некоторым вариантам реализации указанная липидная частица содержит ионизируемый липид, некатионный липид (например, фосфолипид), стерол (например, холестерин) и пегилированный липид, при этом молярное соотношение липидов варьирует от 20 до 70 молярных процентов для ионизируемого липида при целевом значении 40-60, молярный процент некатионного липида варьирует от 0 до 30 при целевом значении 0-15, молярный процент стерола варьирует от 20 до 70 при целевом значении 30-50; и молярный процент пегилированного липида варьирует от 1 до 6 при целевом значении 2-5.
[00180] Согласно некоторым вариантам реализации указанная липидная частица содержит ионизируемый липид / некатионный липид / стерол / конъюгированный липид в молярном соотношении 50:10:38.5:1.5.
[00181] Согласно другим аспектам настоящего изобретения предложен состав на основе липидных наночастиц, содержащий фосфолипиды, лецитин, фосфатидилхолин и фосфатидилэтаноламин.
[00182] Согласно некоторым вариантам реализации могут также быть включены одно или более дополнительных соединений. Указанные соединения могут быть введены по отдельности или указанные дополнительные соединения могут быть включены в липидные наночастицы согласно настоящему изобретению. Другими словами, указанные липидные наночастицы могут содержать другие соединения наряду с зкДНК или по меньшей мере вторую зкДНК, отличную от первой. Без ограничений, другие дополнительные соединения могут быть выбраны из группы, состоящей из малых или больших органических или неорганических молекул, моносахаридов, дисахаридов, трисахаридов, олигосахаридов, полисахаридов, пептидов, белков, аналогов и производных пептидов, пептидомиметиков, нуклеиновых кислот, аналогов и производных нуклеиновых кислот, экстракта, полученного из биологических материалов, или любых их комбинаций.
[00183] Согласно некоторым вариантам реализации указанные одно или более дополнительных соединений могут представлять собой терапевтический агент. Указанный терапевтический агент может быть выбран из любого класса, подходящего для терапевтического назначения. Другими словами, указанный терапевтический агент может быть выбран из любого класса, подходящего для терапевтического назначения. Другими словами, указанный терапевтический агент может быть выбран в соответствии с терапевтическим назначением и требуемым биологическим действием. Например, если зкДНК в составе ЛНЧ подходит для лечения рака, дополнительное соединение может представлять собой противораковый агент (например, химиотерапевтический агент, средство для нацеленной противораковой терапии (в том числе, но не ограничиваясь перечисленными, малую молекулу, антитело или конъюгат антитела с лекарственным средством). Согласно другому примеру, если ЛНЧ, содержащая зкДНК, подходит для лечения инфекции, дополнительное соединение может представлять собой противомикробный агент (например, антибиотик или противовирусное соединение). В еще одном примере, если ЛНЧ, содержащая зкДНК, подходит для лечения иммунного заболевания или нарушения, дополнительное соединение может представлять собой соединение, которое модулирует иммунный ответ (например, иммунодепрессант, иммуностимулирующее соединение или соединение, модулирующее один или более специфических иммунных путей). Согласно некоторым вариантам реализации в композициях и способах согласно настоящему изобретению могут применяться разные коктейли из разных липидных наночастиц, содержащих разные соединения, такие как зкДНК, кодирующие разные белки или разные соединения, такие как терапевтические средства.
[00184] Согласно некоторым вариантам реализации указанное дополнительное соединение представляет собой иммуномодулирующий агент. Например, указанное дополнительное соединение представляет собой иммунодепрессант. Согласно некоторым вариантам реализации указанное дополнительное соединение является иммуностимулирующим.
[00185] Примеры иммуномодуляторов включают, не ограничиваясь перечисленными, интерлейкины (например, ИЛ-2, ИЛ-7, ИЛ-12), цитокины (например, гранулоцитарный колониестимулирующий фактор (Г-КСФ), интерфероны), хемокины (например, CCL3, CCL26, CXCL7), иммуномодулирующие имидные лекарственные средства (IMiDs) (например, талидомид и его аналоги (леналидомид, помалидомид и апремиласт), другие иммуномодуляторы, в том числе, но не ограничиваясь перечисленными: цитозин-фосфат-гуанозин, олигодезоксинуклеотиды, глюканы.
[00186] Согласно некоторым вариантам реализации указанный иммуномодулятор может представлять собой иммуносупрессивное лекарственное средство. Примеры иммуносупрессивных лекарственных средств включают, не ограничиваясь перечисленными, глюкокортикоиды, цитостатики, антитела, лекарственные средства, действующие на иммунофилины, и другие лекарственные средства. Глюкокортикоиды включают, не ограничиваясь перечисленными, преднизон, дексаметазон и гидрокортизон. Примеры цитостатиков включают алкилирующие агенты, такие как мустаргены (например, циклофосфамид), нитрозомочевины и соединения платины. Цитостатики могут также включать антиметаболиты такие как аналоги фолиевой кислоты (например, метотрексат), аналоги пуринов (например, азатиоприн и меркаптопурин), аналоги пиримидинов (например, фторурацил) и ингибиторы синтеза белка. Другие цитостатики включают цитотоксические антибиотики, такие как дактиномицины, антрациклины, митомицин С, блеомицин и митрамицин.
[00187] Антитела для подавления иммунитета включают, не ограничиваясь перечисленными, атгам, полученный из сыворотки лошадей, и тимоглобулин, антитела, направленные на ИЛ-2 рецептор (CD25-) и/или направленные на CD3 антитела, муромонаб-CD3 (MUROMONAB-CD3™, Ортоклон-OKT3), базиликсимаб (Симулект, SIMULECT™), даклизумаб (Зенапакс, ZENAPAX™) и муромонаб.
[00188] Лекарственные средства, действующие на иммунофилины, включают, не ограничиваясь перечисленными, циклоспорин, такролимус, рапамицин (сиролимус, SIROLIMUS™) и эверолимус. Примеры биологических средств включают абатасепт, анакинру, цертолизумаб, голимумаб, иксекизумаб, натализумаб, ритуксимаб, секукинумаб, тоцилизумаб, устекинумаб и ведолизумаб.
[00189] Другие лекарственные средства подходящие для применения в качестве иммуномодуляторов или иммуносупрессоров, включают, не ограничиваясь перечисленными, интерфероны (например, ИФН-β), опиоиды, связывающие ФНО белки (например, связывающий ФНО-α (фактор некроза опухоли альфа) белок, инфликсимаб (ремикейд, REMICADE™), этанерцепт (энбрел, ENBREL™) или адалимумаб (хумира, HUMIRA™)), куркумин (ингредиент куркумы) и катехины (содержатся в зеленом чае), микофенолат, финголимод, мириоцин, антипролиферативные агенты (например, мириоцин, такролимус, микофенолата мофетил, микофенолат натрия, азатиоприн), ингибиторы mTOR (например, сиролимус и эверолимус), ингибиторы кальциневрина (например, циклоспорин и такролимус), ингибиторы IMDS (например, азатиоприн, лефлуномид и микофенолат), финголимод, абатасепт, анакинру, цертолизумаб, голимумаб, иксекизумаб, натализумаб, ритуксимаб, секукинумаб, тоцилизумаб, устекинумаб и ведолизумаб.
[00190] Согласно некоторым вариантам реализации иммуносупрессивные агенты, подходящие для применения в композициях и способах согласно описанию в настоящем документе, могут быть выбраны из одного из следующих соединений: микофеноловая кислота, циклоспорин, азатиоприн, такролимус, циклоспорин A, FK506, рапамицин, лефлуномид, дезоксиспергуалин, преднизон, азатиоприн, микофенолата мофетил, OKT3, ATAG или мизорибин.
[00191] Согласно некоторым вариантам реализации иммуносупрессоры выбраны из группы, состоящей из преднизона, метилпреднизолона, кеналога, медрола для перорального приема, таблеток медрола для перорального приема, инъецируемого депо медрола для инъекций, преднизолона для перорального приема, раствора медрола для инъекций, гидрокортизона для перорального приема, кортефа для перорального приема, раствора медрола для в/в введения, кортизона для перорального приема, целестона для инъекций Celestone Soluspan, орапреда для перорального приема Orapred ODT, Orapred для перорального приема, перорального прелона, метилпреднизолона ацетата для инъекций, преднизона для перорального приема Intensol, бетаматазона ацетата с фосфатом натрия для инъекций, верипреда, целестона для перорального приема, метилпреднизолона натрия сукцината для в/в введения, метилпреднизолона натрия сукцината для инъекций, миллипреда для перорального приема, раствора медрола (без консервантов) для инъекций, раствора кортефа для инъекций, аристоспана для внутрисуставных инъекций, гидрокортизона натрия сукцината для инъекций, преднизолона натрия фосфата для перорального приема, метилпреднизолона сукцината натрия (без консервантов) для в/в введения, раствора медрола (без консервантов) для в/в введения, триамцинолона гексацетонида для инъекций, А-гидрокорта для инъекций, А-метапреда для инъекций, миллипреда (Millipred DP) для перорального приема, Flo-Pred для перорального приема, аристоспана для внутриочаговых инъекций, бетаметазона для перорального приема, метилпреднизолона сукцината натрия (без консервантов) для инъекций, гидрокортизона сукцината натрия (без консервантов) для инъекций, раствора кортефа (без консервантов) для инъекций, преднизолона ацетата для перорального приема, дексаметазона в 0,9% NaCl для в/в введения, райоса (Rayos), левотироксина. Разумеется, иммуносупрессоры, известные специалистам в данной области техники, могут легко быть использованы вместо перечисленных, поскольку указанный перечень не должен быть истолкован как исчерпывающий или ограничивающий.
[00192] Иммуносупрессор может приводить к снижению числа иммунных клеток у субъекта, например, снижению числа иммунных клеток, которые экспрессируют по меньшей мере что-либо одно или более из: CD11b, CD4, CD8, и/или снижению уровня провоспалительных цитокинов, выбранных из, не ограничиваясь перечисленными, ФНОα или МСР-1. Согласно некоторым вариантам реализации провоспалительный цитокин выбран из чего-либо одного или комбинации перечисленного: цитокины, лимфокины, монокины, факторы роста стволовых клеток, лимфотоксины, гематопоэтические факторы, колониестимулирующие факторы (КСФ), интерфероны (ИФН), паратиреоидный гормон, тироксин, инсулин, проинсулин, релаксин, прорелаксин, фолликулостимулирующий гормон (FSH), тиреотропный гормон (TSH), лютеинизирующий гормон (LH), фактор роста печени, простагландин, фактор роста фибробластов, пролактин, плацентарный лактоген, белок ОВ, трансформирующий фактор роста (ТФР), ТФР-α, ТФР-β, инсулиноподобный фактор роста (ИФР), эритропоэтин, тромбопоэтин, фактор некроза опухоли (ФИО), ФНО-α, ФНО-β, мюллерова ингибирующая субстанция (MIS), гонадотропин-ассоциированный пептид мышей, ингибин, активин, фактор роста эндотелия сосудов, интегрин, интерлейкин (ИЛ), гранулоцитарный колониестимулирующий фактор (Г-КСФ), гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), интерферон-альфа, интерферон-бета, интерферон-гамма, фактор S1, ИЛ-1, ИЛ-1 сс, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-11, ИЛ-12, ИЛ-13, ИЛ-14, ИЛ-15, ИЛ-16, ИЛ-17, ИЛ-18 ИЛ-21, ИЛ-23, ИЛ-25, LIF, kit-лиганд, FLT-3, ангиостатин, тромбоспондин и эндостатин.
[00193] Согласно некоторым вариантам реализации провоспалительный цитокин может быть выбран из чего-либо одного или из комбинации интерлейкина-1β (ИЛ-1β), фактора некроза опухоли-α (ФНО-α), интерлейкина-6 (ИЛ-6), интерлейкина-8 (ИЛ-8), интерферона-γ (ИФН-γ), фактора роста эндотелия сосудов (ФРЭС), ингибиторного фактора лейкоза (LIF), моноцитарного хемоаттрактантного белка-1 (МСР-1), RANTES, интерлейкина-10 (ИЛ-10), интерлейкина-12 (ИЛ-12), матриксной металлопротеиназы 2 (ММР2), IP-10, макрофагального белка воспаления 1α (MIP1α) и/или макрофагального белка воспаления 1β (MIP1β).
[00194] Согласно некоторым вариантам реализации указанный иммуномодулирующий агент представляет собой агонист NLRP3. Примеры агонистов NLRP3 включают, не ограничиваясь перечисленными, имидазохинолин; имидазонафтиридин; пиразолопиридин; арил-замещенный имидазохинолин; соединение, содержащее 1-алкокси-1H-имидазольную кольцевую систему; оксазоло[4,5-с]-хинолин-4-амин; тиазоло[4,5-с]-хинолин-4-амин; селеазоло[4,5-с]-хинолин-4-амин; имидазонафтиридин, имидазохинолинамин; 1-замещенный, 2-замещенный 1Н-имидазо[4,5-С]хинолин-4-амин; слитый циклоалкилимидазопиридин; 1Н-имидазо[4,5-с]хинолин-4-амин; 1-замещенный 1H-имидазо-[4,5-с]хинолин-4-амин; имидазо-[4,5-С]хинолин-4-амин; 2-этил-1Н-имидазо[4,5-с]хинолин-4-амин; олефиновый 1Н-имидазо[4,5-с]хинолин-4-амин; 6,7-дигидро-8-(имидазол-1-ил)-5-метил-1-оксо-1Н,5Н-бензо[ij]хинолизин-2-карбоновую кислоту; пиридохиноксалин-6-карбоновую кислоту; 6,7-дигидро-8-(имидазол-1-ил)-5-метил-1-оксо-1Н,5Н-бензо[ij]хинолизин-2-карбоновую кислоту; замещенный нафто[ij]хинолизин; замещенную пиридохиноксалин-6-карбоновую кислоту; производное 7-гидрокси-бензо[ij]хинолизин-2-карбоновой кислоты; замещенную бензо[ij]хинолизин-2-карбоновую кислоту; 7-гидрокси-бензо[ij]хинолизин-2-карбоновую кислоту; замещенный пиридо[1,2,3,-de]-1,4-бензоксазин; и N-метиленмалонат тетрагидрохинолина. Согласно некоторым вариантам реализации указанный агонист NLRP3 представляет собой соединение формулы:
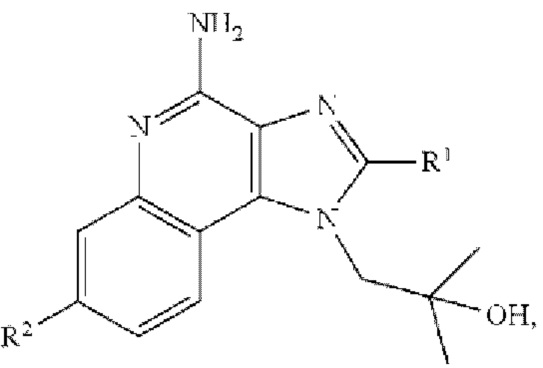
[00195] Согласно некоторым вариантам реализации указанный иммуномодулирующий агент представляет собой лиганд TLR7 и/или TLR8. Согласно некоторым вариантам реализации указанный иммуномодулирующий агент представляет собой имиквимод (1-изобутил-1Н-имидазо[4,5-с]хинолин-4-амин) или резиквимод.
[00196] Согласно некоторым вариантам реализации указанный иммуномодулирующий агент представляет собой соединение на основе имквидазолхинолина формулы:

[00197] Согласно некоторым вариантам реализации указанный иммуномодулирующий агент представляет собой модулятор SMAD7. Например, указанный модулятор SMAD7 может представлять собой антисмысловой олигонуклеотид SMAD7 (AON) согласно определению в WO 2017059225 А1, содержание которого включено в настоящий документ полностью посредством ссылки.
[00198] Указанный иммуномодулирующий агент может представлять собой модулятор TLR. Например, указанный иммуномодулирующий агент может представлять собой модулятор TLR3, TLR4, TLR7, TLR8 или TLR9, например, антагонист TLR3, TLR4, TLR7, TLR8, или TLR9 агонист или a TLR3, TLR4, TLR7, TLR8 или TLR9. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой модулятор TLR3. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой модулятор TLR4. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой модулятор TLR7. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой модулятор TLR8. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой модулятор TLR9. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой агонист TLR3. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой агонист TLR4. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой агонист TLR7. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой агонист TLR8. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой агонист TLR9. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой антагонист TLR3. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой антагонист TLR4. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой антагонист TLR7. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой антагонист TLR8. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой антагонист TLR9. Согласно некоторым вариантам реализации модулятор TLR, описанный в настоящем документе, может модулировать два или более TLR. Согласно некоторым вариантам реализации указанный модулятор TLR может активировать один или более TLR и ингибировать один или более TLR. Согласно некоторым вариантам реализации указанный модулятор TLR представляет собой модулятор TLR9, такой как каппапрокт (KAPPAPROCT®) или монарсен (MONARSEN®). Некоторые примеры модуляторов TLR описаны, например, в WO 2017059225 А1.
[00199] Согласно некоторым вариантам реализации указанный иммуномодулирующий агент представляет собой олигонуклеотид CpG-A или Cpg-B согласно описанию в WO 2017059225 A1.
[00200] Детекция в цитозоле происходящей из патогена ДНК требует сигнализации через TANK-связывающую киназу 1 (TBK1) и зависимый от нее транскрипционный фактор, ИФН-регуляторный фактор 3 (IRF3). Трансмембранный белок, который называется STING (стимулятор генов ИФН; также известный как MITA, ERIS, MPYS и ТМЕМ173) функционирует в качестве сигнального рецептора указанных циклических пуриновых динуклеотидов, вызывая стимуляцию сигнальной оси TBK1-IRF3 и STING-зависимый ответ с интерферонами I типа. Соответственно, согласно некоторым вариантам реализации указанный иммуномодулирующий агент представляет собой модулятор STING. STING прямо связывает циклический дигуанилатмонофосфат, но не другие нерелевантные нуклеотиды или нуклеиновые кислоты. Соответственно, согласно некоторым вариантам реализации указанный модулятор STING представляет собой циклический пуриновый динуклеотид. Примеры циклических пуриновых динуклеотидов и модуляторов STING описаны, например, в US 9549944 B2, содержание которого включено в настоящий документ полностью посредством ссылки.
[00201] Дополнительные примеры иммунодепрессантов включают, не ограничиваясь перечисленными, абатасепт; адалимумаб; агонисты аденозиновых рецепторов; анакинра; ингибиторы рецепторов арильных углеводородов; ингибиторы аутофагии, такие как 3-метиладенин; ингибиторы кальциневрина; ингибиторы кальциневрина, такие как циклоспорин и такролимус; ингибиторы каспазы-1; цертолизумаб; ингибиторы cGAS; кортикостероиды; кортикостероиды, такие как преднизон, будесонид, преднизолон; ингибиторы цитокинов; активаторы рецепторов цитокинов; ингибиторы рецепторов цитокинов; этанерцепт; глюкокортикоиды; голимумаб; агонисты сопряженных с G-белком рецепторов; антагонисты сопряженных с G-белком рецепторов; ингибиторы гистоновой деацетилазы; ингибиторы гистоновой деацетилазы, такие как трихостатин А; ингибиторы IMDH, такие как азатиоприн, лефлуномид и микофенолат; инфликсимаб; ингибиторы функции митохондрий, такие как ротенон; иксекизумаб; ингибиторы киназ; метилпреднизолон; моноклональные антитела, такие как базиликсимаб, даклизумаб и муромонаб; ингибиторы mTOR, такие как рапамицин или аналог рапамицина, сиролимус и эверолимус; натализумаб; ингибиторы NF-κβ, такие как 6Bio, дексаметазон, ТСРА-1, IKK VII; OTK3; окисленные АТФ, такие как блокаторы рецепторов Р2Х; ингибиторы Р38; агонисты активируемых пролифератором пероксисом рецепторов; антагонисты активируемых пролифератором пероксисом рецепторов; ингибиторы фосфатазы; ингибитор фосфодиэстераз, такой как ингибитор фосфодиэстеразы 4 (PDE4), такой как ролипрам; ингибиторы PI3 KB, такие как TGX-221; агонисты простагландина Е2 (PGE2), такие как мизопростол; ингибитор протеасом I (PSI); ингибиторы протеасом; ретиноиды; ритуксимаб; секукинумаб; статины; агонисты рецептора ТФР-β; сигнальные агенты ТФР-β; тмоглобулин; антагонисты TLR9; тоцилизумаб; устекинумаб; и ведолизумаб. Иммунодепрессанты также включают IDO, витамин D3, циклоспорины, такие как циклоспорин А, ингибиторы рецепторов арильных углеводородов, ресвератрол, азатиоприн (Aza), 6-меркаптопурин (6-МР), 6-тиогуанин (6-TG), FK506, санглиферин А, салметерол, микофенолата мофетил (MMF), аспирин и другие ингибиторы СОХ, нифлумовую кислоту, эстриол и триптолид, интерлейкины (например, ИЛ-1, ИЛ-10), циклоспорин А, нацеленные на киРНК цитокины или рецепторы цитокинов и т.п.
[00202] Согласно некоторым вариантам реализации указанный иммуномодулирующий агент выбирают из группы, состоящей из 3-метиладенина, 6-Bio, 6-меркаптопурина (6-МР, 6-тиогуанина (6-TG), FK506, санглиферина А, абатасепта, адалимумаба, анакинры, ингибиторов рецепторов арильных углеводородов, аспирина, ингибиторов аутофагии, азатиоприна, базиликсимаба, будесонида, ингибиторов кальциневрина, ингибиторы каспазы-1, цертолизумаба, ингибиторов cGAS, ингибиторов СОХ, нифлумовой кислоты, циклоспорина, ингибиторов цитокинов, активаторы рецепторов цитокинов, ингибиторы рецепторов цитокинов, даклизумаба, дексаметазона, эстриола, этанерцепта, эверолимуса, глюкокортикоидов, голимумаба, агонистов сопряженных с G-белком рецепторов, антагонистов сопряженных с G-белком рецепторов, ингибиторов гистоновой деацетилазы, IDO, IKK VII, инфликсимаба, интерлейкина-1, интерлейкина-10, иксекизумаба, ингибиторов киназ, лефлуномида, метилпреднизолона, мизопростола, муромонаба, микофенолата, микофенолата мофетила (MMF), натализумаба, OTK3, окисленных АТФ, блокаторов рецептора Р2Х, ингибиторов Р38, агонистов активируемых пролифератором пероксисом рецепторов, антагонистов активируемых пролифератором пероксисом рецепторов, ингибиторов фосфатаз, ингибиторов PI3 KB, преднизолона, преднизона, ингибитора протеасом I (PSI), ингибиторов протеасом, рапамицина и аналогов рапамицина, ресвератрола, ретиноидов, ритуксимаба, ролипрама, ротенона, салметерола, секукинумаба, сиролимуса, статинов, такролимуса, ТСРА-1, TGX-221, тимоглобулина, антагонистов TLR9, тоцилизумаба, трихостатина А, триптолида, устекинумаба, ведолизумаба, витамина D3; и любой комбинации перечисленного.
[00203] Заметим, что любой из иммуномодулирующих агентов, описанных в настоящем документе, могут применяться в липидных наночастицах, зкДНК-векторах и/или композициях согласно описанию в настоящем документе. Например, иммуномодулирующий агент может применяться по отдельности или в комбинации с одним или более (например, одним, двумя, тремя, четырьмя, пятью или более) других иммуномодулирующих агентов, описанных в настоящем документе.
[00204] Согласно некоторым вариантам реализации указанный иммуномодулирующий агент выбран из группы, состоящей из ингибиторов рецепторов арильных углеводородов; ингибиторов каспазы-1; ингибиторов cGAS; ингибиторов цитокинов; агонистов сопряженных с G-белком рецепторов; антагонистов сопряженных с G-белком рецепторов; ингибиторов функции митохондрий; ингибиторов mTOR; ингибиторов NF-κβ; агонистов активируемых пролифератором пероксисом рецепторов; антагонистов фосфатаза; ингибитора фосфодиэстераз, TGX-221; агонистов простагландин Е2 (PGE2); антагонистов TLR9; ингибиторов протеасом; агонистов рецепторов ТФР-β и сигнальных агентов ТФР-β. Может быть использован любой один или более из вышеперечисленных агентов по отдельности или в комбинации с ЛНЧ, содержащими зкДНК.
[00205] Также согласно настоящему изобретению предложена фармацевтическая композиция, содержащая липидную наночастицу и фармацевтически приемлемый носитель или вспомогательное вещество.
[00206] Согласно некоторым аспектам настоящего изобретения предложен состав на основе липидных наночастиц, дополнительно содержащий одно или более фармацевтических вспомогательных веществ. Согласно некоторым вариантам реализации указанный состав на основе липидных наночастиц дополнительно содержит сахарозу, Tris, трегалозу и/или глицин.
Некоторые примеры характеристик ЛНЧ
[00207] Как правило, липидные наночастицы согласно настоящему изобретению имеют средний диаметр, выбранный так, чтобы обеспечивать предполагаемый терапевтический эффект. Соответственно, согласно некоторым аспектам указанная липидная наночастица имеет средний диаметр от приблизительно 30 нм до приблизительно 150 нм, чаще от приблизительно 50 нм до приблизительно 150 нм, чаще приблизительно 60 нм до приблизительно 130 нм, чаще от приблизительно 70 нм до приблизительно 110 нм, чаще всего от приблизительно 85 нм до приблизительно 105 нм и предпочтительно приблизительно 100 нм. Согласно некоторым аспектам настоящего изобретения предложены липидные частицы с относительным размером, превышающим размер обычных наночастиц, составляющим приблизительно 150-250 нм. Размер липидных наночастиц может быть определен с применением квазиупругого рассеяния света с использованием, например, системы Malvern Zetasizer Nano ZS (Малверн, Великобритания).
[00208] В зависимости от предполагаемого применения липидных частиц пропорции компонентов могут варьировать и эффективность доставки конкретного состава может быть измерена с применением, например, анализа показателей эндосомального высвобождения (ERP).
[00209] ЗкДНК может образовывать комплекс с липидной частью частицы или инкапсулирована в липидном окружении липидной наночастицы. Согласно некоторым вариантам реализации зкДНК может быть полностью инкапсулирована в липидном окружении липидной наночастицы, с защитой таким образом ее от разложения нуклеазой, например, в водном растворе. Согласно некоторым вариантам реализации зкДНК в липидной наночастице по существу не разлагается после воздействия на липидную наночастицу нуклеазой при 37°С на протяжении по меньшей мере приблизительно 20, 30, 45 или 60 минут. Согласно некоторым вариантам реализации зкДНК в липидной наночастице по существу не разлагается после инкубации частицы в сыворотке при 37°С на протяжении по меньшей мере приблизительно 30, 45, или 60 минут или по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34 или 36 часов.
[00210] Согласно некоторым вариантам реализации указанные липидные наночастицы по существу не токсичны для субъекта, например, млекопитающего, такого как человек.
[00211] Согласно некоторым аспектам указанный состав на основе липидных наночастиц представляет собой лиофилизированный порошок.
[00212] Согласно некоторым вариантам реализации липидные наночастицы представляют собой частицы с твердой сердцевиной, содержащие по меньшей мере один липидный бислой. Согласно другим вариантам реализации указанные липидные наночастицы имеют структуру без бислоев, т.е. неслоистую (т.е. небислойную) морфологию. Без ограничений, небислойная морфология может включать, например, трехмерные трубки, стержни, структуры с кубической симметрией и т.п. Неслоистая морфология (т.е. небислойная структура) липидных частиц может быть определена с применением аналитических методик, известных и используемых специалистами в данной области техники. Такие методики включают, не ограничиваясь перечисленными, криогенную трансмиссионную электронную микроскопию («крио-ТЭМ»), дифференциальную сканирующую калориметрию («ДСК»), рентгеновскую дифракцию и т.п. Например, морфология липидных наночастиц (слоистая или же неслоистая) может легко быть оценена и охарактеризована с применением, например, крио-ТЭМ-анализа согласно описанию в US 2010/0130588, содержание которого включено в настоящий документ полностью посредством ссылки.
[00213] Согласно некоторым дополнительным вариантами реализации липидные наночастицы с немногослойной морфологией являются электронно-плотными.
[00214] Согласно некоторым аспектам настоящего изобретения предложена липидная наночастица с однослойной или многослойной структурой. Согласно некоторым аспектам настоящего изобретения предложен состав на основе липидных наночастиц, который содержит мультивезикулярные частицы и/или частицы на основе пены.
[00215] Контролируя состав и концентрацию липидных компонентов, можно контролировать скорость, с которой липидный конъюгат выходит из липидной частицы, и, в свою очередь, скорость, с которой указанная липидная наночастица становится фузогенной. Кроме того, другие переменные показатели, включая, например, рН, температуру или ионную силу, могут применяться для изменения и/или контроля скорости, с которой липидная наночастица становится фузогенной. Другие способы которые могут применяться для контроля скорости, с которой указанная липидная наночастица становится фузогенной, будут очевидны для специалистов в данной области техники на основании настоящего описания. Также очевидно, что, контролируя состав и концентрацию липидного конъюгата, можно контролировать размер липидных частиц.
[00216] Значение pKa составов с катионными липидами может быть скоррелировано с эффективностью ЛНЧ для доставки нуклеиновых кислот (см. источники: Jayaraman et al, Angewandte Chemie, International Edition (2012), 51(34), 8529-8533; Semple et al, Nature Biotechnology 28, 172-176 (2010), оба из которых полностью включены в настоящий документ посредством ссылки). Предпочтительный диапазон значений pKa составляет от ~5 до ~ 7. Значение pKa катионного липида может быть определено в липидных наночастицах с применением анализа, основанного на флуоресценции 2-(п-толуидино)-6-нафталинсульфоновой кислоты (TNS).
[00217] Инкапсуляция зкДНК в липидных частицах может быть определена путем проведения эксклюзионного анализа с использованием не проникающего через мембрану флуоресцентного красителя, характеризующегося усиленной флуоресценцией при связывании с нуклеиновой кислотой, например, анализа с Oligreen® или PicoGreen®. Как правило, инкапсуляцию определяют путем добавления красителя в состав на основе липидных частиц, измерения итоговой флуоресценции и сравнения с флуоресценцией, наблюдаемой при добавлении небольшого количества неионогенного детергента. Опосредованное детергентом разрушение липидного бислоя высвобождает инкапсулированную зкДНК, позволяя ей взаимодействовать с не проникающим через мембрану красителем. Инкапсуляция зкДНК может быть рассчитана как E=(I0-I)/I0, где I и I0 относятся к интенсивности флуоресценции до и после добавления детергента.
[00218] Согласно некоторым аспектам настоящего изобретения предложен липосомный состав, который включает одно или более соединений с функциональной группой полиэтиленгликоля (ПЭГ) (так называемые «пегилированные соединения»), которые могут уменьшать иммуногенность/ антигенность соединения (соединений), обеспечивать гидрофильность и гидрофобность соединения (соединений) и/или снижения терапевтически эффективной частоты дозирования. Согласно другим аспектам указанный липосомный состав может просто включать полимер полиэтиленгликоля (ПЭГ) в качестве дополнительного компонента. В таких аспектах молекулярная масса ПЭГ или функциональной группы ПЭГ может составлять от 62 Да до приблизительно 5000 Да.
[00219] Согласно некоторым аспектам настоящего изобретения предложен липосомный состав, который доставляет зкДНК с профилем продленного высвобождения или контролируемого высвобождения на протяжении периода продолжительностью от часов до недель. Согласно некоторым родственным аспектам указанный липосомный состав может содержать водные камеры, связанные липидными бислоями. Согласно другим родственным аспектам указанный липосомный состав инкапсулирует зкДНК с дополнительными компонентами, которые претерпевают физический переход при повышенной температуре, высвобождающий указанный АФИ на протяжении периода продолжительностью от часов до недель.
[00220] Согласно некоторым аспектам указанный липосомный состав содержит сфингомиелин и один или более липидов согласно описанию в настоящем документе. Согласно некоторым аспектам указанный липосомный состав содержит оптисомы.
[00221] Согласно некоторым аспектам настоящего изобретения предложен липосомный состав, который включает один или более липидов, выбранных из: натриевой соли N-(карбонил-метоксиполиэтиленгликоль 2000)-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламина, (дистеароил-sn-глицеро-фосфоэтаноламина), MPEG (метоксиполиэтиленгликоль)- конъюгированного липида, HSPC (гидрогенизированного соевого фосфатидилхолина); ПЭГ (полиэтиленгликоля); DSPE (дистеароил-sn-глицеро-фосфоэтаноламина); DSPC (дистеароилфосфатидилхолина); DOPC (диолеилфосфатидилхолина); DPPG (дипальмитоилфосфатидилглицерина); ЕРС (яичного фосфатидилхолина); DOPS (диолеилфосфатидилсерина); РОРС (пальмитоилолеоилфосфатидилхолина); SM (сфингомиелина); MPEG (метоксиполиэтиленгликоля); DMPC (димиристоилфосфатидилхолина); DMPG (димиристоилфосфатидилглицерина); DSPG (дистеароилфосфатидилглицерина); DEPC (диерукоилфосфатидилхолина); DOPE (диолеоли-sn-глицеро-фосфоэтаноламина), холестерилсульфата (CS), дипальмитоилфосфатидилглицерина (DPPG), DOPC (диолеоли-sn-глицеро-фосфатидилхолина) или любой комбинации перечисленного.
[00222] Согласно некоторым аспектам настоящего изобретения предложен липосомный состав, содержащий фосфолипид, холестерин и пегилированный липид в молярном соотношении 56:38:5. Согласно некоторым аспектам общее содержание липидов в указанном липосомном составе составляет 2-16 мг/мл. Согласно некоторым аспектам настоящего изобретения предложен липосомный состав, содержащий липид, включающий фосфатидилхолиновую функциональную группу, липид, включающий этаноламинную функциональную группу, и пегилированный липид. Согласно некоторым аспектам настоящего изобретения предложен липосомный состав, содержащий липид, включающий фосфатидилхолиновую функциональную группу, липид, включающий этаноламинную функциональную группу, и пегилированный липид в молярном соотношении 3:0,015:2, соответственно. Согласно некоторым аспектам настоящего изобретения предложен липосомный состав, содержащий липид, включающий фосфатидилхолиновую функциональную группу, холестерин и пегилированный липид. Согласно некоторым аспектам настоящего изобретения предложен липосомный состав, содержащий липид, включающий фосфатидилхолиновую функциональную группу, и холестерин. Согласно некоторым аспектам указанный пегилированный липид представляет собой PEG-2000-DSPE. Согласно некоторым аспектам настоящего изобретения предложен липосомный состав, содержащий DPPG, соевый PC (фосфатидилхолин), липидный конъюгат MPEG-DSPE и холестерин.
[00223] Согласно некоторым аспектам настоящего изобретения предложен липосомный состав, содержащий один или более липидов, включающих фосфатидилхолиновую функциональную группу, и один или более липидов, включающих этаноламинную функциональную группу. Согласно некоторым аспектам настоящего изобретения предложен состав, содержащий один или более: липидов, включающих фосфатидилхолиновую функциональную группу, липидов, включающих этаноламинную функциональную группу, и/или стеролов, например, холестерина. Согласно некоторым аспектам указанный липосомный состав содержит DOPC/DEPC; и DOPE.
[00224] Согласно некоторым аспектам настоящего изобретения предложен липосомный состав, дополнительно содержащий одно или более фармацевтических вспомогательных веществ, например, сахарозу и/или глицин.
[00225] Согласно некоторым аспектам настоящего изобретения предложен липосомный состав с однослойной или многослойной структурой. Согласно некоторым аспектам настоящего изобретения предложен липосомный состав, который содержит мультивезикулярные частицы и/или частицы на основе пены. Согласно некоторым аспектам настоящего изобретения предложен липосомный состав относительный размер частиц которого больше обычных наночастиц и составляет приблизительно 150-250 нм. Согласно некоторым аспектам указанный липосомный состав представляет собой лиофилизированный порошок.
[00226] Согласно некоторым аспектам настоящего изобретения предложен липосомный состав, который получают и нагружают зкДНК-векторами, полученными способом согласно примеру 1 или иначе описанными в настоящем документе, путем добавления слабого основания к смеси, содержащей выделенную зкДНК вне липосомы. Указанное добавление увеличивает значение рН вне липосомы до приблизительно 7,3 и направляет указанную зкДНК в липосому. Согласно некоторым аспектам настоящего изобретения предложен липосомный состав с кислотным рН внутри липосомы. В таких случаях рН внутри липосомы может составлять 4-6,9, более предпочтительно, 6,5. Согласно другим аспектам настоящего изобретения предложен липосомный состав, полученный с применением технологии интралипосомальной стабилизации лекарственных средств. В таких случаях используют полимерные или неполимерные высокозаряженные анионы и интралипосомальные захватывающие агенты, например, полифосфат или октасульфат сахарозы.
[00227] Согласно другим аспектам настоящего изобретения предложен липосомный состав, содержащий фосфолипиды, лецитин, фосфатидилхолин и фосфатидилэтаноламин.
[00228] ЗкДНК согласно описанию в настоящем документе может быть включена в фармацевтические композиции, подходящие для введения субъекту, для in vivo доставки в клетки, ткани или органы указанного субъекта. Как правило, указанная фармацевтическая композиция содержит зкДНК согласно описанию в настоящем документе и фармацевтически приемлемый носитель. Например, зкДНК-векторы согласно настоящему изобретению могут быть включены в фармацевтическую композицию, подходящую для требуемого маршрута терапевтического введения (например, парентерального введения). Также предусмотрены пассивная трансдукция тканей посредством внутривенной или внутриартериальной инфузии под высоким давлением, а также внутриклеточное инъецирование, например, внутриядерная микроинъекция или внутрицитоплазматическая инъекция. Фармацевтические композиции для применения в терапевтических целях могут быть введены в состав раствора, микроэмульсии, дисперсии, липосом или другой упорядоченной структуры, подходящей для зкДНК-вектора в высокой концентрации. Стерильные инъецируемые растворы могут быть получены путем включения зкДНК-векторного компонента в требуемом количестве в подходящий буфер вместе с одним ингредиентом или комбинацией ингредиентов, перечисленных выше, по мере необходимости, с последующей стерилизацией фильтрацией.
[00229] ЗкДНК-вектор согласно описанию в настоящем документе может быть включен в фармацевтическую композицию, подходящую для местного, системного, внутриамниотического, интратекального, интракраниального, внутриартериального, внутривенного, внутрилимфатического, внутрибрюшинного, подкожного, трахеального, внутритканевого (например, внутримышечного, внутрисердечного, внутрипеченочного, внутрипочечного, интрацеребрального), интратекального, интравезикального, коньюнктивального (например, экстраорбитального, интраорбитального, ретроорбитального, интраретинального, субретинального, хориоидального, субхориоидального, интрастромального, интракамерального и интравитреального), интракохлеарного и мукозального (например, орального, ректального, назального) введения. Также предусмотрены пассивная трансдукция тканей посредством внутривенной или внутриартериальной инфузии под высоким давлением, а также внутриклеточное инъецирование, например, внутриядерная микроинъекция или внутрицитоплазматическая инъекция.
[00230] Фармацевтически активные композиции, содержащие зкДНК-вектор, могут быть введены в состав для доставки трансгена в нуклеиновой кислоте в клетки реципиента, что приводит к терапевтической экспрессии в них указанного трансгена. Указанная композиция может также включать фармацевтически приемлемый носитель.
[00231] Композиции и векторы, предложенные согласно настоящему изобретению, могут применяться для доставки трансгена для различных целей. Согласно некоторым вариантам реализации указанный трансген кодирует белок или функциональную РНК, предназначенные для применения в научных исследованиях, например, для создания соматической трансгенной модели на животных, несущих указанный трансген, например, для изучения функции указанного трансгенного продукта. Согласно другому примеру указанный трансген кодирует белок или функциональную РНК, предназначенные для применения при создании модели заболевания на животных. Согласно некоторым вариантам реализации указанный трансген кодирует один или более пептидов, полипептидов или белков, которые подходят для лечения, облегчения или предотвращения болезненных состояний у субъекта-млекопитающего. Указанный трансген может быть перенесен в организм пациента (например, экспрессируется у пациента) в достаточном количестве для лечения заболеваний, ассоциированных с пониженной экспрессией, отсутствием экспрессии или дисфункцией гена. Согласно некоторым вариантам реализации указанный трансген может быть перенесен субъекту (например, экспрессироваться у субъекта) в достаточном количестве для лечения заболевания, ассоциированного с повышенной экспрессией, активностью генного продукта, или неадекватной положительной регуляцией гена, которую указанный трансген подавляет или иным образом вызывает необходимое снижение экспрессии.
[00232] Фармацевтические композиции в терапевтических целях, как правило, должны быть стерильными и стабильными в условиях получения и хранения. Указанная композиция может быть введена в состав раствора, микроэмульсии, дисперсии, липосом или другой упорядоченной структуры, подходящей для зкДНК-вектора в высокой концентрации. Стерильные инъецируемые растворы могут быть получены путем включения зкДНК-векторного компонента в требуемом количестве в подходящий буфер вместе с одним ингредиентом или комбинацией ингредиентов, перечисленных выше, по мере необходимости, с последующей стерилизацией фильтрацией.
[00233] зкДНК-вектор согласно описанию в настоящем документе может также быть введен в организм для трансдукции клеток in vivo.
[00234] Как правило, введение осуществляют любым из маршрутов, обычно используемых для приведения молекулы в максимально тесный контакт с клетками крови или тканей. Подходящие способы введения таких нуклеиновых кислот доступны и хорошо известны специалистам в данной области техники, и, хотя для введения конкретной композиции может быть использовано более одного маршрута, конкретный маршрут часто может обеспечить более быструю и более эффективную реакцию, чем другой маршрут. Примеры способов введения зкДНК-вектора согласно описанию в настоящем документе включают оральное, ректальное, трансмукозальное, интраназальное, ингаляционное (например, например, в аэрозоле), буккальное (например, сублингвальное), вагинальное, интратекальное, интраокулярное, чрескожное, интраэндотелиальное введение, введение in utero (или in ovo), парентеральное (например, внутривенное, подкожное, внутрикожное, интракраниальное, внутримышечное [в том числе введение в скелетную, диафрагмальную и/или сердечную мышцу], интраплевральное, интрацеребральное и внутрисуставное), местное (например, на кожу и поверхности слизистых оболочек, в том числе поверхности дыхательных путей, и чрескожное введение), внутрилимфатическое введение и т.п., а также прямую инъекцию в ткань или орган (например, в печень, глаза, скелетные мышцы, сердечную мышцу, диафрагмальную мышцу или головной мозг).
[00235] Может осуществляться введение указанного зкДНК-вектора в любой сайт в организме субъекта, включая, без ограничений, сайт, выбранный из группы, состоящей из головного мозга, скелетных мышц, гладких мышц, сердца, диафрагмы, эпителия дыхательных путей, печени, почек, селезенки, поджелудочной железы, кожи и глаз. Может также осуществляться введение указанного зкДНК-вектора в опухоль (например, в опухоль или возле опухоли, или в лимфатический узел). Наиболее подходящий маршрут в том или ином случае зависит от природы и тяжести состояния, лечение, облегчение и/или предотвращение которого проводят, и от природы конкретного используемого зкДНК-вектора. Кроме того, применение зкДНК позволяет вводить более одного трансгена в единственном векторе или нескольких зкДНК-векторах (например, коктейль зкДНК).
[00236] Введение зкДНК-вектора согласно описанию в настоящем документе в скелетные мышцы включает, не ограничиваясь перечисленным, введение в скелетные мышцы в конечностях (например, в плече, предплечье, бедре и/или голени), спине, шее, голове (например, язык), грудной клетки, брюшной полости, таза/промежности и/или пальцев. ЗкДНК-вектор согласно описанию в настоящем документе может быть доставлен в скелетные мышцы путем внутривенного введения, внутриартериального введения, внутрибрюшинного введения, перфузии конечности (необязательно, перфузии изолированной конечности, ноги и/или руки; см., например, Arruda et al., (2005) Blood 105: 3458-3464), и/или прямой внутримышечной инъекции. Согласно конкретным вариантам реализации зкДНК-вектор согласно описанию в настоящем документе вводят в конечность (руку и/или ногу) субъекта (например, субъекта с мышечной дистрофией, такой как DMD) путем перфузии конечности, необязательно перфузии изолированной конечности (например, путем внутривенного или внутрисуставного введения). Согласно вариантам реализации зкДНК-вектор согласно описанию в настоящем документе может быть введен без использования «гидродинамических» методик.
[00237] Введение зкДНК-вектора согласно описанию в настоящем документе в сердечную мышцу включает введение в левое предсердие, правое предсердие, левый желудочек, правый желудочек и/или перегородку. ЗкДНК-вектор согласно описанию в настоящем документе может быть доставлен в сердечную мышцу путем внутривенного введения, внутриартериального введения, такого как интрааортальное введение, прямой инъекции в сердце (например, в левое предсердие, правое предсердие, левый желудочек, правый желудочек) и/или перфузии коронарной артерии. Введение в диафрагмальную мышцу может быть осуществлено любым подходящим способом, в том числе путем внутривенного введения, внутриартериального введения и/или внутрибрюшинного введения. Введение в гладкие мышцы быть осуществлено любым подходящим способом, в том числе путем внутривенного введения, внутриартериального введения и/или внутрибрюшинного введения. Согласно одному варианту реализации может быть осуществлено введение в эндотелиальные клетки, присутствующие в гладких мышцах, возле и/или на них.
[00238] Согласно некоторым вариантам реализации зкДНК-вектор в соответствии с настоящим изобретением вводят в скелетную мышцу, диафрагмальную мышцу и/или сердечную мышцу (например, для лечения, облегчения и/или предотвращения мышечной дистрофии или заболевания сердца (например, ЗПА или застойной сердечной недостаточности).
[00239] ЗкДНК-вектор в соответствии с настоящим изобретением может быть введен в ЦНС (например, в головной мозг или в глаз). Указанный зкДНК-вектор может быть введен в спинной мозг, ствол мозга (продолговатый мозг, варолиев мост), средний мозг (гипоталамус, таламус, эпиталамус, питуитарную железу, черную субстанцию, шишковидную железу), мозжечок, конечный мозг (полосатое тело, большой мозг, в том числе затылочные, височные, теменные и лобные доли, кору головного мозга, базальные ганглии, гиппокамп и миндалевидное тело), лимбическую систему, неокортекс, полосатое тело, большой мозг и нижний холмик четверохолмия. Указанный зкДНК-вектор может также быть введен в разные области глаза, такие как сетчатка, роговица и/или зрительный нерв. Указанный зкДНК-вектор может быть доставлен в спинномозговую жидкость (например, посредством люмбарной пункции). Указанный зкДНК-вектор может также быть интраваскулярно введен в ЦНС в ситуациях, когда гематоэнцефалический барьер был нарушен (например, при опухоли головного мозга или церебральном инфаркте).
[00240] Согласно некоторым вариантам реализации указанный зкДНК-вектор может быть введен в требуемую область или области ЦНС любым известным в данной области техники маршрутом, в том числе, но не ограничиваясь перечисленным, путем интратекальной, внутриглазной, интрацеребральной, интравентрикулярной, внутривенной (например, в присутствии сахара, такого как маннит), интраназальной, внутриушной, внутриглазной (например, интравитреально, субретинально, в переднюю камеру) и периокулярной (например, в субтеноново пространство) доставки, а также внутримышечной доставки с ретроградной доставкой в моторные нейроны.
[00241] Согласно некоторым вариантам реализации указанный зкДНК-вектор вводят в виде жидкого состава путем прямой инъекции (например, стереотаксической инъекции) в требуемую область или компартмент в ЦНС. Согласно другим вариантам реализации указанный зкДНК-вектор может быть введен путем местного нанесения на требуемую область, или путем интраназального введения аэрозольного состава. Введение в глаз может быть осуществлено путем местного нанесения жидких капель. В дополнительном альтернативном варианте зкДНК-вектор может быть введен в виде твердого состава для медленного высвобождения (см., например, патент США №7201898). Согласно другим дополнительным вариантам реализации указанный зкДНК-вектор может быть использован для ретроградного транспорта для лечения, облегчения и/или предотвращения заболеваний и нарушений, затрагивающих моторные нейроны (например, амиотрофического бокового склероза (ALS); спинальной мышечной атрофии (SMA) и т.п.). Например, указанный зкДНК-вектор может быть доставлен в мышечную ткань, из которой он может мигрировать в нейроны.
Лечение ex vivo
[00242] Согласно некоторым вариантам реализации клетки извлекают из субъекта, вводят в них зкДНК-вектор и возвращают в организм субъекта. Способы извлечения клеток из организма субъекта для лечения ex vivo, с последующим введением обратно в организм субъекта, известны в данной области техники (см., например, патент США №5399346, содержание которого полностью включено в настоящий документ). Как вариант, зкДНК-вектор вводят в клетки от другого субъекта, в культивированные клетки или в клетки из любого другого подходящего источника, и указанные клетки вводят нуждающемуся в этом субъекту.
[00243] Клетки, трансдуцированные зкДНК-вектором, предпочтительно вводят субъекту в «терапевтически эффективном количестве» в комбинации с фармацевтическим носителем. Специалистам в данной области техники будет понятно, что терапевтические эффекты не обязательно должны быть полными или обеспечивать излечение, при условии, что субъект получает некоторое преимущество.
[00244] Согласно некоторым вариантам реализации указанный зкДНК-вектор может кодировать трансген (иногда называемый гетерологичной нуклеотидной последовательностью) представляющий собой любой полипептид, продуцирование которого желательно в клетке in vitro, ex vivo или in vivo. Например, в отличие от применения указанных зкДНК-векторов в способе лечения, согласно некоторым вариантам реализации указанные зкДНК-векторы могут быть введены в культивированные клетки и экспрессируемый генный продукт выделен из них, например, для получения антигенов или вакцин.
[00245] Указанные зкДНК-векторы могут применяться как в ветеринарии, так и в медицине. Подходящие субъекты для применения способов доставки генов ex vivo согласно описанию выше включают как птиц (например, кур, уток, гусей, перепелок, индейку и фазана), так и млекопитающих (например, человека, крупный рогатый скот, овец, коз, лошадей, кошачьих, собачьих и зайцеобразных), при этом млекопитающие являются предпочтительными. Субъекты-люди являются наиболее предпочтительными. Субъекты-люди включают новорожденных, младенцев, молодых людей и взрослых.
[00246] Согласно некоторым вариантам реализации трансген в экспрессионной кассете, экспрессионной конструкции или зкДНК-векторе, описанных в настоящем документе, может быть кодон-оптимизирован для клетки-хозяина. В настоящем документе термин «кодон-оптимизированный» или «кодон-оптимизация» относится к способу модификации последовательности нуклеиновой кислоты для улучшения экспрессии в клетках представляющего интерес позвоночного животного, например, мыши или человека (например, гуманизированной), путем замены по меньшей мере одного, более одного или значимого числа кодонов естественной последовательности (например, прокариотической последовательности) кодонами, чаще или чаще всего используемыми в генах указанного позвоночного животного. У различных видов наблюдается конкретное смещение с предпочтением определенных кодонов для конкретной аминокислоты. Как правило, кодон-оптимизация не изменяет последовательность аминокислот исходного транслируемого белка. Оптимизированные кодоны могут быть определены с использованием, например, платформы для кодон-оптимизации и персонализированного синтеза генов от Aptagen Gene Forge® (Aptagen, Inc.) или другой базы данных в открытом доступе.
[00247] Согласно некоторым вариантам реализации указанный зкДНК-вектор экспрессирует трансген у субъекта клетки-хозяина. Согласно некоторым вариантам реализации указанный субъект клетка-хозяин представляет собой клетку-хозяина человека, включая, например, клетки крови, стволовые клетки, гематопоэтические клетки, CD34+ клетки, клетки печени, раковые клетки, клетки сосудов, мышечные клетки, клетки поджелудочной железы, нервные клетки или клетки сетчатки, эпителиальные или эндотелиальные клетки, дендритные клетки, фибробласты или любую другую клетку, происходящую из организма млекопитающих, включая, без ограничений, гепатоциты (т.е. клетки печени), клетки легких, клетки сердца, клетки поджелудочной железы, клетки ЖКТ, диафрагмальные клетки, ренальные (т.е. почечные) клетки, нервные клетки, клетки крови, клетки костного мозга, или клетки любой одной или более выбранных тканей субъекта, для которого предназначена генная терапия. Согласно одному аспекту субъект клетка-хозяин представляет собой клетку-хозяина человека.
[00248] Один аспект описанной в настоящем документе технологии относится к способу доставки трансгена в клетку. Как правило, в способах in vitro указанный зкДНК-вектор может быть введен в клетку с применением способов согласно описанию в настоящем документе, а также других способов, известных в данной области техники. ЗкДНК-векторы согласно описанию в настоящем документе предпочтительно вводят в клетку в биологически эффективном количестве. Если зкДНК-вектор вводят в клетку in vivo (например, субъекту), биологически эффективное количество указанного зкДНК-вектора представляет собой количество, достаточное для обеспечения трансдукции и экспрессии указанного трансгена в целевой клетке.
Диапазоны доз
[00249] Для облегчения идентификации оптимальных диапазонов дозировок для применения могут необязательно быть проведены анализы in vivo и/или in vitro. Точная доза для использования в составе также зависит от маршрута введения и серьезности состояния, и должна определяться на основании решения специалиста в данной области техники и с учетом обстоятельств каждого субъекта. Эффективные дозы могут быть экстраполированы на основании кривых зависимости ответа от дозы, полученных in vitro или в тестовых модельных системах на животных.
[00250] ЗкДНК-вектор вводят в достаточных количествах для трансфекции клеток требуемой ткани и для обеспечения достаточных уровней переноса генов и экспрессии без чрезмерных нежелательных явлений. Стандартные и фармацевтически приемлемые маршруты введения включают, не ограничиваясь перечисленными, описанные выше в разделе «Введение», такие как прямая доставка в выбранный орган (например, интрапортальная доставка в печень), пероральная, ингаляционная доставка (в том числе интраназальная и внутритрахеальная доставка), интраокулярная, внутривенная, внутримышечная, подкожная, внутрикожная, внутриопухолевая доставка; и другие маршруты для парентерального введения. Маршруты введения могут быть скомбинированы, если требуется.
[00251] Доза количества зкДНК-вектора, требуемая для достижения конкретного «терапевтического эффекта», варьирует в зависимости от ряда факторов, в том числе, но не ограничиваясь перечисленным: маршрута введения нуклеиновой кислоты, уровня экспрессии гена или РНК, требуемого для достижения терапевтического эффекта, специфического заболевания или нарушения, лечение которого проводят, и стабильности указанного гена или генов, РНК-продукта или продуктов, или итогового экспрессируемого белка или белков. Специалист в данной области техники может легко определить диапазон доз зкДНК-вектора для лечения пациента с конкретным заболеванием или нарушением на основании вышеупомянутых факторов, а также других факторов, хорошо известных в данной области техники.
[00252] Режим дозирования может быть скорректирован для обеспечения оптимального терапевтического ответа. Например, олигонуклеотид может быть введен неоднократно, например, ежедневно может вводиться несколько доз, или доза может быть пропорционально снижена с учетом диктуемой терапевтической ситуацией необходимости. Специалист в данной области техники легко сможет определить подходящие дозы и схемы введения рассматриваемых олигонуклеотидов, как для введения в клетки, так и для введения субъектам.
[00253] «Терапевтически эффективная доза» представлена относительно широким диапазоном, который может быть определен в клинических испытаниях и зависит от конкретного применения (нервные клетки требуют очень незначительных количеств, тогда как системные инъекции требуют значительных количеств). Например, для прямой инъекции in vivo в скелетную или сердечную мышцу субъекта-человека величина терапевтически эффективной дозы будет составлять приблизительно около 1 мкг - 100 г зкДНК-вектора. В тех случаях, когда для доставки зкДНК-вектора используют экзосомы или микрочастицы, терапевтически эффективная доза может быть определена экспериментальным путем, однако предположительно будет доставлено от 1 мкг до приблизительно 100 г вектора.
[00254] Получение составов фармацевтически приемлемых вспомогательных веществ и растворов-носителей хорошо известно специалистам в данной области техники, как и разработка подходящих схем дозирования и лечения для применения конкретных композиций, описанных в настоящем документе, в различных схемах лечения.
[00255] Для трансфекции in vitro эффективное количество зкДНК-вектора для доставки в клетки (1×106 клеток) составляет около 0,1-100 мкг зкДНК-вектора, предпочтительно от 1 до 20 мкг, более предпочтительно от 1 до 15 мкг, или от 8 до 10 мкг. Для зкДНК-векторов большего размера необходимы более высокие дозы. Если используются экзосомы или микрочастицы, эффективная in vitro доза может быть определена экспериментальным путем, однако должна предположительно обеспечивать доставку в общем такого же количества зкДНК-вектора.
[00256] Лечение может включать введение единственной дозы или нескольких доз. Согласно конкретным вариантам реализации для достижения требуемого уровня генной экспрессии может быть использовано более одного введения (например, два, три, четыре или более введений) с различными интервалами, например, ежедневно, еженедельно, ежемесячно, ежегодно и т.п. Согласно некоторым вариантам реализации субъекту может быть введено более одной дозы; фактически, при необходимости может быть введено несколько доз, поскольку зкДНК-вектор не вызывает у хозяина иммунного ответа против капсида ввиду отсутствия вирусного капсида. Соответственно, специалист в данной области техники может легко определить подходящее количество доз. Количество введенных доз может, например, составлять порядка 1-100, предпочтительно 2-20 доз.
[00257] Без связи с какой-либо конкретной теорией, отсутствие типичного противовирусного иммунного ответа, вызываемого введением зкДНК-вектора согласно описанию в настоящем документе (т.е. не содержащего компонентов капсида) позволяет неоднократно вводить указанный зкДНК-вектор хозяину. Согласно некоторым вариантам реализации число введений гетерологичной нуклеиновой кислоты субъекту составляет от 2 до 10 раз (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз). Согласно некоторым вариантам реализации зкДНК-вектор доставляют субъекту более 10 раз.
[00258] Согласно некоторым вариантам реализации дозу зкДНК-вектора вводят субъекту не чаще одного раза в календарный день (например, 24-часовой период). Согласно некоторым вариантам реализации дозу зкДНК-вектора вводят субъекту не чаще одного раза в 2, 3, 4, 5, 6 или 7 календарных дней. Согласно некоторым вариантам реализации дозу зкДНК-вектора вводят субъекту не чаще одного раза в календарную неделю (например, 7 календарных дней). Согласно некоторым вариантам реализации дозу зкДНК-вектора вводят субъекту не чаще одного раза в две недели (например, один раз за период продолжительностью две календарных недели). Согласно некоторым вариантам реализации дозу зкДНК-вектора вводят субъекту не чаще одного раза в календарный месяц (например, один раз в 30 календарных дней). Согласно некоторым вариантам реализации дозу зкДНК-вектора вводят субъекту не чаще одного раза за шесть календарных месяцев. Согласно некоторым вариантам реализации дозу зкДНК-вектора вводят субъекту не чаще одного раза в календарный год (например, 365 дней или 366 дней в високосном году).
Единичные лекарственные формы
[00259] Согласно некоторым вариантам реализации указанные фармацевтические композиции могут быть удобным образом представлены в виде единичной лекарственной формы. Единичная лекарственная форма, как правило, адаптирована для одного или более специфических маршрутов введения фармацевтической композиции. Согласно некоторым вариантам реализации указанная единичная лекарственная форма адаптирована для введения путем ингаляции. Согласно некоторым вариантам реализации указанная единичная лекарственная форма адаптирована для введения с помощью испарителя. Согласно некоторым вариантам реализации указанная единичная лекарственная форма адаптирована для введения с помощью небулайзера. Согласно некоторым вариантам реализации указанная единичная лекарственная форма адаптирована для введения с помощью генератора аэрозоля. Согласно некоторым вариантам реализации указанная единичная лекарственная форма адаптирована для перорального введения, для буккального введения или для сублингвального введения. Согласно некоторым вариантам реализации указанная единичная лекарственная форма адаптирована для внутривенного, внутримышечного или подкожного введения. Согласно некоторым вариантам реализации указанная единичная лекарственная форма адаптирована для интратекального или интрацеребровентрикулярного введения. Согласно некоторым вариантам реализации указанная фармацевтическая композиция введена в состав для местного введения. Количество активного ингредиента, которое может быть скомбинировано с материалом носителя для получения единичной лекарственной формы, обычно представлено таким количеством указанного соединения, которое обеспечивает терапевтический эффект.
Получение липидных наночастиц
[00260] Липидные наночастицы могут спонтанно формироваться при смешивании зкДНК и липида или липидов. В зависимости от требуемого распределения размеров частиц, итоговая смесь с наночастицами может быть экструдирована через мембрану (например, с отсечением по размеру 100 нм) с применением, например, экструдера типа Thermobarrel, такого как Lipex Extruder (Northern Lipids, Inc). В некоторых случаях этап экструзии может быть пропущен. Удаление этанола и одновременная замена буфера может осуществляться путем, например, диализа или тангенциальной поточной фильтрации.
[00261] В целом, липидные наночастицы могут быть получены любым способом, известным в данной области техники. Например, липидные наночастицы могут быть получены с применением способов описанных, например, в US 2013/0037977, US 2010/0015218, US 2013/0156845, US 2013/0164400, US 2012/0225129 и US 2010/0130588, содержание каждого из которых включено в настоящий документ полностью посредством ссылки. Согласно некоторым вариантам реализации липидные наночастицы могут быть получены с применением способа непрерывного смешивания, процесса прямого разведения или разведения в поточной линии. Способы и аппараты для получения липидных наночастиц с применением процессов прямого разведения или разведения в поточной линии описаны в US 2007/0042031, содержание которого включено в настоящий документ полностью посредством ссылки. Способы и аппараты для получения липидных наночастиц с применением процессов ступенчатого разведения описаны в US 2004/0142025, содержание которого включено в настоящий документ полностью посредством ссылки.
[00262] В одном неограничивающем примере указанные липидные наночастицы могут быть получены с применением способа ударного распыления. Обычно частицы получают путем смешивания липидов, растворенных в спирте (например, этаноле), с зкДНК, растворенной в буфере, например, цитратном буфере, натрий-ацетатном буфере, буфере с ацетатом натрия и хлоридом магния, буфере с яблочной кислотой, буфере с яблочной кислотой и хлоридом натрия; или буфере с цитратом натрия и хлоридом натрия. Соотношение липидных и зкДНК-компонентов смеси может составлять приблизительно 45-55% липидов и приблизительно 65-45% зкДНК.
[00263] Раствор липидов может содержать ионизируемый липид, некатионный липид (например, фосфолипид, такой как DPSC), ПЭГ или конъюгированную с ПЭГ молекулу (например, ПЭГ-липид) и стерол (например, холестерин) при общей концентрации липидов 5-30 мг/мл, более вероятно - 5-15 мг/мл, наиболее вероятно - 9-12 мг/мл, в спирте, например, в этаноле.
[00264] В растворе липидов относительное молярное содержание липидов может варьировать от приблизительно 25% до 98% для катионного липида, предпочтительно составляя приблизительно 35-65%; от приблизительно 0% до 15% для неионогенного липида, предпочтительно составляя приблизительно 0-12%; от приблизительно 0% до 15% для ПЭГ или конъюгированной с ПЭГ молекулой, предпочтительно составляя приблизительно 1-6%; и от приблизительно 0% до 75% для стерола, предпочтительно составляя приблизительно 30-50%.
[00265] Раствор зкДНК может содержать зкДНК в диапазоне концентраций от 0,3 до 1,0 мг/мл, предпочтительно, 0,3-0,9 мг/мл в забуференном растворе, при рН в диапазоне 3,5-5.
[00266] Для образования ЛНЧ в одном примере неограничивающего варианта реализации указанные две жидкости нагревают до температуры в диапазоне приблизительно 15-40°С, предпочтительно приблизительно 30-40°С, после чего перемешивают, например, в ударно-распылительном смесителе, с немедленным образованием ЛНЧ. Скорость потока при смешивании может варьировать в диапазоне 10-600 мл/мин. Внутренний диаметр (ВД) трубок может варьировать в диапазоне от 0,25 до 1,0 мм, а общая скорость потока в диапазоне 10-600 мл/мин. Комбинация скорости потока и ВД трубок может обеспечивать контроль размера частиц ЛНЧ в диапазоне от 30 до 200 нм. Затем раствор может быть смешан с забуференным раствором с более высоким значением рН при соотношении компонентов смеси в диапазоне от 1:1 до 1:3 по объему, предпочтительно, приблизительно 1:2 по объему. При необходимости указанный забуференный раствор может иметь температуру в диапазоне от 15-40°С или 30-40°С. Затем может быть проведен этап анионообменной фильтрации смеси с ЛНЧ. До проведения анионного обмена смесь с ЛНЧ может быть инкубирована на протяжении некоторого периода времени, например, от 30 минут до 2 часов. Температура во время инкубации может быть установлена в диапазоне 15-40°С или 30-40°С. После инкубации раствор фильтруют через фильтр, например, с размером пор 0,8 мкм, осуществляя при этом этап анионообменного разделения. В указанном способе могут использоваться трубки с ВД в диапазоне от 1 мм до 5 мм и скорость потока от 10 до 2000 мл/мин.
[00267] После получения ЛНЧ может быть проведена их концентрация и диафильтрация с применением процесса ультрафильтрации, в ходе которого происходит удаление спирта и замена буфера на итоговый буферный раствор, например, забуференный фосфатом солевой раствор (ФСБ) с рН, приблизительно равным 7, например, приблизительно 6,9, приблизительно 7,0, приблизительно 7,1, приблизительно 7,2, приблизительно 7,3 или приблизительно 7,4.
[00268] Для процесса ультрафильтрации может быть использован формат тангенциальной поточной фильтрации (TFF) с применением мембраны с номинальным отсечением по молекулярной массе от 30 до 500 КДа. Формат мембраны - половолоконная или плоская кассета. В процессе TFF с адекватным отсечением по молекулярной массе ЛНЧ может удерживаться в ретентате, а фильтрат или пермеат содержит ненужные спирт, цитратный буфер и итоговый буфер. Процесс TFF является многоэтапным, с увеличением исходной концентрации зкДНК до концентрации 1-3 мг/мл. После концентрации проводят диафильтрацию раствора ЛНЧ с 10-20 объемами итогового буфера для удаления спирта и замены буфера. Затем материал может дополнительно сконцентрирован в 1-3 раза. Концентрированный раствор ЛНЧ может быть стерилизован фильтрацией.
зкДНК
[00269] Согласно различным вариантам реализации указанные зкДНК-векторы представляют собой бескапсидные линейные дуплексные молекулы ДНК, образованные непрерывной цепью комплементарной ДНК с ковалентно замкнутыми концами (линейная, непрерывная и бескапсидная структура), которые содержат последовательность инвертированного 5'-концевого повтора (ITR) и последовательность 3'-ITR, отличающиеся друг от друга, или асимметричные относительно друг друга. По меньшей мере один из ITR содержит функциональный сайт концевого разрешения и сайт связывания белка репликации (RPS) (иногда называемый сайтом связывания репликативного белка), например, сайт связывания Rep. Обычно зкДНК-вектор содержит по меньшей мере одну модифицированную последовательность инвертированного концевого повтора (ITR) AAV, т.е. делецию, инсерцию и/или замену относительно другого ITR, и экспрессируемый трансген.
[00270] Согласно одному варианту реализации по меньшей мере один из ITR представляет собой ITR AAV, например, ITR AAV дикого типа. Согласно одному варианту реализации по меньшей мере один из ITR представляет собой ITR, модифицированный относительно другого ITR то есть зкДНК содержит ITR, асимметричные друг относительно друга. Согласно одному варианту реализации по меньшей мере один из ITR представляет собой нефункциональный ITR.
[00271] Согласно некоторым вариантам реализации указанный зкДНК-вектор содержит: (1) экспрессионную кассету, содержащую цис-регуляторный элемент, промотор и по меньшей мере один трансген; или (2) промотор, функционально связанный по меньшей мере с одним трансгеном; и (3) две самокомплементарных последовательности, например, ITR, фланкирующих указанную экспрессионную кассету, при этом указанный зкДНК-вектор не ассоциирован с капсидным белком. Согласно некоторым вариантам реализации указанный зкДНК-вектор содержит две самокомплементарных последовательности, обнаруживаемых в геноме AAV, из которых по меньшей мере одна содержит функциональный Rep-связывающий элемент (RBE) (также иногда называемый в настоящем документе «RBS») и сайт концевого разрешения (trs) AAV, или функциональный вариант RBE, и один или более цис-регуляторных элементов, функционально связанных с трансгеном. Согласно некоторым вариантам реализации указанный зкДНК-вектор содержит дополнительные компоненты для регуляции экспрессии трансгена, например, регуляторные переключатели для контроля и регуляции экспрессии указанного трансгена, и может включать регуляторный переключатель, который представляет собой «аварийный выключатель», обеспечивающий контролируемую клеточную смерть клетки, содержащей зкДНК-вектор.
[00272] Согласно некоторым вариантам реализации указанные две самокомплементарных последовательности могут представлять собой последовательности ITR из любого известного парвовируса, например, депендовируса, такого как AAV (например, AAV1-AAV12). Может применяться любой серотип AAV, в том числе, но не ограничиваясь перечисленным, модифицированная последовательность ITR AAV2, сохраняющая Rep-связывающий сайт (RBS), такой как 5'-GCGCGCTCGCTCGCTC-3' (SEQ ID NO: 531), и сайт концевого разрешения (trs), наряду с вариабельной палиндромной последовательностью, обеспечивающей образование шпилечной вторичной структуры. Согласно некоторым вариантам реализации ITR может быть синтетическим. Согласно одному варианту реализации синтетический ITR основан на последовательностях ITR из более чем одного серотипа AAV. Согласно другому варианту реализации синтетический ITR не включает последовательности на основе AAV. Согласно еще одному варианту реализации синтетический ITR сохраняет структуру ITR, описанную выше, хотя и содержит только некоторую часть или не содержит происходящей из AAV последовательности. Согласно некоторым аспектам синтетический ITR может преимущественно взаимодействовать с Rep дикого типа или Rep специфического серотипа, или, в некоторых случаях, синтетический ITR не распознает Rep дикого типа и распознает только мутированный Rep. Согласно некоторым вариантам реализации указанный ITR представляет собой синтетическую последовательность ITR, сохраняющую функциональный сайт связывания Rep (RBS), такой как 5'-GCGCGCTCGCTCGCTC-3' (SEQ ID NO: 531) и сайт концевого разрешения (TRS) наряду с вариабельной палиндромной последовательностью, обеспечивающей образование шпилечной вторичной структуры. Согласно некоторым примерам модифицированная последовательность ITR сохраняет последовательность RBS, trs, и структуру и положение Rep-связывающего элемента, образующего концевую петлевую часть шпилечной вторичной структуры одной из ITR из соответствующей последовательности ITR AAV2 дикого типа. Примеры последовательностей ITR для применения в зкДНК-векторах раскрыты в таблицах 2-9, 10А и 10В, SEQ ID NO: 2, 52, 101-449 и 545-547, и в частичных последовательностях ITR, представленных на фиг. 26А-26В РСТ-заявки №PCT/US18/49996, поданной 7 сентября 2018 г. Согласно некоторым вариантам реализации зкДНК-вектор может содержать ITR с модификацией в ITR, соответствующей любой из модификаций в последовательностях ITR или частичных последовательностях ITR, представленных в любой одной или более из таблиц 2, 3, 4, 5, 6, 7, 8, 9, 10А и 10В РСТ-заявки №PCT/US18/49996, поданной 7 сентября 2018 г.
[00273] Согласно некоторым вариантам реализации указанный вектор с ДНК с замкнутыми концами содержит промотор, функционально связанный с трансгеном, причем зкДНК не содержит капсидных белков и: (а) получена из зкДНК-плазмиды, которая кодирует мутированный правый ITR AAV2 с тем же числом внутримолекулярных дуплексных пар оснований, что и SEQ ID NO: 2, или мутированный левый ITR AAV2 с тем же числом внутримолекулярных дуплексных пар оснований, что и SEQ ID NO: 51, в шпилечной вторичной конфигурации (предпочтительно, исключая делецию какой-либо концевой петли AAA или ТТТ в указанной конфигурации относительно указанных референсных последовательностей); и (b) идентифицирована как зкДНК с применением анализа для идентификации зкДНК путем электрофореза в агарозном геле в нативных и денатурирующих условиях согласно примеру 1.
[00274] Указанные зкДНК-векторы могут быть получены с применением ряда способов, известных специалисту в данной области техники, после прочтения настоящего описания.. Например, бескапсидный невирусный ДНК-вектор может быть получены из плазмиды (называемой в настоящем документе «зкДНК-плазмидой»), содержащей полинуклеотидную матрицу экспрессионной конструкции, содержащую в указанном порядке: первый инвертированный 5'-концевой повтор (например, ITR AAV); экспрессионную кассету; и 3'-ITR (например, ITR AAV), при этом по меньшей мере один из 5'- и 3'-ITR представляет собой модифицированный ITR, или если модифицированы оба ITR, 5' и 3', они содержат отличающиеся модификации и их последовательности не одинаковы. Без ограничений, полинуклеотидная матрица экспрессионной конструкции, используемая для получения зкДНК-векторов, может представлять собой зкДНК-плазмиду, зкДНК-бакмиду и/или зкДНК-бакуловирус. Согласно некоторым вариантам реализации зкДНК-плазмида содержит сайт рестрикции для клонирования (например, SEQ ID NO: 7), функционально расположенный между ITR, куда может быть инсертирована экспрессионная кассета, которая содержит, например, промотор, функционально связанный с трансгеном, например, репортерный ген и/или терапевтический ген).
[00275] Например, невирусные бескапсидные ДНК-векторы могут быть продуцированы в пермиссивных клетках-хозяев ах с экспрессионной конструкции (например, плазмиды, бакмиды, бакуловируса; или линией клеток в интегрированном состоянии), содержащей гетерологичный ген, расположенный между двумя разными последовательностями инвертированных концевых повторов (ITR). По меньшей мере один из ITR модифицирован путем делеции, инсерции и/или замены относительно последовательности ITR дикого типа (например ITR AAV); и по меньшей мере один из ITR содержит функциональный сайт концевого разрешения (trs) и сайт связывания Rep. Указанный зкДНК-вектор предпочтительно является дуплексным, например, самокомплементарным, на протяжении по меньшей мере части молекулы, такой как экспрессионная кассета. Например, зкДНК не является двуцепочечной кольцевой молекулой. Согласно некоторым вариантам реализации указанный зкДНК-вектор имеет ковалентно замкнутые концы и, соответственно, устойчив к расщеплению экзонуклеазой (например, экзонуклеазой I или экзонуклеазой III), например, на протяжении часа при 37°С.
[00276] Согласно некоторым вариантам реализации зкДНК-вектор содержит, в направлении от 5' к 3': первый инвертированный концевой повтор (ITR) аденоассоциированного вируса (AAV), представляющую интерес нуклеотидную последовательность (например, экспрессионную кассету согласно описанию в настоящем документе) и второй ITR AAV, при этом первый ITR и второй ITR являются асимметричными друг относительно друга, то есть отличаются друг от друга. В примере варианта реализации первый ITR может представлять собой ITR дикого типа и второй ITR может представлять собой мутированный или модифицированный ITR. Согласно некоторым вариантам реализации первый ITR может представлять собой мутированный или модифицированный ITR, а второй ITR - ITR дикого типа. Согласно другому варианту реализации и первый ITR, и второй ITR модифицированы, однако имеют разные последовательности, или содержат разные модификации, или представляют собой модифицированные не идентичным образом ITR. Другими словами, указанные ITR являются асимметричными, в том смысле, что какие-либо изменения в одном ITR не отражаются на другом ITR; или, как вариант, где ITR отличаются друг от друга.
[00277] Согласно некоторым вариантам реализации экспрессионная кассета локализована между двумя ITR, содержащимися вместе с чем-либо одним или более из перечисленного, в следующем порядке: промотор, функционально связанный с трансгеном, посттранскрипционный регуляторный элемент; и сигнал полиаденилирования и терминации. Согласно одному варианту реализации указанный промотор является регулируемым: индуцируемым или репрессируемым. Указанный промотор может представлять собой любую последовательность, которая облегчает транскрипцию трансгена. Согласно одному варианту реализации указанный промотор представляет собой промотор CAG (например SEQ ID NO: 03) или его вариант. Указанный посттранскрипционный регуляторный элемент представляет собой последовательность который модулирует экспрессию трансгена, в неограничивающем примере любую последовательность, которая образует третичную структуру, которая усиливает экспрессию трансгена.
[00278] Как правило, зкДНК-векторы не имеют связанных с упаковкой ограничений, налагаемых ограниченным пространством внутри вирусного капсида. ЗкДНК-векторы представляют собой жизнеспособную альтернативу для продуцирования у эукариот вместо продуцирования у прокариот с плазмидных ДНК-векторов, в отличие от инкапсулированных геномов AAV. Это позволяет инсертировать контрольные элементы, например, регуляторные переключатели согласно описанию в настоящем документе, большие трансгены, несколько трансгенов и т.п.
[00279] Согласно некоторым вариантам реализации указанный первый ITR может представлять собой мутированный или модифицированный ITR, а второй ITR ITR дикого типа. Согласно другому варианту реализации оба ITR, и первый, и второй, модифицированы, однако представляют собой разные последовательности или содержат разные модификации, или представляют собой модифицированные не идентичным образом ITR. Другими словами, указанные ITR являются асимметричными, в том смысле, что какие-либо изменения в одном ITR не отражаются на другом ITR; или, как вариант, где ITR отличаются друг от друга. Примеры ITR в зкДНК-векторе и для применения при получении зкДНК-плазмиды раскрыты в РСТ-заявке PCT/US18/49996, поданной 7 сентября 2018 г.
[00280] Хотя иллюстративные ITR в описании и примерах в настоящем документе представляют собой ITR AAV2, специалисту в данной области техники известно, что, как было указано выше, могут быть использованы ITR любого известного парвовируса, например, депендовируса, такого как AAV (например, из генома AAV1, AAV2, AAV3, AAV4, AAV5, AAV 5, AAV7, AAV8, AAV9, AAV10, AAV 11, AAV12, AAVrh8, AAVrh10, AAV-DJ и AAV-DJ8. Например, NCBI: NC 002077; NC 001401; NC001729; NC001829; NC006152; NC 006260; NC 006261), химерные ITR или ITR из любого синтетического AAV. Согласно некоторым вариантам реализации указанный AAV может инфицировать теплокровных животных, как, например, аденоассоциированные вирусы птиц (AAAV), бычьих (BAAV), собачьих, лошадиных и овечьих. Согласно некоторым вариантам реализации указанный ITR взят из парвовируса В19 (№ доступа GenBank NC 000883), мелкого вируса мышей (MVM) (№доступа GenBank NC 001510); парвовируса гусей (№ доступа GenBank NC 001701); парвовируса змей 1 (№ доступа GenBank NC 006148).
[00281] Парвовирусы и другие представители семейства Parvoviridae в общем описаны в источнике: Kenneth I. Berns, "Parvoviridae: The Viruses and Their Replication," Chapter 69 in FIELDS VIROLOGY (3d Ed. 1996).
[00282] Среднему специалисту в данной области техники известно, что последовательности ITR устроены одинаково и содержат двуцепочечную структуру Холлидея, которая, как правило, представляет собой Т-образную или Y-образную шпилечную структуру (см., например, фиг. 2А и фиг. 3А), при этом каждый ITR образован двумя палиндромными плечами или петлями (В-B и С-С), погруженными в палиндромное плечо большего размера (А-А'), и одноцепочечной последовательностью D (где порядок указанных палиндромных последовательностей определяет поворот ориентации ITR); можно легко определить соответствующие модифицированные последовательности ITR из любого серотипа AAV для применения в зкДНК-векторе или зкДНК-плазмиде на основании примеров последовательностей ITR AAV2, предложенных согласно настоящему изобретению. См., например, описание структурного анализа и сравнения последовательностей ITR из разных серотипов AAV (AAV1-AAV6) в источниках: Grimm et al., J. Virology, 2006; 80(1); 426-439; Yan et al., J. Virology, 2005; 364-379; Duan et al., Virology 1999; 261; 8-14. Примеры специфических изменений и мутаций в ITR описаны подробно в РСТ-заявке PCT/US18/49996, поданной 7 сентября 2018 г. Для ясности, в контексте ITR «измененный» или «мутированный» показывает, что нуклеотиды были инсертированы, делетированы и/или заменены относительно дикого типа, референсной или исходной последовательности ITR, и могут быть изменены относительно другого фланкирующего ITR в зкДНК-векторе, содержащем два фланкирующих ITR. Измененный или мутированный ITR может представлять собой сконструированный ITR. В настоящем документе «сконструированный» относится к аспекту, подвергнутому манипуляциям, осуществляемым руками человека. Например, полипептид считают «сконструированным», если по меньшей мере в одном аспекте указанный полипептид, например, его последовательность, был подвергнут манипуляциям, осуществляемым руками человека, таким образом, чтобы он отличался от существующего в природе в указанном аспекте.
[00283] Любой парвовирус ITR может применяться в качестве ITR или в качестве основы ITR для модификации. Предпочтительно, указанный парвовирус представляет собой депендовирус, более предпочтительно, AAV. Выбор серотипа может быть основан на тропизме указанного серотипа к ткани. AAV2 обладает тропизмом к широкому ряду тканей, AAV1 преимущественно нацелен на нервную ткань и скелетные мышцы, a AAV5 преимущественно нацелен на нервную ткань, пигментный эпителий сетчатки, и фоторецепторы. AAV6 преимущественно нацелен на скелетные мышцы и легкие. AAV8 преимущественно нацелен на печень, скелетные мышцы, сердце, и ткани поджелудочной железы. AAV9 преимущественно нацелен на печень, скелетные ткани и ткани легких. Согласно одному варианту реализации модифицированный ITR основан на ITR AAV2. Например, он выбран из группы, состоящей из: SEQ ID NO: 2 и SEQ ID NO: 52. Согласно одному варианту реализации каждого из указанных аспектов векторного полинуклеотида содержит пару ITR, выбранную из группы, состоящей из: SEQ ID NO: 1 и SEQ ID NO: 52; и SEQ ID NO: 2 и SEQ ID NO: 51. Согласно одному варианту реализации каждого из указанных аспектов векторный полинуклеотид или невирусные бескапсидные ДНК-векторы с ковалентно-замкнутыми концами содержат пару разных ITR, выбранных из группы, состоящей из: SEQ ID NO: 101 и SEQ ID NO: 102; SEQ ID NO: 103, и SEQ ID NO: 104, SEQ ID NO: 105, и SEQ ID NO: 106; SEQ ID NO: 107, и SEQ ID NO: 108; SEQ ID NO: 109, и SEQ ID NO: 110; SEQ ID NO:111, и SEQ ID NO: 112; SEQ ID NO: 113 и SEQ ID NO: 114; и SEQ ID NO: 115 и SEQ ID NO: 116. Согласно некоторым вариантам реализации модифицированный ITR выбирают из любых из SEQ ID NO: 2, 52, 63, 64, 101 499, и они раскрыты в РСТ-заявке №PCT/US18/49996, поданной 7 сентября 2018 г. Согласно некоторым вариантам реализации зкДНК-вектор не содержит модифицированного ITR, выбранного из любой последовательности, состоящей или состоящей по существу из: SEQ ID NO: 500-529 согласно настоящему документу. Согласно некоторым вариантам реализации зкДНК-вектор не содержит ITR, выбранного из любой последовательности, выбранной из SEQ ID NO: 500-529.
[00284] Согласно некоторым вариантам реализации зкДНК может образовывать внутримолекулярную дуплексную вторичную структуру. Примеры вторичной структуры первого ITR и асимметричного второй ITR приведены в контексте ITR дикого типа (см., например, фиг. 2А, 3А и 3С) и модифицированных структур ITR (см., например, фиг. 2В, 3В и 3D). Вторичные структуры выводят или предсказывают на основании последовательностей ITR плазмиды, используемых для получения зкДНК-вектора.
[00285] Согласно некоторым вариантам реализации левый ITR зкДНК-вектора модифицирован или мутирован относительно структуры ITR AAV дикого типа (wt), а правый ITR представляет собой ITR дикого типа. Согласно одному варианту реализации правый ITR зкДНК-вектора модифицирован мутирован относительно структуры ITR AAV дикого типа, а левый ITR представляет собой ITR AAV дикого типа. Согласно таким вариантам реализации модификация ITR (например, левого или правого ITR) может быть получена путем делеции, инсерции или замены одного или более нуклеотидов в ITR дикого типа, происходящем из генома AAV.
[00286] ITR, применяемые согласно настоящему изобретению, могут быть разрешаемыми и неразрешаемыми, и для применения в зкДНК-векторах предпочтительно выбирают последовательности AAV, при этом предпочтительными являются серотипы 1, 2, 3, 4, 5, 6, 7, 8 и 9. Для разрешаемых ITR AAV не нужна последовательность ITR дикого типа (например, эндогенная последовательность или последовательность ITR AAV дикого типа может быть изменена путем инсерции, делеции, усечения и/или миссенс-мутаций), при условии, что концевой повтор опосредует требуемые функции, например, репликацию вируса, упаковку вируса, интеграцию вируса и/или спасение провируса, и т.п. Как правило, хотя не обязательно, TR взяты из одного серотипа AAV, например, обе последовательности ITR указанного зкДНК-вектора взяты из AAV2. Указанные ITR могут представлять собой синтетические последовательности, которые функционируют как инвертированные концевые повторы AAV. Хотя это и не обязательно, ITR могут быть взяты из одного и того же парвовируса, например, обе последовательности ITR взяты из AAV2.
[00287] Согласно некоторым вариантам реализации по меньшей мере один из ITR представляет собой дефектный ITR в отношении связывания Rep и/или никирования Rep. Согласно одному варианту реализации указанный дефект заключается по меньшей мере в 30% снижении относительно ITR дикого типа, согласно другим вариантам реализации он заключается в снижении по меньшей мере на 35%…, 50%…, 65%…, 75%…, 85%…, 90%…, 95%…, 98%…, или полном отсутствии функции, или в любой промежуточной степени снижения. Клетки-хозяева не экспрессируют белки вирусного капсида, и матрица векторного полинуклеотида не содержит каких-либо кодирующих вирусный капсид последовательностей. Согласно одному варианту реализации матрицы векторного полинуклеотида и клетки-хозяева, которые не содержат генов капсида AAV, и итоговый белок также не кодируют и не экспрессируют гены капсидов других вирусов. Кроме того, согласно конкретному варианту реализации молекула нуклеиновой кислоты также не содержит кодирующих последовательностей белка Rep AAV.
[00288] Согласно некоторым вариантам реализации структурный элемент ITR может быть представлен любым структурным элементом, который вовлечен в функциональное взаимодействие ITR с большим белком Rep (например, Rep 78 или Rep 68). Согласно некоторым вариантам реализации указанный структурный элемент обеспечивает селективность взаимодействия ITR с большим белком Rep, т.е. определяет, по меньшей мере отчасти, какой белок Rep функционально взаимодействует с ITR. Согласно другим вариантам реализации указанный структурный элемент физически взаимодействует с большим белком Rep при связывании указанного белка Rep с ITR. Каждый структурный элемент может представлять собой, например, вторичную структуру ITR, нуклеотидную последовательность ITR, промежуток между двумя или более элементами; или комбинацию чего-либо из перечисленного. Согласно одному варианту реализации указанные структурные элементы выбраны из группы, состоящей из плеча А и плеча А', плеча В и плеча В', плеча С и плеча С, плеча D, сайта связывания Rep (RBE) и RBE' (т.е. комплементарной RBE последовательности), и сайта концевого разрешения (trs)
[00289] Более конкретно, способность структурного элемента к функциональному взаимодействию с конкретным большим белком Rep может быть изменена путем модификации указанного структурного элемента. Например, нуклеотидная последовательность структурного элемента может быть модифицирована относительно последовательности ITR дикого типа. Согласно одному варианту реализации указанный структурный элемент (например, плечо А, плечо А', плечо В, плечо В', плечо С, плечо С, плечо D, RBE, RBE' и trs) ITR может быть удален и заменен структурным элементом дикого типа из другого парвовируса. Например, структура для замены может быть взята из AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAV13, парвовируса змей (например, парвовируса королевского питона), парвовируса бычьих, парвовируса коз, парвовируса птиц, парвовирус собачьих, парвовируса лошадиных, парвовируса креветок, свиного парвовируса или AAV насекомых. Например, ITR может представлять собой ITR AAV2, а плечо А или А', или RBE могут быть заменены структурным элементом из AAV5. Согласно другому примеру ITR может представлять собой ITR AAV5, а плечи С или С, RBE и trs могут быть заменены структурным элементом из AAV2. Согласно другому примеру ITR AAV может представлять собой ITR AAV5, где плечи В и В' заменены плечами В и В' ITR AAV2.
[00290] Согласно некоторым вариантам реализации нуклеотидная последовательность структурного элемента может быть модифицирована (например, путем модификации 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20, или более нуклеотидов, или любого числа нуклеотидов в имеющемся диапазоне) для получения модифицированного структурного элемента.
[00291] Согласно некоторым вариантам реализации структура указанного структурного элемента может быть модифицирована. Например, в структурном элементе изменяют высоту стебля и/или число нуклеотидов в петле. Например, высота стебля может составлять приблизительно 2, 3, 4, 5, 6, 7, 8 или 9 нуклеотидов, или более, или соответствовать любому числу в имеющемся диапазоне. Согласно одному варианту реализации высота стебля может составлять от приблизительно 5 нуклеотидов до приблизительно 9 нуклеотидов, и он функционально взаимодействует с Rep. Согласно другому варианту реализации высота стебля может составлять приблизительно 7 нуклеотидов, и он функционально взаимодействует с Rep.. Согласно другому примеру петля может содержать 3, 4, 5, 6, 7, 8, 9 или 10 нуклеотидов, или более, или любое число нуклеотидов в имеющемся диапазоне.
[00292] Согласно другому варианту реализации число сайтов связывания GAGY или связанных с GAGY сайтов связывания в пределах RBE или расширенного RBE может быть увеличено или уменьшено. Согласно одному примеру RBE или расширенный RBE может содержать 1, 2, 3, 4, 5 или 6, или более сайтов связывания GAGY, или любое число сайтов связывания в имеющемся диапазоне. Каждый сайт связывания GAGY может независимо представлять собой точную последовательность GAGY или последовательность, аналогичную GAGY при условии, что указанная последовательность является достаточной для связывания белков Rep.
[00293] Согласно некоторым вариантам реализации промежуток между двумя элементами (например, не ограничиваясь указанным, RBE и шпилькой) может быть изменен (например, увеличен или уменьшен) для изменения функционального взаимодействия с большим белком Rep. Например, указанный промежуток может составлять приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 нуклеотидов или более, или содержать любое число нуклеотидов в имеющемся диапазоне.
[00294] На фиг. 2А и 2В представлен один возможный механизм действия сайта trs в пределах структуры дикого типа ITR-части зкДНК-вектора. Согласно некоторым вариантам реализации указанный зкДНК-вектор содержит одну или более функциональных последовательностей полинуклеотидов ITR, которые содержат Rep-связывающий сайт (RBS; 5'-GCGCGCTCGCTCGCTC-3' (SEQ ID NO: 531) для AAV2) и сайт концевого разрешения (TRS; 5'-AGTT (SEQ ID NO: 46)). Согласно некоторым вариантам реализации по меньшей мере один ITR (wt или модифицированный ITR) является функциональным. Согласно альтернативным вариантам реализации в тех случаях, когда зкДНК-вектор содержит два модифицированных ITR, которые отличаются друг от друга или асимметричны друг относительно друга, по меньшей мере один модифицированный ITR является функциональным и по меньшей мере один модифицированный ITR является нефункциональным.
[00295] Согласно некоторым вариантам реализации модифицированный ITR (например, левый или правый ITR) описанного в настоящем документе зкДНК-вектора содержит модификации в плече петли, усеченном плече или спейсере. Примеры последовательностей ITR с модификациями в плече петли, усеченном плече или спейсере приведены в таблицах 2-9, 10А и 10В РСТ-заявки PCT/US18/49996, поданной 7 сентября 2018 г.
[00296] Указанные зкДНК-векторы могут быть продуцированы с экспрессионных конструкций, которые дополнительно содержат специфическую комбинацию цис-регуляторных элементов. Указанные цис-регуляторные элементы включают, не ограничиваясь перечисленными, промотор, рибопереключатель, инсулятор, миРНК-регулируемый элемент, посттранскрипционный регуляторный элемент, тканеспецифический и клеточноспецифический промотор и энхансер. Согласно некоторым вариантам реализации указанный ITR может действовать как промотор для трансгена. Согласно некоторым вариантам реализации указанный зкДНК-вектор содержит дополнительные компоненты для регуляции экспрессии указанного трансгена, например, регуляторные переключатели согласно описанию в РСТ-заявке №PCT/US18/49996, поданной 7 сентября 2018 г., для регуляции экспрессии указанного трансгена, или «аварийный выключатель», который может обеспечивать смерть клетки, содержащей зкДНК-вектор.
[00297] Экспрессионные кассеты могут также включать посттранскрипционный элемент для повышения экспрессии трансгена. Согласно некоторым вариантам реализации для повышения экспрессии трансгена применяют посттранскрипционный регуляторный элемент (WPRE) вируса гепатита сурков (WHP) (например, SEQ ID NO: 8). Могут применяться другие элементы посттранскрипционного процессинга, такие как посттранскрипционный элемент из гена тимидинкиназы вируса простого герпеса или вируса гепатита В (HBV). К трансгенам могут быть присоединены секреторные последовательности, например, последовательности VH-02 и VK-A26, например, SEQ ID NO: 25 и SEQ ID NO: 26. Экспрессионные кассеты могут включать последовательность полиаденилирования, известную в данной области техники, или ее вариант, например, встречающуюся в природе последовательность, выделенную из бычьего гормона роста BGHpA (например, SEQ ID NO: 74) или вируса SV40pA (например, SEQ ID NO: 10), или синтетическую последовательность (например, SEQ ID NO: 27). Некоторые экспрессионные кассеты могут также включать энхансерную 5'-последовательность позднего поли(А)-сигнала SV40 (USE). Согласно некоторым вариантам реализации USE может быть использован в комбинации с SV40pA или гетерологичным поли(А)-сигналом.
[00298] Указанная экспрессионная кассета может содержать более 4000 нуклеотидов, 5000 нуклеотидов, 10000 нуклеотидов или 20000 нуклеотидов, или 30000 нуклеотидов, или 40000 нуклеотидов или 50000 нуклеотидов, или любое количество от приблизительно 4000 до 10000 нуклеотидов, или 10000-50000 нуклеотидов, или более чем 50000 нуклеотидов. Согласно некоторым вариантам реализации указанная экспрессионная кассета может содержать трансген или нуклеиновую кислоту с длиной в диапазоне от 500 до 50000 нуклеотидов. Согласно некоторым вариантам реализации указанная экспрессионная кассета может содержать трансген или нуклеиновую кислоту с длиной в диапазоне от 500 до 75000 нуклеотидов. Согласно некоторым вариантам реализации указанная экспрессионная кассета может содержать трансген или нуклеиновую кислоту с длиной в диапазоне от 500 до 10000 нуклеотидов. Согласно некоторым вариантам реализации указанная экспрессионная кассета может содержать трансген или нуклеиновую кислоту с длиной в диапазоне от 1000 до 10000 нуклеотидов. Согласно некоторым вариантам реализации указанная экспрессионная кассета может содержать трансген или нуклеиновую кислоту с длиной в диапазоне от 500 до 50000 нуклеотидов. ЗкДНК-векторы не имеют ограничений по размеру, как заключенные в капсид AAV-векторы, и, соответственно, позволяют обеспечить доставку экспрессионной кассеты большого размера для обеспечения эффективной экспрессии трансгенов. Согласно некоторым вариантам реализации указанный зкДНК-вектор лишен специфического прокариотического метилирования. Согласно некоторым вариантам реализации длина экспрессионной кассеты в 5'-3' направлении больше известной максимальной длины для заключаемой в капсид вириона AAV последовательности. Согласно некоторым вариантам реализации указанная длина превышает 4,6 т.п.о., или превышает 5 т.п.о., или превышает 6 т.п.о., или превышает 7 т.п.о.
[00299] На фиг. 1А-1С приведены схематические изображения неограничивающих примеров зкДНК-векторов, или или соответствующая последовательность зкДНК-плазмид. ЗкДНК-векторы являются бескапсидными и могут быть получены с плазмиды, кодирующей, в указанном порядке: первый ITR, экспрессируемую трансгенную кассету и второй ITR, при этом по меньшей мере одна из последовательностей первого и/или второго ITR мутирована относительно соответствующей последовательности ITR AAV2 дикого типа. Указанная экспрессируемая трансгенная кассета предпочтительно включает, в указанном порядке, что-либо одно или более из перечисленного: энхансер/промотор, ORF-репортер (трансген), посттранскрипционный регуляторный элемент (например, WPRE); и сигнал полиаденилирования и терминации (например, поли(А) BGH).
[00300] Указанная экспрессионная кассета может содержать любой представляющий интерес трансген. Представляющие интерес трансгены включают, не ограничиваясь перечисленными, нуклеиновые кислоты, кодирующие полипептиды, или некодирующие нуклеиновые кислоты (например, РНК-интерференция, миРНК и т.п.), предпочтительно терапевтические (например, для медицинского, диагностического или ветеринарного применения) или иммуногенные (например, для вакцин) полипептиды. Согласно некоторым вариантам реализации трансген в экспрессионной кассете кодирует что-либо одно или более из полипептидов, пептидов, рибозимов, пептидных нуклеиновых кислот, киРНК, RNAi, антисмысловых олигонуклеотидов, антисмысловых полинуклеотидов, антител, антигенсвязывающих фрагментов; или любую комбинацию перечисленного. Согласно некоторым вариантам реализации указанный трансген представляет собой терапевтический ген или маркерный белок. Согласно некоторым вариантам реализации указанный трансген представляет собой агонист или антагонист. Согласно некоторым вариантам реализации указанный антагонист представляет собой миметик или антитело, или фрагмент антитела, или его антигенсвязывающий фрагмент, например, нейтрализующее антитело или фрагмент антитела, и т.п. Согласно некоторым вариантам реализации указанный трансген кодирует антитело, в том числе полноразмерное антитело или фрагмент антитела согласно определению в настоящем документе. Согласно некоторым вариантам реализации указанное антитело представляет собой антигенсвязывающий домен или последовательность вариабельного домена иммуноглобулина согласно определению в настоящем документе.
[00301] В частности, указанный трансген может кодировать один или более терапевтических агентов, в том числе, но не ограничиваясь перечисленными, например, белок ((белки), полипептид(ы), пептид(ы), фермент(ы), антитела, антигенсвязывающие фрагменты, а также их варианты и/или активные фрагменты, для применения в лечении, профилактике и/или для облегчения одного или более симптомов заболевания, дисфункции, повреждения и/или нарушения.
[00302] Многие структурные признаки отличают зкДНК-векторы от экспрессионных векторов на основе плазмид. ЗкДНК-векторы могут характеризоваться одним или более из следующих признаков: отсутствие исходной (т.е. не инсертированной) бактериальной ДНК, отсутствие прокариотической точки начала репликации, автономность, т.е. они не требуют наличия каких-либо последовательностей, кроме двух ITR, включающих Rep-связывающий сайт и сайт концевого разрешения (RBS и TRS), и экзогенной последовательности между указанными ITR, присутствие последовательностей ITR, которые образуют шпильки, эукариотического происхождения (т.е. они продуцируются в эукариотических клетках); и отсутствие метилирования ДНК бактериального типа или же любого другого метилирования, воспринимаемого как аномальное организмом хозяина-млекопитающего. В целом, предпочтительно, чтобы предложенные векторы не содержали какой-либо прокариотической ДНК, однако предусмотрена возможность инсерции какой-либо прокариотической ДНК в виде экзогенной последовательности, согласно неограничивающему примеру, в промоторной или энхансерной области. Другой важный признак, отличающий зкДНК-векторы от плазмидных экспрессионных векторов, заключается в том, что зкДНК-векторы представлены одноцепочечной линейной ДНК с замкнутыми концами, тогда как плазмиды всегда представлены двуцепочечной ДНК.
[00303] ЗкДНК-векторы предпочтительно имеют линейную и непрерывную структуру, а не прерывистую структуру, по оценке на основании результатов анализа с расщеплением рестрикционными ферментами (фиг. 4D). Линейная и непрерывная структура считается более стабильной при атаке клеточных эндонуклеаз, а также с меньшей вероятностью подвергается рекомбинации и вызывает мутагенез. Соответственно, зкДНК-вектор, имеющий линейную и непрерывную структуру, представляет собой предпочтительный вариант реализации. Непрерывный, линейный, одноцепочечный зкДНК-вектор с внутримолекулярными дуплексами может содержать ковалентно связанные концы, без последовательностей, кодирующих белки капсида AAV. Указанные зкДНК-векторы структурно отличаются от плазмид (в том числе зкДНК-плазмид, описанных в настоящем документе), которые представляют собой кольцевые дуплексные молекулы нуклеиновых кислот бактериального происхождения. Комплементарные цепи плазмид могут быть разделены после денатурации с получением двух молекул нуклеиновой кислоты, тогда как зкДНК-векторы, напротив, хотя и содержат комплементарные цепи, представляют собой одну молекулу ДНК и, соответственно, даже после денатурации остаются в виде одной молекулы. Согласно некоторым вариантам реализации зкДНК-векторы согласно описанию в настоящем документе могут быть получены без метилирования оснований ДНК прокариотического типа, в отличие от плазмид. Соответственно, зкДНК-векторы и зкДНК-плазмиды отличаются как структурой (в частности, линейной или кольцевой), так и способами, которые применяют для получения и очищения указанных отличающихся объектов (см. ниже), а также метилированием ДНК, которое происходит по прокариотическому типу в зкДНК-плазмидах и по эукариотическому типу в зкДНК-векторе.
[00304] Время извлечения и сбора ДНК-векторов, описанных в настоящем документе, из клеток может быть выбрано и оптимизировано так, чтобы обеспечить высокопродуктивное получение указанных ДНК-векторов. Например, время извлечения может быть выбрано с учетом жизнеспособности клеток, морфологии клеток, роста клеток и т.п. Как правило, клетки могут быть собраны через достаточное время после инфекции бакуловирусом для получения ДНК-векторов, но до начала гибели большинства клеток в результате токсичности вируса. ДНК-векторы могут быть выделены, например, с применением наборов для очищения плазмид, таких как наборы Endo-Free™ от Qiagen. Другие способы, разработанные для выделения плазмид, могут быть также адаптированы для ДНК-векторов. Как правило, может быть использован любой способ очищения нуклеиновых кислот.
[00305] Промоторы: ы. Подходящие промоторы, в том числе описанные выше, могут происходить из вирусов и могут, соответственно, называться вирусными промоторами, или они могут происходить из любого организма, в том числе прокариотических или эукариотических организмов. Подходящие промоторы могут применяться для управления экспрессией с применением любой РНК-полимер азы {например, pol I, pol II, pol III). Примеры промоторов включают, не ограничиваясь перечисленным, ранний промотор SV40, промотор из длинного концевого повтора вируса опухоли молочной железы мышей (LTR); аденовирусный большой поздний промотор (Ad MLP); промотор вируса простого герпеса (HSV), промотор цитомегаловируса (CMV), такой как область немедленного раннего промотора CMV (CMVIE), промотор вируса саркомы Рауса (RSV), промотор U6 малой ядерной РНК человека (U6, например, SEQ ID NO: 18) (Miyagishi et al., Nature Biotechnology 20, 497-500 (2002)), усиленный промотор U6 (например, Xia et al., Nucleic Acids Res. 2003 Sep.1; 31(17)), промотор H1 человека (H1) (например, SEQ ID NO: 19), промотор CAG, промотор альфа-1-антитрипсина человека (НААТ) (например, SEQ ID NO: 21), и т.п.Согласно вариантам реализации указанные промоторы изменяют на содержащем интрон 3'-конце таким образом, чтобы они включали один или более сайтов расщепления нуклеазами. Согласно вариантам реализации ДНК, содержащая сайт(ы) расщепления нуклеазой, является чужеродной для промотора ДНК.
[00306] Промотор может содержать одну или более специфических транскрипционных регуляторных последовательностей для дополнительного усиления экспрессии и/или для изменения пространственных и/или временных характеристик экспрессии. Промотор может также содержать дистальные энхансерные или репрессорные элементы, которые могут быть локализованы на расстоянии до нескольких тысяч пар оснований от сайта старта транскрипции. Промотор может происходить из источников, включающих вирусы, бактерии, грибы, растения, насекомых и животных. Промотор может регулировать экспрессию генного компонента конститутивно или избирательно применительно к клетке, ткани или органу, где происходит экспрессия, или с учетом стадии развития, на которой происходит экспрессия, или в ответ на внешние стимулы, такие как физиологические стрессы, патогены, ионы металлов или индуцирующие агенты. Репрезентативные примеры промоторов включают промотор бактериофага Т7, промотор бактериофага Т3, промотор SP6, лактозный оператор-промотор, tac-промотор, поздний промотор SV40, ранний промотор SV40, RSV-LTR-промотор, CMV IE-промотор, ранний промотор SV40 или поздний промотор SV40 и CMV IE-промотор, а также промоторы, перечисленные ниже. Такие промоторы и/или энхансеры могут применяться для экспрессии любого представляющего интерес гена, например, молекул редактирования генома, донорной последовательности, терапевтических белков и т.п.). Например, вектор может содержать промотор, который функционально связан с последовательностью нуклеиновой кислоты, кодирующей терапевтический белок. Указанный промотор, функционально связанный с кодирующей терапевтический белок последовательностью, может представлять собой промотор вируса обезьян 40 (SV40), промотор вируса опухоли молочной железы мышей (MMTV), промотор вируса иммунодефицита человека (HIV), например, промотор длинного концевого повтора (LTR) вируса иммунодефицита крупного рогатого скота (BIV), промотор вируса Молони, промотор вируса лейкоза птиц (ALV), промотор цитомегаловируса (CMV), такой как немедленный ранний промотор (IE) CMV, промотор вируса Эпштейна-Барр (EBV) или промотор вируса саркомы Рауса (RSV). Указанный промотор может также представлять собой промотор гена человека, например, убиквитина С человека (hUbC), актина человека, миозина человека, гемоглобина человека, креатина мышц человека или металлотионеина человека. Указанный промотор может также представлять собой тканеспецифический промотор, такой как печень-специфический промотор, например, альфа-1-антитрипсина человека (НААТ), естественный или синтетический. Согласно одному варианту реализации доставка в печень может быть достигнута с использованием специфического в отношении эндогенного АроЕ нацеливания композиции, содержащей зкДНК-вектор, в гепатоциты через рецептор липопротеинов низкой плотности (ЛПНП), имеющийся на поверхности гепатоцита.
[00307] Согласно одному варианту реализации используемый промотор представляет собой естественный промотор гена, кодирующего терапевтический белок. Промоторы и другие регуляторные последовательности соответствующих генов, кодирующих терапевтические белки, известны и были охарактеризованы. Используемая промоторная область может дополнительно включать одну или более дополнительных регуляторных последовательностей (например, естественных), таких как энхансеры (например, SEQ ID NO: 22 и SEQ ID NO: 23).
[00308] Неограничивающие примеры подходящих промоторов для применения в соответствии с настоящим изобретением включают промотор CAG, например, из (SEQ ID NO: 3), промотор НААТ (SEQ ID NO: 21), промотор EF1-α человека (SEQ ID NO: 6) или фрагмент промотора EF1a (SEQ ID NO: 15), и промотор EF1-α крысы (SEQ ID NO: 24).
[00309] Последовательности полиаденилирования: последовательность, кодирующая последовательность полиаденилирования, может быть включена в зкДНК-вектор для стабилизации мРНК, экспрессируемой с указанного зкДНК-вектора, и для содействия ядерному экспорту и трансляции. Согласно одному варианту реализации указанный зкДНК-вектор не содержит последовательности полиаденилирования. Согласно другим вариантам реализации указанный вектор включает по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 10, по меньшей мере 15, по меньшей мере 20, по меньшей мере 25, по меньшей мере 30, по меньшей мере 40, по меньшей мере 45, по меньшей мере 50 или более адениновых динуклеотидов. Согласно некоторым вариантам реализации указанная последовательность полиаденилирования содержит приблизительно 43 нуклеотида, приблизительно 40-50 нуклеотидов, приблизительно 40-55 нуклеотидов, приблизительно 45-50 нуклеотидов, приблизительно 35-50 нуклеотидов или любое количество нуклеотидов в диапазонах между указанными значениями.
[00310] Согласно некоторым вариантам реализации указанная зкДНК может быть получена из векторного полинуклеотида, который кодирует гетерологичную нуклеиновую кислоту, функционально расположенную между двумя разными последовательностями инвертированных концевых повторов (ITR) (например ITR AAV), отличающихся тем, что по меньшей мере один из указанных ITR содержит сайт концевого разрешения и сайт связывания репликативного белка (RPS), например, сайт связывания Rep (например, wt ITR AAV SEQ ID NO: 1 или SEQ ID NO: 2 для AAV2), и один из ITR содержит делецию, инсерцию и/или замену относительно другого ITR, например, функционального ITR.
[00311] Клетки-хозяева не экспрессируют белки вирусного капсида, и матрица векторного полинуклеотида не содержит каких-либо кодирующих вирусный капсид последовательностей. Согласно одному варианту реализации матрица векторного полинуклеотида не содержит не только генов капсида AAV, но и генов капсида других вирусов). Кроме того, согласно конкретному варианту реализации указанная молекула нуклеиновой кислоты также не содержит кодирующих последовательностей белка Rep AAV. Соответственно, согласно предпочтительному варианту реализации молекула нуклеиновой кислоты согласно настоящему изобретению не содержит ни функциональных cap-генов AAV, ни функциональных rep-генов AAV.
[00312] Согласно некоторым вариантам реализации настоящего изобретения указанный зкДНК-вектор не содержит модифицированных ITR, содержащих нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 548, 549, 551, 552, 553, 553, 554, 555, 556 и 557.
[00313] Согласно некоторым вариантам реализации указанный зкДНК-вектор содержит регуляторный переключатель согласно описанию в настоящем документе (или в РСТ-заявке №PCT/US18/49996, поданной 7 сентября 2018 г.) и модифицированный ITR с нуклеотидной последовательностью, выбранной из группы, состоящей из: SEQ ID NO: 548, 549, 551, 552, 553, 553, 554, 555, 556 и 557.
[00314] Без ограничений, авторы настоящего изобретения утверждают, что оговоренное выше право на отказ применимо по меньшей мере к пунктам формулы 1-33 в настоящей заявке и пунктам [00293] и [00294] в описании.
[00315] Некоторые варианты реализации различные аспекты настоящего изобретения могут быть определены любым из следующих пунктов:
1. Липосомальный зкДНК-вектор, включающий липосому, инкапсулирующую зкДНК-вектор, содержащий:
экспрессионную кассету, содержащую цис-регуляторный элемент, при этом указанный цис-регуляторный элемент выбран из группы, состоящей из посттранскрипционного регуляторного элемента и поли(А)-сигнала BGH; ITR дикого типа в начале (на 5'-конце) экспрессионной кассеты, при этом указанный ITR дикого типа содержит полинуклеотид с SEQ ID NO: 51; и модифицированный ITR в конце (на 3'-конце) экспрессионной кассеты, при этом указанный модифицированный ITR содержит полинуклеотид с SEQ ID NO: 2, причем указанный ДНК-вектор лишен специфического прокариотического метилирования и не заключен в капсидный белок AAV.
2. ДНК-вектор по пункту 1, где указанный ДНК-вектор имеет линейную и непрерывную структуру.
3. ДНК-вектор по любому из пунктов 1-2, где указанный посттранскрипционный регуляторный элемент содержит посттранскрипционный регуляторный элемент WHP (WPRE).
4. ДНК-вектор по любому из пунктов 1-3, где указанная экспрессионная кассета дополнительно содержит сайт клонирования.
5. ДНК-вектор по любому из пунктов 1-4, где указанная экспрессионная кассета содержит промотор, выбранный из группы, состоящей из промотора CAG, промотора AAT, промотора LP1 и промотора EF1a.
6. ДНК-вектор по пункту 1, где указанная экспрессионная кассета содержит полинуклеотиды SEQ ID NO: 3, SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 9.
7. ДНК-вектор по любому из пунктов 1-6, где указанная экспрессионная кассета дополнительно содержит сайт клонирования и экзогенную последовательность, инсертированную в сайт клонирования.
8. ДНК-вектор по пункту 7, где указанная экзогенный последовательность содержит по меньшей мере 2000 нуклеотидов.
9. ДНК-вектор по пункту 7, где указанная экзогенный последовательность кодирует белок.
10. ДНК-вектор по пункту 7, где указанная экзогенный последовательность кодирует репортерный белок.
[00316] Некоторые варианты реализации различных аспектов настоящего изобретения могут быть определены любым из следующих пунктов:
1. Липидная частица, содержащая ионизируемый липид и невирусный бескапсидный ДНК-вектор с ковалентно замкнутыми концами (зкДНК-вектор), отличающаяся тем, что указанный зкДНК-вектор содержит по меньшей мере одну гетерологичную нуклеотидную последовательность, функционально расположенную между последовательностями асимметричных инвертированных концевых повторов (асимметричных ITR), причем по меньшей мере один из асимметричных ITR содержит функциональный сайт концевого разрешения и сайт связывания Rep.
2. Липидная наночастица по пункту 1, отличающаяся тем, что указанный зкДНК-вектор, после расщепления рестрикционным ферментом с одним сайтом распознавания на зкДНК-векторе и анализа как с помощью природного, так и денатурирующего гель-электрофореза, демонстрирует характеристические полосы линейной и непрерывной ДНК, отличающиеся от полос линейных и прерывистых контрольных ДНК.
3. Липидная наночастица по пункту 1 или 2, отличающаяся тем, что одна или более из последовательностей асимметричных ITR взяты из вируса, выбранного из парвовируса, депендовируса и аденоассоциированного вируса (AAV).
4. Липидная наночастица по пункту 3, отличающаяся тем, что указанные асимметричные ITR взяты из разных вирусных серотипов.
5. Липидная наночастица по пункту 4, отличающаяся тем, что указанные один или более асимметричных ITR взяты из серотипа AAV, выбранного из AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11 и AAV12.
6. Липидная наночастица по любому из пунктов 1-3, отличающаяся тем, что одна или более из последовательностей асимметричных ITR являются синтетическими.
7. Липидная наночастица по любому из пунктов 1-6, отличающаяся тем, что один или более ITR не представляет собой ITR дикого типа.
8. Липидная наночастица по любому из пунктов 17, отличающаяся тем, что один или оба асимметричных ITR модифицирован(ы) делецией, инсерцией и/или заменой по меньшей мере в одной из областей ITR, выбранных из А, А', В, В', С, С, D и D'.
9. Липидная наночастица по любому из пунктов 1-8, отличающаяся тем, что указанный зкДНК-вектор содержит по меньшей мере два асимметричных ITR, выбранные из:
a. SEQ ID NO: 1 и SEQ ID NO: 52; и
b. SEQ ID NO: 2 и SEQ ID NO: 51.
10. Липидная наночастица по любому из пунктов 1-9, отличающаяся тем, что указанный зкДНК-вектор получают способом, включающим следующие этапы:
a. инкубация популяции клеток насекомых, несущих экспрессионную конструкцию зкДНК, в присутствии по меньшей мере одного белка Rep, при этом указанная экспрессионная конструкция зкДНК кодирует указанный зкДНК-вектор, в условиях, эффективных для, и на протяжении времени, достаточного для того чтобы индуцировать продуцирование зкДНК-вектора в указанных клетках насекомых; и
b. выделение указанного зкДНК-вектора из указанных клеток насекомых.
11. Липидная наночастица по пункту 10, отличающаяся тем, что указанную экспрессионную конструкцию зкДНК выбирают из зкДНК-плазмиды, зкДНК-бакмиды и зкДНК-бакуловируса.
12. Липидная наночастица по пункту 10 или пункту 11, отличающаяся тем, что указанная клетка насекомого экспрессирует по меньшей мере один белок Rep.
13. Липидная наночастица по пункту 10, отличающаяся тем, что по меньшей мере один белок Rep взят из вируса, выбранного из парвовируса, депендовируса и аденоассоциированного вируса (AAV)
14. Липидная наночастица по пункту 13, отличающаяся тем, что по меньшей мере один белок Rep взят из серотипа AAV, выбранного из AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11 и AAV12.
15. Липидная частица по любому из пунктов 1-15, отличающаяся тем, что указанный ДНК-вектор получают из векторного полинуклеотида, при этом указанный векторный полинуклеотид кодирует гетерологичную нуклеиновую кислоту, функционально расположенную между двумя последовательностями инвертированных концевых повторов (ITR), причем указанные два ITS отличаются друг от друга (являются асимметричными) и по меньшей мере один из ITR представляет собой функциональный ITR, содержащий функциональный сайт концевого разрешения и сайт связывания Rep, и один из ITR содержит делецию, инсерцию и/или замену относительно функционального ITR; а присутствие белка Rep индуцирует репликацию векторного полинуклеотида и продуцирование ДНК-вектора в клетке насекомого, причем указанный ДНК-вектор может быть способом, включающим следующие этапы:
а. инкубация популяции клеток насекомых, несущих указанный векторный полинуклеотид, который не содержит кодирующих последовательностей вирусного капсида, в присутствии белка Rep, в условиях, эффективных для, и на протяжении времени, достаточного для того чтобы индуцировать продуцирование бескапсидного невирусного ДНК-вектора в клетках насекомых, отличающихся тем, что продуцируемая бескапсидная невирусная ДНК не содержится в указанных клетках насекомых в отсутствие указанного вектора; и
b. сбор и выделение бескапсидной невирусной ДНК из клеток насекомых.
16. Липидная частица по любому из пунктов 10-15, отличающаяся тем, что присутствие бескапсидной невирусной ДНК, выделенной из клеток насекомых, может быть подтверждено.
17. Липидная частица по пункту 16, отличающаяся тем, что присутствие бескапсидной невирусной ДНК, выделенной из клеток насекомых, может быть подтверждено путем расщепления ДНК, выделенной из клеток насекомых, рестрикционным ферментом с одним сайтом распознавания на указанном ДНК-векторе и анализа расщепленного ДНК-материала на неденатурирующем геле для подтверждения присутствия характеристических полос линейной и непрерывной ДНК, по сравнению с линейной и прерывистой ДНК.
18. Липидная частица по любому из пунктов 1-17, отличающаяся тем, что указанный ДНК-вектор получают из векторного полинуклеотида, при этом указанный векторный полинуклеотид кодирует гетерологичную нуклеиновую кислоту, функционально расположенную между последовательностями ДНК-полинуклеотидов первого и второго инвертированных концевых повторов (ITR) AAV2, при этом по меньшей мере один из ITR содержит по меньшей мере одну полинуклеотидную делецию, инсерцию и/или замену относительно соответствующего ITR AAV2 дикого типа SEQ ID NO: 1 или SEQ ID NO: 51 для индукции репликации указанного ДНК-вектора в клетке насекомого в присутствии белка Rep, причем указанный ДНК-вектор может быть способом, включающим следующие этапы:
a. инкубация популяции клеток насекомых, несущих указанный векторный полинуклеотид, который не содержит кодирующих последовательностей вирусного капсида, в присутствии белка Rep, в условиях, эффективных для, и на протяжении времени, достаточного для того чтобы индуцировать продуцирование бескапсидной невирусной ДНК в клетках насекомых, причем указанные клетки насекомых не содержат кодирующих вирусный капсид последовательностей; и
b. сбор и выделение бескапсидной невирусной ДНК из клеток насекомых.
19. Липидная частица по пункту 18, отличающаяся тем, что присутствие бескапсидной невирусной ДНК, выделенной из клеток насекомых, может быть подтверждено.
20. Липидная частица по пункту 19, отличающаяся тем, что присутствие бескапсидной невирусной ДНК, выделенной из клеток насекомых, может быть подтверждено путем расщепления ДНК, выделенной из клеток насекомых, рестрикционным ферментом с одним сайтом распознавания на указанном ДНК-векторе и анализа расщепленного ДНК-материала на неденатурирующем геле для подтверждения присутствия характеристических полос линейной и непрерывной ДНК, по сравнению с линейной и прерывистой ДНК.
21. Липидная частица по любому из пунктов 1-20, отличающаяся тем, что указанная липидная частица дополнительно содержит что-либо одно или более из некатионного липида; конъюгированного с ПЭГ липида; и стерола.
22. Липидная частица по любому из пунктов 1-21, отличающаяся тем, что указанный ионизируемый липид представляет собой липид, описанный в таблице 1.
23. Липидная частица по любому из пунктов 1-22, отличающаяся тем, что указанная липидная частица дополнительно содержит некатионный липид, причем указанный неионогенный липид выбран из группы, состоящей из дистеароил-вп-глицеро-фосфоэтаноламина, дистеароилфосфатидилхолина (DSPC), диолеилфосфатидилхолина (DOPC), дипальмитоилфосфатидилхолина (DPPC), диолеилфосфатидилглицерина (DOPG), дипальмитоилфосфатидилглицерина (DPPG), диолеилфосфатидилэтаноламина (DOPE), пальмитоилолеоилфосфатидилхолина (РОРС), пальмитоилолеоилфосфатидилэтаноламина (POPE), диолеилфосфатидилэтаноламина 4-(N-малеимидометил)-циклогексан-1-карбоксилата (DOPE-mal), дипальмитоилфосфатидилэтаноламина (DPPE), димиристоилфосфоэтаноламина (DMPE), дистеароилфосфатидилэтаноламина (DSPE), монометилфосфатидилэтаноламина (такого как 16-О-монометил ФЭ), диметилфосфатидилэтаноламина (такого как 16-О-диметил ФЭ), 18-1-транс ФЭ, 1-стеароил-2-олеоилфосфатидилэтаноламина (SOPE), гидрогенизированного соевого фосфатидилхолина (HSPC), яичного фосфатидилхолина (ЕРС), диолеилфосфатидилсерина (DOPS), сфингомиелина (SM), димиристоилфосфатидилхолина (DMPC), димиристоилфосфатидилглицерина (DMPG), дистеароилфосфатидилглицерина (DSPG), диерукоилфосфатидилхолина (DEPC), пальмитоилолеоилфосфатидилглицерина (POPG), диэлаидоилфосфатидилэтаноламина (DEPE), лецитина, фосфатидилэтаноламина, лизолецитина, лизофосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозитола, сфингомиелина, яичного сфингомиелина (ESM), кефалина, кардиолипина, фосфатидной кислоты, цереброзидов, дицетилфосфата, лизофосфатидилхолина и дилинолеоилфосфатидилхолина.
24. Липидная частица по любому из пунктов 1-23, отличающаяся тем, что указанная липидная частица дополнительно содержит конъюгированный липид, при этом указанный конъюгированный липид выбран из группы, состоящей из ПЭГ-диацилглицерина (DAG) (такого как 1-(монометокси-полиэтиленгликоль)-2,3-димиристоилглицерол (ПЭГ-ДМГ)), ПЭГ-диалкилоксипропила (DAA), ПЭГ-фосфолипида, ПЭГ-керамида (Cer), пегилированного фосфатидилэтаноламина (ПЭГ-ФЭ), ПЭГ-сукцинатдиацилглицерина (PEGS-DAG) (такого как 4-O-(2',3'-ди(тетрадеканоилокси)пропил-1-O-(w-метокси(полиэтокси)этил)бутандиоат (ПЭГ-S-ДМГ)), ПЭГ-диалкоксипропилкарбама и натриевой соли N-(карбонилметоксиполиэтиленгликоля 2000)-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламина.
25. Липидная частица по любому из пунктов 1 24, отличающаяся тем, что указанная липидная частица дополнительно содержит холестерин или производное холестерина.
26. Липидная частица по любому из пунктов 1-25, отличающаяся тем, что указанная липидная частица содержит:
(i) ионизируемый липид;
(ii) некатионный липид;
(iii) конъюгированный липид, который ингибирует агрегацию частиц; и
(iv) стерол.
27. Липидная частица по любому из пунктов 1-26, отличающаяся тем, что указанная липидная частица содержит:
(a) ионизируемый липид в количестве от приблизительно 20 мол. % до приблизительно 90 мол. % от общего количества липидов, присутствующих в указанной частице;
(b) некатионный липид в количестве от приблизительно 5 мол. % до приблизительно 30 мол. % от общего количества липидов, присутствующих в указанной частице;
(c) конъюгированный липид, который ингибирует агрегацию частиц, в количестве от приблизительно 0,5 мол. % до приблизительно 20 мол. % от общего количества липидов, присутствующих в указанной частице; и
(d) стерол в количестве от приблизительно 20 мол. % до приблизительно 50 мол. % от общего количества липидов, присутствующих в указанной частице.
28. Липидная частица по любому из пунктов 1-27, отличающаяся тем, что соотношение общего количества липидов и ДНК-вектора (по массе или весу) составляет от приблизительно 10:1 до приблизительно 30:1.
29. Композиция, содержащая первую липидную наночастицу и дополнительное соединение, при этом указанная первая липидная наночастица содержит первый бескапсидный невирусный вектор и представляет собой липидную наночастицу по любому из пунктов 1-28.
30. Композиция по пункту 29, отличающаяся тем, что указанное дополнительное соединение включено во вторую липидную наночастицу, и тем, что указанные первая и вторая липидные наночастицы различаются.
31. Композиция по пункту 28 или 29, отличающаяся тем, что указанное дополнительное соединение включено в первую липидную наночастицу.
32. Композиция по любому из пунктов 28-30, отличающаяся тем, что указанное дополнительное соединение представляет собой терапевтический агент.
33. Композиция по пункту 28, отличающаяся тем, что указанное дополнительное соединение представляет собой второй бескапсидный невирусный вектор, при этом указанные первый и второй бескапсидные невирусные векторы различаются.
[00317] Приведенные ниже примеры предназначены для иллюстрации, а не для ограничения.
ПРИМЕРЫ
Пример 1: Примеры способа получения зкДНК-векторов
Конструирование зкДНК-плазмид
[00318] Описано получение зкДНК-векторов с применением полинуклеотидной матричной конструкции. Например, полинуклеотидная матричная конструкция, используемая для получения зкДНК-векторов согласно настоящему изобретению, может представлять собой зкДНК-плазмиду, зкДНК-бакмиду и/или зкДНК-бакуловирус. Без ограничения теорией, в пермиссивной клетке-хозяине в присутствии, например, Rep, полинуклеотидная матричная конструкция с двумя ITR и экспрессионной конструкцией, при этом по меньшей мере один из ITR модифицирован, реплицируется с получением зкДНК-векторов. Получение зкДНК-вектора включает два этапа: во-первых, эксцизию («спасение») матрицы из остова матрицы (например, зкДНК-плазмиды, зкДНК-бакмиды, генома зкДНК-бакуловируса и т.п.) посредством белков Rep, и во-вторых, опосредованную Rep репликацию вырезанного зкДНК-вектора.
[00319] Пример способа получения зкДНК-векторов представлен получением из зкДНК-плазмиды согласно описанию в настоящем документе. На фиг.1А и 1В полинуклеотидная матричная конструкция каждой из зкДНК-плазмид включает как левый ITR, так и правый мутированный ITR, между которыми расположены: (i) энхансер/промотор; (ii) сайт клонирования для трансгена; (iii) посттранскрипционный ответный элемент (например, посттранскрипционный регуляторный элемент вируса гепатита сурков (WPRE)); и (iv) сигнал полиаденилирования (например, из гена бычьего гормона роста (BGHpA). Также между всеми компонентами вводили уникальные сайты распознавания рестрикционной эндонуклеазой (R1-R6) (представлены на фиг. 1А и 1В) для облегчения введения новых генетических компонентов в специфические сайты в указанной конструкции. Сайты для ферментов R3 (PmeI) GTTTAAAC (SEQ ID NO: 7) и R4 (PacI) ТТААТТАА (SEQ ID NO: 542) встраивают в сайт клонирования для введения открытой рамки считывания трансгена. Указанные последовательности клонировали в плазмиду pFastBac НТ В, полученную от ThermoFisher Scientific.
[00320] Вкратце, получали ряд зкДНК-векторов из зкДНК-плазмидных конструкций, приведенных в таблице 3, с применением способа, показанного на фиг. 4А-4С. В таблице 5 указаны номера соответствующих последовательностей полинуклеотидов для каждого компонента, в том числе последовательностей с активностью сайта белка репликации (RPS) (например, сайта связывания Rep) на любом конце промотора, функционально связанного с трансгеном. Номера в таблице 3 относятся к SEQ ID NO в настоящем документе, соответствующим последовательностям каждого компонента.
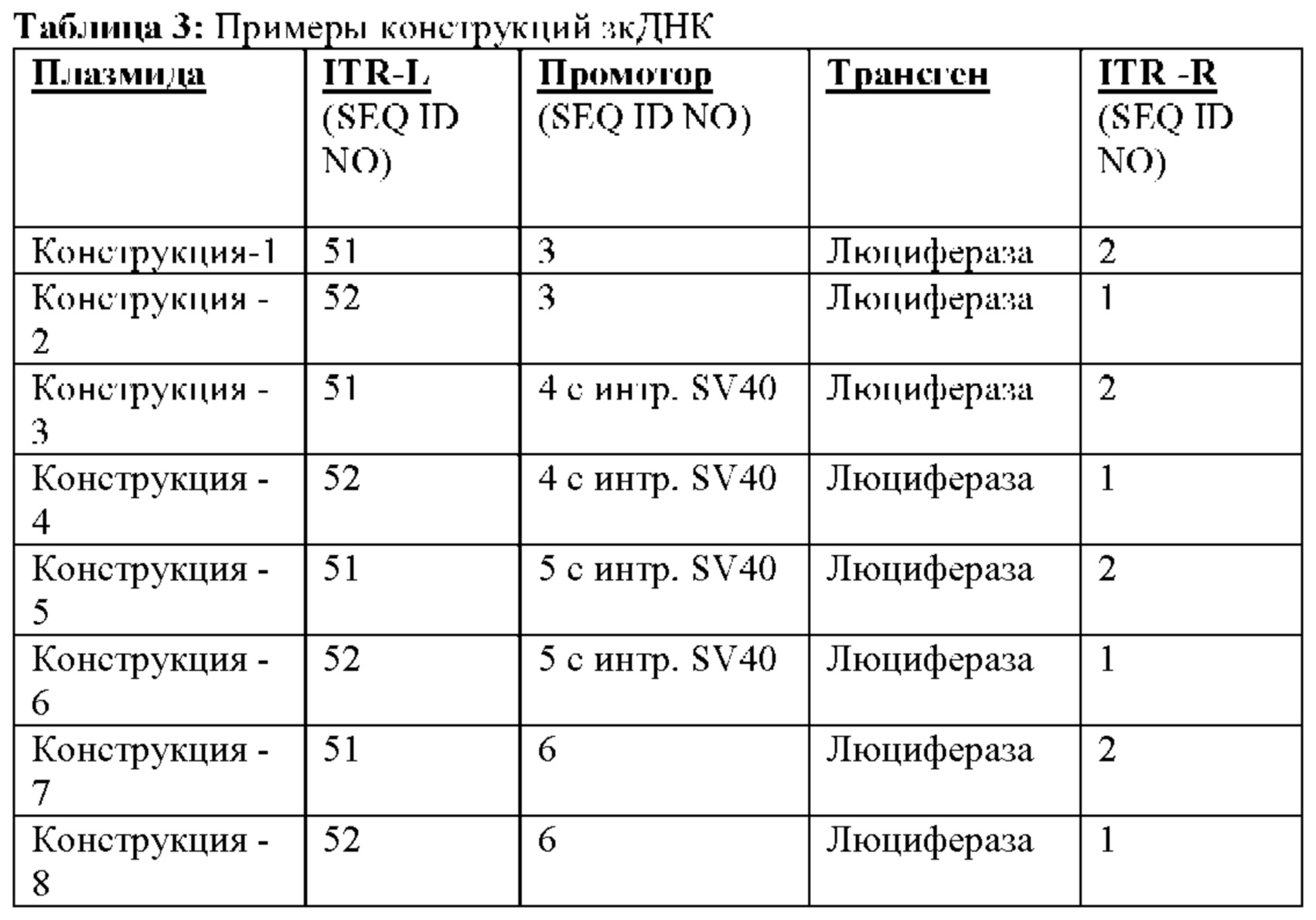
[00321] Согласно некоторым вариантам реализации конструкция для получения зкДНК-векторов содержит промотор, который представляет собой регуляторный переключатель, например, индуцируемый промотор. Для получения зкДНК-векторов использовали и другие конструкции, которые содержат промотор MND или HLCR, функционально связанный с трансгеном люциферазы
Получение зкДНК-бакмид:
[00322] Как показано на фиг. 4А, компетентные клетки DH10Bac (МАХ EFFICIENCY® DH10Bac™ Competent Cells, Thermo Fisher) трансформировали либо тестируемыми, либо контрольными плазмидами, следуя протоколу в соответствии с инструкциями производителя. Индуцировали рекомбинацию между плазмидой и бакуловирусным челночным вектором в клетках DH10Bac для получения рекомбинантных зкДНК-бакмид. Рекомбинантные бакмиды отбирали путем скрининга с положительным отбором, основанного на сине-белом скрининге у Е. coli (маркер
[00323] Рекомбинантные зкДНК-бакмиды выделяли из Е. coli и трансфицировали ими клетки насекомых Sf9 или Sf21 с применением FugeneHD для получения инфекционного бакуловируса. Адгезивные клетки насекомых Sf9 или Sf21 культивировали в 50 мл среды в колбах Т25 при 25°С. Через 4 дня культуральную среду (содержащую вирус Р0) отделяли от клеток, фильтровали через фильтр с размером пор 0,45 мкм, отделяя инфекционные бакуловирусные частицы от клеток или клеточного дебриса.
[00324] Необязательно, первое поколение бакуловируса (Р0) амплифицировали
путем инфицирования интактных клеток насекомых Sf9 или Sf21 в объемах среды от 50 до 500 мл. Клетки поддерживали в суспензионных культурах в инкубаторе с орбитальным шейкером при 130 об/мин и 25°С, проводя мониторинг диаметра и жизнеспособности клеток, до достижения клетками диаметра 18-19 нм (от диаметра интактных клеток 14-15 нм) и плотности ~4,0Е+6 клеток/мл. Через 3-8 дней после инфицирования бакуловирусные частицы Р1 в среде собирали после центрифугирования для удаления клеток и дебриса с последующей фильтрацией через фильтр с размером пор 0,45 мкм.
[00325] Собирали зкДНК-бакуловирус, содержащий тестируемые конструкции, и определяли инфекционную активность, или титр, бакуловируса. В частности, 4×20 мл культур клеток Sf9 с плотностью 2,5Е+6 клеток/мл обрабатывали бакуловирусом Р1 в следующих разведениях: 1/1000, 1/10 000, 1/50 000, 1/100000, и инкубировали при 25-27°С. Инфекционность определяли ежедневно на протяжении 4-5 дней по показателю увеличения диаметра клеток и остановке клеточного цикла, а также изменению жизнеспособности клеток.
[00326] Как показано на фиг. 4А, «Rep-плазмиду» в соответствии с фиг. 6А продуцировали в экспрессионном векторе pFASTBAC™-Dual (ThermoFisher), содержащем и Rep78 (SEQ ID NO: 13) или Rep68 (SEQ ID NO: 12), и Rep52 (SEQ ID NO: 14).
[00327] Указанной Rep-плазмидой трансформировали компетентные клетки DH10Bac (MAX EFFICIENCY® DH10Bac™ Competent Cells (Thermo Fisher), следуя предложенному производителем протоколу. Индуцировали рекомбинацию между Rep-плазмидой и бакуловирусным челночным вектором в клетках DH10Bac для получения рекомбинантных бакмид («Rep-бакмид»). Рекомбинантные бакмиды отбирали с применением положительного отбора, который включал сине-белый скрининг на Е. coli (маркер
[00328] Клетки насекомых Sf9 или Sf21 культивировали в 50 мл среды в течение 4 дней, и инфекционный рекомбинантный бакуловирус («Rep-бакуловирус») выделяли из культуры. Необязательно, первое поколение Rep-бакуловируса (Р0) амплифицировали путем инфицирования интактных клеток насекомых Sf9 или Sf21 и культивировали в 50-500 мл среды. Через 3-8 дней после инфицирования бакуловирусные частицы Р1 в среде собирали, отделяя клетки путем центрифугирования или фильтрации, или используя другой способ фракционирования. Собирали Rep-бакуловирус и определяли инфекционную активность бакуловируса. В частности, 4×20 мл культур клеток Sf9 с плотностью 2,5×106 клеток/мл обрабатывали бакуловирусом Р1 в еле дующих разведениях: 1/1000, 1/10000,1/50000, 1/100000, и инкубировали. Инфекционность определяли ежедневно на протяжении 4-5 дней по показателю увеличения диаметра клеток и остановке клеточного цикла, а также изменению жизнеспособности клеток.
Получение и характеризация зкДНК-вектора
[00329] Как показано на фиг. 4В, затем культуральную среду для клеток насекомых Sf9, содержащую либо (1) образец, содержащий зкДНК-бакмиду или зкДНК-бакуловирус, либо (2) Rep-бакуловирус, описанные выше, добавляли в свежую культуру клеток Sf9 (2,5Е+6 клеток/мл, 20 мл) в соотношении 1:1000 и 1:10000, соответственно. Затем клетки культивировали при 130 об/мин при 25°С. Через 4-5 дней после коинфекции детектируют диаметр и жизнеспособность клеток. Когда диаметр клеток достигал 18-20 нм при жизнеспособности ~70-80%, культуры клеток центрифугировали, среду удаляли и собирали клеточные осадки. Клеточные осадки сначала ресуспендировали в подходящем объеме водной среды, либо воды, либо буфера. ЗкДНК-вектор выделяли и очищали от клеток с использованием протокола очищения от Qiagen MIDI PLUS™ (Qiagen, обработка 0,2 мг массы клеточного осадка на колонку).
[00330] Значения выхода для зкДНК-векторов, продуцированных и очищенных из клеток насекомых Sf9, первоначально определяли на основании поглощения УФ при 260 нм. Значения выхода для различных зкДНК-векторов, определенные на основании поглощения УФ, приведены ниже в таблице 4.

[00331] Оценка зкДНК-векторов может быть проведена путем идентификации с применением электрофореза на агарозном геле в нативных или денатурирующих условиях, что проиллюстрировано на фиг. 4D, где зкДНК-векторы дают несколько полос на нативных гелях, например, см. фиг. 4D. Каждая полоса может соответствовать векторам в отличающейся конформации, например, мономерным, димерным и т.п. Присутствие единственной полосы в денатурирующих условиях и двойных полос (соответствующих мономерным и димерным формам) в не денатурирующих условиях является характеристическим для присутствия зкДНК-вектора.
[00332] Структуры выделенных зкДНК-векторов дополнительно анализировали путем расщепления ДНК, полученной из коинфицированных клеток Sf9 (согласно описанию в настоящем документе) рестрикционными эндонуклеазами, выбранными на основании а) присутствия только одного сайта разрезания в зкДНК-векторах, и b) получения итоговых фрагментов, достаточно больших, чтобы быть явно видимыми при фракционировании на 0,8% денатурирующем агарозном геле (>800 п.о.). Как показано на фиг. 4Е, линейные ДНК-векторы с прерывистой структурой и зкДНК-вектор с линейной и непрерывной структурой можно различить по размерам их реакционных продуктов - например, ДНК-вектор с прерывистой структурой предположительно дает фрагменты размером 1 т.п.о. и 2 т.п.о., тогда как не заключенный в капсид вектор с непрерывной структурой предположительно дает фрагменты размером 2 т.п.о. и 4 т.п.о.
[00333] Соответственно, чтобы качественным образом продемонстрировать, что выделенные зкДНК-векторы имеют ковалентно замкнутые концы, что требуется по определению, указанные образцы расщепляли рестрикционной эндонуклеазой, идентифицированной в контексте специфической последовательности ДНК-вектора как имеющая единственный сайт рестрикции, предпочтительно, дающей два продукта расщепления неравного размера (например, 1000 п.о. и 2000 п.о.). После расщепления и электрофореза на денатурирующем геле (разделяющем две комплементарные цепи ДНК) линейная ковалентно не замкнутая ДНК будет разделяться на фрагменты размером 1000 п.о. и 2000 п.о., тогда как ковалентно замкнутая ДНК (т.е. ЗкДНК-вектор) будет разделяться на фрагменты вдвое больших размеров (2000 п.о. и 4000 п.о.), поскольку две цепи ДНК соединены, а в данных обстоятельствах развернуты и имеют в два раза большую длину (хотя и являются одноцепочечными). Кроме того, при расщеплении мономерных, димерных и n-мерных форм ДНК-векторов все они будут разделяться на фрагменты одинаковых размеров из-за связывания концов мультимерных ДНК-векторов (см. фиг. 4D)
[00334] На фиг. 5 приведен пример изображения денатурирующего геля со следующими зкДНК-векторами: конструкция-1, конструкция-2, конструкция-3, конструкция-4, конструкция-5, конструкция-6, конструкция-7 и конструкция-8 (все они описаны в таблице 12 выше), с расщеплением (+) или без расщепления (-) эндонуклеазой. Каждый зкДНК-вектор из конструкций 18 давал две полосы (*) после реакции с эндонуклеазой. Размеры их фрагментов в двух полосах, определенные по маркеру размера, приведены в нижней части изображения. Размеры полос подтверждают, что каждый из зкДНК-векторов, продуцированных с плазмид, содержащих конструкцию 18, имеет непрерывную структуру.
[00335] В настоящем документе выражение «анализ для идентификации ДНК-векторов путем электрофореза на агарозном геле в условиях нативного и денатурирующего геля» относится к анализу для оценки наличия замкнутых концов зкДНК путем проведения расщепления рестрикционной эндонуклеазой с последующей электрофоретической оценкой продуктов расщепления. Один пример такого анализа приведен ниже, хотя специалисту в данной области техники будет понятно, что возможны многие известные в данной области техники варианты указанного примера. Рестрикционную эндонуклеазу выбирают таким образом, чтобы она представляла собой фермент, разрезающий представляющий интерес зкДНК-вектор в одном месте, что дает продукты с длиной, составляющей приблизительно 1/3× и 2/3× длины ДНК-вектора. Это обеспечивает разделение на полосы как на нативном, так и на денатурирующем геле. Перед денатурацией важно удалить из образца буфер. Набор для очищения продуктов ПЦР от Qiagen PCR или обессоливающие «центрифужные колонки», например, колонки от GE HEALTHCARE ILUSTRA™ MICROSPIN™ G-25, представляют собой некоторые известные в данной области техники варианты для расщепления эндонуклеазами. Указанный анализ включает например, i) расщепление ДНК подходящей рестрикционной эндонуклеазой (или эндонуклеазами), 2) применение, например, набора для очищения продуктов ПЦР от Qiagen, элюирование дистиллированной водой, iii) добавление 10× денатурирующего раствора (10×=0,5 М NaOH, 10 мМ ЭДТК), добавление 10Х красителя, не забуференного, и анализ вместе с ДНК-лэддерами, полученными путем добавления 10Х денатурирующего раствора в 4×, на 0,8 1,0% геле, ранее инкубированном с 1 мМ ЭДТК и 200 мМ NaOH, чтобы обеспечить однородность концентрации NaOH в геле и гелевой камере, и прогонку геля в присутствии 1× денатурирующего раствора (50 мМ NaOH, 1 мМ ЭДТК). Специалисту в данной области техники будет понятно, какое напряжение использовать для проведения электрофореза в зависимости от размеров и требуемого времени получения результатов. После электрофореза гели осушают и нейтрализуют в 1× ТВЕ или ТАЕ, переносят в дистиллированную воду или 1× ТВЕ/ТАЕ с 1× SYBR Gold. Затем полосы могут быть визуализированы, например, с применением красителя от Thermo Fisher, SYBR® Gold Nucleic Acid Gel Stain (10000X концентрат в ДМСО) и эпифлуоресцентного света (синего) или УФ (312 нм).
[00336] Оценка чистоты полученного зкДНК-вектора может быть проведена с применением любого известного в данной области техники способа. Согласно одному неограничивающему примеру способа вклад зкДНК-плазмиды в общее поглощение УФ образцом может быть рассчитан путем сравнения интенсивности флуоресцентности зкДНК-вектора и стандарта. Например, если, на основании поглощения УФ, на гель было загружено 4 мкг зкДНК-вектора, и интенсивность флуоресцентности зкДНК-вектора эквивалентна полосе 2 т.п.о. с известной массой 1 мкг, значит, имеется 1 мкг зкДНК-вектора, и зкДНК-вектор составляет 25% от общего количества поглощающего УФ материала. Затем строят график зависимости интенсивности полосы на геле от вычисленного введенного количества, которому соответствует полоса например, если длина всего зкДНК-вектора 8 т.п.о., а вырезанная сравнительная полоса соответствует 2 т.п.о., интенсивность полосы на графике будет составлять 25% от общего введенного количества, что в указанном случае составит 0,25 мкг для введенных 1,0 мкг. С использованием разведении несущей зкДНК-вектор плазмиды для построения стандартной кривой получают уравнение линии регрессии, которое затем используют для вычисления количества указанного зкДНК-вектора в соответствующей полосе, которое затем можно использовать для определения процента от общего введенного количества зкДНК-вектора, или процента чистоты.
Пример 2: зкДНК-векторы экспрессируют трансген люциферазы in vitro
[00337] Получали конструкции путем введения открытой рамки считывания, кодирующей репортерный ген люциферазы, в сайт клонирования зкДНК-плазмидных конструкций: конструкции-1, конструкции-3, конструкции-5 и конструкции-7. ЗкДНК-плазмиды (см. выше в таблице 3), включающие кодирующую последовательность люциферазы, называют плазмидной конструкцией 1-Luc, плазмидной конструкцией-3-Luc, плазмидной конструкцией-5-Luc и плазмидной конструкцией 7-Luc, соответственно.
[00338] Клетки HEK293 культивировали и трансфицировали 100 нг, 200 нг или 400 нг плазмидных конструкций 1, 3, 5 и 7, с применением FUGENE® (Promega Corp.) в качестве агента для трансфекции. Экспрессию люциферазы с каждой из плазмид определяли на основании активности люциферазы в каждой культуре клеток; результаты приведены на фиг. 7А. Активность люциферазы не детектировалась в необработанных контрольных клетках («необработанных») или клетках, обработанных Fugene по отдельности («Fugene»), что подтверждает, что активность люциферазы является результатом генной экспрессии с плазмид. Как показано на фиг. 7А и 7ВВ, была детектирована устойчивая экспрессия люциферазы с конструкций 1 и 7. При экспрессии люциферазы с конструкции-7 детектировалось дозозависимое увеличение активности люциферазы.
[00339] Рост и жизнеспособность клеток, трансфицированных каждой из плазмид, также были определены и представлены на фиг. 8А и 8В. Рост и жизнеспособность трансфицированных клеток значимо не отличались в разных группах клеток, обработанных разными конструкциями.
[00340] Соответственно, активность люциферазы, измеренная в каждой группе и нормированная по росту и жизнеспособности клеток, не отличалась от активности люциферазы без нормирования. ЗкДНК-плазмида с конструкцией 1-Luc демонстрировала наиболее устойчивую экспрессию люциферазы, с нормированием или без нормирования.
[00341] Соответственно, данные, представленные на фиг. 7А, 7В, 8А и 8В, демонстрируют, что конструкция 1, содержащая в направлении от 5' к 3'- WT-ITR (SEQ ID NO: 51), промотор CAG (SEQ ID NO: 3), сайт клонирования R3/R4 (SEQ ID NO: 7), WPRE (SEQ ID NO: 8), BGHpA (SEQ ID NO: 9) и модифицированный ITR (SEQ ID NO: 2), эффективно продуцирует зкДНК-вектор, который может экспрессировать белок трансгена, входящего в состав указанного зкДНК-вектора.
Пример 3: Липид (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ил-4-(диметиламино)бутаноат (DLin-MC3-DMA)
[00342] Липидные частицы, содержащие зкДНК, могут быть получены или введены в состав в комбинации с липидом (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ил-4-(диметиламино)-бутаноатом (DLin-MC3-DMA), также называемым «МС3» в настоящем документе; имеющим структуру:
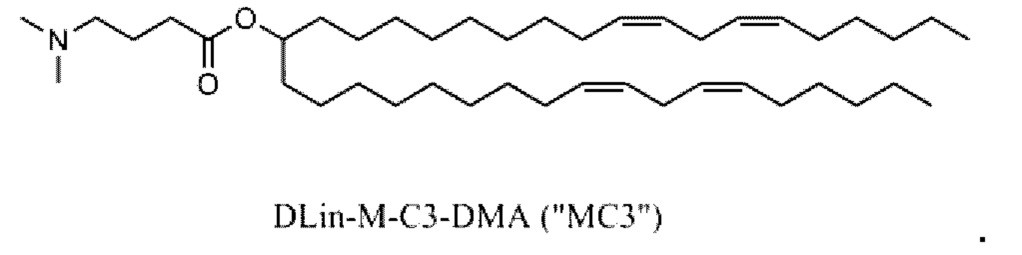
[00343] Липид DLin-MC3-DMA описан в источнике: Jayaraman et al., Angew. Chem. hit. Ed Engl. (2012), 51(34): 8529-8533, содержание которого включено в настоящий документ полностью посредством ссылки. Его синтезируют следующим образом:
[00344] Синтез октадека-9,12-диенилового сложного эфира метансульфоновой кислоты: К раствору спирта 1 (26,6 г, 100 ммоль) в дихлорметане (100 мл) добавляют триэтиламин (13,13 г, 130 ммоль) и охлаждают указанный раствор на ледяной бане. К указанному холодному раствору по каплям добавляют раствор мезилхлорида (12,6 г, 110 ммоль) в дихлорметане (60 мл); после завершения добавления реакционную смесь оставляли для нагревания до температуры окружающей среды и перемешивали в течение ночи. ТСХ реакционной смеси показывает завершение реакции. Реакционную смесь разводят дихлорметаном (200 мл), промывают водой (200 мл), насыщенным NaHCO3 (200 мл), солевым раствором (100 мл) и высушивали (NaSO4). Органический слой концентрируют с получением неочищенного продукта, который очищали с помощью колоночной хроматографии (силикагель), используя 0 10% Et2O в гексанах. Чистые фракции продукта объединяют и концентрируют с получением чистого продукта октадека-9,12-диенилового сложного эфира метансульфоновой кислоты в виде бесцветного масла.1H ЯМР (CDCl3, 400 МГц) δ 5,42-5,21 (m, 4Н), 4,20 (t, 2H), 3,06 (s, 3H), 2,79 (t, 2H), 2,19-2,00 (m, 4Н), 1,90-1,70 (m, 2H), 1,06-1,18 (m, 18H), 0,88 (t, 3H).13С ЯМР (CDCl3) δ 130,76, 130,54, 128,6, 128,4, 70,67, 37,9, 32,05, 30,12, 29,87, 29,85, 29,68, 29,65, 29,53, 27,72, 27,71, 26,15, 25,94, 23,09, 14,60. МС. Молекулярная масса, рассчитанная для C19H36O3S: 344,53.
[00345] Синтез 18-бром-октадека-6,9-диена: Мезилат (октадека-9,12-диениловый сложный эфир метансульфоновой кислоты, 13,44 г, 39 ммоль) растворяют в безводном эфире (500 мл) и добавляют к нему комплекс MgBr.Et2O (30,7 г, 118 ммоль) в атмосфере аргона; смесь конденсируют в атмосфере аргона в течение 26 часов, после чего ТСХ показывает завершение реакции. Реакционную смесь разводят эфиром (200 мл), добавляют в указанную смесь ледяную воду (200 мл) и слои разделяют. Органический слой промывают 1% водным K2CO3 (100 мл), солевым раствором (100 мл) и высушивают (безводный Na2SO4). Концентрация органического слоя дает неочищенный продукт, который дополнительно очищают с помощью колоночной хроматографии (силикагель), используя 0-1% Et2O в гексанах с выделением продукта, 18-бром-октадека-6,9-диена, в виде бесцветного масла.1H ЯМР (CDCl3, 400 МГц) δ 5,41-5,29 (m, 4H), 4,20 (d, 2H), 3,40 (t, J=7 Гц, 2H), 2,77 (t, J=6,6 Гц, 2H), 2,09-2,02 (m, 4H), 1,88-1,00 (m, 2H), 1,46-1,27 (m, 18H), 0,88 (t, J=3,9 Гц, 3Н).13С ЯМР (CDCl3) δ 130,41, 130,25, 128,26, 128,12, 34,17, 33,05, 31,75, 29,82, 29,57, 29,54, 29,39, 28,95, 28,38, 27,42, 27,40, 25,84, 22,79, 14,28.
[00346] Синтез (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ола (DLin-МеОН): в высушенную в пламени круглодонную колбу объемом 500 мл добавляют свежеактивированную стружку Mg (2,4 г, 100 ммоль) и колбу оснащают магнитной мешалкой, капельной воронкой и обратным холодильником. Указанную систему дегазируют, продувают аргоном и добавляют в колбу 10 мл безводного эфира с помощью шприца. 18-бром-октадека-6,9-диен (26,5 г, 80,47 ммоль) растворяют в безводном эфире (50 мл) и добавляют в капельную воронку. Приблизительно 5 мл указанного эфирного раствора добавляют к стружке Mg при интенсивном перемешивании. Отмечают экзотермическую реакцию (для подтверждения /ускорения образования реактива Гриньяра добавляют 5 мг йода и наблюдают немедленное обесцвечивание, подтверждающее образование реактива Гриньяра) и эфир начинает конденсироваться. Остальную часть раствора бромида добавляют по каплям, продолжая осторожно конденсировать реакционную смесь, охлаждая колбу в воде. После завершения добавления реакционную смесь выдерживают при 35°С в течение 1 часа, после чего охлаждают на ледяной бане. Этилформиат (2,68 г, 36,2 ммоль) растворяют в безводном эфире (40 мл), переносят в капельную воронку и добавляют по каплям в реакционную смесь, при перемешивании. Наблюдают экзотермическую реакцию, и реакционная смесь начинает конденсироваться. После начала реакции струей быстро добавляют остаток эфирного раствора формиата и реакционную смесь перемешивают в течение дополнительного 1 часа при температуре окружающей среды. Реакцию гасят путем добавления 10 мл ацетона по каплям с последующим добавлением ледяной воды (60 мл). Реакционную смесь обрабатывают водным раствором H2SO4 (10% по объему, 300 мл) до однородности раствора и слои разделяют. Водную фазу экстрагируют эфиром (2×100 мл). Объединенные эфирные слои высушивают (Na2SO4) и концентрируют с получением неочищенного продукта, который обрабатывают 1 г натрия в метаноле (200 мл) при комнатной температуре в течение ночи. После завершения реакции большую часть растворителя испаряют. Итоговую смесь выливают в 150 мл 5% раствора соляной кислоты. Водную фазу экстрагируют эфиром (2×150 мл). Объединенный эфирный экстракт промывают водой (2×100 мл), солевым раствором (100 мл) и высушивали над безводным сульфатом натрия. Испарение растворителя давало неочищенный продукт, который очищают с помощью колоночной хроматографии (силикагель, 0 10% эфира в гексанах) и чистые фракции продукта испаряют с получением продукта DLin-MeOH в виде бесцветного масла.1H ЯМР (400 МГц, CDCl3) δ 5,47-5,24 (m, 8H), 3,56 (dd, J=6,8, 4,2, 1H), 2,85-2,66 (m, 4H), 2,12-1,91 (m, 9H), 1,50-1,17 (m, 46H), 0,98-0,76 (m, 6H).13С ЯМР (101 МГц, CDCl3) δ 130,41, 130,37, 128,18, 128,15, 77,54, 77,22, 76,91, 72,25, 37,73, 31,75, 29,94, 29,89, 29,83, 29,73, 29,58, 29,53, 27,46, 27,43, 25,89, 25,86, 22,80, 14,30.
[00347] Синтез 6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ил-4-(диметиламино)бутаноата (МС3): DLin-MeOH (144 г, 272 ммоль) растворяют в 1 л дихлорметана и добавляют к нему хлористоводородную соль диметиламиномасляной кислоты 7 (55 г, 328 ммоль) с последующим диизопропилэтиламином (70 мл) и ДМАП (4 г). После перемешивания в течение 5 минут при температуре окружающей среды добавляют EDCI (80 г, 417 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение ночи, после чего ТСХ-анализ (силикагель, 5% МеОН в CH2Cl2) показывает полное исчезновение исходного спирта. Реакционную смесь разводят CH2Cl2 (500 мл) и промывают насыщенным NaHCO3 (400 мл), водой (400 мл) и солевой раствор (500 мл). Объединенные органические слои высушивают над безводным Na2SO4 и удаляют растворители in vacuo. Неочищенный продукт, полученный таким образом, очищают с помощью колоночной флэш-хроматографии [2,5 кг силикагеля, используются перечисленные ниже элюенты: i) колонка упакована 6 л 0,1% Net3 в ДХМ; после загрузки ii) 4 л 0,1% Net3 в ДХМ; iii) 16 л 2% МеОН - 98% 0,1% Net3 в ДХМ; iv) 4 л 2,5% МеОН - 97,5% 0,1% Net3 в ДХМ; v) 12 л 3% МеОН - 97% 0,1% Net3 в ДХМ] с выделением чистого продукта МС3 в виде бесцветного масла.1H ЯМР (400 МГц, CDCl3): δ 5,46-5,23 (m, 8H), 4,93-4,77 (m, 1H), 2,83-2,66 (m, 4H), 2,37-2,22 (m, 4H), 2,20 (s, 6H), 2,10-1,96 (m, 9H), 1,85-1,69 (m, 2H), 1,49 (d, J=5,4, 4H), 1,39-1,15 (m, 39H), 0,95-0,75 (m, 6H).13C ЯМР (101 МГц, CDCl3): δ 173,56, 130,38, 130,33, 128,17, 128,14, 77,54, 77,22, 76,90, 74,44, 59,17, 45,64, 34,36, 32,69, 31,73, 29,87, 29,76, 29,74, 29,70, 29,56, 29,50, 27,44, 27,41, 25,84, 25,55, 23,38, 22,78, 14,27. ЕИ-МС (+ve): MW расч. для C43H79NO2 (M+Н)+; 642,6.
Пример 4: Липид АТХ-002
[00348] Липидные частицы, содержащие зкДНК, могут быть получены или введены в состав в комбинации с липидом АТХ-002, имеющим структуру:

[00349] Липид АТХ-002 описан в WO 2015/074085, содержание которого включено в настоящий документ полностью посредством ссылки. Его синтезируют следующим образом:
[00350] Синтез метил-8-бромоктаноата: В атмосфере N2 8-бромоктановую кислоту (60 г, 1 экв.) растворяют в 400 мл сухого метанола. По каплям добавляют 10 капель концентрированной H2SO4 и реакционную смесь перемешивают при нагревании с обратным холодильником в течение трех часов.
[00351] Реакцию отслеживают с помощью тонкослойной хроматографии (ТСХ) до завершения. Растворитель полностью удаляют под вакуумом. Реакционную смесь разводят этилацетатом и промывают водой. Водный слой реэкстрагировали этилацетатом. Весь органический слой промывают насыщенным раствором NaHCO3. Органический слой повторно промывают водой и наконец промывают солевым раствором. Продукт высушивают над безводным Na2SO4 и концентрируют.
[00352] Синтез диметил-8,8'-(бензандиил)диоктаноата: берут сухой K2CO3 (104,7 г, 6 экв.) и добавляют к сухому диметилформамиду в атмосфере N2. Медленно добавляют бензиламин (13,54 г, 1 экв.) в диметилформамиде. Затем добавляют метил-8-бромоктаноат (60 г, 2 экв.), растворенный в диметилформамиде, при комнатной температуре. Реакционную смесь нагревают до 80°С и поддерживают реакцию в течение 36 часов при перемешивании.
[00353] Реакцию отслеживают с помощью тонкослойной хроматографии до завершения. Реакционный продукт охлаждают до комнатной температуры и добавляют воду. Соединение экстрагируют этилацетатом. Водный слой реэкстрагировали этилацетатом. Весь органический слой промывали водой и в конце солевым раствором. Продукт высушивают над безводным Na2SO4 и концентрируют.
[00354] Реакционный продукт очищают с помощью колоночной хроматографии на силикагеле в 3% метаноле в хлороформе. При использовании системы ТСХ с 10% метанолом в хлороформе продукт мигрирует с коэффициентом удерживания Rf: 0,8, при визуализации путем карбонизации в нингидрине. Указанное соединение представляет собой светло-коричневую жидкость. Структуру подтверждают с помощью1H-ЯМР.
[00355] Синтез диметил-8,8'-азандиилдиоктаноата: Диметил-8,8'-(бензандиил)диоктаноат (3,5 г, 1 экв.) переносят в стеклянный сосуд для гидрирования и добавляют 90 мл этанола, а затем 10% Pd/C (700 мг). Реакционную смесь встряхивают в смесительном аппарате Парра при атмосферном давлении 50 фунтов/кв. дюйм Н2 в течение двух часов при комнатной температуре. Реакционный продукт фильтруют через целит и промывают горячим этилацетатом. Фильтрат концентрируют под вакуумом.
[00356] Синтез диметил-8,8'-((трет-бутоксикарбонил)азандиил)диоктаноата:
Диметил-8,8'-азандиилдиоктаноат (32 г, 1 экв.) переносят в сухом ДХМ (700 мл) и сухом Et3N (9 г; 4 экв.) в реакционную массу и охлаждают до 0°С. Вос-ангидрид (31,3 г, 1,5 экв.), разведенный в ДХМ, добавляют по каплям в вышеописанную реакцию. После завершения добавления реакционную смесь перемешивают при комнатной температуре в течение трех часов.
[00357] Реакцию гасят водой и отделяют слой в ДХМ. Водную фазу реэкстрагируют ДХМ и объединенные слои в ДХМ промывают солевым раствором и высушивают Na2SO4. После концентрации собирают неочищенное соединение. Неочищенный реакционный продукт очищают с помощью колоночной хромато графин, используя 012% этилацетата в гексане. Единственный продукт мигрирует при тонкослойной хроматографии в 20% этилацетате в гексане с Rf, равным 0,5, при карбонизации нингидрином.
[00358] Синтез 8,8'-((трет-бутоксикарбонил)азандиил)диоктановой кислоты:
Диметил-8,8'-((трет-бутоксикарбонил)азандиил)диоктаноат (21 г, 1 экв.) переносят в сухой ТГФ (200 мл). Добавляют 6Н водный раствор гидроксида натрия (175 мл) при комнатной температуре. Реакцию поддерживают при перемешивании в течение ночи при комнатной температуре.
[00359] Реакционную массу испаряют под вакуумом при 25°С для удаления ТГФ. Реакционный продукт подкисляют 5Н HCl. К водному слою добавляют этилацетат. Отделенный органический слой промывали водой и водный слой реэкстрагировали этилацетатом. Объединенные органические слои промывают солевым раствором и высушивают над безводным Na2SO4. Концентрация указанного раствора дает неочищенный продукт.
[00360] Синтез ди((Z)-нон-2-ен-1-ил)8,8'((трет-бутоксикарбонил)азандиила): 8,8'-((трет-бутоксикарбонил)азандиил)диоктановую кислоту (18 г, 1 экв.) растворяют в сухом ДХМ (150 мл). В указанный раствор добавляют HATU (26,15 г, 2,1 экв.). D-изопропилэтиламин (14,81 г, 3,5 экв.) медленно добавляют в реакционную смесь при комнатной температуре. Внутренняя температура поднимается до 40°С и образуется раствор бледно-желтого цвета. В реакционную смесь добавляют ДМАП (400 мг, 0,1 экв.), а затем раствор цис-2-нонен-1-ола (9,31 г, 2 экв.) в сухом ДХМ. Реакционная смесь меняет цвет на коричневый. Реакционную смесь перемешивают в течение пяти часов при комнатной температуре.
[00361] Реакцию проверяют с помощью тонкослойной хроматографии до завершения. В реакционный продукт добавляют воду, и экстрагируют реакционный продукт ДХМ. Слой в ДХМ промывают водой, а затем солевым раствором. Органический слой высушивают над безводным Na2SO4 и концентрируют с получением неочищенного соединения.
[00362] Синтез АТХ-002: Ди((Z)-нон-2-ен-1-ил)8,8'((трет-бутоксикарбонил)азандиил)диоктаноат (13,85 ммоль, 9 граммов) растворяют в сухом ДХМ (150 мл). ТФК добавляют при 0°С для инициации реакции. Реакционной температуре позволяют медленно повыситься до комнатной температуры в течение 30 минут при перемешивании. Тонкослойная хроматография показывает, что реакция завершена. Реакционный продукт концентрируют под вакуумом при 40°С, неочищенный остаток разводят ДХМ и промывают 10% раствором NaHCO3. Водный слой реэкстрагируют ДХМ, объединенные органические слои промывают солевым раствором, высушивают над Na2SO4 и концентрируют. Собранный неочищенный продукт растворяют в сухом ДХМ (85 мл) в атмосфере газообразного азота. Добавляют трифосген, реакционную смесь охлаждают до 0°С и добавляют Et3N по каплям. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Тонкослойная хроматография показывает, что реакция завершена. Растворитель ДХМ удаляют из реакционной массы путем дистилляции в атмосфере N2. Реакционный продукт охлаждают до 0°С, разводят ДХМ (50 мл) и добавляют 2-(диметиламино)этандиол-HCl (0,063 моль, 8,3 г), а затем Et3N (сухой). Затем реакционную смесь перемешивали в течение ночи при комнатной температуре. Тонкослойная хроматография показывает, что реакция завершена. Реакционный продукт разводят 0,3 М раствором HCl (75 мл) и отделяют органический слой. Водный слой реэкстрагируют ДХМ и объединенные органические слои промывают 10% водным раствором K2CO3 (75 мл) и высушивают над безводным Na2SO4. Концентрация растворителя дает неочищенный продукт. Неочищенное соединение очищают на колонке с силикагелем (100-200 меш), используя 3% МеОН/ДХМ.
Пример 5: (13Z,16Z)-N,N-диметил-3-нонилдокоза-13,16-диен-1-амин (соединение 32)
Липидные частицы, содержащие зкДНК, могут быть получены или введены в состав в комбинации с (13Z,16Z)-N,N-диметил-3-нонилдокоза-13,16-диен-1-амином (соединением 32), имеющим структуру:

[00364] Соединение 32 описано в WO 2012/040184, содержание которого включено в настоящий документ полностью посредством ссылки. Его синтезируют следующим образом:
[00365] Синтез α,β-ненасыщенного амида (vii):

[00366] Силиламидный реагент Петерсона (3,1 г, 16,7 ммоль) растворяют в ТГФ (35 мл) и охлаждают до -63°С. В указанный раствор добавляют nBuLi (16,7 ммоль, 6,7 мл 2,5М раствора). Реакцию нагревают до температуры окружающей среды в течение 30 минут. Кетон (iii) (5,0 г, 11,9 ммоль) растворяют в ТГФ (25 мл) во второй колбе. Раствор кетона переносят в реагент Петерсона на 30 минут при поддержании температуры между -60°С и -40°С. Реакцию нагревают до -40°С в течение 1 часа, затем нагревают до 0°С в течение 30 минут. Реакцию гасят бикарбонатом натрия, разводят дополнительной водой и разделяют между водой/гексанами. Органические слои промывают солевым раствором, высушивают над сульфатом натрия, фильтруют и испаряют in vacuo. Очищение с применением флэш-хроматографии (0-40% МТВЕ/гексаны) дает α,β-ненасыщенный амид (vii).1H ЯМР (400 МГц, CDCl3) δ 5,75 (s, 1H), 5,36 (m, 4H), 3,01 (s, 3H), 2,99 (s, 3H), 2,78 (t, 2H), 2,28 (t, 2H), 2,05 (m, 6H), 1,35 (m, 34H), 0,89 (m, 6H).

[00367] α,β-ненасыщенный амид (vii) (1 г, 2,1 ммоль) и LS-Селектрид (4,1 ммоль, 4,1 мл 1М раствора) объединяют в закрытой пробирке и нагревают до 60°С в течение 24 часов. Реакцию охлаждают до температуры окружающей среды и разделяют между растворами хлорида аммония и гептана. Органические слои высушивают над сульфатом натрия, фильтруют и испаряют in vacuo с получением амида (viii). Указанный промежуточный продукт непосредственно переносят в следующую реакцию без очищения.
[00368] В альтернативном варианте восстановление конъюгата α,β-ненасыщенного амида (vii) включает использование восстановления с гидридом меди.

[00369] [В круглодонной колбе объемом 5 л медный катализатор (9,77 г, 17,13 ммоль) растворяют в толуоле (1713 мл) в атмосфере азота. К указанному раствору одной порцией добавляют ПМГС от Aldrich (304 мл, 1371 ммоль). Реакцию выдерживают в течение 5 минут. К растворам добавляют α,β-ненасыщенный амид (vii) (167,16 г, 343 ммоль). Затем к указанной смеси добавляют трет-амиловый спирт (113 мл, 1028 ммоль) в течение 3 часов с помощью шприцевого насоса. После завершения добавления в реакционный раствор добавляют ~1700 мл 20% NH4OH малыми частями. Внимание: в начале гашения происходит интенсивное выделение пузырьков и вспенивание, необходимо тщательное наблюдение и медленное, малыми частями добавление гидроксида аммония. Реакционная смесь разделяется между водой и гексанами. Органические слои фильтруют через целит и испаряют in vacuo. Итоговый эластичный твердый материал превращают в порошок с применением механической мешалки в гексанах с получением твердых частиц малого размера, которые затем фильтруют и промывают гексанами. Затем органические слои испаряют in vacuo и очищают с применением флэш-хроматографии (силикагель, 0-15% этилацетата/гексанов) с получением требуемого амида (viii). ЖХ/МС (М+Н)=490,7.
[00370] Синтез соединения 32: К раствору амида (viii) (2,85 г, 5,8 ммоль) добавляют алюмогидрид лития (8,7 ммоль, 8,7 мл 1М раствора). Реакционную смесь перемешивают при температуре окружающей среды в течение 10 минут, после чего гасят реакцию путем медленного добавления раствора декагидрата сульфата натрия. Твердые вещества фильтруют и промывают ТГФ, фильтрат испаряют in vacuo. Неочищенную смесь очищают с применением препаративной хроматографии с обращенной фазой (колонка С8) с получением (13Z,16Z)-N,N-диметил-3-нонилдокоза-13,16-диен-1-амина (соединение 32) в виде масла. МСВР (М+Н) расчета. 476,5190.1H ЯМР (400 МГц, CDCl3) δ 5,37 (m, 4H), 2,78 (t, 2H), 2,42 (m, 8H), 2,05 (q, 4H), 1,28 (m, 41H), 0,89 (m, 6H).
Пример 6: Соединения 6 и 22
[00371] Липидные частицы, содержащие зкДНК, могут быть получены или введены в состав в комбинации с соединениями 6 или 22, имеющими структуры:

[00372] Соединения 6 и 22 описаны в WO 2015/199952, содержание которого включено в настоящий документ полностью посредством ссылки. Соединения 6 и 22 синтезировали следующим образом:
[00373] Синтез соединения 6: Раствор нонан-1,9-диола (12,6 г) в метиленхлориде (80 мл) обрабатывают 2-гексилдекановой кислотой (10,0 г), ДЦК (8,7 г), и ДМАП (5,7 г). Раствор перемешивают в течение двух часов. Реакционную смесь фильтруют и удаляют растворитель. Остаток растворяют в подогретом гексане (250 мл) и оставляют для кристаллизации. Раствор фильтруют и удаляют растворитель. Остаток растворяют в метиленхлориде и промывают разведенной соляной кислотой. Органическую фракцию высушивают над безводным сульфатом магния, фильтруют и удаляют растворитель. Остаток проводят через колонку с силикагелем (75 г) с применением 0-12% этилацетата/гексана в качестве элюента, с получением 9-(2'-гексилдеканоилокси)нонан-1-ола в виде масла.
[00374] Продукт растворяют в метиленхлориде (60 мл) и обрабатывают хлорхроматом пиридиния (6,4 г) в течение четырех часов. Добавляют диэтиловый эфир (200 мл) и фильтруют супернатант через слой силикагеля. Удаляют растворитель из фильтрата и полученное масло пропускают через колонку с силикагелем (75 г) в градиенте этилацетата/гексана (0-12%), с получением 9-(2'-этилгексаноилокси)нонаналя в виде масла.
[00375] Раствор неочищенного продукта (6,1 г), уксусной кислоты (0.34 г) и 2-N,N-диметиламиноэтиламина (0,46 г) в метиленхлориде (20 мл) обрабатывают триацетоксиборгидридом натрия (2,9 г) в течение двух часов. Указанный раствор разводят метиленхлоридов, промывают водным гидроксидом натрия, а затем водой. Органическую фазу высушивают над безводным сульфатом магния, фильтруют и удаляют растворитель. Остаток проводят через колонку с силикагелем (75 г) в градиенте метанола/метиленхлорида (0-8%), а затем через вторую колонку (20 г) в градиенте метиленхлорида/уксусной кислоты/метанола. Очищенные фракции растворяют в метиленхлориде, промывают разведенным водным раствором гидроксида натрия, высушивают над безводным сульфатом магния, фильтруют и удаляют растворитель, с получением требуемого продукта в виде бесцветного масла.
[00376] Синтез соединения 22: На этапе 1 к раствору 6-бромгексановой кислоты (20 ммоль, 3,901 г), 2-гексил-1-деканола (1,8 экв., 36 ммоль, 8,72 г) и 4-диметиламинопиридина (ДМАП 0,5 экв., 10 ммоль, 1,22 г) в ДХМ (80 мл) добавляют ДЦК (1,1 экв., 22 ммоль, 4,54 г). Итоговую смесь перемешивают при комнатной температуре в течение 16 часов. Осадок удаляют путем фильтрации. Фильтрат концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле с элюцией в градиенте смеси этилацетата в гексанах (0-2%). В результате получают требуемый продукт в виде бесцветного масла.
[00377] На этапе 2 смесь бромида с этапа 1 (1,34 экв., 7,88 г, 18,8 ммоль), N,N-диизопропилэтиламина (1,96 экв., 27,48 ммоль, 4,78 мл) и N,N-диметилэтилендиамина (1 экв., 14,02 ммоль, 1,236 г, 1,531 мл) в ацетонитриле (70 мл) в колбе объемом 250 мл, оснащенной конденсатором, нагревают при 79°С (масляная баня) в течение 16 часов. Реакционную смесь охлаждают до комнатной температуры и концентрируют. Остаток вводят в смесь этилацетата и гексанов (1:9) и воды. Фазы разделяют, промывают водой (100 мл) и солевым раствором. Затем высушивают над сульфатом натрия и концентрируют (8,7 г масла). Неочищенное масло (8,7 г) очищают с помощью колоночной хроматографии на силикагеле (0-3% МеОН в хлороформе). Фракции, содержащие требуемый продукт, объединяют и концентрируют. Остаток растворяют в 1 мл гексана и фильтруют через слой силикагеля (34 мм, промытый 8 мл гексана). Фильтрат высушивают в потоке Ar и досушивают in vacuo в течение ночи. Получают требуемый продукт в виде бесцветного масла.1H ЯМР (400 МГц, CDCl3) δ 3,96 (d, 5,8 Гц, 4Н), 2,55-2,50 (m, 2H), 2,43-2,39 (m, 4H), 3,37-3,32 (m, 2H), 2,30 (t, 7,5 Гц, 4H), 2,23 (s, 6H), 1,63 (квинтетоподобный, 7,6 Гц, 6Н), 1,48-1,40 (m, 4H), 1,34-1,20 (52H), 0,88 (t-подобный, 6,8 Гц, 12Н).
Пример 7: Получение липидных составов
[00378] Липидные наночастицы (ЛНЧ) могут быть получены с соотношением общей массы липидов к массе зкДНК приблизительно 10:1-30:1. Вкратце, ионизируемый липид (например, МС3, АТХ-002, соединение 6, соединение 22, соединение формулы (А') или (А''), или соединение формулы (В'), (В') или (В'')), некатионный липид (например, дистеароилфосфатидилхолин (DSPC)), компонент для обеспечения целостности мембраны (такой как стерол, например, холестерин) и молекулу конъюгированного липида (такого как ПЭГ-липид, например, 1-(монометоксиполиэтиленгликоль)-2,3-димиристоилглицерол, со средней молекулярной массой ПЭГ 2000 («ПЭГ-ДМГ»)), солюбилизируют в спирте (например, этанол) в молярном соотношении 50:10:38,5:1.5. зкДНК разводят до требуемой концентрации в буферном растворе. Например, зкДНК может быть разведена до концентрации 0,1 мг/мл - 0,25 мг/мл в буферном растворе, содержащем ацетат натрия, ацетат натрия с хлоридом магния, цитрат, яблочную кислоту, или яблочную кислоту с хлоридом натрия. Согласно одному примеру зкДНК разводят до 0,2 мг/мл в 10-50 мМ цитратном буфере, рН 4. Спиртовой раствор липидов смешивают с водным раствором зкДНК с применением, например, шприцевых насосов или ударно-распылительного смесителя, в соотношении приблизительно 1:5-1:3 (по объему) при общей скорости потока выше 10 мл/мин. Согласно одному примеру спиртовой раствор липидов смешивают с водным раствором зкДНК в соотношении приблизительно 1:3 (по объему) при скорости потока 12 мл/мин. Спирт удаляют и буфер заменяют ФСБ путем диализа. Как вариант, буфер может быть заменен на ФСБ с использованием центрифужных пробирок. Удаление спирта и одновременная замена буфера может осуществляться, например, путем диализа или тангенциальной поточной фильтрации. Полученные липидные наночастицы фильтруют через стерильный фильтр с размером пор 0,2 мкм до дальнейшего использования.
Пример 8: Анализ состава на основе липидных частиц
[00379] Размер липидных наночастиц может быть определен с использованием квазиупругого рассеяния света в системе Malvem Zetasizer Nano ZS (Малверн, Великобритания); их диаметр составляет приблизительно 55-95 нм или приблизительно 70-90 нм диаметр.
[00380] Значение pKa состава с катионными липидами может быть скоррелировано с эффективностью ЛНЧ для доставки нуклеиновых кислот (см. источники: Jayaraman et al, Angewandte Chemie, International Edition (2012), 51(34), 8529-8533; Semple et al. Nature Biotechnology 28, 172-176 (2010), оба из которых включены полностью посредством ссылки). Предпочтительный диапазон значений pKa составляет от ~5 до ~7. Значение pKa для каждого катионного липида определяют в липидных наночастицах с применением анализа, основанного на флуоресценции 2-(п-толуидино)-6-нафталинсульфоновой кислоты (TNS). Липидные наночастицы, содержащие катионный липид/DSPC/холестерин/ПЭГ-липид (50/10/38,5/1,5 мол. %) в ФСБ при общей концентрации липидов 0,4 мМ могут быть получены с применением процесса в поточной линии согласно описанию в настоящем документе и других источниках. TNS может быть получена в виде 100 мкМ стокового раствора в дистиллированной воде. Везикулы могут быть разведены до 24 мкМ липидов в 2 мл забуференных растворов, содержащих 10 мМ HEPES, 10 мМ MES, 10 мМ аммония ацетат, 130 мМ NaCl, где рН варьирует от 2,5 до 11. Может быть добавлена аликвота раствора TNS с получением конечной концентрации 1 мкМ, и после перемешивания на вортексе измеряют интенсивность флуоресценции при комнатной температуре на люминесцентном спектрофотометре SLM Aminco Series 2 при длине волны возбуждения и длине волны излучения 321 нм и 445 нм. Данные флуоресценции могут быть обработаны методом наилучшего приближения с применением сигмоидальной функции; pKa измеряют как рН, получая значения полумаксимальной интенсивности флуоресценции.
[00381] Инкапсуляция зкДНК в липидные частицы может быть определена путем анализа с Oligreen®. Oligreen® представляет собой сверхчувствительный флуоресцентный краситель для нуклеиновых кислот для количественного определения олигонуклеотидов и одноцепочечной ДНК или РНК в растворе (доступен от Invitrogen Corporation; Карлсбад, Калифорния). В альтернативном варианте может быть использован PicoGreen®. Вкратце, инкапсуляция может быть определена путем проведения эксклюзионного анализа с не проникающим через мембрану флуоресцентным красителем, в котором задействован краситель, характеризующийся усиленной флуоресценцией при связывании с нуклеиновой кислотой. Инкапсуляцию определяют путем добавления указанного красителя в состав на основе липидных частиц, измерения итоговой флуоресценции и ее сравнения с флуоресценцией, наблюдаемой после добавления небольшого количества неионогенного детергента. Опосредованное детергентом разрушение липидного бислоя высвобождает инкапсулированную зкДНК, что позволяет ей взаимодействовать с не проникающим через мембрану красителем. Инкапсуляция зкДНК может быть рассчитана как Е=(I0-I)/I0, где I и I0 относится к интенсивности флуоресценции до и после добавления детергента.
[00382] Относительная активность может быть определена путем измерения экспрессии люциферазы в печени через 4 часа после введения путем инъекции в хвостовую вену. Активность сравнивают при дозе 0,3 и 1,0 мг зкДНК/кг и выражают в нг люциферазы/г печени при измерении через 4 часа после введения.
Пример 9: Оценка примеров зкДНК-ЛНЧ
[00383] Получали липидные наночастицы, содержащие примеры зкДНК, с различными соотношениями N/P (например, 3, 4, 5 и 6) с использованием раствора липидов, содержащих МС3, DSPC, холестерин и ДМГ-ПЭГ2000 (молярное соотношение 50:10:38,5:1,5). Получали водные растворы зкДНК-вектора в забуференных растворах, содержащих соли, такие как натрия ацетат, натрия ацетат с хлоридом магния, цитрат, яблочная кислота, или яблочная кислота с хлоридом натрия. Раствор липидов и раствор зкДНК смешивали с использованием собственной процедуры на наноассемблере с общей скоростью потока 12 мл/мин при соотношении липида и зкДНК 1:3 (по объему).
Характеризация
[00384] Определяли размер липидных наночастиц и инкапсуляцию зкДНК в липидных наночастицах. Размер частиц определяли с применением динамического светорассеяния (ZEN3600, Malvern Instruments). Эффективность инкапсуляции рассчитывали путем определения содержания неинкапсулированной зкДНК, измеряя флуоресценцию после добавления PicoGreen (Thermo Scientific) во взвесь ЛНЧ (Cfree) и сравнивая указанное значение с общим содержанием зкДНК, полученным после лизиса ЛНЧ с применением 1% Triton X-100 (Ctotal), где % инкапсуляции = (Ctotal-Cfree)/Ctotal × 100. Результаты показаны на фиг. 9-11.
Анализ эндосомалъного высвобождения
[00385] Определяли эффект сыворотки и БСА на инкапсулирование и высвобождение зкДНК из ЛНЧ. Имитирующие эндосомы анионные липосомы получали, смешивая DOPS:DOPC:DOPE (молярное соотношение 1:1:2) в хлороформе, с последующим испарением растворителя под вакуумом. Высушенную липидную пленку ресуспендировали в DPBS с краткой обработкой ультразвуком, с последующей фильтрацией через шприцевый фильтр с размером пор 0,45 мкм с получением анионной липосомы.
[00386] ЛНЧ, содержащие зкДНК и БСА или сыворотку, смешивали в равных объемах. Смесь инкубировали при 37°С в течение 20 минут. Затем в смесь ЛНЧ с БСА или сывороткой добавляли анионную липосому с требуемым молярным соотношением анионного/катионного липида в DPBS при рН 7,5 или 6,0. Затем итоговую комбинацию инкубировали при 37°С в течение еще 15 мин. В качестве контроля равный объем DPBS вместо анионной липосомы добавляли в смесь ЛНЧ с БСА или сывороткой. Количество свободной зкДНК при разной обработке при рН7,5 или рН6,0 рассчитывали путем определения содержания неинкапсулированной зкДНК, измеряя флуоресценцию после добавления PicoGreen (Thermo Scientific) во взвесь ЛНЧ (Cfree) и сравнивая указанное значение с общим содержанием зкДНК, полученным после лизиса ЛНЧ с использованием 1% Triton Х-100 (Ctotal), где % Свободной зкДНК = Cfree/Ctotal × 100. % зкДНК, высвобождаемой после инкубации с анионными липосомами, рассчитывали с использованием приведенного ниже уравнения:

[00387] Результаты показаны на фиг. 12-15 и обобщены в таблице 5.

Связывание АроЕ
[00388] Определяли связывание липидных наночастиц с АроЕ. ЛНЧ (10 мкг/мл) инкубировали при 37°С в течение 20 минут с равным объемом рекомбинантного АроЕ3 (500 мкг/мл) в 1× DPBS. После инкубации образцы ЛНЧ 10-кратно разводили с использованием 1× DPBS и анализировали, используя хроматографию с гепарин-сефарозой на AKTA pure 150 (GE Healthcare) в условиях, представленных ниже:

[00389] Результаты показаны на фиг. 16.
Экспрессия HEK293
[00390] Экспрессию зкДНК, инкапсулированной в липидных наночастицах, анализировали следующим образом.
[00391] Клетки HEK293 поддерживали при 37°С с 5% CO2 в культуральной среде DMEM + GlutaMAX™ (Thermo Scientific) с добавлением 10% фетальной бычьей сыворотки и 1% пенициллина-стрептомицина. Клетки высевали в 96-луночные планшеты с плотностью, составляющей 30000 клеток/лунку за день до трансфекции. Реагент для трансфекции липофектамин™ 3000 (Thermo Scientific) использовали для трансфекции контрольной зкДНК в количестве 100 нг/лунку в соответствии с протоколом производителя. Контрольную зкДНК разводили в Opti-MEM™ (Thermo Scientific) и добавляли реагент Р3000™. Затем разводили липофектамин™ 3000 до конечной концентрации, составляющей 3%, в Opti-MEM™. Разведенный липофектамин™ 3000 добавляли к разведенной зкДНК в соотношении 1:1 и инкубировали в течение 15 минут при комнатной температуре. Затем требуемое количество комплекса зкДНК с липидом или ЛНЧ добавляли непосредственно в каждую лунку, содержащую клетки. Клетки инкубировали при 37°С с 5% CO2 в течение 72 часов. Уровни экспрессии секретированного фактора IX в HEK293-кондиционированной среде определяли с применением набора VisuLize FIX Antigen ELISA Kit (Affinity Biologies) в соответствии с инструкциями производителя. Результаты показаны на фиг. 17-19.
Пример 10: Соединения для состава А
[00392] Липидные наночастицы (ЛНЧ), содержащие зкДНК, могут быть получены или введены в состав в комбинации с одним или более соединениями формулы (I) или (II), предпочтительно образующими липосому или липидную наночастицу, подходящую для хранения и терапевтической доставки зкДНК-вектора.
[00393] Соединения формулы (I), подходящие для получения состава на основе липидных частицы, имеют структуру:

где
каждый из R1, R2, R4 и R5 независимо выбран из группы, состоящей из водорода, C1-С20 алкила, замещенного C1-C20 алкила, С2-С20 алкенила, замещенного С2-С20 алкенила, С2-С20 алкинила и холестерила;
R3 выбран из группы, состоящей из C1-C20 алкила, замещенного C1-C20 алкила, С2-С20 алкенила, замещенного С2-С20 алкенила и С2-С20 алкинила;
L выбран из группы, состоящей из S, О, C1-C20 алкенила, замещенного C1-C20 алкенила;
X1 отсутствует, представляет собой
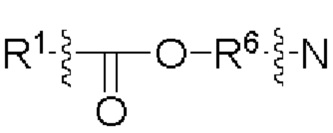
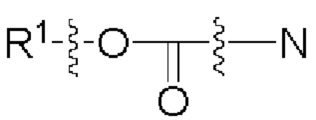
X2 отсутствует, представляет собой

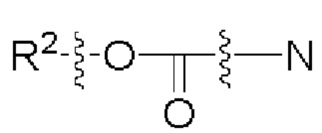
каждый R6 независимо выбран из группы, состоящей из C1-C20 алкила, замещенного C1-C20 алкила, С2-С20 алкенила, замещенного С2-С20 алкенила и С2-С20 алкинила;
или их соли.
[00394] Соединение формулы (I), подходящее для получения состава на основе липидных частицы, имеет структуру:

где
каждый из R1, R2 и R4 независимо выбран из группы, состоящей из водорода, C1-C20 алкила, замещенного C1-C20 алкила, С2-С20 алкенила, замещенного С2-С20 алкенила, С2-С20 алкинила и холестерила;
R3 выбран из группы, состоящей из C1-C20 алкила, замещенного C1-C20 алкила, С2-С20 алкенила, замещенного С2-С20 алкенила и С2-С20 алкинила;
R5 отсутствует или выбран из группы, состоящей из C1-C20 алкила, замещенного C1-C20 алкила, С2-С20 алкенила, замещенного С2-С20 алкенила и С2-С20 алкинила;
L выбран из группы, состоящей из S, О, C1-C20 алкенила, замещенного C1-C20 алкенила;
X1 отсутствует, представляет собой


X2 отсутствует, представляет собой
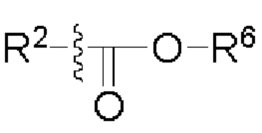

каждый R6 независимо выбран из группы, состоящей из водорода, C1-C20 алкила, замещенного C1-C20 алкила, С2-С20 алкенила, замещенного С2-С20 алкенила и С2-С20 алкинила; и


или их соли.
[00395] В некоторых примерах соединений формулы (I) или формулы (II) R1 представляет собой разветвленный C12-C20 алкил; R2 представляет собой линейный С5-С10 алкил или разветвленный C12-C20 алкил; каждый из R4 и R3 независимо представляет собой линейный C1-C5 алкил; каждый R6 независимо представляет собой линейный или разветвленный C1-С5 алкил; и L представляет собой линейный C1-С3 алкил.
[00396] Примеры соединений формулы (I) или (II) могут быть представлены одним или более соединениями, выбранными из соединений, показанных на фиг. 20.
[00397] Общий синтез соединений формулы (I) и (II) показан на фиг. 21 и 22, где каждое значение R выбрано независимо.
[00398] В общем случае, исходные соединения, описанные выше, и другие соединения могут быть приобретены в коммерческих источниках или получены в соответствии со способами, известными специалисту в данной области техники. Специалист сможет сконструировать даже скаффолды с большим числом заместителей для соединений, описанных в настоящем документе, используя стандартные синтетические способы и обращаясь к справочной литературе и базам данных, посвященным химическим соединениям и химическим реакциям, как известно специалисту в данной области техники. Подходящая справочная литература и исследования, где подробно описан синтез реактантов, подходящих для получения соединений согласно описанию в настоящем документе, или указаны источники на статьи, где описано получение соединений согласно описанию в настоящем документе, включают, например, "Synthetic Organic Chemistry", John Wiley and Sons, Inc. New York; S.R. Sandier et al, "Organic Functional Group Preparations," rd. Ed., Academic Press, New York, 1983; H.O. House, "Modem Synthetic Reactions," 2nd Ed., W.A. Benjamin, Inc. Menio Park, Calif., 1972; Т.L. Glichrist, "Heterocyclic Chemistry," 2nd Ed. John Wiley and Sons, New York, 1992; J. March, "Advanced Organic Chemistry: reactions, Mechanisms and Structure," 5th Ed., Wiley hiterscience, New York, 2001; Специфические и аналогичные реактанты могут также быть идентифицированы в указателях известных химических веществ, составленных Химической реферативной службой Американского химического общества, которые доступны в большинстве публичных и университетских библиотек, а также в базах данных в сети Интернет (более подробная информация может быть получена в Американском химическом обществе, Вашингтон, округ Колумбия). Химические вещества, известные, но не являющиеся коммерчески доступными в каталогах, могут быть изготовлены компаниями, осуществляющими заказной химический синтез, при этом многие компании поставщики стандартных химикатов дополнительно предоставляют услуги заказного синтеза.
Пример 11: Соединения для состава В
[00399] Другие липидные частицы, содержащие зкДНК, могут быть получены или введены в состав в комбинации с одним или более соединениями формулы (III), (IV) или (V), описанными в указанном примере, предпочтительно образующими липосому или липидную наночастицу, подходящую для хранения и терапевтической доставки зкДНК-вектора.
[00400] Соединения формулы (III), подходящие для применения при получении состава на основе липидных частиц, имеют структуру:
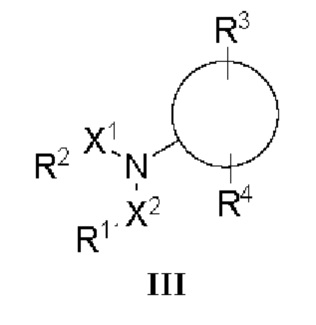
где

каждый из R1, R2, R3 и R4 независимо выбран из группы, состоящей из водорода, C1-C20 алкила, замещенного C1-C20 алкила, С2-С20 алкенила, замещенного С2-С20 алкенила, С2-С20 алкинила и холестерила; и X1 отсутствует, представляет собой C1-C20 алкил, замещенный C1-C20 алкил,
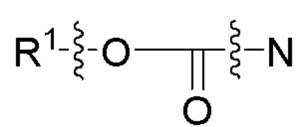
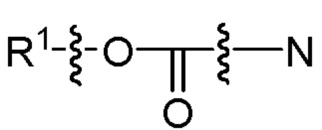
X2 отсутствует, представляет собой C1-C20 алкил, замещенный C1-C20 алкил,


или их соль.
[00401] В некоторых примерах соединений формулы (III) по меньшей мере один из R1, R2, R3 и R4 представляет собой:

[00402] Соединение формулы (III) может представлять собой соединение, выбранное из соединений, показанных на фиг. 23.
[00403] Соединения формулы (IV), подходящие для применения при получении состава на основе липидных частиц, имеют структуру:

где:
n равен 0-150; и каждый из R1, R2 и R3 независимо выбран из группы, состоящей из водорода, C1-C20 алкила, замещенного C1-C20 алкила, С2-С20 алкенила, замещенного С2-С20 алкенила, С2-С20 алкинила и холестерила;
или их соли.
[00404] Соединения формулы (V), подходящие для применения при получении состава на основе липидных частиц, имеют структуру:
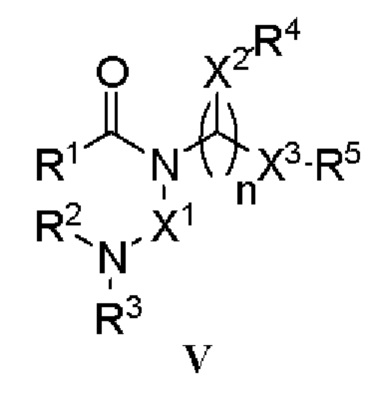
где каждый из R1, R2, R3, R4 и R5 независимо выбран из группы, состоящей из: водорода, C1-C20 алкила, замещенного C1-C20 алкила, С2-С20 алкенила, замещенного С2-С20 алкенила, С2-С20 алкинила и холестерила;
X1 отсутствует, представляет собой C1-C20 алкил, замещенный C1-C20 алкил или
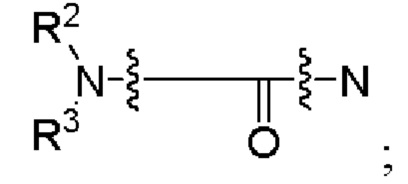
X2 отсутствует, представляет собой C1-C20 алкил, замещенный C1-C20 алкил,


X3 отсутствует, представляет собой C1-C20 алкил, замещенный C1-C20 алкил,

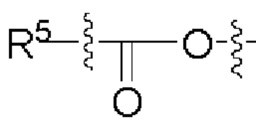
или их соль.
[00405] Примеры соединений формулы (V) включают, не ограничиваясь перечисленными, следующие:

где n и m независимо равны 0-20; и
каждый из R1 и R2 независимо выбран из группы, состоящей из: водорода, C1-C20 алкила, замещенного C1-C20 алкила, С2-С20 алкенила, замещенного С2-С20 алкенила, С2-С20 алкинила и холестерила;
или их соль.
[00406] Общий синтез соединений формулы (III), формулы (IV) и (V) показан на фиг. 24, где каждое значение R выбрано независимо.
[00407] Специалистам в данной области техники будет понятно, что в процессе, описанном в настоящем документе, функциональные группы промежуточных соединений могут нуждаться в защите подходящими защитными группами. Такие функциональные группы включают гидроксильные группы, аминогруппы, меркаптогруппы и карбоновую кислоту. Подходящие защитные группы для гидроксильных групп включают триалкилсилил или диарилалкилсилил (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), тетрагидропиранил, бензил и т.п. Подходящие защитные группы для аминогрупп, амидиногрупп и гуанидиногрупп включают трет-бутоксикарбонил, бензилоксикарбонил и т.п. Подходящие защитные группы для меркаптогрупп включают -C(O)-R'' (где R'' представляет собой алкил, арил или арилалкил), п-метоксибензил, тритил и т.п. Подходящие защитные группы для карбоновой кислоты включают сложные алкил-, арил- или арилалкилэфиры. Защитные группы могут быть добавлены или удалены в соответствии со стандартными методиками, которые известны специалисту в данной области техники, и согласно описанию в настоящем документе. Применение защитных групп описано подробно в источнике: Green, T.W. and P.G.M. Wutz, Protective Groups in Organic Synthesis (1999), 3rd Ed., Wiley (включенном в настоящий документ полностью посредством ссылки). Как будет понятно специалисту в данной области техники, защитная группа может также представлять собой полимерную смолу, такую как смола Ванга, смола Ринка или 2-хлортритил-хлоридная смола. В целом, стартовые компоненты могут быть получены из таких источников, как Sigma Aldrich, Lancaster Synthesis, Inc., Maybridge, Matrix Scientific, TCI, Fluorochem USA, и т.п., или синтезированы в соответствии с источниками, известными специалистам в данной области техники (см., например, источник: Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5e изд. ition (Wiley, December 2000), включенный в настоящий документ полностью посредством ссылки).
Пример 12: Получение липидных составов
[00408] Могут быть получены липосомные наночастицы (ЛНЧ). Катионный липид, DSPC, холестерин и ПЭГ-липид могут быть солюбилизированы в этаноле в молярном соотношении 50:10:38,5:1.5. Липидные наночастицы (ЛНЧ) могут быть получены с соотношением общей массы липидов к массе зкДНК приблизительно 10:1-30:1. Вкратце, зкДНК разводят до 0,2 мг/мл в 10-50 мМ цитратном буфере, рН 4. Шприцевые насосы могут применяться для смешивания раствора липидов в этаноле с водным раствором зкДНК в соотношении приблизительно 1:5-1:3 (по объему) при общей скорости потока выше 15 мл/мин. Затем этанол может быть удален и внешний буфер заменяют на ФСБ путем диализа. Наконец, липидные наночастицы могут быть профильтрованы через стерильный фильтр с размером пор 0,2 мкм. Диаметр липидных наночастиц составляет приблизительно 55-95 нм, в некоторых случаях - приблизительно 70-90 нм, что может быть определено с использованием квазиупругого рассеяния света с помощью системы Malvem Zetasizer Nano ZS (Малверн, Великобритания).
[00409] Значение pKa составов с катионными липидами может быть скоррелировано с эффективностью ЛНЧ для доставки нуклеиновых кислот (см. Jayaraman et al, Angewandte Chemie, International Edition (2012), 51(34), 8529-8533; Semple et al. Nature Biotechnology 28, 172-176 (2010), включенные полностью посредством ссылки). Предпочтительный диапазон значений pKa составляет от ~5 до ~7. Значение pKa каждого катионного липида в липидных наночастицах определяют с применением анализа, основанного на флуоресценции 2-(п-толуидино)-6-нафталинсульфоновой кислоты (TNS). Липидные наночастицы, содержащие катионный липид/DSPC/холестерин/ПЭГ-липид (50/10/38,5/1,5 мол. %) в ФСБ при общей концентрации липидов 0,4 мМ, могут быть получены с применением процесса в поточной линии согласно описанию в настоящем документе и в других источниках. TNS могут быть получены в виде 100 мкМ стокового раствора в дистиллированной воде. Везикулы может быть разведены до концентрации липидов 24 мкМ в 2 мл забуференных растворов, содержащих 10 мМ HEPES, 10 мМ MES, 10 мМ аммония ацетат, 130 мМ NaCl, где значение рН варьирует от 2,5 до 11. Может быть добавлена аликвота раствора TNS с получением конечной концентрации 1 мкМ, и после перемешивания на вортексе измеряют интенсивность флуоресценции при комнатной температуре на люминесцентном спектрофотометре SLM Aminco Series 2 при длине волны возбуждения и длине волны излучения 321 нм и 445 нм. Данные флуоресценции могут быть обработаны методом наилучшего приближения с применением сигмоидальной функции; pKa измеряют как рН, получая значения полумаксимальной интенсивности флуоресценции.
[00410] Состав с липидными наночастицами может также быть получен с использованием следующего молярного соотношения: 50% катионного липида/10% дистеароилфосфатидилхолина (DSPC) / 38,5% холестерина / 1,5% ПЭГ-липида («ПЭГ-ДМГ», т.е. (1-(монометоксиполиэтиленгликоль)-2,3-димиристоилглицерола, при средней молекулярной массе ПЭГ 2000). Относительная активность может быть определена путем измерения экспрессии люциферазы в печени через 4 часа после введения путем инъекции в хвостовую вену согласно описанию в настоящем документе. Активность сравнивают при дозе 0,3 и 1,0 мг зкДНК/кг и выражают в нг люциферазы/г печени при измерении через 4 часа после введения.
[00411] Составы с терапевтическими содержащими зкДНК-конструкции соединениями могут быть получены с применением следующего молярного соотношения: 50% катионного липида/ 10% дистеароилфосфатидилхолина (DSPC) / 38,5% холестерина / 1,5% ПЭГ-липида («ПЭГ-ДМА», 2-[2-(w-метокси(полиэтиленгликоль-2000)этокси]-N,N-дитетрадецилацетамида). Относительная активность может быть определена путем измерения экспрессии люциферазы в печени через 4 часов после введения путем инъекции в хвостовую вену согласно описанию выше. Указанная активность может быть измерена для дозы 0,3 и 1,0 мг мРНК или ДНК/кг и выражена в нг люциферазы/г печени при измерении через 4 часа после введения, согласно описанию выше.
Пример 13: Экспрессия in vivo белка трансгена люциферазы с зкДНК-векторов
[00412] Экспрессию in vivo белка трансгена с зкДНК-векторов, полученных из конструкций 1-8, описанных выше, оценивали у мышей. Тестировали зкДНК-вектор, полученный из зкДНК-плазмидной конструкции 1 (согласно описанию в таблице 5 в примере 1), и он продемонстрировал продолжительную и устойчивую трансгенную экспрессию люциферазы в модели на мышах после гидродинамической инъекции композиции, содержащей зкДНК-вектор, содержащийся в липидных наночастицах, в хвостовую вену. Трансгенную экспрессию люциферазы измеряли с помощью визуализации IVIS после внутривенного введения мышам CD-1® IGS (Charles River Laboratories; мыши дикого типа).
[00413] В исследовании оценивают биораспределение гидродинамически введенного экспрессирующего люциферазу невирусного вектора для генной терапии с помощью IVIS, после внутривенного введения мышам CD-1® IGS. Основа представляет собой стерильный ФСБ. В указанном исследовании двум группам по пять (5) CD-1 мышей вводили либо ФСБ, либо 0,35 мг/кг зкДНК, кодирующей люциферазу, посредством гидродинамической инъекции 1,2 мл в хвостовую вену. Экспрессию люциферазы оценивают с помощью визуализации IVIS на 3, 4, 7, 14, 21, 28, 31, 35 и 42 день. Вкратце, мышам внутрибрюшинно инъецируют 150 мг/кг субстрата люциферина, а затем оценивают люминесценцию всего тела с помощью визуализации IVIS.
[00414] Экспрессия люциферазы in vivo: самцам мышей CD-1 IGS возрастом 5-7 недель (Charles River Laboratories) вводят 0,35 мг/кг 0,35 мг/кг зкДНК-векторной конструкции 14 Luc (группа 1) в объеме 1,2 мл посредством в/в гидродинамического введения на 0 день. Некоторым животным в каждой группе повторно вводят идентичную дозу зкДНК-векторной конструкции 1-4 Luc (группа 1) на 28 день.
[00415] Экспрессию люциферазы с зкДНК-вектора оценивают по in vivo хемилюминесценции с применением инструментария IVIS® после внутрибрюшинной (в/б) инъекции 150 мг/кг субстрата люциферазы. Визуализацию IVIS осуществляют на 3 день, 4 день, 7 день, 14 день, 21 день, 28 день, 31 день, 35 день и 42 день, и собранные органы визуализируют ех vivo после умерщвления на 42 день.
[00416] На протяжении исследования животных ежедневно взвешивают и проводят мониторинг общего состояния здоровья и самочувствия. При умерщвлении кровь каждого животного собирают путем терминальной пункции сердца, разделяют на два части и обрабатывают для получения 1) плазмы и 2) сыворотки; плазму мгновенно замораживают, а сыворотку используют для панели анализов на ферменты печени, после чего мгновенно замораживают. Кроме того, собирают печень, селезенки, почки и паховые лимфатические узлы (ЛУ) и визуализируют ех vivo с применением IVIS.
[00417] Экспрессию люциферазы в печени оценивают с применением ИФА ELISA на люциферазу MAXDISCOVERY® (ВIOО Scientific/PerkmElmer), кПЦР на люциферазу в образцах печени, гистопатологического анализа образцов печени и/или панели анализов на ферменты печени в сыворотке (VetScanVS2; Abaxis Preventative Care Profile Plus).
Источники
[00418] Все источники, перечисленные и раскрытые в настоящем описании и примерах, в том числе патенты, патентные заявки, международные патентные заявки и публикации, включены в настоящий документ полностью посредством ссылок.
Реферат
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая липидную наночастицу для доставки бескапсидного невирусного ДНК-вектора в целевой сайт и фармацевтическую композицию для доставки гетерологичной нуклеиновой кислоты (варианты). В одном варианте реализации липидная наночастица содержит ионизируемый липид и невирусный бескапсидный ДНК-вектор с ковалентно замкнутыми концами (зкДНК-вектор), где указанный зкДНК-вектор содержит по меньшей мере одну гетерологичную нуклеотидную последовательность, функционально расположенную между асимметричными инвертированными концевыми повторами (асимметричными ITR), где ITR асимметричны относительно друг друга и где один или более из асимметричных ITR модифицирован делецией, инсерцией и/или заменой по меньшей мере в одной из областей, выбранных из A, A’, B, B’, C, C’, D и D’, и причем по меньшей мере один из асимметричных ITR содержит функциональный сайт концевого разрешения и сайт связывания Rep. Изобретение расширяет арсенал средств для доставки бескапсидного невирусного ДНК-вектора в целевой сайт. 3 н. и 34 з.п. ф-лы, 37 ил., 5 табл., 13 пр.
Формула
Документы, цитированные в отчёте о поиске
Содержащие нуклеиновые кислоты липидные частицы и относящиеся к ним способы

Комментарии