Способы и композиции для устойчивой иммунотерапии - RU2696876C2
Код документа: RU2696876C2
Чертежи





Описание
Перекрестная ссылка на родственную заявку
Настоящая заявка претендует на приоритет согласно 35 U.S.С. § 119(e) по предварительной заявке на патент США No. 61/899,826, поданной 4 ноября 2013 г., все содержание которой таким образом включено путем ссылки в настоящее описание.
Область техники, к которой относится изобретение
Настоящее изобретение относится к композициям и способам, связанным с иммунотерапией и медициной.
Уровень техники
По всему описанию приводятся технические и патентные публикации, снабженные идентификационными ссылками или арабскими цифрами. Полная библиография ссылок, соответствующих арабским цифрам, содержится в описании, перед формулой изобретения. Содержание всех приведенных ссылок включено путем ссылки в настоящую заявку для более полного описания современного состояния той области техники, к которой относится данное изобретение.
Аутоиммунные заболевания вызываются атакой иммунной системы на собственные ткани. Идеальная терапия должна быть способна избирательно пресекать аутоиммунные реакции (против всех антигенных эпитопов, поражаемых при данном заболевании) без нарушения системного иммунитета (иммунных реакций на чужеродные антигены). К сожалению, специфичности лимфоцитов, задействованных в каком-то одном аутоиммунном заболевании, разнообразны и нечетко определены, что делает это трудной задачей.
Сущность изобретения
В ответ на такую потребность в данной области, здесь описаны терапевтические композиции, применимые при лечении аутоиммунных заболеваний. Один аспект касается способа экспансии и/или развития популяций антипатогенных аутореактивных Т-клеток и/или В-клеток у нуждающегося в этом субъекта, причем способ включает или же в основном состоит или же состоит из введения этому субъекту наночастиц ("NP") с комплексом антиген-МНС класса II ("NP-комплекса"), причем антигены представлены антигенами, связанными с аутоиммунитетом, или аутоантигенами. В некоторых аспектах все антигены на данных NP идентичны или же они могут быть разными. В другом аспекте антигены на NP имеют различные аминокислотные последовательности, но выделены из одного и того же антигенного белка. В другом аспекте антигены на NP происходят из разных белков-антигенов. В другом аспекте MHCII являются одинаковыми или разными.
В одном аспекте изобретения предусмотрен NP-комплекс, содержащий или же в основном состоящий или же состоящий из наночастиц; белка МНС класса II и причастного к заболеванию антигена, который может иметь вид комплекса антиген/MHCII, для применения при экспансии и/или созревании одной или нескольких популяций регуляторных В-клеток и клеток TR1 (например, клеток TR1 и CD4+) у субъекта, причем наночастицы имеют диаметр, выбранный из следующей группы: диаметром от около 1 нм до около 100 нм; диаметром от около 1 нм до около 50 нм или от около 1 нм до около 20 нм или от около 5 нм до около 20 нм, а соотношение числа комплексов антиген-MHCII к наночастицам составляет от около 10:1 до около 1000:1. В одном аспекте комплекс имеет плотность МНС класса II от около 0,05 pMHCII/100 нм2 площади поверхности NP (включая покрытие) до около 25 pMHCII/100 нм2 площади поверхности NP (включая покрытие). Антиген представлен аутоантигеном, участвующим в аутоиммунной реакции или сходной с таковой, к примеру, типа преддиабета, диабета, рассеянного склероза ("MS") или родственных рассеянному склерозу заболеваний, причем необязательно, если заболевание представлено преддиабетом или диабетом, то аутоантиген представлен эпитопом из антигена, экспрессирующегося в β-клетках поджелудочной железы, или аутоантигена IGRP, инсулина, GAD или белка IA-2. В другом аспекте компонент МНС класса II включает в себя весь или часть HLA-DR, HLA-DQ или HLA-DP. Комплекс антиген-МНС класса II ковалентно или нековалентно связан с наночастицами. Наночастицы могут быть биоабсорбируемыми и/или биоразлагаемыми.
В другом аспекте наночастицы не являются липосомами и/или имеют твердое ядро, предпочтительно сердцевину из золота или оксида железа. При ковалентном связывании комплекс антиген-МНС класса II ковалентно связывается с наночастицами через линкер размером менее 5 кДа. В одном аспекте линкер включает полиэтиленгликоль (ПЭГ). рМНС может связываться с наночастицами или с покрытием наночастиц по любой структуре, включая, без ограничения, линкеры или перекрестные сшивки. В одном аспекте МНС связывается с наночастицами или с покрытием направленно через С-конец.
Заявитель обнаружил, что плотность комплексов антиген-МНС класса II на наночастицах способствует терапевтическому эффекту. Итак, как изложено здесь, наночастицы с комплексом антиген-MHCII могут иметь заданную плотность в пределах от 0,05 молекул МНС на 100 нм2 площади поверхности наночастиц (площадь поверхности при измерении вместе с покрытием) в предположении по меньшей мере 2 молекул MHCII либо по меньшей мере 8 или же по меньшей мере 9 или же по меньшей мере 10 или же по меньшей мере 11 или же по меньшей мере 12 молекул MHCII в комплексе с наночастицей. В одном аспекте комплекс имеет плотность MHCII от около 0,01 MHCII на 100 нм2 (0,05 MHCII/100 нм2) до около 30 MHCII/100 нм2 либо от около 0,1 MHCII/100 нм2 до около 25 MHCII/100 нм2 или же от около 0,3 MHCII/100 нм2 до около 25 MHCII/100 нм2 или же от около 0,4 MHCII/100 нм2 до около 25 MHCII/100 нм2 или же от около 0,5 MHCII/100 нм2до около 20 MHCII/100 нм2 или же от около 0,6 MHCII/100 нм2 до около 20 MHCII/100 нм2 или же от около 1,0 MHCII/100 нм2 до около 20 MHCII/100 нм2 или же от около 5,0 MHCII/100 нм2 до около 20 MHCII/100 нм2 или же от около 10,0 MHCII/100 нм2 до около 20 MHCII/100 нм2 или же от около 15 MHCII/100 нм2 до около 20 MHCII/100 нм2 либо по меньшей мере 0,5 или же по меньшей мере 1,0 или же по меньшей мере 5,0 или же по меньшей мере 10,0 или же по меньшей мере 15,0 MHCII/100 нм2, причем площадь поверхности наночастиц в нм2 включает и покрытие. В одном из аспектов, если в комплекс с наночастицей входят 9 или по меньшей мере 9 MHCII, то диапазон плотности составляет от около 0,3 MHCII/100 нм2до около 20 MHCII/100 нм2.
Настоящим изобретением также предусмотрены композиции, содержащие терапевтически эффективное количество NP-комплекса, как описано здесь, и носитель, например, фармацевтически приемлемый носитель. В одном аспекте все NP-комплексы в композиции идентичны. В другом аспекте NP-комплексы в композиции включают в себя различные или разные комплексы МНС-антиген.
Также предусмотрены способы получения комплексов и композиций. Способ может включать или же в основном состоять или же состоять из нековалентного или ковалентного нанесения комплексов антиген-МНС (например, комплексов MHCII) на наночастицы.
Также предусмотрены способы лечения и диагностики. В одном аспекте предусмотрен способ формирования, экспансии и рекрутирования регуляторных В-клеток и/или клеток TR1 (например, клеток TR1 и CD4+) специфичным для антигена образом у нуждающегося в этом субъекта, включающий или же в основном состоящий или же состоящий из введения субъекту эффективного количества NP-комплекса или композиции, как описано здесь.
В другом аспекте предусмотрен способ лечения или профилактики описанных здесь аутоиммунных заболеваний или нарушений, например, MS или родственных MS заболеваний, диабета или преддиабета, у нуждающегося в этом субъекта, который включает или же в основном состоит или же состоит из введения субъекту NP-комплекса или композиции, как описано здесь, причем аутоантиген причастен к подлежащему лечению заболеванию, например, при профилактике или лечении диабета антигеном является причастный к диабету антиген. В другом аспекте аутоиммунное заболевание представлено MS или родственным MS заболеванием, а антиген причастен к MS.
Также предусмотрены наборы. Наборы включают или же в основном состоят или же состоят из описанного здесь NP-комплекса или композиции и инструкций по применению.
В одном аспекте предусмотрен способ получения наночастиц, включающий термическое разложение или нагревание предшественника наночастиц. В одном воплощении наночастицы представляют собой наночастицы металла или оксида металла. В одном воплощении наночастицы представляют собой наночастицы оксида железа. В одном воплощении наночастицы представляют собой наночастицы из золота. В одном воплощении предусмотрены наночастицы, полученные по представленной в изобретении технологии. В одном воплощении предусмотрен способ получения наночастиц из оксида железа, включающий реакцию термического разложения ацетилацетоната железа. В одном воплощении полученные наночастицы оксида железа растворимы в воде. В одном аспекте наночастицы оксида железа подходят для конъюгирования белка. В одном воплощении способ включает в себя одностадийную реакцию термического разложения.
В одном аспекте термическое разложение происходит в присутствии функционализированных молекул ПЭГ. Некоторые неограничительные примеры функционализированных ПЭГ линкеров приведены в табл. 1.
В одном аспекте термическое разложение включает нагревание ацетилацетоната железа. В одном воплощении термическое разложение включает нагревание ацетилацетоната железа в присутствии функционализированных молекул ПЭГ. В одном воплощении термическое разложение включает нагревание ацетилацетоната железа в присутствии бензилового эфира и функционализированных молекул ПЭГ.
Не придерживаясь какой-либо теории, в одном воплощении функционализованные молекулы ПЭГ используются в качестве восстановительных реагентов и в качестве поверхностно-активных веществ. Предусмотренный здесь способ получения наночастиц упрощает и улучшает обычные способы, в которых применяются поверхностно-активные вещества, которые с трудом вытесняются или не полностью вытесняются молекулами ПЭГ, делающими частицы водорастворимыми. Обычно поверхностно-активные вещества либо дорого стоят (например, фосфолипиды), либо токсичны (например, олеиновая кислота или олеиламин). В другом аспекте, не придерживаясь какой-либо теории, способ получения наночастиц исключает необходимость в использовании традиционных поверхностно-активных веществ, обеспечивая тем самым высокую степень молекулярной чистоты и водорастворимости.
В одном воплощении термическое разложение включает в себя ацетилацетонат железа и бензиловый эфир в отсутствие традиционных поверхностно-активных веществ, отличных от используемых здесь.
В одном воплощении температура для термического разложения составляет от около 80 до около 300°С или от около 80 до около 200°С или от около 80 до около 150°С или от около 100 до около 250°С или от около 100 до около 200°С или от около 150 до около 250°С или от около 150 до около 250°С. В одном воплощении время термического разложения занимает примерно от около 1 до около 2 часов.
В одном воплощении способ получения наночастиц из оксида железа включает стадию очистки типа при помощи магнитной колонки Miltenyi Biotec LS.
В одном воплощении наночастицы являются стабильными при 4°С в фосфатно-солевом буфере (PBS) без заметной деградации или агрегации. В одном воплощении наночастицы стабильны в течение по крайней мере 6 месяцев.
В одном аспекте предусмотрен способ получения комплексов с наночастицами, включающий контактирование рМНС с наночастицами оксида железа. Не придерживаясь какой-либо теории, рМНС содержит цистеин на С-карбоксильном конце, который может вступать в реакцию с малеимидной группой в функционализированном ПЭГ при рН от около 6,2 до около рН 6,5 в течение 12-14 часов.
В одном аспекте способ получения комплексов с наночастицами включает стадию очистки типа при помощи магнитной колонки Miltenyi Biotec LS.
Краткое описание фигур
Следующие рисунки входят в состав настоящего описания и включены для дополнительного раскрытия некоторых аспектов настоящего изобретения. Изобретение будет более понятным с привлечением одного или нескольких из этих рисунков в сочетании с подробным описанием конкретных воплощений, представленных здесь.
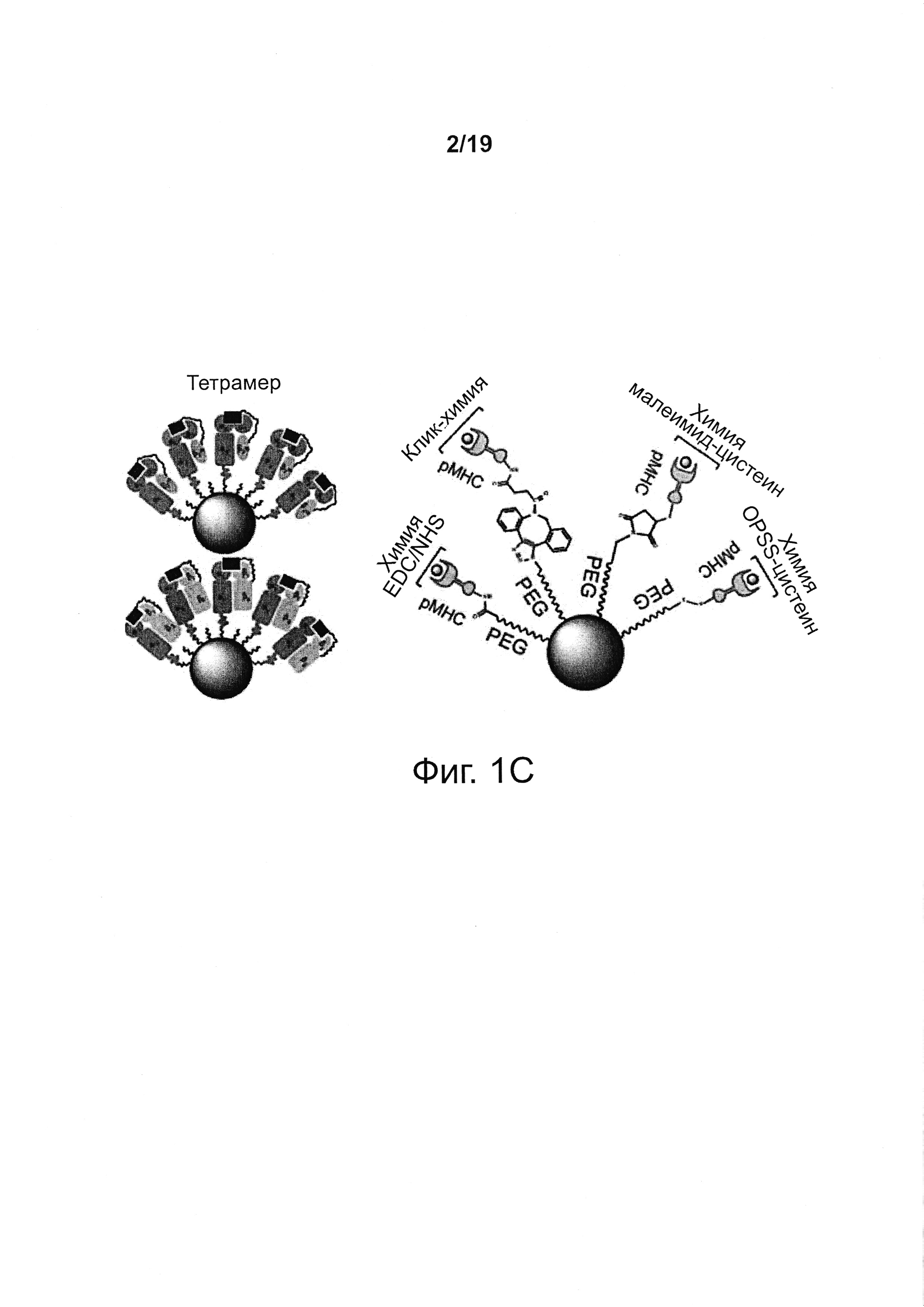
На фиг. 1А-1С представлены схемы NP-комплексов. На фиг. 1А представлена схема одноцепочечной конструкции, экспрессирующей рМНС класса I (сверху), и репрезентативный профиль проточной цитометрии при связывании соответствующего тетрамера рМНС (меченного флуорохромом) с когнатными Т-клетками CD8+. На фиг. 1В представлена схема линкеров и двумерная структура NP-комплексов. Как видно, одна NP может содержать один и тот же антиген, образующий комплекс с ядром наночастицы через различные химические линкеры. На фиг. 1С представлены функционализованные малеимидом NPs, конъюгированные с NPs.
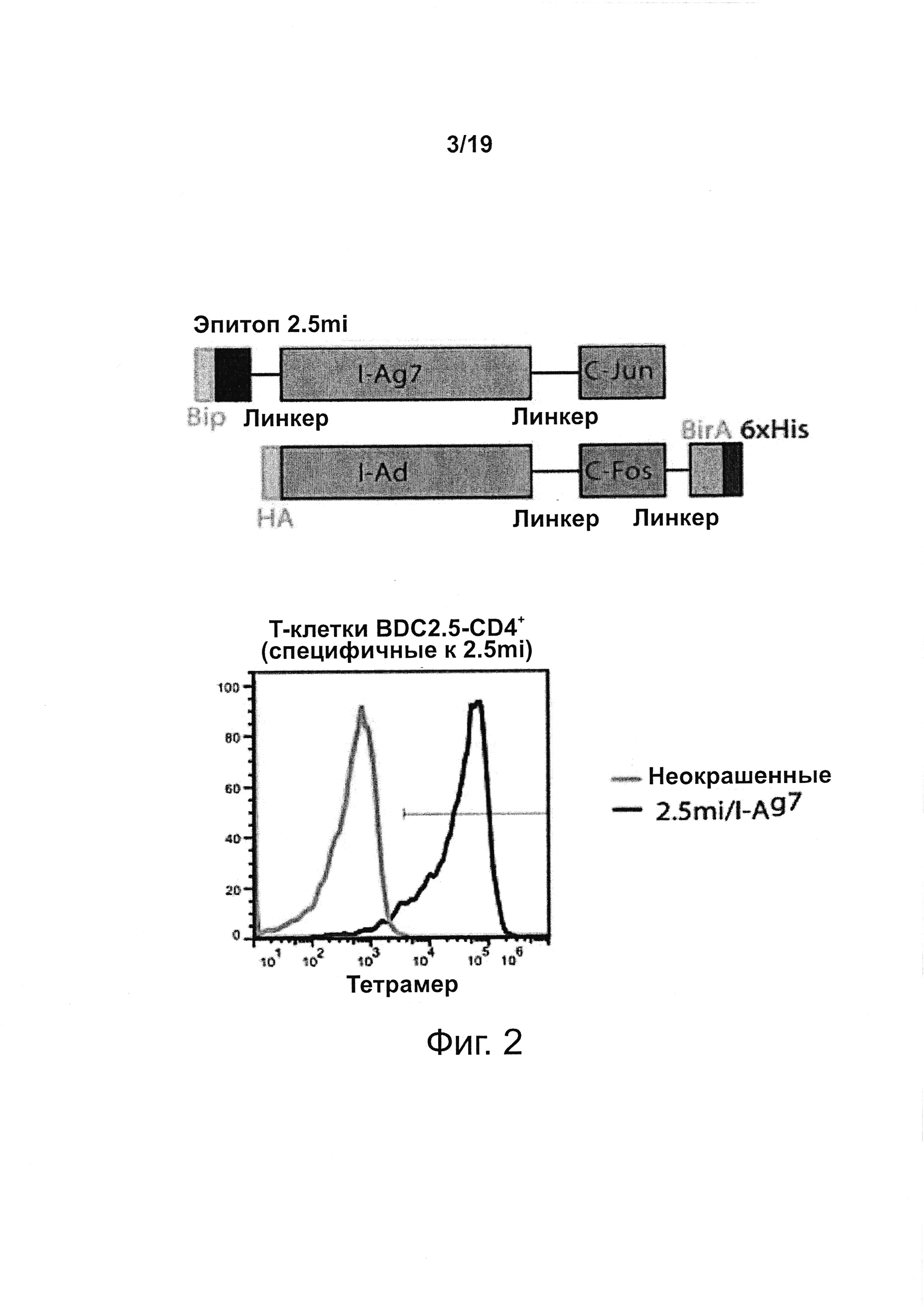
На фиг. 2 представлена структура типичного мономера рМНС класса II (сверху) и репрезентативный FACS-профиль когнатных Т-клеток CD4+, окрашенных соответствующим тетрамером рМНС или оставленных неокрашенными.
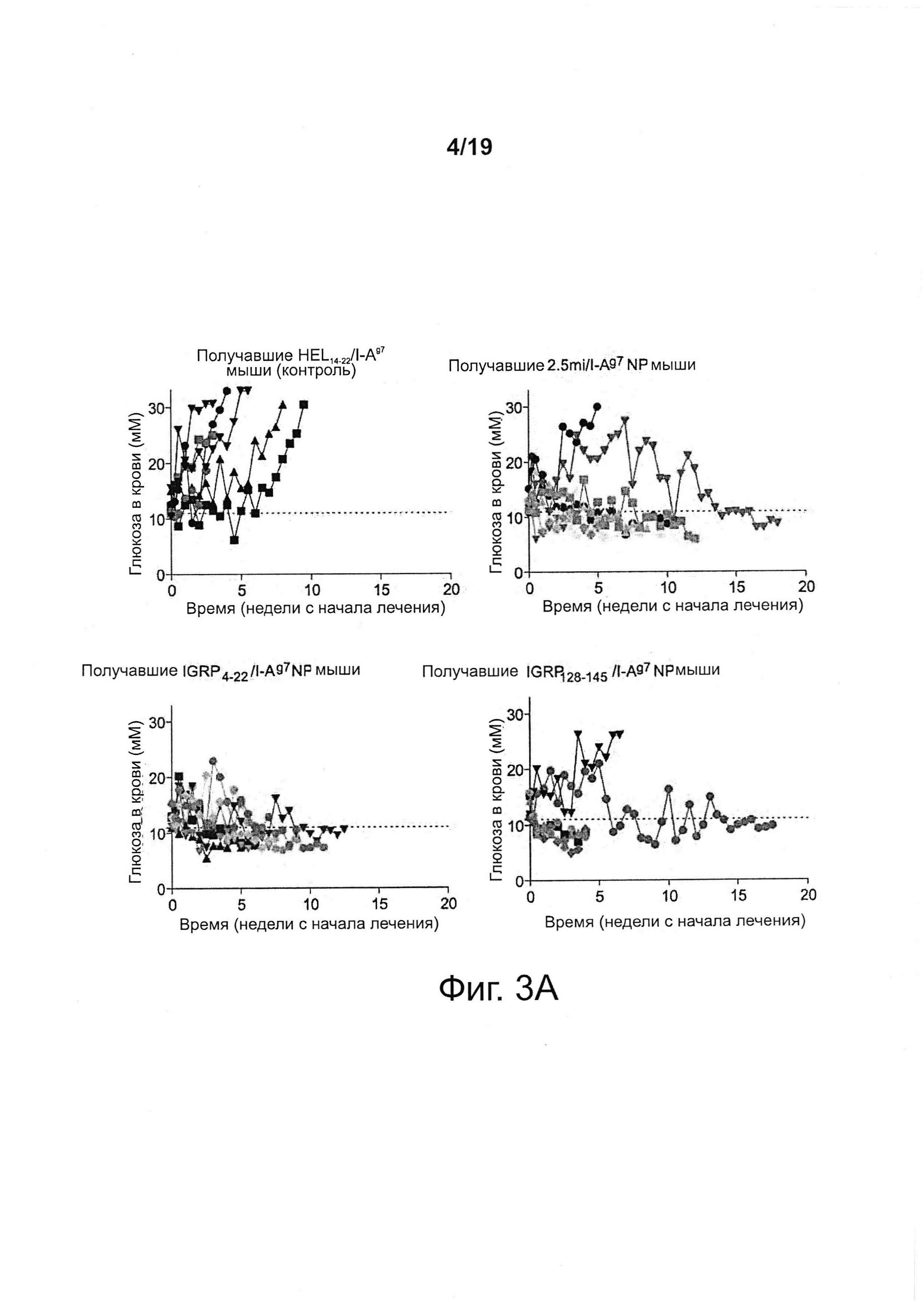
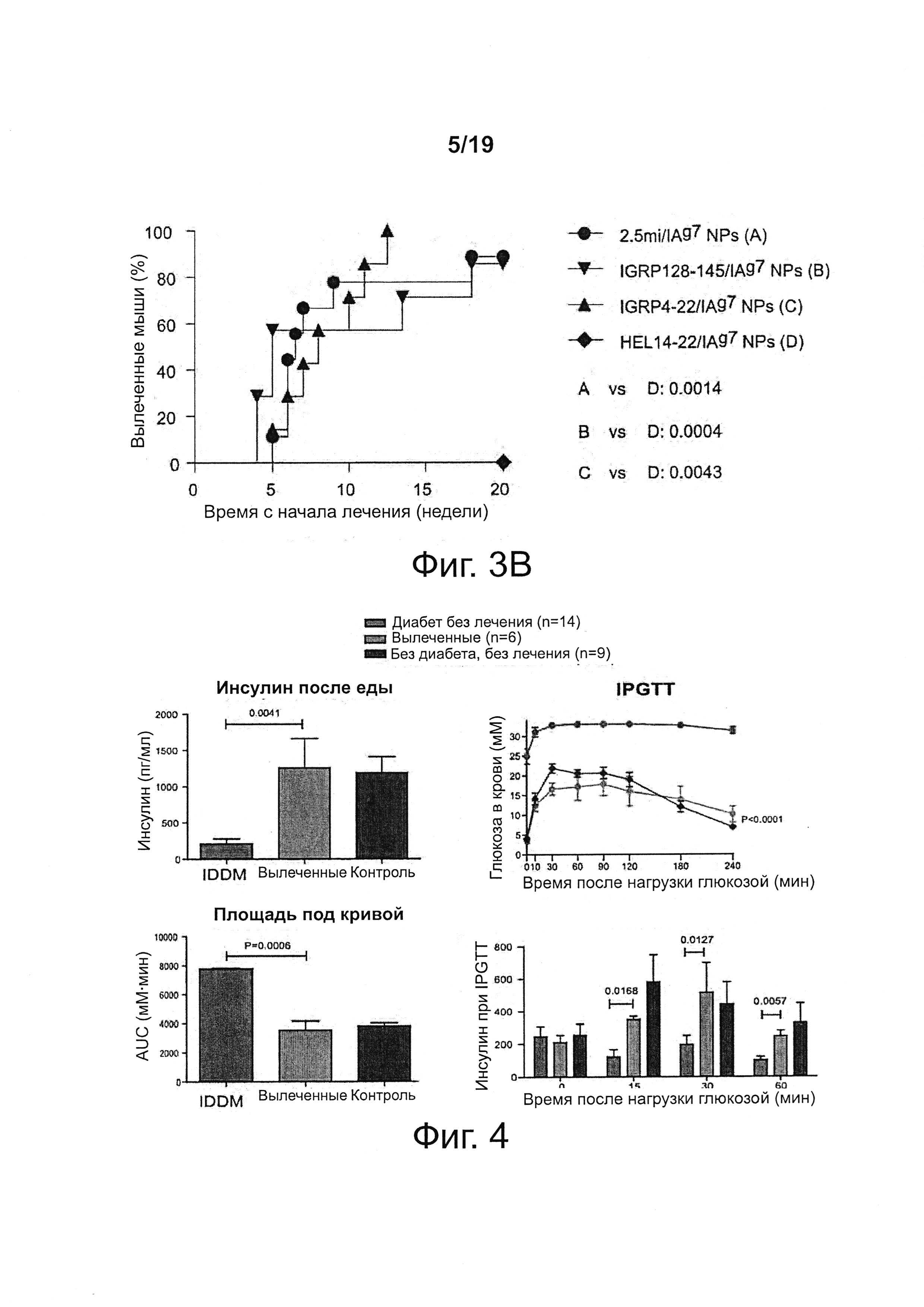
На фиг. 3А-3В показано, что NPs с различными T1D-релевантными рМНС класса II нормализуют гипергликемию у мышей NOD с недавно возникшим диабетом. На фиг. 3А представлены индивидуальные кривые содержания глюкозы в крови у мышей. Мыши считались "излеченными", если у них отмечалась устойчивая нормогликемия в течение 4 недель, после чего лечение отменялось. В качестве контроля использовали HEL14-22, чужеродный антиген. На фиг. 3В представлена частота прекращения заболевания.
На фиг. 4 представлены внутрибрюшинные тесты на толерантность к глюкозе (IPTGTTs) и способность к выработке инсулина у подвергавшиеся длительному лечению мышей. IDDM, страдающие диабетом мыши, не подвергавшиеся лечению; Вылеченные, мыши с нормогликемией в 50-недельном возрасте (> 30 недель после отмены лечения); Контроль сравнимые по возрасту, не страдающие диабетом, не подвергавшиеся лечению мыши (50-недельные).
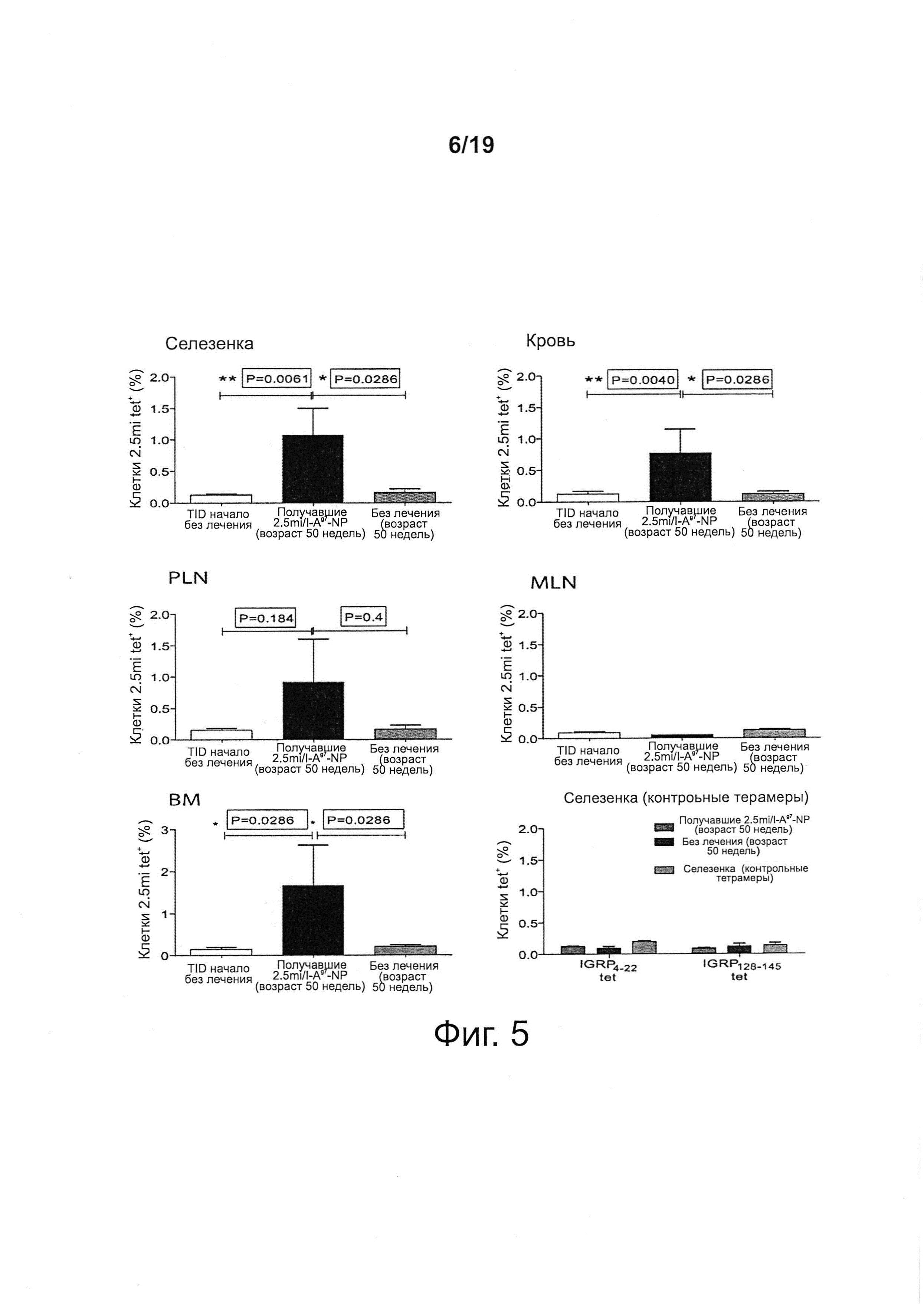
На фиг. 5 показано, что NPs с T1D-релевантными рМНС класса II вызывают экспансию когнатных аутореактивных Т-клеток CD4+. Данные соответствуют мышам, получавшим 2.5mi/I-Ag7-NPs. Внизу справа, экспансия специфична в отношении рМНС на NPs, так как мыши, получавшие 2.5mi/I-Ag7-NPs, не проявляли повышения процента двух других популяций аутореактивных Т-клеток CD4+. PLN, панкреатические лимфатические узлы; MLN, брыжеечные лимфатические узлы; ВМ, костный мозг (резервуар Т-клеток памяти).
На фиг. 6 показано, что NPs с T1D-релевантными рМНС класса II вызывают экспансию когнатных аутореактивных Т-клеток CD4+. Представлена экспансия на селезенке, но аналогичная картина отмечается и в лимфатических узлах поджелудочной железы, в крови и костном мозге. "Начало" соответствует значениям до обработки; "Вылеченные" - это мыши, ставшие нормогликемическими с pMHC-NP (при анализе через > 30 недель после отмены лечения); "IDDM" - это мыши с рецидивами после отмены лечения (~25%); "50-недельные" соответствует не подвергавшимся лечению, не страдающим диабетом контрольным мышам соответствующего возраста.
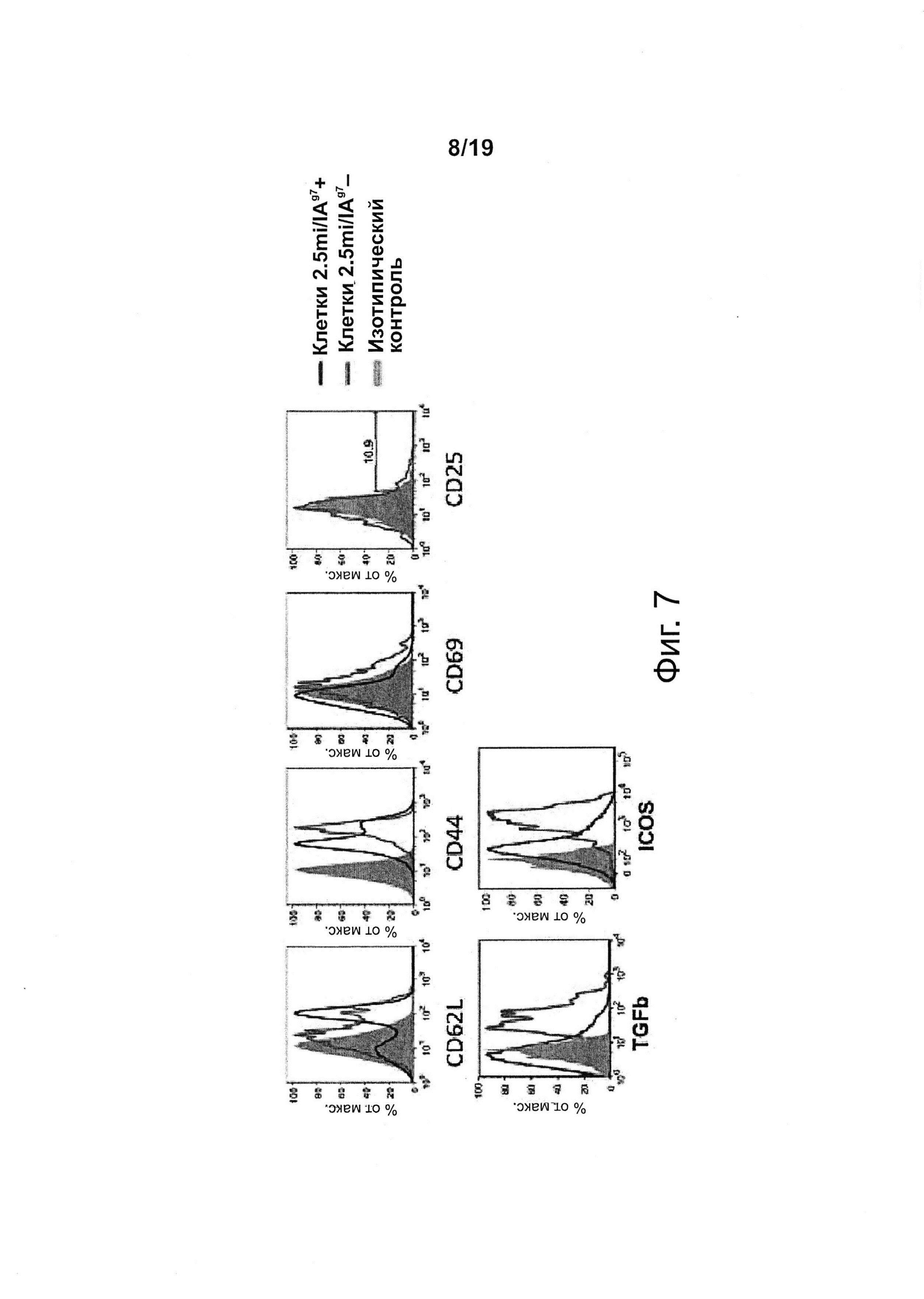
На фиг. 7 показано, что NPs с T1D-релевантными рМНС класса II вызывают экспансию когнатных регуляторных клеток Т-1 ("Tr1 или TR1") типа Т-клеток памяти.
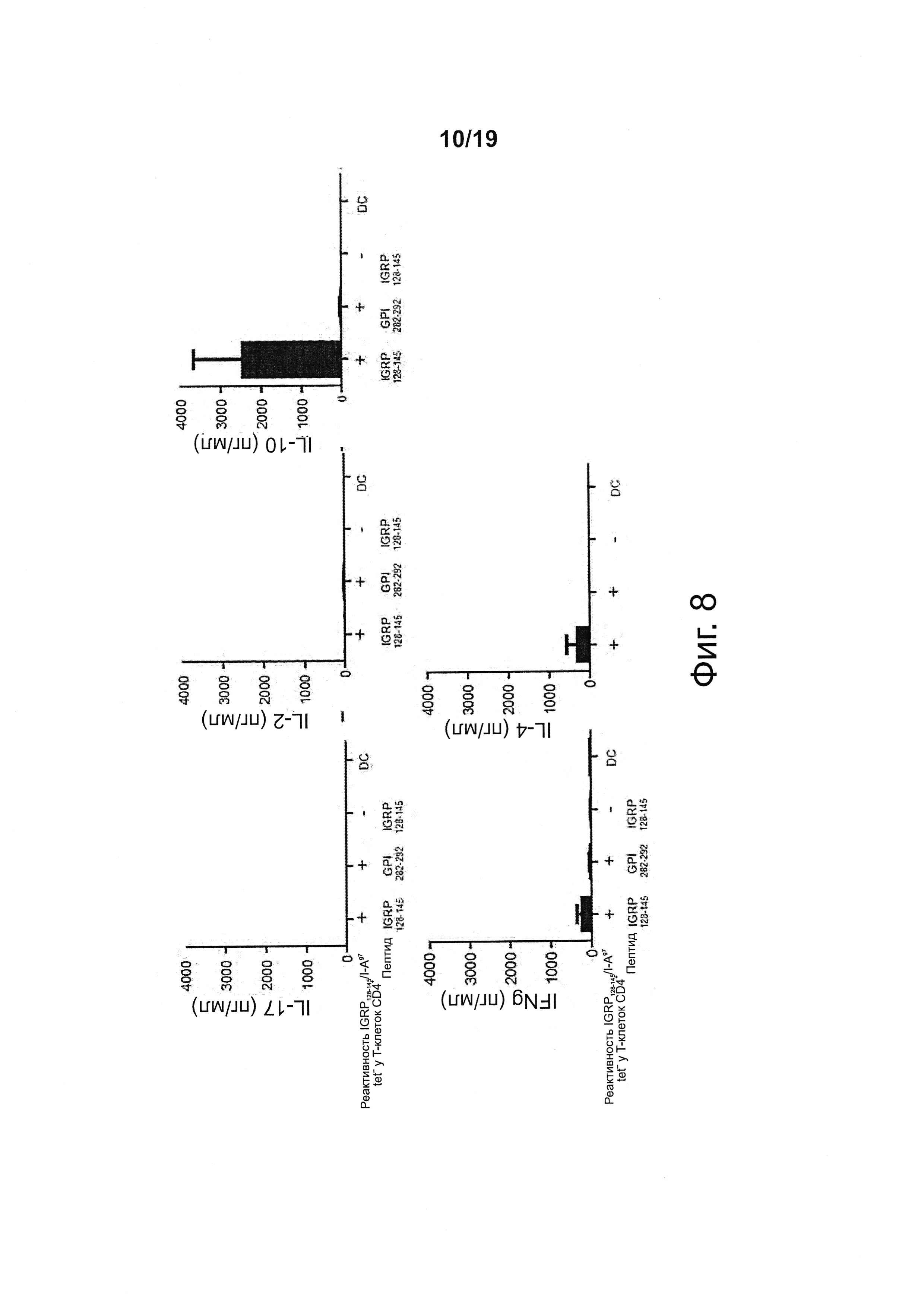
На фиг. 8 показано, что аутореактивные Т-клетки CD4+ после экспансии, вызванной NPs с рМНС класса II, вырабатывают IL-10. Клетки с тетрамерами IGRP126-145/I-Ag7+ из мышей, получавших IGRP126-145/I-Ag7-NPs или контрольные NPs, сортировали, обрабатывали когнатными и некогнатными пептидами, а супернатанты подвергали анализу на содержание цитокинов по технологии Luminex.
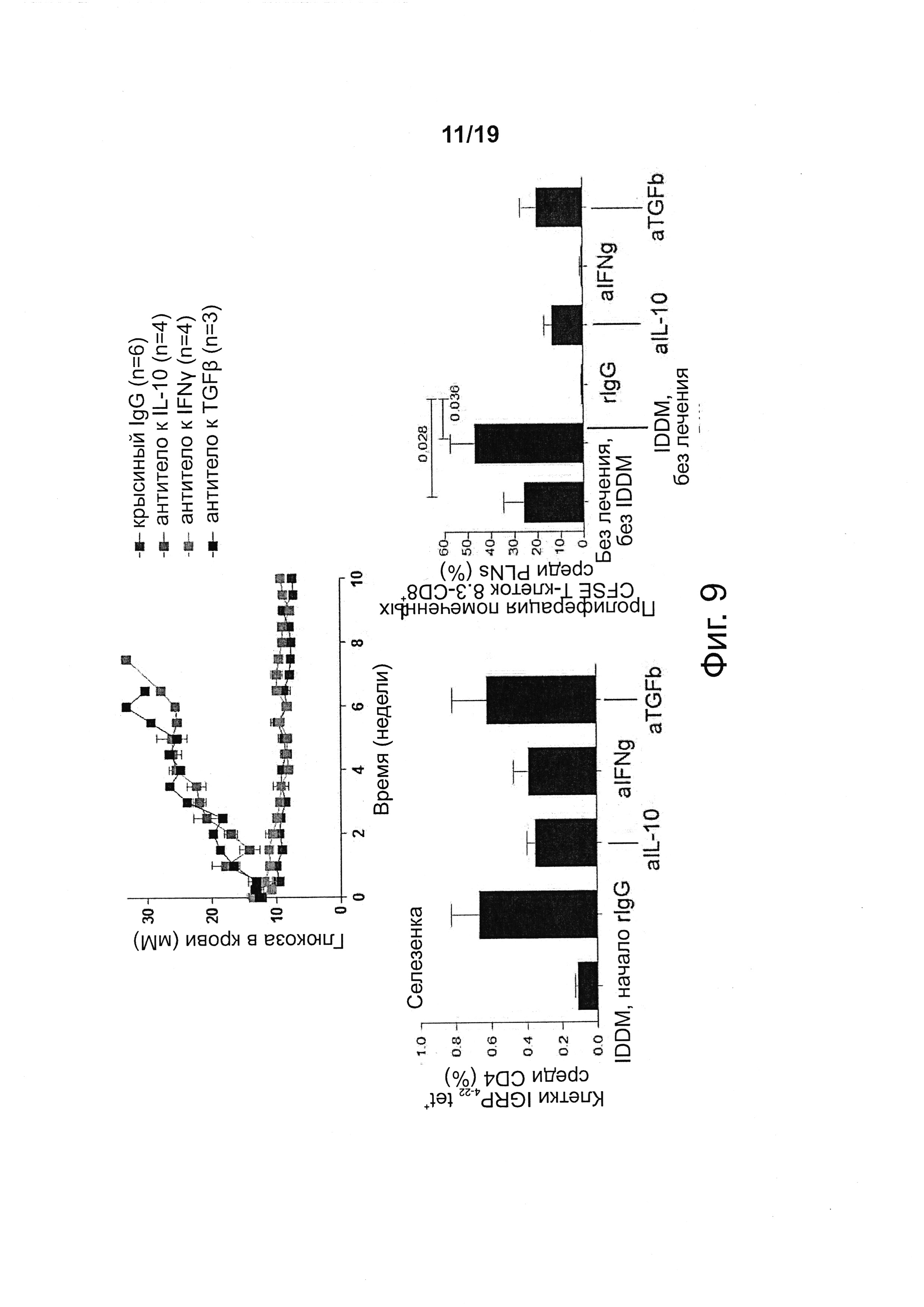
На фиг. 9 показано, что NPs с рМНС класса II обращают гипергликемию зависимым от IL-10 и TGFβ образом. На фиг. 9 показано, что IGRP4-22/IAg7-NPs способны восстанавливать нормогликемию (сверху), вызывать экспансию когнатных клеток Tr1 (внизу слева) и подавлять презентацию аутоантигена в PLNs (для IGRP206-214-реактивных Т-клеток CD8+, внизу справа) у мышей, обработанных блокирующими цитокины антителами ("Abs"). Abs против IL10 и TGFβ частично восстанавливали презентацию аутоантигена и ингибировали терапевтический эффект pMHC-NPs, не нарушая экспансию клеток Tr1.
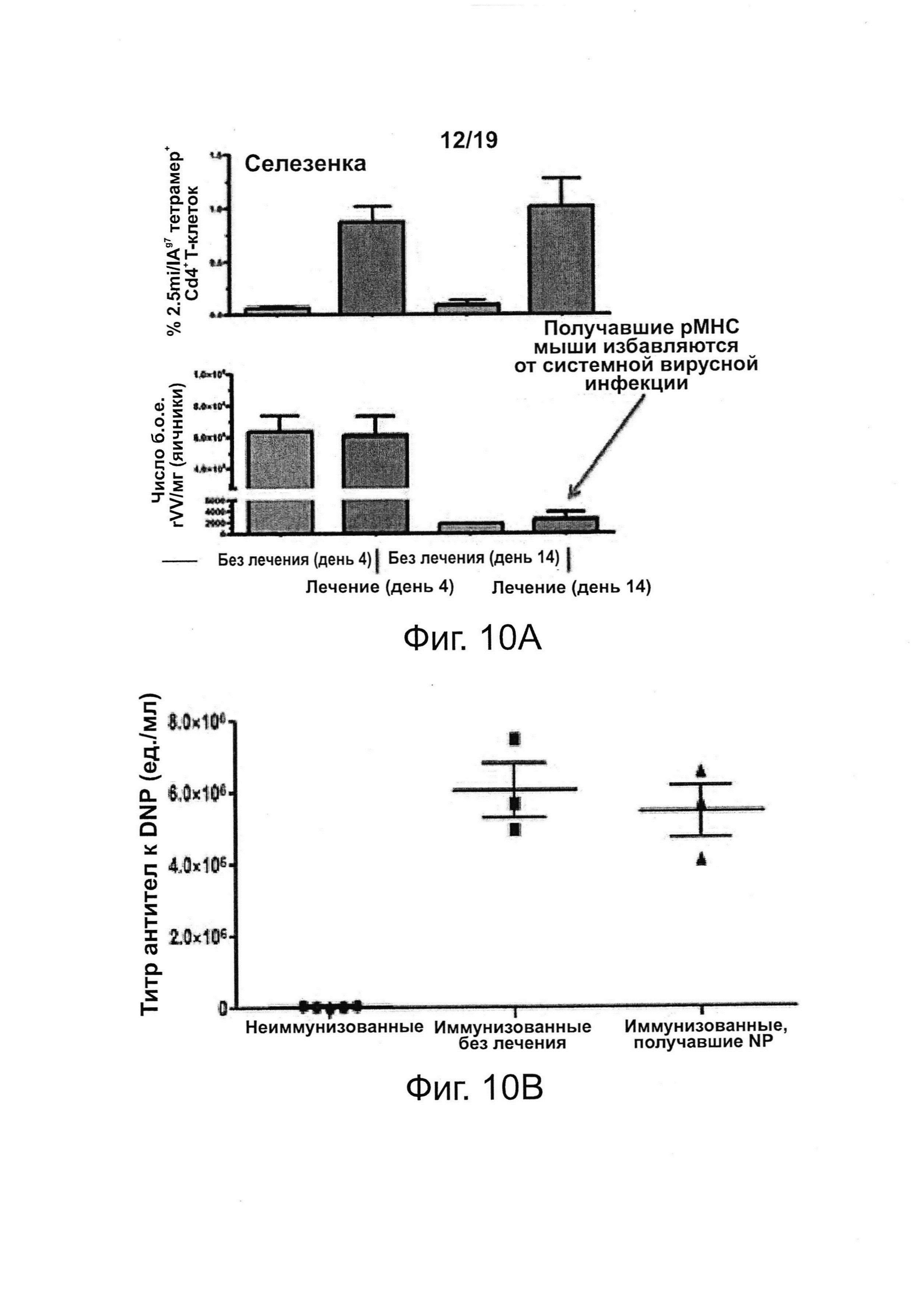
На фиг. 10A-10В показано, что терапия с помощью NPs с рМНС класса II не нарушает системный иммунитет. На фиг. 10А показано, что обработанные pMHC-NP мыши NOD легко избавляются от острой вирусной (вирус осповакцины) инфекции (внизу, сравните 4-й день с 14-й днем после заражения), несмотря на системную экспансию ауторегуляторных Т-клеток Tr1 CD4+ (сверху). На фиг. 10В показано, что обработанные pMHC-NP (10 доз) мыши запускают антительный ответ против KLH-DNP при иммунизации в CFA, по сравнению с необработанными и невакцинированными мышами.
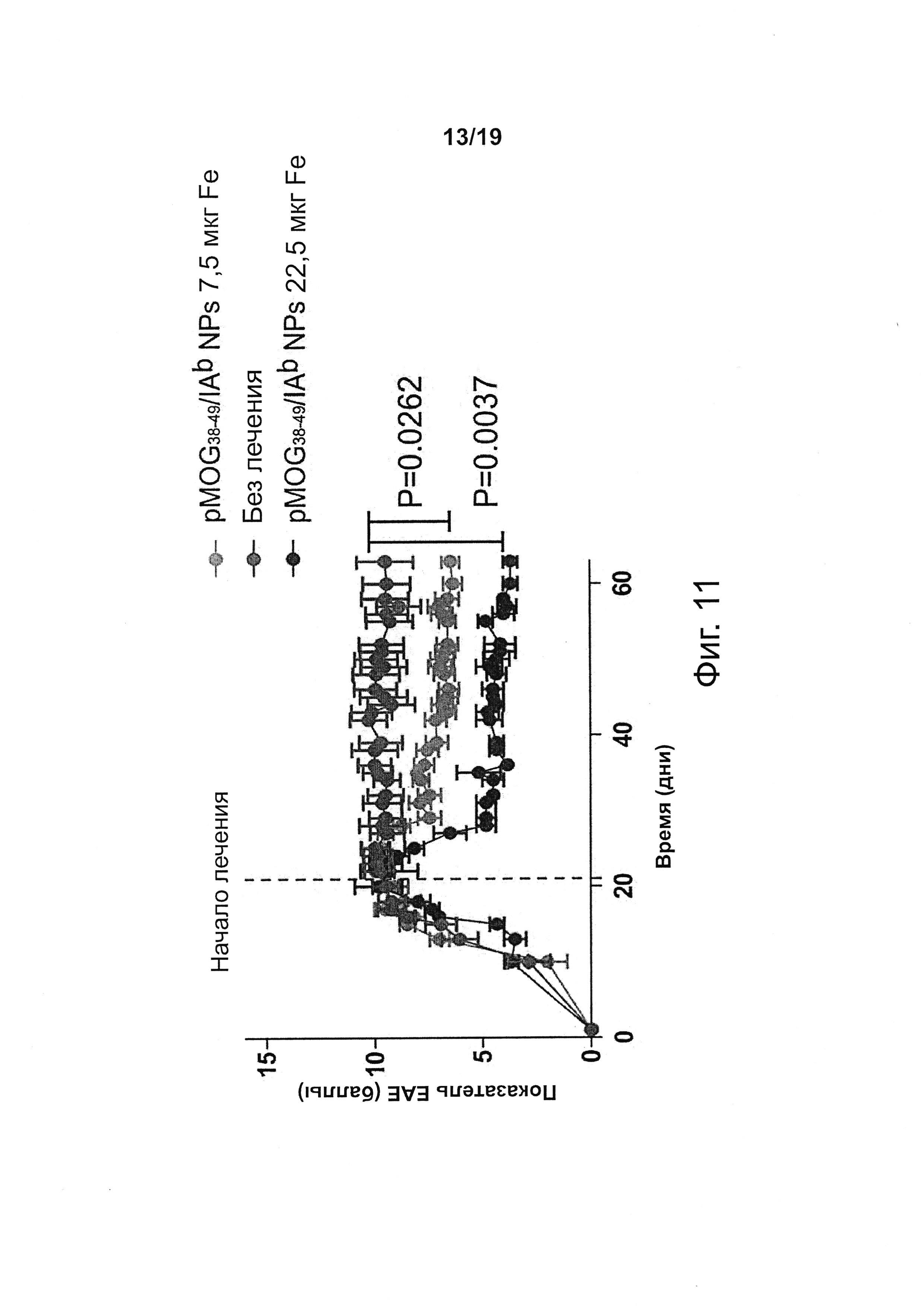
На фиг. 11 показано, что терапия с помощью NPs с рМНС класса II снижает тяжесть установившегося ЕАЕ у мышей C57BL/6. Мышей В6 иммунизировали PMOG35-55 в CFA и обрабатывали коклюшным токсином в/в. У мышей оценивали признаки ЕАЕ по установленным критериям по 15-бальной шкале. Пораженных мышей обрабатывали двумя еженедельными дозами по 7,5-22,5 мкг покрытых PMOG38-49/IAb NPs, начиная с 21-го дня после иммунизации.
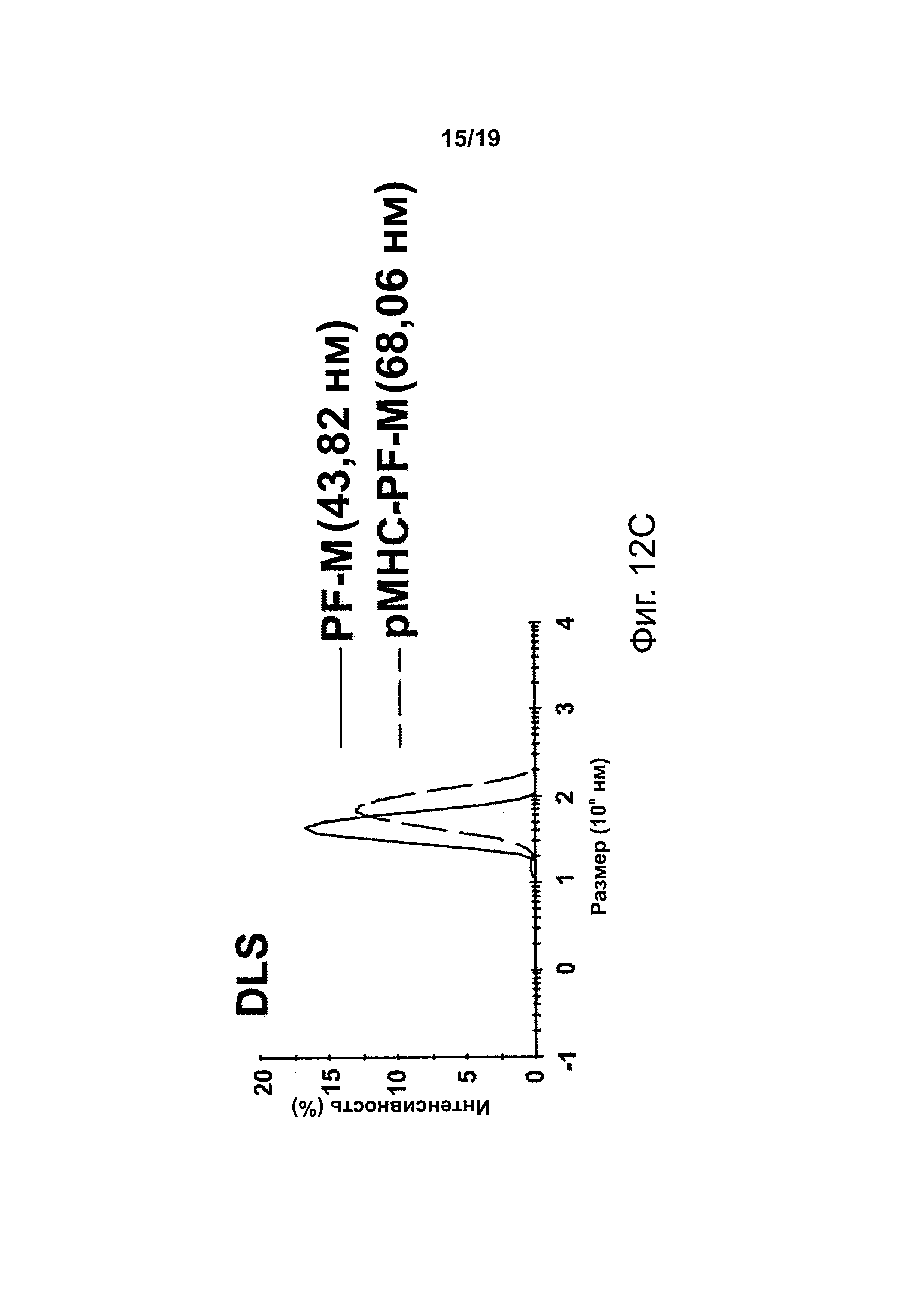
На фиг. 12А-12С представлена структура и свойства NPs с рМНС класса II. Фиг. 12А - эскиз, представляющий различные химические процессы, которые могут использоваться для ковалентного нанесения pMHCs на функционализованные, биосовместимые NPs из оксида железа. Фиг. 12В - трансмиссионная электронная микроскопия покрытых рМНС NPs. На фиг. 12С представлены профили динамического рассеяния света у покрытых рМНС NPs по сравнению с непокрытыми NPs.
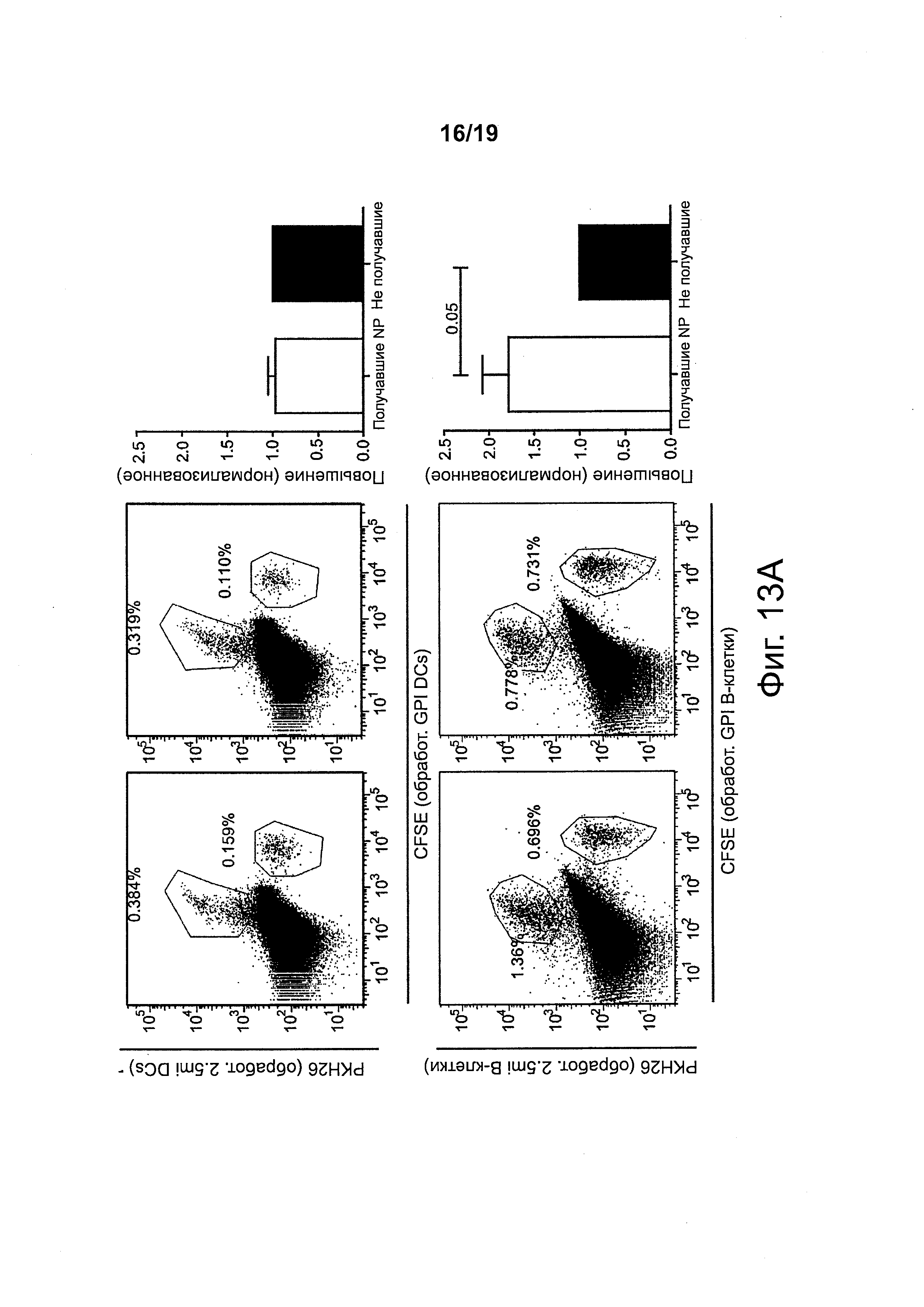
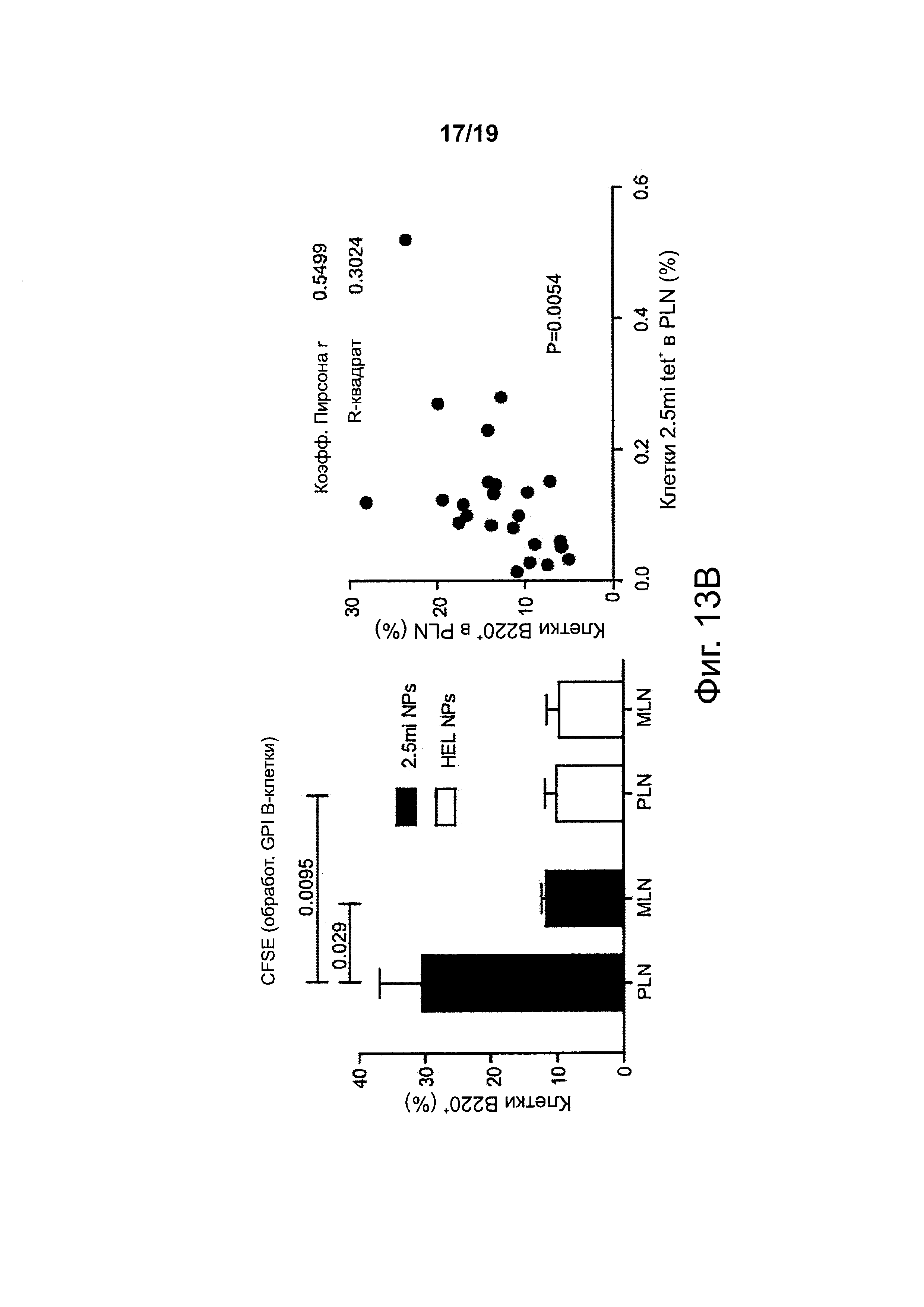
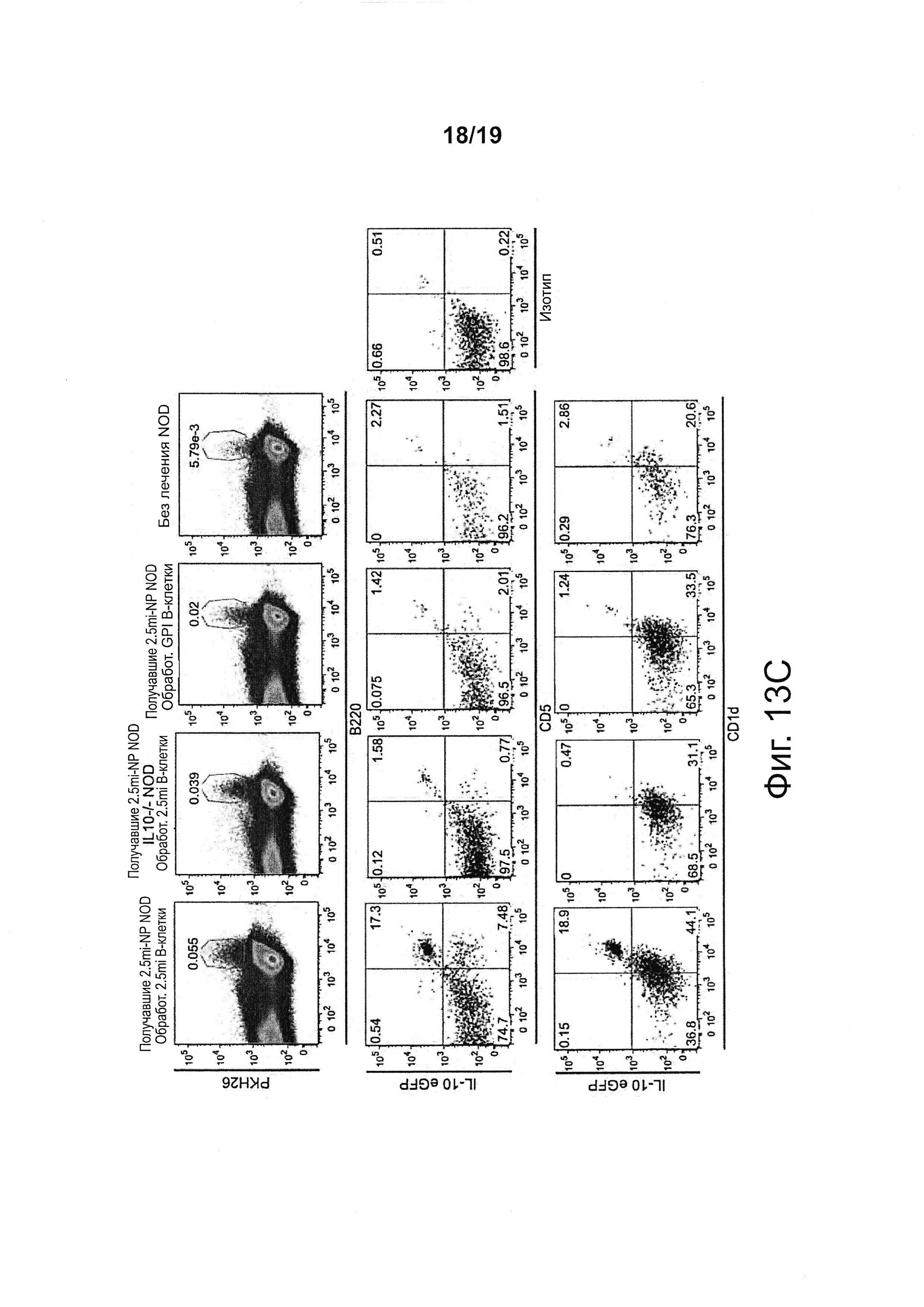
На фиг. 13А-13С представлена экспансия и дифференцировка когнатных В-клеток в клетки B-reg у мышей, получавших NPs с рМНС класса II. На фиг. 13А получавшим 2.5mi/IAg7-NP мышам NOD вводили смеси 1:1 из помеченных РКН26 и обработанных пептидом 2.5mi В-клеток (снизу) (или дендритных клеток, сверху) плюс помеченных CFSE и обработанных пептидом GPI В-клеток (снизу) (или дендритных клеток, сверху). Через 7 дней мышей подвергали анализу на наличие обоих подмножеств В-клеток (снизу) или дендритных клеток (сверху). На левых панелях представлены репрезентативные результаты, а на правых гистограммах представлены сводные результаты, полученные при нескольких экспериментах. Данные показывают, что у получавших 2.5mi/IAg7-NP мышей NOD подвергались экспансии обработанные пептидом 2.5mi В-клетки (но не дендритные клетки). На фиг. 13В (слева) сравнивали содержание В-клеток в панкреатических (PLN) и брыжеечных (MLN) лимфатических узлах у мышей NOD, получавших 2.5mi/IAg7-NPs, в сравнении с получавшими контрольные (не имеющие отношения к диабету) pMHC-NPs. Данные свидетельствуют об усилении рекрутинга В-клеток в первом случае. На фиг. 13В (справа) сравнивали рекрутинг В-клеток к PLNs в зависимости от рекрутинга клеток Tr1. Данные были получены на нескольких различных препаратах pMHC-NP. Данные свидетельствуют о статистически значимой корреляции между рекрутингом подвергшихся вызванной pMHC-NP экспансии клеток Tr1 и рекрутингом В-клеток к PLNs. На фиг. 13С переносили В-клетки, обработанные 2.5mi или контрольным пептидом, из мышей NOD со вставкой гена IL10-EGFP мышам нескольких различных донорских типов (отмечены сверху). Через 7 дней их селезенки подвергали анализу на конверсию перенесенных В-клеток в продуцирующие IL10 (eGFP+) В-клетки, экспрессирующие CDId и CD5 на высоком уровне (В-регуляторные клетки). Данные свидетельствуют о сильной экспансии и конверсии когнатных (нагруженных 2.5mi) В-клеток в клетки B-reg только у получавших 2.5mi/IAg7-NPs мышей.
На фиг. 14 представлен синтез функционализованных с поверхности наночастиц оксида железа путем термического разложения ацетилацетоната железа и биоконъюгация.
Раскрытие сущности изобретения
Следует уяснить, что данное изобретение не ограничивается описанными конкретными воплощениями, поскольку таковые, конечно, могут варьироваться. Кроме того, следует иметь в виду, что используемая здесь терминология предназначается только для описания конкретных воплощений и не должна быть ограничительной, поскольку объем настоящего изобретения будет ограничиваться только прилагаемой формулой изобретения.
Следует отметить, что в настоящем описании и в прилагаемой формуле изобретения слова указанные в единственном числе включают в себя множественное число, если из контекста не следует четко иное. Так, например, ссылка на "наполнитель" включает и несколько наполнителей.
I. Определения
Если не указано иначе, все технические и научные термины, используемые здесь, имеют те же значения, которые обычно подразумеваются рядовыми специалистами в той области, к которой относится данное изобретение. В настоящем изобретении следующие термины имеют следующие значения.
В настоящем изобретении термин "включающий" или "включает" означает то, что композиции и способы включают перечисленные элементы, но не исключают другие. "Состоящий в основном из" при использовании для описания композиций и способов подразумевает исключение других элементов, имеющих какое-либо существенное значение для комбинации указанного назначения. Так, композиция, состоящая в основном из тех элементов, которые определены здесь, не должна исключать наличие других материалов или стадий, которые фактически не оказывают влияния на основные и новые характеристики заявленного изобретения, типа композиций для лечения или профилактики рассеянного склероза. "Состоящий из" означает исключение более чем следовых долей других ингредиентов и существенных стадий способа. Воплощения, определенные каждым из этих переходных терминов, входят в рамки настоящего изобретения.
"Аутореактивные Т-клетки" означает такие Т-клетки, которые распознают "аутоантиген", то есть молекулу, которая вырабатывается и содержится у того же индивида, у которого содержатся данные Т-клетки.
"Патогенные Т-клетки" означает такие Т-клетки, которые причиняют вред субъекту, содержащему данные Т-клетки. В то же время непатогенные Т-клетки практически не наносят вреда субъекту, а антипатогенные Т-клетки уменьшают, ослабляют, ингибируют или сводят на нет вред от патогенных Т-клеток.
В настоящем изобретении термины регуляторные В-клетки или В-регуляторные клетки ("B-reg") означают такие клетки, которые отвечают за противовоспалительный эффект, который характеризуется экспрессией CD1d, CD5 и секрецией IL-10. Клетки В-reg также определяются по экспрессии Tim-1 и могут индуцироваться путем лигирования Tim-1 для усиления толерантности. Показано, что способность становиться клетками В-reg обусловлена многими стимулирующими факторами типа toll-подобных рецепторов, лиганда CD40 и других. Однако полная характеристика клеток B-reg еще продолжается. Клетки B-reg также экспрессируют на высоком уровне CD25, CD86 и TGF-β. Это подмножество В-клеток способно подавлять пролиферацию Th1, что способствует поддержанию аутотолерантности. Усиление функции B-reg должно стать целью многих иммуномодулирующих препаратов, способствуя лучшему контролю аутоиммунных заболеваний. К примеру, см. ncbi.nlm.nih.gov/pubmed/23707422, последний раз просматривалось 31 октября 2013 г.
Регуляторные Т-клетки 1 (Tr1) представляют собой подмножество Т-клеток CD4+, обладающих регуляторными свойствами и способных подавлять антиген-специфичные иммунные реакции in vitro и in vivo. Эти регуляторные Т-клетки-1 (Tr1) определяются уникальным профилем продукции цитокинов и вырабатывают на высоком уровне IL-10 и TGF-β, но не IL-4 или IL-2. Вырабатываемые этими клетками IL-10 и TGF-β опосредуют ингибирование первичных наивных Т-клеток in vitro. Имеются также данные о том, что клетки Tr1 существуют in vivo, и было засвидетельствовано наличие Т-клеток CD4(+), вырабатывающих IL-10 на высоком уровне, у пациентов с тяжелым комбинированным иммунодефицитом, получавших аллогенные трансплантаты стволовых клеток. Клетки Tr1 участвуют в регуляции периферической толерантности и потенциально они могут использоваться в качестве клеточной терапии для модулирования иммунных реакций in vivo. Например, см. ncbi.nlm.nih.gov/pubmed/10887343, последний раз просматривалось 31 октября 2013 г.
Регуляторные Т-клетки 1-го типа (Tr1) определяются по их способности вырабатывать на высоком уровне IL-10 и TGF-β. Клетки Tr1, специфичные к различным антигенам, возникают in vivo, но также могут подвергаться дифференцировке из наивных Т-клеток CD4+ в присутствии IL-10 in vitro. Клетки Tr1 обладают низкой пролиферативной способностью, которая может быть преодолена с помощью IL-15. Клетки Tr1 подавляют ответы наивных и Т-хелперов памяти типа 1 или 2 путем выработки IL-10 и TGF-β. Дальнейшая характеристика клеток Tr1 на молекулярном уровне должна установить их механизмы действия и прояснить их отношения с другими подмножествами Tr-клеток. Можно предвидеть применение клеток Tr1 для выявления новых мишеней для разработки новых терапевтических средств, а также в качестве клеточной терапии для модулирования периферической толерантности. Например, см. ncbi.nlm.nih.gov/pubmed/11722624, последний раз просматривалось 31 октября 2013 г.
Термины "ингибирование", "снижение" или "предотвращение" или другие варианты этих терминов при использовании в формуле изобретения и/или описании означают любое измеримое уменьшение или полное ингибирование для достижения требуемого результата.
По всей заявке термин "примерно" применяется для указания того, что некое значение включает стандартное отклонение или ошибку в отношении устройства или метода, используемого для определения данного значения. Термин "примерно" при использовании перед числовым обозначением, например, температуры, времени, количества и концентрации, включающим диапазон, указывает на степень приближения, которая может варьироваться на (+) или (-) 10%, 5% или 1%.
Под "биосовместимыми" подразумевается то, что компоненты системы доставки не должны вызывать повреждения тканей или повреждения биологической системы у человека. Для придания биосовместимости предпочтительно следует использовать такие полимеры и наполнители, у которых была история безопасного применения на людях или со статусом GRAS (Generally Accepted As Safe, то есть обычно считаются безопасными). Под биосовместимостью имеется в виду то, что ингредиенты и наполнители, используемые в композиции, в конечном счете будут "биоабсорбированы" или выведены из организма без каких-либо отрицательных последствий для организма. Для того чтобы композиция была биосовместимой и считалась нетоксичной, она не должна вызывать токсичности для клеток. Точно так же термин "биоабсорбируемые" относится к таким наночастицам, которые изготовлены из материалов, подвергающихся биоабсорбции in vivo за какое-то время с тем, чтобы избежать долгосрочного накопления данных материалов у пациента. В предпочтительном воплощении биосовместимые наночастицы подвергаются биоабсорбции в течение менее 2-х лет, предпочтительно менее 1 года и еще более предпочтительно менее 6 месяцев. Скорость биоабсорбции зависит от размера частиц, используемого материала и других факторов, хорошо известных специалистам. Для получения наночастиц, используемых в данном изобретении, можно использовать смесь биоабсорбируемых, биосовместимых материалов. В одном воплощении можно комбинировать оксид железа и биосовместимый, биоабсорбируемый полимер. Например, для получения наночастиц можно комбинировать оксид железа и PGLA.
Комплекс антиген-МНС-наночастицы ("NP-комплекс") означает присутствие на поверхности типа биосовместимых биоразлагаемых наносфер пептида, углевода, липида или другого антигенного сегмента, фрагмента или эпитопа антигенной молекулы или белка (то есть собственного пептида или аутоантигена). "Антиген" в настоящем изобретении обозначает всю молекулу, ее часть, фрагмент или сегмент, которые могут индуцировать иммунный ответ у субъекта или экспансию антипатогенных клеток.
"Имитатор (mimic)" является аналогом данного лиганда или пептида, причем такой аналог существенно подобен лиганду. Термин "существенно подобен" означает то, что данный аналог имеет профиль связывания, аналогичный лиганду, за исключением того, что он содержит одну или несколько функциональных групп или модификаций, которые в совокупности составляют менее 50%, менее 40%, менее 30%, менее 20%, менее 10% или менее 5% молекулярной массы лиганда.
Термин "антипатогенные аутореактивные Т-клетки" относится к Т-клеткам с антипатогенными свойствами (то есть к таким Т-клеткам, которые противодействуют аутоиммунным заболеваниям типа MS, родственных MS заболеваний или преддиабета). Такие Т-клетки могут включать в себя противовоспалительные Т-клетки, эффекторные Т-клетки, Т-клетки памяти, низкоавидные Т-клетки, Т-хелперы, ауторегуляторные Т-клетки, цитотоксические Т-клетки, нормальные Т-клетки-киллеры, клетки TR1, Т-клетки CD4+, Т-клетки CD8+ и т.п.
Термин "противовоспалительные Т-клетки" относится к таким Т-клеткам, которые способствуют противовоспалительным реакциям. Противовоспалительная функция Т-клеток может осуществляться за счет выработки и/или секреции противовоспалительных белков, цитокинов, хемокинов и т.п. Противовоспалительные белки также должны охватывать антипролиферативные сигналы, которые подавляют иммунные реакции. Противовоспалительные белки включают IL-4, IL-10, IL-13, IL-21, IL-23, IL-27, IFN-α, TGF-β, IL-1ra, G-CSF и растворимые рецепторы TNF и IL-6. Соответственно, некоторые аспекты изобретения касаются способов лечения у пациентов аутоиммунных заболеваний типа MS, родственных MS заболеваний, диабета или преддиабета, причем способ включает, в основном состоит или же состоит из введения данному пациенту комплекса антиген-MHCII-наночастицы, причем антигеном является причастный к заболеванию антиген.
Термин "IL-10" или "интерлейкин-10" относится к цитокину, кодируемому геном IL-10. Последовательность IL-10 представлена в GenBank под номером доступа NM_000572.2 (мРНК) и NP_300563.1 (белок).
Термин "TGF-β" или "трансформирующий фактор роста бета" относится к белку, который может обладать противовоспалительным действием. TGF-β представляет собой секретируемый белок, который существует в виде по меньшей мере трех изоформ, именуемых TGF-β1, TGF-β2 и TGF-β3. Первоначально это было название для TGF-β1, который был основоположником этого семейства. Семейство TGF-β входит в состав надсемейства белков, известных как надсемейство трансформирующего фактора роста бета, в которое входят ингибины, активин, антимюллеров гормон, костный морфогенетический белок, декапентаплегин и Vg-1.
"Эффективное количество" означает количество, достаточное для достижения поставленной цели, а неограничительные примеры таковых включают: запуск иммунного ответа, модуляцию иммунного ответа, подавление воспалительной реакции и модуляцию активности Т-клеток или популяции Т-клеток. В одном аспекте эффективное количество означает такое, которое действует для достижения поставленной терапевтической цели, например, терапевтически эффективное количество. Как описано подробно далее, эффективное количество или дозировка зависит от цели, композиции и компонента и может быть определена в соответствии с настоящим изобретением.
Использование единственного времени в сочетании с термином "включающий" в формуле изобретения и/или описании может означать "один", но также оно согласуется со значением "один или несколько", "по меньшей мере один" и "один или более одного".
Под "наносферами", "NP" или "наночастицами" имеются в виду небольшие дискретные частицы, которые вводятся по отдельности или во множестве субъектам, в образцы клеток или образцы тканей, как надлежит. В некоторых воплощениях наночастицы имеют практически сферическую форму. В некоторых воплощениях наночастицы не являются липосомами или вирусными частицами. В других воплощениях наночастицы является твердыми или имеют твердое ядро. Термин "практически сферические" в настоящем изобретении означает то, что форма частиц не отклоняется от сферы более чем на 10%. На частицы могут наноситься различные известные антигенные или пептидные комплексы по изобретению. Наночастицы по изобретению имеют размеры от около 1 нм до около 1 мкм, предпочтительно от около 1 нм до около 100 нм или же от около 1 нм до около 50 нм или же от около 5 до около 50 нм или же от около 5 нм до около 100 нм, что в некоторых аспектах относится к среднему или медианному диаметру множества наночастиц, когда подразумевается множество наночастиц. Можно получить и наночастицы меньшего размера, например, методом фракционирования, при котором более крупные частицы оседают на дно в водном растворе. Затем извлекают верхнюю часть раствора методами, известными специалистам в данной области. Эта верхняя часть обогащена частицами меньшего размера. Процесс можно повторять до получения нужного среднего размера.
Использование термина "или" в формуле изобретения применяется и в значении "и/или", если прямо не указано, что имеются в виду только альтернативные значения или же альтернативные значения являются взаимоисключающими, хотя изобретение придерживается определений, которые относятся только к альтернативам и "и/или".
В настоящем изобретении фраза "иммунный ответ" или его эквивалент "иммунологическая реакция" относится к развитию клеточного ответа (опосредованного антиген-специфичными Т-клетками или продуктами их секреции). Клеточный иммунный ответ возникает при презентации полипептидных эпитопов в ассоциации с молекулами МНС класса I или класса II для лечения или профилактики вирусной инфекции, экспансии антиген-специфичных клеток B-reg, клеток ТС1, Т-хелперов CD4+ и/или цитотоксических Т-клеток CD8+ и/или вызванных заболеванием ауторегуляторных Т-клеток и В-клеток "памяти". Реакция может включать в себя активацию и других компонентов.
Термины "воспалительная реакция" и "воспаление" в настоящем изобретении означают сложные биологические реакции сосудистых тканей у человека на вредные воздействия типа патогенов, поврежденных клеток или раздражителей и включают в себя секрецию цитокинов, в частности, провоспалительных цитокинов, т.е. тех цитокинов, которые вырабатываются преимущественно активированными иммунными клетками и участвуют в усилении воспалительных реакций. Примеры провоспалительных цитокинов включают, без ограничения, IL-1, IL-6, IL-10, TNF-α, IL-17, IL-21, IL-23, IL-27 и TGF-β. Примеры воспаления включают острое воспаление и хроническое воспаление. Острое воспаление означает краткосрочный процесс, который характеризуется классическими признаками воспаления (отек, покраснение, боли, жар и потеря функции) вследствие инфильтрации тканей плазмой и лейкоцитами. Острое воспаление обычно возникает тогда, когда присутствует вредоносный раздражитель, и прекращается после того, как раздражитель будет удален, разрушен или отгорожен путем рубцевания (фиброза). Хроническое воспаление означает такое состояние, которое характеризуется параллельно активным воспалением, разрушением тканей и попытками восстановления. Хроническое воспаление не характеризуется классическими признаками острого воспаления, приведенными выше. Вместо этого хронически воспаленная ткань характеризуется инфильтрацией мононуклеарных иммунных клеток (моноцитов, макрофагов, лимфоцитов и плазматических клеток), разрушением тканей и попытками заживления, которые включают ангиогенез и фиброз. Воспаление можно ингибировать в смысле настоящего описания путем воздействия, в частности, ингибирования любого из явлений, составляющих сложные биологические реакции, связанные с воспалением у человека.
К аутоиммунным заболеваниям относятся, без ограничения, сахарный диабет, преддиабет, отторжение при трансплантации, рассеянный склероз, родственные рассеянному склерозу заболевания, преждевременное угасание функции яичников, склеродерма, болезнь Шегрена, волчанка, витилиго, алопеция (облысение), плюригландулярная недостаточность, болезнь Грейвса, гипотиреоз, полимиозит, пузырчатка, болезнь Крона, колит, аутоиммунный гепатит, гипопитуитаризм, миокардит, болезнь Аддисона, аутоиммунные заболевания кожи, увеит, пернициозная анемия, гипопаратиреоз и/или ревматоидный артрит. В некоторых аспектах пептидный компонент комплекса антиген/MHCII/частицы получен или составлен из аутоантигена или эпитопа аутоантигена либо его аналога, участвующего в аутоиммунной реакции, которую зондируют, модулируют или подавляют при лечении. В определенных аспектах аутоантигеном является пептид, углевод или липид. В некоторых аспектах аутоантигеном является фрагмент, эпитоп или пептид белка, углевода или липида, экспрессируемого некоторыми клетками субъекта типа бета-клеток поджелудочной железы, и включают, без ограничения, фрагменты IGRP, инсулина, GAD или белка IA-2. Различные такие белки или эпитопы были установлены при различных аутоиммунных заболеваниях. Аутоантигеном может быть пептид, углевод, липид и т.д., полученный из другого эндокринного или нейрокринного компонента типа приостровковых шванновских клеток и др.
В настоящем изобретении термин "причастный к заболеванию" антиген означает такой антиген или его фрагмент, который выбран для лечения данного заболевания. Например, причастным к диабету антигеном является такой антиген или его фрагмент, которым лечат диабет. Причастный к MS антиген выбирают для лечения MS. Причастный к диабету антиген не может быть выбран для лечения MS. Точно так же причастным к аутоиммунитету антигеном является такой антиген, который имеет отношение к аутоиммунным заболеваниям и не может быть выбран для лечения других расстройств или заболеваний, чем аутоиммунные, например, рака.
В настоящем изобретении термин "диабет" означает изменчивое расстройство метаболизма углеводов, вызванное сочетанием наследственных и экологических факторов, которое обычно характеризуется неадекватной секрецией или использованием инсулина, чрезмерной выработкой мочи, чрезмерным уровнем сахара в крови и моче, а также жаждой, чувством голода и потерей веса. Диабет подразделяется на диабет 1-го типа и диабет 2-го типа. Общепринятой моделью на животных для исследования и лечения диабета служат не страдающие ожирением диабетические ("NOD") мыши. Диабет 1 типа (T1D) у мышей связан с аутореактивными Т-клетками CD8+. У не страдающих ожирением диабетических мышей NOD возникает форма T1D, очень похожая на T1D у человека, что является результатом избирательного разрушения β-клеток поджелудочной железы Т-клетками, распознающими большое число аутоантигенов. Несмотря на то, что возникновение T1D явно требует содействия клеток CD4+, имеются убедительные данные о том, что T1D зависит от Т-клеток CD8+. Было обнаружено, что значительная часть связанных с островками клеток CD8+ у мышей NOD используют CDR3-инвариантные TCR-рецепторы Vαl7-Jα42+, именуемые "8.3-TCR-подобными". Эти клетки, которые распознают мимеотоп NRP-A7 (установленный с помощью комбинаторных библиотек пептидов) в контексте молекул МНС Kd, уже являются существенным компонентом самых ранних инфильтратов CD8+ в островках NOD, диабетогенны и имеют мишенью пептид из белка с неизвестной функцией, родственного белку каталитической субъединицы специфичной для островков глюкозо-6-фосфатазы (IGRP). Клетки CD8+, которые распознают этот пептид (IGRP206-214, похожий на NRP-A7), встречаются необычайно часто в кровотоке (> 1/200 клеток CD8+). Примечательно, что прогрессирование инсулина в диабет у мышей NOD неизменно сопровождается циклической экспансией циркулирующего пула IGRP206-214-реактивных клеток CD8+, а также быстрым созреванием пула, связанного с островками. Совсем недавно было показано, что связанные с островками клетки CD8+ у мышей NOD распознают множественные эпитопы IGRP, указывая на то, что IGRP является главным аутоантигеном для клеток CD8+, по крайней мере, при T1D у мышей. Связанные с островками NOD клетки CD8+, особенно те, что встречаются на ранней стадии в процессе заболевания, также распознают эпитоп инсулина (Ins В15-23).
Исследования по связыванию свидетельствуют, что определенные аллели HLA класса I (т.е. HLA-A*0201) придают людям восприимчивость к T1D. Патологические исследования показали, что очаги инсулита у вновь выявленных больных в основном состоят из (приуроченных к HLA класса I) Т-клеток CD8+, которые также составляют преобладающую популяцию клеток у пациентов после трансплантации поджелудочных изотрансплантатов (от идентичных близнецов) или аллотрансплантатов (от родственных доноров).
Инсулин является главной мишенью антительного ответа и ответа CD4+ при T1D и у людей, и у мышей. Эпитоп hInsB10-18 цепи В инсулина человека презентируется HLA-А*0201 аутореактивным клеткам CD8+ как у реципиентов островковых трансплантатов, так и в ходе спонтанного заболевания. Кроме того, у мышиного пре-проинсулина 1 или 2 были идентифицированы четыре дополнительных пептида, которые распознаются связанными с островками Т-клетками CD8+ у трансгенных по HLA-A*0201 мышей в контексте HLA-A*0201.
В настоящем изобретении термин "преддиабет" означает бессимптомный период, предшествующий диабетическому заболеванию, который характеризуется субклиническим повреждением β-клеток, при этом пациент проявляет нормальный уровень глюкозы в плазме. Он также характеризуется наличием аутоантител к островковым клеткам (ICAs) и, ближе к появлению клинических симптомов, может сопровождаться непереносимостью глюкозы.
В настоящем изобретении термин "рассеянный склероз" или "MS" обозначает такое аутоиммунное заболевание, при котором иммунная система организма разъедает защитную оболочку, покрывающую нервы. Это нарушает коммуникацию между мозгом и остальной частью тела. В конечном счете, это может привести к повреждению самих нервов, причем этот процесс является необратимым.
В настоящем изобретении термин "родственное рассеянному склерозу заболевание" обозначает такое заболевание, которое проявляется вместе с восприимчивостью к MS или с MS. Неограничительные примеры таковых включают оптиконевромиелит (NMO), увеит, нейропатические боли, атеросклероз, артериосклероз, рассеянный системный склероз, оптикоспинальный MS, первичный прогрессирующий MS (PPMS) и рецидивирующий-ремиттирующий MS (RRMS), прогрессирующий системный склероз и атаксический склероз.
Термины "эпитоп" и "антигенная детерминанта" применяются взаимозаменяемо для обозначения тех участков на антигене, на которые реагируют или которые распознают В- и/или Т-клетки. В-клеточные эпитопы могут формироваться как из смежных, так и несмежных аминокислот, налагающихся друг на друга при третичной укладке белка. Эпитопы, образовавшиеся из смежных аминокислот, как правило, сохраняются при воздействии денатурирующих растворителей, тогда как эпитопы, образовавшиеся при третичной укладке, обычно теряются при обработке денатурирующими растворителями. Как правило, эпитоп включает в себя по меньшей мере 3, а чаще по меньшей мере 5 или 8-20 аминокислот в уникальной пространственной конформации. Методы определения пространственной конформации эпитопов включают, к примеру, рентгеновскую кристаллографию и 2-мерный ядерный магнитный резонанс. Например, см. Glenn Е. Morris, Epitope Mapping Protocols (1996). Т-клетки распознают непрерывные эпитопы примерно из 9 аминокислот для клеток CD8 или 13-15 аминокислот для клеток CD4. Т-клетки, которые распознают эпитоп, можно идентифицировать методами in vitro, в которых измеряется антиген-зависимая пролиферация, что определяется по включению3Н-тимидина в примированные Т-клетки в ответ на эпитоп (Burke et al., J. Inf. Dis., 170:1110-1119, 1994), по антиген-зависимой гибели клеток (метод цитотоксических Т-лимфоцитов, Tigges et al., J. Immunol., 156(10): 3901-3910, 1996) или по секреции цитокинов. Наличие клеточного иммунологического ответа можно определить методами анализа пролиферации (Т-клетки CD4+) или анализа CTL (цитотоксические Т-лимфоциты).
Необязательно антиген или предпочтительно эпитоп антигена можно химически конъюгировать с или экспрессировать в виде слитого белка с другими белками типа МНС и родственных МНС белков.
В настоящем изобретении термины "пациент" и "субъект" применяются как синонимы и относятся к млекопитающим. В некоторых воплощениях пациентом является человек. В других воплощениях пациентами являются млекопитающие, которых обычно используют в лаборатории, как-то мыши, крысы, обезьяны, собаки, кошки, быки, лошади или овцы.
В настоящей заявке термин "полинуклеотид" относится к молекулам нуклеиновой кислоты, которые либо являются рекомбинантными, либо были выделены свободными от суммарной геномной нуклеиновой кислоты. Термин "полинуклеотид" охватывает олигонуклеотиды (нуклеиновые кислоты длиной от 100 остатков и меньше), рекомбинантные векторы, в том числе, к примеру, плазмиды, космиды, фаги, вирусы и др. В некоторых аспектах полинуклеотиды включают в себя регуляторные последовательности, выделенные в основном из встречающихся в природе генов или последовательностей, кодирующих белки. Полинуклеотиды могут представлять собой РНК, ДНК, их аналоги или комбинации. Нуклеиновая кислота, кодирующая весь полипептид или его часть, может содержать непрерывную последовательность нуклеиновой кислоты, кодирующую весь полипептид или часть такого полипептида следующей длины: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 441, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990, 1000, 1010, 1020, 1030, 1040,1050, 1060, 1070, 1080, 1090, 1095, 1100, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 9000, 10000 или более нуклеотидов, нуклеозидов или пар оснований. Также предусматривается, что конкретный полипептид из данного вида может кодироваться нуклеиновыми кислотами, содержащими природные вариации, имеющие слегка различные нуклеотидные последовательности, и тем не менее кодирующие один и тот же или практически такой же белок, полипептид или пептид.
Полинуклеотиды состоят из определенной последовательности четырех оснований нуклеотидов: аденина (А); цитозина (С); гуанина (G); тимина (Т); и урацила (U) вместо тимина, если полинуклеотид представляет собой РНК. При этом термин "последовательность полинуклеотида" означает буквенное представление молекулы полинуклеотида. Такое буквенное представление можно вводить в базы данных в компьютере, имеющем центральный блок обработки данных, и использовать для таких приложений биоинформатики, как функциональная геномика и поиск гомологий.
Термин "выделенные" или "рекомбинантные" в применении к нуклеиновым кислотам типа ДНК или РНК относится к молекулам, отделенным от других ДНК или РНК, соответственно, присутствующих в природном источнике макромолекулы, а также к полипептидам. Термин "выделенная или рекомбинантная нуклеиновая кислота" охватывает и такие фрагменты нуклеиновых кислот, которые не встречаются в природе в виде фрагментов и не встречаются в естественном состоянии. Термин "выделенные" также относится к таким полинуклеотидам, полипептидам и белкам, которые выделены из других клеточных белков, и охватывает как очищенные, так и рекомбинантные полипептиды. В других воплощениях термин "выделенные или рекомбинантные" означает отделенные от тех компонентов, клеточных и прочих, с которыми данные клетки, ткани, полинуклеотиды, пептиды, полипептиды, белки, антитела или их фрагменты обычно связаны в природе. Например, выделенные клетки это такие клетки, которые отделены от ткани или клеток с другим фенотипом или генотипом. Выделенные полинуклеотиды отделены от тех 3'- и 5'-смежных нуклеотидов, с которыми они обычно связаны в своем нативном или природном окружении, например, на хромосоме. Специалистам в данной области известно, что не встречающиеся в природе полинуклеотиды, пептиды, полипептиды, белки, антитела или их фрагменты не требуют "выделения" для того, чтобы отличить их от тех, которые встречаются в природе.
Полинуклеотид или участок полинуклеотида (либо полипептид или участок полипептида), имеющий определенный процент (к примеру, 80%, 85%, 90% или 95%) "идентичности последовательности" с другой последовательностью, означает то, что после выравнивания именно такой процент оснований (или аминокислот) будет одинаковым при сравнении этих двух последовательностей. Выравнивание и степень гомологии или идентичности последовательностей можно определить с помощью программного обеспечения, известного в данной области, например, описанного в Current Protocols in Molecular Biology (Ausubel et al., eds. 1987) Supplement 30, раздел 7.7.18, таблица 7.7.1. Предпочтительно для выравнивания используются параметры по умолчанию. Предпочтительной для выравнивания является программа BLAST с параметрами по умолчанию. В частности, предпочтительными являются программы BLASTN и BLASTP с использованием следующих параметров по умолчанию: генетический код = стандартный; фильтр = нет; нить = обе; отсечка = 60; ожидание =10; матрица = BLOSUM62; описания = 50 последовательностей; сортировка по = высокий балл; базы данных = без избыточности, GenBank + EMBL + DDBJ + PDB + трансляции CDS в GenBank + SwissProtein + SPupdate + PIR. Подробную информацию об этих программах можно найти по следующему адресу в Интернете: ncbi.nlm.nih.gov/cgi-bin/BLAST.
Следует иметь в виду даже без прямого заявления, а также, если не указано иначе, что когда настоящее изобретение касается антигена, полипептида, белка, полинуклеотида или антитела, то в рамки данного изобретения будут входить и их эквиваленты или биологические эквиваленты таковых. В настоящем изобретении термин "биологические эквиваленты" служит синонимом "их эквивалентов" при ссылке на данные антигены, белки, антитела, фрагменты полипептидов или нуклеиновые кислоты и охватывает тех, которые имеют минимальную степень гомологии при сохранении требуемой структуры или функциональности. Даже если это специально не указано, предусматривается, что любые полинуклеотиды, полипептиды или белки, упомянутые здесь, также включают их эквиваленты. В одном аспекте эквивалентным является такой полинуклеотид, который гибридизуется в жестких условиях с данным полинуклеотидом или комплементарным ему полинуклеотидом, описанным здесь для применения в описанных способах. В другом аспекте эквивалентным является такое антитело или антигенсвязывающий полипептид, который связывается со сродством, составляющим по меньшей мере 70% или же по меньшей мере 75% или же по меньшей мере 80% или же по меньшей мере 85% или же по меньшей мере 90% или же по меньшей мере 95% или больше относительно эталонного антитела или антигенсвязывающего фрагмента. В другом аспекте такой эквивалент конкурирует с данным антителом или антигенсвязывающим фрагментом за связывание со своим антигеном при анализе конкурентным методом ELISA. В другом аспекте такой эквивалент гомологичен или идентичен по меньшей мере на 80% или же по меньшей мере на 85% или же по меньшей мере на 90% или же по меньшей мере на 95% или же по меньшей мере на 98% эталонному белку, полипептиду или нуклеиновой кислоте и проявляет практически эквивалентную биологическую активность.
"Гибридизация" означает реакцию, в которой один или несколько полинуклеотидов взаимодействуют с образованием комплекса, который стабилизируется посредством водородных связей между основаниями нуклеотидных остатков. Образование водородных связей может происходить путем спаривания оснований Уотсона-Крика, связывания по Hoogstein или любым другим специфичным к последовательности образом. Комплекс может состоять из двух нитей, образующих структуру дуплекса, трех или больше нитей, образующих многоцепочечный комплекс, единственной самогибридизующейся нити или любой комбинации из них. Реакция гибридизации может составлять одну стадию в более обширном процессе типа инициирования реакции PC или ферментативного расщепления полинуклеотида рибозимом.
Примеры жестких условий гибридизации включают: температура при инкубации от около 25°С до около 37°С; концентрация гибридизационного буфера от около 6×SSC до около 10×SSC; концентрация формамида от около 0% до около 25%; и отмывочный раствор от около 4×SSC до около 8×SSC. Примеры умеренных условий гибридизации включают: температура при инкубации от около 40°С до около 50°С; концентрация буфера от около 9×SSC до около 2×SSC; концентрация формамида от около 30% до около 50%; и отмывочный раствор от около 5×SSC до около 2×SSC. Примеры условий высокой жесткости включают: температура при инкубации от около 55°С до около 68°С; концентрация буфера от около 1×SSC до около 0,1×SSC; концентрация формамида от около 55% до около 75%; и отмывочный раствор от около 1×SSC до около 0,1×SSC или деионизированная вода. В общем, время инкубации при гибридизация составляет от около 5 минут до около 24 часов, с 1, 2 или несколькими стадиями отмывки, а время инкубации при отмывке составляет 1, 2 или 15 минут. SSC означает 0,15 М NaCl и 15 мМ цитратный буфер. Предусматривается, что можно использовать эквиваленты SSC и с другими буферными системами.
"Гомологичность" или "идентичность" или "сходство" относится к сходству последовательностей между двумя пептидами или между двумя молекулами нуклеиновых кислот. Гомологичность определяется путем сравнения положений в каждой последовательности, которые подвергаются выравниванию в целях сравнения. Когда какое-то положение в сравниваемых последовательностях занято одним и тем же основанием или аминокислотой, то эти молекулы гомологичны в этом положении. Степень гомологичности между последовательностями является функцией числа совпадающих или гомологичных положений между этими последовательностями. У "неродственных" или "негомологичных" последовательностей степень идентичности с одной из последовательностей настоящего изобретения составляет менее 40% или же менее 25%.
"Гомологичность" или "идентичность" или "сходство" также может относиться к двум молекулам нуклеиновых кислот, которые гибридизуются в жестких условиях.
В настоящем изобретении термины "лечение", "обработка" и т.п. применяются в значении получения требуемого фармакологического и/или физиологического эффекта. Эффект может быть терапевтическим в смысле частичного или полного излечения заболевания и/или отрицательного эффекта, свойственного заболеванию. В одном аспекте лечение означает уменьшение признаков заболевания по установленной шкале.
IGRP, который кодируется геном (располагается на хромосоме 2q28-32, которая перекрывается с локусом подверженности T1D, IDDM7 (2q31)), также недавно был идентифицирован как аутоантиген β-клеток, потенциально имеющий отношение к T1D у человека. Два HLA-A*0201-связывающих эпитопа IGRP человека (hIGRP228-236 и hIGRP265-273) распознаются связанными с островками клетками CD8+ у дефектных по МНС класса I мышей NOD, экспрессирующих трансген HLA-A*0201. Неограничительные примеры антигенов IGRP, связывающихся с мышиными молекулами МНС класса II (IAg7), включают, к примеру, IGRP206-214, который содержит антигенный пептид VYLKTNVFL, и IGRP4-22, который содержит антигенный пептид LHRSGVLIIHHLQEDYRTY или его эквивалент, и IGRP128-145, который содержит антигенный пептид TAALSYTISRMEESSVTL или его эквивалент.
"Предотвратить" означает предотвращение заболевания или эффекта in vitro или in vivo в системе или у субъекта, предрасположенного к этому заболеванию или эффекту.
"Композиция" означает комбинацию из активного средства и другого соединения или композиции, инертного (например, детектируемого реагента или метки) или активного, типа адъюванта. В некоторых воплощениях композиция не содержит адъюванта.
"Фармацевтическая композиция" охватывает комбинации активного средства с носителем, инертным или активным, что делает эти композиции пригодными для диагностического или терапевтического применения in vitro, in vivo или ex vivo.
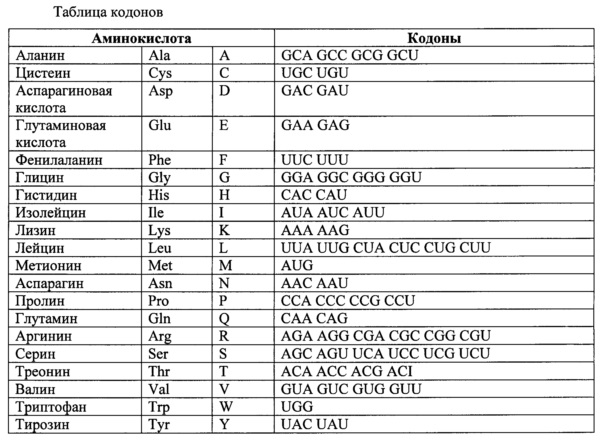
Термин "функционально эквивалентный кодон" применяется здесь для обозначения таких кодонов, которые кодируют одну и ту же аминокислоту, типа шести кодонов для аргинина или серина, а также относится к таким кодонам, которые кодируют биологически эквивалентные аминокислоты (см. таблицу ниже).
В настоящем изобретении "белок" или "полипептид" или "пептид" относится к молекулам, содержащим по меньшей мере 5 аминокислотных остатков.
Другие объекты, отличительные признаки и преимущества настоящего изобретения станут ясными из нижеследующего подробного описания. Однако следует иметь в виду, что подробное описание и конкретные примеры, хотя и раскрывают конкретные воплощения изобретения, но приводятся только в качестве иллюстрации, поскольку из этого подробного описания специалистам в этой области станут очевидными различные изменения и модификации в пределах сущности и объема настоящего изобретения.
II. Описание воплощений
В настоящее время не существует терапевтической платформы, позволяющей полностью подавлять поликлональные аутоиммунные реакции без ущерба для системного иммунитета. Описанное здесь раскрытие заявителя позволяет разрабатывать специфичные к аутоиммунным заболеваниям лекарства, которые превращают аутореактивные, специфичные к заболеваниям Т-клетки CD4+ и В-клетки в когнатные, моноспецифичные регуляторные Т-клетки CD4+ и В-клетки, скоординированно подавляющие все другие реакции аутореактивных Т- и В-клеток хозяина, независимо от их тонкой антигенной специфичности, причем с тончайшей специфичностью к заболеванию и без ущерба для системного иммунитета.
Аутоантигенная сложность диабета 1-го типа (T1D)
T1D вызывает хроническая аутоиммунная реакция, которая постепенно размывает массу панкреатических β-клеток. Разрушение β-клеток у людей и мышей NOD осуществляется Т-клетками, распознающими многие аутоантигены (Tsai, S. et al. (2008) Adv. Immunol. 100:79-124; Lieberman, S. et al. (2003) Tissue Antigens 62:359-377). Хотя точная последовательность событий остается плохо установленной, существующие данные свидетельствуют, что T1D требует участия клеток CD4+ и CD8+; что аутореактивные Т-клетки подвергаются дифференцировке в киллеры при содействии В-клеточных антигенов на локальных АРС; а эти Т-клетки имеют мишенью широкий репертуар аутоантигенов (Tsai, S. et al. (2008) Adv. Immunol. 100:79-124; Santamaria, P. (2010) Immunity 32:437-445).
Было показано, что растворимые пептиды могут вызывать пептид-специфичную толерантность Т-клеток in vivo, но не могут пресекать полиспецифичные аутоиммунные реакции (Han et al. (2005) Nature Medicine 11(6):645-652). Неожиданно оказалось, что, в отличие от терапии с растворимым пептидом, терапия с помощью NPs, покрытых одним из T1D-релевантных рМНС класса I (который первоначально использовали в качестве отрицательного контроля), пресекает прогрессирование T1D у предиабетических мышей NOD и восстанавливает нормогликемию у диабетических животных (Tsai, S. et al. (2010) Immunity 32:568-580). Дальнейшая работа привела к неожиданному открытию того, что терапия pMHC-NP действует путем экспансии, специфичным к эпитопу образом, контактировавших с аутоантигеном аутореактивных клеток CD8+, подавляющих рекрутинг Т-клеток со специфичностью к другим аутоантигенам путем ингибирования и уничтожения нагруженных аутоантигенами APCs. Совсем недавно заявитель обнаружил, что такую терапевтическую платформу можно использовать для экспансии in vivo аутореактивных регуляторных Т-клеток CD4+. В частности, заявитель обнаружил, что NPs, покрытые индивидуальными T1D-релевантными рМНС класса II, вызывают экспансию специфичных к заболеванию Т-клеток TR1 CD4+, экспрессирующих маркеры TR1 CD49b и LAG3 (Gagliani, N. et al. (2013) Nature Medicine 19:739-746) и вырабатывающих цитокины IL-10 и TGF-β (см. ниже).
В совокупности эти наблюдения подтверждают новую парадигму прогрессирования аутоиммунитета, утверждающую, что хроническая стимуляция наивных аутореактивных Т-клеток CD8+ или CD4+ эндогенными эпитопами вызывает их дифференцировку в аутореактивные регуляторные Т-клетки типа клеток памяти; и что эти аутореактивные регуляторные клетки памяти подавляют активацию и когнатных, и не когнатных высокоавидных аутореактивных Т-клеток с различной специфичностью путем подавления и/или уничтожения нагруженных аутоантигенами APCs (Tsai, S. et al. (2010) Immunity 32:568-580). Важно отметить, без всякой связи с теорией, что для подавления сложных аутоиммунных реакций при нанесении в качестве лиганда на NPs можно использовать любую специфичность к отдельным эпитопам (рМНС), вовлеченным в аутоиммунное заболевание (среди многих). Заявитель полагает, что такие препараты NPs не могут активировать наивные Т-клетки, следовательно, индуцировать реакции эффекторных Т-клеток, поскольку они не содержат ключевых ко-стимулирующих молекул, таких как CD80 и CD86. В самом деле, при таком подходе устраняются когнатные наивные и эффекторные аутореактивные клетки. Таким образом, терапевтический подход, который позволил сделать это открытие, обеспечивает платформу для нового класса лекарственных средств при аутоиммунитете, потенциально способных устранять поликлональные аутоиммунные реакции специфичным для заболевания и органа образом без ущерба для системного иммунитета.
III. Способы
Также предусмотрены способы лечения и диагностики. В одном аспекте предусмотрен способ усиления образования, экспансии и рекрутинга В-регуляторных клеток и/или клеток TR1 (например, клеток TR1 и CD4+) антиген-специфичным образом у субъекта, нуждающегося в этом, включающий или же в основном состоящий или же состоящий из введения субъекту эффективного количества NP-комплекса или композиции, как описано здесь.
В другом аспекте предусмотрен способ лечения или профилактики аутоиммунного заболевания или нарушения, как описано здесь, например, MS, родственного MS заболевания, диабета или преддиабета, у нуждающегося в этом субъекта, причем способ включает или же в основном состоит или же состоит из введения субъекту эффективного количества NP-комплекса или композиции, как описано здесь, в которых аутоантиген причастен к подлежащему лечению заболеванию, например, антигеном для профилактики или лечения диабета служит причастный к диабету антиген. В другом аспекте аутоиммунное заболевание представлено рассеянным склерозом или родственным MS заболеванием, а антиген причастен к MS.
Пептидные антигены для лечения или профилактики преддиабета или диабета включают, без ограничения, hInsB10-18 (HLVEALYLV), hIGRP228-236 (LNIDLLWSV), hIGRP265-273 (VLFGLGFAI), IGRP206-214 (VYLKTNVFL), NRP-A7 (KYNKANAFL), NRP-I4 (KYNIANVFL), NRP-V7 (KYNKANVFL), YAI/Db (FQDENYLYL) и/или INS B15-23 (LYLVCGERG), GAD65114-123, VMNILLQYVV; GAD65536-545, RMMEYGTTMV; GFAP143-151, NLAQTDLATV; GFAP214-222, QLARQQVHV; IA-2172-180, SLSPLQAEL; IA-2482-490, SLAAGVKLL; IA-2805-813, VIVMLTPLV; ppIAPP5-13, KLQVFLIVL; ppIAPP9-17, FLIVLSVAL; IGRP152-160, FLWSVFMLI; IGRP211-219, NLFLFLFAV; IGRP215-223, FLFAVGFYL; IGRP222-230, YLLLRVLNI; IGRP228-236, LNIDLLWSV; IGRP265-273, VLFGLGFAI; IGRP293-301, RLLCALTSL; проинсулин L2-10, ALWMRLLPL; проинсулин L3-11, LWMRLLPLL; проинсулин L6-14, RLLPLLALL; проинсулин B5-14, HLCGSHLVEA; проинсулин B10-18, HLVEALYLV; проинсулин B14-22, ALYLVCGER; проинсулин B15-24, LYLVCGERGF; проинсулин В17-25, LVCGERGFF; проинсулин B18-27, VCGERGFFYT; проинсулин B20-27, GERGFFYT; проинсулин B21-29, ERGFFYTPK; проинсулин B25-C1, FYTPKTRRE; проинсулин B27-C5, TPKTRREAEDL; проинсулин C20-28, SLQPLALEG; проинсулин C25-33, ALEGSLQKR; проинсулин C29-A5, SLQKRGIVEQ; проинсулин А1-10, GIVEQCCTSI; проинсулин А2-10, IVEQCCTSI; проинсулин A12-20, SLYQLENYC либо их эквиваленты и/или комбинации. Дополнительные примеры включают ProIns 76-90, SLQPLALEGSLQKRG, ProIns 79-89, PLALEGSLQKR, ProIns 90-109, GIVEQCCTSICSLYQLENYC, ProIns 94-105, QCCTSICSLYQL, GAD 247-266, NMYAMMIARFKMFPEVKEKG, GAD 255-265, RFKMFPEVKEK, GAD 555-567, NFFRMVISNPAAT, IGRP 13-25, QHLQKDYRAYYTF, IGRP 8-27, GVLIIQHLQKDYRAYYTFLN, ProIns B24-C36, FFYTPMSRREVED и эквиваленты каждого из них.
Если же способ направлен на лечение MS или родственных MS заболеваний, то комплекс включает в себя антигены, связанные с рассеянным склерозом. К таким антигенам относятся, к примеру, те, что раскрыты в патентной публикации US 2012/0077686, и антигены, происходящие из основного белка миелина, ассоциированного с миелином гликопротеина, белка миелина олигодендроцитов, протеолипидного белка, олигопротеида миелина олигодендроцитов, ассоциированного с миелином основного белка олигодендроцитов, специфического белка олигодендроцитов, белков теплового шока, специфического белка олигодендроцитов NOGO А, гликопротеина Ро, периферического белка 22 миелина и 3'-фосфодиэстеразы 2'-3'-циклических нуклеотидов. В некоторых воплощениях антиген происходит из гликопротеина миелина олигодендроцитов (MOG). Неограничительные примеры включают, к примеру, MAG287-295, SLLLELEEV; MAG509-517, LMWAKIGPV; MAG556-564, VLFSSDFRI; МВР110-118, SLSRFSWGA; MOG114-122, KVEDPFYWV; MOG166-175, RTFDPHFLRV; MOG172-180, FLRVPCWKI; MOG179-188, KITLFVIVPV; MOG188-196, VLGPLVALI; MOG181-189, TLFVIVPVL; MOG205-214, RLAGQFLEEL; PLP80-88, FLYGALLLA либо их эквиваленты или комбинации.
Дополнительные неограничительные примеры антигенов, которые можно использовать в данном изобретении, включают полипептиды, содержащие или же в основном состоящие или же состоящие из полипептидов следующей группы: MOG35-55, MEVGWYRSPFSRVVHLYRNGK; MOG36-55, EVGWYRSPFSRVVHLYRNGK; MAG287-295, SLLLELEEV; MAG509-517, LMWAKIGPV; MAG556-564, VLFSSDFRI; MBPI110-118, SLSRFSWGA; MOG114-122, KVEDPFYWV; MOG166-175, RTFDPHFLRV; MOG172-180, FLRVPCWKI; MOG179-188, KITLFVIVPV; MOG188-196, VLGPLVALI; MOG181-189, TLFVIVPVL; MOG205-214, RLAGQFLEEL; PLP80-88, FLYGALLLA либо эквивалентов каждого из них или их комбинаций.
Методы определения и мониторинга терапии известны в данной области и вкратце описаны здесь. При введении in vitro, введение осуществляется путем контактирования композиции с тканью или клетками любым подходящим способом, например, путем введения в культуральную среду клеток или ткани, что применяется при скрининге для определения того, подходит ли терапия для данного лица, или для скрининга альтернативных способов лечения в качестве замены или в сочетании с описанными композициями. При введении in vivo, введение осуществляется путем системного или местного введения. In vivo способы могут выполняться не на людях, а на животных, для скрининга альтернативных способов лечения в качестве замены или в сочетании с описанными композициями перед введением человеку. Они также применимы при лечении заболеваний или расстройств у человека или других млекопитающих.
Вышеприведенные способы требуют введения эффективного количества NP-комплекса.
МНС у комплекса антиген-МНС-наночастицы может представлять собой МНС I, МНС II или неклассический МНС, но предпочтительно это MHCII. Белки МНС описаны далее. В одном воплощении МНС у комплекса антиген-МНС-наночастицы представлен МНС класса I. В другом воплощении МНС представлен МНС класса II. В других воплощениях МНС-компонент комплекса антиген-МНС-наночастицы представлен МНС класса II или неклассической молекулой МНС, как описано здесь. В одном из аспектов антиген содержит или же в основном состоит или же состоит из полипептида GWYRSPFSRVVH или эквивалентного GWYRSPFSRVVH.
Размер наночастиц может составлять от около 1 нм до около 1 мкм. В некоторых воплощениях диаметр наночастиц составляет менее 1 мкм. В других воплощениях диаметр наночастиц составляет менее 500 нм, менее 400 нм, менее 300 нм, менее 200 нм, менее 100 нм или менее 50 нм. В других воплощениях диаметр наночастиц составляет от около 1 нм до около 10 нм, 15 нм, 20 нм, 25 нм, 30 нм, 40 нм, 50 нм, 75 нм или 100 нм. В определенных воплощениях размер наночастиц составляет от около 1 нм до около 100 нм, от около 1 нм до около 50 нм, от около 1 нм до около 20 нм или от около 5 нм до около 20 нм.
Размер всего комплекса может составлять от около 5 нм до около 1 мкм. В некоторых воплощениях диаметр комплекса составляет менее 1 мкм или же менее 100 нм. В других воплощениях диаметр комплекса составляет менее 500 нм, менее 400 нм, менее 300 нм, менее 200 нм, менее 100 нм или менее 50 нм. В других воплощениях размер комплекса составляет от около 5 нм или 10 нм до около 50 нм либо от около 5 нм до около 75 нм или от около 5 нм до около 50 нм или от около 5 нм до около 60 нм или от около 10 нм до около 60 нм, а в одном из аспектов примерно 55 нм.
Заявитель обнаружил, что плотность комплексов антиген-МНС на наночастицах способствует терапевтическому эффекту. Итак, как изложено здесь, наночастицы с комплексом антиген-МНС могут иметь заданную плотность в пределах от около 0,05 молекул МНС на 100 нм2 площади поверхности наночастиц, включающей комплекс, в предположении по меньшей мере 2 молекул МНС либо по меньшей мере 8 или же по меньшей мере 9 или же по меньшей мере 10 или же по меньшей мере 11 или же по меньшей мере 12 молекул МНС в комплексе с наночастицей. В одном аспекте комплекс имеет плотность МНС от около 0,01 МНС на 100 нм (0,05 МНС/100 нм2) до около 30 МНС/100 нм2 или же от около 0,1 МНС/100 нм2 до около 25 МНС/100 нм2 или же от около 0,3 МНС/100 нм2 до около 25 МНС/100 нм2 или же от около 0,4 МНС/100 им2 до около 25 МНС/100 нм или же от около 0,5 МНС/100 нм до около 20 МНС/100 нм или же от около 0,6 МНС/100 нм2 до около 20 МНС/100 нм2 или же от около 1,0 МНС/100 нм2 до около 20 МНС/100 нм2 или же от около 5,0 МНС/100 нм2 до около 20 МНС/100 нм2 или же от около 10,0 МНС/100 нм2 до около 20 МНС/100 нм2 или же от около 15 МНС/100 нм2 до около 20 МНС/100 нм2 либо по меньшей мере 0,5 или же по меньшей мере 1,0 или же по меньшей мере 5,0 или же по меньшей мере 10,0 или же по меньшей мере 15,0 МНС/100 нм. В одном из аспектов, если в комплекс с наночастицей входят 9 или по меньшей мере 9 МНС, то диапазон плотности составляет от около 0,3 МНС/100 нм до около 20 МНС/100 нм.
В одном из аспектов способа предусмотрен способ накопления регуляторных В-клеток и/или противовоспалительных Т-клеток у нуждающегося в этом пациента. В одном воплощении Т-клетки представляют собой Т-клетки CD4+ или CD8+. В родственном воплощении Т-клетки секретируют IL-10 или TGF-β. Способ включает, в основном состоит или же состоит из введения нуждающемуся в этом пациенту эффективного количества наночастиц с комплексом антиген-МНС, как описано здесь.
В одном воплощении описанные здесь композиции и способы предназначаются для лечения аутоиммунных заболеваний типа MS, связанных с MS заболеваний, диабета или преддиабета. Способ включает, в основном состоит или же состоит из введения нуждающемуся в этом пациенту эффективного количества наночастиц с комплексом антиген-МНС, как описано здесь.
Подробности относительно способов введения in vitro и in vivo описаны далее.
Настоящим изобретением также предусмотрено применение NP-комплексов для получения лекарственных средств для лечения и/или профилактики заболеваний, как описано здесь.
IV. Комплексы антиген-МНС-наночастица
А. Полипептиды и полинуклеотиды
Следующие аспекты касаются выделенных или очищенных полипептидных антигенов, содержащих или в основном состоящих или же состоящих из аминокислотных последовательностей, как описано здесь, либо полипептидов, по последовательности по меньшей мере на 80% или же по меньшей мере на 85% или же по меньшей мере на 90% или же по меньшей мере на 95% или же по меньшей мере на 98% идентичных аминокислотным последовательностям антигенов, либо полипептидов, кодируемых полинуклеотидами, по последовательности по меньшей мере на 80% или же по меньшей мере на 85% или же по меньшей мере на 90% или же по меньшей мере на 95% или же по меньшей мере на 98% идентичными полинуклеотидам, кодирующим аминокислотные последовательности антигенов, или комплементарными им, либо полипептидов, кодируемых полинуклеотидами, гибридизующимися в условиях от умеренной до высокой жесткости с полинуклеотидами, кодирующими аминокислотные последовательности антигенов, или комплементарными им. Также предусмотрены выделенные и очищенные полинуклеотиды, кодирующие полипептиды описанных здесь антигенов или аминокислотные последовательности, идентичные им по меньшей мере на 80%, либо по меньшей мере на 85% или же по меньшей мере на 90% или же по меньшей мере на 95% или же по меньшей мере на 98% идентичны раскрытым последовательностям или их эквивалентам либо полинуклеотидам, гибридизующимся в жестких условиях с этими полинуклеотидами, их эквивалентами или комплементарными им, а также выделенные или очищенные полипептиды, кодируемые этими полинуклеотидами. Эти полипептиды и полинуклеотиды можно комбинировать с не встречающимися в природе веществами, с которыми они не связаны в природе, например, носителями, фармацевтически приемлемыми носителями, векторами и молекулами МНС, наночастицами, как это известно в данной области и как описано здесь.
Антигены, включая сегменты, фрагменты и другие молекулы, происходящие из различных антигенов, в том числе, но без ограничения, пептиды, углеводы, липиды или другие молекулы, презентируемые классическими и неклассическими молекулами МНС по изобретению, как правило, образуют комплекс или функционально связаны с молекулами МНС или их производными. Распознавание антигена Т-ограничивается главным комплексом гистосовместимости (МНС). Данный Т-лимфоцит распознает антиген только тогда, когда он связан с определенной молекулой МНС. В общем, Т-лимфоциты подвергаются стимуляции только в присутствии собственных молекул МНС, а антиген распознается по мере того, как фрагменты антигена связываются с собственными молекулами МНС. Ограничение по МНС определяет специфичность Т-лимфоцитов в отношении распознаваемого антигена и в отношении молекулы МНС, с которой связывается данный фрагмент антигена. В определенных аспектах некоторые антигены образуют пары с определенными молекулами МНС или происходящими из них полипептидами.
Термин "функционально связанный" или "покрытый" в настоящем изобретении относится к ситуации, когда индивидуальные полипептидные (например, МНС) и антигенные (например, пептидные) компоненты объединяются с образованием активного комплекса перед связыванием на сайте мишени, к примеру, иммунной клетки. Это включает в себя и те ситуации, когда индивидуальные компоненты полипептидного комплекса синтезируются или рекомбинантно экспрессируются, а затем выделяются и объединяются с образованием комплекса, in vitro, перед введением субъекту; ситуации, когда химерный или слитый полипептид (т.е. когда каждый дискретный белковый компонент комплекса содержится в единой полипептидной цепи) синтезируется или рекомбинантно экспрессируется в виде интактного комплекса. Как правило, полипептидные комплексы добавляют к наночастицам, получая наночастицы с адсорбированными или присоединенными полипептидными комплексами, у которых соотношение числа молекул к количеству наночастиц составляет примерно, не менее или не более 0,1, 0,5, 1, 3, 5, 7, 10, 15, 20, 25, 30, 35, 40, 50, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 600, 700, 800, 900, 1000, 1500 или больше к 1, более предпочтительно от около 0,1:1, 1:1 до около 50:1 или 300:1. Содержание полипептидов у наночастиц можно определить стандартными методами.
В. Молекулы МНС
Внутриклеточные и внеклеточные антигены представляют совершенно разные проблемы для иммунной системы, как в отношении распознавания, так и надлежащей реакции. Презентация антигенов Т-клеткам опосредуется двумя различными классами молекул: МНС класса I (MHC-I) и МНС класса II (МНС-II) (также обозначаются здесь как "рМНС"), которые используют различные пути процессинга антигенов. Пептиды, происходящие из внутриклеточных антигенов, презентируются Т-клеткам CD8+ молекулами МНС класса I, которые экспрессируются практически на всех клетках, тогда как происходящие из внеклеточных антигенов пептиды презентируются Т-клеткам CD4+ молекулами МНС-П. Однако есть определенные исключения из этой дихотомии. Некоторые исследования показали, что пептиды, полученные из подвергшихся эндоцитозу корпускулярных или растворимых белков, презентируются на молекулах MHC-I в макрофагах, а также в дендритных клетках. В некоторых воплощениях изобретения идентифицируется определенный антиген, который презентируется на комплексе антиген-МНС-наночастица в контексте соответствующего полипептида МНС класса I или II. В некоторых аспектах может проводиться оценка генетической организации субъекта, чтобы определить, какой полипептид МНС следует использовать для конкретного пациента и конкретного набора пептидов. В некоторых воплощениях компонент МНС класса I включает в себя всю молекулу HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-G или CD-I либо часть ее . В тех вариантах, в которых компонент МНС представлен МНС класса II, этот компонент МНС класса II может включать в себя весь HLA-DR, HLA-DQ или HLA-DP либо часть его.
Также предусмотрено применение неклассических молекул МНС в комплексах с МНС по изобретению. Неклассические молекулы МНС не полиморфны, консервативны среди различных видов и обладают узкими, глубокими, гидрофобными карманами для связывания лигандов. Эти связывающие карманы способны презентировать гликолипиды и фосфолипиды Т-клеткам натуральных киллеров (NKT) или некоторым подмножествам Т-клеток CD8+ типа Qa1 или приуроченным к HLA-E Т-клеткам CD8+. Клетки NKT представляют собой уникальную популяцию лимфоцитов, совместно экспрессирующих маркеры клеток NK и полуинвариантные Т-клеточные рецепторы (TCR). Они причастны к регуляции иммунных реакций, связанных с широким спектром заболеваний.
С. Антигенные компоненты
Некоторые аспекты изобретения охватывают способы и композиции, касающиеся антигенных композиций, включающих сегменты, фрагменты или эпитопы полипептидов, пептидов, нуклеиновых кислот, углеводов, липидов и других молекул, провоцирующих или вызывающих антигенные реакции, которых обычно называют антигенами. В частности, можно идентифицировать антигенные сегменты или фрагменты антигенных детерминант, которые приводят к гибели клеток посредством аутоиммунных реакций, и использовать их при создании описанных здесь комплексов антиген-МНС-наночастицы. Воплощения изобретения включают в себя композиции и способы модулирования иммунных реакций в клетках или тканях организма.
Антигенные полипептиды и пептиды по изобретению могут быть модифицированы посредством разного рода делеций, вставок и/или замен аминокислот. В предпочтительных воплощениях модифицированные полипептиды и/или пептиды способны модулировать иммунные реакции у субъекта. В некоторых воплощениях используются варианты белка или пептида дикого типа, однако во многих воплощениях изобретения для создания комплекса антиген-МНС-наночастица используется модифицированный белок или полипептид. Комплекс антиген-МНС-наночастица может использоваться для получения противовоспалительного иммунного ответа, для модифицирования Т-клеточных популяций иммунной системы (то есть перевоспитания иммунной системы) и/или усиления рекрутинга и накопления противовоспалительных Т-клеток в определенной ткани. Описанные выше термины могут применяться взаимозаменяемым образом. "Модифицированный белок" или "модифицированный полипептид" или "модифицированный пептид" означает такой белок или полипептид, химическая структура которого, в особенности его аминокислотная последовательность, изменена по отношению к белку или полипептиду дикого типа. В некоторых воплощениях модифицированный белок или полипептид или пептид имеет по меньшей мере одну модифицированную активность или функцию (учитывая, что белки или полипептиды или пептиды могут иметь несколько активностей или функций). Специально оговорено, что модифицированный белок или полипептид или пептид может быть изменен в отношении одной активности или функции, но сохранит активность или функцию дикого типа в других отношениях, таких как иммуногенность или способность взаимодействовать с другими клетками иммунной системы в контексте наночастиц с МНС-комплексом.
Неограничительные примеры пептидных антигенов включают, без ограничения, hInsB10-18 (HLVEALYLV), hIGRP228-236 (LNIDLLWSV), hIGRP265-273 (VLFGLGFAI), IGRP206-214 (VYLKTNVFL), NRP-A7 (KYNKANAFL), NRP-I4 (KYNIANVFL), NRP-V7 (KYNKANVFL), YAI/Db (FQDENYLYL) и/или InsB15-23 (LYLVCGERG), а также пептиды и белки, раскрытые в опубликованной заявке на патент США No. 2005/0202032, и их эквиваленты и/или комбинации.
В некоторых аспектах пептидным антигеном для лечения T1D служит GAD65114-123, VMNILLQYVV; GAD65536-545, RMMEYGTTMV; GFAP143-151, NLAQTDLATV; GFAP214-222, QLARQQVHV; IA-2172-180, SLSPLQAEL; IA-2482-490, SLAAGVKLL; IA-2805-813, VIVMLTPLV; ppIAPP5-13, KLQVFLIVL; ppIAPP9-17, FLIVLSVAL; IGRP152-160, FLWSVFMLI; IGRP211-219, NLFLFLFAV; IGRP215-223, FLFAVGFYL; IGRP222-230, YLLLRVLNI; IGRP228-236, LNIDLLWSV; IGRP265-273, VLFGLGFAI; IGRP293-301, RLLCALTSL; проинсулин L2-10, ALWMRLLPL; проинсулин L3-11, LWMRLLPLL; проинсулин L6-14, RLLPLLALL; проинсулин B5-14, HLCGSHLVEA; проинсулин В10-18, HLVEALYLV; проинсулин B14-22, ALYLVCGER; проинсулин B15-24, LYLVCGERGF; проинсулин B17-25, LVCGERGFF; проинсулин B18-27, VCGERGFFYT; проинсулин B20-27, GERGFFYT; проинсулин B21-29, ERGFFYTPK; проинсулин B25-C1, FYTPKTRRE; проинсулин B27-C5, TPKTRREAEDL; проинсулин C20-28, SLQPLALEG; проинсулин C25-33, ALEGSLQKR; проинсулин C29-A5, SLQKRGIVEQ; проинсулин А1-10, GIVEQCCTSI; проинсулин A2-10, IVEQCCTSI; проинсулин A12-20, SLYQLENYC; либо их эквиваленты и/или комбинации.
Дополнительные неограничительные примеры антигенов включают антигены, причастные к MS и/или родственным MS заболеваниям, которые можно использовать в данном изобретении, они включают полипептиды, содержащие или же в основном состоящие или же состоящие из полипептидов следующей группы: MOG35-55, MEVGWYRSPFSRVVHLYRNGK; MOG36-55, EVGWYRSPFSRVVHLYRNGK; MAG287-295, SLLLELEEV; MAG509-517, LMWAKIGPV; MAG556-564, VLFSSDFRI; MBP110-118, SLSRFSWGA; MOG114-122, KVEDPFYWV; MOG166-175, RTFDPHFLRV; MOG172-180, FLRVPCWKI; MOG179-188, KITLFVIVPV; MOG188-196, VLGPLVALI; MOG181-189, TLFVIVPVL; MOG205-214, RLAGQFLEEL; PLP80-88, FLYGALLLA либо эквивалентов каждого из них или их комбинаций.
В следующих аспектах пептидные антигены для лечения MS и родственных MS заболеваний включают, без ограничения: MOG35-55, MEVGWYRSPFSRVVHLYRNGK; MOG36-55, EVGWYRSPFSRVVHLYRNGK; MAG287-295, SLLLELEEV; MAG509-517, LMWAKIGPV; MAG556-564, VLFSSDFRI; МВР110-118, SLSRFSWGA; MOG114-122, KVEDPFYWV; MOG166-175, RTFDPHFLRV; MOG172-180, FLRVPCWKI; MOG179-188, KITLFVIVPV; MOG188-196, VLGPLVALI; MOG181-189, TLFVIVPVL; MOG205-214, RLAGQFLEEL; PLP80-88, FLYGALLLA MAG287-295, SLLLELEEV; MAG509-517, LMWAKIGPV; MAG556-564, VLFSSDFRI и их эквиваленты и/или комбинации.
Антигены для лечения MS и родственных MS заболеваний включают те, что раскрыты в патентной публикации US 2012/0077686, и антигены, происходящие из основного белка миелина, ассоциированного с миелином гликопротеина, белка миелина олигодендроцитов, протеолипидного белка, олигопротеида миелина олигодендроцитов, ассоциированного с миелином основного белка олигодендроцитов, специфического белка олигодендроцитов, белков теплового шока, специфического белка олигодендроцитов NOGO А, гликопротеина Ро, периферического белка 22 миелина и 3'-фосфодиэстеразы 2'-3'-циклических нуклеотидов. В некоторых воплощениях антиген происходит из гликопротеина миелина олигодендроцитов (MOG).
В некоторых воплощениях размер белка или полипептида (дикого типа или модифицированного), в том числе любых комплексов нужного белка или пептида, в частности, слияний МНС-пептид, может составлять, без ограничения, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 825, 850, 875, 900, 925, 950, 975, 1000, 1100, 1200, 1300, 1400, 1500, 1750, 2000, 2250, 2500 аминокислот или больше, включая любые промежутки или значения, производные от них либо их производных. В некоторых аспектах, в качестве антигенов могут использоваться 5, 6, 7, 8, 9, 10 или больше смежных аминокислот, включая их производные, а также фрагменты антигенов типа раскрытых и приведенных здесь аминокислотных последовательностей. Предусматривается, что полипептиды могут быть мутированы путем усечения, что делает их короче, чем соответствующие формы дикого типа, а также они могут быть изменены путем слияния или конъюгирования с гетерологичной последовательностью белка с определенной функцией (например, для презентирования в виде белкового комплекса, для повышения иммуногенности и т.д.).
Белковые композиции могут быть получены любым методом, известным специалистам в данной области, включая (i) экспрессию белков, полипептидов или пептидов с помощью стандартных методов молекулярной биологии, (ii) выделение белковых соединений из природных источников или (iii) химический синтез белковых материалов. Нуклеотидные, а также белковые, полипептидные и пептидные последовательности для различных генов уже описаны ранее и их можно найти в общепризнанных компьютерных базах данных. Такими базами данных являются базы данных GenBank и GenPept Национального центра по биотехнологической информации (через World Wide Web на ncbi.nlm.nih.gov/). Все кодирующие области для этих генов или их части можно амплифицировать и/или экспрессировать с помощью методов, изложенных здесь, либо известных рядовым специалистам.
Варианты аминокислотных последовательностей аутоантигенных эпитопов и других полипептидов из этих композиций могут представлять собой варианты с заменами, вставками или делециями. Модификации в полипептидах по изобретению могут затрагивать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, 500 или больше несмежных или смежных аминокислот пептида или полипептида, по сравнению с диким типом.
У вариантов с делециями обычно не хватает одного или нескольких остатков из нативной или аминокислотной последовательности дикого типа. Подвергаться делеции могут отдельные остатки или несколько смежных аминокислот. В кодирующую последовательность нуклеиновой кислоты может быть введен стоп-кодон (путем замены или вставки) для получения укороченного белка. Мутанты со вставками обычно включают добавление материала не в концевой точке полипептида. Это может включать в себя вставку одного или нескольких остатков. Также могут быть получены концевые добавления, которые называют слитыми белками.
Варианты с заменами обычно содержат замены одной аминокислоты на другую в одном или нескольких сайтах в белке и могут быть разработаны так, чтобы модулировать одно или несколько свойств полипептида с потерей или без потери других функций или свойств. Замены могут быть консервативными, то есть одна аминокислота заменяется на другую со сходной формой и зарядом. Консервативные замены хорошо известны в данной области и включают, к примеру, следующие замены: аланина на серии; аргинина на лизин; аспарагина на глутамин или гистидин; аспартата на глутамат; цистеина на серии; глутамина на аспарагин; глутамата на аспартат; глицина на пролин; гистидина на аспарагин или глутамин; изолейцина на лейцин или валин; лейцина на валин или изолейцин; лизина на аргинин; метионина на лейцин или изолейцин; фенилаланина на тирозин, лейцин или метионин; серина на треонин; треонина на серии; триптофана на тирозин; тирозина на триптофан или фенилаланин; и валина на изолейцин или лейцин. С другой стороны, замены могут быть неконсервативными, при этом затрагивается функция или активность полипептида или пептида, как-то авидность или сродство к клеточным рецепторам. Неконсервативные замены обычно включают замены одних остатков на такие, которые отличаются химически, типа замены полярной или заряженной аминокислоты на неполярную или незаряженную аминокислоту и наоборот.
Белки по изобретению могут быть рекомбинантными или синтезированными in vitro. С другой стороны, рекомбинантный белок может быть выделен из бактерий или других клеток хозяина.
Следует также понимать, что аминокислотные последовательности и последовательности нуклеиновых кислот могут включать в себя дополнительные остатки, как-то дополнительные N- или С-концевые аминокислоты либо 5'- или 3'-последовательности нуклеиновой кислоты, соответственно, и тем не менее быть в основном такими, как изложено в одной из приведенных здесь последовательностей, если только данная последовательность соответствует изложенным выше критериям, включая сохранение биологической активности белка (например, иммуногенности). Добавление концевых последовательностей в особенности применимо к последовательностям нуклеиновых кислот, которые, к примеру, могут включать в себя разного рода некодирующие последовательности, фланкирующие 5'- либо 3'-участки кодирующей области.
Предусматривается, что в композициях по изобретению содержится от около 0,001 мг до около 10 мг общего белка на мл. Так, концентрация белка в композиции может составлять примерно, по меньшей мере или не более 0,001, 0,010, 0,050, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0, 50, 100 мкг/мл или мг/мл или больше (или в любом производном от них диапазоне). Из них примерно, по меньшей мере или не более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100% могут составлять наночастицы с комплексом антиген-МНС.
Кроме того, в патенте США No. 4,554,101 (Норр), который включен сюда путем ссылки, описана идентификация и получение эпитопов из первичных аминокислотных последовательностей на основе гидрофильности. С помощью способов, изложенных в Норр, специалисты в данной области смогут идентифицировать потенциальные эпитопы внутри аминокислотной последовательности и проверить их иммуногенность. Многочисленные научные публикации также были посвящены предсказанию вторичной структуры и идентификации эпитопов из анализа аминокислотных последовательностей (Chou & Fasman, Adv. Enzymol., 47:45-148, 1978; Chou and Fasman, Annu. Rev. Biochem., 47:251-276, 1978; Chou and Fasman, Biochemistry, 13(2):211-222, 1974; Chau and Fasman, Biochemistry, 13(2):222-245, 1974; Chou and Fasman, Biophys. J., 26(3):385-399, 1979). При желании можно использовать любой из них в дополнение к изложенному Норр в патент США No. 4,554,101.
Для любого из данных аутоиммунных заболеваний можно идентифицировать и заранее выбрать комплекс антиген-МНС известными в данной области методами. Существуют алгоритмы, полученные на комплектах выравненных пептидов, для которых известно, что они связываются с данной молекулой МНС, которые можно использовать для прогнозирования и связывания пептид-МНС, и Т-клеточных эпитопов. Например, см. Reche and Reinherz (2007) Methods Mol. Biol. 409:185-200.
В качестве антигенов или антигенных фрагментов в комплексе с молекулами МНС можно использовать и другие молекулы, чем пептиды, и к таким молекулам относятся, без ограничения, углеводы, липиды, небольшие молекулы и т.п. Главными компонентами внешней поверхности у многих клеток являются углеводы. Некоторые углеводы характерны для различных стадий дифференцировки и очень часто эти углеводы распознаются специфичными антителами. Экспрессия различных углеводов может быть приурочена к определенным типам клеток.
D. Субстраты/наночастицы
В некоторых аспектах комплексы антиген/МНС функционально связаны с субстратом, то есть они соединяются ковалентно или нековалентно с субстратом. Субстрат может иметь вид наночастиц, которые необязательно содержат биосовместимый и/или биоабсорбируемый материал. Соответственно, в одном воплощении наночастицы являются биосовместимыми и/или биоабсорбируемыми. В другом аспекте наночастицы имеют твердое ядро и/или не являются липосомами. Субстрат также может иметь вид таких наночастиц, которые описаны ранее в патентной публикации США No. 2009/0155292. Наночастицы могут иметь структуру переменного размера и они известны по-разному как наносферы, наночастицы или биосовместимые биоразлагаемые наносферы или биосовместимые биоразлагаемые наночастицы. Такие композиции в виде частиц, содержащих комплекс антиген/МНС, могут быть получены путем ковалентного или нековалентного присоединения комплекса к наночастицам.
Наночастицы обычно состоят из практически сферического ядра и, необязательно, одного или нескольких слоев. Ядро может варьироваться по размеру и составу. Наряду с ядром, наночастицы могут содержать один или несколько слоев, обеспечивающих функциональные возможности, подходящие для представляющих интерес применений. Толщина слоев, если они есть, может варьироваться в зависимости от потребностей конкретного применения. Например, слои могут придавать полезные оптические свойства.
Слои также могут придавать химические или биологические функциональности и именуются здесь химически активными или биологически активными слоями, и для этих функциональностей толщина слоя или слоев, как правило, составляет от 0,001 микрометра (1 нанометра) до около 10 микрометров или больше (в зависимости от требуемого диаметра наночастиц), причем эти слои обычно наносятся на внешнюю поверхность наночастиц.
Составы сердцевины и слоев могут варьироваться. Подходящими материалами для частиц или ядра являются, без ограничения, полимеры, керамика, стекло, минералы и т.п. Примеры их включают, без ограничения, стандартные и специальные стекла, диоксид кремния, полистирол, полиэфиры, поликарбонат, акриловые полимеры, полиакриламид, полиакрилонитрил, полиамид, фторполимеры, силикон, целлюлозы, кремний, металлы (например, железо, золото, серебро), минералы (например, рубин), наночастицы (например, наночастицы золота, коллоидные частицы, оксиды металлов, сульфиды металлов, селениды металлов и такие магнитные материалы, как оксид железа) и их композиты. Ядро может иметь однородный состав или состоять из двух или нескольких классов материалов, в зависимости от желательных свойств. В некоторых аспектах применяются металлические наночастицы. Эти металлические частицы или наночастицы могут состоять из Au, Pt, Pd, Cu, Ag, Со, Fe, Ni, Mn, Sm, Nd, Pr, Gd, Ti, Zr, Si и In, прекурсоров, их бинарных сплавов, тройных сплавов и интерметаллических соединений. См. патент США No. 6,712,997. В некоторых воплощениях составы сердцевины и слоев могут изменяться при условии, что наночастицы будут биосовместимыми и биоабсорбируемыми. Ядро может иметь однородный состав или состоять из двух или нескольких классов материалов, в зависимости от требуемых свойств. В некоторых аспектах применяются металлические наносферы. Эти металлические наночастицы могут состоять из Fe, Са, Ga и т.п. В некоторых воплощениях наночастицы включают в себя сердцевину, содержащую металл или оксид металла типа золота или оксида железа.
Как уже сказано выше, наночастицы, наряду с ядром, могут включать в себя один или несколько слоев. Наночастицы могут включать в себя слой, состоящий из биоразлагаемого сахарида или другого полимера. Примеры биоразлагаемых слоев включают, без ограничения, декстран; полиэтиленгликоль; полиэтиленоксид; маннит; полиэфиры на основе полилактида (PLA), полигликолида (PGA), поликапролактона (PCL); полигидроксиалканоаты из класса PHB-PHV; и другие модифицированные полисахариды, такие как крахмал, целлюлоза и хитозан. Кроме того, наночастицы могут включать в себя слой с подходящей поверхностью для прикрепления химических функциональных групп для сайтов химического связывания или присоединения.
Слои могут быть получены на наночастицах различными способами, известными специалистам в данной области. Примеры включают методы по технологии золь-гель типа описанных в Iler, Chemistry of Silica, John Wiley & Sons, 1979; Brinker and Scherer, Sol-Gel Science, Academic Press (1990). Другие подходы к получению слоев на наночастицах включают методы поверхностной химии и инкапсуляции типа описанных в Partch and Brown, J. Adhesion, 67:259-276, (1998); Pekarek et al., Nature, 367:258, (1994); Hanprasopwattana, Langmuir, 12:3173-3179, (1996); Davies, Advanced Materials, 10:1264-1270, (1998); и приведенных там ссылках. Также можно использовать методы осаждения из паровой фазы; к примеру, см. Golman and Shinohara, Trends Chem. Engin., 6:1-6 (2000); и патенте США. No. 6,387,498. Еще другие подходы включают методы послойной самосборки типа описанных в Sukhorukov et al, Polymers Adv. Tech., 9(10-11):759-767, (1998); Caruso et al., Macromolecules, 32(7):2317-2328, (1998); Caruso et al., J.Amer. Chem. Soc, 121(25):6039-6046, (1999); патент США. No. 6,103,379; и приведенных в них ссылках.
Наночастицы могут быть получены путем контактирования водной фазы, содержащей комплекс антиген/МНС/костимуляторная молекула и полимер, и неводной фазы с последующим выпариванием неводной фазы, что вызывает слияние частиц из водной фазы, как изложено в патентах США. No. 4,589,330 или 4,818,542. Предпочтительными полимерами для таких препаратов являются природные или синтетические сополимеры или полимеры, выбранные из группы, состоящей из желатина, агара, крахмала, арабиногалактана, альбумина, коллагена, полигликолевой кислоты, полимолочной кислоты, сополимеры гликолида-L(-)лактида с поли(ε-капролактоном), поли(ε-капролактона) с молочной кислотой, поли(ε-капролактона) с гликолевой кислотой, поли(β-гидроксимасляной кислоты), полиэтиленоксида, полиэтилена, поли(алкил-2-цианоакрилата), поли(гидроксиэтилметакрилата), полиамидов, поли(аминокислот), поли(2-гидроксиэтил-DL-аспартамида), полиэфиров мочевины, поли(L-фенилаланин/этиленгликоль/1,6-диизоцианатогексана) и поли(метилметакрилата). Особенно предпочтительными полимерами являются такие полиэфиры, как полигликолевая кислота, полимолочная кислота, сополимеры гликолида-L(-)лактида с поли(ε-капролактоном), поли(ε-капролактона) с молочной кислотой и поли(ε-капролактона) с гликолевой кислотой. Растворители, применимые для растворения полимеров: вода, гексафторизопропанол, хлористый метилен, тетрагидрофуран, гексан, бензол или гексафторацетон полутораводный.
Размер наночастиц может составлять от около 1 нм до около 1 мкм. В некоторых воплощениях диаметр наночастиц составляет менее 1 мкм. В других воплощениях диаметр наночастиц составляет менее 500 нм, менее 400 нм, менее 300 нм, менее 200 нм, менее 100 нм или менее 50 нм. В других воплощениях диаметр наночастиц составляет от около 1 нм до около 10 нм, 15 нм, 20 нм, 25 нм, 30 нм, 40 нм, 50 нм, 75 нм или 100 нм. В определенных воплощениях размер наночастиц составляет от около 1 нм до около 100 нм, от около 1 нм до около 50 нм, от около 1 нм до около 20 нм или от около 5 нм до около 20 нм.
Размер всего комплекса может составлять от около 5 нм до около 1 мкм. В некоторых воплощениях диаметр комплекса составляет менее 1 мкм или же менее 100 нм. В других воплощениях диаметр комплекса составляет менее 500 нм, менее 400 нм, менее 300 нм, менее 200 нм, менее 100 нм или менее 50 нм. В других воплощениях размер комплекса составляет от около 10 нм до около 50 нм или от около 20 нм до около 75 нм или от около 25 нм до около 60 нм или от около 30 нм до около 60 нм, а в одном из аспектов примерно 55 нм.
Е. Связывание комплекса антиген-МНС с наночастицами
Для связывания субстрата или наносфер с комплексами антиген-МНС могут применяться следующие методы.
Связывание может осуществляться путем химической модификации субстрата или наночастиц, что обычно включает создание "функциональных групп" на поверхности, причем данные функциональные группы способны связываться с комплексом антиген-МНС, и/или соединение необязательно химически модифицированной поверхности субстрата или наночастиц со связанными ковалентно или нековалентно так называемыми "соединительными молекулами", с последующим взаимодействием комплекса антиген-МНС с полученными наночастицами.
Термин "соединительная молекула" означает вещество, способное связываться с субстратом или наночастицами и также способное связываться с комплексом антиген-МНС. В некоторых воплощениях комплексы антиген-МНС соединяются с наночастицами через линкер. Неограничительные примеры подходящих линкеров включают линкеры типа дофамин (ВРА)-полиэтиленгликоль (PEG), такие как DPA-PEG-сложный эфир NHS, DPA-PEG-ортопиридил-дисульфид (OPSS) и/или DPA-PEG-азид. Другие линкеры включают пептидные линкеры, этиленгликоль, биотин и стрептавидин.
Термин "функциональные группы" в настоящем изобретении не ограничивается реакционноспособными химическими группами, образующими ковалентные связи, но также включает в себя химические группы, приводящие к ионным взаимодействиям или образованию водородных связей с комплексом антиген-МНС. Кроме того, следует отметить, что строгое различие между "функциональными группами", созданными на поверхности, и соединительными молекулами, несущими "функциональные группы", не представляется возможным, так как иногда модификация поверхности требует реакции небольших соединительных молекул типа этиленгликоля с поверхностью наносфер.
Функциональные группы или несущие их соединительные молекулы могут быть выбраны из аминогрупп, карбоксильных групп, тиолов, тиоэфиров, дисульфидов, гуанидино, гидроксильных групп, аминогрупп, вицинальных диолов, альдегидов, альфа-галоацетильных групп, органических соединений ртути, сложноэфирных групп, галоангидридов, тиоэфиров, ангидридов, изоцианатов, изотиоцианатов, галогенидов сульфокислот, имидоэфиров, диазоацетатов, солей диазония, 1,2-дикетонов, фосфоновых кислот, сложных эфиров фосфорной кислоты, сульфокислот, азолидов, имидазолов, индолов, N-малеимидов, α-β-ненасыщенных карбонильных соединений, арилгалогенидов либо их производных.
Неограничительные примеры других соединительных молекул с более высокой молекулярной массой: молекулы нуклеиновых кислот, полимеры, сополимеры, полимеризующиеся конденсирующие реагенты, диоксид кремния, белки и цепочкообразные молекулы с поверхностью, имеющей противоположную полярность по отношению к субстрату или наночастицам. Нуклеиновые кислоты могут обеспечить связь с аффинными молекулами, содержащими такие же молекулы нуклеиновых кислот, но с комплементарной последовательностью относительно соединительной молекулы.
Конкретным примером ковалентного линкера являются полиэтиленгликоли (PEG) типа функционализованных PEG. В настоящем изобретении "функционализированные PEG" означают молекулы PEG, содержащие концевую функциональную группу, неограничительные примеры которых включают амино-, меркапто-, тиоэфирные, карбоксильные группы и др. Неограничительные примеры функционализованных PEG-линкеров на ядрах различных наночастиц представлены в прилагаемых таблицах 1 и 2, например, PEG-линкер тиол-PEG-NH2.
В некоторых воплощениях описанные здесь линкеры имеют заданные размеры. В некоторых воплощениях линкер составляет менее 10 кДа, менее 5 кДа, менее 4,5 кДа, менее 4 кДа, менее 3,5 кДа, менее 3 кДа, менее 2,5 кДа, менее 2 кДа или менее 1 кДа. В других воплощениях линкер составляет от около 0,5 кДа до около 5, 4,5, 4, 3,5, 3, 2,5, 2, 1,5 или 1 кДа. В других воплощениях линкер составляет от около 1 до около 4,5, 4, 3,5, 3, 2,5, 2 или 1,5 кДа.
В качестве примеров полимеризующихся конденсирующих реагентов можно привести диацетилен, бутадиен-стиролы, винилацетат, акрилаты, акриламид, виниловые соединения, стирол, оксид кремния, оксид бора, оксид фосфора, бораты, пиррол, полипиррол и фосфаты.
Поверхность субстрата или наночастиц может быть химически модифицирована, например, путем связывания производных фосфоновых кислот, содержащих функциональные реакционноспособные группы. Одним из примеров таких производных фосфоновых кислот или сложных эфиров фосфокислот является имино-бис(метиленфосфоно)карбоновая кислота, которая может быть синтезирована по реакции "Mannich-Moedritzer". Эта реакция связывания может проводиться с субстратом или наносферами, полученными непосредственно в процессе получения, или после предварительной обработки (например, триметилсилилбромидом). В первом случае производное (сложного эфира) фосфоновой кислоты, к примеру, может вытеснять компоненты реакционной среды, которые все еще связаны с поверхностью. Это вытеснение может усиливаться с повышением температуры. С другой стороны, считается, что триметилсилилбромид деалкилирует содержащие алкильные группы комплексообразующие вещества на фосфорной основе, тем самым создавая новые сайты связывания для производного (сложного эфира) фосфокислоты. Производные (сложного эфира) фосфоновой кислоты или связанные с ними соединительные молекулы могут содержать те же функциональные группы, которые приведены выше. Другой пример обработки поверхности субстрата или наносфер включает нагревание в диоле типа этиленгликоля. Следует отметить, что такая обработка может быть излишней, если синтез уже проходил в диоле. В таких условиях полученный при этом продукт синтеза должен содержать необходимые функциональные группы. Однако эта обработка применима к субстратам или наночастицам, полученным в присутствии N- или Р-содержащих комплексообразователей. Если такие субстраты или частицы подвергнуть после этого обработке этиленгликолем, то ингредиенты реакционной среды (например, комплексообразующее средство), все еще связанные с поверхностью, будут заменяться диолом и/или же деалкилироваться.
Также можно заменить N-содержащие комплексообразователи, все еще связанные с поверхностью частиц, производными первичных аминов, содержащими вторую функциональную группу. Поверхность субстрата или наночастиц также может быть покрыта окисью кремния. Диоксид кремния позволяет сравнительно просто проводить химическую конъюгацию органических молекул, так как кремнезем легко вступает в реакцию с такими органическими линкерами, как триэтоксисилан или хлорсилан. На поверхность наночастиц также можно наносить гомо- или сополимеры. Примерами полимеризующихся конденсирующих реагентов служат N-(3-аминопропил)-3-меркаптобензамидин, 3-(триметоксисилил)пропилгидразид и 3-(триметоксисилил)пропилмалеимид. Другие неограничительные примеры полимеризующихся конденсирующих реагентов приведены выше. Эти конденсирующие реагенты можно использовать по отдельности или в сочетании, в зависимости от типа сополимера, получаемого в качестве покрытия.
Другой метод модификации поверхности, который можно использовать с субстратами или наночастицами, содержащими соединения оксидов переходных металлов, заключается в превращении соединений оксидов переходных металлов с помощью газообразного хлора или органических хлорирующих реагентов в соответствующие оксихлориды. Эти оксихлориды способны вступать в реакцию с нуклеофилами типа гидроксильных или аминогрупп, которые часто встречаются в биомолекулах. Этот метод позволяет проводить прямое конъюгирование с белками, например, через аминогруппы боковых цепей лизина. Конъюгирование с белками после модификации поверхности оксихлоридами также может осуществляться с помощью бифункционального линкера типа гидразида малеимидопропионовой кислоты.
Для методов нековалентного связывания особенно подходят цепочкообразные молекулы с полярностью или зарядом, противоположным таковым у поверхности субстрата или наносфер. Примеры соединительных молекул, которые могут нековалентно связываться с ядром/оболочкой наносфер, включают анионные, катионные или цвиттер-ионные поверхностно-активные вещества, кислотные или основные белки, полиамины, полиамиды, полисульфоновые или поликарбоновые кислоты. Необходимая связь может образоваться при гидрофобном взаимодействии между субстратом или наносферой и амфифильным реагентом, содержащим функциональную реакционноспособную группу. В частности, можно использовать цепочкообразные молекулы амфифильной природы, как-то фосфолипиды или дериватизированные полисахариды, которые могут сшиваться друг с другом. Абсорбция этих молекул на поверхности может осуществляться путем совместной инкубации. Связывание между аффинной молекулой и субстратом или наночастицей также может основываться на нековалентных, самоорганизующихся связях. Одним из примеров этого являются простые зонды для детектирования с биотином в качестве соединительной молекулы и конъюгированными с авидином или стрептавидином молекулами.
Методики реакций присоединения функциональных групп к биологическим молекулам можно найти в литературе, к примеру, в "Bioconjugate Techniques" (Greg Т. Hermanson, Academic Press 1996). Биологическую молекулу (например, молекулу МНС либо ее производное) можно конъюгировать с соединительной молекулой, ковалентно или нековалентно, в соответствии со стандартными методами органической химии типа окисления, галогенирования, алкилирования, ацилирования, присоединения, замещения или амидирования. Эти методы конъюгирования со связывающейся ковалентно или нековалентно соединительной молекулой могут применяться перед конъюгированием соединительной молекулы с субстратом или наносферами или же после этого. Кроме того, можно, при помощи инкубации, осуществлять прямое связывание молекул с соответственно обработанным (к примеру, триметилсилилбромидом) субстратом или наночастицами, у которых вследствие этой предобработки появится модифицированная поверхность (к примеру, с более высоким зарядом или полярностью).
F. Получение белков
В настоящем изобретении описаны полипептиды, пептиды и белки для применения в различных воплощениях настоящего изобретения. Например, определенные пептиды и их комплексы подвергают анализу на их способность индуцировать или модулировать иммунные реакции. В определенных воплощениях все или часть пептидов или белков по изобретению также можно синтезировать в растворе или на твердом носителе в соответствии со стандартными методами. Коммерчески доступны различные автоматические синтезаторы, которые могут использоваться в соответствии с известными протоколами. Например, см. Stewart and Young, Solid Phase Peptide Synthesis, 2nd Ed., Pierce Chemical Co., (1984); Tarn et al., J. Am. Chem. Soc, 105:6442, (1983); Merrifield, Science, 232(4748):341-347, (1986); и Barany and Merrifield, The Peptides, Gross and Meinhofer (Eds.), Academic Press, NY, 1-284, (1979), которые включены сюда путем ссылки. С другой стороны, можно использовать технологию рекомбинантной ДНК, в которой последовательность нуклеотидов, кодирующую пептид по изобретению, вставляют в экспрессирующий вектор, который путем трансформации или трансфекции вводят в подходящие клетки-хозяева, которые культивируют в условиях, подходящих для экспрессии.
Одно из воплощений изобретения включает применение переноса генов в клетки, в том числе микроорганизмы, для вырабатывания белков. Ген представляющего интерес белка можно перенести в соответствующие клетки-хозяева, а затем культивировать клетки в соответствующих условиях. Можно использовать нуклеиновые кислоты, кодирующие практически любые полипептиды. Получение рекомбинантных экспрессирующих векторов и включенных в них элементов известно специалистам в данной области и вкратце описано здесь. Примеры клеточных линий из млекопитающих включают, без ограничения, клетки Vero и HeLa, другие линии В- и Т-клеток, как-то СЕМ, 721.221, Н9, Jurkat, Raji, а также линии клеток яичников китайского хомячка (СНО), клетки W138, ВНК, COS-7, 293, HepG2, 3Т3, RIN и MDCK. Кроме того, можно выбрать такой штамм клеток-хозяев, который модулирует экспрессию вставленных последовательностей либо модифицирует и процессирует генный продукт нужным образом. Такие модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут быть важными для функционирования белка. Различные клетки-хозяева имеют характерные и специфические механизмы посттрансляционного процессинга и модификации белков. Можно выбрать подходящие линии клеток или системы хозяев с тем, чтобы обеспечить правильные модификации и процессинг экспрессируемого чужеродного белка.
Можно использовать различные системы отбора, включающие, без ограничения, гены тимидинкиназы, гипоксантин-гуанинфосфорибозилтрансферазы и аденин-фосфорибозилтрансферазы HSV в клетках tk-, hgprt- или aprt-, соответственно. Кроме того, в качестве основы для отбора можно использовать устойчивость к антиметаболитам: dhfr, который придает устойчивость к триметоприму и метотрексату; gpt, который придает устойчивость к микофеноловой кислоте; neo, который придает устойчивость к аминогликозиду G418; и hygro, который придает устойчивость к гигромицину.
G. Нуклеиновые кислоты
Настоящее изобретение охватывает и рекомбинантные полинуклеотиды, кодирующие белки, полипептиды, пептиды по изобретению типа тех, что кодируют антигенные пептиды.
В определенных воплощениях изобретение касается выделенных сегментов нуклеиновых кислот и рекомбинантных векторов, содержащих последовательности нуклеиновых кислот, кодирующие аутоантигены и/или молекулы МНС. Термин "рекомбинантный" может применяться в сочетании с полипептидом или названием определенного полипептида, причем это обычно относится к полипептидам, полученным из молекул нуклеиновых кислот, подвергавшихся манипулированию in vitro, или же к продуктам репликации таких молекул.
Сегменты нуклеиновых кислот, используемые в настоящем изобретении, независимо от длины самой кодирующей последовательности, могут комбинироваться с другими последовательностями нуклеиновых кислот, такими как промоторы, сигналы полиаденилирования, дополнительные сайты рестрикционных ферментов, сайты множественного клонирования, другие кодирующие сегменты и т.п., при этом их общая длина может значительно варьироваться. Поэтому предусматривается, что можно использовать фрагменты нуклеиновых кислот практически любой длины, причем их общая длина предпочтительно ограничивается простотой получения и применения по намеченной методике рекомбинантной нуклеиновой кислоты. В некоторых случаях последовательность нуклеиновой кислоты может кодировать последовательность полипептида с дополнительными гетерологичными кодирующими последовательностями, к примеру, для облегчения очистки полипептида, транспорта, секреции, посттрансляционных модификаций, либо для терапевтических преимуществ, таких как таргетинг или эффективность. К модифицированной последовательности, кодирующей полипептид, может быть добавлен тег или другой гетерологичный полипептид, при этом "гетерологичный" означает такой полипептид, который не является таким же, как модифицированный полипептид.
V. Фармацевтические композиции и способы введения
Предусмотрены фармацевтические композиции, применимые для лечения заболеваний.
А. Фармацевтические композиции
Наночастицы с комплексом антиген-МНС могут вводиться сами по себе или в сочетании с носителем типа фармацевтически приемлемых носителей в композициях. Композиции по изобретению обычно вводятся парентерально, путем инъекции, к примеру, внутривенно, подкожно или внутримышечно. Другие композиции, которые подходят для других способов введения, включают пероральные формы. Пероральные формы содержат такие широко используемые наполнители фармацевтического уровня, к примеру, как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния и др. Эти композиции принимают форму растворов, суспензий, таблеток, пилюль, капсул, форм с замедленным высвобождением или порошков и содержат от около 10% до около 95% активного ингредиента, предпочтительно от около 25% до около 70%. Приготовление водных композиций, содержащих наночастицы с комплексом антиген-МНС, которые модифицируют иммунное состояние субъекта, должно быть известно специалистам в данной области в свете настоящего описания. В некоторых воплощениях композиция может вводиться путем ингаляции (например, патент США No. 6,651,655, который специально включен путем ссылки во всей полноте). В одном воплощении наночастицы с комплексом антиген-МНС вводятся системно.
Как правило, композиции по изобретению вводятся способом, совместимым с лекарственной формой, и в таком количестве, которое будет терапевтически эффективным и будет модифицировать иммунную систему. Вводимое количество зависит от субъекта, подлежащего лечению. Точное количество активного ингредиента, которое необходимо вводить, зависит от суждения лечащего врача. Однако подходящие диапазоны доз составляют порядка от 10 до нескольких сот нанограмм или микрограмм наночастиц с комплексом антиген-МНС на одно введение. Подходящие режимы для первоначального введения и последующего также различаются, но в типичном случае за первоначальным введением следуют последующие введения.
Во многих случаях желательно проводить многократное введение наночастиц с комплексом антиген-МНС примерно, не более или по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10 или больше раз. Введение обычно проводят с интервалом от 2-х дней до 12 недель, чаще с интервалом в 1-2 недели. Для поддержания состояния иммунной системы может потребоваться периодическое повторение с интервалом в 0,25-5 лет, обычно в два года. Курс введения может сопровождаться анализами на воспалительные иммунные реакции и/или активность ауторегуляторных Т-клеток.
В некоторых воплощениях фармацевтические композиции вводятся субъектам. Различные аспекты настоящего изобретения включают введение субъектам эффективного количества композиции наночастиц с комплексом антиген-МНС. Кроме того, такие композиции могут вводиться в сочетании с модификаторами иммунной системы. Такие композиции обычно растворяют или диспергируют в фармацевтически приемлемом носителе или водной среде.
Выражения "фармацевтически приемлемый" или "фармакологически приемлемый" относятся к таким молекулярным частицам и композициям, которые не вызывают неблагоприятных, аллергических или других отрицательных реакций при введении животным или людям. В настоящем изобретении "фармацевтически приемлемый носитель" охватывает всевозможные растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие всасывание средства и т.п. Применение таких сред и средств для фармацевтически активных веществ хорошо известно в данной области. За исключением тех случаев, когда какие-либо стандартные среды или средства несовместимы с активными ингредиентами, предусмотрено их применение в иммуногенных и терапевтических композициях.
Фармацевтические формы, подходящие для применения в виде инъекций, включают стерильные водные растворы или дисперсии; формы, содержащие кунжутное масло, арахисовое масло или водный пропиленгликоль; и стерильные порошки для приготовления ex temporo стерильных растворов или дисперсий для инъекций. Во всех случаях эти формы должны быть стерильными и должны быть жидкими в такой степени, чтобы их можно было легко вводить посредством инъекций. Они также должны быть стабильными в условиях производства и хранения и защищены от загрязняющего действия таких микроорганизмов, как бактерии и грибы.
Композиции могут быть составлены в виде нейтральной или солевой формы. Фармацевтически приемлемые соли включают соли с кислотами (которые образуются со свободными аминогруппами белка), которые образованы с неорганическими кислотами, такими, к примеру, как соляная кислота или фосфорная кислота, или с такими органическими кислотами, как уксусная, щавелевая, винная, миндальная и др. Соли, образованные со свободными карбоксильными группами, также могут быть получены из неорганических оснований, таких, к примеру, как гидроксиды натрия, калия, аммония, кальция или железа, и таких органических оснований, как изопропиламин, триметиламин, гистидин, прокаин и др.
Носителем может быть растворитель или дисперсионная среда, содержащая, к примеру, воду, этанол, полиол (например, глицерин, пропиленгликоль или жидкий полиэтиленгликоль), подходящие смеси из них, а также растительные масла. Надлежащая текучесть может поддерживаться, к примеру, с помощью покрытия типа лецитина, путем поддержания требуемого размера частиц в случае дисперсий и с помощью поверхностно-активных веществ. Для предотвращения действия микроорганизмов можно применять различные антибактериальные и противогрибковые средства, например, парабены, хлорбутанол, фенол, сорбиновую кислоту, тимеросал и др. Во многих случаях предпочтительно следует включать в композиции изотонические средства, например, сахара или хлорид натрия. Для пролонгированного всасывания инъекционных композиций можно использовать в композициях средства, замедляющие всасывание, к примеру, моностеарат алюминия и желатин.
Стерильные растворы для инъекций получают путем введения активных соединений в требуемом количестве в соответствующий растворитель с различными другими ингредиентами, перечисленными выше, как потребуется, с последующей стерилизацией. Стерилизация раствора должна проводиться таким образом, чтобы не ухудшить лечебные свойства комплекса антиген-МНС-наночастицы. В общем, дисперсии получают путем введения различных стерилизованных активных ингредиентов в стерильный носитель, содержащий основу дисперсионной среды и другие необходимые ингредиенты из числа тех, которые перечислены выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций предпочтительными способами получения являются методы вакуумной сушки и сушки замораживанием, которые дают порошок активного ингредиента плюс любых других необходимых ингредиентов из предварительно стерилизованного раствора таковых. Одним из таких методов стерилизации растворов является стерилизация фильтрованием, однако настоящее изобретение включает в себя любые методы стерилизации, которые не вызывают существенного снижения терапевтических свойств комплексов антиген-МНС-наночастицы. Методы стерилизации, включающие интенсивное нагревание и давление, к примеру, автоклавирование, могут нарушить третичную структуру комплекса и тем самым значительно уменьшить лечебные свойства комплексов антиген-МНС-наночастицы.
Эффективное количество терапевтической композиции определяется на основании намеченной цели. Термин "единица дозы" или "дозировка" относится к физически дискретным единицам, пригодным для применения у субъектов, причем каждая единица содержит заданное количество композиции, рассчитанное на получение требуемых ответов, приведенных выше в связи с введением, то есть соответствующим способом и режимом введения. Вводимое количество, в отношении количества раз и единицы дозы, зависит от требуемого результата и/или степени защиты. Точное количество композиции также зависит от суждения лечащего врача и индивидуально для каждого индивида. Факторы, влияющие на дозу, включают физическое и клиническое состояние субъекта, способ введения, намеченные цели лечения (ослабление симптомов или же излечение), а также активность, стабильность и токсичность данной композиции. После приготовления растворы должны вводиться способом, совместимым с лекарственной формой, и в таком количестве, которое будет терапевтически или профилактически эффективным. Лекарственные формы легко вводятся в различных дозовых формах типа описанных выше растворов для инъекций.
В. Комбинированная терапия
Композиции и связанные с ними способы настоящего изобретения, в частности, введение комплексов антиген-МНС-наночастицы, также могут применяться в сочетании с проведением традиционных способов терапии. К ним относятся, без ограничения, Avonex (интерферон β-1а), бетаферон (интерферон β-1b), Copaxone (глатирамер ацетат), Novantrone (митоксантрон), Rebif (интерферон β-1a), Tysabri (натализумаб), Gilenya (финголимод), глатирамер, стероиды, Cytoxan, Imuran, баклофен, глубокая стимуляция мозга, Ampyra (дальфампридин), акупунктура и физическая терапия.
При проведении комбинированной терапии можно использовать различные комбинации, например, если "А" означает введение комплексов антиген-МНС-наночастицы, а "В" - дополнительного средства:
А/В/А В/А/В В/В/А А/А/В А/В/В В/А/А А/В/В/В В/А/В/В
В/В/В/А В/В/А/В А/А/В/В А/В/А/В А/В/В/А/ В/В/А/А
В/А/В/А В/А/А/В А/А/А/В В/А/А/А А/В/А/А А/А/В/А
Введение композиций с комплексом пептид-МНС по настоящему изобретению пациентам/субъектам должно соответствовать общим методикам по введению таких соединений, с учетом токсичности, если она есть. Предполагается, что циклы лечения будут повторяться по мере необходимости. Также предусматривается, что в комбинации с описанной терапией могут применяться различные стандартные методы лечения, такие как гидратация.
С. Введение in vitro или ex vivo
В настоящем изобретении термин введение in vitro относится к манипуляциям, которые проводятся на клетках, извлеченных из или находящихся вне субъекта, в том числе, но без ограничения, клетках в культуре. Термин введение ex vivo относится к клеткам, которые подвергались манипуляциям in vitro, а затем вводятся субъекту. Термин введение in vivo охватывает все манипуляции, которые проводятся в пределах субъекта, в том числе введение.
В некоторых аспектах настоящего изобретения композиции можно вводить либо in vitro, ex vivo, либо in vivo. В некоторых воплощениях in vitro инкубируют аутологичные Т-клетки с композициями настоящего изобретения. Затем эти клетки или ткани можно использовать для анализа in vitro или же для введения ex vivo.
Примеры
Следующие примеры приводятся с целью иллюстрации различных воплощений изобретения и не должны никоим образом ограничивать настоящее изобретение. Специалистам в данной области должно быть вполне ясно, что настоящее изобретение хорошо приспособлено для выполнения целей и получения указанных результатов и преимуществ, а также присущих ему целей, задач и преимуществ. Приведенные примеры, наряду с описанными здесь способами, представляют типичные воплощения и не должны ограничивать объем настоящего изобретения. Специалистам должны быть очевидными изменения в нем и другие применения, которые соответствуют сущности изобретения, объем которого определяется формулой изобретения.
Пример 1. Получение и анализ наночастиц с рМНС
Получение рМНС
Для экспрессии рекомбинантных комплексов рМНС класса I использовали два различных способа. Первый заключается в ренатурации тяжелых и легких цепей МНС класса I, экспрессированных в бактериях, в присутствии пептида, с последующей очисткой методами гель-фильтрации и анионообменной хроматографии, как описано (Garboczi, D.N. et al. (1992) Proc Natl. Acad Sci USA 89:3429-3433; Altman, J.D. et al. (1996) Science 274:94-96). Второй заключается в экспрессировании комплексов МНС класса I с высоким выходом в трансдуцированных лентивирусом клетках СНО freestyle в виде одноцепочечных конструкций, в которых кодирующая пептид последовательность, легкие и тяжелые цепи МНС класса I один за другим привязаны гибкими линкерами GS (Yu, Y.Y. et al. (2002) J Immunol 168:3145-3149), а затем С-концевым линкером, кодирующим сайт BirA, тег 6×His со свободным Cys на конце. Секретированные белки очищали из супернатантов культур с помощью никелевых колонок и анионообменной хроматографии и использовали непосредственно для покрытия NP или биотинилировали для получения тетрамеров рМНС с помощью конъюгированного с флуорохромом стрептавидина. Тетрамеры, полученные с использованием репрезентативных одноцепочечных комплексов рМНС, несущих аутоантигенный пептид IGRP206-214 или его аналог NRP-V7, эффективно связываются с когнатными моноклональными аутореактивными Т-клетками CD8+, но не с соответствующими поликлональными клетками (не показано), как установлено методом проточной цитометрии.
Рекомбинантные мономеры рМНС класса II первоначально выделяли из клеток дрозофилы SC2, трансфецированных конструкциями, кодирующими цепи I-Аβ и 1-Аα, несущие лейциновые зипперы c-Jun или c-Fos, соответственно, сайт BirA и тег 6×His, как описано ранее (Stratmann, Т. et al. (2000) J Immunol 165:3214-3225; Stratmann, Т. et al. (2003) J. Clin. Invest. 112:3214-3225). Поскольку при этом подходе выход обычно был низким и это занимало много времени, то заявитель разработал систему экспрессии в клетках СНО freestyle, трансдуцированных лентивирусами, кодирующими моноцистронную матрицу, в которой цепи пептидов 1Аβ и 1Аα комплекса отделены друг от друга обходящей рибосомы последовательностью Р2А (Hoist, J. et al. (2006) Nat Protoc 1:406-417). Как и в случае одноцепочечных конструкций рМНС класса I, описанных выше, к С-концевой части конструкции добавляли линкер, кодирующий сайт BirA, тег 6×His и свободный Cys. После самосборки комплексы рМНС класса II выделяли из супернатантов клеточных культур методами никелевой и анионообменной хроматографии и использовали для нанесения на NP или подвергали биотинилированию и формированию тетрамеров, как описано выше. Тетрамеры рМНС класса II, полученные с использованием репрезентативного комплекса рМНС класса II, несущего аутоантигенный пептид 2.5mi, специфически и эффективно связываются с когнатными моноклональными аутореактивными Т-клетками CD4+, как установлено методом проточной цитометрии.
Окрашивание тетрамерами рМНС
Конъюгированные с РЕ тетрамеры TUM-H-2Kd, NRP-V7-H-2Kd, IGRP206-214-H-2Kd, HEL14-22/IAg7 и BDC2.5mi/IAg7 получали, используя биотинилированные мономеры рМНС, как описано (Stratmann, Т. et al. (2000) J Immunol 165:3214-3225; Stratmann, Т. et al. (2003) J. Clin. Invest. 112:3214-3225; Amrani, A. et al. (2000) Nature 406:739-742). Мононуклеары периферической крови, спленоциты и Т-клетки CD8+ или CD4+ лимфатических узлов окрашивали тетрамером (5 мкг/мл) в буфере FACS (0,1% азида натрия и 1% FBS в PBS) в течение 1 ч при 4°С, отмывали и инкубировали с конъюгированным с FITC антителом против CD8a или против CD4 (5 мкг/мл) или конъюгированным с PerCP антителом против В220 (2 мкг/мл; в качестве холостой пробы) в течение 30 мин при 4°С. Клетки промывали, фиксировали в 1% PFA/PBS и анализировали методом FACS.
Синтез NP
Золотые наночастицы (GNPS) синтезировали путем химического восстановления хлорида золота цитратом натрия, как описано (Perrault, S.D. et al. (2009) Nano Lett 9:1909-1915). Вкратце, вносили 2 мл 1% HAuCl4; (Sigma Aldrich) в 100 мл H2O с интенсивным перемешиванием и нагревали раствор на масляной бане. В кипящий раствор HAuCl4 добавляли 6 мл (для GNPs на 14 нм) или 2 мл (для GNPs на 40 нм) 1% цитрата натрия, перемешивали смесь еще в течение 10 мин, а затем охлаждали до комнатной температуры. GNPs стабилизировали добавлением 1 мкмоль линкеров тиол-PEG (Nanocs, MA), функционализованных группами -СООН или -NH2 в качестве акцепторов рМНС (табл. 1 и 2). ПЭГилированные GNPs промывали водой, чтобы удалить свободный тиол-PEG, концентрировали и хранили в воде для дальнейшего анализа. Плотность NP определяли методом спектрофотометрии и рассчитывали по закону Бера.
Наночастицы из оксида железа серии SFP (SFP-IONPs) получали путем термического разложения ацетата железа в органических растворителях в присутствии ПАВ, а затем делали растворимыми в водных буферах путем ПЭГилирования (Xie, J. et al. (2007) Adv Mater 19:3163; Xie, J. et al. (2006) Pure Appl. Chem. 78:1003-1014; Xu, C. et al. (2007) Polymer International 56:821-826). Вкратце, растворяли 2 ммоль Fe(Acac)3 (Sigma Aldrich, Oakville, ON) в смеси из 10 мл бензилового эфира и олеиламина и нагревали до 100°С в течение 1 ч, а затем при 300°С в течение 2 ч с обратным холодильником в атмосфере азота. Синтезированные NPs осаждали добавлением этанола и ресуспендировали в гексане. Для ПЭГилирования IONPs по 100 мг различных линкеров DPA-PEG в 3,5 кДа (S1-S5 в табл. 1; Jenkem Tech USA) растворяли в смеси СНСl3 и HCON(CH3)2 (DMF). Затем в раствор DPA-PEG добавляли раствор NP (20 мг Fe) и перемешивали в течение 4 ч при комнатной температуре. ПЭГилированные SFP-NPs осаждали в течение ночи добавлением гексана, а затем ресуспендировали в воде. Следовые количества агрегатов удаляли высокоскоростным центрифугированием (20000×g, 30 мин), а монодисперсные SFP-NPs хранили в воде для дальнейшего изучения и конъюгирования с рМНС. Концентрацию железа в препаратах IONP определяли методом спектрофотометрии по А410 в 2N HCl. Исходя из молекулярной структуры и диаметра SFP-NPs (Fe3O4; диаметр 8±1 нм) (Xie, J. et al. (2007) Adv Mater 19:3163; Xie, J. et al. (2006) Pure Appl. Chem. 78:1003-1014), заявитель оценил, что растворы SFP, содержащие 1 мг железа, содержат 5×1014 NPs.
Впоследствии заявитель разработал новый дизайн IONP, который позволяет получать, тоже путем термического разложения, но в одну стадию, ПЭГилированные IONPs при полном отсутствии ПАВ (IONPs серии PF). При этом новом дизайне молекулы ПЭГ используются и в качестве восстановительных реагентов, и в качестве ПАВ. При типичной реакции медленно расплавляли 3 г ПЭГ (2 кДа) в кругл о донной колбе на 50 мл с кипячением при 100°С, а затем смешивали с 7 мл бензилового эфира и 2 ммоль Fe(Acac)3. Реакционную смесь энергично перемешивали в течение 1 ч и нагревали при 260°С с обратным холодильником еще в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры, переносили в центрифужную пробирку и смешивали с 30 мл воды. Нерастворимые вещества удаляли центрифугированием при 2000×g в течение 30 мин. Свободные молекулы ПЭГ удаляли путем ультрафильтрации через фильтры Amicon-15 (с отсечкой в 100 кДа, Millipore, Billerica, MA). Заявителю удалось получить IONPs с большинством исследуемых молекул ПЭГ, хотя и не со всеми (табл. 1, Р1-Р5). Размер IONPs варьируется в зависимости от функциональных групп PEG-линкеров, используемых при реакциях термического разложения (табл. 1 и 2). NPs легко подвергаются очистке на магнитных (MACS) колонках (Miltenyi Biotec, Auburn, СА) или в системе разделения клеток IMag (BD Biosciences, Mississauga, ON). Очищенные IONPs хранили в воде или в различных буферах (рН 5-10), при комнатной температуре или при 4°С, без какой-либо заметной агрегации. Плотность NPs рассчитывали так, как описано выше для SFP-NPs.
Конъюгирование рМНС с NPs
Конъюгирование рМНС с NPs, полученными с помощью PEG-линкеров, несущих дистальные группы -NH2 или -СООН, осуществляли путем образования амидных связей в присутствии 1-этил-3-[3-диметиламинопропил]карбодиимида гидрохлорида (EDC). Наночастицы (BNP-C, SFP-C и PF-C, табл. 2) с группами -СООН сначала растворяли в 20 мМ буфере MES, рН 5,5. Затем в раствор NPs добавляли натриевую соль N-гидроксисульфосукцинимида (sulpha-NHS, Thermo Scientific, Waltham, MA, конечная концентрация 10 мМ) и EDC (Thermo Scientific, Waltham, MA, конечная концентрация 1 мМ). После 20 мин перемешивания при комнатной температуре раствор NPs по каплям вносили в раствор, содержащий мономеры рМНС, растворенные в 20 мМ боратном буфере (рН 8,2). Смесь перемешивали еще в течение 4 ч. Для конъюгирования pMHCs с NH2-функционализованными NPs (GNP-N, SFP-N и PF-N, табл. 2) комплексы рМНС сначала растворяли в 20 мМ буфере MES, рН 5,5, содержащем 100 мМ NaCl. Затем в раствор рМНС добавляли sulpha-NHS (10 мМ) и EDC (5 мМ). Затем активированные молекулы рМНС вносили в раствор NPs в 20 мМ боратном буфере (рН 8,2), и перемешивали в течение 4 ч при комнатной температуре.
Для конъюгирования рМНС с функционализованными малеимидом NPs (SFP-M и PF-M, табл. 2 и фиг. 1С), молекулы рМНС сначала инкубировали с трибутилфосфином (ТВР, 1 мМ) в течение 4 ч при комнатной температуре. Затем pMHCs, по конструкции несущие свободный С-концевой остаток Cys, смешивали с NPs в 40 мМ фосфатном буфере, рН 6,0, содержащем 2 мМ EDTA, 150 мМ NaCl, и инкубировали в течение ночи при комнатной температуре. pMHCs ковалентно связывались с NPs путем образования углерод-сульфидной связи между малеимидной группой и остатком Cys.
Для конъюгирования рМНС или авидина с NPs, функционализованными азидными группами (SFP-Z, табл. 2), использовали клик-химию. Для этой реакции молекулы рМНС или авидина сначала инкубировали с дибензоциклооктиловым (DBCO, Click Chemistry Tools, Scottdale, AZ) реагентом в течение 2 ч при комнатной температуре. Свободные молекулы DBCO удаляли посредством диализа в течение ночи. Затем конъюгаты рМНС-или авидин-DBCO инкубировали с SFP-Z в течение 2 ч, что приводило к образованию триазоловых связей между молекулами pMHCs или авидина и NPs.
Неконъюгированные комплексы рМНС при различных реакциях конъюгирования pMHC-NP удаляли путем экстенсивного диализа против PBS, рН 7,4, при 4°С, через мембраны с пределом отсечения в 300 кДа (Spectrum Labs). С другой стороны, рМНС-конъюгированные IONPs очищали методом магнитного разделения. Конъюгированные NPs концентрировали посредством ультрафильтрации через элементы Amicon Ultra-15 (с отсечкой в 100 кДа) и хранили в PBS.
Электронная микроскопия, динамическое рассеяние света (DLS) и дифракция электронных пучков под малыми углами
Размеры ядер и дисперсность неконъюгированных и рМНС-конъгированных NPs сначала определяли методом трансмиссионной электронной микроскопии (ТЕМ, Hitachi Н7650). Для определения гидродинамического размера, дзета-потенциала и монодисперсности pMHC-NPs использовали динамическое рассеяние света (DLS) на приборе ZetaSizer (Malvern, UK). Химическую природу ядер из оксида железа у NPs серии PF определяли методом дифракции электронных пучков под малыми углами (SEBD).
Инфракрасная спектроскопия с преобразованием Фурье
Химические свойства поверхности частиц IONPs серии PF дизайнов определяли методом инфракрасной спектроскопии с преобразованием Фурье (FTIR). Спектры FTIR контрольного ПЭГ и заякоренного на поверхности PF-NP снимали на FTIR-спектрофотометре Nicolet в режиме ATR (затухающего полного отражения). Каждый спектр записывали в виде средних значений из 256 сканирований со спектральным разрешением в 4 см-1. Определяли сигнатуры валентных колебаний групп С-О-С в каркасе ПЭГ и их дистальных рМНС-акцепторных функциональных групп.
Электрофорез в агарозном геле
Для того, чтобы быстро оценить изменения заряда NP в зависимости от ПЭГилирования или покрытия рМНС, NPs подвергали электрофорезу в 0,8% агарозном геле. ПЭГилированные NPs мигрировали к отрицательному или положительному полюсу в зависимости от общего заряда поверхности. Для подтверждения совместной миграции pMHCs с NPs проводили окрашивание Кумасси синим.
Нативный и денатурирующий электрофорез в полиакриламидном геле
рМНС-конъюгированные NPs подвергали анализу методами нативного PAGE (10%) и SDS-PAGE (12%), чтобы подтвердить отсутствие свободного (неконъюгированного) рМНС в препаратах pMHC-NP и подтвердить наличие интактных тримолекулярных комплексов рМНС на поверхности NPs.
Измерение валентности по рМНС
Для оценки количества мономеров рМНС, конъюгированньгх с индивидуальными наночастицами (валентности по рМНС), измеряли концентрацию рМНС в препаратах pMHC-NPs, используя различные подходы, в том числе метод Бредфорда (Thermo Scientific), аминокислотный анализ (определение 17 различных аминокислот в гидролизованных препаратах pMHC-NPs на основе HPLC) (Университет Торонто), дот-ELISA и сигнатурный анализ пептидов методом масс-спектрометрии, а значения преобразовывали в соотношение числа молекул рМНС к числу NP. Вкратце, в методе "дот-ELISA" делали серийные разведения конъюгированньгх с рМНС и неконъюгированных NPs и растворов мономеров рМНС (в качестве стандарта) в PBS, а затем наносили на мембраны из PVDF в многолуночном фильтровальном планшете (PALL Corporation). Планшет оставляли подсохнуть при комнатной температуре, а затем инкубировали со специфичными к рМНС первичными антителами (т.е. антителами против β2М и против Kd для NPs, покрытых рМНС класса I, клоны 2М2 и SF 1-1.1, BioLegend, San Diego, СА), а затем с вторичными антителами, конъюгированными с HRP или АР. После развития ферментативных цветных реакций содержимое лунок переносили в лунки стандартного планшета для ELISA и измеряли их поглощение при 450 нм на считывающем устройстве. При сигнатурном анализе пептидов методом масс-спектрометрии идентифицировали рМНС-специфичные трипсинизованные пептиды (сигнатурные пептиды TWTAADTAALITR для комплексов с Kd и AQNSELASTANMLR для комплексов с I-AG7) методом масс-спектрометрии. Соответствующие синтетические пептиды метили стабильными изотопами (AQUA peptide synthesis, Sigma Aldrich). Затем готовили серийные разведения помеченных изотопами пептидов до заданных концентраций и смешивали с рМНС-конъюгированными NPs для расщепления трипсином. Смеси подвергали масс-спектрометрии (Agilent QTOF6520) и определяли соотношения между помеченными изотопом и немечеными сигнатурными пептидами в качестве меры концентрации рМНС. Поскольку значения, полученные этими различными методами, были близкими, то предпочтительным стал метод Бредфорда (используя неконъюгированные NPs в качестве холостых проб) из-за его легкости и простоты.
Агонистическая активность pMHC-NPs in vitro
Подвергнутые FACS-сортировке клетки CD8+ из селезенки мышей TCR-TG (2,5×105 клеток/мл) инкубировали с серийными разведениями конъюгированньгх с рМНС или контрольных NPs в течение 24-48 ч при 37°С. Супернатанты подвергали анализу на IFNγ методом ELISA. Культуры клеток обрабатывали 1 мКи [3Н]-тимидина и через 24 ч собирали клетки для измерения включения [3Н].
Терапия с помощью pMHC-NPs
Группам 10-недельных самок мышей NOD вводили в/в покрытые рМНС наночастицы в PBS два раза в неделю на протяжении 5 недель (в общей сложности 10 доз). Определяли возрастание размера пулов Т-клеток тетрамер+ CD8+ или CD4+ в крови, селезенке, лимфатических узлах и/или костном мозге, а также их фенотипические свойства методом проточной цитометрии, как описано (Tsai, S. et al. (2010) Immunity 32:568-580) (а также Clemente-Casares et al., подано). В других экспериментах мышам с уровнем глюкозы в крови >11 мМ в течение 2 дней вводили в/в два раза в неделю рМНС-NPs и отслеживали у них гипергликемию до тех пор, пока не установится стабильная нормогликемия (в течение 4 недель). Животных также ежедневно подвергали анализу на глюкозурию и, если было 3+, то вводили им подкожно человеческий изофан-инсулин (1 ME в сутки).
Статистический анализ
Данные сравнивали по двустороннему t-критерию Стьюдента, U-критерию Манна-Уитни, критерию хи-квадрат или двустороннему критерию ANOVA. Статистическая значимость принималась при р<0,05.
Мыши
Мышей NOD/Lt получали из Jackson Lab (Ваг Harbor, ME). Мыши 17.4а/8.3 (8.3-NOD), 17.6а/8.3а (17.6-NOD) и BDC2-5-NOD уже были описаны (Katz, J.D. et al. (1993) Cell 74:1089-1100; Verdaguer, J. et al. (1997) J Exp Med 186:1663-1676; Han, B. et al. (2005) J Clin Invest 115:1879-1887).
Пример 2. Получение T1D-релевантных рМНС класса II
Получали несколько различных причастных и не причастных к T1D (то есть это отрицательный контроль) комплексов пептид/I-Ag7 в эукариотических клетках (S2 или СНО). Исследования с тетрамерами, полученными из этих мономерных препаратов, подтверждают, что эти мономеры секретируются в супернатант в виде правильно свернутых комплексов рМНС. На фиг. 2 приведен пример.
Нормализация гипергликемии у мышей NOD при обработке NPs с T1D-релевантными рМНС класса II
Диабетические мыши NOD получали два раза в неделю 7,5 мкг NPs, покрытых рМНС класса II. Мыши считались излеченными, если у них отмечалась нормогликемия в течение 4 недель, и в этой точке лечение отменяли. Как видно из фиг. 3, в то время как NPs с 2.5mi/I-Аg7, IGRP128-145/I-Ag7 и IGRP4-22/I-Ag7 приводили к нормализации гипергликемии у 90-100% мышей (n=29 мышей), обработка NPs с HEL14-22/I-А87 (с чужеродным рМНС) не давала эффекта. Внутрибрюшинные тесты на толерантность к глюкозе (IPGTTs) у излеченных мышей через >30 недель после отмены лечения давали кривые, которые были очень похожи на кривые у сходных по возрасту, не страдающих диабетом необработанных контролей и существенно отличались от кривых, полученных у необработанных мышей NOD с острым диабетом (фиг. 4). Таким образом, NPs, покрытые T1D-релевантными рМНС класса II, восстанавливают гомеостаз глюкозы у диабетических мышей.
NPs с T1D-релевантными рМНС класса II вызывают экспансию когнатных ауторегуляторных Т-клеток памяти TR1 CD4+
Исследования крови, селезенки, панкреатических лимфатических узлов (PLNs), брыжеечных лимфатических узлов (MLNs) и костного мозга у 50-недельных диабетических мышей, которые стали нормогликемическими после обработки NPs с 2.5mi/I-Ag7, выявили значительное повышение процента клеток CD4+ с тетрамерами 2.5mi/I-Ag7 по сравнению с мышами в самом начале диабета или сходными по возрасту необработанными животными без диабета (фиг. 5). Экспансия Т-клеток CD4+ была специфичной к антигенам (фиг. 5). Скорость, величина и распределение экспансии были близкими для NPs с тремя исследованными T1D-релевантными рМНС класса II (фиг. 6). Фенотипический анализ подвергшихся вызванной NPs экспансии клеток тетрамер+ и тетрамер- во всех этих группах выявил фенотип, похожий на клетки памяти TR1 (фиг. 7, сверху), с совместной экспрессией TR1-специфичных маркеров, описанных недавно (Gagliani, N. et al. (2013) Nature Medicine 19:739-746) (фиг.7, снизу): CD62low/CD44high/ICOS+/CD257-/FoxP3-/поверхностный TGFβ+/CD49b+/LAG3+. To, что эти клетки не являлись FoxP3+, было подтверждено на мышах NOD, экспрессирующих промотор FoxP3-eGFP, у которых все подвергшиеся вызванной pMHC-NPs экспансии клетки были отрицательными по eGFP (не показано).
В согласии с этими фенотипическими данными, клетки CD4+ тетрамер+, отсортированные из получавших pMHC-NPs мышей, реагировали на клетки DC, обработанные когнатным пептидом, секретируя почти исключительно IL-10 и, в меньшей степени, IFNγ (фиг. 8, а также не показано). Важно отметить, что Т-клетки CD4+, но не клетки CD8+, выделенные из получавших pMHC-NPs доноров, ингибировали T1D у мышей NOD.scid с пересадкой диабетогенных спленоцитов, а мыши, получавшие NPs с рМНС класса II, были защищены на 100% в течение >100 дней (не показано).
Эти подвергшиеся вызванной NPs с рМНС класса II экспансии клетки тетрамер+, в отличие от соответствующих клеток тетрамер-, ингибировали пролиферацию некогнатных Т-клеток в ответ на обработанные пептидом DCs (презентирующие пептиды, на которые нацелены и восприимчивые, и клетки тетрамер+ TR1). Добавление в культуры mAbs против IL10 или против TGFβ частично ингибировало супрессию, в отличие от культур, получавших антитела против IFNγ или крысиный IgG (не показано). Наиболее важно то, что исследования на диабетических мышах, получавших NPs с IGRP4-22 или 2.5mi/I-Ag7 и блокирующие mAbs против IL-10, против TGFP или против IFNγ либо IgG крыс (фиг. 9), показали, что восстановление нормогликемии под действием NPs с рМНС класса II требует IL-10 и TGFP, но не IFNγ. Однако исследования на спонтанно диабетических мышах NOD.Il10-/- и NOD.Ifng-/- свидетельствуют, что экспрессия и IL-10, и IFNγ необходима для развития клеток TR1, подвергающихся экспансии в ответ на NPs с рМНС класса II; у этих мышей терапия pMHC-NP вызывает экспансию Th2-подобных клеток (NOD.Ifng-/-) или клеток IFNγ+/IL-4+/IL10- (мыши NOD.Il10-/-). Исследования на диабетических мышах NOD IGRP-/- (не способных премировать Т-клетки, реагирующие на IGRP), показали, что эти мыши не реагируют на NPs с IGRP4-22/IAg7 (не отмечалось экспансии Т-клеток или восстановления нормогликемии), так как у этих мышей отсутствовали примированные IGRP4-22 клетки. Напротив, все диабетические мыши NOD IGRP. получавшие NPs с 2.5mi/I-Ag7, излечились (не показано). Таким образом, NPs с рМНС класса II, как и NPs с рМНС класса I, действуют, вызывая экспансию премированных заболеванием регуляторных клеток памяти, но не могут вызывать эти ответы de novo, так как у них отсутствуют костимулирующие сигналы.
Наконец, исследования с вирусом осповакцины (rVV) показали, что получавшие NPs с рМНС класса II мыши NOD легко избавляются от острой вирусной инфекции (фиг. 10А). В согласии с этим, у обработанных мышей возникают антительные реакции против модельного антигена в адъюванте (фиг. 10В).
Пример 3. NPs с моноспецифичными рМНС класса II снижают тяжесть ЕАЕ
Далее заявитель протестировал терапевтический потенциал основанной на рМНС класса II наномедицины на экспериментальном аутоиммунном энцефалите (ЕАЕ). Эта модель использовалась при самых строгих испытаниях: для исследования того, могут ли pMHC-NPs обратить вспять установившийся ЕАЕ в противоположность предотвращению или приостановке его развития. Это непростая задача. Недавний обзор по лечению ЕАЕ показал, что у <1% из свыше 400 исследований лечение начиналось через 21 день после индукции ЕАЕ (Hoist, J. et al. (2006) Nat Protoc 1:406-417); представленные данные были получены на мышах, у которых лечение началось через 21 день после индукции ЕАЕ, и показатели заболевания улучшались дозо-зависимым образом (фиг. 11).
Пример 4. Синтез и контроль качества NPs, покрытых рМНС класса II
Заявитель разработал оптимизированный дизайн NP из оксида железа, при котором для синтеза не используются ПАВ и который дает очень стабильные, монодисперсные препараты, на которые можно наносить оптимальные количества рМНС. Хотя можно использовать несколько различных вариантов химии для нанесения рМНС (фиг. 12А), но заявитель регулярно использует NPs, функционализованные конъюгированными с малеимидом полиэтиленгликолями, которые приемлют высокие валентности pMHCs, несущих свободный Cys на своем С-концевом участке (вплоть до более 60 pMHCs/NP). Эти NPs с рМНС класса II проходят через несколько проверок контроля качества с определением валентности рМНС на NP (дот-ELISA, аминокислотный анализ), плотности NP, заряда NP и размера NP (металлического ядра по данным ТЕМ; и гидродинамического диаметра по данным динамического рассеяния света (DLS)). На фиг. 12В представлен репрезентативный снимок ТЕМ, а на фиг. 12С представлены профили DLS у непокрытых и покрытых рМНС NPs. Типичная схема дозировки включает введение 1-50 мкг общего рМНС (покрывающего NP) на одну дозу (около 2 мкл препарата, разведенного в 100 мкл PBS).
Пример 5. Лечение с помощью NPs, покрытых рМНС класса II
Вышеприведенные данные согласуются с данными заявителя, полученными ранее на мышах, получавших NPs с рМНС класса I: NPs с рМНС класса II вызывают экспансию когнатных регуляторных Т-клеток памяти (в данном случае TR1), которые подавляют презентацию других аутоантигенных пептидов местными клетками АРС, нагруженными аутоантигенами (Amrani, A. et al. (2000) Nature 406:739-742).
Сообщалось, что Т-клеточные клоны TR1 CD4+ человека уничтожают некоторые подмножества профессиональных APCs типа дендритных клеток (DCs) (Amrani, A. et al. (2000) Nature 406:739-742). Поэтому заявитель исследовал, будут ли антиген-специфичные клетки TR1, подвергающиеся экспансии в ответ на терапию NPs с рМНС класса II, подавлять аутоиммунитет путем уничтожения нагруженных аутоантигенами APCs. Это делалось путем трансфузии смеси 1:1 клеток DCs, обработанных пептидом 2.5mi или GPI и помеченных РКН26 (DCs, обработанные 2.5mi) либо CFSE (DCs, обработанные GPI), мышам NOD, получавшим 10 доз 2.5mi/IAg7-NPs за предшествующие 5 недель, или мышам NOD, не получавшим никакого лечения. Через 7 дней мышей забивали и сравнивали соотношения между клетками РКН26+ и CFSE+ в двух разных группах. Как видно из фиг. 13А (сверху), не отмечалось никаких различий, что свидетельствует о том, что Т-клетки TR1 CD4+, подвергавшиеся экспансии в ответ на терапию pMHC-NP, не вызывают гибели экспрессирующих антигены DCs.
Чтобы выяснить, была ли это особенность используемого типа APCs (DC) или же общая особенность и других типов APCs, вышеописанные эксперименты повторяли, используя В-клетки селезенки вместо DCs. Неожиданно оказалось, что количество обработанных 2.5mi В-клеток возрастало (а не уменьшалось) у мышей, получавших NPs, покрытые 2.5mi/IAg7 (фиг. 13А, снизу). Это было неожиданно, так как, исходя из существующего уровня техники, ожидался ровно противоположный исход (селективное и специфическое снижение обработанных 2.5mi клеток по сравнению с обработанными GPI клетками).
Затем заявитель проверил, будет ли такой эффект экспансии В-клеток отмечаться при обработке NPs с рМНС класса II путем сравнения абсолютного числа и процента В-клеток в дренирующих поджелудочную железу (PLN) лимфатических узлах и других (MLN) лимфатических узлах у мышей, получавших 2.5mi/IAg7-NPs, по сравнению с необработанным контролем. Как видно из фиг. 13В, у получавших NPs с рМНС класса II мышей NOD было заметное возрастание доли В-клеток в PLN, но не в MLN. Такие различия между PLN и MLN не отмечались у необработанных мышей NOD, указывая на то, что эти эффекты были следствием терапии pMHC-NP. Следует отметить, что была статистически значимая корреляция между частотой 2.5mi-специфичных Т-клеток TR1 CD4+ в PLNs у отдельных мышей и частотой связанных с PLN В-клеток, что означает, что такое усиление рекрутинга В-клеток к PLNs у получавших pMHC-NP мышей NOD было обусловлено экспансией 2.5гт-специфичных Т-клеток TR1 CD4+ в ответ на терапию pMHC-NP.
В совокупности эти данные порождают вероятность того, что В-клетки, подвергавшиеся экспансии в ответ на терапию pMHC-NP, могут представлять собой регуляторные В-клетки, то есть В-клетки, приобретающие способность вырабатывать IL-10 в ответ на когнатные взаимодействия с экспандированными pMHC-NP Т-клетками TR1 CD4+. В таком случае можно постулировать, что 2.5гш-специфичные Т-клетки TR1 CD4+ будут индуцировать дифференцировку и экспансию недифференцированных В-клеток, специфичных к хромогранину А (хромогранин А является естественным антигенным источником эпитопа 2.5mi), которые будут захватывать хромогранин А и поэтому могут презентировать соответствующие комплексы рМНС с 2.5mi/IAg7 на своей поверхности для вырабатывающих IL-10 клеток B-reg.
Для проверки этой гипотезы заявитель проводил трансфузию обработанных 2.5mi или GPI В-клеток (помеченных РКН26) из такой линии мышей NOD, в которой один из двух локусов IL10 несет адресную вставку кассеты IRES-eGFP между стоп-кодоном и сигналом полиаденилирования экзона 5 (11), мышам NOD, получавшим или не получавшим 2.5mi/IAg7-NP.
Через 7 дней после переноса, методом проточной цитометрии определяли фенотип донорских В-клеток РКН26+ у хозяев (фиг. 13С, верхняя панель). Как видно из фиг. 13С (средняя и нижняя панели), значительная часть донорских В-клеток экспрессирует кодируемый IL10 eGFP и является CD5+ и CDldhigh. Это три ключевых маркера клеток В-reg (Xie, J. et al. (2007) Adv Mater 19:3163; Xie, J. et al. (2006) Pure Appl. Chem. 78:1003-1014). Это наблюдалось только у В-клеток, обработанных 2.5mi, но не у В-клеток, обработанных пептидом отрицательного контроля (GPI), и это происходило только у получавших pMHC-NP мышей. Важно отметить, что этот эффект был опосредован, по крайней мере частично, экспандированными IL-10 pMHC-NP Т-клетками TR1 CD4+, так как такой ответ не наблюдался у хозяев NOD, дефектных по IL-10.
В целом эти данные свидетельствуют о том, что терапия NPs с МНС класса II вызывает дифференцировку антиген-специфичных В-клеток в В-регуляторные клетки и их экспансию.
Описания данных, указывающих на существовании В-лимфоцитов с регуляторными свойствами, встречаются в литературе, начиная с 1974 г. Подобно Т-клеткам TR1 CD4+, подвергающимся экспансии в ответ на терапию NPs с МНС класса II, клетки B-reg экспрессируют иммуносупрессорные цитокины, в том числе IL-10 и TGFβ, а также другие молекулы, которые могут ингибировать патогенные аутореактивные Т-иВ-клетки зависимым от антигена и очень специфичным образом, через когнатные, ведомые рМНС класса II, межклеточные взаимодействия (Хи, С. et al. (2007) Polymer International 56:821-826). Хотя и было показано, что различные стимулы способны вызывать образование B-reg in vitro, и в гораздо меньшей степени in vivo, но, насколько известно заявителю, в настоящее время не существует терапевтических подходов, способных индуцировать и вызывать экспансию антиген-специфичных клеток B-reg in vivo. Засвидетельствовав появление весьма специфичных к заболеванию Т-клеток TR1 CD4+, заявитель показал, что нанолекарства на основе рМНС класса II также вызывают появление специфичных к заболеванию клеток B-reg. Поскольку клетки B-reg также могут вызывать дифференцировку эффекторных клеток в Т-клетки TR1 CD4+, то нанолекарства на основе рМНС класса II вызывают глубокий и устойчивый иммуносупрессорный ответ, который очень специфичен к антигенам и поэтому способен избирательно подавлять аутоиммунные реакции без ущерба для системного иммунитета.
Пример 6. Синтез функционализованных на поверхности наночастиц из оксида железа путем термического разложения ацетилацетоната железа и их биоконъюгация
Расплавляют ПЭГ. Добавляют бензиловый эфир и ацетилацетонат железа. После нагревания 1 час при 105°С повышают температуру до 260°С и кипятят с обратным холодильником. Примерно через 2 часа образуются наночастицы железа и окраска раствора становится черной. Реакционную смесь охлаждают до комнатной температуры и добавляют немного воды для извлечения наночастиц из реакционного сосуда. Наночастицы очищают на магнитной колонке Miltenyi Biotec LS. Получение белковых конъюгатов с наночастицами из оксида железа включает добавление белка и наночастиц железа в буфер при рН 6,2-6,5 (0,15 М NaCl и 2 мМ EDTA) с перемешиванием при комнатной температуре в течение 12-14 часов и очистку конъюгированньгх с белком частиц на магнитной колонке Miltenyi Biotec LS.
Следует иметь в виду, что хотя настоящее изобретение было конкретно раскрыто на предпочтительных воплощениях и необязательных признаках, однако специалисты в данной области техники могут прибегать к модификации, усовершенствованию и изменению приведенных здесь воплощений изобретения, причем такие модификации, усовершенствования и варианты считаются входящими в объем настоящего изобретения. Представленные здесь материалы, способы и примеры репрезентативны для предпочтительных воплощений, являются иллюстративными и не могут ограничивать объем изобретения.
Изобретение было описано здесь в широком смысле и обобщенно. Каждый из более узких видов и разновидностей, попадающих в общее раскрытие, также входит в состав изобретения. Это включает в себя общее описание изобретения с оговоркой или отрицательным ограничением, исключающим из него какую-либо тематику, независимо от того, будет ли исключенный материал конкретно указан здесь.
Кроме того, если признаки или аспекты изобретения описаны в терминах групп Маркуша, то специалистам в данной области должно быть понятно, что изобретение при этом также описано в терминах любого индивидуального представителя или подгруппы представителей группы Маркуша.
Использование термина "или" в формуле изобретения применяется и в значении "и/или", если прямо не указано, что имеются в виду только альтернативные значения или же альтернативные значения являются взаимоисключающими, хотя изобретение придерживается определений, которые относятся только к альтернативам и "и/или".
В настоящем описании и формуле изобретения слова "включающий" (и любые его формы типа "включают" и "включает"), "имеющий" (и любые его формы типа "имеют" и "имеет"), "включающий в себя" (и любые его формы типа "включает в себя" и "включают в себя") или "содержащий" (и любые его формы типа "содержит" и "содержат") являются включительными или неокончательными и не исключают дополнительных, не указанных элементов или стадий способа.
По всему описанию различные публикации, патенты и патентные публикации снабжены идентификационными ссылками. Все публикации, патентные заявки, патенты и другие приведенные здесь ссылки прямо включены сюда путем ссылки во всей полноте, в той же степени, как если бы каждая была включена путем ссылки в индивидуальном порядке. В случае конфликта должно возобладать настоящее описание, включая определения.


Реферат
Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована для получения наночастиц из оксида железа, функционализированных ПЭГ. Способ получения наночастиц включает термическое разложение ацетилацетоната железа в присутствии функционализированных молекул ПЭГ или в присутствии функционализированных молекул ПЭГ и бензилового эфира, и при этом температура термического разложения составляет от 80 до 300°С. Группа изобретений относится также к варианту способа получения комплексов наночастиц, включающему контактирование рМНС с наночастицами оксида железа, полученными вышеуказанным способом. Использование данной группы изобретений позволяет получить наночастицы из оксида железа, функционализированные ПЭГ, для экспансии популяций регуляторных В-клеток у субъекта. 2 н. и 13 з.п. ф-лы, 6 пр., 2 табл., 14 ил.

Комментарии