Аргининдеиминаза, инкапсулированная в эритроциты, и их применение при лечении рака и недостаточности аргиназы-1 - RU2773220C2
Код документа: RU2773220C2
Чертежи






Описание
Настоящая заявка на патент притязает на приоритет ранее поданной заявки на Европейский патент № 17306122.7, поданной 31 августа 2017, и заявки на патент Японии № 2017-254383, поданной 28 декабря 2017.
Настоящее изобретение относится к аргининдеиминазе, инкапсулированной в эритроциты, для применения в терапии. В частности, оно относится к их применению при лечении недостаточности аргиназы-1. Также оно относится к новым фармацевтическим композициям, включающим аргининдеиминазу из M. arginini, инкапсулированную в эритроциты, и их применению при лечении заболеваний, при которых может быть полезно снижение аргинина, таких как аргининзависимые раковые заболевания, в частности, аргинин-ауксотрофные раковые заболевания, и недостаточности аргиназы-1.
Предпосылки создания изобретения
Аргинин является полунезаменимой аминокислотой. Он синтезируется в ходе цикла образования мочевины из цитруллина в две стадии благодаря действию аргиносукцинат-синтетазы и аргиносукцинатлиазы. Аргинин метаболизируется до орнитина под действием аргиназы, и орнитин, в свою очередь, может быть трансформирован в цитруллин за счет реакции, катализируемой орнитин-транскарбамилазой.
Показано, что некоторые типы опухолевых клеток требуют снабжения аргинином, и это ведет к предположению, что снижение аргинина является возможным лечением для таких форм раковых заболеваний, называемых аргинин-ауксотрофными раковыми заболеваниями. Аргининдеиминаза, разрушающий аргинин фермент, катализирует гидролиз аргинина до цитруллина и аммиака путем деаминирования гуанидиновой группы. Противоопухолевая активность аргининдеиминазы стала предметом многочисленных публикаций. Так, активность аргининдеиминазы in vivo показана в отношении злокачественной меланомы и гепатокарциномы. Однако фермент аргининдеиминаза имеет некоторые важные недостатки.
Аргининдеиминаза не продуцируется у млекопитающих, и ее получают из микроорганизмов, что делает ее высокоантигенным соединением для млекопитающих.
Кроме того, этот фермент имеет очень короткое время полужизни у млекопитающих – порядка примерно 5 часов, и должен вводиться ежедневно в высокой дозе для того, чтобы быть эффективным.
Для того чтобы преодолеть такие недостатки для лечения рака, в Европейском патенте EP1874341 предлагается оригинальный подход, который состоит в инкасулировании аргининдеиминазы в эритроциты. В EP1874341, особенно в примере 3, страница 10, раскрывается захват аргининдеиминазы из Pseudomonas aeruginosa.
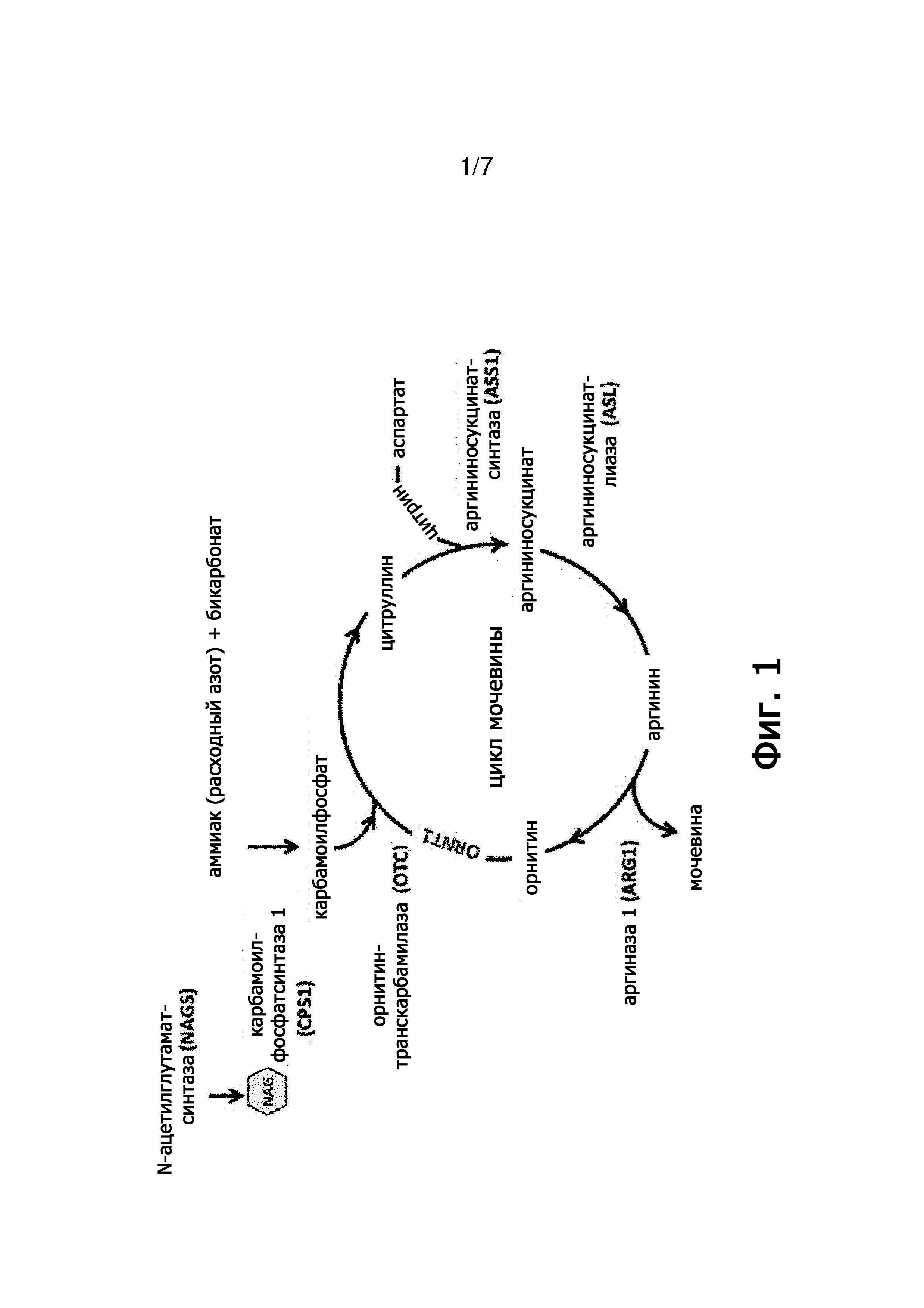
Недостаточность аргиназы-1 является редким генетическим нарушением, влияющим на конечную стадию цикла образования мочевины в печени, которая превращает выделившийся азот в форме аммиака в мочевину для экскреции с мочой. Она вызывается мутациями в гене ARG1, приводя к частичной или полной потере фермента аргиназы 1, который катализирует гидролиз аргинина до орнитина и мочевины (см. фигуру 1).
Пациенты с недостаточностью аргиназы-1 показывают гипераргининемию, прогрессирующее неврологическое и умственное расстройство, персистентную задержку роста и редкие эпизоды гипераммониемии.
В настоящее время не имеется методов лечения в случае недостаточности аргиназы-1, и результаты лечения, как правило, неудовлетворительные, с безбелковой диетой и/или лекарственными средствами поглотителями азота. Основной биохимической особенностью является накопление аргинина, ведущее к токсическим уровням гуанидиновых соединений и оксида азота (Sin et al., PLoS ONE, 8(11)). Поскольку ожидается, что аргинин и его метаболиты вызывают недостаточность аргиназы-1 неврологического типа, общей задачей лечения стали снижение аргинина в плазме с помощью безбелковой диеты, добавление аминокислот и введение поглотителей азота. Однако с этой лечебной стратегией нормализация или почти нормализация аргинина в плазме при недостаточности аргиназы-1 является сомнительной.
Нормализация уровней аргинина в плазме при недостаточности аргиназы-1 является, следовательно, сомнительной, и ранее исследовалось применение терапии с ферментом аргиназой. Например, Burrage et al., исследовали модифицированный пегилированный рекомбинатный фермент человека аргиназу на мышиных моделях недостаточности аргиназы (Burrage et al., Human Molecular Genetics, 2015, 24(22)). Хотя этот фермент приводил к снижению уровня аргинина в плазме, он не улучшал выживания мышей с недостаточностью аргиназы, вероятно, из-за персистенции гипераммониемии. Гипераммониемия является главным вызовом при лечении недостаточности аргиназы (Burrage et al., Human Molecular Genetics, 24(22)).
Поэтому обнаружение альтернативных путей для снижения уровня аргинина в плазме при недостаточности аргиназы было главной целью в течение многих лет.
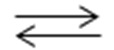
Реакция, катализируемая аргининдеиминазой, это

Это равновесная реакция, и существуют научные аргументы в научном сообществе, предполагающие, что использование аргининдеиминазы для лечения недостаточности аргиназы-1 невозможно, поскольку
- этот фермент бактериального происхождения и может вызывать аллергические реакции;
- продуктами реакции, катализируемой аргининдеиминазой, являются цитруллин и аммиак;
- цитруллин может снова превратиться в аргинин (см. цикл образования мочевины на фигуре 1), и
- аммиак может быть проблемой в контексте недостаточности аргиназы-1, когда пациенты имеют эпизоды гипераммониемии.
В противовес этим техническим предрассудкам Заявитель настоящего изобретения неожиданно обнаружил и показал, что аргининдеиминаза, инкапсулированная в эритроциты, может являться новым подходом для снижения токсического накопления аргинина и побочных продуктов его метаболизма. Заявитель обнаружил, в частности, что снижение уровней сывороточного аргинина у мышей, достигнутое путем введения композиции по настоящему изобретению, является существенным и поэтому представляет терапевтический интерес. Автор изобретения к тому же показал, что указанное снижение уровней сывороточного аргинина у мышей с недостаточностью аргиназы-1 не сопровождается значительными снижениями уровней аммиака. Эти результаты особенно неожиданны из-за существующего технического предрассудка, согласно которому аргининдеиминаза не может способствовать лечению недостаточности аргиназы-1 из-за продуцирования NH3 и возможного обратной конверсии до цитруллина.
Среди различных аргининдеиминаз, которые можно инкапсулировать в эритроциты, Заявитель идентифицировал конкретную аргининдеиминазу, которая имеет свойства, которые ведут к неожиданному улучшению PK/PD параметров.
В частности, улучшает PK/PD параметры аргининдеиминаза, полученная из бактерий Mycoplasma arginini. Кроме того, указанная аргининдеиминаза из Mycoplasma arginini не требует какого-либо кофактора, что является желательным свойством для ее активности в эритроците. Поэтому аргининдеиминаза из Mycoplasma arginini имеет технические преимущества перед другой известной аргининдеиминазой и, следовательно, весьма подходит для применения в контексте настоящего изобретения. Кроме того, аргининдеиминаза из Mycoplasma arginini является гомодимером с молекулярной массой 92 кД и таким образом подходит для включения в эритроциты.
Таким образом, использование указанной аргининдеиминазы будет прогрессом в терапиях для уменьшения аргинина, таких как противораковая терапия, в частности, против аргинин-ауксотрофных раков, и терапии против недостаточности аргиназы-1.
Сущность изобретения
Таким образом, целью изобретения является фармацевтическая композиция, включающая аргининдеиминазу, инкапсулированную в эритроциты, для применения ее при лечении недостаточности аргиназы-1.
Изобретение относится, в частности, к фармацевтической композиции, включающей инкапсулированную в эритроциты аргининдеиминазу и фармацевтически приемлемый носитель, для применения ее при лечении недостаточности аргиназы-1.
В одном предпочтительном воплощении аргининдеиминаза, инкапсулированная в эритроциты, является аргининдеиминазой из M. arginini.
Другой целью изобретения является суспензия эритроцитов, инкапсулирующих аргининдеиминазу из M. arginini. Указанная суспензия представляет собой, в частности, суспензию эритроцитов, инкапсулирующих аргининдеиминазу из M. arginini, в фармацевтически приемлемом носителе.
Другой целью изобретения является фармацевтическая композиция, включающая суспензию по изобретению, для применения ее при лечении недостаточности аргиназы-1 или аргининзависимых раковых заболеваний, лечения или предупреждения септического шока, ингибирования ангиогенеза и лечения ангиогенез-ассоциированных заболеваний, в частности, для ее применения при лечении недостаточности аргиназы-1 или аргининзависимых раковых заболеваний.
Еще одной целью изобретения является способ лечения недостаточности аргиназы-1, включающий введение пациенту, нуждающемуся в этом, эффективного количества фармацевтической композиции по изобретению или введение пациенту, нуждающемуся в этом, эффективного количества аргининдеиминазы, инкапсулированной в эритроциты.
Еще одной целью изобретения является способ лечения недостаточности аргиназы-1 или аргининзависимых раковых заболеваний, лечения или предупреждения септического шока, ингибирования ангиогенеза или лечения ангиогенез-ассоциированных заболеваний, включающий введение пациенту, нуждающемуся в этом, эффективного количества фармацевтической композиции, включающей аргининдеиминазу из M. arginini, или эффективного количества аргининдеиминазы из M. arginini, инкапсулированной в эритроциты.
Подробное описание
Аргининдеиминаза
«Аргининдеиминаза», также называемая «ADI», представляет собой фермент, который катализирует химическую реакцию L-аргинин + H2O
Двумя субстратами этого фермента являются L- аргинин и H2O, в то время как его два продукта представляют собой L-цитруллин и NH3. Аргининдеиминаза принадлежит к семейству гидролаз и указана под ссылкой EC 3.5.3.6 в номенклатуре ферментов IUBMB. ADI может происходить от различных микроорганизмов, таких как Bacillus pyocyaneus, Pseudomonas putida, Halobacterium salinarium, Mycoplasma arginini, Mycoplasma hominis, Pseudomonas aeruginosa, Lactobacillus lactis ssp. Lactis и Pseudomonas plecoglossicida (см. Rui-Zhi Han et al., Appl. Microbiol. Biotechnol., 2016, 100: 4747-4760).
В одном воплощении аргининдеиминаза представляет собой белок.
Используемый в настоящем описании термин «белок» включает молекулы одноцепочечных пептидов, а также полипептидные комплексы, в которых отдельные составляющие полипептиды соединены ковалентным и нековалентным способами.
Используемые в настоящем описании термины «полипептид» и «пептид» относятся к полимеру, в котором мономерами являются аминокислоты, связывающиеся вместе через пептидные или дисульфидные связи. К полипептидам и пептидам, имеющим биологическую функцию, также могут относиться термины «звено» и «домен».
Аргининдеиминаза, используемая в контексте настоящего изобретения, может быть природного, синтетического или искусственного происхождения или полученной генной инженерией (например, методом получения фермента в клетке-хозяине, например, E. coli, после интеграции вектора, экспрессирующего ген, кодирующий фермент), и специалист в данной области техники может обратиться, например, к работе S. Misawa et al., J. of Biotechno., 36, 1994, 145-155, в отношении описания получения ADI из M. arginini в E. coli. Аргининдеиминазы, которые можно использовать, описаны, например, в EP-A-1 011 717, EP-A-0 414 007, US-A-5 372 942, JP-A-6062867, JP-A-2053490, JP-A-2035081. В равной степени изобретение включает применение аналогов этого фермента, таких как варианты и фрагменты, которые в заметной степени могут представлять собой ферменты, которые модифицированы для того, чтобы усилить их ферментативную активность, как описано, например, в EP-A-0 981 607.
По настоящему изобретению используют предпочтительно улучшенную ADI для применения при любом заболевании, при котором благоприятно снижение аргинина в плазме, включая, например, аргининзависимые (аутоксотрофные) раковые заболевания и недостаточность аргиназы.
Соответственно, в одном предпочтительном воплощении аргининдеиминаза, используемая в контексте настоящего изобретения, является аргининдеиминазой из Mycoplasma arginini. Аргининдеиминаза из Mycoplasma arginini является гомодимером с молекулярной массой 92 кД. Относительно небольшой размер указанной аргининдеиминазы, по сравнению с другими аргининдеиминазами, является преимуществом для инкапсулирования в эритроциты.
В одном воплощении аргининдеиминаза из Mycoplasma arginini включает аминокислотную последовательность SEQ ID NO: 1 или ее варианты или фрагменты. Аминокислотная последовательность SEQ ID NO: 1 соответствует аминокислотной последовательности аргининдеиминазы из Mycoplasma arginini, которая доступна из базы данных GenBank под идентификационным номером NCBI WP_004416214.1, и доступна с 22 августа 2017.
В настоящем описании ссылки на аминокислотные последовательности (также называемые полипептидами) включают как определенные аминокислотные последовательности, так и варианты указанных последовательностей.
«Варианты белков» могут представлять собой встречающиеся в природе варианты, такие как сплайс-варианты, аллели и изоформы, или они могут быть получены рекомбинантными способами. Изменения в аминокислотной последовательности могут быть внесены путем замены, делеции или вставки одного или нескольких кодонов в нуклеотидную последовательность, кодирующую белок, что приводит к изменению в аминокислотной последовательности белка. Необязательно, изменение осуществляется путем замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше аминокислот любой другой аминокислотой в белке. Кроме того, или с другой стороны, изменение может быть путем добавления или делеции 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше аминокислот в белке.
«Фрагменты» белков также охватываются изобретением. Такие фрагменты могут быть усеченными по N-концу или С-концу или могут быть лишены внутренних остатков, например, при сравнении с полноразмерным белком. Некоторые фрагменты лишены внутренних остатков, которые не являются необходимыми для ферментативной активности. Предпочтительно указанные фрагменты имеют по меньшей мере примерно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 150, 250, 300, 350, 380, 400 или больше аминокислот в длину.
Варианты белков могут включать белки, которые имеют по меньшей мере примерно 80% идентичность аминокислотных последовательностей с последовательностью полипептида, раскрытой в настоящем описании. Предпочтительно вариант белка будет иметь по меньшей мере примерно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичность аминокислотной последовательности с последовательностью полипептида, раскрытой в настоящем описании. Идентичность аминокислотных последовательностей определяется как процент аминокислотных остатков в последовательности варианта, которые идентичны аминокислотным остаткам в эталонной последовательности, после выравнивания последовательностей и введения гэпов при необходимости для достижения максимального процента идентичности последовательностей, и без учета каких-либо консервативных замен как части идентичности последовательностей. Идентичность последовательностей можно определить по всей длине как варианта, так и эталонной аминокислотных последовательностей.
Специалисту в данной области техники следует иметь в виду, что несколько нуклеиновых кислот могут кодировать один и тот же полипептид в результате вырожденности генетического кода. Кроме того, следует иметь в виду, что специалисты в данной области техники могут, используя рутинные методы, осуществить нуклеотидные замены, которые не влияют на последовательность полипептида, кодированную нуклеиновыми кислотами по изобретению, для отражения применения кодонов любого определенного организма-хозяина, в котором должны экспрессироваться полипептиды. Нуклеиновые кислоты, кодирующие ADI, используемую в контексте изобретения, можно модифицировать любым способом, доступным в технике. Нуклеиновые кислоты, кодирующие ADI, используемую в контексте изобретения, можно получить рекомбинантными, синтетическими или любыми другими способами, доступными специалистам в данной области техники. Их также можно клонировать стандартными методами, такими как ПЦР (полимеразная цепная реакция).
С помощью полипептида, имеющего аминокислотную последовательность по меньшей мере, например, на 95% «идентичную» определенной аминокислотной последовательности по настоящему изобретению, предполагается, что аминокислотная последовательность обсуждаемого полипептида идентична выясненной последовательности за исключением того, что последовательность обсуждаемого полипептида может включать до пяти аминокислотных изменений на каждые 100 аминокислот выясненной аминокислотной последовательности. Иными словами, для того, чтобы получить полипептид, имеющий аминокислотную последовательность по меньшей мере на 95% идентичную выясненной аминокислотной последовательности, до 5% (5 из 100) аминокислотных остатков в обсуждаемой последовательности могут быть встроены, делетированы или заменены на другую аминокислоту.
В контексте настоящей заявки процент идентичности вычисляют с использованием глобального выравнивания (т.е. две последовательности сравнивают полностью по всей длине). Способы сравнения идентичности двух или больше последовательностей известны в технике. Например, можно использовать программу «needle», в которой используется алгоритм глобального выравнивания Нудельмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol., 48: 443-453) для поиска оптимального выравнивания (включая гэпы) двух последовательностей при рассмотрении их полной длины. Программа needle доступна, например, на веб-сайте ebi.ac.uk world wide. Процент идентичности согласно изобретению предпочтительно вычисляют с использованием (глобальной) программы EMBOSS::needle с параметром “Gap Open”, равным 10,0, параметром “Gap Extend”, равным 0,5, и матрицей Blosum62.
Белки, состоящие из аминокислотной последовательности «по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичной» эталонной последовательности, могут включать мутации, такие как делеции, вставки и/или замены по сравнению с эталонной последовательностью. В случае делеций, вставок и/или замен белок, состоящий из аминокислотной последовательности по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичной эталонной последовательности, может соответствовать гомологичной последовательности, полученной из другого вида, чем эталонная последовательность.
Аминокислотные замены могут быть консервативными и неконсервативными. Предпочтительно замены являются консервативными заменами, при которых одну аминокислоту заменяют на другую аминокислоту со схожими структурными и/или химическими свойствами. Замена предпочтительно соответствует консервативной замене как указано в настоящем описании ниже в таблице 1.
Таблица 1. Консервативная аминокислотная замена
Предпочтительно указанные варианты или фрагменты сохраняют биологическую активность белка, имеющего полноразмерную аминокислотную последовательность SEQ ID NO: 1.
В некоторых воплощениях аргинидеиминаза, используемая в контексте изобретения, может представлять собой вариант или фрагмент, имеющий повышенную биологическую активность или ферментативную активность по сравнению с белком, имеющим полноразмерную аминокислотную последовательность SEQ ID NO: 1. Соответственно, указанный вариант или фрагмент может включать аминокислотные замены, которые улучшают его ферментативную активность. «Улучшенная ферментативная активность» в настоящем описании относится, например, к улучшению оптимального рН, улучшению величин Km и kcat и улучшенной теплоустойчивости. Такие мутации или известны специалистам в данной области техники или могут быть легко получены на основе общих знаний, как раскрывается, например, в работе Rui-Zhi Han et al. (Appl. Microbiol. Biotechnol., 2016, 100: 4747-4760).
В одном воплощении вариант аргинидеиминазы или ее фрагмент может быть модифицирован для того, чтобы повысить время полужизни in vivo.
Фармацевтические композиции или суспензии
Термины «фармацевтическая композиция» или «терапевтическая композиция», используемые в настоящем описании, относятся к соединению или композиции, способным вызывать желательное терапевтическое действие, когда должным образом вводятся пациенту.
Изобретение относится к фармацевтической композиции и суспензии, причем обе включают аргинидеиминазу, инкапсулированную в эритроцитах. Определения, данные в настоящем описании, относятся к композициям и суспензиям по изобретению. Эритроциты, инкапсулирующие ADI, предпочтительно находятся в суспензии в фармацевтически приемлемом носителе.
Термины «фармацевтически» или «фармацевтически приемлемая» относятся к молекулам и композициям, которые не продуцируют вредной, аллергической или иной неблагоприятной реакции, когда вводятся млекопитающему, особенно человеку, в соответствующем случае.
Согласно отдельному воплощению, «фармацевтически приемлемый носитель» является «консервирующим раствором» или «консервирующим раствором для эритроцитов», т.е. раствором, в котором эритроциты, инкапсулирующие фермент, суспендированы в своей подходящей форме для хранения в ожидании их применения для инъекции. Консервирующий раствор предпочтительно включает по меньшей мере один агент, промотирующий сохранение эритроцитов, в частности, выбранный из глюкозы, декстрозы, аденина и маннита.
В одном воплощении консервирующий раствор представляет собой водный раствор, включающий NaCl и/или аденин. В другом воплощении консервирующий раствор дополнительно включает по меньшей мере одно соединение, выбранное из группы, включающей глюкозу, декстрозу и маннит. Как пример, он может включать NaCl, аденин и декстрозу. Как пример, консервирующий раствор представляет собой среду AS3. Как другой пример, он может включать NaCl, аденин, глюкозу и маннит. В другом примере консервирующий раствор представляет собой среду SAGM, такую как SAG-маннит, или среду ADsol.
Точная форма фармацевтических композиций, путь введения, дозировка и схема применения естественно зависят от состояния, от которого лечат, тяжести заболевания, возраста, массы и пола пациента и т.д. Также следует иметь в виду, что композиция и суспензии по изобретению предназначены для внутривенного или внутриартериального введения, предпочтительно для инъекции, инфузии или перфузии. Соответственно, фармацевтическая композиция по изобретению составляется для внутривенного или внутриартериального введения.
Композиции по изобретению могут быть готовыми для применения или нет. Готовая для применения фармацевтическая композиция по изобретению имеет гематокрит, подходящий для введения без разбавления. Когда композиция не готова для применения, она также может быть упакована с более высокой гематокритной величиной, так что ее следует разбавить перед введением.
«Гематокрит (Ht или HCT)» вообще известен как объемный процент (об.%) красных кровяных клеток в крови. В контексте настоящего изобретения гематокрит также может относиться к объемному проценту (об.%) красных клеток крови в композиции или суспензии, называемой также фармацевтической композицией или суспензией эритроцитов.
Согласно изобретению, гематокрит готовой к применению фармацевтической композиции преимущественно находится между 40 и 70%, предпочтительно между 45 и 65%, предпочтительнее между 45 и 55%, например, 46 и 54%, 47 и 53%, 48 и 52%, например, составляет примерно 50%. Когда композиция не готова к применению, гематокрит фармацевтической композиции для разбавления может быть более высоким, в частности, находящимся между 50 и 90%, предпочтительно 60 и 90%. В родственном воплощении разбавление фармацевтической композиции для получения величин гематокрита готовой к применению композиции, определенной в настоящем описании выше, может быть осуществлено фармацевтически приемлемым носителем.
«Эритроциты» также называют красными клетками крови. Эритроциты вырабатываются в костном мозге и циркулируют в организме в течение примерно 100-120 дней до того, как их компоненты рециклизуются макрофагами. Почти половину объема крови (40% - 45%) составляют красные клетки крови. Способы выделения эритроцитов известны специалистам в данной области техники.
В одном воплощении эритроциты выделяют из крови млекопитающего того же вида, что и субъект или пациент, которого лечат. Когда млекопитающее представляет собой человека, эритроциты предпочтительно происходят от человека. В одном воплощении эритроциты берут у самого пациента.
В другом воплощении используют стволовые клетки для генерации эритроцитов. Специалист может обратиться к Russeau et al. (ISBT Science Series (2016), 11 (Suppl. 1), 111–117). Стволовые клетки можно дополнительно трансформировать для экспрессии фермента в эритроцитах. Специалисты в данной области техники также могут обратиться к US2015/0182588. Эти документы включены в настоящее описание в качестве ссылок.
Аргининдеиминаза, используемая в контексте изобретения, является высоко активной. Активность может быть выражена, например, в Е. «Единица (Е)» относится к количеству фермента, которое конвертирует 1 мкмоль субстрата в минуту. Соответственно, в контексте настоящего изобретения 1 Е относится к количеству фермента, которое конвертирует 1 мкмоль аргинина в минуту, предпочтительно при 37°С. Предпочтительнее 1 Е относится к активности аргининдеиминазы, когда она присутствует в буферах, обычно используемых для измерения активности аргининдеиминазы, таких как буферы, описанные в указанном документе (Boyde and Rahmatullah, 1980, Analytical Biochemistry, vol. 107, p.424-431). В некоторых воплощениях «единица», определенная в настоящем описании выше, также может называться «международной единицей (МЕ)((IU))». Соответственно, в некоторых воплощениях 1 Е и 1 МЕ являются взаимозаменяемыми.
Способы количественной и/или качественной оценки активности аргининдеиминазы известны в технике. Типично активность аргининдеиминазы измеряют так, как подробно описано в настоящем описании ниже в экспериментальном разделе, в частности, в примере 1 и 2 в экспериментальном разделе. Точные условия эксперимента, используемые при измерении активности аргининдеиминазы, известны специалистам в данной области техники, и описаны, например, в (Boyde and Rahmatullah, 1980, Analytical Biochemistry, vol. 107, p.424-431). В одном воплощении аргининдеиминаза, используемая в контексте изобретения, имеет, до инкапсулирования, специфическую активность 10-100 Е/мг, такую как 20-80, 30-70, 40-60 Е/мг, причем мг относится к количеству очищенного фермента.
Термин «очищенный фермент» в настоящем описании относится к ферменту, имеющему чистоту 90-100%, такую как 92-100%, 94-100%, более 96%, более 97%, более 98%, более 99%, например, 97%. Способы определения чистоты фермента известны специалистам в данной области техники и включают, например, анализ в геле с SDS или масс-спектрометрический анализ, предпочтительно анализ в геле с SDS.
«Аргининдеиминаза инкапсулирована в эритроциты» означает, что аргининдеиминаза содержится внутри эритроцитов.
В одном воплощении концентрация инкапсулированной аргининдеиминазы в контексте настоящего изобретения, также называемая концентрацией аргининдеиминазы в эритроцитах, составляет от 0,1 до 7 мг/мл, предпочтительно 0,5-6,5 мг/мл, например, 1- 6мг/мл, 1-5 мг/мл, 1-4 мг/мл, 1-3 мг/мл, предпочтительнее 1,2-2,8 мг/мл, 1,4-2,6 мг/мл, 1,6-2,4 мг/мл.
В некоторых воплощениях концентрация инкапсулированной аргининдеиминазы составляет по меньшей мере 0,1, 0,2, 0,4, 0,6, 0,8, 1, 1,2, 1,4, 1,6, 1,8, 2, 2,2, 2,4, 2,6, 2,8, 3, 3,5, 4, 4,5, 6 мг/мл. В некоторых воплощениях концентрация инкапсулированной аргининдеиминазы составляет самое большее 7, 6,5, 5, 5,5, 5, 4,5, 4, 3,5, 3, 2,5, 2 мг/мл.
В другом воплощении концентрация инкапсулированной аргининдеиминазы составляет от 1 до 1000 Е/мл, предпочтительно 1-500 Е/мл, например, 1-400 Е/мл, 5-400 Е/мл, 5-350 Е/мл.
В некоторых воплощениях концентрация инкапсулированной аргининдеиминазы составляет по меньшей мере 0.5, 1, 2, 3, 4, 5, 10, 20, 30, 40, 50, 100, 200 to 400 Е/мл. В некоторых воплощениях концентрация инкапсулированной аргининдеиминазы составляет самое большее 1000, 800, 600, 500, 400, 350, 300, 200, 100 Е/мл.
Предпочтительно указанная концентрация инкапсулированной аргининдеиминазы, в мг/мл или в Е/мл, относится к концентрации аргининдеиминазы в эритроцитах на мл фармацевтической композиции по изобретению или суспензии по изобретению, предпочтительнее относится к концентрации аргининдеиминазы в эритроцитах на мл раствора эритроцитов композиции или суспензии, причем указанный раствор типично имеет гематокрит 50%.
В одном воплощении композиция или суспензия по изобретению в сохраняющем растворе характеризуется уровнем внеклеточного гемоглобина, удерживаемом на уровне, равном или меньше 0,5, в частности, 0,3, особенно 0,2, предпочтительно 0,15, еще лучше 0,1 г/дл за 72 часа и сохранением при температуре от 2 до 8°С.
В частности, композиция или суспензия по изобретению в сохраняющем растворе характеризуется уровнем внеклеточного гемоглобина, удерживаемом на уровне, равном или меньше 0,5, в частности, 0,3, особенно 0,2, предпочтительно 0,15, еще лучше 0,1 г/дл в течение периода, заключенного между 24 час и 20 днями, в частности между 24 и 72 час, и сохранением при температуре от 2 до 8°С.
«Уровень внеклеточного гемоглобина» преимущественно измеряют ручным способом, описанным в работе G. B. Blakney and A. J. Dinwoodie, Clin. Biochem., 8, 96-102, 1975. Также существуют автоматические приборы, которые позволяют осуществить такое измерение с чувствительностью, специфической для них.
В частности, композиция или суспензия по изобретению в консервирующем растворе характеризуется скоростью гемолиза, поддерживаемой равной или меньше 2, особенно 1,5, предпочтительно 1% за 72 часа, и сохранением при температуре от 2 до 8°С.
В частности, композиция или суспензия по изобретению в консервирующем растворе характеризуется скоростью гемолиза, поддерживаемой равной или меньше 2, особенно 1,5, предпочтительно 1% в течение периода от 24 час до 20 дней, особенно между 24 и 72 час, и при температуре от 2 до 8°С.
В одном воплощении композиция по изобретению представляет собой суспензию. В одном воплощении суспензия по изобретению и суспензия в контексте изобретения имеют осмолярность от 270 до 350 мосм/л. Способы измерения осмолярности известны специалистам в данной области техники. В одном примере осмолярность измеряют осмометром (микроосмометр Loser, тип 15). Осмолярность предпочтительно измеряют в стандартных условиях (т.е. при 25°C и 1 атм).
Терапевтические методы и применения
Авторы настоящего изобретения показали, что фармацевтическая композиция, включающая аргининдеиминазу, инкапсулированную в эритроцитах, снижает уровни L-аргинина в крови у мышей с недостаточностью аргиназы на 73% через три дня после введения, например, когда вводится в дозе 8 мл/кг. Специалистам в данной области техники следует иметь в виду, что эти результаты показывают, что композицию по изобретению, а также суспензию по изобретению, можно использовать для лечения недостаточности аргиназы, поскольку повышенный уровень сывороточного аргинина непосредственно связан с клиническим состоянием субъекта или пациента, которого лечат.
Авторы изобретения также показали на мышах, что, неожиданно, введение композиции или суспензии по изобретению не вызывает заметных изменений уровней аммиака у обработанных мышей и таким образом потенциально не вызывает возможных эпизодов гипераммониемии у субъекта или пациента, которого лечат.
Соответственно, настоящее изобретение относится к фармацевтической композиции, включающей, инкапсулированную в эритроцитах аргининдеиминазу и фармацевтически приемлемый носитель, для ее применения при лечении недостаточности аргиназы-1. Изобретение также относится к суспензии эритроцитов, инкапсулирующих аргининдеиминазу, в частности, аргининдеиминазу из M. arginini, для ее применения при лечении недостаточности аргиназы-1.
«Недостаточность аргиназы-1» является наследственной болезнью обмена веществ, при которой организм неспособен перерабатывать аргинин (строительный блок белка). Она принадлежит к группе расстройств, известных как нарушения цикла мочевины. Они имеют место, когда в организме нарушается процесс удаления аммиака, что может вызвать повышение уровней аммиака в крови (гипераммониемию). В большинстве случаев симптомы появляются в возрасте от одного года до трех лет. Симптомы могут включать пищевые проблемы, рвоту, плохой рост, эпилиптические припадки и ригидность мышц с непроизвольными движениями (спастичность). Люди с недостаточностью аргиназы-1 также могут иметь задержку роста, потерю развития и умственную отсталость. Недостаточность аргиназы-1 вызывается мутациями в гене ARG1 и наследуется как аутосомно-рецессивная. Большинство людей с недостаточностью аригназы-1 при рождении выглядят здоровыми и имеют нормальное развитие в младенчестве. Первые признаки недостаточности аргиназы-1 обычно появляются в возрасте от одного года до трех лет. В некоторых случаях симптомы появляются раньше или позднее.
Недостаточность аргиназы-1 может характеризоваться одним или несколькими признаками и симптомами, выбранными из списка, включающего плохой рост (присутствует у всех людей, которые имеют недостаточность аргиназы), ригидные мышцы и учащенные непроизвольные движения (спастичность), отставание в развитии, потерю ранее приобретенных вех развития, умственную отсталость, припадки, малый размер головы (микроцефалию), проблемы с равновесием и координацией, поведенческую анормальность, диаминоацидурию, умственную отсталость (тяжелую), неврологическое нарушение речи, анормальность в EEQ (электроэнцефалограмма), гемиплегию/гемипарез, гипераммониемию, прогрессирующую спастическую квадриплегию и припадки.
«Способы диагностики недостаточности аргиназы-1» известны специалистам в данной области техники и обычно включают полное расширенное скрининговое тестирование новорожденных. Обычно трех-четырехкратное повышение концентрации аргинина в плазме выше верхнего предела нормы в большой степени предполагает такой диагноз. Диагноз подтверждают дополнительно типично путем идентификации патогенных вариантов биаллельного гена ARG1 при молекулярном генетическом тестировании или в отсутствии детекции активности фермента аргиназы (обычно <1% от нормальной) в экстрактах красных клеток крови.
Изобретение также относится к способу лечения недостаточности аргиназы-1, включающему введение пациенту, нуждающемуся в этом, эффективного количества аргининдеиминазы, инкапсулированной в эритроцитах, или эффективного количества композиции по изобретению.
В контексте изобретения термин «лечение», используемый в настоящем описании, означает реверсию, облегчение, подавление развития или предупреждение расстройства, или состояния, к которому применяют такой термин, или одного или нескольких симптомов такого расстройства или состояния.
Соответственно, термин «лечение» включает не только лечение, ведущее к полному излечиванию от заболевания, но также лечение, показывающее спад развития заболевания и/или продление времени жизни пациента.
«Эффективное количество» обозначает количество, эффективное, в дозировках и в течение необходимых периодов времени, для достижения желательного терапевтического или профилактического результата.
Терапевтически эффективное количество композиции или суспензии по изобретению для выявления желательного терапевтического результата может изменяться согласно таким факторам, как болезненное состояние, возраст, пол и масса индивидуума и способность белка. Терапевтически эффективное количество охватывает количество, при котором любые токсические или вредные действия ингибитора перевешиваются терапевтически благоприятными эффектами. Терапевтически эффективное количество также охватывает количество, достаточное для предоставления благоприятного действия, например, клинического благоприятного действия.
В некоторых воплощениях способы по изобретению включают введение композиции по изобретению, описанной выше, или последовательно или одновременно в комбинации с по меньшей мере одним дополнительным лечением, которое направлено против недостаточности аргиназы-1.
В настоящем описании одно такое дополнительное лечение, направленное против недостаточности аргиназы-1, относится к безбелковой диете, введению поглотителей азота, инъекциям ботулотоксина или введению аминокислот, таких как орнитин или лизин.
«Поглотители азота» включают, но без ограничения, бензоат, фенилбутират и фенилацетат.
Как показано в настоящем описании выше, авторы настоящего изобретения показали, что аргининдеиминаза M. arginini, инкапсулированная в эритроцитах, снижает уровни L-аргинина в крови у мышей с недостаточностью аргиназы-1 до 73% через три дня после введения, например, когда вводится в дозе 8 мл/кг.
Соответственно, специалистам в данной области техники следует иметь в виду, что фармацевтическая композиция, включающая суспензию эритроцитов, инкапсулирующих аргининдеиминазу из M. arginini, эффективна не только при лечении недостаточности аргиназы-1, но также при лечении других заболеваний, при которых может быть благоприятным снижение концентрации аргинина в крови.
Соответственно, изобретение находит особенно интересное применение при аргигинзависимых раковых заболеваниях, в случае которых показано благоприятное действие снижения аргинина в плазме (см., например, F. Izzo et al., 2004, C.M. Ensor et al., 2002, F.W. Holtsberg et al., 2002, J.S. Bomalaski et al., 2003, и Curley S.A. et al., 2003, цитированы ранее).
Однако снижение аргинина в плазме также может быть благоприятным в случае лечения или предупреждения септического шока, ингибирования ангиогенеза и ассоциированных заболеваний.
Соответственно, в одном воплощении настоящее изобретение относится к фармацевтической композиции, включающей суспензию эритроцитов, инкапсулирующих аргининдеиминазу из M. arginini, для ее применения при снижении концентрации аргинина в крови.
Соответственно, в родственном воплощении настоящее изобретение относится к фармацевтической композиции, включающей инкапсулированную в эритроцитах аргининдеиминазу из M. arginini и фармацевтически приемлемый носитель, для ее применения при снижении концентрации аргинина в крови.
Определения, относящиеся к «фармацевтическим композициям», «аргинидеиминазе», «суспензии», «фармацевтически приемлемом носителе», приводятся в настоящем описании выше и применяются mutatis mutandis.
В частности, снижение концентрации аргинина в крови применимо при лечении недостаточности аргиназы-1, лечении аргининзависимых раковых заболеваний, лечении или предупреждении септического шока, для ингибирования ангиогенеза и лечения ассоциированных заболеваний.
Соответственно, в одном воплощении изобретение относится к фармацевтической композиции, включающей суспензию эритроцитов, инкапсулирующих аргининдеиминазу из M. arginini, для ее применения при лечении недостаточности аргиназы-1, лечении аргининзависимых раковых заболеваний, лечении или предупреждении септического шока, для ингибирования ангиогенеза и лечения ассоциированных заболеваний.
Соответственно, в родственном воплощении настоящее изобретение относится к фармацевтической композиции, включающей инкапсулированную в эритроцитах аргининдеиминазу из M. arginini и фармацевтически приемлемый носитель, для ее применения при лечении недостаточности аргиназы-1, лечении аргининзависимых раковых заболеваний, лечении или предупреждении септического шока, для ингибирования ангиогенеза и лечения ассоциированных заболеваний.
Определение «недостаточности аргиназы-1» приводится в настоящем описании выше.
Термин «аргининзависимые раковые заболевания» относится к раковым заболеваниям с участием раковых клеток, которым для репликации требуется аргинин, такие опухоли неспособны синтезировать часть или весь аргинин, который им требуется, главным образом, из-за утраты биосинтетического фермента аспарагинсинтазы, и поэтому требуют снабжения аргинином, поэтому такие раковые заболевания также называют «аргинин-ауксотрофными раковыми заболеваниями». Снижение аргинина в плазме будет лишать эти клетки аргинина, который необходим для их развития, приводя к нацеленной гибели этих клеток, ингибированию роста опухоли или регрессии массы опухоли.
Аргининзависимые раковые заболевания могут быть выбраны из группы, включающей гепатокарциному, первичный рак печени, меланому, рак молочной железы, нейробластому, лейкоз, мезотелиальный рак, урологический рак, саркому, рак желудка и рак мозга.
«Мезотелиальный рак» обозначает, например, злокачественную множественную мезотелиому (МРМ).
«Урологический рак» включает, например, почечно-клеточный рак, рак предстательной железы, рак толстой кишки и рак мочевого пузыря, в частности, переходно-клеточный рак.
«Саркома» обозначает, например, остеосаркому.
«Рак мозга» обозначает, например, астроцитому, олигодендроглиому.
В одном аспекте аргининзависимый рак представляет собой гепатокарциному или первичный рак печени. В другом аспекте аргининзависимый рак представляет собой меланому, в частности, злокачественную меланому, в ее различных формах, таких как поверхностно-распространяющаяся меланома и нодулярная меланома. Согласно другому аспекту, аргининзависимый рак представляет собой одну из следующих форма рака:
- рак молочной железы,
- нейробластому (Gong H. et al., Int. J. Cancer, 2003, 106: 723-8),
- лейкоз (Gong H. et al., Leukemia, 2000, Vol. 14, 826-9; Noh E.J. et al., Int. J. Cancer, 2004, 112: 502-8).
«Лечение» определяется в настоящем описании выше.
«Предупреждение» означает профилактическое применение (т.е., для индивидуума, восприимчивого к развитию данного заболевания).
Выражение «ингибирование ангиогенеза и лечение ассоциированных заболеваний» относится к лечению таких заболеваний, как ангиома, ангиофиброма, артрит, диабетическая ретинопатия, ретинопатия недоношенных, неоваскулярная глаукома, болезнь роговицы, инволюционная и другие формы макулярной дегенерации, птеригий, ретинальная дегенерация, ретролентальная фиброплазия, псориаз, телеангиэктазия, пиогенная гранулема, себорейный дерматит, акне, рак и метастазы, связанные с ангиогенезом (WO 0209741; Park I.S. et al., Br. J. Cancer, 2003, 89: 907-14).
Другой целью изобретения является применение эритроцитов, инкапсулирующих ADI, или суспензии таких эритроцитов для получения лекарственного средства, предназначенного для лечения заболеваний, представленных в настоящем описании.
Применение учитывает характеристики, представленные для суспензий и фармацевтических композиций по изобретению или лекарственного средства.
Еще одной целью изобретения является способ лечения недостаточности аргиназы-1, включающий введение пациенту, нуждающемуся в этом, эффективного количества фармацевтической композиции по изобретению или введение пациенту, нуждающемуся в этом, эффективного количества аргининдеиминазы, инкапсулированной в эритроциты, или введение пациенту, нуждающемуся в этом, эффективного количества лекарственного средства согласно изобретению.
Еще одной целью изобретения является способ лечения недостаточности аргиназы-1 или аргининзависимых раковых заболеваний, лечение или предупреждение септического шока, ингибирование ангиогенеза или лечение ангиогенез-ассоциированных заболеваний, включающий введение пациенту, нуждающемуся в этом, эффективного количества фармацевтической композиции, включающей аргининдеиминазу из M. arginini, или эффективного количества аргининдеиминазы из M. arginini, инкапсулированной в эритроциты, или введение пациенту, нуждающемуся в этом, эффективного количества лекарственного средства согласно изобретению.
Способ лечения включает введение пациенту, нуждающемуся в этом, «терапевтически эффективной дозы», «терапевтически эффективного количества» или «эффективного количества», причем эффективное количество определено в настоящем описании выше.
В частности, «терапевтически эффективную дозу», «терапевтически эффективное количество» или «эффективное количество» специалист в данной области техники может определить достаточно просто. Количество фактически вводимого фермента может быть определено лечащим врачом с учетом релевантных обстоятельств, включая состояние, от которого лечат, выбранный путь введения, фактически вводимое соединение, возраст, массу и реакцию отдельного пациента, тяжесть симптомов у пациента, и т.д. Эффективные количества типично могут соответствовать поддержанию аргинина ниже порогового уровня в течение достаточного времени.
В некоторых примерах уровень аргинина может поддерживаться ниже порогового уровня в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 дней, предпочтительно в течение по меньшей мере 3 дней.
Типичные эффективные количества фермента подробнее в настоящем описании указаны далее в разделе «Дозы».
Фармацевтические композиции можно вводить внутривенной или внутрартериальной инъекцией и предпочтительно инъекцией, инфузией или перфузией из пакета для крови или подобного. Введение типично выполняют внутривенно в плечо или через венозный катетер.
В частности, вводят от примерно 10 до примерно 250 мл суспензии (одна доза), фармацевтической композиции или лекарственного средства согласно изобретению. Свыше 20 мл предпочтительно применение инфузии или перфузии.
Лечение включает введение одной дозы или нескольких доз согласно принятому протоколу. Оно может предоставляться с интервалами ежемесячно, в две недели или еженедельно, предпочтительно одни, два или три раза в неделю, на протяжении рекомендованной продолжительности лечения.
В одном воплощении лечение в контексте изобретения может заключаться во введении одной дозы каждый раз (каждой дозы), определенной в настоящем описании ниже в разделе «Дозы».
В одном примере лечение в контексте изобретения может заключаться во введении эквивалента 0,001 мг/кг фермента на кг массы тела – 1000 мг/кг мг/кг фермента на кг массы тела, предпочтительно 0,01 мг/кг фермента на кг массы тела – 500 мг/кг фермента на кг массы тела, предпочтительно каждый раз (каждая доза). Предпочтительно вводят от 0,01 мг/кг фермента на кг массы тела до 200 мг/кг фермента на кг массы тела, предпочтительно каждый раз (каждая доза).
В другом примере, также описанном в настоящем описании ниже в разделе «Дозы», лечение в контексте изобретения может заключаться во введении эквивалента 10 Е/кг фермента на кг массы тела и 100000 Е/кг мг/кг фермента на кг массы тела каждый раз (каждая доза), предпочтительно от 10 Е/кг фермента на кг массы тела до 15000 Е/кг фермента на кг массы тела каждый раз (каждая доза), предпочтительнее от 500 Е/кг фермента на кг массы тела до 3500 Е/кг фермента на кг массы тела каждый раз (каждая доза).
Дозы
Композиции по изобретению предпочтительно упаковывают или предоставляют в объеме, содержащем предварительно установленное количество активного материала, вычисленное для получения желательного терапевтического эффекта. Специалистам в данной области техники следует иметь в виду, что объем или доза вводимой композиции зависит, например, от состояния млекопитающего, для которого предназначено введение (например, массы, возраста, пола и состояния здоровья, одновременного лечения, если оно имеется, частоты лечения), типа введения и типа препарата.
В контексте настоящего изобретения объем, в котором упакована композиция для введения, также относится к дозе. В одном воплощении указанный объем составляет от 10 до 250 мл.
Соответственно, композицию для введения предпочтительно упаковывают или предоставляют в одной дозе; предпочтительно указанная доза имеет объем, определенный в настоящем описании выше. Упаковку предпочтительно осуществляют в контейнер, такой как, например, пакет для крови типа, подходящего для трансфузии крови, и т.п. Предпочтительно в указанном контейнере содержится все количество инкапсулированного фермента, соответствующее предписанию врача. Иными словами, одна доза эритроцитов, инкапсулирующих данное количество фермента, может присутствовать в одном контейнере или фармацевтической композиции. В одном воплощении эта одна доза предназначается для введения полностью пациенту, нуждающемуся в этом. В другом воплощении введение может достигаться в одной дозе или нескольких дозах.
Количество инкапсулированного фермента в одной дозе может составлять от 0,001 мг/кг массы тела пациента до 1000 мг/кг массы тела пациента. Предпочтительнее количество инкапсулированного фермента в одной дозе составляет от 0,01 мг/кг массы тела пациента до 1000 мг/кг массы тела пациента. Наиболее предпочтительно количество инкапсулированного фермента в одной дозе составляет от 0,01 мг/кг массы тела пациента до 500 мг/кг массы тела пациента. Наиболее предпочтительно количество инкапсулированного фермента в одной дозе составляет от 0,01 мг/кг массы тела пациента до 200 мг/кг массы тела пациента или от 0,01 мг/кг массы тела пациента до 100 мг/кг массы тела пациента.
В некоторых воплощениях количество инкапсулированного фермента в одной дозе составляет по меньшей мере 0,001, 0,005, 0,01, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50 мг/кг массы тела пациента. В некоторых воплощениях количество инкапсулированного фермента в одной дозе составляет самое большее 200, 150, 100, 80, 70, 60, 50, 45, 40, 35, 30, 25, 20, 25, 15, 10, 5, 1, 0,5, 0,1 мг/кг массы тела пациента.
Количество инкапсулированного фермента в одной дозе также может составлять от 10 Е/кг массы тела пациента до 100000 Е/кг массы тела пациента. Предпочтительнее количество инкапсулированного фермента в одной дозе составляет от 10 Е/кг массы тела пациента до 80000 Е/кг массы тела пациента. Наиболее предпочтительно количество инкапсулированного фермента в одной дозе составляет от 10 Е/кг массы тела пациента до 50000 Е/кг массы тела пациента. Наиболее предпочтительно количество инкапсулированного фермента в одной дозе составляет от 10 Е/кг массы тела пациента до 5000 Е/кг массы тела пациента или от 50 Е/кг массы тела пациента до 3500 Е/кг массы тела пациента.
В некоторых воплощениях количество инкапсулированного фермента в одной дозе может также составлять по меньшей мере 10, 25, 50, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 8500, 9000, 9500, 10000 МЕ/кг массы тела пациента. В некоторых воплощениях количество инкапсулированного фермента в одной дозе может также составлять самое большее 10000, 9500, 9000, 8500, 8000, 7500, 7000, 6500, 6000, 5500, 5000, 4500, 4000, 3500, 3000, 2500, 2000, 1500, 1000, 900, 800, 600, 500, 450, 400, 350, 300, 250, 200, 150, 100 МЕ/кг массы тела пациента.
Специалистам в данной области техники следует иметь в виду, что дозы, используемые для введения, могут быть адаптированы как функция различных параметров, и в частности, как функция типа используемого введения, релевантной патологии или, с другой стороны, желательной продолжительности лечения.
Фармацевтическая композиция, включающая аргининдеимназу, инкапсулированную в эритроцитах, и фармацевтически приемлемый носитель, описана на уровне техники в контексте лечения раковых заболеваний. Адаптация дозировок, описанных в приведенных выше публикациях, к композициям по изобретению для применения при лечении недостаточности аргиназы-1 находится в рамках возможностей специалистов в данной области техники.
Способы инкапсулирования
Эритроциты можно получить так, как описано в настоящем описании выше в разделе «Фармацевтические композиции».
Инкапсулирование ферментов в эритроциты можно выполнять с использованием суспензии эритроцитов, которую приводят в контакт с гипотонической жидкой средой, что приводит к раскрытию пор в мембране эритроцита. Существует три альтернативы в методе лизиса-восстановления, которыми являются гипотонический диализ, гипотоническое предварительное разбухание и гипотоническое разбавление, все основаны на различии осмотического давления между внутренней и внешней сторонами эритроцитов. Предпочтителен гипотонический диализ.
Суспензию эритроцитов, инкапсулирующих фермент, можно получить следующим способом, включающим
1 – суспендирование осадка эритроцитов в изотоническом растворе при уровне гематокрита, равным или больше 65%, охлаждение между +1 и +8°С;
2 – процедуру лизиса при температуре, поддерживаемой между +1 и +8°С, включающую пропускание суспензии эритроцитов при уровне гематокрита, равном или больше 65%, и охлажденного до между +1 и +8°С гипотонического раствора для лизиса в устройстве для диализа, таком как спираль или картридж для диализа (предпочтителен картридж);
3 – процедуру инкапсулирования путем добавления, предпочтительно постепенного, фермента, который инкапсулируют (в частности, в растворе, полученном заблаговременно), в суспензию перед или во время лизиса при температуре, поддерживаемой между +1 и +8°С; и
4 – процедуру восстановления, проводимую в присутствии изотонического или гипертонического, выгодно гипертонического, раствора при более высокой температуре, а именно, составляющей от +30 до +42°С.
В предпочтительной альтернативе можно использовать описанный в WO-A-2006/016247 (EP 1 773 452; включен в настоящее описание в качестве ссылки) способ, включающий
1 – суспендирование осадка эритроцитов в изотоническом растворе при уровне гематокрита, равном или больше 65%, охлаждение между +1 и +8°С;
2 – измерение осмотической хрупкости в образце эритроцитов из того же осадка;
3 – процедуру лизиса при температуре, поддерживаемой между +1 и +8°С, включающую пропускание суспензии эритроцитов при уровне гематокрита, равном или больше 65%, и охлажденного до между +1 и +8°С гипотонического раствора для лизиса в устройстве для диализа, таком как спираль или картридж для диализа (предпочтителен картридж); причем параметры лизиса регулируются согласно осмотической хрупкости, измеренной ранее; в частности, в зависимости от измеренной осмотической хрупкости регулируют прохождение потока суспензии эритроцитов в устройстве для диализа или регулируют осмолярность раствора для лизиса; и
4 – процедуру инкапсулирования путем добавления, предпочтительно постепенного, фермента, который инкапсулируют (особенно в растворе, полученном заблаговременно), в суспензию перед и во время лизиса при температуре, поддерживаемой между +1 и +8°С; и
5 – процедуру восстановления, проводимую в присутствии изотонического или гипертонического, выгодно гипертонического, раствора при более высокой температуре, а именно, составляющей от +30 до +42°С.
Важно, в случае диализа, что осадок эритроцитов суспендируют в изотоническом растворе с уровнем гематокрита, равным или больше 65%, и предпочтительно равным или больше 70%, и эту суспензию охлаждают до температуры между +1 и +8°С, предпочтительно между +2 и +6°С, обычно до температуры около +4°С. Согласно определенному способу уровень гематокрита составляет от 65 до 80%, предпочтительно от 70 до 80%.
Когда измеряют осмотическую хрупкость, выгодно проводить измерение на эритроцитах непосредственно перед стадией лизиса в присутствии или в отсутствие, предпочтительно в присутствии, фермента, который инкапсулируют. Для эритроцитов или суспензии, содержащей их, выгодна температура, приближающаяся к или идентичная температуре, выбранной для лизиса. Согласно другой предпочтительной особенности изобретения, проведенное измерение осмотической хрупкости используют сразу же, т.е., процедуру лизиса выполняют через небольшое время после взятия образца. Предпочтительно промежуток времени между взятием образца и началом лизиса составляет меньше или равен 30 минутам, еще лучше меньше или равен 25 или даже 20 минутам.
Что касается выполнения процедуры лизиса-восстановления с измерением и согласно осмотической хрупкости, специалист в данной области техники может обратиться в отношении подробностей к WO-A-2006/016247. Этот документ полностью включен в настоящее описание в качестве ссылки.
Усовершенствование этого метода инкапсулирования описано в документе WO 2014/180897, к которому может обратиться специалист в данной области техники, и который включен в настоящее описание в качестве ссылки. Так, согласно одному воплощению, эритроциты, инкапсулирующие фермент, получают способом, включающим инкапсулирование активного ингредиента в эритроциты с помощью лизиса-восстановления, получение суспензии или осадка, включающего эритроциты, включающие фермент, и раствор с осмоляльностью выше или равной 280 мОсмол/кг, в частности, между примерно 280 и примерно 380 мОсмол/кг, предпочтительно между примерно 290 и примерно 330 мОсмол/кг, инкубацию осадка или суспензии как таковых или после добавления раствора для инкубации, при осмоляльности больше или равной 280 мОсмол/кг, в частности, между примерно 280 и примерно 380 мОсмол/кг, предпочтительно между примерно 290 и примерно 330 мОсмол/кг. Инкубацию, в частности, выполняют в течение периода долее или равным 30 минутам, в частности, долее или равным 1 часу. Затем удаляют жидкую среду инкубированного раствора, и полученные эритроциты суспендируют в растворе, допускающем инъекцию суспензии пациенту, предпочтительно сохраняющем растворе, допускающем инъекцию суспензии пациенту. Указанная осмоляльность является осмоляльностью раствора, в котором суспендируют эритроциты или осадок в соответствующий момент.
Термин «стабилизированная суспензия эритроцитов» обозначает, в частности, суспензию, имеющую содержание внеклеточного гемоглобина, которое остается меньше или равным 0,2 г/дл до применения суспензии людьми, последнее может происходить, в частности, от 1 до 72 часов после получения партии эритроцитов, включающих активный ингредиент.
Термин «готовая к применению стабилизированная суспензия эритроцитов» обозначает стабилизированную суспензию в растворе, который может быть инъекцирован пациенту, в частности, в консервирующем растворе. Ее гематокрит обычно равен или больше 35%, 40% или 45%.
Термин «осадок эритроцитов» обозначает концентрат эритроцитов, собранных после отделения эритроцитов от жидкой среды, в которой они были ранее суспендированы. Сепарацию можно обеспечить фильтрацией или центрифугированием. Центрифугирование является способом, обычно используемым для такой сепарации. Осадок включает некоторую часть жидкой среды. Как правило, осадок имеет гематокрит, заключенный между 70 и 85%.
Термин «раствор для инкубации» обозначает раствор, в котором эритроциты, инкапсулирующие активный ингредиент, присутствуют во время стадии инкубации. Инкубацию можно выполнять в широком интервале гематокрита, а именно, при гематокрите между 10 и 85%.
Термин «хрупкие эритроциты» обозначает эритроциты, возникающие при процедуре включения, которые, как только суспендированы в консервирующем растворе, могут быть лизированы, когда суспензию хранят при температуре от 2 до 8°С, в частности, через 1-72 часа.
Термин «начальный гематокрит» обозначает гематокрит до потери клеток из-за лизиса хрупких эритроцитов во время инкубации.
Способ может включать, в частности, следующие стадии:
(а) инкапсулирование фермента в эритроцитах, включающее приведение эритроцитов в контакт с гипотонической средой (допускающей раскрытие пор в мембране эритроцитов), контактирование с активным ингредиентом (для возможности введения его в эритроциты), восстановление эритроцитов, в частности, с помощью изотонической или гипертонической среды, преимущественно гипертонической,
(b) получение или приготовление суспензиии или осадка, включающих эритроциты, включающие фермент, и раствор с осмоляльностью больше или равной 280 мОсмол/кг, в частности, от примерно 280 до примерно 380 мОсмол/кг, предпочтительно от примерно 290 до примерно 330 мОсмол/кг,
(с) инкубация осадка или суспензии со стадии (b) как таковых или после добавления раствора для инкубации при осмоляльности больше или равной 280 мОсмол/кг, в частности, от примерно 280 до примерно 380 мОсмол/кг, предпочтительно от примерно 290 до примерно 330 мОсмол/кг, в течение периода больше или равного 30 минутам, в частности, больше или равного 1 часу,
(d) удаление жидкой среды инкубированной суспензии со стадии (с),
(е) суспендирование эритроцитов, полученных на стадии (d), в растворе, допускающем инъекцию суспензии пациенту, предпочтительно консервирующем растворе, допускающем инъекцию суспензии пациенту.
Согласно первому способу, стадия, следующая за инкапсулированием лизисом-восстановлением, а именно стадия (b), включает по меньшей мере 1 цикл промывки, предпочтительно 2 или 3 цикла промывки путем разбавления полученной суспензии или осадка на стадии лизиса-восстановления или стадии (а) в растворе при осмоляльности по меньшей мере большей, чем равной 280 мОсмол/кг, в частности, от примерно 280 до примерно 380 мОсмол/кг, предпочтительно от примерно 290 до примерно 330 мОсмол/кг, и затем получение осадка или суспензии эритроцитов. Этот осадок или эта суспензия включает эритроциты, включающие фермент, и раствор с осмоляльностью больше или равной 280 мОсмол/кг, в частности, от примерно 280 до примерно 380 мОсмол/кг, предпочтительно от примерно 290 до примерно 330 мОсмол/кг. Затем применяют следующие стадии, например, (c), (d) и (е).
Согласно второму способу, на стадии лизиса-восстановления или стадии (а) восстановление эритроцитов с помощью изотоническогой или гипертонической среды дает суспензию эритроцитов, которую затем можно подвергнуть инкубации, например, суспензию со стадии (b), в растворе с осмоляльностью больше или равной 280 мОсмол/кг, в частности, от примерно 280 до примерно 380 мОсмол/кг, предпочтительно от примерно 290 до примерно 330 мОсмол/кг. Иными словами, стадия лизиса-восстановления или стадия (а) включает стадию восстановления эритроцитов, причем суспендированные эритроциты, инкапсулирующие фермент, смешиваются с изотоническоим или гипертоническим раствором для восстановления, преимущественно гипертоническим, с образованием суспензии эритроцитов с осмоляльностью больше или равной 280 мОсмол/кг, в частности, от примерно 280 до примерно 380 мОсмол/кг, предпочтительно от примерно 290 до примерно 330 мОсмол/кг. В этом способе стадия инкубации или стадия (с) включает инкубацию суспензии, возникающей при восстановлении. Инкубацию выполняют в течение периода больше или равного 30 минутам, в частности, больше или равного 1 часу. Затем применяют следующие стадии, например, (d) и (е).
Стадии, следующие за стадией лизиса-восстановления, например, (b)-(е), проводят в условиях, приводящих к лизису хрупких эритроцитов или их большинства, а именно, более 50, 60, 78, 80 или 90% или больше. Для того, чтобы это сделать, возможно воздействовать на период инкубации, температуру инкубации и на осмоляльность раствора, в котором суспендируют эритроциты. Чем выше осмоляльность, тем более длительной может быть инкубация. Таким образом, чем ниже осмоляльность, тем короче может быть инкубация для того, чтобы получить такой же эффект. Также чем выше температура, тем короче может быть время инкубации и наоборот. Последующие один или несколько циклов промывки позволят удалить клеточный дербис и внеклеточный гемоглобин, а также внеклеточный фермент.
Согласно изобретению, цикл промывки включает разбавление суспензии или осаждение эритроцитов и последующее отделение эритроцитов от промывочного раствора. Предпочтительно стадия промывки включает предпочтительно 2 или 3 цикла промывка-отделение. Отделение можно осуществить различными способами, такими как фильтрация и центрифугирование. Центрифугирование предпочтительно.
Инкубация не ограничивается гематокритом суспензии. В связи с этим, инкубировать можно суспензию, имеющую начальный гематокрит обычно от 10 до 85%, в частности, от 40 до 80%. Это также относится к осадку с гематокритом от 70% и, как и к суспензии, с величиной ниже указанной.
Стадия удаления или стадия (d) имеет целью удаление жидкой части суспензии или инкубированного осадка для того, чтобы, в частности, удалить клеточный дербис и внеклеточный гемоглобин, а также, следовательно, внеклеточный фермент.
Согласно первому способу, в случае стадии удаления или стадии (d) выполняют сепарацию, в частности, центрифугирование, причем это применимо именно к суспензии. За такой сепарацией могут следовать один или несколько, например, 2 или 3, цикла промывки путем разбавления в изотоническом растворе и последующая сепарация, в частности, путем центрифугирования.
Согласно второму способу, в случае стадии удаления или стадии (d) выполняют разбавление перед сепарацией, в частности, центрифугирования, причем это применимо к суспензии или к осадку. Разбавление можно выполнить, в частности, изотоническим раствором для промывки или сохраняющим раствором.
Конечная стадия или стадия (е) заключается в получении конечной суспензии, такой, которую можно вводить пациенту без какой-либо другой обработки.
Согласно первому способу, в случае этой стадии разбавление осадка эритроцитов со стадии удаления или стадии (d) выполняют раствором для инъекции, в частности, сохраняющим раствором.
Согласно второму способу, в случае этой стадии выполняют один или несколько циклов промывки осадка эритроцитов, образовавшегося на стадии удалении или стадии (d), раствором для инъекции, в частности, сохраняющим раствором, путем разбавления с последующей сепарацией. После промывки эритроциты снова суспендируют в растворе для инъекции, в частности, в консервирующем растворе.
Способ по изобретению также может включать одну, несколько или все следующие особенности:
- стадию инкубации или стадию (с) выполняют при температуре, составляющей от примерно 2 до примерно 39°С, в течение времени, достаточного для обеспечения лизиса хрупких эритроцитов;
- стадию инкубации или стадию (с) выполняют при низкой температуре, а именно, составляющей от примерно 2 до примерно 10°С, в частности, от примерно 2 до примерно 8°С, и продолжают в течение примерно 1 часа – примерно 72 час, в частности, от примерно 6 час до примерно 48 час, предпочтительно от примерно 19 час до примерно 30 час;
- стадию инкубации или стадию (с) проводят при более высокой температуре, составляющей от примерно 20 до примерно 39°С, в частности, при комнатной температуре (25°С ± 5°С), и продолжают в течение от примерно 30 мин до примерно 10 час, в частности, от примерно 1 часа до примерно 8 час, предпочтительно от примерно 2 час до примерно 4 час; можно работать даже при более высокой температуре, чем комнатная, но это может имеет негативное влияние на выход клеток, Р50 и/или содержание 2,3 DPG;
- на стадии инкубации или стадии (с) суспензия находится при начальном гематокрите, заключенном между 10 и 85%, в частности, между 40 и 80%; можно инкубировать осадок после сепарации, имеющий гематокрит, например, от 70 до 85%, или разбавленный осадок, имеющий гематокрит, заключенный между примерно 40 и 70%;
- стадия инкубации включает перемешивание суспензии;
- стадия инкубации не включает какое-либо перемешивание;
- в качестве раствора для промывки и/или инкубации используют отмеренное количество водного раствора NaCl для получения желательной осмоляльности; так, например, раствор может включать 0,9% NaCl; этот раствор также может включать, например, кроме NaCl, глюкозу, в частности, моногидрат глюкозы, дигидрат мононатрийфосфата, додекагидрат динатрийфосфата; как пример, композиция включает 0,9% of NaCl, 0,2% моногидрата глюкозы, 0,034% дигидрата мононатрийфосфата, 0,2% додекагидрата динатрийфосфата;
- промывку на конечной стадии или стадии (е) выполняют консервирующим раствором;
- осмоляльность раствора (жидкой части) в готовой для применения суспензии или суспензии, которую можно инъецировать пациенту, заключается между примерно 280 и примерно 380 мОсмол/кг, предпочтительно между примерно 290 и 330 мОсмол/кг;
- гематокрит готовой для применения суспензии или суспензии, которую можно инъецировать пациенту, равен или больше 35%, 40% или 45%;
- все стадии промывки и инкубации выполняют с консервирующим раствором;
- раствор для промывки на стадии (b) и/или раствор для промывки на стадии (е) и консервирующий раствор– все имеют один и тот же состав и включают соединение(я), промотирующее(ие) сохранение эритроцитов;
- консервирующий раствор (и раствор(ы) для промывки или растворы для инкубации, при необходимости) представляет собой водный раствор, включающий NaCl, аденин и по меньшей мере одно соединение из числа глюкозы, декстрозы и маннита;
- консервирующий раствор (и раствор(ы) для промывки или для инкубации, при необходимости) включает NaCl, аденин и декстрозу, предпочтительно среду AS3;
- консервирующий раствор (и раствор(ы) для промывки или для инкубации, при необходимости) включает NaCl, аденин, глюкозу и маннит, предпочтительно SAG-маннит или среду ADsol.
Способы по изобретению, в частности, включают следующую стадию:
(а) инкапсулирование фермента в эритроциты, включающее контактирование с гипотонической средой, допускающей открытие пор в мембране эритроцитов, контактирование с ферментом для того, чтобы позволить ему войти в эритроциты, восстановление эритроцитов с помощью изотонической или гипертонической среды. Следует отметить, что фермент может присутствовать в суспензии эритроцитов до лизиса последних или также может быть добавлен во время лизиса или после лизиса, но всегда до восстановления. В одном воплощении этой стадии (а) способ включает следующие субстадии:
(а1) наличие суспензии эритроцитов с гематокритом, равным или больше 60 или 65%,
(а2) измерение осмотической хрупкости эритроцитов в этой суспензии,
(а3) процедура лизиса и интернализации активного(ых) ингредиента(ов), включающая пропускание суспензии эритроцитов через устройство для диализа, в частности, картридж для диализа, в направлении, обратном раствору для лизиса, причем регулируют поток суспензии эритроцитов или регулируют скорость потока раствора для лизиса или регулируют осмоляльность раствора для лизиса в зависимости от осмотической хрупкости, измеренной на (а2),
(а4) процедура восстановления эритроцитов.
Определения, данные в настоящем описании выше в разделах «Аргигиндеиминаза», «Фармацевтические композиции или суспензии», «Терапевтическое применение» и «Дозы», такие как «эритроциты», «уровень гематокрита», «аргинидеиминаза», применяют mutatis mutandis в разделе «Способы инкапсулирования».
Во всей настоящей заявке особенности, описанные в одном разделе, полностью применимы в других разделах настоящего описании. Например, описание, относящееся к «аргинидеиминазе», данное в разделе «Аргигиндеиминаза», полностью применимо к разделу, названному «Фармацевтические композиции или суспензии», разделу, названному «Терапевтические методы и применения», разделу «Способы инкапсулирования» и разделу «Дозы».
Во всей настоящей заявке термин «и/или» является грамматической конструкцией, которую можно интерпретировать как означающую, что может происходить один или несколько случаев, если они связаны. Например, словосочетание «безбелковая диета и/или лекарства поглотители азота» в выражении «выходы обычно плохие с безбелковой диетой и/или лекарствами поглотителями азота» показывает, что выходы обычно плохие для индивидуума, которого лечат с помощью или безбелковой диеты, или лекарств поглотителей азота или их комбинацией, т.е., безбелковой диетой и лекарствами поглотителями азота.
Во всей настоящей заявке термин «включение» следует интерпретировать как охватывающий все конкретно упомянутые особенности, а также необязательные, дополнительные, неконкретизированные. При использовании в настоящем описании использование термина «включение» также раскрывает воплощение, в котором нет иных особенностей, чем конкретно упомянутые особенности (т.е., «состоит из»). Кроме того, указание единственного числа не исключает числа множественного. Простой факт, что некоторые критерии перечисляются во относительно друг друга различных зависимых пунктах формулы изобретения, не указывает, что комбинация этих критериев не может быть использована с пользой.
Далее изобретение будет описываться подробнее с обращением к описанным далее фигурам и примерам. Вся литература и патентные документы, цитированные в настоящем описании, включены в настоящее описание в качестве ссылок. Поскольку изобретение поясняется и описывается подробно в предшествующем описании, примеры должны рассматриваться как пояснительные или иллюстративные, но не как ограничивающие.
Краткое описание последовательностей
SEQ ID NO: 1 показывает аминокислотную последовательность полноразмерной аргининдеиминазы из Mycoplasma arginini, которая доступна из базы данных NCBI под инвентарным номером WP_004416214.1.
ФИГУРЫ
Фигура 1. Схематическое представление цикла мочевины, показывающее роль ферментов (NAGS, CPS1, ASS1, ASL, ARG1, OTC) и транспортеров (ORNT1 и цитрин) в конверсии азота аммиака в мочевине.
Фигура 2. График, представляющий фармакокинетику (РК) меченных CFSE эритроцитов, инкапсулирующих ADI. Продукт ERY-ADI 6 получают лизисом-восстановлением суспензии, содержащей 5 мг/мл ADI. Флуоресцентное мечение продуктов (CFSE) позволяет отследить эритроциты in vivo. Продукт, инъецированный внутривенно мышам C57BL/6 (8 мл/кг), имеет превосходную устойчивость с установленным периодом полувыведения от 18 до 22 дней после его введения.
Фигура 3. График, представляющий фармакодинамику эритроцитов, инкапсулирующих ADI, в течение 16 дней. Продукт ERY-ADI 6 получают лизисом-восстановлением суспензии, содержащей 5 мг/мл ADI. Продукт вводят внутривенно (IV) мышам C57BL/6 (8 мл/кг). Уровень L-аргинина в плазме измеряют ВЭЖХ-МС-МС. Уровень L-аргинина у необработанных мышей C57BL/6 оценивают как составляющий от 75 до 125 мкМ. Продукт ERY-ADI 6 ведет к быстрому снижению через 15 мин после введения, снижая уровня L-аргинина до 0 мкМ в течение 13 дней. В день 16 две из трех мышей показывают полное истощение L-аргинина в плазме. L-Аргинин в плазме у третьей мыши составляет 13 мкМ. Средний уровень L-аргинина в плазме для этой группы мышей в день 16 составляет 4,33 ± 7,51 мкМ.
Фигура 4. График, представляющий уровень L-аргинина в крови у мышей с недостаточностью аргиназы после одного внутривенного введения эритроцитов, инкапсулирующих ADI. Продукт ERY-ADI 4 получают лизисом-восстановлением суспензии, содержащей 4,5 мг/мл ADI. В качестве контроля способом лизиса-восстановления без фермента ADI получают продукт (ненагруженные эритроциты), названный pRBC (переработанные красные клетки крови). В день 0 два продукта вводят внутривенно мышам с недостаточностью аргиназы (4 или 8 мл/кг в случае ERY-ADI 4 и 8 мл/кг в случае pRBC). Образцы крови у всех мышей берут в день 0 (до введения ERY-ADI 4 или pRBC), день 1 и день 3. Когда вводят ERY-ADI 4 в дозе 4 мл/кг, L-аргинин в крови снижается на 60% и на 7% в 1 и 3 дни после инъекции, соответственно. Когда вводят двойную дозу ERY-ADI 4 (8 мл/кг), эффективность эритроцитов, инкапсулирующих ADI, в отношении патологического уровня L-аргинина в крови является впечатляющей; на другой день после инъекции уровень L-аргинина более, чем в 10 раз ниже базовой концентрации L-аргинина у этой мышиной модели (35 ± 22 мкМ против 452 ± 45 мкМ, что соответствует снижению в крови на 92%). Через три (3) дня после введения продукта ERY-ADI 4 уровень L-аргинина в крови еще в 4 раза ниже, чем биохимический уровень при этой патологии (119 ± 57 мкМ против 452 ± 45 мкМ, что соответствует снижению в крови на 73%). Однако, когда вводят ненагруженные эритроциты (pRBC), снижение уровня L-аргинина в крови не наблюдают. Напротив, уровень L-аргинина в крови еще повышается, что показывает, что ненагруженные эритроциты не действуют на биохимическое течение заболевания.
Фигура 5. График, представляющий уровень аммиака в крови у мышей с недостаточностью аргиназы после внутривенного введения одной дозы эритроцитов, инкапсулирующих ADI. Продукт ERY-ADI 4 получают лизисом-восстановлением суспензии, содержащей 4,5 мг/мл ADI. В качестве контроля способом лизиса-восстановления без фермента ADI получают продукт (ненагруженные эритроциты), названный pRBC (переработанные красные клетки крови). В день 0 два продукта вводят внутривенно мышам с недостаточностью аргиназы (4 или 8 мл/кг в случае ERY-ADI 4 и 8 мл/кг в случае pRBC). Образцы крови у всех мышей берут в день 0 (до введения ERY-ADI 4 или pRBC) и день 3 для анализа на сывороточный аммиак. Анализируют сывороточный аммиак, так как конверсия L-аргинина ADI приводит к образованию цитруллина и аммиака. Не наблюдают заметных изменений уровней аммиака, когда мышей обрабатывают эритроцитами, инкапсулирующими ADI, или ненагруженными эритроцитами.
Фигура 6. График, представляющий уровни L-аргинина в крови у мышей с недостаточностью аргиназы после введений ERY-ADI один раз (группа 2), дважды (группа 3) или свободной формы фермента ADI (группа 4).
Фигура 7. График, представляющий уровни L-аргинина в крови у мышей с недостаточностью аргиназы после введений Mock RBC (группа 1), ERY-ADI один раз (группа 2) и дважды (группа 3).
ПРИМЕРЫ
Пример 1. Способ получения и характеризация аргининдеиминазы
Получение штамма и выделение гиперпродуцирующего клона. Природную последовательность ADI из Mycoplasma arginini (GenBank: X54141) оптимизируют путем модификации некоторых кодонов, поскольку генетические коды E. coli и M. arginini различные (создают новую плазмиду, кодированную C1124-ADM-02). Способ очистки описан Misawa с сотр. (Misawa S. et al, 1994, J. of Biotechnol., 36, 1994, 145-155) с некоторыми модификациями, т.е., используют бактериально полученный штамм HMS174 (DE3) T1R вместо штамма JM101. Другие модификации описаны ниже.
Ферментация
Получение достигают в ферментере с партией среды FED_Coli_9 при перемешивании, регулируемом давлении и рН из предварительной культуры 2 при оптической плотности 0,05. Фаза роста (при 37°C) происходит до тех пор, пока не получат оптическую плотность (600 нм) 100, и индукцию экспрессии достигают при 32°C путем добавления в культуральную среду 1 мM IPTG. Клеточный осадок собирают через 26-27 час после индукции в два этапа: культуральную жидкость с клетками концентрируют 5-10 раз после пропускания через полое волокно 500 кДа, затем клеточный осадок извлекают центрифугированием при 15900 × g и затем хранят при -20°C.
Очистка
ADI получают как тельца включения (IB). Клеточные осадки для разрушения клеток суспендируют в буфере для лизиса. Затем разрушенные клетки промывают, собирают IB, и хранят IB при -20°C.
Очистку ADI начинают с оттаивания осадка IB в буфере, состоящем из 50 мМ основания трис, pH 8,5, 6 M гидрохлорида гуанидиния, 10 мМ дитиотреитола. Солюбилизации достигают со временем инкубации 1 час при 37 ± 2°C. После очистки происходит стадия рефолдинга в течение 40-45 часов при комнатной температуре в буфере, состоящем из 3 мM монокалийфосфата (KH2PO4), 7 мM дикалийфосфата (K2HPO4), pH 7,35. После второй стадии очистки среду загружают в колонку с Q-сефарозой. Выполняют элюирование 250 и 500 мM NaCl, и элюированную фракцию подвергают тангенциальной поточной фильтрации (TFF). Две стадии улучшения (с использованием колонки с Sartobind Q) и две стадии TFF завершают очистку ADI. Перед хранением of ADI при -20°C выполняют конечную фильтрацию (0,2 мкМ).
Определение свойств. Определяют удельную активность фермента путем измерения образовавшегося цитруллина, как описано в примере 2. Содержание белка определяют регистрацией поглощения при 280 нМ. Чистоту определяют SDS-PAGE. Осмолярность измеряют осмометром (микроосмометр Loser, тип 15). Основные свойства одной полученной партии ADI суммируются в настоящем описании ниже в таблице 2.
Таблица 2. Основные свойств одной полученной партии ADI
Пример 2. Анализ ADI на удельную активность с использованием измерения цитруллина
Этот анализ основан на 2-стадийной реакции (Boyde and Rahmatullah, 1980, Analytical Biochemistry, vol. 107, p 424-431):
- первая – L-аргинин превращается ADI в цитруллин и аммиак;
- вторая – в присутствии диацетилмонооксима хлорида железа (III), тиосемикарбазида, серной и фосфорной кислот цитруллин превращается в окрашенный хромофор, регистрируемый при 530 нм.
Получают стандартную кривую L-цитруллина для определения ферментативной активности всех анализируемых образцов, считывая поглощение при 530 нм. Удельную активность (Е/мг) вычисляют с использованием ферментативной активности (Е/мл) и содержания белка (мг).
Пример 3. Инкапсулирование ADI в мышиных эритроцитах
Цельную кровь мышей C57BL/6 (Charles River) центрифугируют при 1000 × g в течение 10 мин при 4°C для удаления плазмы и лейкоцитной пленки. Эритроциты промывают три раза 0,9% NaCl (об.:об.). Замороженную ADI оттаивают и добавляют к суспензии эритроцитов для того, чтобы получить конечную суспензию с гематокритом 65%, содержащую начальную концентрацию ADI 2-7 мг/мл.
Затем суспензию загружают в гемодиализатор при скорости потока 120 мл/час и проводят диализ против гипотонического раствора (40-50 мОсмол/кг) при скорости потока 15 мл/мин как противотока. Затем суспензию восстанавливают гипертоническим раствором (1600-2100 мОсмол/кг) и затем инкубируют в течение 30 мин при 37°С. После трех промывок в 0,9% NaCl, 0,2% глюкозы, суспензию помещают в консервирующий раствор AS3 с добавлением 20% плазмы с удаленным комплементом.
Полученные продукты характеризуют в момент времени D0 (в пределах 2 час после их получения) и в момент времени D1 (т.е., после ~18 час – 24 час хранения при 2-8°C). Гематологические характеристики получают с помощью автоматической ветеринарной установки (Sysmex, PocH-100iV).
Результаты
Активность ADI в конечных продуктах анализируют способом, описанным в примере 4, против внешнего диапазона калибровки ADI в водном растворе. Эти результаты показывают, что активность ADI в конечных продуктах возрастает с количеством фермента, внедренного в RBC, и что можно легко инкапсулировать до 2 мг ADI на мл конечного продукта, сохраняя в то же время хорошую устойчивость. Основные характеристики 6 различных партий мышиных продуктов ERY-ADI (ERY-ADI 1 – 6) приводятся в данном описании ниже в таблице 3.
Таблица 3. Основные характеристики 6 различных партий конечных продуктов мышиных ERY-ADI, измеренные в момент времени D0 (2 часа после получения)
Пример 4. Анализ инкапсулированной ADI в эритроцитах
Анализ активности ADI, захваченной красными клетками крови, и в супернатантах основан на измерении NH3, продуцированного ADI из L-аргинина. Ионы NH3 анализируют косвенно по ферментативному действию глутаматдегидрогеназы (GLDH) в соответствии с набором, продаваемым Roche Diagnostics (11877984).
Пример 5. Фармакокинетика эритроцитов, инкапсулирующих ADI, на мышах C57BL/6
Мышиный продукт ERY-ADI 6 метят CFSE (флуоресцентный) и вводят внутривенно мышам C57BL/6. В каждый момент времени (D0 + 15 мин, D0 + 6 час, D1, D2, D5, D9, D13 и D16) умерщвляют 3 мышей, собирают кровь в пробирку с гепаринатом лития и держат при +4°C, оберегая от света, для определения фармакокинетики. Пропорцию меченных CFSE красных клеток крови в цельной крови определяют методом проточной цитометрии. Пять микролитров цельной крови разбавляют в 1 мл PBS, 0,5% BSA, и каждый образец проводят трижды (отсчитывая 10000 клеток в FL-1; цитометр FC500, Beckman Coulter). Оценку выживания красных клеток крови, нагруженных ADI, получают путем добавления части эритроцитов, нагруженных ADI, меченных CFSE, в различные моменты времени к части эритроцитов, нагруженных ADI, меченных CFSE, в T0 + 15 мин (контроль, 100%). Различные проценты, полученные для каждого момента времени, указаны на графике, изображенном на фигуре 2, причем таким образом иллюстрируется доля нагруженных ADI эритроцитов в кровообращении со временем.
На основании вычисления периода полувыведения, меченные CFSE эритроциты, инкапсулирующие ADI, имеют период полувыведения от 18 до 22 дней.
Пример 6. Фармакодинамика эритроцитов, инкапсулирующих ADI, на мышах C57BL/6
Продукт ERY-ADI 6 эритроцитов, инкапсулирующих фермент ADI, инъецируют внутривенно мышам C57BL/6 в дозе 8 мл/кг. В каждый момент времени (D0 + 15 мин, D0 + 6 час, D1, D2, D5, D9, D13 и D16) умерщвляют 3 мышей, собирают кровь в пробирки с гепаринатом лития и хранят при +4°C для определения уровней L-аргинина в плазме.
Как видно на фигуре 3, полное истощение L-аргинина в плазме наблюдают в течение 13 дней сразу же (т.е. через 15 минут) после введения эритроцитов, инкапсулирующих фермент ADI. В самый последний момент исследования (т.е., через 16 дней) 2 мыши из 3 отображают полное истощение L-аргинина в плазме. Уровень L-аргинина в плазме у третьей мыши составляет 13 мкМ – значительно ниже, чем физиологическая концентрация L-аргинина в плазме в этом исследовании (100 ± 25 мкМ).
Пример 7. Введение эритроцитов, инкапсулирующих ADI, мышам с недостаточностью аргиназы (1-ое исследование)
Проводят исследование in vivo с помощью мышиной модели недостаточности аргиназы (полное описание см. в Sin et al., 2013, PLOS One, vol. 8 (11)). Эти мыши лишены активности аргиназы 1 и проявляют тяжелые патобиохимические аспекты гипераргининемии, обычно видимые у людей. Гипераргининемия (или недостаточность аргиназы) запускается 5 инъекциями тамоксифена. Концентрации аргинина в крови начинают возрастать через несколько дней после последней инъекции тамоксифена. Для того, чтобы показать эффективность мышиного продукта ERY-ADI 4 для снижения уровня L-аргинина в крови на этой мышиной модели, ERY-ADI 4 (4 и 8 мл/кг) и ненагруженные эритроциты (8 мл/кг) инъецируют внутривенно 15 мышам с недостаточностью аргиназы через 7 дней после последней инъекции тамоксифена. Кровь собирают в день (D1) и двумя днями позднее (D3) после введения трех продуктов. Результаты этого исследования in vivo представлены на фигурах 4 и 5 и в таблице 4 ниже.
Таблица 4. Сводка результатов исследования in vivo ERY-ADI 4 на мышиной модели недостаточности аргиназы. Показано, в %, снижение уровней аргиназы в крови. Отрицательные числа показывают возрастание уровней аргинина
Как видно из этой таблицы и на фиг.4, эритроциты, инкапсулирующие ADI, когда введены в дозе 4 мл/кг, снижают L-аргинин в крови на 60% и на 7% в 1 и 3 дни после инъекции, соответственно. Когда вводят двойную дозу (8 мл/кг), действие эритроцитов, инкапсулирующих ADI, на патологический уровень L-аргинина в крови впечатляющее; на следующий день после инъекции уровень L-аргинина у этой мышиной модели больше, чем в 10 раз ниже, чем базовая концентрация L-аргинина (35 ± 22 мкМ против 452 ± 45 мкМ, что соответствует снижению в крови на 92%). Через три (3) дня после введения продукта ERY-ADI 4 уровень L-аргинина в крови все еще в 4 раза ниже, чем патобиохимический уровень (119 ± 57 мкМ против 452 ± 45 мкМ, что соответствует снижению в крови на 73%). Однако, когда вводят ненагруженные эритроциты, снижение L-аргинина в крови не наблюдают. Напротив, уровень L-аргинина в крови еще повышается, показывая, что ненагруженные эритроциты не оказывают действия на биохимическое течение заболевания.
В то же время анализируют сывороточный аммиак, так как конверсия L-аргинина ADI приводит к образованию цитруллина и аммиака. Как видно на фигуре 5, не наблюдают заметных изменений уровней аммиака, когда мышей обрабатывают эритроцитами, инкапсулирующими ADI, или ненагруженными эритроцитами.
Пример 8. Введение эритроцитов, инкапсулирующих ADI, мышам с недостаточностью аргиназы (второе исследование)
Для того чтобы подтвердить, что мышиный продукт ERY-ADI снижает уровень L-аргинина в крови на этой мышиной модели, проводят второе исследование на мышах, обработанных тамоксифеном согласно примеру 7. Продукт ERY-ADI инъецируют внутривенно через 3 дня после последней инъекции тамоксифена. Планируют одно или два внутривенных введения ERY-ADI (по 8 мл/кг) (группы 2 и 3 соответственно). Контрольной группе вводят свободную форму фермента ADI (группа 4). Частью исследования является вторая контрольная группа, состоящая из мышей с аргиназной активностью (группа 1).
Кровь собирают в день (D3) и неделей позднее (день 10). В день умерщвления мышей также собирают кровь (день 13).
Результаты второго исследования in vivo представлены на фигуре 6.
Во-первых, уровни аргинина в крови в этом втором исследовании ниже, поскольку авторы изменили схему, относящуюся к инъекциям тамоксифена. В этом исследовании введение ERY-ADI запланировано через 3 дня вместо 7 дней после последней инъекции тамоксифена, что приводит к более низкому базовому уровню аргинина в крови.
Как видно на фигуре 6, эритроциты, инкапсулирующие ADI, когда вводятся в дозе 8 мл/кг, снижают уровень L-аргинина в крови на 81% и 77% по сравнению с базовыми уровнями для групп 2 и 3, соответственно, в день 10 (т.е., через 7 дней после введения). Второе введение ERY-ADI планировалось после сбора крови в день 10. Через десять (10) дней после введения снижение аргинина в крови все еще весьма значительное с процентами снижения приблизительно 82% и 68% для группы 2 и группы 3, соответственно, по сравнению с базовыми уровнями. Напротив, не наблюдают снижения аргинина в крови у мышей, инъецированных свободной формой ADI в день 10 (группа 4). Напротив, концентрация аргинина в крови достигает 349 мкМ, отражая возрастание уровня аргинина в крови у мышиной модели недостаточности аргиназы. Нельзя было измерить уровень L-аргинина в крови в день 13 в группе 4, так как все животные погибли до 2-ой инъекции свободной формы ADI.
Втрое исследование подтвердило результаты, полученные в первом исследовании, с некоторыми дополнительными сведениями о фармакокинетике продукта ERY-ADI, когда его вводили мышам с недостаточностью аргиназы. Одно единственное введение позволяет снизить аргинин в крови в течение по меньшей мере 10 дней, и вторая инъекция продукта ERY-ADI не приводит к какому-либо побочному действию на этой мышиной модели.
Пример 9. Введение эритроцитов, инкапсулирующих ADI, мышам с недостаточностью аргиназы (третье исследование)
Так как не наблюдали выживания, когда введение ERY-ADI выполняли через 3 дня после последней инъекции тамоксифена, запланировано третье исследование с важным изменением в схеме введения. ERY-ADI инъецируют внутривенно в день перед первой инъекцией тамоксифена (день 0). В этом исследовании последнюю инъекцию тамоксифена выполняют в день 5. Планируют одно или два внутривенных введения ERY-ADI (группы 2 и 3, соответственно). Группа 1 является контрольной группой, состоящей из мышей с недостаточностью аргиназы, которым вводят пустые эритроциты (RBC) (т.е., переработанные RBC без ADI). Кровь собирают в день 0, день 11, день 14 (перед вторым введением ERY-ADI), и когда мышей умерщвляют в отношении потери избыточной массы тела (идентифицируют как «окончание исследования»).
Как видно на фигуре 7, эритроциты, инкапсулирующие ADI, когда вводятся в дозе 8 мл/кг, снижают L-аргинин в крови на 71,4% и 78,7%, по сравнению с уровнями в группе 1, в группах 2 и 3, соответственно, в день 11 (т.е., через 11 дней после введения). В день 14 перед вторым введением ERY-ADI (только для группы 3) общий аргинин в крови все еще снижен на 27,3% и 29,3% в группах 2 и 3, соответственно, по сравнению с группой 1. Напротив, не наблюдают снижения аргинина в крови у мышей, инъецированных пустыми RBC (группа 1). В этой группе общая концентрация аргинина в крови достигает 844 мкМ в конце исследования, что отражает повышение общего аргинина в крови у этой мышиной модели недостаточности аргиназы.
Когда ERY-ADI повторно инъецируют в день 14 (группа 3), уровень общего аргинина в крови измеряют несколькими днями позднее, на время умерщвления по этическим соображениям (идентифицируют как «окончание исследования»). Аргинин в крови еще снижается после второго введения ERY-ADI, но мышей с недостаточностью аргиназы должны умерщвлять из-за значительной потери массы тела.
Это третье исследование подтверждает результаты первых двух исследований с некоторыми дополнительными сведениями о фармакодинамике продукта ERY-ADI при инъецировании мышам с недостаточностью аргиназы. Одно введение дает снижение аргинина в крови у этой мышиной модели в течение по меньшей мере 11 дней, и вторая инъекция ERY-ADI дает продленное снижение аргинина в крови в течение по меньшей мере 17 дней (продолжительность жизни первой мыши, которую умертвили по этическим соображениям).
Однако из-за жестокости этой мышиной модели выживание не наблюдают после 15 дней после последней инъекции тамоксифена, какое-бы число введений ERY-ADI не выполняли.
Пример 10. Получение красных клеток крови человека, инкапсулирующих аргининдеиминазу
Мешок (pouch) лишенных лейкоцитов человеческих RBC (предоставленных “Etablissement français du sang”) подвергают трем промывкам 0,9% NaCl. Раствор аргининдеиминазы (ADI) аккуратно оттаивают и добавляют к суспензии RBC, и получают конечную концентрацию с гематокритом 60%, с содержанием 3 или 5 мг/мл ADI. Суспензию гомогенизируют, загружают в гемодиализатор при скорости потока 90 мл/час и диализуют против гипотонического раствора при 30 мОсмол/кг. Затем суспензию восстанавливают гипертоническим раствором и затем инкубируют в течение 30 минут при 30°C. После 3 промывок в 0,9% NaCl, 0,2% глюкозы, суспензию помещают в консервирующий раствор AS3 (NaCl, NaH2PO4, лимонная кислота, Na-цитарат, аденин и глюкоза, осмоляльность 288 мосм/кг и pH 5,88). Полученные продукты характеризуют в день 0, день 1 и день x. Гематологические характеристики получают с помощью ветеринарной автоматической установки (Sysmex, PocH-100iV).
Важно отметить, что в раскрытые композиции и суспензии RBC-инкапсулированная аргининдеиминидаза (ADI) не добавляют (или в этом нет необходимости) магний, железо или другие кофакторы фермента. В отличие от препаратов некапсулированной ADI, которые могут использовать магний или другие кофакторы, присутствующие в кровотоке субъекта, ADI по настоящему раскрытию, как правило, ограниваются тем, что содержится в RBC. Для того, чтобы решить эту проблему, Заявитель специально выбрал независимую от кофакторов ADI (например, M. arginini) для гарантии длительной in vivo активности ADI, без необходимости добавлять продукты с магнием или другим кофактором. Заявитель представляет, что можно эффективно использовать другие независимые от кофакторов ADI при практическом использовании раскрытого изобретения.
При использовании в настоящем описании «независимая от кофакторов ADI» обозначает ADI, которая не зависит от кофакторов фермента, таких как витамины, провитамины, предшественники витаминов или ионы металлов (например, магния, железа, марганца и т.д.). При использовании в настоящем описании «магнийнезависимая ADI» обозначает ADI, которая не зависит от магния для поддержания своей ферментативной активности.
Результаты. Гематологические и биохимические характеристики 6 конечных продуктов в день 0 (день изготовления) собраны ниже в таблице 5: три изготовлены с концентрацией ADI 3 мг/мл и три с концентрацией ADI 5 мг/мл, выраженной в отношении суспензии RBC до диализа. Все продукты ERY-ADI получают из одной и той же партии ADI. Устойчивость in vitro оценивают в день 0, день 1 (таблица 6) и день 7 (таблица 7).
Таблица 5. Гематологические и биохимические характеристики ERY-ADI для VI (день 0)

Независимо от концентрации ADI перед захватом, выход захвата хорошо воспроизводится (от 27,3 до 33,7%).
Таблица 6. Гематологические и биохимические характеристики ERY-ADI для VI (день 1)

Таблица 7. Гематологические и биохимические характеристики ERY-ADI для VI (день 7)

Захват аргининдеиминазы человеческими красными клетками крови оказывается хорошо воспроизводимым процессом. Основные параметры устойчивы в день 0 и день 1 (например, внеклеточный гемоглобин, внеклеточная и внутриклеточная активность фермента, гематокрит, объем тельца). В день 7 измеренные параметры показывают, что продукт ERY-ADI очень устойчив in vitro, независимо от концентрации ADI, добавленной перед процессом захвата (внедрения).
Вывод. Аргининдеиминазу (ADI; EC номер 3.5.3.6), захваченную красными клетками крови (RBC), получают с использованием запатентованной Erytech технологической платформы ERYCAPS®. Захват терапевтических ферментов красными клетками крови может обеспечить длительную терапевтическую активность с пониженной токсичностью.
Внедрение аргининдеиминазы в красные клетки крови (продукт ERY-ADI) существенно улучшает фармакологические свойства фермента, снижение L-аргинина в плазме полное за 15 минут после введения и длится в течение 13 дней.
Инъецированный мышам с недостаточностью аргиназы ERY-ADI показывает впечатляющую эффективность в отношении очень высоких концентраций L-аргинина в крови, которую показывают эти мыши. Действительно, через 24 часа после введения концентрация L-аргинина в крови снижается на 52 и 92%, когда инъецируют 4 или 8 мл/кг, соответственно. Через три дня после введения уровень L-аргинина в крови остается сниженным на 19 и 73%. Кроме того, несмотря на продуцирование аммиака аргининдеиминазой, сывороточный уровень остается сравнимым с уровнем контроля ненагруженных RBC.
Такие результаты подтверждаются во втором исследовании, в котором одно введение дает снижение аргинина в крови в течение по меньшей мере 10 дней, и вторая инъекция ERY-ADI хорошо переносится мышами с недостаточностью аргиназы.
Внедрение аргининдеиминазы в красные клетки крови человека выполняется успешно с хорошей воспроизводимостью и устойчивостью in vitro.
На основании таких результатов ERY-ADI представляется способным противодействовать первичному биохимическому нарушению редкому генетическому заболеванию недостаточности аргиназы.
Теперь изобретение будет описываться в следующих далее нумерованных абзацах.
1. Фармацевтическая композиция, включающая аргининдеиминазу (ADI), инкапсулированную в эритроцитах, и, необязательно, фармацевтически приемлемый носитель, для применения при лечении недостаточности аргиназы-1, причем предпочтительно композиция способна снижать патологические уровни аргинина в плазме или цельной крови у пациента или субъекта, страдающего от недостаточности аргиназы-1 (Arg1), до нормальных физиологических или почти физиологических уровней аргинина в плазме или цельной крови, причем предпочтительно композиция способна снижать патологические уровни аргинина по меньшей мере примерно на 20, 30, 40, 50, 60, 70 или примерно 80% в течение периода по меньшей мере примерно 6, 7, 8, 9, 10 или 11 дней после введения одной дозы композиции;
причем необязательно ADI является одной, любой комбинацией или всеми из следующих ADI: независимая от кофакторов, магнийнезависимая, железонезависимая, независимая от витаминов, независимая от провитаминов; и
причем необязательно композиция характеризуется любым или всеми из следующих интервалов величин указанных параметров:
гематокрит (%): примерно 48 – примерно 51;
объем тельца (фл): примерно 82 – примерно 88;
гемоглобин телец (г/дл): примерно 72 – примерно 30;
число эритроцитов (106/мкл): примерно 5,5 – примерно 6,2;
общий гемоглобин (г/дл): примерно 13,0 – примерно 14,5;
внеклеточный Hb (г/дл): примерно 0,1 – примерно 0,2;
концентрация ADI в эритроцитах (мг/мл RBC): примерно 0,8 – примерно 1,6;
активность ADI в эритроцитах (Е/мл): примерно 42 – примерно 49 или примерно 65 – примерно 74;
внеклеточная активность (%): примерно 0,0 – примерно 4,0;
внутриклеточная активность (%): примерно 96 – примерно 100; и/или
выход захвата ADI (%): примерно 27 – примерно 34.
2. Фармацевтическая композиция для применения согласно абзацу 1, причем указанная композиция представляет собой суспензию, имеющую осмолярность от 270 до 350 мОсм/л.
3. Фармацевтическая композиция для применения согласно абзацу 1 или 2, причем фармацевтически приемлемый носитель представляет собой консервирующий раствор, включающий NaCl и аденин.
4. Фармацевтическая композиция для применения согласно любому из абзацев 1-3, причем указанная ADI является ADI из M. arginini.
5. Фармацевтическая композиция для применения согласно любому из абзацев 1-4, причем ADI включает аминокислотную последовательность SEQ ID NO: 1 или ее вариант или фрагмент.
6. Фармацевтическая композиция для применения согласно абзацу 5, причем указанный вариант включает аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности SEQ ID NO: 1.
7. Фармацевтическая композиция для применения согласно абзацам 5 или 6, причем указанный вариант или фрагмент сохраняет биологическую активность ADI, имеющей аминокислотную последовательность SEQ ID NO: 1.
8. Фармацевтическая композиция для применения согласно любому из абзацев 1-7, причем концентрация инкапсулированной ADI составляет от 0,1 до 7 мг/мл.
9. Фармацевтическая композиция для применения согласно любому из абзацев 1-8, причем фармацевтическая композиция упакована в дозе, имеющей объем от 10 до 250 мл.
10. Фармацевтическая композиция для применения согласно абзацу 9, причем количество инкапсулированной ADI в одной дозе для пациента составляет от 0,01 мг/кг до 500 мг/кг инкапсулированной ADI на кг массы тела указанного пациента.
11. Суспензия эритроцитов, инкапсулирующих ADI из M. arginini.
12. Суспензия по абзацу 11, причем указанная ADI включает аминокислотную последовательность SEQ ID NO: 1 или ее вариант или фрагмент.
13. Суспензия по абзацу 12, причем указанный вариант включает аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности SEQ ID NO: 1.
14. Фармацевтическая композиция, включающая суспензию согласно любому из абзацев 11-13, для применения при лечении недостаточности аргиназы-1 или аргининзависимых раковых заболеваний, лечения или предупреждения септического шока, ингибирования ангиогенеза и лечения ангиогенез-ассоциированных заболеваний.
15. Способ лечения недостаточности аргиназы-1 или аргининзависимых раковых заболеваний, лечения или предупреждения септического шока, ингибирования ангиогенеза и лечения ангиогенез-ассоциированных заболеваний, включающий введение пациенту или субъекту, нуждающемуся в этом, композиции или суспензии по любому из абзацев 1-14.
16. Способ снижения патологических уровней аргинина в плазме до нормальных физиологических уровней в плазме у пациента или субъекта, хронически страдающего от указанных патологических уровней аргинина в плазме, включающий стадию введения более одной дозы композиции или суспензии по любому из абзацев 1-14.
17. Способ по абзацу 16, причем патологические уровни аргинина в плазме являются избыточными примерно в 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590 или 600 мкМ.
18. Способ по абзацу 16 или 17, причем пациент или субъект имеет известную мутацию Arg1 или показывает меньше, чем примерно 5% активность аргиназы или по существу отсутствие активности аргиназы.
19. Способ по абзацу 16 или 17, причем патологические уровни аргинина в плазме по меньшей мере примерно в 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или больше раз выше, чем у здоровых субъектов, не страдающих от патологических уровней аргинина в плазме.
20. Способ по любому из абзацев 16-19, причем одной дозы композиции или суспензии достаточно для поддержания непатологических нормальных физиологических уровней аргинина в плазме в течение по меньшей мере примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 недель.
21. Способ по любому из абзацев 16-20, причем для поддержания физиологических уровней аргинина в плазме композицию или суспензию необходимо вводить только один раз каждые 2 недели или один раз каждые 4 недели.
Далее изобретение будет описываться в следующей далее формуле изобретения без ограничений.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ERYTECH PHARMA
<120> Arginine deiminase encapsulated inside erythrocytes and their use
in treating Cancer and Arginase-1 Deficiency
<130> BET 17L3041
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 410
<212> PRT
<213> Mycoplasma arginini
<400> 1
Met Ser Val Phe Asp Ser Lys Phe Lys Gly Ile His Val Tyr Ser Glu
1 5 10 15
Ile Gly Glu Leu Glu Ser Val Leu Val His Glu Pro Gly Arg Glu Ile
20 25 30
Asp Tyr Ile Thr Pro Ala Arg Leu Asp Glu Leu Leu Phe Ser Ala Ile
35 40 45
Leu Glu Ser His Asp Ala Arg Lys Glu His Lys Gln Phe Val Ala Glu
50 55 60
Leu Lys Ala Asn Asp Ile Asn Val Val Glu Leu Ile Asp Leu Val Ala
65 70 75 80
Glu Thr Tyr Asp Leu Ala Ser Gln Glu Ala Lys Asp Lys Leu Ile Glu
85 90 95
Glu Phe Leu Glu Asp Ser Glu Pro Val Leu Ser Glu Glu His Lys Val
100 105 110
Val Val Arg Asn Phe Leu Lys Ala Lys Lys Thr Ser Arg Glu Leu Val
115 120 125
Glu Ile Met Met Ala Gly Ile Thr Lys Tyr Asp Leu Gly Ile Glu Ala
130 135 140
Asp His Glu Leu Ile Val Asp Pro Met Pro Asn Leu Tyr Phe Thr Arg
145 150 155 160
Asp Pro Phe Ala Ser Val Gly Asn Gly Val Thr Ile His Tyr Met Arg
165 170 175
Tyr Lys Val Arg Gln Arg Glu Thr Leu Phe Ser Arg Phe Val Phe Ser
180 185 190
Asn His Pro Lys Leu Ile Asn Thr Pro Trp Tyr Tyr Asp Pro Ser Leu
195 200 205
Lys Leu Ser Ile Glu Gly Gly Asp Val Phe Ile Tyr Asn Asn Asp Thr
210 215 220
Leu Val Val Gly Val Ser Glu Arg Thr Asp Leu Gln Thr Val Thr Leu
225 230 235 240
Leu Ala Lys Asn Ile Val Ala Asn Lys Glu Cys Glu Phe Lys Arg Ile
245 250 255
Val Ala Ile Asn Val Pro Lys Trp Thr Asn Leu Met His Leu Asp Thr
260 265 270
Trp Leu Thr Met Leu Asp Lys Asp Lys Phe Leu Tyr Ser Pro Ile Ala
275 280 285
Asn Asp Val Phe Lys Phe Trp Asp Tyr Asp Leu Val Asn Gly Gly Ala
290 295 300
Glu Pro Gln Pro Val Glu Asn Gly Leu Pro Leu Glu Gly Leu Leu Gln
305 310 315 320
Ser Ile Ile Asn Lys Lys Pro Val Leu Ile Pro Ile Ala Gly Glu Gly
325 330 335
Ala Ser Gln Met Glu Ile Glu Arg Glu Thr His Phe Asp Gly Thr Asn
340 345 350
Tyr Leu Ala Ile Arg Pro Gly Val Val Ile Gly Tyr Ser Arg Asn Glu
355 360 365
Lys Thr Asn Ala Ala Leu Glu Ala Ala Gly Ile Lys Val Leu Pro Phe
370 375 380
His Gly Asn Gln Leu Ser Leu Gly Met Gly Asn Ala Arg Cys Met Ser
385 390 395 400
Met Pro Leu Ser Arg Lys Asp Val Lys Trp
405 410
<---
Реферат
Группа изобретений относится к области медицины и фармацевтики. Первое изобретение – применение фармацевтической композиции, включающей инкапсулированную в эритроциты аргининдеиминазу, независимую от ко-фактора, и фармацевтически приемлемый носитель, для лечения недостаточности аргиназы-1. Второе изобретение – применение суспензии эритроцитов, в которые инкапсулирована кофактор-независимая аргининдеиминаза, в лечении недостаточности аргиназы-1 для снижения уровней аргинина в плазме или крови пациента, страдающего от дефицита аргиназы-1, по крайней мере на 50, 60, 70 или 80% в течение по крайней мере 6, 7, 8, 9, 10 или 11 дней после введения. Третье изобретение – способ лечения недостаточности аргиназы-1, включающий введение фармацевтической композиции, включающей аргининдеиминазу, инкапсулированную в эритроциты, и фармацевтически приемлемый носитель. Четвертое изобретение – применение эритроцитов, в которые инкапсулирована аргининдеиминаза, для получения лекарственного средства для лечения недостаточности аргиназы-1. Группа изобретений обеспечивает возможность лечения недостаточности аргиназы-1, приводящего к снижению токсического накопления аргинина и побочных продуктов его метаболизма. 4 н. и 30 з.п. ф-лы, 7 ил., 7 табл., 10 пр.
Формула
Документы, цитированные в отчёте о поиске
Аргининдеиминаза с пониженной перекрестной реактивностью к антителам adi-peg 20 для лечения рака

Комментарии