Применение теней бактерий для опосредованной стимуляции врожденнлго иммунитета - RU2564110C2
Код документа: RU2564110C2
Чертежи









Описание
Область техники
Изобретение имеет отношение к использованию теней бактерий для стимулирования врожденного иммунного ответа.
Известный уровень техники
Иммунная система защищает организм от заболеваний путем распознавания и уничтожения патогенов, таких как бактерии, вирусы и паразитические черви, а также опухолевые клетки. Для распознавания и нейтрализации патогенов сформировались разнообразные механизмы. Типичная иммунная система позвоночных включает в себя несколько линий защиты с возрастающей специфичностью. Самые простые механические барьеры препятствуют попаданию патогенов в организм. Если патоген преодолевает эти барьеры, система врожденного иммунитета обеспечивает незамедлительный, но неспецифический ответ. В случае, когда патогены успешно избегают врожденного иммунного ответа, позвоночные располагают третьим уровнем защиты, системой адаптивного иммунитета, которая активируется под влиянием врожденного иммунного ответа. В этом случае иммунная система «настраивает» (адаптирует) свой ответ в условиях инфекции для улучшения распознавания патогена. После устранения патогена этот улучшенный ответ сохраняется в форме иммунологической памяти и позволяет системе адаптивного иммунитета реагировать быстрее и сильнее каждый раз при столкновении с данным патогеном. Вышеупомянутая иммунологическая память также является принципом, лежащим в основе иммунизации. В случае настоящего изобретения система врожденного иммунитета представляет особый интерес.
Система врожденного иммунитета служит для неспецифической защиты хозяина от инвазивных микроорганизмов. После активации, например, при фагоцитозе бактерий, вирусов или простейших макрофагами, моноцитами, нейтрофилами и дендритными клетками, система врожденного иммунитета инициирует серию защитных реакций хозяина (Akira et al., 2006. Cell 124:783-801). Важнейшим механизмом этих реакций является продукция и/или высвобождение провоспалительных цитокинов, молекул антимикробной защиты, гидролитических ферментов, активных форм кислорода (ROS) или активных форм азота (RNS). Различные компоненты микробных патогенов, упоминающиеся под названием патоген-ассоциированных молекулярных паттернов (структур) (PAMPs), распознаются рецепторами распознавания структур (PRRs) системы врожденного иммунитета. К этим рецепторам относятся Toll-подобные рецепторы (TLRs), NOD-подобные рецепторы (NLRs), RIG-подобные рецепторы (RLRs) и пептидогликан-подобные белки узнавания (PGRPs), способствующие ранней защите хозяина от патогенов (Creagh and O'Neill. 2006. Trends Immunol. 27:352-357; Dziarski and Gupta. 2006. Cell Microbiol. 8:1059-1069; Ishii et al., 2008. Cell Host.Microbe 3:352-363). Например, бактериальный PAMP флагеллин, мономерная субъединица жгутика (флагеллума), связывается с TLR5 и активирует транскрипционный фактор NF-kappaB (Hayashi et al., 2001. Nature 410:1099-1103), в конечном итоге приводя к экспрессии провоспалительных цитокинов и антимикробных пептидов, включая псориазин (S100A7c) и β-дефензин 2 человека (hBD-2) в первичных кератиноцитах человека (KCs) (Abtin et al., 2008. FASEB J. 7:2168-2176; Akira, and Takeda. 2004. Nat.Rev.Immunol. 4:499-511; Miller et al., 2005. J.Immunol. 174:6137-6143).
Ранее сообщалось, что супернатанты культуры клеток Е. coli или разрушенные клетки штаммов Е.coli индуцируют и/или усиливают экспрессию антимикробных пептидов псориазина и hBD-2 в эпидермальных кератиноцитах (Abtin et al., 2008. FASEB J. 7:2168-2176; Glaser et al., 2005. Nat.Immunol. 6:57-64.). Указанную реакцию вызывали фрагменты клеток. Как сообщалось ранее, чувствительность кератиноцитов к Е.coli опосредуется рецептором TLR5 и его лигандом флагеллином (Abtin et al., 2008. FASEB J. 7:2168-2176).
Цель настоящего изобретения - активизировать защитную систему врожденного иммунитета, в частности защитную систему врожденного иммунитета кожи. Следовательно, необходимо стимулировать экспрессию модуляторов врожденного иммунитета.
Поэтому, в одном аспекте настоящее изобретение имеет отношение к применению теней бактерий для стимулирования врожденного иммунного ответа.
В соответствии с настоящим изобретением, было неожиданно обнаружено, что кератиноциты распознают структуру оболочки теней бактерий (BGs) и стимулируют врожденный иммунный ответ. В частности, было обнаружено, что врожденный иммунный ответ может стимулироваться тенями бактерий с нативной или почти нативной структурой оболочки.
тени бактерий представляют собой неживые препараты клеточных оболочек бактерий, в частности грамотрицательных бактерий, лишенных цитоплазматического содержимого. Например, тени бактерий можно получить путем контролируемой экспрессии кодируемого плазмидой гена лизиса в бактериях, например, с помощью экспрессии плазмиды, кодирующей ген лизиса E бактериофага φХ174 в грамотрицательных бактериях. Ген E кодирует мембранный белок, способный соединять внутреннюю и внешнюю мембраны и, таким образом, формирующий E-специфический канал лизиса, через который удаляется все содержимое цитоплазмы (Witte et al., 1990. Biochimie 72:191-200; Witte et al., 1990. J.Bacteriol. 172:4109-4114). Тени бактерий, будучи неживыми бактериальными оболочками, сохраняют полную морфологию клетки нативных бактерий. В тенях бактерий сохраняются все структуры клеточной поверхности, включая белки внешней мембраны, адгезины, липополисахарид (LPS) и пептидогликан (Mayr et al., 2005. Adv.Drug Deliv.Rev. 57:1381-1391).
Ранее было показано, что тени бактерий способны активизировать адаптивную иммунную систему. В частности, тени бактерий могут использоваться для иммунизации к их собственным структурам оболочки или в качестве системы доставки антигена к чужеродным антигенам-мишеням (Jalava et al., 2003. Expert. Rev. Vaccines. 2:45-51; Mayr et al., 2005. Adv. Drug Deliv.Rev. 57:1381-1391). Иммунизация тенями Vibrio cholerae защищает от диареи и смерти после стимулирования полностью вирулентным V. cholerae на животной кроличьей модели (Eko et al., 2003. Vaccine 21:3663-3674), или включение корового антигена вируса гепатита В в состав поверхности Е. coli тени бактерий приводит к сильному иммунному ответу на данный коровый антиген у мышей (Jechlinger et al., 2005. Vaccine 23:3609-3617). Тени бактерий также могут использоваться в качестве средства доставки активных веществ, таких как доксорубицин (Paukner et al., 2006. Expert.Opin.Drug Deliv. 3:11-22) или в качестве носителя ДНК (Kudela et al., 2007. Cancer Lett. 1:54-63) и ферментов (Huter et al, 1999. Journal of Controlled Release 61:51-63.).
В настоящем изобретении было обнаружено, что тени бактерий также активизируют защитную систему врожденного иммунитета, в частности, защитную систему врожденного иммунитета кожи. Поэтому, тени бактерий были использованы для стимулирования врожденного иммунного ответа.
В предпочтительном варианте осуществления изобретения поверхность теней бактерий не содержит мономеров флагеллина.
В другом предпочтительном варианте осуществления поверхность теней бактерий не содержит флагеллин.
Флагеллин представляет собой белок примерно от 30000 до 60000 Да, который полимеризуется с образованием филамента бактериального жгутика. Белок флагеллин является основным компонентом жгутика бактерий и в больших количествах присутствует почти у всех жгутиковых бактерий. У млекопитающих адаптивный иммунный ответ, т.е. опосредованный Т-клетками и гуморальный иммунный (образование антител) ответы, нередко возникает на флагеллярные антигены и, следовательно, жгутиковые бактерии. Вероятно, вследствие того, что белок флагеллин чрезвычайно широко распространен у жгутиковых бактерий, также существует специфический природный иммунный рецептор, распознающий флагеллин, TLR5.
Тени бактерий, не содержащие на своей поверхности флагеллин могут быть получены из штамма бактерий, которые не способны экспрессировать флагеллин, например, делеционный мутант флагеллина. Альтернативно, вышеупомянутые тени бактерий могут быть получены из штамма бактерий, не способных транспортировать флагеллин на поверхность клетки. Для получения теней бактерий, не имеющих на поверхности флагеллина, может использоваться любой подходящий метод генной инженерии, известный в данной области техники. Например, делеция гена, кодирующего белок флагеллин, приводит к делеционному мутанту флагеллина. Альтернативно, экспрессия флагеллина может быть подавлена любым подходящим методом, известным в данной области техники, например, с помощью RNAi. Кроме того, мутация, например, преждевременный стоп-кодон, может быть введена в ген, кодирующий белок флагеллин, приводя к экспрессии «укороченного» белка. Делеция и/или мутация последовательностей, контролирующих экспрессию гена флагеллина, также может приводить к потере функции гена и таким образом приводить к образованию штамма бактерий, не способных экспрессировать флагеллин. Также может быть получен мутантный штамм бактерий, не способных транспортировать флагеллин на поверхность клетки, например, путем делеции и/или внесения мутации соответствующей последовательности гена флагеллина. Вышеупомянутые методы хорошо известны специалистам в данной области техники.
Зная, что флагеллин является бактериальным компонентом, важным для стимулирования как врожденного, так и адаптивного иммунного ответа, тем более удивительным оказалось, что тени бактерий, лишенные флагеллина, также являются эффективными при стимулировании врожденного иммунного ответа.
Ответ врожденного иммунитета предпочтительно стимулируется путем индукции экспрессии и/или высвобождения, по меньшей мере, одного модулятора врожденного иммунитета.
Иммуномодуляторы принимают участие в корректировании иммунного ответа до необходимого уровня, такого как иммуностимуляция, иммуносупрессия, или индукция иммунологической толерантности. Иммуностимуляция, т.е. усиление иммунного ответа, является желательной в соответствии с изобретением. Иммунный ответ может быть усилен путем увеличения скорости и степени его развития и увеличения его продолжительности.
Модуляторы врожденного иммунитета представляют собой иммуномодуляторы, как определено выше, которые принимают участие во врожденном иммунном ответе. Примеры модуляторов врожденного иммунитета включают провоспалительные цитокины, активные формы азота (RNS) и активные формы кислорода (ROS).
Согласно изобретению предпочтительно, что индуцируется экспрессия и/или высвобождение, по меньшей мере, одного модулятора врожденного иммунитета, выбранного из группы, состоящей из молекул антимикробной защиты, провоспалительных цитокинов, активных форм азота (RNS) и активных форм кислорода (ROS).
Молекулы антимикробной защиты, также известные как антимикробные пептиды или защитные пептиды хозяина, представляют собой сильные антибиотики широкого спектра действия. Было показано, что указанные молекулы уничтожают грамотрицательные и грамположительные бактерии, микобактерии, вирусы с оболочкой, грибы и даже трансформированные или злокачественные клетки. В отличие от большинства обычных антибиотиков антимикробные пептиды также могут иметь способность активизировать иммунитет, действуя как иммуномодуляторы. Примеры молекул антимикробной защиты включают псориазин и человеческий β-дефензин-2 (hBD-2).
Согласно изобретению усиливается экспрессия, по меньшей мере, одной молекулы антимикробной защиты, выбранной из группы, состоящей из псориазина и человеческого р-дефензина-2 (hBD-2).
Провоспалительные цитокины представляют собой цитокины, способствующие развитию системного воспаления. Примеры провоспалительных цитокинов включают TNF-альфа, интерлейкин-1 (IL-1), интерлейкин-6 (IL-6) и интерлейкин-8 (IL-8).
Согласно изобретению усиливается экспрессия и/или высвобождение, по меньшей мере, одного провоспалительного цитокина, выбранного из группы, состоящей из интерлейкина-6 (IL-6) и интерлейкина-8 (IL-8).
Активные формы азота (RNS) представляют собой семейство антимикробных молекул, которые получаются из оксида азота (NO) и супероксида (O2-) в результате ферментативной активности индуцибельной синтазы оксида азота (iNOS) и NADPH-оксидазы, соответственно. iNOS экспрессируется преимущественно в макрофагах после индукции цитокинами и микробными продуктами, в частности интерфероном-гамма (IFN-γ) и липополисахаридом (LPS). Однако, образование оксида азота (NO) является свойством не только фагоцитов. Другие клетки, вовлеченные в иммунные реакции, например, эпителиальные клетки или кератиноциты, также способны продуцировать эти радикалы (Bogdan, C., 2001. Nat Immunol 2(10): p.907-16; Bogdan, C., 2000 Immunol Rev. 173: p.17-26; Bogdan et al., 2000 Curr Opin Immunol. 12(1): p.64-76).
Было показано, что NO является универсальной молекулой, играющей двойственную эндогенную роль, с коротким временем полужизни около 6 сек (Sharma et al., 2007. Inflammopharmacology 15(6): p.252-9). С одной стороны, он представляет собой ключевую молекулу-медиатор различных клеточных функций, однако, при выработке в избыточных количествах, например, в условиях окислительного «взрыва», он может оказывать цитотоксическое и мутагенное действие (Sharma et al., 2007. Inflammopharmacology 15(6): p.252-9).
Поскольку NO действует как антимикробный агент, эта молекула является абсолютно необходимой для борьбы с внутриклеточными патогенами, такими как Salmonella enterica, Trypanosoma musculi, Mycobacterium tuberculosis, Legionella pneumophila или Leishmania major (Chakravortty and Hensel, 2003. Microbes Infect. 5(7): p.621-7; Summersgill et al., 1992 J Leukoc Biol. 52(6): p.625-9).
Высокореакционноспособный NO вовлечен в патофизиологию многих заболеваний. Однако, вследствие различных эффекторных и иммунорегуляторных функций, например, антимикробной, антитуморогенной и апоптотической активности, или его способности влиять на цитокины и дифференцировку Т-клеток, NO играет важную роль в иммунной системе. Низкие концентрации NO способствуют антимикробной активности в отношении определенных бактериальных патогенов, однако обнаружено, что высокие концентрации играют роль в процессах воспаления и канцерогенеза. В настоящее время известны три основные изоформы синтазы оксида азота (NOS); конститутивно экспрессируемые - нейрональная NOS (также известная как nNOS или NOS1) и эндотелиальная NOS (eNos или NOS3), а также индуцибельная изоформа (iNOS или NOS2). Последняя отвечает за продукцию NO в макрофагах и кератиноцитах. Все три типа NOS окисляют одну молекулу L-аргинина (по азоту гуанидина) до промежуточного продукта, который окисляется с образованием одной молекулы NO и L-цитруллина (Bogdan, С, 2001. Nat Immunol 2(10): p.907-16; Bogdan, С, 2000 Immunol Rev. 173: p.17-26; Bogdan et al., 2000 Curr Opin Immunol. 12(1): p.64-76; Sharma et al., 2007. Inflammopharmacology 15(6): p.252-9).
Бактериальный липополисахарид (LPS) является одним из наиболее важных стимулов для индукции iNOS. Макрофагический сенсор консервативных бактериальных компонентов представлен рецептором TLR4, который способен приводить в действие систему врожденного иммунитета посредством связывания с его главным агонистом LPS (Ishii et al., 2008 Cell Host Microbe. 3(6): p.352-63).
В промоторном участке гена iNOS обнаружены сайты связывания таких транскрипционных факторов, как NFkappa b. Его активация при контакте макрофагов с LPS обусловливает усиленную экспрессию (Bogdan et al., 2000 Curr Opin Immunol. 12(1): p.64-76).
Согласно изобретению усиливается высвобождение, по меньшей мере, одной активной формы азота, например NO.
Активные формы кислорода (ROS) представляют собой свободные радикалы, содержащие атом кислорода. Благодаря наличию неспаренных электронов внешней электронной оболочки, они являются высокореактивными. ROS образуются при нормальном метаболизме кислорода как естественный побочный продукт и играют важную роль в передаче клеточных сигналов. Однако, под воздействием стрессорных факторов окружающей среды (например, УФ или перегрева) уровень ROS может существенно возрастать, что может привести к серьезным повреждениям клеточных структур. Это приводит к ситуации, известной под названием окислительный стресс.
Согласно изобретению усиливается высвобождение, по меньшей мере, одной активной формы кислорода.
Активные формы азота вместе с активными формами кислорода (ROS) вызывают повреждение клеток, являясь причиной нитрозативного стресса. Поэтому, эти два вида радикалов часто упоминаются под названием ROS/RNS.
В другом предпочтительном варианте осуществления изобретения дополнительное активное средство, например лекарственное средство и/или другое биологическое вещество, может вводиться в комбинации с тенями бактерий. Указанное активное средство может быть добавлено к теням бактерий таким образом, что активное средство в значительной степени встраивается в тени бактерий. Альтернативно, активное средство просто присутствует отдельно от теней бактерий. Активное средство может являться иммуномодулятором, т.е. лекарственным средством и/или веществом, подходящим для стимуляции иммунной системы, в частности лекарственным средством и/или веществом, оказывающим влияние на систему врожденного иммунитета, систему адаптивного иммунитета или обе системы. Альтернативно, указанное активное средство может являться любым другим пролекарством или лекарственным средством. Специалисту в данной области техники известно множество подходящих пролекарств и лекарственных средств. Конкретное активное средство для применения с тенями бактерий будет определяться с учетом конкретного состояния лица, получающего тени бактерий с целью стимуляции системы врожденного иммунитета. Активное средство также может являться антиоксидантом, таким как полифенол, например, ресвератрол.
Ресвератрол представляет собой полифенольное соединение, встречающееся в природе в транс-изомерной или в цис-изомерной формах в различных видах растений, в частности, присутствует в кожице винограда, арахисе и ягодах, и обладающее широким спектром иммуномодулирующей активности. С помощью множества исследований были установлены противораковые, антиоксидантные и кардиопротекторные свойства этого соединения, а также увеличение продолжительности жизни различных организмов при его использовании (Aggarwal et al., 2004. Anticancer Res. 24(5A): p.2783-840; Gao et al., 2003. Biochem Pharmacol. 66(12): p.2427-35; Falchetti et al., 2001. Life Sci. 70(1): p.81-96; Saiko et al., 2008. Mutat Res. 658(1-2): p.68-94). Более того, ресвератрол обладает значительным терапевтическим потенциалом при лечении множества инфекционных заболеваний животных и человека. Была продемонстрирована его активность против дерматофитов (Chan, 2002. Biochem Pharmacol. 63(2): p.99-104) и таких вирусов, как Herpes simplex (Faith et al., 2006. Antiviral Res. 72(3): p.242-51). Подавление роста под действием ресвератрола было подтверждено для широкого спектра видов бактерий, включая внутриклеточные Chlamydia pneumoniae, являющиеся причиной острых инфекций дыхательных путей (Chan, 2002. Biochem Pharmacol. 63(2): p.99-104; Schriever et al., 2003 Atherosclerosis. 171(2): p.379-80). Кроме того, наблюдалось снижение инфицирующей способности видов простейших, вызывающих болезни у рыб (Leiro et al., 2004 Dis Aquat Organ. 59(2): p.171-4; Leiro et al., 2004 Antimicrob Agents Chemother. 48(7): p.2497-501), а совсем недавно было продемонстрировано уничтожение с помощью ресвератрола внутриклеточного кожного патогена L. major, вызывающего кожный лейшманиоз (Kedzierski et al., 2007. Parasitol Res. 102(1): p.91-7; Kedzierski et al., 2009. Curr Med Chem. 16(5): p.599-614).
Тени бактерий, используемые в соответствии с изобретением, могут быть получены из целого ряда бактерий. Предпочтительно тени бактерий получают из непатогенных грамотрицательных бактерий, более предпочтительно из штамма Е.coli. Может быть использован любой штамм Е.coli. Примером подходящего штамма Е. coli является Е.coli Nissle 1917.
Как указано выше, поверхностные барьеры, такие как кожа, являются примерами механических барьеров, которые представляют собой первую линию защиты от инфекции. Кроме того, кожа и дыхательные пути секретируют антимикробные пептиды, например Р-дефензины, и таким образом выполняют функцию химических барьеров, защищающих от инфекции. Следовательно, врожденный иммунный ответ предпочтительно стимулируется в коже и/или слизистой оболочке, также называемой слизистой мембраной. Примеры слизистых оболочек включают слизистые оболочки рта, щек, пищевода, желудка и кишечника, слизистые оболочки дыхательных путей, бронхов, носа, слизистые оболочки органов обоняния, а также слизистые оболочки матки, полового члена и эндометрий.
Кожа также как и слизистая оболочка состоит из эпителиальных клеток. Эпителиальные клетки образуют эпителий, представляющий собой ткань, состоящую из клеток, которые выстилают полости и поверхности всего организма.
Кератиноциты представляют собой главный элемент эпидермиса, т.е. внешнего слоя кожи. Кератиноциты являются основными иммуномодуляторами, поддерживающими целостность иммунного ответа путем секреции ингибиторных цитокинов, таких как IL-4 и TGFβ в состоянии покоя, однако при стимулировании кератиноциты провоцируют воспаление кожи и активацию клеток Лангерганса посредством секреции TNFα и IL-1β.
В соответствии с изобретением экспрессия и/или высвобождение, по меньшей мере, одного модулятора врожденного иммунитета предпочтительно индуцируется в эпителиальных клетках. Предпочтительно, эпителиальные клетки представляют собой кератиноциты.
Считается, что стимуляция врожденного иммунного ответа усиливает защиту хозяина от заражения другими организмами неспецифическим образом. Поэтому, в соответствии с изобретением, предпочтительно врожденный иммунный ответ стимулируется у млекопитающих, предпочтительно у людей, более предпочтительно у индивидуумов, восприимчивых к инфекциям или лиц с нарушенной иммунной системой.
В дополнительном аспекте изобретения, тени бактерий вводят млекопитающему, предпочтительно человеку. Предпочтительно тени бактерий вводят в кожу и/или слизистую оболочку.
Подходящие способы введения теней бактерий включают пероральное, местное, через слизистую оболочку, назальное и/или легочное введение.
Например, подходящими фармацевтическими композициями являются композиции в форме жевательной резинки, ингалятора, назального спрея, кожного пластыря, мази, лосьона, аэрозоля, суппозитория, орошения, гелеобразной жидкости, суспензии, зубной пасты.
В соответствии с изобретением возможно введение теней бактерий любому индивидууму. Предпочтительно, тени бактерий вводятся младенцам, детям младшего возраста, пожилым людям, хронически больным лицам, лицам с нарушенной иммунной системой, например, пациентам с синдромом приобретенного иммунодефицита (СПИД), а также реципиентам трансплантатов.
В следующем аспекте изобретение имеет отношение к способу стимуляции неспецифического иммунного ответа, согласно которому тени бактерий вводятся пациенту. Подходящие способы введения теней бактерий и подходящие лекарственные формы/ готовые лекарственные формы/композиции описаны выше.
Фигуры
Фиг.1. Тени бактерий индуцируют экспрессию антимикробного псориазина в первичных кератиноцитах человека. Кератиноциты в течение 24 час инкубировали с флагеллином (10 нг/мл), IL-1α (10 нг/мл), wt (дикого типа) Е.coli тени бактерий в концентрациях, варьирующих от 2×106 до 2×108 частиц/мл, или без стимуляции (NC), после чего выделяли общую РНК и проводили реакцию обратной транскрипции для получения кДНК. Относительный уровень экспрессии антимикробного псориазина определяли при помощи qRT-PCR. Средние значения показаны относительно необработанных клеток (NC). Относительные уровни генной экспрессии были нормированы по экспрессии конститутивного гена β-2-микроблобулина. Данные представляют собой среднее значение±SD от трех образцов.
Фиг.2. Индукция псориазина в кератиноцитах под влиянием wt и ΔFliC Е.coli тени бактерий. Кератиноциты в течение 48 ч инкубировали с wt и ΔFliC Е.coli тени бактерий в концентрации от 1×106 до 2×109 частиц/мл. Стимуляцию флагеллином (10 нг/мл), IL-1α (10 нг/мл), нестимулированные клетки (NC), некондиционированную среду для культивирования бактерий (СМ) и культуральные супернатанты от wt Е.coli (CS wt) и ΔFliC Е.coli (CS ΔFliC) использовали в качестве контролей. Через 48 ч после стимуляции клеточные лизаты кератиноцитов подвергали иммуноблот-анализу для определения выработки псориазина (A). Количественную оценку иммуноблота экспрессии белка псориазина (A) при помощи денситометрического анализа нормализовали относительно IL-1α-стимуляции кератиноцитов (B). Показан один репрезентативный эксперимент из трех проведенных.
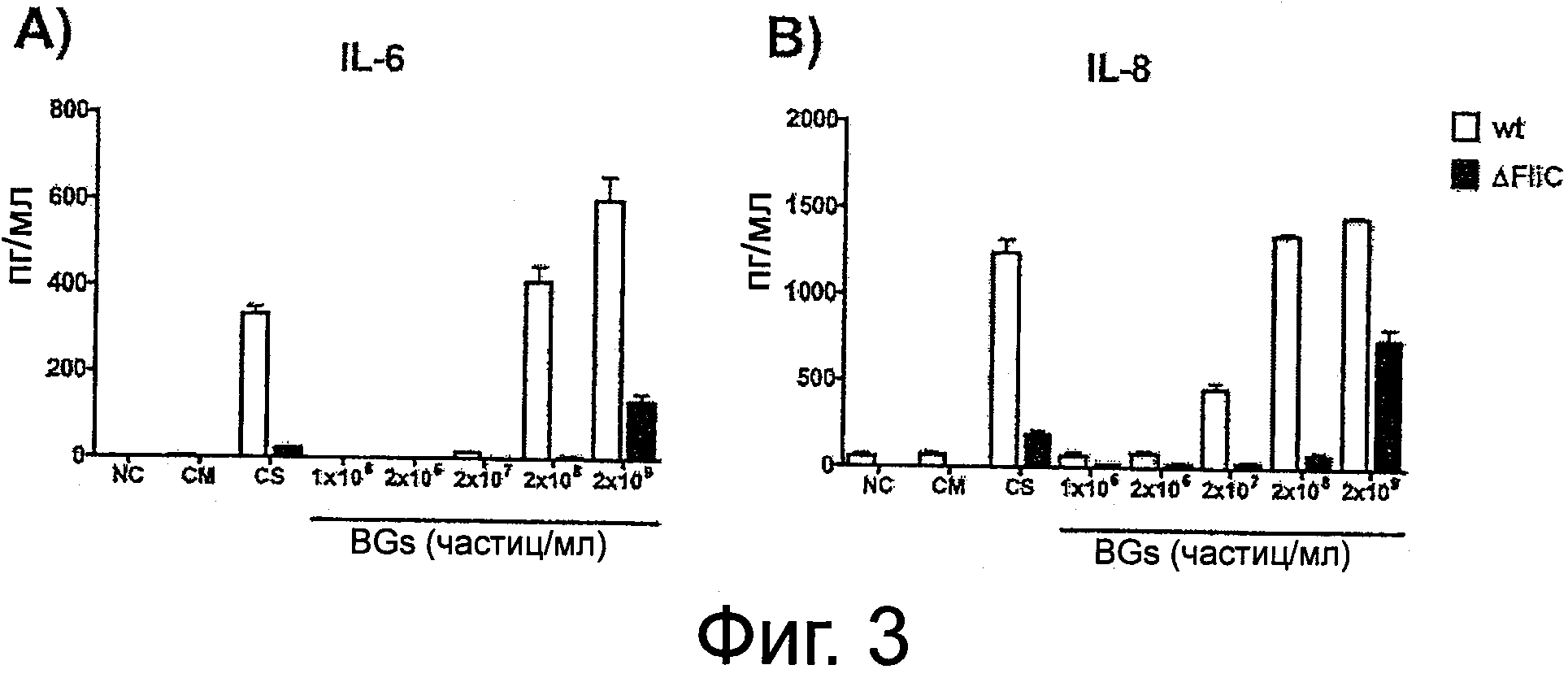
Фиг.3. Тени бактерий индуцируют секрецию провоспалительных цитокинов.
Кератиноциты инкубировали в течение 48 ч с wt Е.coli и ΔFliC Е. coli тени бактерий при концентрациях от 1×106 до 2×109 частиц/мл и в присутствии культуральных супернатантов (CS) от wt и AFHC E.coli. Нестимулированные клетки (NC) и клетки, инкубированные в присутствии некондиционированной среды для культивирования бактерий (СМ), использовали в качестве отрицательных контролей. После периода инкубации культуральную среду собирали и определяли концентрации IL-6 (A) и IL-8 (B) при помощи ELISA. Данные представляют собой среднее значение±SD трех независимых экспериментов, поставленных в трех повторах.
Фиг.4. Сравнительный анализ интернализации теней бактерий первичными кератиноцитами человека методом проточной цитометрии. Кератиноциты инкубировали с FITC-мечеными тенями бактерий (1×103 на клетку) - wt Е.coli (A) и AFHC Е.coli (B) тенями бактерий (открытая гистограмма - сплошная линия) в течение 2 ч при +37°C. Клетки, инкубированные без теней бактерий (затушеванная гистограмма) или с немечеными тенями бактерий (открытая гистограмма - пунктирная линия), использовали в качестве контролей. Значения вычисляли как процентное содержание клеток с повышенной флуоресценцией, инкубированных без или с немечеными тенями бактерий, вычтенное из процентного содержания положительных клеток, инкубированных с FITC-мечеными тенями бактерий. Каждый столбик представляет собой среднее значение четырех независимых экспериментов ±SD (C).
Фиг.5. Корреляция между RV «загружающим» раствором и количеством, восстановленным (извлеченным) из нагруженных Е.coli NM522 теней.
Прямая зависимость RV «загружающего» раствора и количества RV после экстракции этанолом показана посредством линейной регрессии. Значения были получены с помощью HPCL-измерений (A). На фигуре (B) изображена линейная регрессия между применявшимися и связанными FITC-мечеными тенями бактерий после 20 мин совместной инкубации с клетками RAW 264.7. Значения представляют собой средние значения 4 независимых экспериментов и вычислены, как описано в материалах и методах.
Фиг.6. Адгезия и поглощение теней бактерий макрофагами мышей.
После инкубации макрофагов с FITC-мечеными Е.coli NM522 тенями, при соотношении тень к клетке равном 1000, было проведено исследование с помощью конфокального лазерного сканирующего микроскопа. Клетки RAW 264.7 были окрашены техасским красным фаллоидином. FITC-меченые тени бактерий, расположенные внутри клетки, имеют желтый цвет, а непоглощенные - зеленый цвет.Изображения показывают репрезентативный одиночный z-stack (канал) разных оптических срезов. Фотографии были сделаны с помощью 20-кратного объектива после 20 мин инкубации (A) или при использовании 63х масляного объектива (B) после 40 мин инкубации. Обработку изображений не проводили.
Фиг.7. Индукция выработки NO. Клетки RAW 264.7 обрабатывали различными концентрациями LPS в течение 20 часов (A). Влияние различных количеств теней бактерий на стимуляцию образования NO после обработки в течение 20 мин и 20 часов последующей инкубации (B). Дозозависимая индукция может наблюдаться до MOI 1000. Более высокие количества не оказывали какого-либо дополнительного влияния. В последних экспериментах обработку проводили в течение 20 мин и через 20 часов определяли концентрации NO по методу Грисса, как описано в материалах и методах. Столбики показывают средние значения +SD. Каждая экспериментальная точка представляет собой значения 4 независимых культур, измеренных в трех повторах.
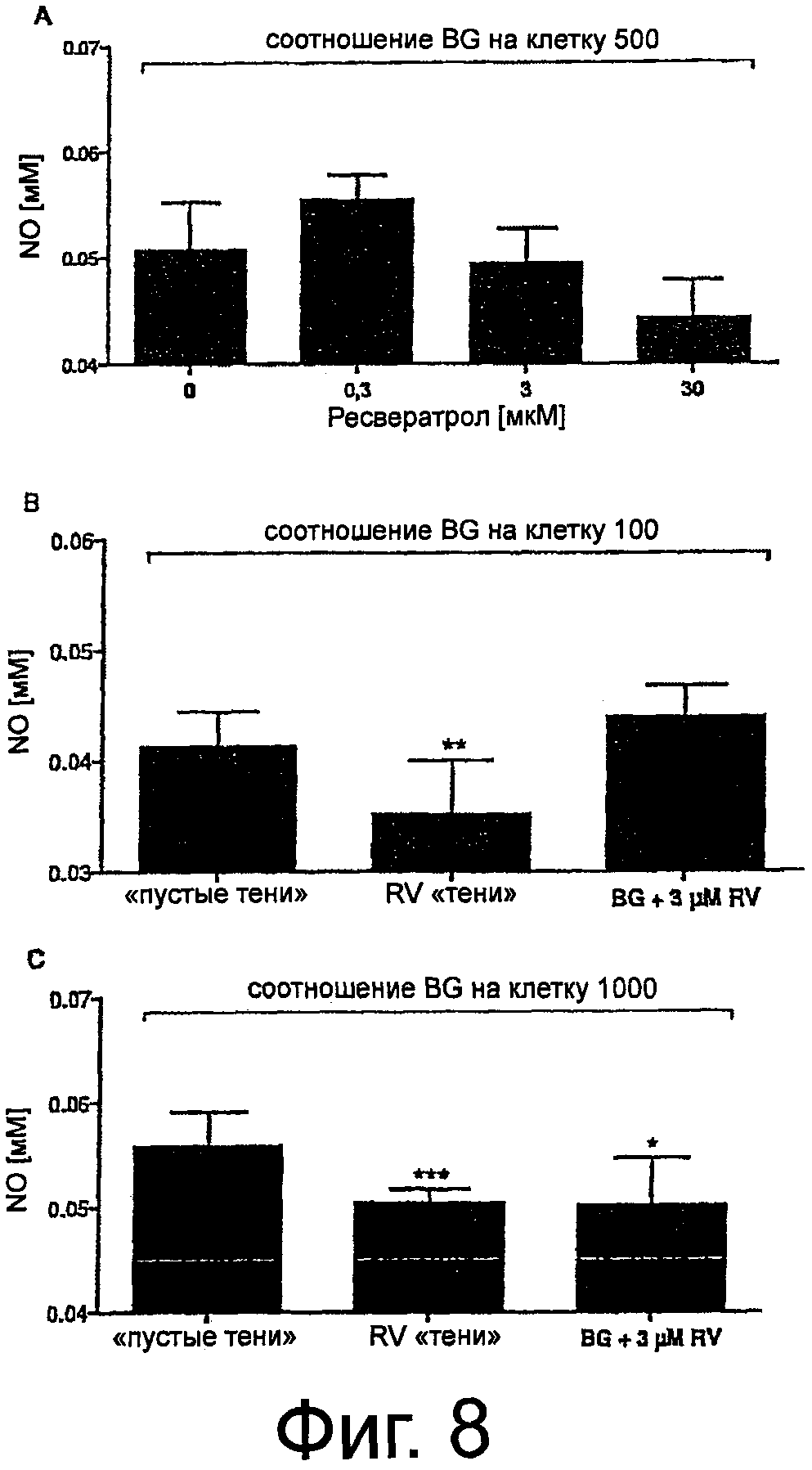
Фиг.8. Влияние RV и теней бактерий, нагруженных RV, на продукцию NO, индуцированную различными количествами теней бактерий, в клеточной линии макрофагов RAW 264.7.
Показано снижение выработки NO, индуцированной тенями бактерий (отношение теней бактерий на клетку равно 500), после одновременной обработки различными концентрациями RV (А). На фиг.(B) показано уменьшение образования NO после обработки при отношении теней бактерий на клетку, равном 100. Высокозначимое уменьшение NO-стимулирования было обнаружено при отношениях равных 1000 (C). Исходя из подсчета связанных с клетками теней бактерий, отношения теней бактерий на клетку, равные 100 и 1000, соответствуют концентрациям RV, равным 0.48+0.25 мкМ и 8.86+2.21 мкМ, соответственно. Видно, что тени бактерий, нагруженные RV, значительно снижают индукцию выработки NO. Для сравнения, предоставленный извне RV, количество которого было примерно в 6 раз больше, чем количество вещества, доставленное тенями бактерий при MOI, равном 100, вообще не оказывал влияния. Во всех экспериментах обработку проводили в течение 20 мин и через 20 часов определяли концентрации NO (A-C) по методу Грисса, как описано в материалах и методах. Столбики показывают средние значения +SD. Каждая экспериментальная точка представляет собой значения, полученные от четырех независимых культур в трех повторах. Звездочки указывают значения, достоверно отличающиеся от соответствующего им контроля (p<0,05). Анализ проводили при помощи двустороннего непарного критерия Стьюдента.
Фиг.9. Влияние ненагруженных теней бактерий Е.coli NM522 на жизнеспособность макрофагов линии RAW 264.7 (A). Клетки инкубировали в трех различных соотношениях теней бактерий на клетку (10, 100, 1000) или в течение 20 мин с последующим периодом восстановления (20 часов) (белые столбики) или в течение 24 часов. Жизнеспособность клеток оценивали с помощью нейтрального красного. Показаны цитотоксические эффекты RV для сравнения с применением RV-нагруженных теней бактерий (46 мкг RV /1×1010 теней бактерий) (B). В то время как результат применения 15 мкМ RV не отличался от контроля, концентрация 30 мкМ RV приводила к потере 20% жизнеспособности. Стимулирующий рост макрофагов наблюдали после обработки RV-теней бактерий при MOI, равном 10 и 100. Совместная инкубация при отношении теней к клетке, равном 1000, приводила к достоверному существенному снижению жизнеспособности клеток (P=0.0462). Столбики показывают средние значения+SD. Каждая экспериментальная точка представляет собой значения от четырех независимых культур, измеренные в трех повторах. Звездочки показывают значения, достоверно отличающиеся от соответствующего им контроля (p<0,05). Анализ проводили при помощи двустороннего непарного критерия Стьюдента.
Изобретение дополнительно иллюстрируется следующими неограничивающими примерами.
Примеры
Пример 1. Тени бактерий стимулируют врожденный иммунный ответ в человеческих кератиноцитах
О способности теней бактерий индуцировать экспрессию модуляторов врожденного иммунитета эпителиальными клетками, в частности человеческими кератиноцитами, известно мало. В настоящем исследовании была изучена способность Е.coli теней бактерий индуцировать экспрессию антимикробных пептидов и противовоспалительных цитокинов в первичных кератиноцитах человека. Полученные результаты показывают, что наличие флагеллина на поверхности теней бактерий усиливает экспрессию антимикробного псориазина и hBD-2 и выработку интерлейкинов (IL)-6 и IL-8 человеческими кератиноцитами.
Материалы и методы
Культура клеток
Первичные кератиноциты человека, извлеченные из крайней плоти новорожденных, получали от Clonetics (Сан-Диего, Калифорния, США) и культивировали в бессывороточной среде для роста кератиноцитов (KGM, Clonetics), как описано ранее (Rendl et al., 2002. J.Invest Dermatol. 119:1150-1155). Для стимуляции третий пассаж кератиноцитов культивировали в 12-луночных культуральных планшетах (Corning Incorporated, Corning, Нью-Йорк, США) и использовали при 60-70% конфлюэнтности (слиянии). Стимуляцию проводили в минимальной среде для кератиноцитов (КВМ, Clonetics).
Выделение РНК и qRT-PCR
После стимуляции клетки промывали фосфатно-солевым буфером (PBS) и выделяли РНК при помощи реактива TRIzol® (Invitrogen, Carlsbad, Калифорния, США) в соответствии с инструкцией производителя. Для синтеза кДНК проводили обратную транскрипцию РНК с использованием обратной транскриптазы MuLV при помощи набора Gene Amp RNA PCR (Applied Biosystems, Foster City, Калифорния, США) и oligo dT праймера (Roche Diagnostics, Базель, Швейцария). Последовательности кДНК исследуемых генов были получены из GenBank. Дизайн праймеров осуществляли при помощи программного обеспечения PRIMER3 от института биомедицинских исследований Уайтхеда (Cambridge, Массачусетс, США). Для амплификации 0-2-микроглобулина (В2М) использовали следующие прямые (F) и обратные (R) интрон-перекрывающие праймеры: F, 5'-GATGAGTATGCCTGCCGTGTG-3';
R, 5'-CAATCCAAATGCGGCATCT-3';
для псориазина: F, 5'-GGAGAACTTCCCCAACTTCCTT-3
R, 5'-GGAGAAGACATTTTATTGTTCCT-3'-
qRT-PCR проводили по технологии LightCycler с использованием набора Fast Start SYBR Green I для амплификации и обнаружения (Roche Diagnostics). Во всех исследованиях кДНК амплифицировали с использованием стандартной программы (10 мин стадия денатурации и 55 циклов по 5 сек при 95°C; 15 сек при 65°C, и 15 сек при 72°C; анализ температуры плавления при шаге 0,1°С; заключительная стадия охлаждения). В каждый капилляр LightCycler загружали 1,5 мкл ДНК мастер-микс; 1,8 мкл MgCl2 (25 мМ); 10,2 мкл H2O; и 0,5 мкл каждого праймера (10 мкМ). Определение относительного количества экспрессии гена-мишени и эффективности амплификации проводили с использованием математической модели Pfaffl (Pfaffl. 2001. Nucleic Acids Res. 29:e45). Уровень экспрессии гена-мишени нормировали по уровню экспрессии конститутивного гена β-2-микроглобулина. Все ПЦР в реальном времени проводили в трех повторах. Специфичность ПЦР-реакций была подтверждена секвенированием ПЦР-продуктов.
Продукция теней бактерий и стимуляция кератиноцитов
Штамм Е.coli NK9373 (wt) и штамм Е.coli NK9375 (ΔfliC), лишенный флагеллина с делецией внутри рамки считывания в гене fliC (Bates et al., 2005. Mol.Microbiol. 57:380-391), были любезно предоставлены Dr. David Bates (Baylor College of Medicine, Хьюстон, Техас). Штаммы E.coli, несущие лизисную плазмиду pGLysivb (неопубликованные данные), выращивали в питательном бульоне animal free Lennox Broth (LBv; 10 г/л сояпептон, 5 г/л дрожжевого экстракта, 5 г/л NaCl), содержащем гентамицин (20 мкг/мл), при 35°C. Два литра среды были инокулированы 4 мл глицеринового стока, полученного от одной колонии трансформированных клеток, и после инкубации в течение ночи использованы в качестве прекультуры для выращивания. Культивирование проводили в 20 л среды в ферментере Techfors S (Infors Ag, Bottmingen, Швейцария). Регистрировали следующие параметры: температура, поток, перемешивание, pH, pO2, образование пены и насосы для кислоты, основания и пеногасителя. Рост и лизис бактерий сопровождались измерением оптической плотности (OD600), определением колониеобразующих единиц с использованием аппарата для спирального посева бактерий на чашки (WASP system, Don Whitley Scientific Limited, West Yorkshire, Великобритания) и микроскопическим исследованием периодически отбираемых образцов. Бактерии выращивали в среде LBv при установленном значении pH 7,2 при аэрации и взбалтывании (поток и перемешивание проводились в запрограммированной последовательности и контролировались) до достижения середины логарифмической фазы. Экспрессию белка лизиса E индуцировали путем повышения температуры до 42°С. После завершения процесса лизиса (достижения плато в уровне pO2) оставшиеся интактные бактерии инактивировали добавлением бета-пропиолактона (BPL). Всего было добавлено 0,075% BPL в виде двух равных доз с временным интервалом 30 мин. Для инкубации с BPL была установлена скорость перемешивания, равная 600 об/мин. Клетки собирали с помощью сепаратора (СТС1, GEA Westfalia Separator GmbH, Oelde, Германия) при температуре 16°C и скорости потока около 200 мл/мин. До ресуспендирования теней бактерий-осадка систему промывали 5 л стерильной дистиллированной воды и затем промывали тени бактерий, используя 5 циклов ресуспендирования/центрифугирования дистиллированной водой в общем объеме 7,5 л при помощи центрифуги Hermle ZK 401 (Hermle Labortechnik GmbH, Wehingen, Германия) при 8000 мин-11, 4°C, 15 мин. Конечный осадок ресуспендировали в 200 мл дистиллированной воды, аликвоты во флаконы для лиофилизации и хранили при -80°C. Образцы лиофилизировали в течение 60 ч при помощи лиофилизатора Lyolab B (LSL Secfroid, Aclens, Швейцария).
Лиофилизированные тени бактерий из Е. coli NM522, Е.coli NK9373 (wt) и Е.coli NK9375 (AfliC) ресуспендировали в среде КВМ до нанесения на кератиноцитах. Для in vitro методов анализа использовали рекомбинантный IL-la (R&D Systems, Minneapolis, Миннесота, США) и очищенный флагеллин из S. typhimurium (Invitrogen). Культуральные супернатанты wt и AFHC Е. coli готовили, как описано в работе Abtin et al. (FASTEB J 22 (2008), 2168-2176). Перед кератиноцито-стимуляцией культуральные супернатанты разводили в соотношении 1:100 в КВМ.
Измерение цитокинов
Культуральные супернатанты стимулированных кератиноцитов очищали от неприкрепленных клеток или фрагментов клеток центрифугированием и хранили при -20°C до исследования. Концентрации IL-6 и IL-8 определяли с помощью твердофазного иммуноферментного анализа (ELISA; R&D Systems) в соответствии с инструкцией производителя.
Иммуноблот-анализ
Для анализа экспрессии белков кератиноцитов лизировали в SDS-PAGE буфере для нанесения (50 мМ Трис; pH 7,4; 2% SDS). После обработки ультразвуком нерастворимые «обломки» клеток удаляли центрифугированием и измеряли концентрацию белка методом ВСА (бицинхониновая кислота) (Pierce, Rockford, IL, США). Вестерн-блоттинг проводили, как описано ранее (Mildner et al., 2006. Biochem.Biophys.Res.Commun. 348:76-82). Равную «загрузку» белковых лизатов подтверждали окрашиванием мембраны при помощи Ponceau S. Были использованы следующие первичные антитела: мышиный моноклональный IgGi антипсориазин клон 47С1068 (разведение 1:500; Abeam, Cambridge, Великобритания). Мембраны обрабатывали реагентом Chemiglow (Alpha Innotech, San Leandro, Калифорния, США) в соответствии с инструкцией производителя.
Для количественного определения плотности полос, полученных при иммуноблотанализе, использовали программное обеспечение ImageJ (Rasband, W.S., Image J, U. S.NIH, Bethesda, Maryland, USA; , 1997-2009). Полученные значения экспрессии псориазина после стимуляции кератиноцитов различными концентрациями частиц wt и ΔFliC E.coli теней бактерий нормировали по уровню экспрессии псориазина, полученному после стимуляции кератиноцитов рекомбинантным IL-1α.
Поглощение теней бактерий, меченых флюоресцеин-изотиоцианатом (FITC) Эффективность эндоцитирующей активности первичных кератиноцитов человека оценивали, как описано ранее (Kudela et al., 2007. Cancer Lett. 1:54-63; Kudela et al., 2005. J.Immunother. 28:136-143). Коротко, первичные кератиноциты человека, культивированные в 24-луночных планшетах (2x105 клеток/лунку), инкубировали с FITC-тенями бактерий (1000 на клетку) в течение 2 часов при +37°C. После инкубации клетки три раза промыли PBS для удаления избытка теней бактерий. Наконец, клетки отделили от места прикрепления при помощи TrypLE™ Express (Invitrogen), дважды промыли PBS, зафиксировали в холодном 1,5% параформальдегиде (Sigma-Aldrich, Сент-Луис, Миссури) на PBS и анализировали с помощью проточного цитометра BD FACSCanto™ (BD Biosciences, Pharmingen, Сан-Хосе, США). Статистический анализ
Полученные результаты анализировали с помощью 5 версии GraphPad Prism (GraphPad Software, Ла-Хойя, Калифорния). Статистическую значимость различий между двумя группами оценивали с помощью критерия Стьюдента и между более чем двумя группами с помощью однофакторного дисперсионного анализа ANOVA. Различия считали статистически значимыми при р<0,05.
Результаты
Экспрессия антимикробных пептидов в первичных кератиноцитов человека
Сообщалось, что культуральные супернатанты Е.coli индуцируют экспрессию антимикробных пептидов псориазина и hBD-2 в эпидермальных кератиноцитах (Abtin et al., 2008. FASEB J. 7:2168-2176; Glaser et al., 2005. Nat.Immunol. 6:57-64). Для изучения способности теней бактерий вызывать врожденный иммунный ответ в эпителиальных клетках первичные кератиноциты человека в течение 24 часов стимулировали частицами теней бактерий, полученными из wt Е. coli, в различных концентрациях. Стимуляция кератиноцитов флагеллином (10 нг/мл) и IL-la (10 нг/мл) служила положительным контролем активизации исследуемого антимикробного пептида, необработанные клетки служили отрицательным контролем. Относительную активизацию (повышение экспрессии) мРНК антимикробного псориазина определяли при помощи количественной ПЦР в реальном времени (qRT-PCR). Как видно на фиг.1, уровень экспрессии мРНК псориазина был повышен в кератиноцитах после инкубации с тенями бактерий.
Стимулированная продукция мРНК псориазина зависела от количества частиц теней бактерий, и наиболее сильное повышение экспрессии наблюдалась при 2x108 теней бактерий частиц/мл, концентрации теней бактерий ниже 2×108 частиц/мл не оказывали влияния (фиг.1).
Ранее мы сообщали, что индукция псориазина в кератиноцитах зависит от экспрессии флагеллина у Е.coli (Abtin et al., 2008. FASEB J. 7:2168-2176). Чтобы изучить, имеет ли флагеллин тени бактерий подобный эффект, мы создали тени бактерий на основе дикого типа (wt) NK9373 и изогенного лишенного флагеллина штамма (ΔfliC) NK9375 Е.coli. В качестве положительных контролей служили кератиноциты, стимулированные флагеллином, IL-1α и культуральным супернатантом от wt Е.coli. Кератиноциты, инкубированные в присутствии некондиционированной бактериальной культуральной среды, культурального супернатанта от AFHC Е. coli и без стимуляции служили в качестве отрицательных контролей. Кератиноциты стимулировали в течение 48 часов и затем исследовали методом иммуноблоттинга в отношении выработки белка псориазина. В отличие от данных по экспрессии мРНК, полоса псориазина небольшой интенсивности обнаруживалась на соответствующем данному белку уровне при концентрации 2×107 теней бактерий частиц/мл (фиг.2A). Сильная индукция псориазина наблюдалась при 2×108 частиц/мл, и была даже более сильной, чем у wt (NK9373) Е. coli теней бактерий при 2×109 частиц/мл. Для изогенного штамма AfliC (NK9375) полоса псориазина небольшой интенсивности была обнаружена, начиная от 2×108 теней бактерий частиц/мл с максимальным уровнем экспрессии при 2×109 теней бактерий частиц/мл (фиг.2A, B).
Экспрессия цитокинов в первичных кератиноцитах человека после обработки тенями бактерий
Секрецию провоспалительных цитокинов IL-6 и IL-8 кератиноцитами после инкубации в течение 48 часов с тенями бактерий исследовали методом ELISA. Высвобождение IL-6 и IL-8 из кератиноцитов после инкубации с wt (NK9373) и AfliC (NK9375) Е.coli тенями бактерий зависело от источника теней бактерий и использованного числа частиц (фиг.3A, B). Полученные результаты показали, что влияние wt (NK9373) Е.coli теней бактерий на высвобождение IL-6 и IL-8 проявлялось, начиная от концентраций 2×107 частиц/мл. В то время как концентрации ниже 2×107 частиц/мл были почти неэффективными, при 2x109 частиц/мл секреция IL-6 сильно увеличивалась от 2 пг/мл (без обработки) до 600 пг/мл, а IL-8 от 60 пг/мл (без обработки) до 1350 пг/мл, соответственно (фиг.3A, B). Однако, AfliC (NK9375) Е.coli тени бактерий увеличивали секрецию обоих цитокинов только при использовании от 2×109 частиц/мл до 134 пг/мл и 750 пг/мл для IL-6 и IL-8, соответственно, в то время как более низкие концентрации теней бактерий не оказывали значимого воздействия на высвобождение обоих цитокинов (фиг.3A, B). Кроме того, были обнаружены достоверные различия в секреции как IL-6, так и IL-8, связанные с присутствием флагеллина, после инкубации кератиноцитов с культуральными супернатантами от wt Е.coli и ΔfliC Е.coli, когда продукция цитокинов была примерно на порядок ниже после инкубации кератиноцитов в присутствии культурального супернатанта ΔFliC Е.coli в сравнении с культуральным супернатантом wt Е.coli (фиг.3A, B). В общей сложности эти результаты подчеркивают важность интактной поверхностной структуры оболочки теней бактерий и роль флагеллина в стимуляции системы врожденного иммунитета.
Эндоцитоз wt (NK9373) и Δflic (NK9375) Е.coli теней бактерий первичными кератиноцитами человека
Как указано выше, повышенная экспрессия антимикробного псориазина и усиленное высвобождение провоспалительных цитокинов из кератиноцитов зависит от наличия флагеллина на поверхности теней бактерий. Для дальнейшего исследования роли флагеллина в поглощении тенями бактерий кератиноцитами, было проведено сравнение и анализ эндоцитоза штаммами wt (NK9373) и ΔfliC (NK9375) Е.coli тенями бактерий. Отсутствие флагеллина на поверхности теней бактерий вызывало значительное снижение (в ~6 раз меньше) способности кератиноцитов связывать и эндоцитировать тени бактерий. FACs-анализ ясно показал различие между интернализацией FITC-меченых wt Е.coli теней бактерий (фиг.4A) и ΔFliC Е.coli теней бактерий (фиг.4B). Как показано на фиг.4C, вследствие наличия интактного флагеллина наблюдалось приблизительно 6-кратное увеличение способности кератиноцитов связывать и интернализовать wt Е.coli тени бактерий по сравнению с ΔFliC Е.coli тенями бактерий.
Обсуждение
Тени бактерий представляют собой неживые препараты клеточных оболочек грамотрицательных бактерий, лишенных цитоплазматического содержимого, при этом их клеточная морфология и нативные поверхностные антигенные структуры остаются сохраненными [40]. В этом исследовании были определены эффекты теней бактерий на регуляцию модуляторов врожденного иммунитета с использованием первичных кератиноцитов человека. Инкубация теней бактерий, полученных из непатогенных Е.coli, с человеческими кератиноцитами повышала экспрессию антимикробного псориазина. Это согласуется с более ранними сообщениями, в которых культуральные супернатанты или разрушенные клетки штаммов Е. coli усиливали экспрессию антимикробных пептидов [2]. Следовательно, это исследование подтвердило, что структуры оболочек теней бактерий, включая флагеллин, являются полностью функциональными и интактными и распознаются кератиноцитами, стимулируя врожденный иммунный ответ, сходный с ответом на бактериальные соединения, использованные в предшествующих исследованиях [2].
Как сообщалось ранее, чувствительность кератиноцитов по отношению к Е.coli опосредована TLR5 и его лигандом флагеллином [2]. Штамм wt Е.coli демонстрировал зависимую от концентрации теней бактерий индукцию выработки псориазина (фиг.1); тогда как штамм ΔFIiC Е.coli показал экспрессию псориазина при концентрациях теней бактерий на один порядок величины выше, чем штамм wt (фиг.2). Соответственно, данные, полученные на основании высвобождения провоспалительных цитокинов IL-6 и IL-8, подчеркивали важность наличия флагеллина в препаратах теней бактерий по сравнению с мутантным штаммом ΔFliC (фиг.3). Из предыдущих исследований с использованием супернатантов Е. coli в качестве источника shad флагеллина и/или очищенного флагеллина видно, что флагеллин является главным индуктором псориазина в человеческих кератиноцитах [2]. Однако, поскольку ΔFliC тени бактерий способны индуцировать псориазин, по-видимому, существуют дополнительные FHC-независимые пути.
Кроме того, изучение поглощения кератиноцитами теней бактерий, полученных из wt Е.coli и ΔFliC Е.Coli, показало, что тени бактерий из штамма, несущего жгутик (fiagella), поглощаются приблизительно на один порядок лучше, чем ΔFliC тени бактерий (фиг.4). Данное наблюдение наводит на мысль, что наличие флагеллина на поверхности теней бактерий способствует связыванию и интернализации теней бактерий кератиноцитами. Более того, ключевая роль флагеллина в индукции выработки псориазина и секреции IL-6 и IL-8 выражается пониженным ответом кератиноцитов при производстве этих белков после инкубации с ΔFliC Е.coli теней бактерий или инкубации с культуральным супернатантом от AFHC Е.coli. Остается вопрос, обладают ли другие компоненты на поверхности, например, LPS ΔFliC Е.coli теней бактерий, сигнальной активностью для выработки антимикробных пептидов и/или провоспалительных цитокинов. Однако высвобождение IL-6 и IL-8 кератиноцитами было более чувствительным к наличию флагеллина, так как не было обнаружено прямой корреляции с количеством частиц теней бактерий (фиг.3). Более высокая секреция кератиноцитами IL-8 по сравнению с IL-6 после инкубации с ΔFliC теней бактерий (фиг.3) и частичная интернализация теней бактерий из ΔFliC Е.coli (фиг.4) может быть связана с присутствием LPS на оболочке теней бактерий. Наличие LPS из разрушенных бактериальных клеток, присутствующих в культуральном супернатанте, может объяснить обнаруженную низкую секрецию IL-8 кератиноцитами после инкубации с супернатантом из ΔFliC Е.coli (фиг.ЗВ). Ранее было показано, что активация клеток меланомы кожи LPS приводит к повышенной выработке IL-8 и клеточной адгезии (Malteni et al., Cancer Lett. 235 (2006), 75-83). Хотя сообщалось, что TLR4 не участвует в поглощении LPS эндотелиальными клетками, связь между TLR4-опосредованной активацией эпидермальных кератиноцитов липополисахаридом (LPS) и их фагоцитарной активностью требует уточнения (Dunzendorfer et al., J. Immunol. 173 (2004), 1166-1170). Несмотря на то, что функциональная экспрессия TLR4 на поверхности кератиноцитов наблюдалась некоторыми исследователями, но не наблюдалась другими [2], интактный LPS на оболочке теней бактерий может способствовать сложному процессу во время узнавания бактериальных компонентов клетками кожи человека, включая кератиноциты. Следовательно, механизмы, вовлеченные в течение активации эпидермальных кератиноцитов через LPS-сигнальный путь, и их точную роль необходимо установить.
Возможно, что кислотная деградация жгутика, имеющегося у wt E.coli теней бактерий, в лизосомальном компартменте кератиноцитов приводит к образованию мономерного флагеллина, который способен связываться с TLR5 и стимулировать экспрессию цитокинов IL-6 и IL-8 и продукцию псориазина. Так как флагеллин, связанный с TLR5 [2], не встречается в ΔFliC теней бактерий и, следовательно, не происходит передачи сигнала, индуцированного этим связыванием, в кератиноцитах тени бактерий должны индуцировать другие пути внутренней передачи сигнала, приводящие к NF-kappaB-индуцированной экспрессии псориазина. Возможно, внутриклеточными рецепторами, которые могут обнаруживать наличие теней бактерий или компонентов тени бактерий независимо от экспрессии флагеллина, являются Nod-подобные рецепторы (NLRs), такие как NOD1 или NOD2. Недавние исследования сообщили о функциональной экспрессии NOD1 [22] и NOD2 [2] фрагментами пептидогликана в кератиноцитах. В частности, NOD1 опосредует обнаружение фрагментов пептидогликана, содержащих производное аминокислоты, мезо-диаминопемилиновую кислоту, a NOD2 опосредует обнаружение мурамил-дипептида [2], у которого оба эти фрагмента являются продуктами деградации интактного пептидогликана Е.coli тени бактерий [60]. О связи между активацией NOD2 мурамил-дипептидом (MDP) и повышенной продукцией антимикробных пептидов в первичных кератиноцитах уже сообщалось [2], а в нашем исследовании продемонстрировано применение теней бактерий для индукции псориазина. Следовательно, полученные результаты демонстрируют возможное применение неживых и безопасных теней бактерий в терапевтических подходах с целью усиления системы врожденной иммунной защиты кожи. Потенциальные терапевтические эффекты теней бактерий можно объединить с действием лекарственных препаратов или других биологически активных веществ посредством их «упаковки» в тени бактерий, которые также могут доставляться внутрь клеток, с целью стимулирования дополнительных полезных для здоровья эффектов [2].
Пример 2. Модулирующее действие нагруженных ресвератролом теней бактерий на продукцию NO в клетках RAW 264.7
Как было показано в более ранних исследованиях, тени бактерий в некоторой степени влияют на параметры системы врожденного иммунитета, например, секрецию цитокинов и экспрессию антимикробных пептидов. Принимая во внимание, что индуцированная iNOS продукция NO, ключевой молекулы во врожденном иммунитете, стимулируется LPS, мы исследовали величину высвобождения радикала, стимулированного тенями бактерий. Более того, было исследовано действие теней, нагруженных RV, в отношении модулированной, вызванной химическими веществами противовоспалительной (снижение продукции NO), а также антипролиферативной активности.
Материалы и методы
Химические вещества
Если не указано иное, все химические вещества были получены от компании Sigma Aldrich.
Культура клеток
Клетки RAW 264.7 получили из американской коллекции типовых культур (АТСС, США), и культивировали в питательной среде, модифицированной Дульбекко, с 4,5 г/л глюкозы (DMEM; Lonza BioWhittaker; W/O Glut P-red) с добавлением 2 мМ L-глутамина (Lonza Bio Whittaker) и 10% эмбриональной телячьей сыворотки, инактивированной с помощью температурной обработки (Gibco; Invitrogen). Кроме того, в среду для культивирования добавляли 100 U Pen-Strep (Lonza). Для оценки жизнеспособности использовали другую среду. При этом клетки культивировали в среде RPMI 1640 (Roswell Park Memorial Institute Medium) с добавлением 10% эмбриональной телячьей сыворотки (FCS), инактивированной нагреванием, пенициллина (104 мкг/мл), стрептомицина (100 мкг/мл), 200 мМ L-глутамина, буфера HEPES (10 мМ), 10% неосновных аминокислот (NEAA) и плазмоцина (5 мкг/мл, Lonza).
Клетки культивировали 45-48 ч (37°C; 5% CO2) до достижения слияния. Использованные в экспериментах среды содержали только антибиотики.
Получение теней бактерий
Тени бактерий из Е.coli NM522 (pGLysivb; 240106-5/6) были получены с помощью контролируемой экспрессии, полученного из фага белка лизиса E, как описано в (Witte et al., 1992. Arch Microbiol. 157(4): p.381-8; Mayr et al., 2005. Infect Immun 73(8): p.4810-7). Инактивацию нелизированных бактерий осуществляли добавлением антибиотиков. Лиофилизированные тени бактерий хранили при комнатной температуре (1 мг лиофилизированного материала (по весу) содержал 1.27*1010 частиц). Тени бактерий ресуспендировали в контрольной среде (test-medium) до экспериментов с обработкой.
Нагрузка теней бактерий ресвератролом
12-24 мг лиофилизованных теней бактерий суспендировали в разных концентрациях ресвератрола (1-35 мг RV/мл метанола) и инкубировали при интенсивном перемешивании (800 об/мин) в течение 30 мин при 28°C. Загруженные тени бактерий собирали центрифугированием при 13000 об/мин в течение 15 мин и трижды промывали осадки водой. Аликвоты теней бактерий 1 мг хранили при -20°C до использования.
Анализ нитритов
Клетки RAW 264.7 рассевали в 96-луночные планшеты и культивировали в течение двух дней. Затем приблизительно 3*105 макрофагов на лунку стимулировали или 200 мкл определенных концентраций «порожних» теней бактерий (положительный контроль), или тенями, нагруженными ресвератролом (46 мкг RV/1×l010 тени бактерий), или «порожними» тенями бактерий плюс определенные концентрации ресвератрола, предоставленные извне, в течение 20 мин. После этого, суспензии теней бактерий удаляли с помощью промывания PBS (дважды) и инкубировали клетки в течение еще 20 часов в темноте при 37°C 5% CO2. Для изучения стимулирующего влияния очищенного LPS (Fluka; Е.coli серотип 055:В5) были проведены эксперименты с длительной инкубацией с различными концентрациями LPS в течение 20 часов.
В качестве индикатора выработки NO измеряли концентрацию нитритов в супернатантах макрофагов, используя реакцию Грисса (Green et al., 1982 Anal Biochem. 126(1): p.131-8). Коротко, 100 мкл каждого супернатанта смешивали с 90 мкл 1% сульфаниламида (Fluka) в 5% H3PO4 и 90 мкл N-(1-Нафтил)-этилендиаминдигидрохлорида в воде. Поглощение определяли при 550 нм при помощи ELISA ридера (Tecan Sunrise).
Исследование поглощения
Нанесение FITC-меченых теней бактерий на клетки RAW 264.7 и их обнаружение
В качестве показателя доставки эндоцитированного ресвератрола определяли поглощение FITC-меченых теней бактерий в анализируемой клеточной линии. Для этого лиофилизированные тени бактерий (5-15 мг) ресуспендировали в 1,5 мл 0,1 М Na2CO3; pH ~9,0. Затем к суспензии теней бактерий добавляли 25 мкл стокового раствора FITC (2 мг FITC в 1 мл DMSO) и перемешивали в течение 2 часов в темноте при 16°C. После пяти стадий отмывки PBS (5 мин; 14000 об/мин) и проверки положительного мечения, осадки теней снова ресуспендировали в натрий-карбонатном буфере и хранили при -20°С до использования.
Клетки RAW 264.7 культивировали и обрабатывали так же, как и при анализе нитритов, с незначительными изменениями. После 20 мин инкубации с определенными количествами «порожних» теней бактерий макрофаги дважды промывали PBS, а промывающие растворы собирали в соседние пустые лунки. Затем измеряли флуоресценцию при помощи флюориметра Tecan Geniospro при длинах волн возбуждения и испускания, равных 485/535 (увеличение 40). Значения общей флуоресценции принимали за 100% нанесенного количества теней, а поглощение вычисляли из итоговой флуоресценции на макрофаг.
Исследование цитотоксичности
Для проверки влияния «порожних» или RV-нагруженных теней бактерий, а также самого данного химического реактива на жизнеспособность клеток RAW 264.7, был использован метод анализа с применением нейтрального красного (NR). Нейтральный красный (3-амино-m-диметиламино-2 метил-феназина гидрохлорид) селективно накапливается в лизосомах живых клеток (Repetto et al. 2008. Nat Protoc, 2008. 3(7): p.1125-31) и таким образом обеспечивает количественную оценку жизнеспособности.
В отдельные лунки 96-луночного планшета высевали по 1,25×105 клеток и давали им прикрепиться в течение ночи. Макрофаги обрабатывали 200 мкл среды, содержащей RV-нагруженные и ненагруженные тени бактерий (все ресуспендировали в sf-среде) в различных соотношениях теней бактерий на клетку (10, 100, 1000) или только RV, или в течение 20 мин с последующим восстановительным периодом 20 часов или в течение 24 часов. Такие же условия были использованы для двух концентраций RV (15 мкМ и 30 мкМ). Тритон Х-100 (0,01%) служил положительным контролем, а клетки, обработанные контрольной средой, служили отрицательным контролем. После обработки клетки дважды промывали PBS и инкубировали или с культуральной средой в течение 20 часов или сразу с 100 мкл NR (конечная концентрация 80 мкг/мл) в течение 2 часов (37°C; 5% CO2). Затем краситель удаляли, а лунки дважды промывали PBS. Извлечение (экстракцию) красителя завершали добавлением 100 мкл кислого обесцвечивающего раствора (1 мл уксусной кислоты, 73 мл 96% этанола и 26 мл деионизированной воды). Планшеты встряхивали в течение 10 мин и измеряли появившуюся окраску при помощи планшетного ридера (Dynex OpsysMR) при 570 нм (контрольная длина волны 690 нм).
Статистика
Все результаты анализировали при помощи GraphPad Prism (версия 5, GraphPad Software, Inc; Сан-Диего; Калифорния, США). Данные выражены как средние значения+SD. Статистический анализ проводили с использованием t-критерия Стьюдента. Статистически значимыми считали значения при p<0,05.
Результаты
Загрузка теней бактерий ресвератролом
Загрузку лиофилизированных Е.coli NM522 тенями бактерий RV проводили простым ресуспендированием теней бактерий в желательном растворе RV. Для определения количества RV в тенях бактерий проводили экстракцию в этаноле и анализировали при помощи ВЭЖХ. Результаты показаны на фиг.5A. Видна четкая зависимость между загрузочной концентрацией RV и полученным извлеченным количеством RV (коэффициент корреляции r2=0,9980). Самая высокая эффективность загрузки была получена после суспендирования лиофилизированных теней бактерий в растворе RV 35 мг/мл. В среднем, после экстракции 1×1010 теней бактерий можно было обнаружить 46 мкг RV. Приблизительно 4% стоковых растворов было получено обратно (восстановлено), если было оценено количество лиофилизованных теней вначале.
Адгезия и поглощение FITC-меченых теней бактерий мышиными макрофагами
Для получения сведений о количестве теней бактерий, которые связываются с или поглощаются мышиными макрофагами после короткого времени совместной инкубации, были проведены эксперименты по количественной оценке флуоресценции. Фиг.5 В показывает результаты, полученные путем измерения флуоресценции RAW 264.7 и Е.coli NM522 теней бактерий после 20 мин совместной инкубации и двух этапов отмывки. Можно видеть четкую зависимость от дозы примененных и связанных с клетками теней, приводящую почти к идеальной линейной регрессии (коэффициент корреляции r2=0,998). Кроме того, при постановке экспериментов с использованием 96- или 24-луночных планшетов различий не наблюдалось (данные не приведены). В среднем 25% использованного количества теней было связано с макрофагами после такого короткого времени инкубации.
Кроме того, чтобы выяснить, поглощаются ли тени бактерий мышиными макрофагами в течение этого периода, были проведены исследования с помощью конфокальной лазерной сканирующей микроскопии (CLSM), в которых интернализация была исследована визуально. Для этого, z-stacks проводились после инкубации FITC-меченых Е.coli NM522 теней с клетками RAW 264.7 через 20 и 40 минут. Макрофаги окрашивали техасским красным фаллоидином, который селективно связывается с F-актиновым скелетом клеток. Изображения, показывающие репрезентативные единичные z-stacks различных оптических сечений, представлены на фиг.6A и фиг.6B. Можно видеть, что FITC-меченые тени бактерий, уже интернализованные клетками, окрашенными красным, становятся желтыми. Зеленый цвет имеют тени бактерий, незахваченные и прикрепившиеся снаружи клетки. Кроме того, при соотношении теней бактерий на клетку, равном 1000, мы наблюдали поглощенные тени бактерий, а также скопления интернализованных теней бактерий в каждом макрофаге.
Индукция выработки NO
Поскольку iNOS индуцируется LPS, продукцию NO исследовали после стимуляции клеток RAW 264.7 различными концентрациями LPS в течение 20 часов. Как показано на фиг.7A, обработка 1-1000 нг/мл LPS приводила к образованию NO при наличии значительной чувствительности, начиная от 1 нг/мл.
Вследствие того, что тени бактерий полностью сохраняют молекулы LPS, связанные с оболочкой, были проведены эксперименты по определению того, до какой степени тени бактерий способны стимулировать продукцию NO. Как выяснилось, соотношения теней на клетку, равного 10, было уже достаточно для достоверной индукции образования NO (P=0,0005), на таком же уровне, что и при 1 нг/ мл свободного LPS.
Четкая, зависимая от количества частиц стимуляция образования NO достигалась при обработке клеток «порожними» тенями бактерий при MOI, равном 100-1000. Однако, более высокие концентрации теней бактерий (2000 и 5000 частиц на клетку) не оказывали какого-либо дополнительного влияния.
Модулирующая способность теней бактерий и теней бактерий, нагруженных RV, стимулировать NO в отличие от RV, привнесенного извне
Как было показано на фиг.7B, тени бактерий способны стимулировать выработку NO дозозависимым образом, в том случае, когда их применяют к макрофагам в соотношении теней бактерий на клетку в пределах от 100 до 1000.
Поскольку во многих исследованиях было показано, что RV способен снижать выработку NO, индуцированную LPS (Saiko et al., 2008. Mutat Res. 658(1-2): p.68-94; Tsai et al., 1999 Br J Pharmacol. 126(3): p.673-80), были проведены эксперименты по исследованию способности RV модулировать продукцию NO, индуцированную тенями бактерий. Для этого «порожние» Е.coli NM522 тенями бактерий применяли к клеткам в соотношении, равном 500. Одновременно, к культурам клеток добавляли три разные концентрации RV. После проведения совместной инкубации в течение 20 мин и двух стадий отмывки продукцию NO измеряли через 20 часов. Результаты показаны на фиг.8A. Можно видеть, что одновременная обработка «порожними» Е.coli NM522 тенями в сочетании с 0,3 мкМ и 0,3 мкМ RV не влияла на индуцированное образование теней бактерий NO. Статистически достоверное различие наблюдалось после обработки 30 мкМ RV (P=0,0078).
Исходя из количества RV, включенного в тени бактерий (фиг.5A), и количества теней бактерий, соединенных с макрофагами (сцепленных с и поглощенных клетками) после 20 мин обработки (фиг.5B), можно определить доставленные тенями бактерий частицы ресвератрола. Поскольку стимуляцию индукции NO в клетках RAW 264.7 проводили при помощи теней бактерий, имеющих самый высокий RV-выход (46 мкг RV/1×1010 тени бактерий) при MOI, равном 100 и 1000, вычисленные значения доставки RV с помощью теней бактерий, могут соответствовать 0,48+0,25 мкМ и 0,86+2,21 мкМ ресвератрола (5,8×1013 и 1,07×1015 RV-частиц на 200 мкл).
Чтобы исследовать, может ли RV, связанный в тенях бактерий, оказывать модулирующее действие на продукцию NO, было проанализировано влияние такого же количества «порожних теней» в сравнении с тенями, нагруженными RV. Кроме того, было оценено высвобождение радикала при одновременном применении «порожних» теней бактерий и 3 мкМ RV (3.61×1014 RV частиц/200 мкл).
Как видно, привнесенный извне RV в сочетании с «порожними» Е.coli NM522 тенями бактерий не снижал высвобождение радикала также эффективно как тени, несущие RV. Наши данные показывают, что значимое уменьшение нитрита было обнаружено при использовании теней, нагруженных RV, при соотношении теней бактерий на клетку, равном 100 (P=0,0048), тогда как 3 мкМ RV не оказывали действия (фиг.8B). С другой стороны, результаты, полученные после обработки макрофагов при MOI, равном 1000, приводили к уменьшению при использовании обоих вариантов. Тем не менее, значимо более низкие количества NO были получены, когда RV-нагруженные тени применяли на клетках RAW 264.7, чем при введении 3 мкМ RV одновременно с «порожними» тенями бактерий (P=0.0002 против Р=0.0158), при сравнении с обработкой одними тенями бактерий (фиг.8C).
Определение жизнеспособности клеток
Чтобы исследовать влияние «порожних» и нагруженных RV теней бактерий (46 мкг RV/1×1010 теней бактерий) на жизнеспособность макрофагов RAW 264.7, были проверены два разных условия обработки с тремя различными соотношениями теней бактерий на клетку (10, 100, 1000). Первый эксперимент проводили так же, как описано для измерений NO, т.е. 20 мин обработки с последующим измерением через 20 часов. Второй эксперимент был связан с эффектами долговременных инкубации в течение 24 часов. Как показано на фиг.9A, тени Е.coli NM522 как таковые не оказывали цитотоксического действия в течение этого периода. Тем не менее, 24-часовая инкубация макрофагов с тенями бактерий при MOI, равном 10, приводила к достоверному эффекту стимулирования роста (P=0,0016), тогда как более высокие концентрации теней бактерий не отличались от контролей, обработанных бессывороточной средой. В то время как, не было обнаружено эффектов ни после кратковременных совместных инкубации с тенями, нагруженными RV, ни при использовании препарата самого по себе (данные не приведены), повышенная метаболическая активность была обнаружена через 24 часа после обработки RV-тенями бактерий при MOI, равном 10 и 100 (P=0,0008 и 0,0111) (фиг.9B).
Поскольку мы не определяли количество связанных с клетками теней бактерий через 24 часа инкубации, не может быть сделано соответствующих утверждений в отношении доставленных теней бактерий концентраций RV.
Теоретически, если все использованные тени бактерий при MOI, равном 1000, могли бы быть поглощены макрофагами, может быть достигнут уровень 30 мкМ. Однако, из исследований по микроскопии нам известно, что это неверно. При условии, что половина количества теней бактерий будет поглощена в течение этого периода, можно получить вычисленную концентрацию ресвератрола, равную 15 мкМ. Поэтому были проведены сравнительные эксперименты, в которых исследовалось влияние на жизнеспособность клеток 15 мкМ и 30 мкМ RV, в противоположность RV, связанному в тенях бактерий (46 мкг RV/1×1010 теней бактерий), которые применялись при соотношении теней на клетку, равном 1000. Тогда как самая низкая концентрация химического вещества совсем не имела влияния, жизнеспособность клеток была резко снижена после обработки 30 мкМ RV (81,23+10,6%). Достоверное снижение жизнеспособности клеток также наблюдалось для RV-теней бактерий (P=0,0462). В среднем 10% клеток погибали из-за доставленного препарата (фиг.9B).
Обсуждение
В настоящем изобретении нами было продемонстрировано, что тени бактерий индуцируют образование NO макрофагами и что эта активность может модулироваться тенями бактерий, нагруженными RV.
Взаимосвязь активности iNOS и высвобождения NO с лечением болезней, вызванных патогенами, например, лейшманиоза или туберкулеза, была продемонстрирована в некоторых исследованиях (Bogdan, С., 2000 Immunol Rev. 173: p.17-26; Sharma et al., 2007. Inflammopharmacology 15(6): p.252-9; Chakravortty и Hensel, 2003. Microbes Infect. 5(7): p.621-7).
В общем, известно, что патогены фагоцитируются клетками системы врожденного иммунитета. Результаты этих исследований показывают, что тени бактерий предпочтительно поглощаются такими клетками, причем было продемонстрировано поглощение различными клеточными линиями макрофагов и дендритных клеток (Haslberger et al., 2000. J Biotechnol. 83(1-2): p.57-66; Kudela et al., 2005. J Immunother. 28(2): p.136-43; Paukner et al., 2003 J Drug Target 11(3): p.151-61). В соответствии с более ранними открытиями, поглощение может быть подтверждено в макрофагальной клеточной линии RAW 264.7 после кратковременной совместной инкубации теней бактерий. Интересно отметить, что с помощью микроскопических исследований (CLSM) было показано, что макрофаги способны поглощать как единичные тени, так и кластеры теней.
Так как тени бактерий имеют все свои патоген-ассоциированные молекулярные паттерны (PAMPs), подобно их природным аналогам, они распознаются соответствующими рецепторами врожденного иммунитета хозяина, например, Toll-подобными рецепторами (TLRs). Следовательно, бактериальный LPS взаимодействует с TLR4, а флагеллин - с TLR5 (Ishii et al., 2008 Cell Host Microbe. 3(6): p.352-63). Поглощение теней бактерий макрофагами мыши клеточной линии RAW 264.7, главным образом, зависит от TLR4, поскольку они почти не экспрессируют TLR5 (Applequist et al., 2003. Int Immunol. 14(9): p.1065-74). В то же время, в Примере 1 показано, что Е. coli теней бактерий проникают в первичные кератиноциты с помощью флагеллин-зависимого TLR5-пути, а также других механизмов поглощения.
Исследования, проведенные Panaro et al., с использованием макрофагов человека служат доказательством прямой корреляции между индуцированной LPS выработкой NO. Эффективность значительно снижалась по обоим параметрам в присутствии L-NMMA, конкурентного ингибитора i-NOS (Panaro et al., 1999. Int J Clin Lab Res. 29(3): p.122-7).
В связи с тем, что известно использование LPS для индукции iNOS посредством взаимодействия с TLR-4 (Bogdan, С, 2001. Nat Immunol 2(10): p.907-16), мы провели сравнительные эксперименты между долговременной инкубацией (20 часов) со свободным LPS и кратковременной инкубацией с различными количествами теней бактерий (20 мин с последующим определением высвобождения NO через 20 часов) в клетках RAW 264.7. Как было выяснено, обработка макрофагов Е.coli тенями при MOI, равном 10, оказывала тот же самый эффект, как 100 нг/мл LPS, что, как было обнаружено Panaro et al., приводило к уничтожению паразитов (Panaro et al., 1999. Int J Clin Lab Res. 29(3): p.122-7). Кроме того, мы проанализировали зависимость между наблюдаемым связыванием клеток теней бактерий, зависимым от количества частиц, и степенью высвобождения NO и обнаружили достоверную положительную корреляцию (Spearman r=1; значение P=0,0167).
Наряду с образованием NO, другие факторы, такие как цитокины, активируют врожденный иммунный ответ к внутриклеточным патогенам. Интерфероны типа I, такие как IFNy, продуцируются различными клетками и проявляют мощную антимикробную активность. В предыдущих исследованиях было показано, что тени бактерий обладают свойством стимулировать продукцию цитокинов. Например, Ebensen et al. обнаружили, что применение М.haemolytica теней бактерий приводило к увеличению количества IFN-γ-продуцирующих клеток селезенки у иммунизированных мышей (Ebensen et al., 2004. J Immunol. 172(11): p.6858-65). В другом исследовании на животной модели уровень IFNγ селезенки достоверно увеличивался после иммунизации Е.coli 0157:Н7 теней бактерий (Mayr et al., 2005. Infect Immun 73(8): p.4810-7). Поскольку известно, что IL-12 усиливает продукцию IFNγ и играет основную роль в развитии ТЫ клеток, были проведены исследования с тенями бактерий, и Haslberger et al. сообщили об эффективной стимуляции продукции IL-12 в антиген-презентирующих клетках (Haslberger et al., 2000. J Biotechnol. 83(1-2): p.57-66).
Возвращаясь к продукции NO, результаты исследований с использованием ресвератрола показали его подавляющий характер в отношении индукции iNOS (Saiko et al., 2008. Mutat Res. 658(1-2): p.68-94; Tsai et al., 1999 Br J Pharmacol. 126(3): p.673-80). Поэтому, в настоящем исследовании были определены эффекты ресвератрола, или совместно инкубированного с «порожними» тени бактерий или внутриклеточно связанного в тени бактерий, относительно индуцированной тенями бактерий выработки NO макрофагами RAW 264.7. Наблюдалось высоко достоверное уменьшение высвобождения радикала при применении RV-нагруженного тенями бактерий по сравнению с их «порожним» вариантом. Более того, внесенное извне чистое вещество в концентрации 3 мкМ, которая является приблизительно в 6 раз более высокой, чем концентрация, доставляемая связанными с клетками тенями при MOI, равном 100, не влияло на образование NO в сравнении с использованием нагруженных теней бактерий, которые снижали высвобождение радикала примерно на 15%.
Насколько нам известно, клеточный механизм поглощения ресвератрола до сих пор остается неясным. До настоящего момента не было обнаружено специфического рецептора для данного лекарственного средства. Благодаря своей структуре, ресвератрол способен взаимодействовать с рецепторами клеточной поверхности, такими как рецепторы эстрогена или интегрины (Saiko et al., 2008. Mutat Res. 658(1-2): p.68-94; Lin et al., 2006 Faseb J. 20(10): p.1742-4). Однако, исходя из наших данных и факта внутриклеточной доставки ресвератрола RV-нагруженными тенями бактерий после поглощения макрофагами, существование рецептора, свойственного для ресвератрола, является весьма вероятным. Для этого гипотетического рецептора мы предлагаем термин «BGRV».
Известно, что бактериальный LPS является причиной множества патофизиологических воздействий на большое разнообразие клеток млекопитающих. В самом худшем случае, последствиями может быть эндотоксический шок и полиорганная недостаточность с последующей гибелью. Эта эндотоксичность опосредована активацией иммунных и воспалительных клеток хозяина, в частности мононуклеарных фагоцитов, которые продуцируют многочисленные биологически активные медиаторы, включая фактор некроза опухолей альфа (TNF-альфа), интерлейкин 1, IL-6 и оксид азота (Hirohashi и Morrison, 1996. Infect Immun. 64(3): p.1011-5).
В связи с тем, что эндотоксическое содержимое грамотрицательных бактерий также присутствует в тени бактерий, в последнее десятилетие проводились исследования безопасности и токсичности теней бактерий. Были проведены эксперименты, в которых препараты теней бактерий, полученных на основе патогенных Escherichia coli 026:В6 и Salmonella typhimurium С5, исследовали на предмет их эндотоксической активности с помощью стандартного анализа на основе лизата амебоцитов Limulus (LAL) и анализа 2-кето-3-дезоксиоктоната (KDO) (Haslberger et al., 2000. J Biotechnol. 83(1-2): p.57-66; Mader et al., 1997. Vaccine. 15(2): p.195-202). В среднем, оба вида теней показали только 2-5% эндотоксической активности по сравнению со свободным LPS S.abortus equi. Эксперименты на культуре клеток линии RAW 264.7 показали, что было необходимо в 100 раз больше теней бактерий для секреции фактора некроза опухолей альфа (TNFα) и синтеза простагландина E2 (PGE2) по сравнению со свободным LPS. Авторы также подчеркнули, что не было зарегистрировано значительно меньше ответов у кроликов, когда тени бактерий вводили внутривенно (i.v.) в дозах <250 нг кг-1, которая была достаточной для индукции измеримого иммунного ответа у кроликов (Mader et al., 1997. Vaccine. 15(2): p.195-202.).
В настоящем исследовании также были проведены исследования цитотоксичности. Не наблюдалось поражающего действия Е. coli теней бактерий как таковых даже при проведении инкубации вплоть до 24 часов. Таким образом, четко показано, что связанное с тенями бактерий длительное воздействие на экспрессию iNOS и продукцию больших количеств NO не вызывает гибель клеток in vitro.
Однако при инкубации клеток при низком MOI теней бактерий, равном 10, наблюдались стимулирующие рост эффекты. При тех же самых условиях обработки это положительное влияние было даже более выражено в том случае, когда RV был загружен внутрь частиц. Тем не менее, цитотоксический эффект, вызванный RV, доставленным тенями бактерий, мог быть дополнительно продемонстрирован после применения уровня 1000 теней бактерий на клетку в течение 24 часов. Другим доказательством эффективной доставки RV теней бактерий является снижение жизнеспособности клеток приблизительно на 10%.
Помимо противовоспалительных эффектов, т.е. подавления iNOS, было показано, что RV обусловливает антимикробную (Chan, 2002. Biochem Pharmacol. 63(2): p.99-104; Faith et al., 2006. Antiviral Res. 72(3): p.242-51; Schriever et al., 2003 Atherosclerosis. 171(2): p.379-80; Kedzierski et al., 2007. Parasitol Res. 102(1): p.91-7) активность in vitro, а в других исследованиях была обнаружена его химиотерапевтическая активность (смотри обзор Saiko et al., 2008. Mutat Res. 658(1-2): p.68-94).
Краткий обзор о содержании ресвератрола в пищевых источниках дается Udenigwe et al. Самые высокие концентрации обнаружены в красных винах в пределах от 2,3-46,3 мкМ (Udenigwe et al., 2008. Nutr Rev. 66(8): p.445-54). Такие значения сравнимы с RV содержанием, найденным в тенях бактерий, и которое доставляется в макрофаги в настоящем исследовании. Однако для достижения вышеупомянутых концентраций требуется потребление одного литра напитка. Кроме того, известно, что RV быстро метаболизируется в пищеварительном канале и печени в пределах 8-14 мин in vivo (Saiko et al., 2008. Mutat Res. 658(1-2): p.68-94). Так как эффекты наблюдались при использовании RV-теней бактерий уже после короткой совместной инкубации с клетками RAW 264.7 в течение 20 мин, мы предполагаем, что возможно такой метаболизм может быть обойден благодаря защите вещества оболочкой теней, и отсроченная клеточно-специфическая доставка может быть приведена в действие in vivo.
Как показано в настоящем исследовании, тени бактерий оказывают высоко значимое влияние на стимуляцию образования NO в макрофагах in vitro, которое, как было показано, поддается модификации, когда RV связан с внутренней частью теней бактерий. Принимая во внимание, что высвобождение N0, также как RV, способствует антимикробным, а также противораковым эффектам, тот факт, что тени бактерий усиливают секрецию клетками цитокинов и антимикробных пептидов, выдвигает эту систему на первый план для использования при терапевтическом лечении внутриклеточных патогенов или рака.
Источники информации
1. Abtin, A., et al., Bacterial ghosts promote innate immune responses in human keratinocytes.
2. Abtin, A., L.Eckhart, M.Mildner, F.Gruber, J.M.Schroder, and E.Tschachler. 2008. Flagellin is the principal inducer of the antimicrobial peptide S100A7c (psoriasin) in human epidermal keratinocytes exposed to Escherichia coli. FASEB J. 7:2168-2176
3. Aggarwal, B.B., et al., Role of resveratrol in prevention and therapy of cancer: preclinical and clinical studies. Anticancer Res, 2004. 24(5A): p.2783-840.
4. Akira, S. and K.Takeda. 2004. Toll-like receptor signalling. Nat.Rev.Immunol. 4:499-511.
5. Akira, S., S.Uematsu, and O.Takeuchi. 2006. Pathogen recognition and innate immunity. Cell 124:783-801.
6. Applequist, S.E., R.P. Wallin, and H.G.Ljunggren, Variable expression of Toll-like receptor in murine innate and adaptive immune cell lines. Int Immunol, 2002. 14(9): p.1065-74.
7. Bates, D., J.Epstein, E.Boye, K.Fahrner, H.Berg, and N.Kleckner. 2005. The Escherichia coli baby cell column: a novel cell synchronization method provides new insight into the bacterial cell cycle. Mol.Microbiol. 57:380-391.
8. Bogdan, С, M.Rollinghoff, and A. Diefenbach, Reactive oxygen and reactive nitrogen intermediates in innate and specific immunity. Curr Opin Immunol, 2000. 12(1): p.64-76.
9. Bogdan, С, M. Rollinghoff, and A. Diefenbach, The role of nitric oxide in innate immunity. Immunol Rev, 2000. 173: p.17-26.
10. Bogdan, C, Nitric oxide and the immune response. Nat Immunol, 2001. 2(10): p.907-16.
11. Chakravortty, D. and M. Hensel, Inducible nitric oxide synthase and control of intracellular bacterial pathogens. Microbes Infect, 2003. 5(7): p.621-7.
12. Chan, M.M., Antimicrobial effect of resveratrol on dermatophytes and bacterial pathogens of the skin. Biochem Pharmacol, 2002. 63(2): p.99-104.
13. Creagh, E.M. and L.A. O'Neill. 2006. TLRs, NLRs and RLRs: a trinity of pathogen sensors that co-operate in innate immunity. Trends Immunol. 27:352-357.
14. Dziarski, R. and D. Gupta. 2006. Mammalian PGRPs: novel antibacterial proteins. Cell Microbiol. 8:1059-1069.
15. Ebensen, Т., et al., Bacterial ghosts are an efficient delivery system for DNA vaccines. J Immunol, 2004. 172(11): p.6858-65.
16. Eko, F.О., T.Schukovskaya, E. Y. Lotzmanova, V.V.Firstova, N.V.Emalyanova, S.N.Klueva, A.L.Kravtzov, L.F.Livanova, V.V.Kutyrev, J.U.Igietseme, and W.Lubitz. 2003. Evaluation of the protective efficacy of Vibrio cholerae ghost (VCG) candidate vaccines in rabbits. Vaccine 21:3663-3674.
17. Faith, S.A., et al., Resveratrol suppresses nuclear factor-kappaB in herpes simplex virus infected cells. Antiviral Res, 2006. 72(3): p.242-51.
18. Falchetti, R., et al., Effects of resveratrol on human immune cell function. Life Sci, 2001. 70(1): p.81-96.
19. Gao, X., et al., Immunomodulatory activity of resveratrol: discrepant in vitro and in vivo immunological effects. Biochem Pharmacol, 2003. 66(12): p.2427-35.
20. Glaser, R., J. Harder, H. Lange, J.Bartels, E.Christophers, and J. M.Schroder. 2005. Antimicrobial psoriasin (S100A7) protects human skin from Escherichia coli infection. Nat.Immunol. 6:57-64.
21. Green, L.C., et al., Analysis of nitrate, nitrite, and [15N]nitrate in biological fluids. Anal Biochem, 1982. 126(1): p.131-8.
22. Harder, J. and G. Nunez. 2009. Functional Expression of the Intracellular Pattern Recognition Receptor NODI in Human Keratinocytes. J.Invest Dermatol. 5:1299-302
23. Haslberger, A.G., et al., Activation, stimulation and uptake of bacterial ghosts in antigen presenting cells. J Biotechnol, 2000. 83(1-2): p.57-66.
24. Hayashi, F., K.D.Smith, A.Ozinsky, T.R.Hawn, E.C.Yi, D.R.Goodlett, J.K.Eng, S.Akira, D. M.Underbill, and A.Aderem. 2001. The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5. Nature 410:1099-1103.
25. Hirohashi, N. and D.C.Morrison, Low-dose lipopolysaccharide (LPS) pretreatment of mouse macrophages modulates LPS-dependent interleukin-6 production in vitro. Infect Immun, 1996. 64(3): p.1011-5.
26. Huter, V., M.P.Szostak, J. Gampfer, S.Prethaler, G. Wanner, F.Gabor, and W.Lubitz. 1999. Bacterial ghosts as drug carrier and targeting vehicles. Journal of Controlled Release 61:51-63.
27. Ishii, K.J., S.Koyama, A.Nakagawa, C.Coban, and S.Akira. 2008. Host innate immune receptors and beyond: making sense of microbial infections. Cell Host.Microbe 3:352-363.
28. Jalava, K., F.О.Eko, E.Riedmann, and W.Lubitz. 2003. Bacterial ghosts as carrier and targeting systems for mucosal antigen delivery. Expert.Rev.Vaccines. 2:45-51.
29. Jechlinger, W., C.Haller, S.Resch, A. Hofmarm, M.P.Szostak, and W.Lubitz. 2005. Comparative immunogenicity of the hepatitis В virus core 149 antigen displayed on the inner and outer membrane of bacterial ghosts. Vaccine 23:3609-3617.
30. Kedzierski, L., et al., In vitro antileishmanial activity of resveratrol and its hydroxylated analogues against Leishmania major promastigotes and amastigotes. Parasitol Res, 2007. 102(1): p.91-7.
31. Kedzierski, L., et al., Leishmaniasis: current treatment and prospects for new drugs and vaccines. Curr Med Chem, 2009. 16(5): p.599-614.
32. Kudela, P., S.Paukner, U.B.Mayr, D.Cholujova, G.Kohl, Z.Schwarczova, J.Bizik, J.Sedlak, and W.Lubitz. 2007. Effective gene transfer to melanoma cells using bacterial ghosts. Cancer Lett. 1:54-63
33. Kudela, P., S.Paukner, U.B.Mayr, D.Cholujova, Z.Schwarczova, J.Sedlak, J.Bizik, and W.Lubitz. 2005. Bacterial ghosts as novel efficient targeting vehicles for DNA delivery to the human monocyte-derived dendritic cells. J.Immunother. 28:136-143.
34. Leiro, J., et al., In vitro effects of resveratrol on the viability and infectivity of the microsporidian Encephalitozoon cuniculi. Antimicrob Agents Chemother, 2004. 48(7): p.2497-501.
35. Leiro, J., et al., In vitro effects of the polyphenols resveratrol, mangiferin and (-)-epigallocatechin-3-gallate on the scuticociliate fish pathogen Philasterides dicentrarchi. Dis Aquat Organ, 2004. 59(2): p.171-4.
36. Lin, H.Y., et al., Integrin alphaVbeta3 contains a receptor site for resveratrol. Faseb J, 2006. 20(10): p.1742-4.
37. Lubitz, P., U.B.Mayr, and W. Lubitz. 2009. Applications of Bacterial Ghosts in Biomedicine, In: C.A.Guzman and G. Feuerstein (eds.), Pharmaceutical Biotechnology. Landes Biosciences, Austin, TX, USA.
38. Mader, H.J., et al., Endotoxicity does not limit the use of bacterial ghosts as candidate vaccines. Vaccine, 1997. 15(2): p.195-202.
39. Mayr, U.В., P.Walcher, C.Azimpour, E. Riedmann, C.Haller, and W.Lubitz. 2005. Bacterial ghosts as antigen delivery vehicles. Adv. Drug Deliv.Rev. 57:1381-1391.
40. Mayr, U.B., et al., Bacterial ghosts as an oral vaccine: a single dose of Escherichia coli 0157:H7 bacterial ghosts protects mice against lethal challenge. Infect Immun, 2005. 73(8): p.4810-7.
41. Mildner, M., C.Ballaun, M. Stichenwirth, R.Bauer, R.Gmeiner, M.Buchberger, V.Mlitz, and E. Tschachler. 2006. Gene silencing in a human organotypic skin model. Biochem. Biophys. Res. Commun. 348:76-82.
42. Miller, L.S., О.E.Sorensen, P.T.Liu, H.R.Jalian, D.Eshtiaghpour, В.E.Behmanesh, W.Chung, T.D.Starner, J. Kim, P.A.Sieling, T.Ganz, and R.L.Modlin. 2005. TGF-alpha regulates TLR expression and function on epidermal keratinocytes. J.Immunol. 174:6137-6143.
43. Panaro, M.A., et al., Inducible nitric oxide synthase and nitric oxide production in Leishmania infantum-infected human macrophages stimulated with interferon-gamma and bacterial lipopolysaccharide. Int J Clin Lab Res, 1999. 29(3): p.122-7.
44. Paukner, S., et al., Sealed bacterial ghosts-novel targeting vehicles for advanced drug delivery of water-soluble substances. J Drug Target, 2003. 11(3): p.151-61.
45. Paukner, S., T.Stiedl, P. Kudela, J.Bizik, F. Al Laham, and W.Lubitz. 2006. Bacterial ghosts as a novel advanced targeting system for drug and DNA delivery. Expert.Opin.Drug Deliv. 3:11-22.
46. Pfaffl, M.W. 2001. A new mathematical model for relative quantification in realtime RT-PCR. Nucleic Acids Res. 29:e45.
47. Rendl, M., J. Ban, P.Mrass, C.Mayer, B.Lengauer, L.Eckhart, W.Declerq, and E.Tschachler. 2002. Caspase-14 expression by epidermal keratinocytes is regulated by retinoids in a differentiation-associated manner. J.Invest Dermatol. 119:1150-1155.
48. Repetto, G., A. del Peso, and J.L.Zurita, Neutral red uptake assay for the estimation of cell viability/cytotoxicity. Nat Protoc, 2008. 3(7): p.1125-31.
49. Riedmann, E.M., J.M.Kyd, A. W. Cripps, and W.Lubitz. 2007. Bacterial ghosts as adjuvant particles. Expert. Rev. Vaccines. 6:241-253.
50. Saiko, P., et al., Resveratrol and its analogs: defense against cancer, coronary disease and neurodegenerative maladies or just a fad? Mutat Res, 2008. 658(1-2): p.68-94.
51. Schriever, C., S.L.Pendland, and G.B.Mahady, Red wine, resveratrol, Chlamydia pneumoniae and the French connection. Atherosclerosis, 2003. 171(2): p.379-80.
52. Sharma, J.N., A.Al-Omran, and S.S. Parvathy, Role of nitric oxide in inflammatory diseases. Inflammopharmacology, 2007. 15(6): p.252-9.
53. Summersgill, J.T., et al., Killing of Legionella pneumophila by nitric oxide in gamma-interferon-activated macrophages. J Leukoc Biol, 1992. 52(6): p.625-9.
54. Tsai, S.H., S.Y.Lin-Shiau, and J.K. Lin, Suppression of nitric oxide synthase and the down-regulation of the activation of NFkappaB in macrophages by resveratrol. Br J Pharmacol, 1999. 126(3): p.673-80.
55. Udenigwe, C.C., et al., Potential of resveratrol in anticancer and anti-inflammatory therapy. Nutr Rev, 2008. 66(8): p.445-54.
56. Viala, J., C.Chaput, I.G. Boneca, A.Cardona, S.E.Girardin, A.P.Moran, R.Athman, S. Memet, M.R.Huerre, A.J.Coyle, P.S.DiStefano, P.J.Sansonetti, A. Labigne, J.Berlin, D.J.Philpott, and R.L.Ferrero. 2004. Nodi responds to peptidoglycan delivered by the Helicobacter pylori cag pathogenicity island. Nat.Immunol. 5:1166-1174.
57. Voss, E., J. Wehkamp, K.Wehkamp, E.F.Stange, J.M.Schroder, and J. Harder. 2006. NOD2/CARD15 mediates induction of the antimicrobial peptide human beta-defensin-2. J.Biol.Chem. 281:2005-2011.
58. Witte, A., et al., Dynamics of РЫХ174 protein E-mediated lysis of Escherichia coli. Arch Microbiol, 1992. 157(4): p.381-8.
59. Witte, A., G.Wanner, U.Blasi, G. Halfmann, M. Szostak, and W. Lubitz. 1990. Endogenous transmembrane tunnel formation mediated by phi XI74 lysis protein E.J.Bacteriol. 172:4109-4114.
60. Witte, A., G.Wanner, W.Lubitz, and J.V.Holtje. 1998. Effect of phi X174 protein E-mediated lysis on murein composition of Escherichia coli. FEMS Microbiol.Lett. 164:149-157.
61. Witte, A., U.Blasi, G.Halfmann, M. Szostak, G.Wanner, and W. Lubitz. 1990. Phi X174 protein E-mediated lysis of Escherichia coli. Biochimie 72:191-200.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110>Lubitz, Werner
<120>Bacterial ghosts for mediating innate immunity
<130>44808PWO
<140>PCT/EP2011/063566
<141>2011-08-05
<160>4
<170>PatentIn version 3.3
<210>1
<211>21
<212>DNA
<213>Artificial
<220>
<223>-2-microglobulin (B2M) F pimer
<400>1
gatgagtatg cctgccgtgt g 21
<210>2
<211>19
<212>DNA
<213>Artificial
<220>
<223>-2-microglobulin (B2M) R primer
<400>2
caatccaaatgcggcatct 19
<210>3
<211>22
<212>DNA
<213>Artificial
<220>
<223>psoriasin F primer
<400>3
ggagaacttc cccaacttcctt 22
<210>4
<211>23
<212>DNA
<213>Artificial
<220>
<223>psoriasin R primer
<400>4
ggagaagaca ttttattgttcct 23
Реферат
Изобретение относится к микробиологии. Описано применение теней бактерий Е. coli для стимуляции врожденного иммунного ответа, где врожденный иммунный ответ стимулируется индукцией экспрессии и/или высвобождением по меньшей мере одного модулятора врожденного иммунитета, выбранного из группы, состоящей из молекул антимикробной защиты, провоспалительных цитокинов, активных форм азота (RNS) и активных форм кислорода (ROS). 3 н. и 18 з.п. ф-лы, 9 ил., 2 пр.

Комментарии