Полученные из бактерий интактные мини-клетки для доставки лекарственных средств к опухолям мозга - RU2664698C2
Код документа: RU2664698C2
Чертежи











Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет предварительной патентной заявки США с серийным №61/569907, поданной 13 декабря 2011 г., полное содержание которой включено в настоящий документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Первичные опухоли мозга состоят из различных групп новообразований, происходящих из клеток множества различных линий дифференцировки. В соответствии с классификацией Всемирной организации здравоохранения (Louis et al., 2007), опухоли центральной нервной системы подразделяются на астроцитарные, олигодендроглиальные или смешанные (олигоастроцитарные). Эти опухоли дополнительно подразделяются на подтипы и классифицируются на основании гистологических показателей на степени I-IV, при этом опухоли IV степени являются наиболее агрессивными. Мультиформная глиобластома (GBM), наиболее агрессивная форма первичной злокачественной опухоли мозга, составляет примерно от 45% до 50% всех первичных опухолей мозга (Wrensch et al., 2002; Behin et al., 2003) и является второй по масштабности причиной смерти от рака у взрослых в возрасте до 35 лет (Allard et al., 2009).
Несмотря на многочисленные терапевтические усилия, включая циторедуктивную хирургию, радиотерапию и химиотерапию, прогноз для пациентов с глиомой остается очень неблагоприятным (Stewart, 2002; Stupp et al., 2005). У большинства из них в конечном итоге развивается рецидивирующее и прогрессирующее заболевание, после чего медиана выживаемости составляет около 6 месяцев (Wong et al., 1999; Lamborn et al., 2008). Медиана выживаемости для пациентов с GBM составляет примерно 12-14 месяцев (Stupp et al., 2005).
Кроме того, метастазы в мозге от первичных опухолей, таких как рак молочной железы, легкого и кожи (меланома), является значительной и растущей проблемой общественного здравоохранения. По оценкам, у 250000 пациентов в Соединенных Штатах в 2009 году было диагностировано наличие метастазов в мозге (Fox et al., 2011), что более чем в 10 раз выше, чем частота развития первичных опухолей мозга (Jemal et al., 2009). Прогноз для пациентов с метастазами в мозге очень неблагоприятный, и большинство пациентов живут только 4-6 месяцев после постановки диагноза. Современные схемы лечения обеспечивают крайне незначительные преимущества в выживаемости (Eichler и Loeffler, 2007).
Полное хирургическое удаление глиом почти невозможно из-за их диффузно инфильтративного характера и близости к жизненно важным структурам мозга. Системная терапия также ограничена, в силу так называемого гематоэнцефалического барьера (ГЭБ) (BBB). См., в основном, Cecchelli et al. (2007).
Этот барьер находится внутри эндотелия капилляров мозга и является объектом изучения уже более 100 лет. Действительно, тот факт, что большинство потенциальных лекарственных средств для опухолей мозга никогда не доходят до этапа клинического применения (Pardridge, 2007), связан, главным образом, с их неспособностью пересекать ГЭБ и достигать уровней, имеющих терапевтический эффект (Groothuis, 2000).
Несмотря на активные усилия в течение нескольких десятилетий, показатели излечиваемости при лечении злокачественных опухолей мозга остаются крайне низкими. Таким образом, лечение рака мозга является одной из самых больших проблем в онкологии. Более того, преобладающее мнение заключается в том, что ГЭБ является основным ограничивающим фактором при доставке лекарственного средства в опухоли мозга.
Соответственно, значительные усилия предпринимаются на глобальном уровне для обнаружения и разработки новых лекарственных средств, которые достаточно малы, чтобы пересекать ГЭБ и улучшать показатели выживаемости для пациентов с GBM. Кроме того, в стадии разработки находятся способы транспортировки лекарственных средств за ГЭБ и в микроокружение опухоли мозга.
Среди подходов, которые были изучены в попытке обойти ограничение ГЭБ, можно назвать следующие.
Гиперосмотическое нарушение ГЭБ (Kroll и Neuwelt, 1998).
Химическая модификация барьера (Black et al., 1997).
Попытки связать лекарственные средства с соединениями, имеющими переносчики через ГЭБ (Bickel et al., 2001; Zhang and Pardridge, 2007).
Прямое введение лекарственных средств в опухоли мозга и их непосредственное окружение (Hassenbusch et al., 2002; Hau et al., 2002; Reardon et al., 2002; Weber et al., 2002). Данный подход включает размещение нагруженных лекарственным средством капсул вокруг ложа удаленной опухоли, инфузию средств в полость удаленной опухоли или вокруг нее, или прямую инфузию лекарственных средств в опухолевую массу.
Конвекционная доставка или «CED» (Bobo et al., 1994; Morrison et al., 1994; Hadjipanayis et al., 2008; Hadjipanayis et al., 2010). При CED небольшой перепад гидростатического давления создается за счет шприцевого насоса для распространения инфузата непосредственно в области центральной нервной системы (ЦНС). CED является минимально инвазивной хирургической процедурой, которая с помощью градиента давления создает конвекцию жидкости в мозге, что позволяет обойти ГЭБ. Таким образом, лекарственные средства можно доставлять в мозг с минимальной токсичностью, а также к нормальным тканям и органам, обычно доступным при системной доставке.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
С учетом недостатков, которыми страдают общепринятые подходы в данной области, предложен способ системного введения терапевтически эффективного количества композиции, состоящей из множества интактных, полученных из бактерий мини-клеток, в котором каждая мини-клетка из множества заключает в себе антинеопластическое средство. К тому же, в настоящем описании предусмотрено использование такой композиции для производства лекарственного средства для лечения опухоли мозга. Множество может включать по меньшей мере примерно 108 мини-клеток, в том числе, но без ограничения, по меньшей мере примерно 1010 мини-клеток. Кроме того, описанная в настоящем документе композиция может содержать менее чем примерно 10 ЕЭ (EU) свободного эндотоксина и/или не более 1 родительской бактериальной клетки на 108 мини-клеток, например, на 1010 мини-клеток.
Антинеопластическое средство, заключающееся в мини-клетках, может представлять собой радиоактивный изотоп, например, такой как иттрий-90, технеций-99m, йод-123, йод-131, рубидий-82, таллий-201, галлий-67, фтор-18, ксенон-133 или индий-111, который может быть присоединен к белку или углеводу на поверхности мини-клеток, или он может быть присоединен к поверхности нацеленного на опухоль лиганда, связанного на поверхности мини-клеток. В данном контексте композиция может содержать, например, от примерно 30 Гр до примерно 100 Гр радиоактивности. Антинеопластическое средство может также представлять собой химиотерапевтическое лекарственное средство, при этом, например, композиция содержит его в количестве не более 1 мг. Кроме того, антинеопластическое средство может представлять собой функциональную нуклеиновую кислоту или полинуклеотид, кодирующий функциональную нуклеиновую кислоту. Таким образом, функциональная нуклеиновая кислота может ингибировать ген, который стимулирует пролиферацию опухолевых клеток, ангиогенез или устойчивость к химиотерапии, и/или который ингибирует апоптоз или арест клеточного цикла. Примерами класса функциональных нуклеиновых кислот являются молекулы рибонуклеиновой кислоты, выбранной из группы, состоящей из миРНК, микроРНК, кшРНК, длинной некодирующей РНК (lincRNA), антисмысловой РНК и рибозима.
В некоторых вариантах осуществления, в соответствии с любым из вышесказанного, каждая мини-клетка из вышеупомянутого множества может содержать лиганд, обладающий специфичностью в отношении поверхностного рецептора нефагоцитирующих клеток млекопитающих, например, антигена опухолевых клеток. Соответственно, лиганд может представлять собой, например, антитело, которое специфически узнает такой антиген опухолевых клеток.
Методологию данного описания можно использовать для лечения целого ряда опухолей мозга, например, но без ограничения, группы, состоящей из глиобластомы, астроцитарной опухоли, олигодендроглиальной опухоли, эпендимомы, краниофарингиомы, опухоли гипофиза, первичной лимфомы мозга, опухоли шишковидной железы, первичной опухоли из зародышевых клеток мозга, а также их сочетаний. Подвергающаяся лечению опухоль может быть первичной опухолью мозга или метастатической опухолью мозга.
Другие цели, особенности и преимущества станут очевидными из следующего далее подробного описания. Подробное описание и конкретные примеры приведены исключительно с иллюстративными целями, поскольку различные изменения и модификации в пределах сущности и объема конкретных вариантов осуществления станут очевидными из данного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГУРА 1. Количественное определение рецептора EGF на клетках опухоли мозга человека (U87-MG) и собаки, обработанных анти-EGFR мАт с последующей обработкой конъюгированными с R-фикоэритрином антителами козы против IgG мыши. Клетки анализировали с использованием FACS и сравнивали с флуоресцентными стандартами микрогранул с R-фикоэритрином. Контрольные клетки обрабатывали таким же образом, за исключением первичного антитела. Результаты количественного определения EGFR показали, что концентрация EGFR на клетку (в порядке убывания) для клеток BCD-1, U87-MG, BCD-9, BCD-8 и J3T составляла 2866854, 1465755, 930440, 774352 и 287622, соответственно. Результаты для каждой линии клеток приведены в случае контроля (кривые с темной границей) и в случае обработки анти-EGFR мАт (кривые без темной границы).
ФИГУРА 2. Приведены результаты анализа клеточной пролиферации (MTS) для определения чувствительности к доксорубицину клеток злокачественной опухоли мозга собаки и человека (U87-MG). Планки погрешностей, ± SEM.
ФИГУРА 3. Репрезентативные гистограммы анализов FACS демонстрируют эффективность связыванияEGFRмини-клетокDox с клетками злокачественной опухоли мозга собаки и человека. >95% клеток в каждом случае демонстрировали значительное связываниеEGFRмини-клетокDox. Клетки, обработанные неспецифически нацеленнымиgp120мини-клеткамиDox, не проявляли какого-либо связывания с клетками. Анти-gp120 антитело направлено против белка gp120 вирусного капсида ВИЧ, который не обнаружен ни на одной из клеток опухолей.
ФИГУРА 4. Клетки опухоли мозга человека и собаки обрабатывалиEGFRмини-клеткамиDox и контрольнымиgp120мини-клеткамиDox в течение 3 часов. Мини-клетки, связанные с клетками опухолей, визуализировали после обработки конъюгатом антитела козы против иммуноглобулинов мыши IgG2a-AF488 (зеленая флуоресценция, показана более светлая зернистость), связывающимся с анти-ЛПС компонентом (IgG2a) биспецифического антитела, используемого для нацеливания соответствующих мини-клеток. Изображения справа или каждая из вертикальных панелей визуализированы на аутофлуоресценцию dox (красная флуоресценция, более темная зернистость) и демонстрируют, что dox находится в ядре большинства трансфицированных клеток. Изображения получали с использованием флуоресцентного микроскопа Leica. Масштабная полоска, 20 мкм.
ФИГУРА 5. Стабилизация/регрессия опухолей у семи собак с опухолями мозга на поздней стадии после леченияEGFRмини-клеткамиDox. МРТ-изображения до лечения (перед введением доз) для каждой собаки приведены в левой вертикальной колонке. В средней и правой вертикальных колонках приведены МРТ-изображения после леченияEGFRмини-клеткамиDox, и количество доз показано для каждой МРТ. Приведенные МРТ-срезы включают сагиттальные (BCD-1 и -6), аксиальные (BCD-2 до -5) и корональные (BCD-7). Объемы опухолей (размеры в см) приведены под каждым изображением МРТ, и стрелка обозначает местоположение соответствующих опухолей.
ФИГУРА 6. Определяли биохимические параметры сыворотки, после лечения, для семи собак со злокачественными опухолями мозга (BCD-1-BCD7). Горизонтальные линии на каждом графике представляют нормальный референсный диапазон у собак. Планки погрешностей, ± SEM.
ФИГУРА 7. Гематологические параметры сыворотки, определенные после лечения у семи собак со злокачественными опухолями мозга (BCD-1-BCD7). Горизонтальные линии на каждом графике представляют нормальный референсный диапазон у собак. Планки погрешностей, ± SEM.
ФИГУРА 8. Уровни TNFα, IL-6 и IL-10 в сыворотке показаны для семи собак со злокачественными опухолями мозга после леченияEGFRмини-клеткамиDox.
ФИГУРА 9. Приведены титры анти-ЛПС антител у 7 собак со злокачественными опухолями мозга (выживающих) после леченияEGFRмини-клеткамиDox.
ФИГУРА 10. Проиллюстрировано выживание (в днях) для 7 собак со злокачественными опухолями мозга (левая ось y, представлено столбиками), наряду с введенными количествами дозEGFRмини-клетокDox (левая ось y, представлено ромбами над каждым столбиком). Полосатые столбики соответствуют собакам, продолжающим жить и находящимся в стадии ремиссии. Темные сплошные столбики соответствуют собакам, у которых заболевание стабилизировалось до рецидива опухоли, возможно, вследствие развития устойчивости к dox, и эти собаки были подвергнуты эвтаназии. Светлый сплошной столбик соответствует собаке, которая находилась в стадии ремиссии, однако умерла из-за посторонней инфекции.
ФИГУРА 11. (a) Совместно регистрированные T1-взвешенные постконтрастные изображения МРТ и изображения ОФЭКТ (SPECT) показаны раздельно, (i) и (iii), и при наложении изображений (ii) в трех ортогональных плоскостях (корональной, сагиттальной и трансаксиальной). Площадь захвата и область, в которой она локализована, указаны стрелками. Захват был ниже, чем во внемозговых очагах, видимых симметрично с каждой стороны головы, но это был единственный захват, наблюдаемый в мозге.
(b) Результаты приведены для другого животного. Только трансаксиальные изображения приведены для МРТ (i) и ОФЭКТ (iii). Интенсивный захват виден в аномалии, продемонстрированной на МРТ. Изображение (ii) представляет собой совместно регистрированное воспроизведение T1-взвешенного постконтрастного изображения МРТ, ОФЭКТ и наложенных изображений. Стрелки указывают зону интенсивной локализации радиоактивно меченых мини-клеток, что соответствует части аномалии на изображении МРТ.
(c) Приведены 2D плоские изображения всего тела через 30 минут и 3 часа после инъекции. Наряду с захватом в щитовидной железе и немного в шее, ранний захват наблюдается в печени, с некоторой экскрецией в кишечник, видимой на более поздних изображениях.
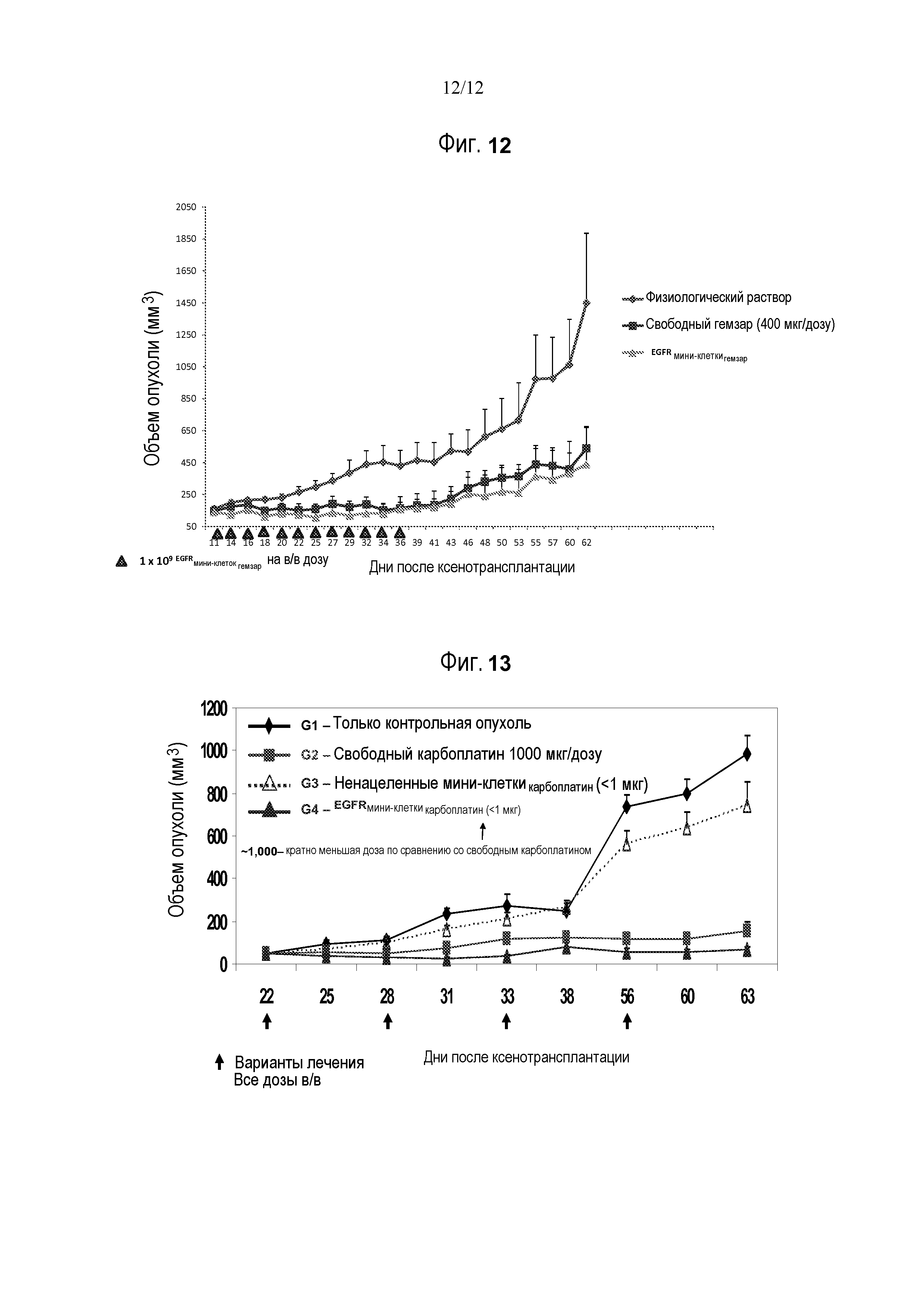
ФИГУРА 12. Ксенотрансплантаты рака поджелудочной железы человека (MIA PaCa) мышам Balb/c nu/nu (n=8 на группу) вводили в/в либо со свободным гемцитабином (гемзар®), либо с нацеленными на EGFR, упакованными гемзаром мини-клетками (EGFRмини-клеткигемзар). При всех введениях мини-клеток вводили по 109 мини-клеток на дозу. Дни введения указаны ниже на оси x (треугольники). Планки погрешностей, ± SEM. Диаграмма показывает объем опухоли в указанные дни после введения.
ФИГУРА. 13. Ксенотрансплантаты рака молочной железы человека (MDA-MB-468) мышам Balb/c nu/nu (n=8 на группу) вводили в/в со свободным карбоплатином или с мини-клетками, упакованными карбоплатином, которые были либо не нацелены, либо нацелены на EGFR (EGFRмини-клеткикарбоплатин). При всех введениях мини-клеток вводили по 109 мини-клеток на дозу. Дни введения указаны ниже на оси x (треугольники). Планки погрешностей, ± SEM. Диаграмма показывает объем опухоли в указанные дни после введения.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится к композициям и способам лечения опухолей мозга. В этом отношении, авторы изобретения установили, что интактные, полученные из бактерий мини-клетки, упакованные одним или более антинеопластическими средствами, при системном введении быстро накапливаются в микроокружении опухоли мозга в терапевтически значимых концентрациях. Это открытие было удивительным, поскольку мини-клетки с диаметром примерно 400 нм имеют гораздо больший размер, чем 12 нм, что, согласно общепринятым представлениям, является верхним пределом размера для частиц, способных пересекать гемантоэнцефалический барьер (ГЭБ). См. Sarin et al. (2008) и Laquintana et al. (2009).
Соответственно, авторы изобретения установили, что множество различных опухолей мозга, как первичных, так и метастатических, можно лечить путем системного введения терапевтически эффективного количества композиции, состоящей из множества таких мини-клеток, когда каждая мини-клетка является переносчиком для активного средства против опухоли.
(A) Определения
Если не указано иное, все технические и научные термины, используемые в данном описании, имеют то же значение, которое им обычно придают специалисты в соответствующей области.
Для удобства, значения некоторых терминов и фраз, используемых в спецификации, примерах и прилагаемой формуле изобретения, приведены ниже. Определения другим терминам и фразам даны на протяжении всего текста спецификации.
Формы единственного числа включают указание на множественное число, если из контекста явно не следует иное.
Термины «рак», «новообразование», «опухоль», «злокачественное новообразование» и «карцинома», используемые в настоящем документе взаимозаменяемо, относятся к клеткам или тканям, которые проявляют фенотип аномального роста, характеризующийся значительной потерей контроля клеточной пролиферации. Способы и композиции по данному изобретению, в частности, применимы к злокачественным, преметастатическим, метастатическим и неметастатическим клеткам.
«Лекарственное средство» означает любое физиологически или фармакологически активное вещество, которое вызывает местный или системный эффект у животных, в частности, млекопитающих и людей.
Термины «индивидуум», «субъект», «хозяин» и «пациент», используемые в данном описании взаимозаменяемо, относятся к любому субъекту-млекопитающему, который нуждается в диагностике, лечении или терапии. Индивидуум, субъект, хозяин или пациент может быть человеком или животным, отличным от человека. Так, подходящие субъекты могут включать, но не ограничиваются ими, приматов, отличных от человека, крупный рогатый скот, лошадей, собак, кошек, морских свинок, кроликов, крыс и мышей.
Термины «лечение», «воздействие», «лечить» и тому подобные означают получение желаемого фармакологического и/или физиологического эффекта у пациента с опухолью мозга. Эффект может быть профилактическим с точки зрения полного или частичного предотвращения развития опухоли мозга или ее симптомов и/или может быть терапевтическим с точки зрения частичной или полной стабилизации или излечения опухоли мозга и/или неблагоприятного эффекта, относящегося к опухоли мозга. Лечение охватывает любое лечение опухоли мозга у млекопитающего, в частности, человека. Желаемый эффект, в частности, представляет собой реакцию опухоли, которую можно измерять по уменьшению массы опухоли или подавлению увеличения массы опухоли. В дополнение к реакции опухоли, в клинической практике в качестве желаемого эффекта лечения также можно использовать увеличение общей выживаемости, выживание без прогрессирования или время до рецидива опухоли, или уменьшение побочных эффектов.
(B) Лечение
Настоящее изобретение находит отражение и доказательства в экспериментальных данных о том, что, в соответствии с открытием авторов изобретения, полученные из бактерий и интактные мини-клетки, имеющие примерно 400 нм в диаметре, при внутривенном (в/в) введении быстро накапливаются в микроокружении опухоли мозга в терапевтически значимых концентрациях. Авторы изобретения также обнаружили, что это проникновение в опухоль мозга происходит не за счет эндоцитоза/трансцитоза эндотелия ГЭБ или любого другого механизма, с помощью которого, согласно предположениям, наночастицы проникают в микроокружение опухоли мозга. С позиции традиционных представлений, таким образом, эти открытия были довольно неожиданными.
1. Традиционные представления о предельном размере для пересечения ГЭБ
Наночастицы рассматриваются как потенциальные носители для переноса лекарственных средств за ГЭБ (Juillerat-Jeanneret, 2008). Показательной в этом отношении является стратегия доставки лекарственного средства в виде наночастиц, направленная на преодоление барьера путем связывания наночастиц с рецепторами в просвете эндотелиальных клеток, составляющих ГЭБ, с последующим эндоцитозом и трансцитозом через эндотелиальные клетки и в микроокружение опухоли мозга. Другой подход предполагает использование «эффекта усиленного проникновения и удержания», обсуждаемого ниже, для осуществления прохода частиц через крошечные промежутки между эндотелиальными клетками ГЭБ.
2. Трансцитоз наночастиц
Показано, что поли(бутил)цианоакрилатные (PBCA) наночастицы, покрытые полисорбатом 80 (Tween® 80), способны доставлять в мозг ряд лекарственных средств, которые в свободном виде не пересекают ГЭБ (Kreuter et al., 1995, 1997, 2001, 2002, 2003 и 2008; Steiniger et al., 2004).
Поскольку полисорбат 80 избирательно способствует адсорбции некоторых плазматических белков (в частности, аполипопротеинов E и B (Petri et al., 2007; Re et al., 2011)) на поверхности этих наночастиц, он позволяет связываться этим наночастицам с соответствующими рецепторами липопротеинов низкой плотности (LDLr; Xin et al., 2011), которые, как известно, избыточно экспрессируются в эндотелиальных капиллярных кровеносных сосудах, связанных с ГЭБ (Dehouck et al., 1994).
После связывания с LDLr наночастицы интернализируются эндотелиальными клетками кровеносных сосудов (Zensi et al., 2009), переносятся трансцитозом через эти клетки и затем транспортируются в микроокружение опухоли мозга.
Усилия, предпринимаемые во всем мире по разработке наночастиц для лечения опухолей мозга, фокусируются на поиске инновационных путей для обхода ГЭБ путем трансцитоза через связанные с ГЭБ эндотелиальные клетки и проникновения в микроокружение опухоли мозга. Это является серьезной проблемой в силу того, что эти частицы должны оставаться интактными в процессе трансцитозного движения внутри клеток и не разрушаться лизосомами. Последние являются внутриклеточными компартментами с высокой кислотностью, которые обычно разрушают поглощенные путем эндоцитоза материалы.
Дополнительным серьезным недостатком этого подхода является то, что LDLr не являются уникальными для ГЭБ. Они лишь избыточно экспрессированы в эндотелиальных клетках, связанных с ГЭБ. Таким образом, эти наночастицы потенциально способны проникать во многие нормальные ткани и нормальную центральную нервную систему, поскольку эти рецепторы повсеместно встречаются в эндотелиальных клетках во всей кровеносной системе. До сих пор не были найдены рецепторы, которые являются уникальными только для связанных с ГЭБ кровеносных сосудов и, следовательно, потенциальная серьезная токсичность для нормальных тканей остается проблемой.
3. Пассивное проникновение в опухоли мозга
Последние данные показали, что физиологический верхний предел размера пор в ГЭБ микроциркуляторной части сосудистого русла злокачественной глиомы составляет только примерно 12 нм (Sarin et al., 2008). Кроме того, показано, что молекулы должны быть размером <400 дальтон (Bickel, 2005; Pardridge, 2007), чтобы иметь возможность пересечь поры, обнаруженные в ГЭБ.
Ограничения, связанные с размерами, повсеместно признаются исследователями и клиницистами в данной области. Например, на основании обзора современной литературы можно сделать вывод о том, что наночастицы должны иметь размер менее 12 нм и иметь большие периоды полураспада в крови, чтобы пересекать ГЭБ микроциркуляторной части сосудистого русла злокачественной глиомы (Laquintana et al., 2009).
Разнообразные наночастицы были изучены в этом отношении, включая липосомы, полимерные наночастицы, твердые липидные наночастицы, полимерные мицеллы и дендримеры. После внутривенного введения эти частицы могут просачиваться из сосудов в ткань опухоли мозга из-за нарушенного ГЭБ сосудов опухоли мозга, но в меньшей степени также и в нормальные ткани мозга (Moghimi et al., 2005).
Это пассивное нацеливание наночастиц в опухоли мозга с нарушенным ГЭБ обычно связано с вышеупомянутым эффектом усиленного проникновения и удержания (EPR), который, как считают, играет решающую роль в доставке лекарственного средства к солидным опухолям. Например, в статье Laquintana et al. (2009) отражено современное представление о том, что липосомы, которые, как правило, имеют размер от 50 до 150 нм, остаются в пределах микроциркуляторной части сосудистого русла, в результате чего инкапсулированные химиотерапевтические лекарственные средства небольшого размера диффундируют через мембрану липосом и через поры ГЭБ злокачественных глиом. Таким образом, считается, что более крупные частицы (от 50 до 150 нм) не способны просачиваться из сосудов в ткань через ГЭБ сквозь повреждения в барьере.
Следовательно, согласно традиционным представлениям, для того, чтобы пассивно пересечь ГЭБ в результате EPR эффекта и достичь фармакологически значимых количеств в микроокружении опухоли мозга, наночастицы должны иметь размер <12 нм и макромолекулы, такие как лекарственные средства, должны иметь молекулярную массу <400 дальтон. На эти представления делается упор в обзорной статье Pardridge (2010), в которой подчеркнуто, что «самым важным фактором в разработке лекарственного средства для мозга является наличие эффективной технологии нацеливания лекарственного средства в мозге».
Это является причиной того, что большинство потенциальных лекарственных средств для центральной нервной системы (ЦНС) не пересекают гематоэнцефалический барьер (ГЭБ). Биофармацевтические препараты, которые представляют собой высокомолекулярные лекарственные средства, не пересекают ГЭБ. Таким образом, в отсутствие технологии нацеливания в мозге, рекомбинантные белки, моноклональные антитела, пептиды, малые интерферирующие РНК (миРНК) и генно-терапевтические средства не могут быть разработаны для мозга, поскольку эти лекарственные средства не пересекают ГЭБ. Что касается малых молекул, принято считать, что эти вещества пересекают ГЭБ. Однако, >98% всех малых молекул не пересекают ГЭБ (Pardridge et al., 2005). Только растворимые в липидах малые молекулы с молекулярной массой (ММ) <400 дальтон (Да) пересекают ГЭБ при посредстве липидов. Однако большинство низкомолекулярных лекарственных средств либо имеют ММ >400 Да, либо имеют высокую растворимость в воде, что препятствует свободной диффузии через ГЭБ. Вследствие этого, даже если исследования разработчиков лекарственных средств для ЦНС сфокусированы на малых молекулах, вполне вероятно, что технология нацеливания лекарственных средств через ГЭБ будет по-прежнему необходима для успешного завершения программы разработки низкомолекулярных лекарственных средств для ЦНС в случае большинства лекарственных средств.
4. Дополнительные барьеры для проникновения в опухоль мозга
Помимо ГЭБ, поступление в мозг дополнительно ограничено относительной малочисленностью отверстий и пиноцитозных пузырьков в эндотелиальных клетках мозговых капилляров, а также присутствием окружающего внеклеточного матрикса, перицитов и астроцитарных ножек (Hawkins и Davis, 2005). Кроме того, ГЭБ обычно считается неприступным для лекарственных средств и макромолекул благодаря множеству белков-транспортеров лекарственных средств, которые выводят лекарственные средства из мозга.
Например, было показано, что АТФ-зависимые транспортеры способны серьезно ограничивать проникновение в мозг лекарственных средств, даже таких, которые обладают благоприятными физико-химическими свойствами и предположительно должны пересекать ГЭБ с относительной легкостью. Большинство этих транспортеров принадлежат к двум суперсемействам, семейству АТФ-связывающих кассет (ABC) и семейству переносчиков растворенных веществ. P-гликопротеин (P-gp, ABCB1), белок устойчивости рака молочной железы (BCRP, ABCG2), и белки, связанные с множественной лекарственной устойчивостью (MRPs, ABCCs), являются важными членами семейства ABC. См. статьи Schinkel (1999), Borst et al. (2000), Sun et al. (2003), Schinkel and Jonker (2003), Kusuhara and Sugiyama (2005), Loscher and Potschka (2005) и Nicolazzo and Katneni (2009).
Соответственно, авторы настоящего изобретения нашли действительно удивительным то, что интактные, полученные из бактерий мини-клетки накапливаются в опухолях мозга, несмотря на то, что мини-клетки имеют гораздо больший размер (~400 нм), чем всеми признанный верхний предел размера (<12 нм), который должны иметь наночастицы для проникновения в опухоли мозга. Также неожиданным было то, что мини-клетки проникают в мозг пассивно, через нарушенный ГЭБ. В этом отношении, авторы изобретения обнаружили удивительный факт, что кровеносные сосуды, связанные с опухолями мозга, относятся не только к ГЭБ-типу. Установлено, что даже на ранней стадии растущая опухоль имеет множество кровеносных сосудов, в частности, в своей сердцевине. Такие кровеносные сосуды отличаются нарушением целостности; то есть, сосуды имеют большие отверстия и являются «негерметичными», в отличие от сосудов ГЭБ-типа. Вследствие этого, в нарушение традиционных представлений, частицы, такие крупные, как мини-клетки, то есть, гораздо крупнее, чем вышеописанные общепризнанные пределы размеров пор ГЭБ, тем не менее, имеют размер меньше, чем отверстия в стенках негерметичного кровеносного сосуда; таким образом, они могут пассивно вытекать через эти отверстия из сосудов в ткань и в микроокружение опухоли мозга.
Более того, авторы изобретения обнаружили, что относительно большой размер интактных, полученных из бактерий мини-клеток на самом деле является положительным, даже ключевым фактором, влияющим на то, как быстро терапевтически значимые концентрации мини-клеток достигаются в микроокружении опухоли мозга, согласно полученным данным. То есть, чем меньше частица, тем больше вероятность того, что частица будет удерживаться кровотоком в кровеносных сосудах. Напротив, мини-клетки являются частицами относительно большей массы, и они, таким образом, менее подвержены влиянию силы кровотока. Следовательно, мини-клетки, скорее всего, будут следовать по пути через кровеносные капилляры, что приводит к постоянным столкновениям с эндотелиальными стенками кровеносных капилляров. Это чисто физическое явление увеличивает вероятность того, что мини-клетки, как более крупные частицы, будут выталкиваться через отверстия в негерметичной сосудистой сети, которая, как обнаружили авторы изобретения, является отличительной чертой нарушенного ГЭБ в опухолях.
В мозге человека существует более 100 миллиардов капилляров, общая длина которых составляет около 400 миль, и тем не менее, внутриэндотелиальный объем этих капилляров составляет только примерно 1 мкл/г мозга (Pardridge, 2011). Считается, что эта очень высокая плотность кровеносных сосудов в мозге также вносит вклад в быстрое, высококонцентрированное накопление мини-клеток в опухолях мозга, согласно полученным данным.
Признавая, что диаметр просвета капилляров, связанных с ГЭБ, таким образом, может быть всего 1 мкм, авторы изобретения интуитивно понимали, что такие крупные частицы, как интактные, полученные из бактерий мини-клетки (~400 нм), по размеру будут составлять примерно половину диаметра связанных с ГЭБ кровеносных капиллярных сосудов, и вследствие этого, будут быстро просачиваться из сосудов в ткань через нарушенный ГЭБ, где размер отверстий больше, чем 400 нм. С другой стороны, поскольку отверстия в нормальной сосудистой системе организма млекопитающего не превышают примерно 100 мкм, интактные, полученные из бактерий мини-клетки, введенные системно, согласно полученным данным, будут сохраняться в общей сосудистой системе до их утилизации профессиональными фагоцитами в ретикулоэндотелиальной системе или пока они пассивно не будут просачиваться в негерметичной сосудистой системе из сосудов в ткань микроокружения опухоли мозга.
Соответственно, когда два типа наночастиц вводят в/в в равных количествах, например, наночастицы диаметром менее 12 нм и интактные, полученные из бактерий мини-клетки, можно ожидать, что концентрация циркулирующих более мелких частиц будет быстро уменьшаться, поскольку они будут просачиваться из кровеносной системы в нормальные ткани, где сосудистая система имеет размеры пор более чем 12 нм. Известно, например, что печень и желудочно-кишечная ткань имеют нормальные сосудистые отверстия размером примерно 100 нм (Wisse et al., 2008) и периферийная кожа имеет отверстия в диапазоне ~40 нм. Напротив, мини-клетки будут слишком велики, чтобы выходить из нормальной сосудистой системы; таким образом, можно ожидать, что они будут оставаться в высокой концентрации в нормальной системе кровообращения, в результате чего большее их число будет просачиваться из сосудов в микроокружение опухоли мозга, как описано выше.
Таким образом, в одном варианте осуществления настоящее изобретение относится к лечению опухоли мозга, включающему введение терапевтически эффективного количества композиции, состоящей из множества интактных, полученных из бактерий мини-клеток, несущих антинеопластическое средство. Введение композиции, содержащей мини-клетки, предпочтительно является системным, например, внутривенным или внутриартериальным.
(C) Антинеопластические средства
Как отмечалось, композиции мини-клеток по настоящему изобретению применимы для доставки антинеопластических средств к опухолям мозга. В данном контексте выражение «антинеопластическое средство» означает лекарственное средство, химическое или биологическое, которое предотвращает или подавляет рост, развитие, созревание или распространение неопластических клеток.
В контексте данного изобретения выбор антинеопластического средства для лечения конкретного пациента с опухолью мозга зависит от нескольких факторов, в соответствии с общепринятой медицинской практикой. Эти факторы включают, но не ограничиваются ими, возраст пациента, индекс по шкале Карнофски, а также то, какое лечение пациент мог получать ранее. См., в основном, Principles and Practice of Neuro-Oncology, M. Mehta (Demos Medical Publishing 2011) и Principles Of Neuro-Oncology, под редакцией D. Schiff и P. O’Neill (McGraw-Hill 2005).
В целом, стандарт медицинской помощи, применимый к конкретной злокачественной опухоли мозга, предусматривает, в первую очередь, клинический анализ, от которого будет зависеть выбор используемого активного средства. Эта концепция будет определять выбор, например, активного средства из приведенного ниже в таблице 1 списка антинеопластических средств, подходящих для лечения опухолей мозга, который опубликован Калифорнийским университетом в Лос-Анджелесе.
По настоящему изобретению лекарственное средство можно также выбирать из одного из классов, описанных ниже, для упаковки в интактные, полученные из бактерий мини-клетки, которые затем вводят в организм для лечения злокачественной опухоли мозга.
Полифункциональные алкилирующие средства, например, циклофосфамид (цитоксан), мехлорэтамин, мелфалан (алкеран), хлорамбуцил (лейкеран), тиотепа (тиоплекс), бусульфан (милеран).
Алкилирующие лекарственные средства, например, прокарбазин (матулан), декарбазин (DTIC), алтретамин (гексален), хлорамбуцил, цисплатин (платинол), карбоплатин, ифосфамид, оксалиплатин.
Антиметаболиты, например, метотрексат (MTX), 6-тиопурины (меркаптопурин [6-MP], тиогуанин [6-TG]), меркаптопурин (пуринтол), тиогуанин, флударабин фосфат, кладрибин (лейстатин), пентостатин, фторурацил (5-FU), цитарабин (ara-C), азацитидин.
Растительные алкалоиды, терпеноиды и ингибиторы топоизомеразы, например, винбластин (велбан), винкристин (онковин), виндезин, винорелбин, подофиллотоксины (этопозид {VP-16} и тенипозид {VM-26}), камптотецины (топотекан и иринотекан), таксаны, такие как паклитаксел (таксол) и доцетаксел (таксотер).
Антибиотики, например, доксорубицин (адриамицин, рубекс, доксил), даунорубицин, идарубицин, дактиномицин (космеген), пликамицин (митрамицин), митомицин (мутамицин), блеомицин (бленоксан).
Гормональные средства, например, ингибиторы эстрогена и андрогена (тамоксифен и флутамид), агонисты гонадотропин-рилизинг гормонов (леупролид и гозерелин (золадекс)), ингибиторы ароматазы (аминоглутетимид и анастрозол (аримидекс)).
Разные противораковые лекарственные средства, например, амсакрин, аспарагиназа (элспар), гидроксимочевина, митоксантрон (новантрон), митотан (лизодрен), производные ретиноевой кислоты, факторы роста клеток костного мозга (сарграмостим и филграстим), амифостин.
Средства, нарушающие метаболизм фолатов, например, пеметрексед.
Гипометилирующие ДНК средства, например, азацитидин, децитабин.
Ингибиторы пути поли(аденозиндифосфат[АДФ]-рибоза)-полимеразы (PARP), такие как инипариб, олапариб, велипариб.
Ингибиторы пути PI3K/Akt/mTOR, например, эверолимус.
Ингибиторы гистон-деацетилазы (HDAC), например, вориностат, энтиностат (SNDX-275), моцетиностат (MGCD0103), панобиностат (LBH589), ромидепсин, вальпроевая кислота.
Ингибиторы циклин-зависимой киназы (CDK), например, флавопиридол, оломуцин, росковитин, кенпауллон, AG-024322 (Pfizer), фаскаплизин, рювидин, пурваланол A, NU2058, BML-259, SU 9516, PD-0332991, P276-00.
Ингибиторы белков теплового шока (HSP90), например, гелданамицин, танеспимицин, алвеспимицин, радицикол, дегвелин, BIIB021.
Ингибиторы мышиного белка MDM2, например, цис-имидазолин, бензодиазепиндион, спирооксиндолы, изохинолинон, тиофен, 5-деазафлавин, триптамин.
Ингибиторы киназы анапластической лимфомы (ALK), например, аминопиридин, диаминопиримидин, пиридоизохинолин, пирролопиразол, индолoкарбазол, пирролопиримидин, дианилинопиримидин.
Ингибиторы поли[АДФ-рибоза]-полимеразы (PARP), например, бензамид, фталазинон, трициклический индол, бензимидазол, индазол, пирролокарбазол, фталазинон, изоиндолинон.
Активные средства, применимые по настоящему изобретению, не ограничены этими классами лекарственных средств или конкретными средствами, перечисленными выше. На различных платформах по разработке новых лекарственных препаратов продолжают создаваться новые средства, направленные на уникальные молекулярные сигнатуры клеток злокачественных опухолей; действительно, были обнаружены тысячи таких химических и биологических лекарственных средств, лишь некоторые из которых перечислены в настоящем документе. Тем не менее, удивительная способность интактных, полученных из бактерий мини-клеток заключать в себе упакованными самые разные активные средства, гидрофильные или гидрофобные, означает, что практически любое такое лекарственное средство, будучи упакованным в мини-клетки, обладает потенциалом для лечения злокачественной опухоли мозга, в соответствии с результатами настоящего изобретения.
В принципе, потенциальная пригодность конкретного антинеопластического средства для лечения опухоли мозга частично зависит от того, можно ли это средство эффективно доставлять в мозг. Благодаря преимуществам настоящего изобретения, согласно которому нагруженные лекарственным средством мини-клетки пересекают ГЭБ и доставляют свой лекарственный полезный груз точно в опухоль мозга, многие лекарственные средства, которые в противном случае не проявили бы свою эффективность в лечении опухоли мозга, теперь будут вполне пригодными кандидатами для такого лечения. Соответственно, в данном описании рубрика «антинеопластические средства» не ограничивается лекарственными средствами с известной эффективностью в лечении злокачественных опухолей мозга, но она также охватывает средства, которые, как установлено, обладают одной или более из вышеуказанных активностей против неопластических клеток.
Аналогичным образом, примерами класса антинеопластических средств являются радиоактивные изотопы, химиотерапевтические лекарственные средства и функциональные нуклеиновые кислоты, включая, но без ограничения, регуляторные РНК.
1. Радиоактивные изотопы
«Радиоактивный изотоп» представляет собой атом с нестабильным ядром, то есть, атом, характеризующийся избытком энергии, способной передаваться либо вновь образованной излучаемой частице внутри ядра, либо атомному электрону. Таким образом, радиоактивный изотоп претерпевает радиоактивный распад, и испускает гамма-луч(и) и/или субатомные частицы. Многочисленные радиоактивные изотопы известны в данной области, и некоторые из них, как известно, подходят для использования в медицинских целях, такие как иттрий-90, технеций-99m, йод-123, йод-131, рубидий-82, таллий-201, галлий-67, фтор-18, ксенон-133 и индий-111.
Радиоактивные изотопы нашли широкое применение в медицинской радиологии, в частности, как излучатели бета-лучей для повреждения клеток опухолей. Вследствие этого, радиоактивные изотопы соответствующим образом применяются как антинеопластические средства в настоящем изобретении.
Радиоактивные изотопы можно связывать с интактными, полученными из бактерий мини-клетками любым известным методом. Так, белок или другой фрагмент на поверхности мини-клеток (см. ниже) можно метить радиоактивным изотопом с использованием коммерчески доступных средств для мечения, например, при помощи реагента для иодирования Pierce, продукта компании Pierce Biotechnology Inc. (Рокфорд, Иллинойс), подробно описанного в статье Rice et al. (2011). Альтернативно, радиоактивные изотопы можно включать в белки, находящиеся внутри мини-клеток.
В последнем случае, продуцирующий мини-клетки бактериальный штамм трансформируют плазмидной ДНК, кодирующей чужеродный белок. Когда мини-клетки образуются в процессе асимметричных клеточных делений, несколько копий плазмидной ДНК отделяется в цитоплазму мини-клеток. Полученные рекомбинантные мини-клетки инкубируют в присутствии радиоактивно меченых аминокислот в условиях, при которых чужеродный белок, экспрессируемый внутри мини-клеток с плазмидной ДНК, включает несущие радиоактивный изотоп аминокислоты. В соответствии с протоколом Clark-Curtiss и Curtiss (1983), например, рекомбинантные мини-клетки инкубируют в минимальной ростовой среде, содержащей35S-метионин, в результате чего новые экспрессированные кодируемые плазмидой белки включают35S-метионин. Аналогичный подход можно использовать для того, чтобы рекомбинантные мини-клетки были упакованы другими радиоактивными метками, при желании.
Олигосахариды на поверхности мини-клеток также можно радиоактивно метить с использованием, например, хорошо зарекомендовавших себя протоколов, описанных Fukuda (1994). Примером таких олигосахаридов, которые являются эндемичными для мини-клеток, служит O-полисахаридный компонент липополисахарида (ЛПС), находящегося на поверхности мини-клеток, полученных из грамотрицательных бактерий (см. ниже).
Предпочтительной методологией в этом отношении является радиоактивное мечение биспецифического антитела, которое используют для нацеливания мини-клеток на конкретные опухоли. См. раздел G, ниже, и патентную публикацию US 2007/0237744, содержание которой включено в настоящий документ посредством ссылки. То есть, биспецифическое антитело, «покрывающее» мини-клетку, образует значительное количество дополнительного поверхностного белка для радиоактивного мечения. Соответственно, можно добиться более высокой удельной активности радиоактивной метки, связанной с покрытой антителом мини-клеткой. Напротив, радиоактивное мечение непокрытых мини-клеток, то есть, когда радиоактивный изотоп метит только эндемичные фрагменты, может приводить к более слабому мечению (более низкой удельной активности). В одном варианте осуществления это более слабое мечение, как полагают, имеет место потому, что связанные с внешней мембраной белки мини-клеток, полученных из грамотрицательных бактерий, маскируются ЛПС, который, как обсуждается ниже, содержит длинные цепи O-полисахарида, покрывающие поверхность мини-клеток.
Для лечения опухоли мозга композиция по изобретению будет доставляться в дозе или в нескольких дозах, что, в целом, обеспечивает уровень облучения внутри опухоли, который достаточен, по меньшей мере, для уменьшения массы опухоли, если не для полной элиминации опухоли. Ход лечения можно контролировать по этой линии в каждом конкретном случае. В целом, однако, количество радиоактивности, содержащейся в композиции, как правило, будет порядка от примерно 30 до 50 Гр, хотя по изобретению также предусмотрено большее количество радиоактивности, скажем, от примерно 50 до 100 Гр, что дает общий диапазон от примерно 30 Gy до примерно 100 Гр.
В некоторых случаях количество радиоактивности, содержащейся в композиции, может быть даже меньше, чем указано выше, учитывая высокоэффективную и специфическую доставку радиоактивных изотопов из мини-клеток в опухоль мозга. Соответственно, в одном аспекте композиция содержит от примерно 20 до 40 Гр или от примерно 10 до 30 Гр, или от примерно 1 до примерно 20 Гр, или менее чем 10 Гр.
2. Химиотерапевтические лекарственные средства
Антинеопластическое средство, используемое по настоящему изобретению, может также представлять собой химиотерапевтическое лекарственное средство. В данном описании термины «химиотерапевтическое лекарственное средство», «химиотерапевтическое средство» и «химиотерапия» используются взаимозаменяемо для обозначения лекарственного средства, обладающего способностью убивать или разрушать неопластическую клетку. Химиотерапевтическое средство может представлять собой низкомолекулярное лекарственное средство или биологическое лекарственное средство, как подробно изложено ниже.
Подкатегория «низкомолекулярные лекарственные средства» охватывает органические соединения, характеризующиеся наличием (i) влияния на биологический процесс и (ii) относительно низкой молекулярной массы по сравнению с макромолекулой. Низкомолекулярные лекарственные средства, как правило, имеют массу примерно 800 дальтон или менее, где слово «примерно» указывает на то, что определенное значение молекулярной массы может варьироваться в зависимости от точности измерений и экспериментальной ошибки примерно на несколько дальтон или десятков дальтон. Таким образом, низкомолекулярное лекарственное средство может иметь молекулярную массу примерно 900 дальтон или менее, примерно 800 или менее, примерно 700 или менее, примерно 600 или менее, примерно 500 или менее, или примерно 400 дальтон или менее. Более конкретно, низкомолекулярное химиотерапевтическое лекарственное средство может иметь молекулярную массу примерно 400 дальтон или более, примерно 450 дальтон или более, примерно 500 дальтон или более, примерно 550 дальтон или более, примерно 600 дальтон или более, примерно 650 дальтон или более, примерно 700 дальтон или более, или примерно 750 дальтон или более. В другом варианте осуществления низкомолекулярное химиотерапевтическое лекарственное средство, упакованное в мини-клетки, имеет молекулярную массу от примерно 400 до примерно 900 дальтон, от примерно 450 до примерно 900 дальтон, от примерно 450 до примерно 850 дальтон, от примерно 450 до примерно 800 дальтон, от примерно 500 до примерно 800 дальтон, или от примерно 550 до примерно 750 дальтон.
Для целей настоящего описания определение «биологическое лекарственное средство» означает, наоборот, биологически активную макромолекулу, которая может быть создана в результате биологического процесса, исключая «функциональные нуклеиновые кислоты», описанные ниже, и полипептиды, которые по размеру квалифицируются как низкомолекулярные лекарственные средства, определенные выше. Подкатегория «биологические лекарственные средства», таким образом, стоит особняком и не перекрывается с подкатегориями низкомолекулярных лекарственных средств и функциональных нуклеиновых кислот. Примерами биологических лекарственных средств являются терапевтические белки и антитела, полученные либо естественным, либо рекомбинантным, либо синтетическим путем, например, с использованием инструментария медицинской химии и дизайна лекарственных средств.
До настоящего времени было принято считать, что молекулы размером более 400 дальтон неспособны проходить сквозь поры в ГЭБ (Bickel, 2005; Pardridge, 2007); следовательно, они не подходят для лечения опухолей мозга. Однако, будучи упакованы в мини-клетки, такие химиотерапевтические лекарственные средства достигают целевых клеток опухоли мозга, минуя ГЭБ.
Как низкомолекулярные лекарственные средства, так и биологические лекарственные средства, более того, некоторые молекулы, которые были спроектированы для химиотерапевтических целей, тем не менее, не проходят доклинические или клинические испытания из-за неприемлемой токсичности или другие проблем безопасности. Авторы настоящего изобретения показали, что упаковка химиотерапевтического лекарственного средства в мини-клетку с последующей системной доставкой в организм пациента с опухолью, например, пациента с опухолью мозга, приводит к доставке лекарственного средства к клеткам опухоли. Кроме того, даже после того, как клетки опухолей разрушаются, и содержащая лекарственное средство цитоплазма высвобождается в соседние нормальные ткани, это не приводит к токсичности для нормальных тканей. Это происходит потому, что лекарственное средство уже связано с клеточными структурами опухоли, такими как ДНК, и более не способно атаковать нормальные клетки. Соответственно, настоящее изобретение особенно полезно для доставки высокотоксичных химиотерапевтических лекарственных средств в организм пациента с опухолью.
Термины «высокотоксичное химиотерапевтическое лекарственное средство» или «супертоксичное химиотерапевтическое лекарственное средство» в данном описании относятся к химиотерапевтическим лекарственным средствам, которые имеют относительно низкую летальную дозу по сравнению с эффективной дозой для целевого типа рака. Таким образом, в одном аспекте высокотоксичное химиотерапевтическое лекарственное средство имеет медианную летальную дозу (LD50), которая ниже, чем его медианная эффективная доза (ED50) для целевого типа рака, такого как (1) тип рака, для которого лекарственное средство предназначено, (2) первый тип рака, в отношении которого проводятся доклинические или клинические испытания данного лекарственного средства, или (3) тип рака, в отношении которого лекарственное средство проявляет наибольшую эффективность среди всех протестированных типов рака. Например, высокотоксичное химиотерапевтическое лекарственное средство может иметь величину LD50, которая ниже, чем примерно 500%, 400%, 300%, 250%, 200%, 150%, 120% или 100% от величины ED50 лекарственного средства для целевого типа рака. В другом аспекте высокотоксичное химиотерапевтическое лекарственное средство имеет максимальную сублетальную дозу (то есть, наивысшую дозу, которая не вызывает серьезную или необратимую токсичность), которая ниже чем его минимальная эффективная доза для целевого типа рака, например, примерно 500%, 400%, 300%, 250%, 200%, 150%, 120%, 100%, 90%, 80%, 70%, 60% или 50% от минимальной эффективной дозы.
В одном варианте осуществления настоящего изобретения, таким образом, опухоль мозга у субъекта лечат способом, включающим системное введение терапевтически эффективного количества композиции, состоящей из множества интактных, полученных из бактерий мини-клеток, каждая из которых заключает в себе высокотоксичное химиотерапевтическое лекарственное средство. Майтанзиноиды и дуокармицины, описанные ниже, являются представителями класса супертоксичных химиотерапевтических лекарственных средств, используемых таким образом.
Подходящие лекарственные средства для химиотерапии рака в данном контексте включают азотистые иприты, нитрозомочевины, этиленимин, алкансульфонаты, тетразин, соединения платины, пиримидиновые аналоги, пуриновые аналоги, антиметаболиты, аналоги фолата, антрациклины, таксаны, алкалоиды барвинка, ингибиторы топоизомеразы и гормональные средства, в числе прочего.
Химиотерапевтические лекарственные средства, являющиеся примерами подкатегории низкомолекулярных лекарственных средств, включают актиномицин-D, алкеран, ара-C, анастрозол, BiCNU, бикалутамид, блеомицин, бусульфан, капецитабин, карбоплатин, карбоплатин, кармустин, CCNU, хлорамбуцил, цисплатин, кладрибин, CPT-11, циклофосфамид, цитарабин, цитозин арабинозид, цитоксан, дакарбазин, дактиномицин, даунорубицин, дексразоксан, доцетаксел, доксорубицин, DTIC, эпирубицин, этиленимин, этопозид, флоксуридин, флударабин, фторурацил, флутамид, фотемустин, гемцитабин, гексаметиламин, гидроксимочевину, идарубицин, ифосфамид, иринотекан, ломустин, мехлорэтамин, мелфалан, меркаптопурин, метотрексат, митомицин, митотан, митоксантрон, оксалиплатин, паклитаксел, памидронат, пентостатин, пликамицин, прокарбазин, стероиды, стрептозоцин, STI-571, стрептозоцин, тамоксифен, темозоломид, тенипозид, тетразин, тиогуанин, тиотепу, томудекс, топотекан, треосульфан, триметрексат, винбластин, винкристин, виндезин, винорелбин, VP-16 и кселоду.
Майтанзиноиды (молекулярная масса: ~738 дальтон) представляют собой группу химических производных майтанзина, проявляющего сильную цитотоксичность. Хотя из-за проблемы с токсичностью они считаются небезопасными для использования пациентами-людьми, майтанзиноиды подходят для доставки в опухоль мозга пациента с помощью мини-клеток, в соответствии с настоящим изобретением.
Дуокармицины (молекулярная масса: ~588 дальтон) представляют собой серию родственных натуральных продуктов, впервые выделенных из бактерий стрептомицетов. Они также проявляют сильную цитотоксичность, но считаются небезопасными для использования человеком. Подобно майтанзиноидам, дуокармицины являются подходящими химиотерапевтическими лекарственными средствами для использования по изобретению.
Подкатегория биологических химиотерапевтических лекарственных средств включает, без ограничения, аспарагиназу, AIN-457, бапинеузумаб, белимумаб, брентуксимаб, бриакинумаб, канакинумаб, цетуксимаб, далотузумаб, деносумаб, эпратузумаб, эстафенатокс, фарлетузумаб, фигитумумаб, галиксимаб, гемтузумаб, гирентуксимаб (WX-G250), герцептин, ибритумомаб, инотузумаб, ипилимумаб, меполизумаб, муромонаб-CD3, наптумомаб, нецитумумаб, нимотузумаб, окрелизумаб, офатумумаб, отеликсизумаб, озогамицин, пагибаксимаб, панитумумаб, пертузумаб, рамуцирумаб, реслизумаб, ритуксимаб, REGN88, соланезумаб, танезумаб, теплизумаб, тиуксетан, тозитумомаб, трастузумаб, тремелимумаб, ведолизумаб, залутумумаб и занолимумаб.
Композиция может содержать не более примерно 1 мг химиотерапевтического лекарственного средства. Альтернативно, количество химиотерапевтического лекарственного средства может составлять не более примерно 750 мкг, 500 мкг, 250 мкг, 100 мкг, 50 мкг, 10 мкг, 5 мкг, 1 мкг, 0,5 мкг или 0,1 мкг. В другом аспекте композиция содержит химиотерапевтическое лекарственное средство в количестве менее чем примерно 1/1000, или альтернативно, менее чем примерно 1/2000, 1/5000, 1/10000, 1/20000, 1/50000, 1/100000, 1/200000 или 1/500000 от терапевтически эффективного количества лекарственного средства при использовании без упаковки в мини-клетки. В другом аспекте изобретения композиция может содержать по меньшей мере примерно 1 нмоль химиотерапевтического лекарственного средства. Соответственно, изобретение также охватывает варианты осуществления, в которых количество химиотерапевтического лекарственного средства составляет по меньшей мере примерно 2 нмоль, примерно 3 нмоль, примерно 4 нмоль, примерно 5 нмоль, примерно 10 нмоль, примерно 20 нмоль, примерно 50 нмоль, примерно 100 нмоль и примерно 800 нмоль, соответственно.
3. Функциональные нуклеиновые кислоты
«Функциональная нуклеиновая кислота» означает молекулу нуклеиновой кислоты, которая при введении в клетку-хозяина специфически препятствует экспрессии белка. Что касается лечения опухоли мозга, в соответствии с настоящим изобретением предпочтительно, чтобы функциональная нуклеиновая кислота, доставленная в клетки опухоли в виде полезной нагрузки с помощью интактных, полученных из бактерий мини-клеток, ингибировала ген, который способствует пролиферации клеток опухоли, ангиогенезу или устойчивости к химиотерапии, и/или который ингибирует апоптоз или арест клеточного цикла (то есть, «стимулирующий образование опухоли ген»).
Как правило, молекулы функциональной нуклеиновой кислоты, используемые по данному изобретению, обладают способностью уменьшать экспрессию белка за счет взаимодействия с транскриптом для белка. Эта категория полезной нагрузки мини-клеток по изобретению включает регуляторные РНК, такие как миРНК, кшРНК, короткие РНК (как правило, длиной менее чем 400 оснований), микро-РНК (микроРНК), рибозимы и РНК-приманки, антисмысловые нуклеиновые кислоты и длинные некодирующие РНК (LincRNA), в числе прочего. В этом отношении, «рибозим» означает молекулу РНК, обладающую ферментативной активностью, которая способна неоднократно расщеплять другие молекулы РНК специфическим для нуклеотидной последовательности образом. «Антисмысловой олигонуклеотид» означает молекулу нуклеиновой кислоты, которая комплементарна части транскрипта конкретного гена, так что молекула может гибридизоваться с транскриптом и блокировать его трансляцию. Антисмысловой олигонуклеотид может представлять собой РНК или ДНК. Группа «LincRNA» или «длинной межгенной некодирующей РНК» охватывает не кодирующие белок транскрипты длиной более 200 нуклеотидов. LincRNAs могут регулировать транскрипцию, сплайсинг и/или трансляцию генов, как описано, например, в статье Khalil et al., Proc Natl Acad. USA 106: 11667-72 (2009).
Каждый из типов регуляторной РНК может быть источником молекулы функциональной нуклеиновой кислоты, которая ингибирует стимулирующий образование опухоли ген, описанный выше, и, таким образом, подходит для использования по настоящему изобретению. Таким образом, в одном предпочтительном варианте осуществления изобретения интактные мини-клетки несут молекулы миРНК, опосредующие механизм посттранскрипционной, вызывающей сайленсинг гена РНК-интерференции (РНКи), которые можно использовать для нацеливания на стимулирующие образование опухоли гены. Например, см. статью MacDiarmid et al., Nature Biotech. 27: 645-51 (2009) (антитело-представляющие мини-клетки доставляют, с химиотерапевтическим лекарственным средством, миРНК, которые противодействуют развитию лекарственной устойчивости), и статью Oh and Park, Advanced Drug Delivery Rev. 61: 850-62 (2009) (доставка терапевтических миРНК для лечения рака молочной железы, яичников, шейки матки, печени, легкого и предстательной железы, соответственно).
Как отмечалось, термин «миРНК» обычно относится к двухцепочечным молекулам РНК длиной от примерно 10 до примерно 30 нуклеотидов, которые получили название из-за их способности специфически интерферировать с экспрессией белка. Предпочтительно, молекулы миРНК имеют 12-28 нуклеотидов в длину, более предпочтительно 15-25 нуклеотидов в длину, еще более предпочтительно 19-23 нуклеотидов в длину и наиболее предпочтительно 21-23 нуклеотидов в длину. Таким образом, молекулы миРНК могут иметь 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или 29 нуклеотидов в длину.
Длина одной цепи определяет длину молекулы миРНК. Например, миРНК, которая описана как имеющая 21 рибонуклеотид в длину (21-мер) может содержать две противоположно направленные цепи РНК, которые отжигаются на протяжении 19 последовательных пар оснований. Два оставшихся рибонуклеотида на каждой цепи будут образовывать «выступ». Если миРНК содержит две цепи различной длины, более длинная из цепей определяет длину миРНК. Например, дцРНК, содержащая одну цепь, имеющую 21 нуклеотид в длину, и вторую цепь, имеющую 20 нуклеотидов в длину, является 21-мером.
Инструменты, помогающие проектировать миРНК в частности и регуляторные РНК в целом, легко доступны. Например, компьютерная программа для проектирования миРНК доступна в интернете на сайте www.dharmacon.com.
В другом предпочтительном варианте осуществления интактные мини-клетки по настоящему изобретению несут микроРНК, которые, подобно миРНК, способны опосредовать механизм посттранскрипционной, вызывающей сайленсинг гена РНК-интерференции (РНКи). Также, как в случае миРНК, вызывающий сайленсинг гена эффект, опосредованный микроРНК, можно использовать для нацеливания на стимулирующие образование опухоли гены. Например, см. статью Kota et al., Cell 137: 1005-17 (2009) (доставка микроРНК путем трансфекции приводила к ингибированию пролиферации раковых клеток, специфическому для опухоли апоптозу и впечатляющей защите от прогрессирования заболевания без токсичности в мышиной модели рака печени) и статью Takeshita, et al., Molec. Ther. 18: 181-87 (2010) (доставка синтетической микроРНК путем временной трансфекции приводила к ингибированию роста метастатических клеток опухоли предстательной железы в тканях костей).
При том, что они обе опосредуют РНК-интерференцию, микроРНК и миРНК имеют заметные различия. В этом отношении, термин «микроРНК», как правило, относится к классу одноцепочечных молекул РНК длиной от 17 до 27 нуклеотидов (а не двухцепочечных, как в случае миРНК). Таким образом, молекулы микроРНК могут иметь 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 нуклеотидов в длину. Предпочтительно, молекулы микроРНК имеют 21-25 нуклеотидов в длину.
Еще одно различие между микроРНК и миРНК заключается в том, что первые, как правило, не полностью комплементарны целевой мРНК. С другой стороны, миРНК должны быть полностью комплементарны целевой мРНК. Следовательно, миРНК обычно приводит к сайленсингу одной конкретной мишени, тогда как микроРНК действует случайным образом.
Кроме того, при том, что обе они собраны в RISC (РНК-индуцируемый сайленсинг-комплекс), миРНК и микроРНК отличаются по соответствующему первичному процессингу перед сборкой RISC. Эти различия подробно описаны в статье Chu et al., PLoS Biology 4: 1122-36 (2006) и статье Gregory et al., Methods in Molecular Biology 342: 33-47 (2006).
Целый ряд баз данных служат депозитариями микроРНК. Например, см. miRBase (www.mirbase.org) и tarbase (http://diana.cslab.ece.ntua.gr/DianaToolsNew/index.php?r=tarbase/index). В общепринятой практике микроРНК, как правило, имеют в названии префикс «-mir», в сочетании с порядковым номером. Например, новая микроРНК, полученная после mir-352 мыши, будет называться mir-353 мыши.
Опять-таки, инструменты, помогающие проектировать регуляторные РНК, включая микроРНК, легко доступны. Для этих целей компьютерная программа для проектирования микроРНК доступна в интернете на сайте wmd2.weigelworld.org/cgi-bin/mirnatools.pl.
Как отмечалось выше, функциональная нуклеиновая кислота, используемая по изобретению, может ингибировать ген, который стимулирует пролиферацию клеток опухоли, ангиогенез или устойчивость к химиотерапии. Ингибируемый ген сам может также ингибировать апоптоз или арест клеточного цикла. Примеры генов, которые могут являться мишенями для функциональной нуклеиновой кислоты, приведены ниже.
Функциональные нуклеиновые кислоты по изобретению предпочтительно нацелены на ген или транскрипт белка, который способствует лекарственной устойчивости, ингибирует апоптоз или способствует формированию неопластического фенотипа. В данной области были достигнуты успехи, основанные на стратегии применения функциональных нуклеиновых кислот в данных контекстах, однако без преимуществ, которые обеспечивают мини-клеточные векторы. См., например, статьи Sioud (2004), Caplen (2003), Nieth et al. (2003), Caplen and Mousses (2003), Duxbury et al. (2004), Yague et al. (2004), и Duan et al. (2004).
Белки, которые способствуют лекарственной устойчивости, являются предпочтительными мишенями для функциональных нуклеиновых кислот. Белки могут способствовать приобретенной лекарственной устойчивости или врожденной лекарственной устойчивости. Если болезнетворные клетки, такие как клетки опухолей, изначально реагируют на лекарственные средства, но становятся невосприимчивыми на последующих циклах лечения, то устойчивый фенотип является приобретенным. Полезные мишени, играющие роль в приобретенной лекарственной устойчивости, включают транспортеры ATP-связывающей кассеты, такие как P-гликопротеин (P-gp, P-170, PGY1, MDR1, ABCB1, MDR-ассоциированный белок, белок множественной лекарственной устойчивости 1), MDR-2 и MDR-3. MRP2 (белок, связанный с множественной лекарственной устойчивостью), BCR-ABL (область локализации сайта инициации реаранжировки - протоонкоген Абельсона), связанный с устойчивостью белок STI-571, белок устойчивости рака легкого, циклооксигеназа-2, ядерный фактор каппа, XRCC1 (белок, входящий в группу 1 комплементации, которая обусловливает чувствительность клеток к рентгеновскому излучению), ERCC1 (ген эксцизионной репарации ДНК), GSTP1 (глутатион-S-трансфераза), мутантный β-тубулин и факторы роста, такие как IL-6, являются дополнительными мишенями, способствующими приобретенной лекарственной устойчивости.
Особенно полезные мишени, которые способствуют лекарственной устойчивости, включают транспортеры ATP-связывающей кассеты, такие как P-гликопротеин, MDR-2, MDR-3, BCRP, APT11a и LRP.
Полезные мишени также включают белки, стимулирующие устойчивость к апоптозу. Сюда относятся Bcl-2 (B-клеточный лейкоз/лимфома), Bcl-XL, A1/Bfl 1, киназа фокальной адгезии, дигидродиолдегидрогеназа и мутантный белок p53.
Кроме того, полезные мишени включают онкогенные и мутантные белки-супрессоры опухолей. Примерами являются β-катенин, PKC-α (протеинкиназа C), C-RAF, K-Ras (V12), Dead box РНК-геликаза DP97, DNMT1 (ДНК-метилтрансфераза 1), FLIP (Flice-подобный ингибиторный белок), C-Sfc, 53BPI, белок группы Polycomb EZH2 (энхансер гомолога zeste), ErbB1, HPV-16 E5 и E7 (ранний белок 5 и ранний белок 7 вируса папилломы человека), фортилин и MCI1P (белок миелоидного лейкоза 1), DIP13α (взаимодействующий с DDC белок 13a), MBD2 (метил-CpG-связывающий домен), p21, KLF4 (Kruppel-подобный фактор 4), tpt/TCTP (трансляционно-контролируемый опухолевый белок), SPK1 и SPK2 (сфингозинкиназа), P300, PLK1 (Polo-подобная киназа-1), Trp53, Ras, ErbB1, VEGF (фактор роста эндотелия сосудов), BAG-1 (BCL2-ассоциированный атаноген 1), MRP2, BCR-ABL, связанный с устойчивостью белок STI-571, белок устойчивости рака легкого, циклооксигеназа-2, ядерный фактор каппа, XRCC1, ERCC1, GSTP1, мутантный β-тубулин и факторы роста.
Также полезными в качестве мишеней являются общие регуляторные элементы, например, белки, связывающие элемент цитоплазматического полиаденилирования (CEPBs). Например, CEPB4 избыточно экспрессирован при глиобластоме и раке поджелудочной железы, при этом белок активирует сотни генов, связанных с ростом опухолей, и он не обнаружен в здоровых клетках (Oritz-Zapater et al., 2011). В соответствии с настоящим описанием, таким образом, лечение глиобластомы можно осуществлять путем введения композиции, содержащей интактные, полученные из бактерий мини-клетки, заключающие в себе средство, препятствующее избыточной экспрессии CEPB4, такое как миРНК или другие молекулы функциональной нуклеиновой кислоты, которые нарушают экспрессию CEPB4 клетками опухоли мозга.
(D) Опухоли мозга
Тот факт, что потеря целостности сосудов, как подробно описано выше, характерна для всех типов и стадий опухолей мозга, означает, что методологию по настоящему изобретению можно адаптировать для использования в лечении любой опухоли мозга. В этом отношении, «опухоль мозга» представляет собой солидное новообразование, находящееся внутри черепной коробки или в центральном позвоночном канале.
Существует более 120 типов опухолей мозга. Большинство медицинских учреждений используют систему классификации Всемирной организации здравоохранения (ВОЗ) для идентификации опухолей мозга. ВОЗ классифицирует опухоли мозга по клеточному происхождению и тому, как клетки ведут себя, начиная с наименее агрессивных (доброкачественных) до наиболее агрессивных (злокачественных). Для некоторых типов опухолей существует градация, начиная со степени I (наименее злокачественные) до степени IV (наиболее злокачественные), что отражает скорость их роста. Существуют различия в системах градации, в зависимости от типа опухоли. Классификация и определение степени отдельной опухоли помогают прогнозировать ее вероятное поведение. Наиболее часто диагностируемые типы включают неврому слухового нерва, астроцитому (включая опухоль I степени - волосовидную астроцитому, II степени - низкодифференцированную астроцитому, III степени - анапластическую астроцитому и IV степени - глиобластому (GBM)), хордому, лимфому ЦНС, краниофарингиому, другие глиомы (глиому ствола мозга, эпендимому, смешанную глиому, глиому зрительного нерва и субэпендимому), медуллобластому, менингиому, метастатические опухоли мозга, олигодендроглиому, опухоли гипофиза, примитивные нейроэктодермальные опухоли (PNET), другие связанные с мозгом состояния и шванному.
У детей наиболее часто встречаются следующие опухоли мозга: глиома ствола мозга, краниофарингиома, эпендимома, ювенильная волосовидная астроцитома (JPA), медуллобластома, глиома зрительного нерва, опухоль шишковидной железы, примитивные нейроэктодермальные опухоли (PNET) и рабдоидная опухоль.
Настоящую технологию можно применять для лечения любой опухоли мозга, включая, но без ограничения, вышеупомянутые типы и степени, при условии, что имеет место ангиогенез. На практике, этот ориентир относится к тому моменту, когда по меньшей мере опухоль можно обнаружить с помощью МРТ, то есть, если она выросла до того размера, когда ей необходима новая сосудистая система. Таким образом, методология по изобретению подходит для лечения первичной опухоли мозга или метастатической (вторичной) опухоли мозга, на любой из следующих стадий:
I степень: Ткань доброкачественная. Клетки выглядят почти как нормальные клетки мозга, и клетки растут медленно.
II степень: Ткань злокачественная. Клетки меньше похожи на нормальные клетки, по сравнению с клетками опухоли I степени.
III степень: Злокачественная ткань содержит клетки, которые по виду сильно отличаются от нормальных клеток. Аномальные клетки активно растут. Эти аномально выглядящие клетки называются анапластическими.
IV степень: Злокачественная ткань содержит клетки, которые выглядят совершенно аномально и имеют тенденцию к очень быстрому росту.
Известно, что опухоли различных типов избыточно экспрессируют некоторые рецепторы на поверхности своих клеток. Например, злокачественные опухоли молочной железы, которые метастазируют в мозг, как правило, имеют повышенный процент метастатических клеток рака молочной железы, которые избыточно экспрессируют рецептор HER2 (Palmieri et al., 2007). Те же авторы показали, что экспрессия рецептора EGF также гораздо выше в мозговых метастазах. В другом примере показано, что рецептор интегрина α3β1 избыточно экспрессирован в клетках рака легкого, которые метастазировали в мозг (Yoshimasu et al., 2004).
Зная об этом, лечение по настоящему изобретению метастазов в мозге, являющихся следствием конкретной первичной раковой опухоли, можно адаптировать соответствующим образом для использования нацеливающего лиганда для упакованных лекарственным средством мини-клеток, который обладает специфичностью, соответствующей первичной раковой опухоли. Таким образом, для метастазов в мозге, являющихся следствием первичного рака молочной железы, в лечении будет использован лиганд, проявляющий специфичность для HER2, при этом лиганд будет связан с мини-клеткой. Аналогично, для лечения метастазов в мозге, вызванных первичным раком легкого, лиганд будет лигандом, который проявляет специфичность для α3β1, таким как анти-α3β1 антитело, и так далее.
В соответствии с общепринятой технологией, системное введение моноклональных антител, например, анти-HER2, как в препарате Roche/Genentech трастузумабе, предназначено не для лечения метастазов в мозге, являющихся следствием первичного рака молочной железы. Это представление основано на том факте, что активные средства - антитела не пересекают гематоэнцефалический барьер достаточно эффективно для достижения терапевтически значимой концентрации в области метастатической опухоли в мозге. Например, см. статью Stemmler et al. (2007) (уровни трастузумаба в цереброспинальной жидкости возрастали только в условиях нарушенного гематоэнцефалического барьера, например, при менингеальном карциноматозе или радиотерапии). Поэтому, тем более удивительной и важной является эффективность композиции, описанной в настоящем документе, в лечении метастатических злокачественных опухолей мозга при нацеливании с помощью лиганда вышеупомянутым способом.
(E) Мини-клетки
Термин «мини-клетка» относится к производному бактериальной клетки, которое лишено хромосом («свободное от хромосом») и возникает в результате нарушения координации в процессе бинарного деления клеток с сегрегацией ДНК. Мини-клетки отличаются от других мелких везикул, например, так называемых «мембранных пузырьков» (размером ~0,2 мкм или менее), которые возникают и высвобождаются спонтанно в определенных ситуациях, но которые не связаны с конкретными генетическими перестройками или эписомной экспрессией генов. К тому же, интактные мини-клетки отличаются от бактериальных «теней», которые не возникают в результате конкретных генетических перестроек или эписомной экспрессии генов. Полученные из бактерий мини-клетки, используемые по настоящему изобретению, являются полностью интактными и, таким образом, отличаются от других свободных от хромосом форм производных бактериальных клеток, характеризующихся наружной или ограничивающей мембраной, которая нарушена или разрушена, даже удалена. См. патент США №7183105 на странице 111, строки с 54 и далее. Интактная мембрана, которая отличает мини-клетки по настоящему изобретению, позволяет удерживать терапевтически полезную нагрузку внутри мини-клетки до высвобождения полезной нагрузки после поглощения в клетках опухоли.
Мини-клетку, используемую по настоящему изобретению, можно получать из бактериальных клеток, таких как E. coli и S. typhymurium. Прокариотическая хромосомная репликация связана с нормальным бинарным делением, которое включает образование септы в середине клетки. В E. coli, например, мутация генов min, например, minCD, может устранять ингибирование образования септы на полюсах клетки во время клеточного деления, что приводит к образованию нормальной дочерней клетки и лишенной хромосом мини-клетки. См. статьи de Boer et al., 1992; Raskin & de Boer, 1999; Hu & Lutkenhaus, 1999; Harry, 2001.
Помимо мутаций в опероне min, лишенные хромосом мини-клетки также образуются в результате ряда других генетических перестроек или мутаций, которые влияют на образование септы, например, в гене divIVB1 в B. subtilis. См. статью Reeve and Cornett (1975). Мини-клетки также могут образовываться в результате отклонений в уровнях экспрессии генов белков, участвующих в клеточном делении/сегрегации хромосом. Например, избыточная экспрессия minE приводит к разделению полюсов и образованию мини-клеток. Аналогично, лишенные хромосом мини-клетки могут возникать в результате дефектов в сегрегации хромосом, примерами являются мутация smc в Bacillus subtilis (Britton et al., 1998), делеция spoOJ в B. subtilis (Ireton et al., 1994), мутация mukB в E. coli (Hiraga et al., 1989) и мутация parC в E. coli (Stewart and D’Ari, 1992). Кроме того, CafA может повышать скорость клеточного деления и/или ингибировать разделение хромосом после репликации (Okada et al., 1994), что приводит к образованию сцепленных клеток и лишенных хромосом мини-клеток.
Соответственно, для настоящего изобретения мини-клетки можно получать из любой бактериальной клетки, как грамположительной, так и грамотрицательной. Кроме того, мини-клетки, используемые по изобретению, должны обладать интактными клеточными стенками (то есть, быть «интактными мини-клетками»), как указано выше, и их следует отличать и отделять от других небольших везикул, таких как мембранные пузырьки, которые не могут быть результатом конкретных генетических перестроек или эписомной экспрессии генов.
В конкретном варианте осуществления родительские (исходные) бактерии для мини-клеток могут быть грамположительными, или они могут быть грамотрицательными, как уже упоминалось. Таким образом, в одном аспекте родительские бактерии представляют собой одну или более, выбранные из терра-/глидобактерий (BV1), протеобактерий (BV2), BV4, включая спирохеты, сфингобактерий и планктобактерий. В другом аспекте бактерии представляют собой одну или более, выбранные из фирмикутов (BV3), таких как бациллы, клостридии или тенерикуты/молликуты, или актинобактерий (BV5), таких как актиномицеты или бифидобактерии.
В еще одном аспекте бактерии представляют собой одну или более, выбранные из эубактерий (Chloroflexi, Deinococcus-Thermus), цианобактерий, термодесульфобактерий, термофилов (Aquificae, Thermotogae), альфа, бета, гамма (Enterobacteriaceae), дельта или эпсилон протеобактерий, спирохет, фибробактерий, Chlorobi/Bacteroidetes, хламидий/веррукомикробов, планктомицетов, ацидобактерий, Chrysiogenetes, Deferribacteres, Fusobacteria, Gemmatimonadetes, Nitrospirae, Synergistetes, Dictyoglomi, Lentisphaerae Bacillales, Bacillaceae, Listeriaceae, Staphylococcaceae, Lactobacillales, Enterococcaceae, Lactobacillaceae, Leuconostocaceae, Streptococcaceae, Clostridiales, Halanaerobiales, Thermoanaerobacterales, Mycoplasmatales, Entomoplasmatales, Anaeroplasmatales, Acholeplasmatales, Haloplasmatales, Actinomycineae, Actinomycetaceae, Corynebacterineae, Mycobacteriaceae, Nocardiaceae, Corynebacteriaceae, Frankineae, Frankiaceae, Micrococcineae, Brevibacteriaceae и Bifidobacteriaceae.
Для фармацевтического применения композиция по изобретению должна содержать мини-клетки, которые отделены как можно тщательнее от иммуногенных компонентов и других токсических примесей. Методы очистки полученных из бактерий мини-клеток для удаления свободного эндотоксина и родительских бактериальных клеток описаны в WO 2004/113507, полное содержание которого включено в настоящий документ посредством ссылки. Вкратце, процесс очистки позволяет достичь удаления (a) мелких везикул, таких как мембранные пузырьки, которые, как правило, имеют размер менее чем 0,2 мкм, (b) свободных эндотоксинов, высвобождающихся из клеточных мембран, и (c) родительских бактерий, живых или мертвых, и их обломков, которые также являются источником свободных эндотоксинов. Такое удаление можно проводить, в том числе, с помощью 0,2-мкм фильтра для удаления более мелких везикул и обломков клеток, 0,45-мкм фильтра для удаления родительских клеток после индукции образования родительскими клетками филаментов; антибиотиков для уничтожения живых бактериальных клеток и антител против свободных эндотоксинов.
В основе метода очистки лежит открытие авторов настоящего изобретения, заключающееся в том, что, несмотря на различия бактериальных источников, все интактные мини-клетки имеют размер примерно 400 нм, то есть, они крупнее, чем мембранные пузырьки и другие мелкие везикулы, и при этом меньше, чем родительские бактерии. Определение размера мини-клеток можно проводить с использованием твердофазных, таких как электронная микроскопия, или жидкофазных, таких как динамическое рассеяние света, методов. Значение размера, полученное каждым из таких методов, может иметь диапазон ошибки, и от метода к методу значения могут несколько различаться. Так, размер мини-клеток в сухом состоянии, измеренный с помощью электронной микроскопии, может составлять примерно 400 нм ±50 нм. С другой стороны, при измерении с помощью динамического рассеяния света размер тех же мини-клеток может составлять примерно 500 нм ±50 нм. Кроме того, размер упакованных лекарственным средством, нацеленных при помощи лиганда мини-клеток при измерении методом динамического рассеяния света может составлять примерно 600 нм ±50 нм.
Этот разброс значений размера можно легко использовать на практике, например, для целей отделения мини-клеток от иммуногенных компонентов и других токсических примесей, описанных выше. Таким образом, интактная, полученная из бактерий мини-клетка характеризуется наличием цитоплазмы, окруженной твердой мембраной, которая придает мини-клетке жесткую сферическую структуру. Эта структура видна на полученных при помощи трансмиссионного электронного микроскопа изображениях, на которых измеряют диаметр мини-клеток, в поперечнике мини-клеток между внешних границ твердой мембраны. Такое измерение дает вышеприведенное значение размера 400 нм ±50 нм.
Другим структурным элементом мини-клетки, полученной из грамотрицательных бактерий, является O-полисахаридный компонент липополисахарида (ЛПС), встроенного в наружную мембрану за счет якоря из липида A. Компонент представляет собой цепь из повторяющихся единиц углеводных остатков, количество которых может достигать от 70 до 100 повторяющихся единиц четырех-пяти сахаров на каждую цепь. Поскольку эти цепи не являются жесткими, в жидком окружении, как in vivo, они могут принимать волнообразную гибкую структуру, которая делает их похожими на водоросли в коралловом море; то есть, цепи движутся вместе с жидкостью, оставаясь закрепленными на мембране мини-клетки.
Под влиянием O-полисахаридного компонента определяемое методом динамического рассеяния света значение размера мини-клетки составляет от примерно 500 нм до примерно 600 нм, как отмечено выше. Тем не менее, мини-клетки из грамотрицательных и грамположительных бактерий одинаково легко проходят через 0,45-мкм фильтр, что дает основания считать эффективный размер мини-клеток равным 400 нм ± 50 нм. Вышеупомянутый разброс в размерах охвачен настоящим изобретением и, в частности, отражен с помощью слова «примерно» во фразе «размер примерно 400 нм» и тому подобных.
Что касается токсических примесей, композиция по изобретению может содержать менее чем примерно 350 ЕЭ свободного эндотоксина. Примерами в этом отношении являются уровни свободного эндотоксина, составляющие примерно 250 ЕЭ, примерно 200 ЕЭ, примерно 150 ЕЭ, примерно 100 ЕЭ, примерно 90 ЕЭ, примерно 80 ЕЭ, примерно 70 ЕЭ, примерно 60 ЕЭ, примерно 50 ЕЭ, примерно 40 ЕЭ, примерно 30 ЕЭ, примерно 20 ЕЭ, примерно 15 ЕЭ, примерно 10 ЕЭ, примерно 9 ЕЭ, примерно 8 ЕЭ, примерно 7 ЕЭ, примерно 6 ЕЭ, примерно 5 ЕЭ, примерно 4 ЕЭ, примерно 3 ЕЭ, примерно 2 ЕЭ, примерно 1 ЕЭ, примерно 0,9 ЕЭ, примерно 0,8 ЕЭ, примерно 0,7 ЕЭ, примерно 0,6 ЕЭ, примерно 0,5 ЕЭ, примерно 0,4 ЕЭ, примерно 0,3 ЕЭ, примерно 0,2 ЕЭ, примерно 0,1 ЕЭ, примерно 0,05 ЕЭ и примерно 0,01 ЕЭ, соответственно.
Композиция по изобретению может также содержать по меньшей мере примерно 108 мини-клеток, например, по меньшей мере примерно 5×108. Альтернативно, композиция может содержать порядка 109 или 1010 мини-клеток, например, 5×109, 1×1010 или 5×1010 мини-клеток. Кроме того, среди любого такого количества мини-клеток композиция по изобретению может содержать менее чем примерно 10 примесных родительских бактериальных клеток, например, менее чем примерно 9, 8, 7, 6, 5, 4, 3, 2 или 1 родительских бактериальных клеток.
(F) Упаковка антинеопластического средства в мини-клетки
Антинеопластические средства, такие как белки и функциональные нуклеиновые кислоты, которые могут быть закодированы нуклеиновой кислотой, можно вводить в мини-клетки путем трансформации родительской бактериальной клетки вектором, таким как плазмида, который кодирует антинеопластическое средство. Когда мини-клетка образуется из родительской бактериальной клетки, в мини-клетке сохраняется несколько копий плазмиды и/или продукт экспрессии, антинеопластическое средство. Более подробно упаковка продукта экспрессии в мини-клетку описана в заявке WO 03/033519, полное содержание которой включено в настоящий документ посредством ссылки.
Данные, представленные в WO 03/033519, демонстрируют, например, что рекомбинантные мини-клетки, несущие экспрессионные плазмиды генов млекопитающих, можно доставлять в фагоцитирующие клетки и нефагоцитирующие клетки. В заявке также описана генетическая трансформация продуцирующих мини-клетки родительских бактериальных штаммов гетерологичными нуклеиновыми кислотами, находящимися на эписомно реплицирующихся плазмидных ДНК. После разделения родительских бактерий и мини-клеток, происходила сегрегация некоторого количества эписомной ДНК в мини-клетки. Полученные рекомбинантные мини-клетки легко поглощались фагоцитирующими клетками млекопитающих и разрушались внутри внутриклеточных фаголизосом. Более того, некоторое количество рекомбинантной ДНК ускользало через мембрану фаголизосом и переносилось в ядро клеток млекопитающих, где рекомбинантные гены экспрессировались.
Нуклеиновые кислоты также можно упаковывать в мини-клетки напрямую. Так, нуклеиновую кислоту можно упаковывать напрямую в интактные мини-клетки путем совместной инкубации множества интактных мини-клеток с нуклеиновой кислотой в буфере. Состав буфера можно варьировать, в зависимости от условий, хорошо известных в данной области, для оптимизации нагрузки нуклеиновой кислоты в интактные мини-клетки. Буфер также можно варьировать в зависимости от нуклеотидной последовательности и длины нуклеиновой кислоты, которую предстоит нагружать в мини-клетки. После упаковки нуклеиновая кислота остается внутри мини-клетки и защищена от разрушения. Исследования продолжительной инкубации упакованных миРНК мини-клеток, инкубированных в стерильном физиологическом растворе, продемонстрировали, например, отсутствие утечки миРНК.
В других вариантах осуществления несколько нуклеиновых кислот, направленных на различные целевые мРНК, можно упаковывать в одну и ту же мини-клетку. Такой подход можно использовать для борьбы с лекарственной устойчивостью и устойчивостью к апоптозу. Например, онкологические пациенты часто бывают невосприимчивыми к химиотерапевтическим лекарственным средствам. Такая невосприимчивость может быть опосредована избыточной экспрессией генов, таких как гены, кодирующие выносящий клеточный насос, обеспечивающий множественную лекарственную устойчивость (МЛУ), и антиапоптотические гены, в частности. Для борьбы с такой устойчивостью мини-клетки можно упаковывать функциональными нуклеиновыми кислотами, направленными на связанные с МЛУ гены, в терапевтически значимых концентрациях и вводить пациентам перед химиотерапией. Кроме того, упаковка в одну и ту же мини-клетку нескольких функциональных нуклеиновых кислот, направленных на различные целевые мРНК, может повышать успех терапии, поскольку большинство молекулярных мишеней подвержены мутациям и имеют несколько аллелей. Более подробная информация о прямой упаковке нуклеиновой кислоты в мини-клетку приведена в заявке WO 2009/027830, полное содержание которой включено в настоящий документ посредством ссылки.
Низкомолекулярные лекарственные средства, как гидрофильные, так и гидрофобные, можно упаковывать в мини-клетки путем создания градиента концентрации лекарственного средства между внеклеточной средой, содержащей мини-клетки, и цитоплазмой мини-клеток. Когда внеклеточная среда содержит более высокую концентрацию лекарственного средства, чем цитоплазма мини-клеток, лекарственное средство естественным образом движется вниз по этому градиенту концентрации в цитоплазму мини-клеток. Однако когда градиент меняется на противоположный, лекарственное средство не выходит из мини-клеток.
Чтобы нагрузить мини-клетки лекарственными средствами, которые обычно не растворимы в воде, лекарственные средства сначала можно растворять в соответствующем растворителе. Например, паклитаксел можно растворять в смеси 1:1 этанола и кремофора EL (полиэтоксилированное касторовое масло), с последующим разбавлением в PBS для получения раствора паклитаксела, который частично растворен в водной среде и несет минимальные количества органического растворителя для гарантии того, что лекарственное средство будет оставаться в растворе. Мини-клетки можно инкубировать в этой конечной среде для нагрузки лекарственного средства. Таким образом, авторы изобретения обнаружили, что даже гидрофобные лекарственные средства могут диффундировать в цитоплазму или мембрану мини-клеток, в результате чего достигается высокое и терапевтически значимое содержание лекарственного средства в цитоплазме. Это неожиданно, поскольку мембрана мини-клеток состоит из гидрофобного фосфолипидного бислоя, который, как можно было бы ожидать, предотвращает диффузию гидрофобных молекул в цитоплазму.
В примере 10, ниже, продемонстрирована нагрузка в мини-клетки различных типичных низкомолекулярных лекарственных средств, имеющих разные размеры и химические свойства: доксорубицина, паклитаксела, фтор-паклитаксела, цисплатина, винбластина, монсатрола, ингибитора тимидилатсинтазы (ТС) OSI-7904, иринотекана, 5-Фторурацила, гемцитабина и карбоплатина. Более того, во всех случаях полученные упакованные низкомолекулярным лекарственным средством мини-клетки проявляли значительную противоопухолевую эффективность in vitro и in vivo. Таким образом, представленные в настоящем документе данные наглядно демонстрируют эффективность и универсальность способов нагрузки мини-клеток.
(G) Направление мини-клеток на определенные клетки млекопитающих
В следующем аспекте данного изобретения мини-клетки композиции, описанные выше, направлены на целевые опухолевые клетки млекопитающих при помощи лиганда. В некоторых вариантах осуществления лиганд является «биспецифическим». То есть, лиганд проявляет специфичность в отношении клеточных компонентов как мини-клеток, так и (опухолевых) клеток млекопитающих, так что это приводит к связыванию данной мини-клетки с клеткой-мишенью, в результате чего последняя поглощает первую. Использование биспецифических лигандов для нацеливания мини-клетки на клетку опухоли дополнительно описано в WO 05/056749 и WO 05/079854, полное содержание которых включено в настоящий документ посредством ссылок. После связывания такого лиганда с мини-клеткой незанятая специфичность («моноспецифичность») лиганда сохраняется до связывания с целевой (опухолевой) клеткой млекопитающего.
Лиганд может экспрессироваться из мини-клеток или их родительских клеток, а затем экспонироваться на поверхности мини-клеток. Альтернативно, лиганд можно связывать с клеточной мембраной мини-клеток («наносить на нее»), например, за счет взаимодействия лиганд-рецептор. В любом случае для лиганда не требуется специфичность в отношении мини-клетки, и он только проявляет специфичность в отношении компонента, характерного для клеток млекопитающих. То есть, такой компонент не обязательно должен быть уникальным для клеток опухолей, как таковых, или даже для конкретного вида клеток опухолей, которые лечат, при условии, что клетки опухолей представляют компонент на своей клеточной поверхности. При внутривенном введении мини-клетки быстро накапливаются в микроокружении опухоли, как обнаружили авторы настоящего изобретения (см. также примеры ниже). Это накопление, возникающее вследствие вышеописанной негерметичности сосудов опухолей, обеспечивает целевую доставку упакованной в мини-клетки терапевтической полезной нагрузки к клеткам опухоли. Тем не менее, может быть полезным, и иногда является предпочтительным, если в соответствии с изобретением лиганд будет нацелен на компонент опухоли, подлежащей лечению.
В любом случае мини-клетки, содержащиеся во введенной композиции по изобретению, накапливаясь в микроокружении опухоли мозга, как описано выше, контактируют и связываются с целевыми клетками опухолей, вызывая их поглощение этими клетками, которые затем подвергнутся действию терапевтической полезной нагрузки. Эта полезная нагрузка может представлять собой цитотоксическое лекарственное средство, например, доксорубицин или любое другое антинеопластическое лекарственное средство, описанное выше. Полезная нагрузка может также представлять собой миРНК или микроРНК, например, антиапоптотическую последовательность для РНКи, например, анти-Bcl2.
Авторы изобретения обнаружили, что этот подход с целевой доставкой широко применим к целому ряду опухолевых клеток млекопитающих, включая клетки, которые обычно резистентны к специфической адгезии и эндоцитозу мини-клеток. Например, лиганды, состоящие из антитела, направленного на анти-HER2 рецептор или анти-EGF рецептор, эффективно связывают мини-клетки с соответствующими рецепторами на целом ряде целевых нефагоцитирующих клеток. Такие клетки включают клетки рака легкого, яичников, мозга, молочной железы, предстательной железы и кожи.
Достигнутое таким образом связывание предшествует быстрому эндоцитозу мини-клеток каждым типом нефагоцитирующих клеток. В более общем смысле, подходящая целевая клетка по настоящему изобретению характеризуется экспрессией рецептора клеточной поверхности, который при связывании лиганда способствует эндоцитозу. Клетки-хозяева обычно резистентны к адгезии. Вследствие этого, при адгезии за счет лиганда клетка-хозяин активирует свой механизм эндоцитоза для удаления лиганда.
Термин «эндоцитоз» охватывает (1) фагоцитоз и (2) пиноцитоз, причем эта категория включает (2a) макропиноцитоз, для которого не требуется связывание рецептора, а также (2b) опосредованный клатрином эндоцитоз, (2c) опосредованный кавеолами эндоцитоз и (2d) независимый от клатрина/кавеол эндоцитоз, все из которых, как правило, могут входить в поздний эндосомальный/лизосомальный путь. Авторы настоящего изобретения обнаружили, что взаимодействие между лигандом на мини-клетке и поверхностным рецептором клетки млекопитающего активирует определенный путь эндоцитоза, включающий опосредованный рецептором эндоцитоз (rME) в поздний эндосомальный/лизосомальный компартмент. Авторы настоящего изобретения также установили, что за счет такого пути эндоцитоза мини-клетки были способны высвобождать свою полезную нагрузку в цитоплазму целевой клетки млекопитающего. В случае, если полезная нагрузка представляет собой кодирующую нуклеиновую кислоту, нуклеиновая кислота не только полностью не разрушается в позднем эндосомальном/лизосомальном компартменте, но также и экспрессируется в целевой клетке млекопитающего.
Лиганды, полезные для вышеописанного подхода с целевой доставкой по данному изобретению, включают любой агент, который связывается с поверхностным компонентом на целевой клетке и с поверхностным компонентом на мини-клетке. Предпочтительно, поверхностный компонент на целевой клетке представляет собой рецептор. Лиганды могут включать полипептидный и/или углеводный компонент. Антитела являются предпочтительными лигандами.
Например, антитело, обладающее специфичностью в отношении поверхностного компонента, такого как опухолевый антиген, на целевых клетках опухоли мозга млекопитающего, можно эффективно использовать для нацеливания мини-клеток на клетки-мишени в опухоли мозга, подлежащей лечению. Примеры рецепторов клеточной поверхности включают рецептор эпидермального фактора роста (EGFR), рецептор фактора роста эндотелия сосудов (VEGFR), рецептор тромбоцитарного фактора роста (PDGFR) и рецептор инсулиноподобного фактора роста (IGFR), все из которых на высоком уровне экспрессируются в ряде солидных опухолей, включая опухоли мозга, а также фолатный рецептор, который избыточно экспрессирован в некоторых аденомах гипофиза. Биспецифический лиганд может также быть нацелен на мутантные или вариантные рецепторы, например, рецептор IL-13Rα2, который экспрессируется в 50%-80% GBM человека (Debinski et al., 2000; Jarboe et al., 2007; Okada et al., 2008; Wykosky et al., 2008), но отличается от своего физиологического аналога IL4R/IL13R, который экспрессируется в нормальных тканях (Hershey 2003). IL13Rα2 практически отсутствует в нормальных клетках мозга (Debinski and Gibo 2000). Кроме того, опухоли, которые дают метастазы в мозг, могут избыточно экспрессировать некоторые рецепторы, и эти рецепторы также могут быть подходящими мишенями. Например, в одном исследовании показано (Da Silva et al., 2010), что метастазы в мозге рака молочной железы экспрессировали все члены семейства HER тирозинкиназных рецепторов. HER2 был амплифицирован и избыточно экспрессирован в 20% метастазов в мозге, EGFR был избыточно экспрессирован в 21% метастазов в мозге, HER3 был избыточно экспрессирован в 60% метастазов в мозге и HER4 был избыточно экспрессирован в 22% метастазов в мозге. Интересно, что экспрессия HER3 была повышена в клетках рака молочной железы, находящихся в мозге.
Предпочтительные лиганды включают антитела и/или производные антител. Используемый в настоящем документе термин «антитело» охватывает молекулу иммуноглобулина, полученную в результате развития иммуногенного ответа in vitro или in vivo. Соответственно, категория «антитело» включает моноклональные антитела и гуманизированные антитела, а также производные антител, такие как одноцепочечные фрагменты антитела (scFv), биспецифические антитела и так далее. Известно множество различных биспецифических лигандов на основе белков и антител, о чем свидетельствует обзорная статья Caravella и Lugovskoy (2010), полное содержание которой включено в настоящий документ посредством ссылки. Антитела и производные антител, полезные по настоящему изобретению, можно также получать методами рекомбинантной ДНК.
(H) Препараты и способы, и режимы введения
Препараты композиции по изобретению можно предоставлять в стандартной лекарственной форме, например, в ампулах или флаконах, или в многодозовых контейнерах, с добавлением или без добавления консерванта. Препарат может представлять собой раствор, суспензию или эмульсию в масляных или водных растворителях, и может содержать вспомогательные средства, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. Подходящий раствор является изотоническим с кровью реципиента, и примерами являются солевой раствор, раствор Рингера и раствор декстрозы. Альтернативно, препараты могут быть в форме лиофилизированного порошка, предназначенного для восстановления в подходящем растворителе, например, стерильной апирогенной воде или физиологическом солевом растворе. Препараты могут также находиться в форме депо-препарата. Такие длительно действующие препараты можно вводить имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией.
Некоторые аспекты изобретения относятся к содержащей мини-клетки композиции, включающей терапевтически эффективное количество антинеопластического средства. «Терапевтически эффективное» количество антинеопластического средства представляет собой дозу интересующего средства, например, миРНК или химиотерапевтического лекарственного средства, которая вызывает фармакологическую реакцию при введении субъекту, в соответствии с настоящим изобретением.
В контексте настоящего изобретения, таким образом, терапевтически эффективное количество может быть оценено с точки зрения предотвращения или уменьшения опухоли мозга или симптома опухоли мозга, либо в модели на животных, либо у субъекта-человека, при введении мини-клеток, несущих терапевтически полезную нагрузку, как дополнительно описано ниже. Количество, которое проявило себя «терапевтически эффективным количеством» в конкретном случае для конкретного субъекта, может не быть эффективным для 100% субъектов, к которым применяли аналогичное лечение по поводу опухоли мозга, даже если такая доза признана «терапевтически эффективным количеством» квалифицированными практикующими врачами. В этом отношении, соответствующая доза также будет варьироваться в зависимости, например, от типа, стадии и степени тяжести опухоли мозга. В любом случае, настоящие примеры тестирования in vitro (примеры 3 и 4) и тестирования in vivo (примеры 5, 7 и 8) по настоящему изобретению, а также методология количественного определения распределения лекарственного средства in vivo (пример 9), при рассмотрении в свете всего описания, позволяют человеку, обладающему знаниями в области доклинических и клинических испытаний потенциальных лекарственных средств, определять обычным экспериментальным путем терапевтически эффективное количество активного средства для конкретной ситуации. Кроме того, если термин «терапевтически эффективное» используют применительно к количеству мини-клеток в фармацевтической композиции, это количество может быть установлено на основе того, какое антинеопластическое средство упаковано в мини-клетки, и эффективности этого средства в лечении опухоли мозга. В связи с этим, терапевтический эффект можно измерять при помощи клинических или патологических параметров, таких как масса опухоли. Уменьшение или сокращение увеличения массы опухоли, соответственно, можно использовать для измерения терапевтических эффектов.
Препараты по изобретению можно вводить различными способами и в различные участки тела млекопитающего для достижения желаемого терапевтического эффекта(ов), либо местным, либо системным введением. В конкретном аспекте способ введения представляет собой внутривенную инъекцию.
Как правило, препараты по изобретению можно использовать в соответствующих дозах, определенных рутинным тестированием, для получения оптимального физиологического эффекта при минимальной потенциальной токсичности. Режим дозирования можно выбирать в зависимости от различных факторов, включая возраст, массу тела, пол, медицинское состояние пациента; степень тяжести или стадию развития опухоли мозга, способ введения, а также функцию почек и печени пациента.
Оптимальная точность в достижении концентрации мини-клеток и лекарственного средства в пределах диапазона, который обеспечивает максимальную эффективность с минимальными побочными эффектами, может и, как правило, будет требовать режима введения, основанного на кинетике доступности средства для целевых участков и целевых клеток. Распределение, равновесное состояние и элиминация мини-клеток или средства может учитываться при определении оптимальной концентрации для режима лечения. Дозировку мини-клеток и лекарственного средства, соответственно, можно регулировать для достижения желаемых эффектов.
Более того, введение доз препаратов можно оптимизировать с использованием фармакокинетической/фармакодинамической модельной системы. Так, можно выбирать один или более режимов дозирования, и фармакокинетическую/фармакодинамическую модель можно использовать для определения фармакокинетического/фармакодинамического профиля одного или более режимов дозирования. На основе такого конкретного профиля затем можно выбирать для введения один из режимов дозирования, который позволяет достичь желаемого фармакокинетического/фармакодинамического ответа. Например, см. WO 00/67776.
Препарат по изобретению можно вводить пациенту с опухолью мозга по меньшей мере один раз в неделю на протяжении нескольких недель. Так, препарат можно вводить по меньшей мере один раз в неделю в течение периода времени от нескольких недель до нескольких месяцев.
Более конкретно, препараты по изобретению можно вводить по меньшей мере один раз в сутки в течение примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или 31 дней. Альтернативно, препараты можно вводить примерно один раз в сутки или примерно один раз в 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или 31 дней или более.
В другом варианте осуществления изобретения препараты можно вводить примерно один раз в неделю или примерно один раз в 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 недель или более. Альтернативно, препараты можно вводить по меньшей мере один раз в неделю в течение примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 недель или более.
Альтернативно, препараты можно вводить примерно один раз в месяц или примерно один раз в 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев или более.
Препараты можно вводить в виде разовой суточной дозы. Альтернативно, общую суточную дозу можно вводить в виде разделенных доз два, три или четыре раза в сутки.
Следующие далее примеры являются только иллюстративными, а не ограничивающими, и способствуют более полному пониманию изобретения.
Пример 1. Получение упакованных доксорубицином мини-клеток, нацеленных на EGFR собаки
Мини-клетки получали из мутанта с хромосомной делецией minCDE- Salmonella enterica серологического варианта Typhimurium, S. typhimurium, очищали, упаковывали доксорубицином (dox) и наводили на цель путем присоединения биспецифического моноклонального антитела (мАт), имеющего специфичность в отношении поверхностного O-полисахарида мини-клеток и собачьего EGFR (их обозначалиEGFRмини-клеткиDox), как ранее описано в статье MacDiarmid et al. (2007).
EGFRмини-клеткиDox сначала характеризовали в отношении их пригодности для в/в введения семи собакам со злокачественными опухолями мозга на поздней стадии (собаки были обозначены BCD-1 - BCD-7). Две дополнительные собаки, BCD-8 и BCD-9, находящиеся в Центре специализированной ветеринарной помощи, не были включены в исследование из-за очень поздней стадии их опухолей мозга и были подвергнуты эвтаназии. Из образцов биопсии мозга были получены клетки соответствующих опухолей мозга для исследований in-vitro.
Пример 2. Характеристика моноклонального антитела против человеческого EGFR в отношении связывания с клетками опухоли мозга собаки
Хорошо известно, что повышенная регуляция и избыточная экспрессия EGFR имеет место в ~60% случаев GBM как у людей (Smith et al., 2001), так и у собак (Higgins et al., 2010). В связи с отсутствием специфических для собачьего EGFR мАт, коммерчески доступные мАт против человеческого EGFR тестировали на линиях клеток опухолей мозга собаки и человека для определения перекрестной реактивности мАт с EGFR на клетках опухоли мозга собаки.
По возможности, образцы биопсии опухоли мозга получали от собак из конкретного исследования. Образцы ткани от BCD-1, -8 и -9 обрабатывали в течение 10 мин раствором 1 мг/мл коллагеназы в модифицированной по способу Дульбекко среде Игла (DMEM), содержащей 10% эмбриональной телячьей сыворотки (ЭТС) и Penstrep. Нерасщепленную ткань удаляли фильтрованием через тампон из двойного слоя стерильной марли. Расщепление коллагеназой останавливали путем разбавления клеток 5 мл среды и центрифугирования при 1200 g в течение 5 мин. Клетки промывали дополнительными 5 мл среды с последующим повторным центрифугированием и ресуспендированием. Затем клетки высевали во флаконы для тканевых культур.
Линию клеток J3T собачьей GBM (Rainov et al., 2000), получали от Dr. Michael Berens из Научно-исследовательского института трансляционной геномики (Финикс, Аризона, США). Все культуры клеток опухоли мозга собак поддерживали в среде DMEM с добавлением 10% (по объему) ЭТС, 100 Ед/мл пенициллина, 100 Ед/мл стрептомицина, 2 мМ L-глутамина и 2 мМ заменимых аминокислот.
Эпителиальную линию клеток человеческой GBM-астроцитомы (U87-MG) получали из Американской коллекции типовых культур (ATCC) и выращивали в среде OPTI-MEM (Invitrogen, США) с добавлением 5% эмбриональной бычьей сыворотки (ЭБС).
Клетки собирали, смывая их со стенок флакона 2 мМ ЭДТА/PBS, и разносили по 1×106 клеток/пробирку. Клетки промывали дважды в блокирующем растворе (PBS с 2% БСА и 0,1% азида натрия) и инкубировали в блокирующем растворе в течение 10 мин на льду, с последующей инкубацией с 1 мкг/мл моноклонального антитела против человеческого EGFR (IgG2a; Calbiochem) в течение 45 мин на льду. После двух промываний блокирующим раствором клетки инкубировали с конъюгированными с R-фикоэритрином антителами козы против IgG мыши (Molecular Probes/Invitrogen) в течение 45 мин на льду при осторожном перемешивании. После двух промываний в блокирующем растворе клетки ресуспендировали в PBS и использовали для анализа методом проточной цитометрии. В качестве контролей для определения аутофлуоресценции вместо первичного антитела использовали PBS.
На суспензиях окрашенных клеток проводили измерения с помощью проточного цитометра FC 500, используя программное обеспечение CXP для цитометра (Beckman Coulter). Количество рецепторов EGF определяли методом аналитической проточной цитометрии в сравнении со стандартами из флуоресцентных микрогранул с R-фикоэритрином (Quantum R-PE MESF beads; Bang Laboratories Inc, Фишерс, Индиана, США). Калибровочную кривую строили как график зависимости между заданным числом эквивалентных молекул R-фикоэритрина на гранулу и log их средней интенсивности флуоресценции. Интенсивность клеточной флуоресценции экстраполировали на стандартную калибровочную кривую флуоресценции. Значения средней интенсивности флуоресценции преобразовывали в количество антител, связавшихся с клеткой, после вычитания отрицательного контроля.
Результаты показали (фигура 1), что мАт прочно связываются с EGFR на клетках как собачьей (J3T, BCD-1, -8 и -9), так и человеческой (U87-MG) злокачественной опухоли мозга.
Исследования по количественному определению рецепторов с использованием FACS анализа показали (фигура 1), что концентрация EGFR на клетку (в порядке убывания) для клеток BCD-1, U87-MG, BCD-9, BCD-8 и J3T составляла 2866854, 1465755, 930440, 774352 и 287622, соответственно. Из этого следовало, что клетки каждого типа избыточно экспрессируют EGFR.
Перекрестная реактивность связывания мАт против человеческого EGFR с собачьим EGFR, таким образом, была подтверждена после анализа связывания in vitro с клетками злокачественной опухоли мозга собаки и человека.
Таким образом, для достижения активного нацеливания на клетки опухоли мозга мАт против человеческого EGFR были выбраны для нанесения на упакованные Dox мини-клетки.
Пример 3. Определение чувствительности клеток злокачественной опухоли мозга собак к химиотерапевтическому лекарственному средству доксорубицину
До использования упакованных dox, нацеленных на EGFR мини-клеток для лечения собак со злокачественной опухолью мозга на поздней стадии, важно было определить, являются ли клетки опухоли мозга собак чувствительными или устойчивыми к химиотерапевтическому лекарственному средству доксорубицину.
Клетки опухоли мозга собак BCD-1, -8, -9 и J3T, а также клетки линии U87-MG опухоли мозга человека высевали в 96-луночные планшеты при плотности 5×103 клеток на лунку. Клетки инкубировали в течение ночи при 37°C, 5% CO2.
Доксорубицин добавляли к клеткам в 100 мкл соответствующей среды, содержащей сыворотку, в диапазоне концентраций от 1,7 нМ до 8600 нМ и инкубировали в течение 72 часов.
Для измерения цитотоксического эффекта доксорубицина проводили анализ на пролиферацию клеток с использованием MTS. В каждую лунку добавляли 20 мкл раствора MTS (реагент CellTitre 96® Aqueous One MTS - Promega) и инкубировали в темноте в течение 30 минут. Оптическую плотность считывали при длине волны 490 нм. Данные анализировали в программе Prism GraphPad (Ла-Хойя, Калифорния, США) с использованием нелинейной регрессии и 4-параметрической кривой, построенной по точкам.
Анализ клеточной пролиферации показал, что все вышеуказанные линии клеток были в равной степени чувствительны к доксорубицину (фигура 2).
Пример 4. Эффективность связыванияEGFRмини-клетокDox с клетками опухоли мозга собак
Собачьи и человеческие клетки опухолей трансфицировали в течение 2 часов специфически и неспецифически нацеленными мини-клетками,EGFRмини-клеткамиDox иgp120мини-клеткамиDox, соответственно, и после отмывания от не прикрепившихся мини-клеток, клетки обрабатывали мАт против IgG2a мыши, мечеными флуоресцентным красителем Alexa-Fluor 488 (AF-488). Используемое мАт к gp120 направлено против гликопротеина gp120 оболочки вируса иммунодефицита человека 1, и оно не было обнаружено на поверхности ни одной из линий клеток опухоли мозга, протестированных в данном исследовании. Затем клетки анализировали методом FACS. Результаты показали (фигура 3), что в каждом случае >95% клеток сильно флуоресцировали при обработкеEGFRмини-клеткамиDox и никакой флуоресценции клеток не наблюдалось при обработке контрольнымиgp120мини-клеткамиDox.
Наблюдаемая эффективность связывания была дополнительно подтверждена с помощью флуоресцентной микроскопии для непосредственной визуализации связыванияEGFRмини-клетокDox с клетками опухоли мозга, а также внутриклеточной доставки доксорубицина в раковые клетки.
EGFRмини-клеткиDox использовали для трансфицирования линии клеток опухоли мозга собак и контрольной линии клеток человека. Через три часа после трансфекции и отмывания избытка несвязанных мини-клеток, мини-клетки, оставшиеся прикрепленными к клеткам данных линий, выявляли путем мечения нацеленными на EGFR мАт с конъюгатом анти-IgG2a-AF488. Результаты показали (фигура 4), что специфически нацеленные мини-клетки (EGFRмини-клеткиDox) связывались в больших количествах с человеческими и собачьими клетками злокачественных опухолей мозга, в то время как контрольные мини-клетки не связывались. Кроме того, большинство клеток, обработанныхEGFRмини-клеткамиDox, демонстрировали аутофлуоресценцию dox в клеточном ядре, что указывало на то, что значительное количество мини-клеток подверглось эндоцитозу, было лизировано во внутриклеточных лизосомах и dox высвобождался внутри клеток. Этот механизм внутриклеточной доставки лекарственных средств за счет нацеленных при помощи биспецифического антитела, упакованных лекарственным средством мини-клеток в различные опухолевые линии клеток был сформулирован ранее авторами настоящей заявки и опубликован (MacDiarmid et al., 2007).
Приведенные выше результаты предоставили логическое обоснование для упаковки мини-клеток препаратом dox и нацеливания их на EGFR.
Пример 5. Лечение семи собак со злокачественными опухолями мозга на поздней стадии при помощиEGFRмини-клетокDox и противоопухолевая эффективность
Собаки в этом исследовании были домашними любимцами, находящимися в качестве пациентов в Центре специализированной ветеринарной помощи (VSC) или в Специализированной больнице для мелких животных (SASH) в Сиднее, Австралия. Участие в исследовании было предложено для пациентов в случае, когда владелец собаки отказывался от стандартной терапии, или в случаях запущенного заболевания, для которого не существует эффективной стандартной терапии. Собак лечили в соответствии с руководством по содержанию и использованию лабораторных животных Национального совета по здравоохранению и медицинским исследованиям Австралии и с одобрения Комиссии по биоэтике EnGeneIC. Подписанное информированное согласие было получено от всех владельцев. Для всех пациентов проводили вскрытие и исследование после смерти по любой причине.
Все опухоли мозга были диагностированы по результатам гистологических или цитологических исследований, по мере возможности. Предсмертные диагнозы были основаны на сочетании характерного изображения магнитно-резонансной томографии (МРТ) и клинических признаков. Гистологическое диагностирование считали слишком инвазивным в этих случаях опухоли мозга, и диагноз подтверждали при вскрытии.
Используемые способы определения стадий опухолей варьировались в зависимости от гистологического типа и анатомической зоны опухоли, а также клинического состояния. Они включали, но без ограничения, физическое обследование, общий анализ крови, биохимический профиль сыворотки, анализ мочи, профиль коагуляция, грудные рентгенограммы, УЗИ брюшной полости и магнитно-резонансную томографию (МРТ). МРТ-сканирование проводили на приборе 1.5T Phillips Achieva.
Собаки отвечали предъявляемым требованиям для исследования, если они имели адекватное общее состояние, а также гематологические и биохимические параметры сыворотки, позволяющие проходить лечение. У всех животных было поддающееся измерению заболевание на момент начала исследования, однако ограничения по стадии заболевания или тяжести заболевания отсутствовали. Пациентам было разрешено продолжать принимать препараты, способствующие предотвращению судорог и отека ЦНС. Также разрешено было продолжать принимать препараты, предписанные ранее для лечения сопутствующих состояний. Альтернативные методы лечения были запрещены на время исследования.
Лечение введением 1×1010EGFRмини-клетокDox на дозу проводили на еженедельной основе. Лечебные препараты вводили через асептически введенный периферический венозный катетер (в левую краниальную вену) в объеме 2 мл инфузией на протяжении 2 минут.
Пациенты были госпитализированы, и у них отбирали 3 мл крови через яремную вену. Кровь помещали в раствор калия ЭДТА для изучения гематологии и в пробирки с активатором свертывания для получения сыворотки для биохимических анализов. Дополнительные 5 мл собирали перед введениемEGFRмини-клетокDox и через 4 часа после введения мини-клеток. За собаками наблюдали на протяжении всего периода клинического лечения, и при отсутствии каких-либо токсических побочных эффектов через 4 часа после введенияEGFRмини-клетокDox собак разрешали забирать домой.
Кровь помещали в стерильную пробирку, центрифугировали при 1580×g в течение 15 мин при комнатной температуре (20-22°C) и сыворотку собирали в асептических условиях. Сыворотки хранили при -80°C до их использования для составления профилей продукции цитокинов и антител. Для пациентов проводили премедикацию хлорфенирамина малеатом в дозе 0,5 мг/кг и дексаметазона натрия фосфатом в дозе 0,2 мг/кг за 15 минут до начала лечения.
Исследования проводили на семи собаках со злокачественными опухолями мозга на поздней стадии, которые прошли исходную процедуру определения клинической стадии болезни с клиническим обследованием и МРТ мозга.
У пациентов-собак, обозначенных номерами от BCD-1 до BCD-7, наблюдали типичные клинические признаки опухоли мозга на поздней стадии, включая судороги, атаксию, частичный паралич конечностей, частичную потерю периферийного зрения и агрессивное поведение (см. таблицу 2, ниже).
Внутривенные (в/в) болюсные инъекции 1×1010EGFRмини-клетокDox (2 мл) проводили собакам один раз в неделю, и каждую неделю проводили клиническую оценку, определение в сыворотке гематологических параметров, биохимических параметров, иммунного ответа (титров антител к доминантному антигену мини-клеток, ЛПС) и продукции цитокинов. МРТ-сканирование мозга проводили примерно каждые 8 недель для определения противоопухолевого ответа. Дозу мини-клеток для введения собакам предварительно определяли в исследованиях на 20 собаках с гемангиосаркомой на поздней стадии и токсикологических исследованиях на обезьянах резусах (данные не представлены).
Полученные результаты показали, что аномальные клинические симптомы опухоли мозга, определенные во время определения клинической стадии болезни (таблица 2), возвращались к норме после примерно пяти-пятнадцати дозEGFRмини-клетокDox.
Ответ оценивали по результатам МРТ-сканирования. Ответ для солидных опухолей классифицировали в соответствии с Критериями оценки ответа при солидных опухолях (RECIST v 1.1). Кроме того, определяли объем опухоли мозга с использованием формулы: длина×ширина×высота×(π/6). Полный ответ (CR) определяли как исчезновение известного макроскопического опухолевого очага, частичный ответ (PR) определяли как ≥50% уменьшение размера опухоли по сравнению с исходным, но не CR, стабилизацию заболевания определяли в случае опухолей, не соответствующих критериям CR, PR или прогрессирования заболевания, и прогрессирование заболевания (PD) определяли как ≥25% увеличение размера опухоли или появление новых очагов.
МРТ-сканирование показало, что у всех собак рост опухоли был остановлен, и в одном случае, BCD-2, не было никаких признаков большой массы опухоли (фигура 5) после всего лишь пяти дозEGFRмини-клетокDox.
Пример 6. Отсутствие признаков токсичности у собак со злокачественными опухолями мозга, несмотря на многократное введение дозEGFRмини-клетокDox
Токсичность оценивали на основании анкеты, заполняемой владельцами собак, включающей вопросы о признаках дисфункции желудочно-кишечного тракта (анорексия, диарея, рвота и энтерит) и общих признаках (вялость/усталость). Гематологическую и биохимическую токсичность определяли на еженедельной основе перед каждым введением препарата. Токсичность определяли в баллах в соответствии с общими критериями терминологии для обозначения нежелательных явлений после химиотерапии или биологической антинеопластической терапии для собак и кошек, версия 1.0, Ветеринарной кооперативной онкологической группы (VCOG-CTCAE).
Масса тела оставалась неизменной на протяжении всего курса лечения. Температура тела повышалась с 38,5°C до 39°C в течение первого часа после введения дозы и возвращалась к норме через 4 часа.
Сыворотку (5 мл) получали от собак перед введением дозыEGFRмини-клетокDox и через 4 часа после введения дозы. Оценку биохимических и гематологических профилей в сыворотке (фигуры 6 и 7) проводили в лаборатории IDEXX Laboratories (Сидней, Австралия). Диапазон нормальных значений для собак был предоставлен IDEXX laboratories.
Биохимические параметры сыворотки оставались в пределах диапазона нормальных значений (фигура 6). На момент первоначального определения клинической стадии болезни у всех собак наблюдали значительное повышение содержания ферментов печени аланинаминотрансферазы (ALT) и щелочной фосфатазы (ALP), вероятно, потому, что все собаки получали общепринятое лечение глюкокортикоидами (преднизолон) в диапазоне доз от 0,5 до 2 мг/кг один раз в сутки и фенобарбитоном (1 мг два раза в сутки) от неконтролируемых судорог. УЗИ печени проводили регулярно для всех собак, и никакие признаки опухоли в печени не были обнаружены. На протяжении всего исследования состояние печени оставалось нормальным, указывая на отсутствие каких-либо нежелательных явлений в печени, несмотря на многократное введение дозEGFRмини-клетокDox.
Гематологические показатели для всех собак также оставались в пределах нормальных значений на протяжении всего исследования (фигура 7).
Пример 7. Продукция цитокинов и антител у собак со злокачественными опухолями мозга после многократного введения дозEGFRмини-клетокDox
Сыворотки собак анализировали на собачьи воспалительные цитокины TNFα, IL-6 и противовоспалительный цитокин IL-10 с использованием наборов DuoSet® для ELISA, поставляемых компанией R&D Systems (США), после валидации каждого метода ELISA в соответствии с инструкцией производителя. Для развития окраски в микролуночных планшетах с высоким связыванием (Greiner) использовали субстрат TMB (Sigma) и результаты считывали на планшетном ридере Biotek uQuant при длине волны 450 нм.
Продукция воспалительного цитокина TNFα варьировалась у каждой собаки и какая-либо закономерность отсутствовала. У трех собак (BCD-2, -4 и -6) не наблюдалось возрастания уровня TNFα, несмотря на многократное введение доз препарата (фигура 8). У BCD-5 и BCD-7 также не наблюдалось возрастания уровня TNFα до дозы 9 и 10, соответственно, в то время как последующие 3 и 7 доз, соответственно, приводили к значительному возрастанию уровней, но без клинических неблагоприятных признаков. У BCD-1 был повышен уровень TNFα в момент определения клинической стадии болезни, и введение последующих 97 дозEGFRмини-клетокDox не приводило к дальнейшему повышению уровня TNFα.
Для воспалительного цитокина IL-6 наблюдали тенденцию, когда через 4 часа после введения дозы (фигура 8) наблюдался небольшой всплеск продукции IL-6, которая возвращалась к норме через 24 часа. Последующие дозы не приводили к увеличению всплеска IL-6, и тенденция оставалась прежней после каждой дозы. Исключение составляла собака BCD-4, у которой уровень IL-6 оставался нормальным на протяжении всего исследования (39 доз за 288 дней).
Интересно, что уровень противовоспалительного цитокина IL-10 был повышен тогда, когда наблюдались всплески продукции TNFα и IL-6 (фигура 8). Хорошо известно, что моноциты и макрофаги секретируют IL-10 после активации различными медиаторами, такими как бактериальный ЛПС (Sabat et al., 2010).
ЛПС, очищенный из S. typhimurium (Sigma), помещали в лунки (250 нг/лунку) в буфере нанесения (10 мМ Na-карбонатный буфер, pH 9,6) и инкубировали в течение ночи при 4°C. Планшеты блокировали блокирующим буфером, содержащим 1% БСА в PBS, в течение 1 часа при 37°C. Образцы сыворотки в серийных разведениях добавляли в каждый планшет и инкубировали при 4°C в течение ночи. После промывания связанные антитела обнаруживали при помощи конъюгата с пероксидазой хрена (HRP) (RDI) антител козы против IgG собаки.
Титр антител определяли как реципрокное разведение сыворотки, дающее полумаксимальное значение оптической плотности (450 нм). Программу KC Junior использовали для вычерчивания по точкам 2-параметрической кривой для каждого образца сыворотки. Все образцы анализировали в двойном повторе, и данные представляли с указанием стандартной ошибки среднего.
Титры сывороточных антител к O-полисахариду (фигура 9) демонстрировали типичный ответ, выражающийся в 20-кратном увеличении титра IgG к третьей дозе (за три недели) и достижении плато без дальнейшего повышения на протяжении всего исследования у каждой собаки. Это не удивительно, поскольку O-полисахаридный компонент ЛПС, как известно, является независимым от T-клеток антигеном типа 1, и эти антигены активируют B-клетки, главным образом, за счет стимуляции митогенных рецепторов, например, Toll-подобных рецепторов (TLRs).
Пример 8. Количество введенных многократных дозEGFRмини-клетокDox и выживание собак со злокачественными опухолями мозга на поздней стадии
Интересно, что собаки BCD-1 - BCD-7 выживали в течение 822, 709, 471, 288, 408, 140 и 101 дней, соответственно, и получали 97, 43, 44, 39, 32, 20 и 13 дозEGFRмини-клетокDox, соответственно (фигура 10). BCD-2, -3 и -5 продолжают жить в настоящее время, а BCD-2 не получала дозу в течение более 300 дней без каких-либо рецидивов опухоли. BCD-4 выживала в течение 288 дней, и заболевание оставалось стабильным, однако она погибла из-за почечной инфекции. Посмертное вскрытие выявило, что смерть наступила не из-за опухоли мозга. Удивительно, но, несмотря на очень большое количество дозEGFRмини-клетокDox, введенных системно, не было никаких клинических признаков неблагоприятных явлений.
Пример 9. In-vivo визуализацияEGFRмини-клеток в мозге двух собак со злокачественными опухолями мозга на поздней стадии
Биораспределение наночастиц in vivo, в частности, у крупных животных, вызывает затруднение из-за очень малого размера частиц, способности нести достаточно флуоресцентных молекул на частицу для возможности визуализации и концентрации, достигаемой in vivo в каждом конкретном органе. Кроме того, согласно современным представлениям, наночастицы крупнее 12 нм не проникают в опухоли мозга из-за наличия ГЭБ. Однако поразительная противоопухолевая эффективность, наблюдаемая у всех 7 собак, побудила авторов изобретения определить, действительно лиEGFRмини-клеткиDox каким-то образом проникают в опухоли мозга, несмотря на их недопустимо большой размер ~ 400 нм.
EGFRмини-клетки радиоактивно метили123йодом, и 1×1010 мини-клеток вводили в/в собакам BCD-3 и BCD-5. Собак усыпляли седативным средством и проводили визуализацию методом однофотонной эмиссионной компьютерной томографии (ОФЭКТ). Обеим собакам также ранее проводили МРТ-сканирование для точного определения размера и локализации опухоли.
Животным вводили инъекцией примерно 40 МБк радиоактивно меченых [123I]-EGFRмини-клеток и получали изображения в различные временные точки в течение следующих 4 часов. Все визуализации проводили на трех-детекторной гамма-камере ОФЭКТ (однофотонной эмиссионной компьютерной томографии) Picker 3000XP, снабженной низкоэнергетическими универсальными коллиматорами с параллельными отверстиями. Для всех съемок использовали параметры окна фотопика 159 кэВ±10%. Животных подвергали легкой анестезии перед визуализацией. Визуализацию для одной собаки (BCD-3) проводили не томографически через 30 минут и 3 часа после инъекции в лежачем положении для изучения биораспределения. Несколько плоских изображений, охватывающих голову и туловище, получали на матрицах 256×256 в течение 2 минут на каждое положение лежа в оба момента времени и объединяли после съемки для получения 2D сканированных изображений всего тела. Все томографические (ОФЭКТ) изображения получали на матрицах 128×128, используя 120 проекций с радиальным шагом 3° (всего 360°) по 20 секунд на проекцию. Все данные передавались на автономную медицинскую радиологическую рабочую станцию (HERMES, Nuclear Diagnostic, Стокгольм, Швеция) и реконструировались с использованием алгоритма итеративной реконструкции (OSEM, 8 подмножеств, 4 итерации). Изображения были реконструированы с программным масштабированием 2,0 для получения вокселей размером 1,78×1,78×2,56 мм (X×Y×Z). После реконструкции изображения пропускали через фильтр Баттерворта 10 порядка и отсечкой 1,25 циклов.пиксель-1. Ранее полученные МРТ изображения для собак были импортированы на рабочую станцию и анатомические (МРТ) и функциональные (ОФЭКТ) изображения заносили в программу.
Сканированные изображения всего тела (фигура 11ci и ii) показали интенсивное поглощение меченых [123I]-EGFRмини-клеток в печени в более ранние временные точки (30 минут после инъекции). Этот факт, а также отсутствие ранней визуализации щитовидной железы указывали на хорошее мечение мини-клеток. Выделение в кишечник было видно на более поздних изображениях, как и некоторое двустороннее поглощение в железах на шее и небольшое поглощение в щитовидной железе присутствующего (предположительно) свободного [123I]-йода.
ОФЭКТ изображения мозга (фигуры 11ai-iii и 11biii; ОФЭКТ) свидетельствовали о сосредоточении радиоактивности в области, соответствующей опухоли мозга, видной на МРТ изображении (фигуры 11ai-iii и 11bi; МРТ). Наложенные изображения совместно регистрированных T1-взвешенных постконтрастных изображений МРТ и ОФЭКТ (фигуры 11ai-iii и 11bii; ОФЭКТ/МРТ) показали, что сконцентрированная радиоактивность была локализована в сердцевине опухоли у каждой собаки.
Эти примеры демонстрируют противоопухолевую эффективность в 100% случаев опухолей мозга на поздней стадии, беспрецедентный результат, достигнутый с помощью настоящего изобретения. Это также очень неожиданный результат, учитывая следующие соображения.
1. Лекарственные средства размером порядка размера доксорубицина (579,98 дальтон), такие как паклитаксел (853,9 дальтон) и винбластин (810,9 дальтон), никогда до сих пор не рассматривались в качестве препаратов для системной (в/в) доставки и лечения опухолей мозга. Учитывая общепризнанный предел отсечения примерно 400 дальтон, как обсуждалось выше, они вообще не должны пересекать ГЭБ.
2. В результате продолжающихся десятилетиями исследований темозоломид был единственным одобренным FDA лекарственным средством для лечения злокачественных опухолей мозга; только потому, что это единственное лекарственное средство, имеющее молекулярную массу 194,15 дальтон, что ниже признанного порога отсечения в 400 дальтон для пересечения ГЭБ.
3. Даже если бы рассматривался вопрос о применении его в лечении опухолей мозга, доксорубицин при общепринятой химиотерапии, как правило, вводят в дозе от 100 мг до 125 мг среднему пациенту (60 кг). Это соответствует от 100000 мкг до 125000 мкг на введенную в/в дозу, что считается минимумом для достижения терапевтической эффективности при лечении некоторых видов рака. Согласно изобретению, напротив, доза доксорубицина, содержащаяся в 1×1010EGFRмини-клеткахDox, составляет примерно 4 мкг, что в 25000-31250 раз меньше, чем доза, вводимая при обычной химиотерапии с использованием dox. Это отклонение от общепринятой практики, в соответствии с изобретением, в сочетании с современными представлениями о лечении рака убедило бы практикующих врачей даже не рассматривать перспективу использования такой низкой дозы лекарственного средства в любом контексте, не говоря уже о контексте лечения злокачественных опухолей мозга.
4. Применение способа доставки в виде мини-клеток по настоящему изобретению противоречит общепринятым ограничениям по размерам, описанным выше, основанием для него, в свою очередь, послужило общепринятое представление в нарушенном ГЭБ в опухолях мозга. Тем не менее, полученные в настоящем изобретении данные продемонстрировали, что интактные, полученные из бактерий мини-клетки быстро проникают в опухоли мозга в значительных концентрациях, позволяющих, например, визуализировать радиоактивно меченые мини-клетки в микроокружении опухоли мозга. Результаты также свидетельствуют о весьма значительной стабилизации/регрессии опухоли у каждого из получавших лечение субъектов, беспрецедентном достижении, которое подчеркивает эффективную терапевтическую парадигму, в соответствии с изобретением, для области клинической онкологии, для которой ранее были характерны крайне незначительные результаты.

Пример 10. Упаковка различных низкомолекулярных лекарственных средств в мини-клетки
Данный пример иллюстрирует как возможность загрузки разнообразных низкомолекулярных лекарственных средств в мини-клетки, так и значительную противоопухолевую эффективность полученных композиций, содержащих упакованные низкомолекулярным лекарственным средством мини-клетки. Используемыми низкомолекулярными лекарственными средствами были:
A. доксорубицин,
B. паклитаксел,
C. фтор-паклитаксел,
D. цисплатин,
E. винбластин,
F. монсатрол,
G. ингибитор тимидилатсинтазы (TS) OSI-7904
H. иринотекан,
I. 5-фторурацил,
J. гемцитабин и
R. карбоплатин.
Упаковка доксорубицина, винбластина и паклитаксела. Эффективность упаковки доксорубицина, флуоресцентного винбластина и фтор-паклитаксела в интактные мини-клетки была продемонстрирована в статье авторов настоящего изобретения MacDiarmid et al., Cancer Cell 11: 431-45 (2007). На фигуре 1E в статье MacDiarmid et al. Cancer Cell (2007) с помощью различных флуоресцентных красителей продемонстрировано, что мини-клетки упакованы большим количеством доксорубицина (DOX), винбластина (VIN) и паклитаксела (PAC), соответственно.
Доксорубицин, фтор-паклитаксел и цисплатин не вытекают из мини-клеток после упаковки. В статье MacDiarmid et al. Cancer Cell (2007) дополнительно использовали кинетику для демонстрации того, что лекарственные средства (доксорубицин, фтор-паклитаксел и цисплатин) не только в достаточном количестве загружаются в интактные мини-клетки, но эти лекарственные средства не вытекают из интактных мини-клеток после упаковки (см. фигуру 2A в статье).
Упакованные доксорубицином и паклитакселом мини-клетки были эффективны в лечении ксенотрансплантатов рака молочной железы. Кроме того, данные, приведенные на фигуре 4A в статье MacDiarmid et al. Cancer Cell (2007), свидетельствуют о том, что ксенотрансплантаты рака молочной железы человека были эффективно излечены упакованными доксорубицином или паклитакселом мини-клетками.
Противоопухолевый эффект упакованных монастролом мини-клеток. В другой статье, опубликованной авторами настоящего изобретения, MacDiarmid et al., Cell Cycle 17: 1-7 (2007), представлены данные для демонстрации эффективности упакованных монастролом мини-клеток в ингибировании роста опухоли у мышей с ксенотрансплантатами рака молочной железы человека (см. фигуру 1A в статье).
Как показано на фигуре 1A, монастрол был эффективно упакован в интактные мини-клетки, и ксенотрансплантаты рака молочной железы человека были эффективно излечены упакованными монастролом мини-клетками.
Противоопухолевый эффект мини-клеток, упакованных ингибитором тимидилатсинтазы OSI-7904. Аналогичным образом, ксенотрансплантаты рака толстого кишечника человека были эффективно излечены упакованными лекарственным средством мини-клетками. Фигура 1B в статье MacDiarmid et al. (2007) демонстрирует, что нагруженные OSI-7904 мини-клетки были более эффективны в дозе, которая в ~385 раз меньше, чем липосомный препарат OSI-7904L, чем липосомный препарат OSI-7904L. Таким образом, вектор для доставки в виде мини-клеток резко увеличивал терапевтический индекс OSI-7904.
Эффективное лечение устойчивых к иринотекану ксенотрансплантатов рака толстого кишечника человека. Иринотекан также был упакован в интактные мини-клетки. Далее, эффективное лечение устойчивых к иринотекану ксенотрансплантатов рака толстого кишечника человека после двойного последовательного лечения упакованными кшРНК-MDR1 мини-клетками, а затем нацеленными мини-клетками с иринотеканом продемонстрировано на фигурах 5A и 5A в статье MacDiarmid et al., Nature Biotechnology 27: 643-51 (2009), другой статье, опубликованной авторами настоящего изобретения.
Эффективное лечение устойчивых к 5-фторурацилу ксенотрансплантатов рака толстого кишечника человека. Подобно иринотекану, 5-Фторурацил также был упакован в интактные мини-клетки, и эффективное лечение устойчивых к 5-фторурацилу ксенотрансплантатов рака толстого кишечника человека было достигнуто после двойного последовательного лечения упакованными кшРНК-MDR1 мини-клетками, а затем нацеленными мини-клетками с 5-фторурацилом. См. дополнительные фигуры 4A и 4B в статье MacDiarmid et al., (2009).
Эффективное лечение ксенотрансплантатов рака поджелудочной железы человека упакованными гемцитабином (гемзар®) мини-клетками. На фигуре 12 показано, что ксенотрансплантаты рака поджелудочной железы человека были эффективно излечены упакованными гемцитабином (гемзар®) мини-клетками.
Ксенотрансплантаты рака поджелудочной железы человека (MIA PaCa) мышам Balb/c nu/nu вводили в/в либо со свободным гемзаром, либо с нацеленными на EGFR упакованными гемзаром мини-клетками (EGFRмини-клеткигемзар). На фигуре 12 показано, что, хотя дозы в мини-клетках составляли только ~50 нг гемзара, противоопухолевая эффективность леченияEGFRмини-клеткамигемзар была практически такой же, как противоопухолевая эффективность свободного гемзара, введенного в количестве 400000 нг на дозу.
Карбоплатин в лечении ксенотрансплантатов рака молочной железы человека. Эффект упакованных карбоплатином мини-клеток в лечении ксенотрансплантатов рака молочной железы человека продемонстрирован на фигуре 13.
Ксенотрансплантаты рака молочной железы человека (MDA-MB-468) мышам Balb/c nu/nu вводили в/в либо со свободным карбоплатином, либо с ненацеленными мини-клетками, упакованными карбоплатином, либо с нацеленными на EGFR упакованными карбоплатином мини-клетками (EGFRмини-клеткикарбоплатин). Результаты на фигуре 13 демонстрируют, что лечениеEGFRмини-клеткамикарбоплатин было высокоэффективно для достижения стабилизации опухоли, хотя доза карбоплатина была в ~1000 раз ниже, чем доза свободного карбоплатина.
СПИСОК ЛИТЕРАТУРЫ
Allard, E., Passirani, C., Benoit, J.P. Convection-enhanced delivery of nanoparticles for the treatment for brain tumors. Biomaterials 30, 2302-2318 (2009).
Behin, A., Hoang-Xuan, K., Carpentier, A.F., Delattre, J.Y. Primary brain tumours in adults. Lancet 361, 323-331 (2003).
Bickel, U. How to Measure Drug Transport across the Blood-Brain Barrier. NeuroRx. 2, 15–26 (2005).
Black, K.L., Ningaraj, N.S. Modulation of brain tumor capillaries for enhanced drug delivery selectively to brain tumor. Cancer Control 11, 165-73 (2004).
Bobo, R.H., Laske, D.W., Akbasak, A., Morrison, P.F., Dedrick, R.L., Oldfield, E.H. Convection-enhanced delivery of macromolecules in the brain. Proc. Natl. Acad. Sci. U S A 91, 2076–2080 (1994).
Borst, P. et al. A family of drug transporters: the multidrug resistance-associated proteins. J. Natl. Cancer Inst. 92, 1295-1302 (2000).
Caravella J., Lugovskoy, A. Design of next-generation protein therapeutics. Curr. Opin. Chem. Biol. 14, 520-528 (2010).
Britton, R.A., Lin, D.C., Grossman, A.D. Characterization of a prokaryotic SMC protein involved in chromosome partitioning. Genes Dev. 12, 1254-9 (1998).
Caplen, N.J. RNAi as a gene therapy approach. Expert Opin. Biol. Ther. 3, 575-86 (2003).
Caplen, N.J., Mousses, S. Short interfering RNA (siRNA)-mediated RNA interference (RNAi) in human cells. Ann. NY Acad. Sci. 1002, 56-62 (2003).
Cecchelli, R., Berezowski, V., Lundquist, S., Culot, M., Renftel, M., Dehouck, M.P., Fenart, L. Modelling of the blood-brain barrier in drug discovery and development. Nat. Rev. Drug Discov. 6, 650-661 (2007).
Chu, C.Y., Rana, T.M. Translation repression in human cells by microRNA-induced gene silencing requires RCK/p54. PLoS Biol. 4, e210 (2006).
Clark-Curtiss, J.E., Curtiss, R. III Analysis of recombinant DNA using Escherichia coli minicells. Methods Enzymol. 101, 347-62 (1983).
Da Silva L et al. HER3 and downstream pathways are involved in colonization of brain metastases from breast cancer. Breast Cancer Res. 12, R46 (1-13) (2010).
Debinski, W., Gibo, D.M. (2000) Molecular expression analysis of restrictive receptor for interleukin 13, a brain tumor-associated cancer/testis antigen. Mol. Med. 6, 440–449 (2000).
Debinski, W., Slagle, B., Gibo, D.M., Powers, S.K., Gillespie, G.Y. Expression of a restrictive receptor for interleukin 13 is associated with glial transformation. J. Neurooncol. 48, 103–111 (2000).
de Boer, P.A., Crossley, R.E., Rothfield, L.I. Roles of MinC and MinD in the site-specific septation block mediated by the MinCDE system of Escherichia coli. J. Bacteriol. 174, 63-70 (1992).
Dehouck, B., Dehouck, M.P., Fruchart, J.C., Cecchelli, R. Upregulation of the low-density lipoprotein receptor at the blood-brain barrier: intercommunications between brain capillary endothelial cells and astrocytes. J. Cell Biol. 126, 465-473 (1994).
Duan, Z., et al. Inhibition of ABCB1 (MDR1) and ABCB4 (MDR3) expression by small interfering RNA and reversal of paclitaxel resistance in human ovarian cancer cells. Mol. Cancer Ther. 3, 833-8 (2004).
Duxbury, M.S., et al. Systemic siRNA-mediated gene silencing : A new approach to targeted therapy of cancer. Ann. Surg. 240, 667-74 (2004).
Eichler, A.F., Loeffler, J.S. Multidisciplinary management of brain metastases. Oncologist 12, 884–98 (2007).
Fox, B.D., Cheung, V.J., Patel, A.J., Suki, D., Rao, G. Epidemiology of metastatic brain tumors. Neurosurg. Clin. N. Am. 22, 1–6 (2011).
Fukuda, M. Radiolabeling oligosaccharides after mild periodate oxidation. Curr. Protocols Molec. Biol. (Suppl. 26), 17.5.1-17.5.8 (1994).
Gregory, R.I., Chendrimada, T.P., Shiekhattar, R. MicroRNA biogenesis: isolation and characterization of the microprocessor complex. Methods Mol. Biol. 342, 33-47 (2006).
Groothuis, D.R. The blood-brain and blood tumor barriers: a review of strategies for increasing drug delivery. Neuro-oncol. 2, 45-59 (2000).
Hadjipanayis, C.G., Fellows-Mayle, W., Deluca, N.A. Therapeutic efficacy of a herpes simplex virus in combination with radiation or temozolomide for intracranial glioblastoma after convection enhanced delivery. Mol. Ther. 16, 1783–1788 (2008).
Hadjipanayis, C.G., Machaidze, R., Kaluzova, M., Wang, L., Schuette, A.J., Chen, H., et al. EGFRvIII antibody-conjugated iron oxide nanoparticles for magnetic resonance imaging-guided convection-enhanced delivery and targeted therapy of glioblastoma. Cancer Res. 70, 6303-6312 (2010).
Hassenbusch, S.J., Gunes, S., Wachsman, S., Willis, K.D. Intrathecal clonidine in the treatment of intractable pain: a phase I/II study. Pain Med. 3, 85-91 (2002).
Hau, V.S., Huber, J.D., Campos, C.R., Lipkowski, A.W., Misicka, A., Davis, T.P. Effect of guanidino modification and proline substitution on the in vitro stability and blood-brain barrier permeability of endomorphin II. J. Pharm. Sci. 91, 2140-9 (2002).
Hawkins, B.T., Davis, T.P. The blood–brain barrier/neurovascular unit in health and disease. Pharmacological Reviews 57, 173-185 (2005).
Hershey, G.K. IL-13 receptors and signaling pathways: An evolving web. J. Allergy Clin. Immunol. 111, 677–690 (2003).
Higgins, R.J. et al. Spontaneous canine gliomas: overexpression of EGFR, PDGFR alpha and IGFBP2 demonstrated by tissue microarray immunophenotyping. J. Neurooncol. 98, 49-55 (2010).
Hiraga, S., Niki, H., Ogura, T., Ichinose, C., Mori, H., Ezaki, B., Jaffe, A. Chromosome partitioning in Escherichia coli: novel mutants producing anucleate cells. J. Bacteriol. 171, 1496-1505 (1989).
Hu, Z., Lutkenhaus, J. Topological regulation of cell division in Escherichia coli involves rapid pole to pole oscillation of the division inhibitor MinC under the control of MinD and MinE. Mol. Microbiol. 34, 82-90 (1999).
Ireton, K., Gunther, N.W. 4th., Grossman, A.D. spo0J is required for normal chromosome segregation as well as the initiation of sporulation in Bacillus subtilis. J. Bacteriol. 176, 5320-9 (1994).
Jarboe, J.S., Johnson, K.R., Choi, Y., Lonser, R.R., Park, J.K. Expression of interleukin-13 receptor α2 in glioblastoma multiforme: Implications for targeted therapies. Cancer Res. 67, 7983–7986 (2007).
Jemal, A., Siegel, R., Ward, E., Hao, Y., Xu, J., Thun, M.J. Cancer statistics, 2009. CA Cancer J. Clin. 59, 225–49 (2009).
Juillerat-Jeanneret, L. The targeted delivery of cancer drugs across the blood-brain barrier: chemical modifications of drugs or drug-nanoparticles? Drug Discov. Today 13, 1099-1106 (2008).
Khalil, A.M. et al. Many human large intergenic noncoding RNAs associate with chromatin-modifying complexes and affect gene expression. Proc. Natl. Acad. Sci. U S A. 106, 11667-72 (2009).
Kota, J. et al. Therapeutic microRNA delivery suppresses tumorigenesis in a murine liver cancer model. Cell 137, 1005-17 (2009).
Kreuter, J., Alyautdin, R.N., Kharkevich, D.A., Ivanov, A.A. Passage of peptides through the blood–brain barrier with colloidal polymer particles (nanoparticles), Brain Res. 674, 171–174 (1995).
Kreuter, J., Petrov, V.E., Kharkevich, D.A., Alyautdin, R.N. Influence of the type of surfactant on the analgesic effects induced by the peptide dalargin after its delivery across the blood–brain barrier using surfactant-coated nanoparticles, J. Control. Release 49, 81–87 (1997).
Kreuter, J. Nanoparticulate systems for brain delivery of drugs. Adv. Drug Deliv. Rev. 47, 65–81 (2001).
Kreuter, J., Shamenkov, D., Petrov, V., Ramge, P., Cychutek, K., Koch-Brandt, C., Alyautdin, R. Apolipoprotein-mediated transport of nanoparticle- bound drugs across the blood–brain barrier, J. Drug Target. 10, 317–325 (2002).
Kreuter, J., Ramge, P., Petrov, V., Hamm, S., Gelperina, S.E., Engelhardt, B., Alyautdin, R., von Briesen, H., Begley, D.J. Direct evidence that polysorbate-80-coated poly(butylcyanoacrylate) nanoparticles deliver drugs to the CNS via specific mechanisms requiring prior binding of drug to the nanoparticles, Pharm. Res. 20, 409–416 (2003).
Kreuter, J., Gelperina, S. Use of nanoparticles for cerebral cancer. Tumori 94, 271–277 (2008).
Kroll, R.A., Neuwelt, E.A. Outwitting the blood-brain barrier for therapeutic purposes: osmotic opening and other means. Neurosurgery 42, 1083-99 (1998).
Kusuhara, H., Sugiyama, Y. (2005) Active efflux across the blood–brain barrier: role of the solute carrier family. NeuroRx 2, 73-85 (2005).
Lamborn, K.R. et al. Progression-free survival: an important end point in evaluating therapy for recurrent high-grade gliomas. Neuro Oncol. 10, 162-70 (2008).
Laquintana, V., Trapani, A., Denora, N., Wang, F., Gallo, J.M., Trapani, G. New strategies to deliver anticancer drugs to brain tumors. Expert Opin. Drug Deliv. 6, 1017-1032 (2009).
Loscher, W., and Potschka, H. Role of drug efflux transporters in the brain for drug disposition and treatment of brain diseases. Prog. Neurobiol. 76, 22-76 (2005).
Louis, D. N. et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol. 114, 97–109 (2007).
MacDiarmid, J.A. et al. Bacterially derived 400 nm particles for encapsulation and cancer cell targeting of chemotherapeutics. Cancer Cell 11, 431–445 (2007).
MacDiarmid, J.A., Madrid-Weiss, J., Amaro-Mugridge, N.B., Phillips, L. & Brahmbhatt, H. Bacterially-derived nanocells for tumor-targeted delivery of chemotherapeutics and cell cycle inhibitors. Cell Cycle 6, 2099–2105 (2007).
MacDiarmid, J.A. et al. Sequential treatment of drug-resistant tumors with targeted minicells containing siRNA or a cytotoxic drug. Nat. Biotechnol. 27, 643-651 (2009).
Moghimi, S.M., Hunter, A.C., Murray, J.C. Nanomedicine: current status and future prospects. FASEB J. 19, 311–330 (2005).
Morrison, P.F., Laske, D.W., Bobo, H., Oldfield, E.H., Dedrick, R.L. High-flow microinfusion: tissue penetration and pharmacodynamics. Am. J. Physiol. 266, R292–305 (1994).
Nicolazzo, J.A., Katneni, K. Drug transport across the blood–brain barrier and the impact of breast cancer resistance protein (ABCG2). Curr. Top. in Med. Chem. 9, 130-147 (2009).
Nieth, C., et al. Modulation of the classical multidrug resistance (MDR) phenotype by RNA interference (RNAi). FEBS Lett. 545, 144-50 (2003).
Oh, Y.K., Park, T.G. siRNA delivery systems for cancer treatment. Adv. Drug Deliv. Rev. 61, 850-62 (2009).
Okada, Y., Wachi, M., Hirata, A., Suzuki, K., Nagai, K., Matsuhashi, M. Cytoplasmic axial filaments in Escherichia coli cells: possible function in the mechanism of chromosome segregation and cell division. J. Bacteriol. 176, 917-22 (1994).
Okada, H., et al. Expression of glioma-associated antigens in pediatric brain stem and non-brain stem gliomas. J. Neurooncol. 88, 245–250 (2008).
Oritz-Zapater et al. Key contribution of CPEB4-mediated translational control to cancer progression. Nature Medicine, doi: 10.1038/nm.2540 (published on-line December 4, 2011).
Palmieri, D., Bronder, J.L., Herring, J.M., Yoneda, T., Weil, R.J., Stark, A.M., et al. Her-2 overexpression increases the metastatic outgrowth of breast cancer cells in the brain. Cancer Res. 67, 4190–98 (2007).
Pardridge, W.M. Molecular biology of the blood-brain barrier. Mol. Biotechnol. 30, 57-70 (2005).
Pardridge, W.M. Drug targeting to the brain. Pharm. Res. 9, 1733-1744 (2007).
Pardridge, W.M. Blood-brain barrier delivery. Drug Discov. Today 12, 54–61 (2007).
Pardridge, W.M. Biopharmaceutical drug targeting to the brain. J. Drug Target. 18, 157-167 (2010).
Pardridge, W.M. Drug transport in brain via the cerebrospinal fluid. Fluids Barriers CNS 8, 1-4 (2011).
Petri, B., Bootz, A., Khalansky, A., Hekmatara, T., Muller, R., Uhl, R., et al. Chemotherapy of brain tumour using doxorubicin bound to surfactant-coated poly( butyl cyanoacrylate) nanoparticles: revisiting the role of surfactants. J. Control. Release 117, 51-58 (2007).
Rainov, N.G., Koch, S., Sena-Esteves, M. & Berens, M.E. Characterization of a canine glioma cell line as related to established experimental brain tumor models. J. Neuropathol. Exp. Neurol. 59, 607–613 (2000).
Raskin, D.M. de Boer, P.A. MinDE-dependent pole-to-pole oscillation of division inhibitor MinC in Escherichia coli. J. Bacteriol. 181, 6419-6424 (1999).
Reardon, D.A. et al. Phase II trial of murine (131)I-labeled antitenascin monoclonal antibody 81C6 administered into surgically created resection cavities of patients with newly diagnosed malignant gliomas. J. Clin. Oncol. 20, 1389-97 (2002).
Re, F., Cambianica, I., Zona, C., Sesana, S., Gregori, M., Rigolio, R., La Ferla, B., Nicotra, F., Forloni, G., Cagnotto, A., Salmona, M., Masserini, M., Sancini, G. Functionalization of liposomes with ApoE-derived peptides at different density affects cellular uptake and drug transport across a blood-brain barrier model. Nanomedicine 7, 551-559 (2011)..
Reeve, J.N., Cornett, J.B. Bacteriophage SPO1-induced macromolecular synthesis in minicells of Bacillus subtilis. J. Virol. 15, 1308-16 (1975).
Rice, S.L., Roney, C.A., Daumar, P., Lewis, J.S. The next generation of positron emission tomography radiopharmaceuticals in oncology. Semin. Nucl. Med. 41, 265-282 (2011).
Sabat, R. et al. Biology of interleukin-10. Cytokine Growth Factor Rev. 21, 331-344 (2010).
Sarin, H., Kanevsky, A.S., Wu, H., et al. Effective transvascular delivery of nanoparticles across the blood-brain tumor barrier into malignant glioma cells. J. Transl. Med. 6, 80 (2008).
Schinkel, A.H. P-glycoprotein, a gatekeeper in the blood–brain barrier. Adv. Drug Del. Rev. 36, 179-194 (1999).
Schinkel, A.H., Jonker, J.W. Mammalian drug efflux transporters of the ATP binding cassette (ABC) family: an overview. Adv. Drug Del. Rev. 55, 3-29 (2003).
Sioud, M. Therapeutic siRNAs. Trends Pharmacol. Sci. 25, 22-8 (2004).
Smith, J.S. et al. PTEN mutation, EGFR amplification, and outcome in patients with anaplastic astrocytoma and glioblastoma multiforme. J. Natl. Cancer Inst. 93, 1246–1256 (2001).
Steiniger, S.C., Kreuter, J., Khalansky, A.S., Skidan, I.N., Bobruskin, A.I., et al. Chemotherapy of glioblastoma in rats using doxorubicin-loaded nanoparticles. Int. J. Cancer 109, 759-767 (2004).
Stemmler, H.J., Schmitt, M., Willems, A., Bernhard, H., Harbeck, N., Heinemann, V. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood–brain barrier. Anticancer Drugs 18, 23–28 (2007).
Stewart, L.A. Chemotherapy in adult high-grade glioma: a systematic review and meta-analysis of individual patient data from 12 randomised trials. Lancet 359, 1011-18 (2002).
Stewart, P.S. and D’Ari, R. Genetic and morphological characterization of an Escherichia coli chromosome segregation mutant. J. Bacteriol. 174, 4513-6 (1992).
Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N. Engl. J. Med. 352, 987-996 (2005).
Sun, H. et al. (2003) Drug efflux transporters in the CNS. Adv. Drug Del. Rev. 55, 83-105 (2003).
Takeshita, F., et al. Systemic delivery of synthetic microRNA-16 inhibits the growth of metastatic prostate tumors via downregulation of multiple cell-cycle genes. Mol. Ther. 18, 181-7 (2010).
Weber, F.W. Local convection enhanced delivery of IL4-Pseudomonas exotoxin (NBI-3001) for treatment of patients with recurrent malignant glioma. Acta Neurochir. Suppl. 88, 93-103 (2003).
Wisse, E., Jacobs, F., Topal, B., Frederik, P., De Geest, B. The size of endothelial fenestrae in human liver sinusoids: implications for hepatocyte-directed gene transfer. Gene Ther. 15, 1193-1199 (2008).
Wong, E.T. et al. Outcomes and prognostic factors in recurrent glioma patients enrolled onto phase II clinical trials. J. Clin. Oncol. 17, 2572–2578 (1999).
Wrensch, M., Minn, Y., Chew, T., Bondy, M., Berger, M.S. Epidemiology of primary brain tumors: current concepts and review of the literature. Neuro. Oncol. 4, 278-299 (2002).
Wykosky, J., Gibo, D.M., Stanton, C., Debinski, W. Interleukin-13 receptor α 2, EphA2, and Fos-related antigen 1 as molecular denominators of high-grade astrocytomas and specific targets for combinatorial therapy. Clin Cancer Res. 14, 199–208 (2008).
Xin, H., Jiang, X., Gu, J., Sha, X., Chen, L., Law, K., et al. Angiopep-conjugated poly(-ethylene glycol)-co-poly(epsilon-caprolactone) nanoparticles as dual targeting drug delivery system for brain glioma. Biomaterials 32, 4293-305 (2011).
Yagüe, E., et al. Complete reversal of multidrug resistance by stable expression of small interfering RNAs targeting MDR1. Gene Ther. 11, 1170-4 (2004).
Yoshimasu, T., Sakurai, T., Oura, S., Hirai, I., Tanino, H., Kokawa, Y., et al. Increased expression of integrin alpha3beta1 in highly brain metastatic subclone of a human non-small cell lung cancer cell line. Cancer Sci. 95, 142–48 (2004).
Zensi, A., Begley, D., Pontikis, C., Legros, C., Mihoreanu, L., et al. Albumin nanoparticles targeted with Apo E enter the CNS by transcytosis and are delivered to neurones. J. Control. Release 137, 78-86 (2009).
Zhang, Y., Pardridge, W.M. Conjugation of brain-derived neurotrophic factor to a blood-brain barrier drug targeting system enables neuroprotection in regional brain ischemia following intravenous injection of the neurotrophin. Brain Res. 889, 49-56 (2001).
Реферат
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована у субъекта для лечения опухоли мозга, имеющей кровеносные сосуды с отверстиями в своих стенках. Для этого осуществляют системное введение субъекту с опухолью терапевтически эффективного количества композиции, состоящей из интактных, полученных из бактерий мини-клеток с диаметром 400 нм ±50 нм. При этом каждая мини-клетка содержит антитело, которое специфически распознает антиген опухолевых клеток. Каждая мини-клетка содержит антинеопластическое средство. Мини-клетки пассивно вытекают через отверстия в стенках кровеносных сосудов. Также предложено применение композиции, содержащей указанные мини-клетки, для получения лекарственного средства для лечения опухоли мозга. Группа изобретений обеспечивает лечение опухолей мозга путем накопления мини-клеток, содержащих антинеопластическое средство, в микроокружении опухоли мозга и доставки антинеопластического средства непосредственно к опухолевым клеткам, без эндотелиального эндоцитоза/трансцитоза через гематоэнцефалический барьер. 2 н. и 42 з.п. ф-лы, 2 табл., 13 ил., 10 пр.

Комментарии