Состоящие из множества частиц фармацевтические составы с контролируемым высвобождением избирательного ингибитора повторного поглощения серотонина - RU2275191C2
Код документа: RU2275191C2
Чертежи

Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к фармацевтическим составам с контролируемым высвобождением и, в частности, к формам с контролируемым высвобождением флювоксамина и других избирательных (селективных) ингибиторов повторного поглощения серотонина, предназначенным для орального введения.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Избирательные ингибиторы повторного поглощения серотонина (ИИПС) (selective serotonin reuptake inhibitors, SSRf), типичными представителями которых являются флюоксетин, флювоксамин, пароксетин и сертралин) используются, наряду с другими применениями, как антидепрессанты. В нижеследующем описании при упоминании ИИПС ссылки будут в собирательном значении относиться к флювоксамину, если не будет указано иное.
Малеат флювоксамина - это избирательный ингибитор повторного поглощения серотонина (5НТ), принадлежащий к химическому классу 2-аминоэтил-оксим-эфиров аралкилкетонов. Химически он обозначается как малеат 5-метокси-4'-(трифторметил)валерофенон-(Е)-O-(2-аминоэтил)оксима (1:1) и имеет эмпирическую формулу С15Н21O2N2F3·С4Н4 O4. Флювоксамин и другие оксимовые эфиры раскрыты в описании патента США №4085225 (US Philips Corp.). Описаны фармацевтические составы для таблеток, суппозиториев и инъекций.
Было установлено, что флювоксамин эффективно ослабляет симптомы депрессии и помогает при навязчивых компульсивных расстройствах. Его удобно вводить в форме таблеток (25 мг, 50 мг и 100 мг) в виде малеата флювоксамина, имеющегося в продаже под товарным знаком Luvox (фирма Solvay Pharmaceuticals Inc.). Традиционное лечение флювоксамином обычно начинают с однократного введения 50 мг на ночь. Дозировку можно постепенно увеличивать ступеньками по 50 мг каждые 4-7 дней, при условии ее переносимости, до достижения максимального терапевтического эффекта, однако она не должна превышать 300 мг в день. Желательно общую дневную дозу, если она превышает 100 мг, вводить двумя раздельными порциями. Если эти порции не равны, большую дозу обычно дают на ночь.
Флювоксамин активно метаболизируется печенью и удаляется с мочой почками. Luvox® подвержен эффекту обширного первого проникновения, что обычно дает величину абсолютной биодоступности около 53%. Обычно после введения одиночных оральных доз Luvox® пик его уровня наблюдается через 3-8 ч. Указывается, что время половинного выведения флювоксамина из плазмы у здоровых молодых добровольцев в стационарной фазе после многократного орального введения доз 100 мг в день равно 15,6 ч.
Как указано выше, дозировку употребляемых обычно таблеток флювоксамина титруют до установления переносимой дозы, обладающей максимальным терапевтическим эффектом, с разделением на две порции доз, превышающих 100 мг. Процедура ступенчатого титрования и побочные эффекты, сопутствующие обычному введению один раз в день доз, превышающих 100 мг, могут ухудшать соблюдение пациентами режима лечения и отдалять достижение терапевтического эффекта.
Ближайшим аналогом заявленного изобретения является состав, описанный в публикации международной заявки WO 99/01121 А1, опубликованной 14.01.1999. Однако указанный известный состав не способен обеспечить специфические параметры высвобождения, позволяющие обеспечить оптимальный режим приема препарата.
Поэтому цель настоящего изобретения - предложить состав с контролируемым высвобождением избирательного ингибитора повторного поглощения серотонина (5НТ). Другая цель настоящего изобретения - предложить состав с контролируемым высвобождением ИИПС, пригодный для введения не чаще, чем в среднем с 12-часовым интервалом. Еще одна цель нестоящего изобретения - предложить состав с контролируемым высвобождением ИИПС, пригодный для введения один или два раза в день. Далее целью настоящего изобретения является создание способа лечения депрессии и/или навязчивого компульсивного расстройства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает состоящий из множества частиц фармацевтический состав с контролируемым высвобождением избирательного ингибитора повторного поглощения серотонина (ИИПС) для орального применения, который содержит частицы указанного ИИПС или его фармацевтически приемлемой соли, покрытые контролирующим скорость высвобождения полимером, обеспечивающим контролируемое высвобождение указанного ИИПС в течение не менее 12 часов после орального введения. Частицы предпочтительно представляют собой гранулы или шарики.
Предпочтительно далее, чтобы указанные гранулы содержали ядро из указанного ИИПС или его фармацевтически приемлемой соли, покрытое указанным контролирующим скорость высвобождения полимером с образованием контролирующей скорость высвобождения мембраны, окружающей указанное ядро.
Согласно одному из вариантов осуществления изобретения, контролирующая скорость высвобождения мембрана составлена из преобладающей доли фармацевтически приемлемого пленкообразующего, нерастворимого в воде полимера и (но не обязательно) меньшей доли фармацевтически приемлемого пленкообразующего, растворимого в воде полимера, причем отношение нерастворимого в воде полимера к растворимому в воде полимеру, если указанный растворимый в воде полимер наличествует, должно быть таким, чтобы обеспечить скорость высвобождения ИИПС, позволяющую поддерживать контролируемое высвобождение ИИПС в течение не менее чем 12 часов после орального введения.
Однако мембрана может состоять из фармацевтически приемлемого пленкообразующего, нерастворимого в воде полимера. В качестве альтернативы, мембрана может представлять собой смесь контролирующих скорость высвобождения полимеров, состоящую из преобладающей доли фармацевтически приемлемого пленкообразующего, нерастворимого в воде полимера и меньшей доли фармацевтически приемлемого пленкообразующего, растворимого в воде полимера.
Полимеры, которые могут быть использованы для формирования контролирующей скорость высвобождения мембраны, более детально описаны далее.
Согласно особенно предпочтительному варианту осуществления, контролирующая скорость высвобождения мембрана содержит аммонийно-метакрилатный сополимер, как описано ниже.
Ядро может содержать органическую кислоту, причем компонент ИИПС и органическая кислота присутствуют в соотношении от 50:1 до 1:50.
Органическая кислота, если таковая используется, предпочтительно выбрана из адипиновой кислоты, аскорбиновой кислоты, лимонной кислоты, фумаровой кислоты, яблочной кислоты, янтарной кислоты и винной кислоты. Компонент ИИПС и органическая кислота, если последняя присутствует, предпочтительно содержатся в соотношении от 20:1 до 1:1 и - более предпочтительно - в соотношении от 10:1 до 2:1.
Активный ингредиент в фармацевтическом составе по настоящему изобретению может по необходимости представлять собой любой избирательный ингибитор повторного поглощения серотонина. В частности, подходящие активные ингредиенты для использования в настоящем изобретении включают такие ингредиенты, выбранные из циталопрама, кломипрамина, флюоксетина, флювоксамина, пароксетина, сертралина, тразодона и зимелдина, которые все в различной степени ингибируют повторное поглощение серотонина.
Активный ингредиент может присутствовать в форме свободного основания или в форме фармацевтически приемлемой соли - такой, как хлористоводородная форма или малеатная форма.
Кроме того, пригодный для применения активный ингредиент может присутствовать либо в форме одного достаточно оптически чистого энантиомера, либо как смесь энантиомеров - рацемическая или иная.
Предпочтительным ИИПС является флювоксамин или его фармацевтически приемлемая соль.
Согласно одному из вариантов осуществления изобретения, скорость высвобождения ИИПС из частиц, измеренная in vitro в 0,05 М фосфатном буфере при рН 6,8 с помощью лопастного аппарата USP типа II для измерения растворения согласно Фармакопее США (US Pharmacopoeia XXII), в основном соответствует следующим параметрам перехода в раствор:
(а) За 0,5 часа измерений в указанном аппарате высвобождается не более 15% всего ИИПС;
(b) За 1 час измерений в указанном аппарате высвобождается не более 25% всего ИИПС;
(c) За 2 часа измерений в указанном аппарате высвобождается от 20% до 75% всего ИИПС;
(а) За 4 часа измерений в указанном аппарате высвобождается не менее 75% всего ИИПС;
(е) За 6 часов измерений в указанном аппарате высвобождается не менее 85% всего ИИПС.
Согласно другому варианту осуществления, скорость высвобождения ИИПС из частиц, измеренная in vitro в 0,05 М фосфатном буфере при рН 6,8 с помощью лопастного аппарата USP тип II для измерения растворения согласно US Pharmacopoeia XXII, в основном соответствует следующим параметрам перехода в раствор:
(a) За 4 часа измерений в указанном аппарате высвобождается не более 20% всего ИИПС;
(b) За 6 часов измерений в указанном аппарате высвобождается не более 45% всего ИИПС;
(c) За 8 часов измерений в указанном аппарате высвобождается от 45% до 80% всего ИИПС;
(а) За 10 часов измерений в указанном аппарате высвобождается не менее 70% всего ИИПС;
(е) За 12 часов измерений в указанном аппарате высвобождается не менее 80% всего ИИПС.
Ядро содержит (но не обязательно) смазывающее вещество, такое как, например, стеарат натрия, стеарат магния, стеариновую кислоту или тальк.
Ядро предпочтительно содержит ИИПС или его фармацевтически приемлемую соль и соединенную с ним органическую кислоту (если она присутствует), заключенные в полимерный материал или связывающее вещество, которое далее называется здесь полимерным материалом, если не указано иное. Компонент ИИПС и полимерный материал присутствуют предпочтительно в соотношении от 1:1 до 100:1, более предпочтительно - от 5:1 до 30:1. Полимерный материал может быть быстро растворимым в воде или, в качестве альтернативы, может быть свободно проницаемым для ИППС и воды. Однако полимерный материал может быть также нерастворимым в воде или, в качестве альтернативы, может быть малопроницаемым для ИППС и воды. Могут быть также использованы смеси любых из названных выше полимеров при условии, что использованный полимер (полимеры) эффективно обеспечивает (обеспечивают) покрытие всего ИИПС в ядре. Соотношение водорастворимого/легко проницаемого и водонерастворимого/слабо проницаемого полимеров может быть установлено путем определенной комбинации выбранных полимеров.
Желательно, чтобы ядро содержало:
(a) порошкообразную смесь, содержащую ИИПС или его фармацевтически приемлемую соль, органическую кислоту, выбранную из адипиновой кислоты, аскорбиновой кислоты, лимонной кислоты, фумаровой кислоты, яблочной кислоты, янтарной кислоты и винной кислоты; и
(b) фармацевтически приемлемый полимерный материал, причем указанный полимерный материал наличествует в количестве, эффективно обеспечивающем покрытие всей порошкообразной смеси в ядре.
Ядро может содержать чередующиеся слои указанной порошкообразной смеси и указанного полимерного материала.
Термин «водорастворимый полимер» в том смысле, как он использован здесь, включает полимеры, хорошо проницаемые для воды - такие, как Eudragit RL. Подобным же образом термин «водонерастворимый полимер» в том смысле, как он использован здесь, включает полимеры, малопроницаемые для воды - такие, как Eudragit RS.
В качестве водорастворимого полимера пригодны поливиниловый спирт, поливинилпирролидон, метилцеллюлоза, оксипропилцеллюлоза, оксипропилметилцеллюлоза или полиэтиленгликоль, или же их смеси.
В качестве водонерастворимого полимера пригодны этилцеллюлоза, ацетат целлюлозы, пропионат целлюлозы (низкого, среднего или высокого молекулярного веса), ацетат-пропионат целлюлозы, ацетат-бутират целлюлозы, ацетат-фталат целлюлозы, триацетат целлюлозы, полиметилметакрилат, полиэтилметакрилат, полибутилметакрилат, полиизобутилметакрилат, полигексилметакрилат, полиизодецилметакрилат, полилаурилметакрилат, полифенилметакрилат, полиметилакрилат, полиизопропилакрилат, полиизобутилакрилат, полиоктадецилакрилат, полиэтилен, полиэтилен низкой плотности, полиэтилен высокой плотности, полиэтиленоксид, полиэтилентерфталат, поливинилизобутиловый эфир, поливинилацетат, поливинилхлорид или полиуретан, или же их смесь.
Подходящим полимером, который легко проницаем для флювоксамина и воды, является полимер, имеющийся в продаже под товарным знаком Eudragit® RL. Подходящим полимером, который слабо проницаем для флювоксамина и воды, является полимер, имеющийся в продаже под товарным знаком Eudragit® RS, или полимер, проницаемость которого зависит от рН, - такие, как имеющиеся в продаже под товарными знаками Eudragit® L, Eudragit® S, или Eudragit® E. Полимеры семейства Eudragit® - это полимерные лаковые вещества на основе акрилата и/или метакрилатов.
Полимерные материалы, имеющиеся в продаже под товарными знаками Eudragit® RL и Eudragit® RS, - это акриловые смолы, представляющие собой сополимеры эфиров акриловой и метакриловой кислот с низким содержанием четвертичных аммонийных групп (как указано в брошюре "Eudragit®" фирмы Rohm Pharma GmbH (1985). Аммонийные группы присутствуют в виде солей и повышают проницаемость лаковых пленок. Eudragit® RL и RS - это соответственно легко проницаемый (RL) и малопроницаемый (RS), независимо от рН, материал. Eudragit® L - это анионный полимер, синтезированный из метакриловой кислоты и метилового эфира метакриловой кислоты. Он нерастворим в кислотах и чистой воде. Он становится растворимым в нейтральной и слабощелочной среде. Проницаемость Eudragit® L зависит от рН. Выше рН 5,0 полимер приобретает повышающуюся проницаемость. (Eudragit® L описан в брошюре "Eudragit®" фирмы Rohm Pharma GmbH (1986)).
Полимеры Eudragit S и Eudragit L могут быть объединены в любом соотношении в одной покрывающей пленке. Используя комбинации полимеров, можно теоретически получить покрывающие пленки, которые растворимы при значениях рН между значениями рН, при которых растворимы Eudragit L и Eudragit S.
Полимерный материал ядра может состоять только из Eudragit RS, как указано здесь далее в примерах.
ИИПС, органическая кислота (если таковая присутствует) и полимерный материал предпочтительно наращивают на центральной инертной сердцевине. Эта сердцевина может состоять из зерен мелкого драже сахара/крахмала, имеющих средний диаметр в интервале от 0,4 до 0,85 мм, обычно от 0,71 до 0,85 мм для состава без органической кислоты и обычно от 0,6 до 0,71 мм для состава с органической кислотой. Реальный размер используемого зерна может меняться в зависимости от требуемого для определенного состава количества вводимых лекарства/органической кислоты. Ядро можно создавать в обычной емкости для покрытия. В качестве альтернативы, ИИПС, органическую кислоту и полимерный материал можно наращивать на центральной инертной сердцевине, как определено выше, в автоматической системе для покрытия - например, в грануляторе CF. Ядро может также содержать, в дополнение к указанным выше компонентам, добавочные компоненты - такие, как диспергирующий агент, облегчающее проскальзывание вещество и/или поверхностно-активное вещество.
Полимерное покрытие, используемое для создания контролирующей скорость высвобождения мембраны, может также включать один или несколько вспомогательных агентов, выбранных из наполнителя, пластификатора и подавителя ценообразования.
Типичные представители наполнителей включают тальк, пыль двуокиси кремния, глицерил-моностеарат, стеарат магния, стеарат кальция, каолин, коллоидную двуокись кремния, гипс, двуокись кремния микронного размера и трисиликат магния.
Предпочтительным наполнителем является тальк.
Количество использованного наполнителя колеблется от приблизительно 2% до приблизительно 500% по весу, отнесенному к общему сухому весу полимера, предпочтительно от 100% до 450%, более предпочтительно от 410% до 440%.
Полимерное покрытие может также включать материал, способствующий обработке (процессингу) полимеров. Такие материалы обычно называются «пластификаторами» и включают, например, адипаты, азелаты, бензоаты, цитраты, изоэбукаты, фталаты, себацинаты, стеараты и гликоли.
Типичные представители пластификаторов включают ацетилированные моноглицериды; бутилфталил-бутилгликолят; дибутилтартрат; диэтилфталат; диметилфталат; этилфталил-этилгликолят; глицерин; этиленгликоль, пропиленгликоль; триацетинцитрат; триацетин; трипропиноин; диацетин; дибутилфталат; ацетил-моноглицерид; полиэтиленгликоли; касторовое масло, триэтилцитрат; многоатомные спирты, сложные эфиры уксусной кислоты, триацетат глицерина, ацетилтриэтил цитрат дибензилфталат, дигексилфталат, бутилоктилфталат, диизононилфталат, диоктилазелат, эпоксидированный таллат, триизооктил-тримеллитат, диэтилгексилфталат, ди-н-октилфталат, ди-изо-октилфталат, ди-изо-децилфталат, ди-н-ундецилфталат, ди-н-тридецилфталат, три-2-этилгексил-тримеллитат, ди-2-этилгексиладипат, ди-2-этилгексилсебацинат, ди-2-этилгексилазелат, дибутилсебацинат, глицерил-монокаприлат и глицерил-монокапрат.
Предпочтительным пластификатором является дибутилсебацинат.
Количество необходимого для использования пластификатора составляет предпочтительно от 10% до 50%, наиболее предпочтительно около 20%, по отношению к весу сухого полимера.
Примером подавителя пенообразования является симетикон (Simethicone). Количество необходимого для использования подавителя пенообразования в покрытии предпочтительно составляет от 0% до 0,5% от конечного состава.
Количество полимера, необходимого для формирования частиц, определяется на основании желательных параметров доставки лекарства, в том числе количества предназначенного к доставке лекарства, необходимой скорости его высвобождения и размера частиц. Покрытие мембранными полимерами составляет от 10% до 100% прироста веса ядер, предпочтительно 25-70% прироста веса за счет полимера. Контролирующая скорость высвобождения мембрана частиц, включая все твердые компоненты, - такие, как сополимер, наполнитель, пластификатор и возможные (не обязательные) добавки и вспомогательные вещества для процессинга, дает прирост веса ядер от приблизительно 11% до 450%, предпочтительно прирост веса от 30% до 160%. Полимерный слой может быть нанесен любым известным способом, в том числе распылительным нанесением. Распыление может быть осуществлено с помощью аппарата для покрытия с использованием движущегося слоя (fluidized bed coater) (предпочтительно Wurster coating), или же в системе лоточного покрытия.
Покрытые ядра после нанесения полимерного слоя (слоев) подвергают высушиванию или созреванию. «Созревание» означает, что частицы выдерживают при контролируемой температуре в течение времени, достаточного для обеспечения стабильных скоростей высвобождения. Созревание можно проводить, например, в термостате или в устройстве для сушки в движущемся слое. Созревание можно осуществлять при любой температуре выше комнатной температуры.
На полимерное покрытие может быть нанесен изолирующий или ограждающий слой.
Изолирующий или ограждающий слой может быть нанесен на полимерное покрытие для предотвращения агломерации частиц.
Ядро удобно покрывать (упаковывать) контролирующей скорость высвобождения полимерной мембраной, содержащей по меньшей мере один полимерный материал, как описано выше. Ядро может быть покрыто любым количеством покрывающих слоев, необходимым для обеспечения необходимой скорости высвобождения.
Контролирующая скорость высвобождения мембрана может содержать один полимер или же смесь двух или более полимеров.
Водонерастворимый полимер мембраны - это один из указанных выше полимеров для ядра, он включает полимеры, малопроницаемые или непроницаемые для воды, как описано здесь выше.
Подобным же образом водорастворимый полимер мембраны - это один из указанных выше полимеров для ядра, он включает полимеры, легко проницаемые для воды, как описано здесь выше.
Аммонийно-метакрилатные сополимеры, в том числе полимеры, поставляемые фирмой Rohm & Haas под товарными знаками Eudragit RS и Eudragit RL, которые упоминались выше, особенно пригодны для использования в контролирующей скорость высвобождения мембране в составах по настоящему изобретению. Эти полимеры нерастворимы в чистой воде, разбавленных кислотах, буферных растворах или пищеварительных жидкостях во всем интервале физиологических значений рН. Пленки набухают в воде (и в пищеварительных жидкостях вне зависимости от значений рН). В набухшем состоянии они становятся проницаемыми для воды и растворенных активных веществ. Проницаемость пленок зависит от соотношения этилакрилатных (ЭА), мемтилметакрилатных (ММА) и триметиламмонийэтилметакрилат-хлоридных (ТАМ-С1) групп в полимере. Полимеры, имеющие соотношение ЭА:ММА:ТАМ-С1, равные 1:2:0,2 (Eudragit RL), более проницаемы, чем полимеры с соотношением 1:2:0,1 (Eudragit RS). Пленки с Eudragit RL описаны как «нерастворимые пленки с высокой проницаемостью», а пленки с Eudragit RS описаны как «нерастворимые пленки с низкой проницаемостью».
Формы фармацевтических составов для орального введения с контролируемым высвобождением ИИПС по настоящему изобретению могут быть либо в виде состоящих из множества частиц составов, либо в форме таблеток. Термин «состоящий из множества частиц», как он использован здесь, включает дискретные частицы, гранулы, мини-таблетки и их смеси или комбинации. Состоящая из множества частиц форма для оральной дозировки по настоящему изобретению может содержать смесь двух или более популяций частиц, гранул или мини-таблеток, имеющих различные характеристики высвобождения in vitro и/или in vivo. Например, состоящая из множества частиц форма для оральной дозировки может содержать смесь компонента для постоянного высвобождения и компонента для контролируемого высвобождения, помещенную в подходящую капсулу, например в твердую или мягкую желатиновую капсулу. Если состоящий из множества частиц фармацевтический состав помещен в капсулу, его можно вводить путем проглатывания капсулы или открывания указанной капсулы и высыпания компонентов в пищу. В качестве альтернативы, состоящий из множества частиц фармацевтический состав может быть помещен в пакетик (саше).
Частицы вместе с одним или более из вспомогательных материалов-наполнителей можно спрессовать в таблетированную форму - такую, как многослойная таблетка. Обычно многослойная таблетка может состоять из двух слоев, которые могут содержать одинаковое или различное количество одного и того же активного ингредиента, имеющего одинаковые или различные параметры высвобождения, или она может содержать в каждом слое различные активные ингредиенты. Такая многослойная таблетка может быть факультативно покрыта контролирующим высвобождение полимером так, чтобы привнести дополнительные свойства контролируемого высвобождения.
Как указано выше, фармацевтические составы с контролируемым высвобождением ИИПС и формы для оральной дозировки по настоящему изобретению могут содержать вспомогательные наполнители, такие, как, например, разбавители, смазывающие вещества, поверхностно-активные вещества, дезинтегрирующие агенты (разрыхлители), пластификаторы, препятствующие слипанию агенты, замутняющие агенты, пигменты, ароматизаторы и т.п. Специалистам в данной области понятно, что точный выбор наполнителей и их относительные количества до некоторой степени зависят от окончательной формы оральной дозировки, в которую включен фармацевтический состав с контролируемым высвобождением ИИПС.
Подходящие разбавители включают, например, фармацевтически приемлемые инертные наполнители, такие, как микрокристаллическая целлюлоза, лактоза, двухосновный фосфат кальция, сахариды и/или смеси любых из этих перечисленных веществ. Примеры разбавителей включают микрокристаллические целлюлозы, такие, как поставляемые под товарным знаком Avicel, в том числе, например, Avicel pH101, Avicel pH102, Avicel pH112, Avicel pH200, Avicel рН301 и Avicel pH302; лактозы, такие, как моногидрат лактозы, безводная лактоза и Pharmatose DCL21 (Pharmatose - товарный знак), в том числе безводная, моногидратная и высушенная распылительной сушкой формы; двухосновный фосфат кальция, такой, как Emcompress (Emcompress - товарный знак); маннитол; крахмал; сорбит; сахароза и глюкоза.
Подходящими смазывающими веществами, в том числе агентами, действующими на текучесть предназначенного для прессования порошка, являются, например, коллоидная двуокись кремния, такая, как Aerosil (Aerosil -товарный знак); тальк; стеариновая кислота, стеарат магния, стеарат кальция и стеарил-фумарат натрия.
Подходящие разрыхлители включают, например, слабо сшитый поливинилпирролидон, кукурузный крахмал, картофельный крахмал, маисовый крахмал и модифицированные крахмалы, натриевая соль кросс-кармеллозы, кросс-повидон, натрий-гликолят крахмала и их комбинации и смеси.
Согласно следующему аспекту настоящего изобретения, предлагается фармацевтический состав с контролируемым высвобождением ИИПС для орального применения, представляющий собой смесь частиц, как они определены выше.
Согласно следующему аспекту настоящего изобретения, предлагается фармацевтический состав с контролируемым высвобождением ИИПС для орального применения, представляющий собой смесь частиц, как они определены выше, в смеси с формой ИИПС или его фармацевтически приемлемой соли, предназначенной для немедленного высвобождения, чтобы обеспечить быстрое достижение эффективного в терапевтическом смысле содержания его в крови.
Предпочтительно форма ИИПС, предназначенная для его немедленного высвобождения, представляет собой гранулы, как определено выше, без указанной контролирующей скорость высвобождения мембраны.
Согласно одному из вариантов осуществления изобретения, скорость высвобождения ИИПС из фармацевтического состава, измеренная in vitro в 0,05 М фосфатном буфере при рН 6,8 с помощью лопастного аппарата USP типа II для измерения растворения согласно Фармакопее США (US Pharmacopoeia XXII), в основном соответствует следующим параметрам перехода в раствор:
(a) За 1 час измерений в указанном аппарате высвобождается не более 20% всего ИИПС;
(b) За 2 часа измерений в указанном аппарате высвобождается не более 60% всего ИИПС;
(c) За 4 часа измерений в указанном аппарате высвобождается не менее 20% всего ИИПС;
(d) За 6 часов измерений в указанном аппарате высвобождается не менее 35% всего ИИПС;
(e) За 8 часов измерений в указанном аппарате высвобождается не менее 50% всего ИИПС;
(f) За 10 часов измерений в указанном аппарате высвобождается не менее 70% всего ИИПС;
(g) За 12 часов измерений в указанном аппарате высвобождается не менее 75% всего ИИПС.
Согласно другому варианту осуществления, скорость высвобождения ИИПС из фармацевтического состава, измеренная in vitro в 0,05 М фосфатном буфере при рН 6,8 с помощью лопастного аппарата USP тип II для измерения растворения согласно US Pharmacopoeia XXII, в основном соответствует следующим параметрам перехода в раствор:
(a) За 1 час измерений в указанном аппарате высвобождается не более 20% всего ИИПС;
(b) За 2 часа измерений в указанном аппарате высвобождается не более 45% всего ИИПС;
(c) За 4 часа измерений в указанном аппарате высвобождается от 20% до 70% всего ИИПС;
(d) За 6 часов измерений в указанном аппарате высвобождается от 35% до 85% всего ИИПС;
(e) За 8 часов измерений в указанном аппарате высвобождается не менее 50% всего ИИПС;
(f) За 10 часов измерений в указанном аппарате высвобождается не менее 70% всего ИИПС;
(g) За 12 часов измерений в указанном аппарате высвобождается не менее 75% всего ИИПС.
Согласно еще одному варианту осуществления, скорость высвобождения ИИПС из фармацевтического состава, измеренная in vitro в 0,05 М фосфатном буфере при рН 6,8 с помощью лопастного аппарата USP тип II для измерения растворения согласно US Pharmacopoeia XXII, в основном соответствует следующим параметрам перехода в раствор:
(a) За 2 часа измерений в указанном аппарате высвобождается не более 50% всего ИИПС;
(b) За 6 часов измерений в указанном аппарате высвобождается не менее 35% всего ИИПС;
(c) За 22 часа измерений в указанном аппарате высвобождается не менее 80% всего ИИПС.
Фармацевтический состав для введения один раз в день может содержать смесь состава с контролируемым высвобождением, как он определен выше, с предназначенной для немедленного высвобождения формой указанного ИИПС, составляющей до 75% по весу, предпочтительно от приблизительно 10% до 50% по весу.
Согласно еще одному аспекту настоящего изобретения, предлагается способ лечения депрессии, навязчивого компульсивного расстройства или иного болезненного состояния, подверженного воздействию ИИПС, состоящий во введении пациенту, находящемуся в одном из таких состояний, терапевтически эффективного количества состоящего из множества частиц фармацевтического состава с контролируемым высвобождением ИИПС.
Во избежание повторов, изобретение будет далее детально описано со ссылкой на флювоксамин как на характерный пример.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
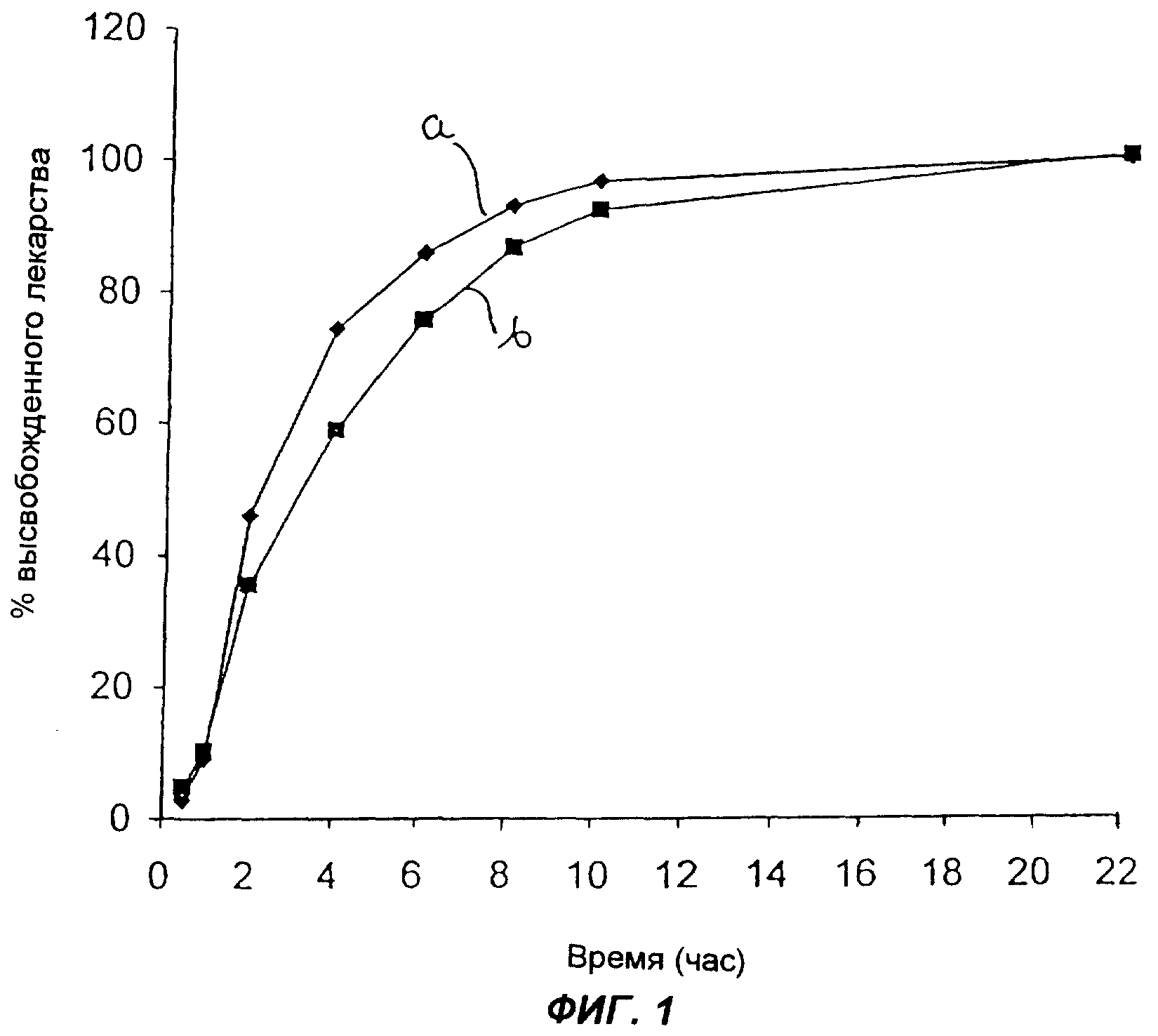
Фиг.1 представляет собой график зависимости процента высвобожденного лекарства от времени (ч) для капсул с контролируемым высвобождением по примеру 2.
Фиг.2 представляет собой график зависимости от времени (ч) концентрации флювоксамина в плазме (нг/мл) после однократного введения, как описано в примере 3, для различных фармацевтических составов, приготовленных согласно настоящему изобретению, в сравнении с кривой его содержания в плазме для таблеток, поставляемых под товарным знаком Luvox.
Фиг.3 представляет собой график зависимости концентрации флювоксамина в плазме (нг/мл) от времени (ч) при условиях ускоренного и дозированного высвобождения, как описано в примере 4.
Фиг.4 представляет собой график зависимости концентрации флювоксамина в плазме (нг/мл) от времени (ч) при стационарных условиях для продукта С, приготовленного в примере 1, в сравнении с кривой его содержания в плазме для таблеток, поставляемых под товарным знаком Luvox, как описано в примере 5.
Фиг.5 представляет собой график зависимости концентрации флювоксамина в плазме (нг/мл) от времени (ч) при стационарных условиях для продукта D, приготовленного в примере 1, в сравнении с кривой его содержания в плазме для таблеток, поставляемых под товарным знаком Luvox, как описано в примере 6.
Изобретение будет далее проиллюстрировано нижеследующими примерами.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1
Получение четырех состоящих из множества частиц фармацевтических составов с контролируемым высвобождением флювоксамина
Приготовление наполненных лекарством шариков
Были произведены две партии наполненных лекарством шариков, соответственно 1 и 2, и детали рецептур приведены в таблице 1. Партия 2 была выбрана для приготовления шариков с контролируемым высвобождением (KB). Эту партию предпочли партии 1, так как она давала более быстрое высвобождение лекарства и поэтому была сочтена более подходящей для немедленно высвобождающейся (НВ) порции.
Наполненные лекарством шарики готовили смешиванием малеата флювоксамина и талька в течение 5 мин до образования гомогенного порошка в смесителе (гомогенизаторе) Е 5904. Гомогенный порошок и сахарные зерна с напыленным Eudragit RS поочередно наносили на зерна мелкого драже. Шарики сушили в термостате при 55°С в течение 20 ч для удаления растворителя. Затем шарики просеивали для удаления агломератов.
Затем определяли емкость и растворимость полученных таким образом наполненных лекарством шариков. Определение растворимости проводили в аппарате USP Apparatus 2 с использованием 900 мл фосфатного буфера рН 6,8 и скорости вращения лопастей 50 об/мин. Все измерения повторяли 6 раз.
В таблице 2 приведены результаты определения емкости. Согласно измеренной емкости при использовании зерен мелкого драже размером 0,71-0,85 мм было достигнуто наполнение лекарством 0,53%.
Результаты измерений перехода в раствор суммированы в таблице 3. Результаты удовлетворяют техническим требованиям Фармакопеи США для продуктов с немедленным высвобождением, согласно которым за 45 мин должно высвобождаться не менее 75% (например, в партии 1 за 45 мин высвобождалось 97,2%; в партии 2 за 45 мин - 99,1%). Поскольку партия 2 демонстрировала лучшие параметры растворения, эта партия была выбрана для покрытия, чтобы получить шарики с контролируемым высвобождением.
Приготовление шариков с контролируемым высвобождением
Шарики с контролируемым высвобождением получали, покрывая полимером наполненные лекарством шарики. Раствор для полимерного покрытия и тальк наносили поочередно с контролируемой скоростью. Введение талька на этой стадии предотвращает агломерацию шариков в ходе процесса покрытия.
В ходе этой процедуры отбирали пробы шариков при уровнях полимерного покрытия 4%, 6%, 8%, 10%, 12% и 15%.
Детали рецептуры для полученной партии указаны в таблице 4. Детали рецептуры полимерного покрытия для 100 мг содержащих флювоксамин шариков с контролируемым высвобождением (KB) суммированы в таблице 5. Стадии приготовления шариков с контролируемым высвобождением были следующими: наполненные лекарством шарики покрывали в аппарате CF750 Coater раствором для полимерного покрытия состава: Eudragit RS с изопропиловым спиртом (ИПС) и дибутилсебацинатом (ДБС) в качестве пластификатора в присутствии талька для предотвращения агломерации. Шарики сушили в термостате при 55°С в течение 20 ч для удаления остатков растворителя. Затем шарики просеивали для удаления агломератов.
Измерения емкости и перехода в раствор проводили на полученных шариках KB (т.е. 4%, 6%, 8%, 10%, 12% и 15%). Тестирование перехода в раствор осуществляли в аппарате USP Apparatus 2 с использованием 900 мл фосфатного буфера рН 6,8 и скорости вращения лопастей 50 об/мин. Тестирование проводили на протяжении 22 ч.
Данные по емкости для шариков KB со 100 мг флювоксамина суммированы в таблице 6. Из этой таблицы видно, что с повышением процента полимерного покрытия снижается емкость (шарики с 4% покрытия имеют емкость 464,8 мг/г в сравнении с 295,9 мг/г для шариков с 15% покрытием). Полученный результат был ожидаемым, поскольку значения емкости рассчитаны как отношение реальной емкости к конечному весу шарика (мг/г).
Результаты измерений перехода в раствор суммированы в таблице 7.
Приготовление капсул KB со 100 мг малеата флювоксамина
Белые/матово-белые желатиновые капсулы размера 2 подвергали сдвоенному заполнению с помощью капсулятора Bosch (E5572). Для всех четырех продуктов был выбран размер порций 600 г. Параметры работы капсулятора были установлены такими, чтобы обеспечить необходимое процентное содержание в каждом из двух типов шариков с контролируемым высвобождением. В таблицах 8А и 8В приведены детали рецептур для капсул KB со 100 мг малеата флювоксамина. Продукты обозначены как А, В, С и D.
Чтобы получить требуемую скорость перехода в раствор для трех из продуктов, с помощью сдвоенного заполнения были «смешаны» два разных слоя полимерных покрытий.
Для полученных капсул KB были проведены измерения емкости и скорости перехода в раствор. Тестирование перехода в раствор осуществляли в аппарате USP Apparatus 2 с использованием 900 мл фосфатного буфера рН 6,8 и скорости вращения лопастей 50 об/мин. Тестирование проводили на протяжении 22 ч.
В таблице 9 суммированы результаты измерений емкости для капсул со 100 мг активного вещества. Видно, что приготовление капсул было успешным, так как все партии капсул имели емкость более 97 мг/г.
В таблице 10 показаны результаты измерений скорости перехода вещества в раствор для капсул со 100 мг лекарства. Результаты подтверждают, что сдвоенное заполнение является удобным способом «смешивания» шариков с различными уровнями полимерного покрытия. Использованные комбинации были успешны также в том смысле, что их поведение соответствовало теоретическим предсказаниям.
Пример 2
Получение капсул с дополнительным контролем высвобождения
Приготовление шариков, наполненных лекарством
Наполненные лекарством шарики получали, как описано в примере 1, за исключением того, что шарики сушили в термостате при 55°С в течение 18 ч. Просеивание вели на ситах с размером отверстий 0,98 мм и 1,5 мм. Детали рецептур приведены в таблице 11.
Для полученных наполненных лекарством шариков были оценены емкость и степень перехода вещества в раствор.
Тестирование перехода в раствор осуществляли в аппарате USP Apparatus 2 с использованием 900 мл фосфатного буфера рН 6,8 и скорости вращения лопастей 50 об/мин. Все измерения с УФ-детектированием были повторены шестикратно.
В таблице 12 детализированы результаты измерений емкости. Результаты измерений емкости показывают, что при использовании зерен мелкого драже была достигнута степень наполненности лекарством 54%. Включены результаты измерений емкости и перехода в раствор для предыдущих партий НВ и KB из примера 1 (соответственно партия 1 и партия 2), поскольку шарики из этих партий были использованы для приготовления капсул.
В таблице 13 и фиг.1 суммированы результаты измерений перехода в раствор. Результаты удовлетворяют техническим требованиям Фармакопеи США для продуктов с немедленным высвобождением (НВ), согласно которым за 45 мин должно высвобождаться не менее 75% продукта (например, в партии 3 за 45 мин высвобождалось 95,4%; в партии 4 за 45 мин - 99, 1%).
Приготовление шариков с контролируемым высвобождением
Шарики с контролируемым высвобождением получали путем покрытия полимером наполненных лекарством шариков. Раствор для полимерного покрытия и тальк наносили одновременно с контролируемой скоростью. Введение талька на этой стадии предотвращает агломерацию шариков в ходе процесса покрытия.
Партию НВ покрывали раствором для покрытия, содержащим Eudragit RS и дибутилсебацинат (раствор для покрытия содержал 7,4% твердых веществ: полимер + пластификатор).
В ходе процесса отбирали пробы шариков при уровнях полимерного покрытия 4%, 6%, 8%, 12% и 15%. В таблице 14 приведены детали рецептуры для полученной партии. В таблице 15 суммированы детали рецептуры полимерного покрытия для шариков KB со 100 мг флювоксамина. Шарики с контролируемым высвобождением получали в соответствии с процедурой, описанной выше в примере 1, но без этапа просеивания.
Измерения емкости и перехода в раствор проводили на полученных шариках с контролируемым высвобождением (т.е. 4%, 6%, 8%, 10%, 12% и 15%). Тестирование перехода в раствор осуществляли в аппарате USP Apparatus 2 с использованием 900 мл фосфатного буфера рН 6,8 и скорости вращения лопастей 50 об/мин. Тестирование проводили на протяжении 22 ч.
Результаты измерения емкости для шариков KB со 100 мг флювоксамина суммированы в таблицах 16 и 17.
При сравнении измеренных величин со значениями емкости для партии из примера 1 обнаруживается различие, особенно на уровне 4% (например, в примере 1:4%=464,8 мг/г).
Результаты измерений перехода в раствор суммированы в таблицах 18 и 19. Как и ожидалось, с увеличением степени покрытия полимером возрастает период задержки и происходит гораздо более медленный переход вещества в раствор.
Ожидалось, что партии со степенью полимерного покрытия 8% будут давать сходные результаты измерений перехода в раствор, поскольку предполагалось, что партия 5 подобна партии из примера 1. Различия можно объяснить небольшой разницей в процессе. Продукт из примера 5 давал более приемлемый режим перехода в раствор.
Приготовление капсул KB со 100 мг малеата Флювоксамина
Белые/матово-белые желатиновые капсулы размера 2 подвергали сдвоенному заполнению с помощью капсулятора Bosch (E5572). Для продукта С был выбран размер партии 0,4789 кг, а для продукта D - 0,4919 кг. Параметры работы капсулятора были установлены такими, чтобы обеспечить необходимое процентное содержание в каждом из двух типов шариков с контролируемым высвобождением. В таблице 20 приведены детали рецептур для капсул KB со 100 мг малеата флювоксамина.
Для исследования влияния питания и стационарного режима в примере 4 и в примерах 5 и 6 соответственно необходимо было иметь капсулы KB со 100 мг лекарства с графиком высвобождения, подобным графику для капсул продукта С и продукта D, которые были использованы для биологических испытаний в примере 3. Для этого было принято решение использовать шарики с покрытием 8% из примера 1 и шарики с покрытием 4% партии 5 из данного примера.
Чтобы соблюсти некоторое постоянство, было решено придерживаться для продукта D соотношения в комбинации 40% шариков с 4% покрытием и 60% шариков с 8% покрытием, а для продукта С соотношение в комбинации было изменено до округленных величин 60% шариков с 4% покрытием и 40% шариков с 8% покрытием.
Измерения емкости и перехода в раствор проводили на полученных капсулах КВ. Тестирование перехода в раствор осуществляли в аппарате USP Apparatus 2 с использованием 900 мл фосфатного буфера рН 6,8 и скорости вращения лопастей 50 об/мин. Тестирование проводили на протяжении 22 ч.
В таблице 21 суммированы результаты измерения емкости для капсул со 100 мг флювоксамина.
Результаты измерений перехода вещества в раствор очень близки к результатам для капсул продукта С и продукта D, полученных в примере 1.
Новые партии капсул давали несколько большую скорость перехода в раствор, как видно из таблицы 22 и фиг.1.
На фиг.1 кривая а соответствует партии №10, а кривая b соответствует партии №11.
Пример 3
Биологические исследования
Первой целью биологических исследований было сравнение биологической доступности 100 мг капсул с составами A-D (продукты A-D), которые упомянуты в примерах 1 и 2, с таблетками 100 мг Luvox® (Solvay Pharmaceuticals Inc.). Второй целью было получить характеристики изменения концентрации в плазме состава KB в сравнении с таблетками 100 мг Luvox®.
В биологических исследованиях применялись открытая маркировка, однократная дозировка, пятикратное введение, пять периодов, рандомизированное перекрестное планирование и период выведения («отмывки») по меньшей мере в 10 дней между днями введения препаратов.
Некомпартментальная оценка фармакокинетики основывалась на содержании флювоксамина в плазме, измеренном в пробах крови. Пробы крови отбирали перед введением препарата и в следующие моменты времени после введения референсных и испытуемых препаратов: 0 (перед введением), 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 20, 24, 30, 36, 48, 72 и 96 час.
Были зарегистрированы десять (10) человек, которые участвовали в испытаниях вплоть до их завершения. Все 10 человек участвовали в исследованиях фармакокинетики и переносимости.
Диагнозы и основные критерии для включения в испытания:
Были отобраны здоровые мужчины в возрасте от 18 до 40 лет, имевшие фенотип усиленного метаболизма декстрометорфана.
Испытуемые продукты, дозировки и способ введения
Капсулы KB со 100 мг флювоксамина - продукт А (очень быстрый переход в раствор).
Капсулы KB со 100 мг флювоксамина - продукт В (быстрый переход в раствор).
Капсулы KB со 100 мг флювоксамина - продукт С (переход в раствор со средней скоростью).
Капсулы KB со 100 мг флювоксамина - продукт D (медленный переход в раствор).
Участвующие в испытаниях получали единичную оральную дозу - одну капсулу и 240 мл водопроводной воды, после чего в течение 10 ч не было приема пищи.
Референсный продукт, дозировки и способ введения
Таблетки Luvox® 100 мг (продукт Е).
Участвующие в испытаниях получали единичную оральную дозу - одну таблетку и 240 мл водопроводной воды, после чего в течение 10 ч не было приема пищи.
Фармакокинетика
С использованием некомпартментальных методов были рассчитаны следующие фармакокинетические параметры: площадь под кривой зависимости концентрации лекарства в плазме от времени от момента введения дозы до точки последнего отбора пробы (AUC(0-t)); площадь под кривой зависимости концентрации лекарства в плазме от времени, экстраполированной к бесконечности (AUC(O-∞)); максимальная измеренная концентрация лекарства в плазме (Сmax) и время, в которое эта концентрация была измерена (tmax); концентрация в точке 24 ч (С24h); относительная биологическая доступность испытуемого вещества (веществ) по сравнению с продуктом сравнения (Frel(%)); время, при котором концентрация лекарства в плазме снижается на 50% (t1/2) и константа конечной скорости удаления (элиминации) первого порядка (Kel).
Статистические методы
Была выполнена описательная статистическая обработка нужных фармакокинетических параметров. Для оценки различий в поведении препаратов была применена программа анализа отклонений (ANOVA).
Результаты исследования Фармакокинетики
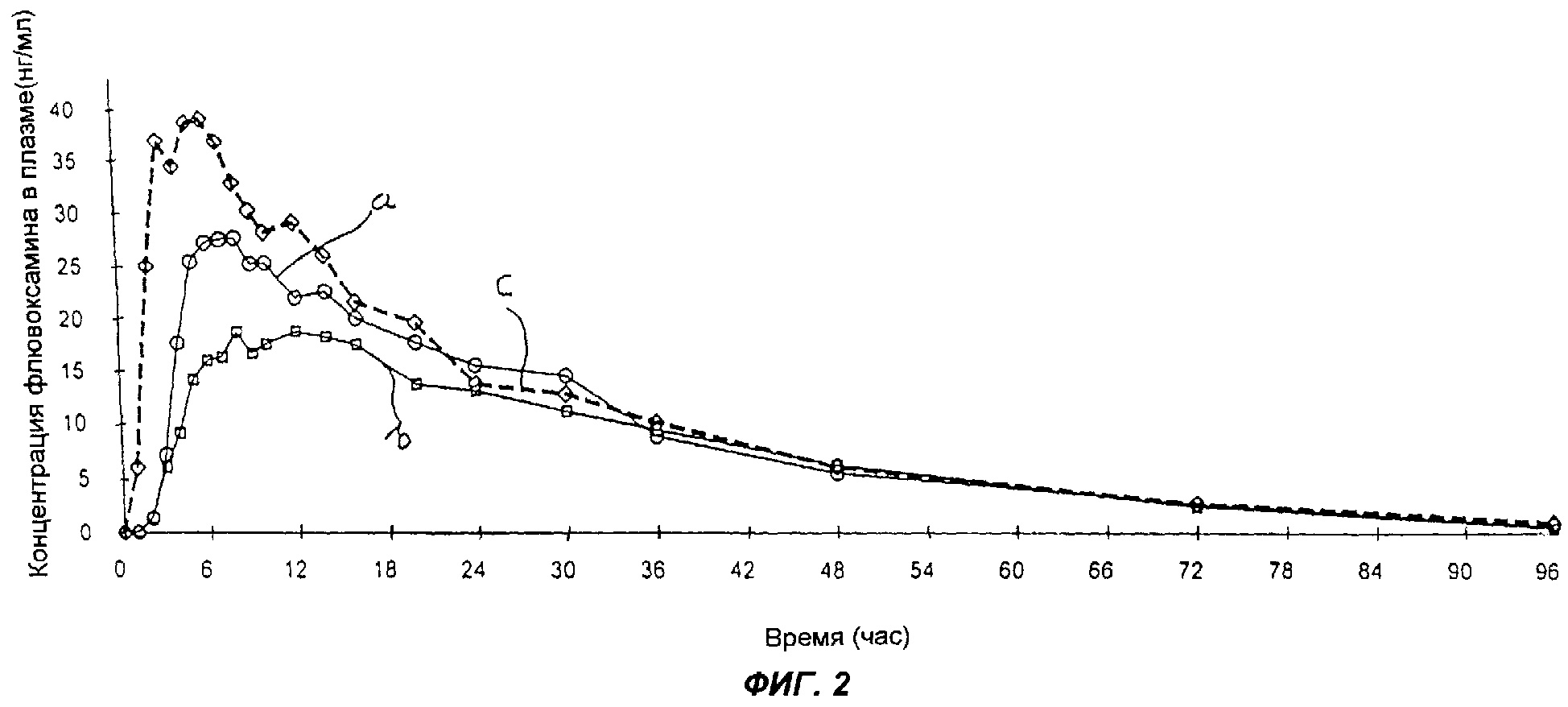
Результаты статистического анализа и доверительные интервалы для фармакокинетических параметров суммированы в таблице 23. Кривые зависимости средней концентрации в плазме от времени представлены на фиг.2, где кривая а соответствует продукту С, кривая b - продукту D и кривая с - препарату сравнения Luvox®.
ВЫВОД
Все испытанные фармацевтические составы по настоящему изобретению имеют Сmax, сниженную по сравнению с референсным продуктом (таблетки Luvox®), причем эта величина значительно ниже у продуктов С и D. Для всех составов по настоящему изобретению tmax пролонгировано по сравнению с максимальным временем для таблеток Luvox®. Для продукта D tmax существенно увеличено. Относительная биологическая доступность для всех составов составляет не менее 80% в сравнении с таблетками Luvox®.
Пример 4
Определение влияния питания на относительную биодоступность фармацевтического состава с контролируемым высвобождением флювоксамина
Исследование было проведено с целью оценить влияние питания на относительную биологическую доступность продукта С, приготовленного в примере 2.
Методология
В исследованиях применялись открытая маркировка, однократная дозировка, двукратное введение, два периода, рандомизированное перекрестное планирование с 10-дневным периодом выведения между периодами введения препаратов. Некомпартментальная оценка фармакокинетики основывалась на содержании флювоксамина в плазме. Пробы крови отбирали перед введением препаратов и в следующие моменты времени после введения референсных и испытуемых препаратов: 0 (перед введением), через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 20, 24, 30, 36, 48, 72 и 96 ч после введения.
Количество людей (запланированное и обследованное)
В исследования были вовлечены 16 человек, 13 мужчин и 3 женщины со средним возрастом 27,3 лет. Субъект №9 прервал обследование по личным причинам после завершения отбора крови на 72 ч во 2-м периоде. Все 16 человек участвовали в анализе фармакокинетики.
Диагноз и основные критерии для участия в исследованиях
Здоровые мужчины и женщины в возрасте от 18 до 45 лет с фенотипом усиленного метаболизма декстрометорфана.
Испытуемый продукт, дозировка и способ введения
Обследуемые получали одиночную оральную дозу продукта С, запивая ее 180 мл водопроводной воды, после чего следовали либо голодание в течение 10 ч ночью, либо обильная жирная пища.
Фармакокинетика
С использованием некомпартментальных методов были рассчитаны следующие фармакокинетические параметры: площадь под кривой зависимости концентрации лекарства в плазме от времени от момента введения дозы до точки последнего отбора пробы (AUC(0-t)); площадь под кривой зависимости концентрации лекарства в плазме от времени, экстраполированной к бесконечности (AUC(0-∞)); максимальная измеренная концентрация лекарства в плазме (Сmax) и время, в которое эта концентрация была измерена (tmax); относительная биодоступность (F) состава в условиях голодания и питания; время, при котором концентрация лекарства в плазме снижается на 50% (t1/2) и константа конечной скорости элиминации первого порядка (Kel).
Статистические методы
Были рассчитаны некомпартментальные фармакокинетические параметры и проведена описательная статистическая обработка. Для оценки различий в режимах была применена программа анализа отклонений (ANOVA).
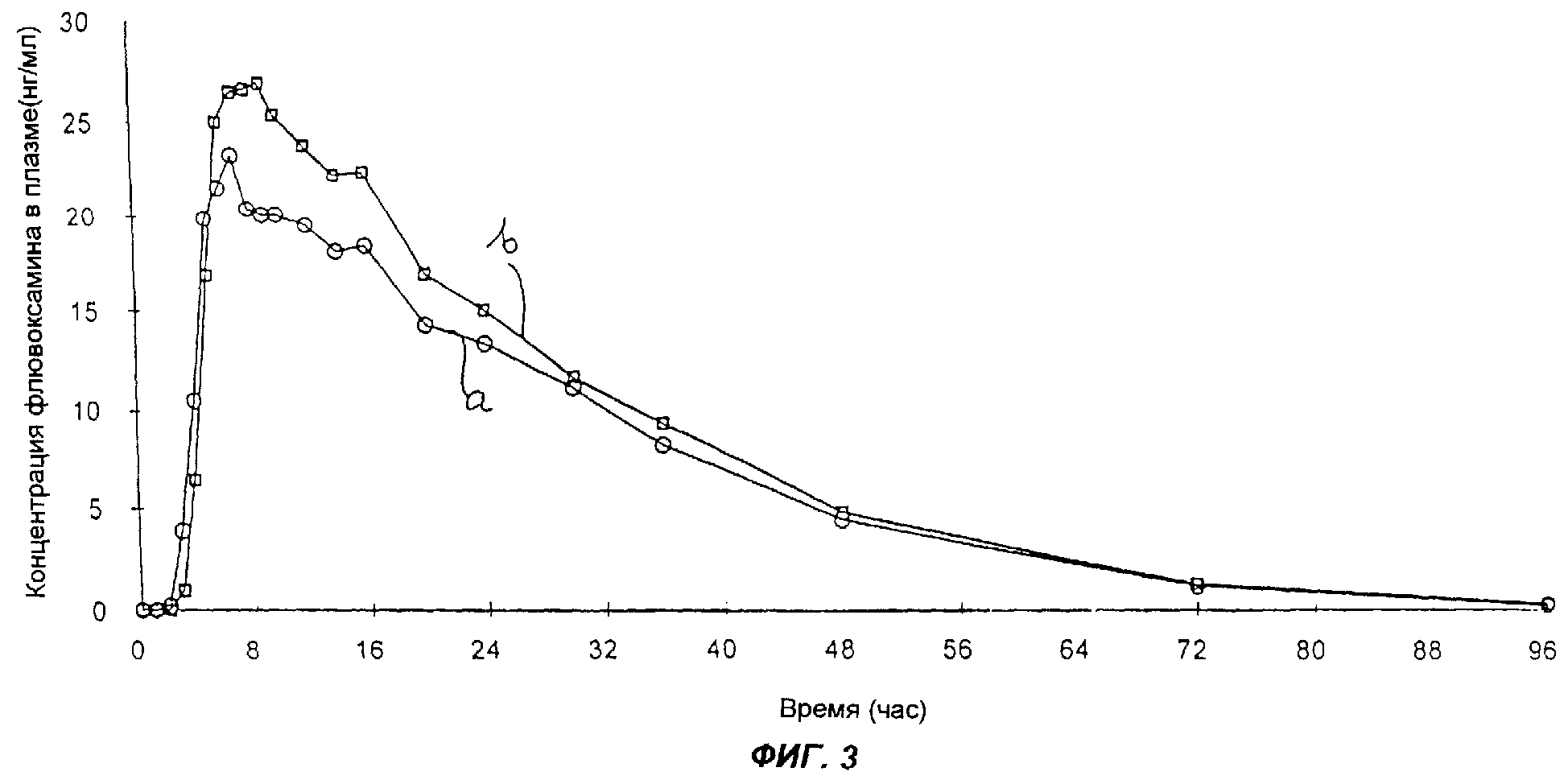
Результаты изучения фармакокинетики
Результаты изучения фармакокинетики суммированы в таблице 24 и на фиг.3. На фиг.3 кривая а соответствует условиям голодания, а кривая b - условиям питания.
Средние Cmax и AUC(0-∞) флювоксамина в присутствии пищи увеличивались соответственно на 18% и 14%. Сделан вывод, что такое увеличение не имеет никакого клинического значения. В присутствии пищи не было обнаружено никаких признаков демпинга дозы фармацевтического состава с контролируемым высвобождением.
ВЫВОД
Обнаружено, что оба режима в данной группе людей безопасны и хорошо переносимы. Для состава с контролируемым высвобождением не обнаружено никакого клинически существенного взаимодействия с пищей.
Пример 5
Определение фармакокинетики флювоксамина после введения здоровым добровольцам-мужчинам нескольких доз капсул KB со 100 мг флювоксамина и таблеток 100 мг Luvox®
Исследование было проведено с целью определить фармакокинетику флювоксамина после введения здоровым добровольцам-мужчинам нескольких доз приготовленного в примере 2 продукта С и 100 мг Luvox®.
Методология
В исследованиях применялись множественная дозировка, открытая маркировка, два режима введения, два периода, рандомизированное перекрестное планирование с 7-дневным периодом очищения между введением последней дозы флювоксамина в периоде 1 и первой дозы флювоксамина в периоде 2.
Количество людей (запланированное и обследованное)
В исследования были вовлечены двенадцать (12) человек, средний возраст которых был 26,3 лет, и 10 из них прошли полное обследование. Два человека прервали участие в исследованиях по причинам, не связанным с исследуемыми препаратами. Остальные 10 человек участвовали в определении фармакокинетики.
Диагноз и основные критерии для участия в исследованиях
Здоровые мужчины-добровольцы в возрасте от 18 до 45 лет включительно с фенотипом усиленного метаболизма декстрометорфана.
Испытуемый продукт, дозировка и способ введения
Продукт С
Каждый наблюдаемый получал одну оральную дозу в день, запивая ее 180 мл водопроводной воды, в течение 10 последовательных дней в каждом периоде введения препарата.
Фармакокинетика
Пробы крови отбирали в следующие моменты времени после введения референсного и испытуемого препаратов на 10-й и 27-й день: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 20, 24, 30, 36 и 48 ч.
Кроме того, каждое утро в дни с 1 по 10 и с 18 по 27 перед введением препарата отбирали преддозовые пробы крови.
С использованием некомпартментальных методов были определены следующие фармакокинетические параметры флювоксамина после каждого курса: площадь под кривой зависимости концентрации лекарства в плазме от времени в 24-часовом интервале после многократного введения (AUC(0-τ)); максимальная концентрация лекарства (Сmax) и время ее достижения (tmax); время установления стационарного состояния; минимальная концентрация в плазме (Cmin); средняя концентрация в плазме в течение интервала введения доз (Cav); относительная биодоступность (F) продукта С в сравнении с таблетками Luvox®, определяемая отношением величин AUC(0-τ); величина флуктуации от пиков к провалам, определяемая как отношение (Cmax-Сmin)/Cav).
Статистические методы
Для оценки различий в фармакокинетических параметрах между двумя режимами лечения флювоксамином была предложена описательная статистика. В каждом периоде введения препаратов сравнивали минимальные концентрации флювоксамина в плазме, чтобы определить, достигается ли стационарное состояние после 10 последовательных введений.
Результаты изучения фармакокинетики
Результаты изучения фармакокинетики суммированы в таблице 25 и на фиг.4. На фиг.4 кривая а соответствует продукту С, а кривая b - референсному препарату Luvox®.
Относительная биодоступность продукта С, рассчитанная на основании AUC(0-τ), составляла 94,0% по сравнению с таблетками Luvox®. Продукт С также имел меньший индекс флуктуации, что отражает более низкие значения Сmax в сравнении с таблетками Luvox®.
ВЫВОД
Оба препарата были безопасными и хорошо переносимыми в этой группе здоровых мужчин. Продукт С после многократного введения вел себя подобно таблеткам Luvox® и давал меньшие флуктуации концентраций флювоксамина в плазме.
Пример 6
Определение фармакокинетики флювоксамина после многократного введения здоровым добровольцам-мужчинам капсул KB 100 мг флювоксамина и таблеток 100 мг Luvox®
Исследование было проведено с целью определить фармакокинетику флювоксамина после многократного введения здоровым добровольцам-мужчинам приготовленного по примеру 2 продукта D и 100 мг Luvox®.
Методология
В исследованиях применялись множественная дозировка, открытая маркировка, два режима введения, два периода, сбалансированное рандомизированное перекрестное планирование с 7-дневным периодом очищения между введением последней дозы флювоксамина в периоде 1 и первой дозы флювоксамина в периоде 2.
Количество людей (запланированное и обследованное)
В исследования были вовлечены четырнадцать (14) человек, средний возраст которых был 31,1 года. Все 14 человек прошли полное исследование и участвовали в определении фармакокинетики.
Диагноз и основные критерии для участия в исследованиях
Здоровые мужчины-добровольцы в возрасте от 18 до 45 лет с фенотипом усиленного метаболизма декстрометорфана.
Испытуемый продукт, дозировка и способ введения:
Продукт D
Каждый наблюдаемый получал одну оральную дозу в день, запивая ее 180 мл водопроводной воды, в течение 10 последовательных дней в каждом периоде введения препарата.
Испытуемый продукт, дозировка и способ введения
Таблетки 100 мг Luvox® (малеат флювоксамина).
Каждый наблюдаемый получал одну оральную дозу в день, запивая ее 180 мл водопроводной воды, в течение 10 последовательных дней в каждом периоде введения препарата.
Фармакокинетика
Была применена такая же процедура, как в случае примера 4.
Статистические методы
Был принят такой же формат, как в случае примера 4.
Результаты изучения Фармакокинетики
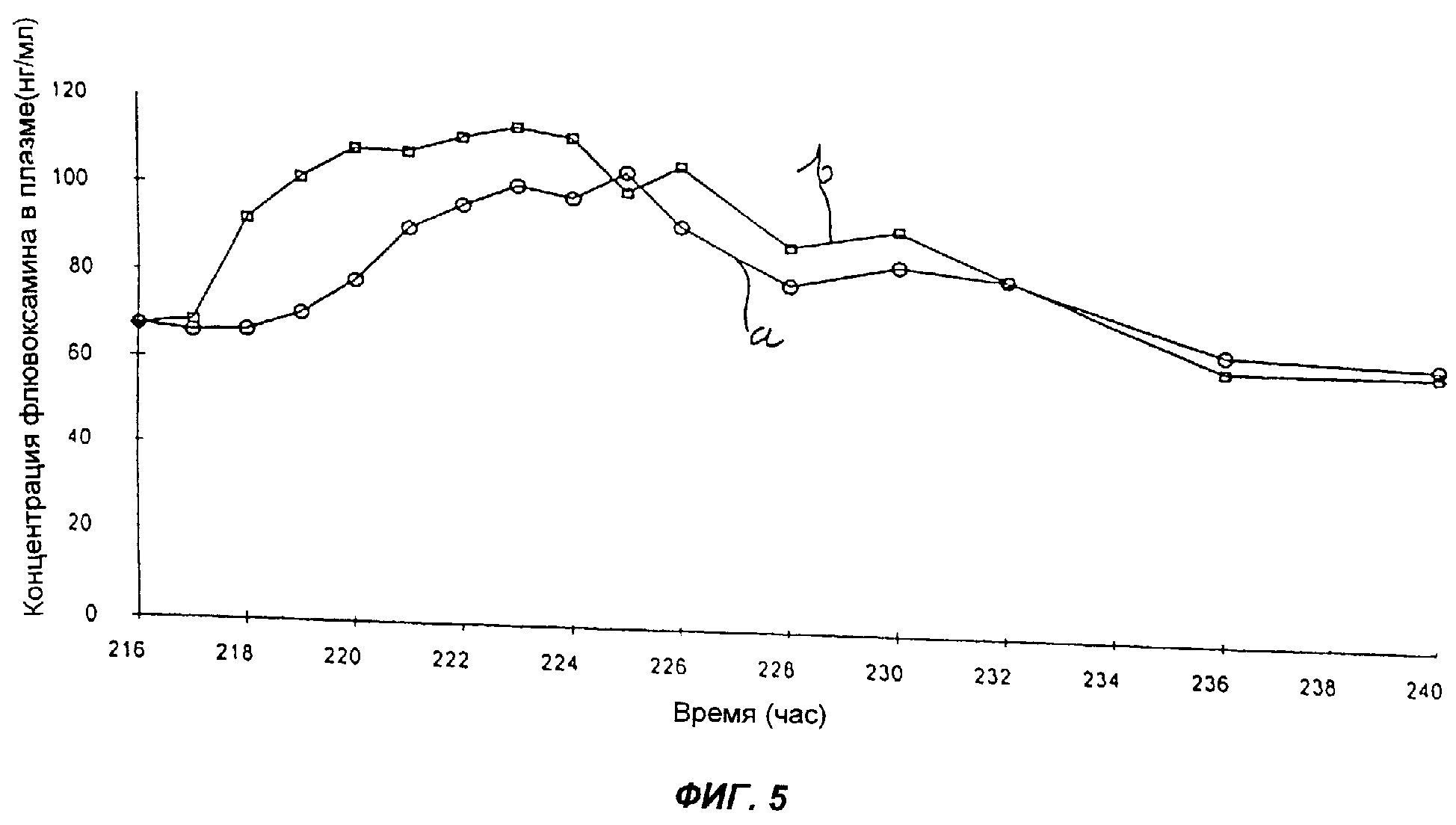
Результаты изучения фармакокинетики суммированы в таблице 26 и на фиг.5. На фиг.5 кривая а соответствует продукту D, а кривая b - референсному препарату Luvox®.
Относительная биологическая доступность продукта D, рассчитанная на основании AUC(0-τ), составляла 91,0% по сравнению с таблетками Luvox®. Продукт D также имел меньший индекс флуктуации, что отражает более низкие значения Сmax в сравнении с таблетками Luvox®.
ВЫВОД
Оба препарата были безопасными и хорошо переносимыми в этой группе здоровых мужчин. Состав KB (с контролируемым высвобождением) после многократного введения вел себя подобно таблеткам Luvox® и давал меньшие флуктуации концентраций флювоксамина в плазме.
Реферат
Предложено: состоящие из множества частиц фармацевтические составы с контролируемым высвобождением избирательного ингибитора повторного поглощения серотонина (ИИПС) с мембранным покрытием, содержащим аммонийно-метакрилатный сополимер, или составы, содержащие смесь частиц ИИПС, или составы, содержащие смесь частиц ИИПС с формой для немедленного высвобождения ИИПС, и способы лечения депрессии, включающие введение этих составов. В частности, ИИПС представляет собой флюоксетин, флювоксамин, пароксетин, сертралин, или их соли. Предложенные составы обеспечивают меньший индекс флуктуации, что отражает более низкие значения максимальных концентраций вещества в плазме крови после многократного введения, безопасность и хорошую переносимость. 4 н. и 7 з.п. ф-лы, 5 ил., 27 табл.

Комментарии