Вакцинация с использованием иммуно-изолированных клеток, продуцирующих иммуномодулятор - RU2727697C2
Код документа: RU2727697C2
Чертежи









Описание
Родственные заявки
[0001] По этой заявке испрашивается приоритет заявки на патент США No. 62/232940, поданной 25 сентября 2015 г., и заявки на патент США No. 62/384416, поданной 7 сентября 2016 г., полное содержание каждой из которой приведено в настоящем описании в качестве ссылки.
Область изобретения
[0002] Настоящее изобретение относится в общем к области иммунологии, в частности, к иммунизации на основе клеток против опухолей и к вакцинации против инфекционных агентов.
Уровень техники для изобретения
[0003] В области вакцинации вакцины первого поколения содержали только антиген, иммунный ответ против которого являлся желательным. Однако, поскольку присутствие только антигена в большинстве случаев является только слабо эффективным, разработано второе поколение вакцин, где вакцинирующая композиция включала один или несколько адъювантов в качестве иммуномодуляторов (т.е., GM-CSF отдельно или в комбинации с другими адъювантами) для усиления этого иммунного ответа. Чтобы являться эффективным, адъювант должен стабильно высвобождаться в участке вакцинации в течение нескольких суток.
[0004] Описано несколько различных способов доставки адъюванта в участок вакцинации, и выбор способа зависит от контекста иммунизации.
[0005] Например, в контексте вакцин на основе антигена (в отличие от вакцин на основе клеток), обычным способом является простое объединение антигена с адъювантом в вакцинирующей композиции. Полученную композицию вводят напрямую пациенту, таким образом, доставляя антиген и адъювант одновременным и совместно локализованным образом.
[0006] Однако этот простой способ невозможно использовать во всех условиях вакцинации. Например, для большинства злокачественных опухолей (например, легкого, ободочной кишки, желудка, лимфомы и головного мозга), антигены для вакцинации, которые можно использовать, часто неизвестны. Таким образом, для этих типов злокачественных опухолей, необходимы способы иммунизации на основе клеток против опухолей. Для способов иммунизации, включающих вакцины на основе клеток, антиген(ы) продуцируют цельные клетки, которые имплантируют пациенту. Такие способы требуют использования более трудоемких способов для обеспечения эффективной доставки адъюванта.
[0007] В одном примере иммуномодулятор инъецируют напрямую в участке вакцинации, либо в «голой» форме, либо в составе с замедленным высвобождением, с использованием пэгилированных, липосомных микросфер. Однако этот способ часто является ограниченным техническими и биохимическими затруднениями, поскольку системное введение адъюванта является неэффективным и может являться токсичным, и местное высвобождение рекомбинантных белков, используемых в качестве адъюванта (т.е., GM-CSF), является ненадежным, поскольку GM-CSF является нестабильным белком, обладающим временем полужизни только несколько часов в организме человека. Таким образом, чтобы являться эффективным, GM-CSF должен непрерывно продуцироваться in situ, чтобы являться терапевтически эффективным.
[0008] Другим примером, используемым, чтобы обойти проблемы, возникающие при способе прямой инъекции, является применение «посторонних клеток» для местной продукции иммуномодуляторов. В этих способах клетки, продуцирующие необходимый адъювант, вводят поблизости от источника антигена, таким образом, обеспечивая эффективное, местное высвобождение адъюванта в участке вакцинации.
[0009] Однако этот способ также обладает некоторыми недостатками. Для иммунизации человека, необходимо множество иммунизаций, и, поскольку сингенные посторонние клетки не являются легко доступными, наиболее часто используют аллогенные клетки. Таким образом, после первой инъекции, посторонние клетки узнает иммунная система хозяина (аллогенное узнавание) и отторгает, таким образом, предотвращая дальнейшую стабильную и длительную продукцию иммуномодулятора и подвергая риску желательный иммунный ответ против вакцин с антигенными веществами.
[0010] Чтобы преодолеть эту проблему аллогенного узнавания, Borrello et al (Human Gene Therapy, 1999, 10(12), 1983-1991) описали способ, в котором клетка, поставляющая GM-CSF, представляет собой линию клеток K-562 (No. депозита в ATCC CCL-243), которые не экспрессируют молекулы MCH на поверхности и не могут экспрессировать антигены HLA класса I или II, таким образом, потенциально уменьшая диапазон ответов на аллоантигены, возникающих при повторяющихся иммунизациях. Однако, эти клетки представляют собой клетки злокачественных опухолей человека и являются высоко чувствительными к активным механизмам отторжения, которые возникают без вовлечения белков HLA класса I или II, которые являются менее специфическими, но очень быстрыми и активными для разрушения клеток. Например, известно, что клетки K-562 являются очень чувствительными к клеткам NK, а также к T-клеткам γδ, что приводит к быстрому уничтожению аллогенных клеток.
[0011] Таким образом, является вероятным, что посторонние клетки K-562, инъецированные в участке вакцинации, будут разрушены эффективно и быстро посредством независимых от MHC цитотоксических механизмов, которые могут значительно уменьшать высвобождение иммуномодулятора.
[0012] Более того, в дополнение к тому, что они являются очень чувствительными к быстрому разрушению клетками NK, клетки K-562 могут также экспрессировать MHC класса I при воздействии интерферона γ. Поскольку интерферон γ может присутствовать или высвобождаться в участке вакцинации во время первой или после повторных иммунизаций, такая повышающая регуляция MHC класса I может также приводить к быстрому разрушению клеток посредством классического клеточного иммунитета.
[0013] По этим причинам, применение клеток, таких как K-562, при вакцинации, связано с многочисленными недостатками.
[0014] Другим решением, широко используемым в контексте вакцин на основе клеток, является объединение продукции антигена и высвобождения иммуномодулятора посредством модификации клетки, которая является источником антигена, чтобы она также поставляла иммуномодулятор. Например, в вакцинах против злокачественных опухолей, источником антигена обычно является цельная клетка опухоли, которую можно модифицировать, например, посредством трансфекции, для одновременной продукции необходимого адъюванта.
[0015] Принимая во внимание благоприятные результаты, полученные в модели на мышах, в первоначальных исследованиях для человека использовали такой же способ. Однако, доказано, что этот способ является очень трудоемким и занимающим много времени, поскольку собранные хирургическими способом клетки пациента необходимо размножать in vitro для ретровирусной инфекции, что таким образом, предотвращает широкое применение способа.
[0016] Использование других вирусных векторов для инфекции клеток опухолей также предлагали, чтобы обойти трудности, наблюдаемые при использовании ретровирусных векторов.
[0017] Несмотря на это, главной проблемой, ассоциированной с тестированными новыми вирусами, является то, что, в большинстве случаев, некоторые вирусные белки могут экспрессироваться из клеток опухолей после инфекции, и эти вирусные белки сильно узнает иммунная система в качестве чужеродных, инфекционных агентов. Таким образом, первоначальная цель индукции иммунного ответа против слабых антигенов опухолей сдвигается или перенаправляется против вирусного белка, что приводит к маскировке противоопухолевого иммунного ответа и примированию реципиента против последующей иммунизации, что может дополнительно усиливать разрушение инъецированных клеток и вероятно, может уменьшать эффективность схемы противоопухолевой иммунизации.
[0018] Таким образом, в то время как использование аутологичных модифицированных клеток опухолей в качестве объединенного источника антигена и адъюванта заведомо минимизирует риск нежелательного иммунного ответа, сама стадия вирусной инфекции вызывает значительные проблемы.
[0019] Для ограничения проблем, возникающих при вирусной инфекции аутологичных клеток, разработаны новые способы, не требующие клеток пациента. В этих способах источник антигена обеспечивают посредством линий клеток, полученных от других пациентов со сходным типом злокачественной опухоли, и пациента иммунизируют с использованием повторяющихся инъекций облученных, секретирующих GM-CSF, аллогенных (от другого человека) клеток опухолей. Процент пациентов, для которых показан иммунный ответ в исследованиях с использованием этих способов, являлся более низким, чем ожидали.
[0020] Соответственно, в данной области сохраняется необходимость разработки вакцинных композиций, обеспечивающих как постоянный источник иммуномодулятора, так и антигенный компонент, которые являются в основном свободными от нежелательных взаимодействий с природной или адаптивной иммунной системой.
Сущность изобретения
[0021] Разработка хорошей антигензависимой иммунотерапии злокачественных опухолей требует правильной локализации, правильного антигенного материала (т.е., аутологичных клеток опухолей), правильного иммуностимулирующего сигнала (например, GM-CSF (отдельно или в комбинации с другими адъювантами), длительной доставки необходимого адъюванта, стабильной и воспроизводимой доставки адъюванта и антигенного компонента, доступности материала клинической квалификации, так же как возможности масштабирования продукции. Активная противораковая иммунизация требует опухолеспецифических антигенов и сильного адъюванта. Местное стабильное высвобождение иммуномодулятора, такого как GM-CSF, более нескольких суток в участке иммунизации присутствует среди наиболее сильных адъювантов. Оно индуцирует сильный, длительный, специфический противоопухолевый иммунитет во всех тестированных типах мышиных злокачественных опухолей. Однако, системная доставка GM-CSF не является хорошим адъювантом, поскольку она привлекает MSDC и не вызывает резкого усиления иммунитета против злокачественных опухолей.
[0022] С использованием терапии инкапсулированными клетками (ECT), разработана платформа для подкожного введения клинической квалификации. Настоящее изобретение относится к способу иммунизации клинической квалификации, в котором используют двухкомпонентные вакцинные композиции. Один компонент вакцинной композиции представляет собой антигенный компонент (т.е., летально облученные аутологичные клетки опухолей или один или несколько инфекционных агентов), в то время как другой компонент представляет собой по меньшей мере одну извлекаемую биосовместимую макрокапсулу, содержащую иммуно-изолированные аллогенные клетки, которые секретируют или которые подвергнуты воздействию генной инженерии для секреции эффективного количества иммуномодулирующего средства (т.е., GM-CSF) в течение периода по меньшей мере одной недели. Эти иммуно-изолированные аллогенные клетки секретируют активную форму иммуномодулятора непрерывным и неиммуногенным образом в непосредственной близости от антигенного компонента.
[0023] Настоящее изобретение относится к новому способу, который преодолевает недостатки, ассоциированные с предшествующими способами иммунизации, и который основан на композициях и способах, описанных в WO 2003/105895, полное содержание которой приведено в настоящем описании в качестве ссылки.
[0024] Способы вакцинации, описанные в настоящем описании, не требуют каких-либо разработанных по индивидуальным требованиям протоколов генотерапии и не включают в себя применение каких-либо вирусных векторов. Вместо этого, стандартизованный адъювант (т.е., GM-CSF) высвобождается из макрокапсул подкожно в непосредственной близости от антигенного компонента. Эта иммунотерапия на основе клеток объединяет длительное, стабильное, стандартизованное местное высвобождение GM-CSF и опухолеспецифические антигены.
[0025] Любые вакцинные композиции, описанные в настоящем описании, можно использовать для терапевтической или профилактической вакцинации для терапии или лечения злокачественных опухолей (также обозначаемых в настоящем описании взаимозаменяемо как Onco-Maxi-Vax или MVX-ONCO-1), или для лечения или предотвращения действия инфекционного агента (также обозначаемых в настоящем описании взаимозаменяемо как Immuno-Maxi-Vax или IA-Maxi-Vax). Поскольку противораковая терапия основана на запуске природного механизма собственного иммунного ответа пациента для уничтожения клеток злокачественных опухолей, его можно использовать для всех типов злокачественных опухолей, включая как солидные опухоли, так и связанные с кровью злокачественные опухоли.
[0026] Изобретение относится к вакцинным композициям, содержащим: (a) по меньшей мере одну извлекаемую биосовместимую макрокапсулу, содержащую между приблизительно 1×105 и приблизительно 1×106 иммуно-изолированных аллогенных клеток (например, приблизительно 8×105 иммуно-изолированных аллогенных клеток), которые секретируют по меньшей мере 20 нг/24 часа GM-CSF, и (b) антигенный компонент, где по меньшей мере одна биосовместимая макрокапсула обладает сердцевиной, содержащей аллогенные клетки, и внутренней спиралью, где аллогенные клетки распределены на внутренней спирали; и полупроницаемой мембраной, окружающей сердцевину, позволяющей диффузию через нее GM-CSF. Тестировали несколько различных концентраций аллогенных клеток внутри биосовместимых макрокапсул (например, 5, 8, 10 и 15×105 клетки). В одном неограничивающем варианте осуществления, выбрали 8×105 клеток, поскольку это обеспечивает наилучшую длительную стабильность, пригодную для длительного высвобождения с минимальной изменчивостью.
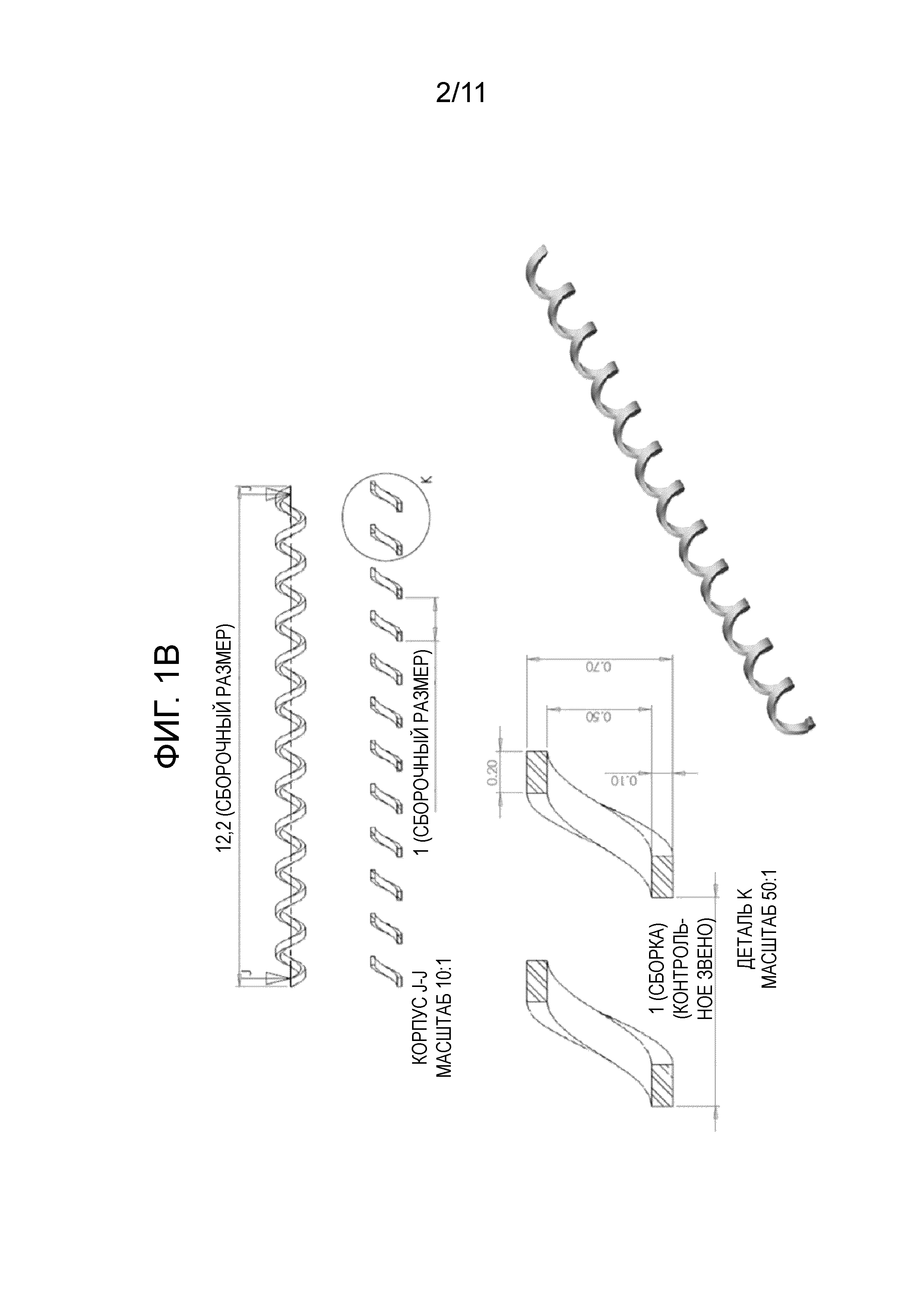
[0027] Полупроницаемая мембрана изготовлена из материала, выбранного из группы, состоящей из полиэфирсульфона (PES) и термопластичного полиуретана, и/или внутренняя спираль изготовлена из алюминия или титана. Тестировали несколько видов толщины мембраны с несколькими различными размерами пор (например, PES 5, UltraPES 0.8, Ultra PES 0.7). В некоторых вариантах осуществления, расстояние между витками на внутренней спирали составляет приблизительно 1 мм±0,1 мм. Внутреннюю спираль можно изготавливать из алюминия, титана или т.п.
[0028] Каждая биосовместимая капсула может являться цилиндрической по форме. В некоторых вариантах осуществления, каждая биосовместимая макрокапсула имеет длину между 5 и 25 мм (т.е., длину приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 мм). Двенадцать мм выбрали в качестве наилучшего размера для способов имплантации, манипуляции, изготовления и загрузки клеток.
[0029] Макрокапсулы могут также содержать трубку для извлечения, которая может быть изготовлена из любого пригодного материала, включая, но без ограничения, полиуретан. Мембрану по меньшей мере одной макрокапсулы можно прикреплять к трубке для извлечения. Например, коннектор (например, коннектор из нержавеющей стали) можно использовать для прикрепления трубки для извлечения к мембране по меньшей мере одной биосовместимой макрокапсулы. Конец коннектора, который вставляют в мембрану, предпочтительно, имеет форму усеченного конуса.
[0030] Трубка для извлечения может дополнительно содержать крючок для извлечения по меньшей мере одной макрокапсулы после имплантации. Например, крючок можно использовать для прикрепления макрокапсул в ходе имплантации и использовать для удаления макрокапсул после определенного периода времени.
[0031] В некоторых вариантах осуществления, крючок для извлечения содержит отверстие и по меньшей мере две ножки для облегчения присоединения к трубке для извлечения.
[0032] Крючок для извлечения может быть изготовлен из любого пригодного материала, включая, но без ограничения, нержавеющую сталь, и его можно использовать для прикрепления к трубке для извлечения с использованием отверждаемого ультрафиолетовым излучением клея.
[0033] Хирургическую нить можно продевать через отверстие для прикрепления крючка для извлечения после имплантации.
[0034] По меньшей мере одна биосовместимая макрокапсула дополнительно содержит разъем для загрузки для облегчения загрузки клеток. В некоторых вариантах осуществления, разъем для загрузки обладает усеченным коническим концом. Разъем для загрузки может быть вставлен в мембрану с притиранием.
[0035] В других вариантах осуществления, по меньшей мере одна биосовместимая макрокапсула содержится в пробирке для транспортировки, обладающей корпусом пробирки и крышкой пробирки, которая может содержать одно или несколько отверстий. Кроме того, крышка пробирки может также содержать винтовое соединение Люэра, вставленное в крышку с притиранием. Разъем для загрузки можно вставлять с подгонкой в винтовое соединение Люэра в крышке.
[0036] В некоторых вариантах осуществления, вакцинная композиция содержит две биосовместимые макрокапсулы.
[0037] Иммуно-изолированные аллогенные клетки внутри каждой макрокапсулы секретируют по меньшей мере 20 нг/24 час GM-CSF в течение периода по меньшей мере одной недели.
[0038] В некоторых вариантах осуществления, антигенный компонент представляет собой аутологичные клетки опухолей, которые, необязательно, могут являться облученными. В этих вариантах осуществления, антигенный компонент представляет собой между приблизительно 1×106 и приблизительно 1×107 аутологичных клеток опухолей (например, приблизительно 4×106 аутологичных клеток опухолей). Летально облученные клетки опухолей можно хранить замороженными в течение длительного хранения в течение вплоть до 12 месяцев (т.е., 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев).
[0039] В других вариантах осуществления, антигенный компонент происходит из инфекционного агента (например, вируса, бактерии, паразитарного патогена или гриба). Например, пригодные антигенные компоненты включают в себя инактивированный патоген, лизат инфекционного агента, экстракт белка, рекомбинантный белок, пептид или ДНК. В качестве неограничивающих примеров, вирус выбран из группы, состоящей из HIV, CMV, рецидивирующей герпетической инфекции, гепатита B, вируса Эпштейна-Барр, гепатита C и вируса папилломы человека (HPV); бактерия выбрана из группы, состоящей из микобактериальной инфекции, Helicobacter pylori и менингококковой инфекции; паразитарный патоген выбран из группы, состоящей из малярии, токсоплазмы, Pneumocystis и эхинококкоза; и/или гриб выбран из группы, состоящей из кандиды и аспергиллы.
[0040] В любых вакцинных композициях, описанных в настоящем описании, иммуно-изолированные аллогенные клетки дополнительно секретируют по меньшей мере одно дополнительное иммуномодулирующее средство (например, IL-12, IL-15, IL-4, интерферон-гамма, хемокины или факторы роста дендритных клеток, IL-3, IL-9, IL-1, IL-2, IL-7, трансмембранные рецепторы IFNγ, фактор стволовых клеток (SCF), растворимый или мембранный, FL (лиганд Flt3), G-CSF, агонисты TLR7, T-клеточный иммуноглобулин муцин-3 (TIM-3), продукт гена индуцируемого глюкокортикоидами белка, родственного семейству TNFR (GITR), продукт гена активации лимфоцитов 3 (LAG-3), Vista, стимулятор B- и T-лимфоцитов (также известный как CD272) (BTLA), индуцируемый костимулятор T-клеток (ICOS) (также известный как CD278), член 4 суперсемейства рецепторов фактора некроза опухолей (OX40) (также известный как CD134 или TNFRSF4), CD40, CD137 (также известный как 41BB), CD27 и их комбинации).
[0041] Мембрана, окружающая иммуно-изолированные аллогенные клетки внутри сердцевины макрокапсулы, является избирательно проницаемой. Например, отсекаемая молекулярная масса (MWCO) для мембраны составляет приблизительно 280 кДа.
[0042] В некоторых вариантах осуществления, иммуно-изолированные аллогенные клетки генетически модифицируют для экспрессии GM-CSF, например, посредством трансфекции плазмидой или инфекции вирусом.
[0043] Иммуно-изолированные аллогенные клетки представляют собой устойчивую линию клеток человека (например, линию неадгерентных клеток, таких как клетки гематопоэтического происхождения). В некоторых вариантах осуществления, иммуно-изолированные аллогенные клетки являются бессмертными или иммортализованными и/или не являются опухолевыми. Иммуно-изолированные аллогенные клетки происходят из относящегося к млекопитающим источника (например, человека или не относящегося к человеку млекопитающего). В некоторых вариантах осуществления, иммуно-изолированные аллогенные клетки являются облученными.
[0044] Иммуно-изолированные аллогенные клетки секретируют между приблизительно 80 и приблизительно 960×10-15 г/24 час GM-CSF, более чем 10×10-15 г/24 час GM-CSF, или более чем 100×10-15 г/24 час GM-CSF.
[0045] В конкретных вариантах осуществления, по меньшей мере одна биосовместимая макрокапсула секретирует между 50 и 150 нг/сутки (например, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145 или 150 нг/сутки) GM-CSF.
[0046] Любые вакцинные композиции, описанные в настоящем описании, могут также содержать одно или несколько дополнительных лекарственных средств. В некоторых вариантах осуществления, одно или несколько дополнительных лекарственных средств представляют собой модуляторы иммунных контрольных точек. Например, модуляторы иммунных контрольных точек могут представлять собой продукты или средства (например, белки, антитела, соединения и т.д.), нацеленные на одну или несколько иммуномодулирующих молекул, например, таких как ассоциированный с цитотоксическими T-лимфоцитами белок (CTLA-4), белок 1 программируемой гибели клеток (PD-1), лиганд белка 1 программируемой гибели клеток (PD-L1), TIM-3, GITR, LAG-3, Vista, BTLA, ICOS, OX40, CD40, CD137 (также известный как 41BB), CD27, индоламин-2,3-диоксигеназа (IDO) и их комбинации.
[0047] Таким образом, инкапсулированные клетки можно конструировать для продукции молекул, обладающих либо ингибирующей, либо усиливающей активностью, в зависимости от того, является ли мишень иммунной контрольной точкой с ингибирующей (т.е., антагонистической) или усиливающей (т.е., агонистической) активностью.
[0048] Синергизм между иммунизацией на основе клеток и блокированием CTLA-4/PD-1 показан в доклинических моделях. Предпочтительно, местная продукция CTLA-4 является желательной.
[0049] По меньшей мере одну биосовместимую макрокапсулу и/или антигенный компонент можно замораживать, хранить и размораживать перед использованием.
[0050] В любых вакцинных композициях, описанных в настоящем описании, по меньшей мере одна биосовместимая макрокапсула может также содержать одно или несколько из следующего: i) трубка для извлечения; ii) крючок для извлечения, прикрепленный к трубке для извлечения, где крючок для извлечения облегчает извлечение по меньшей мере одной биосовместимой макрокапсулы после имплантации; iii) коннектор, где коннектор прикрепляет мембрану по меньшей мере одной биосовместимой макрокапсулы к трубке для извлечения; iv) разъем для загрузки, где разъем для загрузки облегчает загрузку клеток; и/или v) пробирка для транспортировки, где пробирка для транспортировки обладает корпусом пробирки и крышкой пробирки.
[0051] Изобретение также относится к фармацевтическим композициям, содержащим любые описанные вакцинные композиции и один или несколько физиологически приемлемых носителя (носителей).
[0052] Изобретение также относится к наборам, содержащим вакцинные композиции и/или фармацевтические композиции и инструкции для применения. Например, в таких наборах, антигенный компонент может содержать клетки, продуцирующие или высвобождающие один или несколько антигенов, такие как клетки опухолей, необязательно, являющиеся облученными. Альтернативно, антигенный компонент можно получать из инфекционного агента (например, вируса, бактерии, паразитарного патогена или гриба).
[0053] В любом из наборов, описанных в настоящем описании, по меньшей мере одну из биосовместимых макрокапсул стерилизуют (например, перед использованием). После стерилизации, по меньшей мере одну биосовместимую макрокапсулу можно индивидуально упаковывать в стерильные пакеты для хранения, транспортировки и/или доставки.
[0054] Изобретение также относится к применениям вакцинных композиций, фармацевтических композиций и/или наборов, описанных в настоящем описании, для терапевтической или профилактической вакцинации (например, терапии или вакцинации против злокачественных опухолей). В качестве неограничивающего примера, злокачественная опухоль может быть выбрана из группы, состоящей из рака легкого, меланомы, рака молочной железы, рака ободочной кишки, рака поджелудочной железы, рака почки, острого лейкоза, хронического лейкоза, глиобластомы, лимфомы низкой степени злокачественности, лимфомы высокой степени злокачественности, множественной миеломы, саркомы, злокачественной опухоли кости, опухоли мозга, рака желудка, рака пищевода, рака головы и шеи, рака щитовидной железы, рака мочевого пузыря, рака предстательной железы, рака яичника, рака тела матки, хордомы и рака шейки матки. В некоторых вариантах осуществления, злокачественная опухоль представляет собой рак легкого; карциному поджелудочной железы; карциному яичника; или рак головы и шеи.
[0055] В других вариантах осуществления, терапевтическая или профилактическая вакцинация представляет собой терапию или вакцинацию против инфекционного агента. Например, инфекционный агент выбран из группы, состоящей из вируса (например, HIV, CMV, рецидивирующей герпетической инфекции, гепатита B, вируса Эпштейна-Барр, гепатита C или вируса папилломы человека (HPV)), бактерии (например, микобактериальной инфекции, Helicobacter pylori или менингококковой инфекции), паразита (например, малярии, токсоплазмы, Pneumocystis или эхинококкоза) и гриба (например, кандиды или аспергиллы).
[0056] В любом из этих применений по меньшей мере одну биосовместимую макрокапсулу и антигенный компонент имплантируют, и по меньшей мере одну биосовместимую макрокапсулу впоследствии удаляют. Например, по меньшей мере одну биосовместимую макрокапсулу и антигенный компонент вводят последовательно под кожу в непосредственной близости или контакте. Антигенную нагрузку (т.е., облученные клетки злокачественных опухолей или часть инфекционного агента) не удаляют. Вместо этого, их разрушает иммунная система.
[0057] По меньшей мере одну биосовместимую макрокапсулу имплантируют до антигенного компонента.
[0058] По меньшей мере одну биосовместимую макрокапсулу имплантируют на период менее, чем 12 суток; на период между 4 и 10 сутками; или на период между 5 и 7 сутками.
[0059] В любом из этих применений, профилактическая или терапевтическая вакцинация включает в себя множественные инъекции, например, множественные инъекции, которые происходят через равные интервалы. Когда профилактическая или терапевтическая вакцинация представляет собой терапию или вакцинацию против злокачественных опухолей, равные интервалы включают в себя еженедельные инъекции в течение четырех недель с последующими двумя дополнительными иммунизациями каждые две недели. Когда профилактическая или терапевтическая вакцинация представляет собой терапию или вакцинацию против инфекционного агента, равные интервалы включают в себя еженедельные инъекции в течение по меньшей мере двух недель. Предпочтительно, множественные инъекции представляют собой подкожные инъекции.
[0060] Изобретение также относится к способам терапевтической или профилактической вакцинации посредством введения эффективного количества любых вакцинных композиций, фармацевтических композиций, или наборов, описанных в настоящем описании, пациенту. Например, терапевтическая или профилактическая вакцинация представляет собой терапию или вакцинацию против злокачественных опухолей. В качестве неограничивающего примера, злокачественная опухоль может быть выбрана из группы, состоящей из рака легкого, меланомы, рака молочной железы, рака ободочной кишки, рака поджелудочной железы, рака почки, острого лейкоза, хронического лейкоза, глиобластомы, лимфомы низкой степени злокачественности, лимфомы высокой степени злокачественности, множественной миеломы, саркомы, злокачественной опухоли кости, опухоли мозга, рака желудка, рака пищевода, рака головы и шеи, рака щитовидной железы, рака мочевого пузыря, рака предстательной железы, рака яичника, рака тела матки, хордомы, и рака шейки матки. В некоторых вариантах осуществления, злокачественная опухоль представляет собой рак легкого; карциному поджелудочной железы; карциному яичника; или рак головы и шеи.
[0061] В других вариантах осуществления, терапевтическая или профилактическая вакцинация представляет собой терапию или вакцинацию против инфекционного агента. Например, инфекционный агент выбран из группы, состоящей из вируса (например, HIV, CMV, рецидивирующей герпетической инфекции, гепатита B, вируса Эпштейна-Барр, гепатита C или вируса папилломы человека (HPV)), бактерии (например, микобактериальной инфекции, Helicobacter pylori или менингококковой инфекции), паразита (например, малярии, токсоплазмы, Pneumocystis или эхинококкоза) и гриба (например, кандиды или аспергиллы).
[0062] В любом из этих способов, по меньшей мере одну биосовместимую макрокапсулу и антигенный компонент имплантируют, и по меньшей мере одну биосовместимую макрокапсулу впоследствии удаляют. Например, по меньшей мере одну биосовместимую макрокапсулу и антигенный компонент вводят последовательно под кожу в непосредственной близости или контакте.
[0063] По меньшей мере одну биосовместимую макрокапсулу имплантируют до антигенного компонента.
[0064] По меньшей мере одну биосовместимую макрокапсулу имплантируют на период менее, чем 12 суток; на период между 4 и 10 сутками; или на период между 5 и 7 сутками.
[0065] В любом из этих способов, профилактическая или терапевтическая вакцинация включает в себя множественные инъекции, например, множественные инъекции, которые происходят через равные интервалы. Когда профилактическая или терапевтическая вакцинация представляет собой терапию или вакцинацию против злокачественных опухолей, равные интервалы включают в себя еженедельные инъекции в течение четырех недель с последующими двумя дополнительными иммунизациями каждые две недели. Когда профилактическая или терапевтическая вакцинация представляет собой терапию или вакцинацию против инфекционного агента, равные интервалы включают в себя еженедельные инъекции в течение по меньшей мере двух недель. Предпочтительно, множественные инъекции представляют собой подкожные инъекции.
[0066] Наконец, изобретение также относится к способам получения по меньшей мере одной биосовместимой макрокапсулы, используемой в любых вакцинных композициях, описанных в настоящем описании. Например, такие способы могут включать стадии (a) культивирования аллогенных клеток в течение по меньшей мере двух пассажей, чтобы убедиться, что клетки секретируют GM-CSF; (b) ресуспендирования культивированных клеток в среде для культивирования клеток; (c) загрузки клеток по меньшей мере в одну биосовместимую макрокапсулу (например, с использованием давления стерильного воздуха); и/или (d) разрезания трубки для извлечения, чтобы удалить разъем для загрузки. Такие способы могут включать также дополнительные стадии герметичного закрытия отрезанного конца трубки для извлечения и/или промывки и криоконсервирования (например, с использованием паровой фазы жидкого азота) по меньшей мере одной биосовместимой макрокапсулы.
[0067] Изобретение также относится к вакцинным композициям, фармацевтическим композициям и/или наборам, описанным в настоящем описании, для применения в терапевтической или профилактической вакцинации.
[0068] Например, терапевтическая или профилактическая вакцинация представляет собой терапию или вакцинацию против злокачественных опухолей, необязательно, где злокачественная опухоль выбрана из группы, состоящей из рака легкого, меланомы, рака молочной железы, рака ободочной кишки, рака поджелудочной железы, рака почки, острого лейкоза, глиобластомы, лимфомы низкой степени злокачественности, лимфомы высокой степени злокачественности, множественной миеломы, саркомы, злокачественной опухоли кости, опухоли мозга, рака желудка, рака пищевода, рака головы и шеи, рака щитовидной железы, рака мочевого пузыря, рака предстательной железы, рака яичника, рака тела матки, хордомы и рака шейки матки.
[0069] В других вариантах осуществления, терапевтическая или профилактическая вакцинация представляет собой терапию или вакцинацию против инфекционного агента, необязательно, где инфекционный агент выбран из группы, состоящей из вируса, бактерии, паразита и гриба. В качестве неограничивающего примера, вирус может быть выбран из группы, состоящей из HIV, CMV, рецидивирующей герпетической инфекции, гепатита B, вируса Эпштейна-Барр, гепатита C и вируса папилломы человека (HPV), бактерия выбрана из группы, состоящей из микобактериальной инфекции, Helicobacter pylori и менингококковой инфекции, паразитарный патоген выбран из группы, состоящей из малярии, токсоплазмы, Pneumocystis и эхинококкоза, или гриб выбран из группы, состоящей из кандиды и аспергиллы.
[0070] Для любых вакцинных композиций, фармацевтических композиций или наборов для применения в соответствии с описанным в настоящем описании, по меньшей мере одну биосовместимую макрокапсулу и антигенный компонент имплантируют, и по меньшей мере одну биосовместимую макрокапсулу впоследствии удаляют, необязательно, по меньшей мере одну биосовместимую макрокапсулу и антигенный компонент вводят последовательно под кожу в непосредственной близости или контакте, или по меньшей мере одну биосовместимую макрокапсулу имплантируют до антигенного компонента. Например, в вакцинной композиции, фармацевтической композиции или набора для применения, по меньшей мере одну биосовместимую макрокапсулу имплантируют на период менее, чем 12 суток, на период между 4 и 10 сутками или на период между 5 и 7 сутками.
[0071] Для этих вакцинных композиций, фармацевтических композиций или наборов для применения, профилактическая или терапевтическая вакцинация включает множественные инъекции, необязательно, где множественные инъекции происходят через равные интервалы, необязательно где множественные инъекции представляют собой подкожные инъекции.
[0072] Изобретение также относится к вакцинным композициям, фармацевтическим композициям или наборам для применения, описанного в настоящем описании, где (i) когда профилактическая или терапевтическая вакцинация представляет собой терапию или вакцинацию против злокачественных опухолей, равные интервалы представляют собой еженедельные инъекции в течение четырех недель с последующими двумя дополнительными иммунизациями каждые две недели, или (ii) когда профилактическая или терапевтическая вакцинация представляют собой терапию или вакцинацию против инфекционного агента, равные интервалы являются еженедельными.
[0073] Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, какое является общепринятым для специалиста в области, к которой относится это изобретение. Несмотря на то, что способы и материалы, сходные или эквивалентные описанным в настоящем описании, можно использовать в практическом осуществлении или тестирования настоящего изобретения, пригодные способы и материалы описаны ниже. Полное содержание всех публикаций, заявок на патенты, патентов и других ссылок, упомянутых в настоящем описании, приведено в настоящем описании в качестве ссылки. В случае конфликта, настоящее описание, включая определения, имеет преимущество. Кроме того, материалы, способы и примеры являются только иллюстративными и не являются ограничивающими.
[0074] Другие признаки и преимущества изобретения очевидны из следующего подробного описания и формулы изобретения.
Краткое описание чертежей
[0075] Фигуры 1A-1E представляют собой серии схематических изображений биосовместимых макрокапсул, используемых в вакцинных композициях. Фигура 1A представляет собой схематическое изображение целой биосовместимой макрокапсулы, содержащей внутреннюю спираль (деталь J), на которой распределены аллогенные клетки, коннектор (деталь H) и крючок для извлечения (деталь I). Фигура 1B представляет собой подробное схематическое изображение внутренней спирали. Фигура 1C представляет собой подробное схематическое изображение коннектора. На фигуре 1D показана хирургическая нить, используемая для удержания биосовместимой макрокапсулы на месте после имплантации. Фигура 1E представляет собой подробное схематическое изображение разъема для загрузки/пробирки для транспортировки.
[0076] Фигура 2 представляет собой схему, показывающую способ двухкомпонентной вакцинации против злокачественных опухолей, описанный в настоящем описании (Onco-Maxi-Vax).
[0077] Фигура 3 представляет собой схему, показывающую способ терапевтической вакцинации против злокачественных опухолей, описанный в настоящем описании. По этому способу, суспензию отдельных клеток из аутологичных клеток опухолей перерабатывают, облучают и замораживают до подкожной инъекции. Подобным образом, биосовместимые макрокапсулы, содержащие иммуно-изолированные секретирующие GM-CSF аллогенные клетки, замораживают до имплантации. На время лечения, облученные аутологичные клетки опухолей инъецируют подкожно, и макрокапсулы имплантируют в сходной локализации. Подкожно имплантированные капсулы удаляют через 7 суток, в то время как облученные клетки опухолей разрушает иммунная система пациента. Этот способ включает множественные инъекции и приводит к индукции противоопухолевого иммунного ответа и потенциальной регрессии опухолей у подвергнутых лечению пациентов.
[0078] Фигура 4 представляет собой серию фотографий, показывающих эффект лечения MVX-ONCO-1 на метастазы в легких.
[0079] Фигура 5 представляет собой график, показывающий уменьшение уровня маркера Ca125 в сыворотке при невосприимчивом раке яичника на поздних стадиях после лечения MVX-ONCO-1.
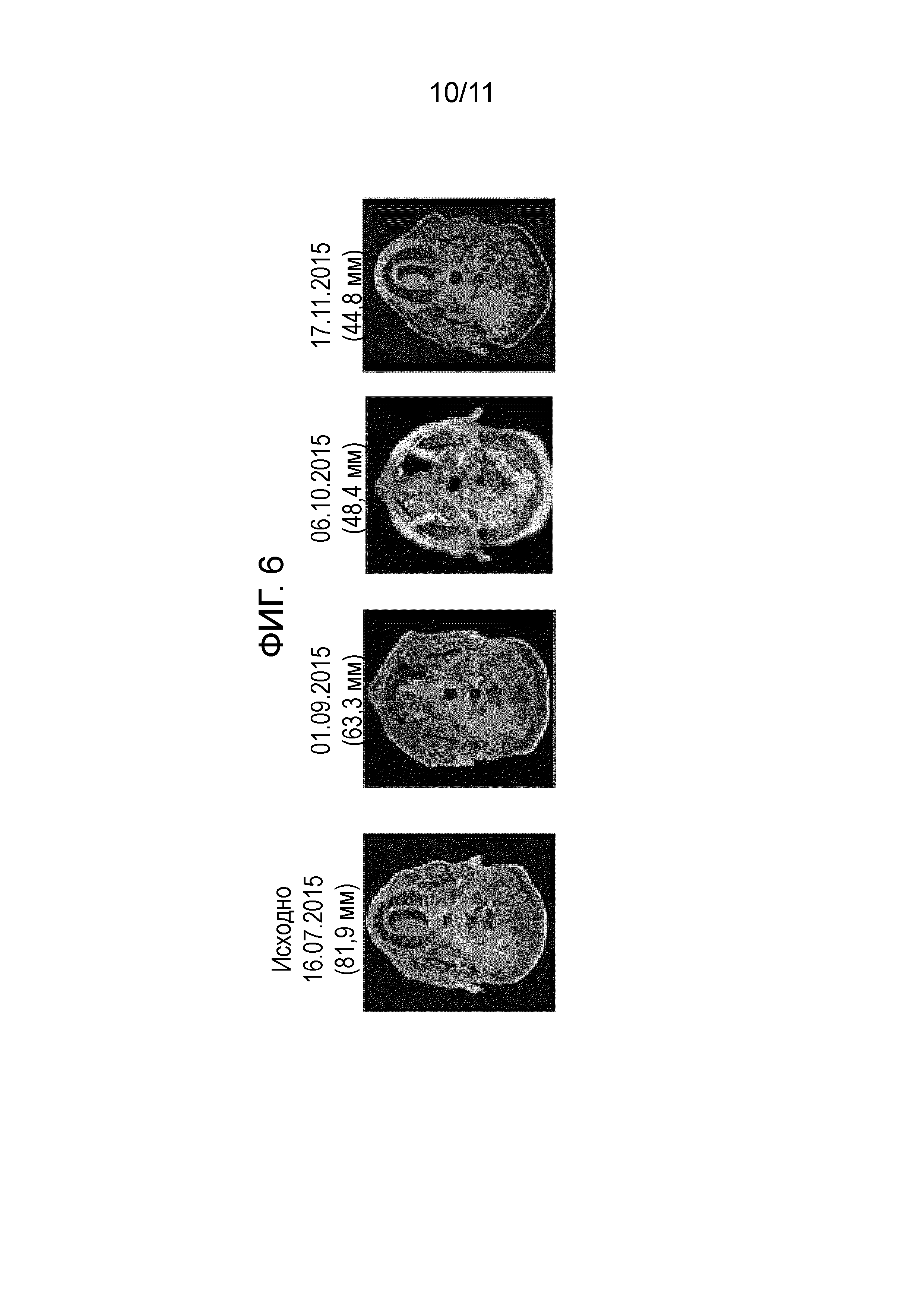
[0080] На фигуре 6 показаны результаты ЯМР до, во время и после лечения для пациента с невосприимчивой, рецидивирующей хордомой. Частичный ответ задокументирован и продолжается более чем 12 месяцев.
[0081] На фигуре 7 показаны результаты функционального анализа на основе клеток, проведенного для определения биологической активности GM-CSF, продуцированного линией клеток MVX-1.
Подробное описание
Определения
[0082] Термины «хозяин», «лицо», «пациент» и т.п. используют в настоящем описании взаимозаменяемо для обозначения относятся пациента, подвергаемого иммунизации.
[0083] В контексте настоящей заявки, следующие термины определяют следующим образом:
[0084] В рамках изобретения термины «иммуномодулятор» или «иммуномодулирующее средство» или т.п. относится к соединению или композиции, которые могут усиливать, увеличивать или уменьшать иммунный ответ на антиген или иммуноген. Одним из неограничивающих примеров иммуномодулятора является гранулоцитарно-макрофагальный-колониестимулирующий фактор (GM-CSF). Специалисту в данной области понятно, что любой другой пригодный иммуномодулятор(ы), известный в данной области, можно использовать в вакцинных композициях, описанных в настоящем описании.
[0085] «Иммуностимулирующее средство» или «иммуноактиватор» или т.п. представляет собой иммуномодулятор, который специфически усиливает или увеличивает иммунный ответ на антиген или иммуноген. Термин «иммуностимулирующее средство» или «иммуноактиватор» используют в настоящем описании как синоним термина «адъювант».
[0086] Клетки рассматривают как являющиеся «иммуно-изолированными», если, при введении хозяину, они являются физически защищенными от иммунного ответа хозяина, т.е., не присутствует значительного приобретенного или природного иммунного ответа против любых компонентов клеток, включая антигены клеточной поверхности, секретированные белки и т.д., при условии отсутствия физического контакта между клетками и эффекторами иммунной системы. Следовательно, значительного опосредованного антителами или клетками иммунного ответа на эти клетки не наблюдают в организме хозяина.
[0087] Иммуно-изолированные аллогенные клетки не подвергаются атаке или разрушению посредством иммунного ответа хозяина, поскольку они не поддаются детекции иммунной системой, что предотвращает любой иммунный ответ против них, и поскольку они физически защищены от любого иммунного ответа.
[0088] В рамках изобретения термины «инкапсуляция» или «инкапсулированный» или т.п. относятся к конкретным способам иммуно-изоляции клеток в биосовместимом устройстве (т.е., макрокапсуле или устройстве для терапии инкапсулированными клетками (ECT)), содержащем капсулу из материала, например, пластика, который является неиммуногенным для организма хозяина. Действие заключения клетки или популяции клеток в устройство с барьером, такое как биосовместимая макрокапсула, известно как макроинкапсуляция. Термины «капсула», «устройство», «макрокапсула» и т.п., применяют в настоящем описании взаимозаменяемо для обозначения макрокапсул, составляющих один из компонентов вакцинных композиций, описанных в настоящем описании.
Вакцинные композиции
[0089] Вакцинные композиции, описанные в настоящем описании, содержат два компонента: антигенный компонент и по меньшей мере одну извлекаемую биосовместимую макрокапсулу, содержащую аллогенные клетки, которые секретируют иммуномодулятор (т.е., GM-CSF), для применения в терапевтической и/или профилактической вакцинации. Предпочтительно, инкапсулированные клетки модифицируют для продукции иммуномодулятора, хотя предусмотрено также применение клеток и линий клеток, естественным образом продуцирующих иммуномодулятор.
[0090] Изобретение также относится к фармацевтическим композициям и наборам, которые можно использовать в этом контексте. Любые вакцинные композиции, фармацевтические композиции или наборы, описанные в настоящем описании, являются пригодными для применения в терапевтической и/или профилактической вакцинации. Подобным образом, любые вакцинные композиции, фармацевтические композиции, или наборы, описанные в настоящем описании, можно использовать в способах терапевтической и/или профилактической вакцинации.
[0091] Например, терапевтическая или профилактическая вакцинация может представлять собой терапевтическую или профилактическую вакцинацию против опухоли или злокачественной опухоли, или терапевтическую или профилактическую вакцинацию против одного или нескольких инфекционных агентов.
[0092] Продуцируемое иммуномодулирующее средство может представлять собой белок, синтезированный макроинкапсулированными аллогенными клетками, но оно может представлять собой также, например, компонент клетки, такой как липид, или экзогенную молекулу, дополнительно трансформированную клеткой, например, антигены, процессированные антигенпредставляющими клетками, или метаболиты. В одном варианте осуществления, иммуномодулирующее средство представляет собой huGM-CSF. Поскольку в способах иммунизации против злокачественных опухолей на основе клеток, антигены часто являются слишком слабыми для запуска значительного иммунного ответа, и известно, что некоторые молекулы, вовлеченные в этот ответ, усиливают или увеличивают его, иммуномодулирующее средство, предпочтительно, представляет собой иммуностимулирующее средство, которое может функционировать посредством привлечения антигенпредставляющих клеток (например, дендритных клеток) и которое может также стимулировать активность CD4 или CD8 T-клеток.
[0093] Особенно активные иммуностимулирующие средства принадлежат к семейству цитокинов. Пригодные цитокины включают в себя, но без ограничения, GM-CSF (гранулоцитарный и гранулоцитарно-макрофагальный стимулирующий фактор), IL-3, IL-4, IL-9, IL-1, IL-2, IL-7 (интерлейкин), трансмембранные рецепторы IFNγ, SCF (фактор стволовых клеток) растворимый или мембранный, FL (лиганд Flt3), G-CSF, так же как любые их комбинации. Предпочтительными иммуностимулирующими средствами являются GM-CSF (например, GM-CSF человека) и FL.
[0094] В контексте терапии злокачественных опухолей, GM-CSF является особенно рекомендуемым в качестве иммуностимулирующего средства, поскольку он был идентифицирован как наиболее активный цитокин для активации системного противоопухолевого иммунитета. (См. Dranoff et al, 1993, Proc Natl Acad Sci USA, 90(8):3539-43). Однако, GM-CSF также является эффективным в качестве иммуностимулирующего средства в вакцинации и терапии против инфекционного агента.
[0095] Для индукции адекватного иммунного ответа, может являться особенно преимущественной комбинация нескольких иммуномодулирующих средств, которые могут стимулировать различные пути. Например, одной из предпочтительных комбинаций является GM-CSF и FL. Однако, можно использовать также любые другие комбинации двух или более иммуномодулирующих средств. Определение пригодных комбинаций находится в компетенции обычного специалиста в данной области.
[0096] Иммуно-изоляция преодолевает значительные недостатки, ассоциированные с использованием отрицательных по HLA клеток, таких как линия клеток K-562. Поскольку инкапсулированные клетки полностью защищены от иммунной системы, они не разрушаются посредством врожденного или клеточного иммунитета, в отличие от неинкапсулированных клеток K-562, затрагиваемых отторжением из-за врожденного иммунитета. Способность макроинкапсулированных клеток выживать, секретировать белок в течение длительного периода времени и позволять множественные иммунизации напрямую связана с физическим барьером макрокапсулы. Кроме того, уровень и длительность высвобождения GM-CSF у пациента после имплантации капсулы, маловероятно отличается у одного индивидуума от другого, в зависимости от его или ее врожденного иммунитета или иммуносупрессии. В отличие от этого, когда используют не являющиеся иммуно-изолированными клетки (т.е., секретирующие GM-CSF клетки K-562), стабильность высвобождения GM-CSF, вероятно, может значительно меняться как у любого данного пациента между первой и последующими иммунизациями, так и от одного пациента к другому.
[0097] Предпочтительным способом иммуно-изоляции клеток является обеспечение физического барьера, «скрывающего» их от общей иммунной системы, чего можно достигать посредством устройства с барьером, такого как биосовместимая макрокапсула, обладающая сердцевиной, содержащей клетки, и внутренней спиралью с распределенными на ней клетками, окруженными полупроницаемой мембраной.
[0098] Иммуно-изоляция секретирующих иммуномодулятор клеток преодолевает значительные недостатки, ассоциированные с имплантацией свободных клеток, которая, как правило, требует иммуносупрессирующих лекарственных средств, чтобы защищать их от иммунной системы хозяина. Посредством механического блокирования иммунных атак, применение устройств с барьерами, таких как макрокапсулы, исключает необходимость иммуносупрессивной терапии. Кроме того, если желательно, клетки можно легко извлекать после определенного периода времени, что позволяет переключаемое высвобождение иммуномодулирующего средства. Посредством извлечения имплантированного устройства, высвобождение средства останавливают, что предотвращает нежелательное присутствие молекулы по окончании процесса иммунизации.
[0099] Устройства с барьерами, такие как биосовместимые макрокапсулы, используемые в вакцинных композициях, описанных в настоящем описании, отделяют живые клетки от иммунной системы хозяина посредством синтетической, избирательно проницаемой, неиммуногенной мембраны. Применение полупроницаемой мембраны позволяет свободный обмен питательными веществами, белками, кислородом и биотерапевтическими веществами между внешним и внутренним пространством. Малые молекулы (например, молекулы, необходимые для выживаемости клеток) могут проходить через поры в мембране макрокапсулы, в то время как высокомолекулярные вещества, такие как иммуноциты или антитела, исключаются. Мембрана исключает также воспалительные клетки и, таким образом, защищает инкапсулированные клетки от отторжения тканью.
[0100] И наоборот, иммуномодулирующие средства, продуцируемые клетками, можно доставлять через поры во внешнюю среду. Диаметр пор предпочтительно выбирают в таком диапазоне, что малым молекулам или белкам и иммуномодуляторам позволяют пересекать барьер, и что более крупным молекулам, подобным иммуноглобулинам, не позволяют, чтобы устройство сохраняло свои иммунопротективные свойства.
[0101] Капсулы могут обладать различными формами и размерами. Конкретно, капсула может обладать любой конфигурацией, пригодной для поддержания биологической активности и обеспечения доступа для доставки продукта или функции, включая, например, цилиндрическую, прямоугольную, дискообразную, имеющую форму пластыря, овальную, звездчатую или сферическую. Если капсула предназначена для извлечения после ее имплантации, конфигурации, имеющие тенденцию к миграции капсулы от участка имплантации, такие как сферические капсулы, достаточно небольшие, чтобы передвигаться в кровеносных сосудах реципиента-хозяина, не являются предпочтительными. Конкретные формы, такие как прямоугольники, пластыри, диски, цилиндры, и плоские листы, обеспечивают большую структурную целостность и являются предпочтительными, когда извлечение является желательным. В одном варианте осуществления, макрокапсула имеет цилиндрическую форму.
[0102] Полупроницаемая мембрана устройств, описанных в настоящем описании, изготовлена из избирательно проницаемой, иммунопротективной мембраны или из мембраны для ультрафильтрации, или мембраны для микрофильтрации. Специалисту в данной области известно, что полупроницаемая мембрана, как правило, имеет медианный размер пор приблизительно 100 нм. В других вариантах осуществления, полупроницаемая мембрана может быть изготовлена из непористого материала для мембраны (например, гидрогеля или полиуретана).
[0103] Различные полимеры и смеси полимеров можно использовать для изготовления окружающей полупроницаемой мембраны, включая полисульфоны (включая полиэфирсульфоны (PES)), полиакрилаты (включая акриловые сополимеры), поливинилидены, сополимеры поливинилхлорида, полиуретаны (включая термопластичный полиуретан), полистиролы, полиамиды, ацетаты целлюлозы, нитраты целлюлозы, полифосфазены, полиакрилонитрилы, хлорид сополимера(акрилонитрила/винила), так же как их производные, сополимеры и смеси. В качестве неограничивающего примера, полимеры для капсулы представляют собой полые волокна из термопластичного полиэфирсульфона (PES) (OD:720 мкм; ID:524 мкм, отсекаемые молекулярные массы: 32 и 80 кДа; Akzo Nobel Faster AG, Wupperthal, Germany) и полимер AN-69 (анионный сополимер акрилонитрила и металлилсульфоната натрия, Hospal R&D Int, Meyzieu, France).
[0104] В любой из макрокапсул, описанных в настоящем описании, номинально отсекаемая молекулярная масса (MWCO) полупроницаемой мембраны составляет 500 кДа. В некоторых вариантах осуществления, MWCO составляет приблизительно 280 кДа.
[0105] Тестировали несколько различных видов толщины мембраны с несколькими размерами пор (например, PES5, UltraPES 0.8, и UltraPES 0.7). В конечном счете, UltraPES0.7 (Membrana GmbH, Wuppertal, Germany) выбрали для применения в клинических исследованиях. Подобным образом, тестировали также различную длину капсул, и 12 мм выбрали в качестве наилучшего размера для способов имплантации, манипуляции, изготовления и загрузки клеток.
[0106] Предпочтительно, толщина полупроницаемой мембрана составляет между приблизительно 90-120 мкм. Любому из устройств, описанных в настоящем описании, можно придавать конфигурацию цилиндра, полого волокна или плоского листа. Длина устройства может составлять между приблизительно 4 мм - 15 мм. В некоторых вариантах осуществления, устройство обладает внутренним диаметром между приблизительно 0,9 мм и 1-1,2 мм. Концы устройства можно герметично закрывать с использованием коннектора или метилметакрилата.
[0107] В некоторых вариантах осуществления, для макроинкапсуляции применяют предварительно сформированные макрокапсулы, сформированные из мембраны, разработанной для подкожной имплантации. Эти макрокапсулы содержат также трубку для извлечения, которую располагают между дермой и подкожным слоем. В некоторых вариантах осуществления, трубка для извлечения изготовлена из полимера медицинской квалификации (включая термопластичный полиуретан, полиэтилен низкой и высокой плотности, PEEK, поликарбонат-уретан и/или термопластичные эластомеры).
[0108] На конце, ближнем к терапевту (т.е., дальним от мембраны), трубка для извлечения обладает страховочным крючком (также обозначаемым как крючок для извлечения), который можно использовать для облегчения извлечения капсулы после имплантации. Предпочтительно, крючок для извлечения обладает отверстием на одном конце и обладает двумя ножками на другом конце для облегчения прикрепления внутри трубки для извлечения. В качестве неограничивающего примера, крючок для извлечения изготовлен из нержавеющей стали медицинской квалификации (т.е., из сплавов нержавеющей стали 316LVM, 316L, 302 и/или 304). Крючок для извлечения можно прикреплять с использованием любых пригодных способов, известных в данной области. В качестве неограничивающего примера, его можно прикреплять с использованием отверждаемого ультрафиолетовым излучением (УФ) клея, и/или хирургическую нить можно продевать через отверстие в крючке для извлечения, который остается снаружи кожи после имплантации макрокапсулы.
[0109] Коннектор можно использовать для облегчения соединения мембраны макрокапсулы с трубкой для извлечения. В качестве неограничивающего примера, коннектор из нержавеющей стали можно приклеивать к мембране. В некоторых вариантах осуществления, конец коннектора, который вставляют в мембрану, предпочтительно, имеет конец конической формы (например, в форме усеченного конуса).
[0110] Макрокапсулы содержат внутреннюю спираль, изготовленную из металла медицинской квалификации, например, такого как алюминий или титан, которую можно вставлять в усеченный конический конец коннектора. Эта внутренняя спираль обеспечивает хорошее упорядочивание клеток внутри капсулы, конкретно, равномерное распределение, и предотвращает агглютинацию на стенках. Внутренняя спираль может также предотвращать агрегацию клеток и улучшать распределение клеток внутри устройства. (См. Публикацию PCT No. WO 96/02646).
[0111] Пригодные внутренние спирали могут обладать определенным количеством витков на сантиметр. Например, спираль можно получать из исходных материалов (Hefaeus Materials), растянутых для формирования усиленной пружины, обладающей конкретным расстоянием между витками (например, 1 мм±0,1 мм). (См. фигуру 1B).
[0112] После формирования внутренней спирали, мембрану надвигают на усиленную пружину (т.е., внутреннюю спираль) и герметично прикрепляют к трубке для извлечения с использованием отверждаемого УФ клея. В одном варианте осуществления, мембрану помещают приблизительно на 2 мм в полиуретановую сердцевину и приклеивают непосредственно перед усеченным коническим концом коннектора. В других вариантах осуществления, всю трубку для извлечения заполняют клеем для прикрепления мембраны.
[0113] В пустые макрокапсулы можно загружать внутреннюю спираль, например, с использованием разъема для загрузки (например, BD Vasculon™ или BD Insyte-W™ 0,9 мм×25 мм), стерилизованного этиленоксидом (EO). Этот разъем для загрузки прикрепляют к мембране, например, с использованием отверждаемого УФ клея. В некоторых вариантах осуществления, разъем для загрузки обладает усеченным коническим концом, вставленным с притиранием в ближний к мембране конец коннектора.
[0114] Пробирку для транспортировки можно модифицировать из 14 мл пробирки Falcon посредством просверливания одного или нескольких отверстий в корпусе пробирки и в крышке устройства. Специалистам в данной области понятно, что эти отверстия должны соответствовать мембране после вставки для обеспечения хорошей стерилизации EO. Винтовое соединение Люэра можно вставлять в крышку и притирать. Затем разъем для загрузки можно вставлять с подгонкой в крышку с винтовым соединением Люэра. Укомплектованные пробирки для транспортировки затем стерилизуют и возвращают в стерильные пакеты, упакованные индивидуально.
[0115] Макрокапсулы могут обладать различным размером в диапазоне от нескольких микрометров до трех-четырех сантиметров. В зависимости от размера капсулы и размера клеток, так много, как 200000 клеток, можно загружать в 1 см устройство. В некоторых вариантах осуществления, устройство обладает цилиндрической формой и длиной приблизительно 12 мм. Специалист в данной области способен определять оптимальную конфигурацию (т.е., форму, размер, длину, количество клеток и т.д.) для макрокапсул, используемых в вакцинных композициях, описанных в настоящем описании, без какого-либо излишнего экспериментирования.
[0116] Пригодные аллогенные клетки для применения в макрокапсулах, описанных в настоящем описании, можно получать из рабочего банка клеток, содержащего 5×106 клеток/аликвоту, сохраняемых в жидком газе. Эти клетки размораживают перед использованием и культивируют в течение 2-3 пассажей в полной среде RPMI 1640 с 10% FBS, пенициллином/стрептомицином и G418 (селективным антибиотиком), чтобы убедиться, что клетки секретируют GMCSF. Затем приблизительно 800000 клеток ресуспендируют в 30 мкл полной среды, и все 30 мкл затем загружают в каждую капсулу с использованием давления стерильного воздуха. Затем трубку для извлечения разрезают для удаления разъема для загрузки, и конец трубки для извлечения герметично закрывают с использованием отверждаемого УФ клея.
[0117] Затем капсулу промывают в полной среде (асептически) и инкубируют в 6-луночном планшете с асептической полной средой (приблизительно 3-5 мл среды).
[0118] Макрокапсулы могут содержать между 1×105 аллогенных клеток и 1×106 аллогенных клеток (например, 8×105 клеток) на капсулу. Эти клетки, содержащиеся внутри сердцевины макрокапсулы, распределены на внутренней спирали внутри макрокапсул, и окружены полупроницаемой мембраной.
[0119] Перед культивированием, можно проводить стадию контроля безопасности/качества (QC). Целью этой стадии QC безопасности является оценка микробиологического «статуса», «статуса» микоплазмы и LAL/эндотоксинов в клетках. Микробиологическую оценку и оценку микоплазмы проводят посредством отбора образцов супернатанта и культивирования их на селективном агаре. LAL/эндотоксины также оценивают количественно в образце супернатанта, но посредством реакции с бактериальным эндотоксином и/или липополисахаридом.
[0120] После 7 суток культивирования, в супернатанте измеряют секрецию GM-CSF. Предпочтительно, устройства секретируют по меньшей мере 20 нг/капсулу/сутки. Как правило, секретируется между приблизительно 50-150 нг/капсулу/сутки. Таким образом, заявленные макрокапсулы являются способными к длительной доставке низких доз иммуностимулирующего средства (т.е., GM-CSF).
[0121] Тестировали несколько концентраций клеток внутри макрокапсул (например, 5, 8, 10 и 15×105 клеток). 8×105 клеток представляла собой выбранную концентрацию, поскольку она обеспечивает наилучшую длительную стабильность для длительного высвобождения с минимальной изменчивостью.
[0122] После изготовления, устройства макрокапсул можно подвергать криоконсервированию перед использованием, с использованием любых способов, известных в данной области. Например, в некоторых вариантах осуществления, криоконсервирование проводят в паровой фазе жидкого азота.
[0123] Иммуно-изолированные аллогенные клетки, используемые в вакцинных композициях, описанных в настоящем описании, являются живыми и предпочтительно, предоставляют выбранное иммуномодулирующее средство на длительной основе (например, в течение по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более суток). В одном варианте осуществления, иммуно-изолированные клетки секретируют иммуномодулирующее средство в течение периода по меньшей мере 7 суток.
[0124] Иммуно-изолированные аллогенные клетки либо могут естественным образом продуцировать иммуномодулирующее средство, либо их можно генетически модифицировать для экспрессии иммуномодулирующего средства. Посредством генетической модификации клетки, которая в норме не продуцирует иммуномодулирующее средство, вакцинные композиции не ограничены теми клетками, которые продуцируют его естественным образом. Пригодные иммуномодулирующие средства не являются ограниченными природными иммуномодулирующими средствами, поскольку известно, что мутантные белки иногда проявляют улучшенную активность. Таким образом, иммуномодулирующее средство может представлять собой модифицированный вариант белка вместо белка дикого типа. В некоторых случаях, клетки генетически модифицируют для секреции растворимого варианта мембранного белка, чтобы обеспечить его секрецию.
[0125] Кроме того, посредством генетической модификации клеток, является также возможным контролировать уровень экспрессии иммуномодулирующего средства. Одной из особенно привлекательных ситуаций является сверхэкспрессия средства посредством клонирования его последовательности под контролем промотора, как известно, очень сильного в используемой клетке. Таким образом, модифицированные клетки становятся сконструированными фабриками, продуцирующими высокие уровни иммуномодулирующего средства. Промотор можно выбирать в соответствии с его активностью, чтобы иметь контролируемый уровень экспрессии иммуномодулятора. В другом варианте осуществления, можно использовать клетки, естественным образом содержащие ген иммуномодулирующего средства, где ген является транскрипционно молчащим в этой конкретной клетке. В этой ситуации, транскрипцию можно активировать посредством вставки подходящих регуляторных последовательностей, например, посредством гомологичной рекомбинации. Можно использовать также индуцируемые регуляторные последовательности, отвечающие на специфические стимулы, такие как вещества, свет и т.д.
[0126] В некоторых вариантах осуществления, секретирующие иммуномодулирующее средство клетки могут секретировать более, чем 10 нг/106 клеток/24 час иммуномодулирующего средства (например, GM-CSF). Например, клетки могут секретировать количество иммуномодулирующего средства, равное или превосходящее 100 нг/106 клеток/24 час, или более чем 500 нг/106 клеток/24 час. Можно использовать аллогенные клетки, секретирующие более чем 10×10-15 г иммуномодулирующего средства за 24 час или более чем 100×10-15 г/24 час иммуномодулирующего средства. Например, можно использовать клетки, секретирующие между 80 и 960×10-15 г/24 час или более чем 500×10-15 г/24 час иммуномодулирующего средства. Устройства, описанные в настоящем описании, могут секретировать по меньшей мере 20 нг/капсулу в сутки. Например, устройства могут секретировать между 50-150 нг/капсулу/сутки (например, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145 или 150 нг/капсулу/сутки).
[0127] При необходимости, несколько капсул (например, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) можно имплантировать одновременно для достижения желательного уровня секреции.
[0128] Любой способ генетической модификации, известный в данной области, можно использовать для генетической модификации иммуно-изолированных аллогенных клеток. Например, можно использовать сконструированные плазмиды, введенные посредством трансфекции, и вирусы, введенные посредством инфекции. Можно использовать ретровирусы, поскольку их можно сконструировать для введения гена, кодирующего иммуномодулирующее средство, в геном клетки-хозяина.
[0129] Пригодные аллогенные клетки не являются ограниченными клетками, естественным образом продуцирующими представляющее интерес иммуномодулирующее средство. Вместо этого, можно использовать множество клеток. Предпочтительно, клетки легко поддаются трансдукции или трансфекции, культивированию и размножению. В любых вакцинных композициях, описанных в настоящем описании, не обязательно использовать клетки опухолей в качестве посторонних клеток, продуцирующих иммуномодулятор. Специалисты в данной области могут использовать различные типы клеток например, такие как иммортализованные не происходящие из опухолей фибробласты, миобласты, клетки опухолей, эндотелиальные клетки, фибробласты или клетки гематопоэтического происхождения. Определение подходящего типа клеток находится в компетенции обычного специалиста в данной области.
[0130] Из производственных соображений, можно использовать неадгерентные клетки (исключая фибробласты или эпителиальные клетки), которые можно легко хранить замороженными. Из соображений безопасности, тестировали только клетки с уровнем биобезопасности 1. Пять различных линий клеток тестировали по их способности подвергаться инкапсуляции: CCL243, CCL246, CCL246,1, TIB202 и CRL1582. CCL243 (клетки гематопоэтического происхождения) выбрали в итоге и затем генетически модифицировали для экспрессии huGM-CSF. MVX-1 представляет собой линию клеток, полученную посредством клонирования отдельной клетки из генетически модифицированной линии клеток CCL243. Капсулы, нагруженные клетками MVX-1, выбрали по их способности эффективно подвергаться замораживанию для длительного хранения вплоть до 18 месяцев (т.е., вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 месяцев). GM-CSF, продуцированный линией клеток MVX-1, по-видимому, является эквивалентным коммерчески доступному GM-CSF в функциональном анализе на основе клеток. (См. пример 6, ниже).
[0131] В некоторых вариантах осуществления, аллогенные клетки представляют собой бессмертные или иммортализованные линии клеток, которые можно генетически модифицировать один раз и использовать для всех композиций и способов, описанных в настоящем описании. Поскольку клетки являются иммуно-изолированными внутри биосовместимой макрокапсулы, они не подвергаются опасности со стороны иммунной системы хозяина, и использование иммортализованных клеток не подвергает опасности другие клетки поблизости от них.
[0132] Важно, поскольку клетки являются макроинкапсулированными, можно использовать аллогенные или гетерологичные клетки. Таким образом, не является необходимым использовать аутологичные клетки. Клетки, используемые в вакцинных композициях, предпочтительно, представляют собой клетки человека.
[0133] Специалисту в данной области понятно, что иммуно-изоляция клеток внутри биосовместимой макрокапсулы является преимущественной, поскольку источник иммуномодулирующего средства не является ограниченным уникальным индивидуумом.
[0134] Поскольку аллогенные клетки внутри макрокапсул являются живыми, иммуномодулятор продуцируется непрерывно, в течение по меньшей мере нескольких (например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более) суток.
Имплантация
[0135] Криоконсервированные капсулы размораживают и культивируют в течение по меньшей мере 7 суток до имплантации. В течение суток 1-4 культивирование происходит в полной среде, в то время как в течение суток 5-7 культивирование происходит в неполной среде, лишенной пенициллина и стрептомицина. Затем капсулы анализируют по секреции GM-CSF на сутки 7. До имплантации, капсулу поддерживают в инкубаторе и помещают в 15 мл пробирку Falcon с неполной средой, и транспортируют до операционной или помещения для имплантации.
[0136] Определение подходящего способа имплантации находится в компетенции обычного специалиста в данной области.
[0137] В качестве неограничивающего примера, пациентам можно вводить местный анестетик до имплантации. Медицинские работники могут прикреплять петлю из хирургической нити для извлечения (например, петлю из полиамидной хирургической нити) к крючку для извлечения и использовать иглу 14 калибра для введения катетера (например, катетера 14 калибра B Braun Vasofit). Затем капсулу вставляют в катетер и устройство для ввдения используют для продвижения капсула вниз по цилиндру катетера. Затем катетер удаляют, но устройство для введения используют для обеспечения того, чтобы капсула оставалась на месте под кожей во время удаления.
[0138] Иммуно-изолированные аллогенные клетки имплантируют на несколько суток, например, менее чем на 12 суток (например, менее чем на 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 суток), например, между 4 и 10 сутками, например, между 5 и 7 сутками. Имплантация иммуно-изолированных аллогенных клеток на такой короткий период не приводит к заметному фиброзу, индуцируемому высвобождением иммуномодулирующего средства. Кроме того, воспаление в участке вакцинации и/или вокруг макрокапсулы, не индуцирует уменьшение жизнеспособности клеток внутри капсулы, и, таким образом, не предотвращает продукцию и высвобождение иммуномодулирующего средства в этих временных рамках.
[0139] Макрокапсулы можно облучать, например, посредством рентгеновского излучения, до имплантации. Облучение обеспечивает то, что даже если произойдет повреждение капсулы, заключенные клетки являются неспособными к размножению. Более того, облучение обеспечивает то, что секреция иммуномодулирующего средства прекратится через приблизительно 10 суток, из-за индуцированной облучением гибели клеток. Это, в свою очередь, может являться преимущественным, если секретируемое иммуномодулирующее средство вызывает сильный воспалительный ответ. Конкретно, подкожная имплантация макроинкапсулированных секретирующих GM-CSF иммуно-изолированных аллогенных клеток может индуцировать некроз кожи при имплантации на период, превышающий от 15 суток до 1 месяца. Облучение капсулы или клеток до имплантации не предотвращает последующее извлечение капсулы.
[0140] В конкретных вариантах осуществления, две капсулы имплантируют пациенту, на удалении приблизительно 5-15 мм (т.е., на удалении 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 мм). Важно, что из-за характерного механизма действия способов терапии, описанных в настоящем описании, имплантация не должна происходить поблизости от опухоли. Выбор подходящей локализации и расстояния друг от друга для капсул находится в компетенции обычного специалиста в данной области.
[0141] Когда капсулы имплантированы пациенту, их можно закреплять с использованием пластыря, такого как стерильный пластырь, для предотвращения их движения от участка имплантации. Имплантированные капсулы с хирургической нитью, выступающей из кожи пациента, закрывают прозрачным пластырем для мониторирования участка вакцинации.
MVX-ONCO-1
[0142] Любые вакцинные композиции, фармацевтические композиции или наборы, описанные в настоящем описании, можно использовать в контексте терапии злокачественных опухолей или в способе терапии злокачественных опухолей. Этот продукт обозначен «MVX-ONCO-1», который представляет собой терапевтический продукт (терапевтическую вакцину), изготовленную из двух компонентов, находящихся в непосредственной близости во время иммунизации.
[0143] Одним из компонентов системы MVX-ONCO-1 является источник антигенов опухоли (т.е., антигенный компонент), который получен из облученных аутологичных клеток, собранных от пациента, подлежащего лечению, и является специфическим для каждого пациента. Предпочтительно, ткань пациента отбирают у необлученных пациентов. Перед использованием, патолог может подтверждать, что вырезаны клетки опухоли или злокачественной опухоли. Для солидных опухолей, вырезают приблизительно 5-10 г (например, 5, 6, 7, 8, 9 или 10 г) ткани.
[0144] В одном варианте осуществления, один компонент содержит между приблизительно 1×106 и приблизительно 1×107 аутологичных клеток опухолей (например, приблизительно 4×106 аутологичных клеток опухолей). Для обеспечения максимального воздействия антигена, источник антигена получают из собственных клеток опухолей каждого пациента, которые можно получать посредством биопсии, хирургии или пункции.
[0145] Для плеврального выпота (или других жидких образцов), собирают приблизительно 1 литр, и жидкие образцы центрифугируют, промывают в буфере (т.е., сбалансированном солевом растворе Хенкса), и клетки подсчитывают.
[0146] Для солидных образцов, коллагеназу IV квалификации GMP можно использовать для расщепления ткани. Механическое расщепление с использованием скальпеля можно, альтернативно или дополнительно, использовать, чтобы разрезать ткань на мелкие фрагменты. Полученные фрагменты ткани затем помещают в пластиковый пакет и дополнительно расщепляют посредством механического давления с использованием лабораторного измельчителя с лопастями или лезвиями.
[0147] Затем расщепленные фрагменты ткани распределяют в 50 мл пробирки Falcon и центрифугируют. Супернатант отбрасывают, и осадок промывают буфером, не содержащим Ca2+ и Mg2+, для инактивации коллагеназы, активность которой требует присутствия двухвалентных катионов. Затем осадок ресуспендируют и фильтруют через сито 70 мкм, позволяющее прохождение отдельных клеток. Затем клетки снова осаждают, и клетки подсчитывают. Специалисту в данной области известно, что можно также проводить тестирование жизнеспособности клеток с использованием трипанового синего.
[0148] Клетки, полученные из образца жидкости или солидной опухоли, расщепляют для получения суспензии клеток и затем облучают при 10000 рад (т.е., 15-150 грей (Гр)) перед хранением в аликвотах в жидком азоте. Облучение проводят в качестве меры безопасности для предотвращения любого роста клеток опухолей, повторно инъецируемых пациентам. Летально облученные клетки опухолей можно замораживать для длительного хранения вплоть до 12 месяцев (т.е., вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, или 12 месяцев).
[0149] Когда способ вакцинации используют в области онкологии, антигенный компонент представляет собой цельную клетку опухоли. Поскольку некоторые антигены присутствуют на множестве опухолей из одной и той же линии, клетки опухолей могут представлять собой аллогенные клетки. Однако, клетки опухолей являются аутологичными по отношению к пациенту.
[0150] Облученные аутологичные клетки можно аликвотировать на подходящие дозы для однократной вакцинации. Предпочтительно, резерв супернатанта сохраняют для микробиологического скрининга, скрининга микоплазмы и/или эндотоксинов. Затем индивидуальные аликвоты можно подвергать криоконсервированию в диметилсульфоксиде (DMSO). До имплантации, DMSO можно отмывать, и можно получать суспензию в малом объеме. В качестве неограничивающего примера, можно получать раствор 4×106 клеток в 500 мкл HBSS.
[0151] Другим компонентом MVX-ONCO-1, который является общим для всех пациентов, является источник иммуномодулятора. Этот компонент содержит по меньшей мере одну извлекаемую биосовместимую макрокапсулу, содержащую иммуно-изолированные аллогенные клетки, секретирующие иммуномодулятор. В одном варианте осуществления, макрокапсулы содержат между приблизительно 1×105 и приблизительно 1×106 иммуно-изолированных аллогенных клеток (например, приблизительно 8×105 клеток), секретирующих по меньшей мере 20 нг/24 часа GM-CSF (например, 20-500 нг/24 часа) В различных вариантах осуществления, иммуно-изолированные аллогенные клетки секретируют 20, 30, 40, 50, 60 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, или более нг/24 часа GM-CSF).
[0152] В вакцинной композиции MVX-ONCO-1, инкапсулированные клетки являются генетически модифицированными для секреции иммуностимулирующих молекул (например, GM-CSF) и функционируют в качестве иммуно-изолированного биореактора, который продуцирует и секретирует сильные иммуностимулирующие сигналы в участке вакцинации. В настоящее время, GM-CSF является наиболее активной иммуностимулирующей молекулой для получения противоопухолевых иммунных ответов. Таким образом, инкапсулированные клетки могут являться генетически модифицированными для секреции только GM-CSF. Однако, в зависимости от исследований синергизма, другие иммуномодулирующие молекулы можно без труда добавлять к или вместо GM-CSF. Например, другие цитокины, такие как IL-12, IL-15, IL-4, интерферон-гамма, хемокины или факторы роста дендритных клеток, IL-3, IL-9, IL-1, IL-2, IL-7, трансмембранные рецепторы IFNγ, фактор стволовых клеток (SCF) растворимый или мембранный, FL (лиганд Flt3), G-CSF, TLR7, агонисты TIM-3, GITR, TIM-3 GITR, LAG-3, Vista, BTLA, ICOS, OX40, CD40, CD137 (также известный как 41BB), CD27 и любую их комбинацию (комбинации) можно добавлять к или вместо GM-CSF.
[0153] Два компонента вакцинных композиций против злокачественных опухолей, описанных в настоящем описании, помещают под кожу пациента в непосредственной близости или контакте. Например, раствор, содержащий облученные аутологичные клетки, можно имплантировать между двумя макрокапсулами. В некоторых вариантах осуществления, компоненты имплантируют в участках, отдаленных от первичной опухоли или метастазов, чтобы осуществлять вакцинацию в не возбужденной иммунологически локализации. Однако, в некоторых вариантах осуществления, можно также вводить вакцинную композицию поблизости от опухоли.
[0154] Через пять-семь суток после имплантации, капсулу удаляют, например, с использованием прикрепленных к ней крючка, страховки или нити. Антигенный компонент не извлекают. Вместо этого, он постепенно подвергается процессингу и удалению иммунной системой пациента посредством естественных механизмов.
[0155] Лечение вакцинацией с использованием Onco-Maxi-Vax включает повторяющиеся иммунизации. Важно поддерживать гибкое расписание вакцинации. Например, вакцинную композицию можно вводить подкожно в течение 4 недель с последующими двумя дополнительными иммунизациями каждые две недели. Повторяющиеся иммунизации можно осуществлять в одной и той же или в сходных локализациях в организме пациента. В одном способе, применяют четыре различных участка имплантации (например, оба плеча и оба бедра), и имплантацию вакцины в каждом участке чередуют в ходе лечения.
[0156] При применении для терапии злокачественных опухолей, дозу аутологичных клеток опухолей можно корректировать в зависимости от количества клеток, собранных от пациентов. Рекомендовано иметь приблизительно 106-107 клеток на иммунизацию плюс клетки, необходимые для тестирования (т.е., 28×106). Определение и/или корректировка дозы аутологичных клеток опухолей находится в компетенции обычного специалиста в данной области.
[0157] В некоторых вариантах осуществления, клетки опухолей, являющиеся источником антигенного компонента, и иммуно-изолированные аллогенные клетки, являющиеся источником иммуномодулирующего компонента, являются различными, что обеспечивает преимущество над предшествующими способами вакцинации, поскольку нет необходимости подвергать клетки опухолей манипуляциям, отличных от сбора и/или облученния.
[0158] Эту противоопухолевую иммунизацию можно проводить для широкого диапазона клеток опухолей. Как обсуждают выше, инкапсулированные иммуно-изолированные аллогенные клетки являются идентичными для каждого пациента. Однако, антигенный компонент является уникальным для пациента и может быть получен из клеток опухолей, которые можно собирать из солидной первичной опухоли, из метастаза и/или жидкости, содержащей клетки опухолей (плевральной жидкости, перитонеальной жидкости, костного мозга или крови).
[0159] В клинической онкологии, у большинства пациентов присутствует первичная опухоль или очаг метастазирования. Однако, не все опухоли или метастазы одинаково легко перерабатывать. Таким образом, для типа опухоли, подвергаемого тестированию, необходимо соответствие различным критериям в отношении осуществимости. Злокачественные опухоли, вероятно, обладающие первичной опухолью, которую можно собирать, включают в себя, но без ограничения: опухоль центральной нервной системы, такую как глиобластома; опухоль легкого (немелкоклеточный рак легкого); опухоль предстательной железы; карциному желудка; карциному молочной железы; лимфому; карциному поджелудочной железы; гепатокарциному (опухоль печени); карциному ободочной кишки; почечноклеточный рак; карциному яичника; карциному матки; саркому (мягких тканей); лейкоз (лимфатических узлов или крови); и/или множественную миелому (крови, костного мозга, лимфатических узлов, мягких тканей).
[0160] Злокачественные опухоли, вероятно, обладающие метастазами, которые можно собирать, зависят от локализации метастазов. По техническим причинам, более сложно собирать метастазы в костях, чем в других локализациях. Эти злокачественные опухоли могут включать, но без ограничения: карциному головы и шеи (метастазы в лимфатических узлах); рак легкого (метастазы в легких, печени, мягких тканях, головном мозге; метастазы в надпочечниках); предстательной железы (метастазы не в костях); карциному молочной железы (метастазы в легких, печени, мягких тканях, плевральной жидкости); карциному желудка (метастазы в печени); карциному поджелудочной железы (метастазы в печени); карциному ободочной кишки (метастазы в печени); меланому (метастазы в легких, лимфатических узлах, мягких тканях, печени, головном мозге); почечноклеточный рак (метастазы в легких, печени); карциному яичника (метастазы в перитонеальной или плевральной жидкости, печени); герминому (метастазы в легких); и/или карциному мочевого пузыря (метастазы в печени, лимфатических узлах).
[0161] Любые из вакцинных композиций, фармацевтических композиций и наборов, описанных в настоящем описании, можно использовать для терапевтической иммунизации против злокачественных опухолей или в способе терапии злокачественных опухолей. В качестве неограничивающего примера, злокачественные опухоли, подвергаемые лечению, могут включать, но без ограничения: рак легкого, меланому, рак молочной железы, рак ободочной кишки, рак поджелудочной железы, рак почки, острый лейкоз, хронический лейкоз, глиобластому, лимфомы низкой степени злокачественности, лимфомы высокой степени злокачественности, множественную миелому, саркому, злокачественную опухоль кости, опухоль мозга, рак желудка, рак пищевода, рак головы и шеи, рак щитовидной железы, рак мочевого пузыря, рак предстательной железы, рак яичника, рак тела матки, хордому и рак шейки матки.
[0162] После вакцинации, прогрессирование опухоли можно мониторировать с использованием любого способа, известного в данной области. Например, визуализацию, такую как сканирование CT, можно использовать для регистрации любых изменений объема опухоли на основании подтвержденных инструментов, таких как критерии оценки ответа солидных опухолей (RECIST) или иммуноопосредованные критерии ответа (irRC). Подобным образом, можно мониторировать серологические маркеры опухоли, включая, но без ограничения, CA 153, CA19-9, CEA, AFP, NSE, CA 125.
[0163] Когда возможно, предпринимают попытки хирургического удаления метастазов, чтобы задокументировать любые изменения структуры опухоли. Подробно описано, что классическая оценка опухолей по двумерным измерениям может не являться наилучшим способом оценки для оценки потенциальной эффективности лечения иммунизацией. Клетки опухолей могут очень эффективно разрушаться и заменяться на фиброзные или воспалительные клетки без поддающихся детекции изменений размера при радиологическом обследовании. Метаболическая активность, как оценено по сканированию PET, может являться полезной в этих условиях. Анализ очага опухоли после иммунизации представляет собой большой интерес для иммунологического анализа, такого как характеризация потенциального антигена опухолей, являющегося мишенью лечения.
IA-Maxi-Vax
[0164] В другом варианте осуществления, любые вакцинные композиции, описанные в настоящем описании, используют в контексте терапевтической или профилактической иммунизации против различных инфекционных заболеваний. Этот продукт обозначен «IA-Maxi-Vax» (инфекционный агент).
[0165] Как и MVX-ONCO-1, «IA-Maxi-Vax», можно использовать в качестве терапевтического или профилактического продукта (вакцины), изготовленного из двух компонентов, находящихся физически в непосредственной близости.
[0166] В IA-Maxi-Vax, антигенный компонент содержит один или несколько компонентов из инфекционных агентов. Таким образом, всех пациентов, страдающих специфической инфекцией или подверженных риску развития специфической инфекции, можно лечить с использованием одного и того же продукта. Множество известных антигенных компонентов описано при инфекционных заболеваниях, вызванных вирусными, бактериальными, паразитарными или грибковыми патогенами, и их используют в настоящее время для способов иммунизации. Любой из этих антигенов можно использовать в форме инактивированных патогенов, лизатов инфекционных агентов, экстрактов белков, рекомбинантных белков, пептидов, ДНК или в других формах. В некоторых условиях, в зависимости от инфекционного агента или медицинского состояния хозяина, иммунизация является слабой или не обеспечивающей защиту, что приводит к значительной заболеваемости или смертности.
[0167] В вакцинной композиции IA-Maxi-Vax, один компонент вакцины содержит комбинацию антигенов или пул антигенов для данного инфекционного агента. Как и для MVX-ONCO-1, другой компонент IA-Maxi-Vax представляет собой по меньшей мере одну биосовместимую макрокапсулу, содержащую иммуно-изолированные аллогенные клетки, секретирующие GM-CSF.
[0168] Лечение вакцинацией с использованием «IA-Maxi-Vax» включает повторяющиеся иммунизации в различных подкожных участках. Общее количество вакцинаций зависит от способа и доз, и его необходимо корректировать в каждом конкретном случае. Например, вакцинация может требовать еженедельных инъекций в течение по меньшей мере 2 недель (например, 2, 3, 4, 5, 6, 7, или более недель). Определение и/или корректировка доз находится в компетенции обычного специалиста в данной области.
[0169] Примеры состояний, которые можно предотвращать или лечить с использованием «IA-Maxi-Vax», включают в себя, но без ограничения:
Вирусные инфекции:
Мишень: пациенты с HIV на различных стадиях их заболевания (пациенты на ранней стадии могут являться лучшими кандидатами, с более сильной иммунной системой)
Мишень: инфекция CMV в конкретном состоянии (до или после трансплантации органов)
Мишень: рецидивирующая герпетическая инфекция
Гепатит B или вирус Эпштейна-Барр
Гепатит C
Вирус папилломы человека (HPV)
Бактериальные инфекции:
Мишень: Микобактериальная инфекция в специфической популяции, такой как пациенты с HIV
Мишень: Helicobacter pylori. H. pylori является этиологическим фактором при большинстве видов язвы желудка или гастрите.
Паразитарные инфекции:
Малярия, токсоплазма, Pneumocystis, эхинококк
Грибковые инфекции:
Кандида, аспергилла
Гиперчувствительность замедленного типа (DTH)
[0170] Реакции гиперчувствительности замедленного типа (DTH) представляют собой воспалительные реакции, инициированные мононуклеарными лейкоцитами. Термин замедленный используют, чтобы отличать вторичный клеточный ответ, который возникает через 48-72 часов после воздействия антигена, от ответа немедленной гиперчувствительности, который, как правило, проявляется в пределах 12 минут после воздействия антигена. Эти реакции опосредованы T-клетками и моноцитами/макрофагами, а не антителами. Их называют также реакциями гиперчувствительности типа IV.
[0171] В контексте иммунотерапии опухолей, тестирование DTH проводят с использованием облученных аутологичных клеток опухолей, инъецированных внутрикожно в непораженную кожу. Через 24 и 48 часов, присутствие и диапазон местной воспалительной реакции регистрируют посредством оценки размера утолщенного эпидермиса. DTH проводят до, во время и после терапии MVX-ONCO-1.
[0172] Обычно, пациенты, у которых отрицательная DTH до лечения переходит в положительную DTH во время и/или после лечения, проявляют тенденцию к лучшему исходу с использованием вакцинных композиций, описанных в настоящем описании. В результате, полезно тестирование пациентов по ответу DTH+ перед вакцинацией. Тестирование ответа DTH+ требует по меньшей мере 3×106 клеток: 1×106 клеток до вакцинации; 1×106 клеток на неделях 5-6; и 1×106 клеток после вакцинации на неделе 12.
[0173] Предпочтительно, ответ DTH тестируют на части организма, противоположной участку имплантации капсулы.
[0174] Определение подходящего расписания дозирования и/или участка имплантации находится в компетенции обычного специалиста в данной области. Один из неограничивающих примеров расписания дозирования показан в следующей таблице:
[0175] По меньшей мере 28×106 клетки или более необходимо для полного протокола вакцинации и тестирования:
6×4×106 клеток для вакцинации;
3×1×106 клеток для тестирования DTH; и
0,5×106 облученных клеток и 0,5×106 non-облученных клеток, которые культивируют в течение 10 суток и посчитывают. Должно быть < 0,5×106 клеток в облученной аликвоте. Тест проводят, чтобы убедиться, что клетки облучены надлежащим образом.
Фармацевтические композиции и наборы
[0176] В настоящем описании представлены также фармацевтические композиции и наборы, содержащие вакцинные композиции, описанные в настоящем описании. Все эти продукты особенно хорошо подходят для промышленного производства, поскольку их легко получать в большом количестве благодаря «универсальным» характеристикам устройства. Поскольку аллогенные клетки являются иммуно-изолированными, одинаковые инкапсулированные клетки являются подходящими для всех пациентов. Эта «универсальная» характеристика представляет особенный интерес для терапии злокачественных опухолей, где необходимы множественные инъекции вакцины или фармацевтической композиции.
[0177] Фармацевтическая композиция в соответствии с настоящим изобретением содержит фармацевтические композиции, объединенные с физиологически и/или фармацевтически приемлемым носителем. Можно использовать любой пригодный физиологически или фармацевтически приемлемый носитель, известный в данной области. Такие композиции могут содержать также любую фармацевтическую добавку, необходимую для выживаемости клеток и для успешности введения или имплантации.
[0178] В настоящем описании представлены наборы, содержащие вакцинные композиции, описанные в настоящем описании, вместе с инструкциями для применения.
[0179] Представлены также применения вакцинных композиций, фармацевтических композиций и наборов для применения в терапевтической и/или профилактической вакцинации, так же как способы терапевтической и/или профилактической вакцинации с использованием любых вакцинных композиций, фармацевтических композиций и/или наборов, описанных в настоящем описании. Например, вакцинация может представлять собой терапевтическую вакцинацию против злокачественных опухолей, или терапевтическую или профилактическую вакцинацию против инфекционных агентов. В случае иммунизации против злокачественных опухолей, пациент, как правило, является страдающим заболеванием до лечения. В случае иммунизации против инфекционного агента, пациент является страдающим заболеванием или нарушением, или подверженных риску развития заболевания или нарушения.
[0180] Пациент предпочтительно представляет собой пациента-человека, но животные также предусмотрены. Пациент может нуждаться в вакцинации по различным причинам, поскольку профилактическая иммунизация является предпочтительной, как для доброкачественного заболевания, или является необходимой например, в случае серьезной эпидемии.
[0181] Иммунизация инфекционным агентом может являться профилактической, поскольку пациент может вступить в контакт с антигенным компонентом раньше или позже. Подобным образом, иммунизация инфекционным агентом может также являться терапевтической, поскольку пациент уже вступил в контакт с антигенным компонентом, но является неспособным самостоятельно образовать адекватный иммунный ответ.
[0182] Можно использовать различные способы вакцинации в зависимости от желательного характера вакцинации. Введение обоих компонентов можно осуществлять одновременно, отдельно или последовательно. Может являться преимущественным разделение введения по времени. Фактически, поскольку аллогенные клетки являются иммуно-изолированными в биосовместимых макрокапсулах, они, как правило, оказывают длительный эффект. В отличие от этого, антигенный компонент, вероятно, подвергается очень быстрому процессингу и уничтожению посредством иммунной системы хозяина. В таком случае, когда введение компонентов разделено, введение антигенного компонента можно повторять, при однократном введении иммуно-изолированных аллогенных клеток.
[0183] Антигенные и иммуномодулирующие средства должны являться совместно локализованными для оказания оптимизированного эффекта.
[0184] Для оптимизированного способа иммунизации, введение повторяют несколько раз с равными интервалами. Например, когда профилактическая или терапевтическая вакцинация представляет собой терапию или вакцинацию против злокачественных опухолей, равные интервалы представляют собой еженедельные инъекции в течение четырех недель с последующими двумя дополнительными иммунизациями каждые две недели. Подобным образом, когда профилактическая или терапевтическая вакцинация представляет собой терапию или вакцинацию против инфекционного агента, равные интервалы представляют собой еженедельные инъекции в течение двух недель.
[0185] В некоторых вариантах осуществления, вакцинную композицию вводят в подкожной локализации, поскольку эта область является богатой дендритными клетками. Однако, специалистам в данной области понятно, что введение можно осуществлять внутрикожно или в любой другой локализации, вероятно, благоприятной для ожидаемого иммунного ответа. Например, вводимую композицию можно инъецировать, употреблять внутрь, имплантировать, наносить или подвергать любым другим способам введения.
[0186] Изобретение описано, следующие примеры предложены с целью иллюстрации, а не ограничения.
Примеры
Пример 1: Открытое клиническое исследование фазы I, оценивающее безопасность и переносимость MVX-ONCO-1 у пациентов с солидной опухолью, которые больше не являются подходящими для какой-либо стандартной терапии (клиническое исследование NCT02193503)
Цели:
[0187] Целью исследования являлась оценка безопасности и переносимости 6 доз вакцины MVX-ONCO-1, продукта клинической квалификации для терапии инкапсулированными клетками (ECT), введенного подкожно (инъекции и имплантации капсул), у пациентов с метастазирующими солидными опухолями на поздних стадиях при прогрессировании, которые не являются или больше не являются подходящими для какой-либо стандартной терапии их опухолевого заболевания.
Конечные точки:
[0188] Первичной конечной точкой исследования являлась оценка параметров безопасности и осуществимости, включая неблагоприятные и серьезные неблагоприятные события (встречаемость, причины, тяжесть), местную и системную переносимость вводимого исследуемого лекарственного средства, изменения лабораторных параметров и показатели жизненно важных функций у пациентов с солидными опухолями. Вторичной конечной точкой исследования являлась оценка клинической активности и иммунологическое мониторирование (например, измерение некоторых ответов опухолей с использованием способа визуализации, серологических маркеров опухолей и метаболическое мониторирование).
Дизайн исследования:
[0189] Оно представляло собой открытое исследование фазы I, которое включало 15 пациентов с прогрессирующими солидными опухолями, невосприимчивыми или не подходящими в отношении стандартной химиотерапии.
[0190] По этическим причинам, проведение хирургических процедур с единственной целью получения материала опухолей для этого исследования является неприемлемым. Таким образом, материал опухолей являлся доступным только от пациентов, подвергавшихся плевральной или асцитной пункции для удаления жидкости, содержащей злокачественные клетки, или от пациентов, подвергнутых хирургической операции, которая являлась необходимой по медицинским причинам, не связанным с клиническим протоколом.
Получение тканей опухолей: предоперационное и операционное
[0191] Пациенты подписывали формы предоперационного и клинического информированного согласия, дающие разрешение на применение избыточной ткани опухоли и манипуляции с ней для получения вакцин из аутологичных клеток опухолей.
Хирургическая и гистопатологическая документация
[0192] Аутологичные клетки пациентов собирали в операционной или посредством стерильных процедур для получения клеток опухолей (асцитная пункция, плевральная жидкость, костный мозг, биопсия под контролем CT). Отчет об операции по сбору клеток включал в себя описание обнаружений во время операции, с конкретными ссылками на степень заболевания и на то, удалены или нет какие-либо соседние органы вместе с образцом.
Диссоциация аутологичных клеток опухолей и изготовление вакцин
[0193] Переработку клеток опухолей для получения вакцин выполняли для ткани, полученной от каждого индивидуального пациента. Диссоциацию и изготовление доз вакцины проводили в соответствии с требованиями современной надлежащей производственной практики (cGMP) при строгом соблюдении асептических способов в соответствии со стандартными операционными процедурами (СОП) LTC. После завершения процесса, клетки замораживали и хранили в паровой фазе жидкого азота в специально предназначенном для этого сосуде.
Лечение и кратковременное отслеживание
[0194] Иммунизацию проводили в здоровом участке кожи, вдали от скоплений клеток опухолей. Пациентов лечили с использованием 6 подкожных (sc) иммунизаций (недели 1-2-3-4-6-8), объединяющих 4×106 облученных аутологичных клеток опухолей и 2 макрокапсулы, содержащие каждая 8×105 клеток MVX-1, генетически модифицированных для продукции >20 нг/ 24 час huGM-CSF более 7 суток.
[0195] Подходящих пациентов подвергали лечению вакциной каждую неделю, начиная на сутки исследования 1 (SD1), в течение 4 недель, с последующими двум дополнительными инъекциями, с интервалом 2 недели. Анализ безопасности и эффективности проводили в конце W18 исследования (9 недель полного цикла вакцинации+9 недель отслеживания). Размер опухоли оценивали в исходной точке и на W6, W12 и W18.
[0196] Макрокапсулы удаляли через 7 суток и анализировали по продукции huGM-CSF.
Длительное отслеживание
[0197] Пациентов будут отслеживать с точки зрения безопасности до смерти или года 5 после SD1, в зависимости от того, что наступит ранее. Кроме того, пациентов исключали из исследования из-за крупных нарушений протокола, неконтролируемых тяжелых сопутствующих заболеваний или серьезных неблагоприятных событий, несоблюдения протокола пациентом или по административным причинам.
Популяция для исследования:
[0198] Популяция для исследования включала пациентов с метастазирующими солидными опухолями на поздних стадиях при прогрессировании, которые не являются или больше не являются подходящими для какой-либо стандартной терапии их типа опухолей.
Критерии включения:
Пациенты мужского или женского пола в возрасте 18 лет и старше с метастазирующими злокачественными опухолями на поздних стадиях при прогрессировании в различных участках [карцинома легкого (либо мелкоклеточная, либо немелкоклеточная), ободочной кишки, молочной железы, поджелудочной железы (экзокринная или эндокринная), желудка, пищевода, головы и шеи, щитовидной железы, почки, мочевого пузыря, предстательной железы, яичников, матки (шейки или тела); саркома мягких тканей, костей, матки, меланома; первичная опухоль мозга], где все известные способы лечения исчерпаны или не являются осуществимыми
Ожидаемая продолжительность жизни: по оценкам по меньшей мере 4 месяца
Оценка функционального статуса 0-2 (оценка WHO)
Отсутствие важных нарушений функционирования печени (ALT < 2,5 раза выше верхнего предела нормального диапазона, билирубин в пределах нормального диапазона (исключение: метастазы в печени: ALT < 5 раз выше ULN; билирубин < 3 раз выше ULN)
Отсутствие важных нарушений функционирования почек (креатинин ≤ 1,5 раза выше верхнего предела нормального диапазона)
Отсутствие важных нарушений функционирования костного мозга (гемоглобин > 9,0 г/дл WBC > 2,5×109/л, нейтрофилы ≥ 1,5 x109/л, тромбоциты ≥ 50 x109/л)
Первичная опухоль и/или метастазы, поддающиеся частичному/полному хирургическому удалению или пункции, и оценка последующего сбора клеток > 27×106 клеток
Способность понимания концепции клинического исследования
Способность понимания формы информации для пациента и формы информированного согласия
Предоставление информированного согласия
Критерии исключения:
Участие в любом другом экспериментальном исследовании или подвергание экспериментальной терапевтической процедуре, рассматриваемых как создающие помехи для этого исследования, в течение 4 предшествующих недель
Подвергание любому химиотерапевтическому лечению в течение 4 предшествующих недель
Тяжелое сопутствующее заболевание
Вторая злокачественная опухоль в анамнезе, которую подвергали направленному на излечение лечению, и которая находится в полной ремиссии в течение < 5 лет
Пациент с системным заболеванием, отличным от злокачественной опухоли, неконтролируемым посредством обычных лекарственных средств
Не подвергавшиеся лечению метастазы в головном мозге (скрининг по CT или ЯМР обязателен даже для пациентов без симптомов). Пациентов с метастазами в головном мозге без доказательств рецидива в головном мозге после хирургии/радиотерапии при скрининге, можно включать
Длительное иммуносупрессивное лечение, включая стероиды > 30 мг кортизона или эквивалента/сутки
Антикоагулянтная терапия с использованием кумарина или длительного iv введения гепарина. Низкомолекулярный гепарин (LMWH) разрешен при условии, что лечение можно прекратить за несколько часов до подкожной имплантации
Положительный ответ антител против HIV-1, HIV-2, HTLV-1, поверхностного антигена вируса гепатита B или гепатита C
Женщины со способностью к деторождению, которые являются беременными или кормящими, или которые не используют надлежащих противозачаточных средств (хирургических, гормональных или двойной барьерной контрацепции, т.е. кондома и диафрагмы).
Известная аллергия на реагенты в исследуемом продукте (MVX-ONCO-1), подобные пенициллину, стрептомицину.
Исследуемое лекарственное средство (IMP):
[0199] Из производственных соображений, можно использовать неадгерентные клетки (исключая фибробласты или эпителиальные клетки), которые можно легко хранить замороженными. Из соображений безопасности, тестировали только клетки с уровнем биобезопасности 1. Пять различных линий клеток тестировали по их способности подвергаться инкапсуляции: CCL243, CCL246, CCL246.1, TIB202 и CRL1582. CCL243 (клетки гематопоэтического происхождения) выбрали в итоге и затем генетически модифицировали для экспрессии huGM-CSF. MVX-1 представляет собой линию клеток, полученную посредством клонирования отдельной клетки из генетически модифицированной линии клеток CCL243.
[0200] MVX-ONCO-1 представляет собой форму активной специфической иммунотерапии (ASI), способ, посредством которого иммунный ответ пациента на клетки опухолей стимулируют и/или дополняют.
[0201] MVX-ONCO-1 представляет собой специфическую для пациента иммунотерапию на основе клеток, состоящую из:
a. иммуномодулятора (GM-CSF: гранулоцитарно-макрофагального колониестимулирующего фактора), высвобожденного из защищенной от иммунной системы, макроинкапсулированной, аллогенной, генетически модифицированной линии клеток (MVX-1), и
b. облученных, аутологичных клеток опухолей в качестве источника антигена.
[0202] Капсулы, нагруженные клетками MVX-1, выбирали по их способности к эффективному замораживанию для длительного хранения вплоть до 18 месяцев (т.е., вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 месяцев). Макрокапсулы, нагруженные клетками MVX-1, перерабатывали и хранили замороженными.
Доза вакцины:
[0203] Одна имплантация состояла из двух макрокапсул, содержащих линию клеток MVX-1, генетически модифицированную для высвобождения стабильного количества GM-CSF более 7 суток (>20 нг/24 часа) и минимум 4×106 летально облученных аутологичных клеток опухолей.
[0204] Все терапевтические продукты перерабатывали в условиях надлежащей производственной практики (GMP).
Введение:
[0205] Под местной анестезией, две макрокапсулы имплантировали подкожно на расстоянии 1 см, параллельно. Облученные аутологичные клетки инъецировали подкожно между двумя капсулами. Пациентов подвергали лечению, только если минимум 27×106 облученных, аутологичных клеток опухолей было доступно (6 вакцин по 4×106 клеток+3 теста кожной гиперчувствительности замедленного типа с использованием 1×106 клеток).
Доза и расписание:
[0206] В литературе не существует данных относительно оптимального количества антигенной нагрузки. Таким образом, в первых клинических исследованиях, количество клеток опухоли не повышали. Для пациентов в исследовании, для которых показано либо стабильное заболевание, либо частичный/полный ответ, предложена длительная иммунизация раз в месяц, если аутологичные клетки еще являлись доступными после первых 6 инъекций.
[0207] Две биосовместимые макрокапсулы, каждая нагруженная с использованием 8×105 MVX-1 клеток, продуцирующих GM-CSF человека, и подкожную инъекцию 4×106 облученных аутологичных клеток опухолей вводили еженедельно в течение четырех недель. Два дополнительных введения проводили каждые две недели. Через семь суток после имплантации (т.е., на сутки 8 после имплантации), макрокапсулы эксплантировали.
Анализ данных и статистика:
[0208] Обработку данных и статистический анализ проводили после того, как для последнего зарегистрированного пациента завершали оценку на W18. Все параметры эффективности анализировали описательно. Дополнительный анализ проводили с равными интервалами в зависимости от кривой выживаемости пациента.
[0209] Характеристики пациентов, оцениваемые в ходе фазы скрининга, вводили в таблицу для визуального сравнения. Для количественных переменных, предоставляли следующую описательную статистику: N, среднее, стандартное отклонение, минимальное, медианное и максимальное значения; для качественных переменных, предоставляли частоту и процент пациентов.
[0210] Следующие параметры описывали в исходной точке:
Демографические данные пациентов
Характеристики заболевания в исходной точке, включая диагноз, статус активности заболевания, предшествующее лечение.
Вторичное состояние, включая лечение.
Анамнез.
Предшествующие и сопутствующие лекарственные средства
Ожидаемое расширение:
[0211] Из соображений безопасности, второму пациенту проводили вакцинацию только после того, как первого пациента подвергали первым 4 вакцинациям. В течение такого же периода ожидания/наблюдения наблюдали третьего пациента, которому проводили вакцинацию только после того, как второго пациента подвергали его/ее первым 4 вакцинациям. Затем, среднее расширение составляло один участник каждые 2 недели (24 дополнительные недели для 12 пациентов).
Продолжительность исследования для пациентов:
[0212] Скрининг+сбор клеток+изготовление доз вакцины (2 недели)+1 полное лечение вакцинацией (9 недель)+отслеживание (9 недель): приблизительно 6 месяцев.
[0213] Обобщение блок-схемы исследования приведено в следующей таблице:
Результаты:
[0214] Всех 15 пациентов, включенных в терапевтические исследования, подвергали лечению. MVX-ONCO-1 для каждого пациента была успешно изготовлена, в соответствии с GMP и SOP клинических исследований, и все бактериальное тестирование по эндотоксинам и/или микоплазме для MVX-ONCO-1 являлось отрицательным.
[0215] Не было необходимости отбрасывать ни одну из полученных терапевтических вакцинных композиций из-за контроля качества.
[0216] Типы злокачественных опухолей, подвергнутых лечению с использованием MVX-ONCO-1, включают в себя злокачественные опухоли яичников, головы и шеи, поджелудочной железы, предстательной железы и колоректальные злокачественные опухоли. До настоящего времени введено 77 вакцин.
[0217] Уровень секреции GM-CSF из нагруженных капсул перед подкожной имплантацией находился в указанных пределах во всех случаях. Кроме того, все подкожно имплантированные макрокапсулы успешно удалены через 7 суток после имплантации. После удаления, все макрокапсулы тестировали по последующему высвобождению GM-CSF, и для всех показаны стабильные, высокие уровни секреции. Одна из капсул разрушилась после удаления.
[0218] Предполагаемых непредвиденных серьезных нежелательных реакций (SUSAR) не наблюдали в связи с этим исследованием. Кроме того, не зарегистрировано серьезных неблагоприятных событий (SAE) или системных неблагоприятных событий (AE), связанных с продуктом MVX-ONCO-1. Вместо этого, все SAE были связаны с прогрессированием заболевания. Зарегистрировано двадцать два связанных AE, но ни одно не было серьезным. Шесть были обусловлены незначительными дефектами макрокапсул, что привело к травмам в участке имплантации, одной степени 2 и пяти степени 1. Из 16 зарегистрированных несерьезных связанных с лекарственным средством неблагоприятных реакций на лекарственное средство, 12 представляли собой гематомы в участке имплантации степени 1, 3 представляли собой слабую лихорадку степени 1, и 1 представляло собой вазовагальную реакцию степени 3. Местные AE степени 1-2 в участке(участках) вакцинации включали в себя боль во время имплантации, местный дискомфорт и/или ограниченное воспаление.
[0219] Обобщение результатов для осуществимости приведено ниже:
[0220] Соответственно, результаты этого исследования показывают, что продукт MVX-ONCO-1 является безопасным и очень хорошо переносимым, и эти результаты показывают, что изготовление IMP клинической квалификации и лечение пациентов с использованием этого инновационного способа является осуществимым. Кроме того, продукт MVX-ONCO-1 является также активным, как 99,5% IMP квалификации GMP.
[0221] В конце кратковременного отслеживания (неделя 18), 6 пациентов (40%) являлись живыми, и 9 умерли (60%). При длительном отслеживании, 4 пациента умерли, и два пациента являлись живыми. Общая выживаемость (OS) лежала в диапазоне от 46 суток до 441 суток (среднее: 199 суток (SD: 121 сутки), медиана 134 суток). В соответствии с критериями RECIST 1.1., для 2 из 15 пациентов (13,33%) показан частичный ответ, и для 6 (40,00%) показано стабильное заболевание в качестве наилучшего общего ответа в любой временной точке.
[0222] Обобщение результатов эффективности представлено ниже:
Заключение:
[0223] Это первое исследование для человека показало очень хороший профиль безопасности, так же как осуществимость этой новой специфической для пациента иммунотерапии на основе клеток. Кроме того, во вторичных конечных точках показано клиническое преимущество для значительной части пациентов с находящимися на поздней стадии, прогрессирующими, невосприимчивыми солидными злокачественными новообразованиями. Ранний анализ параметров иммуномониторирования показал, что пациенты, способные индуцировать реакцию гиперчувствительности замедленного типа на свои собственные клетки опухолей после иммунизации с использованием MVX-ONCO-1, проявляют тенденцию обладать лучшей выживаемостью. Кроме того, в предварительном анализе подгрупп лимфоцитов, до, во время и после иммунизации с использованием MVX-ONCO-1, у одного пациента с продленным частичным ответом показан специфический для антигена иммунный ответ.
[0224] Исследования фазы 2 с использованием MVX-ONCO-1 запланированы для нескольких типов опухолей (например, карциномы поджелудочной железы на поздних стадиях, карциномы яичников, и/или плоскоклеточной карциномы головы и шеи), так же как для комбинированной терапии с модуляторами иммунных контрольных точек. Например, предусмотрены следующие клинические исследования фазы IIa (без контрольной группы):
-MVX-ONCO-1 при злокачественных опухолях головы и шеи
-MVX-ONCO-1 в качестве монотерапии при раке легкого
-MVX-ONCO-1 в комбинации с химиотерапией, в качестве вспомогательного средства для улучшения эффективности при раке яичника после рецидива, после стандартной терапии первой линии таксолом и карбоплатином
-MVX-ONCO-1 в качестве монотерапии при раке поджелудочной железы
[0225] Предусмотрены клинические исследования, включающие злокачественные опухоли головы и шеи, поскольку:
- из этих опухолей можно легко собрать клетки,
- эти злокачественные опухоли, как правило, имеют плохой прогноз (<6 месяцев),
- они являются часто встречающимися злокачественными опухолями,
- эти опухоли являются способными отвечать на PD1/PDL-1, и таким образом, они являются иммуногенными опухолями
[0226] Конечной точкой этих исследований может быть общий процент выживаемости через 6 месяцев.
Пример 2: Сбор аутологичных клеток опухолей (антигенная нагрузка)
[0227] Опухолевую массу (из первичного очага или метастазов) от пациента, подлежащего лечению, собирали хирургическим способом. Стандартное патологическое обследование проводили на части массы, чтобы подтвердить злокачественную природу собранного материала. Затем его перерабатывали для получения суспензии отдельных клеток. Это проводили как механическими, так и ферментативными способами.
[0228] Сначала опухолевую массу разрезали на более мелкие фрагменты с использованием препаровальной лупы, затем опухоль помещали в стерильный пакет с стерильным раствором, содержащим различные ферменты (коллагеназу). Пакет вставляли в измельчитель клеток (Stomacher Lab System), перерабатывающий продукт в суспензию клеток. Комбинация ферментативного и механического воздействия при 37°C в течение нескольких часов позволяла эффективную диссоциацию внеклеточного матрикса опухоли и его превращение в суспензию отдельных клеток. Это проводили в бессывороточном растворе.
[0229] Затем клетки промывали три раза с использованием HBSS с использованием охлаждаемой центрифуги (Sorvall) при 4°C, 5 минут, 700 об./мин, и ресуспендировали в HBSS. Затем клетки подсчитывали с использованием раствора трипанового синего (Fluka) и камеры Нейбауэра.
[0230] Клетки ресуспендировали в выбранной концентрации, облучали при 10000 рад (100 Гр) в облучателе, предназначенном для клинического применения, разделяли на аликвоты и замораживали в среде для замораживания, содержащей 10% DMSO.
Пример 3: Иммуно-изолированный источник цитокинов
a) Получение клеток, продуцирующих GM-CSF.
[0231] Клетки, подлежащие введению в капсулы, являлись аллогенными (полученными из линии клеток человека). Для предотвращения непредвиденной токсичности, использовали линии клеток, которые уже были одобрены в клинических протоколах, таких как иммортализованные фибробласты или миобласты. Эти клетки сначала стабильно трансфицировали с использованием кДНК GM-CSF человека.
[0232] Использовали два способа трансфекции: ретровирусная трансфекция и электропорация. Для ретровирусной трансфекции, кДНК hGM-CSF вставляли в рамке считывания в ретровирусный вектор MFG, и транскрипцией управляли посредством LTR вируса. Плазмида не содержала никакого селективного маркера или гена устойчивости к антибиотику.
[0233] Для трансфекции посредством электропорации, кДНК hGM-CSF помещают под контроль промотора CMV, и плазмида содержит селективный маркер (такой как ген устойчивости к антибиотику).
[0234] Могут являться пригодными также различные типы клеток для трансфекции и различные плазмиды GM-CSF, что оставляет больше гибкости по отношению к требованиям местного управления здравоохранения.
[0235] Продуцирующие цитокин клетки культивировали в бессывороточных средах при 37°C с 5% CO2 с использованием стандартных способов. Сбор проводили следующим образом: супернатант конфлюэнтных, адгерентных клеток из 10 см культуральной чашки удаляли, и клетки промывали один раз с использованием 5 мл автоклавированного фосфатно-солевого буфера (PBS) в течение 5 минут при 37°C. Затем PBS удаляли, и добавляли 2 мл трипсин-ЭДТА 0,5% (Life Technologies N°25300054), и клетки инкубировали в течение четырех минут при 37°C. Трипсин/ЭДТА обеспечивали открепление адгерентных клеток опухолей. Затем клетки собирали с использованием 2 мл пипетки и разводили в 5 мл сбалансированного солевого раствор Хенкса (HBSS Life Technologies N°24020091). Клетки промывали три раза с использованием HBSS с использованием охлаждаемой центрифуги (Sorvall) при 4°C, 5 минут, 700 об./мин) и ресуспендировали в HBSS. Затем клетки подсчитывали с использованием раствора трипанового синего (Fluka) и камеры Нейбауэра.
[0236] Количество hGM-CSF, продуцированного и секретированного клетками, оценивали посредством Elisa (наборы R&D system и Pharmingen) в фильтрованном супернатанте клеток. Этот анализ позволил выбор линии клеток с наилучшей продукцией цитокинов.
b) Иммуно-изоляция клеток, продуцирующих цитокин
[0237] Для обеспечения замедленного высвобождения цитокина аллогенными клетками и обеспечения повторяющейся иммунизации, являлось необходимым проведение иммуно-изоляции клеток, продуцирующих цитокин, из иммунной системы реципиента. Это проводили посредством любой макроинкапсуляции.
[0238] Клетки, продуцирующие цитокин, загружали в макрокапсулы. Можно использовать любые из макрокапсул, описанных в настоящем описании. В капсулу загружали суспензию клеток со скоростью 10,5 мкл/мин. Герметичное закрытие капсулы получали посредством полимерного клея, но это можно осуществлять также посредством нагревания или хирургических зажимов. Анализ супернатанта инкапсулированных клеток, содержащих секретирующие GM-CSF клетки, показал, что стабильное, непрерывное высвобождение GM-CSF обеспечивали в течение по меньшей мере пятнадцати суток после загрузки, где уровни цитокина составляли приблизительно 70 нг/105 клеток/24 час.
Пример 4: Иммунизация
[0239] Иммунизация с использованием Onco-Maxi-Vax требовала подкожной инъекции в близком контакте двух компонентов вакцинной композиции.
[0240] Капсулу, содержащую клетки, продуцирующие цитокин, помещали в подкожную ткань с использованием небольшого разреза кожи под местной анестезией. Кожу закрывали с использованием хирургической клейкой ленты.
[0241] Облученные клетки опухолей от пациента (= антигенная нагрузка) размораживали, промывали два раза с использованием 0,9% NaCl, стерильного раствора, и затем инъецировали, подкожно, в очень близком соседстве с капсулой, с использованием иглы 24 калибра.
[0242] Вакцинацию повторяли с равными интервалами. Участок вакцинации являлся различным для каждой иммунизации (стенка брюшной полости, верхняя часть плеча, бедра, грудная клетка и т.д.).
Пример 5: Сравнительные данные
[0243] Предпринимали попытки оптимизации «универсального» компонента вакцинных композиций, описанных в настоящем описании, посредством введения различных улучшений и/или изменений в капсулы, описанные в предшествующей области техники (например, WO 2003/105895).
[0244] Например, в вакцинных композициях, описанных в настоящем описании, предпочтительно использовать неадгерентные типы клеток внутри макрокапсул. Кроме того, линия клеток MVX-1 имеет гематопоэтическое происхождение, в отличие от предшествующих устройств, в которых предусмотрено применение клеток фибробластного или эпителиального происхождения.
[0245] Кроме того, в вакцинных композициях, применениях и способах, описанных в настоящем описании, используют новые способы замораживания и отличный режим кондиционирования GMP, которые не применяли в композициях, описанных в WO2003/105895.
Пример 6: Анализ биологической активности GM-CSF
[0246] Функциональный анализ на основе клеток проводили для определения биологической активности GM-CSF, продуцированного линией клеток MVX-1. Два образца супернатанта клеток, содержащего продуцированный GM-CSF, тестировали в двух повторах с использованием клеточного анализа LanthaScreen™ (ThermoFisher Scientific), в котором используют флуоресцентный резонансный перенос энергии с временным разрешением (TR-FRET) между меченным тербием антителом, специфическим для участка фосфорилирования (PSSA), и зеленым флуоресцентным белком (GFP), слитым с субстратом конкретной киназы для обеспечения считываемого показателя анализа, который является ратиометрическим, надежным и пригодным для применений высокопроизводительного скринига (HTS). Использование GFP, слитого с мишенью, вместе с одним антителом для детекции упрощает протокол анализа, исключает необходимость бусин или дополнительных реагентов, и упрощает анализ по сравнению с другими способами «сэндвича» с двумя антителами.
Условия анализа
Тестируемые соединения
[0247] Все тестируемые соединения сначала получали в 1000X концентрации в 100% DMSO. Серийные разведения (½ log) тестируемых соединений получали в DMSO. Известный ингибитор подготавливали таким же способом.
Планшет для анализа
[0248] 384-луночный белый, плоскодонный, полистирольный, обработанный для культивирования клеток планшет для анализа Corning (Corning #3570).
Среды для анализа
[0249] Клеточные анализы LanthaScreen, как правило, проводили в средах с низким содержанием сыворотки (или в бессывороточных средах), чтобы снизить активацию путей и предоставить фон для последующих анализов.
Буфер для лизиса
[0250] Полный буфер для лизиса из клеточного анализа LanthaScreen состоит из 20 мМ Tris-HCl, pH 7,4, 5 мМ ЭДТА, 5 мМ NaF, 150 мМ NaCl, 1% NP-40 (или эквивалента), коктейля ингибиторов протеаз (Sigma #P8340), коктейля ингибиторов фосфатаз (Sigma #P2850), и 2-5 нМ подходящего Tb-PSSA.
Протокол анализа агонистов (общий)
1. 32 мкл клеток, разведенных в средах для анализа до соответствующей плотности клеток, добавляют в планшет для анализа. При необходимости, клетки инкубируют при 37°C/5% CO2 в течение 0-24 часов (в зависимости от специфики линии клеток) перед добавлением соединения.
2. 40 нл раститровки 1000X соединения или известного активатора добавляют к клеткам в планшете для анализа. 8 мкл среды для анализа добавляют в эти лунки.
3. 8 мкл среды для анализа добавляют в оставшиеся контрольные лунки для доведения объема до 40 мкл.
4. Планшет для анализа инкубируют при 37°C/5% CO2 в увлажненном инкубаторе в течение предопределенного отрезка времени (специфического для линии клеток/анализа).
5. Клетки лизируют посредством добавления буфера для лизиса с предопределенной концентрацией меченного Tb Ab (специфического для анализа).
6. Планшеты для анализа инкубируют в темноте при комнатной температуре в течение предопределенного отрезка времени (специфического для анализа).
7. Считывают планшет в флуоресцентном считывателе для планшетов.
Протокол анализа антагонистов (общий)
1. 32 мкл клеток, разведенных в средах для анализа до соответствующей плотности клеток, добавляют в планшет для анализа. При необходимости, клетки инкубируют при 37°C/5% CO2 в течение 0-24 часов (в зависимости от специфики линии клеток) перед добавлением соединения.
2. 40 нл раститровки 1000X соединения или известного ингибитора плюс 4 мкл среды для анализа добавляют к клеткам в планшете для анализа и инкубируют в течение 30 минут при 37°C/5% CO2 в увлажненном инкубаторе.
3. 4 мкл активатора в концентрации EC80, как определено в анализе активации, добавляют во все лунки, содержащие тестируемое соединение и известный ингибитор, для доведения конечного объема смеси для анализа до 40 мкл.
4. 4 мкл среды для анализа добавляют в оставшиеся контрольные лунки для доведения объема до 40 мкл.
5. Планшет для анализа инкубируют при 37°C/5% CO2 в увлажненном инкубаторе в течение предопределенного отрезка времени (специфического для линии клеток/анализа).
6. Клетки лизируют посредством добавления буфера для лизиса с предопределенной концентрацией меченного Tb Ab (специфического для анализа).
7. Планшеты для анализа инкубируют в темноте при комнатной температуре в течение предопределенного отрезка времени (специфического для анализа).
8. Считывают планшет в флуоресцентном считывателе для планшетов.
Контроль анализа
[0251] Следующие виды контроля осуществляли для каждого индивидуального анализа, в каждом планшете для анализа:
Контроль МАКС. СТИМ. (если применимо)
[0252] Максимальный сигнал TR-FRET (отношение излучения; 520 нм/490 нм) устанавливают посредством контроля МАКС. СТИМ. (или контроля 0% ингибирования). Эти контрольные лунки содержат GFP+ клетки, стимулированные с использованием агониста в концентрации EC100 в присутствии 0,1% DMSO.
Контроль НЕСТИМ.
[0253] Минимальный сигнал TR-FRET устанавливают посредством контроля НЕСТИМ. Эти контрольные лунки содержат нестимулированные клетки в присутствии 0,1% DMSO.
Контроль EC80 (только в режиме ингибирования)
[0254] Контроль EC80 представляет собой концентрацию известного активатора в среде для анализа, определенную в ходе эксперимента активации. В режиме ингибирования, контроль EC80 используют для определения фактического фона активации или 0% ингибирования.
0% ингибирования
[0255] Сигнал TR-FRET, полученный для лунок, содержащих клетки, стимулированные с использованием агониста в концентрации EC80 в присутствии 0,1% DMSO (в отсутствие соединения).
Раститровка известного ингибитора (если применимо)
[0256] Стандартную кривую для контрольного известного ингибитора (раститровка по 10 точкам) получают в каждом планшете для анализа, чтобы убедиться, что ингибирование в анализе находится в пределах ожидаемого диапазона IC50.
[0257] Соответствующие линии клеток LanthaScreen, доступные для скрининга, представлены ниже:
*Значения EC50 и IC50 являются репрезентативными
STAT5 A/B [pTyr694/699] - LanthaScreen STAT5 TF-1 - Скрининг активаторов, стимуляция GM-CSF
[0258] Клетки размораживают и ресуспендируют в среде для анализа (OPTI-MEM, 0,5% csFBS, 0,1 мМ NEAA, 1 мМ пируват натрия, 100 ед./мл/100 мкг/мл Pen/Strep) до концентрации 3125000 клеток/мл. 32 мкл суспензии клеток добавляют в каждую лунку белого обработанного для TC планшета для анализа (100000 клеток/лунку) и инкубируют в течение 16-24 часов при 37°C/5% CO2 в увлажненном инкубаторе. 40 нл контрольного активатора GM-CSF или тестируемого соединения добавляют в соответствующие лунки для анализа с последующим добавлением 8 мкл среды для анализа. Планшет для анализа инкубируют в течение 30 минут при 37°C/5% CO2 в увлажненном инкубаторе. 30 мкл буфера для лизиса из клеточного анализа LanthaScreen, содержащего 5 нМ антитела LanthaScreen против STAT5 A/B [pTyr694/699] и 10 нМ антитела против антител мыши с Tb, добавляют в лунки. Планшет для анализа инкубируют в течение 120 минут при комнатной температуре. Планшет для анализа считывают с использованием флуоресцентного считывателя для планшетов.
STAT5 A/B [pTyr694/699] - LanthaScreen STAT5 TF-1 - Скрининг ингибиторов, стимуляция GM-CSF
[0259] Клетки размораживают и ресуспендируют в среде для анализа (OPTI-MEM, 0,5% csFBS, 0,1 мМ NEAA, 1 мМ пируват натрия, 100 ед./мл/100 мкг/мл Pen/Strep) до концентрации 3125000 клеток/мл. 32 мкл суспензии клеток добавляют в каждую лунку белого обработанного для TC планшета для анализа (100000 клеток/лунку) и инкубируют в течение 16-24 часов при 37°C/5% CO2 в увлажненном инкубаторе. 40 нл контрольного ингибитора - ингибитора I JAK - или тестируемого соединения добавляют в соответствующие лунки для анализа с последующим добавлением 4 мкл среды для анализа. Планшет для анализа инкубируют в течение 30-60 минут при 37°C/5% CO2 в увлажненном инкубаторе. 4 мкл 10X контрольного активатора GM-CSF в предопределенной концентрации EC80 добавляют в лунки, содержащие контрольный ингибитор или соединения. Планшет для анализа инкубируют в течение 30 минут при 37°C/5% CO2 в увлажненном инкубаторе. 30 мкл буфера для лизиса из клеточного анализа LanthaScreen, содержащего 5 нМ антитела LanthaScreen против STAT5 A/B [pTyr694/699] и 10 нМ антитела против антител мыши с Tb, добавляют в лунки. Планшет для анализа инкубируют в течение 120 минут при комнатной температуре. Планшет для анализа считывают с использованием флуоресцентного считывателя для планшетов.
[0260] Все результаты этого анализа являлись положительными (см. фигуру 7). GM-CSF, продуцированный линией клеток MVX-1, по-видимому, являлся эквивалентным коммерчески доступному GM-CSF, в пределах ограничений анализа.
Эквиваленты
[0261] Детали одного или нескольких вариантов осуществления изобретения указаны в прилагаемом описании выше. Несмотря на то, что любые способы и материалы, сходные или эквивалентные описанным в настоящем описании, можно использовать в практическом осуществлении или тестировании настоящего изобретения, в настоящее время описаны предпочтительные способы и материалы. Другие признаки, объекты и преимущества изобретения очевидны из описания и из формулы изобретения. В описании и прилагаемой формуле изобретения, формы единственного числа включают в себя ссылки на формы множественного числа, если контекст явно не требует иного. Если не определено иначе, все технические и научные термины, применяемые в настоящем описании, обладают таким же значением, какое является общепринятым для специалиста в области, к которой относится это изобретение. Содержание всех патентов и публикаций, процитированных в этом описании, приведено в качестве ссылки.
[0262] Предшествующее описание представлено только с целью иллюстрации и предназначено для ограничения изобретения не посредством точно описанной формы, но посредством прилагаемой к нему формулы изобретения.
Реферат
Группа изобретений относится к области медицины, а именно к вакцинной композиции, содержащей: (a) по меньшей мере одну извлекаемую биосовместимую макрокапсулу, содержащую от приблизительно 1×10до приблизительно 1×10иммуно-изолированных аллогенных клеток гематопоэтического происхождения, секретирующих по меньшей мере 20 нг/24 часа GM-CSF в течение по меньшей мере 7 суток, и (b) антигенный компонент, где антигенный компонент содержит от 1×10до 1×10аутологичных клеток опухолей, полученных от пациента с хордомой, и где по меньшей мере 4×10клеток опухолей являются облученными,где по меньшей мере одна биосовместимая макрокапсула содержит: сердцевину, содержащую аллогенные клетки и внутреннюю спираль, имеющую расстояние между витками приблизительно 1 мм ± 0,1 мм, где аллогенные клетки распределены на внутренней спирали; и полупроницаемую мембрану, окружающую сердцевину, позволяющую диффузию через нее GM-CSF, и дополнительно содержит одно или несколько из следующего: (i) трубка для извлечения; (ii) крючок для извлечения, прикрепленный к трубке для извлечения, где крючок для извлечения облегчает извлечение по меньшей мере одной биосовместимой макрокапсулы после имплантации; (iii) коннектор, где коннектор прикрепляет мембрану по меньшей мере одной биосовместимой макрокапсулы к трубке для извлечения; (iv) разъем для загрузки, где разъем для загрузки облегчает загрузку клеток, и (v) пробирка для транспортировки, где пробирка для транспортировки содержит корпус пробирки и крышку пробирки, причем указанная композиция предназначена для лечения злокачественной опухоли, выбранной из группы, состоящей из рака легкого, меланомы, рака молочной железы, рака ободочной кишки, рака поджелудочной железы, рака почки, острого лейкоза, хронического лейкоза, глиобластомы, лимфомы низкой степени злокачественности, лимфомы высокой степени злокачественности, множественной миеломы, саркомы, злокачественной опухоли кости, опухоли мозга, рака желудка, рака пищевода, рака головы и шеи, рака щитовидной железы, рака мочевого пузыря, рака предстательной железы, рака яичника, рака тела матки, хордомы и рака шейки матки, или для терапевтической или профилактической вакцинации, также относится к фармацевтической композиции, содержащей вакцинную композицию и физиологически приемлемый носитель, также относится к способу терапии или вакцинации против злокачественных опухолей, также относится к способу получения по меньшей мере одной биосовместимой макрокапсулы, используемой в вакцинной композиции, включающему: (a) культивирование аллогенных клеток в течение по меньшей мере двух пассажей, чтобы убедиться, что клетки секретируют GM-CSF; (b) ресуспендирование культивированных клеток в среде для культивирования клеток; (c) загрузку клеток по меньшей мере в одну биосовместимую макрокапсулу через разъем для загрузки; и (d) разрезание трубки для извлечения, чтобы удалить разъем для загрузки. Группа изобретений заключается в получении вакцинных композиций, обеспечивающих как постоянный источник иммуномодулятора, так и антигенный компонент, которые являются в основном свободными от нежелательных взаимодействий с природной или адаптивной иммунной системой. 6 н. и 36 з.п. ф-лы, 6 пр., 11 ил.

Комментарии