Новый состав для мягких желатиновых капсул, содержащих ретиноид - RU2344810C2
Код документа: RU2344810C2
Чертежи
Описание
Настоящее изобретение в основном относится к новому фармацевтическому составу, содержащему ретиноиды, в форме мягкой желатиновой капсулы.
По своему молекулярному строению ретиноиды представляют собой класс соединений, относящихся к витамину А, который включает натуральные и синтетические соединения и для которого была установлена клиническая эффективность при лечении дерматологических, онкологических и иммунологических заболеваниях.
Считается, что действие ретиноидов заключается во взаимодействии с ядерными ретиноидными рецепторами такими, как, например, известные ретиноидные рецепторы RARα, β и γ или RXRα, β и γ. Воздействие ретиноидов может быть агонистическим или антагонистическим. Ретиноиды с агонистическим рецепторным воздействием связывают и активируют рецепторы, тогда как ретиноиды с антагонистическим рецепторным воздействием связывают рецепторы, но не активируют их.
Конкретными примерами ретиноидов, для которых обнаружена клиническая применимость, являются, в частности, полностью транс-ретиноевая кислота, которая, как известно, эффективна при лечении акне, 13-цис-ретиноевая кислота, которая может использоваться для лечения тяжелых случаев акне (см. Römpps Chemie Lexikon, 1987), или 9-цис-ретиноевая кислота, 9-цис-ретиналь и 9-цис-ретинол, которые, как указывалось, являются клинически эффективными при лечении иммунных заболеваний, опосредованных ТН-клеткой типа 1 (WO 99/09969).
Ретиноиды или их фармацевтически приемлемые производные в общем случае можно назначать для местного или систематического применения.
Известны пероральные фармацевтические препараты в форме таблеток, саше (пакетов), аэрозоля для ингаляций, мягких и твердых желатиновых капсул, которые описаны, например, в ЕР-А-0552624 A1, WO 00/25772 и WO 99/24024.
Предпочтительной пероральной дозированной формой является мягкая желатиновая капсула, поскольку этот материал легко растворяется в пищеварительном тракте. Обзор мягких желатиновых капсул приведен, например, в Soft Gelatin Capsules Development, Tabibi, S.E. и Gupta, S.L., Editor: Liu, Rong, Water-Insoluble Drug Formation (2000), pp.609-633, Interpharm Press, Buffalo Grove, I11., USA. Более того, в общем случае препаратам в форме капсул являются предпочтительными, поскольку в них скрыты неприятные вкус и запах, которые могут быть связаны с самим действующим фармацевтическим компонентом. Капсулы также могут защищать действующее вещество от разрушения под действием кислорода или света.
В ЕР-А-0552624 A1, например, описана мягкая желатиновая капсула с составом наполнителя, содержащим от 5 до 50 мг 9-цис-ретиноевой кислоты, от 1 до 3 частей масла и от 1 до 5 частей смеси парафинов.
Кроме того, в WO 99/24024 описан конкретный препарат в форме мягкой желатиновой капсулы, содержащей ретиноид, в состав которого входит 20 мг действующего вещества ретиноида; 0,028 мг DL-α-токоферола; 4,2 мг гидрогенизированного касторового масла; 56,00 мг каприлового/капринового/стеаринового триглицеридов и 199,772 мг среднецепочечных триглицеридов.
Основным недостатком этого состава является очень медленное растворение, что обусловлено образованием пленок, которые возникают после длительного хранения при температуре выше 5°С. Этот процесс образования пленок усиливается с ростом температуры хранения препарата. Кроме того, в водной среде обнаруживается недиспергированный наполнитель, и в некоторые случаях происходит образование игл.
Таким образом, целью настоящего изобретения является создание усовершенствованного фармацевтического состава для содержащей ретиноид мягкой желатиновой капсулы, который обладает улучшенной растворимостью и характеризуется отсутствием тенденции к образованию пленок и/или недиспергированного наполнителя или игл.
В соответствии с настоящим изобретением новый фармацевтический состав по п.1 формулы изобретения содержит мягкую желатиновую капсулу, заполненную наполнителем, содержащим ретиноид в качестве действующего вещества, натуральное растительное масло, частично гидрогенизированное натуральное растительное масло и среднецепочечные триглицериды.
Новый состав обладает отличной кривой растворимости, в нем не образуются ни пленки, ни недиспергированный наполнитель, ни иглы, как это наблюдалось для ранее используемого состава, описанного на стр.19, абзац 14ff заявки WO 99/24024, упомянутой выше.
В предпочтительном варианте осуществления изобретения для увеличения вязкости и предотвращения седиментации суспендированного внутри капсулы лекарственного препарата наполнитель дополнительно содержит натуральный воск, особо предпочтительно желтый воск.
Кроме того, предпочтительно наполнитель может также содержать антиоксидант, который препятствует окислению действующего вещества, а также натуральных масел, и таким образом увеличивает устойчивость состава.
Натуральное растительное масло, используемое в новом составе, предпочтительно выбирают из соевого масла, кукурузного масла, подсолнечного масла, рапсового масла, льняного масла, кунжутного масла, оливкового масла, кокосового масла, арахисового масла, сафлорового масла, касторового масла и хлопкового масла или смеси двух или более этих масел. Наиболее предпочтительным является соевое масло, так как оно широко распространено и хорошо переносится.
Частично гидрогенизированные натуральные растительные масла также выбирают из масел, перечисленных выше.
Среднецепочечные триглицериды обычно выбирают из триглицеридов насыщенных жирных кислот, содержащих от 8 до 10 атомов углерода, в частности из триглицеридов каприловой и/или каприновой кислот.
Антиоксидант предпочтительно выбирают из DL-α-токоферола, бутилгидрокситолуола (БГТ) и бутилгидроксианизола (БГА).
Оболочка мягкой желатиновой капсулы обычно сдержит желатин, один или более пластификаторов и воду.
Пластификаторы предпочтительно выбирают из группы, состоящей из глицерина, сорбита, пропиленгликоля и смеси этих компонентов. Более предпочтительно пластификатор состоит из смеси глицерина и сорбита. Функцией пластификатора является обеспечение эластичности мягких желатиновых капсул.
Желатин, используемый в мягкой желатиновой оболочке, предпочтительно является свиным желатином, который, в частности, получают из свиной кожи.
В соответствии с настоящим изобретением было найдено, что при использовании комбинации свиного желатина в мягкой желатиновой оболочке и нового состава наполнителя неожиданно возникает синергетический эффект по отношению к характеристикам растворимости фармацевтического состава.
Этот эффект не наблюдался ни для комбинации бычьего желатина с новым наполнителем, ни для комбинации свиного желатина с наполнителем, использованным ранее в WO 99/24024. Вместе с тем комбинация нового наполнителя с бычьим желатином превосходила по качеству комбинацию бычьего желатина со старым наполнителем.
Дополнительным преимуществом свиного желатина также является то, что его использование позволяет избежать нормативных разногласий, связанных с использованием бычьего желатина, в частности при возникновении трансмиссивных спонгиоформных энцефалопатий коров (коровьего бешенства).
Ретиноид, содержащийся в составе в качестве действующего компонента, может быть выбран из группы, состоящей из ретинола, ретиналя, ретиноевой кислоты и их производных. В качестве конкретных примеров можно привести полностью транс-ретинол, полностью транс-ретиноевую кислоту, 13-цис-ретиноевую кислоту и 9-цис-ретиноевую кислоту. Ретиноиды могут также присутствовать в форме фармацевтически приемлемых производных таких, как соли, эфиры и пролекарства.
Наполнитель, помещенный в мягкую желатиновую капсулу, предпочтительно содержит примерно от 50 до 80 мас.%, в частности примерно от 60 до 70 мас.%, особо предпочтительно примерно от 62 до 64 мас.% натурального растительного масла, примерно от 15 до 35 мас.%, в частности примерно от 20 до 30 мас.%, особо предпочтительно примерно от 24 до 25 мас.% гидрогенизированного натурального растительного масла и примерно от 3 до 20 мас.%, в частности примерно от 6 до 12 мас.%, особо предпочтительно примерно от 8 до 9 мас.% среднецепочечных триглицеридов.
Если наполнитель также содержит натуральный воск, то его содержание предпочтительно составляет примерно от 1 до 10 мас.%, в частности примерно от 3 до 6 мас.%, особо предпочтительно примерно 4 мас.%, наиболее предпочтительным является желтый воск.
Исходя из вышеупомянутого синергетического эффекта, возникающего для наполнителя и оболочки капсулы по отношению к характеристикам растворимости in vitro, особо предпочтительный состав в соответствии с настоящим изобретением содержит оболочку мягкой желатиновой капсулы, в состав которой входит свиной желатин, глицерин, сорбит и вода, и наполнитель, в состав которого входит ретиноид, в частности 9-цис-ретиноевая кислота, в качестве действующего компонента, соевое масло, гидрогенизированное соевое масло, среднецепочечные триглицериды, желтый воск и DL-α-токоферол.
При необходимости можно добавить другие фармацевтически приемлемые добавки такие, как красители, вкусовые добавки, стабилизаторы, эмульгирующие компоненты и другие.
Далее изобретение будет подробно описано на примерах, не ограничивающих его объем.
Примеры
Мягкие желатиновые капсулы, соответствующие известному прототипу и настоящему изобретению, получали, используя стандартный метод, схема которого описана далее, следуя требованиям GMP (Правила организации производства и контроля качества лекарственных средств). Каждую стадию (если это необходимо) проводили в инертной атмосфере (азот) при желтом освещении.
Для приготовления наполнителя триглицериды и масляные компоненты взвешивают в емкости из нержавеющей стали, нагревают до температуры максимум 70°С и охлаждают до комнатной температуры при постоянном перемешивании. При необходимости к полученной смеси добавляют антиоксидант, например DL-α-токоферол, и затем перемешивают при комнатной температуре в течение примерно 30 минут.
Затем в смеси добавляют ретиноид, например 9-цис-ретиноевую кислоту, и перемешивают до получения однородной суспензии. Суспензию до инкапсулирования хранят в инертной атмосфере при пониженном давлении в герметично закрытой емкости из нержавеющей стали, обеспечивающей защиту суспензии от света.
Процесс инкапсулирования гомогенной суспензии в мягкую желатиновую оболочку, хорошо известный специалистам в данной области техники (см, например, Bauer, K.H. и др., Lehrbuch der Pharmazeutischen Technologie, 6th ed., pp.343-348, Stuttgart, 1999), проводят в ротационной красильной машине.
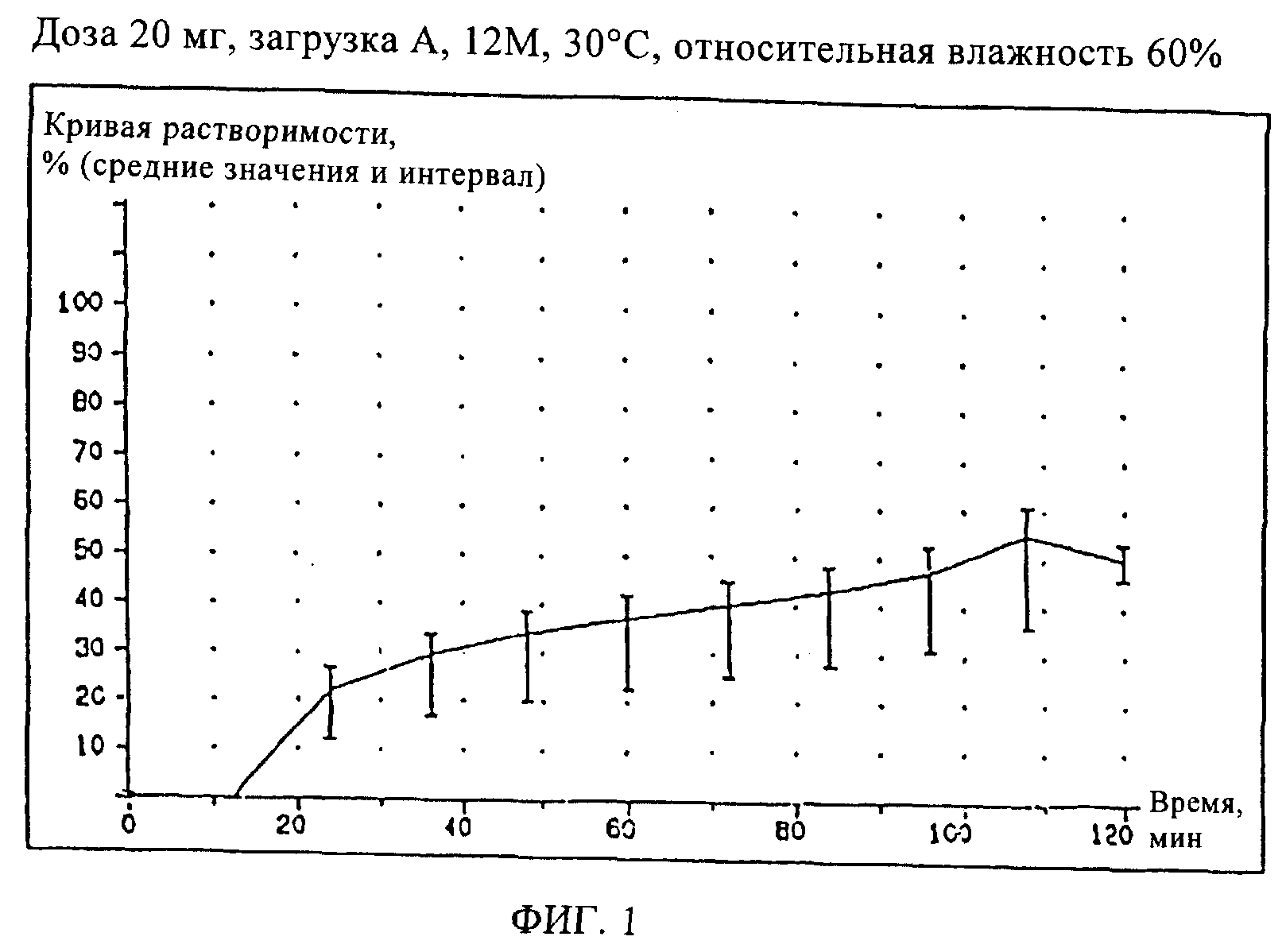
Сравнительный пример 1 (загрузка А)
Состав мягкой желатиновой капсулы, соответствующий прототипу, описанному в WO 99/24024, приготовили, как описано выше, при этом использовали следующие компоненты наполнителя и оболочки капсулы:
Старый наполнитель:
Использовали Miglyol® 812 и Softisan® 378 производства Sasol, Witten, Gennany, DL-α-токоферол производства Roche Vitamins, Sissein, Switzerland; гидрогенизированное касторовое масло и алитретиноин производства Hoffmann La-Roche, Basel, Switzerland.
Оболочка капсулы
В Примерах и Сравнительных Примерах использовали все типы желатина производства DGF Stoess, Eberbach, Germany, глицерин производства Uniquema, Emmerich, Germany, сорбит, жидкий некристаллизирующийся производства Merck, Darmstadt, Germany, оксид железа красный и желтый производства Kahl, Trittau, Germany, соевое масло, а также частично гидрогенизированное соевое масло производства Florin, Muttenz, CH.
Испытания растворимости проводили с известным составом, описанным в Сравнительном Примере 1. Было найдено, что для смеси Miglyol® 812/Softisan® 378/гидрогенизированное касторовое масло при испытании возникают проблемы с растворимостью, связанные с образованием пленки после хранения при повышенных температурах. Уже после 1 недели при температуре 40°С при испытании растворимости наполнитель покрывался хорошо видимой пленкой. Кроме того, также наблюдались комки недиспергированного наполнителя.
Кривая растворимости мягкой желатиновой капсулы, соответствующая Сравнительному Примеру 1 (загрузка А), показана на Фиг.1. Даже при оптимизированных условиях тестирования кривая растворимости при более высоких температурах становится пологой, что, по-видимому, обусловлено упомянутыми выше эффектами. Степень растворимости образцов, хранившихся при 40°С, уже через 1 месяц редко превышает 20% (данные не показаны).
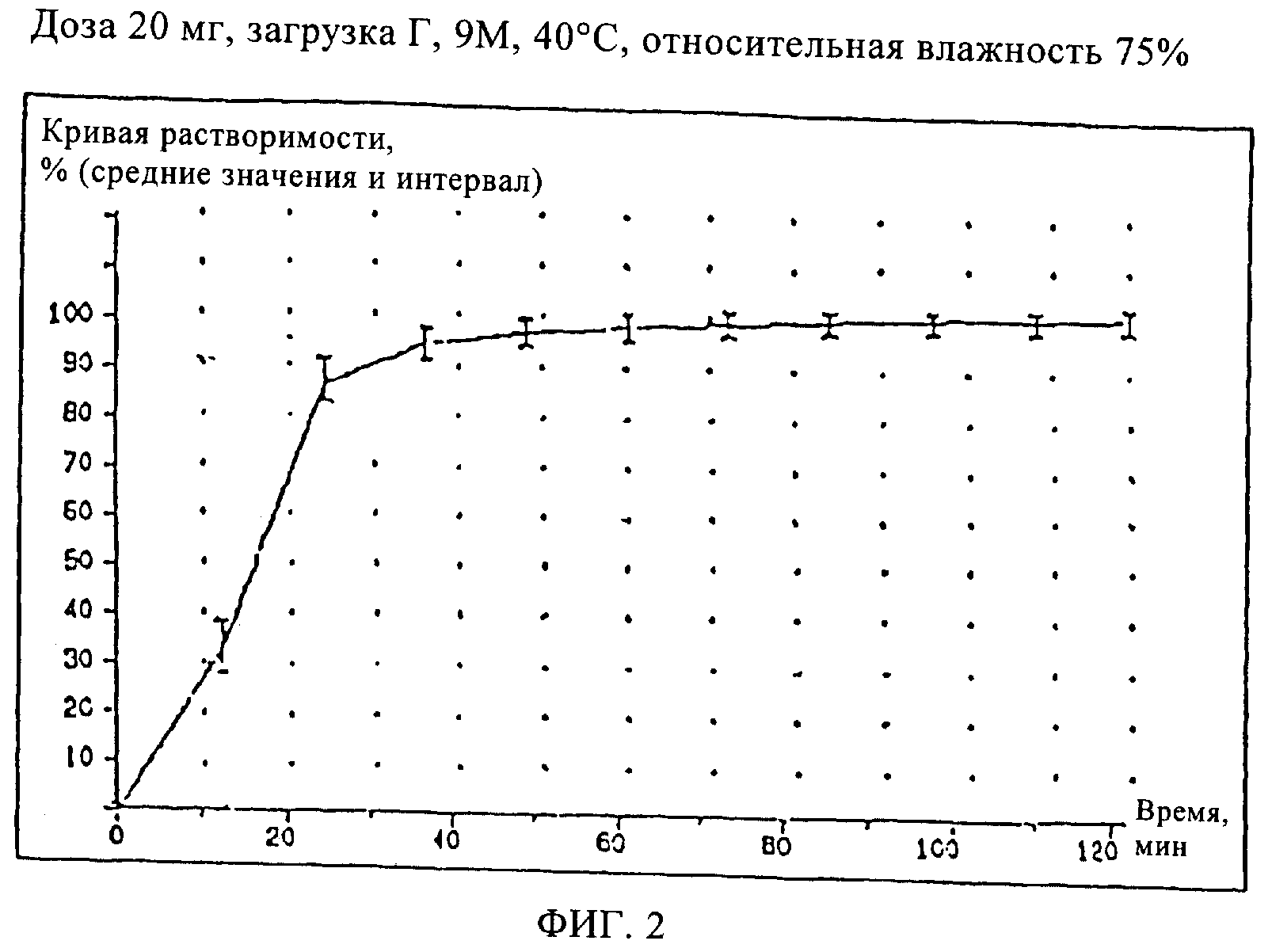
Пример 2 (загрузка Г)
Состав мягкой желатиновой капсулы, соответствующий настоящему изобретению, приготавливали, как описано выше, при этом использовали следующие компоненты:
Новый наполнитель, соответствующий настоящему изобретению:
Оболочка капсулы:
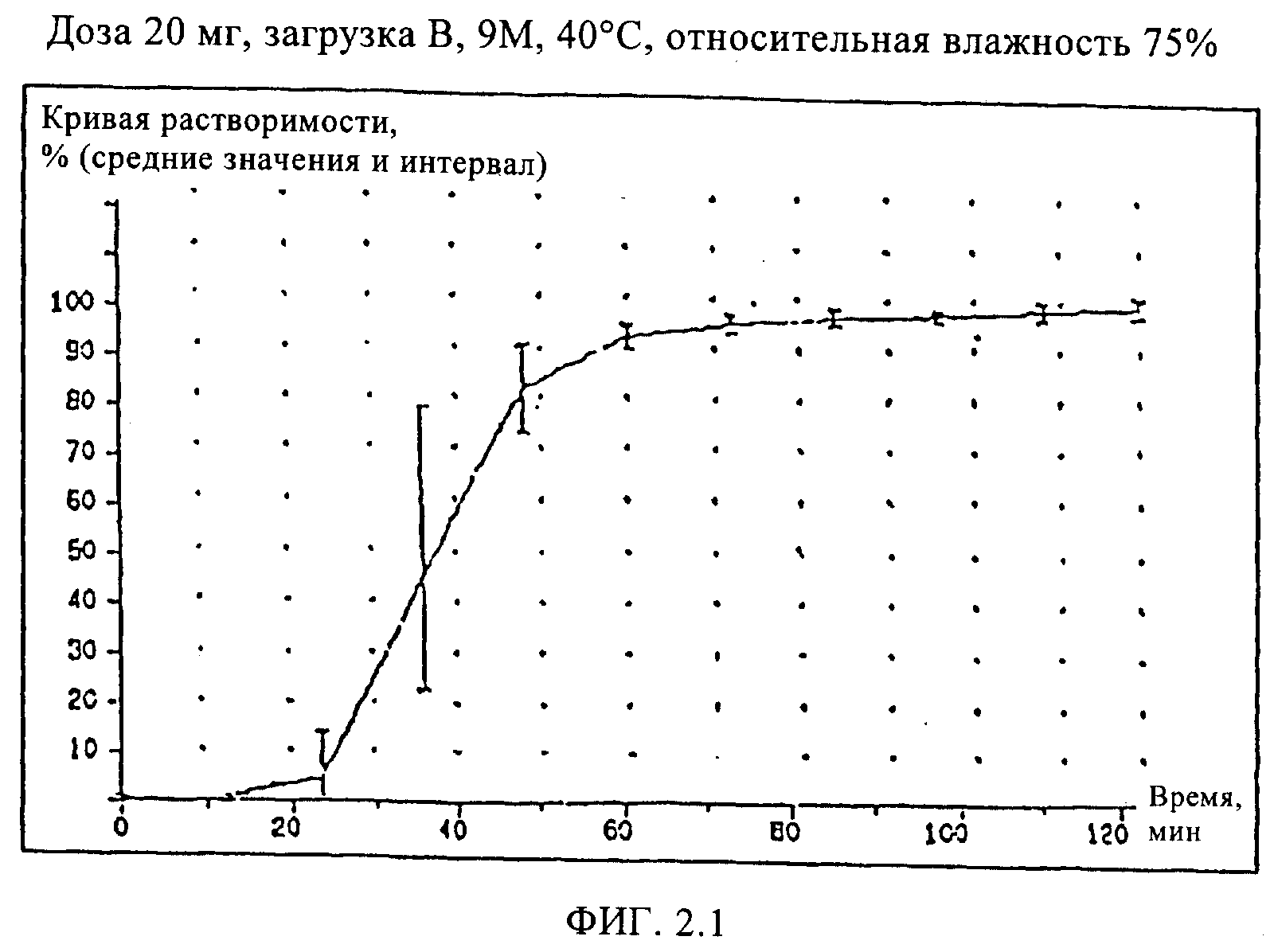
Пример 3 (загрузка В)
Кроме того, состав мягкой желатиновой капсулы, соответствующий настоящему изобретению, был приготовлен, как описано в Примере 2. При этом наполнитель был полностью идентичен наполнителю Примера 2, а оболочка капсулы содержала вместо свиного желатина бычий и имела следующий состав:
Оболочка капсулы:
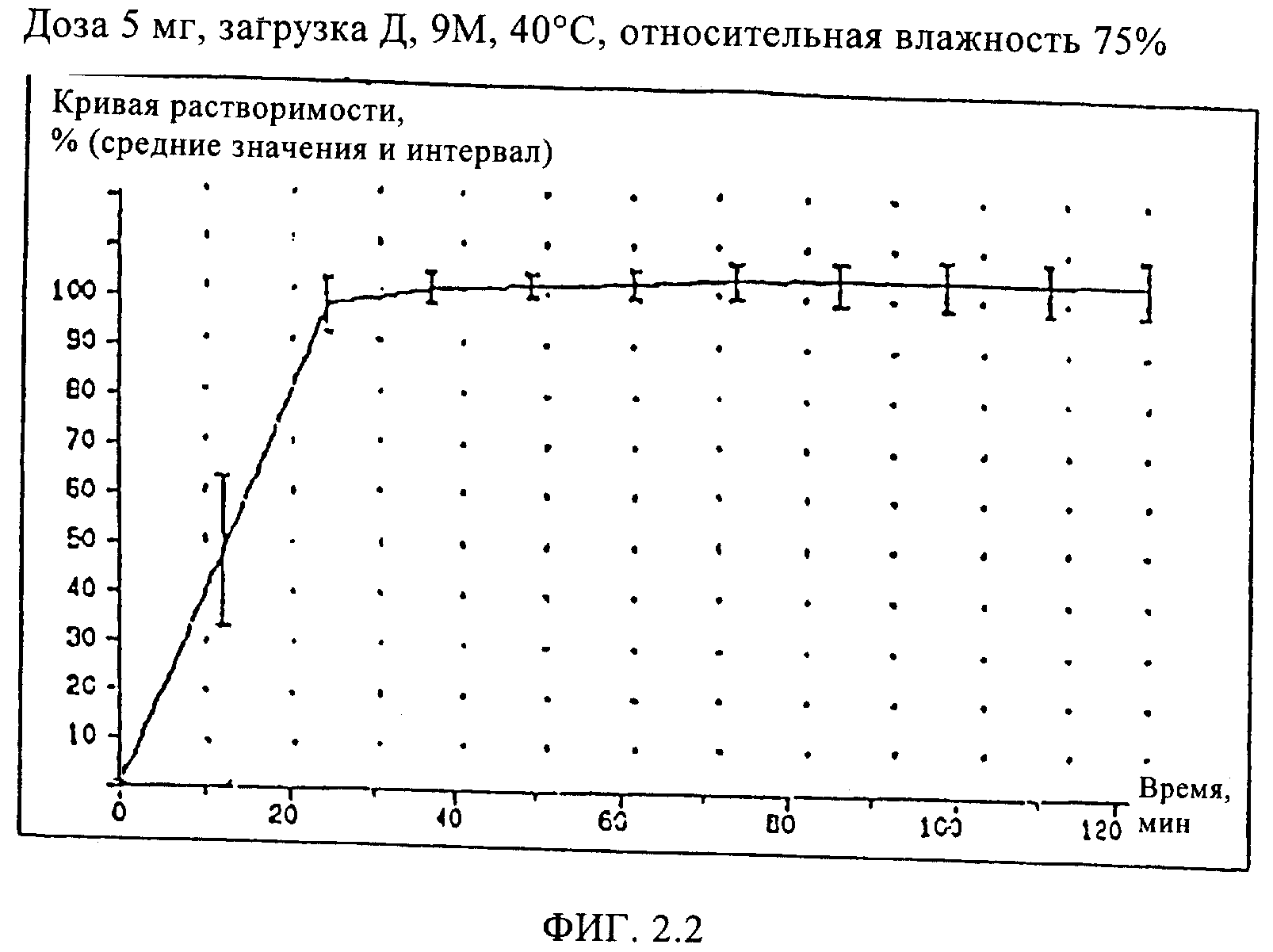
Пример 4 (загрузка Д)
Кроме того, приготовили состав мягкой желатиновой капсулы, соответствующий настоящему изобретению, с наполнителем, описанным в Примере 2, за исключением того, что использовали 5 мг алитретиноина и дополнительно 15 мг соевого масла и следующий состав оболочки капсулы:
Оболочка капсулы:
Было найдено, что составы, описанные в Примерах 2, 3 и 4, сохраняют необходимую стабильность при хранении при температурах до 30°С по крайней мере в течение 12 месяцев.
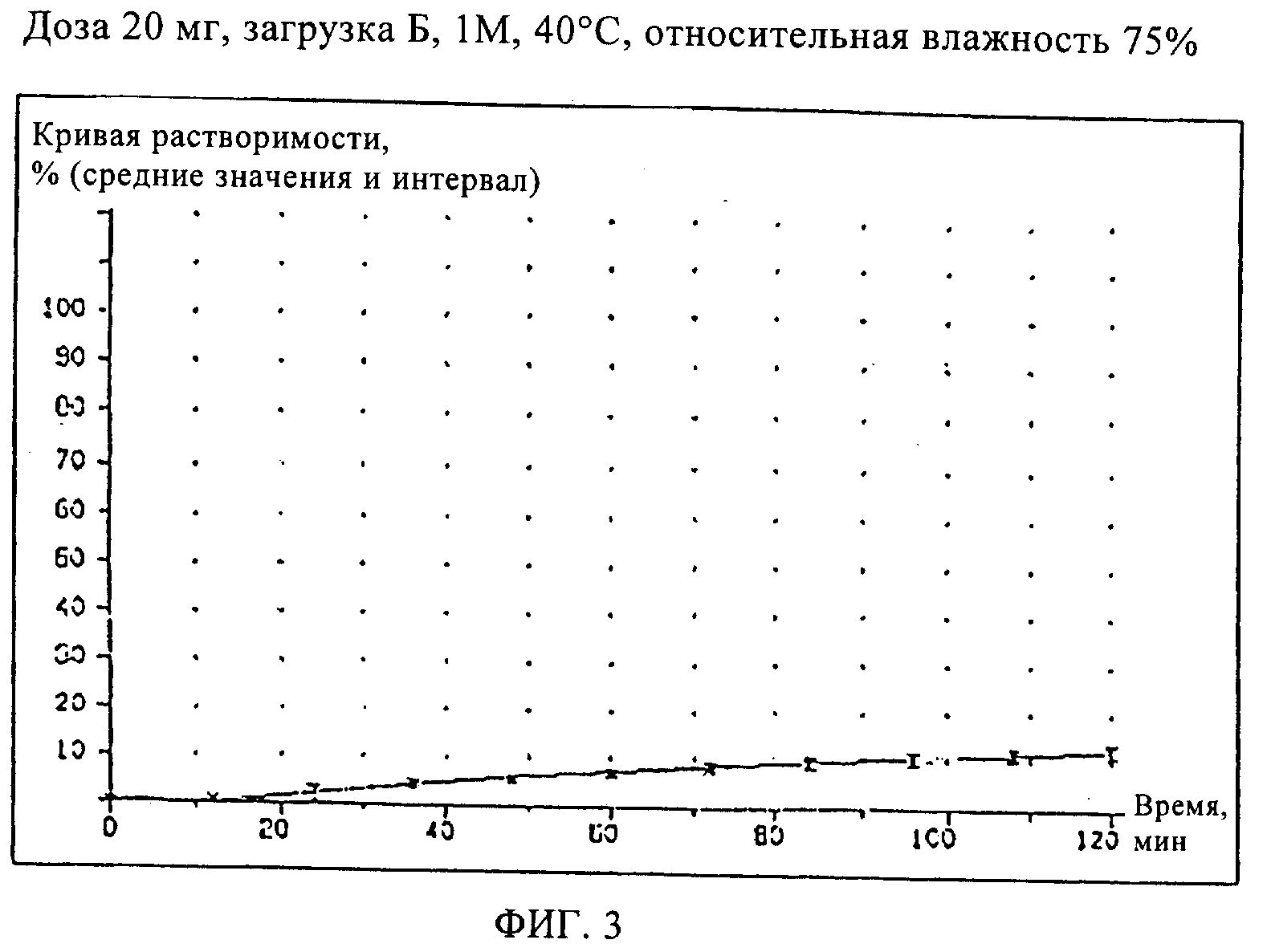
Сравнительный Пример 5 (загрузка Б)
Кроме того, приготовили состав мягкой желатиновой капсулы, содержащий старый состав наполнителя, приведенный в Сравнительном Примере 1, и состав оболочки капсулы из Примера 2.
Испытания растворимости проводили для образцов составов, описанных в Примерах 2, 3, 4 (загрузки Г, В и Д) и в Сравнительном Примере 5 (загрузка Б), хранившихся при температуре 40°С и относительной влажности 75%, чтобы ускорить определение возможных различий в кривых растворимости рассматриваемых составов.
Кривые растворимости составов Примеров 2, 3, и 4 приведены на Фиг.2, кривая растворимости состава Сравнительного Примера 5 приведена на Фиг.3.
Как видно из кривой растворимости состава Сравнительного Примера 5, в котором использовался старый наполнитель, этот состав имеет такую же плохую растворимость, как и состав Сравнительного Примера 1, тогда как составы Примеров 2, 3 и 4 характеризуются значительно лучшей растворимостью, что проявляется в улучшенных кривых растворимости.
В новых составах, соответствующих настоящему изобретению, почти полное высвобождение лекарства происходит за короткое время в той же установке для испытаний растворимости. Эти результаты могут быть воспроизведены даже после 12 месяцев хранения при тех же условиях ускоренного хранения.
Наконец, химическую устойчивость действующего вещества, находящегося в виде суспензии в составе наполнителя, описанном в Сравнительном Примере 1, а также Примере 2, испытывали в течение 6-месячного хранения и определяли количество продуктов разложения (включая продукты разложения 13-цис-ретиноевой кислоты и полностью транс-ретиноевой кислоты, а также неизвестные продукты разложения). Результаты для сравнения приведены в следующей таблице.
Условия хранения: продолжительность 6 месяцев, температура 40°С, относительная влажность 75%.
Как видно из таблицы, суммарное количество продуктов разложения может быть уменьшено от 1,49% для известного состава до 0,98% для состава, соответствующего настоящему изобретению.
Кроме того, испытание устойчивости, аналогичное описанному выше, было проведено для наполнителей составов Сравнительного Примера 1 и Примера 2, содержащих только 5 мг действующего компонента вместо 20 мг и дополнительно 15 мг соевого масла (Сравнительный Пример 1) или 15 мг Miglyol® 812 (Пример 2). В этом случае суммарное количество продуктов разложения может быть уменьшено с 2,93% до 1,64% (соответствует уменьшению примерно на 50%).
Это улучшение химической устойчивости является дополнительным преимуществом нового состава настоящего изобретения.
Реферат
Изобретение относится к фармакологии. Фармацевтический состав ретиноидов включает мягкую желатиновую капсулу, заполненную наполнителем, содержащим ретиноид в качестве действующего вещества, от 50 до 80 мас.% натурального растительного масла, от 15 до 35 мас.% частично гидрогенизированного натурального растительного масла и от 3 до 20 мас.% среднецепочечных триглицеридов, причем наполнитель дополнительно включает от 1 до 10 мас.% натурального воска. В особо предпочтительном варианте осуществления изобретения мягкая желатиновая капсула содержит комбинацию вышеуказанного состава и оболочки капсулы, содержащей свиной желатин. Изобретение обеспечивает улучшение растворимости состава. 16 з.п. ф-лы, 1 табл., 3 ил.

Комментарии