Композиции с замедленным (пролонгированным) высвобождением - RU2093148C1
Код документа: RU2093148C1
Чертежи





Описание
Настоящее изобретение относится к пролонгируемым композициям, в особенности к тем, у которых параметры, характеризующие процесс замедленного высвобождения, обусловлены свойствами покрытия/оболочки. В настоящем случае термин покрытие/оболочка охватывает покрытия твердых подложек, а также капсул, заключающих жидкости и/или твердые компоненты, и термин "покрытый" используется в аналогичном значении.
Во многих случаях желательно, чтобы активное вещество было покрыто таким образом, чтобы его высвобождение из оболочки происходило только после предварительно определенного интервала или только после изменения окружающей среды. В медицинском контексте это выгодно, в частности, потому, что позволит осуществлять пероральный прием лекарственного средства, которое находится в такой оболочке, которая позволяет пройти лекарственному средству через желудок и высвободиться только после достижения покрытого оболочкой материала тонкой кишки. Такие покрытия (оболочки называются энтеросолюбильными оболочками) покрытиями и их можно довольно просто изготовить, приняв во внимание следующие данные среда в желудке кислая, а в кишечнике нейтральная или слабощелочная.
Более трудной задачей является создание лекарственного средства, покрытого оболочкой, которое бы проходило через желудок и тонкую кишку и высвобождало бы активный ингредиент только тогда, когда достигнет толстой кишки или ободочной кишки.
Многие заболевания толстой кишки, например язвенный колит, заболевание chron's, и возможно также рак толстой кишки, будут лучше излечиваться, если будет достигнута эффективная доставка лекарственного средства в место локализации заболевания. Лекарственные/терапевтические средства включают кортикостероиды, например гидрокортизон и преднизолон, бисокодил, фенолфталеин, реин, сульфасалазин, холестирамин, азатиоприн, 5-аминосалициловую кислоту и различные антибиотики, а также средства, вызывающие релаксацию гладких мышц. Доступны лишь немногочисленные эффективные пероральные средства, а введение через прямую кишку это грязный и сравнительно дорогой способ. Если лекарства для лечения заболеваний толстой кишки инкапсулированы в энтеросолюбильную оболочку, то адсорбция лекарства из тонкой кишки происходит очень быстро, и лишь незначительное количество лекарства достигает требуемого места действия. В том случае, когда достигается высвобождение лекарственного средства непосредственно в зоне заболевания, то можно использовать меньшие дозы лекарства, что приводит к снижению побочного действия препарата.
Также встречаются ситуации, несвязанные с лечением заболеваний толстой кишки, когда бывает необходимо доставить лекарство в толстую кишку до его высвобождения. Так, в случае некоторых заболеваний, таких как артрит, высвобождение лекарства в подвздошной кишке может вызвать осложнения и желательно, чтобы слабительные и противодиарейные препараты высвобождались непосредственно в толстой кишке. Другие лекарственные средства могут также выиграть от такой формы высвобождения, которая зависит от абсорбционных характеристик.
Ряд сообщений свидетельствуют о высвобождении в конкретном участке толстой кишки. Так, гликозидные производные стероидных лекарственных средств слабо адсорбируются в желудке и тонкой кишке, но под действием микробов высвобождаются в толстой кишке (смотри работу Frienoh D.R. и Chang G.W. J. Meg. chem, 1984, 27, 261). Кроме того, полимерные покрытия на основе поперечно-сшитых с азоароматическими группами полимеров, для лекарственных средств пептидной природы, по имеющимся сообщениям защищают лекарственные средства от переваривания в желудке и тонкой кишке, а также позволяют высвободиться лекарственному средству из оболочки в толстой кишке под действием присущей ей микрофлоры, разрушающей азосвязи (смотри работу Saffron M. et. al. Sciehce 1986, 233, 1081).
В патентной заявке ОК N 8912038. 9 (опубликованной как ВБ 22203 5 ОА) описано использование глазированной амилозы в тех случаях, когда необходимо эффективное высвобождение в конкретном участке толстой кишки. Эта заявка относится к возможности дальнейшего покрытия амилозной оболочки соединения, но только в контексте использования "традиционного желатина или энтеросолюбильного покрытия" для этой цели. Недавно было обнаружено, что наиболее положительный результат может быть получен в случае использования особой формы дополнительного покровного материала в сочетании с глазированной амилозой или же с другими преимущественно аморфными формами амилозы, каучукообразной амилозой.
В соответствии с настоящим изобретением состав замедленного высвобождения включает активное соединение и аморфную форму амилозы и имеет внешнее покрытие, включающее пленку, образованную целлюлозой или полимерным материалом на основе акрила.
Это изобретение базируется на открытии свойства внешней оболочки, включающей целлюлозный или акриловый полимерный материал, связанного с усилением параметров, определяющих высвобождение состава. Не делая никаких предположений о каком-либо конкретном способе замедленного высвобождения для состава настоящего изобретения, предполагают, что целлюлозный или акриловый полимерный материал выполняет в желудке и тонкой кишке функцию, связанную с поддержкой тех задач, которые выполняет амилоза по предотвращению высвобождения активного соединения в этих частях пищеварительного тракта. Однако полагают, что целлюлозный или акриловый полимерный материал постепенно, по мере прохождения через пищеварительный тракт состава, размягчается так, что, когда он попадает в толстую кишку, то высвобождение активного соединения в ней в основном регулируется распадом амилозы под действием ферментов, выделяемых микрофлорой, присутствующей в толстой кишке.
Пленка, образуемая целлюлозными материалами, используемыми в составах настоящего изобретения, может быть разной, но для ее образования предпочтительно использовать эфиры целлюлозы, включая натрий карбоксиметилцеллюлозу, натрий карбоксиметил 1-гидроксиэтилцеллюлозу, 2-гидроксиэтилцеллюлозу, 2-гидроксипропилцеллюлозу, метилцеллюлозу, 2-гидроксиэтилметилцеллюлозу, 2-гидроксипропилметилцеллюлозу, 2-гидроксибутилметилцеллюлозу, и 2-гидроксиэтил этилцеллюлозу, которые характеризуются как водорастворимые, и, в частности, 2-цианоэтилцеллюлозу, этил 2-гидроксиэтил целлюлозу, и, в особенности, этилцеллюлозу, которые относятся к растворимым в органических растворителях производным целлюлозы. Могут быть использованы смеси различных производных целлюлозы.
Хотя материалы на основе целлюлозы являются предпочтительными пленкообразующими материалами, используемыми для формирования внешней оболочки, акриловые полимеры могут также использоваться в составах настоящего изобретения либо сами по себе, либо в сочетании с целлюлозным материалом. В частности, могут использоваться как полиакрилаты, так и полиметакрилаты, и, в особенности, сополимеры акрилатов с метакрилатами, эфирные группы в этих сополимерах различны, например они могут быть представлены C1-C18 алкильными группами.
Область предпочтительных молекулярных масс пленкообразующих полимерных материалов находится в интервале от 42.000 до 280.000 г/моль (или дальтон), а для пленкообразующих материалов на основе акриловых полимеров от 150.000 до 250.000 г/моль (или дальтон), но могут также использоваться материалы с молекулярной массой, выходящей за пределы представленных молекулярных масс, например полимеры с более высокой молекулярной массой соответственно могут быть использованы.
Деструкция целлюлозных материалов in vivo, как правило, не зависит от значения pH среды, и предпочтительно, чтобы это было так и для акрилового полимерного материала от pH среды может быть достигнута за счет подбора соответствующих заместителей боковой цепи в основной цепи полимера, в частности, выбором боковых цепочек, имеющих низкий отрицательный заряд или предпочтительно незаряженных боковых цепочек, а не цепочек, имеющих положительный заряд. Предпочтительны полимерные материалы на основе акрилов, выпускаемые на рынок фирмой Dumas /OK/ Tuhbridge Wells под торговой маркой Eudragit, в частности материалы Eudragit RL и RS, деструкция которых не зависит от pH среды. Среди целлюлозных материалов предпочтительна этилцеллюлоза, выпускаемая под торговой маркой Этоцель фирмами Dow chemical и Shihetsy Chemical Products.
Как указывалось, глазированная амилоза это одна из двух форм преобладающей аморфной амилозы, другой является каучукообразная форма, и именно глазированную/стеклообразную амилозу выбирают для использования в настоящем изобретении. Амилоза существует в стеклообразном состоянии ниже температуры стеклования (Тg). Повышение температуры выше Тg приводит к резкому увеличению теплоемкости амилозы 0, 5±0,15 г-1 K-1 (джоуль на грамм на градус Кельвина). Этот инкремент теплоемкости позволяет определить Tg и измерить ее, используя метод дифференциальной сканирующей калориметрии. (Примеры, в которых описаны способы определения значений Tg и более ранние литературные ссылки на эти способы, приведены в работе Orford et al Jnt. J. Biol macromol, 1989, 11, 91).
Конкретная Tg данного препарата амилозы зависит от его чистоты и других свойств. Так, например, теоретическое значение Tg для чистой, сухой амилозы может быть предварено значением 210oC, но присутствие воды снижает эту цифру: при содержании воды, составляющем 10 вес./вес. значение Tg равно 80oC, а при содержании воды, равном 20 вес./вес. оно равно 7oC. Обнаружено, что α-амилолитические ферменты не охотно разрушают глазированную/стеклообразную амилозу, и это их свойство сохраняется до температуры, на 20oC превышающей температуру стеклования амилозы. Было обнаружено, что такие материалы в основном нерастворимы в воде в интервале значений pH от 1-9 при 37oC и устойчивы к условиям деструкции, существующим в желудке или кишечнике. Однако они могут разрушаться под действием фекальных микроорганизмов, присутствующим в толстом кишечнике. Как указывалось, способность глазированной/стеклообразной амилозы обеспечивать необходимые параметры замедленного высвобождения не исчезает сразу после прохождения стеклообразной амилозы через температуру стеклования, и амилоза, которую получают в условиях стеклования при температурах ниже Тg может быть использована при Тg или при температурах несколько выше чем Тg, также как и при температурах ниже Тg, если при этом еще сохраняются свойства, присущие стеклообразному состоянию. Однако глазированная/стеклообразная амилоза, используемая в настоящем изобретении, предпочтительно имеет температуру стеклования Тg не менее чем на 20oС ниже температуры, при которой предполагается использовать данный состав, другими словами при температуре тела, равной примерно 37oС. Итак, температура стеклования амилозы Тg не должна быть ниже чем на 20oС, 37oС, говоря другими словами, она должна быть выше или равна 17oС, и, предпочтительно, когда она выше или равна примерно 30oС, или более предпочтительно, когда температура стеклования выше или примерно равна 40oС. Температура стеклования Тg может быть предварительно рассчитана путем определения количества воды в амилозе. Контроль за содержанием воды может быть осуществлен путем варьирования концентрации раствора амилозы, который, либо охлаждают, либо напыляют, а затем высушивают полученный гель.
Окончательным испытанием на пригодность конкретного образца амилозы в любых заданных условиях является безусловно определение способности образца противостоять гидролитической деструкции в водной среде, конкретно при значениях рН среды в интервале 1-9 и температуре 37oC, и также хорошо, когда образец противостоит ферментативному разрушению в присутствии пищеварительных ферментов, которые обычно присутствуют в желудке и тонкой кишке, но когда он подвергается разрушению под действием ферментов, расщепляющих амилозу, выделяемых микробной флорой обычно присутствующей в толстой кишке (смотри испытания, описанные в примерах 1 и 4).
Удобным способом формирования глазированной/стеклообразной формы амилозы является либо путь формирования геля из водного раствора с последующей его сушкой, либо высушивание путем напыления. В первом варианте удобно, когда раствор амилоз имеет концентрацию 1,5-40 вес./вес. амилозы, предпочтительно, когда концентрация амилозы составляет 3-30% более предпочтительно, когда она составляет 4-20% а наиболее предпочтительно 6-10% и охлаждают его от 70-95oС, предпочтительно, от 88-92oС, до 0-40oС, предпочтительно, до 5-35oС, более предпочтительно до 10-30oС, со скоростью охлаждения, составляющей от 10-3 до 105oС/с, предпочтительно от 0,1 до 1,0oС в секунду. В общем процесс охлаждения должен длиться в течение часа, предпочтительно он должен занимать 2 ч или менее, лучше день, для того, чтобы предотвратить слишком быструю кристаллизацию, хотя некоторая степень кристаллизации приемлема, например 20% или в особенности 10% или менее. Гелеобразование протекает за счет раздела фаз, в результате которого образуется концентрированная, обогащенная полимером фаза и фаза с обедненным содержанием полимера. Полимер-обогащенная фаза может содержать только 10 вес./вес. воды и следовательно ее стеклование (образование глазури) будет идти при комнатной температуре даже в том случае, если весь гель будет содержать свыше 90 вес./вес. воды. Весь препарат может быть высушен, если это необходимо или желательно, при температуре 0-160oС, а более предпочтительно, при примерно 60oС на воздухе или в инертной атмосфере, например в азоте или в вакууме, для получения глазированного/стеклообразного или более глазированного/стеклообразного продукта.
Сухая стеклообразная амилоза может быть расплавлена для получения слябов или пленок, или вначале может быть превращена в порошок или гранулы. Такой процесс плавления может сопровождаться добавлением подходящего разбавителя, такого как вода, если понижают Тg. Расплавленную амилозу можно затем использовать для нанесения покрытия на препараты активного соединения.
В альтернативном варианте водный или водно-спиртовый раствор, например водно-бутанольный раствор, амилозы, предпочтительно содержащий 1-15% подходит раствор, содержащий 2-10% а наиболее подходит раствор примерно 2-3 вес. /вес. напыляют непосредственно на состав, содержащий активное соединение, и сушат на воздухе, в инертной атмосфере, например в азоте, или в вакууме, до образования глазированной оболочки. Еще один вариант с использованием водного раствора состоит в том, что водный раствор напыляют, как описано, на подходящую инертную подложку или распыляют в достаточно большом объеме воздуха или инертного газа с образованием в результате стекловидной пленки или стеклообразных частиц, которые затем расплавляют и используют для покрытия составов активного соединения так, как об этом сказано выше.
Исходя из общих соображений содержание влаги в стеклообразной амилозе должно быть как можно меньше. Таким образом подходит содержание, не превышающее 20 вес. /вес. но предпочтительно, когда содержание влаги меньше этой величины, например когда содержание влаги не превышает 10, 5 или 1 вес./вес.
В случае как процесса гелеобразования, так и процесса напыления можно включать дисперсии или растворы подходящих активных соединений в раствор амилозы таким образом, что образующиеся в результате глазированные (стеклообразные формы) частицы содержат фактически лекарственное средство. В частности, удобно выдавливать амилозный раствор, содержащий активное соединение в форму, при этом происходит образование твердых гранул/пилюль, покрытых глазированной оболочкой.
Амилоза может быть получена из любого подходящего источника, хотя предпочтительно получать ее из крахмала, например из зернового крахмала или крахмала, извлеченного из клубней, но в особенности хорош для этих целей крахмал, извлекаемый из бобовых растений, например из зерен гороха, путем осаждения из водного раствора в виде комплекса со спиртом, например комплекса с 1-бутанолом, метанолом, этанолом, пропан-1-олом, пропан-2-олом, пентанолом, 2-метилбутан-2-олом, или 2-метилбутан-1-олом, как это описано в работе Rihg и др. Macromolecules, 1985, 18, 182. Алкоголь может быть затем удален из водной дисперсии этого комплекса путем пропускания через эту дисперсию подходящего, нагретого инертного газа, например азота.
Следует учитывать, что присутствие других материалов в смеси со стеклообразной амилозой будет снижать степень селективности деградации этого материала как в желудке, так и в тонком и толстом кишечнике, поэтому предпочтительно, чтобы стеклообразная амилоза была преимущественно свободна /т.е. содержала не более 20 мас. и предпочтительно, не более 10 или 5 мас./ любого материала, который способен перевариваться в желудке или тонком кишечнике. В частности, стеклообразная амилоза предпочтительно содержит не более чем 10 или 5 мас. амилопектина, например 1 или 2% или меньше, а также любого другого материала, содержащего гликозидные связи типа обнаруживаемых в амилопектине.
Кроме того, предпочтительно, чтобы стеклообразная амилоза не имела гидроксигрупп в форме производного, если же раковые производные амилозы, содержащие гидроксильные группы присутствуют, то желательно, чтобы содержание гидроксигрупп не превышало 10% в частности чтобы оно составляло не более 4 или 5% а предпочтительно, 1 или 2% или меньше.
Удобным способом определения чистоты амилозы является определение способности амилозы связывать йод в стандартной процедуре анализа, такой как описана в работе Banks и др. Starch, 1971, 23, 118. Так, чистая, не содержащая производных, амилоза связывает йод в количестве, отставляющем примерно 19,5 вес. /вес. точнее 19,5±05 вес./вес. в то время как другие основные полисахариды крахмала, например амилопектин, связывает менее 2,0 вес./вес. йода, а превращение амилозы в ее производные также приводит к снижению ее способности связывать йод. В связи со сказанным, в настоящем изобретении удобно использовать амилозу, которая связывает йод на уровне 15,0±0,5 вес./вес. или выше, предпочтительно, на уровне 18,0±0,5 вес./вес. или выше, и в особенности, предпочтительна амилоза, которая связывает йод на уровне 19,5±0,5 вес./вес.
Удобно, когда молекулярная масса амилозы, используемой в настоящем изобретении составляет по крайней мере 20000 г/моль /или дальтон/ и предпочтительно когда выше этой величины, так, что предпочтительнее использовать амилозу с молекулярной массой, равной по крайней мере 100000, 200000, 300000, 400000 или 500000 г/моль, в зависимости от конкретных обстоятельств.
Хотя в использовании стеклообразной амилозы в составах настоящего изобретения имеется преимущество, но также можно использовать и каучукообразную амилозу. В частности, ее можно добавлять на стадии формирования покрытия, для контроля проницаемости или в качестве пластификатора, добавляемого к амилозе, таким же путем, как это описано здесь далее в связи с использованием пластификаторов с целлюлозными или акриловыми полимерными материалами. Это может привести к образованию амилозы, которая будет скорее каучукообразной, нежели стеклообразной при комнатной температуре, поскольку пластификатор может снижать температуру стеклования Тg амилозы, что приведет к тому, что она будет стекловаться на несколько десятков градусов ниже, например на 10o, 20o, 30oС или более, комнатной температуры. Несмотря на то, что в температурном интервале, охватывающем 20oC выше Тg, сохраняются характерные признаки стеклообразного состояния, о чем шла речь выше, амилоза настоящего состава может скорее находиться в каучукообразном состоянии при физиологической температуре, если также не находится в таком состоянии при комнатной температуре. Такие составы, содержащие каучукообразную амилозу, также представляют ценность, в особенности, когда получены с использованием водорастворимого пластификатора, поскольку пластификаторы подобного типа будут иметь тенденцию к вымыванию в водной среде, образуя в результате пористый амилозный материал. В частности, это имеет значение, когда амилоза используется для получения внутреннего покрытия, а внешней оболочкой служит целлюлоза или акриловый полимерный материал, о чем будет идти речь ниже, такая оболочка может обеспечить наиболее подходящий способ достижения контролируемого высвобождения в толстой кишке.
Другой аспект настоящего изобретения заключается в составах и их использовании в соответствии с описанием патентной заявки ОК N 02120 48.9 (опубликованной под N 222035 ОА ВБ), упоминаемой здесь ранее, и ее эквивалентами (патентная заявка Канады N 600598, патентная заявка европейская N 89305318.1 и РСТ заявка ВБ/00581 и национальные заявки Дании, Финляндии, Японии, Норвегии и США, вытекающие из нее), согласно которому глазированная/стеклообразная амилоза заменяется каучукообразной амилозой, в частности каучукообразной амилозой, полученной с использованием пластификатора, как это описано выше.
Термин "активное соединение", в частности, включает любое соединение, используемое в медицинской практике человека и животных как в диагностических целях, так и для лечения. Терапевтические средства, представляющие конкретный/особый интерес, упоминались ранее. Составы настоящего изобретения представляют интерес и в диагностическом контексте, например они представляют интерес как средства доставки контрастного вещества в толстую кишку при рентгеноскопии или ЯМР-сканировании, помимо их использования в качестве средств, позволяющих осуществлять замедленное высвобождение препарата, предназначенного для лечения, в особенности при доставке этих препаратов в толстую кишку. Альтернативная область диагностики, кроме рентгеноскопии и ЯМР-сканирования, находится в доставке аллергенных компонентов пищи в толстую кишку при диагностике природы аллергии.
Следует учитывать, что активное соединение может быть смешано с другими материалами-носителями, пригодными дня конкретного использования. Так, в частности, при использовании в терапевтических целях активное соединение зачастую смешивают с одним или более веществ, добавляемых для увеличения объема, и лабрикантом, например лактозой и стеаратом магния соответственно. Дозировки активного соединения, используемого в терапевтических целях, описываются в литературе, например в ABPI Data Shect Compehdium, или в некоторых случаях быть меньше, что связано с более эффективным способом доставки соединения.
Одним из предпочтительных "активных соединений" является 5-аминосалициловая кислота /5-АСА/, лекарство, которое принимают перорально при лечении расстройств толстого кишечника. При введении 5-АСА перорально лишь небольшое количество его достигает толстой кишки, поскольку большая часть лекарства инактивируется и/или абсорбируется в желудке и тонкой кишке. Настоящее изобретение обеспечивает состав, включающий 5-АСА, который можно вводить перорально, с замедленным высвобождением значительного количества активного ингредиента в толстой кишке. 5-АСА предпочтительно выпускают в форме шариков, сформированных в смеси с микрокристаллической целлюлозой и минимальным количеством неорганического связующего, такого как бентонит.
В составах замедленного высвобождения, соответствующих настоящему изобретению, амилоза зачастую присутствует как внутреннее покрытие активного соединения. В тех случаях, когда это удобно, внутреннее покрытие, однако, может не полностью состоять из амилозы, природа и положение которой позволяют осуществлять соответствующее высвобождение или задержку активного соединения в толстой кишке. Например, амилоза может обеспечить "окно" во внутреннем покрытии или может обеспечить временную прочность иному слабому инертному покрытию. В случае необходимости еще одно активное соединение может быть расположено между внутренним покрытием из амилозы и внешней целлюлозной или акриловой полимерной оболочкой, образуя структуру типа сэндвич. Таким способом можно обеспечить высвобождение двух лекарственных средств, раздельное во времени и пространстве. В альтернативном варианте можно соответственно разместить часть дозы активного соединения во внутренней оболочке, а часть между внутренней и внешней оболочкой.
Материал, который заключают в оболочку из амилозы может быть твердым или водным раствором, или неводным раствором, при условии, что он не разрушает амилозу, или, по крайней мере, не приводит к деструкции амилозы с нежелательной скоростью. Не обязательно использовать амилозу только как оболочку для активного соединения. Альтернативой ее использованию в качестве покрытия может служить использование амилозы для создания матрицы, в которой диспергирован активный компонент, в этом случае амилоза может быть смешана с активным компонентом. Матрицу затем покрывают целлюлозой или акриловым полимерным материалом.
Однако наиболее предпочтительной формой состава служит состав, который включает активное соединение, покрытое амилозой, которую затем заключают в оболочку из целлюлозы или акрилового полимерного материала. Настоящее изобретение, таким образом, включает состав с замедленным высвобождением, содержащий активное соединение, покрытое внутренней оболочкой из аморфной амилозы и внешним покрытием из пленки, образованной целлюлозой или акриловым полимерным материалом.
Характеристики высвобождения состава можно регулировать, варьируя природу этих двух оболочек/покрытий. Так, степень проницаемости внешнего покрытия пленки, образованной целлюлозой или акриловым полимерным материалом, может варьироваться, что, в свою очередь, обеспечит нужную степень высвобождения активного соединения. Изменять степень проницаемости оболочки, можно, в частности, варьируя ее толщину, а также используя пластификаторы, например, в количестве от 1 до 10 мас. в особенности пригодны растворимые в воде пластификаторы. Что касается толщины, то она может быть подобрана путем рутинного, не относящегося к изобретению, эксперимента, руководствуясь следующими соображениями: можно утверждать, что зачастую предпочтительно, чтобы толщина наружной оболочки находилась в пределах от 5 до 50 mм, в особенности предпочтительны покрытия с толщиной от 20 до 50 mм, например с толщиной, равной примерно 40 mм. Однако следует учитывать, что, в частности, в тех случаях, когда в покрытие включен пластификатор/ы/, то возможны более широкие пределы вариации толщин, включая иногда толщины, превышающие те, которые только что были указаны. Примеры подходящих пластификаторов, в частности для целлюлозных материалов, включают полипропилен, дибутилфталат и, особенно, водорастворимые материалы такие, как полиэтиленгликоль, глицерин, и этилцитрат.
Наряду с тем, что составы настоящего изобретения обеспечивают замедленное высвобождение по крайней мере основного количества активного соединения, до тех пор, пока состав не достигнет толстого кишечника, составы настоящего изобретения также регулируют высвобождение активного соединения по достижении составом толстого кишечника. Так, скорость распада амилозы под действием микрофлоры толстой кишки может изменяться в зависимости от того, какова толщина споя амилозы, образующего внутреннюю оболочку. Подходящая толщина, как и в случае наружной оболочки, может быть установлена путем простого эксперимента, но, руководствуясь соображением, что зачастую предпочтительны внутренние оболочки толщиной в пределах от 5 до 50 mм, а особенно толщиной от 20 до 40 mм, например оболочки с толщиной, равной примерно 30 mм. Также возможно варьировать высвобождение в толстой кишке путем нанесения покрытия на различные частицы активного соединения из слоя амилозы различной толщины. Кроме того, можно изменять физическую природу амилозы либо путем высушивания, которое приводит к уменьшению размера пор и, следовательно, к снижению проницаемости геля, либо путем добавления жирных или воскообразных веществ, таких как воск карнаубы /восконосная пальма/, что замедляет проникновение воды в тех случаях, когда это бывает необходимым. Обе эти процедуры оказывают, в свою очередь, воздействие на скорость метаболизма амилозы под действием микрофлоры толстой кишки. Следует учитывать, что замедленное высвобождение будет зависеть как от природы амилозы, создающей барьер, так и от ее деструкции микроорганизмами при достижении толстой кишки. В результате может быть достигнуто некоторое регулируемое высвобождение в тонком кишечнике за счет регулирования свойств используемой амилозы.
В еще одном в особенности предпочтительном типе состава, соответствующем настоящему изобретению, амилоза присутствует в смеси с целлюлозой или акриловым полимерным материалом, образующими наружную оболочку. Обнаружено, что в случае использования такого смешанного наружного покрытия, предпочтительно использовать от 3 до 5 частей по массе целлюлозы или акрилового полимера на одну часть по массе амилозы, наиболее предпочтительное соотношение равно примерно 5 1. Следует иметь ввиду, что толщина покрытия и отношение компонент в покрытии могут варьироваться, приводя, в свою очередь, к изменению скорости высвобождения активного компонента.
Следует принимать во внимание, что в независимости от того одно или два покрытия/оболочки присутствуют, регулирование высвобождения активного ингредиента во времени может быть осуществлено путем вариации одного или более параметров, регулирующих высвобождение, например, толщины покрытия, способа нанесения покрытия и отношения компонент, образующих покрытие. Также возможно использовать смесь, например, шариков с нанесенными на них покрытиями, которые позволяют обеспечить различные времена высвобождения, что в свою очередь обеспечивает ритмичное высвобождение активного ингредиента.
Изобретение предусматривает также использование пленки, образованной целлюлозой или акриловым полимерным материалом, активного соединения и аморфной амилозы для производства медикаментов, предназначаемых для использования в лечении больных при медленном и/или замедленном систематическом высвобождении активного соединения.
Состав может быть выпущен в различных формах, например в виде порошка или спрессованным в монолит, или сформован, например, в виде таблеток, имеющих наружную оболочку из целлюлозы или акрилового полимерного материала, внутри которой заключена матрица амилозы с диспергированным в ней активным соединением, активное соединение, покрытое оболочкой из амилозы или активное соединение, на которое нанесено /которое заключено в оболочку/ покрытие на основе смеси целлюлозы или акрилового полимерного материала и амилозы. Пластификаторы, описанные выше, могут также играть свою роль в стабилизации покрытий на сформованных составах, таких как таблетки.
Предпочтительные формы состава могут быть получены путем распыления первого покрытия из амилозы на активное соединение или смесь активного соединения с другими компонентами, описанными здесь ранее, а затем наносят второе покрытие из целлюлозы или акрилового полимерного материала. Концентрация целлюлозы или акрилового полимерного материала в напыляемом растворе может быть такой же, что и концентрация амилозы в растворе для напыления, но удобно, когда верхний предел равен примерно 5 вес./вес.
Альтернативно готовят смесь амилозы и целлюлозы или акрилового полимерного материала для напыления. Удобно для напыления покрытий использовать стандартную "машинку" для напыления, выпускаемую под торговой маркой Aeromatic. Материал для покрытия должен быть растворен в подходящем растворителе, например в водно-бутанольной смеси, как указывалось ранее, в случае нанесения покрытия из амилозы, или в смеси метиленхлорид/метанол в случае целлюлозы или акрилового полимерного материала.
Настоящее изобретение проиллюстрировано следующими примерами.
Пример 1. Глазированная/стеклообразная амилоза. Получение.
Крахмальный полисахарид амилоза, преимущественно линейный полимер, составленный a-1,4-связанной Д-глюкозой, был выделен из крахмала, полученного из гладкозернистого гороха и очищен путем осаждения из водного раствора в виде комплекса с н-бутанолом. Выделенная амилоза имела молекулярную массу, равную 500000 г/моль. Концентрированные водные растворы амилозы были регенерированы из водных дисперсий комплекса путем удаления н-бутанола током горячего азота. Водный раствор амилозы с концентрацией 7 вес./вес. отлили в форме плитки геля/(сляба) толщиной 1,1 х 10-3м путем быстрого охлаждения раствора амилозы, помещенного между двумя стеклянными пластинами, от 90oС до 20oС. Гель удалили со стеклянных пластин и оставили на ночь сушиться при комнатной температуре. Толщина получившейся в результате пленки была равна 6 х 10-5м.
In vitro расщепление ферментами.
Было установлено, что пленка, полученная в соответствии с только что приведенным описанием, нерастворима в водной среде в интервале рН от 1 до 9 при 37oС. Пленку амилозы также проинкубировали при 37oС в 0, 05 М фосфатном буфере /рН 6,9/, содержащем 0,04 вес./об. NaCl и кристаллическую a-амилазу поджелудочной железы /25 единиц/мг полисахарида. После трехдневного инкубационного периода растворилось менее 10 мас. пленки. В альтернативном варианте использовали пленку, полученную из смеси амилоза/этилцеллюлоза /Этоцель/, взятых в весовом соотношении 1 4, в результате инкубирования в течение 6 ч деструкции подверглась лишь незначительная часть (около 16%) амилозного содержимого смеси.
In vitro расщепление микробами.
Пленка амилозы, полученная в соответствии с описанием, приведенным выше, была инкубирована при 37oС со смешанным фекальным инокулятом микроорганизмов в атмосфере углекислого газа, начальная плотность микроорганизмов составляла 1 х 107/мл. Через 24 ч пленка потеряла примерно 50% своей массы; а через 48 ч пленка полностью разложилась.
Пример 2. Получение медикамента.
(А) 3 вес./вес. водный раствор амилозы, полученной как описано в примере 1, напылили при температуре 90oC стандартные таблетированные составы сульфасалазина, содержащие 50 мг сульфасалазина (4-гидрокси-4-/2-пиридил-сульфамоил/-азобензол-3-карбоновая кислота) в смеси с лактозой и стеаратом магния, и увлажненные таблетки высушили в нагретом воздухе при 100oС до содержания влаги 0,2 вес. /вес. Затем при комнатной температуре на покрытую амилозой таблетку напылили раствор, содержащий 10 вес./вес. этилцеллюлозы /Этоцель/ в смеси метиленхлорида и метанола, взятых в соотношении объемном 50 50, затем увлажненную таблетку высушили также, как и ранее.
(В) 3 вес./вес. раствор амилозы в воде, полученной в соответствии с описанием примера 1, при температуре 90oC напылили на таблетку, содержащую 500 мг месалазина /5-аминосалициловая кислота/ в смеси с лактозой и стеаратом магния, и увлажненную таблетку высушили в потоке нагретого воздуха при 100oС до содержания влаги 0.2 вес./вес. Затем при комнатной температуре на покрытую амилозой таблетку напылили раствор, содержащий 10 вес./вес. этилцеллюлозы (Этоцель) в смеси метиленхлорида и метанола, взятых в объемном соотношении 50 50, затем увлажненную таблетку высушили также, как и ранее.
(С) 3 вес./вес. раствор амилозы в воде, полученный как описано в примере 1, напылили при температуре 90oC на таблетку, содержащую 20 мг или гидрокортизона, или преднизолона в смеси с лактозой и стеаратом магния, и увлажненную таблетку высушили в потоке нагретого воздуха при 100oС до содержания влаги 0,2 вес. /вес. Затем на покрытую амилозой таблетку напылили раствор, содержащий 10 вес./вес. этилцеллюлозы 100 /Этоцель/ в смеси метиленхлорида и метанола, взятых в объемном соотношении 50 50, увлажненную таблетку затем высушили, как и ранее.
Пример 3. Высвобождение/выделение активного соединения из составов.
В качестве модели активного соединения был использован теофилин. Шарики диаметром 1 мм, каждый содержащий примерно 80 г теофилина, были получены методом экструзии/сфероидизации из состава, содержащего лекарство и микрокристаллическую целлюлозу (Авицель рН 101). Шарики были затем покрыты (а) оболочкой из амилозы, (б) оболочкой из этилцеллюлозы или (с) внутренней оболочкой из амилозы и наружной из этилцеллюлозы.
Покрытия наносили, использовав систему напыления Aeromatic и 3 вес./вес. раствор стеклообразной амилозы (полученный как описано в примере 1) в смеси н-бутанол вода, взятых в объемном соотношении 10 90, при 60oС или наносили 10 вес. /вес. раствор атилцеллюлозы 100 /Этоцель/ в смеси метиленхлорида и метанола, взятых в объемном соотношении 50 50, при комнатной температуре. В каждом случае на 50 г шариков был использован раствор для покрытия объемом 10 мл в случае (а) и (б), и либо по 10 мл каждого раствора или 20 мл каждого раствора в случае (с). В случаях (а) и (б) шарики после нанесения покрытия сушили на воздухе, а в случае (с) шарики сушили на воздухе после нанесения каждого покрытия.
Высвобождение активного соединения из шариков определяли путем перемешивания шариков мешалкой с числом оборотов 50 об./мин в течение 5 ч в 0,1 М водном растворе хлористоводородной кислоты, фосфатном буфере с рН 4,0 или дистиллированной воде. Содержание теофилина измеряли путем определения поглощения в УФ области спектра при длине волны 270 нм. Полученные результаты приведены в таблице 1, из которой видно, что две оболочки обеспечивают заметно более медленное высвобождение активного соединения, чем в случае, когда лекарство заключено только в одну оболочку.
Пример 4. Замедленное высвобождение составов, включающих АСА.
Дальнейшие эксперименты проводились с использованием 5-аминосалициловой кислоты (обозначаемой здесь как 5-АСА) в качестве представительного активного соединения, используемого в лечении расстройств толстого кишечника.
а) Приготовление шариков, содержащих 5-АСA.
Микрокристаллическую целлюлозу (Авицель pН 101) и бентонитовый порошок перемешивали в течение 5 мин и добавили очищенную воду с последующим перемешиванием в течение 10 мин. Конечная смесь содержала 41,40 мас. 5-АСА, 24,15 мас. микрокристаллической целлюлозы, 3, 45 мас. бентонита и 50,90 мас. воды. Полученную пластичную массу затем экструдировали, и экструдат пропустили через сферонизатор. Полученные шарики затем сушили в кипящем слое в течение 30 мин при 60oС, после чего просеяли и получили шарики размером 1,40 1,70 мм в диаметре, содержащие лекарственное средство на уровне 60% (расчете на общую массу сухого шарика).
б) Приготовление шариков с покрытием.
Шарики, полученные в стадии а) были покрыты различными покрытиями, представленными в таблице 2. В каждом случае на шарики массой 40 г покрытие наносили в кипящем слое (Aeromatic stream I). Способ нанесения варьировался в зависимости от природы используемого полимера, эти способы также указаны в таблице 2. Масса покрытия дана в процентах от общей массы покрытого шарика. Отношения смесей также даны по массе.
Способы нанесения покрытий.
A) Амилоза наносилась одним слоем или в качестве первого слоя из 3 - 4% -ной водной суспензии, содержащей 8% бутанола, температура кипящего слоя, из которого шло нанесение, поддерживалась равной 60oС. Слой этилцеллюлозы наносился из органического растворителя, использовали этилцеллюлозу (доступную под маркой "Этилцеллюлоза N 50"), растворенную в смеси дихлорметана и метанола, взятых в объемном соотношении 50 50, с получением раствора, содержащего 5 вес./вес. нанесение осуществляли в кипящем слое с температурой между 48 и 50oС со скоростью подачи 0,3 0,4 мл/мин. Покрытые шарики отверждались при 60oС в течение 1 ч.
В) Этилцеллюлозу в водной среде непосредственно наносили на 20%-ную суспензию в водном растворе аммиака (коммерчески доступна, включая добавленный пластификатор, как "Ethocel"). Смеси этоцеля и амилозы /нанесенные, как указано в А/ были получены при смешении в отношении 4 1 при температуре, поддерживаемой выше 60oС в процессе нанесения покрытия. Покрытые шарики сушили в течение 1 ч при 60oC.
С) Дисперсия метакрилового сополимера была получена из смеси 1 1 дисперсий Eudragit RL 30 Д и Eudragit RS 30 Д, которые представляют соответственно сополимеры эфиров акриловой и метакриловой кислоты высокой и низкой проницаемости с низким содержанием четвертичного аммония, поставляемых в виде 30% -ных водных дисперсий. Смесь дисперсий (10 вес./вес. в расчете на твердый Eudragit (перемешали перед нанесением покрытия и продолжали перемешивание в процессе нанесения и добавили 10 вес./вес. пластификатора - полиэтиленгликоля/ПЭК 300/ в расчете на массу полимера. Полученную смесь соединили с амилозой (полученную, как в стадии А) в соотношении 4 1 - амилоза/сополимер и нагрели выше 60oC. Покрытие наносили на предварительно нагретые шарики при скорости подачи 0,5 мл/мин. Шарики сушили в течение 2 ч при 40oС.
С) Растворение покрытия.
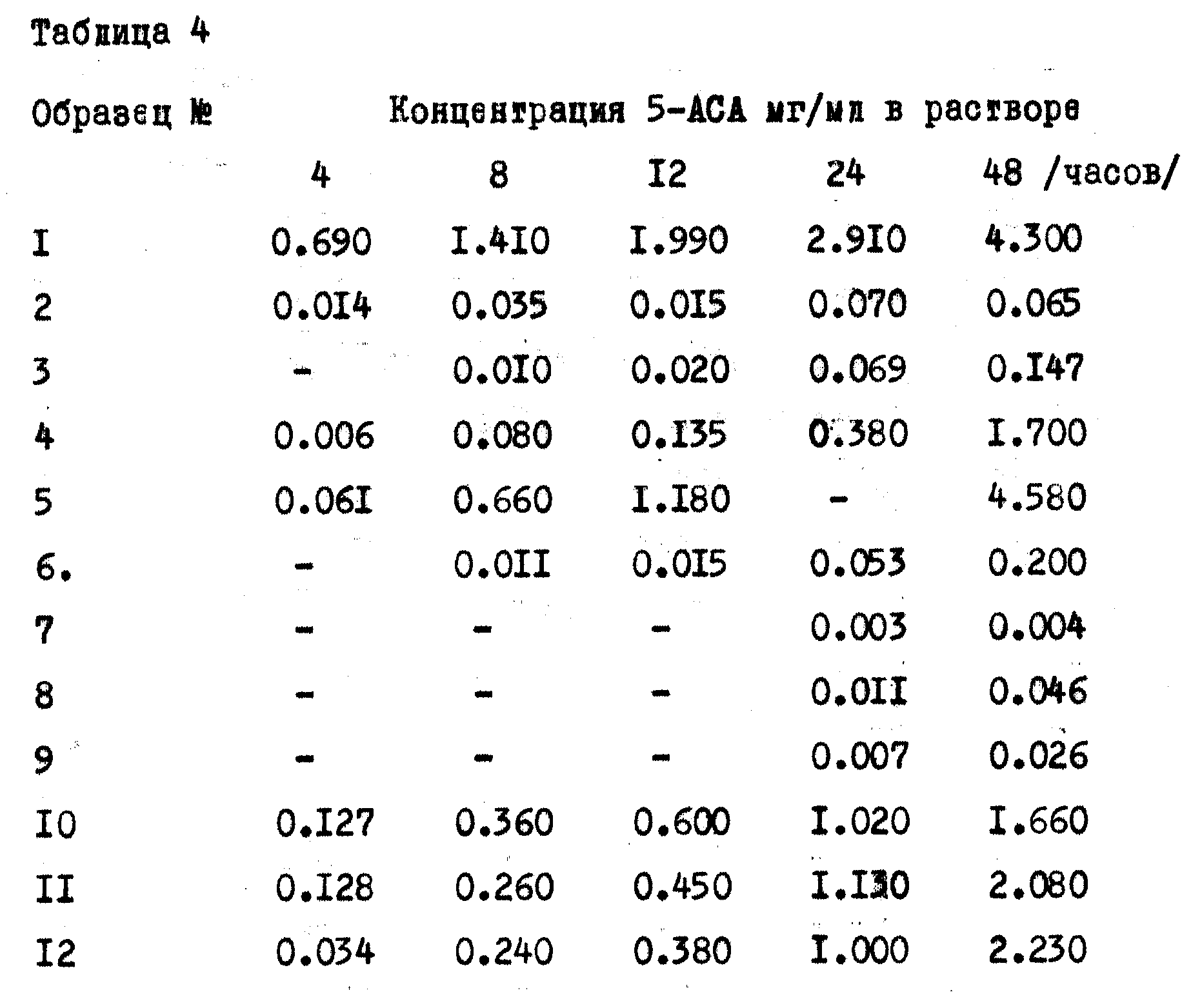
Высвобождение 5-АСА из шариков определяли в следующем эксперименте: 300 мг шарики (180 мг 5-АСА) и 900 мл растворяющей жидкости при 37oС перемешивали со скоростью 100 об/мин. В качестве растворяющей жидкости использовали воду, 0,1 М раствор HCl (рН 1,2) и фосфатный буфер с рН 7,2. Образцы анализировались на содержание 5-АСА методом спектрометрии через определенные промежутки времени. Полученные результаты приведены в таблице 5, анализ проводился через 3 и 6 ч соответственно.
Д) In vitro Микробное расщепление.
Шарики, покрытые оболочкой, представленной в таблице 2, были подвергнуты воздействию микробной среды (микробному расщеплению) следующим образом: образцы шариков поместили в замес системной культуры, концентрация шариков составила 0,7 мас. на замес. Система содержала 5 вес.от фекального шлама, выдержанного в анаэробных условиях в фосфатном 0,1 М буфере с рН 7,0, для создания анаэробных условий использовали аргон. Ферментеры инкубировали при 37oС, и образцы удаляли через определенные отрезки времени в течение 48 ч, центрифугировали и анализировали методом ВЭЖХ для определения количества высвобожденного 5-АСА. Результаты приведены в таблице 4.
Реферат
Состав пролонгированного действия, содержащий активное соединение и аморфную амилозу и имеющие наружное покрытие из пленки, сформированной целлюлозой или акриловым полимерным материалом, например глазированная/стеклообразная амилоза играет особо важную роль в процессе селективного высвобождения медикаментозных средств и средств, предназначаемых для диагностики в толстом кишечнике. 8 з.п. ф-лы. 4 табл.

Комментарии