Способ лечения трижды негативного рака молочной железы - RU2757905C2
Код документа: RU2757905C2
Чертежи





Описание
Родственные заявки
[0001] Данная заявка испрашивает приоритет заявки США № 62/324,711, поданной 19 апреля 2017 года. Все содержание вышеупомянутой заявки включено в данный документ путем ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Представлен способ лечения трижды негативного рака молочной железы. В этом способе используются кабозантиниб или кабозантиниб в сочетании с другими видами терапии или агентами.
УРОВЕНЬ ТЕХНИКИ
[0003] Рак молочной железы представляет собой вторую по величине причину смертности от рака среди американских женщин. Трижды негативный рак молочной железы (ТНРМЖ) относится к любому рак молочной железы который не экспрессирует гены рецептора эстрогена (ER), рецептора прогестерона (PR) или Her2/neu. ТНРМЖ составляет 15-25% случаев рака молочной железы. Его сложнее лечить, чем другие подтипы рака молочной железы потому, что большинство химиотерапий нацелены на один из трех рецепторов. ТНРМЖ имеет закономерность рецидивов, которая сильно отличается от гормонально-положительных раковых опухолей молочной железы. Риск рецидива является значительно более высоким в течение первых 3-5 лет, но после этого резко падает и является существенно ниже уровня гормонально-положительного рака молочной железы. Эта картина рецидива признана для всех типов трижды негативных видов рака, для которых имеется достаточное количество данных, хотя абсолютные рецидивы и показатели выживаемости различаются по подтипам.
[0004] В то время как трижды негативный рак молочной железы (ТНРМЖ) составляет только 15-25% случаев рака молочной железы, он связан с тканевыми изменениями с высокой степенью злокачественности, ранними висцеральными метастазами и смертью.
[0005] В связи с этим существует настоятельная необходимость в эффективных целевых терапевтических средствах для лечения ТНРМЖ. В настоящее время не существуют целенаправленных способов лечения этого подтипа.
[0006] В результате этого остается потребность в новых способах лечения ТНРМЖ.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] Эти и другие потребности удовлетворяются настоящим изобретением, которое направлено на способ лечения ТНРМЖ у больных людей. В этом способе используется кабозантиниб. Изобретение также относится к применению кабозантиниба для лечения ТНРМЖ у больных людей. Изобретение также относится к применению кабозантиниба при изготовлении лекарственного средства для лечения ТНРМЖ у больных людей.
[0008] Способы и связанные с ними области применения, описанные в настоящем документе, используют кабозантиниб, который является пероральным ингибитором тирозинкиназы, включая MET, рецепторы VEGF и AXL. Кабозантиниб имеет структуру, изображенную ниже.

[0009] В предпочтительных вариантах осуществления изобретения вводят (S)-малатную соль кабозантиниба. Кабозантиниб (S)-малат описывается химически как N-(4-(6,7-диметоксихинолин-4-илокси)фенил)-N'-(4-фторфенил)циклопропан-1,1-дикарбоксамид, (2S)-гидроксибутандиоат. Молекулярная формула представляет собой C28H24FN3O5·C4H6O5, а молекулярная масса составляет 635,6 дальтон в виде соли малата. Химическая структура соли кабозантиниба (S)-малата показана ниже.

Кабозантиниб (S)-малат в виде капсульной лекарственной формы (COMETRIQ®) был одобрен для лечения медуллярного рака щитовидной железы. Кабозантиниб (S)-малат в виде таблетированной формы (CABOMETYX®) был одобрен для лечения распространенного почечно-клеточного рака у пациентов, получивших предшествующую анти-ангиогенную терапию.
[0010] Кабозантиниб является ингибитором MET, рецепторной тирозинкиназы, которая способствует пролиферации, инвазии и выживанию клеток при активации его лигандом, фактором роста гепатоцитов (HGF). Повышенная экспрессия MET и HGF связана с гипоксией опухоли, повышенной инвазивностью и метастазами и снижением выживаемости при метастатическом раке молочной железы. Кроме того, экспрессия МЕТ является непропорционально повышенной в ТНРМЖ и связана с более худшим прогнозом. Было обнаружено, что число копий МЕТ было увеличено в 14% случаев ТНРМЖ, в отличие от 8% случаев положительного на рецептор гормонов (HR1) рака молочной железы, и 7% случаев положительного на рецептор эпидермального фактора роста человека 2-го типа (HER21) рака молочной железы. Доклинические исследования показывают, что экспрессия MET направляет дифференцировку опухолей в подтип ТНРМЖ. Мыши, несущие активирующую нокин мутацию MET или мутантный MET-трансген регулируемый промотором вируса опухоли молочной железы мыши, получили ТНРМЖ, что указывает на то, что ингибирование передачи сигналов MET может быть перспективным терапевтическим подходом.
[0011] В одном аспекте изобретение относится к способу лечения трижды негативного рака молочной железы у больного человека, включающему введение пациенту определенного количества кабозантиниба или его фармацевтически приемлемой соли, при этом количество кабозантиниба является достаточным для активации иммунной системы. В этом и других аспектах кабозантиниб применяется в виде кабозантиниб (S)-малата.
[0012] В еще одном аспекте изобретение относится к способу лечения трижды негативного рака молочной железы у больного человека, включающему введение пациенту, нуждающемуся в таком лечении, кабозантиниба или его фармацевтически приемлемой соли, в дозе, которая активирует биомаркеры циркулирующих клеток.
[0013] Эти и другие аспекты и варианты осуществления изобретения описаны ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0014] На фиг. 1 изображен экспериментальный дизайн исследования.
[0015] На фиг. 2A изображен график типа гистограммы (водопадная диаграмма) наилучшего ответа.
[0016] На фиг. 2B и фиг. 2C показана вероятность выживаемости без прогрессирования заболевания в динамике по времени.
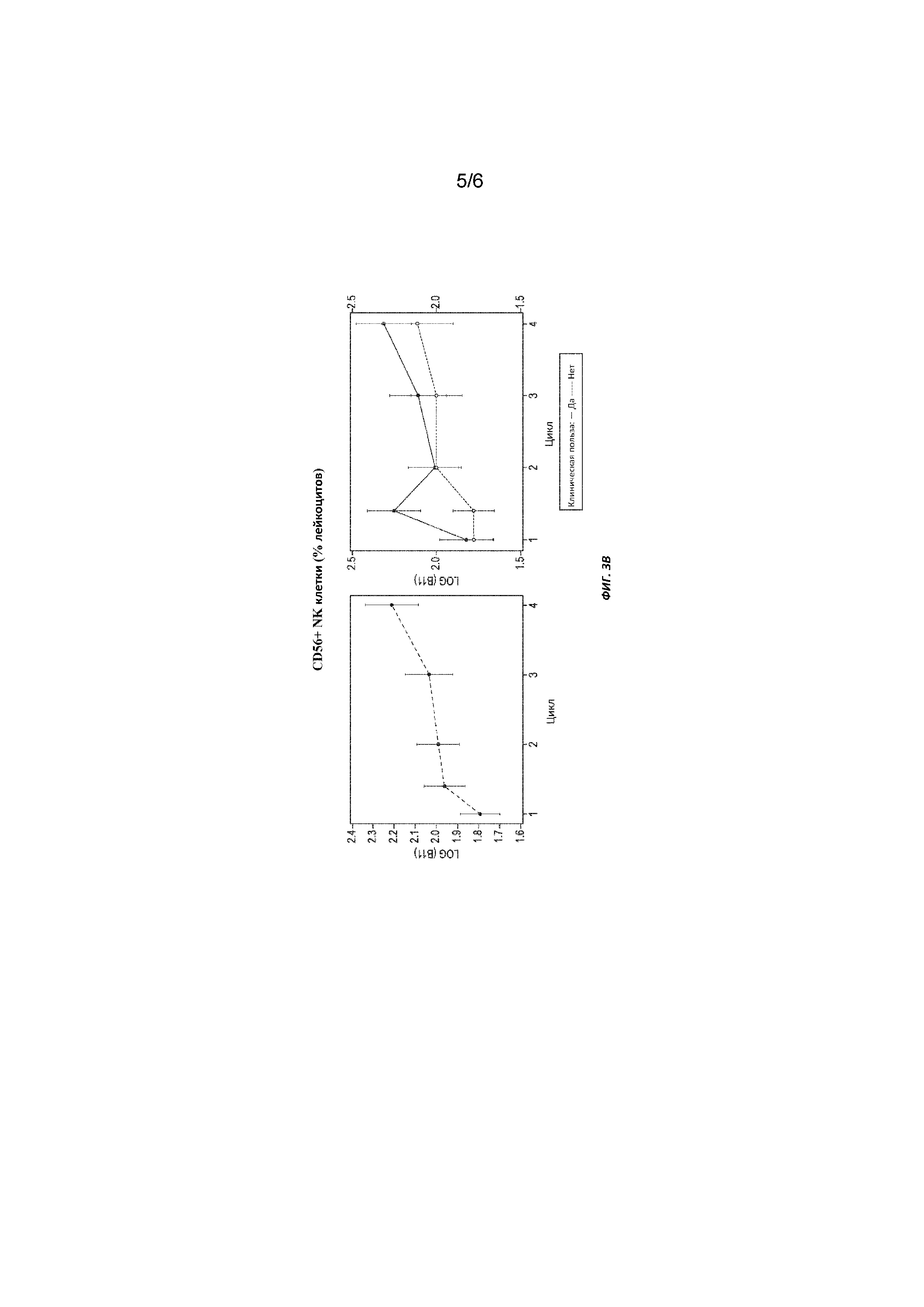
[0017] На фиг. 3A, фиг. 3B и фиг. 3C обобщены изменения циркулирующих опухолевых биомаркеров в ходе исследования.
Подробное описание
[0018] Как указано выше, изобретение относится к способу лечения трижды негативного рака молочной железы у больного человека, включающему введение пациенту определенного количества кабозантиниба или его фармацевтически приемлемой соли, при этом количество кабозантиниба является достаточным для активации иммунной системы.
[0019] В одном варианте осуществления изобретения кабозантиниб применяется в виде кабозантиниб (S)-малата.
[0020] В дополнительном варианте осуществления изобретения кабозантиниб (S)-малат вводят в виде таблетированной формы, содержащей приблизительно (% по массе):
30-32 массовых процента соли кабозантиниба (S)-малата;
38-40 массовых процентов микрокристаллической целлюлозы;
18-22 массовых процента лактозы;
2-4 массовых процента гидроксипропилцеллюлозы;
4-8 массовых процентов кроскармеллозы натрия;
0,2-0,6 массового процента коллоидного диоксида кремния;
0,5-1 массового процента стеарата магния; и дополнительно содержащей:
материал пленочного покрытия, содержащий гипромеллозу, диоксид титана, триацетин и желтый оксид железа.
[0021] В дополнительном варианте осуществления изобретения кабозантиниб (S)-малат вводят в виде таблетированной формы, содержащей приблизительно (% по массе):
31-32 массовых процента соли кабозантиниба (S)-малата;
39-40 массовых процентов микрокристаллической целлюлозы;
19-20 массовых процента лактозы;
2,5-3,5 массовых процента гидроксипропилцеллюлозы;
5,5-6,5 массовых процентов кроскармеллозы натрия;
0,25-0,35 массового процента коллоидного диоксида кремния;
0,7-0,8 массового процента стеарата магния; и дополнительно содержащей:
3,9-4,1 массового процента материала пленочного покрытия, содержащего гипромеллозу, диоксид титана, триацетин и желтый оксид железа.
[0022] В дополнительном варианте осуществления изобретения кабозантиниб (S)-малат вводят в виде таблетированной формы, содержащей 20, 40 или 60 мг кабозантиниба эквивалента в чистом основании (FBE).
[0023] В дополнительном варианте осуществления изобретения кабозантиниб (S)-малат вводят в виде таблетированной формы, состав которой выбран из группы, состоящей из:
* Эквивалент в чистом основании (FBE)
[0024] В дополнительном варианте осуществления изобретения кабозантиниб (S)-малат вводят один раз в день.
[0025] В дополнительном варианте осуществления изобретения количество кабозантиниба, которое вводится один раз в день, составляет 60 мг FBE.
[0026] В дополнительном варианте осуществления изобретения количество вводимого кабозантиниба является достаточным для активации иммунной системы пациента, увеличивая количество циркулирующих CD3+ клеток. В другом варианте осуществления изобретения количество CD8+ T-клеток увеличивается. В еще одном варианте осуществления изобретения количество CD4+ клеток увеличивается. В другом варианте осуществления изобретения количество CD56+ NK-клеток увеличивается. В другом варианте осуществления изобретения количество CD14+ моноцитов уменьшается.
[0027] В дополнительном варианте осуществления изобретения количество вводимого кабозантиниба является достаточным для активации иммунной системы пациента, увеличивая количество циркулирующих CD3+ клеток и CD8+ T-клеток. В дополнительном варианте осуществления изобретения количество вводимого кабозантиниба является достаточным для активации иммунной системы пациента, увеличивая количество циркулирующих CD3+ клеток, CD8+ T-клеток и CD4+ клеток. В дополнительном варианте осуществления изобретения количество вводимого кабозантиниба является достаточным для активации иммунной системы пациента, увеличивая количество циркулирующих CD3+ клеток, CD8+ T-клеток, CD4+ клеток и CD56+NK клеток. В другом варианте осуществления изобретения количество циркулирующих CD3+клеток и CD8+ T-клеток увеличивается, а количество моноцитов CD +14 у пациента уменьшается. В другом варианте осуществления изобретения количество циркулирующих CD3+ клеток, CD8+ T-клеток и CD4+ клеток увеличивается, а количество моноцитов CD14+ у пациента снижается.
[0028] В другом варианте осуществления изобретения количество циркулирующих CD3+ клеток, CD8+ T-клеток, CD4+ клеток и CD56+ NK-клеток увеличивается, а количество моноцитов CD14+ у пациента уменьшается.
[0029] В еще одном аспекте изобретение относится к способу лечения трижды негативного рака молочной железы у больного человека, включающему введение пациенту, нуждающемуся в таком лечении, кабозантиниба или его фармацевтически приемлемой соли, в дозе, которая активирует биомаркеры циркулирующих клеток.
[0030] В одном варианте осуществления изобретения этого аспекта активацию биомаркера циркулирующей клетки определяют путем измерения по меньшей мере одного биомаркера циркулирующих клеток, который экспрессируется у пациента.
[0031] В дополнительном варианте осуществления изобретения биомаркер циркулирующих клеток выбирают из группы, состоящей из CD3+ клеток, CD8+ Т-клеток, CD4+ клеток, CD56+ NK-клеток и CD14+ клеток.
[0032] В дополнительном варианте осуществления изобретения количество вводимого кабозантиниба является достаточным для активации иммунной системы пациента, увеличивая количество циркулирующих CD3+ клеток и CD8+ T-клеток. В дополнительном варианте осуществления изобретения количество вводимого кабозантиниба является достаточным для активации иммунной системы пациента, увеличивая количество циркулирующих CD3+ клеток, CD8+ T-клеток и CD4+ клеток. В дополнительном варианте осуществления изобретения количество вводимого кабозантиниба является достаточным для активации иммунной системы пациента, увеличивая количество циркулирующих CD3+ клеток, CD8+ T-клеток, CD4+ клеток и CD56+NK клеток. В другом варианте осуществления изобретения количество циркулирующих CD3+клеток и CD8+T-клеток увеличивается, а количество моноцитов CD14+ у пациента уменьшается. В другом варианте осуществления изобретения количество циркулирующих CD3+ клеток, CD8+ T-клеток и CD4+ клеток увеличивается, а количество моноцитов CD14+ у пациента снижается.
[0033] В другом варианте осуществления изобретения количество циркулирующих CD3+ клеток, CD8+ T-клеток, CD4+ клеток и CD56+ NK-клеток увеличивается, а количество моноцитов CD14+ у пациента уменьшается.
[0034] В еще одном аспекте изобретение относится к способу лечения трижды негативного рака молочной железы у больного человека, включающему введение пациенту, нуждающемуся в таком лечении, кабозантиниба или его фармацевтически приемлемой соли, в дозе, которая активирует биомаркеры циркулирующих клеток в сочетании с одной или более дополнительных терапий или препаратами. Ряд способов лечения и препаратов являются доступными или находятся в стадии совершенствования и обобщены, например, на www.cancerresearch.org/cancer-immunotherapy/impacting-all-cancers/breast-cancer (последний визит 24 марта 2017 года).
[0035] В одном варианте осуществления изобретения дополнительная терапия или препарат представляет собой иммунотерапию или препарат.
[0036] В соответствии с данными Исследовательского института рака, несмотря на то что рак молочной железы исторически считался иммунологически бессимптомным, несколько доклинических и клинических исследований показывают, что иммунотерапия имеет потенциал для улучшения клинических исходов для пациентов с раком молочной железы. См. www.cancerresearch.org/cancer-immunotherapy/impacting-all-cancers/breast-cancer (последний визит 24 марта 2017 года). В целом, иммунотерапия обладает несколькими ключевыми преимуществами по сравнению с традиционными химиотерапевтическими и целенаправленными способами лечения, направленными на опухоль, что в сочетании с другими видами лечения, такими как кабозантиниб, могут быть значимыми для пациентов с ТНРМЖ. Во-первых, иммунотерапия обычно приводит к меньшему количеству побочных эффектов, что позволяет проводить ее в течение более длительных периодов времени и/или в сочетании с другими препаратами без дополнительной токсичности. Пациенты также могут быть менее склонны к развитию резистентности к иммунотерапии из-за способности иммунной системы одновременно нацеливаться на множественные антигены рака и адаптироваться к изменениям раковых клеток. Некоторые виды иммунотерапии, которые показали свои перспективы в недавних клинических испытаниях, описаны ниже и считаются подходящими для комбинации с кабозантинибом.
[0037] Терапевтические вакцины. Раковые вакцины предназначены для того, чтобы вызвать иммунный ответ против опухолеспецифических или связанных с опухолью антигенов, способствуя иммунной системе в атаке раковых клетхок, несущие эти антигены. Несколько исследований вакцин, предоставляемых отдельно или с другими видами терапии, в настоящее время регистрируют (отбирают для исследований) больных раком молочной железы.
[0038] Препарат NeuVax (nelipepimut-S или E75) находится на стадии исследования его возможности предотвращать рецидив рака молочной железы среди пациентов с низким и средним уровнями экспрессии HER2 (HER2 1+ и 2+) после операции. Выборка пациентов для исследования фазы III (PRESENT) в настоящее время полностью завершена (NCT01479244). Исследование удовлетворяет специальной оценке протокола (SPA) Управления США по надзору в сфере пищевых продуктов и лекарственных средств (FDA), а это означает, что если исследование будет соответствовать заданной конечной точке, оно будет отвечать необходимым критериям для подачи заявки на разрешение регуляторного органа. Существует также фаза IIb исследования NeuVax для пациентов, имеющих рак с поражением лифоузлов или трижды негативный рак молочной железы после стандартного лечения (NCT01570036), и фаза I/II среди неоадъювантно пролеченных пациентов с HER2 3+ с поражением лимфолузлов и без поражения лимфоузлов, не достигающих полного патоморфологического регресса, или адъювантно пролеченных пациентов с HER2 3+ раком с поражением лимфоузлов (NCT02297698).
[0039] Были определены следующие дополнительные исследования:
[0040] Исследование фазы I двух вакцин - INO-1400, с направленным действием на обратную транскриптазу теломеразы (TERT), которая была обнаружена более чем у 85% всех раковых заболеваний человека, и INO-9012, с направленным действием на интерлейкин 12 (IL-12), что усиливает активность иммунных клеток - для пациентов с отдельными опухолями, включая рак молочной железы (NCT02327468).
[0041] Исследование фазы I вакцины OBI-833, которая направленно воздействует на маркер Globo H, который обычно находится в клетках различных опухолей, для пациентов с некоторыми видами метастатического рака, включая рак молочной железы (NCT02310464).
[0042] Исследование фазы I вакцины MAG-Tn3, которая направленно воздействует на углеводный антиген Tn, который сверхэкспрессируется в ряде типов опухолей, для пациентов с локализованным раком молочной железы при высоком риске рецидива (NCT02364492).
[0043] Исследование фазы I пептидной вакцины HER2 у пациентов с раком молочной железы (NCT02276300).
[0044] Исследование фазы I вакцины дендритных клеток у пациентов с метастатическим раком молочной железы (NCT02479230).
[0045] Исследование фазы I индивидуальной вакцины у пациентов с персистирующим трижды негативным раком молочной железы после неоадъювантной химиотерапии (NCT02348320).
[0046] Исследование фазы I индивидуальной вакцины Poly-ICLC (агонист толл-рецепторов), агониста TLR-3 (Toll-like receptor 3), у пациентов с персистирующим трижды негативным раком молочной железы после неоадъювантной химиотерапии (NCT02427581).
[0047] Ингибиторы контрольных точек/Иммунные модуляторы. Перспективным направлением клинических исследований рака молочной железы является использование ингибиторов контрольных точек иммунного ответа. Эти способы лечения работают путем направленного воздействия на молекулы, которые служат в качестве контроля и уравновешивания в регуляции иммунных реакций. Блокируя ингибирующие молекулы или, альтернативно, активируя стимулирующие молекулы, эти способы лечения предназначены для реализации или усиления ранее существовавших противораковых иммунных реакций. Для нескольких ингибиторов контрольных точек, с направленным действием на множество разных контрольных точек, в настоящее время регистрируют пациентов с раком молочной железы:
Пембролизумаб (Китруда ®, MK-3475): PD-1 антитело
[0048] Исследование фазы III у пациентов с метастатическим трижды негативным раком молочной железы по сравнению с химиотерапией (NCT02555657).
[0049] Исследование фазы II для пациентов с раком молочной железы, с ингибитором HDAC (деацетилазы гистонов ) и антиэстрогенной терапией (NCT02395627).
[0050] Исследование фазы II для пациентов с трижды негативным раком молочной железы или с гормон-рецептор-положительным метастатическим раком молочной железы в сочетании с химиотерапией или антиэстрогенной терапией (NCT02648477).
[0051] Исследование фазы II для пациентов с метастатическим отечно-инфильтративным раком молочной железы, которые ранее получали химиотерапию с клиническим ответом (NCT02411656).
[0052] Исследование фазы II у пациентов с метастатическим трижды негативным раком молочной железы (NCT02447003).
[0053] Исследование фазы I/II у пациентов с распространенным раком, включая трижды негативный рак молочной железы, в сочетании с PLX3397, ингибитором тирозинкиназы KIT, CSF1R и FLT3 (NCT02452424).
[0054] Исследование фазы I/II у пациентов с распространенным раком, включая рак молочной железы (NCT02318901).
[0055] Исследование фазы I/II у пациентов с распространенным раком, включая рак молочной железы в сочетании с химиотерапией (NCT02331251).
[0056] Исследование фазы I/II у пациентов с трижды негативным раком молочной железы в сочетании с нирапарибом, ингибитором PARP (NCT02657889).
[0057] Исследование фазы I/II у пациентов с метастатическим трижды негативным раком молочной железы в сочетании с химиотерапией (NCT02513472).
[0058] Исследование фазы I у пациентов с резистентным раком, включая трижды негативный рак молочной железы, в сочетании с MGA217, антителом, которое нацелено на B7-H3 (NCT02475213).
[0059] Исследование фазы I для пациентов с прогрессирующими опухолями, включая трижды негативный рак молочной железы, в комбинации с ингибитором JAK, INCB039110 или ингибитором PI3K-дельта, INCB050465 (NCT02646748).
[0060] Неоадъювантное исследование фазы I у пациентов с трижды негативным раком молочной железы в сочетании с химиотерапией (NCT02622074).
[0061] Исследование фазы I у пациентов с раком молочной железы, который метастазируется в кости (NCT02303366).
Ниволумаб (Opdivo®): антитело PD-1 +/- Ипилимумаб (Yervoy®), антитело CTLA-4
[0062] Исследование фазы II ниволумаба после индукционного лечения для пациентов с трижды негативным раком молочной железы (NCT02499367).
[0063] Исследование фазы I для тестирования ниволумаба и ипилимумаба, а также энтиностата, ингибитора HDAC, у пациентов с локально распространенным или метастатическим HER2-отрицательным раком молочной железы (NCT02453620).
[0064] Исследование фазы I для тестирования ипилимумаба (Yervoy) в сочетании с MGA217, антителом, которое нацелено на B7-H3, у пациентов с рефрактерным раком, включая трижды негативный рак молочной железы (NCT02381314).
[0065] Исследование фазы I ниволумаба в сочетании с химиотерапией у пациентов с рецидивирующим метастатическим раком молочной железы (NCT02309177).
Дурвалумаб (MEDI4736), антитело PD-L1 +/- тремелимумаб: CTLA-4 антитело
[0066] Исследование фазы II дурвалумаба, тремелимумаба или их комбинации у пациентов с прогрессирующими опухолями, включая трижды негативный рак молочной железы (NCT02527434).
[0067] Исследование фазы II дурвалумаба и тремелимумаба у пациентов с метастатическим HER2-отрицательным раком молочной железы (NCT02536794).
[0068] Исследование фазы I/II дурвалумаба, тремелимумаба и Poly-ICLC, агониста TLR 3, у пациентов с прогрессирующими, измеримыми раками, включая местно-рецидивирующий рак молочной железы (NCT02643303). Данное исследование спонсируется научно-исследовательским институтом рака.
[0069] Исследование фазы I/II неоадъювантного применения дурвалумаба с химиотерапией для трижды негативного рака молочной железы 1-3 стадии (NCT02489448).
[0070] Исследование фазы I/II дурвалумаба в сочетании с олапарибом, ингибитором PARP или цедиранибом, ингибитором VEGF, у пациентов с прогрессирующими солидными опухолями, включая рак молочной железы (NCT02484404).
[0071] Исследование фазы I/II применения дурвалумаба и эпакадостата (INCB024360), ингибитора IDO, у пациентов с избранными прогрессирующими опухолями, включая трижды негативный рак молочной железы (NCT02318277). IDO выражается рядом типов опухолей и коррелирует с плохим прогнозом.
[0072] Исследование фазы I/II применения дурвалумаба и ибрутиниба, ингибитора BTK, у пациентов с рецидивирующими или рефрактерными опухолями, включая рак молочной железы (NCT02403271).
[0073] Исследование фазы I применения дурвалумаба у пациентов с раком молочной железы в сочетании с селуметинибом, ингибитором MEK 1 и 2 (NCT02586987).
[0074] Исследование фазы I применения дурвалумаба с тремелимумабом у пациентов с раком молочной железы (NCT02639026).
[0075] Исследование фазы I дурвалумаба и тремелимумаба у пациентов с прогрессирующими солидными опухолями, включая трижды негативный рак молочной железы (NCT01975831). Данное исследование спонсируется научно-исследовательским институтом рака.
Тремелимумаб
[0076] Пилотное исследование тремелимумаба и облучения мозга у пациентов с раком молочной железы, который метастазировал в мозг (NCT02563925).
Атезолизумаб (MPDL3280A): Антитело PD-L1
[0077] Исследование фазы III у пациентов с ранее нелеченным метастатическим трижды негативным раком молочной железы в сочетании с химиотерапией (NCT02425891).
[0078] Исследование фазы II неоадъювантной (первой линии) терапии у пациентов с трижды негативным раком молочной железы в сочетании с химиотерапией (NCT02530489).
[0079] Исследование фазы I/II у пациентов с прогрессирующим раком, включая трижды негативный рак молочной железы, в сочетании с варлилумабом (CDX-1127), антителом анти-CD27 (NCT02543645).
[0080] Исследование фазы I для пациентов с HER2-положительным раком молочной железы, полученное с помощью ингибиторов HER2 (NCT02605915).
[0081] Исследование фазы I у пациентов с некоторыми типами прогрессирующего рака, включая рак молочной железы (NCT01375842).
[0082] Исследование фазы I CPI-444, которое направленно воздействует на рецептор аденозина А2А, который подавляет противоопухолевую активность иммунных клеток, +/- атезолизумаб для пациентов с прогрессирующим раком, включая трижды негативный рак молочной железы (NCT02655822).
Другие лекарственные средства
[0083] Исследование фазы II IMP321, слитого белка LAG-3, у пациентов с гормон-рецептор-положительным метастатическим раком молочной железы в сочетании с химиотерапией (NCT02614833).
[0084] Исследование фазы I/II MEDI6469, антитела к OX40, у пациентов с раком молочной железы 4 стадии, у которых оказались безуспешными предыдущая гормональная терапия или химиотерапия (NCT01642290). OX40 представляет собой костимулирующую молекулу, экспрессируемую после активации Т-клеток, которая повышает выживаемость Т-клеток и противораковую эффекторную функцию.
[0085] Исследование фазы I/II PDR001, антитела PD-1, у пациентов с прогрессирующим раком, включая трижды негативный рак молочной железы (NCT02404441).
[0086] Исследование фазы I для тестирования MGD009, белка B7-H3 x CD3 DART у пациентов с неоперабельным или метастатическим раком с экспрессией B7-H3, включая рак молочной железы (NCT02628535).
Адоптивная клеточная терапия
[0087] Другим направлением иммунотерапии рака молочной железы является адоптивный перенос Т-клеток. В этом подходе Т-клетки извлекаются из организма пациента, генетически модифицируются или обрабатываются химическими веществами для повышения их активности, а затем повторно вводятся пациенту с целью улучшения противоракового ответа иммунной системы. В настоящее время проводится несколько исследований способов адоптивного переноса Т-клеток для пациентов с раком молочной железы, в том числе:
[0088] Исследование фазы I химерного рецептора антигена (CAR) Т-клеток, с направленным воздействие на протоонкоген cMet - который аномально активируется при раке и коррелирует с плохим прогнозом - проходит испытания при метастатическом резистентном раке молочной железы для по меньшей мере одной стандартной терапии, или у впервые диагностированного пациента с операбельным трижды негативным раком молочной железы (NCT01837602).
[0089] Исследование фазы I применения иммунных клеток, полученных для таргетирования на белок мезотелин, который чрезмерно экспрессируется при некоторых раковых заболеваниях у пациентов с прогрессирующим раком, включая рак молочной железы (NCT02414269).
[0090] Исследование фазы I Т-клеток, полученных для распознавания маркеров NY-ESO-1, MAGE-A4, PRAME, сурвивина и SSX у пациентов с солидными опухолями, включая рак молочной железы (NCT02239861).
Онколитическая вирусная терапия
[0091] Онколитическая вирусная терапия использует модифицированный вирус, который может привести к самоуничтожению опухолевых клеток и вызвать больший иммунный ответ против рака.
[0092] Исследование фазы I/II применения PexaVec (JX-594) -вируса, полученного для секреции ГМКСФ (GM-CSF) и удаления гена киназы, который обычно наблюдается в раковых клетках с мутированным путем RAS или p53 у пациентов с распространенным раком молочной железы (NCT02630368).
Антитела
[0093] Моноклональные антитела являются молекулами, генерируемыми в лаборатории, которые нацеливают специфические антигены на опухоли. Многие антитела в настоящее время используются при лечении рака, а некоторые, как наблюдается, генерируют иммунный ответ.
[0094] Исследование фазы III применения маргетуксимаба (MGAH22), антитела anti-HER2, плюс химиотерапии по сравнению с применением трастузумаба (Herceptin®) плюс химиотерапии у пациентов с HER2-положительным метастатическим раком молочной железы (NCT02492711).
[0095] Исследование фазы II применения маргетуксимаба (MGAH22) у пациентов с рецидивирующим или рефрактерным прогрессирующим раком молочной железы, опухоли которого экспрессируют HER2 на уровне 2+ и отсутствует амплификация гена HER2 при определении методом FISH (NCT01828021).
[0096] Исследование фазы II применения глембатумумаб ведотин (CDX-011), конъюгата антитело-лекарственное средство, у пациентов с прогрессирующим трижды негативным раком молочной железы, раковые клетки которого образуют белок под названием гликопротеин NMB, с которым связывается CDX-011 (NCT01997333).
[0097] Исследование фазы I/II применения TRC105, антитела, с направленным действием на эндоглин, который представляет собой белок, который сверхэкспрессируется в эндотелиальных клетках и необходим для ангиогенеза, процесса образования новых кровеносных сосудов, у пациентов с гормон-рецептор-положительным и HER2-отрицательным раком молочной железы (NCT02520063).
[0098] Исследование фазы II применения MCS110, антитела, которое нацелено на фактор, стимулирующий колонии макрофагов, у пациентов с прогрессирующим трижды негативным раком молочной железы (NCT02435680).
[0099] Пилотное исследование QBX258, которое нацелено на интерлейкин 4 (IL-4) и интерлейкин 13 (IL-13) у пациентов с лимфедемой, связанной с раком молочной железы 1-2 стадии (NCT02494206).
Адъювантная иммунотерапия
[00100] Адъюванты - это вещества, которые либо используются отдельно, либо в сочетании с другими иммунотерапиями для усиления иммунного ответа. В некоторых адъювантных иммунотерапиях используются лиганды-молекулы, которые связываются с белками, такими как рецепторы для того, чтобы способствовать регулированию иммунного ответа. Эти лиганды могут быть либо стимулирующими (агонистами), либо блокирующими (антагонистами).
[00101] Исследование фазы I/II применения дурвалумаба и эпакадостата (INCB024360), ингибитора IDO, у пациентов с избранными прогрессирующими опухолями, включая трижды негативный рак молочной железы (NCT02318277). IDO экспрессируется рядом типов опухолей и коррелирует с плохим прогнозом.
[00102] Исследование фазы I motolimod (VTX-2337), агониста TLR8 у пациентов с метастатическими, персистирующими, рецидивирующими или прогрессирующими солидными опухолями, включая рак молочной железы (NCT02650635).
[00103] Исследование фазы I энтиностата (KHK2375), низкомолекулярного лекарственного средства, которое нацелено как на раковые клетки, так и на иммунные регуляторные клетки у пациентов с прогрессирующим или рецидивирующим раком молочной железы (NCT02623751).
Цитокины
[00104] Цитокины представляют собой сигнализирующие молекулы, которые способствуют регуляции роста и активности клеток иммунной системы.
[00105] Исследование фазы I/II интерлейкина 12 (IL-12) у пациентов с метастатическим раком молочной железы (NCT02423902).
[00106] В еще одном аспекте изобретение относится к способу лечения HER2 трижды негативного рака молочной железы у больного человека, включающему введение пациенту, нуждающемуся в таком лечении, кабозантиниба или его фармацевтически приемлемой соли, в дозе, которая активирует биомаркеры циркулирующих клеток в сочетании с одним или более дополнительными препаратами.
[00107] В одном варианте осуществления данного аспекта изобретения один или более циркулирующих биомаркеров выбирают из группы, состоящей из клеток CD31, CD31 CD4-CD81 T-лимфоцитов, моноцитов CD141, CD3+CD4+CD8-T-лимфоцитов, CD3-CD561 NK лимфоцитов, CD1331 предшественников/стволовых клеток, CD4+CD25+регуляторных Т-клеток, CD4+CD127+Т-клеток памяти и CD3+CD56+NKT-клеток.
[00108] В еще одном варианте осуществления изобретения трижды негативный HER2 рак молочной железы представляет собой HER3+или FISH-положительный рак молочной железы.
[00109] В другом варианте осуществления изобретения один или более дополнительных препаратов представляют собой иммуномодулятор, выбранный из группы, состоящей из трастузумаба, пертузумаба, адотратузумаба эмантина, лапатиниба, фулвестранта, пемборлизумаба, ниволумаба, ипилимумаба, дурвалумаба, тремелимумаба, эпакадостата, атезолизумаба и PDR001, как описано выше.
[00110] В еще одном аспекте изобретение относится к способу лечения трижды негативного рака молочной железы у больного человека, включающему введение пациенту, нуждающемуся в таком лечении, кабозантиниба или его фармацевтически приемлемой соли, в дозе, которая активирует биомаркеры циркулирующих клеток в сочетании с одной или более дополнительных терапий или препаратами.
[00111] В одном варианте осуществления данного аспекта изобретения один или более циркулирующих биомаркеров выбирают из группы, состоящей из клеток CD31, CD31 CD4-CD81 T-лимфоцитов, моноцитов CD141, CD3+CD4+CD8-T-лимфоцитов, CD3-CD561 NK лимфоцитов, CD1331 предшественников/стволовых клеток, CD4+CD25+регуляторных Т-клеток, CD4+CD127+Т-клеток памяти и CD3+CD56+NKT-клеток.
[00112] В другом варианте осуществления изобретения один или более дополнительных препаратов является выбранным из группы, состоящей из трастузумаба, пертузумаба, адотратузумаба эмантина и лапатиниба, как описано выше.
[00113] В другом варианте осуществления изобретения один или более дополнительных препаратов представляют собой вакцину, при этом вакцина выбрана из группы, состоящей из пептидной вакцины типа nelipepimut-S, INO-1400, INO-9012, OBI-833, MAG-Tn3 HER-2, индивидуальной вакцины и POLY-ICLC, как описано выше.
[00114] В еще одном варианте осуществления изобретения один или более дополнительных препаратов является выбранным из группы, состоящей из слитого белка LAG IMP321, антитела к OX40 MEDI6469 и B7-H3 x CD3 DART белка MGD009, как описано выше.
[00115] В другом варианте осуществления изобретения одна или более дополнительных терапий выбраны из адоптивного переноса Т-клеток, онколитической вирусной терапии, антител, адъювантной иммунотерапии и цитокинов, как описано выше.
[00116] Настоящее изобретение иллюстрируется следующими неограничивающими вариантами осуществления изобретения.
[00117] Вариант осуществления изобретения 1. Способ лечения трижды негативного рака молочной железы у больного человека, включающий введение пациенту определенного количества кабозантиниба или его фармацевтически приемлемой соли, при этом количество кабозантиниба является достаточным для активации одного или более циркулирующих биомаркеров иммунной системы.
[00118] Вариант осуществления изобретения 2. Способ по варианту осуществления изобретения 1, отличающийся тем, что один или более циркулирующих биомаркеров является выбранным из группы, состоящей из клеток CD31, CD31 CD4-CD81 T-лимфоцитов, моноцитов CD141, CD3+CD4+CD8-T-лимфоцитов, CD3-CD561 NK лимфоцитов, CD1331 предшественников/стволовых клеток, CD4+CD25+регуляторных Т-клеток, CD4+CD127+Т-клеток памяти и CD3+CD56+NKT-клеток.
[00119] Вариант осуществления изобретения 3. Способ по вариантам осуществления изобретения 1-2, отличающийся тем, что кабозантиниб применяется в виде кабозантиниб (S)-малата.
[00120] Вариант осуществления изобретения 4. Способ по вариантам осуществления изобретения 1-3, отличающийся тем, что кабозантиниб (S)-малат вводят в виде таблетированной формы, содержащей приблизительно (% по массе):
30-32 массовых процента соли кабозантиниба (S)-малата;
38-40 массовых процентов микрокристаллической целлюлозы;
18-22 массовых процента лактозы;
2-4 массовых процента гидроксипропилцеллюлозы;
4-8 массовых процентов кроскармеллозы натрия;
0,2-0,6 массового процента коллоидного диоксида кремния;
0,5-1 массового процента стеарата магния; и дополнительно содержащей:
материал пленочного покрытия, содержащий гипромеллозу, диоксид титана, триацетин и желтый оксид железа.
[00121] Вариант осуществления изобретения 5. Способ по вариантам осуществления изобретения 1-4, отличающийся тем, что кабозантиниб (S)-малат вводят в виде таблетированной формы, содержащей приблизительно (% по массе):
31-32 массовых процента соли кабозантиниба (S)-малата;
39-40 массовых процентов микрокристаллической целлюлозы;
19-20 массовых процента лактозы;
2,5-3,5 массовых процента гидроксипропилцеллюлозы;
5,5-6,5 массовых процентов кроскармеллозы натрия;
0,25-0,35 массового процента коллоидного диоксида кремния;
0,7-0,8 массового процента стеарата магния; и дополнительно содержащей:
3,9-4,1 массового процента материала пленочного покрытия, содержащего гипромеллозу, диоксид титана, триацетин и желтый оксид железа.
[00122] Вариант осуществления изобретения 6. Способ по вариантам осуществления изобретения 1-5, отличающийся тем, что кабозантиниб (S)-малат вводят в виде таблетированной формы, содержащей 20, 40 или 60 мг кабозантиниба.
[00123] Вариант осуществления изобретения 7. Способ по вариантам осуществления изобретения 1-6, отличающийся тем, что кабозантиниб (S)-малат вводят в виде таблетированной формы, состав которой выбран из группы, состоящей из:
* Эквивалент в чистом основании (FBE)
[00124] Вариант осуществления изобретения 8. Способ по вариантам осуществления изобретения 1-7, отличающийся тем, что кабозантиниб (S)-малат вводят один раз в день.
[00125] Вариант осуществления изобретения 9. Способ по вариантам осуществления изобретения 1-8, отличающийся тем, что количество кабозантиниба, которое вводится один раз в день, составляет 60 мг.
[00126] Вариант осуществления изобретения 10. Способ лечения трижды негативного рака молочной железы у больного человека, включающий введение пациенту, нуждающемуся в таком лечении, кабозантиниба или его фармацевтически приемлемой соли, в дозе, которая активирует биомаркеры циркулирующих клеток.
[00127] Вариант осуществления изобретения 11. Способ по варианту осуществления изобретения 10, отличающийся тем, что активацию биомаркера циркулирующей клетки определяют путем измерения по меньшей мере одного биомаркера циркулирующих клеток, выявленных у пациента.
[00128] Вариант осуществления изобретения 12. Способ по вариантам осуществления изобретения 10-11, отличающийся тем, что биомаркер циркулирующих клеток выбирают из группы, состоящей из CD3+ клеток, CD8+ Т-клеток, CD4+ клеток, CD56+ NK-клеток и CD14+ клеток.
[00129] Вариант осуществления изобретения 13. Способ по вариантам осуществления изобретения 10-12, отличающийся тем, что кабозантиниб применяется в виде кабозантиниб (S)-малата.
[00130] Вариант осуществления изобретения 14. Способ по вариантам осуществления изобретения 10-13, отличающийся тем, что кабозантиниб (S)-малат вводят в виде таблетированной формы, содержащей приблизительно (% по массе):
30-32 массовых процента соли кабозантиниба (S)-малата;
38-40 массовых процентов микрокристаллической целлюлозы;
18-22 массовых процента лактозы;
2-4 массовых процента гидроксипропилцеллюлозы;
4-8 массовых процентов кроскармеллозы натрия;
0,2-0,6 массового процента коллоидного диоксида кремния;
0,5-1 массового процента стеарата магния; и дополнительно содержащей:
материал пленочного покрытия, содержащий гипромеллозу, диоксид титана, триацетин и желтый оксид железа.
[00131] 15. Способ по вариантам осуществления изобретения 10-14, отличающийся тем, что кабозантиниб (S)-малат вводят в виде таблетированной формы, содержащей приблизительно (% по массе):
31-32 массовых процента соли кабозантиниба (S)-малата;
39-40 массовых процентов микрокристаллической целлюлозы;
19-20 массовых процента лактозы;
2,5-3,5 массовых процента гидроксипропилцеллюлозы;
5,5-6,5 массовых процентов кроскармеллозы натрия;
0,25-0,35 массового процента коллоидного диоксида кремния;
0,7-0,8 массового процента стеарата магния; и дополнительно содержащей:
3,9-4,1 массового процента материала пленочного покрытия, содержащего гипромеллозу, диоксид титана, триацетин и желтый оксид железа.
[00132] Вариант осуществления изобретения 16. Способ по вариантам осуществления изобретения 10-15, отличающийся тем, что кабозантиниб (S)-малат вводят в виде таблетированной формы, содержащей 20, 40 или 60 мг кабозантиниба.
[00133] Вариант осуществления изобретения 17. Способ по вариантам осуществления изобретения 10-16, отличающийся тем, что кабозантиниб (S)-малат вводят в виде таблетированной формы, состав которой выбран из группы, состоящей из:
* Эквивалент в чистом основании (FBE)
[00135] Вариант осуществления изобретения 18. Способ по вариантам осуществления изобретения 10-17, отличающийся тем, что кабозантиниб (S)-малат вводят один раз в день.
[00136] Вариант осуществления изобретения 19. Способ по вариантам осуществления изобретения 10-18, отличающийся тем, что количество кабозантиниба, которое вводится один раз в день, составляет 60 мг.
[00137] Вариант осуществления изобретения 20. Способ лечения трижды негативного HER2 рака молочной железы у больного человека, включающий введение пациенту, нуждающемуся в таком лечении, кабозантиниба или его фармацевтически приемлемой соли, в дозе, которая активирует биомаркеры циркулирующих клеток в сочетании с одной или более дополнительных терапий или препаратами.
[00138] Вариант осуществления изобретения 21. Способ по варианту осуществления изобретения 20, отличающийся тем, что один или более циркулирующих биомаркеров является выбранным из группы, состоящей из клеток CD31, CD31 CD4-CD81 T-лимфоцитов, моноцитов CD141, CD3+CD4+CD8-T-лимфоцитов, CD3-CD561 NK лимфоцитов, CD1331 предшественников/стволовых клеток, CD4+CD25+регуляторных Т-клеток, CD4+CD127+Т-клеток памяти и CD3+CD56+NKT-клеток.
[00139] Вариант осуществления изобретения 22. Способ по варианту осуществления изобретения 20, отличающийся тем, что трижды негативный HER2 рак молочной железы представляет собой HER3+или FISH-положительный рак молочной железы.
[00140] Вариант осуществления изобретения 23. Способ по варианту осуществления изобретения 20, отличающийся тем, что один или более дополнительных препаратов представляют собой иммуномодулятор, выбранный из группы, состоящей из трастузумаба, пертузумаба, адотратузумаба эмантина, лапатиниба, фулвестранта, пемборлизумаба, ниволумаба, ипилимумаба, дурвалумаба, тремелимумаба, эпакадостата, атезолизумаба и PDR001.
[00141] Вариант осуществления изобретения 24. Способ лечения трижды негативного рака молочной железы у больного человека, включающий введение пациенту, нуждающемуся в таком лечении, кабозантиниба или его фармацевтически приемлемой соли, в дозе, которая активирует биомаркеры циркулирующих клеток в сочетании с одной или более дополнительных терапий или препаратами.
[00142] Вариант осуществления изобретения 25. Способ по варианту осуществления изобретения 24, отличающийся тем, что один или более циркулирующих биомаркеров является выбранным из группы, состоящей из клеток CD31, CD31 CD4-CD81 T-лимфоцитов, моноцитов CD141, CD3+CD4+CD8-T-лимфоцитов, CD3-CD561 NK лимфоцитов, CD1331 предшественников/стволовых клеток, CD4+CD25+регуляторных Т-клеток, CD4+CD127+Т-клеток памяти и CD3+CD56+NKT-клеток.
[00143] Вариант осуществления изобретения 26. Способ по варианту осуществления изобретения 24, отличающийся тем, что один или более дополнительных препаратов является выбранным из группы, состоящей из трастузумаба, пертузумаба, адотратузумаба эмантина и лапатиниба.
[00144] Вариант осуществления изобретения 27. Способ по варианту осуществления изобретения 24, отличающийся тем, что один или более дополнительных препаратов представляют собой вакцину, при этом вакцина выбрана из группы, состоящей из пептидной вакцины типа nelipepimut-S, INO-1400, INO-9012, OBI-833, MAG-Tn3 HER-2, индивидуальной вакцины и POLY-ICLC.
[00145] Вариант осуществления изобретения 28. Способ по варианту осуществления изобретения 24, отличающийся тем, что один или более дополнительных препаратов является выбранным из группы, состоящей из слитого белка LAG IMP321, антитела к OX40 MEDI6469 и B7-H3 x CD3 DART белка MGD009.
[00146] Вариант осуществления изобретения 29. Способ по варианту осуществления изобретения 24, отличающийся тем, что одна или более дополнительных терапий выбраны из адоптивного переноса Т-клеток, онколитической вирусной терапии, антител, адъювантной иммунотерапии и цитокинов.
[00147] Вариант осуществления изобретения 30. Способ лечения трижды негативного рака молочной железы у больного человека, имеющего исходную плазменную концентрацию sMET, которая является большей, чем средняя исходная плазменной концентрации sMET у человека, включающий введение пациенту определенного количества кабозантиниба или его фармацевтически приемлемой соли, при этом количество кабозантиниба является достаточным для активации иммунной системы.
[00148] Вариант осуществления изобретения 31. Способ по варианту осуществления изобретения 30, отличающийся тем, что исходная плазменная концентрация sMET является равной среднему значению 795 мг/мл, или превышает его.
[00149] Вариант осуществления изобретения 32. Способ по варианту осуществления изобретения 31, отличающийся тем, что выживаемость без прогрессирования заболевания пациентов, имеющих исходную плазменную концентрацию sMET, превышающую или равную среднему значению 795 мг/мл, увеличивается по сравнению с пациентами, у которых исходная плазменная концентрация sMET является меньшей, чем среднее значение 795 мг/мл.
[00150] Далее настоящее изобретение будет проиллюстрировано следующими неограничивающими примерами.
Примеры
Лечение кабозантинибом вызывает значительные изменения в циркулирующих популяциях иммунных клеток у пациентов с метастатическим трижды негативным раком молочной железы (ТНРМЖ)
[00151] Цель: оценить изменения циркулирующих популяций иммунных клеток у пациентов, включенных в исследование фазы II применения кабозантиниба (XL184), ингибитора множества рецепторных тирозинкиназ, включая MET и VEGFR2, для метастатического ТНРМЖ. (NCT02260531)
[00152] Экспериментальный дизайн. В этом несравнительном двухэтапном исследовании фазы 2 пациенты с метастатическим ТНРМЖ с измеряемыми проявлениями болезни по RECIST и до 3-х линий предшествующей химиотерапии для метастатического заболевания получали кабозантиниб 60 мг ежедневно в 21-дневном цикле. Пациентам повторно определяли стадию рака через 6 недель после начала лечения и каждые 9 недель после этого. Первичной конечной точкой была частота объективного ответа (ЧОО). Предопределенные вторичные конечные точки включали выживаемость без прогрессирования заболевания (PFS) и токсичность. В рамках настоящего исследования мы исследовали клеточные биомаркеры с использованием проточной цитометрии в последовательных образцах крови, собранных в дни 0 (исходный/перед лечением), 8, 22, 43 и 64 лечения кабозантинибом. Модели со смешанными эффектами использовались для оценки изменений уровней биомаркеров в динамике по времени от момента включения в исследование до дня 64. Знаковый ранговый критерий Уилкоксона был использован для оценки того, отличается ли изменение уровня биомаркеров от момента включения в исследование до 8-го дня лечебной эффективностью. Скорректированные p-значения, контролирующие уровень ложноположительных результатов, использовались для корректировки для нескольких сравнений.
[00153] Экспериментальный дизайн изображен на Фиг. 1.
[00154] Результаты: анализ включал всех 35 пациентов, которые инициировали протокольную терапию. Как сообщалось ранее (ASCO 2015), ЧОО составляла 11%, процент пациентов с улучшением клинических показателей (PR+SD) в течение 15 недель составлял 34% (95% ДИ 19-52%), а средний показатель выживаемости без прогрессирования заболевания PFS составлял 2,0 месяца (95%, ДИ 1,3-3,3). От момента включения в исследование до дня 64 наблюдалось значительное увеличение числа циркулирующих CD3+клеток и CD8+Т-клеток и уменьшение CD14+моноцитов (все p <0,05) во всех временных точках. Наблюдалась тенденция к увеличению CD4+клеток (p=0,08) и CD56+NK-клеток (p=0,07), но не было существенных изменений во фракции CD133+предшественников/стволовых клеток, CD4+CD25+Tregs, CD4+CD127+Т-клеток памяти и CD3+CD56+NKT клеток. Изменения уровня биомаркеров от момента включения в исследование до 8-го дня существенно не различались между пациентами с клинической лечебной эффективностью и без нее.
[00155] Резюме Анализ биомаркеров циркулирующих клеток показал, что кабозантиниб вызывает системные изменения, согласующиеся с активацией иммунной системы у пациентов с метастатическим ТНРМЖ. Эти данные, генерирующие гипотезу, поддерживают дальнейшие исследования кабозантиниба с иммунотерапией в этой популяции пациентов.
Экспериментальные данные
[00156] Пациенты Характеристики пациентов приведены в таблице 1. Право на участие имели пациенты в возрасте 18 лет и старше с измеряемыми проявлениями метастатического ТНРМЖ. Трижды негативный статус был определен как эстроген-рецептор отрицательный (ER-) (<10% окрашивание иммуногистохимией [IHC]), прогестерон-рецептор-отрицательный (PR-) (<10% окрашивание IHC) и HER2-отрицательный (0 или 11 по способу IHC или флуоресцентная гибридизация in situ [FISH] <2,0). Пациенты имели измеримые проявления болезни по критериям оценки ответа при солидных опухолях (RECIST) версии 1.1 и получили от 0 до 3 предшествующих химиотерапевтических схем лечения для метастатического ТНРМЖ. У них должен был отсутствовать прием любого миелосупрессивного препарата в течение 21 дня до начала приема кабозантиниба и они должны были прекратить всю биологическую терапию и лучевую терапию по меньшей мере за 14 дней до начала лечения в рамках исследования. Пациенты должны были обладать статусом № 2 в Восточной объединенной онкологической группе (ECOG) и должны были иметь наличие опухолевой ткани, фиксированной в формалине и залитой парафином (FFPE). Ключевыми критериями исключения были следующие: получение другого экспериментального препарата в течение 14 дней от первой дозы исследуемого препарата; предварительное получение ингибитора MET, отличного от тивантиниба (ARQ-197); известные метастазы в мозг, которые не лечили, или проводили симптоматическую или требуемую терапию для контроля симптомов; и корригированный интервал QT около 470 миллисекунд. Исследования были одобрены местными программами по защите пациентов, участвующих в исследованиях и институциональными наблюдательными советами, а исследования проводились в соответствии с Хельсинкской декларацией. Пациентам повторно определяли стадию рака через 6 недель после начала лечения и каждые 9 недель после этого.
Таблица 1
n=35
В том числе химиотерапия для грудной локализации или узлового рецидива, которые были полностью удалены хирургическим вмешательством перед диагнозом метастатического заболевания.
В том числе химиотерапия для грудной локализации или узлового рецидива, которые не были полностью удалены хирургическим вмешательством.
[00157] Дизайн исследования и лечение. Как указано, это было несравнительное двухэтапное исследование фазы II, в котором оценивалась эффективность монотерапии кабозантинибом у пациентов с метастатическим ТНРМЖ. Лечение состояло из перорального приема кабозантиниба в дозе 60 мг в день в течение 21-дневного цикла. Пациенты подвергались проведению повторных исследований рака с целью оценить результаты лечения через 6 недель и каждые 9 недель после этого. Пациенты с полной или частичной ремиссией в соответствии с RECIST продолжали получать лечение в рамках исследования, в то время как пациенты с прогрессирующим заболеванием были сняты с исследования. Снижение дозы для уменьшения токсичности происходило, если у пациентов наблюдалась нейтропения 3 или 4 степени или тромбоцитопения, или негематологические побочные эффекты. От начальной дозы, которая составляла 60 мг ежедневно, дозы уменьшались по мере необходимости до 40 и 20 мг в день. В целях определения влияния лечения кабозантинибом на боль и применение обезболивающих препаратов, боль оценивалась по анкете участника, и было зафиксировано ежедневное использование обезболивающих лекарственных препаратов. Их прием был завершен на момент включения в исследование и в течение недели 3, 6 и каждых 6 недель после этого до даты последнего последующего визита участника.
[00158] Первичной конечной точкой была активность кабозантиниба, которая определяется частотой объективного ответа (ЧОО) у пациентов с метастатическим ТНРМЖ. Предопределенные вторичные конечные точки включали выживаемость без прогрессирования заболевания (PFS), токсичность и боль. Корреляционные исследования включали анализ экспрессии MET и фосфо-MET в архивной опухолевой ткани, а также молекулярных и клеточных биомаркеров кабозантиниба.Клеточные биомаркеры были исследованы с использованием проточной цитометрии в последовательных образцах крови, собранных в дни 0 (исходный/перед лечением), 8, 22, 43 и 64 лечения кабозантинибом. Модели со смешанными эффектами использовались для оценки изменений уровней биомаркеров в динамике по времени от момента включения в исследование до дня 64. Знаковый ранговый критерий Уилкоксона был использован для оценки того, отличается ли изменение уровня биомаркеров от момента включения в исследование до 8-го дня лечебной эффективностью. Скорректированные p-значения, контролирующие уровень ложноположительных результатов, использовались для корректировки для нескольких сравнений.
[00159] Флуоресцентная гибридизация in situ (FISH), оценка МЕТ амплификации в ткани. MET FISH маркeрный субстрат, помеченный SpectrumRed, и CEP7 контрольный маркeрный субстрат, помеченный Spectrum Green, были приобретены у Abbott Molecular (Des Plaines, IL, www.abbott molecular.com). FISH выполнялась по стандартным протоколам. Вкратце, тканевые микропрепараты размером 5 микрометров выпекали в течение ночи при 60 °C, депарафинизировали, обрабатывали в 1% боргидриде натрия в течение 4 часов и нагревали в автоклаве в течение 20 минут в цитратном буфере (рН 6). После обработки с 150 мг/мл раствором протеиназы K, микропрепараты фиксировали в 1% нейтральном буферном формалине и денатурировали в 70% формамиде в течение 4 минут при 72 °C. Маркeрные субстраты денатурировали в течение 5 минут при температуре 80°C и инкубировали в течение 30 минут при температуре 37°C для предварительного отжига. Гибридизацию проводили в течение ночи при 37 °C. После гибридизации микропрепараты промывали в течение 20 минут в 50% формамидном/2X стандартном физиологическом растворе цитрата (SSC) при 45°C с последующим промыванием в течение 5 минут в 1 х SSC при 45 °C. Оценка и получение сигнала FISH выполнялись вручную с использованием наборов фильтров и программного обеспечения, разработанных Applied Spectral Imaging (Carlsbad, CA, www.spectral-imaging.com). Было захвачено несколько полей, содержащих по меньшей мере 50 опухолевых клеток, и было рассчитано отношение числа сигналов MET к CEP7. Оценка плоидности проводилась визуальным скринингом всей области опухоли, и регистрировались клетки с максимальным количеством сигналов. МЕТ амплификация была определена как отношение MET/CEP7 ≥ 2. Образцы с отношением MET/CEP7 между 1,5 и 2 были определены как имеющие относительный прирост MET. Образцы с отношением MET/CEP7 равным 1, но с более чем двумя копиями каждого маркeрного субстрата, считались имеющими полисомию хромосомы 7.
[00160] Оценка МЕТ амплификации в циркулирующих опухолевых клетках. Циркулирующие опухолевые клетки (CTCs) были обогащены из 7,5 мл цельной крови пациента в профильном центре циркулирующей опухолевой клетки (Brigham and Women's Hospital, Бостон, MA, www.brighamandwomens.org) используя Circulating Tumor Cell Profile Kit (Veridex/Janssen Diagnostics, Raritan, NJ, www.janssen.com). Обработанные образцы получали в виде клеток, суспендированных в 900 мл буфера. Равный объем PBS добавляли до того, как пробирки центрифугировали при 200 g в течение 8 минут. Надосадочную жидкость осторожно удаляли, оставляя приблизительно 60 мл буфера. Сгусток клеток осторожно ресуспендировали и суспензию наносили на меченый микропрепарат и оставляли сушить в вакуумном эксикаторе при комнатной температуре. Микропрепараты помещали в метанол при 220 °С для созревания и хранения.
[00161] Для FISH высушенные микропрепараты обрабатывали в 23 SSC при 37°C в течение 30 минут, с последующей 10 минут обработкой с 0,002% раствора пепсина в 0,01 MHCl при 37°C и 15 минут фиксации в 1% формалине при комнатной температуре. Микропрепараты дегидратировали в серии этанолов, высушивали и коденатурировали с микропрепаратом FISH MET/CEP7 (Kreatech/Leica Microsystems Inc., Buffalo Grove, IL, www.leica-microsystems.com) на пластине при 80°C в течение 2 минут. Гибридизацию проводили при 37°C в течение ночи, затем промывали 0,43SSC/0,3% Igepal при 72°C в течение 3 минут и промывали 23 SSC/0,1% Igepal при комнатной температуре в течение 1 минуты. Микропрепараты дегидратировали в серии этанолов и высушивали перед применением гистологической среды Vectashield с 49,6-диамидино-2-фенилиндолом (Vector Laboratories Inc., Burlingame,CA, vectorlabs.com). Оценка и получение сигнала FISH выполнялись вручную с использованием наборов фильтров и программного обеспечения, разработанного Applied Spectral Imaging.
[00162] Анализы циркулирующих биомаркеров Потенциальные биомаркеры активности кабозантиниба были идентифицированы путем измерения белков плазмы в начале исследования, на 8-й день терапии, на 1-й день каждого цикла терапии и, если возможно, во время прогрессирования. Восемь миллилитров крови собирали в вакутайнеры с крышками фиолетового цвета (плазма с EDTA) и отправляли на жидком льду в сертифицированную клиническую лабораторию Clinical Laboratory Improvement Amendments в Steele Laboratories (Massachusetts General Hospital), где цельную кровь разделяли центрифугированием на клеточную фракцию и плазму. Фракция стволовых клеток/клеток предшественников, лимфоцитов и миелоидов всех циркулирующих мононуклеарных клеток подсчитывалась с помощью проточной цитометрии с использованием цитометра LSR-II и программного обеспечения FACSDiva в свежих образцах крови с использованием следующих маркеров: CD3, CD4, CD8, CD14, CD25, CD34, CD45, CD56, CD127, и CD133 (Becton Dickinson, Franklin Lakes, NJ, www.bd.com). Плазму готовили стандартным способом и хранили при -78°C до сбора и анализа всех образцов. Измеряемые биомаркеры включали VEGF, плацентарный фактор роста (PlGF), VEGF-C, VEGF-D, растворимый VEGFR1 (sVEGFR1), основной фактор роста фибробластов (bFGF) и sTie-2 (с использованием 7-plex Growth Factor array) и гранулоцитарный фактор, стимулирующий колонии макрофагов (GM-CSF), интерферон гамма (IFN-g), фактор некроза опухолей альфа (TNF-a) и интерлейкин 1, бета (IL-1b), IL-2, IL-6, IL- 8, IL-10 и IL-12 гетеродимер p70 (с использованием 9-plex Inflammatory Factor array, как Meso Scale Discovery, Gaithersburg, MD,, www.mesoscale.com); так и HGF, sMET, карбоангидраза IX (CAIX), стромальный клеточный фактор 1 a (SDF1a),и sVEGFR2 с помощью иммуноферментного анализа с использованием одного аналита с ферментным соединением (R&D Systems, Миннеаполис, Миннесота, www.rndsystems.com).
[00163] Статистический анализ. В этом исследовании использовалась оптимальная двухступенчатая конструкция Саймона для контроля погрешности I типа на уровне 10% и мощности по меньшей мере на 90% для определения приемлемой частоты ответа. По дизайну исследования на первом этапе должны были быть зачислены 13 участников. Если бы был по меньшей мере 1 ответ, увеличение должно было продолжаться на втором этапе, где должны были быть зарегистрированы еще 22 пациента. Если среди 35 пациентов было по меньшей мере 4 ответа, схема лечения считается достойной дальнейшего изучения. При истинном проценте положительного клинического ответа в 5% вероятность того, что схема будет объявлена достойной дальнейшего изучения, составила 10%, а с истинным процентом положительного клинического ответа 20% вероятность того, что схема будет объявлена достойной дальнейшего изучения, составила 90%.
[00164] Объективный ответ оценивался с использованием RECIST 1.1 По протоколу пациенты, не достигшие подтвержденного полного ответа (CR) или подтвержденного частичного ответа (PR), считались не ответившими. Сообщалось, что показатель объективного ответа составлял 95% доверительного интервала (ДИ) для двухэтапных дизайнов. PFS и 95% ДИ были описаны с использованием способов Каплана-Мейера. PFS была определена как продолжительность времени от момента включения в исследование до момента объективного прогрессирования заболевания или до момента смерти от любой причины, в зависимости от того, что наступило раньше. Для пациентов, которые были сняты с протокольного лечения по какой-либо причине, кроме прогрессирования, дата PFS была цензурирована на дату последнего стадирования исследования (либо протокольной или внепротокольной терапии), на которую пациент был зарегистрирован без прогрессирования, либо на дату начала альтернативной противоопухолевой терапии, в зависимости от того, что наступило раньше. Процент пациентов с улучшением клинических показателей был включен в качестве разведочного анализа. Клиническая польза включала подтвержденные полный ответ (CR - complete response), частичный ответ (PR - partial response) и стабилизацию заболевание (SD) в течение 15 недель или дольше. Если у пациентов был неподтвержденный PR, за которым следует SD, они считались получающими клиническую пользу.
[00165] Описательная статистика использовалась для суммирования значений биомаркера в относящиеся к протоколу временные точки. С помощью критерия суммы рангов Уилкоксона оценивали разницу между исходными значениями биомаркеров между пациентами, которые получали или не получали клиническую пользу. С использованием знакового рангового критерия Уилкоксона оценивали изменение биомаркера от дня 1 до дня 8. Изменение значений биомаркеров на днях 1, 8, 22, 43 и 64 оценивали с использованием линейных моделей со смешанными эффектами; при этом значения в период после дня 64 не анализировались из-за небольшого числа пациентов, все еще находящихся в протоколе. В линейной модели со смешанными эффектами фиксированные эффекты были временем оценки, а пациенты вводились как случайный эффект. Логарифмическая трансформация по возможности использовалась для достижения нормальности. Исходные биомаркеры были стратифицированы с использованием медианных значений для всей когорты. С помощью логарифмического рангового критерия было проведено сравнение PFS среди пациентов с низким или высоким исходным уровнем sMET. Все тесты проводились с двухсторонней а5 0,05. Процедура Беньямини-Хохберга использовалась для корректировки значений р для контроля уровня ложноположительных результатов в оценке множества циркулирующих биомаркеров.
Анализ результатов
[00166] Пациенты. Анализ включал всех 35 пациентов, которые инициировали протокольную терапию. Медианный возраст составлял 50 лет (диапазон 31-78); пациенты получали 0 (n=5 6, 17%), 1 (n=5 18, 51%), 2 (n=5 4, 11%) или 3 (n=5 7; 20%) линий химиотерапии для метастатического ТНРМЖ (Таблица 1). Среднее число метастатических областей составляло 3 (диапазон 1-6). Наиболее распространенными областями метастатического заболевания были региональные лимфатические узлы (n=5 26, 74%), легкие (n=5 18, 51%), молочная железа или грудная стенка (n=5 16, 46%), кость (n=5 13; 37%) и печень (n=5 12; 34%).
[00167] Эффективность. Пациенты получали терапию в среднем 3 цикла (9 недель) (диапазон 1-17).Один пациент достиг PR в составе первых 13 пациентов, поэтому исследование продолжилось на втором этапе. В общей сложности 3 пациента достигли PR (ЧОО, 9% [95% ДИ: 2, 26]; Таблица 2 и Фиг. 2A).
Таблица 2
a В том числе 7 пациентов (20%) с клинически прогрессирующим заболеванием до определения опухоли, указанной в протоколе.
Сокращения: PD, прогрессирование заболевания; PR, частичный ответ; RECIST, критерии оценки ответа при солидных опухолях; SD, стабилизация заболевания
[00168] Таким образом, исследование не достигло уровня клинической активности для определения успеха в рамках двухэтапного дизайна Саймона. Из этих пациентов один получил 17 циклов протокольной терапии и находился на лечении в течение 11,7 месяцев, а другой получил 8 циклов протокольной терапии и находился на лечении в течение 6,5 месяцев. Двадцать из 35 пациентов (57%) имели SD в качестве наилучшего ответа, а 9 из 35 (26%) пациентов имели SD в течение > 15 недель. Процент пациентов с улучшением клинических показателей в течение 15 недель составлял 34% [95% ДИ: 19%, 52%], а средняя PFS составляла 2,0 месяца [1,3, 3,3] (Фиг. 2B).
[00169] Двадцать один из 24 пациентов, которые сообщили о боли при поступлении в исследование, заполнили по меньшей мере один опросник о боли на 1 или 4 неделе. Одиннадцать (52%) из них сообщили об уменьшении боли с момента включения в исследовании, а 10 из них прекратили использование обезболивающих препаратов.
[00170] Токсичность. Наиболее распространенными токсическими факторами (все формы, которые, возможно, были связаны с протокольной терапией), были усталость (77%), диарея (40%), воспаление слизистой оболочки полости рта (37%) и ладонно-подошвенная эритродизестезия (PPE, 37%, Таблица 3). Было 15 случаев 3-х форм нежелательных явлений, включая повышение содержания аспартатаминотрансферазы (n 5 2), повышение содержания липазы (n 5 3) или гипертензию (n 5 2). Наблюдалось 4 случая нестандартной токсичности. Двенадцать пациентов (34%) нуждались в снижении дозы, 4 в связи с РРЕ, и 8 в связи с другими видами токсичности. Все, кроме одного пациента, пропустили по меньшей мере одну дозу во время проведения протокольной терапии, 26 из-за токсичности и 8 по другим причинам. В целом, 32 пациента (91%) не прошли лечение согласно плану в связи с прогрессированием заболевания и 3 (9%) из-за токсичности.
Таблица 3
[00171] МЕТ-амплификация и экспрессия. Анализ архивных тканей на MET-амплификацию и экспрессию показал MET-амплификацию у 2 из 35 пациентов (MET/CEP7, 2,14 и 2,16) и относительную МЕТ-амплификацию (MET/CEP7 1,7) у 1 пациента. Эти 3 пациента также были единственными, кто показал относительный прирост МЕТ в CTCs.
[00172] Плазменные биомаркеры. Лечение кабозантинибом было связано с увеличением в плазме PIGF, VEGF и VEGF-D от момента включения в исследование до 22-го дня, которое поддерживалось на 64-й день (p <0,001). CAIX плазмы также увеличивалась, а sVEGFR2 уменьшалась на 43 и 64 днях (p, 0,001). Плазменный HGF первоначально снижался на 8-й день, а затем увеличивался на 64-й день (p5.02), тогда как плазменный SDF1a временно увеличивался на 22-й день (p5.002) (Таблица 4). Плазменные sVEGFR1, sMET, sTIE-2 или bFGF со временем существенно не изменялись (Таблица 4). Кинетика VEGF-C, GM-CSF, IL-1b, IL-2, IFN-g, IL-6, IL-8, IL-10, TNF-a и IL-12/p70 не анализировалась из-за большого количества необнаруживаемых результатов измерений.
Таблица 4
Среднее значение и IQR для VEGF-C, GM-CSF, IL-1β, IL-2, IFN-γ, IL-6, IL-8, IL-10, TNF-α и IL-12/p70 не были включены в таблицу, потому что большинство из них имели средние значения ниже обнаруживаемого порогового значения.
ap-значения были получены из линейной модели со смешанными эффектами, скорректированной для множественного сравнения с использованием метода ложных обнаружений.
Сокращения: bFGF, основной фактор роста фибробластов; CAIX, карбоангидраза IX; GM-CSF, гранулоцитарно-макрофагальный колониестимулирующий фактор; HGF, фактор роста гепатоцитов, IFN-γ, интерферон, IL-1β, интерлейкин 1β; IQR, межквартильный размах; PIGF, плацентарный фактор роста; SDF1α, стромальный клеточный фактор 1α, sFLT-1, растворимая fms-подобная тирозинкиназа 1; sMET, растворимый MET; TNF- α, фактор некроза опухоли α; VEGF, фактор роста эндотелия сосудов; VEGFR2, рецептор 2 фактора роста эндотелия сосудов.
[00173] Из всех биомаркеров, проанализированных на исходном уровне, только высокий исходный уровень sMET (≥ 795 нг/мл среднее значение) был связан с пролонгированной PFS (медианная PFS 3,3 месяца, нижний доверительный интервал 95% 2,4), по сравнению с низким sMET (<795 нг/мл, среднее значение PFS 1,3 [1,3,3,3] месяцев, p 5.03) (Фиг. 2C). Была отмечена незначительная тенденция к увеличению исходного sMET у пациентов с клинической пользой (1008 пг/мл [межквартильный размах (IQR): 858, 1089] по сравнению с теми, кто этого не получил (759 пг/мл [IQR: 663, 921]) (некорректированный p= 0,06). Изменения в плазме VEGF-C на 22-й день коррелировали с клинической пользой (p5.03), но только образцы от 19 из 35 пациентов были доступны в этой временной точке
[00174] Клеточные биомаркеры. После лечения кабозантинибом было обнаружено значительное увеличение доли циркулирующих CD31 клеток и CD31 CD4-CD81 T-лимфоцитов на 22 и 64 день (p=0,04 и p=0,01 соответственно) и снижение процента CD141 моноцитов на дни 22 и 64 (p 5.01) (Таблица 5). Наблюдались незначительная тенденция к увеличению CD3+CD4+CD8- T (p= 0,008) и CD3-CD561 NK лимфоцитов (p= 0,07), но в то же время изменения во фракциях CD1331 предшественников/стволовых клеток, CD4+CD25+регуляторных T клеток, CD4+CD127+Т-клеток памяти или CD3+CD56+NKT-клеток (Фиг. 3A-3C и Таблица 5). Ни один из клеточных биомаркеров не связан с оценкой исходов.
Таблица 5
ap-значения были получены из линейной модели со смешанными эффектами, скорректированной для множественного сравнения с использованием метода ложных обнаружений.
Сокращения: CTLs, цитотоксические Т-лимфоциты; IQR, межквартильный размах; NK cells, естественные клетки-киллеры; NKT cells, естественные киллерные Т-клетки; Tregs, регуляторные Т-лимфоциты; WBC, лейкоциты.
Дискуссия
[00175] Монотерапия кабозантинибом не соответствовала предварительно определенной конечной точке эффективности (ЧОО составила 9%), но показала процент пациентов с улучшением клинических показателей в 34% через 15 недель и среднюю PFS 2,0 месяца у ранее проходивших лечение пациентов с метастатическим ТНРМЖ. Лечение было хорошо переносимым, а наиболее распространенными токсическими показателями степени 3 были усталость, диарея, воспаление слизистой оболочки полости рта и PPE. Пациенты часто сообщали об уменьшении боли, а некоторые смогли прекратить принимать анальгетики, в соответствии с предыдущими результатами, свидетельствующими об уменьшении боли и сокращении употребления наркотических препаратов после приема кабозантиниба.
[00176] МЕТ остается важной целью в ТНРМЖ, как показано в недавних доклинических исследованиях. У двух пациентов, включенных в это исследование (6%), были опухоли с амплификацией МЕТ (в соответствии с образцами архивных опухолей и оценками CTC), один из которых прекратил терапию из-за токсичности. Таким образом, никакой потенциальной корреляции не может быть установлено между МЕТ амплификацией и ответом. Тем не менее, высокие исходные плазменные концентрации sMET были связаны с более длительной PFS, что указывает на то, что рак, вызывающий увеличение sMET, может с большей вероятностью реагировать на ингибирование MET. Большие рандомизированные исследования должны подтвердить связь sMET с результатами (OS, PFS или боль) и установить, является ли sMET прогностическим или прогнозирующим фактором в ТНРМЖ. Концентрация HGF плазмы, лиганда MET, были ниже у пациентов с клинической пользой по сравнению с теми, у кого ее не было, но эта ассоциация не достигла статистического уровня значимости. Дальнейшие более крупные исследования, изучающие связь МЕТ-амплификации в опухоли и циркулирующего HGF с ответом на ингибирование MET в ТНРМЖ, являются оправданными.
[00177] Лечение кабозантинибом было связано с изменениями концентраций биомаркеров, которые согласуются с антиваскулярными эффектами и увеличением тканевой гипоксии - увеличивается содержание в плазме CAIX, PIGF, VEGF, VEGF-D и SDF1a. Более того, кабозантиниб значительно уменьшал концентрации в плазме рецептора 2 васкулоэндотелиального фактора роста sVEGFR2, потенциального «фармакодинамического» биомаркера для анти-VEGFR2 TKI. Ни одно из этих системных изменений не было связано с клиническими исходами. Увеличение содержания в плазме VEGF-C связано с отсутствием клинической пользы и заслуживает дальнейшего изучения.
[00178] Анализ с помощью проточной цитометрии показал постоянное увеличение доли циркулирующих CD31 Т-клеток после терапии кабозантинибом, в значительной степени обусловленное увеличением популяции CD4/CD8+цитотоксических Т-лимфоцитов. Более того, наблюдалось постоянное снижение CD14+моноцитов, смешанной популяции, которая охватывает иммуносупрессивные и проангиогенные миелоидные клетки. Эти результаты могут отражать активацию системного противоопухолевого иммунитета после лечения кабозантинибом, как это наблюдается в доклинических моделях, но это не связано с исходом. Эти данные являются привлекающими внимание, учитывая недавний интерес к комбинированию кабозантиниба с ингибиторами контрольных точек иммунного ответа (NCT02496208).
[00179] Механизм действия и клиническая польза ингибиторов VEGFR и MET, когда они используются отдельно или в комбинации, остаются неясными. Ранее было показано, что некоторые ингибиторы VEGF и MET являются неэффективными при метастатическом раке молочной железы. Механизм лечебной эффективности блокады VEGF может быть связан с нормализацией сосудов, а не с антиваскулярными эффектами и индуцированием в опухолях гипоксии. HGF и MET представляют собой индуцируемые гипоксия-индуцируемые белки, и повышенная экспрессия МЕТ после ингибирования VEGFR2 была связаны с обходной терапевтической резистентностью. К сожалению, блокада антител, как VEGF с использованием бевацизумаба, так и MET с использованием онартузумаба с паклитакселом не продемонстрировала клинической пользы у пациентов с метастатическим ТНРМЖ, которые ранее не получали паклитаксел для метастатического заболевания. Данные циркулирующего биомаркера показывают, что кабозантиниб может иметь сильные антиваскулярные эффекты в метастатическом ТНРМЖ. Чтобы преодолеть эти ограничения, наши гипотезообразующие результаты показывают, что: (a) sMET следует дополнительно изучить как потенциальный биомаркер ответа; и (б) системные изменения в противоопухолевом иммунитете могут быть эффективно максимально использованы с помощью рациональных комбинаций с иммунотерапией.
[00180] Это исследование имеет несколько ограничений, связанных с несравнительным дизайном и небольшим количеством пациентов. Клинически, среднее значение PFS было малым, в значительной степени обусловленной ранним PD у пациентов без лечебной эффективности. Будущие исследования (такие как NCT01441947 (кабозантиниб с фулвестрантом ) и NCT0226053 (кабозантиниб с трастузумабом) являются оправданными и должны проверять данные биомаркера и характеризовать опухоли у пациентов, которые получают пользу от терапии.
[00181] Это исследование фазы II применения кабозантиниба показало 9% ЧОО, предварительную активность и благоприятную безопасность у пациентов с метастатическим ТНРМЖ. Исследовательский анализ показал, что циркулирующие уровни sMET могут быть потенциальным биомаркером для кабозантиниба, и что этот препарат может иметь вызывающую интерес иммуномодулирующую активность. Эти гипотезы следует тестировать в более крупных исследованиях при метастатическим ТНРМЖ и других злокачественных новообразованиях.
Другие варианты осуществления изобретения
Вышеописанное изобретение для ясности и понимания было описано более подробно с помощью иллюстраций и примера. Изобретение описано со ссылкой на различные конкретные и предпочтительные варианты осуществления изобретения и способы. Тем не менее, следует понимать, что многие варианты и модификации могут быть сделаны, оставаясь при этом в пределах сущности и объема изобретения. Специалисту в данной области будет очевидно, что изменения и модификации могут быть реализованы в рамках прилагаемой формулы изобретения. Поэтому следует понимать, что приведенное выше описание предназначено для иллюстрации, а не для ограничения. Таким образом, объем изобретения должен быть определен, не согласно вышеприведенного описания, а вместо этого должен быть определен согласно нижеприведенной прилагаемой формулы изобретения вместе с полным объемом эквивалентов, на которые такие требования имеют право.
Реферат
Группа изобретений относится к способу лечения трижды негативного рака молочной железы. Способ лечения трижды негативного рака молочной железы у пациента-человека включает введение пациенту определенного количества кабозантиниба (S)-малата, при этом количество кабозантиниба (S)-малата является достаточным для активации одного или более циркулирующих биомаркеров иммунной системы, где кабозантиниб (S)-малат вводят в разовой дозе 20, 40 или 60 мг эквивалента свободного основания кабозантиниба (FBE) один раз в день в таблетированной форме, содержащей 20, 40 или 60 мг эквивалента свободного основания (FBE) кабозантиниба. Также раскрыты способ лечения трижды негативного HER2 рака молочной железы у пациента-человека и способ лечения трижды негативного рака молочной железы у пациента-человека с определенной концентрацией sMET. Группа изобретений обеспечивает активацию биомаркеров иммунной системы. 3 н. и 9 з.п. ф-лы, 7 ил., 5 табл., 1 пр.

Комментарии