Композиция для ингибирования молочнокислых бактерий, загрязняющих технологическую среду при производстве топливного этанола (варианты), способ контроля загрязнения молочнокислыми бактериями указанной среды и способ контроля их роста в ферментационном проц - RU2397200C2
Код документа: RU2397200C2
Чертежи

Описание
УРОВЕНЬ ТЕХНИКИ
Данное изобретение относится к усовершенствованному способу контроля микроорганизмов в водной технологической среде с использованием кислот хмеля. Кроме того, данное изобретение относится к получению топливного этанола. Более конкретно, оно относится к способу получения топливного этанола с использованием кислот хмеля.
В настоящее время в мире существует огромная потребность в жидких топливах и она обеспечивается почти целиком дистиллятными нефтяными топливами. Конечно, хорошо известно, что нефть является невосстанавливаемым источником, и что существуют ограниченные запасы этого источника топлива. В результате в настоящее время проводится очень активный поиск альтернативных жидких топлив или топливных наполнителей.
В свете постоянно увеличивающейся потребности в жидких топливах и сокращающихся источников нефтетоплива исследователи начали исследовать альтернативные жидкие топлива для определения возможности коммерческого получения таких заменителей для удовлетворения этой увеличивающейся потребности. Недавние события в мире, в том числе нехватка нефтетоплива, резкое увеличение стоимости нефтепродуктов и бензиновых продуктов и политическая нестабильность многих нефтедобывающих стран, продемонстрировали уязвимость существующих источников жидких топлив. Даже в том случае, если бы такие нестабильность запасов и экономическая нестабильность были приемлемыми, ясно, что всемирное производство нефтепродуктов при прогнозируемых уровнях неспособно ни идти наравне с увеличивающейся потребностью, ни продолжаться безгранично. Становится очевидным, что скоро придет время, когда должен будет совершен переход к источникам, которые являются изобильными и предпочтительно возобновляемыми.
Одним из наиболее часто признаваемых заменителей, которые могли бы быть сделаны доступными в значительных количествах в ближайшем будущем, является спирт и, в частности, этанол. Например, в настоящее время в Соединенных Штатах и по всему миру имеются многочисленные торговые центры, которые продают смесь бензина и приблизительно 10-процентного - 20-процентного этанола (обычно называемую «газохолом»), которая может быть использована в качестве топлива в обычных автомобильных двигателях. Кроме того, этанол может быть смешан с присадками с получением жидкого топлива на основе этанола, с этанолом в качестве главного компонента, которое пригодно для эксплуатации в большинстве типов двигателей.
Этанол может быть получен почти из любого материала, который существует в форме ферментируемого сахара или может быть превращен в ферментируемый сахар. Имеются многочисленные природные сахара, доступные для ферментации, но такие углеводы, как крахмал и клетчатка, могут быть превращены в ферментируемые сахара, которые затем ферментируются в этанол. Даже в настоящее время в большей части всего мира этанол получают посредством ферментационного процесса. Этанол может быть также получен синтетически из этилена.
Крахмал является одним из наиболее обильных возобновляемых исходных материалов. Одним ответом на потребность в альтернативных воспроизводимых топливах является превращение этого очень распространенного материала при низкой стоимости в ферментируемые сахара в качестве исходного сырьевого материала для ферментации в этанол. Термин технологическая среда, используемый в получении топливного этанола, является общим термином, включающим в себя любую из сред, в которых могут жить молочнокислые или уксуснокислые бактерии и использоваться в получении топливного этанола или спиртных напитков, и включает в себя, но не ограничивается ими, исходный сырьевой материал, любую осахаренную или гидролизованную крахмальную или сахарную среду, любую крахмальную или сахарную среду, включающую в себя дрожжи, и/или дистиллят из любого ферментационного процесса. Крахмал для этого процесса, использующего исходный сырьевой материал, обычно получают из таких сельскохозяйственных культур, как кукуруза, сорго, пшеница, осоложенный ячмень, картофель и рис. Ферментируемыми (сбраживаемыми) сахарами, получаемыми из крахмала, являются глюкоза и мальтоза, и их обычно получают из крахмала гидролизом или осахариванием, например кислотным гидролизом или ферментативным гидролизом. Большинство способов гидролиза, которые были доступными, являются обычно очень дорогими в отношении получения исходного сырьевого материала для широкомасштабного производства спирта. В отношении максимизации получения этанола из крахмального исходного сырьевого материала желательно иметь как можно больше ферментируемых веществ в ферментационном субстрате.
Практика показала, что предпочтительно добавлять ферменты солода, такие как глюкоамилаза, которые способствуют гидролизу крахмалов и превращению более сложных декстринов и декстрозных сахаров, которые присутствуют в сахарных растворах ферментационных способов предшествующего уровня. Ферменты солода могут быть куплены или, в случае получения виски, экстрагированы природным образом из осоложенного ячменя. Хотя такие ферменты солода придают желательный вкус этанолу, получаемому для потребления людьми, эти ферменты солода не делают этанол более предпочтительным заменителем жидкого топлива и фактически могут создавать проблемы для подобного применения.
После завершения стадии осахаривания ферментируемые сахара добавляют к дрожжам, где начинается ферментация (сбраживание). Альтернативно в настоящее время многие спиртовые заводы добавляют вышеуказанный фермент в ферментер с дрожжами. Это одновременное осахаривание и сбраживание позволяет ферментировать более высокие концентрации крахмала. Если источником сахара являются сельскохозяйственные культуры, такие как сахарный тростник, сахарные свеклы, плоды или мелассы, осахаривание не является необходимым и ферментация может начинаться добавлением дрожжей и воды.
В случае обычных известных систем для получения этанола из крахмала, например, с использованием двухферментной системы для разжижения и осахаривания крахмала до глюкозы с последующей периодической ферментацией обычными являются общие продолжительности обработки 60-80 часов. Обычно используют продолжительности ферментации 50-70 часов. Такие продолжительные общие периоды выдерживания приводят к требованиям огромных емкостей в системе обработки, когда предполагается крупномасштабное производство этанола.
В процессе ферментации дрожжи добавляют к раствору простых сахаров. Дрожжи представляют собой небольшой микроорганизм, который использует сахар в растворе в качестве пищи и при этом выделяет этанол и диоксид углерода в качестве побочных продуктов. Диоксид углерода выделяется в виде газа, поднимаясь вверх через жидкость, а этанол остается в растворе. К сожалению, дрожжи загнивают, когда концентрация этанола в растворе приближается приблизительно к 18 объемным процентам, независимо от того, присутствуют ли все еще ферментируемые сахара.
Для почти полной ферментации и для получения больших количеств этанола общей практикой является применение периодического процесса, в котором используют чрезвычайно большие ферментационные резервуары, способные вмещать в себя до 500000 галлонов. С такими большими резервуарами экономически нереально подавать количество дрожжей, достаточное для быстрой ферментации сахарного раствора. Таким образом, общепринятые ферментационные процессы требовали 72 и более часов, поскольку такие периоды времени требуются для размножения популяции дрожжей до необходимой концентрации. Например, в ферментационный резервуар добавляют некоторое количество дрожжей. За 45-60 минут популяция дрожжей будет удвоена; за другие 45-60 минут эта новая популяция дрожжей будет удвоена. Такое размножение занимает многие часы для получения количества дрожжей, необходимого для ферментации такого большого количества сахарного раствора.
Сахара, используемые в общепринятых ферментационных процессах, содержат обычно приблизительно от 6 процентов до 20 процентов больших, сложных сахаров, таких как декстрины и декстроза, которые требуют гораздо более длительного времени для подвергания ферментации, если они будут подвергнуты ферментации, чем простые гексозные сахара, такие как глюкоза и фруктоза. Таким образом, обычной практикой является завершение процесса ферментации после указанного периода, такого как 72 часа, даже хотя не все эти сахара были утилизированы. При рассмотрении процессов предшествующего уровня с экономической точки зрения предпочтительнее пренебречь оставшимися несброженными сахарами, чем ожидать полного сбраживания всех сахаров в данной партии.
Одной из важных проблем в случае общепринятых ферментационных систем является трудность поддержания стерильных условий, свободных от бактерий, в партиях большого размера и в случае продолжительного ферментационного периода. Если партия становится загрязненной, не только дрожжи и сахарный раствор должны быть выброшены, но и весь ферментационный резервуар должен быть опорожнен, вычищен и стерилизован. Такое действие занимает много времени и является очень дорогостоящим.
Кроме того, многие из этих бактерий конкурируют с дрожжами за сахар, уменьшая посредством этого количество продуцируемого этанола. Бактрии могут расти приблизительно в десять раз быстрее, чем дрожжи, следовательно, загрязнение в этих участках является неизбежным. При потреблении сахара эти бактерии продуцируют молочную кислоту и другие побочные продукты. Кроме того, если ферментационные резервуары не дезинфицируются или не стерилизуются должным образом между партиями или использованиями, бактерии и другие нежелательные микроорганизмы могут становиться прикрепленными к внутренним стенкам бродильных чанов, где они будут расти и усиленно размножаться. Эти нежелательные микроорганизмы могут загрязнять этанольные побочные продукты, такие как корм для животных, или они могут потреблять полезные количества субстрата, или сахара, уменьшая тем самым продуцирование этанола. Экономичность и эффективность ферментационных процессов часто являются такими, что они не могут противостоять любой такой потере продукции.
Во время производства топливного этанола бактериальное загрязнение происходит почти на каждой стадии этого процесса, где вода и крахмал/сахар присутствуют при температурах ниже 40оС. Загрязнение исходит обычно из крахмального материала, так как эти сельскохозяйственные культуры приносят бактерии с полей. Промывание материала помогает понизить количество бактерий, однако, бактериальное загрязнение является неизбежным. Примером этого являются мокрые способы помола, когда кукурузу замачивают в течение 24-48 часов. Само намачивание высушенных кукурузных зерен в воде дает такие высокие уровни молочной кислоты, как 0,5%. На каждый грамм образованной молочной кислоты теряются почти два грамма крахмала. Lactobacillus brevis и Lactobacillus fermentum являются двумя гетероферментными бактериями, обычно обнаруживаемыми в заторах спиртового производства. Эти бактерии способны превращать один моль глюкозы в один моль молочной кислоты и один моль уксусной кислоты, соответственно, наряду с одним молем этанола и одним молем диоксида углерода.
Существующие способы убивания этих нежелательных микроорганизмов, среди прочих, часто включают в себя введение чужеродных агентов, таких как антибиотики, нагревание и введение сильных химических дезинфицирующих средств, в ферментацию до или во время производства этанола. Обычно синтетические химические антибиотики добавляют в ферментационные резервуары для уменьшения роста продуцирующих молочную кислоту бактерий. Добавление каждого из этих чужеродных агентов в этот процесс значительно увеличивает время и стоимость производства этанола. Антибиотики являются очень дорогими и могут в высокой степени увеличивать стоимость крупномасштабного производства. Если антибиотики не использовать, обычной является 1-5-процентная потеря этанола. Установка для производства пятидесяти миллионов галлонов топливного этанола, работающая с уровнем молочной кислоты 0,3 мас.% в дистиллируемом растворе теряет приблизительно 570000 галлонов этанола каждый год из-за бактерий. Применение нагревания требует значительной энергии для нагревания ферментационных резервуаров, а также, возможно, требует применения особых, спроектированных для выдерживания давления резервуаров, которые могут выдерживать высокие температуры и давления, генерируемые в таких способах тепловой стерилизации. Химические обработки могут также увеличивать стоимость продукции прежде всего из-за стоимости самих химикалиев, эти химикалии часто являются вредными веществами, требующими специального обращения и предосторожностей в отношении окружающей среды и безопасности и не являются «зелеными», т.е. не являются органическими.
После ферментации общепринятыми способами удаляли этанол из ферментационного раствора и затем концентрировали этанольный продукт дистилляцией. Дистилляционные колонны, способные к такому отделению и концентрированию, хорошо известны в данной области. После ферментации, 5-15-процентный спиртовой раствор, часто называемый дистиллируемым раствором или вином, концентрировали до 50-95-процентного этанола посредством дистилляции. Этот этанол может быть использован «как таковой» для приготовления спиртных напитков. Альтернативно 95-процентный этанол, обычно получаемый в установках для топливного этанола, пропускают через молекулярные сита для удаления оставшейся воды с получением этанола топливной категории, более чем 99%-ного этанола, используемого для смешивания с бензином.
Топливный этанол получают с сухим способом помола или с мокрым способом помола. Сухой способ помола начинается размалыванием сухих зерен кукурузы почти до порошка с последующей тепловой обработкой и обработкой высокотемпературными ферментами для разрушения крахмала до ферментируемых сахаров. Этот сахаристый раствор, содержащий приблизительно 30 процентов твердых веществ, 70 процентов из которых представляет крахмал, охлаждают до 30оС, обрабатывают дрожжами и ферментируют в этанол посредством периодической или непрерывной ферментации. Этанол выделяют из этого раствора посредством дистилляции. Оставшиеся твердые вещества в этом растворе выделяют, сушат и продают в качестве корма для крупного рогатого скота.
Во время мокрого способа помола сухие зерна кукурузы замачивают с водой для обеспечения абсорбции влаги этими зернами. Замочную воду удаляют и замоченные зерна получают в рыхлоизмельченном виде и обрабатывают посредством ряда стадий для разделения зародышей, волокна, клейковины и крахмала. Крахмал обрабатывают с получением фруктозного сиропа, некоторая часть которого продается компаниям по производству конфет, пищевых продуктов и газированных напитков. Остальной фруктозный кукурузный сироп обрабатывают дрожжами и ферментируют с получением этанола.
Многого остается желать в области производства этанола в отношении эффективной стерилизации ферментационных резервуаров, которая является безопасной, недорогой и благоприятной для окружающей среды, но которая все еще увеличивает, а не разрушает или ограничивает эффективную продуцирующую спирт активность микроорганизмов. В данной области существует потребность в соединении и способе увеличения выходов топливного этанола из ферментации.
Хмелевые шишки использовали в пивоварении в течение более тысячи лет. Известно, что этот похожий на сосновые шишки ингредиент придает горький вкус (горечь), аромат и консервирующие свойства пиву. Многие из активных соединений, ответственных за горечь, являются также ответственными за консервирующие свойства хмеля. Эти соединения были идентифицированы, и они являются по своему характеру органической кислотой. Одним главным соединением в хмеле является органическая кислота, известная как гумулон, и ее называют также альфа-кислотами. Альфа-кислоты составляют 10-15 мас.% в сухом хмеле и более 50 мас.% экстракта, полученного с использованием диоксида углерода из хмеля. Во время варки пива хмель кипятят и альфа-кислоты подвергают тепловой изомеризации с образованием нового соединения, известного как изо-альфа-кислоты. Изо-альфа-кислоты являются истинными придающими горький вкус и консервирующими соединениями, обнаруживаемыми в пиве.
На протяжении последних сорока лет промышленное хмелеводство развилось в поставщика высокотехнологичных ингредиентов для пивоваренной промышленности. В настоящее время хмель экстрагируют СО2 и большую часть этого СО2-экстракта хмеля дополнительно обрабатывают для отделения фракции альфа-кислот от остального экстракта хмеля. Затем эти альфа-кислоты изомеризуют тепловой обработкой в изо-альфа-кислоты и готовят в виде точных спецификаций для облегчения применения и точного добавления к пиву. Производные изо-альфа-кислот получают также выполнением простых химических реакций. Эти восстановленные изо-альфа-кислоты, в частности ро-изо-альфа-кислоты, тетрагидроизо-альфа-кислоты (THIAA) и гексагидроизо-альфа-кислоты (HHIAA), являются очень стабильными в отношении света и нагревания.
В данной области существует потребность в соединении и способе для уменьшения роста микроорганизмов в ферментации топливного этанола для увеличения выхода этанола.
Эти и другие недостатки и проблемы предшествующего уровня техники решаются данным изобретением.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Показаны и описаны способ и соединение для уменьшения продуцирующих молочную кислоту микроорганизмов в технологической среде.
В одном варианте осуществления, когда водный щелочной раствор кислоты хмеля добавляют в технологическую среду, имеющую рН меньший, чем рН щелочного раствора кислоты хмеля, эта кислота хмеля является особенно эффективной для контроля микроорганизмов. Действительно, общее применение кислоты хмеля для получения желаемого эффекта может быть в значительной степени уменьшено. Таким образом, описан способ контроля микроорганизмов в водной технологической среде, предусматривающий добавление водного щелочного раствора кислоты хмеля к технологической среде, где рН этого водного щелочного раствора кислоты хмеля является более высоким, чем рН технологической среды.
В результате низкого дозового количества добавляемого раствора в сравнении с технологической средой этот раствор адаптируется почти полностью к рН технологической среды при добавлении к этой технологической среде, и кислота хмеля переходит из диссоциированной формы (формы соли) в ассоциированную, антибактериально эффективную форму (форму свободной кислоты). Неожиданным образом, кислота хмеля является особенно эффективной в качестве антибактериального агента при применении таким образом. Кроме того, могут быть использованы различные формы кислот хмеля, которые в противном случае не могли бы использоваться или могли бы использоваться только при низкой эффективности.
Изомеризованные кислоты хмеля являются особенно эффективными в контроле бактериального роста в технологических средах или потоках перегонных установок. Действительно, посредством использования стандартизированного раствора изомеризованных кислот хмеля можно точно дозировать количество кислоты хмеля, требуемое для контроля бактериального роста.
Данное изобретение будет лучше всего понятным со ссылкой на следующее подробное описание предпочтительного варианта осуществления, взятого вместе с сопутствующим графическим материалом. Приведенное ниже обсуждение является описательным, иллюстративным и даваемым в качестве примера и не должно рассматриваться как ограничивающее объем изобретения, определенный прилагаемой формулой изобретения.
КРАТКОЕ ОПИСАНИЕ НЕСКОЛЬКИХ ВИДОВ ГРАФИЧЕСКОГО МАТЕРИАЛА
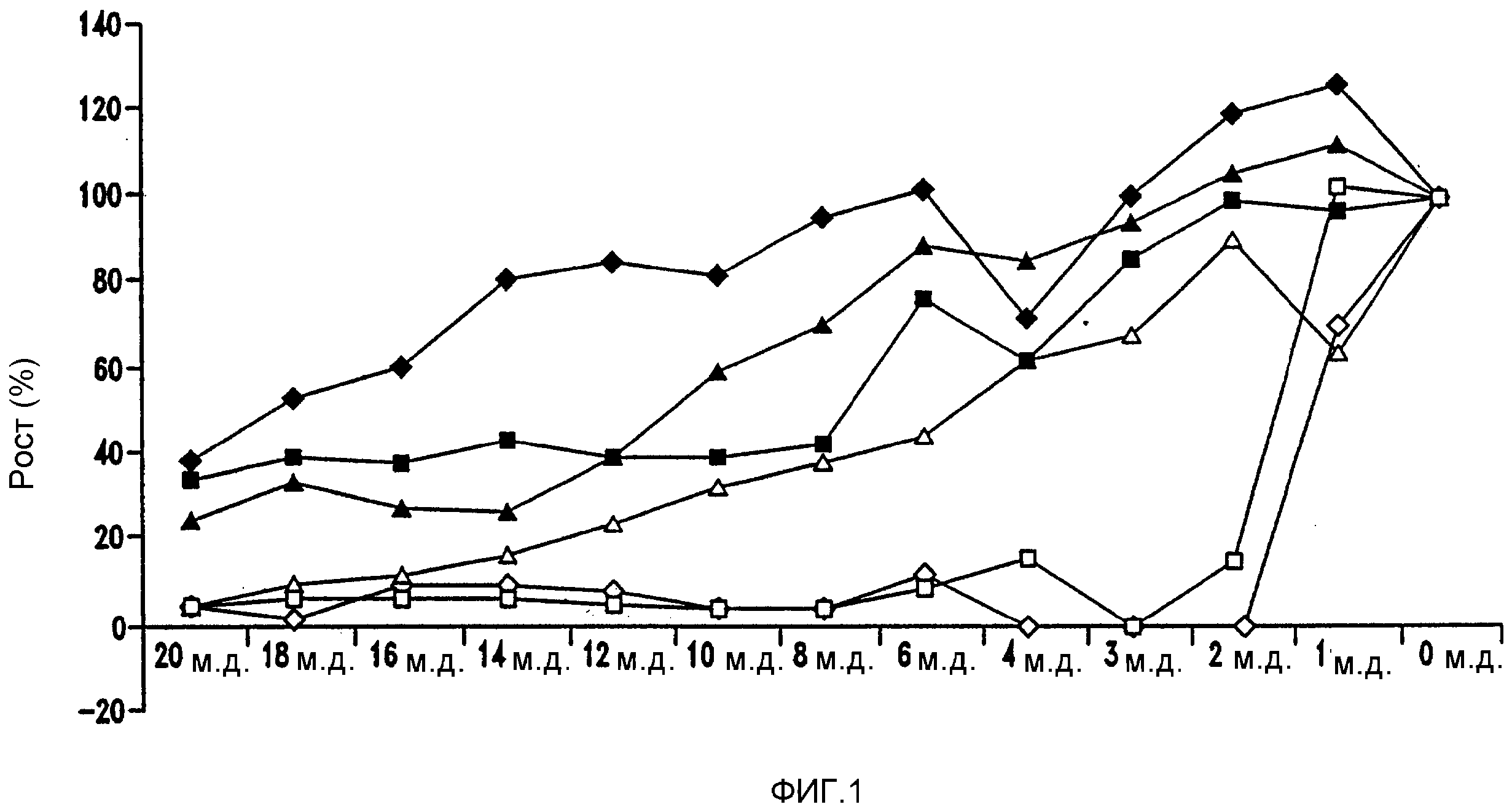
Фигура 1 показывает рост Lactobacillus brevis LTH 52 90 (Lb. brevis) в диапазоне различных концентраций различных соединений хмеля и производных соединений хмеля в модифицированной среде MRS при 86°F (30°С). Среду MRS, доведенную до рН 5,2, инокулировали Lb. brevis (106 организмов/мл). После 60 часов инкубации рост оценивали фотометрически при 578 нм в ячейке с длиной пути 1 см: ▲ α-кислоты; ■ β-кислоты и эфирные масла; ♦ ро-изо-α-кислоты; Δ изо-α-кислоты; □ гексагидроизо-α-кислоты; ◇ тетрагидроизо-α-кислоты.
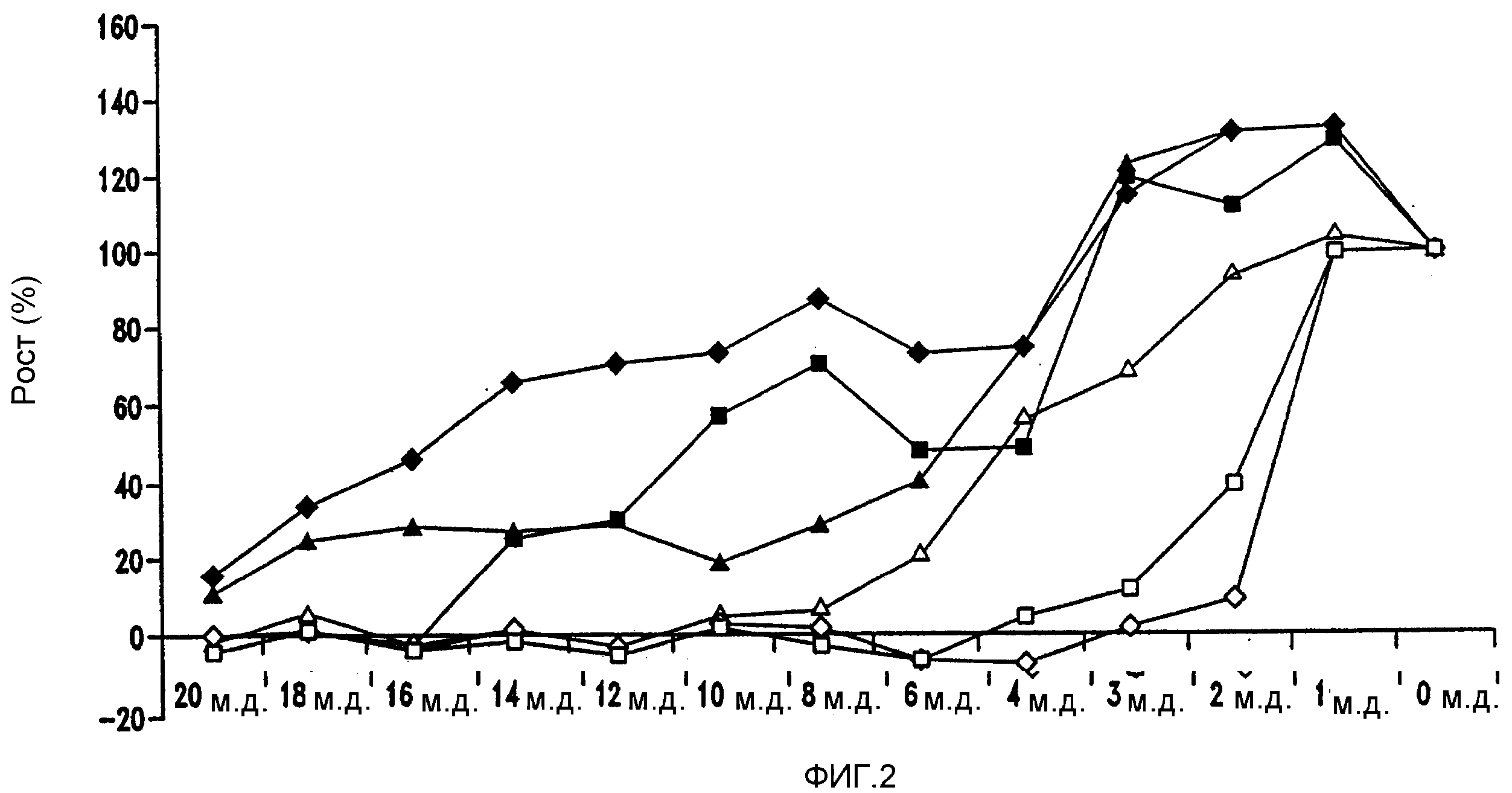
Фигура 2 показывает рост Lactobacillus fermentum LTH 5289 (Lb. fermentum) в диапазоне различных концентраций различных соединений хмеля и производных соединений хмеля в модифицированной среде MRS при 96,8°F (36°С). Среду MRS, доведенную до рН 5,2, инокулировали Lb. fermentum (106 организмов/мл). После 60 часов инкубации рост оценивали фотометрически при 578 нм в ячейке с длиной пути 1 см: ♦ α-кислоты; ■ β-кислоты и эфирные масла; ♦ ро-изо-α-кислоты; Δ изо-α-кислоты; □ гексагидроизо-α-кислоты; ◇ тетрагидроизо-α-кислоты.
Фигура 3 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций тетрагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
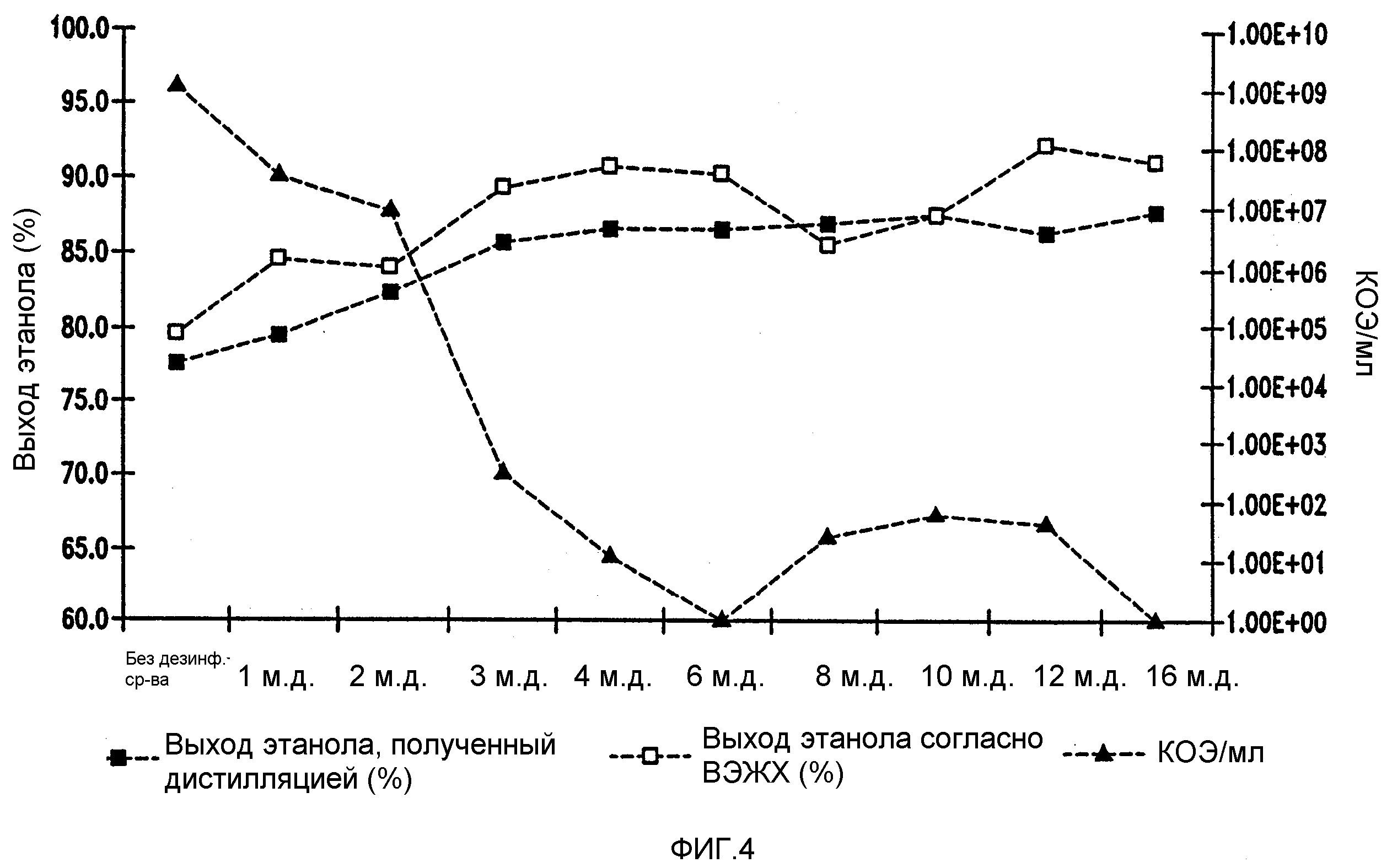
Фигура 4 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций тетрагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл. Ферментацию проводили при рН 5,2 и 96,8°F (36°С)в течение 72 часов.
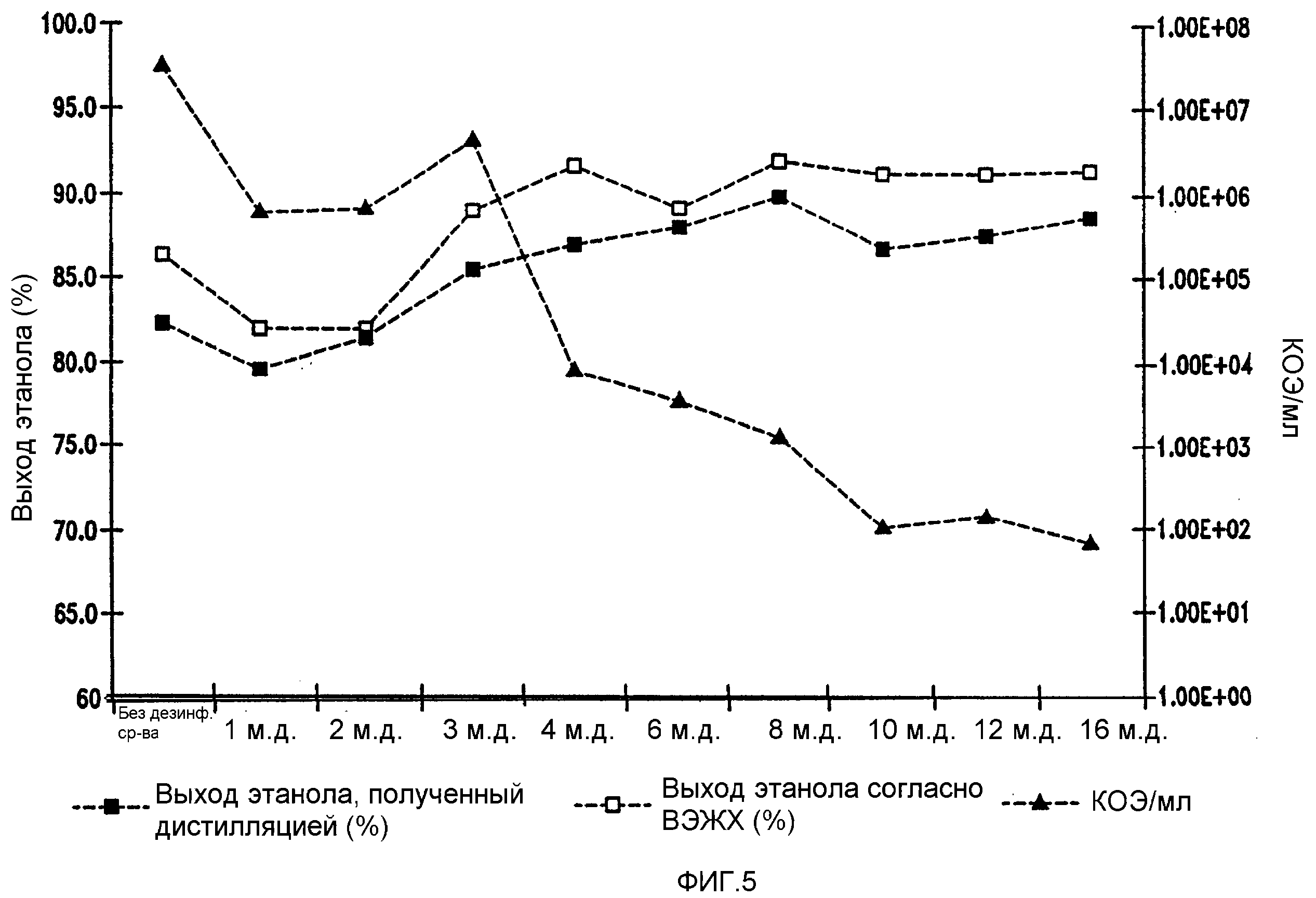
Фигура 5 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций гексагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл. Ферментацию проводили при рН 5,2 и 96,8°F (36°С)в течение 72 часов.
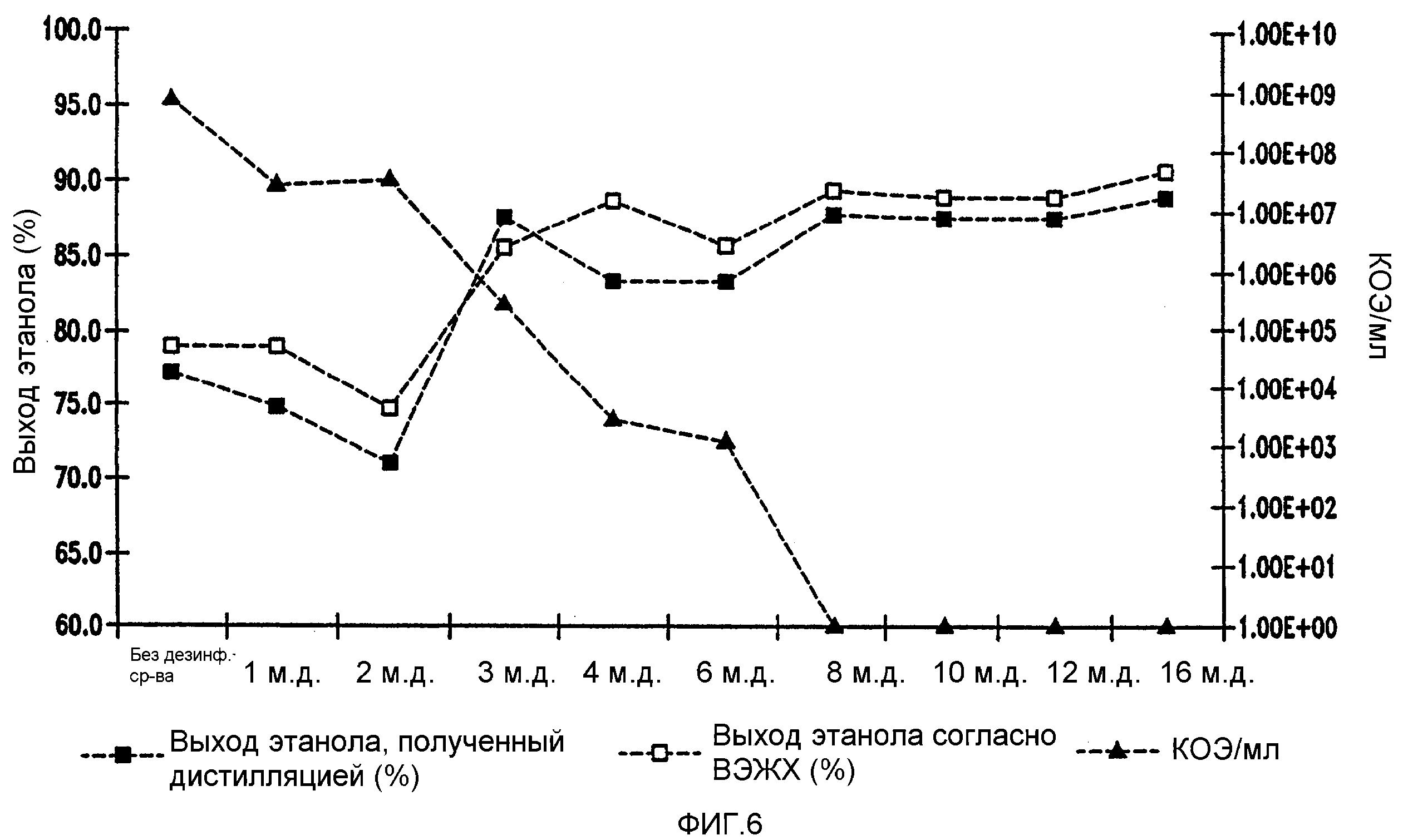
Фигура 6 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций гексагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,7 4 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл. Ферментацию проводили при рН 5,2 и 96,8°F(36°C) в течение 72 часов.
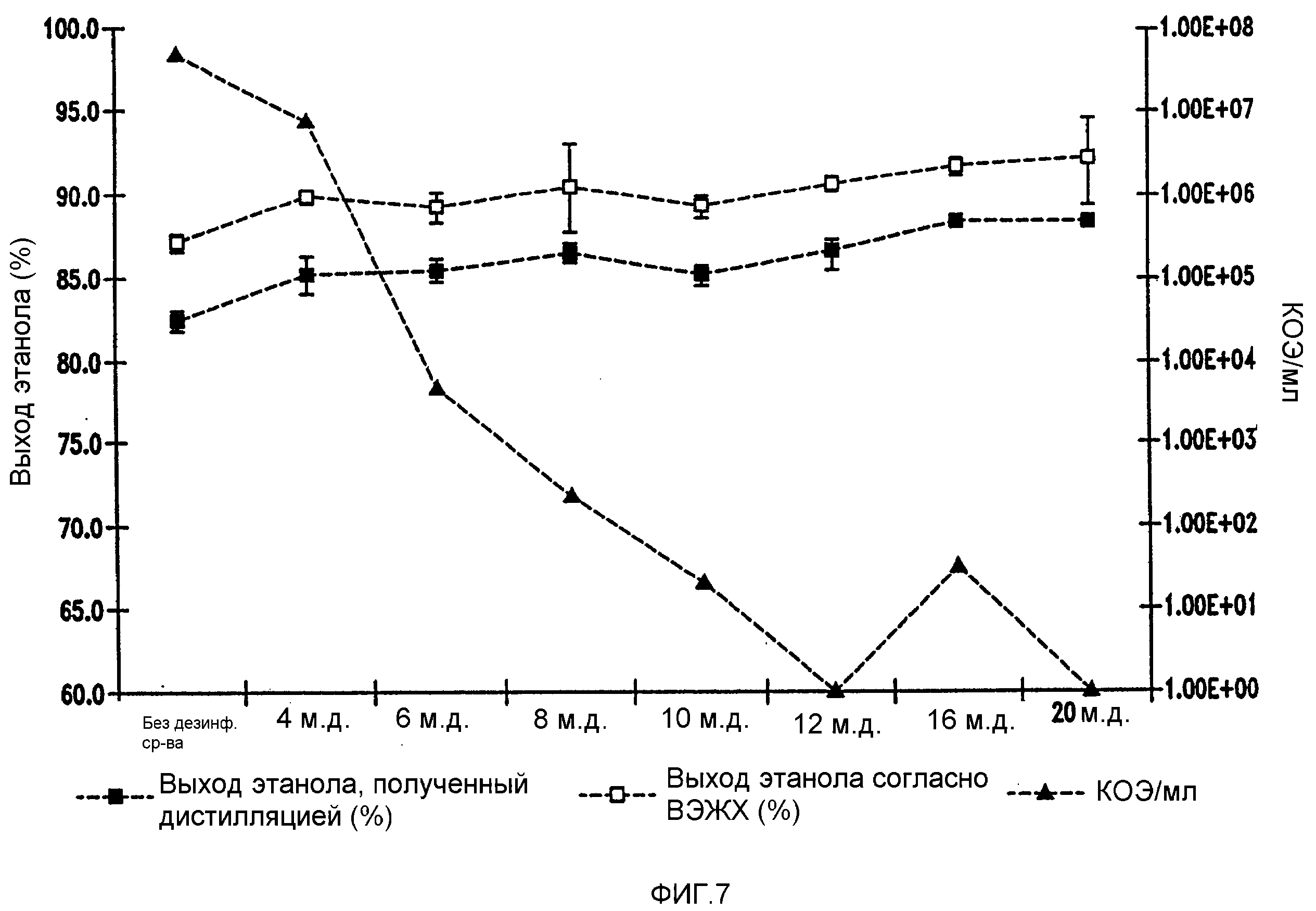
Фигура 7 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций изо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл. Ферментацию проводили при рН 5,2 и 86°F (30°С)в течение 96 часов.
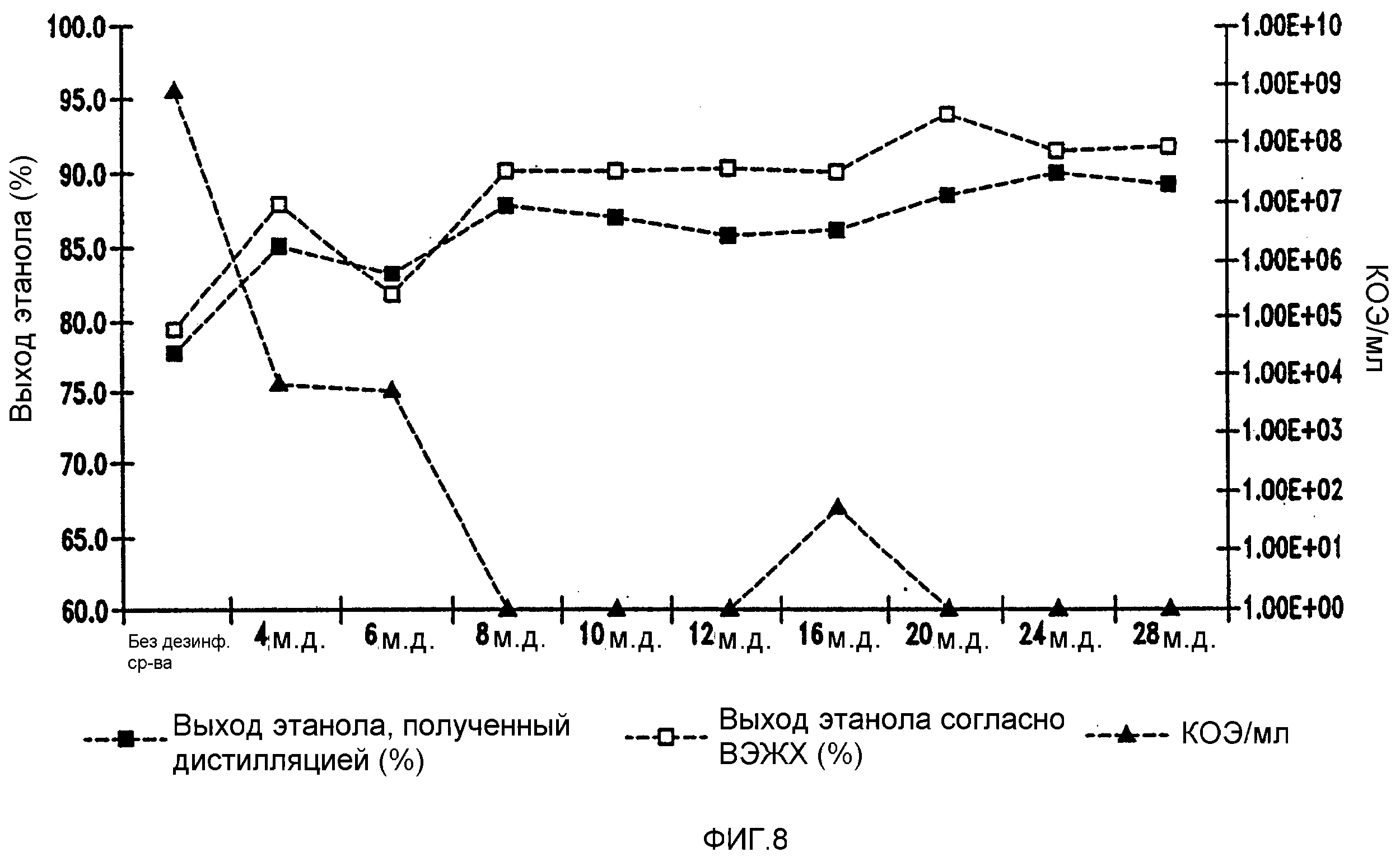
Фигура 8 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций изо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл. Ферментацию проводили при рН 5,2 и 96,8°F (36°С) в течение 72 часов.
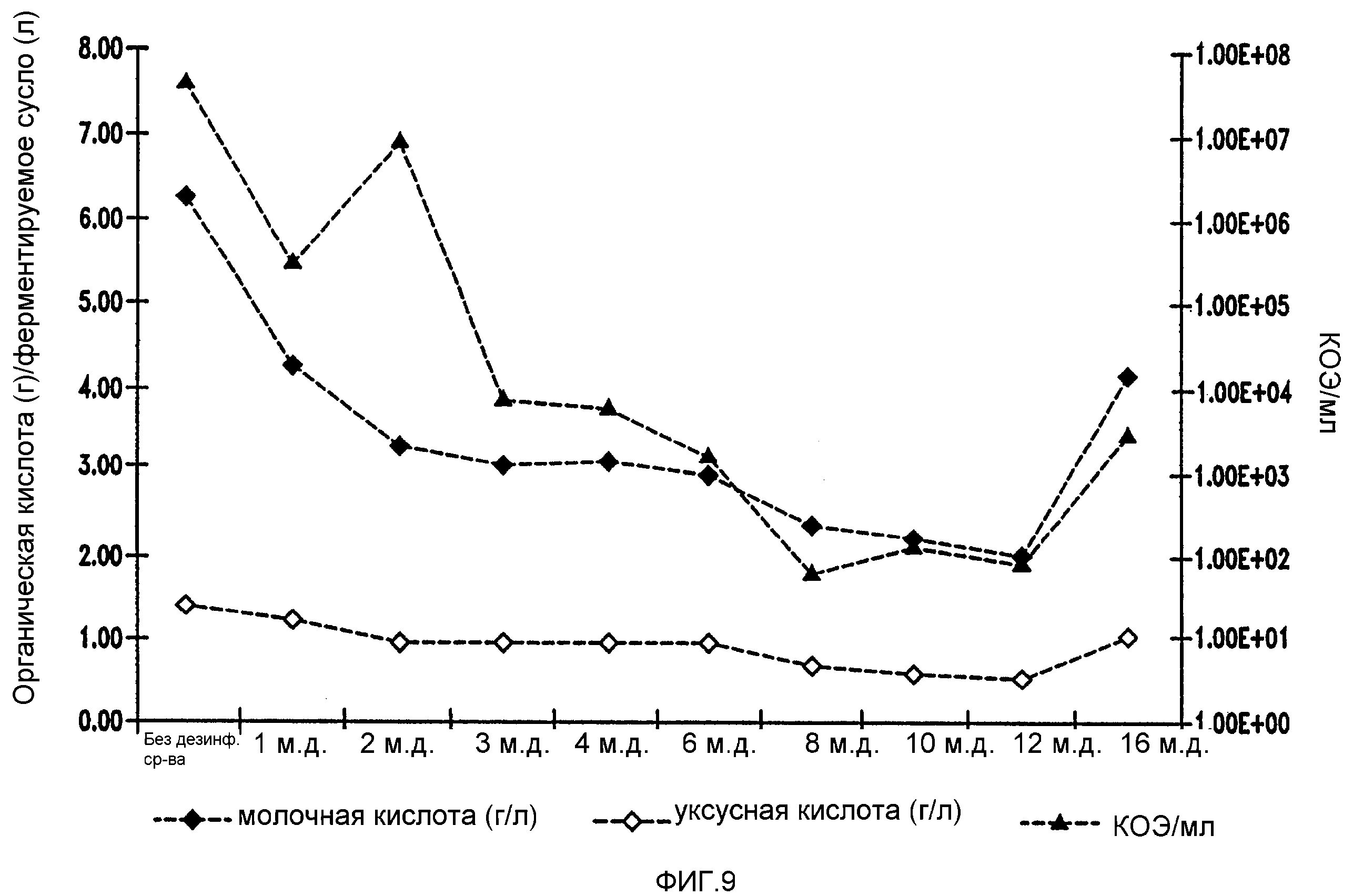
Фигура 9 показывает уменьшение бактериальных метаболитов, продуцируемых Lb. brevis, при увеличении концентраций тетрагидроизо-α-кислот в ферментируемом мелассном сусле.
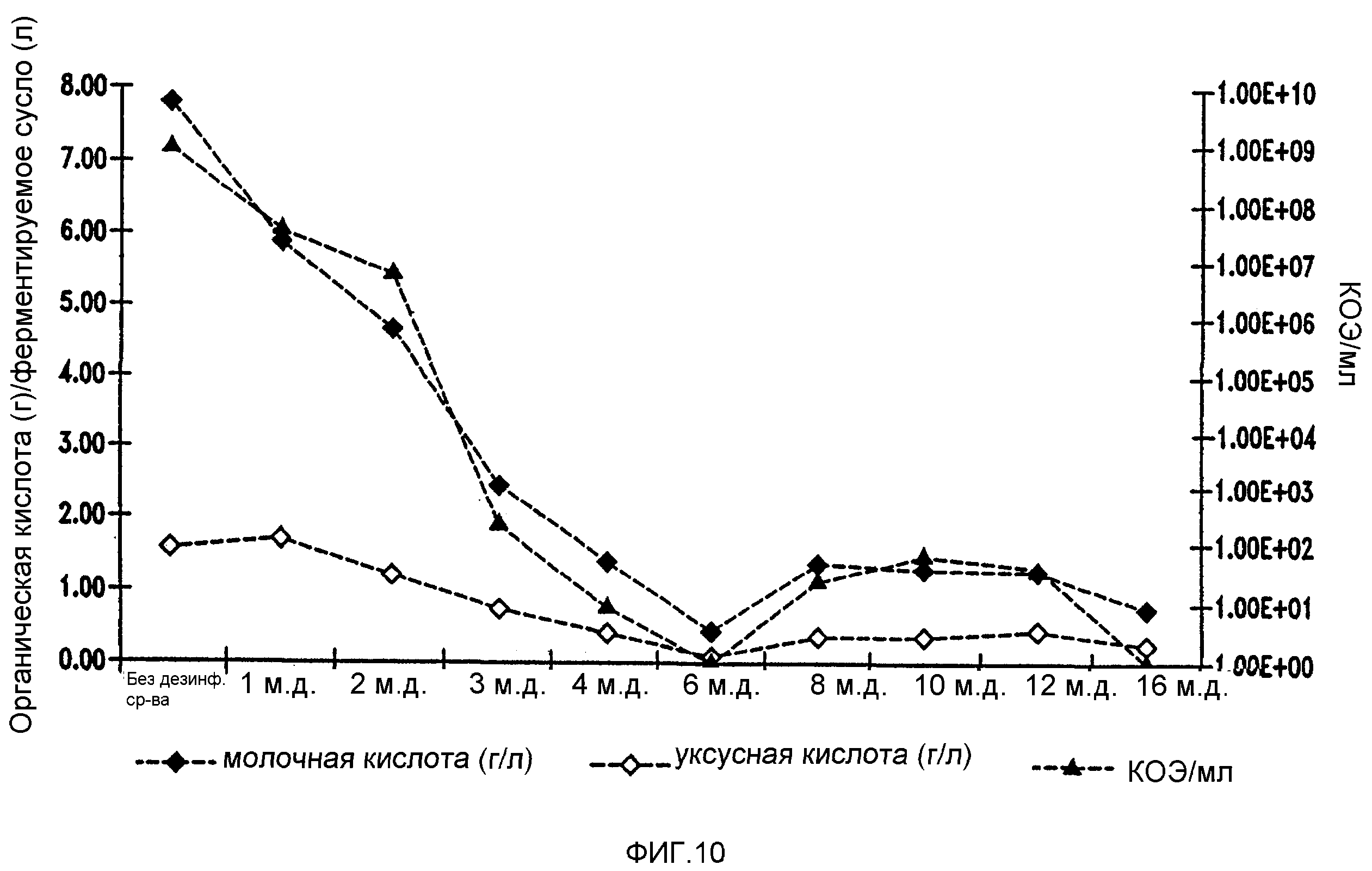
Фигура 10 показывает уменьшение бактериальных метаболитов, продуцируемых Lb. fermentum, при увеличении концентраций тетрагидроизо-α-кислот в ферментируемом мелассном сусле.
Фигура 11 показывает уменьшение бактериальных метаболитов, продуцируемых Lb. brevis, при увеличении концентраций гексагидроизо-α-кислот в ферментируемом мелассном сусле.
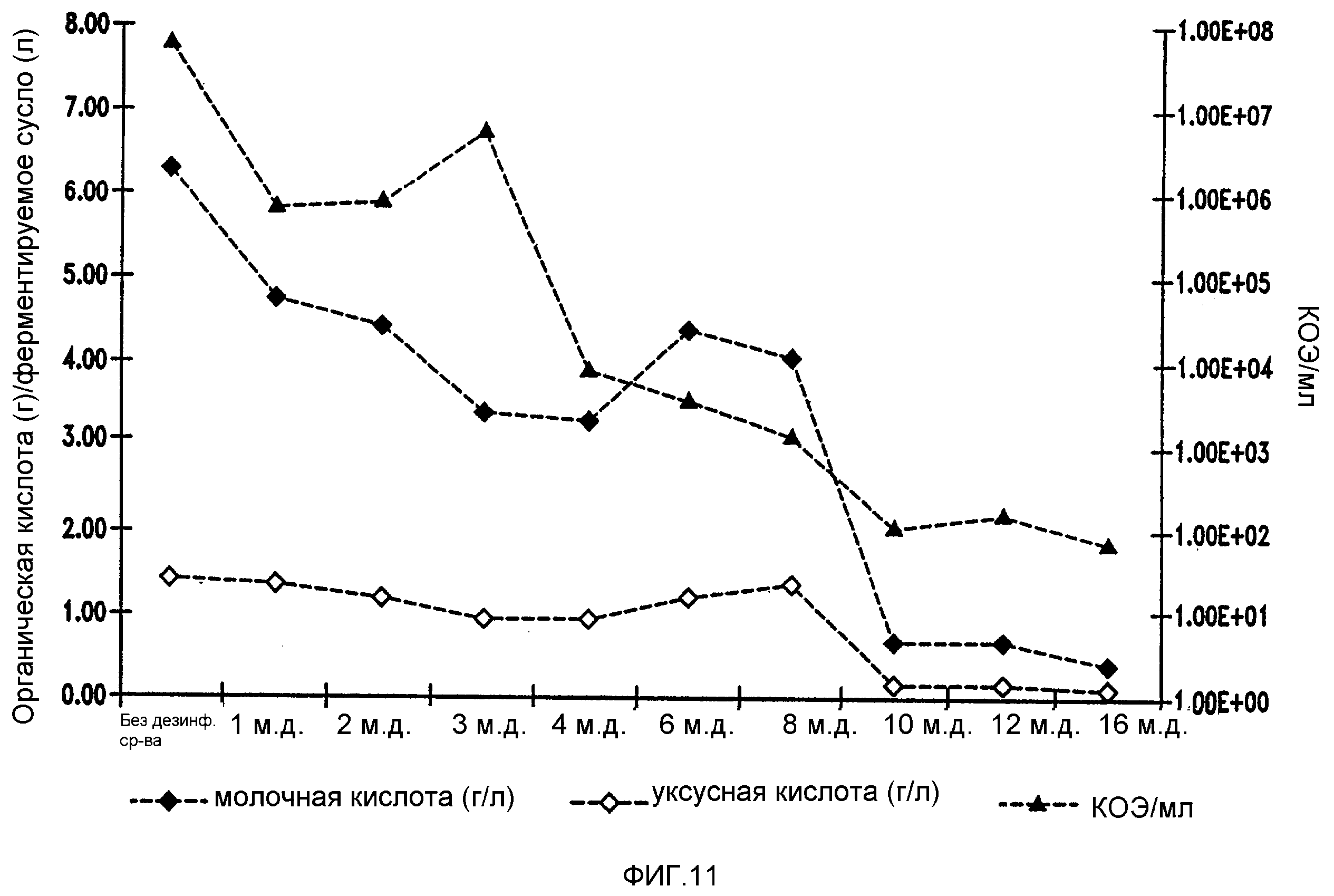
Фигура 12 показывает уменьшение бактериальных метаболитов, продуцируемых Lb. fermentum, при увеличении концентраций гексагидроизо-α-кислот в ферментируемом мелассном сусле.
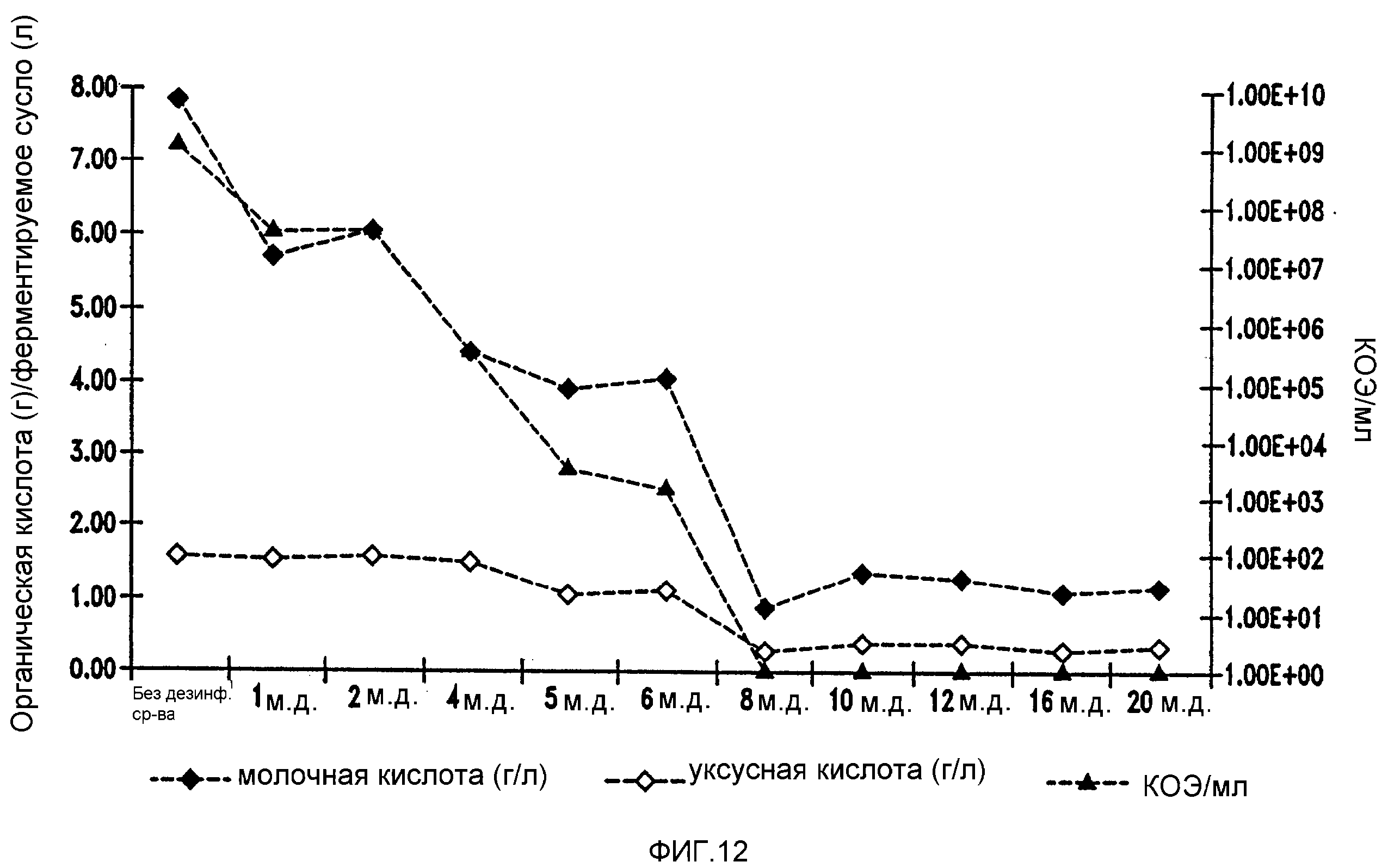
Фигура 13 показывает уменьшение бактериальных метаболитов, продуцируемых Lb. brevis, при увеличении концентраций изо-α-кислот в ферментируемом мелассном сусле.
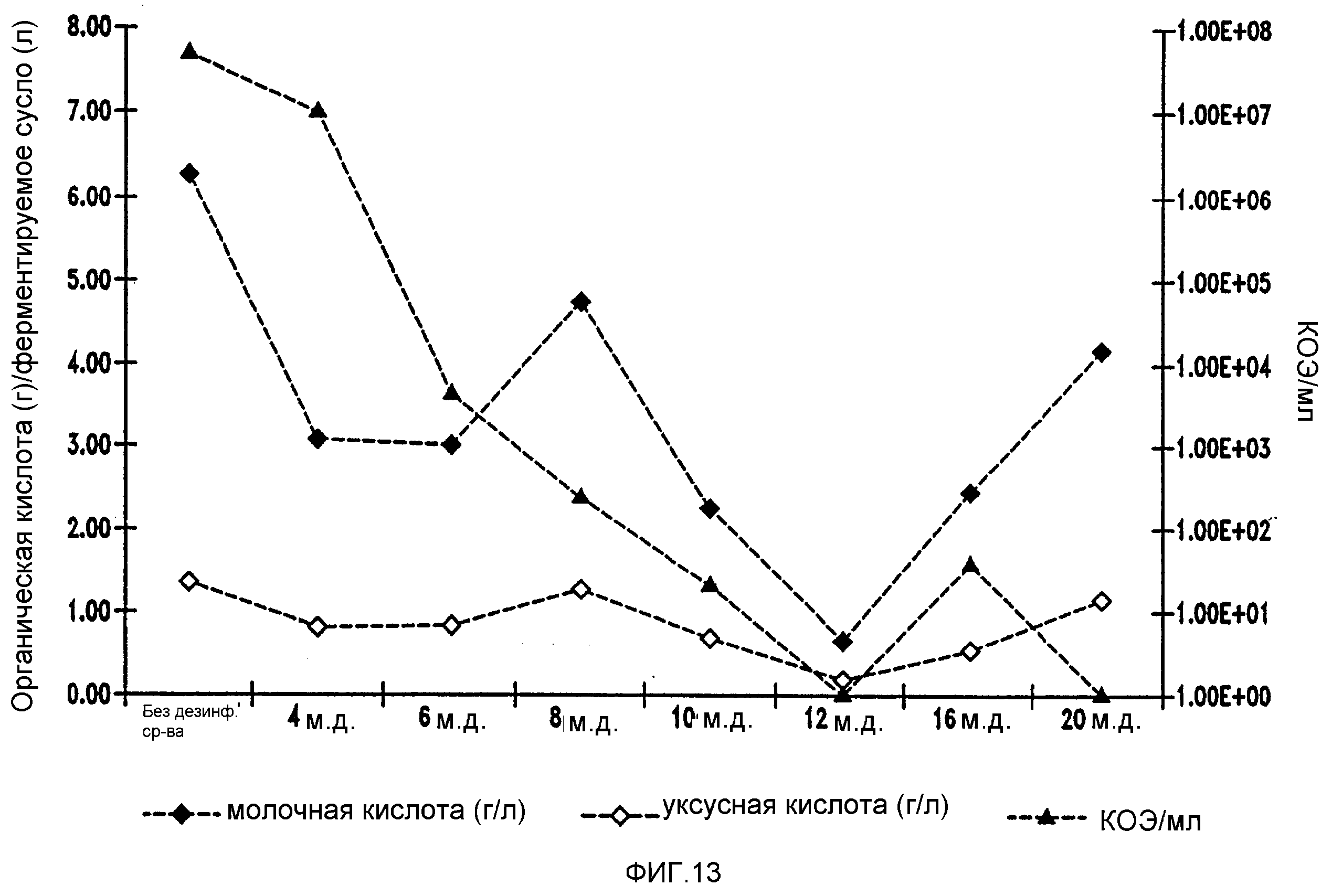
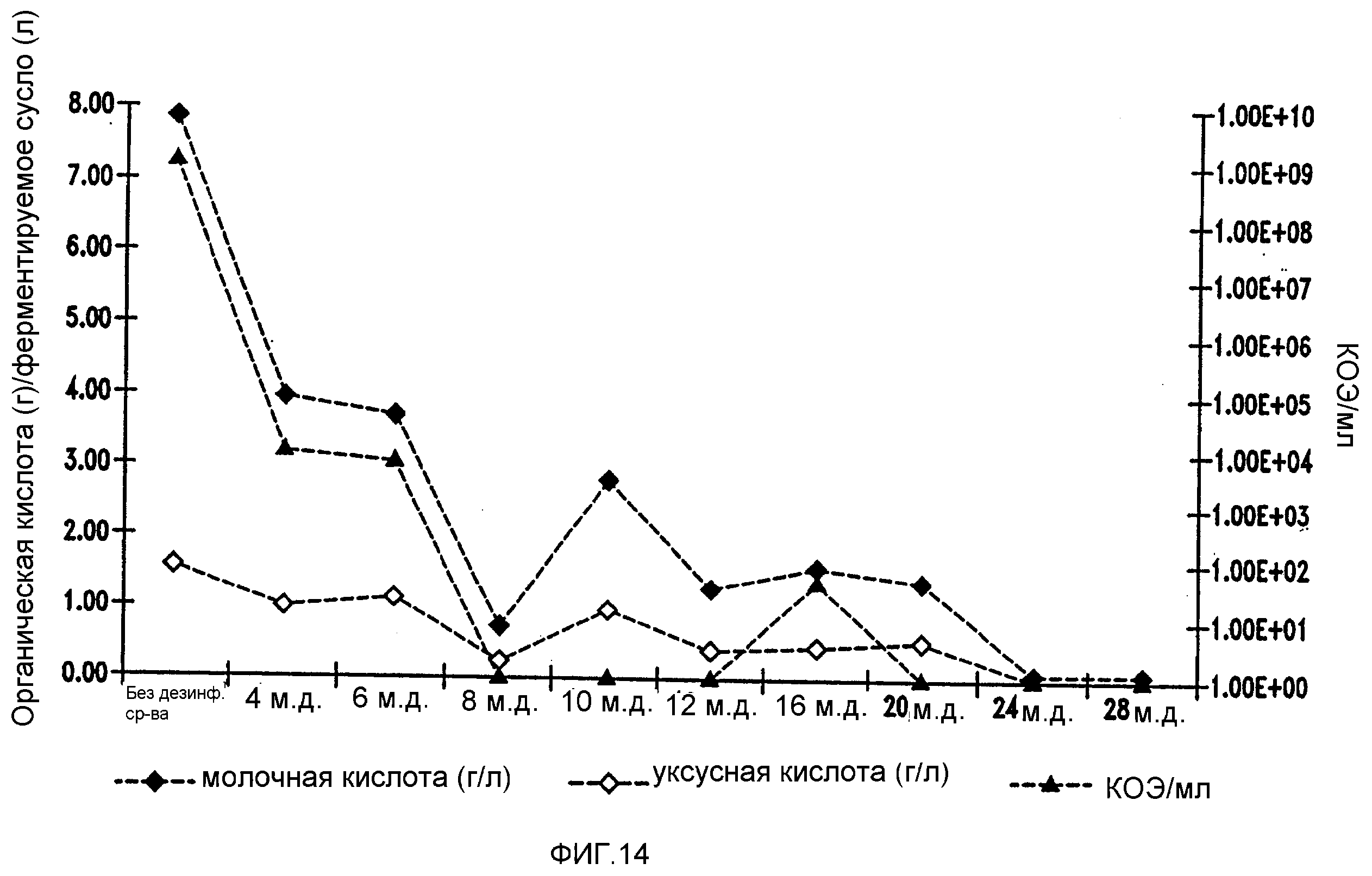
Фигура 14 показывает уменьшение бактериальных метаболитов, продуцируемых Lb. fermentum, при увеличении концентраций изо-α-кислот в ферментируемом мелассном сусле.
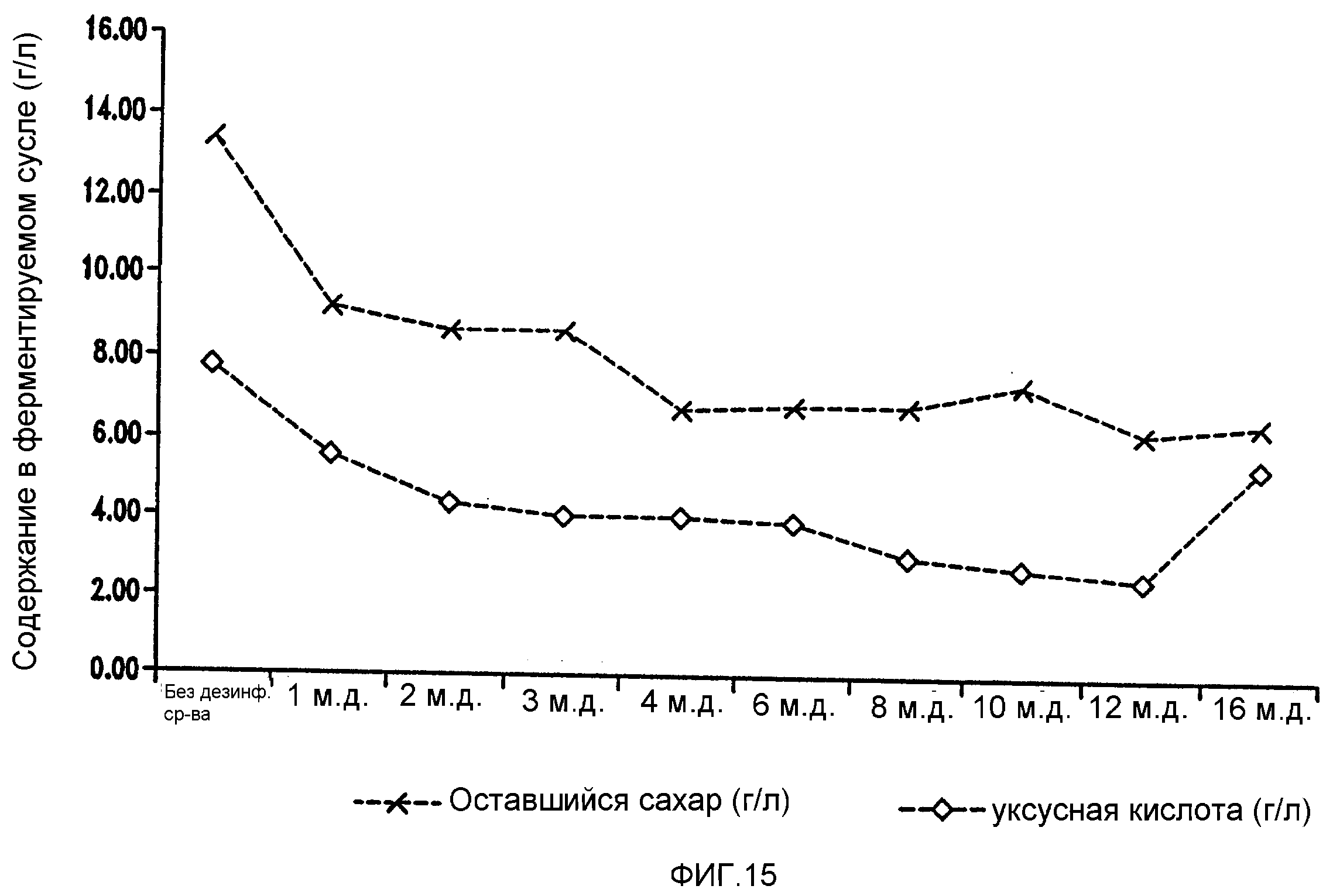
Фигура 15 показывает синхронизированное уменьшение бактериальных метаболитов, продуцируемых Lb. brevis, и оставшегося сахара при увеличении концентраций тетрагидроизо-α-кислот в ферментируемом мелассном сусле.
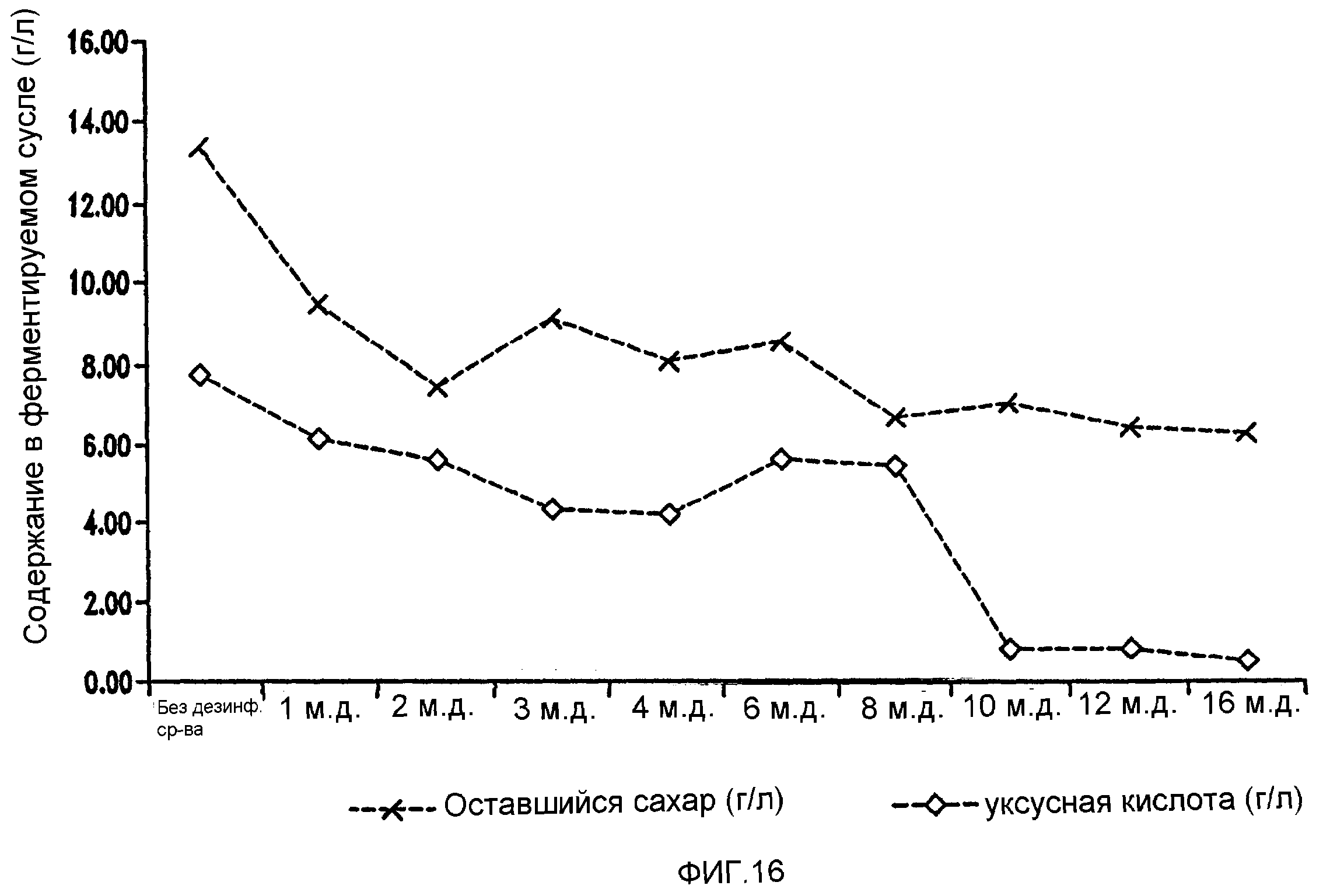
Фигура 16 показывает синхронизированное уменьшение бактериальных метаболитов, продуцируемых Lb. brevis, и оставшегося сахара при увеличении концентраций гексагидроизо-α-кислот в ферментируемом мелассном сусле.
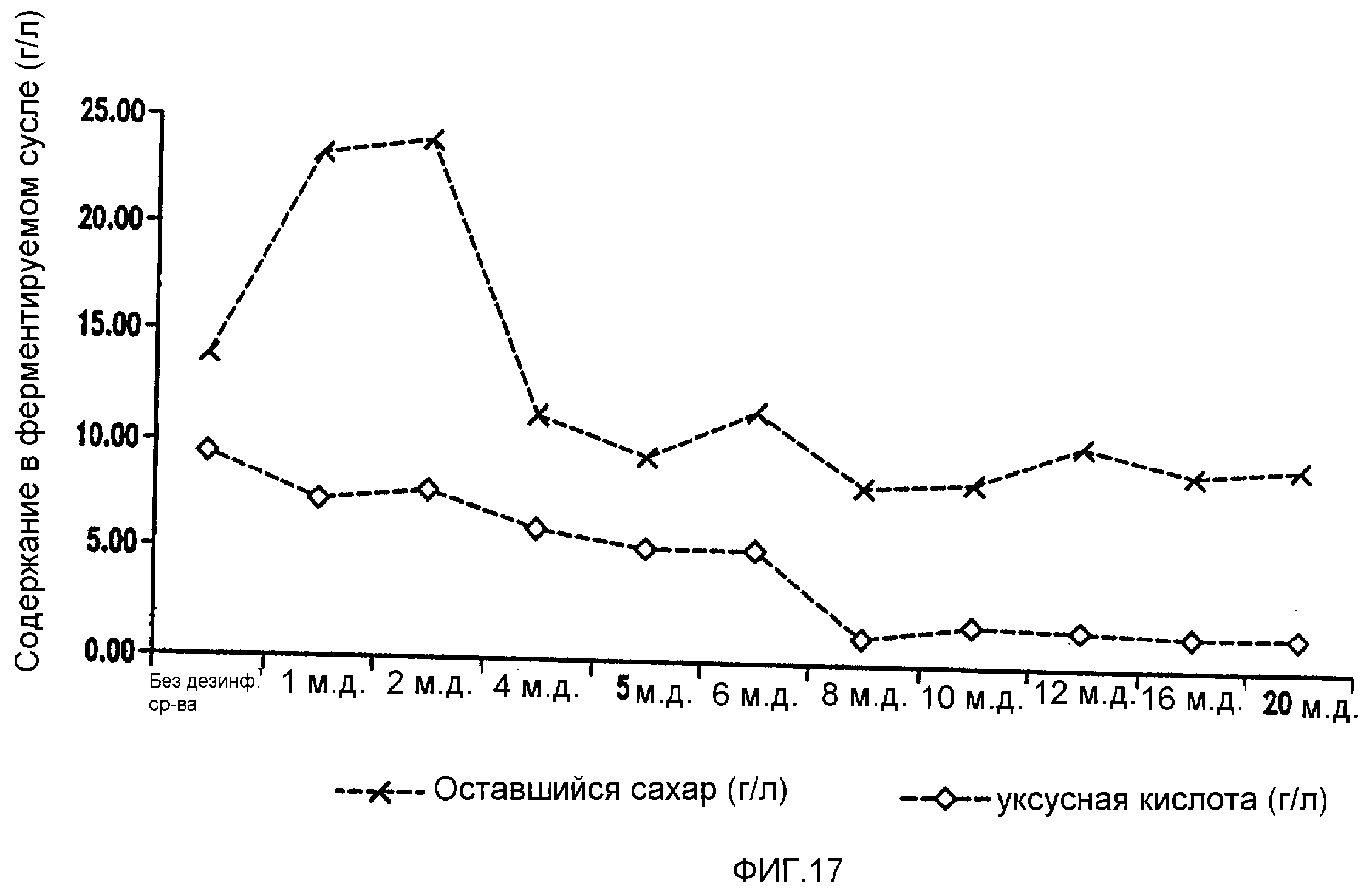
Фигура 17 показывает синхронизированное уменьшение бактериальных метаболитов, продуцируемых Lb. fermentum, и оставшегося сахара при увеличении концентраций гексагидроизо-α-кислот в ферментируемом мелассном сусле.
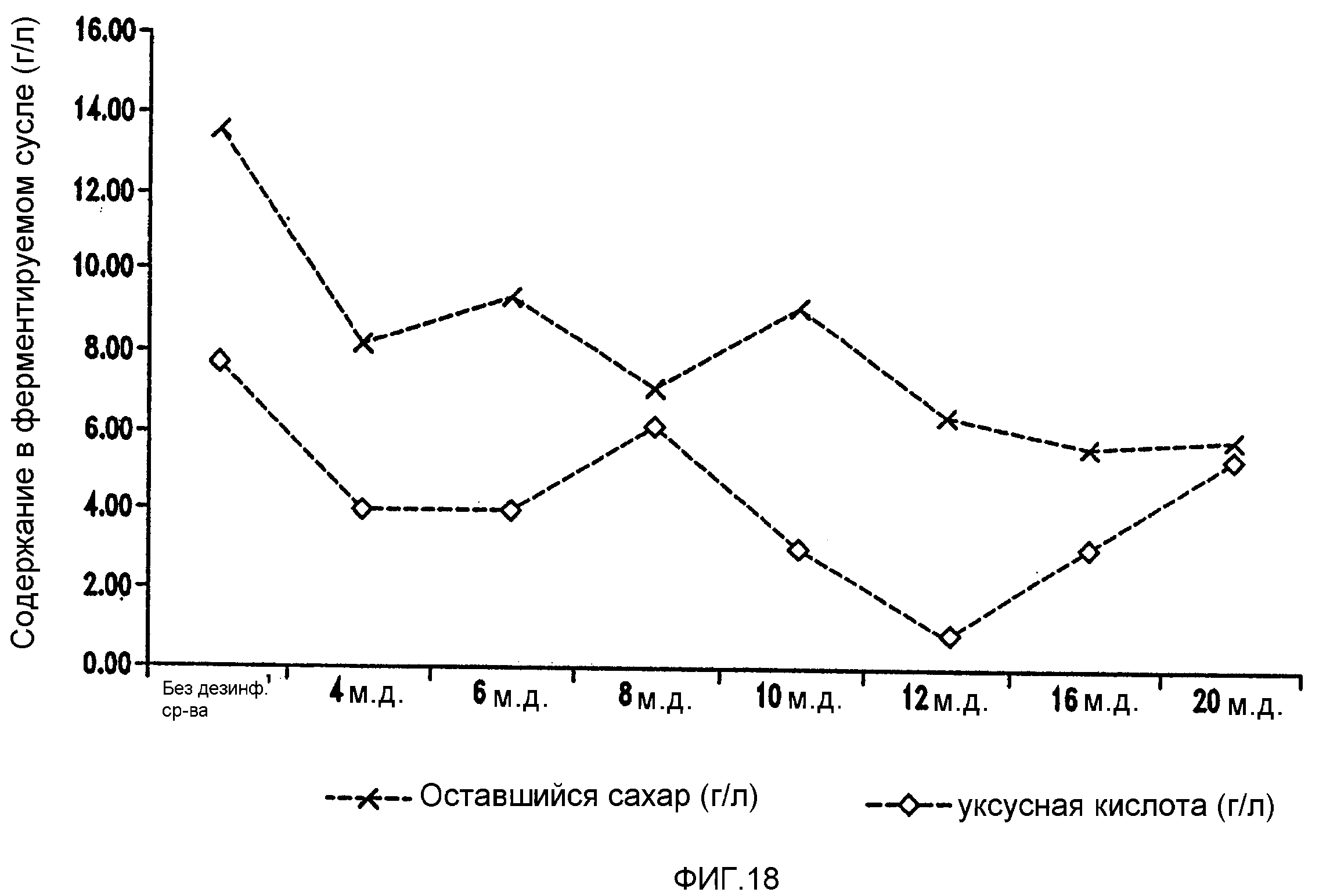
Фигура 18 показывает синхронизированное уменьшение бактериальных метаболитов, продуцируемых Lb. brevis, и оставшегося сахара при увеличении концентраций изо-α-кислот в ферментируемом мелассном сусле.
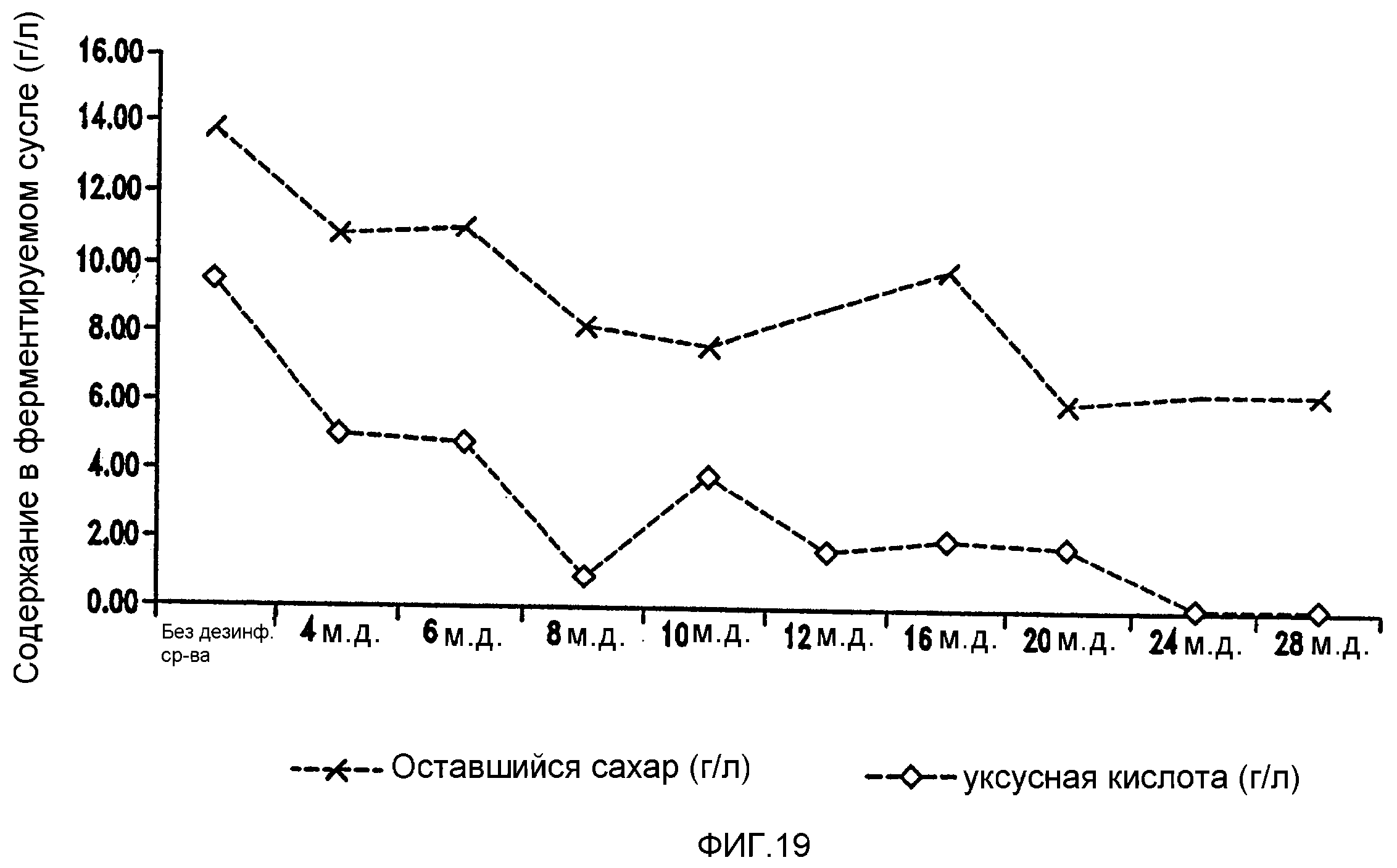
Фигура 19 показывает синхронизированное уменьшение бактериальных метаболитов, продуцируемых Lb. fermentum, и оставшегося сахара при увеличении концентраций изо-α-кислот в ферментируемом мелассном сусле.
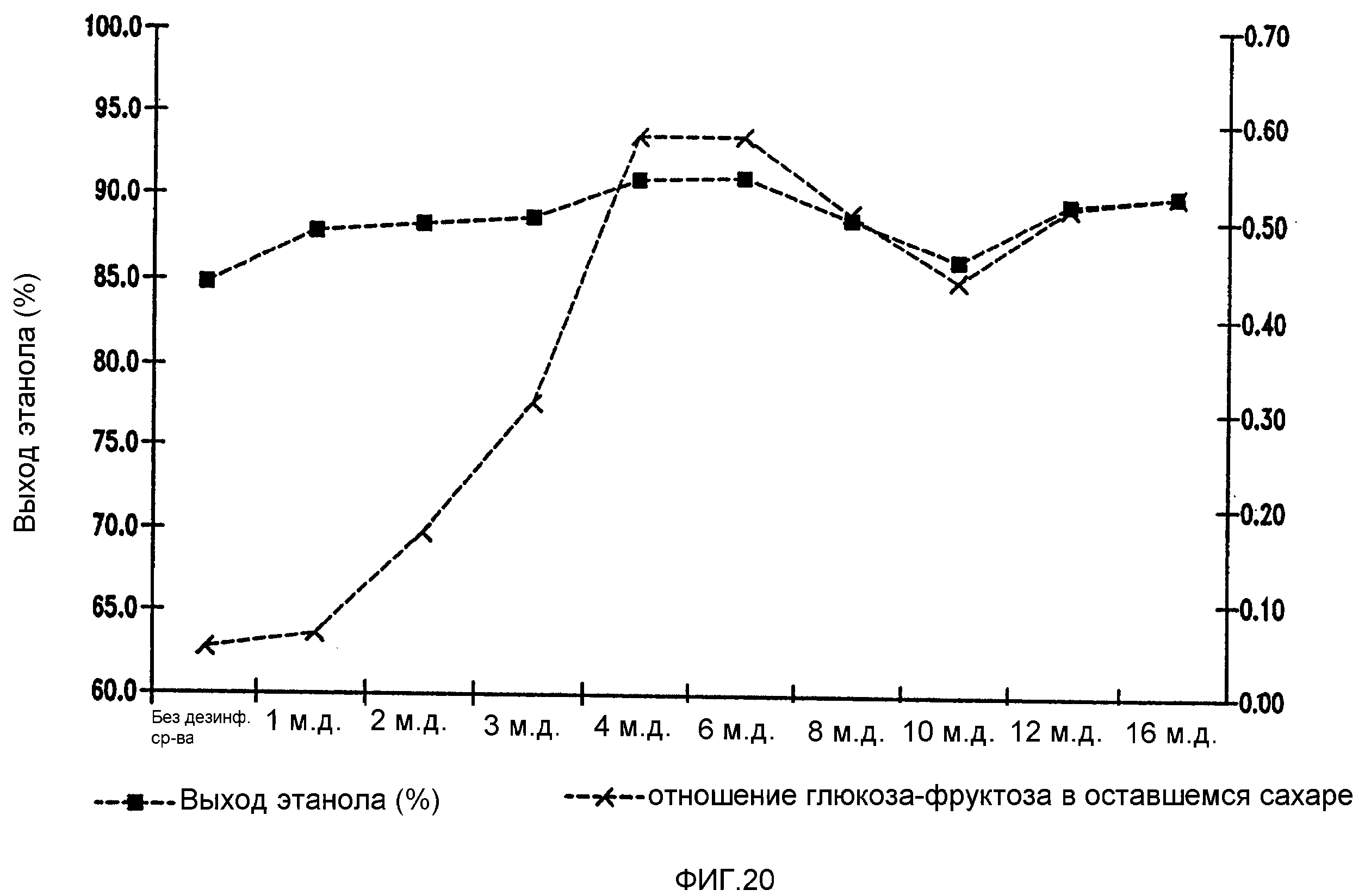
Фигура 20 показывает динамику отношения глюкоза-фруктоза в оставшемся сахаре и выхода этанола при увеличении концентраций тетрагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,7 4 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. brevis. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
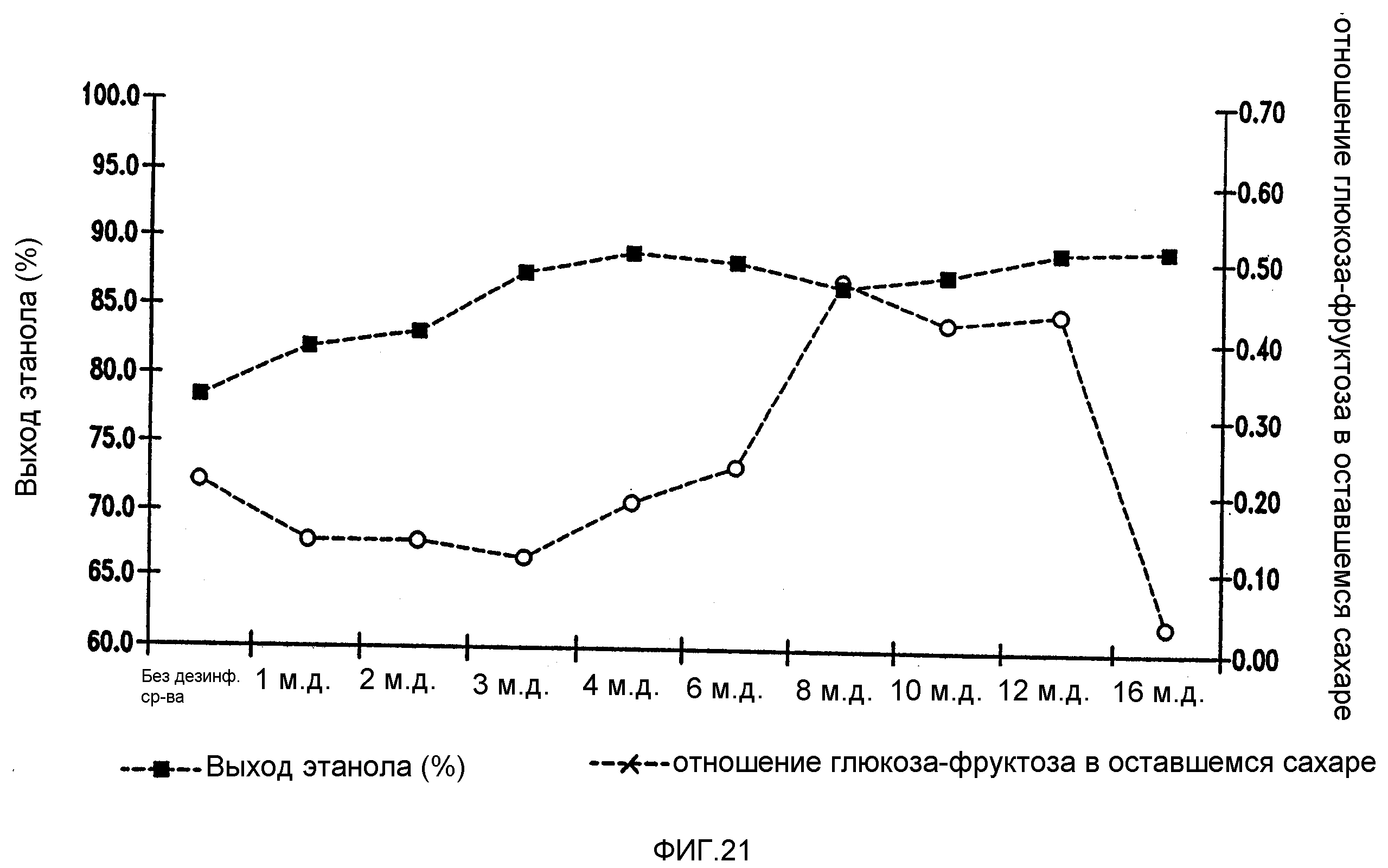
Фигура 21 показывает динамику отношения глюкоза-фруктоза в оставшемся сахаре и выхода этанола при увеличении концентраций тетрагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. fermentum. Ферментацию проводили при рН 5,2 и 96,8°F (36°С)в течение 72 часов.
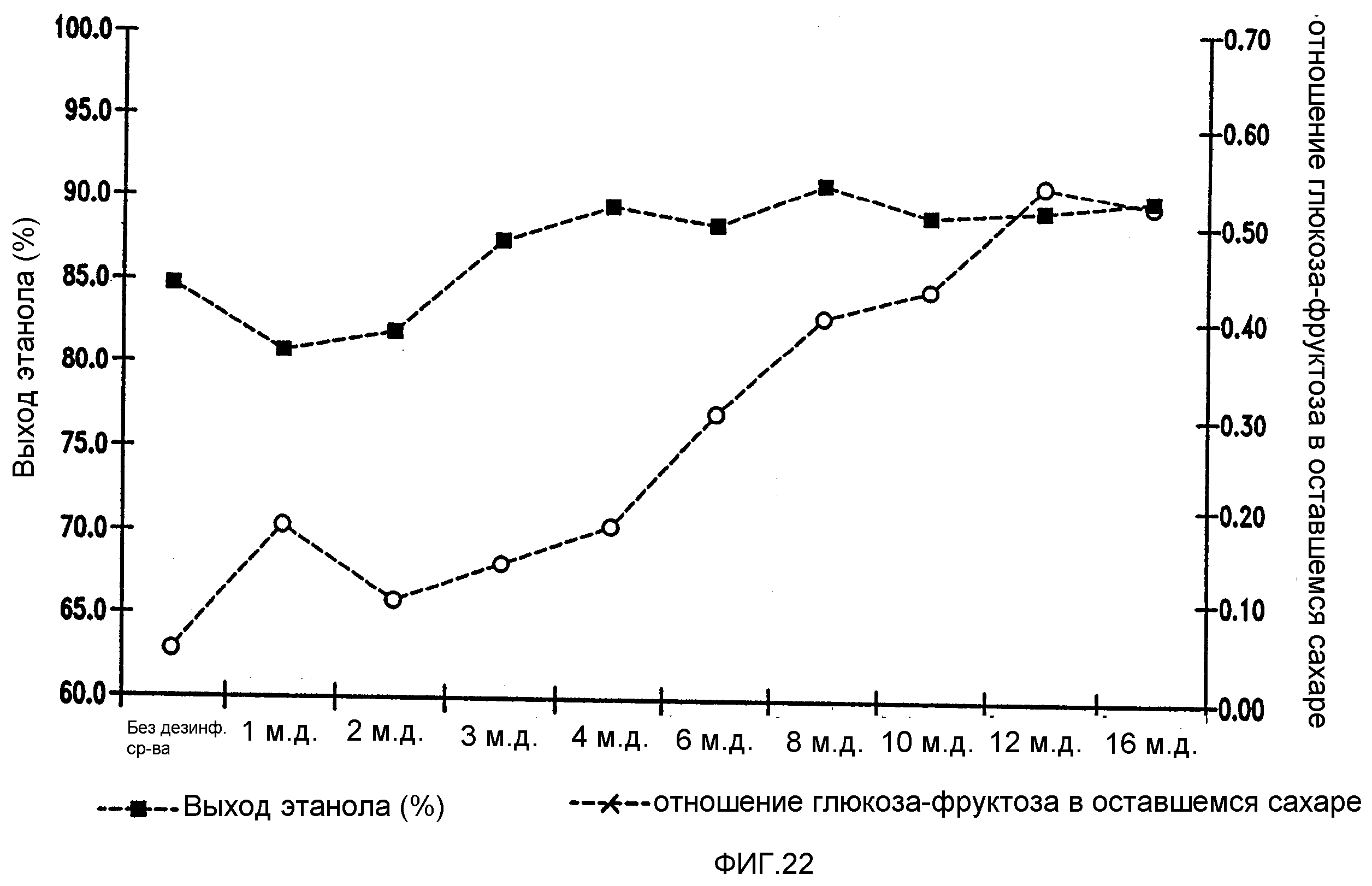
Фигура 22 показывает динамику отношения глюкоза-фруктоза в оставшемся сахаре и выхода этанола при увеличении концентраций гексагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. brevis. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
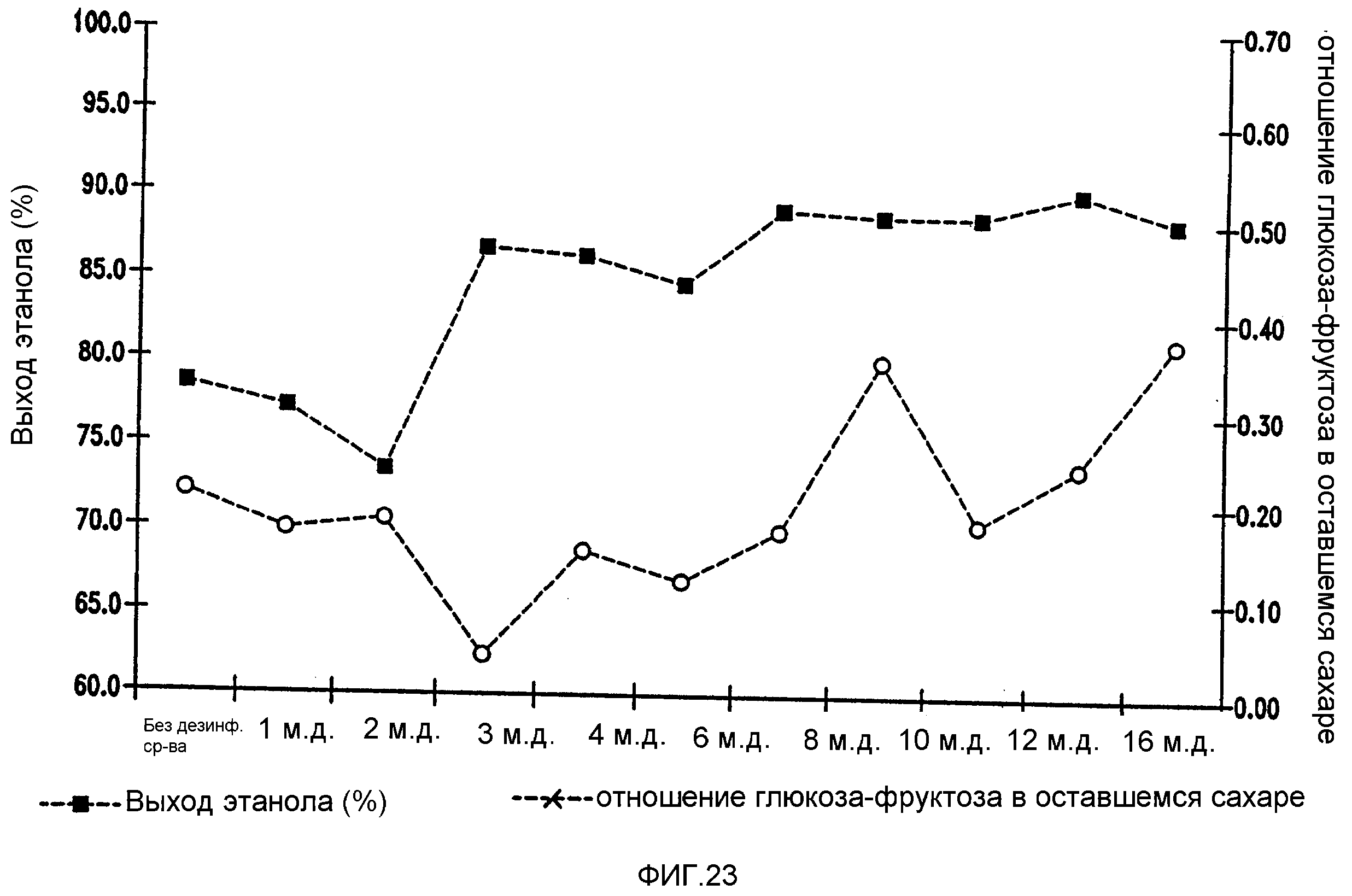
Фигура 23 показывает динамику отношения глюкоза-фруктоза в оставшемся сахаре и выхода этанола при увеличении концентраций гексагидроизо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. fermentum. Ферментацию проводили при рН 5,2 и 96,8°F (36°С)в течение 72 часов.
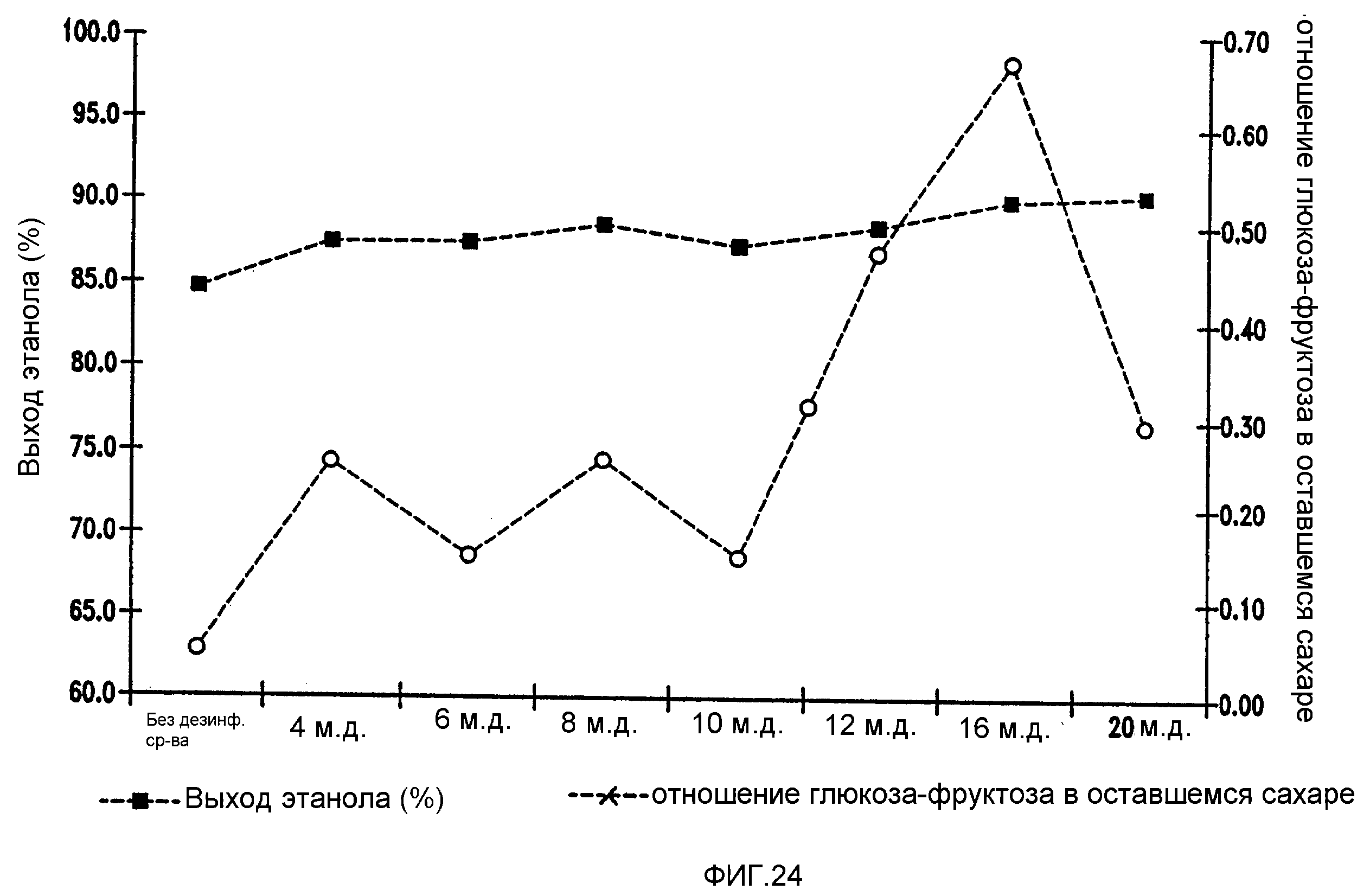
Фигура 24 показывает динамику отношения глюкоза-фруктоза в оставшемся сахаре и выхода этанола при увеличении концентраций изо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. brevis. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
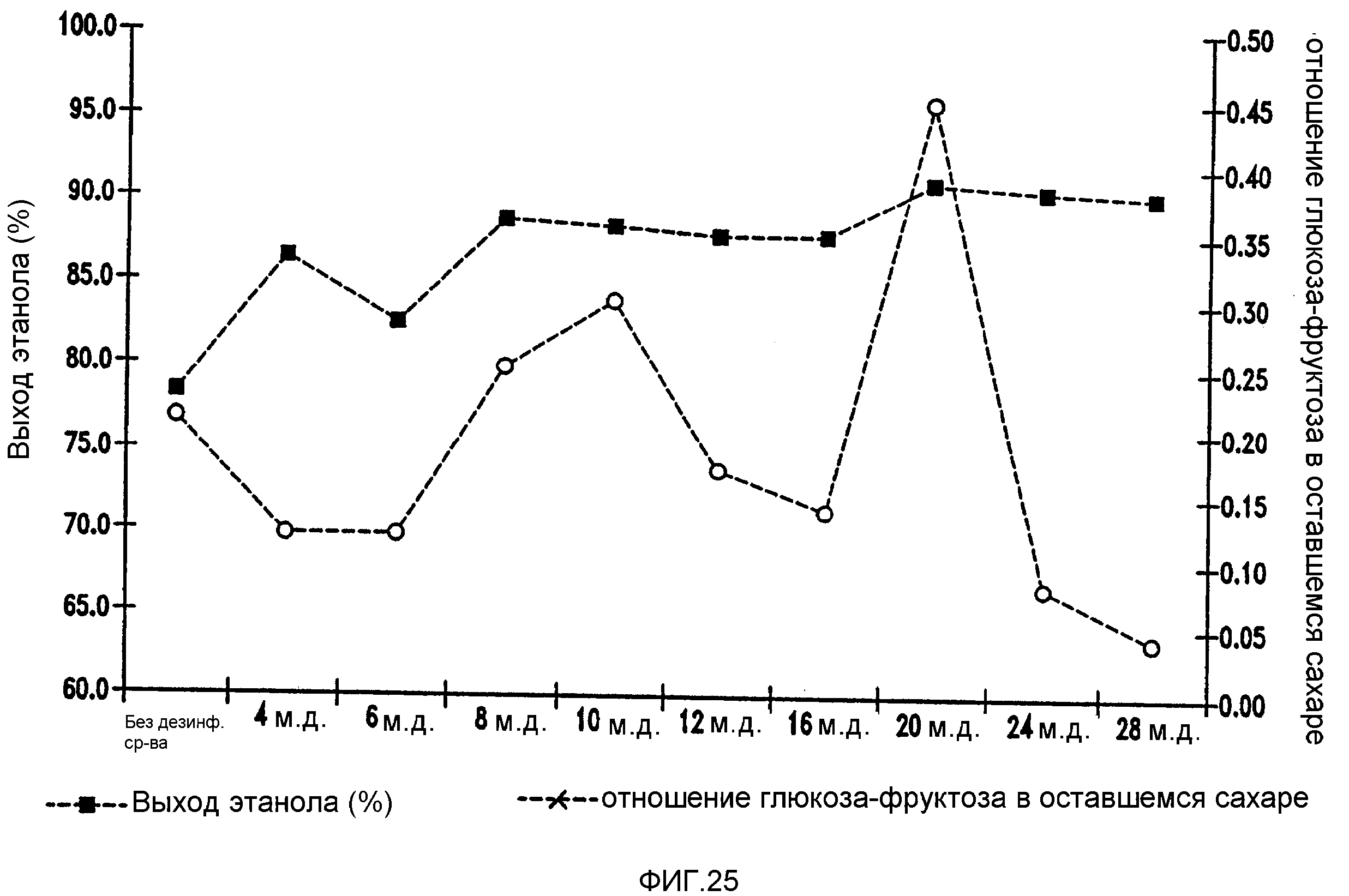
Фигура 25 показывает динамику отношения глюкоза-фруктоза в оставшемся сахаре и выхода этанола при увеличении концентраций изо-α-кислот в мелассном сусле. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. fermentum. Ферментацию проводили при рН 5,2 и 96,8°F (36°С) в течение 72 часов.
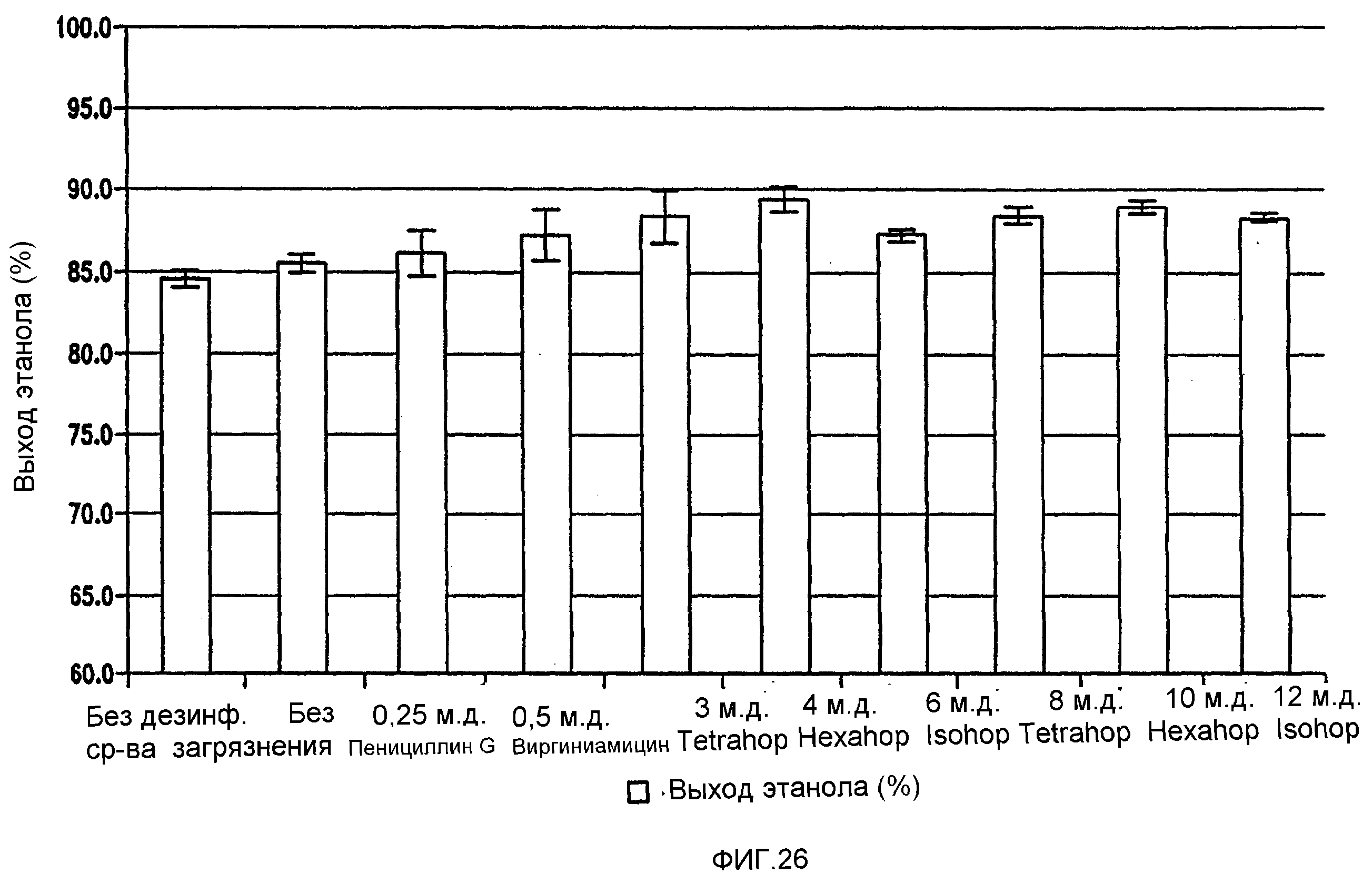
Фигура 26 показывает сравнение выхода этанола. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. brevis. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
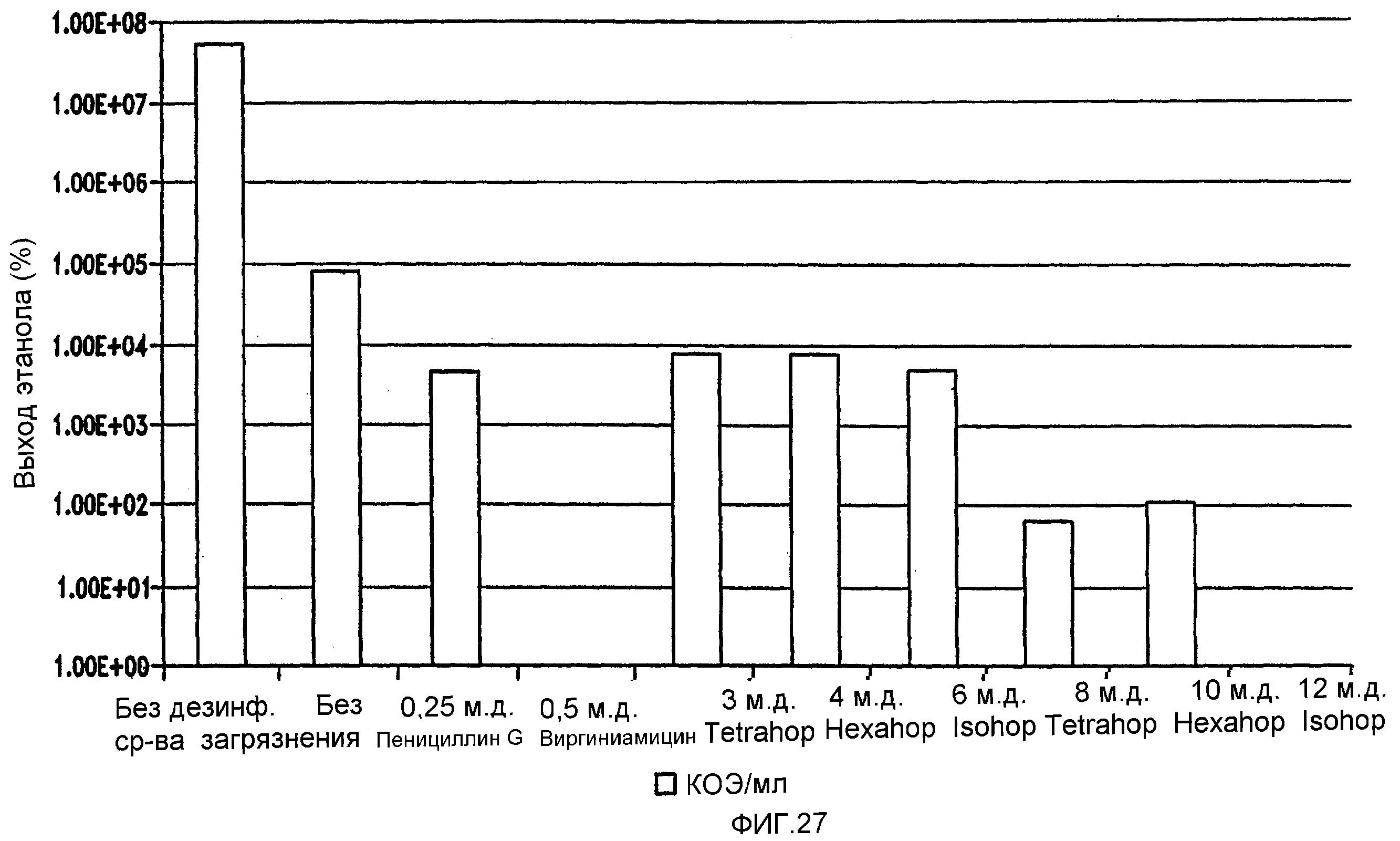
Фигура 27 показывает сравнение эффективности в ингибировании Lb. brevis. Количество жизнеспособных клеток с использованием быстрого способа посева штрихом на MRS-чашках анаэробно инкубировали при 86°F (30°С) в течение 48 часов.
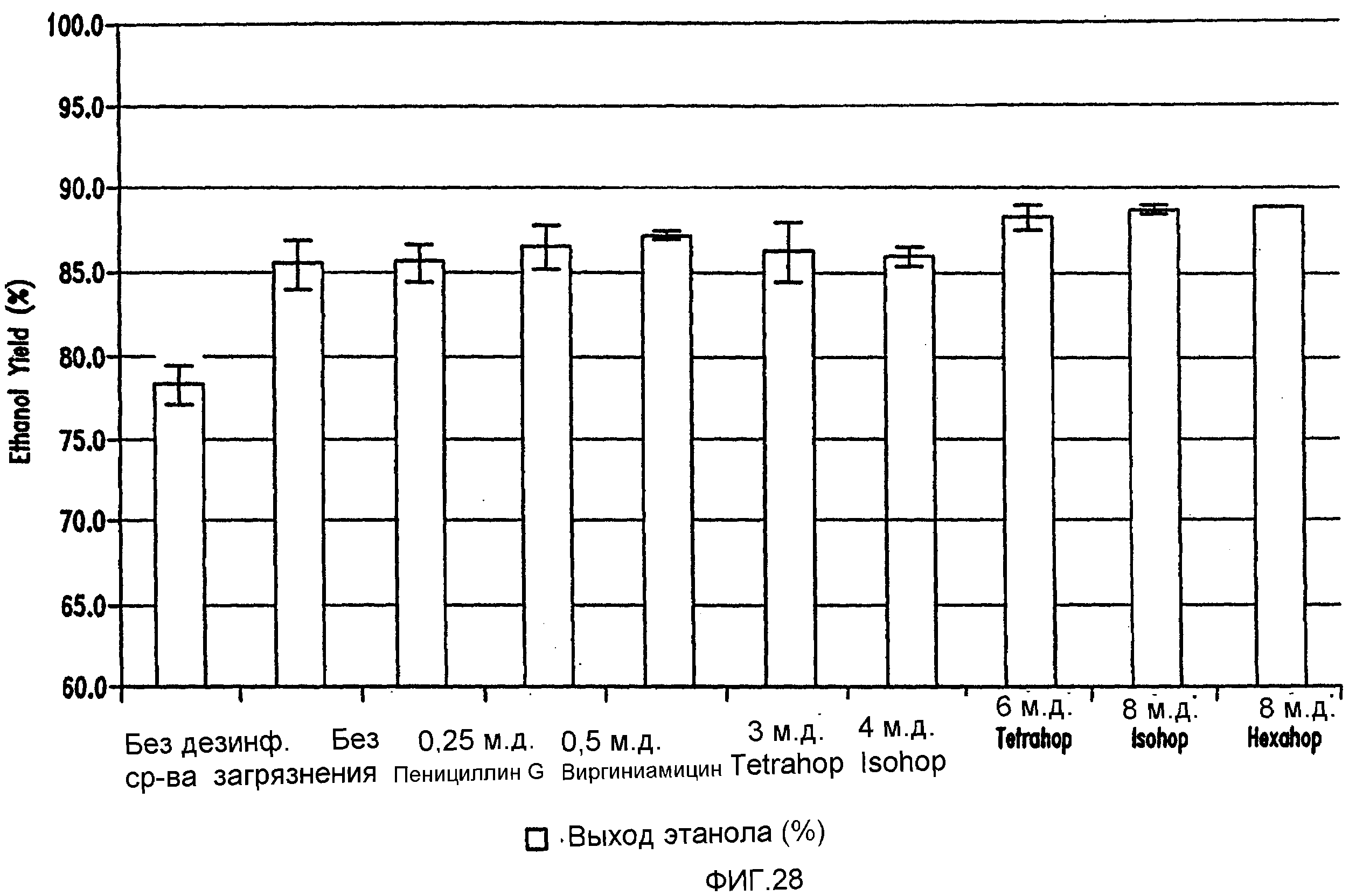
Фигура 28 показывает сравнение выхода этанола. Мелассное сусло, содержащее 129,74 г/л сахарозы, загрязняли исходными количествами бактериальных клеток 106/мл Lb. fermentum. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
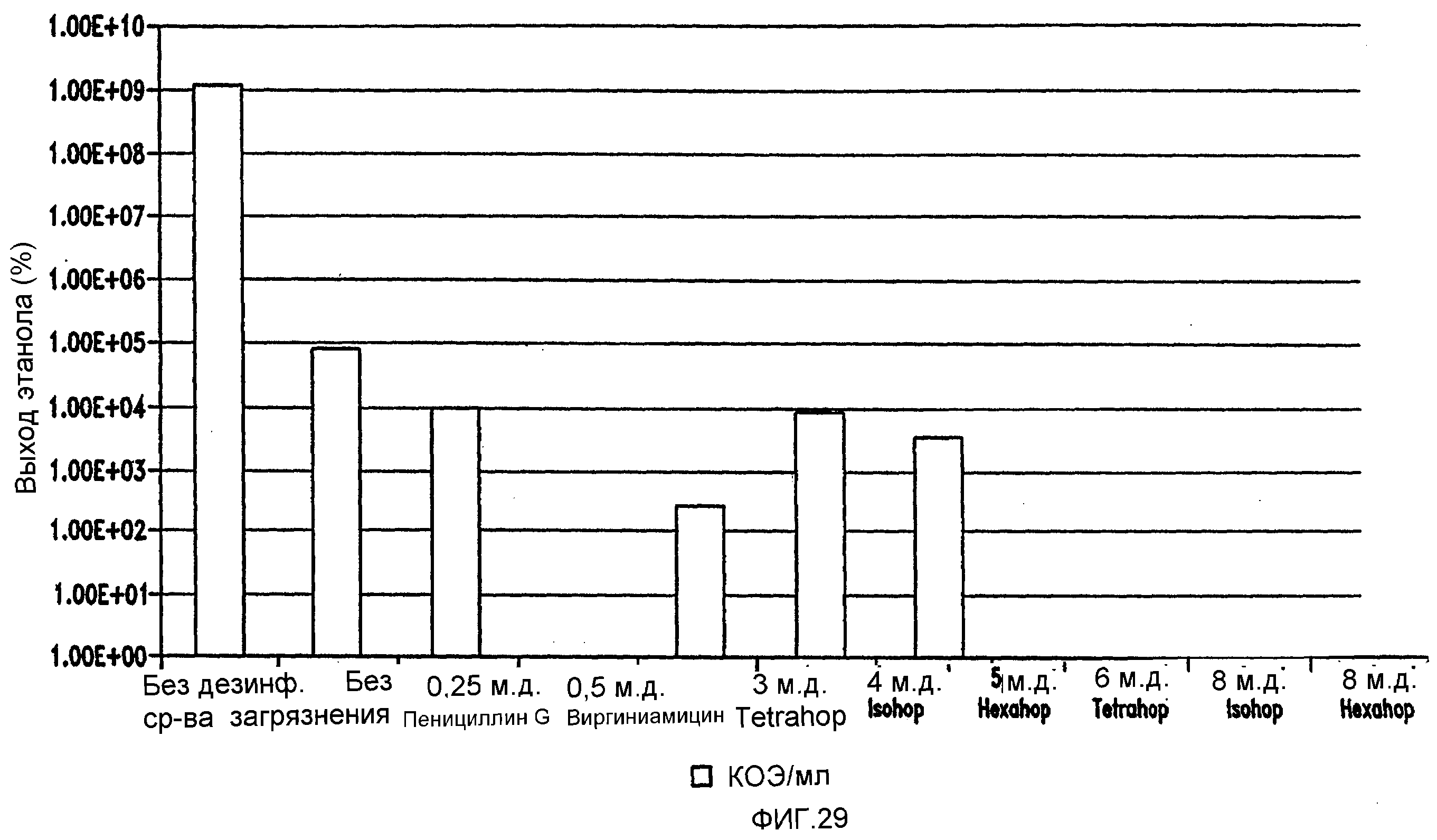
Фигура 29 показывает сравнение эффективности в ингибировании Lb. fermentum. Количество жизнеспособных клеток с использованием быстрого способа посева штрихом на MRS-чашках анаэробно инкубировали при 96,8°F (36°С) в течение 48 часов.
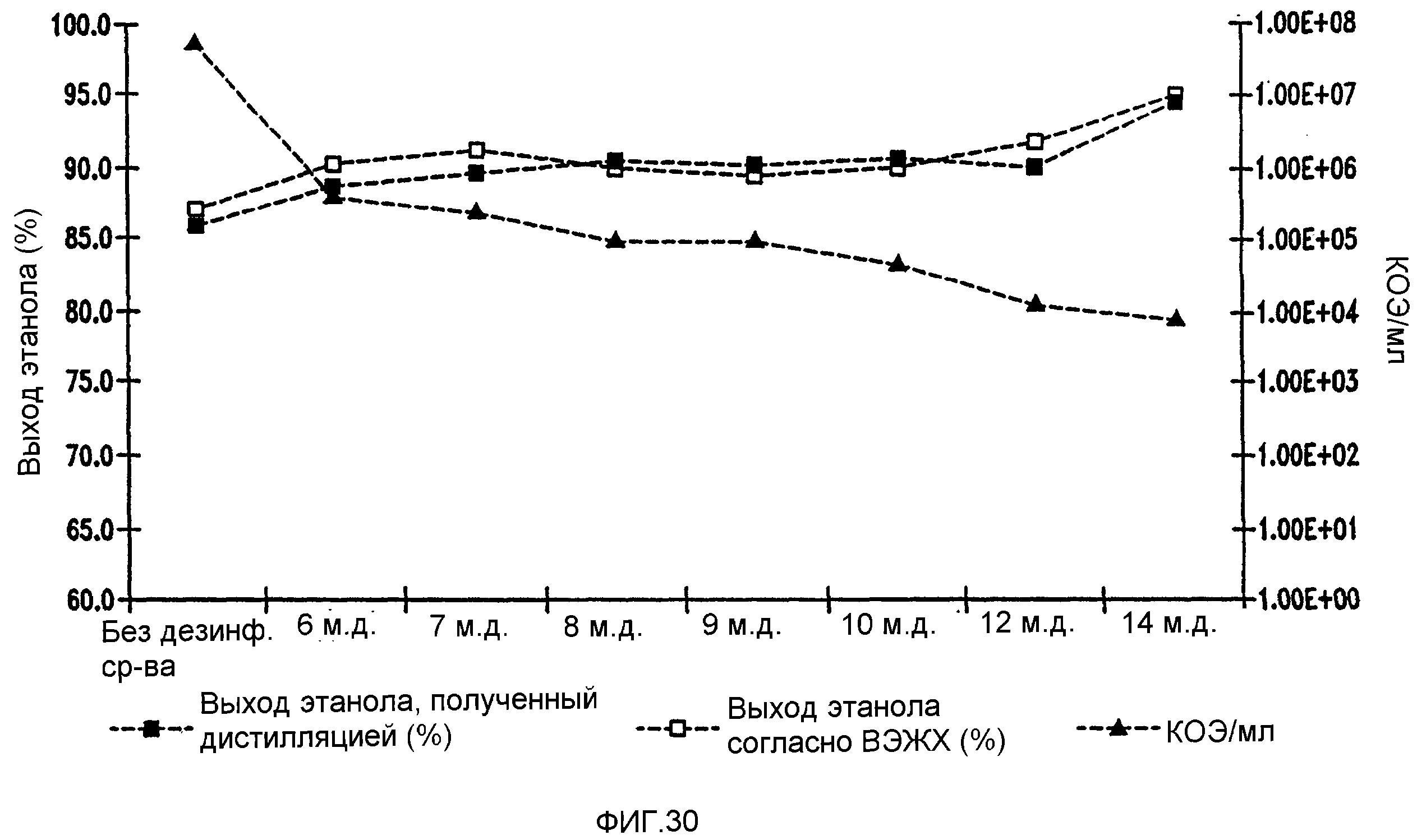
Фигура 30 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций тетрагидроизо-α-кислот в пшеничном заторе. Пшеничный затор, содержащий 59,96% ферментируемого вещества, загрязняли исходными количествами бактериальных клеток 107/мл. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
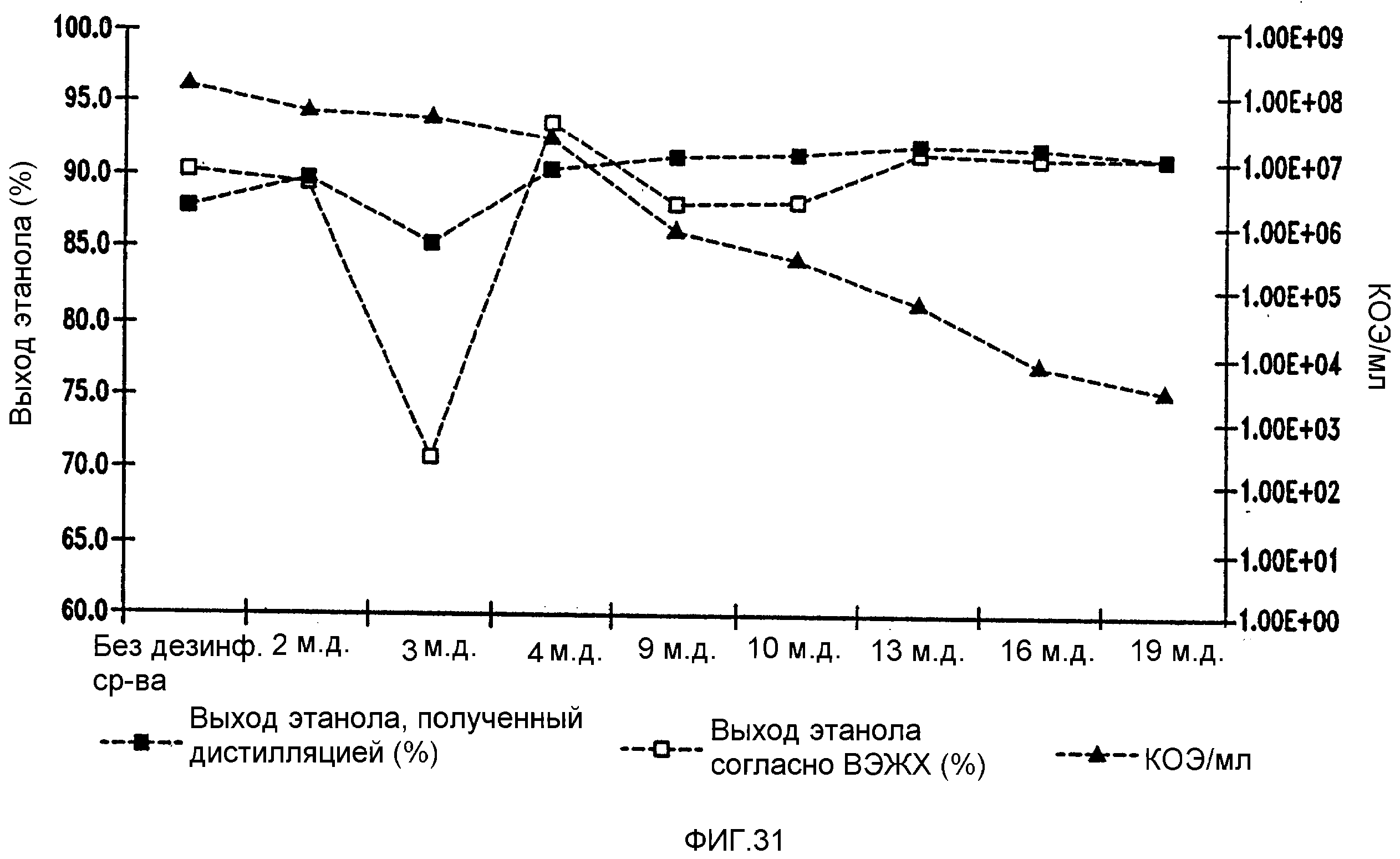
Фигура 31 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций тетрагидроизо-α-кислот в пшеничном заторе. Пшеничный затор, содержащий 59,96% ферментируемого вещества, загрязняли исходными количествами бактериальных клеток 107/мл. Ферментацию проводили при рН 5,2 и 96,8°F (36°С) в течение 72 часов.
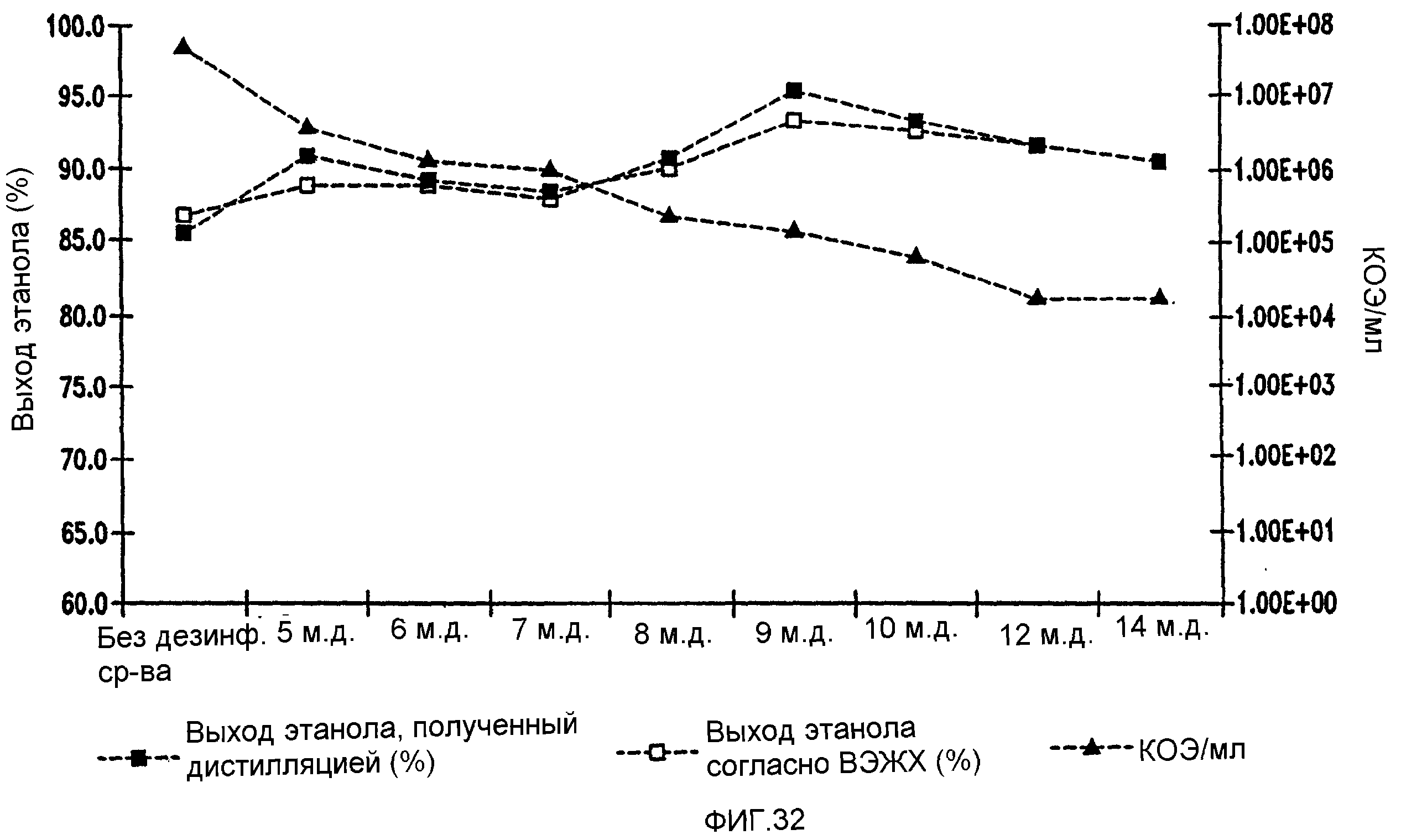
Фигура 32 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций гексагидроизо-α-кислот в пшеничном заторе. Пшеничный затор, содержащий 59,96% ферментируемого вещества, загрязняли исходными количествами бактериальных клеток 107/мл. Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
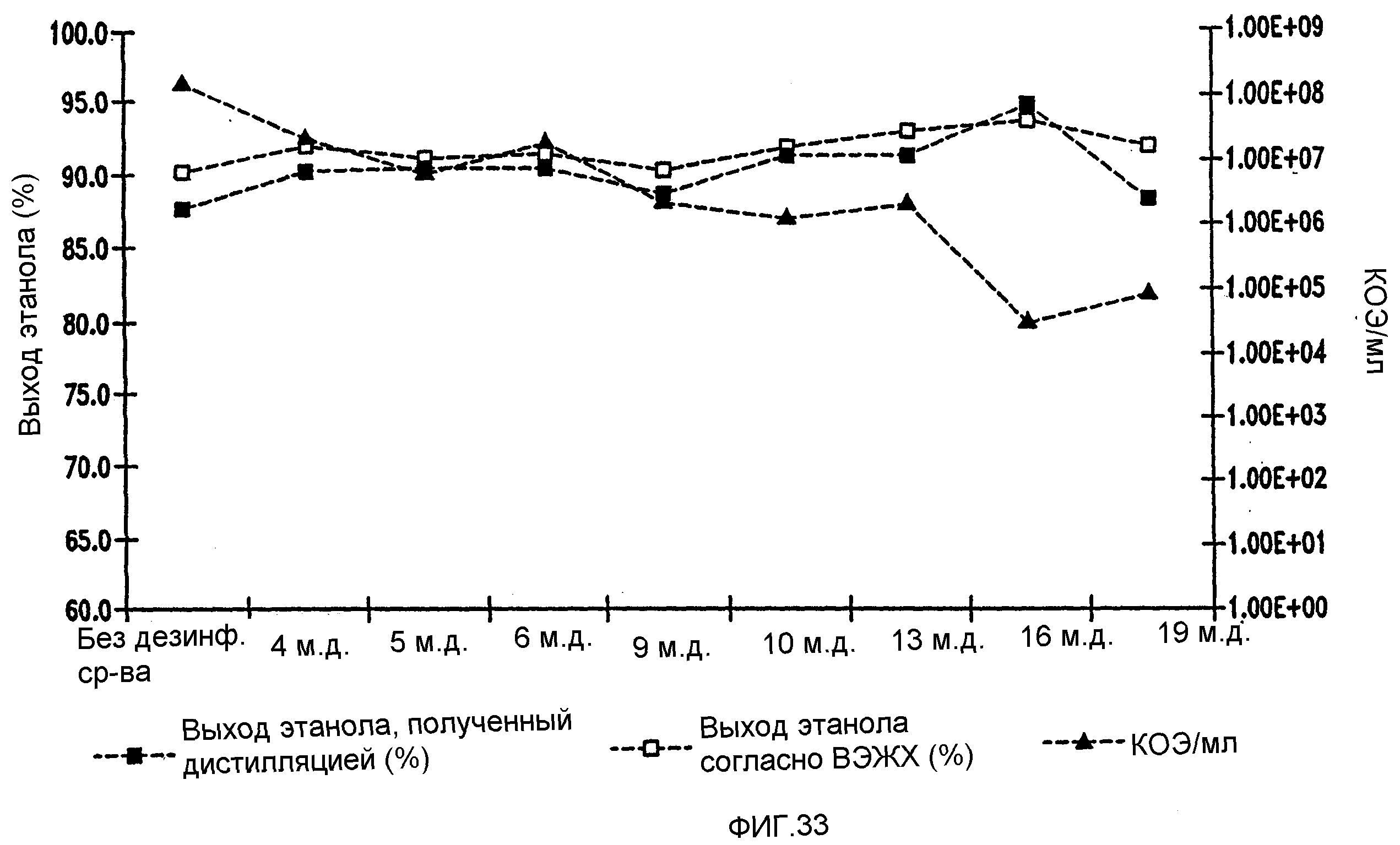
Фигура 33 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций гексагидроизо-α-кислот в пшеничном заторе. Пшеничный затор, содержащий 59,96% ферментируемого вещества, загрязняли исходными количествами бактериальных клеток 107/мл. Ферментацию проводили при рН 5,2 и 96,8°F в течение 72 часов.
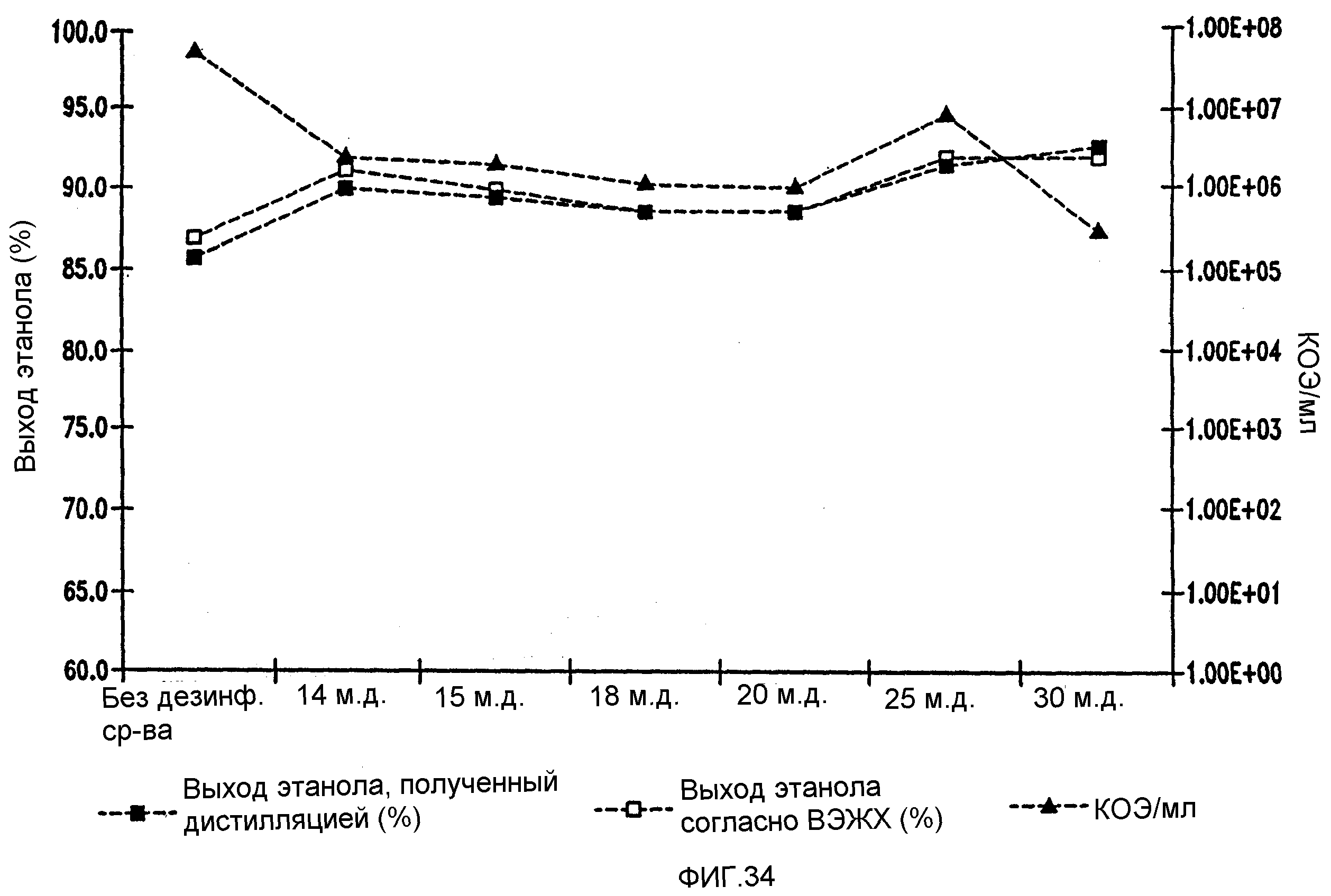
Фигура 34 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций изо-α-кислот в пшеничном заторе. Пшеничный затор, содержащий 59,96% ферментируемого вещества, загрязняли исходными количествами бактериальных клеток 107/мл. Ферментацию проводили при рН 5,2 и 86°F в течение 96 часов.
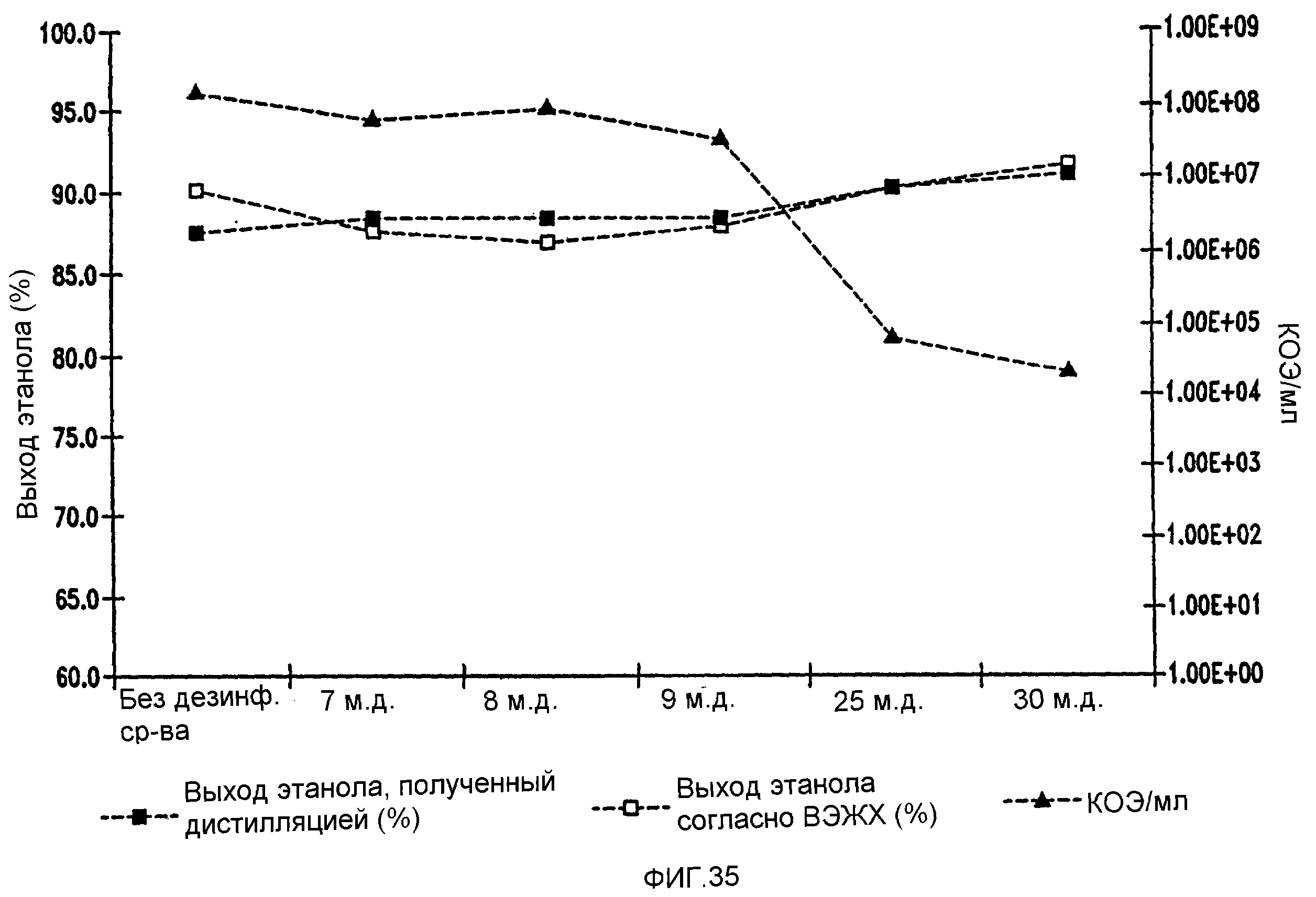
Фигура 35 показывает динамику выхода этанола при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций изо-α-кислот в пшеничном заторе. Пшеничный затор, содержащий 59,96% ферментируемого вещества, загрязняли исходными количествами бактериальных клеток 107/мл. Ферментацию проводили при рН 5,2 и 96,8°F в течение 72 часов.
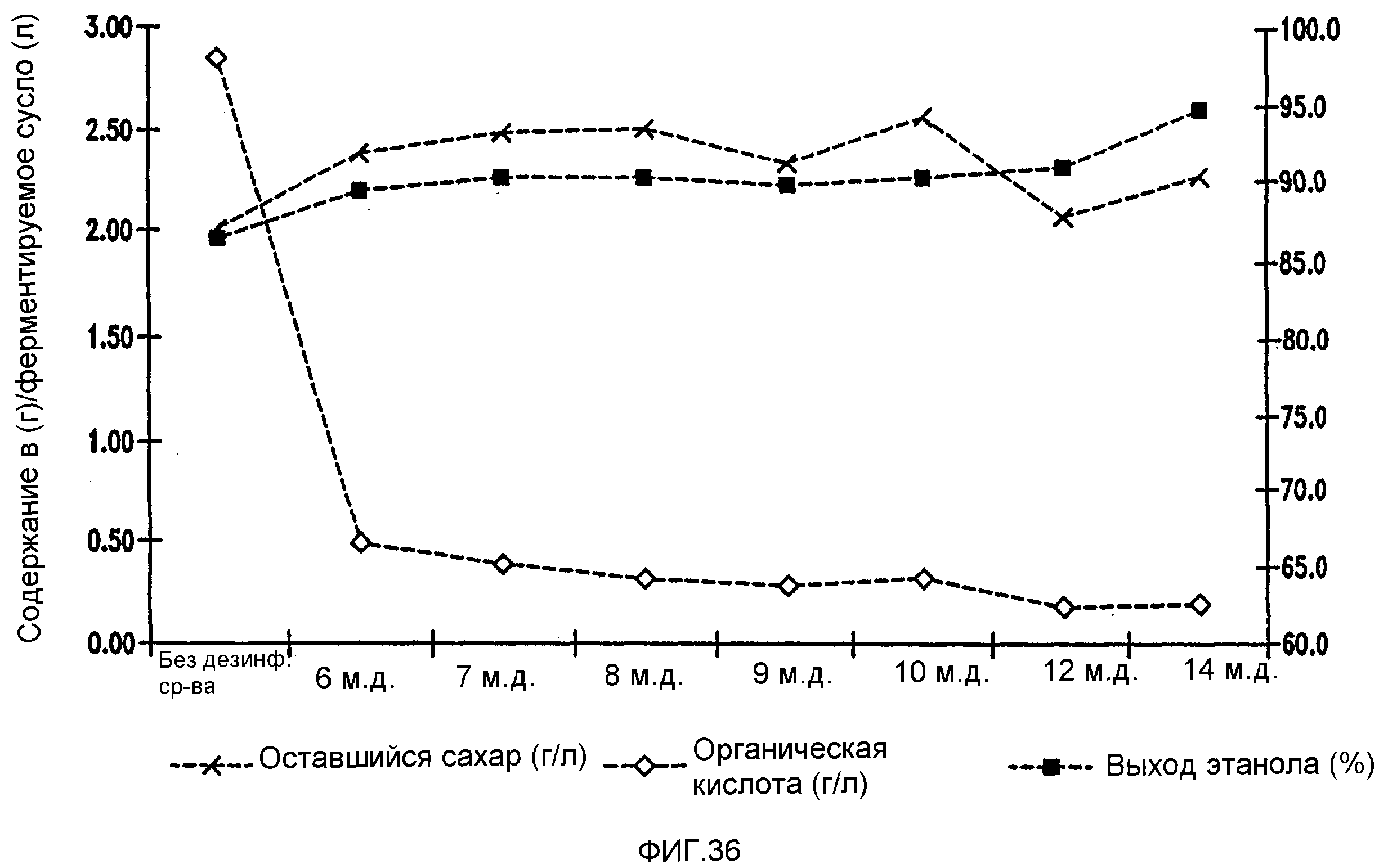
Фигура 36 показывает динамику выхода этанола, содержания оставшегося сахара и бактериальных метаболитов при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций тетрагидроизо-α-кислот в пшеничном заторе.
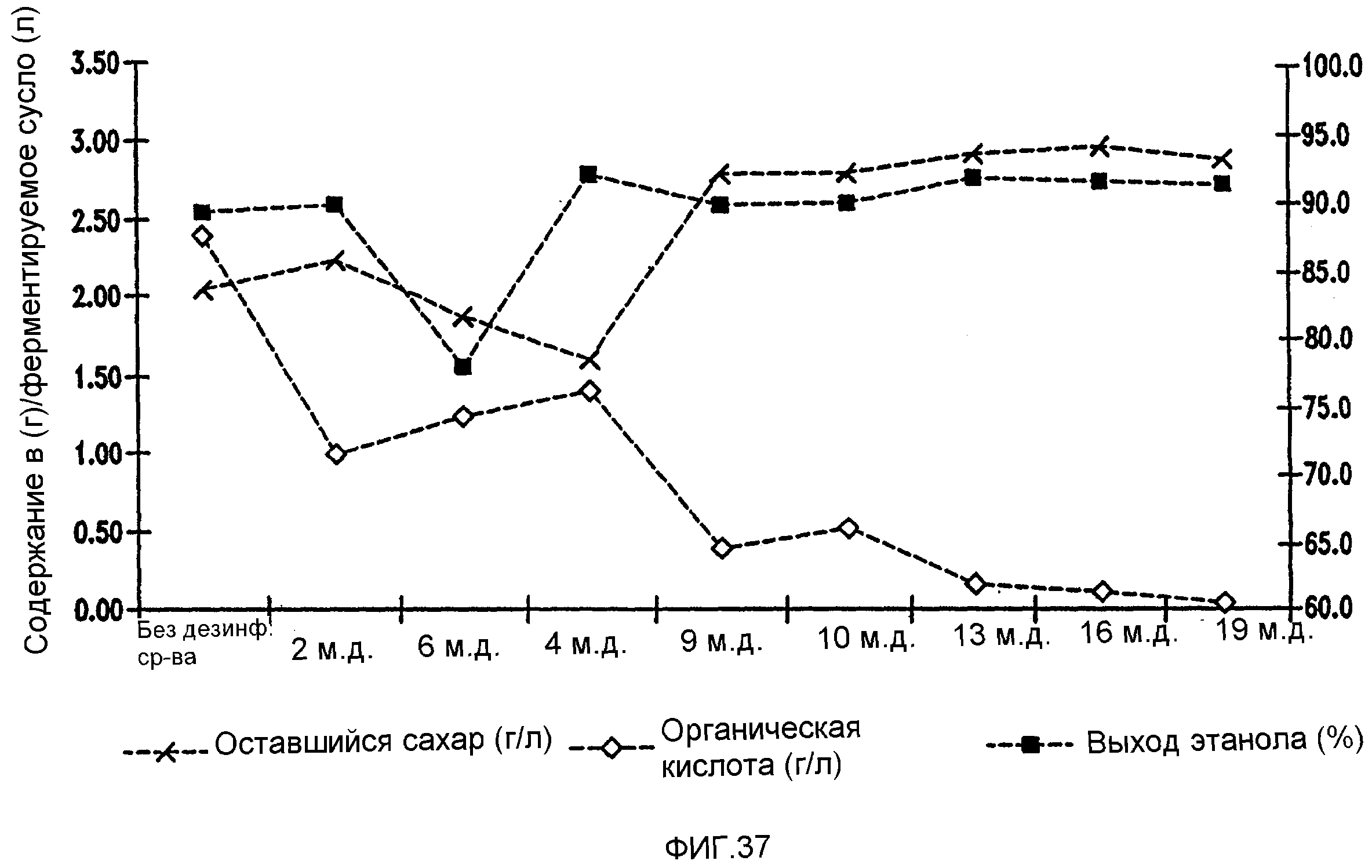
Фигура 37 показывает динамику выхода этанола, содержания оставшегося сахара и бактериальных метаболитов при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций тетрагидроизо-α-кислот в пшеничном заторе.
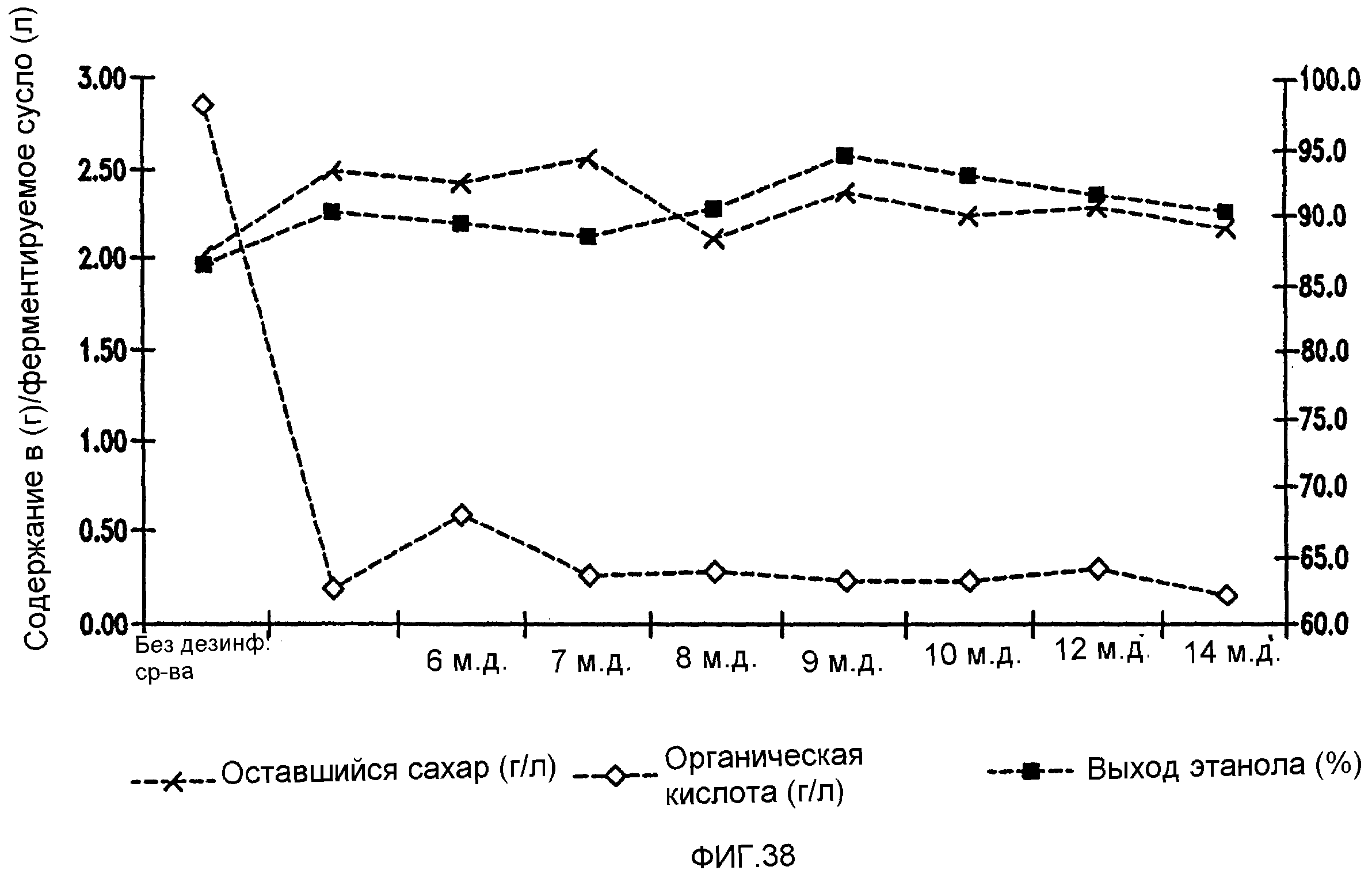
Фигура 38 показывает динамику выхода этанола, содержания оставшегося сахара и бактериальных метаболитов при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций гексагидроизо-α-кислот в пшеничном заторе.
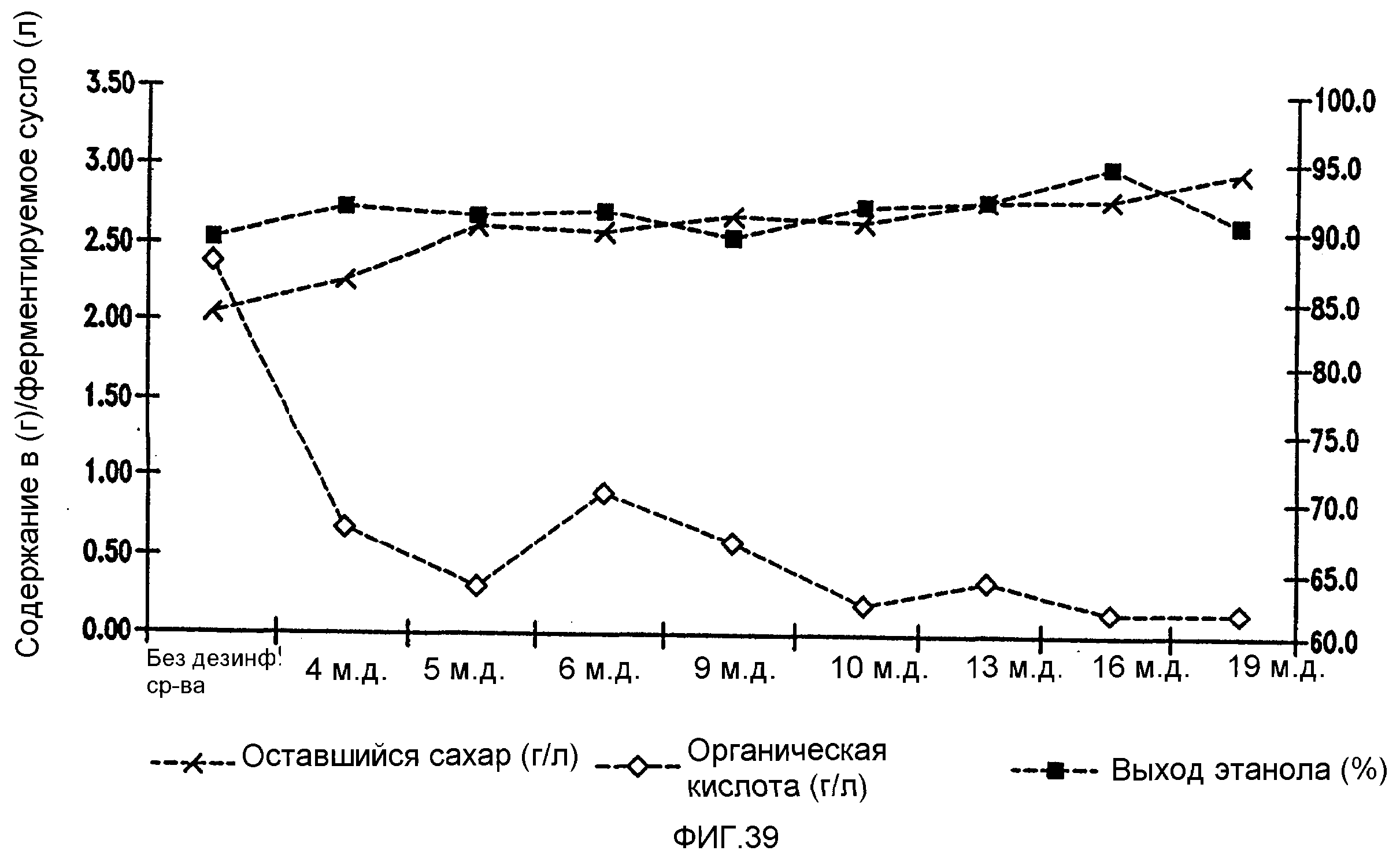
Фигура 39 показывает динамику выхода этанола, содержания оставшегося сахара и бактериальных метаболитов при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций гексагидроизо-α-кислот в пшеничном заторе.
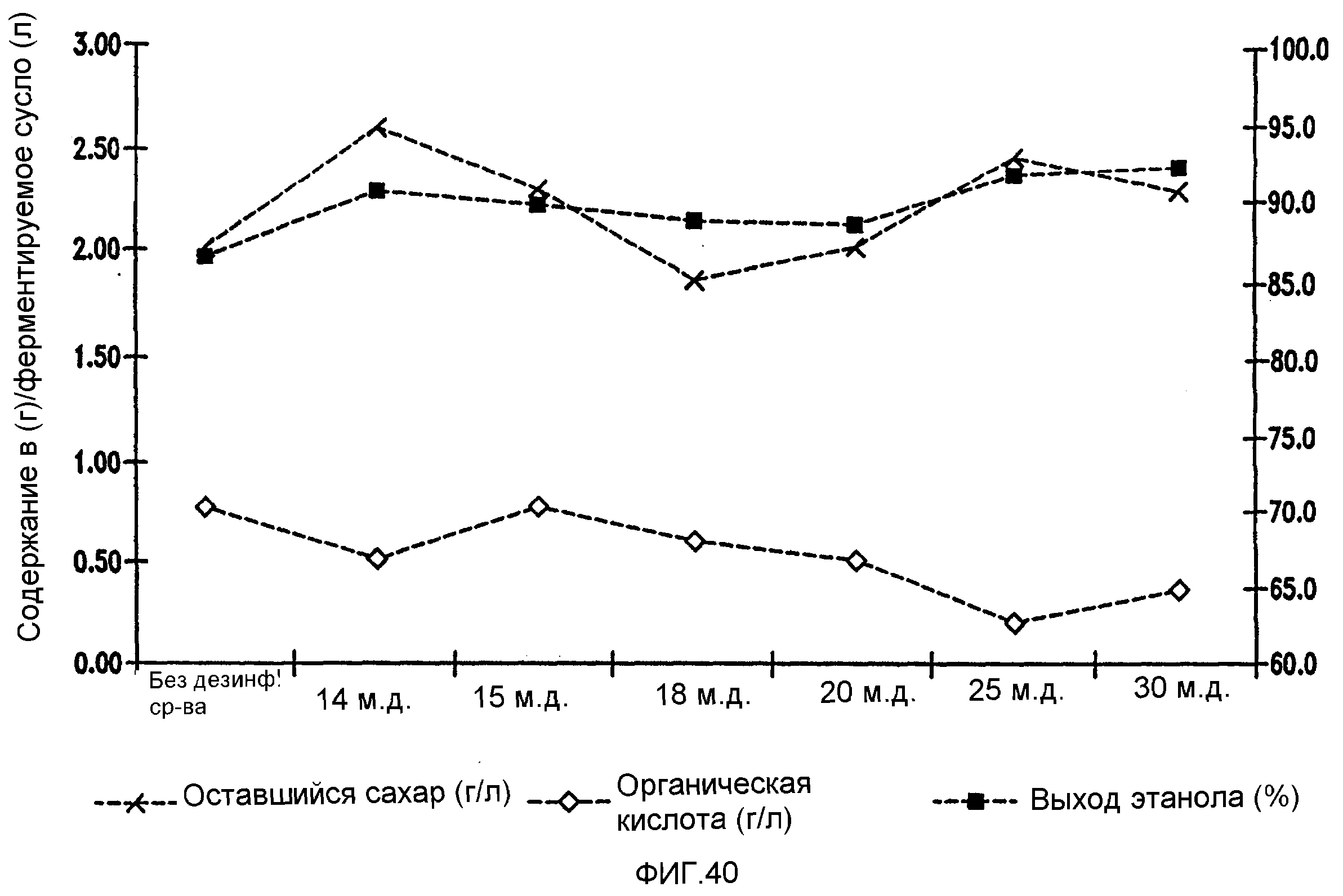
Фигура 40 показывает развитие выхода этанола, содержания оставшегося сахара и бактериальных метаболитов при уменьшении количеств жизнеспособных клеток Lb. brevis, коррелированном с увеличением концентраций изо-α-кислот в пшеничном заторе.
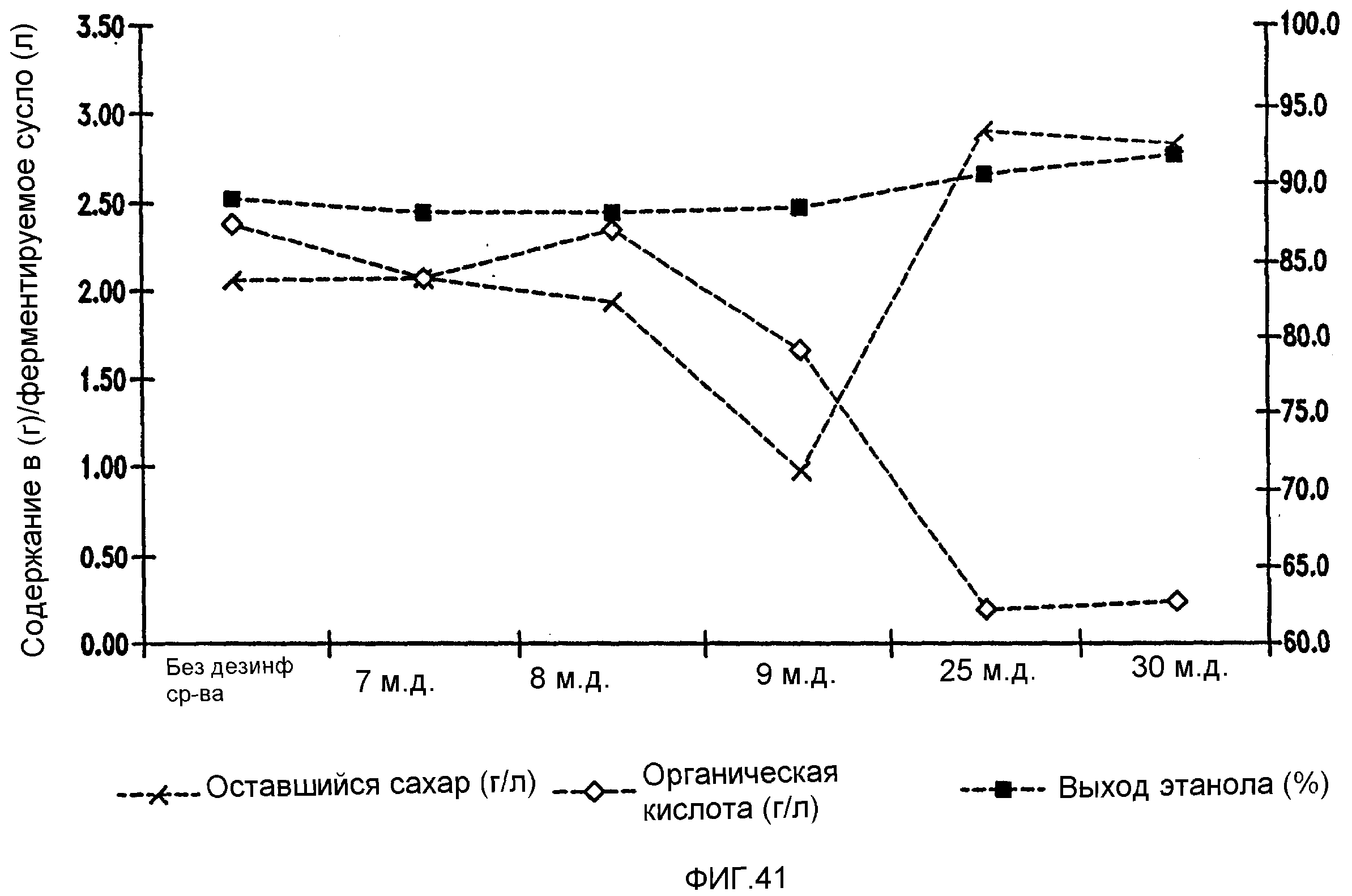
Фигура 41 показывает динамику выхода этанола, содержания оставшегося сахара и бактериальных метаболитов при уменьшении количеств жизнеспособных клеток Lb. fermentum, коррелированном с увеличением концентраций изо-α-кислот в пшеничном заторе.
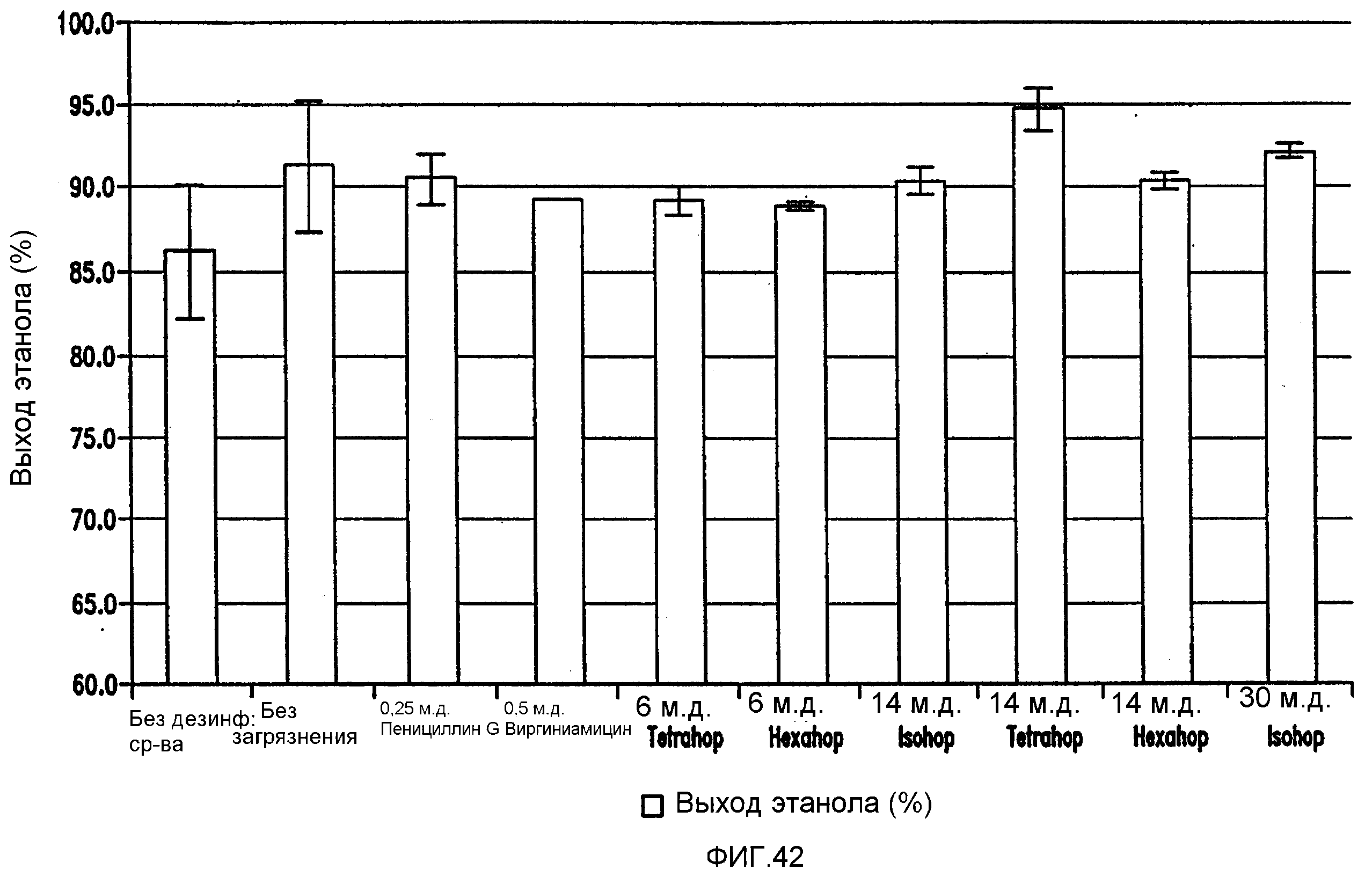
Фигура 42 показывает сравнение выхода этанола. Пшеничный затор, содержащий 59,9% ферментируемого материала, загрязняли исходными количествами бактериальных клеток 106/мл Lb. brevis.
Ферментацию проводили при рН 5,2 и 86°F (30°С) в течение 96 часов.
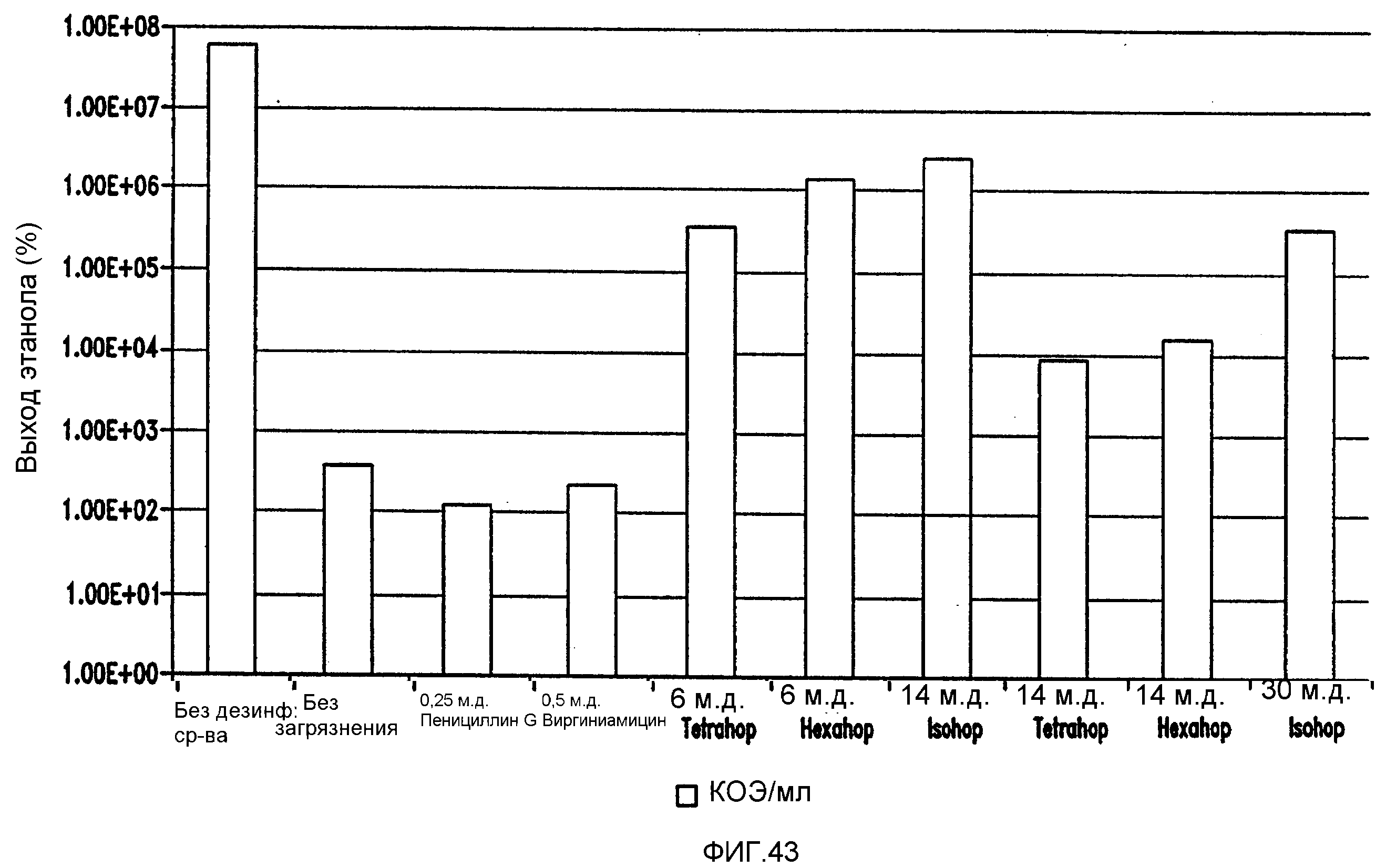
Фигура 43 показывает сравнение эффективности в ингибировании Lb. brevis в пшеничном заторе. Количество жизнеспособных клеток с использованием быстрого способа посева штрихом на MRS-чашках анаэробно инкубировали при 86°F (30°С)в течение 48 часов.
Фигура 44 показывает сравнение выхода этанола. Пшеничный затор, содержащий 59,9% ферментируемого материала, загрязняли исходными количествами бактериальных клеток 107/мл Lb. fermentum. Ферментацию проводили при рН 5,2 и 96,8°F (36°С)в течение 72 часов.
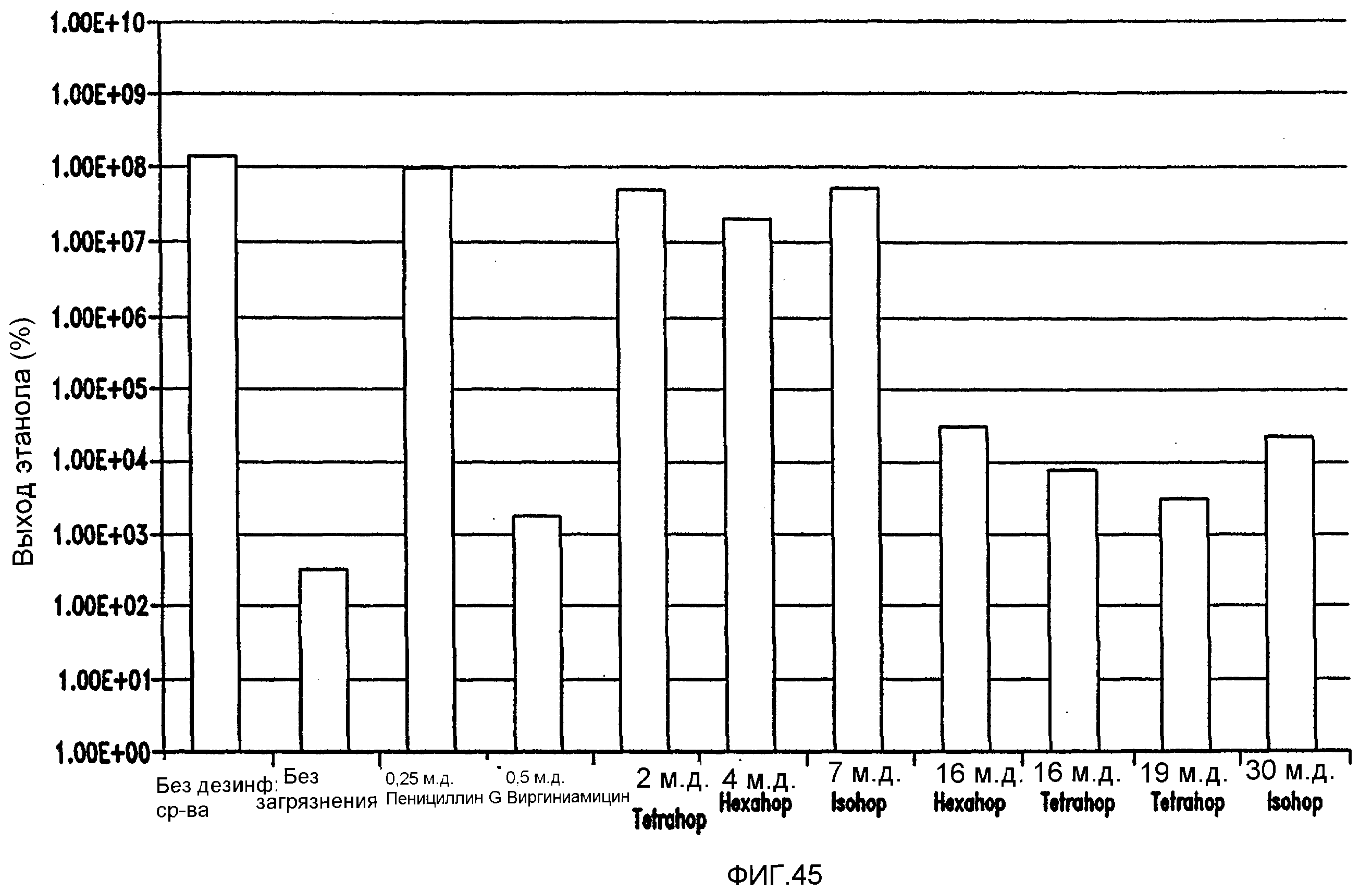
Фигура 45 показывает сравнение эффективности в ингибировании Lb. fermentum в пшеничном заторе. Количество жизнеспособных клеток с использованием быстрого способа посева штрихом на MRS-чашках анаэробно инкубировали при 86°F (30°С) в течение 48 часов.
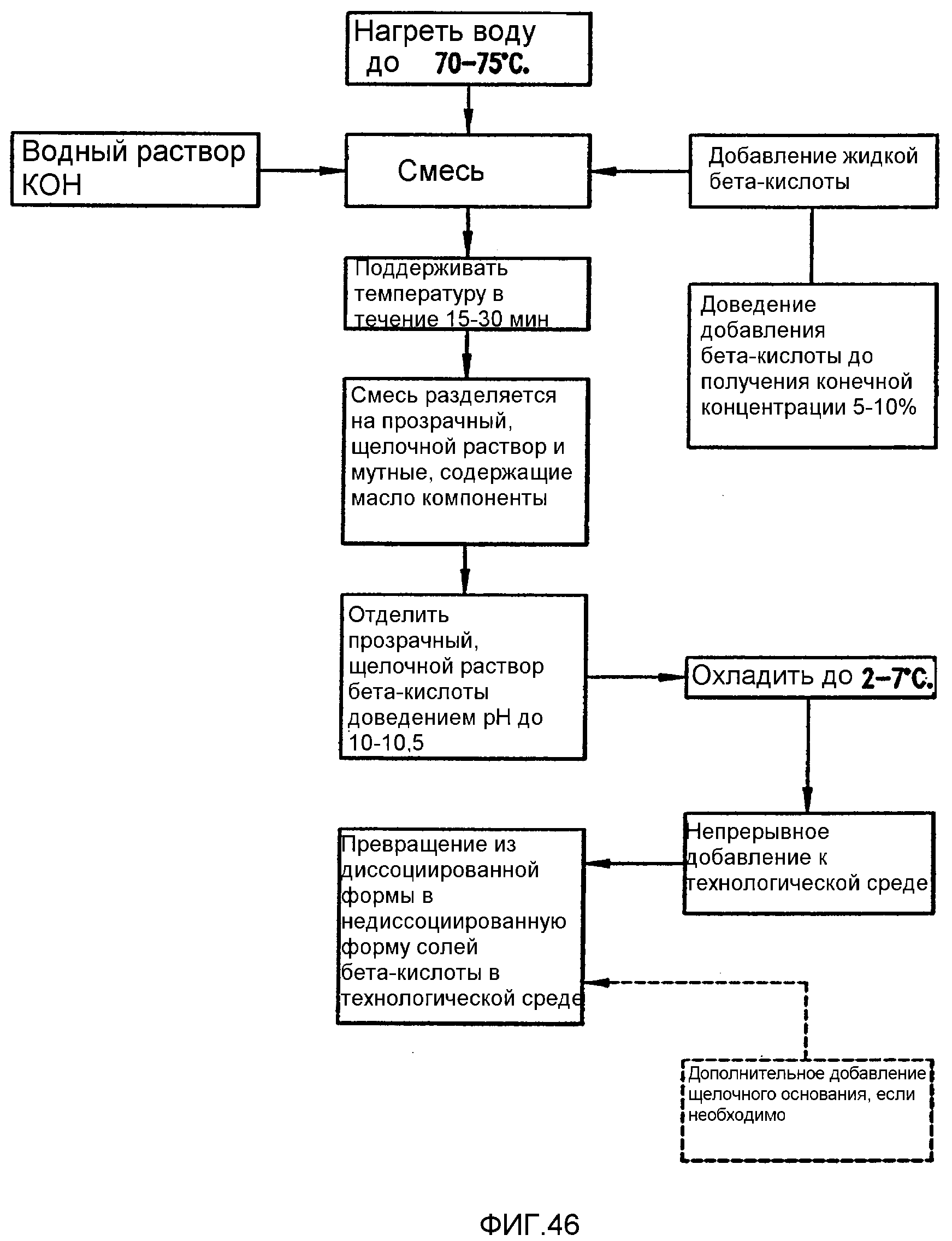
Фигура 46 является диаграммой одного варианта осуществления последовательности процесса для получения водного щелочного раствора бета-кислоты.
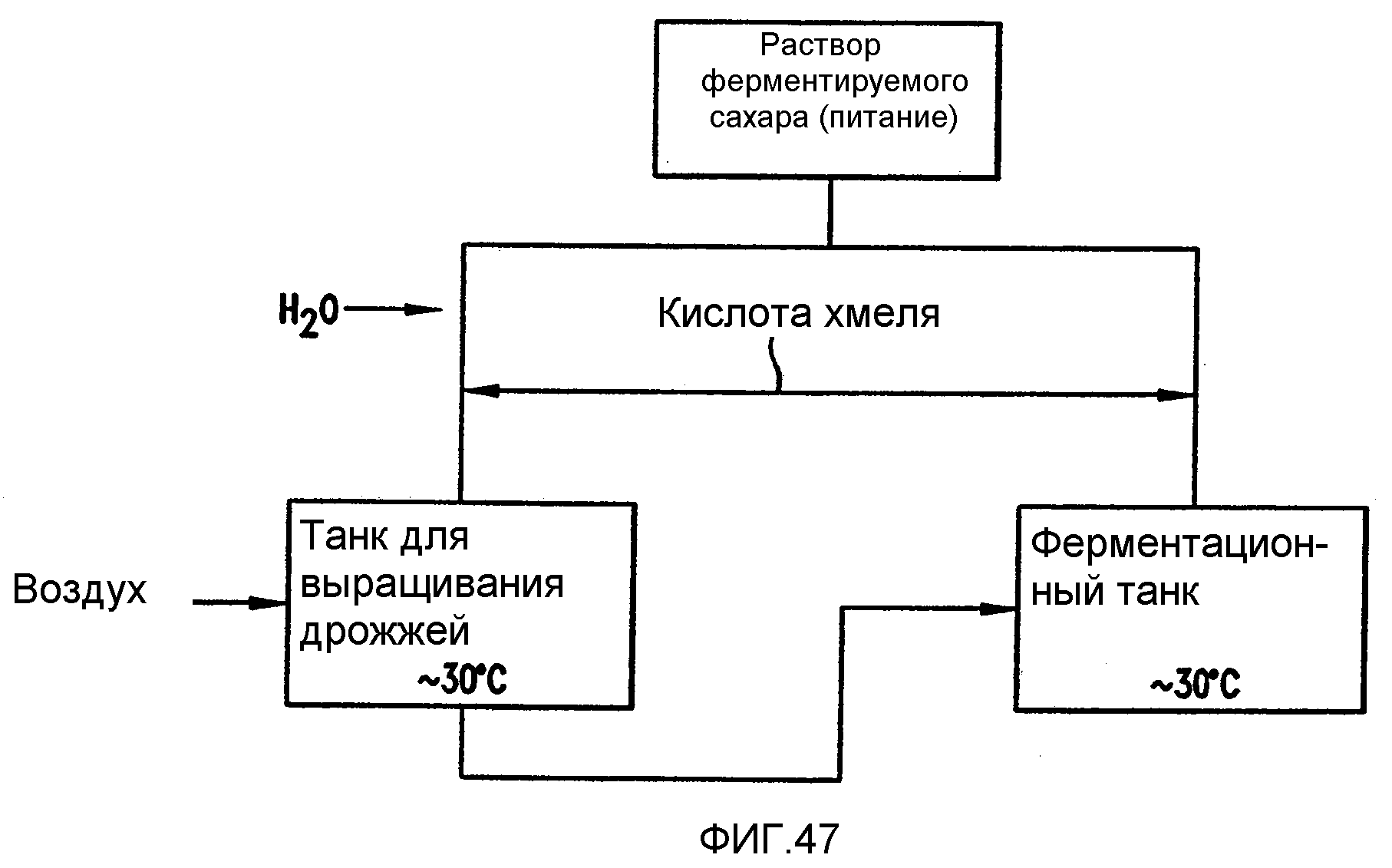
Фигура 47 является диаграммой одного варианта осуществления для контроля бактериального роста в перегонной установке, где ферментируемый раствор хранят в виде концентрата и изомеризованную кислоту хмеля вводят в потоки питания, идущие к танкам для выращивания дрожжей и ферментерам непосредственно после разбавления.
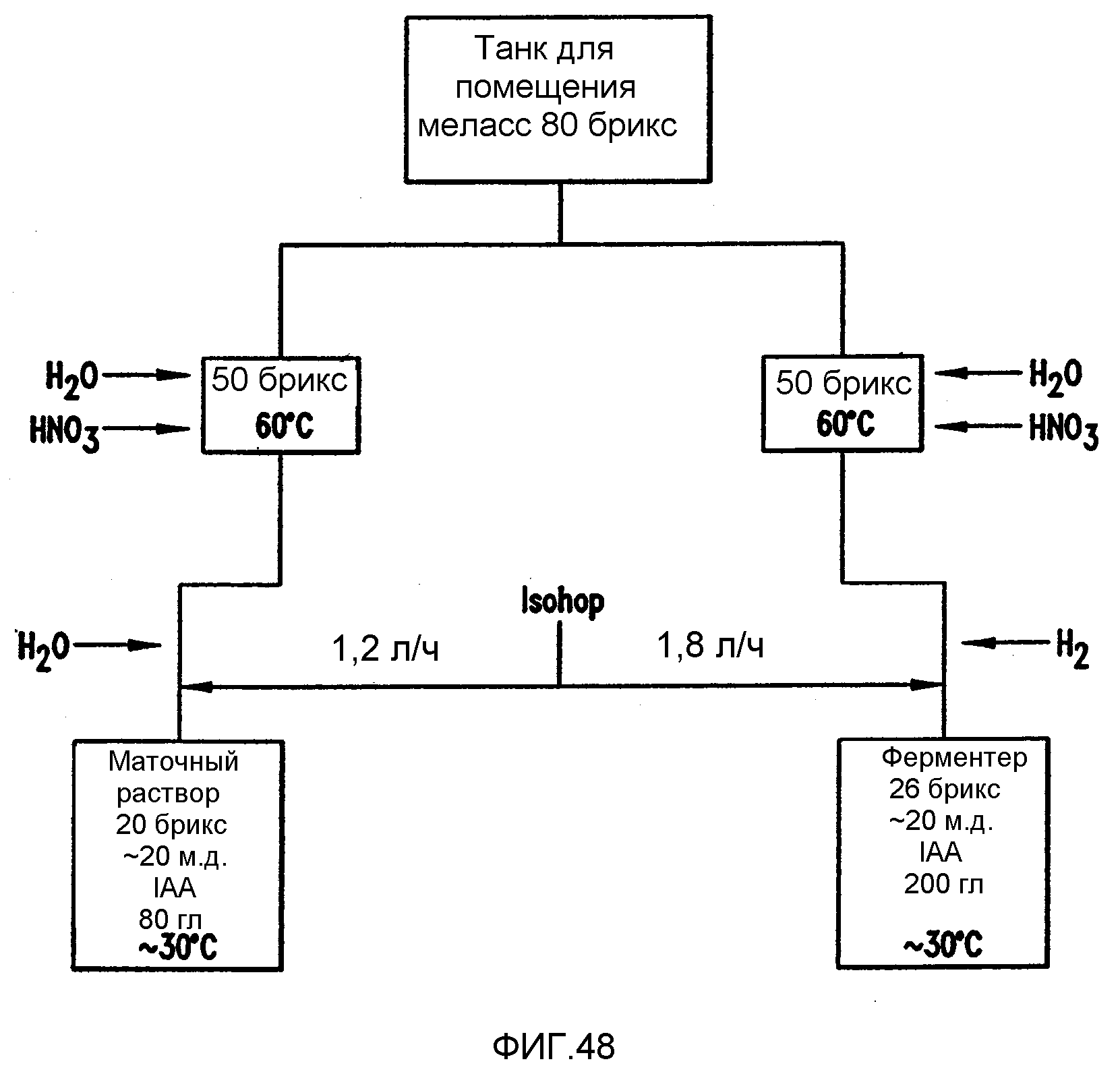
Фигура 48 является диаграммой, показывающей разбавление концентрированных меласс в перегонной установке в соответствии с примером 7.
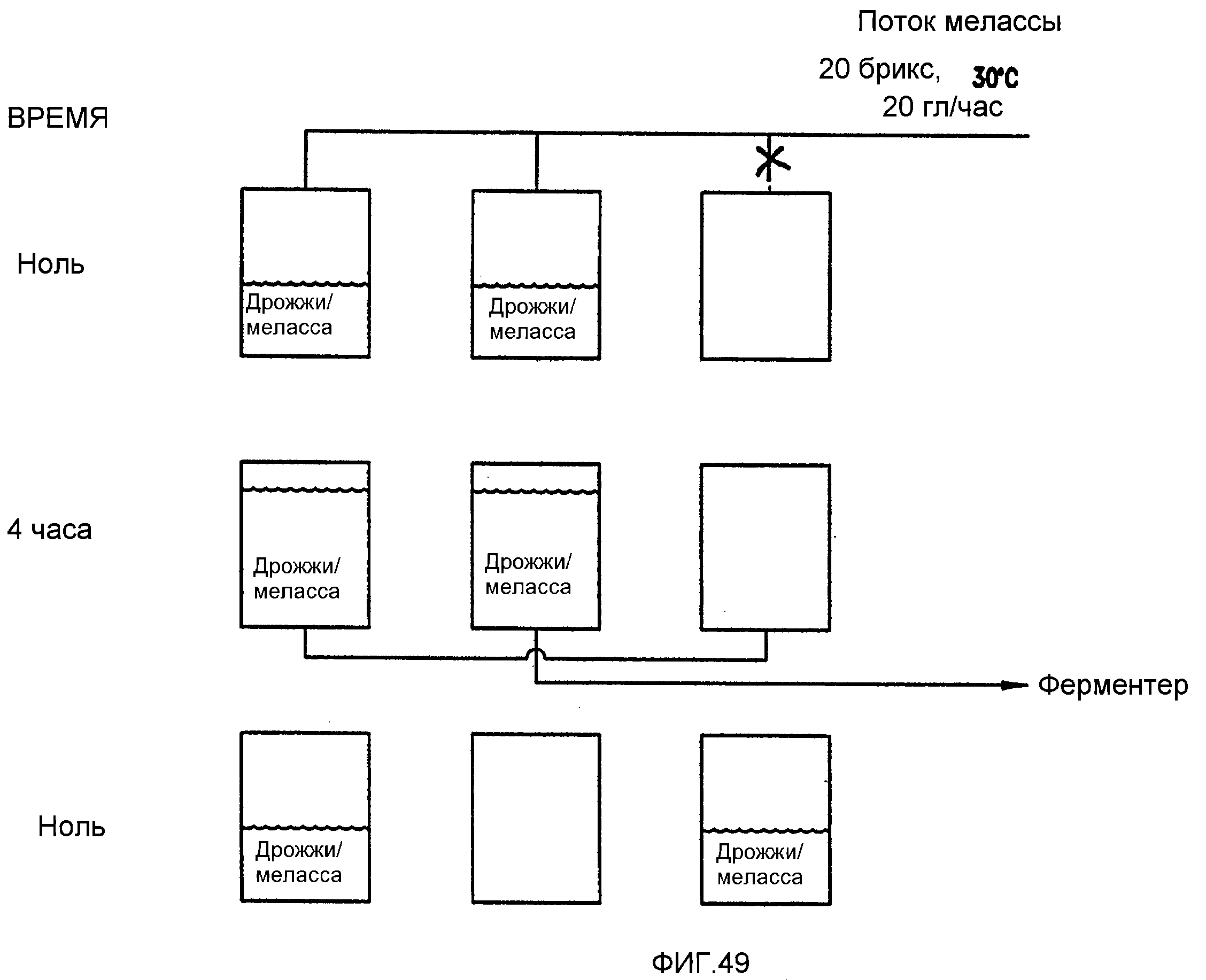
Фигура 49 является диаграммой, демонстрирующей, каким образом дрожжи в танках для выращивания дрожжей выращиваются в перегонной установке, обработанной в соответствии с примером 7.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА
Данное изобретение относится к способу контроля микроорганизмов в водной технологической среде, предусматривающему добавление водного щелочного раствора кислоты хмеля к этой технологической среде, причем рН водного щелочного раствора является более высоким, чем рН технологической среды.
Кислота хмеля является природной кислотой хмеля или ее производным, такими как альфа-кислота, бета-кислота, тетрагидро-альфа-кислота (ТНАА) или гексагидро-бета-кислота (ННВА) или их смеси; изомеризованной кислотой или ее производным, такими как изо-альфа-кислота (IAA), ро-изо-альфа-кислота (RIAA), тетрагидроизо-альфа-кислота (THIAA) или гексагидроизо-альфа кислота (HHIAA) или их смеси. Альфа-кислоты, содержащиеся в кислоте хмеля, могут превращаться в изо-альфа-кислоты во время приготовления раствора кислоты хмеля и сохранять их антибактериальное/антимикробное действие.
В зависимости от продукта кислоты хмеля концентрация кислоты хмеля в водном растворе будет варьироваться. Например, концентрация THIAA в водном растворе равна обычно 10 мас.%, в то время как концентрация IAA может быть такой высокой, как 30 мас.%. Обычно, конечная концентрация кислоты в растворе находится в диапазоне приблизительно 2 - приблизительно 40 мас.%, в другом аспекте приблизительно 5 - приблизительно 20 мас.% и в другом аспекте приблизительно 10 - приблизительно 15 мас.%. Более высокие концентрации кислот хмеля могут быть подходящими, когда требуются более длительные периоды времени транспортировки. Обычно кислоты хмеля в их кислотной форме обнаруживают низкую растворимость в воде. Однако кислоты хмеля могут быть смешаны с гидроксидом щелочного металла, например гидроксидом калия, для получения растворимой соли щелочного металла кислоты хмеля. Таким образом, предпочтительно использовать гидроксиды щелочных металлов, например гидроксид калия или гидроксид натрия или их смеси, в качестве щелочной среды для контроля микроорганизмов. Концентрации этой щелочной среды находятся в диапазоне приблизительно 20 мас.% - приблизительно 45 мас.% или в другом аспекте приблизительно 20 мас.%.
Как обсуждалось выше, рН водного щелочного раствора кислоты хмеля является более высоким, чем рН технологической среды. В результате низкого дозируемого количества добавляемого раствора в сравнении с технологической средой этот раствор адаптируется почти полностью к рН технологической среды при добавлении к технологической среде и кислота хмеля переходит из формы соли в форму свободной кислоты, которая является антибактериально эффективной. рН водного щелочного раствора кислоты хмеля, добавляемого к технологической среде, находится в диапазоне приблизительно 7,5 - приблизительно 13,0, а в другом аспекте приблизительно 9,5 - приблизительно 11,0. При использовании этого раствора в таком диапазоне достигается высокая бактерицидная эффективность. Этот раствор может добавляться без риска серьезного повреждения кожи человека. Кроме того, этот раствор не создает неприятных или повреждающих паров в отличие от других химических агентов.
В одном варианте осуществления водный щелочной раствор кислоты хмеля готовят следующим образом:
а) обеспечение водной среды;
b) нагревание;
с) добавление кислоты хмеля, предпочтительно расплавленной кислоты хмеля, так что конечная концентрация этой кислоты хмеля находится в заданном диапазоне концентрации;
d) добавление водного щелочного раствора с получением заданного рН;
е) смешивание щелочной среды с добавленной кислотой хмеля;
f) поддержание этой смеси в диапазоне повышенных температур в пределах заданного периода времени;
g) отделение раствора кислоты хмеля от этой смеси и
h) охлаждение раствора кислоты хмеля.
Фигура 46 является диаграммой последовательности процесса для получения водного щелочного раствора бета-кислоты. В одном варианте осуществления водный раствор гидроксида калия нагревают от приблизительно 60 до приблизительно 80оС, в другом аспекте от приблизительно 65 до приблизительно 75оС, еще в одном аспекте от приблизительно 70 до приблизительно 75оС, и кислоту хмеля, например расплавленную бета-кислоту, добавляют в этот раствор гидроксида калия. Эту температуру смеси поддерживают затем в течение приблизительно 15-30 минут или до тех пор, пока эта смесь не разделяется на прозрачный щелочной раствор бета-кислоты и содержащие масло компоненты. Этот прозрачный щелочной раствор бета-кислоты, обычно имеющий рН приблизительно 10 - приблизительно 10,5, отделяют от этой смеси и затем охлаждают до температуры, более низкой, чем комнатная температура, например до приблизительно 2 - приблизительно 7оС. Затем этот раствор подают в технологическую среду периодически, например с использованием ударной дозы, или непрерывно.
Этот процесс приготовления водного щелочного раствора кислоты хмеля позволяет получать раствор, который может храниться и/или транспортироваться при более высоких концентрациях кислот хмеля на протяжении более длительных периодов. При этих условиях эти растворы являются очень стабильными. Этот состав обозначает, что этот раствор может подаваться наливанием его вручную через горловину резервуара, так как он не будет повреждать кожу человека, и этот щелочной раствор не создает неприятных или повреждающих паров в отличие от других химических агентов. Такой раствор обеспечивает подходящие характеристики для транспорта, способа применения раствора и хранения вследствие щелочных свойств. рН этого раствора выбран также для гарантии наиболее высокого возможного увеличения действия при его непосредственном применении. Этот раствор может также подаваться через замкнутые подающие системы для не допускающей выделения подачи обычных антибактериальных веществ. Эти процедурные стадии могут изменяться в их последовательности во времени. Вышеуказанная последовательность обеспечивает очень точный рН водного щелочного раствора кислоты хмеля.
В этом способе контроля микроорганизмов водный щелочной раствор кислоты хмеля может добавляться к технологической среде непрерывно или прерывистым образом, например с использованием ударной дозы. Например, для ударной дозы водный щелочной раствор кислоты хмеля периодически добавляют к технологической среде, например, эту подачу выполняют в определенных временных точках в пределах очень коротких интервалов времени, при которых локально и в течение короткого интервала времени могут быть получены высокие концентрации. Высокие локальные концентрации, достигаемые этим способом подачи, позволяют избежать адаптации микроорганизмов. Раствор может подаваться вручную в технологическую среду. Альтернативно этот раствор может добавляться в технологическую среду с использованием замкнутых систем подачи. Это означает, что контроль микроорганизмов может выполняться при применении уже доступного оборудования этого процесса (замкнутых систем подачи).
Обычно температура подлежащей обработке технологической среды равна менее 100оС, в одном аспекте менее 50оС, в другом аспекте менее 30оС. Как обсуждалось выше, в технологической среде водный щелочной раствор кислоты хмеля смешивается со слабокислой или по меньшей мере менее щелочной по реакции технологической средой. В результате низких подаваемых количеств высококонцентрированного раствора кислоты хмеля, например, раствора бета-кислоты или альфа-кислоты, он адаптируется почти полностью к рН технологической среды, вследствие чего кислота хмеля превращается из ее формы соли в антибактериально и/или антимикробно эффективную форму свободной кислоты.
В другом варианте осуществления расплавленные коммерческие кислоты хмеля, такие как бета-кислоты, могут быть непосредственно добавлены к технологической среде. В таком способе расплав смешивают со щелочным раствором при увеличенной температуре незадолго перед ударной подачей. После растворения расплава всю смесь подают в виде единственной ударной подачи. Для коротких периодов могут быть выбраны сильно щелочные условия, которые могли бы приводить к потере кислот хмеля во время промежуточного хранения.
Способ контроля микроорганизмов может быть автоматизирован посредством использования контролей времени для подающих насосов и клапанов. В этом случае также происходит увеличение эффективности. Улучшенное действие означает, что общая концентрация активных ингредиентов может быть уменьшена, что обусловливает ряд преимуществ. Либо достигается уменьшенная стоимость вследствие меньшей подачи, либо та же самая подача дает лучшее действие. Для кислот хмеля с одной и той же концентрацией уменьшается объем транспорта вследствие более высокой эффективности.
Этот способ контроля микроорганизмов может быть применен предпочтительно в перегонных установках для получения непивных алкогольных напитков, в частности спиртных напитков, или в производстве вина и содержащих вино напитков, кроме того, в производстве природного этанола, топливного этанола и фармацевтических лекарственных средств. Этот способ может быть также применен в производстве всех типов молочных продуктов, дрожжей, плодово-ягодных соков и помещенных в жестяные банки продуктов в водном растворе. Кроме того, этот способ может быть использован в приготовлении косметических и детергентных композиций.
Было обнаружено, что изомеризованные кислоты хмеля и их производные особенно эффективны в контроле бактериального роста перегонных установок. Изомеризованные кислоты хмеля легче использовать, чем традиционные препараты хмеля. Действительно, посредством использования стандартизованного раствора изомеризованных кислот хмеля можно точно дозировать точное количество кислоты хмеля, требуемое для контроля бактериального роста.
Таким образом, в другом варианте осуществления описан способ контроля бактериального роста в перегонной установке, предусматривающий добавление эффективного антибактериального количества изомеризованной кислоты хмеля в технологические потоки, например потоки дрожжей и/или потоки ферментера перегонной установки. В одном варианте осуществления технологические потоки обрабатывают щелочным водным раствором изомеризованной кислоты хмеля. Изомеризованные кислоты хмеля в таких низких концентрациях, как 2 м.д., в технологической среде могут эффективно контролировать бактериальный рост. Поскольку изомеризованные кислоты хмеля являются нерастворимыми при концентрации приблизительно 100 м.д., можно избежать локализованных высоких концентраций.
Таким образом, изомеризованную кислоту хмеля предпочтительно дозируют в процесс очень медленно, например, с использованием насосов с подачей малых доз.
Фигура 47 демонстрирует пример, в котором ферментируемый раствор хранят в виде концентрата и изомеризованную кислоту хмеля подают в питающие потоки, идущие к танкам для выращивания дрожжей и ферментерам, сразу же после разбавления. При очень высоких концентрациях, больших, чем 80 бриксов (градусов по Бриксу), не происходит бактериальный рост, хотя бактерии все еще присутствуют в материале питания. После разбавления материала питания до ферментируемой концентрации приблизительно 25 бриксов может происходить бактериальный рост. Посредством добавления изомеризованной кислоты хмеля в этой точке в данном процессе бактериальный рост может ингибироваться сразу же с начала процесса.
Альтернативой подаче изомеризованной кислоты хмеля как к танкам для выращивания дрожжей, так и к ферментерам является подача более высокой концентрации кислоты хмеля прямо в танки для выращивания дрожжей. После выращивания дрожжей раствор дрожжей, содержащий изомеризованную кислоту хмеля, переносят в пустой ферментер. По мере заполнения ферментера происходит ферментация и концентрация кислоты хмеля разбавляется. При добавлении точного количества изомеризованной кислоты хмеля в танки для выращивания дрожжей разбавление в ферментере обеспечит конечную концентрацию изомеризованной кислоты хмеля приблизительно 2 - приблизительно 4 м.д. При этой концентрации изомеризованная кислота хмеля все еще может контролировать бактериальный рост.
Имеется много преимуществ использования изомеризованных кислот хмеля в качестве антимикробных агентов в использующих дистилляцию отраслях промышленности. Прежде всего, кислоты хмеля являются природными продуктами, которые используют для придания горького вкуса пиву, потребляемому миллионами людей каждый день. Ясно, что они являются безопасными для потребления человеком. Кроме того, поскольку эти кислоты хмеля имеют точки кипения выше 200оС, они позволяют в малой степени беспокоиться в отношении загрязнения дистиллированного продукта хмелем, и следовательно, можно рассматривать применение кислот хмеля в качестве технологической добавки. Наконец, добавление изомеризованных кислот хмеля является экономически эффективным.
Кислоты хмеля являются эффективными в контроле роста бактерий, обычно обнаруживаемых в ферментационных потоках. В результате контроля роста этих бактерий глюкоза может превращаться в этанол, вместо превращения в молочную кислоту и уксусную кислоту, увеличивая таким образом выход этанола. Хотя все кислоты хмеля уменьшали количество бактерий, кислотами, которые контролировали рост микроорганизмов лучше вследствие их стабильности, были THIAA, HHIAA и IAA. рН оказывает влияние на минимальные ингибирующие концентрации (MIC) кислот хмеля. Чем ниже рН ферментационного потока, тем меньше количество кислот хмеля, требуемое для ингибирования роста бактерий. Температура также влияет на антимикробные свойства кислот хмеля, причем, чем выше температура, тем ниже MIC.
Обычно, хотя возможен диапазон концентраций, MIC составляют приблизительно 2 м.д. TIAA, приблизительно 3 м.д. HHIAA или приблизительно 4 м.д. IAA для контроля роста бактерий в дрожжерастильных аппаратах и ферментерах. Поскольку кислоты хмеля являются нерастворимыми при высоких концентрациях и низких рН, в одном аспекте, концентрация кислоты хмеля должна поддерживаться ниже 100 м.д. кислоты хмеля. Это может достигаться посредством применения дозирующих насосов с низкой скоростью тока 5-30 литров в час. Добавлением кислот хмеля в начале роста дрожжей и в начале ферментации рост бактерий может быть ингибирован с начала процесса ферментации.
Различные концентрации кислот хмеля испытывали в MRS-бульоне, ферментациях мелассного сусла и пшеничного затора для определения минимальной ингибирующей концентрации кислоты хмеля в отношении Lb. brevis или Lb. fermentum. Было определено, что кислоты хмеля ингибировали рост бактерий как в MRS-бульоне, так и в ферментациях, увеличивая тем самым процент продуцируемого этанола.
В MRS-бульоне различные концентрации альфа-кислот, бета-кислот, IAA, ро-изо-альфа-кислот, THIAA и HHIAA добавляли к MRS-бульону, обработанному 106 клеток/мл Lb. brevis или Lb. fermentum. В случае MRS-бульона, обработанного 106 клеток/мл Lb. brevis, при рН 5,2, 30оС, этот обработанный бульон выдерживали в течение 60 часов для определения MIC, как показано на фиг. 1. Хотя альфа-кислоты и бета-кислоты ингибировали рост Lb. brevis, вследствие проблем с растворимостью эти кислоты не испытывали дополнительно в ферментационных экспериментах. MIC альфа-кислот оценивали при приблизительно 14 м.д., бета-кислот приблизительно 10 м.д., ро-изо-альфа-кислот при приблизительно 20 м.д., изо-альфа-кислот при приблизительно 16 м.д., THIAA приблизительно при 3 м.д. и HHIAA при приблизительно 3 м.д.
В другом аспекте различные концентрации альфа-кислот, бета-кислот, изо-альфа-кислот, ро-изо-альфа-кислот, THIAA и HHIAA добавляли к MRS-бульону, обработанному 106 клеток/мл Lb. fermentum. MRS-бульон, при рН 5,2, 30оС, выдерживали в течение 60 часов для определения MIC, как показано на фиг. 2. Хотя альфа-кислоты и бета-кислоты ингибировали рост Lb. fermentum, вследствие проблем с растворимостью эти кислоты не испытывали дополнительно в ферментационных экспериментах. MIC альфа-кислот оценивали при приблизительно 20 м.д., бета-кислот при приблизительно 16 м.д., ро-изо-альфа-кислот при приблизительно 20 м.д., IAA при приблизительно 8 м.д., THIAA при приблизительно 2 м.д. и HHIAA при приблизительно 3 м.д.
MIC, минимальную бактерицидную концентрацию (MBC) и выходы этанола также измеряли в ферментациях меласс, загрязненных 106 клеток/мл бактерий и обработанных THIAA, HHIAA и IAA, как показано в таблице 1. THIAA в мелассном сусле имела MIC 3 м.д. и МВС 8 м.д. для Lb. brevis и MIC 3 м.д. и МВС 6 м.д. для Lb. fermentum. HHIAA в мелассном сусле имела MIC 4 м.д. и МВС 10 м.д. для Lb. brevis и MIC 4 м.д. и МВС 8 м.д. для Lb. fermentum. IAA в мелассном сусле имела MIC 6 м.д. и МВС 12 м.д. для Lb. brevis и MIC 4 м.д. и МВС 8 м.д. для Lb. fermentum. Выход этанола для каждой ферментации сравнивали с контрольной ферментацией. Обработка ферментационных потоков MIC соответствующих кислот хмеля приводила в среднем к 10% увеличению выхода этанола.
Мелассное сусло, содержащее 129,7 г/л сахарозы, при рН 5,2, инокулированное 106 бактериальных клеток/мл и выдержанное в течение 96 часов. Температуры были 30оС для Lb. brevis и 36оС для Lb. fermentum. THIAA = тетрагидроизо-альфа-кислоты, HHIAA = гексагидроизо-альфа-кислоты, IAA = изо-альфа-кислоты.
Фигуры 26 и 28 показывают, что ферментации проходили быстрее при использовании кислот хмеля вместо пенициллина G и виргиниамицина.
MIC и выходы этанола измеряли в ферментациях пшеничного затора, загрязненного 106 клеток/мл бактерий и обрабатанного THIAA, HHIAA и IAA, как показано в таблице 1. THIAA в пшеничном заторе имела MIC 6 м.д. для Lb. brevis и MIC 4 м.д. для Lb. fermentum. HHIAA в пшеничном заторе имела MIC 9 м.д. для Lb. brevis и MIC 4 м.д. для Lb. fermentum. IAA в пшеничном заторе имела MIC 14 м.д. для Lb. brevis и MIC 9 м.д. для Lb. fermentum. Выход этанола для каждой ферментации сравнивали с контрольной ферментацией. Обработка ферментационных потоков MIC соответствующих кислот хмеля приводила в среднем к 3-5% увеличению выхода этанола.
Пшеничный затор, содержащий 15,7% твердых веществ, 60% ферментируемого вещества, при рН 5,2, инокулированный 107 бактериальных клеток/мл и выдеранный в течение 96 часов. Температуры были 30оС для Lb. brevis и 36оС для Lb. fermentum. THIAA = тетрагидроизо-альфа-кислоты, HHIAA = гексагидроизо-альфа-кислоты, IAA = изо-альфа-кислоты.
В ферментационных экспериментах, обсуждаемых ниже, с мелассным суслом сахарной свеклы в качестве среды, молочнокислые бактерии инокулировали непосредственно в MRS-бульон. Этот способ был ответственным за высокие исходные концентрации молочной кислоты и уксусной кислоты в этом сусле и способствовал визуализации действия загрязнения молочнокислыми бактериями сусла по потерям выхода этанола. Даже когда бактерии присутствуют в высоких количествах в опосредованных дрожжами ферментациях, они должны создавать биомассу быстро для создания достаточного метаболического потенциала для конкуренции с дрожжевыми клетками за сахар и создания уменьшающих выход этанола уровней молочной кислоты до терминации ферментации (Narendranath, N.V., et al., Appl. & Envir. Microbiol., 63 (11): 4158-4163, 1997). Указания количества органических кислот в дальнейшем относится к количеству органических кислот (например, молочной кислоты и уксусной кислоты), продуцируемых во время ферментации.
Уменьшение количеств жизнеспособных клеток молочнокислых бактерий при увеличении концентраций кислот хмеля происходило вместе с измеряемым уменьшением бактериальных метаболитов в ферментируемом мелассном сусле сахарной свеклы. В суслах, ферментированных с неингибированным загрязнением молочнокислых бактерий, содержание молочной кислоты и уксусной кислоты, продуцируемой этими бактериями во время ферментации, было приблизительно в три раза более высоким, чем в суслах, в которых эти бактерии были успешно ингибированы.
Параллельно с уменьшением органических кислот потребление сахаров дрожжами улучшалось, а содержание оставшегося сахара, состоящего из рафинозы, сахарозы, глюкозы и фруктозы, в ферментированном сусле уменьшалось. Отношение глюкоза-фруктоза в общем оставшемся сахаре улучшалось, в то время как неиспользованная часть рафинозы и сахарозы оставалась постоянной. Потребление сахара дрожжами зависит от отношения глюкоза-фруктоза в среде. Отношение глюкоза-фруктоза, меньшее, чем 0,2, ограничивает активность дрожжей. Когда рост молочнокислых бактерий был неугнетенным, глюкоза обычно полностью потреблялась дрожжами и бактериями, и высокие содержания оставшейся фруктозы вызывали потери выхода этанола до приблизительно 15%. В суслах, в которых рост молочнокислых бактерий был успешно ингибирован, оставшийся сахар содержал глюкозу и фруктозу в соотношении 1:2. Кроме того, выходы этанола улучшались до приблизительно 90% и более.
Влияние на рост происходит, когда концентрация бактерий превышает 104 КОЕ/мл (Essia, N. et al., Appl. Microbiol. Biotechnol.; 33: 490-493, 1990). В соответствии с этим наилучшие выходы достигались, когда количество жизнеспособных бактерий уменьшалось ниже 104 КОЕ/мл, и обычно не могло быть улучшено любым дополнительным уменьшением бактериальных клеток при более высоких концентрациях кислот хмеля. Конкретная концентрация кислоты хмеля, при которой количества бактерий уменьшаются ниже 104/мл, является "эффективной концентрацией".
1. Материалы и способы
В проведении экспериментов, описанных в примерах 1-5, использовали следующие материалы и способы. В данное изобретение включены вариации в материалах и способах, известные специалистам с квалификацией в данной области.
Используемые бактерии
Использовали два вида рода Lactobacillus, оба выделенные из закваски: Lactobacillus brevis (LTH 5290) и Lactobacillus fermentum (LTH528 9). Предварительные тесты показали, что оба вида были способны расти в мелассном сусле сахарной свеклы, а также в пшеничном заторе и были устойчивыми к более, чем 9% (об./об.) этанолу. Количество бактерий в культурах стационарной фазы роста, которые были выращены, соответственно, в мелассном сусле сахарной свеклы и пшеничном заторе, не отличались от количества бактерий в культурах стационарной фазы роста, выращенных в бульоне de Man-Rogosa-Sharpe (MRS) (107-108 КОЕ/мл). Оба штамма принадлежат к семейству гетероферментных лактобацилл, способны ферментировать сахарозу, и их метаболизм глюкозы продуцирует один моль молочной кислоты (DL-форму), один моль уксусной кислоты и этанол и один моль CO2 на моль глюкозы. Оптимальная температура для роста равна 86°F (30°С) для Lb. brevis и 98,6°F (36°С) для Lb. fermentum. Анализы ферментации в каждом случае проводили при подходящей оптимальной температуре для загрязняющего микроорганизма. Время ферментации адаптировали к общему потреблению сахара дрожжами при ненарушенной ферментации при каждом температурном условии. Сусла, загрязненные Lb. brevis, инокулировали в течение 96 часов при 86°F (30°С); сусла, загрязненные Lb. fermentum, инкубировали в течение 72 часов при 98,6°F (36°С).
Среды
Среду de Man-Rogosa-Sharp (Fa. Merck, Darmstadt) использовали для поддержания тест-организма. После того как заметили, что эти бактерии не растут хорошо, так как глюкоза становилась недоступной в реакциях Майлларда во время автоклавирования, эту среду обогащали стерильным раствором глюкозы после стерилизации, добавлением 5 г/л глюкозы к MRS-бульону и MRS-arapy. Эту среду называют MRS.
Для оценки MIC величину РН этой среды доводили до рН 5,2 концентрированной НС1 перед стерилизацией. Эту модифицированную среду называют модифицированной MRS.
(i) Приготовление бактериальных инокулятов для мелассного сусла сахарной свеклы
Чистые элитные штаммы хранили в замороженном виде при -101,2°F (-75°С)в MRS-бульоне, содержащем 8%-ный глицерин, и инокулировали из них в пробирки с крышками на 10 мл, содержащие 2 мл MRS-бульона. Верхнее пространство каждой пробирки продували простерилизованным фильтрованием через микропористую мембрану (мембранный фильтр с размерами пор 0,45 мкм) СO2-газом и крышки заделывали пленкой, покрытой парафиновым воском. Эти пробирки шкубировали в шейкере с регулируемыми условиями окружающей среды при 100 об/мин при 86°F (30°С) (Lb. brevis) и 96,8°F (36°С) (Lb. fermentum), соответственно. Спустя 12 часов по 1 мл этих начальных культур переносили в пробирки с крышкой на 10 мл, содержащие 9 мл MRS-бульона, и инкубировали в течение дополнительных 24 часов, после чего переносили в колбы на 100 мл с завинчивающимися крышками, содержащие 90 мл MRS-бульона, и снова инкубировали при подходящей температуре в течение 24 часов. После этого бактериальные клетки асептически собирали в стерильных центрифужных пробирках центрифугированием при 10200×g в течение 15 минут при 4°С. Осадки промывали дважды стерильной 1% пептонной водой и ресуспендировали в 20 мл стерильного 0,85% солевом растворе. Эти порции переносили в колбы на 1 л с завинчивающимися крышками, содержащие 750 мл MRS-бульона, и снова инкубировали в течение 24 часов. Количества клеток этих микроорганизмов приближенно определяли с использованием фотометра Бека. Четная функция, описывающая зависимость между оптической плотностью против MRS-бульона при длине волны 578 нм и количеством колониеобразующих единиц на мл, была установлена для обоих штаммов. Инокуляцию мелассного сусла сахарной свеклы лактобациллами выполняли непосредственно в MRS-среде вместо добавления дрожжевого экстракта в качестве питательной добавки для дрожжей. Стерилизованную ультрафильтрацией через мембрану (мембранный фильтр с размерами пор 0,45 мкм) аликвоту 5 мкл суспензии клеток в MRS для инокуляции определяли высокоэффективной жидкостной хроматографией с использованием колонки ProntoSil 120-3-С18 AQ, которая анализирует сахара, органические кислоты и спирт, убедившись, что глюкоза в MRS среде была полностью потреблена, и определением количества молочной кислоты и уксусной кислоты, добавленных к свежему суслу. Подходящие количества суспензии клеток добавляли с получением в целом 500 г сусла в лабораторных ферментационных колбах и исходных количеств жизнеспособных бактериальных клеток 106 КОЕ/мл сусла. После этого величину рН повторно доводили до рН 5,2, если это было необходимо.
(ii) Приготовление бактериальных инокулятов для пшеничного затора
Чистые элитные штаммы хранили в замороженном виде при -101,2°F (-74°С)в MRS-бульоне, содержащем 8%-ный глицерин, и инокулировали из них в пробирки с крышками на 10 мл, содержащие 2 мл MRS-бульона. Верхнее пространство каждой пробирки продували простерилизованным фильтрованием через микропористую мембрану (мембранный фильтр с размерами пор 0,4 5 мкм) CO2-газом и крышки заделывали пленкой, покрытой парафиновым воском. Эти пробирки инкубировали в шейкере с регулируемыми условиями окружающей среды при 100 об/мин при 86°F (30°С) (Lb. brevis) и 96,8°F (36°С) (Lb. fermentum), соответственно. Спустя 12 часов по 1 мл этих начальных культур переносили в пробирки с крышкой на 10 мл, содержащие 9 мл MRS-бульона и инкубировали в течение дополнительных 24 часов, после чего переносили в колбы на 100 мл с завинчивающимися крышками, содержащие 90 мл MRS-бульона, и снова инкубировали при подходящей температуре в течение 24 часов.
Для инокуляции пшеничного затора эти бактериальные клетки асептически собирали в стерильных центрифужных пробирках центрифугированием при 10200×g в течение 15 минут при 4°С. Осадки промывали дважды стерильной 1% пептонной водой и ресуспендировали в 20 мл стерильного 0,85% солевом растворе. Такие собранные бактериальные клетки каждого штамма объединяли снова с получением концентрированной клеточной суспензии и хранили при 30,2°F (-1°С), пока их не распределяли.
Количества клеток этих микроорганизмов приближенно определяли с использованием фотометра Бека. Четная функция, описывающая зависимость между оптической плотностью против 0,85% солевого раствора при длине волны 578 нм и количеством колониеобразующих единиц на мл была установлена для обоих штаммов. Подходящие количества этой концентрированной суспензии клеток добавляли к количествам 500 г пшеничного затора в лабораторных ферментационных колбах с получением исходных количеств жизнеспособных бактериальных клеток 107 КОЕ/мл сусла.
Приготовление дрожжевого инокулята
Количество жизнеспособных клеток на грамм активных сухих дрожжей S. cerevisiae (Schlienzmann Brennereihefе forte) определяли подсчетом дрожжевых клеток на среде YPD. 0,1 г, 0,5 г и 1 г активных сухих дрожжей S. cerevisiae помещали в 10 мл стерильного 0,85% солевого раствора и инкубировали при 86°F (30°С) в течение 30 минут. Готовили серию разведений от 10-1 до 10-9 каждой суспензии и количество жизнеспособных клеток определяли способом посева штрихом на чашках. Количества жизнеспособных клеток умножали на коэффициент 10 для элиминации начального разведения посредством расчета. Подсчет приводил к приблизительно 109 жизнеспособных дрожжевых клеток на грамм активных сухих дрожжей.
Время ферментации подвергали мониторингу в зависимости от осмотического давления и содержания сахаров в сусле, температуры ферментации и дозы дрожжей для минимизации исходного количества жизнеспособных клеток дрожжей. Это было необходимо для получения видимых потерь этанола в ферментациях лабораторного масштаба. Как сообщалось Hynes S.H. et al., (J. Indust. Microbiol, and Biotech. 18 (4): 284-291, 1991) (и различные другие авторы), даже неугнетенные рост и продуцирование молочной кислоты бактериями часто являются недостаточными для того, чтобы оказывать действие на ферментацию, если инокулят в заторе является высоким (107 дрожжей на г затора). В тестах, описанных в примерах ниже, использовали дрожжевой инокулят 0,6 г активных сухих дрожжей для 500 г сусла, что соответствует исходному количеству жизнеспособных клеток 1,2×106. Эффекты могли быть даже более высокими с использованием меньших количеств дрожжей, но этот инокулят был необходим для завершения ненарушенной ферментации в мелассах сахарной свеклы, содержащих 130 г/л сахарозы, в пределах 72 часов, как это желательно.
Для каждой ферментационной пробы 500 г сусла, 0,6 г активных сухих дрожжей S. cerevisiae диспергировали в 10 мл водопроводной воды и инкубировали при 86°F (30°С) в течение 30 минут. После встряхивания вручную эту суспензию добавляли в лабораторную ферментационную колбу.
Получение ингибиторных веществ
(iii) Получение экстрактов хмеля
Шесть имеющих различный состав CO2-экстрактов хмеля из Haas Hop Products, Inc., Wasington, D.C., испытывали для обоих штаммов Lactobacillus. Испытанными продуктами Haas Hop Products были: (1) Alphahop®, чистая стандартизованная высококонцентрированная смолистая композиция 92% α-кислот; (2) Betastab®, чистая стандартизованная композиция 10% β-кислот и эфирных масел хмеля; (3) Redihop®, чистый стандартизованный раствор 35% ро-изо-α-кислот; (4) Isohop®, чистый стандартизованный раствор 30% изо-α-кислот; (5) Hexahop Gold™, чистый стандартизованный раствор более чем 8% гексагидроизо-α-кислот и (6) Tetrahop™, чистый стандартизованный раствор 10% тетрагидроизо-α-кислот. Эти СО2-экстракты хмеля с различными концентрациями разбавляли в деионизованной стерильной воде таким образом, что все разведения содержали 0,001% кислоты хмеля. Alphahop® растворяли 1:1 в 95% этаноле перед разбавлением вследствие его плохой растворимости в воде.
Обычно кислоты хмеля обнаруживают низкую растворимость в воде. Однако кислоты хмеля могут быть смешаны с гидроксидом щелочного металла, предпочтительно гидроксидом калия, для получения водорастворимой соли щелочного металла кислоты хмеля. Таким образом, в способе для контроля микроорганизмов предпочтительно использовать гидроксиды щелочных металлов, в частности гидроксид калия или гидроксид натрия или их смеси, в качестве щелочной среды. Концентрации этой щелочной среды предпочтительно находятся в диапазоне приблизительно 1 - приблизительно 4 мас.%, более предпочтительно приблизительно 2 - приблизительно 3 мас.%.
Как обсуждалось выше, в описанном здесь способе снижения концентрации продуцирующих молочную кислоту бактерий рН водного щелочного раствора хмеля, добавляемого к технологической среде, является более высоким, чем рН технологической среды. В результате низкого дозового количества добавляемого раствора в сравнении с технологической средой, этот раствор адаптируется почти полностью к рН технологической среды при добавлении к этой технологической среде, и кислота хмеля переходит от диассоциированной формы (формы соли) в ассоциированную, антибактериально эффективную форму свободной кислоты. В одном аспекте рН этого водного щелочного раствора кислоты хмеля, добавляемого к технологической среде, находится в дмапазоне приблизительно 7,5 - приблизительно 13,0, в другом аспекте приблизительно 9,5 - приблизительно 11,0. С использованием этого раствора в таком диапазоне достигается высокая бактерицидная эффективность. Этот раствор может добавляться без риска серьезного повреждения кожи человека. Кроме того, этот раствор не создает неприятных или вредных паров, в отличие от других химических агентов.
Предварительное испытание MIC показало, что Isohop®, Hexahop Gold™ и Tetrahop™, вследствие результатов растворимости, были наиболее эффективными против бактерий. Эти три продукта использовали для испытания эффективности в качестве дезинфицирующего средства в мелассном сусле и пшеничном заторе. Подходящие количества разведений, описанных выше, добавляли к суслу с получением концентраций в диапазоне от 1 до 28 м.д. полученного затора.
(iv) Приготовление виргиниамицина
Источником виргиниамицина был Stafac®, содержащий 10% виргиниамицин. Hynes S.H. et al., (J. Indust. Microbio. and Biotech. 18(4): 284-291, 1997) сообщали, что концентрация 0,5 мг виргиниамицина является эффективной против большинства молочнокислых бактерий. 0,125 г Stafac® растворяли в 50 мл деионизованной стерильной воды с получением разведения, содержащего 0,25 мг виргиниамицина на мл. Один миллилитр этого разведения добавляли к 500 г сусла с получением концентрации 0,5 м.д. в этом сусле.
(v) Приготовление пенициллина G
Penicillin G Sodium для технического применения в перегонных установках, доступный от Novo Industri A/S, Denmark, использовали в соответствии с инструкциями изготовителя, согласно которым 1 г пенициллина G является достаточным для получения 4000 л сусла. 12,5 мг Пенициллина G растворяли в 100 мл деионизованной стерильной воды с получением разведения, содержащего 0,125 мг/мл. 1 мл этого разведения добавляли к 500 г сусла с получением концентрации 0,25 м.д. в этом сусле.
(vi) Получение мелассного сусла и ферментация
Содержание сахарозы мелассах свеклы определяли с использованием поляриметра после осветления ацетатом свинца. Мелассы свеклы, приблизительно 78% сухого вещества и приблизительно 49,9% сахарозы (масса/масса), разбавляли дистиллированной водой с получением сусел, содержащих 129,74 г/л сахарозы. Это сусло нагревали до 176°F (80°С), доводили до рН 5,2 1 н H2SO4 и перемешивали при 176°F (80°С) в течение 30 минут для пастеризации сусла и превращения большой части сахарозы в глюкозу и фруктозу. Предварительное тестирование качеств биологической ферментации показало, что не было необходимости освобождения от пены или фильтрования этого сусла.
После этого этот затор охлаждали до 86°F (30°С) для Lb. brevis и 98,6°F (36°С) для Lb. fermentum. В этой точке к суслу добавляли различные концентрации экстрактов хмеля, разведенных в деионизованной стерильной воде, или общепринятые антибиотики, разведенные в деионизованной стерильной воде. Непосредственно перед инокуляцией дрожжей эти пробы загрязняли бактериями с получением исходных количеств жизнеспособных клеток 107 КОЕ/мл и после этого переносили количественно в ферментационные колбы на 1 л, доливали водопроводной водой до 500 г и закрывали резиновыми пробками с ферментационными трубками.
Дополнительные тесты показали, что стерилизованный MRS-бульон, который был использован для размножения Lactobacillus, мог заменять раствор дрожжевого экстракта в качестве дрожжевой питательной добавки. В последующих экспериментах, описанных ниже, лактобациллы добавляли непосредственно в использованную MRS-среду, не содержащую сахаров, и аликвоту стерилизованного, использованного MRS-бульона добавляли для заражения свободных проб.
Ферментации проводили при 86°F (30°С) в течение 96 часов при инокуляции Lb. brevis и при 96,8°F (360°С) в течение 72 часов при инокуляции Lb. fermentum в лабораторных ферментационных колбах на 1 л, содержащих 500 г сусла.
(vii) Затирание пшеницы и ферментация
(а) Определение ферментируемого вещества
Коммерческую озимую пшеницу размалывали при установке 0,5 мм на дисковой дробилке Retsch model SR2 Haan, доступной из Retsen GMBH & Company, Germany. Количество ферментируемого вещества, такого как мальтоза, глюкоза и фруктоза, анализировали с использованием ВЭЖХ-способа (Senn 1988). 10 г размолотой пшеницы ±0,001 г помещали в 300 мл водопроводной воды. Величину рН доводили до рН 6,9-6,5 1 н. NaOH, затем добавляли 0,2 мл высокотемпературной α-амилазы (Optimash рН 420, Solway Enzymes, Hanover) с получением пробы. Эти пробы нагревали до 203°F (95°С)в заторной бане МА-ЗЕ VLB (Bender and Hohbein, Munich) и выдерживали при этой температуре в течение 60 минут. Затем температуру снижали до 131°F (55°С), величину рН доводили до рН 5,0-5,3 1 н H2SO4 и добавляли осахаривающие ферменты (0,2 мл грибной α-амилазы L40000, доступной из Solway Enzymes, Hanover; 2 мл San Super 240L, доступного от Novo, Bagsvaerd, Denmark; 0,1 мл Optilase F300, доступной из Solway Enzymes, Hanover). Осахаривание происходило в течение ночи. После этого эти пробы охлаждали до 68°F (30°С), переносили количественно в градуированные колбы на 1 л, доводили дистиллированной водой до метки 1 л и сначала фильтровали с использованием волнового фильтра, затем фильтровали через мембрану с использованием фильтра с размерами пор 0,45 мкм. Аликвоту 10 мкл этого фильтрата анализировали при помощи ВЭЖХ с использованием колонки ProntoSil 120-3-С18 AQ, которая анализирует сахара, органические кислоты и спирт, для определения содержания в г/л мальтозы, глюкозы и фруктозы. Для определения контрольных величин (слепого опыта) использовали 250 мл водопроводной воды с ферментами, но без размолотой пшеницы. Количество ферментируемого вещества рассчитывали после вычитания величин слепого опыта:
[(((глюкоза [г/л] + фруктоза [г/л]] × 0,899) + (мальтоза [г/л] × 0,947)/ доза размолотой пшеницы] × 100
(b) Стандартный лабораторный способ затирания и ферментации пшеницы
Коммерческую озимую пшеницу размалывали при установке 0,5 мм на дисковой дробилке Retsch model SR2 Haan. Для затирания 80 г размолотой пшеницы на пробу (59,96% ферментируемого вещества (масса/масса) помещали в 300 мл водопроводной воды. Эти пробы помещали в заторную баню MA-3E VLB (Bender and Hohbein, Munich) и добавляли высокотемпературную бактериальную α-амилазу. Температуру повышали до 149°F для клейстеризации крахмала. Этот затор выдерживали в течение 30 минут при этой температуре для завершения разжижения. Затем этот препарат охлаждали до температуры осахаривания 125,6°F и выдерживали при этой температуре еще в течение 30 минут. Величину рН доводили до рН 5,2 1 н. H2SO4. Осахаривание декстрина до глюкозы проводили добавлением 0,625 мл глюкоамилазы (SAN Super 240 л Aspergillus niger, (Novo, Bagsvaerd, Denmark) на пробу. После этого этот затор охлаждали до 86°F для Lb. brevis и 98,6°F для Lb. fermentum. В этой точке к суслу добавляли различные концентрации экстрактов хмеля, разведенных в деионизованной стерильной воде, или общепринятые антибиотики, разведенные в деионизованной стерильной воде. Непосредственно перед инокуляцией дрожжей эти пробы загрязняли бактериями с получением исходных количеств жизнеспособных клеток 107 КОЕ/мл и после этого переносили количественно в ферментационные колбы на 1 л, доливали водопроводной водой до 500 г и закрывали резиновыми пробками с ферментационными трубками. Ферментации проводили при 86°F (30°C) в течение 96 часов при инокуляции Lb. brevis и при 96,8°F (36°C) в течение 72 часов при инокуляции Lb. fermentum в лабораторных ферментационных колбах на 1 л, содержащих 500 г сусла.
(viii) Способы анализов
(а) Анализ минимальной ингибирующей концентрации (MIC)
MIC α-кислот, β-кислот, изо-α-кислот, ро-изо-α-кислот, гексаизо-α-кислот и тетрагидроизо-α-кислот определяли способом разведения в пробирках. Все тесты выполняли по меньшей мере дважды с независимо приготовленными средами и тест-растворами. Тест-инокулят готовили асептическим сбором бактериальных клеток культуры в середине логарифмической фазы роста в MRS-бульоне центрифугированием при 10200×g в течение 15 минут при 4°С. Осадки промывали дважды стерильной 1% пептонной водой и ресуспендировали в 20 мл стерильного 0,85% солевого раствора. Такие собранные бактериальные клетки каждого штамма объединяли с получением концентрированной суспензии клеток и хранили при 39,2°F (4°С) до их распределения. После определения количеств клеток измерением оптической плотности с использованием фотометра Бека подходящие количества концентрированной суспензии клеток добавляли в 10 мл модифицированного MRS-бульона, содержащего диапазон соединений хмеля и произведенных из хмеля соединений, с получением исходных количеств жизнеспособных клеток 106/мл и 107/мл. Эти пробирки инкубировали анаэробно в анаэробных банках с Anaerocult® А (доступным от Merck, Darmstadt) при 86° (30°С) для Lb. brevis и 96,6°F (36°С) для Lb. fermentum в течение 60 часов. Рост оценивали фотометрически при 578 нм против модифицированного MRS-бульона в одноразовых пластиковых микрокюветах в фотометре Бека.
(b) Определение выхода этанола в ферментированном сусле
Дистилляцию проводили с использованием программируемого оборудования для дистилляции с водяным паром модели Vapodest (доступным от Gerhardt, Bonn). 50 г сусла переносили в перегонную колбу. Немедленно добавляли 0,25 н NaOH для доведения рН до 7,0 для предотвращения переноса органических кислот и после времени реакции 2 секунды перегонку с водяным паром начинали при 85% производительности в течение 225 секунд. Диситиллят улавливали в градуированную колбу на 10 0 мл, доливали до отметки 100 мл деионизованной водой и устанавливали на температуру 68°F (20°С).
Для определения выхода этанола использовали цифровую модель денситометра DMA 48 (доступную от Chempro, Hanau). Определенный объем дистиллята вводили в U-образную пробирку для взятия проб этого денситометра. Эта пробирка для взятия проб имеет опору, которая способна вибрировать. Незатухающая вибрация стимулируется увеличивающейся массой этой пробирки. При постоянной температуре введенная масса соразмерна плотности. Продолжительность цикла этой системы вибрации является основой расчета для плотности. Эталонная температура равна 68°F (20°С). Величины плотности переводили в объемные проценты при помощи таблицы 6 Amtliche Alkoholetafeln и умножали на коэффициент 2 для учета разведения пробы сусла 50 г в 100 мл дистиллята. Выход этанола 100 кг исходного материала рассчитывают следующим образом:
[I A/dt исходного материала] = содержание спирта дистиллята [об/об] × масса ферментированного затора [г])/начальная масса исходного материала [г]
Выход этанола 100 кг ферментируемого материала рассчитывают следующим образом:
[I A/dt ферментируемого материала] = [I A/dt исходного материала] × 100]/ферментируемый материал [%]
(с) Определение количества жизнеспособных клеток бактерий
Количества жизнеспособных клеток подвергали мониторингу быстрым способом посева штрихом на чашках (Baumgart, J.: Mikrobiologische Untersuchungen von Lebensmitteln, Behr's Verlag, Hamburg, 1994). MRS-чашки делили на шесть одинаковых кусков, подобных частям пирога. Из каждой пробы ферментируемого сусла готовили серию разведений от 10 до 10-6 в стерильном солевом растворе и каплю 50 мкл каждого разведения тщательно помещали на поверхности одного куска из этих шести кусков. Двенадцать чашек одновременно инкубировали анаэробно в анаэробной банке с Anaerocult® (доступного от Merck, Darmstadt) и инкубировали в течение 48 часов при подходящей температуре (86°F для загрязнения Lb. brevis и 96,6°F для загрязнения Lb. fermentum). Куски, содержащие 5-50 колоний, брали для подсчета. Количество колониеобразующих единиц на мл сусла рассчитывали в виде взвешенного среднего
КОЕ/мл=[ΣС/(n1×1+n2×0,1)]×d,
где [ΣС = количество колоний а самом низком поддающемся счету разведении + количество колоний в самом высоком поддающемся счету разведении;
n1 = количество чашек в самом низком поддающемся счету разведении;
n2 = количество чашек в самом высоком поддающемся счету разведении;
d = 1/самое низкое поддающееся счету разведение.
(d) Анализ ВЭЖХ
Оставшиеся сахара (рафинозу, сахарозу, мальтозу, глюкозу, фруктозу), органические кислоты (молочную кислоту, уксусную кислоту) и этанол в ферментируемом сусле определяли с использованием анализа ВЭЖХ с применением колонки ProntoSil 120-3-C18 AQ, поддерживаемой при 122°F, после калибровки с использованием стандартов аналитической чистоты. Вводили инжекцией стерилизованную фильтрацией (мембранный фильтр с размерами пор 0,45 мкм) аликвоту 5 мкл сусла. Определение выполняли в двух повторностях для каждой пробы. 0,01 н. H2SO4 использовали в качестве подвижной фазы при скорости тока 0,6 мл/мин. Эти компоненты детектировали с использованием дифференциального детектора по коэффициенту преломления RI 16. Эти данные обрабатывали с использованием программного обеспечения Bischoff McDAq.
(е) Вызывание резистентностей и мониторинг перекрестных резистентностей
Выжившие бактерии Lb. brevis и Lb. fermentum выделяли из чашек для определения количества жизнеспособных бактериальных клеток из мелассных сусел с наивысшей концентрацией изо-α-кислот, гексагидроизо-α-кислот и тетрагидроизо-α-кислот, которая позволяла выживать некоторому небольшому количеству микроорганизмов. Эти колонии переносили из MRS-чашек в 10 мл модифицированного MRS-бульона, содержащих умеренную концентрацию конкретного соединения хмеля, при которой этот организм выживал. Верхнее пространство каждой пробирки промывали стерилизованным фильтрацией (мембранный фильтр с размерами пор 0,45 мкм) газом СО2, крышки герметизировали покрытой парафиновым воском пленкой и инкубировали в шейкере с регулируемыми условиями окружающей среды при подходящей температуре для конкретных бактерий в течение 48 часов. Контрольные пробирки вообще не содержали кислот хмеля. После этого 100 мкл каждой пробы распределяли на поверхности MRS-чашек способом посева штрихом и инкубировали анаэробно в анаэробных банках с Anaerocult® при соответствующей температуре в течение 48 часов для регенерации. Этот посев выполняли в двух повторностях для каждой пробы. Эту процедуру повторяли десять раз, каждый раз концентрация подвергаемого мониторингу соединения хмеля в этих пробирках повышалась на 1 м.д.
Из этой серии выживали только колонии Lb. brevis. Их переносили в 10 мл модифицированного MRS-бульона, содержащих диапазон двух других соединений хмеля, для испытания перекрестных резистентностей. Эти пробирки обрабатывали, как описано выше.
2. Примеры
С использованием вышеописанных материалов и способов и их вариаций выполняли различные тесты для обнаружения ингибирующей концентрации кислот хмеля, в том числе тесты для определения минимальных ингибирующих концентраций и эффективных концентраций кислот хмеля, которые могут быть использованы для уменьшения или элиминации продуцирующих молочную кислоту и/или уксусную кислоту бактерий во время производства топливного этанола и спиртных напитков. Следующие далее примеры предназначены для иллюстрации, но не для ограничения, данного изобретения.
Пример 1: Определение MIC
Alphahop®, чистую стандартизованную высококонцентрированную смолистую композицию 92% α-кислот хмеля; Betastab®, чистую стандартизованную композицию 10% β-кислот и эфирных масел хмеля; Redihop®, чистый стандартизованный раствор 35% ро-изо-α-кислот; Isohop®, чистый стандартизованный раствор 30% изо-α-кислот; Hexahop Gold™, чистый стандартизованный раствор более чем 8% гексагидроизо-α-кислот, и Tetrahop™, чистый стандартизованный раствор 10% тетрагидроизо-α-кислот, все из которых доступны из John I Haas, Inc. Haas Hop Products или Washington, D.C., USA, испытывали для определения концентрации, которая могла бы действовать на уменьшение и/или элиминацию продуцирующих уксусную кислоту и/или молочную кислоту бактерий. Конкретно используемыми в этом тесте были Lb. brevis и Lb. fermentum, хотя могут контролироваться также и другие типы бактерий.
Как показано на фигурах 1 и 2, Alphahop®, Betastab® и Redihop® ингибировали рост в сравнении с контрольными пробирками, не содержащими соединения хмеля (100% рост), но имели, вследствие их плохой растворимости в воде, лишь слабое антибактериальное действие в сравнении с Isohop®, Hexahop Gold™ и Tetrahop™. Минимальные ингибирующие концентрации (MIC), концентрации, при которых наблюдается некоторый контроль микроорганизма, для Alphahop®, Betastab® и Redihop® составляют приблизительно 20 м.д. или более. Таким образом, в ферментационные тесты были взяты Isohop®, Hexahop Gold™ и Tetrahop™.
Как показано на фигурах 1 и 2, Lb. fermentum оказался более чувствительным к ионофорному действию кислот хмеля, чем Lb. brevis. MIC Isohop® для Lb. brevis была приблизительно 16 м.д. и 8 м.д. для Lb. fermentum. ННIAA показала превосходные антибактериальные свойства с MIC между 3 и 6 м.д. для обоих штаммов, а THIAA превзошла другие кислоты с MIC 3 м.д. для Lb. brevis и 2 м.д. для Lb. fermentum.
Пример 2: Определение эффективной концентрации и оптимальной концентрации кислоты хмеля
Эффективные концентрации, необходимые для THIAA, HHIAA и IAA, не различались в высокой степени между Lb. brevis и Lb. fermentum. Lb. fermentum был более чувствительным и при увеличенных концентрациях все бактерии были убиты, в то время как количества Lb. brevis могли только значительно уменьшаться до величины приблизительно 101-102 мл. Концентрация, при которой количества бактерий являются минимальными или элиминированными, является “оптимальной концентрацией”.
Как показано на фигуре 3, эффективная концентрация THIAA для ингибирования Lb. brevis была приблизительно 3 м.д. Оптимальная концентрация, при которой количества жизнеспособных клеток в сильной степени уменьшались, была приблизительно 8 м.д. Не было улучшения в уменьшении количеств жизнеспособных клеток или улучшений в выходе этанола с более высокими концентрациями THIAA. Фигура 4 показывает, что эффективная концентрация THIAA для ингибирования Lb. fermentum была приблизительно 3 м.д. Оптимальная концентрация, при которой все Lb. fermentum были убиты, была приблизительно 6 м.д.
Фигура 5 показывает, что эффективная концентрация HHIAA для ингибирования Lb. brevis была приблизительно 4 м.д. Оптимальная концентрация, при которой количества жизнеспособных клеток были значительно уменьшены, была приблизительно 10 м.д.
Фигура 6 показывает, что эффективная концентрация НHIAA для ингибирования Lb. fermentum была приблизительно 4 м.д. Оптимальная концентрация, при которой все Lb. fermentum были убиты, была приблизительно 8 м.д. Не было улучшения в уменьшении количеств жизнеспособных клеток или улучшений в выходе этанола с более высокими концентрациями НHIAA.
Фигура 7 показывает, что эффективная концентрация IAA для ингибирования Lb. brevis была приблизительно 6 м.д. Оптимальная концентрация, при которой все клетки были убиты, была приблизительно 12 м.д. Фигура 8 показывает, что эффективная концентрация изо-α-кислот для ингибирования Lb. fermentum была приблизительно 4 м.д. Оптимальная концентрация, при которой все клетки были убиты, была приблизительно 8 м.д. Такие высокие концентрации, как 20 м.д. IAA, показали улучшение в выходе этанола, которое могло быть обусловлено стрессом дрожжей.
В случае IAA, эффективные концентрации из ферментационных тестов и концентрации MIC коррелировали с оптимальными концентрациями.
Фигуры 9-14 показывают уменьшение бактериальных метаболитов, продуцируемых Lb. brevis и Lb. fermentum, при увеличении концентраций кислот хмеля. Lb. brevis и Lb. fermentum, оба, являются штаммами гетероферментных бактерий и продуцируют молочную кислоту, уксусную кислоту, этанол и СО2. Количества Lb. fermentum в мелассном сусле сахарной свеклы, загрязненном 106 КОЕ/мл (без дезинфицирующего агента), достигали 109/мл, продуцировали больше молочной кислоты и уксусной кислоты и вызывали более тяжелые потери выхода этанола, чем Lb. brevis. Lb. brevis рос медленнее и достигал количеств клеток 5х107. Фигуры 15-19 показывают, что ход снижающейся кривой оставшегося сахара (т.е. рафинозы, сахарозы, глюкозы и фруктозы) в ферментируемом сусле был синхронным с ходом кривой органических кислот.
Фигуры 20-25 иллюстрируют влияние отношения глюкоза-фруктоза в оставшемся сахаре при увеличении концентраций THIAA, HHIAA и IAA. Хорошие выходы этанола обычно достигаются при отношении, большем, чем 0,2.
Пример 3: Свойства изо-α-кислот, гексагидроизо-α-кислот и тетрагидроизо-α-кислот в сравнении с обычными антибиотиками в мелассном сусле при инокуляции 106 КОЕ/мл Lactobacillus brevis или Lactobacillus fermentum
Результаты ферментационных экспериментов с кислотами хмеля сравнивали с результатами ферментационных экспериментов с использованием обычных антибиотиков пенициллина G и виргиниамицина в качестве дезинфицирующих агентов.
Пенициллин часто используют в концентрациях более 1,5 м.д. в периодических ферментациях вследствие возможности индуцированной ферментативной деградации этого антибиотика некоторыми бактериями и довольно низкой стабильности пенициллина G при рН менее 5 (Kelsall 1995). В этом случае использовали 0,25 м.д. пенициллина G в соответствии с инструкциями изготовителя.
Использовали 0,5 м.д. виргиниамицина. Виргиниамицин в концентрации 0,5 м.д. является эффективным против большинства молочнокислых бактерий (Hynes S.H. et al., (J. Indust. Microbio. and Biotech. 18 (4): 284-291, 1997). Сусла идентичным образом инокулировали 106 КОЕ/мл Lb. brevis или Lb. fermentum.
Выходы этанола (фигуры 26 и 28) и количества жизнеспособных клеток (фигуры 27 и 29), которые достигались с обоими антибиотиками, сравнивали с выходами этанола в ненарушенных ферментациях без кислот хмеля и с выходами этанола каждой эффективной и оптимальной концентрации IAA и их производных. Как эффективные, так и оптимальные концентрации каждой кислоты хмеля давали лучшие выходы этанола, чем выходы этанола, достигаемые с пенициллином G или виргиниамицином. Все загрязненные сусла, в которых рост молочнокислых бактерий был успешно ингибирован, достигали лучших выходов этанола, чем сусла без преднамеренного загрязнения.
Виргиниамицин был наиболее эффективным против бактерий во всех суслах, не оставляющим жизнеспособных клеток. Эффективные концентрации кислот хмеля уменьшали количества бактерий в размере, сходном с размером уменьшения пенициллином G. Оптимальные концентрации были такими же эффективными, что и оптимальные концентрации виргиниамицина в случае Lb. fermentum.
Пример 4: Свойства изо-α-кислот, гексагидроизо-α-кислот и тетрагидроизо-α-кислот в пшеничном заторе
Во всех ферментационных экспериментах с пшеничной заторной средой молочнокислые бактерии собирали центрифугированием и инокулировали в виде концентрированной суспензии клеток в 0,85% солевой раствор после промывания дважды стерильной 1% пептонной водой. Подходящие количества добавляли к пшеничному затору с получением исходных количеств жизнеспособных клеток 107/мл. Пшеничный затор содержал 15,7% твердых веществ.
Рост и продуцирование молочной кислоты этими бактериями были недостаточными, чтобы иметь сильное действие на выход этанола. В пробах, которые вообще не содержали ингибиторого вещества, рост и продуцирование молочной кислоты вызывали потери выхода этанола до 7%. Наблюдаемые потери выхода этанола были большими, чем ожидаемые потери, рассчитанные из количества глюкозы, отвлеченной на продуцирование молочной кислоты. Даже минимальные концентрации кислот хмеля, более низкие, чем MIC, останавливали рост бактерий и сильно уменьшали продуцирование органических кислот, хотя уменьшение количеств жизнеспособных клеток ниже 104/мл требовало концентраций кислот хмеля, в значительной степени более высоких, чем MIC. Это, определенно, связано не только с более высокой инокуляцией бактериями, но также с более высокой вязкостью пшеничного затора и лучшей ситуацией питания для лактобацилл в пшеничном сусле. Lb. fermentum опять рос быстрее, чем Lb. brevis, и продуцировал более высокие количества органической кислоты, но был более чувствительным к кислотам хмеля.
Продуцировалось недостаточно молочной кислоты для нарушения потребления сахара дрожжами. В отличие от тест-серии с мелассным суслом сахарной свеклы, количества оставшегося сахара, состоящего их мальтозы, глюкозы и фруктозы, оставались постоянными и скорее увеличивались с уменьшенными количествами жизнеспособных клеток. По существу не было влияния на отношение глюкоза-фруктоза, и оно было равно 0,5 или было более высоким.
Эффективная концентрация THIAA, показанная на фигурах 30 и 31, и ННIAA, показанная на фигурах 32 и 33, для ингибирования Lb. brevis и Lb. fermentum была приблизительно 14-16 м.д. Как показано на фигурах 34 и 36, эффективная концентрация IAA для ингибирования Lb. brevis и Lb. fermentum была выше 30 м.д.
Фигуры 36-41 показывают развитие выхода этанола, содержания оставшегося сахара и метаболитов бактерий при уменьшении количеств жизнеспособных клеток Lb. brevis или Lb. fermentum, коррелированном с увеличением концентраций кислот хмеля в пшеничном заторе.
Пример 5: Свойства изо-α-кислот, гексагидроизо-α-кислот и тетрагидроизо-α-кислот в сравнении с обычными антибиотиками в мелассном сусле при инокуляции 107 КОЕ/мл Lactobacillus brevis или Lactobacillus fermentum
Результаты ферментационных экспериментов с кислотами хмеля сравнивали с результатами ферментационных экспериментов с использованием обычных антибиотиков пенициллина G и виргиниамицина в качестве дезинфицирующих агентов.
Использовали 0,25 м.д. пенициллина G в соответствии с рекомендациями изготовителя и 0,5 м.д. виргиниамицина. Сусла идентичным образом инокулировали 106 КОЕ/мл Lb. brevis или Lb. fermentum.
Выходы этанола (фиг. 42 и 44) и количества жизнеспособных клеток (фиг. 43), которые достигались с обоими антибиотиками, сравнивали с выходами этанола в ненарушенных ферментациях без кислот хмеля и с выходами этанола каждой эффективной и оптимальной концентрации IAA и их производных. Как минимальные, так и эффективные и оптимальные концентрации каждой кислоты хмеля давали сходные или лучшие выходы этанола, чем выходы этанола, достигаемые с пенициллином G или виргиниамицином. Эффективные концентрации давали сходные или лучшие выходы этанола, чем сусла без преднамеренного загрязнения. В суслах, загрязненных Lb. brevis, пенициллин G и виргиниамицин уменьшали количества жизнеспособных клеток ниже 103/мл и ниже количеств жизнеспособных клеток в суслах без загрязнения. Эффективные концентрации Tetrahop™ и Hexahop Gold™ уменьшали количества жизнеспособных клеток до 104.
В суслах, загрязненных Lb. fermentum, виргиниамицин был наиболее эффективным и уменьшал количества жизнеспособных клеток до 103 клеток/мл. Применение пенициллина G практически не обнаружило действия. Эффективные концентрации Tetrahop™, Hexahop Gold™ и Isohop уменьшали количества жизнеспособных клеток до приблизительно 104 клеток/мл.
Пример 6
Щелочной раствор изо-альфа-кислоты подавали к стадии ферментации перегонной установки в концентрации приблизительно 10 - приблизительно 20 м.д. Температура этой стадии ферментации ниже 30оС и рН ниже 6.
Пример 7
Два перистальтических насоса калибровали с использованием деионизованной воды для доставки 20 м.д. изо-альфа-кислот в два потока мелассы при 28оС. Один насос подавал ISOHOP® (30 мас.% водного раствора калийной соли изо-альфа-кислоты, коммерчески доступной от Haas Hop Product, Inc.) для разбавления потока мелассы, 20 бриксов (20% твердых веществ), питающего три танка для выращивания дрожжей. Другой насос подавал ISOHOP® в разбавленный поток мелассы, 26 бриксов, питающий 8 ферментеров. Эти два потока шли постоянно и перегонная установка работала по сушеству полунепрерывно. Трубки-щупы и клапаны были приварены к двум трубам, которые доставляли эти два потока мелассы.
Фигура 48 является диаграммой, показывающей, как концентрированную мелассу сначала разбавляют до приблизительно 50 - приблизительно 55 бриксов и рН доводят до приблизительно 6,2 при 60оС. Эти разбавления занимали приблизительно 45-60 минут, и потоки дополнительно разбавляли по ходу процесса и охлаждали до 30оС перед добавлением ISOHOP® и введением в танк для выращивания дрожжей и ферментер. Концентрированная меласса содержит некоторое количество бактерий, однако, при 80 бриксах нет достаточного количества воды для роста бактерий, и следовательно, они остаются в состоянии покоя. Однако после разбавления бактерии имеют возможность расти. Таким образом, ISOHOP® вводили в разбавленный мелассный раствор по возможности быстро. Поскольку танки для разбавления были небольшими, разбавления проводили непрерывно и подавали вперед к их соответствующим танкам. Заполнение каждого танка для выращивания дрожжей занимает приблизительно 4 часа, заполнение ферментационного танка мелассой приблизительно 16 часов и ферментация занимает дополнительно 48 часов.
Раствор для выращивания дрожжей из танка для выращивания дрожжей и “вино” из ферментации загружали Lactobacillus. Аналитический анализ показал, что количество бактерий составляет 3 миллиона бактериальных клеток/мл. Эти два раствора анализировали также на оставшийся сахар, выход спирта и общие органические кислоты, такие как молочная кислота, уксусная кислота и т.д.
Фигура 49 является диаграммой, демонстрирующей рост дрожжей в танках для выращивания дрожжей. Во временной точке 0 были два танка для выращивания дрожжей, которые имели общий объем 100 гл каждый. Каждый танк содержал приблизительно 40 гл дрожжей и мелассы в качестве питания и постоянно аэрировался. Мелассное питание постоянно добавляли в эти два танка для выращивания дрожжей при скорости тока 20 гл в час. Заполнение этих двух танков до объема 80 гл каждый, занимает четыре часа. После того как каждый танк получал общий объем 80 гл, содержимое одного танка переносили в пустой ферментер, в то время как половину другого танка откачивали в третий пустой танк для выращивания дрожжей для продолжения процесса выращивания дополнительного количества дрожжей.
После того как 80 гл раствора дрожжей отсылали в пустой ферментер, в этот ферментационный танк добавляли 120 гл мелассы ~ 26 бриксов. Добавление этого мелассного раствора занимало приблизительно 16 часов и спустя 48 часов после добавления мелассного раствора ферментацию завершали. Объединенные 200 гл мелассы/дрожжей/спирта и т.д. откачивали в дистилляционные колонны для выделения этанола.
После добавления в течение приблизительно 20 часов 15 м.д. ISOHOP® добавляли к мелассному питанию, идущему в ферментер, и приблизительно 13 м.д. ISOHOP® добавляли к мелассному питающему раствору для питания дрожжей. Микроскопическое исследование раствора для выращивания дрожжей и ферментационных растворов показало снижение количества бактерий.
Спустя 40 часов после добавления было ясно, что количество бактерий в растворе для выращивания дрожжей значимо снижалось, и ферментационный раствор выглядел приблизительно нормальным. Первая ферментация с ISOHOP® завершалась. Пробы вина анализировали, и анализ показал, что количество органической кислоты уменьшалось на приблизительно 0,4% в сравнении с количеством перед добавлением ISOHOP®. Оставшийся сахар в вине при измерении показал 130 м.д., и перегонка этого материала давала нормальный выход этанола. Дрожжевые клетки в ферментере не обнаруживали флокуляции, что указывало на то, что загрязнение бактериями было низким.
После трех дней добавления 11 м.д. ISOHOP® в раствор для выращивания дрожжей и 15 м.д. в ферментер микроскопическое исследование раствора для выращивания дрожжей показало низкое количество бактерий Lactobacillus или отсутствие их, и ферментационные растворы выглядели нормальными. На основе того факта, что антибиотик виргиниамицин уменьшает количество бактерий только на 50%, кажется, что ISOHOP® работает лучше, чем виргиниамицин.
В день 4 добавление ISOHOP® в ферментер прекращали и 11 м.д. ISOHOP® добавляли в танк для выращивания дрожжей в течение следующих 48 часов. Этот раствор 11 м.д. разбавлялся до 4 м.д. при добавлении мелассного раствора в ферментер. Анализ раствора для выращивания дрожжей показало низкое количество бактерий Lactobacillus или отсутствие их и только небольшое количество кокковых бактерий, а растворы ферментера показали небольшое различие или отсутствие различия между ферментациями, которые имели 15 м.д. ISOHOP®, и ферментациями, которые непрерывно получали 4 м.д. ISOHOP® через танки для выращивания дрожжей.
Приведенное выше обсуждение является описательным, иллюстративным и приводимым в качестве примера и не должно рассматриваться как ограничивающее объем изобретения, определенный прилагаемой формулой изобретения.
Реферат
Изобретение относится к получению топливного этанола с использованием кислот хмеля. Шесть кислот хмеля альфа-кислота, бета-кислоты, изо-альфа-кислоты, ро-изо-альфа-кислоты, тетрагидроизо-альфа-кислоты и гексагидроизо-альфа-кислоты испытывали для определения, какие из них являются наиболее эффективными в ингибировании роста бактерий, обычных при получении топливного этанола. Бактериями, используемыми в этих испытаниях были Lactobacillus brevis и Lactobacillus fermentum. Минимальные ингибирующие концентрации (МИК) кислот хмеля определяли с использованием MRS-бульона, а также сред мелассного сусла и пшеничных заторов во время их ферментации. Во всех случаях кислоты хмеля контролировали рост этих двух бактерий Lactobacillus, причем тетрагидроизо-альфа-кислота, гексагидроизо-альфа-кислота и изо-альфа-кислота убивали большинство бактерий при самой низкой МИК. Обработка аппаратов для размножения дрожжей, замочных танков и ферментеров кислотами хмеля с минимальной ингибирующей концентрацией будет останавливать рост бактерий, увеличивать выход этанола и позволит избежать необходимости в антибиотиках. 4 н. и 55 з.п. ф-лы, 49 ил., 2 табл.

Комментарии