Твердые фармацевтические препаративные формы с регулируемым высвобождением на основе сульфоалкиловых эфиров циклодекстрина - RU2233176C2
Код документа: RU2233176C2
Чертежи

Описание
Область техники, к которой относится изобретение
Данное изобретение относится к твердым фармацевтическим препаративным формам с регулируемым высвобождением на основе циклодекстрина. Конкретнее оно относится к препаративным формам с регулируемым высвобождением на основе сульфоалкиловых эфиров циклодекстрина (SAE-CD), где большая часть лечебного средства не образует комплекса с SAE-CD.
Предпосылки создания изобретения
Комплексы лекарственных средств с циклодекстринами, как правило, формируют до их применения в фармацевтических композициях. Патент США №5134127 (патент '127), Stella et al., относится к сульфоалкилэфирным производным циклодекстрина (SAE-CD). Производные SAE-CD предлагается использовать в различных лекарственных формах в качестве солюбилизирующих агентов для лекарственных средств, плохо растворимых или не растворимых в воде. Патент '127 относится к композициям и препаративным формам, содержащим лекарственное средство в комплексе с производным SAE-CD, где образуется комплекс клатрат/лекарственное средство или их комплексы включения. Рассматриваемые фармацевтические препаративные формы относятся к композициям, включающим клатратный комплекс и фармацевтически приемлемый носитель. Для всех препаративных форм, описанных в патенте '127, необходимо предварительное образование комплекса "лекарственное средство/SАЕ-СD" перед получением препаративной формы.
Клатратные комплексы циклодекстрина (CD) и лекарственного средства, как правило, получают отдельно до включения в требуемую фармацевтическую препаративнну форму. Способы получения таких препаративных форм включают стадии, требующие контроля и регулирования, что может усложнить процесс получения препаративной формы. Усилия направлялись на получение препаративных форм циклодекстринов с плохо растворимыми в воде лекарственными средствами в виде физических смесей и в виде комплексов включения. Muranushi et al. (Nippon Yakurigaky Zasahi, (1988), 91(6), 377-383) сравнивали профили растворения для чистого бенексата, физической смеси бенексата и циклодекстрина и комплекса бенексата и циклодекстрина. Они сообщают о существенно возросшей растворимости бенексата в виде комплекса при сравнении с формой физической смеси или чистой формой.
Подобные результаты приводят J.J. Torres-Labandeira et al. (STP Pharma. Sci., (1994), 4(3), 235-239), согласно которым обнаружено, что биологическая доступность комплекса глиборнурида и β -циклодекстрина в два-три раза лучше, чем биологическая доступность физической смеси глиборнурида и β -циклодекстрина. D. Peri et al. (Drug. Dev. Ind. Pharm. (USA), (1994), 20(4), 1401-1410) также сообщают, что комплекс лекарственного средства и β -циклодекстрина показывает улучшенную растворимость по сравнению с физической смесью или свободным лекарственным средством в случае толнафтата. При испытании напроксена и β -циклодекстрина обнаружено, что соответствующий комплекс включения имеет раствормость за 5 мин, в шесть-девять раз превышающую растворимость физической смеси (Otero-Espinar et al., Int. J. Pharm. (Netherlands), (1991), 75(1), 37-44).
Другие свидетельства того, что комплекс включения лекарственного средства и β -циклодекстрина, как правило, обладает существенно улучшенным профилем растворения по сравнению с соответствующей физической смесью, приводят Lin et al. (Int. J. Pharm. (Netherlands), (1989), 56(3), 249-259), которые они получили при испытании комплексов и физических смесей β -циклодекстрина и ацетаминофена, индометацина, пироксикама и варфарина. Esclusa-Diaz et al. (Int. J. Pharm. (Netherlands), (1996), 142(2), 183-187) также сообщают, что комплекс кетоконазола и β -циклодекстрина имеет значительно лучшую растворимость, чем соответствующая физическая смесь.
В патенте США 4946686, McClelland et al., описывается, но не приводится примеров, другое применение физических смесей лекарственных средств и циклодекстринов. Указанная композиция создавалась только для регулируемого высвобождения лекарственного средства, где модулирующие растворимость элементы присутствовали в виде частиц с медленным высвобождением, диспергированных в смеси эксципиентов лекарственного средства. Все компоненты затем окружались микропористой водонерастворимой оболочкой.
Okimoto et al. (Pharmaceutical Research, (1998), 15(10), 1562-1568) описывают таблетку с осмотическим насосом, содержащую преднизолон, являющийся лекарственным средством, плохо растворимым в воде, и SAE-CD (SBE)7м-β -CD. Таблетку с осмотическим насосом получают посредством смешивания преднизолона и циклодекстрина в присутствии воды, что приводит к включению значительной, если не большей, части преднизолона в комплекс. Для создания таблетки с осмотическим насосом на сердцевину, содержащую лекарственное средство и циклодекстрин, наносят покрытие - полупроницаемую мембрану, содержащую порообразователь. Приведенные результаты показывают, что профиль отсроченного высвобождения обеспечивается таблеткой с осмотическим насосом до тех пор, пока присутствует полупроницаемая мембрана. Okimoto et al. также сообщают, что SAE-CD можно использовать в качестве солюбилизирующего агента и в качестве осмотического агента.
Guinchedi et al. (J. Pharm. Pharmacol., (1994) 46: p. 476-480) описывают получение композиции с высвобождением нулевого порядка, содержащей водонерастворимое лекарственное средство нафтазон, β -циклодекстрин и гипромеллозу. Способ получения указанной композиции сводится к образованию значительного количества предварительно сформированного комплекса лекарственного средства и циклодекстрина, который заметно изменяет морфологию и характеристики как лекарственного средства, так и циклодекстрина.
Chino et al. (Proceed. Intern. Symp. Control Rel. Bioact. Mater., (1992), 19: p. 98-99) описывают получение композиции с отсроченным высвобождением, содержащей лекарственное средство, циклодекстрин и гидрогель, где циклодекстрин и гидрогель или коньюгируются вместе, или смешиваются перед формированием конечной препаративной формы. В каждом примере лекарственное средство 5-FU образовывало комплекс с циклодекстрином во время получения композиции.
Mura et al. (Pharm. Acta Helv., (1992), 67(9-10), 282-288) описывают препаративные формы, включающие метил-β -циклодекстрин в сочетании с клоназепамом, в твердой композиции, где лекарственное средство и циклодекстрин вводят или не вводят в комплекс перед диспергированием или растворением в гелевой матрице. Mura et al. сообщают, что метил-β -циклодекстрин повышает скорость вытекания клоназепама из указанных гелей через липофильную мембрану, содержащую нитрат целлюлозы, пропитанный лауриловым спиртом.
Uekama et al. (J. Pharm. Sci., (1990), 79(3n): 244-248) описывают лекарственную форму с постепенным высвобождением пиретанида, представляющую собой двухслойную таблетку с первым слоем с быстрым высвобождением и вторым слоем с постепенным высвобождением, где первый слой с быстрым высвобождением содержит β -циклодекстрин в виде комплекса с пиретанидом.
Corrigan and Stanley (Pharm. Acta Helv., (1981), 56 (7): 204-208) описывают препаративную форму с регулируемым высвобождением, содержащую фенобарбитон и β -циклодекстрин или в виде предварительно образованного комплекса или в виде физической смеси. Corrigan and Stanley сообщают, что предварительно образованный комплекс показывает себя значительно лучше, чем физическая смесь, в смысле обеспечения приемлемо регулируемого растворения лекарственного средства.
Martini (Proceed. Intern. - Symp. Control. Rel. Bioact. Mater., (1993), 20: 304-305) описывает применение β -циклодекстрина для улучшения биологической доступности лекарственных средств с очень низкой водорастворимостью, но хорошей скоростью поглощения через биологические мембраны. Препаративная форма по Martini содержит физическую смесь β -циклодекстрина и лекарственного средства темазепама в виде или физической смеси, или предварительно сформированного комплекса. Только в одном из нескольких примеров Martini et al. получают композицию с физической смесью, имеющую профиль растворения, сравнимый с профилем растворения препаративной формы с предварительно сформированным комплексом.
Elger et al. в заявке на европейский патент №251459 А описывают фармацевтическую композицию с регулируемым высвобождением, содержащую лекарственное средство, водорастворимые полидекстрозу или циклодекстрин и жирный спирт или полиалкиленгликоль, где лекарственное средство и циклодекстрин могут присутствовать в виде физической смеси или комплекса включения.
Таким образом, известный уровень техники утверждает, что предварительно получаемый комплекс лекарственного средства и циклодекстрина будет, как правило, иметь значительно лучшие растворимость, профиль растворения и биологическую доступность, чем соответствующая физическая смесь. В фармацевтической промышленности упрощенные способы предпочтительнее, чем сложные, и, что касается композиций, содержащих циклодекстрин, и конкретно - композиций, содержащих SAE CD, все еще сохраняется потребность в упрощенных композициях и способах их получения. В фармацевтической области техники остается потребность в фармацевтической препаративной форме, содержащей физическую смесь лекарственного средства и циклодекстрина, обладающую профилем растворения, биологической доступностью и растворимостью, схожими с такими же характеристиками соответствующего комплекса лекарственного средства и циклодекстрина.
Краткое изложение сущности изобретения
В настоящем изобретении преодолеваются недостатки, присущие известным твердым фармацевтическим препаративным формам, содержащим физическую смесь лечебного средства и циклодекстрина. Изобретение относится к упрощенным твердым фармацевтическим композициям и препаративным формам, содержащим сульфоалкиловый эфир циклодекстрина, и способам их получения для отсроченной, пролонгированной или регулируемой доставки лечебных средств. Фармацевтические препаративные формы данного изобретения выгодно получают упрощенными способами, не требующими предварительного формирования комплексов SAE-CD с лечебными средствами перед получением препаративных форм. Препаративные формы содержат необязательное пленочное покрытие, окружающее твердую сердцевину, содержащую модификатор скорости высвобождения и физическую смесь лечебного средства и сульфоалкилового эфира циклодекстрина, которая при воздействии воды или жидкостей организма образует комплекс лечебного средства и сульфоалкилового эфира циклодекстрина. Фармацевтическая препаративная форма, содержащая физическую смесь лечебного средства и сульфоалкилового эфира циклодекстрина, будет обладать растворимостью, профилем растворения и/или биологической доступностью, приближающимися к параметрам соответствующего комплекса включения.
Препаративные формы настоящего изобретения с отсроченным высвобождением могут включать сердцевину без покрытия, содержащую матрицу с отсроченным высвобождением, сердцевину, покрытую полупроницаемой мембраной, необязательно содержащей порообразователь, и/или композицию осмотического "устройства". В одном из вариантов воплощения изобретения высвобождение SAE-CD из препаративной формы не зависит от соотношения лечебного средства и циклодекстрина в физической смеси. В другом варианте воплощения изобретения высвобождение лекарственного средства из препаративной формы с регулируемым высвобождением по изобретению зависит от соотношения "лекарственное средство/циклодекстрин", где чем меньше указанное соотношение, тем быстрее высвобождается лекарственное средство, и чем больше указанное соотношение, тем медленнее высвобождается лекарственное средство из препаративной формы изобретения. В еще одном варианте воплощения изобретения высвобождение лекарственного средства, по существу, не зависит от размера частиц SAE-CD, используемого в препаративной форме. В другом варианте воплощения изобретения присутствует модификатор скорости высвобождения в количестве, достаточном, чтобы сделать высвобождение лекарственного средства зависящим от молекулярной массы или вязкости модификатора скорости высвобождения. Еще в одном из вариантов воплощения изобретения модификатор скорости высвобождения присутствует в количестве, достаточном, чтобы сделать высвобождение лекарственного средства, по существу, не зависящим от молекулярной массы или вязкости модификатора скорости высвобождения. В другом варианте воплощения изобретения увеличение соотношения "лекарственное средство: циклодекстрин" снижает скорость высвобождения лекарственного средства и повышает скорость высвобождения SAE-CD. В другом варианте воплощения изобретения скорость высвобождения лекарственного средства, по существу, равна скорости высвобождения циклодекстрина из препаративной формы, когда соотношение "лекарственное средство/SAE-CD" приблизительно равно от 1:1 до 3:1 или примерно 2,3:1. В другом варианте воплощения изобретения повышение соотношения лекарственного средства и модификатора скорости высвобождения снижает скорость высвобождения лекарственного средства из препаративной формы. В другом варианте воплощения изобретения повышение соотношения модификатора скорости высвобождения и циклодекстрина снижает скорость высвобождения циклодекстрина.
Соответственно в одном аспекте настоящее изобретение относится к твердой фармацевтической препаративной форме, содержащей пленочное покрытие и твердую сердцевину, где пленочное покрытие содержит пленкообразователь и порообразователь, и твердая сердцевина содержит фармацевтически приемлемый носитель и физическую смесь терапевтически эффективного количества лечебного средства и сульфоалкилового эфира циклодекстрина (SAE-CD), где основная часть лечебного средства не образует комплекса с SAE-CD.
Препаративные формы настоящего изобретения являются простыми композициями, получаемыми упрощенным способом. Настоящее изобретение также относится к получению широкого интервала лекарственных форм с уникальными свойствами.
В одном из вариантов воплощения изобретения сульфоалкиловый эфир циклодекстрина представляет собой соединение формулы (I)
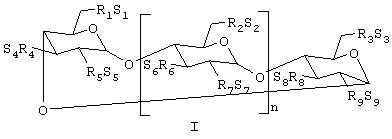
где n равен 4, 5 или 6;
R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляют собой, каждый независимо, -О- или -О-((С2-С6)-алкилен)-SО3-группу, где по меньшей мере один из R1 и R2 независимо представляет -О-((С2-С6 )-алкилен)-SO3- группу, предпочтительно - -О-(СН2)m-SО3-группу, где m равен 4 (например, -OCH2CH2CH2SO3 - или -ОСН2СН2СН2СН2S03-); и
S1, S2, S3, S4, S5, S6, S7, S8 и S9 представляют, каждый независимо, фармацевтически приемлемый катион, которым являются, например, Н+, ионы щелочных металлов (например, Li+, Na+, K+), щелочно-земельных металлов (например, Са+2, Mg+2), аммония и катионы аминов, такие как катионы (C1-C6)-алкиламинов, пиперидина, пиразина, (C1-C6)-алканоламина и (C4-C8)-циклоалканоламина.
Пленочное покрытие служит для регулирования высвобождения лечебного средства и SAE-CD из твердой сердцевины. Пленкообразователь является основным компонентом пленочного покрытия и, как правило, служит для постепенного высвобождения лечебного средства и/или SAE-CD. Предполагается применение самых разных пленкообразователей. Порообразователь служит для повышения проницаемости пленочного покрытия за счет или образования пор, или создания участков повышенной водопроницаемости в пленке, образованной пленкообразователем.
В другом аспекте настоящее изобретение относится к упрощенному способу получения твердых фармацевтических препаративных форм, содержащих сульфоалкилэфирное производное циклодекстрина. Таким образом, изобретение относится к способу получения фармацевтической твердой лекарственной формы, содержащей SAE-CD, включающему стадии образования твердой сердцевины, содержащей физическую смесь сульфоалкилэфирного производного циклодекстрина формулы (I), фармацевтически приемлемого носителя и эффективного количества лечебного средства, основная часть которого не образует комплекса с сульфоалкилэфирным производным циклодекстрина; и
нанесения на твердую сердцевину покрытия из пленкообразующего средства, содержащего пленкообразователь и порообразователь, для создания фармацевтически приемлемой твердой лекарственной формы.
Способ настоящего изобретения не требует, чтобы в лекарственной форме предварительно, перед введением лекарственной формы, был сформирован комплекс лечебного средства и сульфоалкилового эфира циклодекстрина. Таким образом, основная часть лечебного средства в конечной лекарственной форме будет оставаться в форме, не связанной в комплексе. Наличие порообразователя в покрытии позволяет указанной препаративной форме доставлять лечебное средство путем диффузии через покрытие.
Еще в одном своем аспекте изобретение относится к способу изменения биологической доступности и/или биоабсорбции лечебных средств. Так, в одном из вариантов воплощения настоящее изобретение относится к способу изменения биологической доступности или скорости биоабсорбции лечебного средства, включающему стадии предоставления сульфоалкилового эфира циклодекстрина и лечебного средства, большая часть которого не образует комплекса с сульфоалкиловым эфиром циклодекстрина, и введения пациенту лечебного средства и сульфоалкилового эфира циклодекстрина, причем указанный сульфоалкиловый эфир циклодекстрина изменяет биологическую доступность или скорость биоабсорбции указанного лечебного средства.
Сульфоалкиловый эфир циклодекстрина и лечебное средство предпочтительно, но необязательно, находятся в одинаковых лекарственных формах. Необходимо только, чтобы SAE-CD и лечебное средство образовывали комплекс после введения пациенту. Подходящая лекарственная форма, содержащая как SAE-CD, так и лечебное средство, будет допускать гидратацию физической смеси лечебного средства и SAE-CD, в то время как сама лекарственная форма гарантирует правильное образование комплекса "лечебное средство: SAE-CD". В некоторых вариантах препаративной формы по настоящему изобретению используется широкий ряд лечебных средств, в том числе водорастворимые гидрофильные и плохо растворимые в воде гидрофобные лечебные средства.
Фармацевтические препаративные формы, описанные в изобретении, также могут содержать один или несколько дополнительных адъювантов и/или активных ингредиентов, выбранных из известных в технике, в том числе корригенты, разбавители, красители, связующие вещества, наполнители, вещества, облегчающие скольжение, смазывающие вещества, антистатики, буферные вещества, антиоксиданты, консерванты, поверхностно-активные вещества, дезинтегрирующие агенты, биоадгезивы, усилители проникания, стабилизаторы ингибиторов протеаз и уплотняющие наполнители.
Еще в одном из вариантов воплощения изобретение относится к твердой фармацевтической препаративной форме с регулируемым высвобождением, способной доставлять лечебное средство с регулируемой скоростью даже в отсутствие окружающего сердцевину покрытия, модифицирующего скорость высвобождения. Соответственно в одном из вариантов изобретение относится к твердой фармацевтической препаративной форме с регулируемым высвобождением, состоящей, по существу, из сердцевины, содержащей физическую смесь лечебного средства; по меньшей мере одного сульфоалкилового эфира циклодекстрина; по меньшей мере одного модификатора скорости высвобождения и по меньшей мере одного фармацевтически приемлемого эксципиента, где большая часть лечебного средства не образует комплекса с сульфоалкиловым эфиром циклодекстрина; и лечебное средство высвобождается из сердцевины с регулируемой скоростью в отсутствие окружающего сердцевину покрытия, модифицирующего скорость высвобождения.
В указанном варианте по меньшей мере один компонент из числа сульфоалкилового эфира циклодекстрина и модификатора скорости высвобождения ответственен за высвобождение лечебного средства с регулируемой скоростью. Указанная препаративная форма с регулируемым высвобождением также может содержать одно или несколько покрытий, которые также модифицируют подачу лечебного средства, что делает препаративную форму формой с пролонгированным высвобождением, направленным высвобождением, высвобождением в определенное время, отсроченным высвобождением или даже системой с высвобождением, регулируемым еще точнее.
Другой вариант изобретения относится к фармацевтической препаративной форме с регулируемым высвобождением, содержащей покрытие, модифицирующее скорость высвобождения, не требующее порообразователя. Соответственно еще один вариант воплощения изобретения относится к твердой фармацевтической препаративной форме с регулируемым высвобождением, содержащей сердцевину, содержащую физическую смесь лечебного средства и по меньшей мере одного сульфоалкилового эфира циклодекстрина, где большая часть лечебного средства не образует комплекса с сульфоалкиловым эфиром; и покрытие, окружающее указанную сердцевину и состоящее из одного или нескольких пленкообразователей, где указанное лечебное средство высвобождается из указанной сердцевины с регулируемой скоростью в отсутствие порообразователя в указанном покрытии.
В указанном конкретном варианте воплощения изобретения сердцевина также может содержать модификатор скорости высвобождения, способный изменять скорость, с которой лечебное средство высвобождается из сердцевины. Когда покрытие представляет собой полупроницаемую мембрану, т.е. со сквозными каналами, препаративная форма изобретения представляет собой устройство по типу осмотического насоса.
Еще один вариант воплощения изобретения относится к многослойной фармацевтической препаративной форме с регулируемым высвобождением, для которой не требуется предварительного образования комплекса лечебного средства и циклодекстрина. Соответственно в таком варианте настоящее изобретение относится к многослойной твердой фармацевтической препаративной форме с регулируемым высвобождением, содержащей по меньшей мере два слоя, выбранных из числа по меньшей мере одного первого слоя, содержащего физическую смесь лечебного средства и сульфоалкилового эфира циклодекстрина, и по меньшей мере одного отличающегося второго слоя, содержащего модификатор скорости высвобождения, где указанные первый и второй слои накладываются один на другой; указанное лечебное средство высвобождается из указанной сердцевины с регулируемой скоростью, и большая часть указанного лечебного средства не образует комплекса с указанным сульфоалкиловым эфиром циклодекстрина.
Согласно данному варианту, препаративная форма может содержать два или большее число различных слоев и предпочтительно будет содержать первый слой, содержащий по меньшей мере лечебное средство и сульфоалкиловый эфир, окруженный двумя другими слоями, содержащими по меньшей мере модификатор скорости высвобождения.
Еще один аспект изобретения относится к многослойной твердой фармацевтической препаративной форме с комбинированным быстрым и регулируемым высвобождением, содержащей по меньшей мере один первый слой с регулируемым высвобождением, содержащий физическую смесь первого лечебного средства, модификатора скорости высвобождения и сульфоалкилового эфира циклодекстрина для высвобождения указанного первого лечебного средства с регулируемой скоростью в первую окружающую среду применения; и по меньшей мере один второй слой с быстрым высвобождением, содержащий предварительно сформированный комплекс второго лечебного средства и сульфоалкилового эфира циклодекстрина для высвобождения указанного второго лечебного средства, по существу, сразу же во вторую окружающую среду применения, где указанные первый и второй слои накладываются один на другой и большая часть указанного первого лечебного средства не образует комплекса с указанным сульфоалкиловым эфиром циклодекстрина.
Еще один аспект изобретения относится к твердой фармацевтической препаративной форме с сочетанием быстрого и регулируемого высвобождения, содержащей физическую смесь первой группы частиц, содержащих физическую смесь первого лечебного средства, модификатора скорости высвобождения и сульфоалкилового эфира циклодекстрина для высвобождения указанного первого лечебного средства с регулируемой скоростью в первую окружающую среду применения, и второй группы частиц, содержащих комплекс включения второго лечебного средства и сульфоалкилового эфира циклодекстрина для быстрого высвобождения указанного второго лечебного средства во вторую окружающую среду применения.
В еще одном варианте воплощения изобретения препаративная форма с регулируемым высвобождением представляет собой осмотическую твердую препаративную форму (осмотический насос), поставляющую лекарственное средство регулируемым способом путем диффузии лекарственного средства через мембрану и осмоса лекарственного средства через каналы в мембране. Комбинированная диффузионная и осмотическая регулируемая доставка лекарственного средства может быть достигнута с помощью формы типа осмотического насоса, содержащей сердцевину, содержащую физическую смесь сульфоалкилового эфира циклодекстрина, лечебного средства и фармацевтически приемлемого носителя, и мембрану, окружающую указанную сердцевину и содержащую пленкообразователь и порообразователь, причем поэтому указанная мембрана имеет каналы для сообщения указанной сердцевины с окружающей средой применения; первая часть указанного лечебного средства диффундирует через указанную мембрану, а вторая часть указанного лечебного средства проходит через указанные каналы и большая часть указанного лечебного средства не образует комплекса с указанным суьфоалкиловым эфиром циклодекстрина.
Мембрана осмотического насоса имеет предварительно установленный состав и/или толщину, которые изменяются для регулирования подачи лечебного средства. В одном из вариантов воплощения изобретения мембрана имеет такую толщину и такой состав, что диффузия лечебного средства через мембрану усиливается. В другом варианте мембрана имеет такую толщину и такой состав, что усиливается осмос лечебного средства через каналы в мембране.
Хотя каждая из описанных выше фармацевтических препаративных форм по изобретению включает фармацевтическую композицию, содержащую физическую смесь лечебного средства и сульфоалкилового эфира циклодекстрина, где большая часть лечебного средства не образует комплекса с сульфоалкиловым эфиром циклодекстрина, препаративные формы настоящего изобретения также могут включать еще другие композиции, содержащие комплекс лечебного средства и сульфоалкилового эфира циклодекстрина. Соответственно каждая из указанных препаративных форм может включать первую композицию, содержащую лекарственное средство и циклодекстрин не в форме комплекса, и вторую композицию, содержащую лекарственное средство и циклодекстрин в форме комплекса. Специалистам в этой области техники следует иметь в виду, что вторая композиция, содержащая комплекс лекарственного средства и циклодекстрина, является композицией или с быстрым высвобождением, или с регулируемым высвобождением, но будет использоваться предпочтительно как композиция с быстрым высвобождением для обеспечения немедленного высвобождения лечебного средства, посредством чего у пациента, которому ввели указанную композицию, быстро возрастает содержание лечебного средства в плазме.
После рассмотрения настоящего описания специалисту в этой области техники будет понятно, что соотношение сульфоалкилового эфира циклодекстрина и лекарственного средства также используется для регулирования подачи лекарственного средства.
Другие особенности, преимущества и варианты воплощения изобретения станут очевидны для специалистов в этой области техники из последующего описания, примеров и прилагаемой формулы изобретения.
Краткое описание чертежей
Описанные далее чертежи составляют часть настоящего описания и предназначены только для иллюстрации некоторых аспектов изобретения. Изобретение можно лучше понять, обратившись к одному или нескольким чертежам в сочетании с подробным описанием представленных конкретных вариантов воплощения изобретения.
Фиг.1. Профили высвобождения для препаративных форм, содержащих метилпреднизолон и SBE7β-CD.
Фиг.2а и 2b. Профили высвобождения для препаративных форм, содержащих физическую смесь и высушенный вымораживанием комплекс метилпреднизолона и SBE7β-CD.
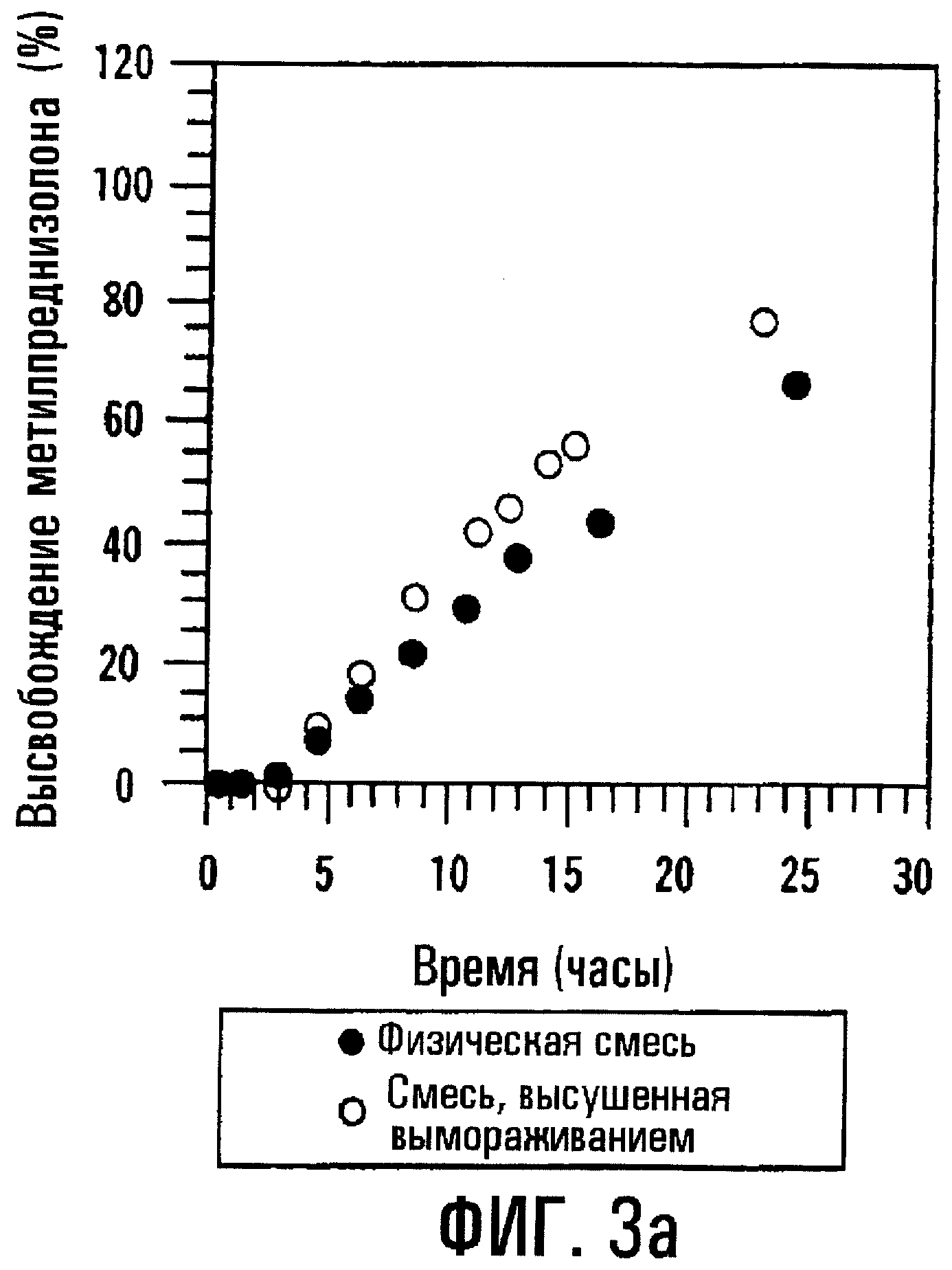
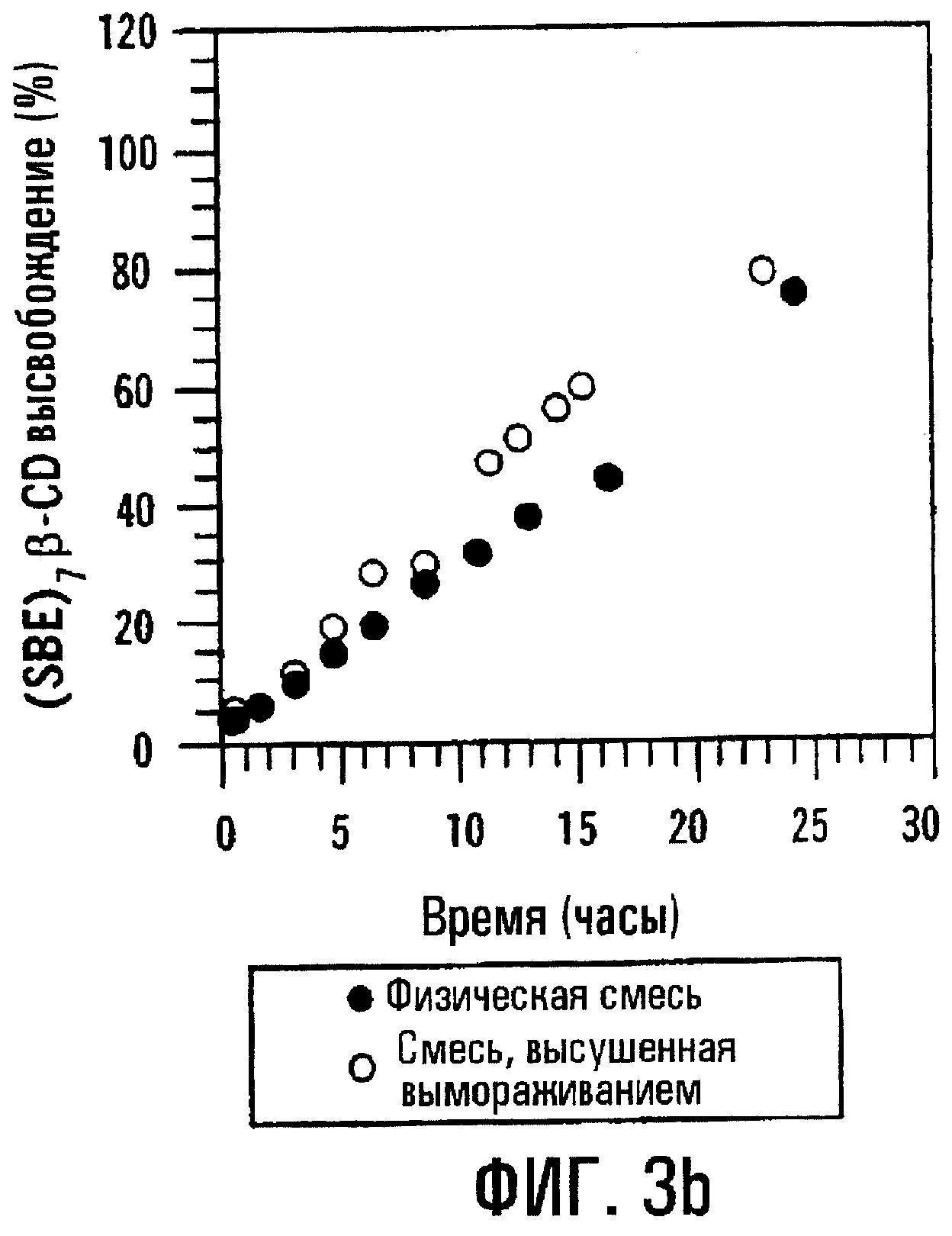
Фиг.3а и 3b. Профили высвобождения метилпреднизолона (МР) и SBE7β-CD из препаративных форм, содержащих физическую смесь и высушенный вымораживанием комплекс, имеющих пленочное покрытие 200 мкм.
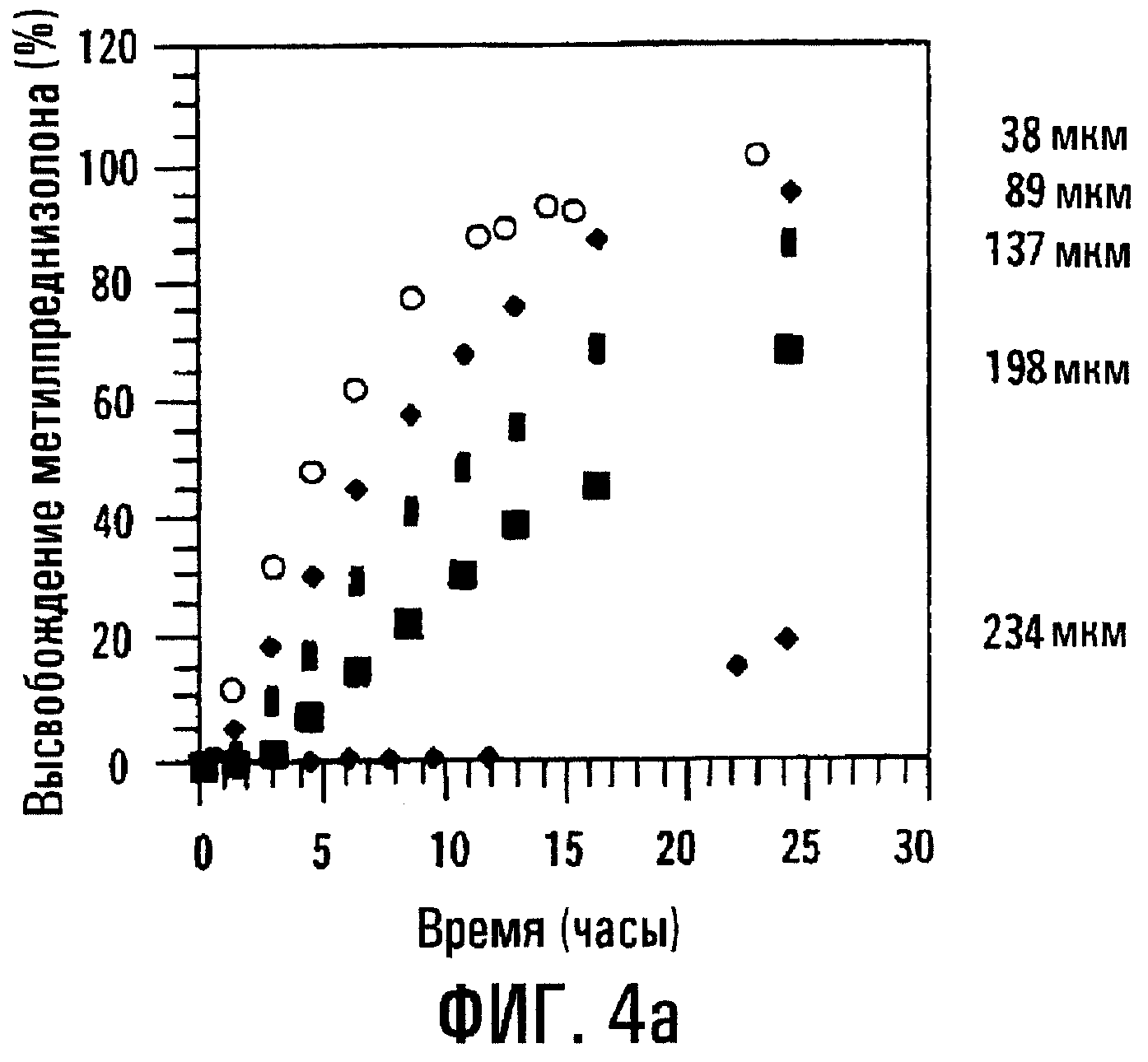
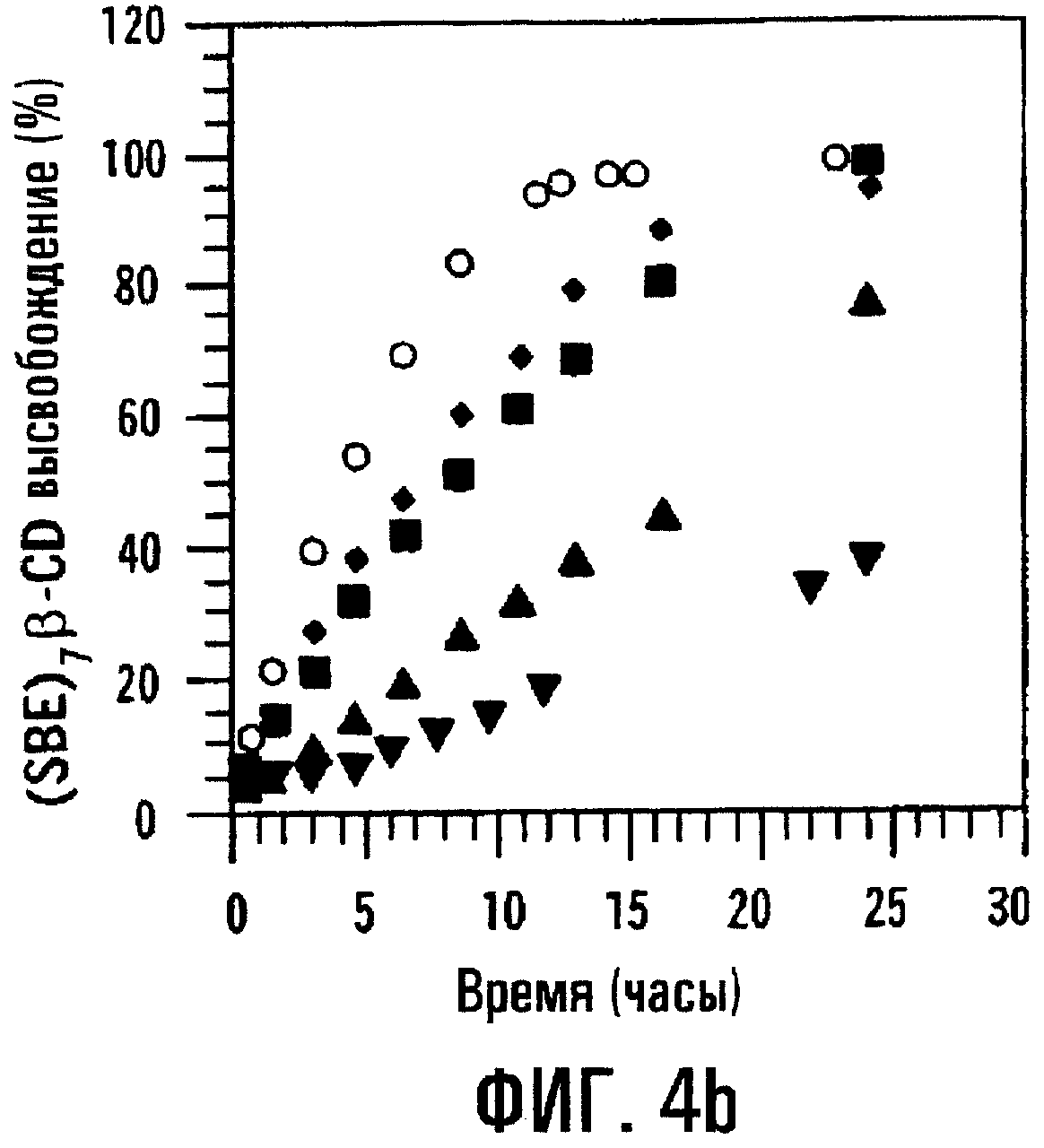
Фиг.4а и 4b. Влияние толщины пленки на профили высвобождения МР и SBE7β-CD из таблетки с пленочным покрытием.
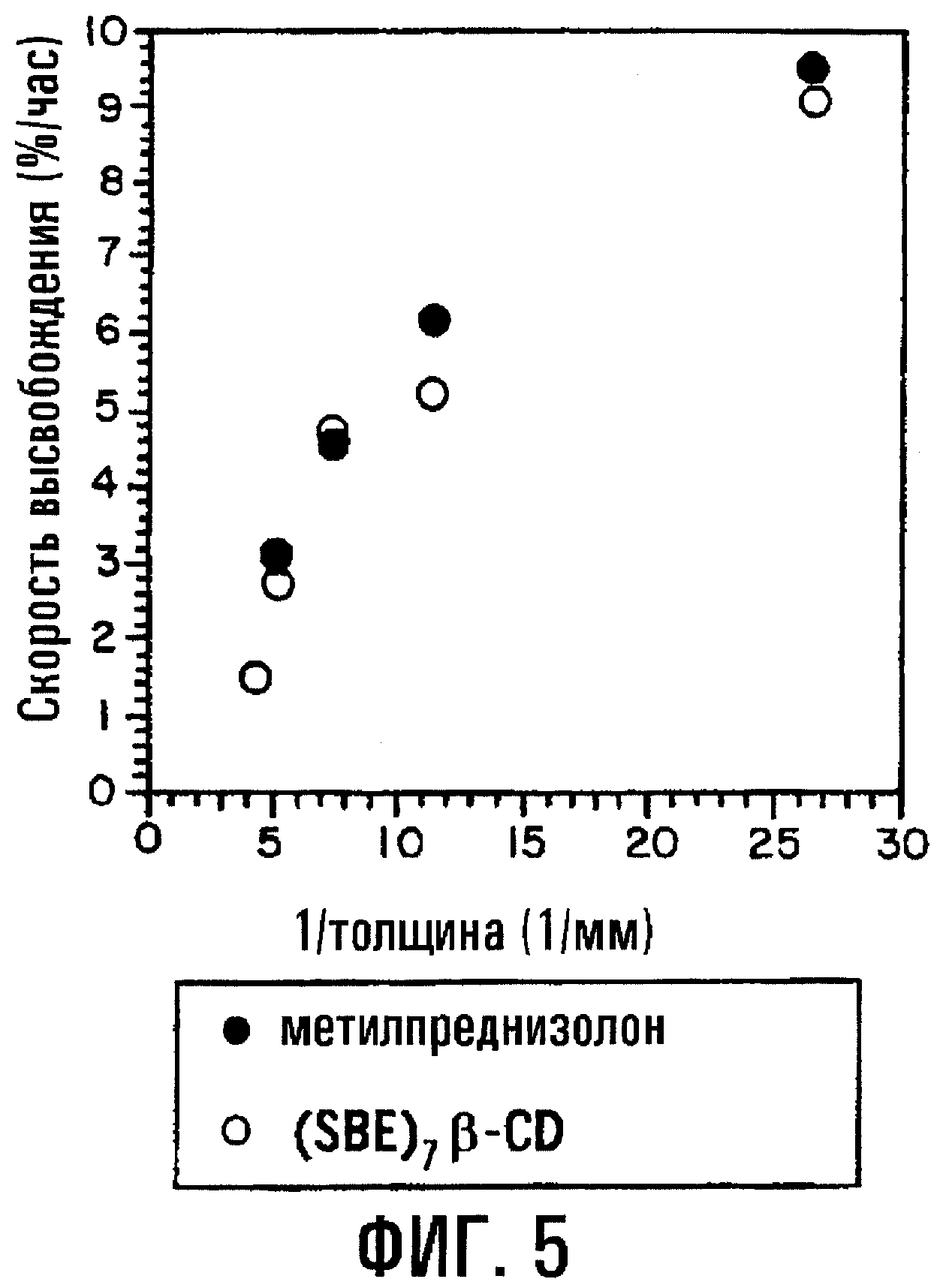
Фиг.5. Соотношение между скоростью высвобождения МР и SBE7β-CD и величиной, обратной толщине пленки, для таблетки с физической смесью.
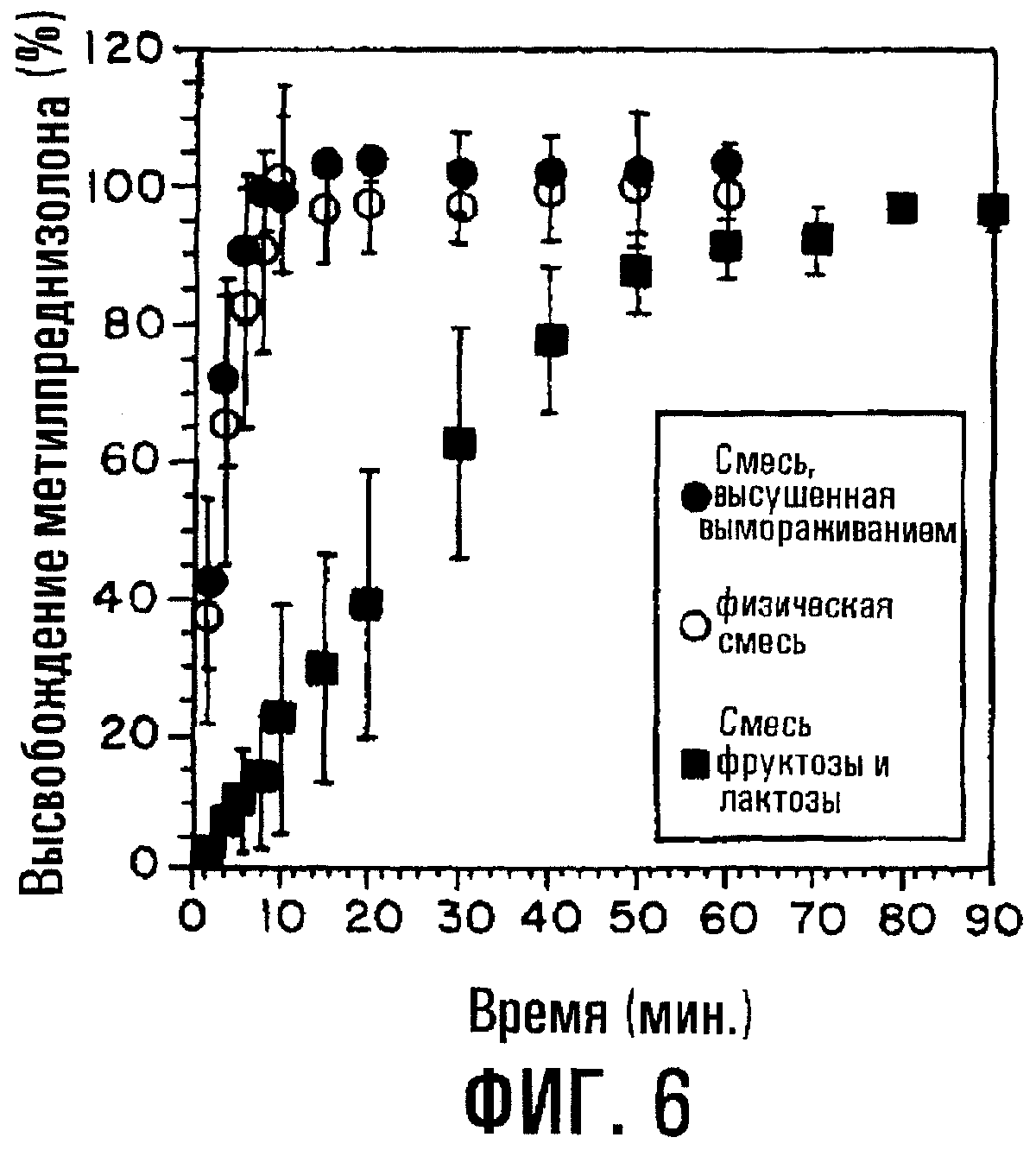
Фиг.6. Влияние SBE7β-CD на высвобождение МР из сердцевины таблетки без покрытия, содержащей или высушенный вымораживанием комплекс, или физическую смесь. Также приводятся данные для контроля, где SBE7β-CD отсутствует.
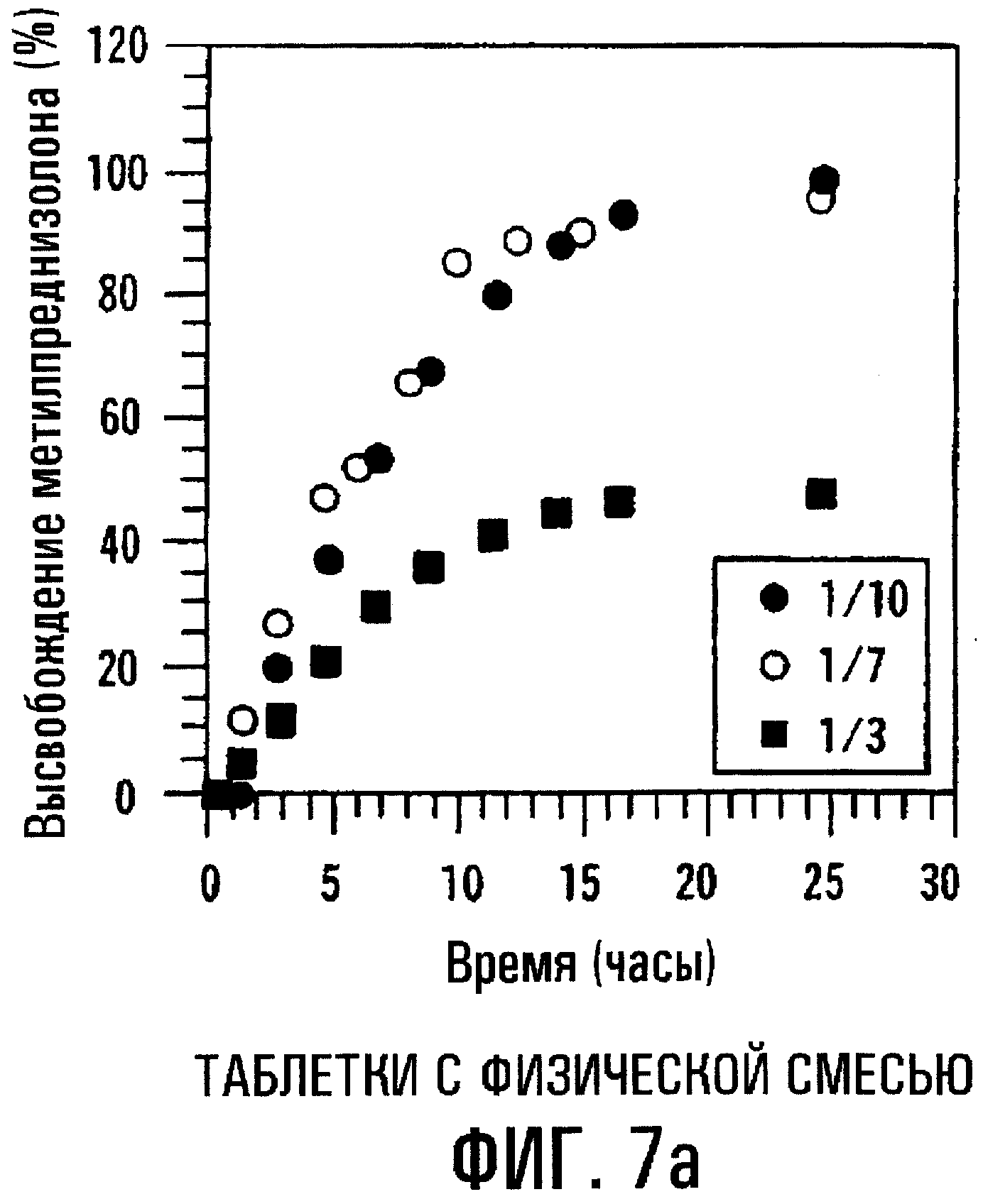
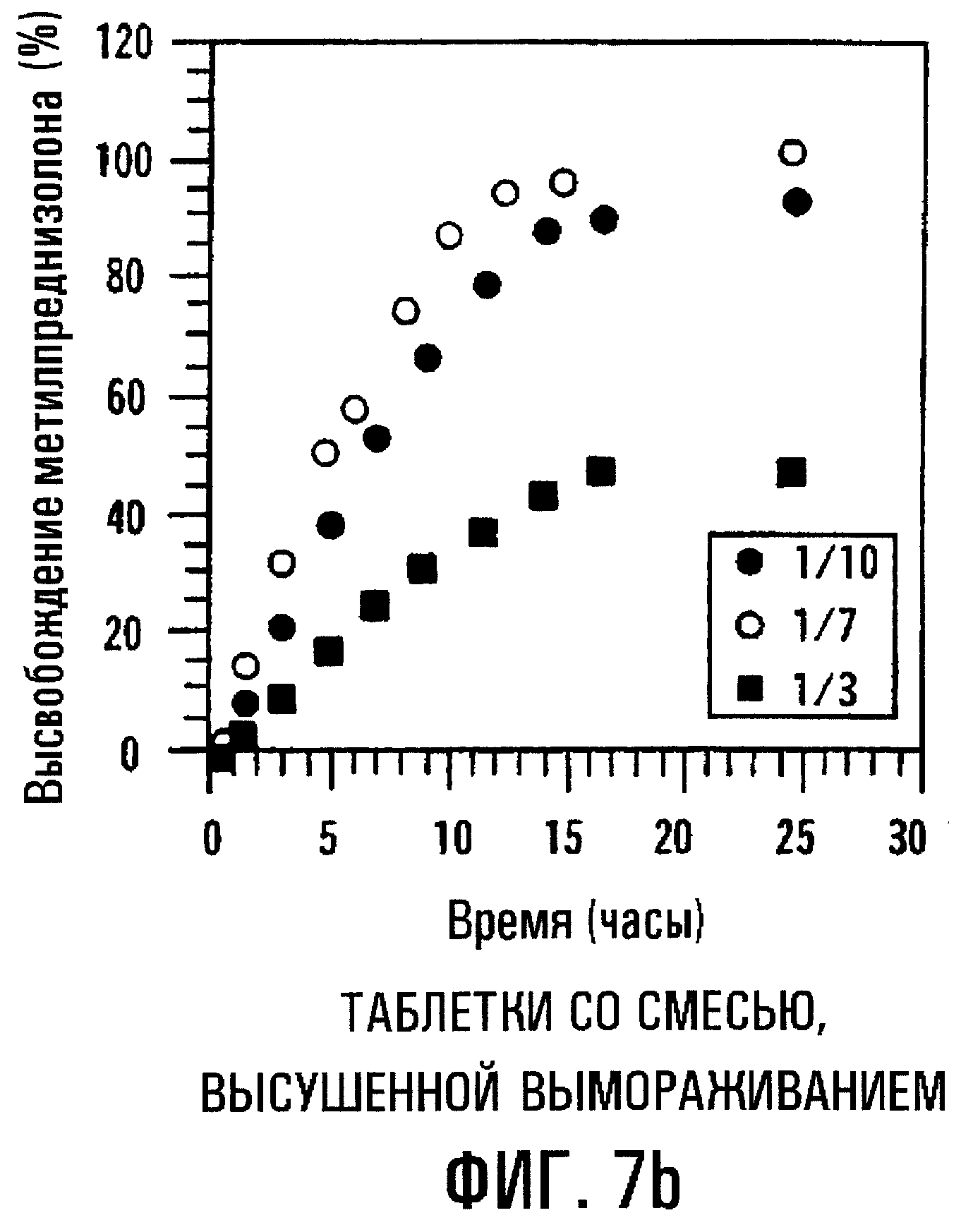
Фиг.7а и 7b. Влияние молярного соотношения MP/SBE7β-CD на высвобождение МР из сердцевин таблеток с пленочным покрытием, содержащих физическую смесь или высушенный вымораживанием комплекс.
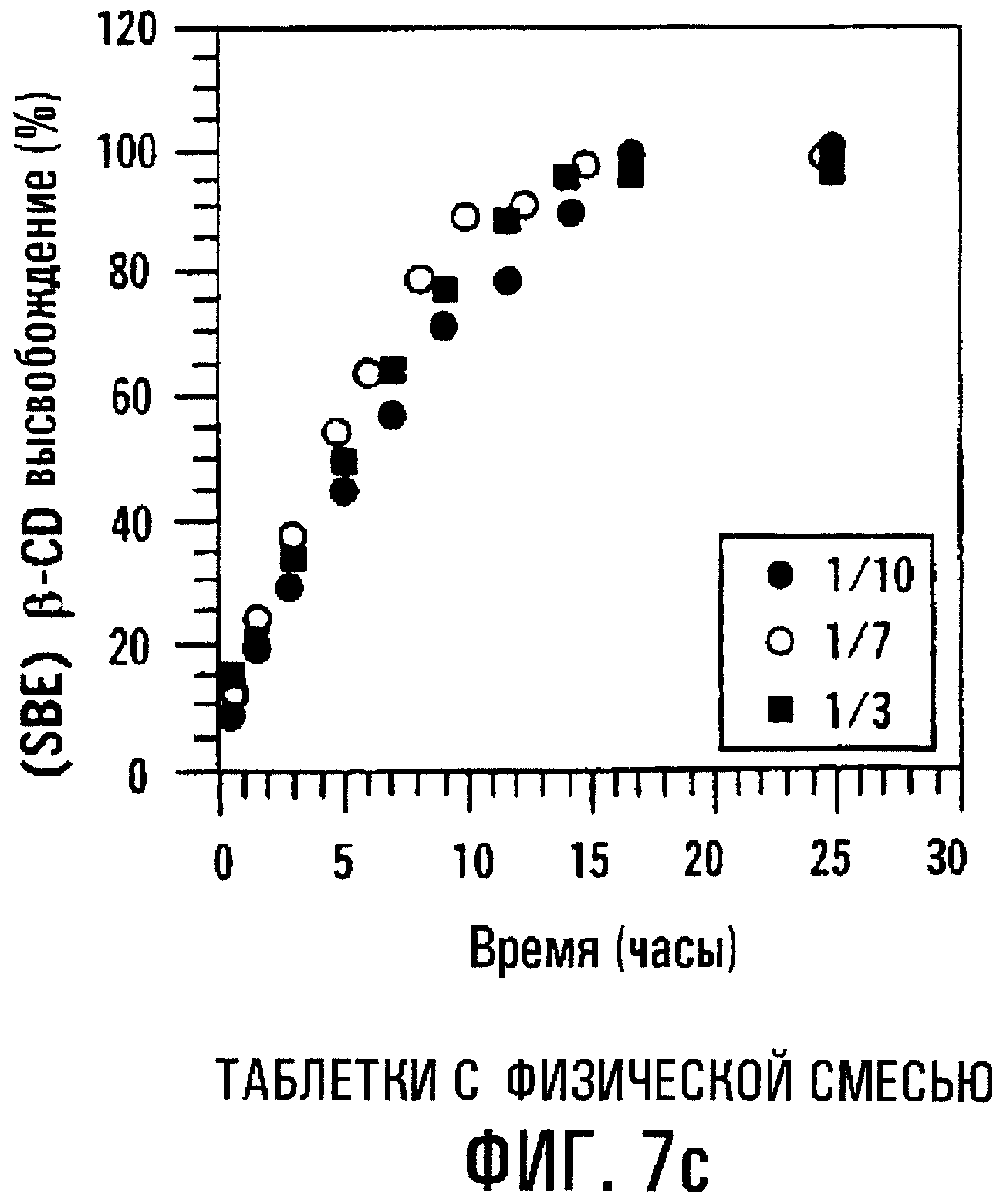
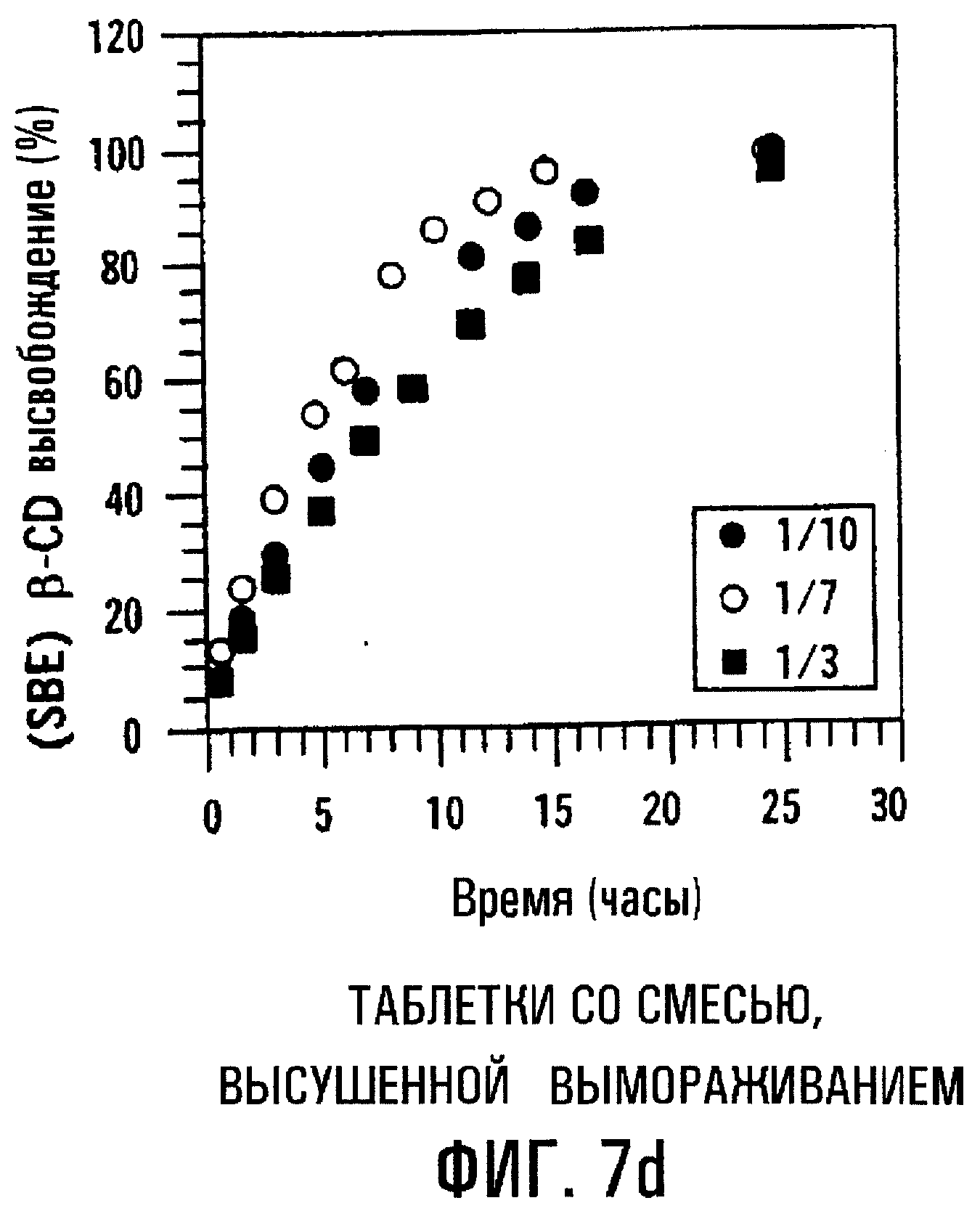
Фиг.7с и 7d. Влияние молярного соотношения MP/SBE7β-CD на профиль высвобождения SBE7β-CD из сердцевин таблеток с пленочным покрытием, содержащих физическую смесь или высушенный вымораживанием комплекс.
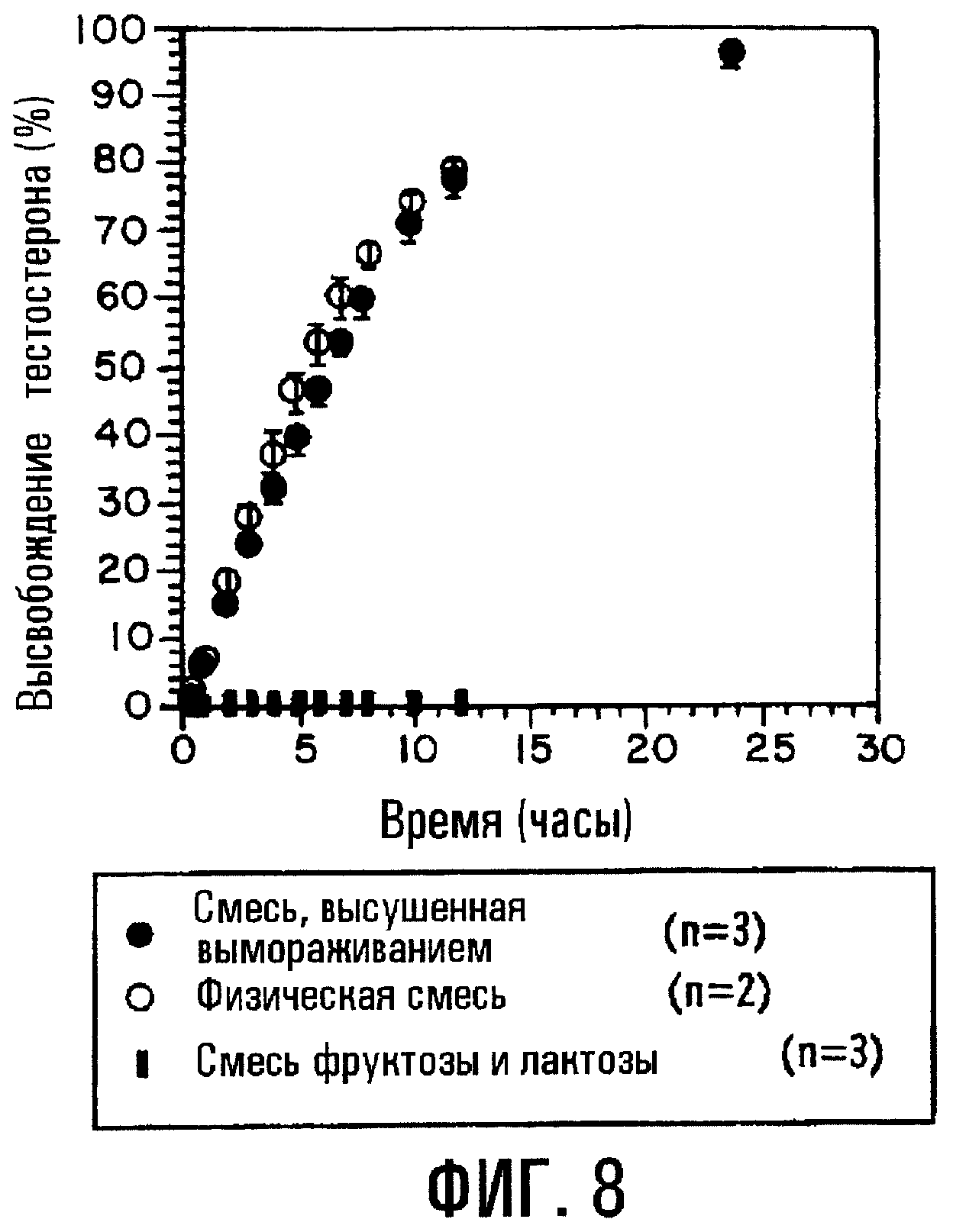
Фиг.8. Профиль высвобождения для композиций таблеток с регулируемым высвобождением с тестостероном/8ВЕ7β-СD.
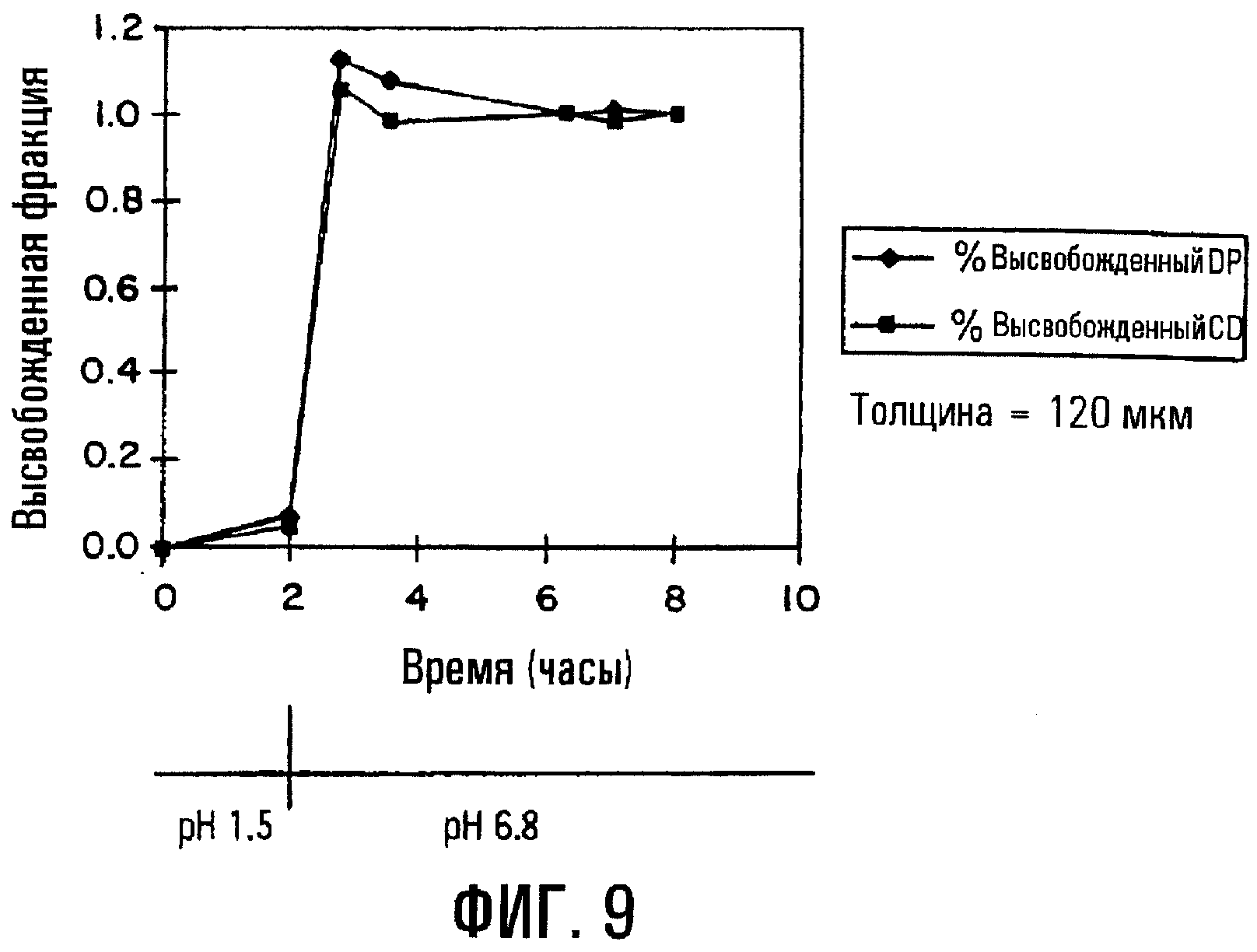
Фиг.9. Профиль высвобождения для препаративной формы с пролонгированным высвобождением дипиридамола (DP) из сердцевины таблетки, содержащей физическую смесь DP и SBE7β-CD, с мембранным покрытием (толщина 120 мкм) из EUDRAGITTM-L и мочевины.
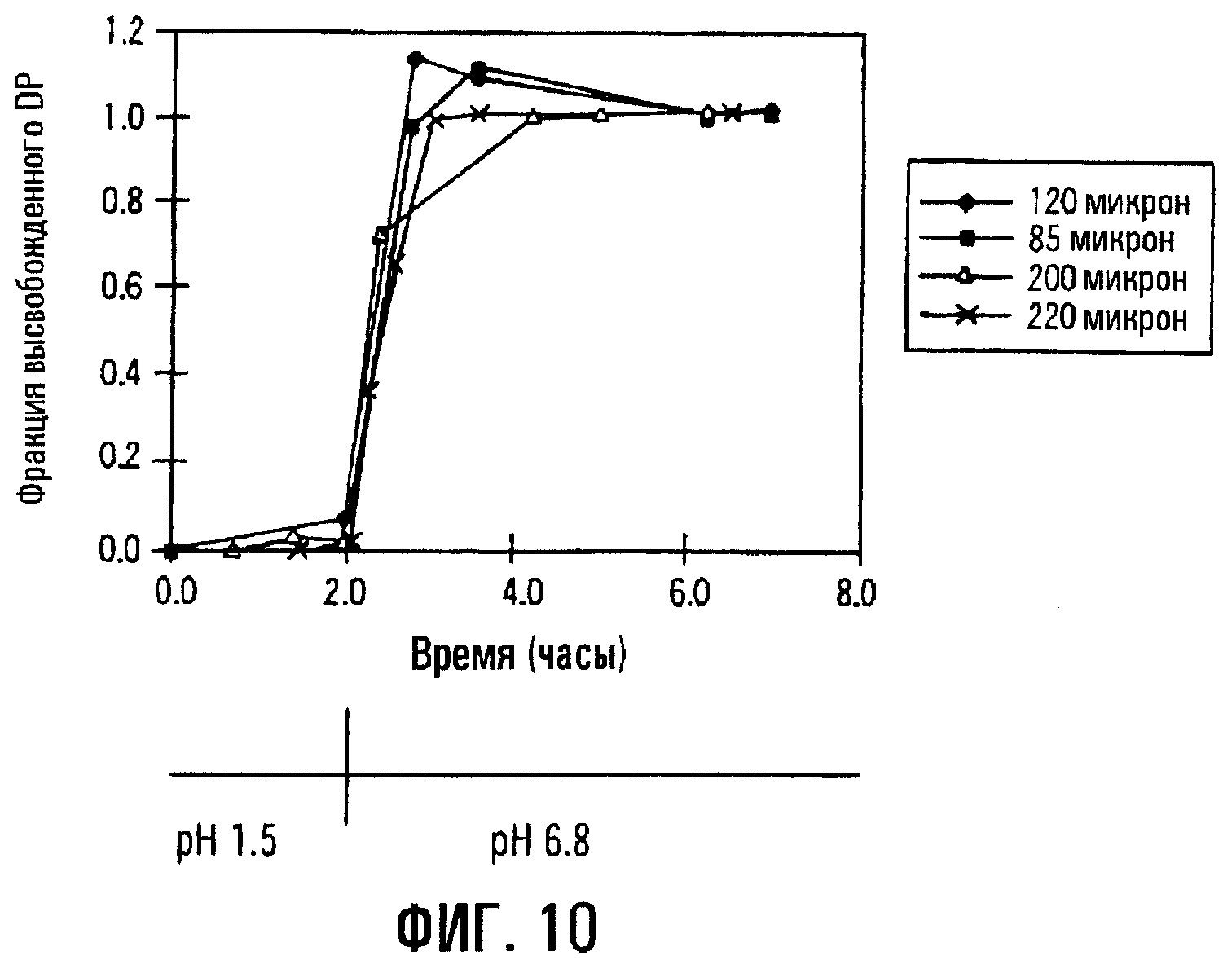
Фиг.10. Влияние толщины пленки на высвобождение DP из сердцевины таблетки, содержащей физическую смесь DP и SBE7β-CD, с мембранным покрытием из EUDRAGITTM-L и мочевины.
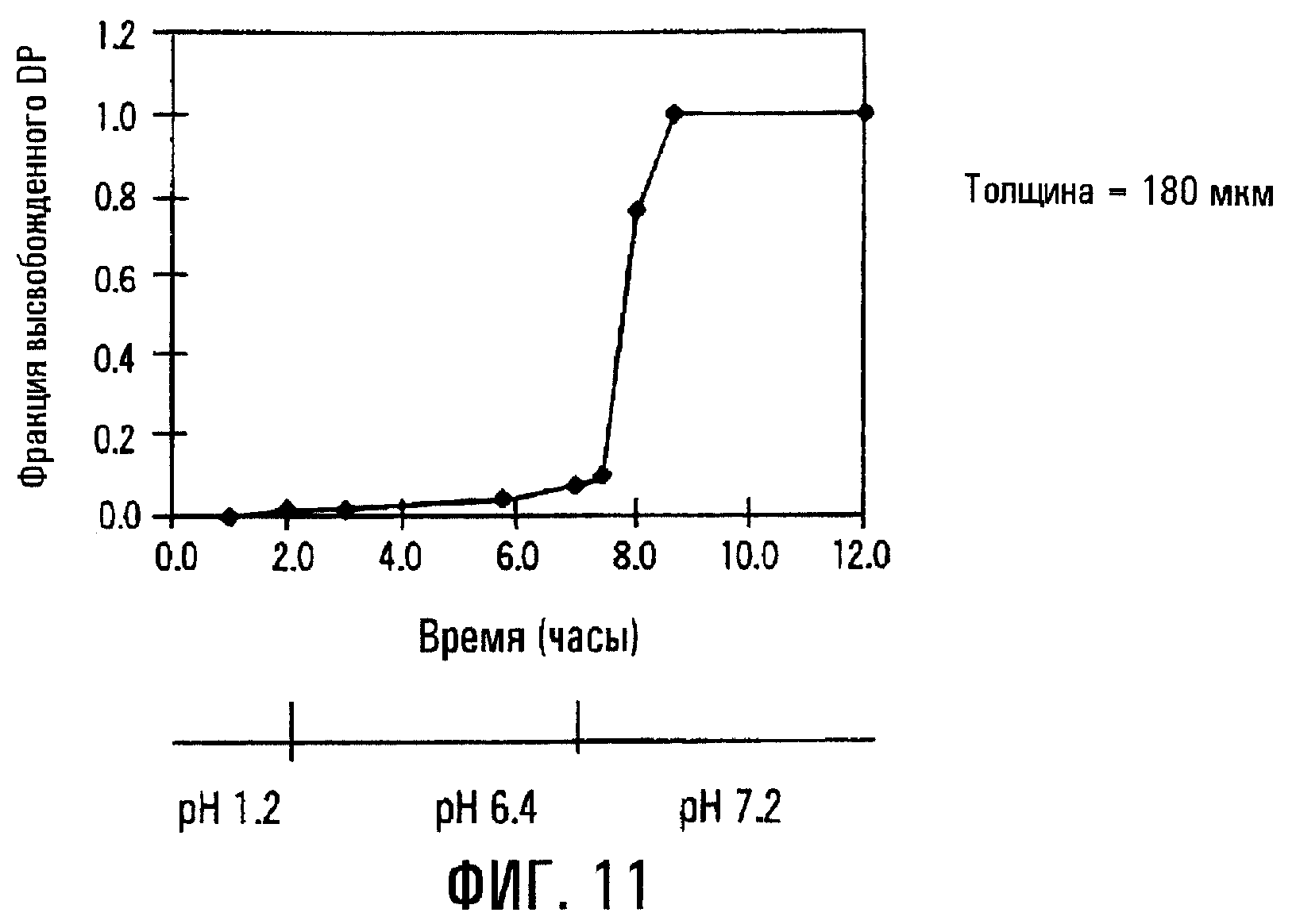
Фиг.11. Профиль высвобождения DP через пленочное покрытие толщиной 180 мкм из EUDRAGITTM-S и мочевины, окружающее сердцевину таблетки, содержащей физическую смесь DP и SBE7β-CD.
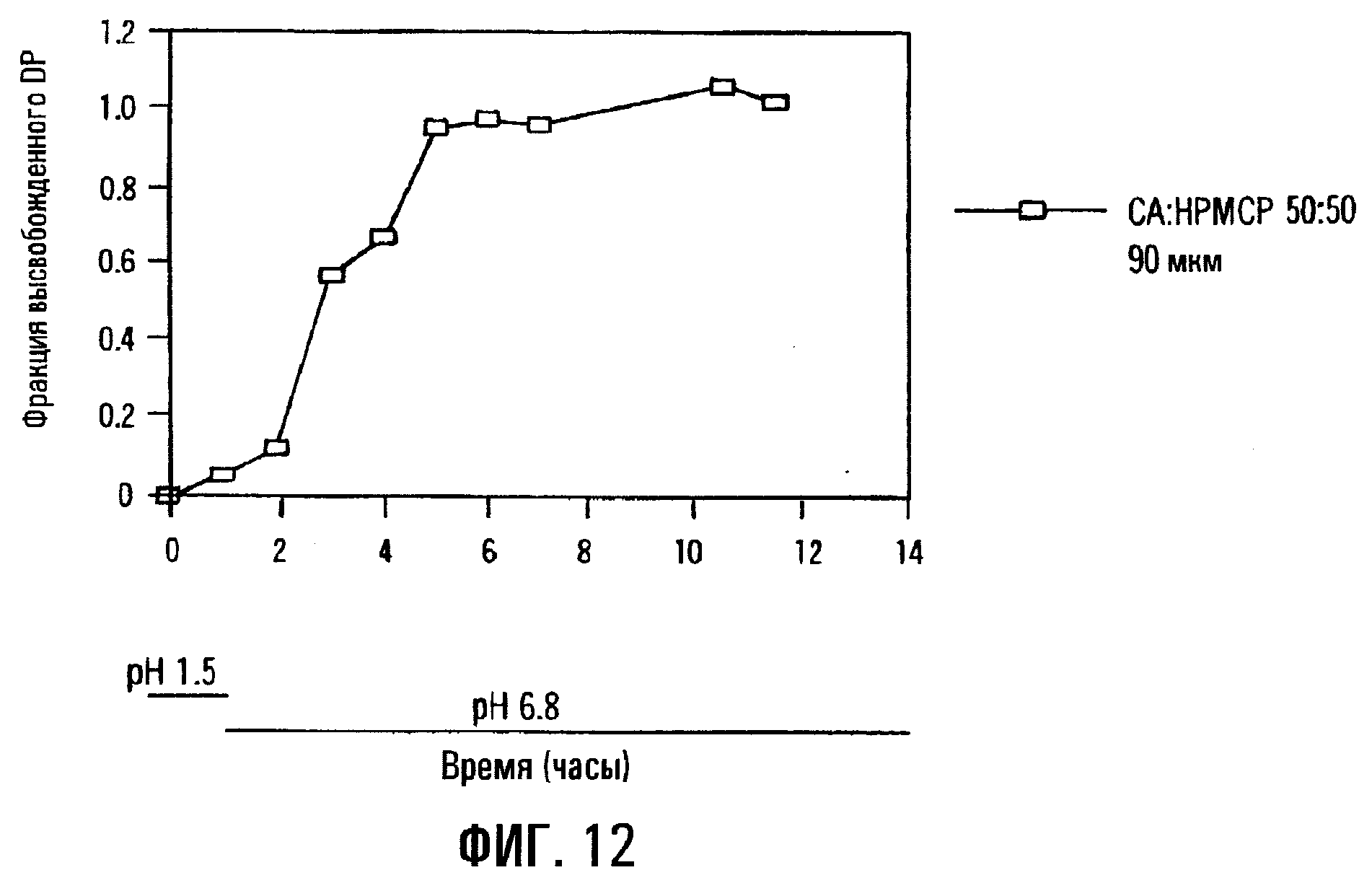
Фиг.12. Профиль высвобождения DP из сердцевины таблетки, содержащей физическую смесь DP и SBE7β-CD, с пленочным покрытием из ацетата целлюлозы (СА) и фталата гидроксипропилметилцеллюлозы (НРМСР) толщиной 90 мкм.
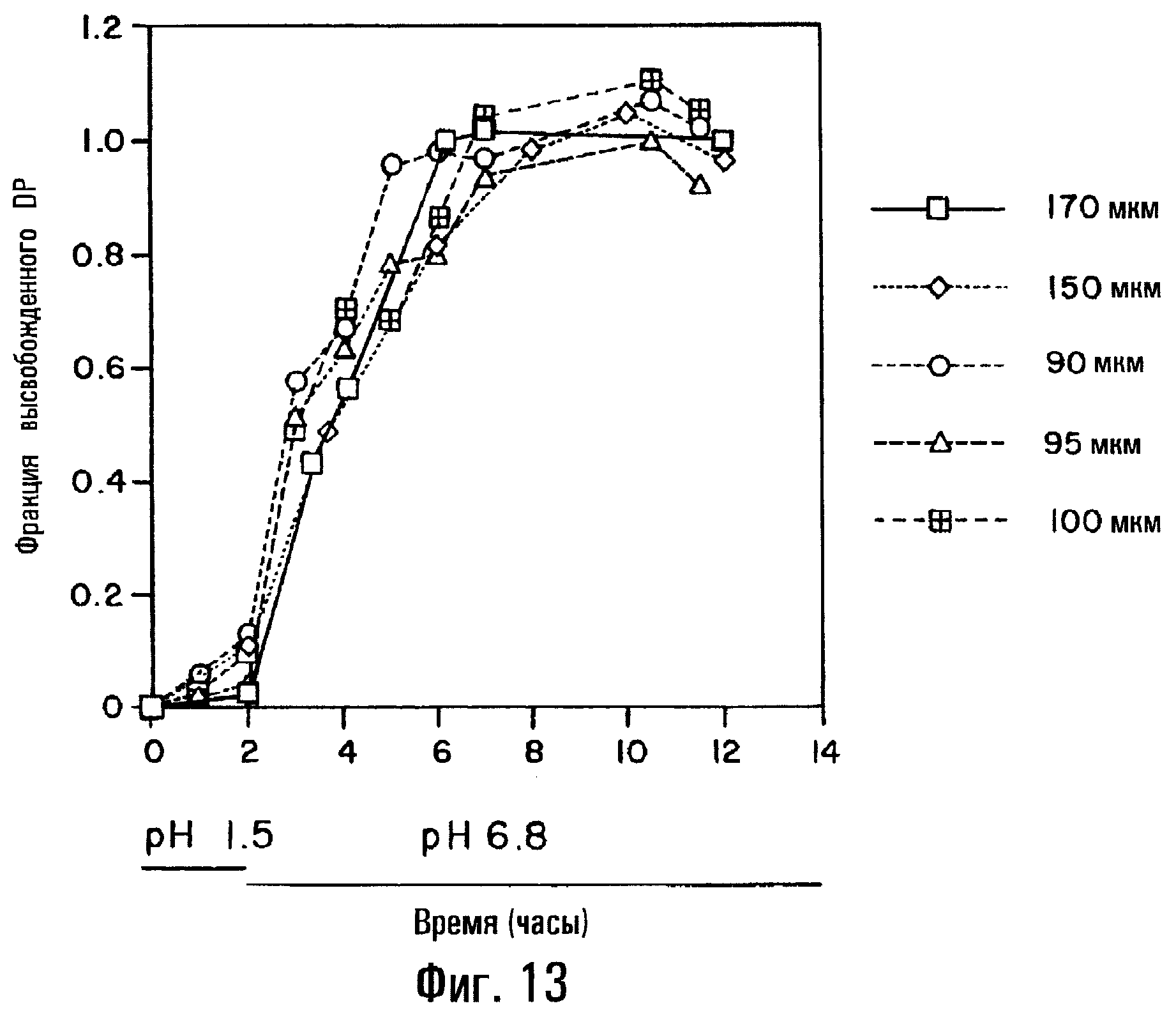
Фиг.13. Влияние толщины пленки на высвобождение DP из таблетки, содержащей физическую смесь DP и SBE7β-CD, покрытой пленкой из СА и НРМСР (50:50).
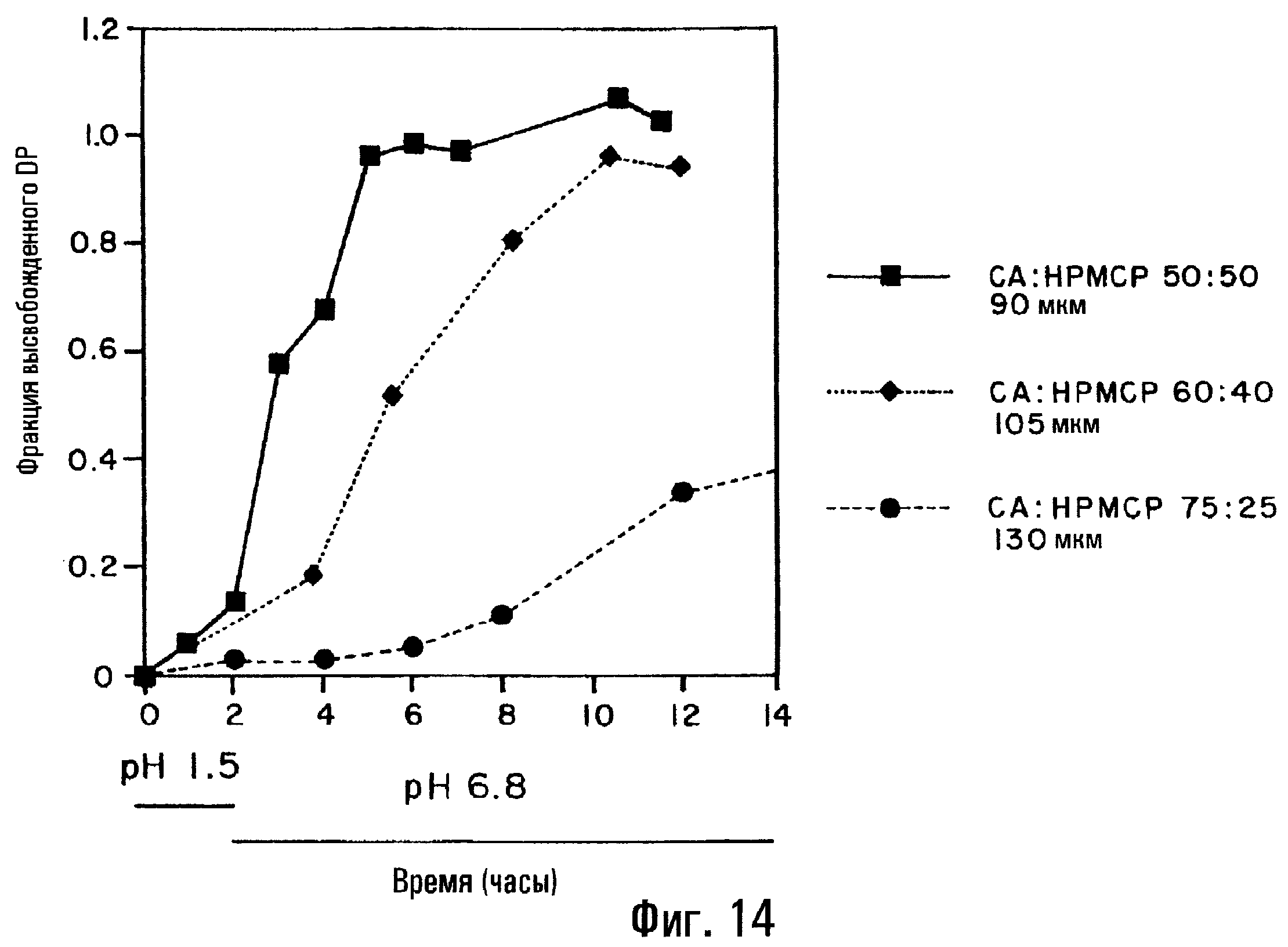
Фиг.14. Профили высвобождения DP из таблеток с комбинированным профилем пролонгированного и регулируемого высвобождения и влияние на них толщины пленки и состава пленки.
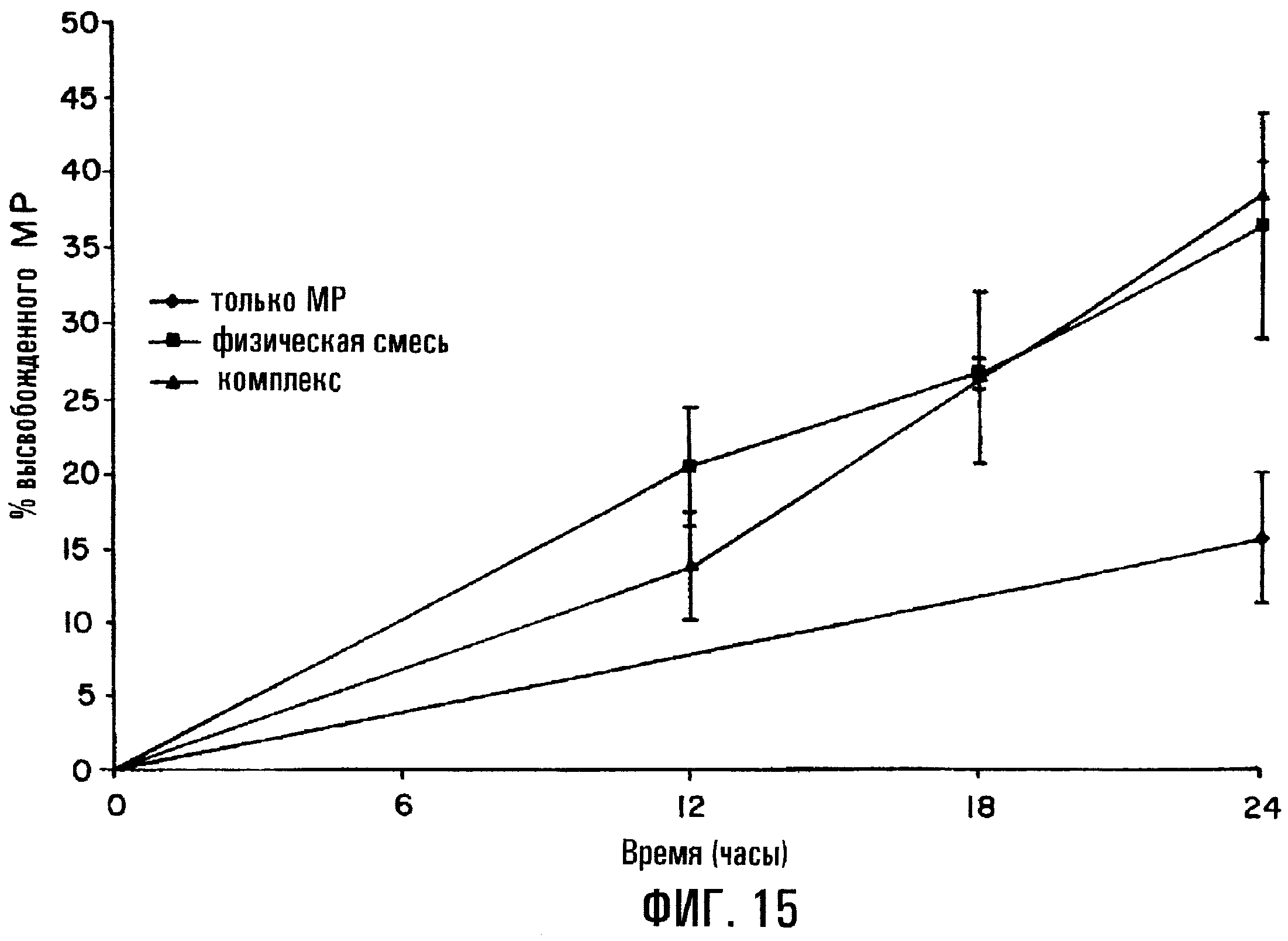
Фиг.15. Профиль высвобождения метилпреднизолона (МР) из таблеток, содержащих физическую смесь МР и SBE7β-CD, с покрытием, содержащим композицию из EUDDRAGITTM RS30D и EUDRAGITTM RL30D, но без порообразователя.
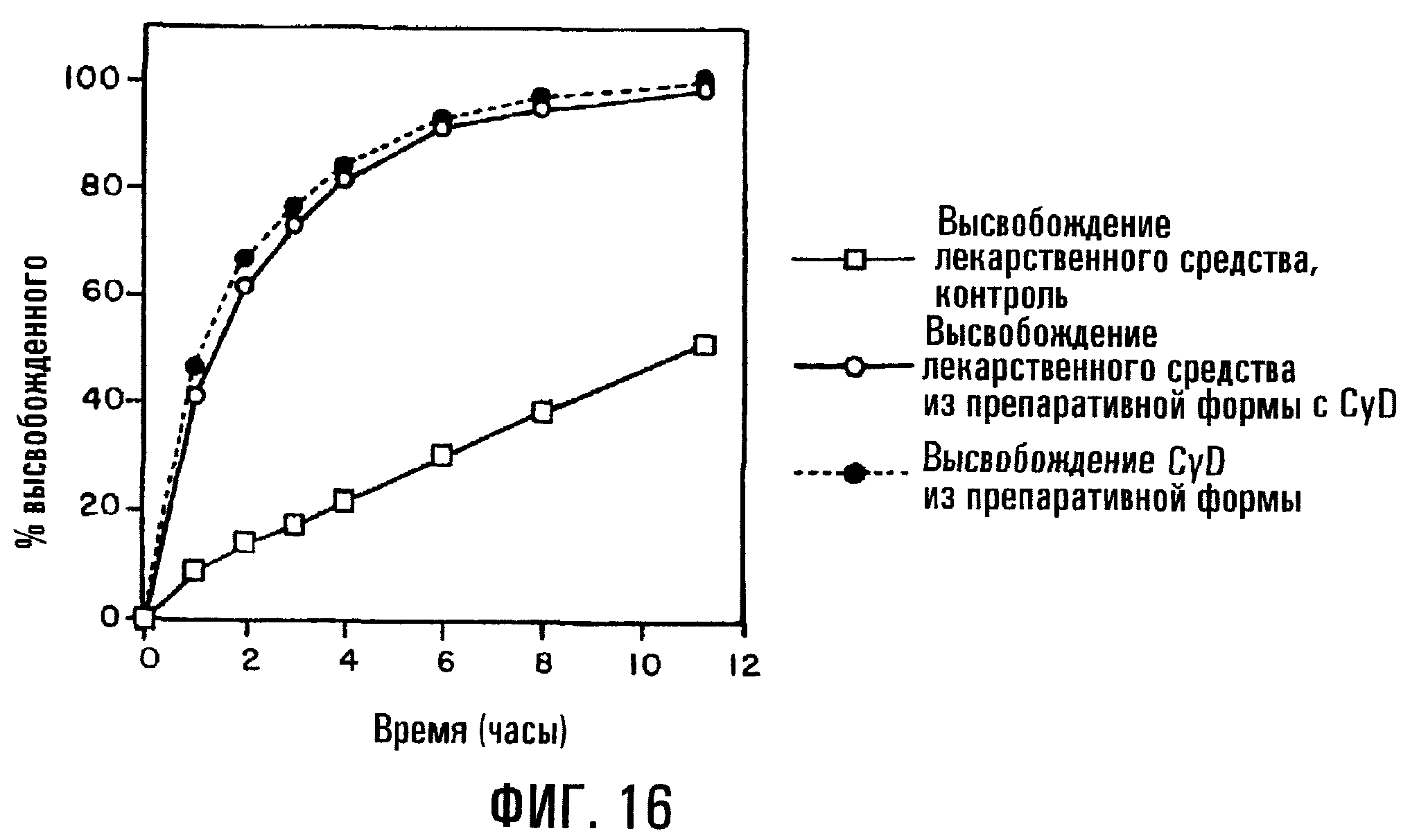
Фиг.16. Профили высвобождения преднизолона (PD) из таблеток с сердцевиной, содержащей физическую смесь PD и SBE7β-CD и модификатор скорости высвобождения, где таблетка не имеет покрытия.
Фиг.17. Профили высвобождения PD из таблеток, состоящих по существу из сердцевин с различным соотношением циклодекстрина и лечебного средства.
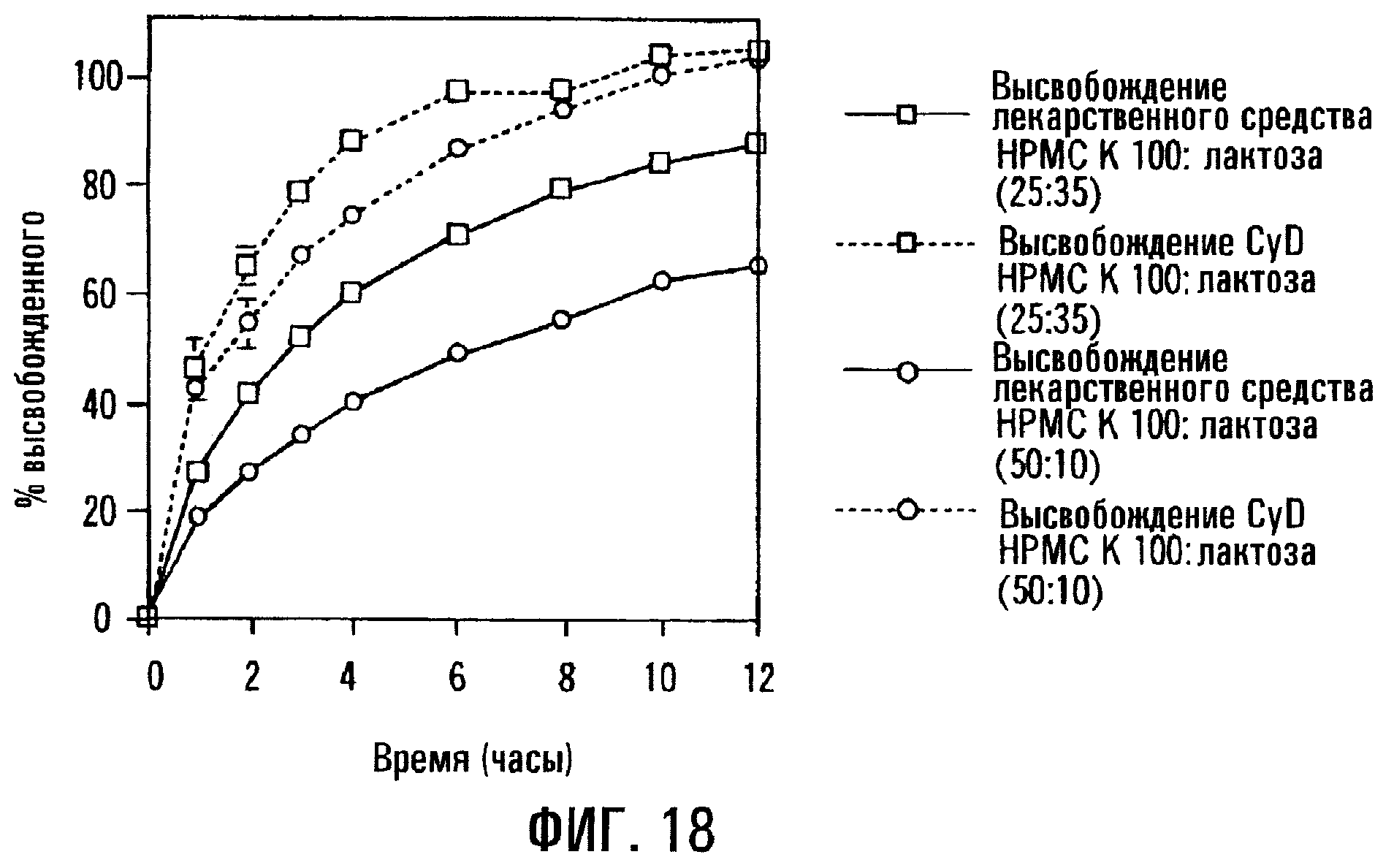
Фиг.18. Профили высвобождения PD из таблеток, состоящих из сердцевин без покрытия, содержащих постоянное количество циклодекстрина и PD, но различные количества модификатора скорости высвобождения.
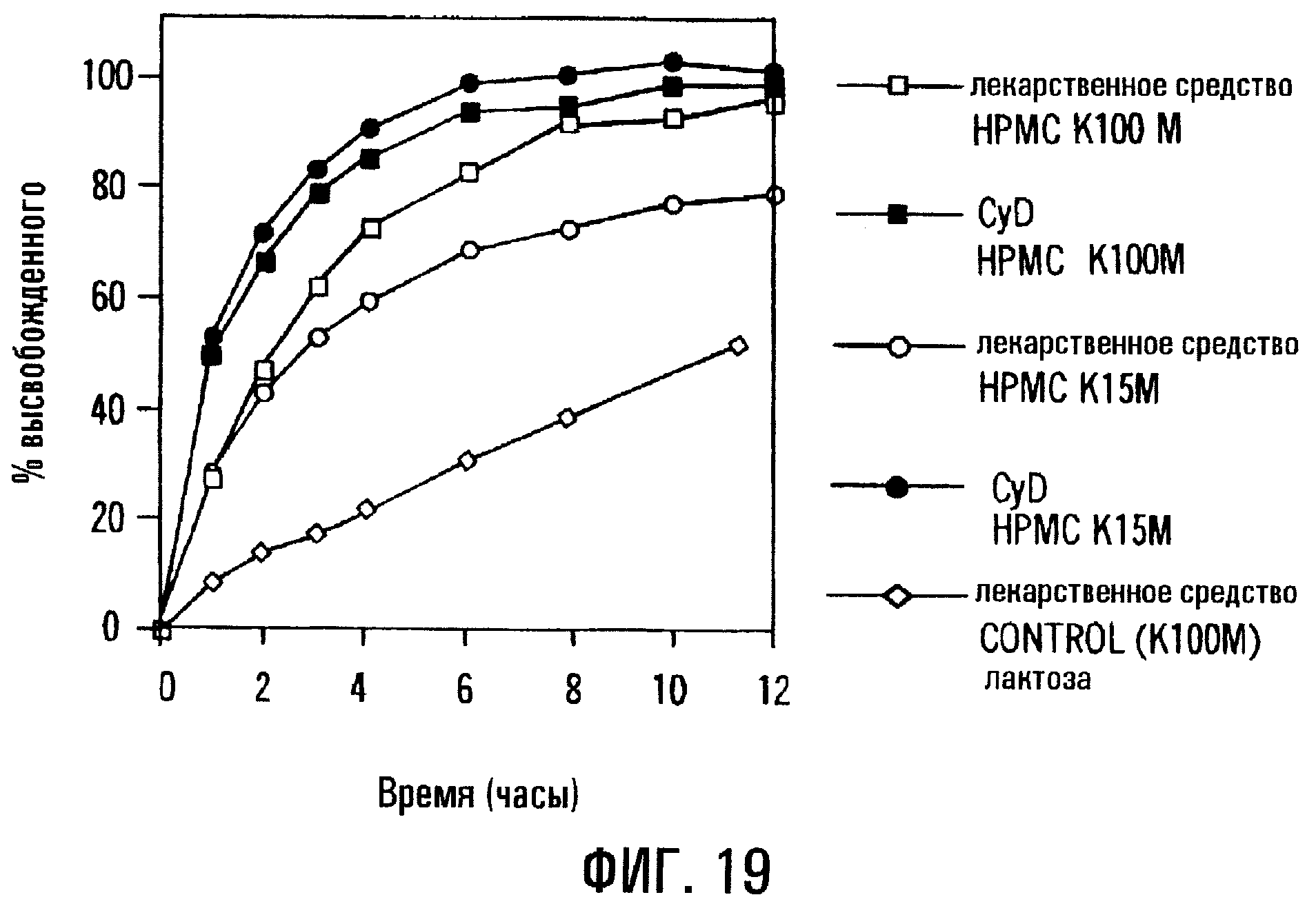
Фиг.19. Профили высвобождения PD из таблеток, состоящих из сердцевин без покрытия, содержащих модификаторы высвобождения с различной вязкостью и растворимостью, а также имеющих состав с различным соотношением лекарственного средства и полимерного модификатора.
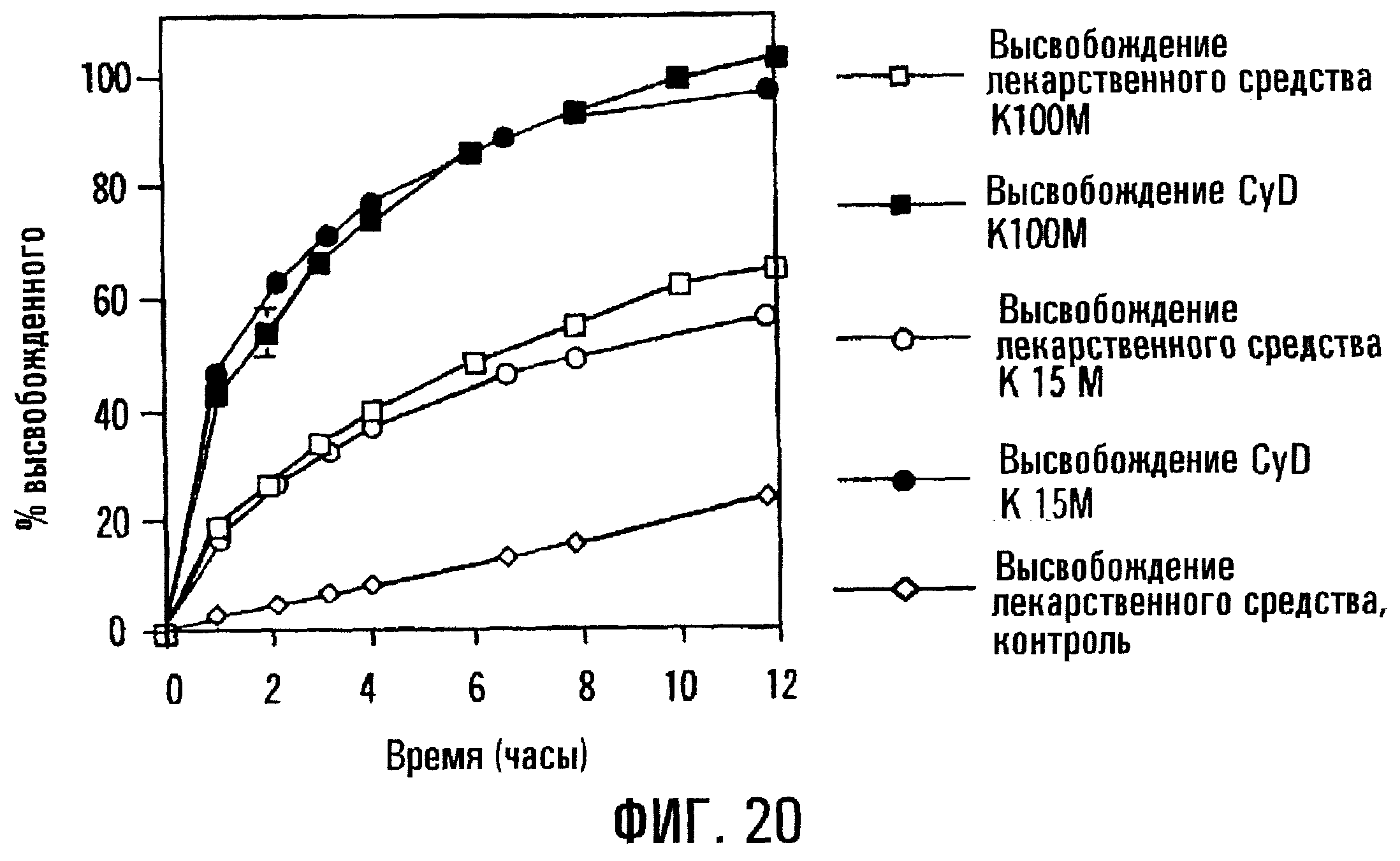
Фиг.20. Профили высвобождения PD из таблеток, состоящих из сердцевин без покрытия, содержащих модификаторы высвобождения с различной вязкостью и растворимостью, а также имеющих состав с различным соотношением лекарственного средства и полимерного модификатора.
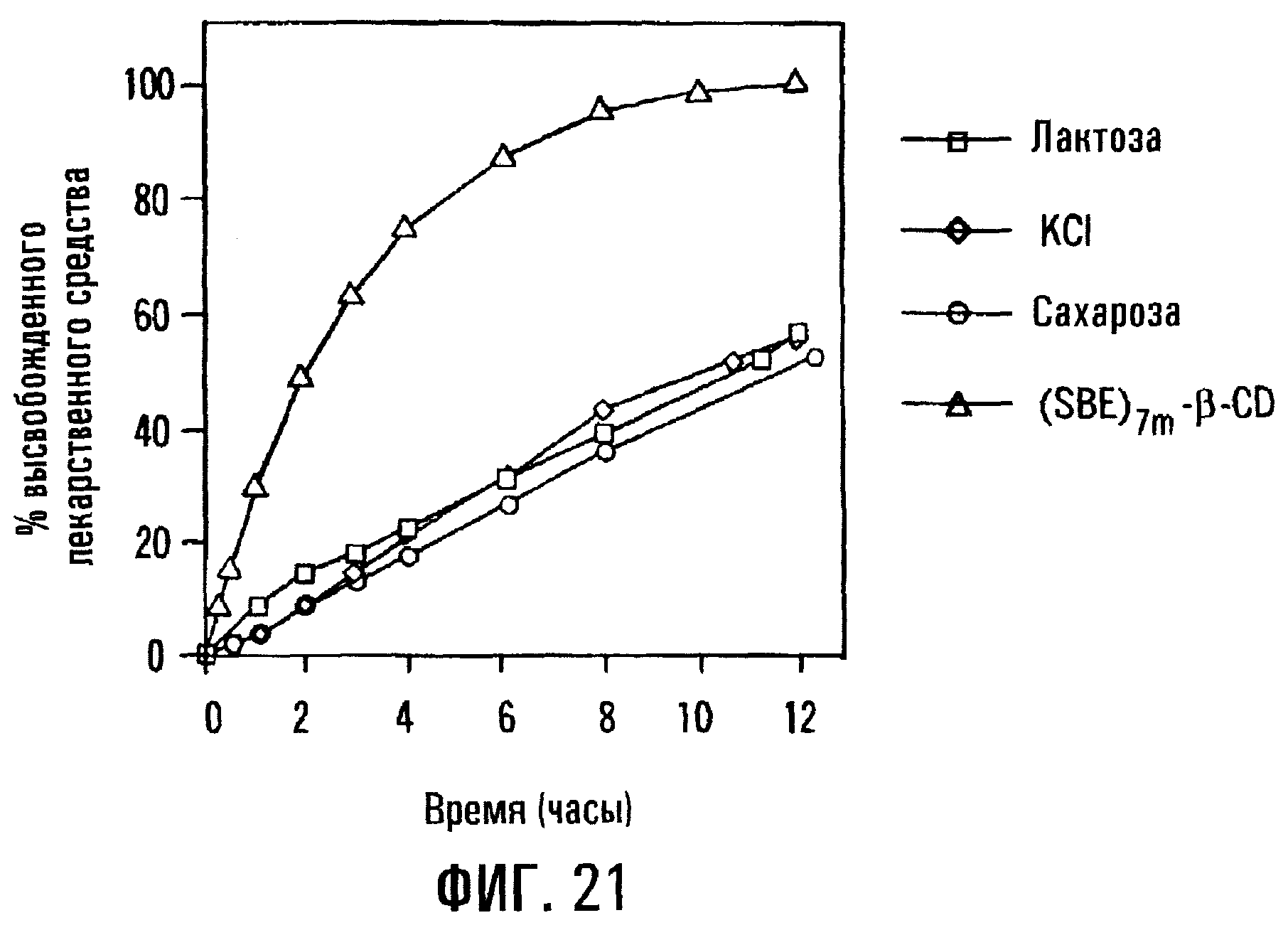
Фиг.21. Профили высвобождения PD из таблеток с сердцевиной, содержащей физическую смесь PD, модификатора скорости и одного компонента из числа SBE7β-CD, KC1, сахарозы или лактозы, где таблетка не имеет покрытия.
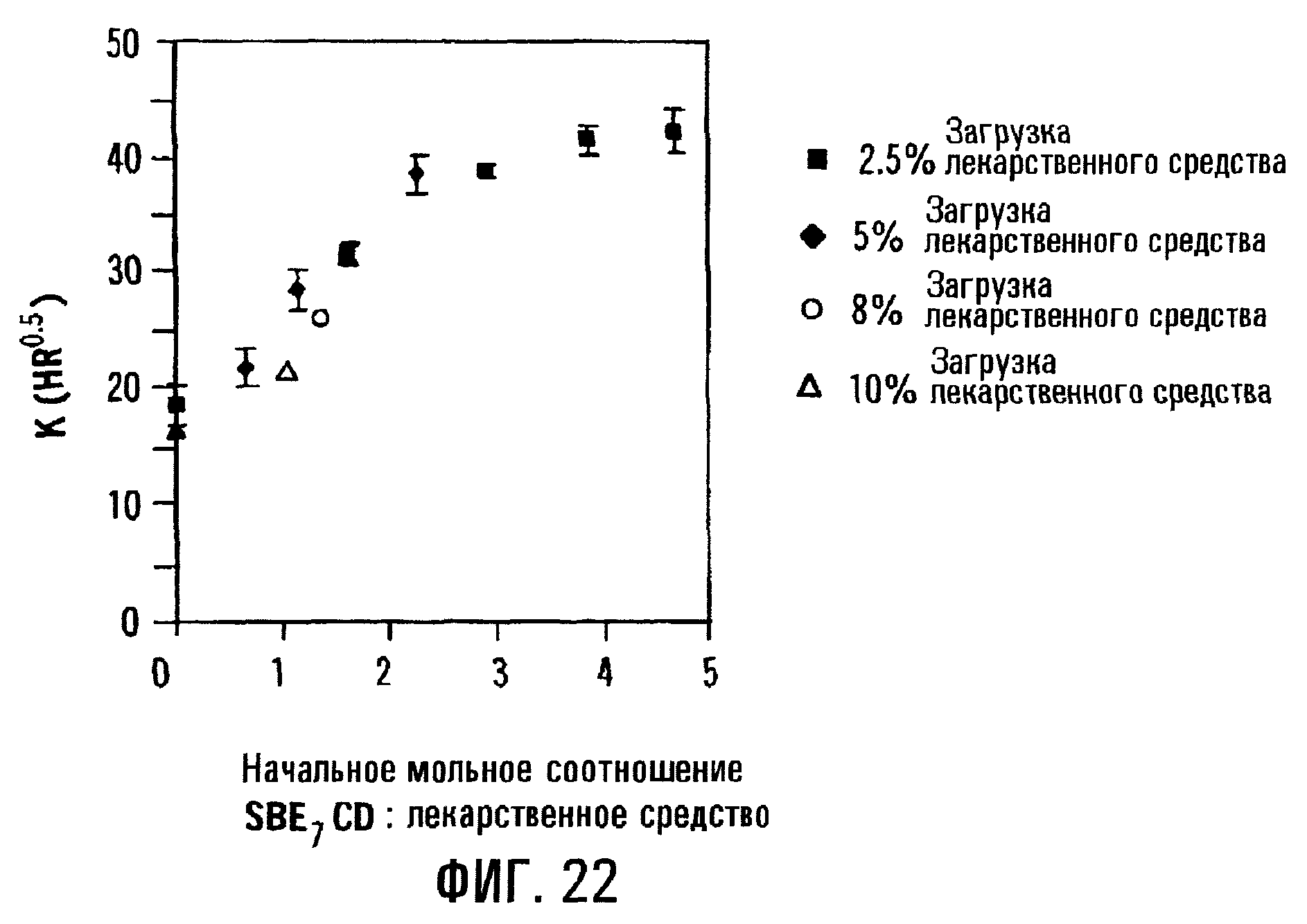
Фиг.22. Профили высвобождения PD из композиций для таблеток, где изменяется соотношение SBE7β-CD: лекарственное средство.
Фиг.23а изображает первый вариант двухслойной таблетки по изобретению.
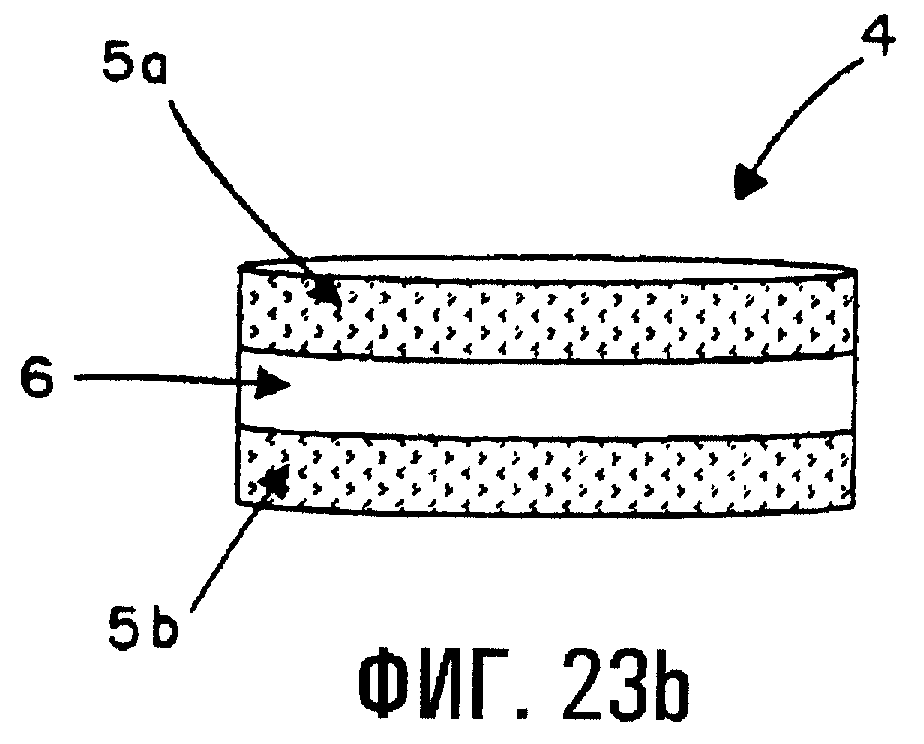
Фиг.23b изображает первый вариант трехслойной таблетки по изобретению.
Фиг.24 изображает второй вариант таблетки с регулируемым высвобождением по изобретению.
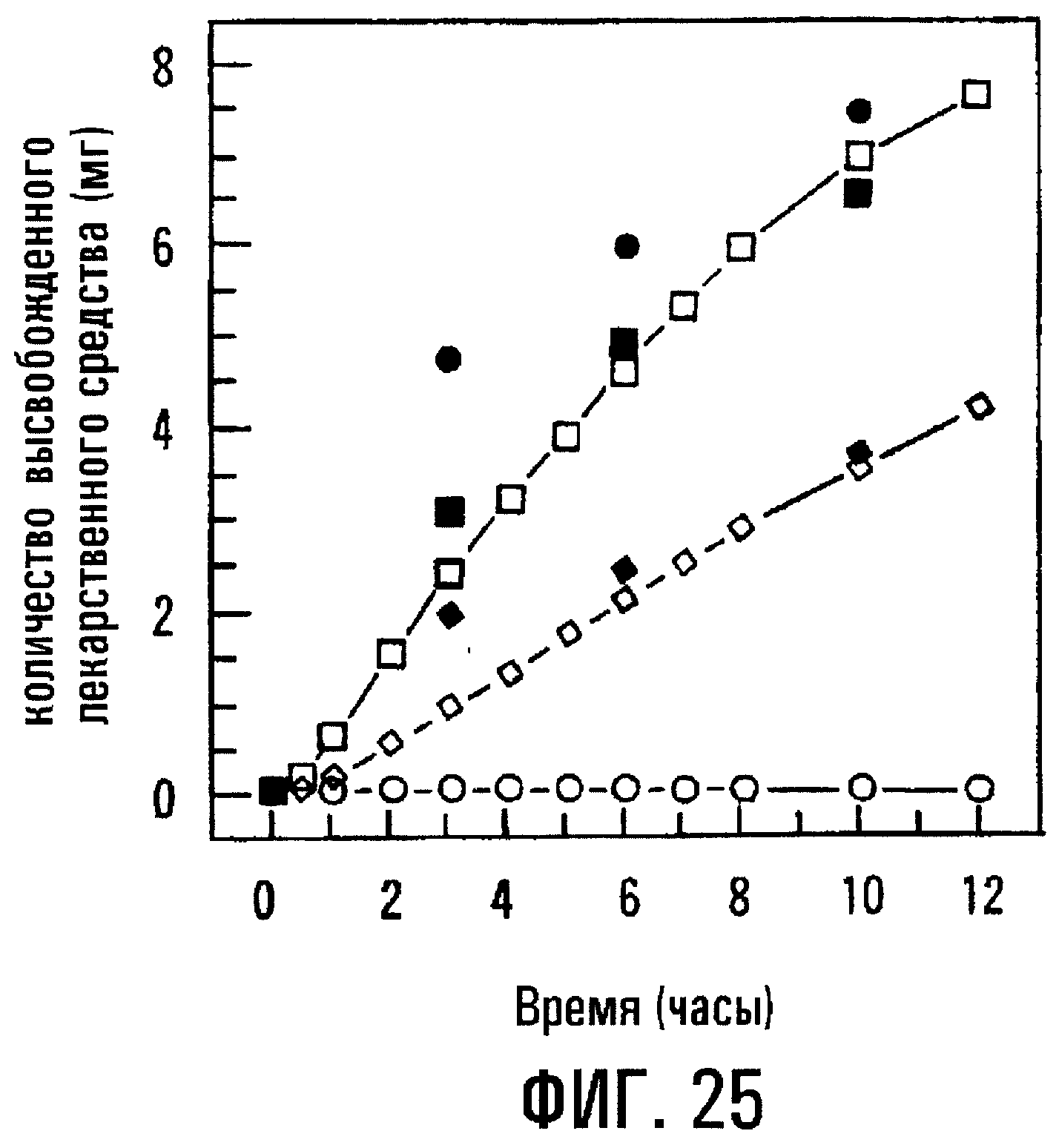
Фиг.25 изображает профили высвобождения тестостерона (TS) и эксципиентов из форм типа различных осмотических насосов, одна из которых получена согласно настоящему изобретению.
Подробное описание изобретения
Настоящее изобретение преодолевает недостатки, присущие известным фармацевтическим препаративным формам, содержащим физическую смесь лечебного средства и циклодекстрина, путем создания препаративной формы, которую легко получить и которая имеет растворимость лечебного средства, профиль растворения и/или биологическую доступность, приближающиеся к соответствующим характеристикам соответствующей ей фармацевтической препаративной формы, содержащей комплекс лечебного средства и циклодекстрина. В настоящем изобретении используют сульфоалкилэфирные производные циклодекстрина (SAE-CD) при получении широкого ряда фармацевтических препаративных форм.
Препаративные формы настоящего изобретения применяют для быстрой, регулируемой, пролонгированной, точной по времени, пульсирующей и отсроченной доставки широкого ряда лечебных средств. Препаративные формы также можно включать в самые разные лекарственные формы.
Сульфоалкилэфирные производные циклодекстрина
Используемые термины "алкилен" и "алкил" (например, в -О-((С2-С6)-алкилен)SО3-группе или в алкиламинах) включают линейные, циклические и разветвленные, насыщенные и ненасыщенные (т.е. содержащие одну двойную связь) двухвалентные алкиленовые группы и одновалентные алкильные группы соответственно. Термин "алканол" в данном тексте включает подобным образом как линейные, циклические, так и разветвленные, насыщенные и ненасыщенные алкильные компоненты алканольных групп, в которых гидроксильная группа может располагаться в любой части алкильной группы. Термин "циклоалканол" относится к незамещенным или замещенным (например, метилом или этилом) циклическим спиртам.
Настоящее изобретение относится к композициям, содержащим смесь производных циклодекстрина, имеющих строение, представленное формулой (I), где в состав в целом входят, в среднем, по меньшей мере 1 и до 3n+6 групп алкилсульфоновой кислоты на молекулу циклодекстрина. Настоящее изобретение также относится к композициям, содержащим производное цилодекстрина одного типа или по меньшей мере 50% производного цилодекстрина одного типа.
Указанные производные циклодекстрина являются или замещенными по меньшей мере по одной из первичных гидроксильных групп (т.е. по меньшей мере один из R1 - R3 является заместителем), или они замещены как по первичной гидроксильной группе, так и по гидроксильной группе в положении 3 (т.е. как по меньшей мере один из R1 - R3, так и по меньшей мере один из R4, R6 и R8 является заместителем). Замещение по гидроксильной группе в положении 2 хотя и возможно теоретически, но, как показали исследования авторов изобретения, в продуктах изобретения по существу не появляется.
Производные циклодекстрина настоящего изобретения получают в виде очищенных композиций, т.е. композиций, содержащих по меньшей мере 95 мас.% производного(ых) циклодекстрина, причем замещение происходит по меньшей мере по первичной гидроксильной группе молекулы циклодекстрина (т.е. R1, R2 или R3 формулы (I)). В предпочтительном варианте получают очищенные композиции, содержащие по меньшей мере 98 мас.% производного(ых) циклодекстрина.
В некоторых композициях изобретения непрореагировавший циклодекстрин по существу удален, причем остаточные примеси (т.е. <5 мас.% композиции) не оказывают влияния на рабочие характеристики композиции, содержащей производное циклодекстрина.
Используемые производные циклодекстрина получают так, как описано в патенте США 5134127, включенном в настоящее описание в качестве ссылки. Способ получения может включать растворение циклодекстрина в водном основании при подходящей температуре, например при 70-80° С, в наибольшей возможной концентрации. Например, для получения производных циклодекстрина в данном случае количество подходящего алкилсультона, соответствующее числу молей присутствующих в CD первичных гидроксильных групп, добавляют при энергичном перемешивании для обеспечения максимального контакта с гетерогенной фазой.
К различным производным SAE-CD, которым давали оценку, относятся SBE4 β, SBE7β, SBE11βи SBE4 γ, соответствующие производным SAE-CD формулы I, где n=5, 5, 5 и 6; m равен 4; и присутствуют соответственно сульфоалкилэфирные заместители 4, 7, 11 и 4. Обнаружено, что указанные производные SAE-CD повышают растворимость лекарственных средств, плохо растворимых в воде, до различной степени. Например, в табл.1 сведены данные по константе связывания и растворимости, полученные в случае некоторых SAE-CD (0,1 М при 25° С) и метилпреднизолона.

В другом варианте воплощения изобретения используют дипиридамол (DP), являющийся лекарственным средством основного характера (pka=6,28) с плохой водорастворимостью своего свободного основания (3,6 мкг/мл при 25° С) и низкой и изменчивой биологической доступностью. Обнаружено, что SBE7β-CD заметно повышает растворимость DP. В табл.2 приводятся данные по растворимости DP в присутствии и в отсутствие SBE7β -CD при разных значениях рН.

Хотя описанные выше варианты являются примерами производных SAE-CD, подходящих для изобретения, их не следует рассматривать как ограничивающие полный объем охраны, на который изобретение имеет право.
Фармацевтическая препаративная форма, содержащая сульфоалкиловый эфир циклодекстрина
Для того чтобы получить фармацевтическую препаративную форму с циклодекстрином, имеющую приемлемые растворимость, профиль растворения и биологическую доступность, в технике, как правило, предполагается, что предварительно необходимо, как правило, сформировать отдельно, перед получением содержащей указанные компоненты препаративной формы клатрат или комплекс включения циклодекстрина и лечебного средства. Однако авторы настоящего изобретения нашли, что отдельное предварительное формирование комплекса "SAE-CD:лечебное средство" не является необходимым.
Фармацевтическая препаративная форма изобретения, содержащая SAE-CD, будет содержать описанное выше производное SAE-CD формулы (I), фармацевтически приемлемый носитель, лечебное средство и, необязательно, дополнительные адъюванты и активные ингредиенты, где большая часть лечебного средства не образует комплекса с производным SAE-CD.
Так как предполагается, что только большая часть лечебного средства, включенного в препаративную форму настоящего изобретения, не образует комплекса с производным SAE-CD, возможно, что будет присутствовать некоторое количество комплекса лечебного средства и SAE-CD. Присутствие комплекса "SAE-CD:лечебное средство" в препаративной форме настоящего изобретения может быть преднамеренным или непреднамеренным, т.е. комплекс можно получить отдельно согласно патенту Stella et al., и затем ввести в препаратиную форму, или комплекс может образоваться во время получения препаратиной формы настоящего изобретения.
Термином "комплекс "лечебное средство:SAE-CD"", как правило, обозначается клатрат или комплекс включения сульфоалкилэфирного производного циклодекстрина формулы (I) и лечебного средства. Соотношение "лечебное средство: SAE-CD", имеющееся в комплексе, может изменяться в интервале от примерно 1:2 до примерно 2:1 в молярном отношении соответственно и предпочтительно составляет примерно 1:1. В другом варианте лекарственных форм, описанных здесь, соотношение "лечебное средство: SAE-CD" находится в интервале от примерно 2:1 до примерно 1:100 в молярном отношении, предпочтительно - от примерно 1:1 до примерно 1:20 и предпочтительнее - от примерно 2:1 до примерно 1:10 в молярном отношении. Таким образом, SAE-CD будет, как правило, но необязательно, присутствовать в избытке относительно лечебного средства. Величина избытка будет определяться действительной растворимостью средства, предполагаемой дозой средства и константой связывания для образования комплекса включения между конкретным лекарственным средством (средством) и конкретным SAE-CD.
Под "связанным в комплекс" подразумевается "является частью комплекса включения с", т.е. связанное в комплекс лечебное средство является частью клатрата или комплекса включения с сульфоалкилэфирным производным циклодекстрина. Под "большей частью" подразумевается по меньшей мере примерно 50 мас.% лечебного соединения. Таким образом, препаративная форма по настоящему изобретению будет содержать лечебное средство, более примерно 50 мас.% которого не образует комплекса с SAE-CD. В разных вариантах воплощения изобретения предпочтительно свыше 60 мас.%, предпочтительнее свыше 75 мас.%, даже предпочтительнее свыше 90 мас.% и наиболее предпочтительно свыше 95 мас.% лечебного средства будет оставаться в фармацевтической препаративной форме несвязанным в комплекс с SAE-CD.
Под "физической смесью" подразумевается смесь лекарственного средства и SAE-CD, образованная путем физического смешивания лекарственного средства и SAE-CD таким образом, чтобы свести к минимуму образование комплекса лекарственного средства и SAE-CD.
Предполагается, что лечебное средство начнет образовывать комплекс с SAE-CD после введения пациенту лекарственной формы, содержащей композицию изобретения, и воздействия на композицию жидкостей организма. Например, когда пациенту вводят перорально капсулу, содержащую порошки лечебного средства и SAE-CD, капсула будет растворяться, причем таким образом создается возможность контакта желудочного сока с лечебным средством и SAE-CD и будет образовываться комплекс лечебного средства и SAE-CD. Подходящая лекарственная форма создаст возможность гидратации физической смеси перед высвобождением из лекарственной формы для обеспечения правильного комплексообразования.
Соотношение "лечебное средство:SAE-CD", имеющееся в препаративной форме, будет зависеть от ряда факторов, таких как действительная растворимость средства, предполагаемая доза средства и константа связывания для образования комплекса включения между конкретным лекарственным средством (средством) и конкретным SAE-CD. Указанные факторы в сочетании будут определять количество SAE-CD, необходимое в лекарственной форме, и, следовательно, соотношение "SAE-CD: лечебное средство".
Молекулярная масса большинства SAE-CD составляет примерно 2000, большинство лечебных средств имеет молекулярную массу в интервале 200-500 и большинство лекарственных средств образует комплексы включения с SAE-CD 1:1. Вследствие указанного различия в молекулярной массе необходимое количество SAE-CD, как правило, будет составлять по массе минимум 1-10 крат от количества лечебного средства и даже может быть еще выше. В таком случае предполагается, что 1 моль CD будет солюбилизировать 1 моль лекарственного средства и что константа связывания между средством и CD является неопределенно высокой. В случае большинства твердых лекарственных форм для введения людям наилучшей являются таблетки общей массой менее 1 г, и, поскольку в составе таблетки должны быть другие эксципиенты, таблетка будет содержать предпочтительно менее 500 мг CD. Поэтому на основании такого простого предположения количество лекарственного средства в композиции с SAE-CD будет составлять, как правило, менее 50 мг. Так как большинство лекарственных средств не будет иметь бесконечно высокую константу связывания с SAE-CD, общая доза лекарственного средства, которую, как правило, можно ввести в композицию с SAE-CD, составляет <50 мг.
Конкретнее, средства могут образовывать комплексы включения с SAE-CD от слабых до очень сильных. Очень слабый комплекс включения может представлять собой комплекс, где константа связывания составляет менее 500 М-1; слабое связывание может представлять собой связывание, при котором константа связывания составляет от примерно 500 до примерно 1000 М-1; умеренный комплекс будет характеризоваться константой связывания от примерно 1000 до примерно 5000 М-1; сильный комплекс будет представлять собой комплекс с константой связывания от примерно 5000 до примерно 20000 М-1 и очень сильный комплекс будет характеризоваться константой связывания, превышающей примерно 20000 М-1.
Относительное улучшение растворимости плохо растворимого лекарственного средства в присутствии SAE-CD будет производным константы связывания и молярной концентрации присутствующего SAE-CD. В случае очень слабо связываемого лекарственного средства может быть необходимым молярное соотношение между SAE-CD и средством 100:1. Если это так, количество лекарственного средства в препаративной форме может быть таким низким, как 1 мг. Если константа связывания между SAE-CD и средством является очень высокой, тогда можно допустить соотношение примерно 1:1. В таком случае можно использовать такую высокую дозировку лекарственного средства, как 50 мг, при условии, что действительная растворимость лекарственного средства является подходящей. Рассмотрим лекарственные средства с константной связывания 10000 М-1, величиной, реальной для ряда лекарственных средств. В присутствии 0,1 М SAE-CD растворимость лекарственного средства может повыситься примерно в 1000 раз по сравнению с растворимостью в отсутствие SAE-CD. Если действительная растворимость лекарственного средства составляет примерно 1 нг/мл, тогда в присутствии только 0,1 М SAE-CD будет возможна только растворимость примерно 1 мкг/мл, однако, если действительная растворимость лекарственного средства составляет примерно 10 мкг/мл, тогда в присутствии примерно 0,1 М SAE-CD может быть возможна растворимость примерно 10 мкг/мл.
В настоящем изобретении рассматриваются различные фармацевтические препаративные формы, содержащие физическую смесь лечебного средства и SAE-CD: таблетка как форма осмотического насоса, слоистая таблетка, таблетка с покрытием, шарики с покрытием, порошок для воссоздания, капсулы, гранулы с покрытием и пленки, полученные экструзией из расплава.
Таблетки с покрытием, гранулы и шарики данного изобретения содержат необязательное пленочное покрытие и твердую сердцевину. Пленочное покрытие содержит пленкообразователь и необязательно порообразователь. Пленочное покрытие также может содержать несколько пленкообразующих веществ и необязательно порообразователей, например, в некоторых вариантах пленочного покрытия используют сочетания пленкообразующих веществ.
Термины "пленкообразователь" и "средство, регулирующее высвобождение" в данном случае используются как взаимозаменяемые, и подразумевается, что они включают полимерные соединения (природного, синтетического, полусинтетического происхождения или полученные генной инженерией), которые будут образовывать пленочное покрытие на твердой сердцевине препаративной формы и регулировать высвобождение или снижать скорость высвобождения лечебного средства или SAE-CD из указанной сердцевины. Пленкообразователи, рассматриваемые в изобретении, также описываются и приводятся примеры их конкретных вариантов.
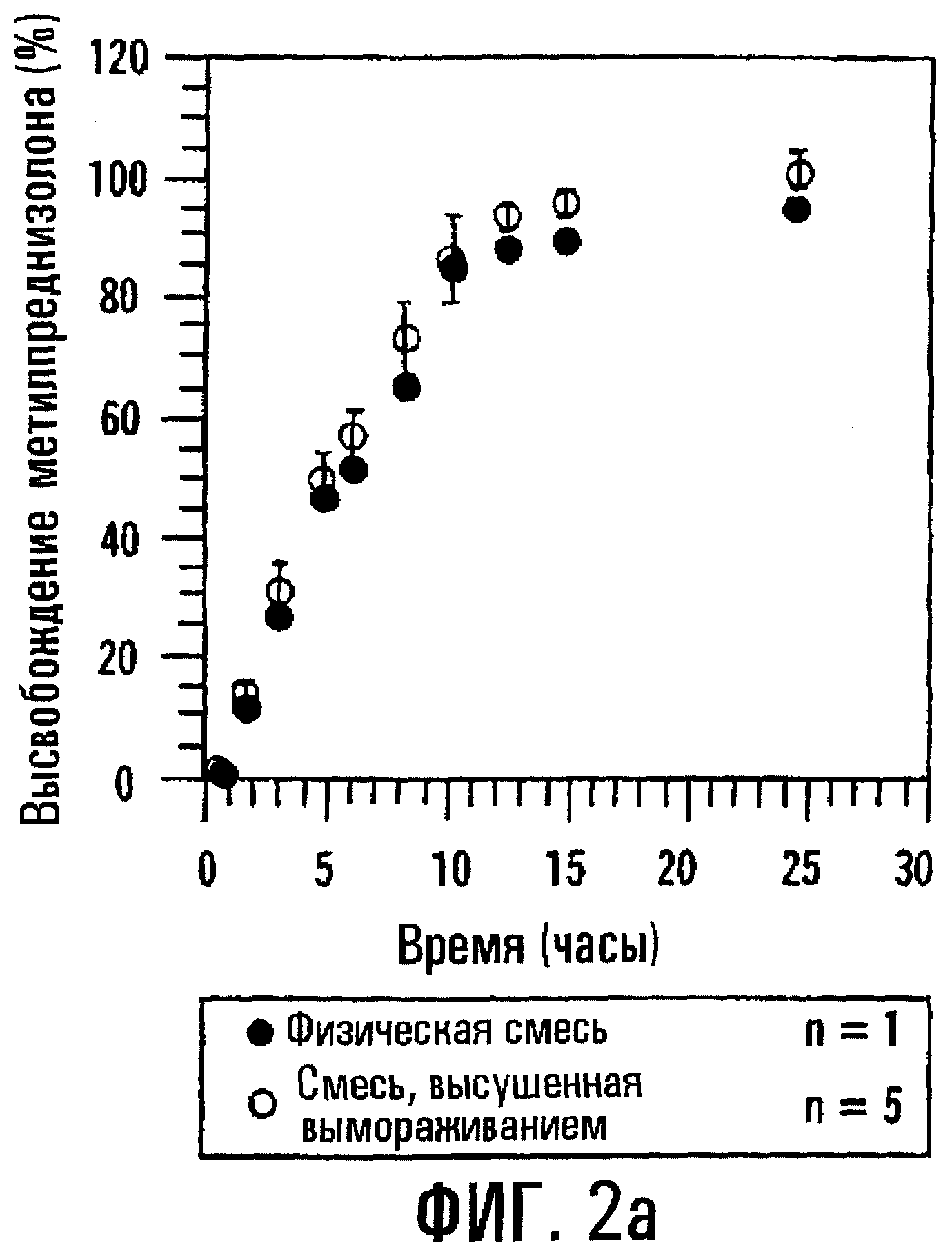
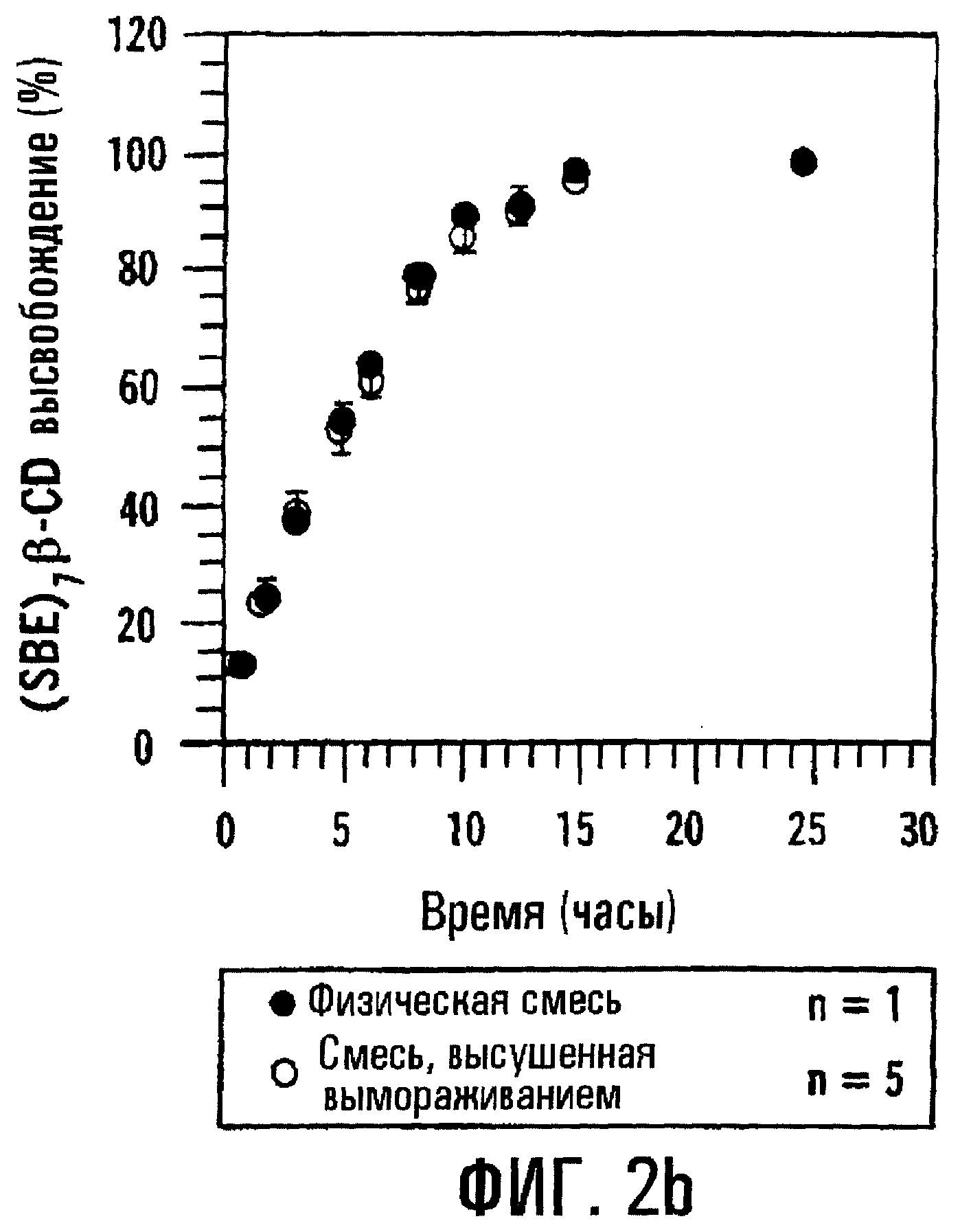
Фиг.1, соответствующая процедуре, подробно описанной в примере 1, изображает профили высвобождения для двух таблеток типа осмотического насоса, содержащих метилпреднизолон (МР), которые отличаются только по образованию комплекса SAE-CD и лечебного средства. Две композиции, первая из которых содержит физическую смесь метилпреднизолона и SBE7β-CD, а вторая содержит комплекс метилпреднизолона и SBE7β-CD, вводят в состав таблеток с регулируемым высвобождением по типу осмотического насоса, согласно примеру 1. МР и SBE7β-CD (присутствующие в молярном соотношении 1:7) вместе с фармацевтическим носителем прессуют в твердую сердцевину, на которую затем распылением наносят покрытие из смеси этилцеллюлозы, PEG3350, PEG400 и этанола с образованием на твердой сердцевине пленочного покрытия толщиной 140 мкм. Профиль растворения определяют с использованием прибора для определения растворения II по USP (100 об/мин, 37° С) и анализа метилпреднизолона (МР) методом ВЭЖХ. Для количественного определения SAE-CD разработан флуорометрический анализ с использованием 2,6-толуидинонафталинсульфоната (2,6-TNS). Первая композиция, которой на фиг.1 соответствуют незаштрихованные кружки, содержит отдельно сформированный предварительно комплекс MP-SBE7β-CD, высушенный вымораживанием. Вторая композиция, которой на фиг.1 соответствуют заштрихованные кружки, содержит большую часть МР, не связанного в комплекс, находящегося в виде физической смеси с SBE7 β -CD. Третья композиция, показанная квадратами, содержит физическую смесь лактозы, фруктозы и МР. Из подобия кривых, соответствующих предварительно сформированному комплексу и физической смеси, ясно, что последняя имеет профиль высвобождения, подобный или по существу подобный профилю высвобождения первого. Следует отметить, что для данной определьной лекарственной формы МР и SBE7β-CD имеют по существу одинаковые профили высвобождения. Результаты приводятся на фиг.2а и 2b для МР и SBE7β-CD соответственно.
Когда лечебное средство представляет собой тестостерон (TST), композиция с физической смесью SBE7β-CD и TST показывает такой же профиль высвобождения, как соответствующая смесь, высушенная вымораживанием (фиг.8). Твердая сердцевина таблетки содержит TST и SBE7β-CD в молярном соотношении 1:1. Пленочное покрытие данной таблетки содержит сорбит, PEG400 и ацетат целлюлозы. Профили высвобождения препаративной формы с физической смесью и комплексом сравнимы с профилем высвобождения базовой препаративной формы с TST и фруктозой-лактозой.
Когда толщина пленочного покрытия или оболочки, окружающей сердцевину таблетки, содержащую или физическую смесь, или высушенный вымораживанием комплекс МР и SBE7β -CD, повышается до 200 мкм, отмечается небольшое различие в профилях высвобождения физической смеси и высушенного вымораживанием комплекса; однако SBE7β-CD имеет профиль высвобождения, по существу похожий на профиль высвобождения МР. Результаты представлены на фиг.3а и 3b соответственно. Для примера получали также таблетки с покрытием с толщиной пленки 38, 89, 137, 198 и 234 мкм и оценивали их так же, как описано выше. Результаты, представленные на фиг.4а и 4b, показывают, что SBE7β-CD обнаруживает по существу такой же профиль высвобождения, как МР, в каждой лекарственной форме. В варианте при толщине 234 мкм оказывается, что высушенный вымораживанием комплекс высвобождает SBE7β-CD быстрее, чем МР; однако, когда по данным по высвобождению для физической смеси в вариантах, отображенных на фиг.4а и 4b, строят график зависимости от обратной толщины пленки, результаты показывают, что SBE7β-CD имеет профиль высвобождения, по существу подобный профилю высвобождения МР (фиг.5).
Толщина пленки не оказывает существенного влияния на профиль высвобождения данной лекарственной формы. Фиг.10 отображает влияние, которое толщина пленки оказывает на препаративную форму с пролонгированным высвобождением, включающую пленочное покрытие из EUDRAGITTM-L и мочевины и твердую сердцевину с физической смесью дипиридамола и SBE7β-CD. Результаты показывают, что в данном варианте профиль высвобождения DP не зависит от толщины пленки, но зависит от рН раствора.
Заменяя состав пленочного покрытия на EUDRAGITTM-S и мочевину, можно получить препаративную форму с пролонгированным высвобождением, высвобождающую DP при рН примерно 7,2 быстрее, чем при рН примерно 6,8 (фиг.11). Большая величина рН соответствует величине рН, найденной в нижнем отделе тонкой кишки или в толстой кишке пациента. Соответственно можно получить препаративную форму с пролонгированным высвобождением для высвобождения лечебного средства в тонком кишечнике или колоректального высвобождения, содержащую твердую сердцевину и пленочное покрытие, причем твердая сердцевина содержит лечебное средство и SAE-CD, а пленочное покрытие содержит пленкообразователь, представляющий собой полимер с растворимостью, зависящей от рН.
Пленка, окружающая твердую сердцевину, будет влиять на высвобождение МР и SBE7β-CD. В вариантах воплощения изобретения, где пленка, окружающая сердцевину, отсутствует, сердцевина, содержащая физическую смесь SBE7β-CD и МР, может иметь такие же или по существу такие же характеристики высвобождения, как сердцевина, содержащая комплекс указанных веществ. Фиг.6 изображает профиль высвобождения МР из твердых сердцевин, содержащих высушенный вымораживанием комплекс (заштрихованные кружки), физическую смесь (незаштрихованные кружки) и физическую смесь фруктозы, лактозы и МР (квадраты). В данном примере смесь фруктозы и лактозы служит скорее в качестве осмотического агента, чем солюбилизатора. Физическая смесь обнаруживает по существу такие же профили высвобождения, как комплекс.
Молярное соотношение MP/SBE7β-CD может влиять на профиль высвобождения данной лекарственной формы. Фиг.7a-7d изображают профили высвобождения МР и SBE7β-CD из таблеток с пленочным покрытием, содержащих МР и SBE7β-CD в виде физической смеси (фиг.7а и 7с) и в виде комплекса, высушенного вымораживанием (фиг.7b и 7d), где молярные соотношения MP/SBE7β-CD составляют 1/10, 1/7 и 1/3 (мас./мас.). Результаты показывают, что при уменьшении относительного количества SBE7β-CD профиль высвобождения МР располагается ниже. Таким образом, лекарственные формы с различными профилями высвобождения получают также путем регулирования соотношения МР/SВЕ7β-CD. Результаты также показывают, что физическая смесь и комплекс, высушенный вымораживанием, имеют по существу одинаковые характеристики высвобождения.
Используемое пленочное покрытие может содержать полимер с растворимостью, зависящей от рН. Фиг.9 изображает профиль высвобождения для препаративной формы с пролонгированным высвобождением, содержащей сердцевину таблетки и пленочное покрытие. Сердцевина таблетки содержит физическую смесь SBE7β-CD и дипиридамола (DP). Пленочное покрытие (150 мкм) содержит EUDRAGITTM-L, обнаруживающий зависящую от рН растворимость. Когда рН раствора, в который погружают таблетку, через два часа повышается от 1,5 до 6,8, SBE7β-CD и DP показывают по существу одинаковые профили высвобождения. Двухчасовое пролонгирование соответствует лекарственной форме, которая будет высвобождать большую часть DP в подвздошной кишке или в тощей кишке пациента.
Пленочные покрытия или мембраны изобретения могут содержать сочетание пленкообразующих веществ. Фиг.12 отображает один из вариантов воплощения изобретения, где пленочное покрытие содержит смесь 1:1 ацетата целлюлозы (СА) и фталата гидроксипропилметилцеллюлозы (НРМСР), а твердая сердцевина содержит SBE7β-CD и DP. Указанное сочетание пленкообразователей дает композицию с комбинированным - пролонгированным и регулируемым - высвобождением лечебного средства.
Оказывается, что изменение толщины пленки от 90 до 170 мкм по существу не влияет на профиль высвобождения DP с использованием пленкообразователей с растворимостью, зависящей от рН. Таким образом, в данном варианте изобретение относится к фармацевтической препаративной форме с пролонгированным и регулируемым высвобождением, имеющей профиль высвобождения, лишь в самой малой степени зависящий от толщины пленки (фиг.13).
Определенные варианты воплощения изобретения осуществлены для демонстрации пролонгированного высвобождения, комбинированного пролонгированного и регулируемого высвобождения и/или регулируемого высвобождения. В варианте, иллюстрированном фиг.14, на сердцевину таблетки, содержащую DP/SBE7β-CD, наносят покрытие из СА:НРМСР в разных соотношениях и с разной толщиной пленки. Вариант с пролонгированным высвобождением, показанный квадратами, имеет толщину пленочного покрытия 90 мкм при соотношении СА:НРМСР 1:1. В варианте с комбинированным пролонгированным и регулируемым высвобождением, показанном ромбами, толщина пленочного покрытия составляет 105 мкм при соотношении СА:НРМСР 6:4. Таким образом, изменяя соотношение СА:НРМСР, можно регулировать относительный вклад регулируемого и пролонгированного высвобождения в общий профиль высвобождения лекарственной формы.
Следует отметить, что в отсутствие SAE-CD по настоящему изобретению подходящий профиль высвобождения лекарственного средства для лекарственных средств, указанных здесь в качестве примеров, не будет получен. Например, из сердцевины таблетки, содержащей DP, лимонную кислоту и смесь фруктозы и лактозы, заключенной в пленку из СА:НРМСР (50:50) толщиной 120 мкм, высвобождения DP не происходит. В другом примере, где такая же сердцевина таблетки окружена пленкой из EUDRAGITTM-L и мочевины (50:50) толщиной 120 мкм, наблюдают частичное высвобождение DP.
Соответственно настоящее изобретение также относится к фармацевтической препаративной форме с профилем пролонгированного высвобождения, регулируемого высвобождения или комбинированного пролонгированного и регулируемого высвобождения, содержащей сердцевину таблетки и пленочное покрытие на сердцевине таблетки, причем сердцевина таблетки содержит физическую смесь лечебного средства и SAE-CD, а пленочное покрытие содержит сочетание пленкообразующих веществ.
Кроме того, в соответствии с примером 2 получают таблетки типа осмотического насоса и оценивают их характеристики растворения. Указанные таблетки включают сердцевину таблетки, содержащую DP/SAE-CD, окруженную пленочным покрытием, содержащим один или несколько следующих материалов: ацетат целлюлозы, этилцеллюлоза, воск, EUDRAGITTM E100, EUDRAGITTM RS и EUDRAGITTM RL, EUDRAGITTM L, EUDRAGITTM S, ацетатфталат целлюлозы, фталат гидроксипропилметилцеллюлозы и ацетатсукцинат НРМС. К оцениваемым порообразователям относятся полиэтиленгликоль 3350 (PEG 3350), сорбит, сахароза, полиолы, ксилит, маннит, углеводы, сахара, лактоза, мальтоза, декстроза, водорастворимые циклодекстрины и мочевина. Другими соединениями, подходящими в качестве пленкообразователей, являются ацетатбутират целлюлозы, ацетатпропионат целлюлозы, пропионат целлюлозы, НРМС, караген, нитрат целлюлозы, гидрофильные целлюлозные добавки, гидроксипропилметилцеллюлоза, метилцеллюлоза, гидроксиэтилцеллюлоза, этилцеллюлоза, поливиниловый спирт и латексные дисперсии, поликислоты, полимеры, растворяющиеся в кишечнике, полисахариды, аравийская камедь, трагакант, гуаровая смола, желатин, белки, альбумин, многофункциональные кислоты, полимеры, разлагаемые микроорганизмами, полиглутаминовая кислота и их сочетания.
Как указывалось ранее, не требуется, чтобы фармацевтическая препаративная форма по изобретению содержала сердцевину с покрытием, где покрытие содержит пленкообразователь и порообразователь. В примере, иллюстрируемом фиг.14, скорость высвобождения и общее количество высвобожденного DP регулируется как толщиной пленки, так и составом пленки, при этом повышение количество СА относительно НРМС приводит к общему снижению скорости доставки DP и снижению общего количества высвобожденного DP. Однако в примере, отраженном на фиг.15, МР высвобождается из таблетки, содержащей покрытие, состоящее из пленкообразователя, пластификатора и антиадгезива, но без порообразователя. В указанной препаративной форме покрытие содержит сочетание EudragitTM RS и EudragitTM RL в соотношении 9:1 по массе, и покрытие на сердцевине таблетки составляет приблизительно 5 мас.% от общей массы таблетки. Соответственно настоящее изобретение также относится к фармацевтическим препаративным формам с регулируемым высвобождением, состоящим по существу из сердцевины, окруженной покрытием, содержащим пленкообразователь, где покрытие регулирует скорость подачи лекарственного средства даже в отсутствие в покрытии порообразователя.
По меньшей мере в одном аспекте изобретение относится к твердой фармацевтической препаративной форме с регулируемой подачей, состоящей по существу из сердцевины без покрытия, где сердцевина содержит матрицу с регулируемым высвобождением, включающую модификатор скорости высвобождения, лечебное средство и сульфоалкиловый эфир циклодекстрина. В отличие от других вариантов воплощения настоящего изобретения, указанный конкретный вариант может относиться к регулируемому высвобождению плохо растворимого в воде лекарственного средства преднизолона (PD) в отсутствие покрытия, модифицирующего скорость высвобождения. В примере, иллюстрируемом фиг.16, модификатором скорости высвобождения является гидроксипропилметилцеллюлоза (НРМС). В отсутствие циклодекстрина даже через 11 ч высвобождается только приблизительно 50 мас.% PD; однако добавление SAE-CD вызывает доставку свыше 90% лекарстенного средства приблизительно за 6 ч и по существу полную доставку лекарственного средства за 11 ч.
Пример влияния изменения соотношения лечебного средства и сульфоалкилового эфира циклодекстрина показан на фиг.17, где количество преднизолона и НМРС в сердцевине без покрытия сохраняется постоянным, в то время как количество SBE7β-CD и моногидрата лактозы изменяется. Конкретно постоянное количество DP составляет 5 мас.% препаративной формы, а постоянное количество НРМС составляет приблизительно 25 мас.% препаративной формы. Количества циклодекстрина и лактозы изменяются таким образом, что они могут составлять приблизительно 70 мас.% препаративной формы в примере, показанном на фиг.17. Как правило, когда количество SAE-CD в препаративной форме снижается, а количество лактозы возрастает, скорость высвобождения PD и общее количество высвобожденного PD уменьшаются, а скорость доставки SAE-CD возрастает. Иначе говоря, когда соотношение PD/SAE-CD возрастает, скорость высвобождения лекарственного средства снижается, а скорость высвобождения SAE-CD возрастает. Соответственно один из вариантов фармацевтической препаративной формы с регулируемым высвобождением по изобретению включает сердцевину без покрытия, содержащую SAE-CD, лечебное средство и модификатор скорости высвобождения. Примерами таких препаративных форм являются формы, где в пределах 4 ч после их введения доставляется приблизительно 40% лекарственного средства, предпочтительно - 60% лекарственного средства, предпочтительнее - 80% лекарственного средства, и в пределах 8 ч высвобождается соответственно 60% лекарственного средства, предпочтительно - 80% лекарственного средства и предпочтительнее - 90% лекарственного средства.
В препаративных формах с регулируемым высвобождением согласно изобретению, где сердцевина не имеет покрытия, соотношение модификатора скорости высвобождения и или лечебного средства, или SAE-CD, или того и другого, будет влиять на скорость подачи лекарственного средства и общее количество подаваемого лекарственного средства. Соответственно на фиг.18 изображены профили высвобождения для разных препаративных форм, где количество лекарственного средства и циклодекстрина сохраняется постоянным, а количество модификатора скорости высвобождения (НРМС) и разбавителя (лактоза) изменяется. Как правило, когда соотношение модификатора скорости высвобождения и лекарственного средства возрастает, скорость высвобождения лекарственного средства падает и когда соотношение модификатора скорости высвобождения и циклодекстрина возрастает, скорость высвобождения циклодекстрина падает. В конкретном примере, отраженном на фиг.18, в данном варианте воплощения изобретения, когда соотношение модификатора скорости высвобождения и лекарственного средства составляет приблизительно 10:1, приблизительно 40-50% лекарственного средства будет высвобождаться за примерно 6 ч после введения и приблизительно 55-60% лекарственного средства будет высвобождаться за примерно 12 ч после введения. Когда соотношение модификатора скорости высвобождения и лекарственного средства составляет приблизительно 5:1, из препаративной формы будет высвобождаться приблизительно 65-75% лекарственного средства за примерно 6 ч и приблизительно 75-90% лекарственного средства за примерно 12 ч после введения. PD составляет 5 мас.% препаративной формы, SAE-CD составляет 35 мас.% препаративной формы, а количество НРМС в препаративной форме изменяется по возрастающей от 25 до 50 мас.%.
В вариантах препаративной формы по изобретению, содержащей сердцевину без покрытия, на высвобождение лекарственного средства с регулируемой скоростью, как правило, влияют молекулярная масса и/или вязкость модификатора скорости высвобождения, используемого для включения в сердцевину. Вообще считается, что возрастание вязкости полимера может соответствовать возрастанию молекулярной массы полимера, возрастанию разветвлений в полимере или возрастанию степени замещения полимера. Например, фиг.19 соответствует сердцевине без покрытия, содержащей 5 мас.% PD, 70 мас.% SAE-CD и 25 мас.% НРМС. НРМС является или НРМС К100М (с вязкостью 100000 сПз), или НРМС К15М (с вязкостью 15000 сПз). Когда вязкость модификатора скорости высвобождения повышается, повышается скорость высвобождения PD. Контрольный образец, содержащий НРМС К100М и не содержащий циклодекстрина, высвобождает приблизительно 30 мас.% PD за 6 ч и приблизительно 50 мас.% PD за 11 ч. Неожиданно, когда вязкость НРМС возросла от 15000 до 100000, скорость доставки PD и общее количество доставленного PD возрастали; и в то же время скорость доставки циклодекстрина и общее количество выделившегося циклодекстрина падали. Такое поведение является совершенно неожиданным, так как в технике вообще предполагается, что скорость выделения компонентов из матрицы с регулируемым высвобождением будет снижаться с возрастанием вязкости модификатора скорости высвобождения. Соответственно данный вариант изобретения относится к препаративной форме с регулируемым высвобождением, где модификатор скорости высвобождения присутствует в количестве, достаточном для придания скорости высвобождения лекарственного средства зависимости от вязкости модификатора скорости высвобождения.
Фиг.20 включает профили высвобождения для препаративных форм из сердцевин с регулируемым высвобождением, содержащих 5 мас.% PD, 35 мас.% SAE-CD, 50 мас.% НРМС и 10 мас.% лактозы, где вязкость НРМС возрастает от 15000 до 100000 сПз. В данном конкретном примере, где концентрация НРМС высока относительно циклодекстрина и лекарственного средства, оказывается, что скорость подачи и общее количество высвобожденных лекарственного средства и SAE-CD по существу не зависят от вязкости НРМС. Соответственно препаративная форма в виде сердцевины без покрытия по изобретению может обеспечить высвобождение лечебного средства, где примерно 60% лечебного средства высвобождается в пределах примерно 4 ч и примерно 80% лечебного средства высвобождается в пределах примерно 10 ч, или где примерно 80% композиции высвобождается в пределах примерно 4 ч и свыше 90% композиции высвобождается в пределах примерно 10 ч. Изобретение также относится к препаративной форме с регулируемым высвобождением без покрытия, где приблизительно 40% лечебного средства высвобождается в пределах 4 ч и приблизительно 50% лечебного средства высвобождается в пределах 8 ч. Иначе говоря, один из вариантов препаративной формы включает модификатор скорости высвобождения, присутствующий в количестве, достаточном для того, чтобы скорость высвобождения лекарственного средства по существу не зависела от вязкости модификатора скорости высвобождения.
Фиг.19 и 20 показывают, что когда в препаративной форме модификатор скорости высвобождения присутствует в более высокой концентрации, скорость высвобождения лекарственного средства в препаративной форме по существу не будет зависеть от вязкости модификатора скорости высвобождения, в то время как когда в сердцевине модификатор скорости высвобождения присутствует в более низкой концентрации, скорость высвобождения лекарственного средства из сердцевины будет существенно зависеть от вязкости модификатора скорости высвобождения. Иными словами, повышение количества модификатора скорости высвобождения в сердцевине, как правило, снижает зависимость скорости высвобождения лекарственного средства от молекулярной массы или вязкости модификатора скорости высвобождения.
Другой аспект изобретения относится к многослойной твердой фармацевтической препаративной форме с регулируемым высвобождением или к лекарственной форме, содержащей по меньшей мере первый слой, содержащий физическую смесь лечебного средства и SAE-CD, и по меньшей мере второй слой, содержащий модификатор скорости высвобождения. В данном варианте, как и во всех других вариантах воплощения настоящего изобретения, большая часть лечебного средства не образует комплекса с SAE-CD. Компоненты по меньшей мере первого и второго слоев будут объединяться для обеспечения регулируемой подачи лечебного средства. В данном варианте препаративная форма может включать в себя два, три, четыре или большее число слоев, спрессованных по отдельности, одновременно, последовательно или иным образом, с образованием препаративной формы с нужный профилем высвобождения лечебного средства. В предпочтительном варианте многослойная препаративная форма будет содержать средний первый слой, содержащий лечебное средство и SAE-CD, расположенный между двумя вторыми слоями, причем каждый содержит модификатор скорости высвобождения. Первый и второй слои по изобретению могут содержать дополнительные фармацевтические эксципиенты и компоненты, известные специалистам в этой области техники.
Несмотря на то, что предметом изобретения являются твердые фармацевтические препаративные формы, содержащие сочетание SAE-CD и лечебного средства, где большая часть лечебного средства не образует комплекса с SAE-CD, препаративные формы настоящего изобретения также могут включать дополнительные композиции, где лечебное средство образует комплекс с SAE-CD. Например, в одном из вариантов изобретения сердцевина может содержать первую композицию и вторую композицию, где первая композиция содержит физическую смесь SAE-CD и лечебного средства, где большая часть лечебного средства не образует комплекса с SAE-CD, а вторая композиция содержит предварительно сформированный комплекс SAE-CD и лечебного средства.
В примере 8 подробно описывается способ, являющийся примером получения многослойных таблеток по изобретению, содержащих по меньшей мере слой с немедленным высвобождением рядом со слоем с регулируемым высвобождением. Фиг.23а изображает двухслойную таблетку (1), содержащую слой с немедленным высвобождением (3), содержащий предварительно установленное количество лекарственного средства и SAE-CD, присутствующие вместе в виде физической смеси, и матрицу быстрого высвобождения, и слой с регулируемым высвобождением (2), содержащий предварительно установленное количество физической смеси лекарственного средства, SAE-CD и модификатора скорости высвобождения. Слой с немедленным высвобождением распадается и высвобождает лекарственное средство в окружающую среду после введения пациенту или добавления таблетки в растворяющую среду. Фиг.23b изображает трехслойную таблетку, где слой с регулируемым высвобождением (6), полученный так, как описано в примере 8, располагается между двумя слоями с немедленным высвобождением (5а, 5b), полученными так, как описано в примере 8. Надо заметить, что слои с немедленным высвобождением на фиг.23b содержат предварительно сформированный комплекс индометацина и SAE-CD. На двухслойные и трехслойные таблетки при необходимости можно нанести верхний слой, энтеросолюбильное покрытие или покрытие для регулируемого высвобождения.
В другом варианте воплощения изобретения многослойная препаративная форма с регулируемым высвобождением содержит по меньшей мере первый, второй и третий слои, где первый слой содержит первую композицию, содержащую физическую смесь SAE-CD и лечебного средства, где большая часть лечебного средства не образует комплекс с SAE-CD, второй слой содержит вторую композицию, содержащую предварительно сформированный комплекс SAE-CD и лечебного средства, и третий слой содержит модификатор скорости высвобождения. В данном конкретном варианте третий слой может закрывать или один слой из числа первого и второго слоев, или оба слоя.
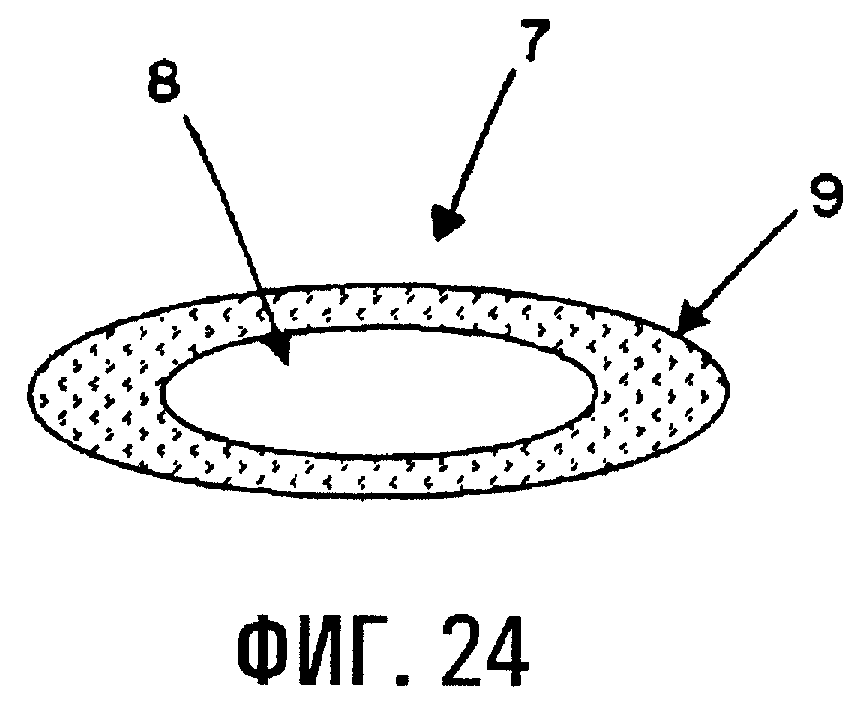
Фиг.24 отображает еще один вариант препаративной формы с регулируемым высвобождением (7) по изобретению, где сердцевина с регулируемым высвобождением (8), содержащая физическую смесь лекарственного средства и SAE-CD, окружена оболочкой, полученной путем прессования (9), содержащей предварительно сформированный комплекс лекарственного средства и SAE-CD.
Препаративные формы с регулируемым высвобождением изобретения также включают физическую смесь препаративных форм в виде частиц или гранул, где первая группа частиц содержит физическую смесь первого лечебного средства, первого сульфоалкилового эфира циклодекстрина и модификатор скорости высвобождения, а вторая группа частиц содержит комплекс включения первого лечебного средства и второго сульфоалкилового эфира циклодекстрина. Первая группа частиц предпочтительно будет поставлять первое лечебное средство регулируемым образом, а вторая группа частиц предпочтительно будет быстро поставлять второе лечебное средство. Первое и второе лечебные средства могут быть одинаковыми или разными. Подобным образом, первый и второй сульфоалкиловые эфиры циклодекстрина могут быть одинаковыми или разными. Формы в виде частиц предпочтительно будут включать дополнительные фармацевтически приемлемые эксципиенты. Если желательна пролонгированная и регулируемая доставка второго лечебного средства, на частицы второй группы нужно нанести покрытие, регулирующее высвобождение. Пролонгированное высвобождение может регулироваться величиной рН, эрозией или растворимостью. Покрытия для пролонгированного высвобождения включают описанные покрытия, а также другие покрытия, известные специалистам в этой области техники.
Препаративные формы типа осмотического насоса, которые получают в соответствии с примерами, описанными ниже, содержат полупроницаемую мембрану, окружающую сердцевину, содержащую физическую смесь лечебного средства, SAE-CD и фармацевтически приемлемого носителя, где большая часть лечебного средства не образует комплекса с SAE-CD, а мембрана имеет сквозные каналы для сообщения сердцевины с окружающей средой применения. Сердцевина также может включать осмотический агент и фармацевтически приемлемые эксципиенты. Полупроницаемая мембрана может содержать один или несколько порообразователей для придания мембране пористости, посредством чего создается возможность для диффузии лечебного средства через мембрану и создается осмотический насос с двойной функцией.
В примерах, описанных подробно ниже, где препаративная форма содержит пленочное покрытие вокруг сердцевины, пленка также может включать сквозные каналы для сообщения сердцевины с окружающей средой применения. Например, канал формируется в пленке путем сверления лазером или сверлом. Если пленка пористая, т.е. допускается диффузия через нее лекарственного средства, а также содержит каналы, препаративная форма может подавать лекарственное средство при сочетании осмотического и диффузионного способа. Если пленка полупроницаемая, т.е. не допускает диффузии через нее лекарственного средства, и содержит каналы, препаративная форма будет подавать лекарственное средство осмотическим путем.
Термин "осмотический агент" обозначает соединение или группу соединений, создающих осмотическое давление сквозь мембрану осмотического насоса при воздействии воды, поглощаемой из окружающей среды применения. Такими осмотическими агентами являются, например, соли, водорастворимые соединения, сахара и другие соединения такого типа, известные специалистам в этой области техники. SAE-CD и другие гидрофильные или ионизируемые соединения или полимеры также могут служить в качестве осмотических агентов.
В примере 11 описывается получение осмотического насоса, подающего тестостерон (TS) в среду применения при сочетании диффузионного и осмотического способа. Фиг.25 представляет сравнительные профили высвобождения TS, сахара, гидроксипропил-β -циклодекстрина (HP-β -CD) и (SBE)7m-β -CD из различных препаративных форм по типу осмотического насоса. Первая препаративная форма содержит физическую смесь TS (⃝ ) и смеси сахаров (• , лактоза и фруктоза, 1:1); вторая препаративная форма содержит TS ( ) и (SBE)7m-β -CD ( ) и третья препаративная форма содержит TS (◇ ) и HP-β -CD (◆ ). Результаты показывают, что осмотический насос, содержащий (SBE)7m-β -CD, высвобождает большее количество TS и с более приемлемой скоростью, чем другие осмотические насосы, содержащие смесь сахаров или НР-β -CD.
Выгодные свойства препаративной формы настоящего изобретения позволяют получать устройства для доставки лекарственных средств с комбинированной и регулируемой диффузионной и осмотической подачей лекарственного средства. Такие устройства получают, изменяя количество порообразователя или соотношение гидрофильного полимера и гидрофобного полимера в полупроницаемой мембране и/или изменяя толщину полупроницаемой мембраны в устройстве. В предпочтительном варианте толщина пленки будет достаточной для снижения скорости высвобождения лекарственного средства путем диффузии относительно скорости высвобождения лекарственного средства путем диализа, так что комплекс включения "лечебное средство/SAE-CD", образовавшийся в сердцевине устройства, будет подаваться преимущественно путем осмоса.
В другом предпочтительном варианте лечебное средство будет подаваться в большей степени путем диффузии через мембрану и в меньшей степени путем осмоса через каналы в мембране. Указанный тип устройства с комбинированной и регулируемой подачей получают путем уменьшения толщины мембраны и повышения пористости мембраны, т.е. повышая количество порообразователя относительно пленкообразователя.
Еще в одном предпочтительном варианте лечебное средство будет подаваться в большей степени путем осмоса через каналы в мембране и в меньшей степени путем диффузии через мембрану. Указанный тип устройства с комбинированной и регулируемой подачей получают путем увеличения толщины мембраны и уменьшения пористости мембраны, т.е. снижая количество порообразователя в мембране, или удаляя его, и/или повышая диаметр канала, проходящего через пору.
Слои, мембраны или покрытия в различный вариантах воплощения фармацевтических композиций и препаративных форм настоящего изобретения, как правило, наносят в виде пленок или путем прессования. Пленку, как правило, формируют путем нанесения раствора, суспензии или эмульсии на имеющуюся сердцевину или твердую основу и удаления жидкой части с образованием по существу сухой пленки. Нанесение покрытия путем прессования, как правило, осуществляют путем прессования второй фармацевтической композиции на первой фармацевтической композиции.
Используемый термин "порообразователь" описывает агент, который способствует образованию пор в пленочном покрытии по изобретению или улучшает водопроницаемость пленки. К таким порообразователям относятся, например, углеводы, такие как лактоза, декстроза, фруктоза, сахароза, манноза; α -гидроксикислоты, такие как лимонная кислота, винная кислота, фумаровая кислота, янтарная кислота, гликолевая кислота, молочная кислота, их сочетания и их соли; галоидные противоионы, такие как бромид-, фторид-, иодид- и хлорид-ион; двухвалентые катионы металлов, таких как магний и кальций; анионобразующие агенты, такие как фосфаты, сульфаты, сульфонаты, нитраты, бикарбонаты, их сочетания и содержащие такие анионы соли; производные целлюлозы, такие как НРС, НРМС, гидроксиэтилцеллюлоза, метилцеллюлоза; полиэтиленоксид; поливинилпирролидон; смолы и желирующие агенты, такие как гуаровая и ксантановая смолы, альгиновая кислота, аравийская камедь, трагакант, их сочетания и их соли; глины, такие как монтмориллонитовая глина, бентонит, вигум, каолинитовые глины; материалы смешанного типа, такие как кизельгур, силикат магния, бентон, гекторит, плуроникиTM, гидрофильные поверхностно-активные вещества; полиолы, такие как сорбит, маннит, ксилит; белки, такие как альбумин, коллаген, желатин; водорастворимые аминокислоты; дезинтегрирующие агенты, такие как крахмал, натрийкрахмалгликолят, кроскармелоза; и водорастворимые органические соединения и их сочетания. Порообразователи, являющиеся водопроницаемыми, будут, как правило, улучшать проницаемость пленки.
Подразумевается, что препаративные формы изобретения образуют комплекс SAE-CD, когда подвергаются воздействию жидкостей организма. В отдельных вариантах воплощения изобретения лекарственные формы изобретения будут допускать гидратацию физической смеси SAE-CD и лечебного средства перед высвобождением лечебного средства в помощь образованию комплекса.
Способ изменения биологической доступности и скорости биоабсобции
Настоящее изобретение относится к выгодному способу повышения водорастворимости и изменения биологической доступности и/или биоабсорбции в организме пациента плохо растворимых в воде гидрофобных лекарственных средств с плохой биологической доступностью. В случае водорастворимых гидрофильных лекарственных средств с исключительно высокой биологической доступностью настоящее изобретение относится к способу изменения скорости их биоабсорбции в организме пациента.
Термины "плохо растворимое в воде" и "гидрофобное" относятся к лечебному средству с растворимостью в воде с нейтральным рН менее примерно 1 мг/мл при 20° С. Термины "водорастворимое" и "гидрофильное" относятся к лечебному средству с растворимостью в воде с нейтральным рН, превышающей примерно 1 мг/мл при 20° С.
В некоторых вариантах воплощения изобретения способ настоящего изобретения изменения биологической доступности или скорости абсорбции лечебного средства включает стадии обеспечения сочетания лечебного средства и сульфоалкилэфирного производного циклодекстрина и введения указанного сочетания пациенту. "Изменение биологической доступности и/или скорости биоабсорбции" означает, что биологическая доступность и/или скорость биоабсорбции лечебного средства, когда его вводят в сочетании с SAE-CD, будут отличаться от (или изменяться относительно) его биологической доступности и/или скорости биоабсорбции, когда его вводят отдельно.
В других вариантах способ настоящего изобретения включает стадии приготовления композиции как с сульфоалкильным производным циклодекстрина, так и с лечебным средством без образования комплекса, в одной фармацевтически приемлемой лекарственной форме и введение указанной лекарственной формы пациенту.
Не вдаваясь в механизм явления, полагают, что SAE-CD изменяет биологическую доступность и/или скорость абсорбции лечебного средства за счет образования клатрата или комплекса включения с ним после воздействия жидкостей организма пациента. Сочетание лечебного средства и SAE-CD можно получить различными способами, подробно описанными ниже. Необходимо только, чтобы SAE-CD присутствовал в количестве, достаточном для создания возможности образования комплекса с лечебным средством в организме пациента, получающего такую препаративную форму.
Общие положения
Лечебное средство, подходящее для настоящего изобретения, может обладать широким интервалом показателей водорастворимости, биологической доступности и гидрофильности. Таким образом, настоящее изобретение предполагает рассмотрение любого лечебного средства, которое будет образовывать клатрат или комплекс включения с соединением SAE-CD формулы а). Лечебные средства, для которых настоящее изобретение является особенно подходящим, включают плохо растворимые в воде гидрофобные лечебные средства и водорастворимые гидрофильные лечебные средства. Препаративные формы настоящего изобретения, как правило, доступны в стандартных дозах, содержащих менее примерно 500 мг, предпочтительно - менее примерно 150 мг и предпочтительнее - менее примерно 50 мг лечебного средства. Специалистам в этой области техники следует иметь в виду, что лечебное средство, используемое в препаративных формах настоящего изобретения, выбирают независимо в каждом случае из числа описанных лечебных средств.
Количество лечебного соединения, включаемого в препаративные формы настоящего изобретения, выбирают согласно известным принципам фармации, клинической медицины и фармакологии. Как правило, имеется в виду терапевтически эффективное количество лечебного соединения. Под термином "терапевтически эффективное количество" подразумевается, что рассматривается фармацевтически эффективное количество в отношении, например, фармацевтических препаратов. Фармацевтически эффективное количество является количеством лекарственного средства или фармацевтически активного вещества, достаточным для того, чтобы добиться требуемого или желательного лечебного ответа, или, иными словами, количеством, достаточным для того, чтобы добиться приемлемой биологической реакции при его введении пациенту. При использовании в связи с витамином или минеральным веществом термин "эффективное количество" обозначает количество, составляющее по меньшей мере примерно 10% ежесуточной дозы конкретного ингредиента для пациента, рекомендованной в США ("RDA"). Например, если предполагаемый ингредиент представляет собой витамин С, тогда эффективное количество витамина С должно включать количество витамина С, достаточное для получения 10% или более RDA. Как правило, когда таблетка содержит минеральное вещество или витамин, она будет включать большие количества, предпочтительно - примерно 100% или более, соответствующих RDA. Лечебное соединение, как правило, применяют в мелкоизмельченной форме, т.е. в порошке или гранулах, с тем, чтобы повысить скорость растворения. Предпочтительно применять лечебное соединение в виде тонкодисперсного порошка, чтобы повысить скорость растворения, причем предпочтительнее, чтобы не менее 80% лечебного соединения, желательно - не менее 90%, могло проходить через сито 100 меш (150 мкм). Включаемое количество лечебного соединения колеблется, как правило, от примерно 0,1 до 50 мас.%, предпочтительно от примерно 1 до 25 мас.% относительно всей композиции, и соотношение можно изменять подходящим образом в зависимости от используемого лечебного соединения.
Примеры лечебных средств включают синтетические антибактериальные средства типа плохо растворимых в воде пиридонкарбоновых кислот, такие как бенофлоксацин, налидиксовая кислота, эноксацин, офлоксацин, амифлоксацин, флумекин, тосфлоксацин, пиромидиевая кислота, пипемидиевая кислота, милоксацин, оксолиниевая кислота, циноксацин, норфлоксацин, ципрофлоксацин, перфлоксацин, ломефлоксацин, энрофлоксацин, данофлоксацин, бинфлоксацин, сарафлоксацин, ибафлоксацин, дифлоксацин и их соли. Другие лечебные средства включают пенициллин, тетрациклин, цефалоспорин и другие антибиотики, антибактериальные вещества, антигистаминные и противоотечные средства, противовоспалительные, антипаразитарные, противовирусные средства, местные анестетики, противогрибковые, амебецидные или трихомоноцидальные средства, аналгетики, противоартритные, противоастматические средства, антикоагулянты, противосудорожные средства, антидеперссанты, противодиабетические, антибластомные, антипсихотические и гипотензивные средства и миорелаксанты. Представителями антибактериальных веществ являются бета-лактамовые антибиотики, тетрациклины, хлорамфеникол, неомицин, грамицидин, бацитрацин, сульфонамиды, нитрофуразон, налидиксидовая кислота и аналоги и противомикробная комбинация флудаланин/пентизидон. Характерными представителями антигистаминных и противоотечных средств являются периламин, хлорфенирамин, тетрагидрозолин и антазолин.
Представителями противовоспалительных лекарственных средств являются кортизон, гидрокортизон, бетаметазон, дексаметазон, флуокортолон, преднизолон, триамцинолон, индометацин, сулиндак и его соли и соответствующий сульфид.
Характерным антипаразитарным соединением является ивермектин.
Характерными противовирусными соединениями являются ацикловир и интерферон. Характерными аналгезирующими лекарственными средствами являются дифлунизал, аспирин или ацетаминофен. Характерными противоартритными средствами являются фенилбутазон, индометацин, силиндак, его соли и соответствующий сульфид, дексаметазон, ибупрофен, аллопуринол, оксифенбутазон или пробенецид. Храктерными противоастматическими лекарственными средствами являются теофилин, эфедрин, дипропионат беклометазона и эпинефрин. Характерными антикоагулянтами являются бисгидроксикумарин и варфарин. Представителями противосудорожных средств являются дифенилгидантоин и диазепам. Характерными антидепрессантами являются амитриптилин, хлордиазепоксид, перфеназин, протриптилин, имипрамин и доксепин. Характерными противодиабетическими средствами являются инсулин, соматостатин и его аналоги, толбутамид, толазамид, цетогексамид и хлорпропамид. Характерными антибластомными средствами являются адриамицин, флуороурацил, метотрексат и аспарагиназа. Представителями антипсихотических средств являются прохлорперазин, тиоридазин, молиндон, флуфеназин, трифлуоперазин, перфеназин, армитриптилин и трифлуопромазин. Характерными гипотензивными средствами являются спиронолактон, метилдопа, гидралазин, клонидин, хлоротиазид, десерпидин, тимолол, пропранолол, метопролол, гидрохлорид празозина и резерпин. Представителями миорелаксантов являются сукцинилхолинхлорид, данбролен, циклобензаприн, метокарбамол и диазепам.
Некоторыми другими примерами лечебных средств являются, но не ограничиваются перечисленным, адифенин, аллобарбитал, аминобензойная кислота, амобарбитал, ампициллин, анетол, аспирин, азопропазон, азуленбарбитуровая кислота, беклометазон, беклометазондипропронат, бенциклан, бензальдегид, бензокаин, бензодиазепины, бензотиазид, бетаметазон, бетаметазон-17-валерат, бромбензойная кислота, бромоизовалерилмочевина, бутил-п-аминобензоат, хлоральгидрат, хлорамбуцил, хлорамфеникол, хлорбензойная кислота, хлорпромазин, коричная кислота, клофибрат, кофермент А, кортизон, ацетат кортизона, циклобарбитал, циклогексилантранилат, дезоксихолиевая кислота, дексаметазон, ацетат дексаметазона, диазепам, дигитоксин, дигоксин, эстрадиол, флуфенамовая кислота, флуоцинолонацетонид, 5-фторурацил, флурбипрофен, гризеофулвин, гуайазулен, гидрокортизон, ацетат гидрокортизона, ибупрофен, индикан, индометацин, иод, кетопрофен, антибиотики группы ланкацидина, мефенамовая кислота, менадион, мефобарбитал, метарбитал, метициллин, метронидазол, митомицин, нитразепам, нитроглицерин, нитрозомочевины, параметазон, пенициллин, пентобарбитал, фенобарбитал, фенобарбитон, фенилмасляная кислота, фенилвалериановая кислота, фенитоин, преднизолон, ацетат преднизолона, прогестерон, пропилпарабен, просцилларидин, простагландин А, простагландин В, простагландин Е, простагландин F, хинолоновые антимикробные средства, резерпин, спиронолактон, натрийсульфацетамид, сульфонамид, тестостерон, талидомид, дилаурилсульфат тиамина, тиамфениколпальмитат, тиопентал, триамцинолон, виаграTM, витамин А, витамин D3, витамин Е, витамин К3 и варфарин.
Лечебное соединение (соединения), содержащееся в фармацевтической препаративной форме, при необходимости вводят в состав в виде его (их) фармацевтически приемлемых солей. Используемый термин "фармацевтически приемлемые соли" относится к производным описываемых соединений, где лечебное средство изменяют путем получения его солей кислот или оснований. Примерами фармацевтически приемлемых солей являются, но не ограничиваются перечисленным, соли минеральных или органических кислот соединений основного характера, таких как амины; соли щелочей или органических оснований соединений кислотного характера, таких как карбоновые кислоты и т.п. К фармацевтически приемлемым солям относятся обычные нетоксичные соли или соли четвертичных аммониевых оснований исходного соединения, образованные, например, от нетоксичных неорганических или органических кислот. Например, такие обычные нетоксичные соли включают соли, полученные из неорганических кислот, таких как хлороводородная, бромоводородная, серная, сульфоновая, сульфаминовая, фосфорная, азотная кислота и т.п.; и соли, полученные из органических кислот, таких как аминокислоты, уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памовая, малеиновая, оксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изэтионовая кислота и т.п.
Фармацевтически приемлемые соли настоящего изобретения синтезируют из исходного лечебного соединения, содержащего основную или кислотную группу, обычными химическими способами. Как правило, такие соли получают, например, посредством взаимодействия форм свободных кислоты или основания указанных соединений с заранее установленным количеством соответствующего основания или кислоты в воде, или в органическом растворителе, или в смеси указанных растворителей. Как правило, предпочтительны неводные среды. Перечень подходящих солей можно найти в работе Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Company, Easton, PA, 1990, chp. 40, включенной в настоящее описание в качестве ссылки.
Выражение "фармацевтически приемлемый" используется в данном описании в отношении тех соединений, материалов, композиций и/или лекарственных форм, которые, в рамках здравого медицинского смысла, подходят для применения в контакте с тканями организмов человека и животных, не будучи излишне токсичными, не вызывая раздражения, аллергической реакции или другой проблемы или осложнения, соразмерно с разумным соотношением польза/опасность.
Используемый термин "активный ингредиент" можно также отнести к корригенту, подсластителю, витамину, минеральному веществу и другим подобным соединениям для применения в фармацевтических композициях. Препаративная форма настоящего изобретения также может содержать адъюванты, такие как красители, дезинтегрирующие агенты, смазывающие вещества, биоадгезивы, и другие, известные специалистам в этой области техники.
К дезинтегрирующим агентам (способствующим распаду) относятся крахмалы, такие как кукурузный и картофельный крахмал, предварительно желатинизированные и модифицированные крахмалы, производные целлюлозы, такие как Ac-di-sol, монтморрилонитовые глины, поперечносшитый ПВП, подслащивающие вещества, бентонит и вигумTM, микрокристаллическая целлюлоза, альгинаты, натрийкрахмалгликолят, смолы, такие как агар, гуар, плод рожкового дерева, карайа (karaya), пектин и трагакант. В отдельных вариантах таблетка по изобретению не будет растворяться слишком быстро, с тем, чтобы дать возможность осуществиться гидратации содержащейся в ней физической смеси SAE-CD и лечебного средства.
К ингибиторам протеаз, которые могут входить в препаративные формы настоящего изобретения, относятся, например, антипаин, леупептин, химостатин, амистатин и пуромицин, но не только они.
К усилителям проникновения, которые могут входить в препаративные формы настоящего изобретения, относятся, например, но не только перечисленные, вещества, образующие хелаты с кальцием, такие как ЭДТК, метилированный β -циклодекстрин, и поликарбоновые кислоты; поверхностно-активные вещества, такие как лаурилсульфат натрия, додецилсульфат натрия, карнитин, сложные эфиры карнитина и твин; соли желчных кислот, такие как таурохолат натрия; жирные кислоты, такие как олеиновая и линолевая кислота; и вещества, не являющиеся поверхностно-активными, такие как азонTM и диалкилсульфоксиды.
Корригенты, включаемые в композицию, можно выбрать из числа синтетических душистых масел и ароматических веществ и/или натуральных масел, экстрактов из растений, листьев, цветков, плодов и т.д. и их сочетаний. К ним могут относиться коричное масло, масло гаультерии, мятные масла, гвоздичное масло, лавровое масло, анисовое масло, эвкалиптовое и тимьяновое масло, кедровое масло, масло мускатного ореха, шалфейное масло, масло горького миндаля и масло акации. В качестве корригентов также полезны ваниль, цитрусовое масло, в том числе лимонное, апельсиновое, виноградное масло, лаймовое и грейпфрутовое масло и фруктовые эссенции, в том числе яблочная, грушевая, персиковая, земляничная, малиновая, вишневая, сливовая, ананасная, абрикосовая и т.д. Корригенты, являющиеся, как обнаружено, особенно полезными, включают коммерчески доступные апельсиновую, виноградную, вишневую отдушки и отдушки для жевательной резинки и их смеси. Количество корригента может зависеть от ряда факторов, включая желательный органолептический эффект. Особенно предпочтительными корригентами являются виноградная и вишневая отдушки и цитрусовые отдушки, такие как апельсиновая.
Вещества, включаемые в препаративную форму настоящего изобретения, можно предварительно обработать с образованием гранул. Такой способ известен как грануляция. Обычно "грануляцией" называют любой процесс укрупнения частиц, с помощью которого мелкие частицы собираются в более крупные постоянные скопления с образованием свободнотекущей композиции с подходящей консистенцией. Такие гранулированные композиции могут иметь консистенцию, напоминающую консистенцию сухого песка. Грануляцию можно осуществлять путем перемешивания в оборудовании для смешивания или путем уплотнения, экструзии или агломерации.
Используемый в данном описании термин "витамин" относится к органическим веществам в малых количествах, необходимых в питании. Для целей настоящего изобретения термин "витамин" включает без ограничений тиамин, рибовлафин, никотиновую кислоту, пантотеновую кислоту, пиридоксин, биотин, фолиевую кислоту, витамин В12, липоевую кислоту, аскорбиновую кислоту, витамин А, витамин D, витамин Е и витамин К. Термин "витамин" также включает их коферменты. Коферменты представляют собой специфические химические формы витаминов. Коферменты включают тиаминпирофосфаты (ТРР), флавинмононуклеотид (FMM), флавинадениндинуклеотид (FAD), никотинамидадениндинуклеотид (NAD), никотинамидадениндинуклеотидфосфат (NADP), кофермент А (СоА), пиридоксальфосфат, биоцитин, тетрагидрофолиевую кислоту, кофермент В12, липолизин, 11-цис-ретиналь и 1,25-дигидроксихолекальциферол. Термин "витамин(ы)" также включает холин, карнитин и альфа-, бета- и гамма-каротины.
Используемый в данном описании термин "минеральное вещество" относится к неорганическим веществам, металлам и т.п., необходимым в питании человека. Таким образом, термин "минеральное вещество", используемый здесь, включает кальций, железо, цинк, селен, медь, иод, магний, фосфор, хром и т.п., и их смеси, и не только их.
Используемый термин "пищевая добавка" обозначает вещество, обладающее ощутимым питательным эффектом при введении в небольших количествах. Пищевые добавки включают такие ингредиенты как перга, отруби, пшеничные проростки, бурая водоросль, жир печени трески, женьшень и рыбий жир, аминокислоты, белки, и их смеси, и не только их. Для повышения ценности пищевые добавки могут включать витамины и минеральные вещества.
В препаративную форму настоящего изобретения может быть включен биоадгезив. Биоадгезивом называют вещество, прилипающее к биологической поверхности, такой как слизистая оболочка или кожная ткань. Биоадгезив будет закреплять лекарственную форму на слизистой оболочке. Предпочтительный биоадгезив является волокнистым или представляет микрочастицы, набухает, но не растворяется в воде. Подходящее соотношение биоадгезива и других компонентов будет обеспечивать сильную биоадгезию. Биоадгезивы-полимеры, используемые в данном изобретении, включают, например, гидрофильные и диспергируемые в воде полимеры, содержат свободные гидроксильные группы и имеют относительно высокую способность связываться с основаниями. Указанные полимеры, как и гидрофильные целлюлозы, представляют собой поликарбоксилированные виниловые полимеры и полиакриловые кислоты. Некоторые гидрофильные смолы-полисахариды, такие как гуаровая смола, смола плода рожкового дерева, смола семян psyllium и т.п., также подходят для применения в составе. Массовое соотношение биоадгезива и активного ингредиента может быть самым разным. На практике массовое соотношение биоадгезива и активного ингредиента, как правило, составляет от примерно 1:10 до примерно 10:1.
Для фармацевтической препаративной формы настоящего изобретения, содержащей SAE-CD, для того, чтобы получить подходящий продукт, могут потребоваться особые гидрофобные или гидрофильные связующие вещества. Подходящими гидрофобными связующими веществами являются ацетатбутарат целлюлозы, ацетатпропионат целлюлозы, высокомолекулярный (200000) пропионат целлюлозы, пропионат целлюлозы со средней молекулярной массой (75000), низкомолекулярный пропионат целлюлозы (25000), ацетат целлюлозы, нитрат целлюлозы, этилцеллюлоза, поливинилацетат и т.п. Подходящими гидрофильными связующими веществами являются поливинилпирролидон, поливиниловый спирт, полиэтиленоксид, водорастворимая или набухающая в воде целлюлоза, производные крахмалов и другие соединения, известные специалистам в этой области техники.
Примерами других связующих веществ, которые можно добавлять в препаративную форму, являются, например, аравийская камедь, трагакант, желатин, крахмал, производные целлюлозы, такие как метилцеллюлоза и натрийкарбоксиметилцеллюлоза, альгиновые кислоты и их соли, полиэтиленгликоль, гуаровая смола, полисахариды, сахара, инвертные сахара, полоксомеры (плуроникTM F68, плуроникTM F127), коллаген, альбумин, желатин, целлюлозы в неводных растворителях, предварительно желатинизированный крахмал, крахмальный клейстер и сочетания перечисленных выше и подобных веществ. К другим связующим веществам относятся, например, полипропиленгликоль, сополимер оксиэтилена и оксипропилена, сложный полиэтиленэфир, полиэтиленгликоль, полиэтиленсорбитан, полиэтиленоксид или их сочетания и другие вещества, известные специалистам в этой области техники.
Температуры плавления и/или размягчения таких связующих веществ, как правило, повышается с возрастанием их молекулярной массы. В случае связующих веществ с температурой плавления и/или размягчения, превышающей 150° С, может потребоваться применение пластификатора во время получения подходящей лекарственной формы, с тем, чтобы температуры плавления или размягчения связующего вещества была бы ниже 150° С. Связующее вещество, как правило, находится в форме порошка, гранул, хлопьев или расплава.
Используемый термин "модификатор скорости высвобождения" относится к веществу, которое будет изменять скорость высвобождения лечебного средства из фармацевтической препаративной формы по изобретению. Модификатор скорости высвобождения будет способствовать обеспечению регулируемой скорости высвобождения лечебного средства и может действовать вместе с другими соединениями в препаративной форме для обеспечения или пролонгированного, отсроченного высвобождения, высвобождения в определенный момент времени, зависящего от рН, направленного высвобождения или также регулируемой подачи лечебного средства. Следует иметь в виду, что некоторые связующие вещества, указанные здесь, также можно рассматривать как модифиаторы скорости высвобождения.
Используемый термин "пластификатор" охватывает все соединения, способные пластифицировать связующее вещество, используемое в изобретении. Пластификатор должен снижать температуру плавления или температуру стеклования (температура в точке размягчения) связующего вещества. Пластификаторы, такие как низкомолекулярный ПЭГ, как правило, раздвигают интервал средней молекулярной массы связующего вещества, посредством чего снижается его температура стеклования или размягчения. Пластификаторы, как правило, снижают вязкость полимера. Возможно, что пластификатор будет придавать препаративной форме по изобретению некоторые особенно важные физические свойства.
К пластификаторам, полезным для изобретения, можно отнести, например, и не только перечисленные полимеры с низкой молекулярной массой, олигомеры, сополимеры, масла, некрупные органические молекулы, низкомолекулярные полиолы с алифатическими гидроксилами, пластификаторы типа сложных эфиров, простые эфиры гликолей, полипропиленгликоль, многоблочные блок-сополимеры, простые блок-сополимеры, низкомолекулярный полиэтиленгликоль, эфиры лимонной кислоты, триацетин, полиэтиленгликольфталаты, эфиры фосфорной кислоты, эфиры себациновой кислоты, производные гликолей, эфиры жирных кислот и глицерин.
Такими пластификаторами также могут быть этиленгликоль, 1,2-бутиленгликоль, 2,3-бутиленгликоль, стиролгликоль, диэтиленгликоль, дипропиленгликоль, триэтиленгликоль, тетраэтиленгликоль и другие полиэтиленгликоли, моноизопропиловый эфир монопропиленгликоля, моноэтиловый эфир пропиленгликоля, моноэтиловый эфир этиленгликоля, моноэтиловый эфир диэтиленгликоля, эфир молочной кислоты и сорбита, этиллактат, бутиллактат, этилгликолят, дибутилсебацат, диметилсебацат, ди-2-этилгексилсебацат, трикрезилфосфат, триэтилфосфат, трифенилфосфат, ацетилированные моноглицериды, вазелиновое масло, касторовое масло, глицерилтриацетат, бутилстеарат, моностеарат глицерина, бутоксиэтилстеарат, стеариловый спирт, циклогексилэтилфталат, циклогексилметилдибутилфталат, диэтилфталат, дибутилфталат, диизопропилфталат, диметилфталат, диоктилфталат, ацетилтрибутилцитрат, триэтилцитрат, ацетилтриэтилцитрат, трибутилцитрат и аллилгликолят. Все указанные пластификаторы доступны коммерчески из таких источников, как Aldrich или Sigma Chemical Co., или Morflex, Inc.. Предполагается, и в объеме изобретения, что в препаративных формах настоящего изобретения можно использовать сочетания пластификаторов.
Фармацевтические препаративные формы настоящего изобретения, как правило, содержат твердую сердцевину, содержащую сульфоалкиловый эфир циклодекстрина формулы I, как описано выше, фармацевтически приемлемый носитель и терапевтически эффективное количество лечебного средства, большая часть которого не образует комплекса с сульфоалкиловым эфиром циклодекстрина. Твердая сердцевина будет окружена пленочным покрытием. Указанные препаративные формы можно включать в твердые лекарственные формы, такие как, например, но не только перечисленные, жевательная пластина, капсула, волокно, пленка, гель, гранула, жевательная резинка, имплантат, вкладыш, шарик, порошок, таблетка, лейкопластырь, пастилка, пилюля, прокладка и облатка.
Предназначенные пути введения включают оральный, пероральный, буккальный, назальный, через имплантат, ректальный, вагинальный, подъязычный, ушной и уретральный. Препаративную форму настоящего изобретения, как правило, вводят с фармацевтически приемлемыми носителями или разбавителями, доля и характер которых определяются растворимостью и химическими свойствами выбранного лечебного средства, выбранной лекарственной формой и обычной фармацевтической практикой. Твердые пероральные формы могут содержать обычные экципиенты, например лактозу, сахарозу, стеарат магния, смолы и подобные вещества, корригенты, красители, буферирующие вещества, консерванты или стабилизаторы. Указанные препаративные формы также могут содержать гигроскопичные вещества, которые могут притягивать воду в сердцевину таблетки. К таким гигроскопичным веществам можно отнести водорастворимые электролиты, низкомолекулярные органические соединения, осмотические агенты для повышения осмотического давления в лекарственной форме и притягивания воды.
Используемый термин "пациент" принят для обозначения теплокровных животных, таких как млекопитающие, например кошки, собаки, мыши, морские свинки, лошади, коровы, овцы и люди.
Термин "стандартная (отдельная) лекарственная форма" используется для обозначения одно- или многодозовой формы, содержащей некоторое количество активного ингредиента и разбавитель или носитель, причем указанное количество таково, что для однократного введения в лечебных целях нормально требуется одна или несколько таких отдельных предварительно установленных единиц. В случае многодозовых форм, таких как жидкости или таблетки с бороздками, указанная предварительно установленная единица будет являться одной частью, например половиной или четвертью таблетки с бороздками, многодозовой лекарственной формы. Следует иметь в виду, что конкретная доза для любого пациента будет зависеть от различных факторов, включая показания к лечению, используемое лечебное средство, активность лечебного средства, серьезность показаний, состояние здоровья пациента, возраст, пол, массу, питание и фармакологическую реакцию, конкретную используемую лекарственную форму и другие подобные факторы.
В помощь при получении подходящих лекарственных форм для настоящего изобретения можно использовать многие компоненты или соединения. К таким компонентам и соединениям относятся подкисляющий агент, подщелачивающий агент, абсорбент, антифунгицидный консервант, антиоксидант, буферирующее средство, краситель, инкапсулирующее средство, корригент, загуститель, основа суппозиториев, подслащиватель, антиадгезив для таблеток, связующее вещество для таблеток, разбавитель для таблеток и капсул, вещество для получения покрытия на таблетках, эксципиент для непосредственного прессования таблеток, дезинтегрирующий агент, вещество для таблеток, облегчающее скольжение, смазывающее вещество для таблеток, добавка для придания непрозрачности таблеткам/капсулам и глянцующее средство для таблеток и не только они.
Используемый термин "подкисляющий агент" предназначен для обозначения соединения, используемого для создания кислой среды для устойчивости продукта. К таким соединениям относятся, например, уксусная кислота, лимонная кислота, фумаровая кислота, хлороводородная кислота и азотная кислота, и т.п., и не только они.
Используемый термин "подщелачивающий агент" предназначен для обозначения соединения, используемого для создания щелочной среды для устойчивости продукта. К таким соединениям относятся, например, раствор аммиака, карбонат аммония, диэтаноламин, моноэтаноламин, гидроксид калия, борат натрия, карбонат натрия, гидроксид натрия, триэтаноламин и троламин, и т.п., и не только они.
Используемый термин "адсорбент" предназначен для обозначения вещества, способного удерживать другие молекулы на своей поверхности физическими или химическими (хемосорбция) способами. Такими соединениями являются, например, порошкообразный и активированный уголь, и т.п., и не только он.
Используемый термин "консервант" предназначен для обозначения соединения, используемого для предотвращения роста микроорганизмов. К таким соединениям относятся, например, хлорид бензалкония, хлорид бензетония, бензиловый спирт, хлорид цетилпиридиния, хлорбутанол, фенол, фенилэтиловый спирт, фенилмеркунитрат и тимеросаль, и т.п., и не только они.
Используемый термин "антиоксидант" предназначен для обозначения вещества, которое ингибирует окисление и, таким образом, используется для предотвращения разрушения препаратов путем окисления. К таким соединениям относятся, например, аскорбиновая кислота, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, фосфорноватистая кислота, монотиоглицерин, пропилгаллат, аскорбат натрия, бисульфит натрия, формальдегидсульфоксид натрия и метабисульфит натрия, и т.п., и не только они.
Используемый здесь термин "буферирующее вещество" предназначен для обозначения соединения, используемого для противодействия изменениям рН после разбавления или добавления кислоты или щелочи. К таким соединениям относятся, например, метафосфат калия, фосфат калия, одноосновный ацетат натрия, и безводный цитрат натрия, и дигидрат цитрата натрия, и т.п., и не только они.
Используемый здесь термин "краситель" предназначен для обозначения соединения, используемого для придания окраски твердым фармацевтическим препаратам (например, таблеткам и капсулам). К таким соединениям относятся, например, красный FD&C №3, красный FD&C №20, желтый FD&C №6, голубой FD& C №2, зеленый D&C №5, оранжевый FD&C №5, красный D&C №8, жженый сахар и оксид железа, красное вино, и т.п., и не только они. Красители также могут содержать оксид титана, натуральные красители, такие как экстракт кожицы винограда, порошок столовой свеклы, бетакаротин, аннато, кармин, куркума, паприка и т.п.
Используемый термин "инкапсулирующее средство" предназначен для обозначения соединения, используемого для образования тонкой оболочки с целью заключения в нее лекарственного средства или лекарственной препаративной формы для облегчения введения. К таким соединениям относятся, например, желатин, нейлон, сложные полиэфиры, разлагаемые микроорганизмами, D,L-полимолочная кислота, полилактид-ко-10-гликолевая кислота, ацетатфталат целлюлозы, и т.п., и не только они.
Используемый термин "корригент" предназначен для обозначения соединения, используемого для придания фармацевтическому препарату приятного вкуса и часто запаха. Кроме природных корригентов также используют многие синтетические корригенты. К таким соединениям относятся, например, анисовое масло, коричное масло, какао, ментол, апельсиновое масло, мятное масло и ваниль, и т.п., и не только они.
Используемый термин "подсластитель" предназначен для обозначения соединения, используемого для придания сладости фармацевтическому препарату. К таким соединениям относятся, например, аспартам, декстроза, глицерин, маннит, сахариннатрий, сорбит и сахароза, и т.п., и не только они.
Используемый термин "антиадгезивы для таблеток" предназначен для обозначения веществ, предотвращающих прилипание ингредиентов таблеток к пуансонам и матрицам таблетирующей машины во время таблетирования. К таким соединениям относятся, например, стеарат магния, кукурузный крахмал, диоксид кремния, тальк, и т.п., и не только они.
Используемый термин "связующие вещества для таблеток" предназначен для обозначения веществ, используемых для вызывания адгезии частиц порошка в таблеточных гранулятах. К таким соединениям относятся, например, аравийская камедь, альгиновая кислота, натрийкарбоксиметилцеллюлоза, прессованный сахар (например, NuTab), этилцеллюлоза, желатин, раствор глюкозы, метилцеллюлоза, повидон и предварительно желатинизированный крахмал, и т.п., и не только они.
Используемый термин "разбавитель для таблеток и капсул" предназначен для обозначения инертных веществ, используемых в качестве наполнителей для создания нужного объема, свойств текучести и характеристик сжатия при получении таблеток и капсул. К таким соединениям относятся, например, двухосновный фосфат кальция, каолиновая глина, фруктоза, сахароза, декстроза, лактоза, маннит, микрокристаллическая целлюлоза, порошкообразная целлюлоза, осажденный карбонат кальция, сорбит, сульфат кальция, крахмал, и т.п., и не только они.
Используемый термин "вещество для создания покрытия на таблетках" предназначен для обозначения соединения, используемого для формирования покрытия на сформированной таблетке в целях защиты лекарственного средства от разложения под действием атмосферных кислорода или влаги, для обеспечения нужной картины высвобождения лекарственного вещества после введения, для маскирования вкуса или запаха лекарственного вещества или в эстетических целях. Покрытия могут быть разных типов, включая сахарные покрытия, пленочные покрытия или энтеросолюбильные покрытия. Сахарное покрытие имеет в основе воду и является в результате утолщенным покрытием на сформированной таблетке. Таблетки с сахарным покрытием, как правило, растворяются при высоких величинах рН кишечника. Пленочное покрытие представляет собой тонкую оболочку вокруг сформованной таблетки или крупинки. Если такое покрытие не является энтеросолюбильным, оно будет растворяться в желудке. Таблетка или крупинка с энтеросолюбильным покрытием будет проходить через желудок и разрушаться в кишечнике. Некоторые покрытия, являющиеся водонерастворимыми (например, этилцеллюлоза), можно использовать для нанесения на таблетки и крупинки для замедления высвобождения лекарственного средства, когда таблетка проходит через желудочно-кишечный тракт. К таким соединениям относятся, например, раствор глюкозы и сахароза, являющиеся примерами веществ для сахарного покрытия; гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, метилцеллюлоза (например, метоцел) и этилцеллюлоза (например, этоцел), являющиеся примерами пленочных покрытий; и ацетатфталат целлюлозы и шеллак (35% раствор в спирте, "фармацевтическая глазурь"), являющиеся примерами энтеросолюбильного покрытия, и т.п., и не только они.
Используемый термин "эксципиент для непосредственного прессования таблеток" предназначен для обозначения соединения, используемого при непосредственном прессовании композиций для таблеток. К таким соединениям относятся, например, двухосновный фосфат кальция (например, Ditab), фосфо-, высушенная распылением или безводная лактоза, микрокристаллическая целлюлоза (авицелTM), декстран (EMDEXTM), сахароза (NUTABTM) и не только они, но и другие соединения, известные специалистам в этой области техники.
Используемый здесь термин "вещество для облегчения скольжения" предназначен для обозначения веществ, используемых в составах для таблеток и капсул для снижения трения во время прессования таблеток. К таким соединениям относятся, например, коллоидный или высокодисперсный диоксид кремния, стеарат магния, кукурузный крахмал и тальк, и т.п., и не только они.
Используемый термин "смазывающее вещество для таблеток" предназначен для обозначения веществ, используемых в составах для таблеток для снижения трения во время прессования таблеток. К таким соединениям относятся, например, стеарат кальция, стеарат магния, минеральное масло, стеариновая кислота, гидрогенизированное растительное масло, бензойная кислота, полиэтиленгликоль, NaCl, PRUVTM, стеарат цинка, и т.п., и не только они.
Используемый термин "добавка для придания непрозрачности таблеткам/капсулам" предназначен для обозначения соединения, используемого для придания непрозрачности покрытию на таблетке или капсуле. Его можно использовать одно или в сочетании с красителем. К таким соединениям относится, например, диоксид титана, и т.п., и не только они.
Используемый термин "средство для глянцевания таблеток" предназначен для обозначения соединения, используемого для придания привлекательного блеска таблеткам с покрытием. К таким соединениям относятся, например, карнаубский воск, белый воск, и т.п., и не только они.
Обнаружено, что препаративная форма настоящего изобретения, включающая физическую смесь лечебного средства и SAE-CD, особенно подходит для ряда лечебных средств, включая симвастатин, криптофицин, жаспамид, амброзин, бусульфан, пропанолол, этопозид, таксол, брефелдин А, пролекарство брефелдина А (NSC#D656202), 9-амино-20(S)-камптотецин, камптотецин, ацетат преднизолона, преднизолон, панкреастатин, ризоксин, бриостатин 1, таксотер-О6-бензилгуанин, андростан, гуанин, хлорамфеникол, дапсон, сульфакон, бенклометазон, дипропионат, менадион, цитрат тамоксифена, холестерин, эстрон, гидрохлорид верапмила, эквилин, варфарин, индометацин, фенитоин, циннаризин, гидрохлорид амиодарона, напроксен, пироксикам, тиабендазол, папаверин, миконазол (свободное основание), нифедипин, тестостерон, прогестерон, карбамазепин, метилпреднизолон, дексаметазон, гидрокортизон и нитрат миконазола.
Описанное выше можно легче понять, обратившись в приведенным далее примерам, где подробно описаны процедуры получения препаративных форм по настоящему изобретению. Указанные примеры не следует рассматривать как ограничивающие объем и сущность настоящего изобретения.
Пример 1
Препаративная форма с отсроченным высвобождением, содержащая тестостерон и (SBE)7-β -CD
Данный пример демонстрирует полезность настоящего изобретения для получения препаративных форм с отсроченным высвобождением фармакологически активного средства, причем примером такого средства является тестостерон.
Исследования растворимости фаз
К 0,25 мл растворов (SBE)7-β -CD концентрации в интервале от 0,0 до 0,05 моль/л добавляют избыточные количества тестостерона. Дисперсии оставляют для установления равновесия минимум на 24 ч при встряхивании на водяной бане (100 такт/мин, 25° С). Дисперсии центрифугируют 10 мин при 2500 об/мин, отбирают образец супернатанта в 20 мкл с помощью 100-мкл газоплотного шприца (Hamilton Co., Невада), разбавляют подвижной фазой и анализируют методом ВЭЖХ на содержание тестостерона в растворе. Затем определяют константу связывания K1:1 тестостерон - (SBE)7-β -CD методом Higuchi и Connors для диаграммы типа Al.
Получение сердцевины таблетки
Сердцевину таблетки получают при молярном соотношении тестостерон/(SBE)7-β -CD 1/1. Сердцевина таблетки состоит или из комплекса тестостерона и (SBE)7-β -CD, или из физической смеси двух соединений. Комплекс получают путем сушки вымораживанием раствора тестостерона и (SBE)7-β -CD (5-15% в (SBE)7 -β -CD)). Получают также таблетки, не содержащие (SBE)7-β -CD). Они состоят из тестостерона и смеси фруктозы и лактозы (50:50 мас./мас., Fischer Scientific, Нью-Джерси) в соотношении 1/1. Смеси измельчают в ступке и просеивают через сито 200 меш (75 мкм) в условиях низкого влагосодержания. Когда смеси не используют, их хранят в эксикаторе. Таблетки примерно в 120 мг прессуют в пресс-форме для таблеток с использованием пресса Carver Laboratory (Fred S. Carver Inc., Нью-Джерси) при давлении 1 т в течение 1 мин.
Получение полупроницаемой мембраны
Состав для покрытия для препаративной формы получают путем растворения 1,0% сорбита (Sigma, Миссури) в 3,7% бидистиллированной воды и 0,4% PEG 400 (Sigma, Миссури). В растворе суспендируют 2,0% ацетата целлюлозы (СА-398-10, Eastman Chemical Co., Теннесси) и к смеси добавляют 55,7% метиленхлорида и 37,2% метанола. Дисперсию встряхивают и обрабатывают ультразвуком до полного растворения твердых компонентов. Раствор для покрытия распыляют воздушным распылителем (Airbruch, Paashe) на поверхности из нержавеющей стали при равномерном воздушном потоке (40° С). Затем оставляют при комнатной температуре на 24 ч. Мембраны отделяют от поверхности, проверяют на наличие разрывов и трещин под оптическим микроскопом (Х70) и определяют их толщину с использованием микрометра (Ames, Миннесота). Затем мембраны закрепляют на разъемной пресс-форме, содержащей таблетку, приводя в контакт с поверхностью таблетки сторону, которая прилегала к стальной пластине.
Исследования высвобождения in vitro
Исследования высвобождения осуществляют, помещая разъемную форму в прибор для растворения II, USP (Vanderkamp 600, VanKel Industries Inc.), содержащий 900 мл воды при 37° С, 100 об/мин. Образцы отбирают в разные моменты времени. Высвобождение в 100% определяют, удаляя мембрану из пресс-формы и допуская полное растворение лекарственного средства. Образцы анализируют методом ВЭЖХ на содержание тестостерона.
Определение тестостерона методом ВЭЖХ
Тестостерон детектируют с использованием колонки ODS Hypersil, 15 см, с последующей УФ-детекцией при 238 нм (Shimadzu Scientific Instruments, Inc., Япония). Подвижная фаза состоит на 60% из ацетонитрила и на 40% из бидистиллированной воды.
Пример 2
Препаративная форма с отсроченным высвобождением, содержащая дипиридамол и (SBE)7-β -CD
Аналитические процедуры
Дипиридамол анализируют с использованием колонки ODS Hypersil, 15 см. Объем образца составляет 20 мкл, а длина волны УФ-детекции 285 нм (Shimadzu 6A, Shimadzu, Япония). Подвижная фаза, состоящая на 70% из метанола и на 30% из аммонийфосфатного буфера (рН 5,0), проходит через колонку при скорости потока 1,5 мл/мин. (SBE)7-β -CD детектируют с использованием флуоресцентного анализа 0,2 мл 1 мМ раствора 2, 6-толуидинонафталинсульфоната на 0,8 мл образца. Указанный раствор затем возбуждают при 325 нм и детектируют излучение флуоресценции при 455 нм с использованием детектора флуоресценции Perkin Elmer 25 (Perkin-Elmer, Коннектикут).
Эксперименты по растворимости фаз
Получают растворы (SBE)7-β -CD (0-0,1 М) в разных буферных растворах при величинах рН в интервале от 4,0 до 7,0 (цитрат для 4 и 5; фосфат для 6 и 7). К 0,25 мл таких растворов добавляют избыточные количества дипиридамола и оставляют для установления равновесия минимум на 24 ч при встряхивании на водяной бане при 25° С (предварительные эксперименты показали, что равновесие достигается в пределах 24 ч). Растворы центрифугируют в течение 10 мин при 2500 об/мин. Осторожно отбирают образец супернатанта в 20 мкл с использованием 100-мкл газоплотного шприца (Hamilton Co., Невада), разбавляют подвижной фазой и анализируют методом ВЭЖХ. Затем данные по растворимости используют для определения константы связывания с использованием метода Higuchi и Connors для поведения фазы типа AL.
Получение физической смеси
Дипиридамол (Sigma, Миссури), (SBE)7-β -CD и лимонную кислоту (Sigma, Миссури) (молярное соотношение 1:9:3) физически смешивают и измельчают вручную с использованием ступки и пестика. Затем измельченную смесь просеивают через сито 200 меш (75 мкм). Этот процесс повторяют дважды. Когда указанную смесь не используют, ее хранят в эксикаторе.
Описание разъемной пресс-формы и получение таблеток
Разъемная пресс-форма состоит из цилиндрической основной детали из нержавеющей стали, платформы из нержавеющей стали, верхней крышки из нержавеющей стали, двух тефлоновых пластин (верхней и нижней) и тефлоновых вставок. Цилиндрическая основная деталь имеет отверстие (радиусом 7,5 мм) по центру, в котором прессуют таблетку. Как верхняя крышка из нержавеющей стали, так и верхняя тефлоновая пластина имеют отверстия по центру того же радиуса. Основную деталь переворачивают и крепят на платформе. В цилиндрическое отверстие засыпают приблизительно 120 мг физической смеси, содержащей лекарственное средство, (SBE)7-β -CD и лимонную кислоту, и на нее прочно устанавливают пуансон. Сердцевину таблетки прессуют с усилием в 1 т в течение 1 мин с использованием пресса Carver (Fred Carver Inc., Нью-Джерси). Пуансон осторожно извлекают из основной детали.
Пленочные покрытия
Получение полимерных растворов
Составы для покрытий из EUDRAGITTM получают путем растворения 5,0% (мас./мас.) EUDRAGITTM R или S (Huls America, Нью-Джерси), 5% мочевины (SIGMA, Миссури) или полиэтиленгликоля (PEG 3350, SIGMA, Миссури) и 0,75% триэтилцитрата (TEC, SIGMA, Миссури) в 89,25% этанола. Растворение осуществляют до тех пор, пока не получат прозрачный раствор. Готовят растворы ацетата целлюлозы (CA-320S7, Eastman Chemical Co., Теннесси) и фталата гидроксипропилметилцеллюлозы (НРМСР, Eastman Chemical Co., Теннесси), растворяя 5% 5 полимеров и 1% ТЕС в 94% растворителя, состоящего из равных количеств метиленхлорида и метанола. Соотношение СА и НРМСР изменяют от 50:50 до 75:25, но общее количество полимера всегда сохраняется на уровне 5%. Растворение осуществляют до тех пор, пока не получат прозрачные растворы.
На несение покрытия на таблетки
Затем раствор для формирования покрытия распыляют воздухом непосредственно на поверхности таблеток в условиях равномерного воздушного потока (приблиз. 70° С). Таблетки с покрытием сушат еще в течение 15 мин в том же воздушном потоке. Таблетки дополнительно сушат в течение 12-16 ч при комнатной температуре. Полагают, что толщина мембраны составляет разницу в толщине таблетки до и после нанесения покрытия. Измерения толщины осуществляют с использованием резьбового микрометра.
Исследования высвобождения in vitro
Исследования высвобождения для таблеток с покрытием из Eudragit L и СА:НРМСР проводят, помещая разъемную форму в прибор для растворения II, USP (Vanderkamp 600, VanKel Industries Inc.), содержащий 450 мл НС1 (рН 1,5, 37° С, 100 об/мин). Через 2 ч форму осторожно извлекают, помещают в 450 мл фосфатного буфера (рН 1,5, 37° С, 100 об/мин) и продолжают эксперимент по растворению. Периодически отбирают 1,5-мл образцы и в сосуд для растворения добавляют равные количества растворяющей среды. Для таблетки с покрытием из СА:НРМСР 100%-ное высвобождение определяют, удаляя мембрану из пресс-формы и допуская полное растворение лекарственного средства. Эксперименты по высвобождению для таблеток с покрытием из Eudragit проводят подобным образом в 450 мл НС1 в течение первых 2 ч, затем их помещают в фосфатный буфер (рН 6,4) еще на 5 ч и затем помещают в фосфатный буфер (рН 7,2). Условия высвобождения и процедуры такие же, как описано выше.
Образец в 0,5 мл разбавляют вполовину подвижной фазой, и затем разбавленные образцы анализируют с использованием ВЭЖХ-анализа для определения концентрации лекарственного средства, как описано в последнем разделе. Остаток образца фильтруют через мембрану из PVDF (Fischer Scientific, Нью-Джерси), и затем свободные от лекарственного средства образцы анализируют на (SBE)7-β -CD с использованием флуорометрического анализа, как описано ниже.
Пример 3
Препаративная форма с отсроченным высвобождением, содержащая метилпреднизолон и (SBE)7-β -CD
Исследования растворимости фаз
К 0,25 мл растворов (SBE)7-β -CD концентрации в интервале от 0,0 до 0,2 моль/л добавляют избыточные количества метилпреднизолона. Дисперсии оставляют для установления равновесия минимум на 24 ч при встряхивании на водяной бане (100 такт/мин, 25° С). Дисперсии центрифугируют 10 мин при 2500 об/мин, отбирают образец супернатанта в 20 мкл с помощью 100-мкл газоплотного шприца (Hamilton Co., Невада), разбавляют подвижной фазой и анализируют методом ВЭЖХ на содержание метилпреднизолона в растворе. Затем определяют константу связывания K1:1 метилпреднизолон - (SBE)7-β -CD методом Higuchi и Connors для диаграммы типа AL.
Получение сердцевины таблетки
Сердцевину таблетки получают при молярном соотношении метилпреднизолон/(SBE)7-β -CD 1/7. Молярное соотношение вычисляют с использованием ранее определенной константы связывания для того, чтобы иметь в сердцевине таблетки количество (SBE)7-β -CD, достаточное для солюбилизации всего имеющегося метилпреднизолона. Также получают сердцевины таблеток с соотношениями 1/3 и 1/10 для того, чтобы исследовать влияние соотношения метилпреднизолон/(SBE)7-β -CD на высвобождение (см. результаты 4). Сердцевина таблетки состоит или из комплекса метилпреднизолона и (SBE)7-β -CD, или из физической смеси двух соединений. Комплекс получают путем сушки вымораживанием раствора метилпреднизолона и (SBE)7-β -CD (5-15% в (SBE)7-β -CD)). Получают также таблетки, не содержащие (SBE)7-β -CD. Они состоят из метилпреднизолона и смеси фруктозы и лактозы (50:50 мас./мас., Fischer Scientific, Нью-Джерси) в соотношении 1/7. Смеси измельчают в ступке и просеивают через сито 200 меш (75 мкм) в условиях низкого влагосодержания. Когда смеси не используют, их хранят в эксикаторе. Таблетки примерно в 150 мг прессуют в разъемной пресс-форме с использованием пресса Carver Laboratory (Fred S. Carver Inc., Нью-Джерси) при давлении 1 т в течение 1 мин.
Получение полупроницаемой мембраны
Состав для покрытия для препаративной формы получают путем смешивания 4,5% этилцеллюлозы (этоцель, стандарт 10 высшего качества, Dow Chemicals, Мичиган) с эквивалентным количеством полиэтиленгликоля 3350 (PEG 3350, Sigma, Миссури). К смеси добавляют 0,9% PEG 400 (Sigma, Миссури) и 90,1% абсолютного этанола. Дисперсию встряхивают и обрабатывают ультразвуком до полного растворения твердых компонентов. Раствор для покрытия распыляют воздушным распылителем (Airbruch, Paasche) на тефлоновую поверхность в условиях равномерного воздушного потока (40° С). По окончании распыления мембраны сушат в потоке воздуха при 40° С в течение 5 мин. Затем их оставляют при комнатной температуре на 24 ч. Мембраны отделяют от тефлоновой поверхности, проверяют на наличие разрывов и трещин под оптическим микроскопом (Х70) и определяют их толщину с использованием микрометра (Ames, Миннесота). Затем мембраны закрепляют на разъемной пресс-форме, содержащей таблетку, приводя в контакт с поверхностью таблетки сторону, которая прилегала к тефлону.
Исследования высвобождения in vitro
Исследования высвобождения осуществляют, помещая разъемную форму в прибор для растворения II, USP (Vanderkamp 600, VanKel Industries Inc.), содержащий 350 мл воды при 37° С, 100 об/мин. Образцы отбирают в разные моменты времени. 100% высвобождение определяют, удаляя мембрану из пресс-формы и допуская полное растворение лекарственного средства. Образцы анализируют методом ВЭЖХ на содержание метилпреднизолона и (SBE)7-β -CD соответственно.
Обнаружение метилпреднизолона методом ВЭЖХ
Метилпреднизолон детектируют с использованием колонки ODS Hypersil, 15 см, с последующей УФ-детекцией при 254 нм (LC-10AT, Shimadzu Scientific Instruments, Inc., Япония). Подвижная фаза состоит на 30% из ацетонитрила и на 70% из ацетатного буфера, рН 4,7.
Флуорометрическая детекция (SBE)7-β -CD
(SBE)7-β -CD обнаруживают, добавляя 0,2 мл 1Е-3 моль/л раствора 2,6-10-толуидинонафталинсульфоната на 0,8 мл образца. Раствор возбуждают при 325 нм и детектируют излучение флуоресценции при 455 нм (флуоресцентный спектрофотометр 65040, Perkin-Elmer, Коннектикут).
Пример 4
Таблетка, содержащая (SBE)7 -β -CD и лечебное средство
Лекарственные формы - таблетки по изобретению можно получить следующим образом. Лечебное средство и (SBE)7-β -CD смешивают в сухом виде в течение примерно 10 мин. Добавляют остальные ингредиенты, и сухую смесь перемешивают в течение примерно 10 мин. Затем прессуют таблетки до твердости примерно 8-10 кг. Далее приводятся составы, используемые для получения лекарственных форм изобретения.
Препаративная форма с индометацином
Ингредиент Количество (мг)
1: индометацин 25
1: SBE7-β -CD 300
2: EMDEXTM 160
2: полиокс-0,4М(полиэтиленоксид) 20
2: сахароза 55
3: PRUVTM (стеарилфумарат натрия) 12
3: стеарат магния 3
3: кукурузный крахмал 25
Всего 600
Указанные выше ингредиенты используют для получения сердцевины таблетки в 600 мг с профилем быстрого высвобождения. Цифры рядом с названиями ингредиентов показывают общий порядок добавления. После добавления каждой группы ингредиентов смесь перемешивают в сухом состоянии в течение 5-10 мин. PRUVTM, стеарат магния и кукурузный крахмал добавляют отдельно (стадия 3) от других ингредиентов и добавляют к общей процедуре дополнительную стадию сухого перемешивания в течение 5 мин.
Препаративная форма с дипиридамолом
Ингредиент Количество (мг)
дипиридамол 25
1: SBE7-β -CD 300
2: лимонная кислота 53
2: PEG 3350 25
2: декстроза 125
2: кабосил М5Р 2
3: PRUVTM 10
3: стеарат магния 5
3: Ac-Di-SolTM 10
Всего 555
Указанные выше ингредиенты используют для получения сердцевины таблетки в 555 мг с профилем быстрого высвобождения. Цифры рядом с названиями ингредиентов показывают общий порядок добавления. После добавления каждой группы ингредиентов смесь перемешивают в сухом состоянии в течение 5-10 мин. PRUVTM, стеарат магния и Ac-Di-SolTM добавляют отдельно (стадия 3) от других ингредиентов и добавляют к общей процедуре дополнительную стадию сухого перемешивания в течение 5 мин.
Препаративная форма с пироксикамом
Ингредиент Количество (мг)
1: пироксикам 10
1: SBE4-β -CD 77
2: сорбит 45
2: декстроза 50
2: лимонная кислота 10
2: ксилит 47,5
2: PEG 3350 9
3: стеарат магния 1,5
3: мелкодисперсный диоксид кремния 1,5
3: натрийкросскармелоза 5,5
Всего 257
Указанные выше ингредиенты используют для получения сердцевины таблетки в 500 мг с профилем быстрого высвобождения. Цифры рядом с названиями ингредиентов показывают общий порядок добавления. После добавления каждой группы ингредиентов смесь перемешивают в сухом состоянии в течение 5-10 мин. Стеарат магния, мелкодисперсный диоксид кремния (кабосилTM М5Р) и натрийкросскармелозу добавляют отдельно (стадия 3) от других ингредиентов и добавляют к общей процедуре дополнительную стадию сухого перемешивания в течение 5 мин.
Препаративная форма с дилтиаземом
Ингредиент Количество (мг)
1: дилтиазем 10
1: SBE7-β -CD 270
2: лимонная кислота 19
2: PEG 6000 5
2: декстроза 246
2: сорбит 40
3: PRUVTM 5
2: кабосилTM М5Р 3
3: натрийкрахмалгликолят 2
Всего 600
Указанные выше ингредиенты используют для получения таблетки в 600 мг с профилем быстрого высвобождения. Цифры рядом с названиями ингредиентов показывают общий порядок добавления. После добавления каждой группы ингредиентов смесь перемешивают в сухом состоянии в течение 5-10 мин. PRUVTM, кабосилTM М5Р и натрийкрахмалгликолят добавляют отдельно (стадия 3) от других ингредиентов и добавляют к общей процедуре дополнительную стадию сухого перемешивания в течение 5 мин.
Препаративная форма с варфарином
Ингредиент Количество (мг)
1: варфарин 2
1: SBE7-β -CD 150
2: EMDEXTM 138,5
2: NаНСО3 20
2: лаурилсульфат натрия 2,0
3; стеарат магния 2,5
Всего 315
Указанные выше ингредиенты используют для получения сердцевины таблетки в 315 мг с профилем быстрого высвобождения. Цифры рядом с названиями ингредиентов показывают общий порядок добавления. После добавления каждой группы ингредиентов смесь перемешивают в сухом состоянии в течение 5-10 мин. Стеарат магния добавляют отдельно (стадия 3) от других ингредиентов и добавляют к общей процедуре дополнительную стадию сухого перемешивания в течение 5 мин.
Препаративная форма с метилпреднизолоном А
Ингредиент Количество (мг)
1: МР 10
1: SBE7-γ -CD 200
2: ксилит 151
2: предварительно желатинизированный крахмал 150
2: сахароза 33
3: кабосилTM М5Р 4
3: PRUVTM 12
Всего 560
Указанные выше ингредиенты используют для получения сердцевины таблетки в 560 мг с профилем быстрого высвобождения. Цифры рядом с названиями ингредиентов показывают общий порядок добавления. После добавления каждой группы ингредиентов смесь перемешивают в сухом состоянии в течение 5-10 мин. PRUVTM и кабосилTM М5Р добавляют отдельно (стадия 3) от других ингредиентов и добавляют к общей процедуре дополнительную стадию сухого перемешивания в течение 5 мин.
Препаративная форма метилпреднизолоном В
Ингредиент Количество (мг)
МР 4
Высушенный распылением моногидрат лактозы
(SUPERTABTM, FMC Corp.) 96
Микрокристаллическая целлюлоза
(CEOLUSTM, FMC Corp.) 32
Стеарилфумарат натрия
(PRUVTM, Mendell) 2
SBE7-β -CD (CAPTISOLTM, Cydex, Inc.) 116
Всего 250
Приведенную препаративную форму получают, уменьшая сначала размер частиц SBE7 -β -CD с помощью призматической деревянной (wedgewood) ступки и пестика и последующего просеивания через сито 100 меш. Стеарилфумарат натрия также просеивают через сито 100 меш перед применением. SBE7-β -CD и МР смешивают с учетом геометрии в стеклянной ступке. Затем во время смешивания последовательно добавляют компоненты CEOLUSTM, SUPERTABTM, PRUVTM. Таблетки, каждая массой приблизительно 250 мг, прессуют вручную на таблеточном прессе Stokes B2 с использованием стандартной оснастки с лунками 7 мм с вогнутой поверхностью. Таблетки прессуют до твердости приблизительно 6350 кг (14 кф).
Состав для минитаблеток с индометацином для желатиновых капсул
Ингредиент Количество (мг)
1: индометацин 25
1: SBE7-β -CD 300
2: EMDEXTM 155
2: полиокс-0,4М(полиэтиленоксид) 20
2: сахароза 55
3: PRUVTM (стеарилфумарат натрия) 20
3: кукурузный крахмал 25
Всего 600
Указанные выше ингредиенты используют при получения 600-мг твердых желатиновых капсул, содержащих минитаблетки 3× 200 мг с пленочным покрытием в соответствии с изобретением. Сердцевины минитаблеток без пленочного покрытия имеют профиль быстрого высвобождения. Минитаблетки получают следующим образом. Цифры рядом с названиями ингредиентов показывают общий порядок добавления. После добавления каждой группы ингредиентов смесь перемешивают в сухом состоянии в течение 5-10 мин. PRUV™ и кукурузный крахмал добавляют отдельно (стадия 3) от других ингредиентов и добавляют к общей процедуре дополнительную стадию сухого перемешивания в течение 5 мин. Затем смесь делят на три равных части и каждую часть прессуют в минитаблетку. После нанесения на сердцевину таблетки покрытия из пленкообразователя по изобретению в соответствии с примером, описанным ниже, минитаблетки с покрытием помещают в твердую желатиновую капсулу.
Следует отметить, что в некоторых из приведенных выше примерах связующие вещества, такие как EMDEXTM и полиокс-0,4М, можно заменить веществами, регулирующими высвобождение, или модификаторами скорости высвобождения, такими как НРМС, НРС, ацетатбутират целлюлозы, ацетатпропионат целлюлозы, пропионат целлюлозы, караген, ацетат целлюлозы, нитрат целлюлозы, метилцеллюлоза, гидроксиэтилцеллюлоза, этилцеллюлоза, поливинилацетат, латексные дисперсии, аравийская камедь, трагакант, гуаровая смола, желатин и т.п. Таким образом, получают сердцевины таблеток без покрытия с профилем регулируемого или отсроченного высвобождения и затем, необязательно, наносят на них покрытие из пленкообразователей изобретения для получения таблетки с профилем комбинированного пролонгированного и регулируемого или отсроченного высвобождения, т.е. после достижения предварительно определенной части желудочно-кишечного тракта (GI-тракта) пленка на таблетке будет становиться пористой и позволит лечебному средству высвобождаться из сердцевины таблетки по типу регулируемого или отсроченного высвобождения. Сердцевина таблетки с отсроченным или регулируемым высвобождением подойдет для таблеток, имеющих пленкообразователь, хорошо растворимый в воде, очень пористую пленку, содержащих большое количество осмотического или солюбилизирующего агента и отвечающих другим подобным условиям.
Другими способами получения сердцевины таблеток являются, например, сухая грануляция, влажная грануляция, грануляция из расплава, экструзия из расплава и прессование-измельчение-повторное прессование. Соответственно способ сухой грануляции может включать предварительное формирование таблеток или заготовок из всех ингредиентов таблеток, за исключением SAE-CD, измельчение предварительно полученной таблетки или заготовки, смешивание измельченного материала с SAE-CD и повторное прессование смеси с образованием таблетки нужного состава.
Состав сердцевины таблетки с регулируемым или отсроченным высвобождением индометацина
Ингредиент Количество (мг)
1: индометацин 25
1: SBE7 -β -CD 300
2: НРМС 100
2: сахароза 55
3: PRUVTM (стеарилфумарат натрия) 20
3: кукурузный крахмал 25
Всего 525
Указанные выше ингредиенты используют для получения сердцевины таблетки в 525 мг с профилем регулируемого или отсроченного высвобождения. Цифры рядом с названиями ингредиентов показывают общий порядок добавления. После добавления каждой группы ингредиентов смесь перемешивают в сухом состоянии в течение 5-10 мин. PRUVTM и кукурузный крахмал добавляют отдельно (стадия 3) от других ингредиентов и добавляют к общей процедуре дополнительную стадию сухого перемешивания в течение 5 мин.
Состав сердцевины таблетки с регулируемым высвобождением преднизолона
Ингредиент Количество (мг)
Преднизолон 15
SBE7-β -CD 210
НРМС К100М 75
Всего 300
Указанные выше ингредиенты используют для получения сердцевины таблетки в 300 мг с профилем регулируемого высвобождения. Ингредиенты смешивают вручную, и отдельные таблетки получают на прессе Carver под давлением 1 т в течение 7 с. Таблетки получают с использованием стандартной оснастки с лунками ~8 мм (5/16") с вогнутой поверхностью. Определение профиля высвобождения путем растворения проводят с соответствии с методом 2 USP при 37° С, мешалка 100 об/мин, в 900-мл водяной бане. Количество выделившегося преднизолона (PD) определяют методом ВЭЖХ, а количество выделившегося SBE7-β -CD определяют с помощью TNS.
Другие сердцевины таблеток с регулируемым высвобождением, полученные по изобретению, содержат перечисленные ниже ингредиенты в соответствующем количестве.
Ингредиент Количество (мг)
Преднизолон 5-30
SBE7-β -CD 5-210
Лактоза 0-210
НРМС К100М 50-200
Фармацевтическая препаративная форма с регулируемым высвобождением - сердцевина без покрытия - может содержать лечебное средство, SAE-CD, модификатор скорости высвобождения и, необязательно, один или несколько фармацевтических эксципиентов.
Пример 5
Сердцевина таблетки, полученная из гранул, содержащих SBE7-β -CD, и лечебное средство
Лекарственные формы - таблетки согласно изобретению - могут содержать гранулы, и их получают, как правило, влажной грануляцией следующим образом. Указанные проценты соответствуют массовым процентам относительно конечной массы композиции. Данный пример имеет в основе дозу метилпреднизолона (МР) 10 мг. Лечебное средство (20%) и SBE7-β -CD смешивают в сухом состоянии с образованием физической смеси. Лактозу (40%) и декстрозу (8%) гранулируют с водной суспензией ПВП (4%) до получения прироста 2 мас.% и получают нужные гранулы. NаНСО3 (3,5%), PRUVTM (4,5%), SiO2 (0,5%) и ксилит (2%) смешивают в сухом состоянии с гранулами и физической смесью, и полученную смесь прессуют в таблетки до твердости примерно 8-10 кг.
Пример 6
Пленочные покрытия для таблеток
Пленочные покрытия для таблеток согласно изобретению получают с использованием перечисленных далее ингредиентов и условий. Составы для пленочных покрытий, как правило, получают на основе воды, воды и растворителя и/или растворителя, например спирта. Как правило, пленкообразователь растворяют и/или суспендируют в примерно 1/2 объема предполагаемого объема раствора и добавляют другие ингредиенты. Затем смесь доводят до конечного объема, добавляя соответственно воду или растворитель. Полученный раствор или суспензию используют в соответствии с примером 7 для формирования покрытия на серцевинах таблеток, полученных так, как описано выше. Составы покрытий, подробно описанные ниже, приводятся в расчете на 100 мл конечного раствора или суспензии.
Композиция для пленки с EUDRAGITTM RS 30D
Ингредиент Количество (г)
EUDRAGITTM
RS 30D 15 (на сухую массу)
Триэтилцитрат (ТЕС) 3
Тальк 7,5
EUDRAGITTM RS 30D получают от изготовителя в виде 30 мас.% водной латексной дисперсии. EUDRAGITTM RS 30D (пленкообразователь) диспергируют в воде (50 мл) при перемешивании и добавляют последовательно ТЕС, тальк и НРМС (порообразователь). Объем полученного раствора доводят до 100 мл, добавляя воду. Вообще могут быть полезными и другие порообразователи и пленкообразователи.
Композиция для пленки с EUDRAGITTM RL 100
Ингредиент Количество (г)
EUDRAGITTM RL 100 15 (на сухую массу)
TEC 3
Тальк 7, 5
НРС 1,5
Композицию с EUDRAGITTM RL 100 получают в изопропаноле (IPA). EUDRAGITTM RL 100 растворяют в IPA (50 мл) при перемешивании и добавляют последовательно ТЕС, тальк и НРС. Объем полученного раствора доводят до 100 мл, добавляя IPA.
Композиция для пленки с EUDRAGITTM RS 30D и EUDRAGITTM RL 30D
Ингредиент Количество (г)
EUDRAGITTM RS 30D 13,5 (на сухую массу)
EUDRAGITTM RL 300 1,5 (на сухую массу)
ТЕС 3
Тальк 7,5
НРС 1,5
EUDRAGITTM RL 30D и EUDRAGITTM RS 30D разводят в воде при перемешивании и добавляют последовательно ТЕС, тальк и НРС. Объем полученного раствора доводят до нужного, добавляя воду. EUDRAGITTM RL 30D служит для улучшения водопроницаемости пленки из EUDRAGITTM.
Композиция для пленки с этилцеллюлозой
Ингредиент Количество (г)
Этилцеллюлоза 15 (на сухую массу)
Дибутилсебацат 4,5
Тальк 8,0
НРМС Е5 1,5
Этилцеллюлозу растворяют в изопропаноле при перемешивании и добавляют последовательно дибутилсебацат, тальк и НРМС Е5. Полученный объем доводят до нужного, добавляя изопропанол. Такую же процедуру проводят с использованием НРС вместо НРМС Е5.
Композиция для пленки с ацетатом целлюлозы
Ингредиент Количество (г)
Ацетат целлюлозы 12 (на сухую массу)
ТЕС 5
Тальк 7,5
Лактоза 1,5
Ацетат целлюлозы растворяют в изопропаноле при перемешивании и добавляют последовательно тальк и лактозу. Полученный объем доводят до нужного, добавляя растворитель. При использовании такой композиции для пленки может возникнуть необходимость работать на машине для нанесения покрытий Hi при 45° С или более высокой температуре.
Композиция для пленки с EUDRAGITTM RS 30D и EUDRAGITTM L 100
Ингредиент Количество (г)
EUDRAGITTM RS 30D 15 (на сухую массу)
микроизмельченный
EUDRAGITTM L 100 1 (на сухую массу)
Триэтилцитрат (ТЕС) 3
Тальк 7,5
ТЕС и тальк добавляют при перемешивании к дисперсии EUDRAGITTM RS 30D. Добавляют при энергичном перемешивании порошок тонкоизмельченного EUDRAGITTM L 100, и объем дисперсии доводят до нужного, добавляя воду. В таких комбинированных составах пленок вообще могут быть полезны другие пленкообразователи, такие как ацетат целлюлозы и НРМСР.
Композиция для пленки с EUDRAGITTM L 100
Ингредиент Количество (г)
EUDRAGITTM L 100 5 (на сухую массу)
Триэтилцитрат (ТЕС) 3
Тальк 7,5
EUDRAGITTM L 100 при перемешивании растворяют или суспендируют в изопропаноле или воде соответственно и последовательно добавляют ТЕС и тальк. Полученный объем доводят до нужного, добавляя еще растворитель или воду. В некоторых вариантах воплощения изобретения данная пленка будет использоваться для создания таблетки с высвобождением в тонком кишечнике или для нанесения покрытия на таблетки, уже имеющие другое пленочное покрытие по изобретению. Полученные таблетки обеспечивают препаративную форму с пролонгированным, регулируемым или отсроченным высвобождением лечебного средства из сердцевины таблетки.
Композиция для получения пленки с EUDRAGITTM RS 30D и EUDRAGITTM RL30D
Ингредиент Количество (г)
EUDRAGITTM
RS 30D 15,0 (на сухую массу)
EUDRAGITTM
RL 30D 1,67 (на сухую массу)
Пластификатор (триэтилцитрат) 2,8
Антиадгезив (глцерилмоностеарат
ImwittorTM 900) 1, 5
Деионизированная вода сколько требуется
Воду, триэтилцитрат и ImwittorTM 900 соединяют в химическом стакане для образования дисперсии, которую гомогенизируют с использованием смесителя PowergenTM до тех пор, пока температура не станет ниже 35° С. Затем дисперсию просеивают через сито 60 меш, восстанавливают и перемешивают до тех пор, пока температура не станет ниже 30° С. Дисперсию EUDRAGITTM, включающую EUDRAGITTM RS 30D (30 мас.% водная дисперсия) и EUDRAGITTM RL 30D (30 мас.% водная дисперсия), пропускают через сито 60 меш, затем соединяют с первой дисперсией и оставляют для установления равновесия на 30 мин перед распылением полученной дисперсии на сердцевины таблеток. Указанная композиция дает полупроницаемую мембрану, которая не содержит порообразователя.
Композиция для получения пленки с EUDRAGITTM RS 30D и EUDRAGITTM RL 30D
Ингредиент Количество (мас.%)
EUDRAGITTM RS 30D 40
EUDRAGITTM RL 30D 3
Пластификатор (триэтилцитрат) 2, 5
Тальк 6
Деионизированная
вода сколько требуется до 100
Указанная композиция не содержит порообразователя, но тем не менее позволяет влаге проникать в сердцевину таблетки. Дисперсии пластифицируют ТЕС за 1 ч до распыления на сердцевины таблеток.
Композиция для получения пленки с AQUACOATTM
Ингредиент Количество (мас.%)
AQUACOATTM50
Дибутилсебацат (DBS) 3
Вода сколько требуется до 100
Указанные дисперсии пластифицируют DBS по меньшей мере за 8 ч до распыления на сердцевины таблеток.
Другие дисперсии на основе этилцеллюлозы, такие как продукты SURELEASETM от Coloreon, также подходят для покрытий для целей регулируемого высвобождения.
Пример 7
Нанесение покрытия из пленкообразователей на сердцевину таблетки
Таблетки с пленочным покрытием, как правило, получают так, как описано далее. Другие равнозначные условия и оборудование, известные специалистам в этой области техники, как правило, будут полезны при получении данных препаративных форм.
Используют машину для нанесения покрытий Vector Hi при ел е дующих р ежимах:
температура на входе 45-75° С;
температура на выходе 28-38° С;
скорость распыления 2-3 г/мин;
загрузка таблеток 300 г;
скорость вращения 20 об/мин.
После получения раствора или суспензии, содержащих пленкообразователь и другие ингредиенты (согласно примеру 6), сердцевины таблеток помещают в машину для нанесения покрытий и формируют покрытие до тех пор, пока не образуется пленка толщиной примерно 100-125 мкм. Таблетки с покрытием сушат при примерно 40° С в течение ночи. Толщину таблеток и состав пленки изменяют по необходимости. Данный способ используют, как правило, для составов для получения пленочных покрытий на основе воды или растворителя.
Пример 8
Многослойные таблетки
Двухслойные и многослойные таблетки, содержащие физическую смесь или предварительно сформированный комплекс лекарственного средства и SBE7-β -CD в препаративной форме с удерживающей матрицей, получают на прессе Stoke's D или подобном оборудовании.
Способ А: двухслойная таблетка
Слой с немедленным высвобождением, содержащий физическую смесь индометацина и SBE7-β -CD, получают согласно примеру 4. Конкретно, 240 мг гранулята, содержащего 10 мг индометацина, прессуют на прессе Stoke's D и получают слой с немедленным высвобождением.
Слой с регулируемым высвобождением получают, смешивая перечисленные далее ингредиенты, где индометацин и циклодекстрин присутствуют в виде физической смеси.
Индометацин 15 мг
SBE7-β -CD 180 мг
НРМС К15М 80 мг
Лактоза, высушенная распылением 85 мг
МСС РН 101 48 мг
Стеарат магния 2 мг
Индометацин и SBE7-β -CD соединяют в физическую смесь и добавляют к НРМС, лактозе, высушенной распылением, и МСС и все смешивают в течение 15 мин в смесителе Twin Shell. Затем к порошку добавляют стеарат магния и все перемешивают еще в течение 5 мин. Затем смесь прессуют на слой с немедленным высвобождением. Таблетки массой 650 мг прессуют до твердости приблизительно 10 кг. Затем на таблетки наносят покрытие из полимера, быстро растворяющегося в воде, такого как НРМС Е5, или энтеросолюбильное покрытие, или покрытие для регулируемого высвобождения.
Способ В: трехслойная таблетка
Композицию для первого слоя с немедленным высвобождением получают так, как только что описано, за исключением того, что получают комплекс индометацина и SBE7-β -CD с использованием хорошо известных условий для формирования комплекса "лекарственное средство/SAE-CD", и указанный комплекс включают в состав с немедленным высвобождением вместо соответствующей физической смеси. Композицию для первого слоя с немедленным высвобождением прессуют и получают первый слой с немедленным высвобождением. Композицию с регулируемым высвобождением получают так, как описано в способе А, и прессуют на одну сторону первого слоя с немедленным высвобождением для формирования слоя с регулируемым высвобождением. Получают вторую композицию с немедленным высвобождением согласно способу, примененному для получения первой композиции с немедленным высвобождением. Затем вторую композицию с немедленным высвобождением прессуют на слой с регулируемым высвобождением на сторону, противоположную первому слою с немедленным высвобождением. Это является примером варианта воплощения изобретения, когда индометацин распределяется в трех слоях препаративной формы следующим образом: по 25 мас.% лекарственного средства присутствует в каждом, первом и втором, слое с немедленным высвобождением, а остальные 50 мас.% лекарственного средства присутствуют в слое с регулируемым высвобождением. Затем на таблетку можно нанести покрытие из полимера, быстро растворяющегося в воде, такого как НРМС Е5, или энтеросолюбильное покрытие, или покрытие для регулируемого высвобождения.
Пример 9
Таблетки, содержащие сердевину с регулируемым высвобождением и покрытие, сформированное путем прессования
Сердцевины таблеток, содержащие физическую смесь индометацина и циклодекстрина при наличии НРМС К15М и других эксципиентов, как описано в предыдущем примере, можно спрессовать в таблетки с матрицей постепенного высвобождения. С использованием подходящего таблетирующего оборудования, известного в технике, гранулят с немедленным высвобождением, содержащий предварительно сформированный комплекс, прессуют на сердцевины с постепенным высвобождением. В результате быстрого распада гранулята в покрытии, полученном путем прессования, предварительно сформированный комплекс будет высвобождаться в растворяющую среду или в GI-жидкости, и появится возможность для быстрого растворения индометацина. Постепенная эрозия и гидратация сердцевины таблетки с покрытием из физической смеси будет промотировать образование комплекса лекарственного средства и циклодекстрина и регулировать высвобождение комплекса в окружающую среду.
Пример 10
Получение гранулятов методами плавления
Грануляты, содержащие физическую смесь лекарственного средства, циклодекстрина и гидрофильных полимеров наряду с другими функциональными эксципиентами, можно получить грануляцией из расплава или экструзией из расплава. Получают физическую смесь перечисленных далее ингредиентов.
Дилтиазем 10 мг
SBE7-β -CD 270 мг
Лимонная кислота 19 мг
PEG 6000 42 мг
НРМС К15М 50 мг
Всего 400 мг
Затем полученный материал пропускают через экструдер при 60° С или гранулируют из расплава при той же температуре, и получают гранулы, которые затем просеивают через сито №20 и смешивают с 75 мг MCC PH101, 10 мг стеарата магния и 15 мг талька, и получают таблетки массой 500 мг. Такие таблетки, содержащие лекарственное средство в форме физической смеси, будут гидратироваться в растворяющей среде или в желудочно-кишечном тракте и постепенно высвобождать дилтиазем по диффузионному или эрозионному механизму.
Пример 11
Осмотические насосы с регулируемой поставкой лекарственного средства по диффузионному и осмотическому механизму
Для получения серцевин физические смеси TS с (SBE)7m-β -CD, HP-β -CD или сахаром (физическая смесь лактозы и фруктозы, 1/1), каждая из которых содержит 10 мг TS, прессуют при давлении 1 т/см2 в течение 60 с с использованием лабораторного пресса CarverTM с пуансоном с плоской поверхностью 6,35 мм. Молярные соотношения TS и (SBE)7m-β -CD в физических смесях колеблятся от 1:1 до 1:1,43, а молярные соотношения в физической смеси с HP-β -CD колеблятся от 1:1 до 1:1,79. Физические смеси TS с производными β -CD или сахаром получают с использованием ступки и пестика. Прессованную сердцевину таблетки помещают в пресс-форму для таблеток, описанную выше.
Полупроницаемую мембрану получают, смешивая 59,3% ацетата целлюлозы, 29,6% сорбита и 11, 1% PEG или талька в смеси дихлорметан/метанол/вода (массовое соотношение 3/2/0,2). Конечная концентрация твердых веществ в растворе составляет 3,34% (мас./мас.). Мембраны получают воспроизводимо на базе устройства типа осмотического насоса, формируя пленочное покрытие с использованием краскопульта при скорости распыления 1,7 г/мин, с совмещенной сушкой горячим воздухом из сушильной камеры, закрепленной на 30 см выше пресс-формы. Затем мембраны отделяют от базовой поверхности устройства по типу осмотического насоса и помещают на высвобождающую сторону устройства. Мембрану удерживают на месте с помощью уплотнения из тефлонаTM и шайбы из нержавеющей стали.
Растворение и скорости высвобождения TS из сердцевин таблеток (без мембранного покрытия) или из устройства по типу осмотического насоса (сердцевины таблеток с покрытием из полупроницаемой мембраны) определяют с применением прибора USP с использованием метода с применением лопастной мешалки. Среда представляет собой 900 мл дистиллированной воды или различных растворов КС1 при 37° С при перемешивании лопастной мешалкой со скоростью в интервале от 0 до 100 об/мин. Устройство помещают в сосуд высвобождающей стороной вверх. Образцы растворов TS анализируют методом ВЭЖХ, описанным ранее для исследования растворимости фаз.
Определение осмотических веществ, высвобожденных из устройств. Количество каждого из осмотических веществ - (SBE)7m-β -CD, HP-β -CD и сахара, высвобожденных из ОРТ, вычисляют по разнице между массой всех высвобожденных ингредиентов и массой остальных высвобожденных компонентов при исследовании в каждый момент отбора образцов. Масса остальных компонентов при исследовании в каждый момент отбора образцов представляет собой сумму количества тестостерона, определенного методом ВЭЖХ, и содержания сорбита и PEG, определенного гравиметрическим методом, исходя из осмотических насосов, не содержащих осмотических агентов. Массу высвобожденного осмотического агента определят как остаточную массу после упаривания и вакуумной сушки образца раствора в 200 мл в течение 12 ч при 60° С. Оказывается, что из-за своей высокой растворимости в воде сорбит и PEG сразу же и полностью высвобождаются из мембраны осмотического насоса после его погружения в испытываемый раствор.
Выше приведено подробное описание конкретных вариантов воплощения изобретения. Специалисты в этой области техники, в свете данного описания, должны иметь в виду, что можно осуществить очевидные модификации описанных здесь вариантов без отхода от сущности и объема изобретения. Все описанные варианты и пункты формулы изобретения можно осуществить без излишнего экспериментирования с учетом данного описания. Полный объем изобретения изложен в основных пунктах формулы изобретения, представленной далее, и их эквивалентах. Соответственно формулу изобретения и описание не следует истолковывать как чрезмерно сужающие полный объем защиты, на который дает право настоящее изобретение.
Реферат
Изобретение относится к твердым фармацевтическим препаративным формам с регулируемым высвобождением на основе сульфоалкиловых эфиров циклодекстрина (SAE-CD). Фармацевтические препаративные формы настоящего изобретения состоят из сердцевины, содержащей физическую смесь одного или нескольких SAE-CD, необязательно модификатора скорости высвобождения и лечебного средства, большая часть которого не образует комплекса с SAE-CD, и необязательно изменяющего скорость высвобождения покрытия, окружающего сердцевину. Описываются многослойные твердые фармацевтические препаративные формы с регулируемым высвобождением и с комбинированным быстрым и регулируемым высвобождением, а также лекарственные формы по типу осмотического насоса и такие лекарственные формы, как таблетки с покрытием и без покрытия, минитаблетки, пилюли, микропилюли, частицы, порошки и гранулы. Технический результат: препаративные формы настоящего изобретения легче получать, чем другие препаративные формы на основе SAE-CD, известные в технике, и к тому же они обеспечивают подобную или более высокую эффективность, что выгодно. Они будут обладать растворимостью, профилем растворения и/или биодоступностью, приближающимися к препаратам соответствующего комплекса включения. Производное SAE-CD используют для изменения биологической доступности и/или биоабсорбции лечебных средств. 7 н. и 83 з.п. ф-лы, 2 табл., 30 ил.
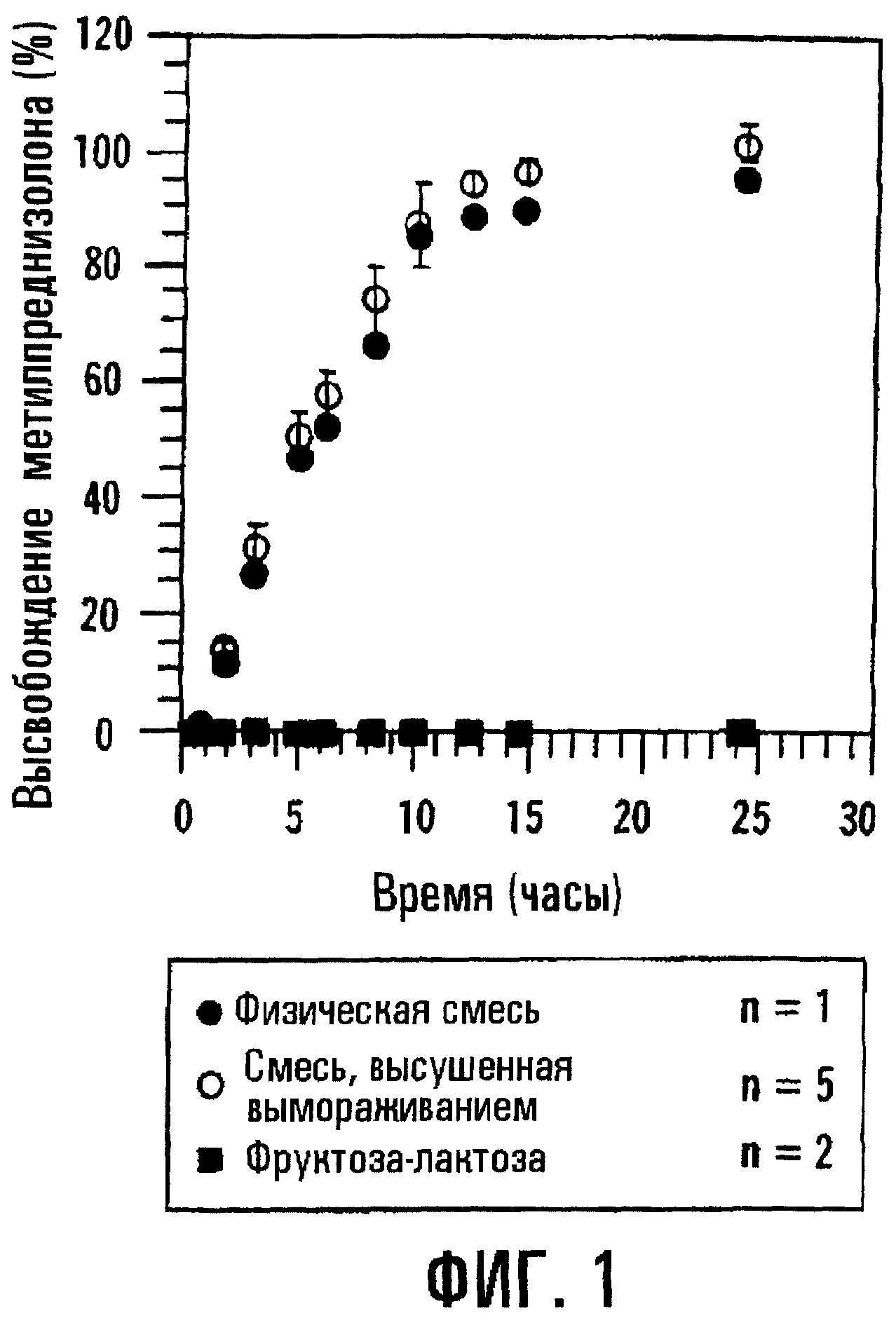
Формула
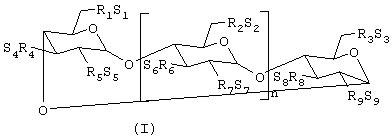

Комментарии