Конъюгаты гидрокодона с бензойной кислотой, производными бензойной кислоты и гетероарилкарбоновой кислотой, пролекарства, способы их получения и их применение - RU2505541C2
Код документа: RU2505541C2
Чертежи















Описание
Родственные заявки
В данной заявке заявляется приоритет предварительной заявки на патент США с серийным № 61/222718, поданной 2 июля 2009 г., которая во всей своей полноте включена в данную заявку посредством ссылки.
Исследования или разработки, субсидируемые из федеральных источников
Данные отсутствуют.
Предпосылки к созданию изобретения
Опиоиды являются высокоэффективными аналгезирующими средствами, и обычно их предписывают при купировании острой и хронической боли. Их обычно также используют как средства против кашля. Однако опиоиды вызывают эйфорию, а также легко вызывают привыкание. В результате ими часто злоупотребляют, что приводит к далеко идущим социальным последствиям и оказывает серьезное воздействие на здоровье.
Из-за возможного злоупотребления желательно получить любую фармацевтическую композицию, содержащую агонист опиоида, таким образом, чтобы на практике она препятствовала злоупотреблению или предохраняла от злоупотребления лекарственным средством. Люди, незаконно употребляющие наркотики, часто пытаются обойти свойства лекарственных форм с пролонгированным высвобождением лекарственного средства путем инъекции или другого неправильного использования подобных лекарственных форм с тем, чтобы добиться немедленного высвобождения агониста опиоида.
Несмотря на их способность вызывать зависимость и возможное злоупотребление ими, морфиноподобные лекарственные препараты, в частности, кодеин, гидрокодон и оксикодон, в последние десятилетия часто предписывают для купирования жестокой острой и хронической боли. Частично это вызвано отсутствием альтернативы для ослабления жестокой боли, стойкой к действию других менее мощных аналгезирующих средств, таких как нестероидные противовоспалительные препараты (NSAID). В связи с этим сохраняется потребность в уменьшении возможного злоупотребления ими. К сожалению, предпринятые до настоящего времени попытки не решили данную проблему.
Гидрокодон является опиоидным аналгезирующим средством, а также противокашлевым средством и представляет собой мелкие кристаллы белого цвета или кристаллический порошок. Гидрокодон является полусинтетическим наркотическим аналгетиком, который получают из кодеина, и многие его воздействия качественно подобны действию кодеина. Его главным образом используют для облегчения умеренной или умеренно жестокой боли. Кроме того, в субаналгезирующих дозах (2,5-5 мг) его используют как противокашлевое средство в микстурах и таблетках от кашля.
Пациенты, принимающие опиоидные аналгезирующие средства, такие как гидрокодон, для ослабления боли, непроизвольно могут стать зависимыми. По мере развития толерантности к опиоидам, все большее количество лекарства требуется для облегчения боли и для хорошего самочувствия, что первоначально можно было достичь, принимая предписанную дозу. Указанное обстоятельство приводит к эскалации дозы, которая, если ее не контролировать, может быстро привести к зависимости. В некоторых случаях пациенты становились сильно зависимыми всего через тридцать дней.
Сущность изобретения
В настоящем изобретении используется образование сложных ковалентных соединений (конъюгатов) опиоида гидрокодона с определенными арилкарбоновыми кислотами, с целью снижения его потенциальной способности вызывать передозировку или приводить к злоупотреблениям, за счет того, что для высвобождения активного гидрокодона требуется in vivo разрушение конъюгатов под действием ферментов или обмена веществ. В настоящем изобретении предлагаются также способы доставки гидрокодона в виде конъюгатов, которые высвобождают гидрокодон после перорального введения и препятствуют злоупотреблению им окольными путями, такими как внутривенная инъекция ("введение наркотика внутривенно") или интраназальное введение ("прием дозы порошкообразного наркотика").
В соответствии с по меньшей мере одним аспектом в настоящем изобретении предлагается композиция для замедленного/пролонгированного/управляемого высвобождения гидрокодона в виде сложного соединения, которая позволяет осуществить замедленное/пролонгированное/управляемое высвобождение гидрокодона и/или его активного метаболита, гидроморфона, в кровеносную систему человека или животного в пределах безопасного терапевтического окна путем, например, перорального приема. По меньшей мере некоторые композиции/составы по настоящему изобретению могут снижать возможность привыкания/злоупотребления и/или уменьшать другие обычные побочные эффекты, связанные с гидрокодоном и подобными ему соединениями.
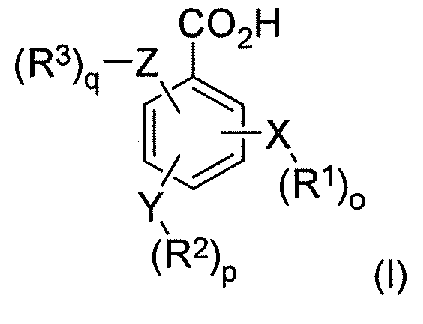
В соответствии с одним аспектом в настоящем изобретении предлагается композиция, которая содержит по меньшей мере один конъюгат гидрокодона и по меньшей мере одной бензойной кислоты или ее производного, ее соли или их комбинации, при этом бензойная кислота или ее производное имеет следующую формулу I:

где X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-; R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил; o, p, q независимо выбраны из 0 или 1; а x обозначает целое число в диапазоне от 1 до 10. В соответствии с некоторыми аспектами бензойная кислота или ее производное представляет собой аминобензоат, гидроксибензоат, аминогидроксибензоат, его производное или их комбинацию.
В соответствии с другим аспектом в настоящем изобретении предлагается композиция, которая содержит по меньшей мере один конъюгат гидрокодона и по меньшей мере одной бензойной кислоты, ее производного или их комбинации.
В соответствии с еще одним аспектом в настоящем изобретении предлагаются конъюгаты гидрокодона для использования с целью купирования боли, предпочтительно, от умеренной до жестокой боли, или для использования с целью уменьшить или предотвратить злоупотребление при пероральном, интраназальном или парентеральном введении лекарственного средства. В соответствии с некоторыми аспектами конъюгаты придают стойкость к злоупотреблению при пероральном, интраназальном или парентеральном введении лекарственного средства.
В соответствии с другим аспектом в настоящем изобретении предлагается по меньшей мере один конъюгат гидрокодона, который обеспечивает меньшую скорость высвобождения с течением времени и бульшую или равную величину площади под кривой (AUC) по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона за тот же самый интервал времени. В соответствии с другими аспектами конъюгат гидрокодона показывает меньшую изменчивость фармакокинетического профиля при пероральном введении по сравнению с неконъюгированным гидрокодоном. В соответствии с еще одним аспектом по меньшей мере один конъюгат дает меньше побочных эффектов по сравнению с неконъюгированным гидрокодоном, или предотвращает злонамеренное использование лекарственных средств путем как физического, так и химического манипулирования.
В соответствии с другим аспектом предлагается по меньшей мере один конъюгат в количестве, достаточном для того, чтобы обеспечить терапевтически биоэквивалентное значение AUC, по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона. В соответствии с дальнейшими аспектами предлагается по меньшей мере один конъюгат в количестве, достаточном для того, чтобы обеспечить терапевтически биоэквивалентное значение AUC, по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона, и при этом указанное количество не приводит к появлению пикового значения Cmaxили дает меньшее значение Cmax, чем терапевтически эквивалентное количество неконъюгированного гидрокодона. В соответствии с другими аспектами предлагается по меньшей мере один конъюгат в количестве, достаточном для того, чтобы обеспечить терапевтически биоэквивалентное значение AUC, по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона, и при этом указанное количество не приводит к появлению эквивалентного пикового значения Cmax. В соответствии с некоторыми аспектами по меньшей мере один конъюгат дает эквивалентное пиковое значение Cmax при сравнении с неконъюгированным гидрокодоном.
В соответствии с другим аспектом в настоящем изобретении предлагается способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует связывания опиоида или которое опосредуется связыванием опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной бензойной кислоты или ее производного, ее соли или их комбинации, при этом бензойная кислота или ее производное имеет формулу I:
где
X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-; R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил; o, p, q независимо выбраны из 0 или 1; а x обозначает целое число в диапазоне от 1 до 10.
В соответствии с другим аспектом по меньшей мере один конъюгат необратимо связывается с рецепторами опиоида пациента. В соответствии с еще одним аспектом по меньшей мере один конъюгат необратимо связывается с рецепторами опиоида пациента, не оказывая при этом угнетающего воздействия на ЦНС.
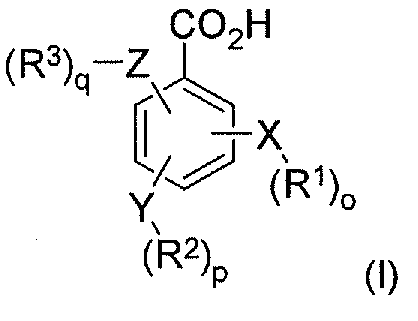
В соответствии с другим аспектом в настоящем изобретении предлагается способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует ингибирования связывания опиоида или которое опосредуется ингибированием связывания опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной бензойной кислоты или ее производного, ее соли или их комбинации, при этом бензойная кислота или ее производное имеет формулу I:
где
X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-; R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил; o, p, q независимо выбраны из 0 или 1; а x обозначает целое число в диапазоне от 1 до 10.
В соответствии с некоторыми аспектами в настоящем изобретении предлагается по меньшей мере один конъюгат, который обратимо ингибирует связывание опиоида с рецепторами опиоида пациента. В соответствии с другими аспектами по меньшей мере один конъюгат обратимо ингибирует связывание опиоида с рецепторами опиоида пациента, не оказывая при этом угнетающего воздействия на ЦНС.
В соответствии с другим аспектом в настоящем изобретении предлагается способ лечения пациента, имеющего заболевание, расстройство или состояние (такое как боль), которое можно лечить путем связывания опиоида с рецепторами опиоида пациента, при этом способ включает пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной бензойной кислоты, ее соли, ее производного или их комбинации.
В соответствии с другим аспектом в настоящем изобретении предлагается способ лечения пациента, имеющего заболевание, расстройство или состояние (такое как боль), которое можно лечить путем ингибирования связывания опиоида с рецепторами опиоида пациента, при этом способ включает пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной бензойной кислоты, ее соли, ее производного или их комбинации.
В соответствии с еще одним аспектом в настоящем изобретении предлагается фармацевтический набор реагентов, включающий определенное количество индивидуальных дозировок в упаковке, которые содержат фармацевтически эффективное количество по меньшей мере одного конъюгата гидрокодона и по меньшей мере одного бензоата, его соли, его производного или их комбинации, при этом бензоат имеет формулу I:
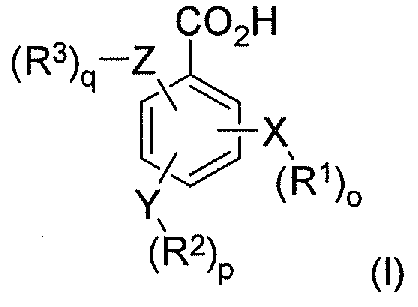
где X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-; R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил; o, p, q независимо выбраны из 0 или 1; а x обозначает целое число в диапазоне от 1 до 10. В соответствии с некоторыми аспектами указанный набор включает инструкции по использованию указанного набора реагентов в способе лечения или предотвращения симптомов отмены лекарственного средства или купирования боли у пациента-человека или пациента-животного.
В соответствии с другим аспектом в настоящем изобретении предлагается фармацевтический набор реагентов, включающий определенное количество индивидуальных дозировок в упаковке, которые содержат фармацевтически эффективное количество по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной бензойной кислоты, ее соли, ее производного или их комбинации. В соответствии с некоторыми аспектами указанный набор дополнительно включает инструкции по использованию указанного набора в способе лечения или предотвращения симптомов отмены лекарственного средства или купирования боли у пациента-человека или пациента-животного.
В соответствии с еще одним аспектом в настоящем изобретении предлагается композиция, содержащая по меньшей мере один конъюгат гидрокодона и по меньшей мере одной гетероарилкарбоновой кислоты, ее производного или их комбинации.
В соответствии с еще одним аспектом в настоящем изобретении предлагается по меньшей мере один конъюгат гидрокодона и по меньшей мере одной гетероарилкарбоновой кислоты, ее производного или их комбинации, где по меньшей мере одна гетероарилкарбоновая кислота выбрана из формулы II, формулы III и формулы IV:

где X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-; R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил; o, p, q независимо выбраны из 0 или 1; а x обозначает целое число в диапазоне от 1 до 10. В соответствии с некоторыми аспектами по меньшей мере одна гетероарилкарбоновая кислота является производным пиридина.
В соответствии с некоторыми аспектами в настоящем изобретении предлагается по меньшей мере один конъюгат, который предотвращает злонамеренное использование лекарственных средств путем как физического, так и химического манипулирования.
В соответствии с другим аспектом в настоящем изобретении предлагается способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует связывания опиоида или которое опосредуется связыванием опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной гетероарилкарбоновой кислоты.
В соответствии с еще одним аспектом в настоящем изобретении предлагается способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует связывания опиоида или которое опосредуется связыванием опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной гетероарилкарбоновой кислоты, где гетероарилкарбоновая кислота выбрана из формулы II, формулы III и формулы IV, где формула II, формула III и формула IV имеют следующие структуры:

где X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-; R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил; o, p, q независимо выбраны из 0 или 1; а x обозначает целое число в диапазоне от 1 до 10.
В соответствии с другим аспектом в настоящем изобретении предлагается способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует связывания опиоида или которое опосредуется связыванием опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной никотиновой кислоты, ее производного или их комбинации.
В соответствии с другим аспектом в настоящем изобретении предлагается способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует ингибирования связывания опиоида или которое опосредуется ингибированием связывания опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной гетероарилкарбоновой кислоты. В соответствии с некоторыми аспектами гетероарилкарбоновая кислота выбрана из формулы II, формулы III и формулы IV, где формула II, формула III и формула IV имеют следующие структуры:

где X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-; R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил; o, p, q независимо выбраны из 0 или 1; а x обозначает целое число в диапазоне от 1 до 10.
В соответствии с другим аспектом в настоящем изобретении предлагается способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует ингибирования связывания опиоида или которое опосредуется ингибированием связывания опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной никотиновой кислоты, ее производного или их комбинации.
В соответствии с еще одним аспектом в настоящем изобретении предлагается фармацевтический набор реагентов, включающий определенное количество индивидуальных дозировок в упаковке, которые содержат фармацевтически эффективное количество по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной гетероарилкарбоновой кислоты, ее производного или их комбинации, где гетероарилкарбоновая кислота выбрана из формулы II, формулы III и формулы IV, где формула II, формула III и формула IV имеют следующие структуры:
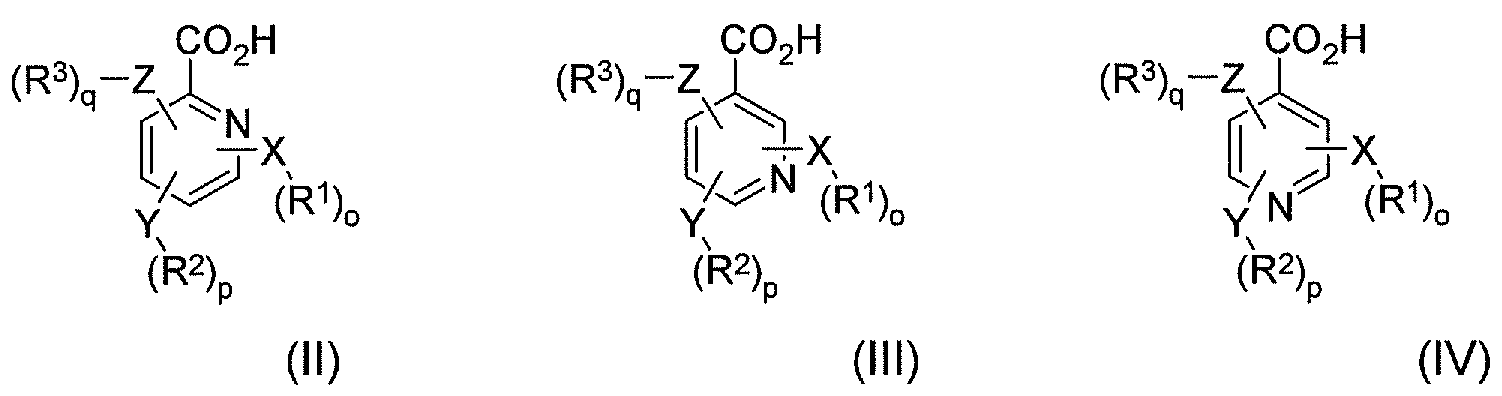
где X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-; R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил; o, p, q независимо выбраны из 0 или 1; а x обозначает целое число в диапазоне от 1 до 10. В соответствии с некоторыми аспектами указанный набор дополнительно включает инструкции по использованию указанного набора в способе лечения или предотвращения симптомов отмены лекарственного средства или купирования боли у пациента-человека или пациента-животного.
В соответствии с еще одним аспектом в настоящем изобретении предлагается пролекарство, включающее по меньшей мере один конъюгат гидрокодона и по меньшей мере одной бензойной кислоты или производного бензойной кислоты, ее соли или их комбинации, при этом бензойная кислота или производное бензойной кислоты имеет следующую формулу I:

где X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-; R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил; o, p, q независимо выбраны из 0 или 1; а x обозначает целое число в диапазоне от 1 до 10.
В соответствии с другим аспектом в настоящем изобретении предлагается пролекарство, включающее по меньшей мере один конъюгат гидрокодона и по меньшей мере одной бензойной кислоты, производного бензойной кислоты или их комбинации.
В соответствии с еще одним аспектом в настоящем изобретении предлагается пролекарство, включающее по меньшей мере один конъюгат гидрокодона и по меньшей мере одной гетероарилкарбоновой кислоты, ее производного или их комбинации. В соответствии с некоторыми аспектами пролекарство включает по меньшей мере одну гетероарилкарбоновую кислоту, выбранную из формулы II, формулы III и формулы IV, где формула II, формула III и формула IV имеют следующие структуры:

где X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-; R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил; o, p, q независимо выбраны из 0 или 1; а x обозначает целое число в диапазоне от 1 до 10.
В соответствии с еще одним аспектом в настоящем изобретении предлагается пролекарство, включающее по меньшей мере один конъюгат гидрокодона и по меньшей мере одной никотиновой кислоты, ее производного или их комбинации.
В соответствии с некоторыми аспектами пролекарство включает аминобензоат, гидроксибензоат, аминогидроксибензоат, его производное или их комбинации.
В соответствии с некоторыми аспектами по меньшей мере один конъюгат обратимо связывается с рецепторами опиоида пациента. В соответствии с другими аспектами по меньшей мере один конъюгат обратимо связывается с рецепторами опиоида пациента, не оказывая при этом угнетающего воздействия на ЦНС. В соответствии с другим аспектом по меньшей мере один конъюгат препятствует или уменьшает по меньшей мере один вызывающий запор побочный эффект неконъюгированного гидрокодона.
Краткое описание нескольких типов чертежей
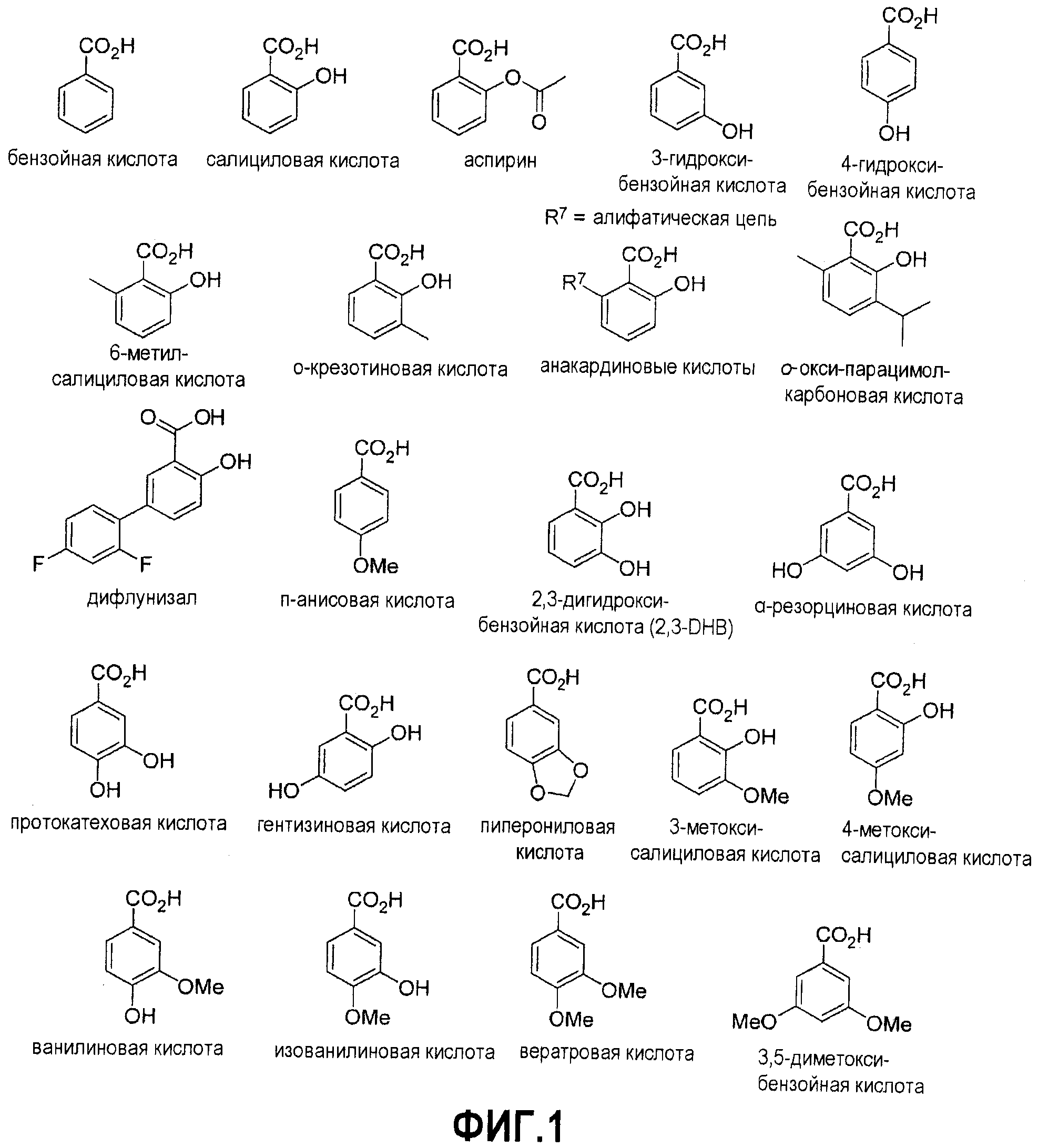
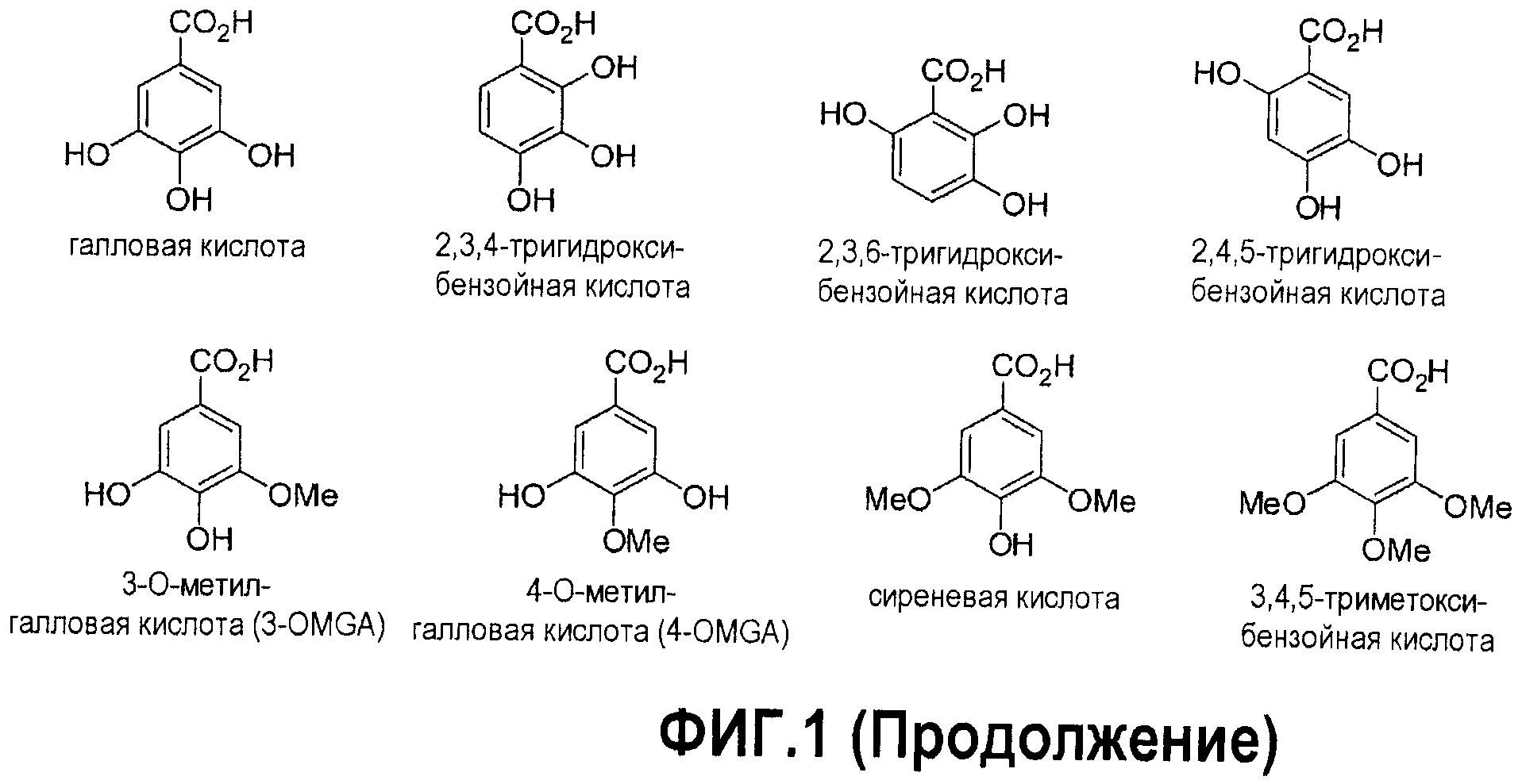
Фигура 1. Химические структуры гидроксибензойных кислот и производных гидроксибензойных кислот, используемых с целью получения конъюгатов по настоящему изобретению.
Фигура 2. Химические структуры аминобензойных кислот для использования с целью получения конъюгатов по настоящему изобретению.
Фигура 3. Химические структуры аминогидроксибензойных кислот для использования с целью получения конъюгатов по настоящему изобретению.
Фигура 4. Фигура 4A представляет собой таблицу типичных лекарственных форм гидрокодона и диапазонов доз, а фигура 4B представляет собой таблицу типичных лекарственных форм гидрокодона, которые используют в сиропах от кашля.
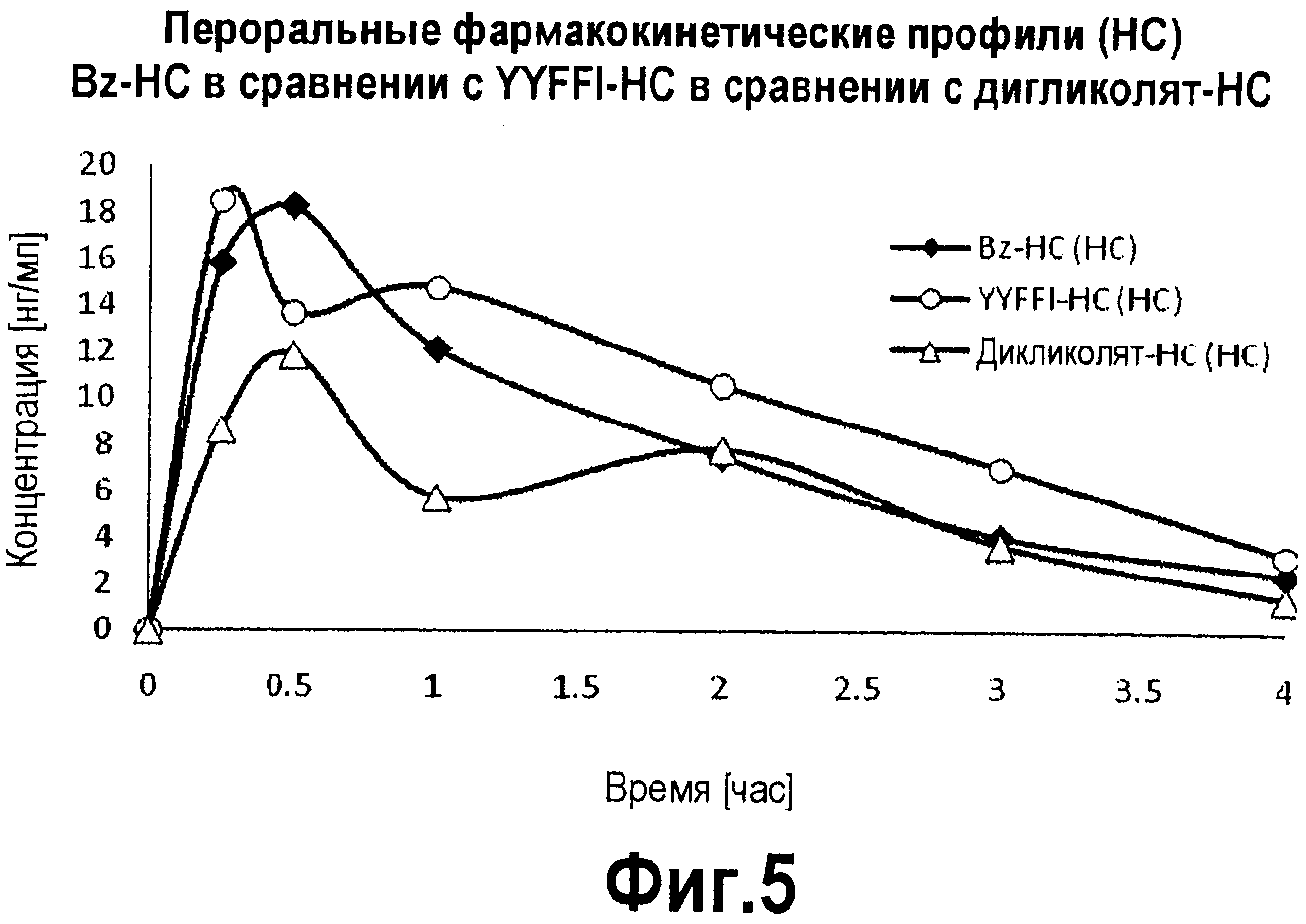
Фигура 5. График фармакокинетического профиля концентраций в плазме гидрокодона, высвободившегося из Bz-HC (бензоат-гидрокодон), YYFFI-HC (Tyr-Tyr-Phe-Phe-Ile-гидрокодон) и дигликолят-HC, с течением времени после перорального введения крысам.
Фигура 6. График фармакокинетического профиля концентраций в плазме активного метаболита, гидроморфона, с течением времени после перорального введения Bz-HC, YYFFI-HC и дигликолят-HC крысам.
Фигура 7. График фармакокинетического профиля концентраций в плазме гидрокодона, высвободившегося из Bz-HC и адипат-HC, с течением времени после интраназального введения крысам.
Фигура 8. График фармакокинетического профиля концентраций в плазме активного метаболита, гидроморфона, с течением времени после интраназального введения Bz-HC и адипат-HC крысам.
Фигура 9. График фармакокинетического профиля концентраций в плазме гидрокодона, высвободившегося из Bz-HC, никотинат-HC и гидрокодон·BT, с течением времени после перорального введения крысам.
Фигура 10. График фармакокинетического профиля концентраций в плазме активного метаболита, гидроморфона, с течением времени после перорального введения Bz-HC, никотинат-HC и гидрокодон·BT крысам.
Фигура 11. График фармакокинетического профиля концентраций в плазме гидрокодона, высвободившегося из Bz-HC, 2-ABz-HC и гидрокодон·BT, с течением времени после перорального введения крысам.
Фигура 12. График фармакокинетического профиля концентраций в плазме активного метаболита гидрокодона с течением времени после перорального введения Bz-HC, 2-ABz-HC и гидрокодон·BT крысам.
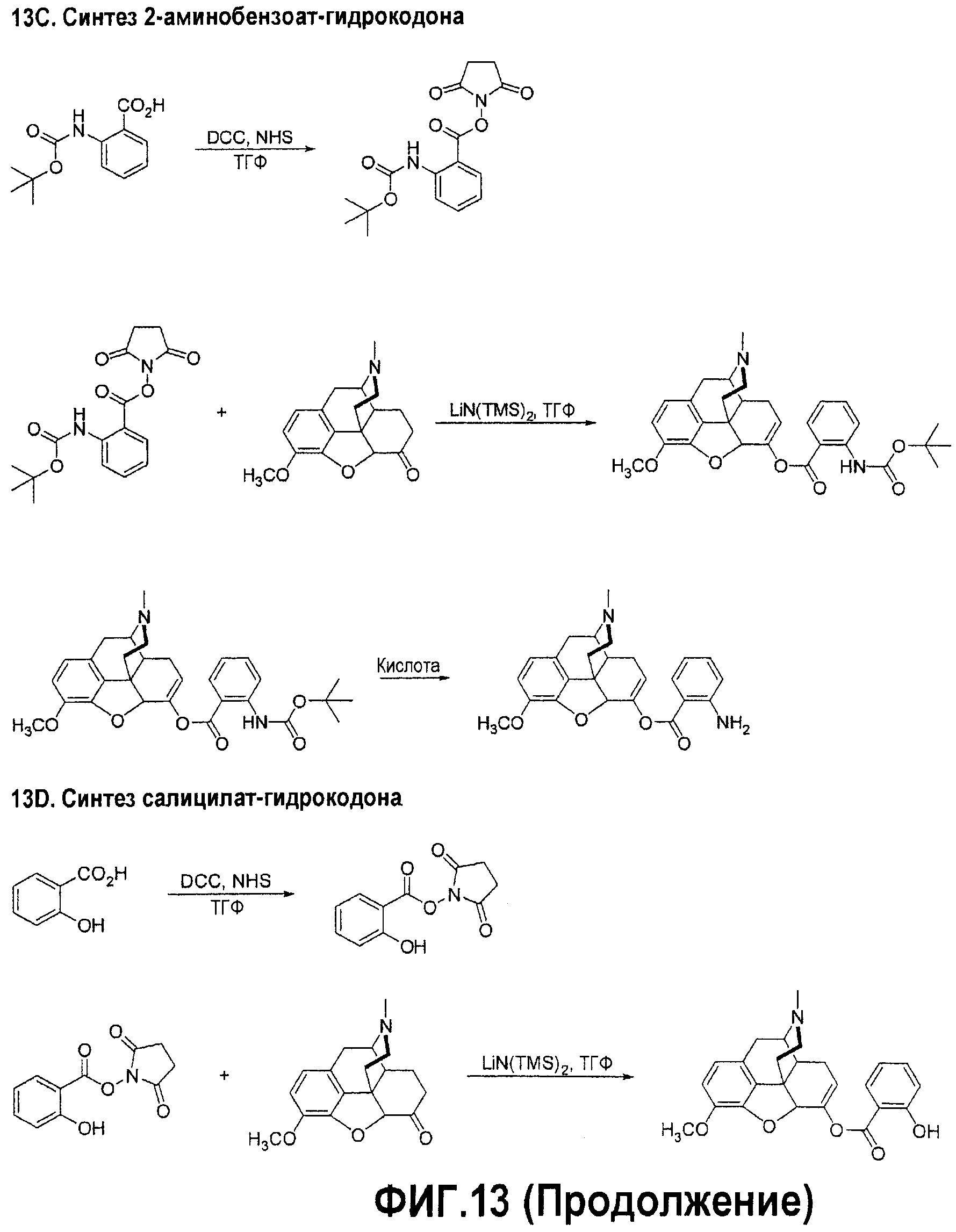
Фигура 13. Диаграммы синтеза конъюгатов гидрокодона. На фигуре 13A приведен синтез бензоата гидрокодона. На фигуре 13B приведен синтез никотината гидрокодона (никотиновая кислота). На фигуре 13C приведен синтез 2-аминобензоата гидрокодона. На фигуре 13D приведен синтез салицилата гидрокодона.
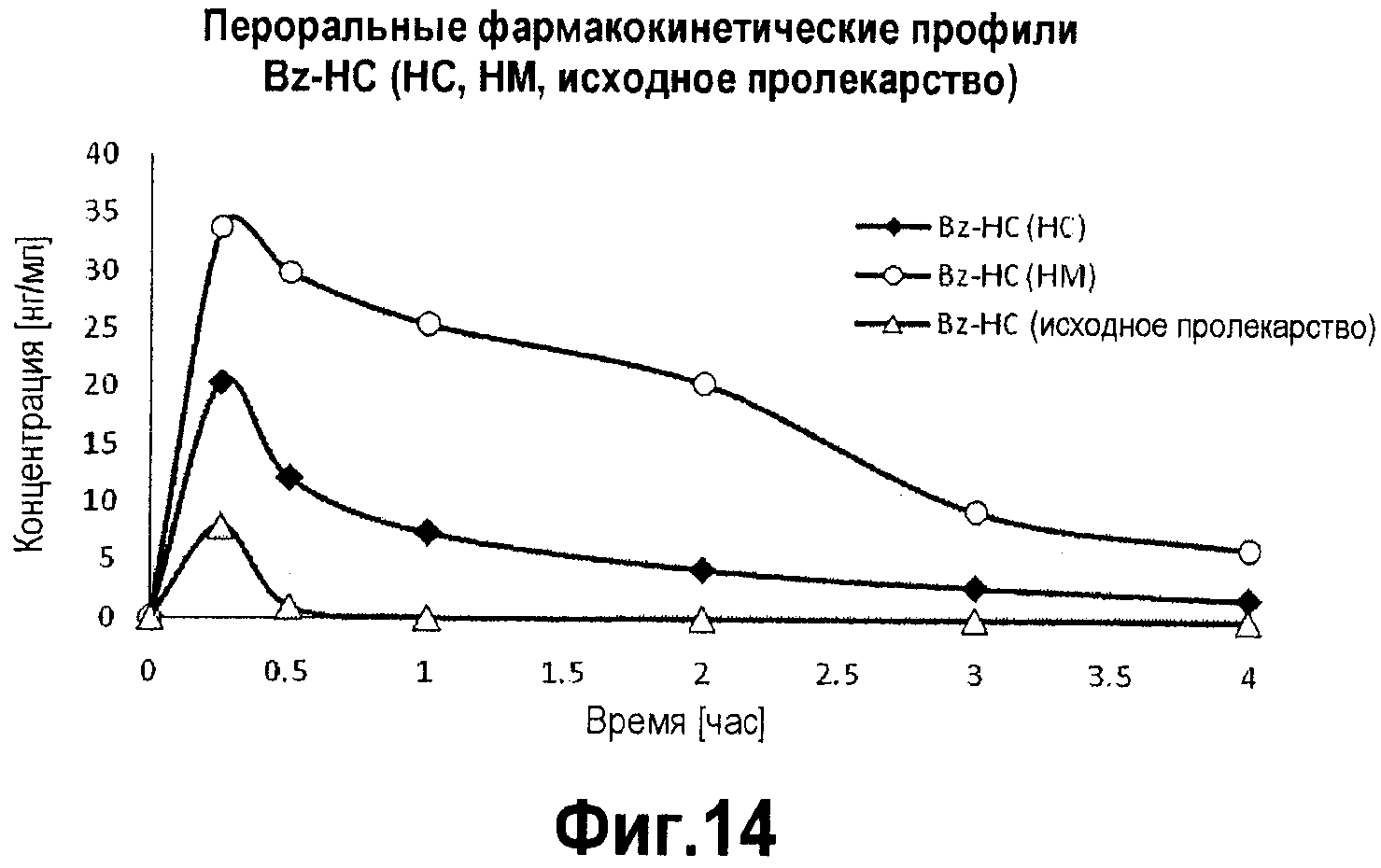
Фигура 14. График фармакокинетического профиля концентраций в плазме исходного Bz-HC, активного метаболита гидроморфона и гидрокодона, высвободившегося из Bz-HC, с течением времени после перорального введения крысам.
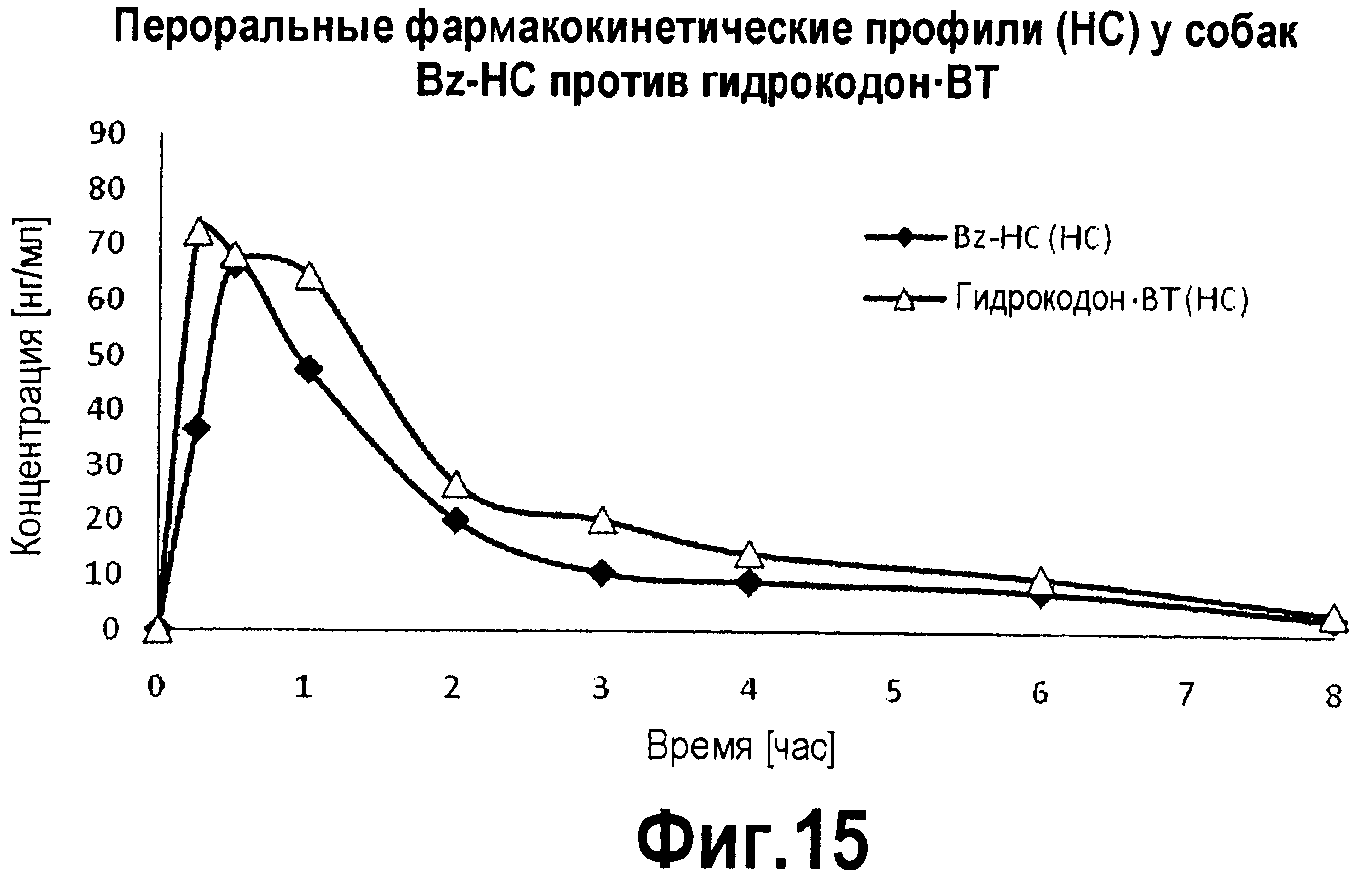
Фигура 15. График фармакокинетического профиля концентраций в плазме гидрокодона, высвободившегося из Bz-HC и гидрокодон·BT, с течением времени после перорального введения собакам.
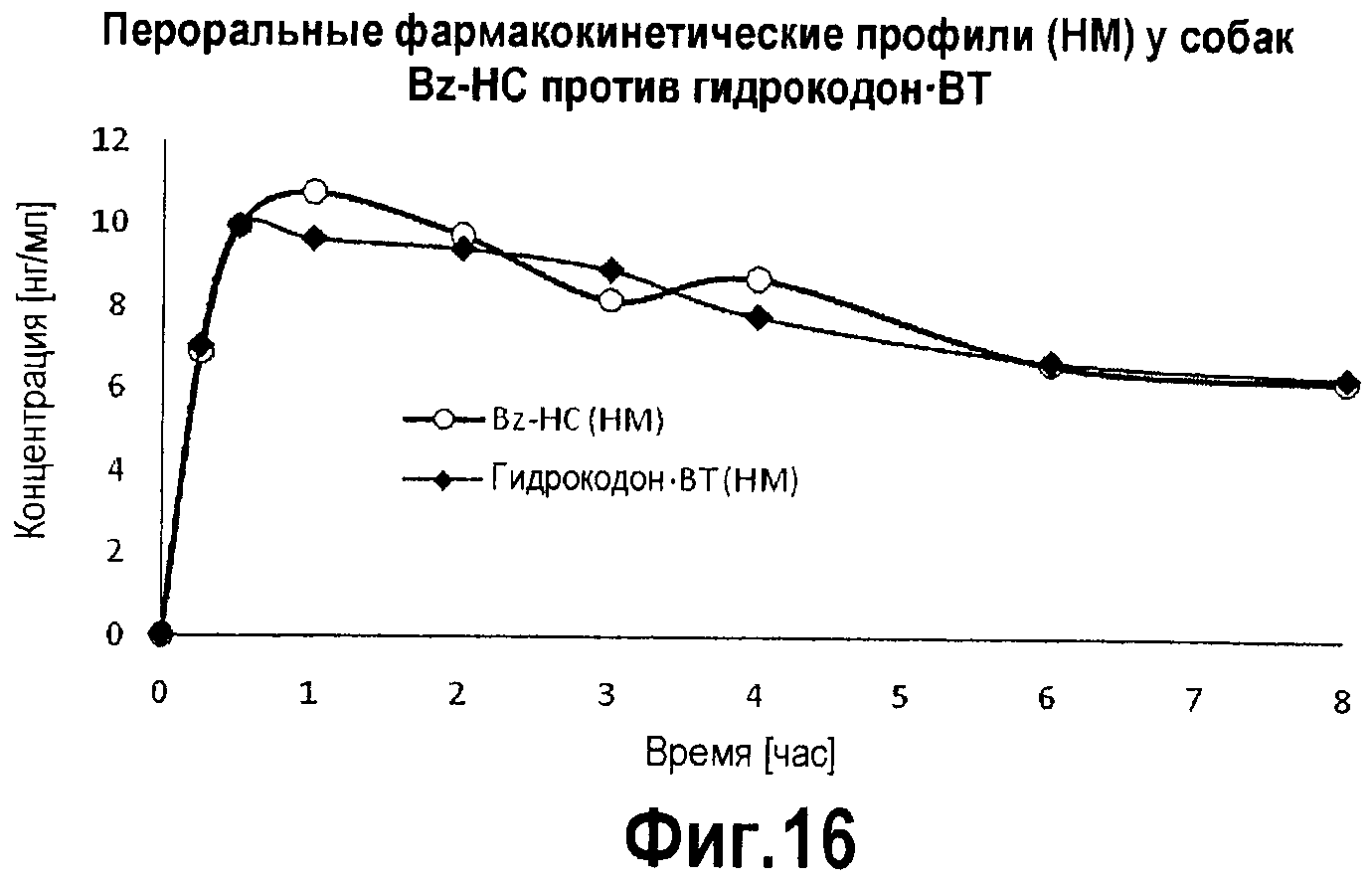
Фигура 16. График фармакокинетического профиля концентраций в плазме активного метаболита, гидроморфона, с течением времени после перорального введения Bz-HC и гидрокодон·BT собакам.
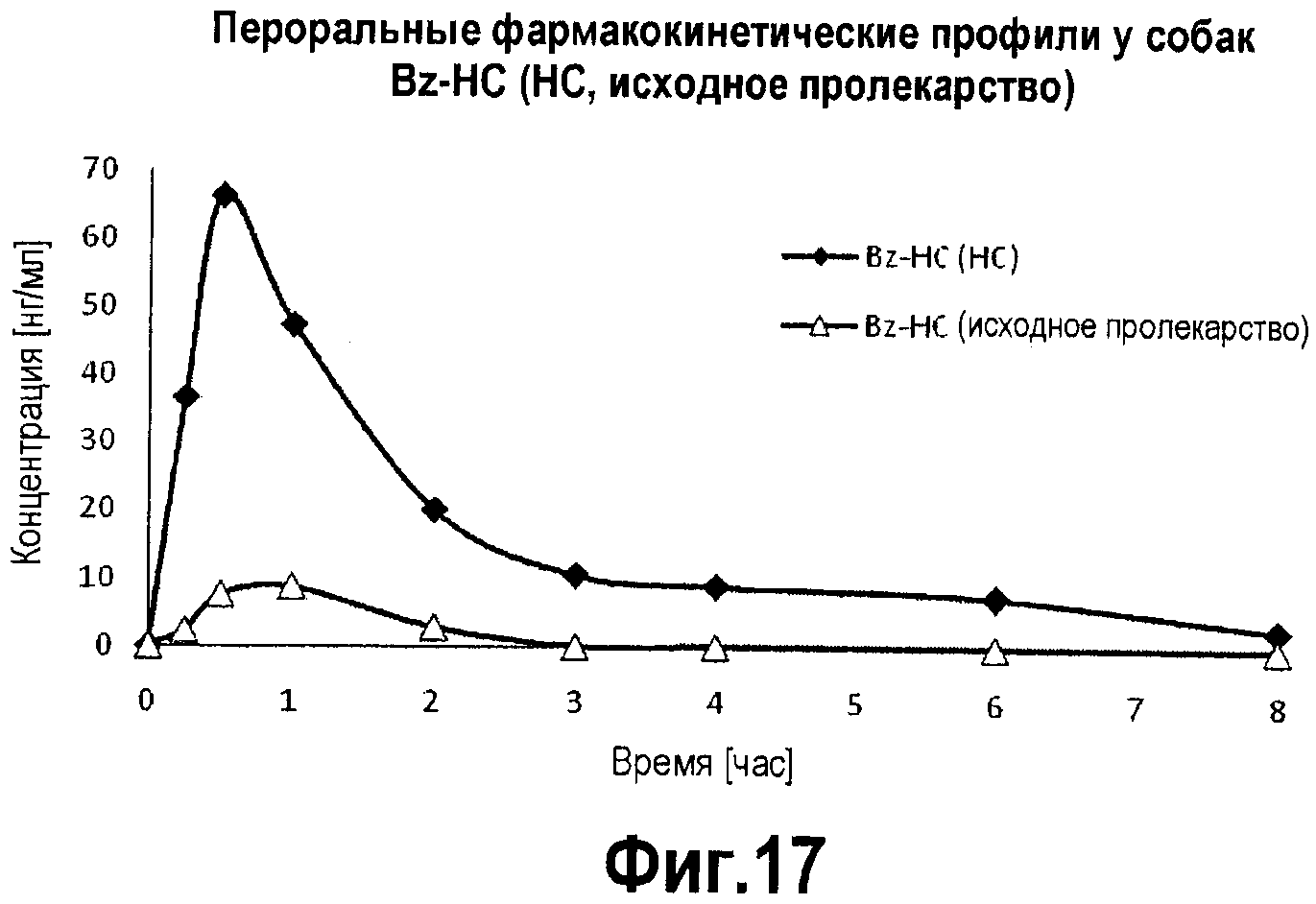
Фигура 17. График фармакокинетического профиля концентраций в плазме исходного Bz-HC и гидрокодона, высвободившегося из Bz-HC, с течением времени после перорального введения собакам.
Фигура 18. График фармакокинетического профиля концентраций в плазме исходного Bz-HC, активного метаболита, гидроморфона, и гидрокодона, высвободившегося из Bz-HC, с течением времени после внутривенного введения крысам в количестве 0,30 мг/кг.
Фигура 19. График фармакокинетического профиля концентраций в плазме гидрокодона, высвободившегося из Bz-HC, с течением времени после перорального введения крысам для шести различных дозировок.
Фигура 20. График фармакокинетического профиля концентраций в плазме активного метаболита, гидроморфона, с течением времени после перорального введения Bz-HC крысам для шести различных дозировок.
Подробное описание изобретения
В настоящем изобретении предлагаются композиции, содержащие арилкарбоновые кислоты, химически связанные с гидрокодоном (морфинан-6-он, 4,5-альфа-эпокси-3-метокси-17-метил), с получением новых пролекарств и композиций гидрокодона. В некоторых вариантах осуществления настоящего изобретения химическая связь между указанными двумя фрагментами может быть образована путем взаимодействия C-6 енольного таутомера гидрокодона с активированной карбоксильной группой арилкарбоновой кислоты с получением енол-сложноэфирного конъюгата.
Следует понимать, что используемый термин "опиоид" включает любое лекарственное средство, которое активирует рецепторы опиоида, находящиеся в мозге, спинном мозге и кишечнике. Существуют четыре обширных класса опиоидов: встречающиеся в природе алкалоиды опия, такие как морфин (прототип опиоида), кодеин и тебаин; эндогенные опиоидные пептиды, такие как эндорфины; полусинтетические опиоиды, такие как героин, оксикодон и гидрокодон, которые получают путем модификации природных алкалоидов опия и которые имеют сходные химические структуры; и чисто синтетические вещества, такие как фентанил и метадон, которые получают не из опия и которые могут иметь химические структуры, абсолютно отличные от алкалоидов опия. Дополнительными примерами опиоидов являются гидроморфон, оксиморфон, метадон, леворфанол, дигидрокодеин, меперидин, дифеноксилат, суфентанил, алфентанил, пропоксифен, пентазоцин, налбуфин, буторфанол, бупренорфин, мептазинол, дезоцин и их фармацевтически приемлемые соли.
Следует понимать, что используемый термин "гидрокодон" включает полусинтетический наркотический аналгетик и противокашлевое средство, который получают из кодеина и многие действия которого качественно аналогичны действию кодеина. Его обычно используют для облегчения умеренной и умеренно жестокой боли. Торговые названия включают Anexsia™, Hycodan™, Hycomine™, Lorcet™, Lortab™, Norco™, Tussionex™, Tylox™ и Vicodin™. Настоящее изобретение охватывает другие солевые формы гидрокодона, такие как битартрат гидрокодона, и полимерные смеси гидрокодона с пролонгированным высвобождением содержимого.
В некоторых вариантах осуществления настоящего изобретения предлагаются связанные с гидрокодоном карбоновые кислоты, в которых карбоксильные группы непосредственно соединены с арильным фрагментом. Карбоновые кислоты, у которых карбоксильные группы непосредственно соединены с арильным фрагментом, включают бензоаты и гетероарилкарбоновые кислоты.
В некоторых вариантах осуществления настоящего изобретения предлагается по меньшей мере один конъюгат гидрокодона и по меньшей мере одной бензойной кислоты или производного бензойной кислоты, ее соли или их комбинации. Бензоаты распространены в природе и, например, включают, однако этим не ограничиваясь, аминобензоаты (в частности, аналоги антраниловой кислоты, такие как фенаматы), аминогидроксибензоаты и гидроксибензоаты (например, аналоги салициловой кислоты).
Бензойная кислота и производные бензойной кислоты по настоящему изобретению имеют следующую общую структуру:

где X, Y и Z могут быть независимо любой комбинацией H, O, S, NH и -(CH2)X-; R1, R2 и R3 независимо могут быть любыми из следующих групп: Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил; o, p, q могут независимо обозначать либо 0, либо 1.
Подходящие гидроксибензойные кислоты можно найти на фигуре 1 и они включают, однако этим не ограничиваясь, бензойную кислоту, салициловую кислоту, ацетилсалициловую кислоту (аспирин), 3-гидроксибензойную кислоту, 4-гидроксибензойную кислоту, 6-метилсалициловую кислоту, o,м,п-крезотиновую кислоту, анакардиновые кислоты, 4,5-диметилсалициловую кислоту, o,м,п-окси-парацимолкарбоновую кислоту, дифлузинал, o,м,п-анисовую кислоту, 2,3-дигидробензойную кислоту (2,3-DHB), α,β,γ-резорциновую кислоту, протокатеховую кислоту, гентизиновую кислоту, пиперониловую кислоту, 3-метоксисалициловую кислоту, 4-метоксисалициловую кислоту, 5-метоксисалициловую кислоту, 6-метоксисалициловую кислоту, 3-гидрокси-2-метоксибензойную кислоту, 4-гидрокси-2-метоксибензойную кислоту, 5-гидрокси-2-метоксибензойную кислоту, ванилиновую кислоту, изованилиновую кислоту, 5-гидрокси-3-метоксибензойную кислоту, 2,3-диметоксибензойную кислоту, 2,4-диметоксибензойную кислоту, 2,5-диметоксибензойную кислоту, 2,6-диметоксибензойную кислоту, вератровую кислоту (3,4-диметоксибензойную кислоту), 3,5-диметоксибензойную кислоту, галловую кислоту, 2,3,4-тригидроксибензойную кислоту, 2,3,6-тригидроксибензойную кислоту, 2,4,5-тригидроксибензойную кислоту, 3-O-метилгалловую кислоту (3-OMGA), 4-O-метилгалловую кислоту (4-OMGA), 3,4-O-диметилгалловую кислоту, сиреневую кислоту, 3,4,5-триметоксибензойную кислоту.
Подходящие аминобензойные кислоты приведены на фигуре 2 и они включают, однако этим не ограничиваясь, антраниловую кислоту, 3-аминобензойную кислоту, 4,5-диметилантраниловую кислоту, N-метилантраниловую кислоту, N-ацетилантраниловую кислоту, фенамовые кислоты (например, толфенамовую кислоту, мефенамовую кислоту, флуфенамовую кислоту), 2,4-диаминобензойную кислоту (2,4-DABA), 2-ацетиламино-4-аминобензойную кислоту, 4-ацетиламино-2-аминобензойную кислоту, 2,4-диацетиламинобензойную кислоту.
Подходящие аминогидроксибензойные кислоты включают, однако этим не ограничиваясь, 4-аминосалициловую кислоту, 3-гидроксиантраниловую кислоту и 3-метоксиантраниловую кислоту.
В некоторых вариантах осуществления настоящего изобретения композиция включает бензоатный конъюгат, включающий по меньшей мере один гидрокодон, связанный по меньшей мере с одной бензойной кислотой или производным бензойной кислоты, ее солью или их комбинацией.
В некоторых вариантах осуществления настоящего изобретения бензоаты включают множество аналогов бензойной кислоты, бензоатные производные, имеющие гидроксильные группы или аминогруппы, или комбинации обоих указанных групп. Функциональные гидроксильные группы и аминогруппы могут присутствовать в их свободной форме или же они могут быть закрыты другим химическим фрагментом, предпочтительно, однако этим не ограничиваясь, метильными или ацетильными группами. Фенильные группы могут иметь дополнительные заместители, однако общее количество заместителей может быть равно четырем или меньше, трем или меньше или двум или меньше.
В другом варианте осуществления настоящего изобретения пролекарством или композицией конъюгата по настоящему изобретению является бензоат-гидрокодон, который имеет структуру:

бензоат-гидрокодон (Bz-HC)
В еще одном варианте осуществления настоящего изобретения предлагается пролекарство или композиция, включающая по меньшей мере один конъюгат гидрокодона и по меньшей мере одной гетероарилкарбоновой кислоты, ее производного или их комбинации. Гетероарилкарбоновая кислота может быть выбрана из формулы II, формулы III и формулы IV, где формула II, формула III и формула IV имеют следующие структуры:

В указанных формулах X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-; R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил; o, p, q независимо выбраны из 0 или 1; а x обозначает целое число в диапазоне от 1 до 10.
В некоторых вариантах осуществления настоящего изобретения карбоксильная группа арилкарбоновых кислот может быть присоединена непосредственно к ароматическому ядру. Настоящее изобретение включает как арильные группы, содержащие лишь атомы углерода, так и арильные группы с гетероатомами (гетероарильные группы). Арильная или гетероарильная группа, которая непосредственно присоединена к функциональной карбоксильной группе, может быть 6-членным циклом и не содержит или же содержит один гетероатом. В некоторых вариантах осуществления настоящего изобретения дополнительные замещенные или незамещенные ароматические или алифатические циклы могут быть конденсированы с указанным 6-членным арильным или гетероарильным фрагментом. В некоторых вариантах осуществления настоящего изобретения арилкарбоновые кислоты могут иметь только одну свободную карбоксильную группу, а общее количество фенильных заместителей в 6-членном цикле должно быть четыре или меньше, например, 4, 3, 2 или 1.
В некоторых вариантах осуществления настоящего изобретения, в зависимости от индивидуальной арилкарбоновой кислоты, которая связана с гидрокодоном, конъюгат гидрокодона может иметь нейтральную форму, форму свободной кислоты, форму свободного основания или различные фармацевтически приемлемые анионные или катионные солевые формы или смеси солей с любым отношением положительно или отрицательно заряженных компонентов. Указанные солевые формы включают, однако этим не ограничиваясь: ацетат, L-аспартат, безилат, бикарбонат, карбонат, D-камсилат, L-камсилат, цитрат, эдизилат, фумарат, глюконат, гидробромид/бромид, гидрохлорид/хлорид, D-лактат, L-лактат, D,L-лактат, D,L-малат, L-малат, мезилат, памоат, фосфат, сукцинат, сульфат, D-тартрат, L-тартрат, D,L-тартрат, мезо-тартрат, бензоат, глюцептат, D-глюкуронат, гибензат, изетионат, малонат, метилсульфат, 2-напсилат, никотинат, нитрат, оротат, стеарат, тозилат, ацефиллинат, ацетурат, аминосалицилат, аскорбат, борат, бутират, камфорат, камфокарбонат, деканоат, гексаноат, холат, ципионат, дихлороацетат, эдентат, этилсульфат, фурат, фузидат, галактарат (мукат), галактуронат, галлат, гентизат, глутамат, глутарат, глицерофосфат, гептаноат (энантат), гидроксибензоат, гиппурат, фенилпропионат, иодид, ксинафоат, лактобионат, лаурат, малеат, манделат, метансульфонат, миристат, нападизилат, олеат, оксалат, пальмитат, пикрат, пивалат, пропионат, пирофосфат, салицилат, салицилсульфат, сульфосалицилат, таннат, терефталат, тиосалицилат, триброфенат, валерат, вальпроат, адипат, 4-ацетаминобензоат, камсилат, октаноат, эстолат, эзилат, гликолят, тиоцианат и ундециленат.
В настоящем изобретении подходящий конъюгат гидрокодона включает никотинат-гидрокодон, который имеет следующую структуру:
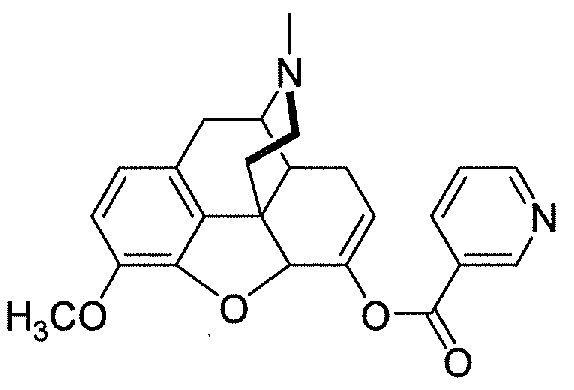
никотинат-гидрокодон (никотинат-HC)
В некоторых вариантах осуществления настоящего изобретения предлагается конъюгат гидрокодона, который разрушается в условиях in vivo либо ферментативно, либо иным образом, высвобождая активный гидрокодон и соответствующую карбоновую кислоту или их метаболиты. Арилкарбоновые кислоты, используемые в конъюгатах по настоящему изобретению, не токсичны при данных уровнях дозирования и, преимущественно, представляют собой известные лекарственные средства, натуральные продукты, метаболиты или GRAS (общепризнанные безопасными) соединения (в частности, консерванты, красители, ароматизаторы и т.п.) или их нетоксичные миметики.
Соединения, композиции и способы по настоящему изобретению снижают возможность передозировки, снижают возможность злоупотребления или привыкания и/или улучшают характеристики гидрокодона, связанные с высокой токсичностью или подоптимальными профилями высвобождения лекарственного средства. Не желая ограничивать себя изложенной ниже теорией, авторы настоящего изобретения полагают, что предохранение от передозировки может возникать вследствие того, что при пероральном приеме конъюгаты подвергаются воздействию различных ферментов и/или метаболических путей, при этом воздействие на конъюгат будет оказано в кишечнике, и он подвергается пресистемному метаболизму, в отличие от воздействия ферментов в системе кровообращения и на мембранах слизистых оболочек, что ограничивает возможность гидрокодона быть высвобожденным из конъюгата. Таким образом, устойчивость к злоупотреблению обеспечивается за счет ограничения "начального проявления приятных чувств" или "нервного подъема", возникающего под воздействием активного гидрокодона, высвободившегося из пролекарства, и за счет ограничения эффективности альтернативных путей введения препарата.
Композиции по настоящему изобретению предпочтительно не обладают фармакологической активностью или обладают существенно сниженной фармакологической активностью, когда их вводят путем инъекции или интраназально. Однако они остаются перорально биодоступными. Вновь, не желая связывать себя какой-либо конкретной теорией, авторы настоящего изобретения полагают, что биодоступность может явиться результатом гидролиза химической связи (то есть, ковалентной связи) после перорального приема. По меньшей мере в одном варианте осуществления настоящего изобретения высвобождение гидрокодона снижается, когда композицию по настоящему изобретению доставляют парентеральными путями.
Например, в одном варианте осуществления настоящего изобретения композиция по настоящему изобретению сохраняет свою эффективность и устойчивость к злоупотреблению после дробления таблетки, капсулы или другой пероральной лекарственной формы. Напротив, из неконъюгированных (или "несопряженных") парентеральных форм гидрокодона указанный гидрокодон немедленно высвобождается после дробления и позволяет использовать содержимое измельченной таблетки путем инъекции или позволяет принять дозу порошкообразного наркотика, вызывая эффект "начального проявления приятных чувств", который жаждут наркозависимые люди.
В некоторых вариантах осуществления настоящего изобретения конъюгаты гидрокодона можно перорально вводить пациенту-животному или пациенту-человеку, а после введения они высвобождают активный гидрокодон за счет гидролиза конъюгатов в организме. Не желая связывать себя какой-либо конкретной теорией, авторы настоящего изобретения полагают, что поскольку арилкарбоновые кислоты представляют собой встречающиеся в природе метаболиты или их миметики или же являются фармацевтически активными соединениями, то они легко распознаются физиологическими системами, что приводит к их гидролизу и высвобождению гидрокодона. Сами конъюгаты либо не обладают фармакологической активностью, либо обладают ограниченной фармакологической активностью и, следовательно, могут двигаться по метаболическим путям, которые отличны от метаболических путей исходного лекарственного средства.
В некоторых вариантах осуществления настоящего изобретения выбор подходящих арилкарбоновых кислот ("лигандов") для конъюгирования с гидрокодоном определяет процесс высвобождения гидрокодона в большой круг кровообращения, и его можно контролировать даже в том случае, когда конъюгат вводят способом, отличным от перорального. В одном варианте осуществления настоящего изобретения модифицированный гидрокодон способен высвобождать гидрокодон аналогично свободному или немодифицированному гидрокодону. В другом варианте осуществления настоящего изобретения конъюгированный гидрокодон высвобождает гидрокодон контролируемо или пролонгированно. В некоторых вариантах осуществления настоящего изобретения указанное контролируемое высвобождение способно облегчить определенные побочные эффекты и улучшить профиль безопасности исходного лекарственного средства. Указанные побочные эффекты могут включать, однако этим не ограничиваясь, беспокойство, кровотечения, запор, снижение аппетита, затрудненное дыхание, головокружение, сонливость, саднение во рту, понос, головную боль, тошноту, спазмы желудка, желудочную боль, рвоту. В другом варианте осуществления настоящего изобретения конъюгированный гидрокодон позволяет в процессе обмена веществ осуществить селективное превращение гидрокодона в гидроморфон. В другом варианте осуществления настоящего изобретения указанные конъюгаты могут применяться для купирования боли, такой как умеренная боль и жестокая боль.
Гидрокодон и другие опиоиды обладают сильно выраженной способностью вызвать зависимость и стимулируют злоупотребление ими. Неправильное применение рекреационными препаратами представляет собой обычную проблему и обычно начинается с пероральных доз, которые принимают с целью испытать эйфорию ("начальное проявление приятных чувств", "нервный подъем"). С течением времени наркозависимый человек часто увеличивает пероральные дозировки, чтобы добиться более сильных "нервных подъемов" или компенсировать повышенную толерантность к опиоиду. Указанное поведение обостряется и приводит к поиску других путей введения, таких как интраназальный ("прием дозы порошкообразного наркотика") и внутривенный ("введение наркотика внутривенно").
В некоторых вариантах осуществления настоящего изобретения гидрокодон, который конъюгирован с подходящим лигандом в виде арилкарбоновой кислоты, после перорального приема не приводит к быстрому возрастанию его концентрации в плазме, к чему стремится человек, который способен злоупотреблять лекарственными препаратами. В некоторых вариантах осуществления настоящего изобретения высвободившийся из указанных конъюгатов гидрокодон имеет отсроченную величину Tmax и, возможно, меньшее значение Cmax, чем неконъюгированный гидрокодон. Не желая связывать себя какой-либо конкретной теорией, авторы настоящего изобретения полагают, что конъюгаты по настоящему изобретению, когда их принимают перорально или другим отличным от перорального путем, не создают ощущение "начального проявления приятных чувств" даже в том случае, когда их вводят в более высоких дозах, но все еще способны ослаблять боль.
Кроме того, в некоторых вариантах осуществления настоящего изобретения гидрокодон, конъюгированный с подходящими лигандами по настоящему изобретению, не гидролизуется эффективно в том случае, когда его вводят путем, отличным от перорального. В результате указанные конъюгаты, когда их вводят в виде инъекции или в виде порошка, не создают в плазме или крови больших концентраций высвобожденного гидрокодона по сравнению со свободным гидрокодоном, который вводят указанными путями.
В некоторых вариантах осуществления настоящего изобретения конъюгаты по настоящему изобретению, поскольку они включают ковалентно связанный гидрокодон, не способны при физическом манипулировании высвобождать опиоид гидрокодон из конъюгированного гидрокодона такими способами, как, например, измельчение или дробление твердых лекарственных форм. Кроме того, конъюгаты по настоящему изобретению устойчивы к химическому гидролизу в условиях, которые человек, способный злоупотреблять лекарственными препаратами, может использовать, чтобы "извлечь" активную часть молекулы, например, путем кипячения или путем кислотной или щелочной обработки раствора конъюгата.
Композиции и пролекарства по настоящему изобретению могут быть приготовлены в виде пероральных лекарственных форм. Указанные лекарственные формы включают, однако этим не ограничиваясь, таблетку, капсулу, таблетку в форме капсулы, пастилку, лепешку, порошок, суспензию, сироп, раствор или тонкопленочную пероральную форму (OTF). Предпочтительными пероральными формами являются капсула, таблетка, раствор и OTF.
Твердые лекарственные формы могут включать, однако этим не ограничиваясь, следующие типы вспомогательных соединений: антиадгезивные вещества, связующие вещества, покрытия, разрыхлители, наполнители, ароматизаторы и пигменты, глиданты, лубриканты, консерванты, сорбенты и подсластители.
Пероральные композиции по настоящему изобретению могут также быть включены в раствор или суспензию в водной жидкости или неводной жидкости. Состав может представлять собой эмульсию, такую как жидкая эмульсия масла в воде или жидкая эмульсия воды в масле. Указанные масла можно вводить, добавляя очищенные и стерильные жидкости к подготовленному энтеральному составу, который затем помещают в зонд для искусственного кормления пациента, который не может глотать.
Могут быть приготовлены капсулы из мягкого геля или мягкие желатиновые капсулы, например, путем диспергирования композиции в подходящем носителе (обычно используют растительные масла) с образованием высоко вязкой смеси. Указанную смесь затем инкапсулируют в пленку из желатина, используя способы и технологическое оборудование, известные специалистам из области получения мягких гелей. Сформированные указанным образом индивидуальные препараты затем высушивают до постоянного веса.
Жевательные таблетки можно, например, приготовить путем смешивания композиций с инертными наполнителями, пригодными для формирования относительно мягкой, ароматизированной лекарственной формы в виде таблетки, которая предназначена для разжевывания, а не для глотания. Можно использовать обычные таблетировочные машины и обычные способы таблетирования, например, прямое прессование или гранулирование, т.е. агрегирование зерен сыпучего материала перед прессованием. Специалисты, которые принимают участие в приготовлении твердых лекарственных форм, имеют опыт применения указанных способов и технологического оборудования, поскольку предназначенные для жевания лекарственные формы являются весьма распространенными лекарственными препаратами в фармацевтической промышленности.
Можно приготовить, например, таблетку с пленочной оболочкой, формируя на таблетке покрытие с помощью таких способов, как нанесение покрытия методами, в которых используют вращающийся выпарной аппарат, или нанесение покрытия воздушно-суспензионным методом, с целью формирования на таблетке непрерывного пленочного слоя.
Спрессованные таблетки, например, можно получить, смешивая состав с инертными наполнителями, предназначенными для того, чтобы придать смеси связующие свойства или разрыхляющие свойства. Смесь либо непосредственно спрессовывают, либо гранулируют, а затем спрессовывают, используя известные в промышленности способы и технологическое оборудование. Полученные лекарственные формы в виде таблеток затем упаковывают, в зависимости от потребности рынка, например, в виде стандартной разовой лекарственной формы, рулетов, баллонов, прозрачных упаковок и т.д.
Настоящее изобретение охватывает также использование биологически приемлемых носителей, которые можно получить из широкого круга веществ. Без ограничений, подобные вещества включают растворители, связующие и адгезивы, лубриканты, пластификаторы, разрыхлители, пигменты, наполнители, ароматизаторы, подсластители и разнообразные другие вещества, такие как буферные добавки и адсорбенты, с тем, чтобы приготовить конкретную композицию лекарственного средства.
Связующие соединения можно выбрать из широкого круга веществ, таких как гидроксипропилметилцеллюлоза, этилцеллюлоза или другие подходящие производные целлюлозы, повидон, сополимеры акриловой и метакриловой кислоты, фармацевтическая глазурь, смолы, продукты переработки молока, такие как сыворотка, крахмалы и их производные, а также другие обычные связующие, известные специалистам из области техники. Неограничивающими настоящее изобретение примерами растворителей являются вода, этанол, изопропиловый спирт, метиленхлорид или их смеси и комбинации. Неограничивающими настоящее изобретение примерами наполнителей являются сахар, лактоза, желатин, крахмал и диоксид кремния.
Следует понимать, что помимо тех ингредиентов, которые, в частности, указаны выше, композиции по настоящему изобретению могут включать другие подходящие агенты, такие как вкусовые добавки, консерванты и антиоксиданты. Подобные антиоксиданты должны быть пригодными в пищу и могут включать витамин E, каротин, BHT или другие антиоксиданты.
Другими соединениями, которые могут быть включены путем смешивания, являются, например, инертные с медицинской точки зрения ингредиенты, в частности, твердые и жидкие разбавители, такие как лактоза, декстроза, сахароза, целлюлоза, крахмал или фосфат кальция для таблеток или капсул, оливковое масло или этилолеат для мягких капсул и вода или растительное масло для суспензий или эмульсий; лубриканты, такие как оксид кремния, тальк, стеариновая кислота, стеарат магния или кальция и/или полиэтиленгликоли; желатинизирующие средства, такие как коллоидные глины; загустители, такие как трагакантовая камедь или альгинат натрия, связующие вещества, такие как крахмалы, гуммиарабики, желатин, метилцеллюлоза, карбоксиметилцеллюлоза или поливинилпирролидон; разрыхлители, такие как крахмал, альгиновая кислота, альгинаты или натриевый гликолят крахмала; шипучие смеси; красители; подсластители; смачивающие агенты, такие как лецитин, полисорбаты или лаурилсульфаты; и другие терапевтически приемлемые вспомогательные ингредиенты, такие как увлажнители, консерванты, буферные добавки и антиоксиданты, которые являются известными добавками для указанных композиций.
Для перорального приема тонкоизмельченные порошки или гранулы, содержащие разбавители, диспергаторы и/или поверхностно-активные вещества, могут быть приготовлены в виде дозы жидкого лекарства в воде или сиропе, в виде капсул или пакетов-саше в сухом состоянии, в виде не водной суспензии, куда могут добавляться суспендирующие средства, или в виде суспензии в воде или сиропе. Если желательно, можно добавить усилители вкуса, консерванты, суспендирующие средства, загустители или эмульгаторы.
Жидкие дисперсии для перорального приема могут представлять собой сиропы, эмульсии или суспензии. Сиропы в качестве носителя могут содержать, например, сахарозу или сахарозу с глицерином, и/или маннитом, и/или сорбитом. В частности, сироп для страдающих диабетом пациентов может содержать в качестве носителя лишь те вещества, например сорбит, которые не превращаются при обмене веществ в глюкозу или которые при обмене веществ образуют лишь очень малое количество глюкозы. Суспензии и эмульсии могут содержать в составе носителя, например, природную камедь, агар, альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт.
В настоящее время одобренные для использования композиции гидрокодона представляют собой комбинированные лекарственные средства гидрокодона, в зависимости от предполагаемого назначения, содержащие гидрокодон и одно или несколько других неактивных наркотических ингредиентов. Примеры указанных активных фармацевтических препаратов включают, однако этим не ограничиваясь, ацетаминофен, фенилпропаноламин, гоматропин, ибупрофен, аспирин, фенирамин, хлорфенирамин, фенилэфрин, псевдоэфедрин, пириламин и гуаифенезин. Можно приготовить композицию конъюгированного гидрокодона по настоящему изобретению с одним из указанных активных веществ или с комбинацией указанных или других активных веществ или же приготовить композицию виде отдельного активного ингредиента без добавок каких-либо других активных веществ.
Содержащие конъюгат композиции или пролекарства могут использоваться в способах лечения пациента, имеющего заболевание, расстройство или состояние, которое требует или которое опосредуется связыванием или ингибированием связывания опиоида с рецепторами опиоида пациента. Лечение включает пероральное введение пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона, как указано в настоящем изобретении. Конъюгат может демонстрировать меньшую скорость высвобождения с течением времени и меньшую величину AUC по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона. В других вариантах осуществления настоящего изобретения по меньшей мере один конъюгат может демонстрировать меньшую изменчивость фармакокинетического профиля при пероральном приеме по сравнению с неконъюгированным гидрокодоном.
В других вариантах осуществления настоящего изобретения по меньшей мере один конъюгат предлагается в количестве, достаточном для того, чтобы обеспечить терапевтически биоэквивалентное значение AUC (площадь под кривой), по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона. В других вариантах осуществления настоящего изобретения по меньшей мере один конъюгат предлагается в количестве, достаточном для того, чтобы обеспечить терапевтически биоэквивалентное значение AUC, по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона, при этом конъюгат имеет более низкую величину Cmax (пиковая концентрация) в плазме или не показывает эквивалентную величину Cmax концентрации в плазме. В соответствии с некоторыми аспектами конъюгат предлагается в количестве, достаточном, чтобы получить терапевтически биоэквивалентную величину Cmax, по сравнению с неконъюгированным гидрокодоном.
Подходящими заболеваниями, расстройствами и состояниями, которые можно лечить с помощью пролекарств или композиций по настоящему изобретению, являются зависимость от наркотиков или привыкание к чрезмерному употреблению лекарственных средств и/или острая или хроническая боль.
Дозировки конъюгатов по настоящему изобретению зависят от их молекулярной массы и соответствующего массового процента гидрокодона как части конъюгата в целом, и поэтому они могут быть более высокими, чем дозировки свободного гидрокодона. Дозы можно рассчитать на основании концентрации дозировок битартрата гидрокодона, которая меняется в диапазоне от 2,5 мг до 15 мг на дозу. Конверсию дозы при переходе от битартрата гидрокодона к пролекарству гидрокодона можно осуществить, используя следующую формулу:
доза(HC пролекарство/конъюгат) = [доза(HC битартрат) × (молекулярная масса(HC пролекарство/конъюгат)/494,49)]/пропорция гидрокодона, высвободившегося из пролекарства/конъюгата
HC: гидрокодон
Подходящие дозировки конъюгированного гидрокодона по настоящему изобретению включают, однако этим не ограничиваясь, композиции, которые содержат от приблизительно 0,5 мг или больше, или же от приблизительно 2,5 мг или больше, или же от приблизительно 5,0 мг или больше, или же от приблизительно 7,5 мг или больше, или же от приблизительно 10 мг или больше, или же от приблизительно от 20 мг или больше, или же от приблизительно 30 мг или больше, или же от приблизительно от 40 мг или больше, или же от приблизительно от 50 мг или больше, или же от приблизительно от 60 мг или больше, или же от приблизительно от 70 мг или больше, или же от приблизительно от 80 мг или больше, или же от приблизительно от 90 мг или больше, или же от приблизительно от 100 мг или больше, и включают любые его дополнительные приращения, например, 0,1; 0,2; 0,25; 0,3; 0,4; 0,5; 0,6; 0,7; 0,75; 0,8; 0,9 или 1,0 мг, и множители (например, ×1; ×2; ×2,5; ×5; ×10; ×100 и т.д.). Настоящее изобретение включает также составы дозы, в том числе одобренные в настоящее время к использованию композиции гидрокодона (см. фигуру 4), где дозировку можно рассчитать, используя вышеуказанную формулу, которую определяет количество битартрата гидрокодона. В настоящем изобретении предлагаются лекарственные формы, составленные в виде монотерапевтического средства или лекарственного средства для комбинированной терапии с другим активным фармакологическим ингредиентом (фигура 4).
Конъюгаты гидрокодона с производными бензойной кислоты или никотиновой кислоты по настоящему изобретению обладают рядом преимуществ, включая, однако этим не ограничиваясь, меньшую изменчивость концентраций гидрокодона или гидроморфона в плазме по сравнению со свободным гидрокодоном, меньшую потенциальную опасность злоупотребления лекарством, меньший риск химического или физического манипулирования, что приводит к выделению всей дозы гидрокодона, улучшенные лекарственные формы за счет образования ковалентной связи с карбоновой кислотой или ее производными, повышенный или сниженный метаболизм гидрокодона в гидроморфон и/или сниженные побочные эффекты, помимо злоупотребления лекарственным средством.
Гидрокодон представляет собой наркотическое аналгезирующее средство, которое действует как слабый агонист рецептора опиоида в центральной нервной системе (ЦНС). Он, прежде всего, воздействует на μ (мю) рецептор (OP3), но также проявляет активность как агонист δ (дельта) рецептора (OP1) и κ (каппа) рецептора (OP2). Кроме того, гидрокодон обладает противокашлевыми свойствами, подавляя кашлевой рефлекс в медуллярном кашлевом центре мозга.
Побочные эффекты опиоидных аналгезирующих средств включают желудочно-кишечное расстройство, вызываемое связыванием опиоидов с мю (μ) рецепторами, имеющимися в желудочно-кишечном тракте. Побочные эффекты в желудке включают снижение секреции хлористоводородной кислоты, снижение двигательной функции желудка, при этом удлиняется время опорожнения желудка, что может привести к гастроэзофагеальному рефлюксу. Время прохождения содержимого желудка через двенадцатиперстную кишку может возрасти на целых 12 часов, и абсорбция перорально введенных препаратов замедляется. В тонком кишечнике опиоидные аналгезирующие средства уменьшают секрецию желчи, секрецию поджелудочной железы и кишечные секреции и приводят к задержке переваривания пищи в тонком кишечнике. Пропульсивные перистальтические волны в толстой кишке снижаются или прекращаются после назначения опиоидов, а тонус возрастает до уровня спазма. Возникающая вследствие этого задержка в продвижении содержимого кишечника вызывает значительное высыхание экскрементов, что, в свою очередь, замедляет их продвижение через толстую кишку. Указанные действия в сочетании с игнорированием нормальных раздражителей для рефлекса дефекации, вызванным центральным действием лекарственного средства, способствуют развитию вызываемого опиоидом запора.
Гидрокодон применяют для купирования острой и умеренно жестокой боли и для подавления кашля (в частности, сухого, непродуктивного кашля). Пролекарства по настоящему изобретению могут назначаться для ослабления боли, или для подавления кашля, или для лечения любого состояния, которое может потребовать блокирование рецепторов опиоида.
Конъюгаты по настоящему изобретению могут снизить побочные эффекты опиоидных аналгезирующих средств, включая снижение или подавление эффектов, вызывающих запоры.
В настоящем изобретении предлагается также способ синтеза, с целью получения конъюгатов гидрокодона по настоящему изобретению. В одном варианте осуществления настоящего изобретения синтез по настоящему изобретению включает следующие стадии:
1. Защита лиганда, если необходимо;
2. Активирование карбоксильной группы лиганда, если он еще не находится в активированной форме;
3. Добавление активированного лиганда к гидрокодону или наоборот в присутствии основания; и
4. Удаление защитных групп лиганда, если они использовались.
Если арилкарбоновая кислота содержит какие-нибудь дополнительные реакционноспособные функциональные группы, которые могут помешать протеканию реакции сочетания с гидрокодоном, то может оказаться необходимым вначале присоединить одну или несколько защитных групп. Может использоваться любая подходящая защитная группа, в зависимости от типа функциональной группы и условий проведения реакции. Примерами некоторых защитных групп являются: ацетил (Ac), β-метоксиэтоксиметиловый эфир (MEM), метоксиметиловый эфир (MOM), п-метоксибензиловый эфир (PMB), триметилсилил (TMS), трет-бутилдиметилсилил (TBDPS), три-изопропилсилил (TIPS), карбобензилокси (Cbz), п-метоксибензилкарбонил (Moz), трет-бутилоксикарбонил (Boc), 9-флуоренилметоксикарбонил (Fmoc), бензил (Bn), п-метоксибензил (MPM), тозил (Ts). Подходящим является также временное образование ацеталей или кеталей из карбонильных групп.
Карбоксильную группу лигандов необходимо активировать, чтобы она вступила во взаимодействие с гидрокодоном и образовала заметные количества конъюгата. Указанную активацию можно осуществить множеством способов с использованием многочисленных конденсирующих агентов, известных специалисту. Примерами подобных конденсирующих агентов являются: N,N'-дициклогексилкарбодиимид (DCC), N-(3-диметиламинопропил)-N'-этилкарбодиимид (EDCI), N,N'-диизопропилкарбодиимид (DBC), 1,1'-карбонилдиимидазол (CDI) или другие карбодиимиды; (бензотриазол-1-илокси)трис(диметиламино)фосфония гексафторфосфат (BOP), бромтрипирролидинофосфония гексафторфосфат (PyBroP), (бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (PyBOP) или другие фосфониевые реагенты; O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU), фтор-N,N,N',N'-тетраметилформамидиния гексафторфосфат (TFFH), N,N,N',N'-тетраметил-O-(N-сукцинимидил)урония тетрафторборат (TSTU) или другие аминиевые реагенты. Арилкарбоновую кислоту можно также превратить в соответствующий ацилгалогенид, ацилазид или смешанный ангидрид.
На любой из стадий схемы синтеза конъюгата гидрокодона с арилкарбоновой кислотой может потребоваться основание. Подходящие основания включают, однако этим не ограничиваясь: 4-метилморфолин (NMM), 4-(диметиламино)пиридин (DMAP), N,N-диизопропилэтиламин, бис(триметилсилил)амид лития, диизопропиламид лития (LDA), трет-бутоксид любого щелочного металла (например, трет-бутоксид калия), гидрид любого щелочного металла (например, гидрид натрия), алкоголят любого щелочного металла (например, метоксид натрия), триэтиламин или любой другой третичный амин.
Подходящие растворители, которые могут использоваться при проведении любой реакции схемы синтеза конъюгата гидрокодона с арилкарбоновой кислотой включают, однако этим не ограничиваясь: ацетон, ацетонитрил, бутанол, хлороформ, дихлорметан, диметилформамид (ДМФА), диметилсульфоксид (ДМСО), диоксан, этанол, этилацетат, диэтиловый эфир, гептан, гексан, метанол, метил-трет-бутиловый эфир (MTBE), изопропанол, изопропилацетат, диизопропиловый эфир, тетрагидрофуран, толуол, ксилол или воду.
В некоторых вариантах осуществления настоящего изобретения пролекарство является гидрофобным и, таким образом, плохо растворяется в воде. Когда композицию смешивают с водой, это приводит к образованию желеподобной консистенции или образованию комковатой суспензии. Примеры подобных пролекарств включают, однако этим не ограничиваясь, пиперонилат-HC, 3-OH-4-MeO-Bz-HC, 3-OH-Bz-HC и галлат-HC. Указанные пролекарства нельзя вводить крысам в виде интраназальной дозировки, поскольку они не растворяются в воде. Не желая связывать себя какой-либо теорией, авторы настоящего изобретения полагают, что указанные соединения затвердевают или образуют комочки, когда пациент-человек пытается вдохнуть их через нос ("прием дозы порошкообразного наркотика"). Указанное свойство не только делает неприятной попытку злоупотреблять лекарственным средством интраназально, но, видимо, также препятствует прониканию пролекарства через слизистую оболочку носа. Как следствие, указанные соединения становятся неэффективными для данного пути введения.
В настоящем изобретении предлагаются фармацевтические наборы реагентов для лечения или предотвращения симптомов отмены лекарственного средства или купирования боли у пациента. Пациент может быть человеком или животным. Подходящими пациентами-людьми являются пациенты-дети, пожилые пациенты и обычные пациенты. Набор реагентов включает конкретное количество индивидуальных доз в упаковке, содержащих фармацевтически эффективное количество по меньшей мере одного конъюгата гидрокодона по настоящему изобретению. Набор реагентов может также включать инструкции по использованию указанного набора реагентов. Конкретное количество индивидуальных доз может включать от приблизительно 1 до приблизительно 100 индивидуальных дозировок, или же от приблизительно 1 до приблизительно 60 индивидуальных дозировок, или же от приблизительно 10 до приблизительно 30 индивидуальных дозировок, включая, приблизительно 1, приблизительно 2, приблизительно 5, приблизительно 10, приблизительно 15, приблизительно 20, приблизительно 25, приблизительно 30, приблизительно 35, приблизительно 40, приблизительно 45, приблизительно 50, приблизительно 55, приблизительно 60, приблизительно 70, приблизительно 80, приблизительно 100, и включать любые дополнительные приращения, например, 1, 2, 5, 10, и множители (например, ×1; ×2; ×2,5; ×5; ×10; ×100 и т.д.).
Описываемое изобретение и его преимущества станут более понятны со ссылкой на приведенные ниже примеры. Указанные примеры приведены для того, чтобы описать конкретные варианты осуществления настоящего изобретения. Следует понимать, что приведенные конкретные примеры не ограничивают объем настоящего изобретения и не противоречат сущности настоящего изобретения. Специалистам должно быть понятно, что полный объем описываемого изобретения охватывает объект изобретения, определяемый приведенной в данном описании формулой изобретения, а также любые изменения, модификации и эквиваленты формулы изобретения.
Примеры
Пример 1. Химическая стабильность бензоатных и гетероарилкарбоксилатных конъюгатов гидрокодона
Примеры конъюгатов гидрокодона по настоящему изобретению и контрольные тестовые конъюгаты не по настоящему изобретению испытывают на их химическую стабильность в условиях, аналогичных тем, которые потенциальный злоупотребляющий лекарствами пациент может использовать для "извлечения" активной части молекулы, растворенной в воде, хлористоводородной кислоте или бикарбонате натрия при комнатной температуре или при 100°С. Конъюгаты на один час помещают в водный раствор либо при температуре окружающей среды (приблизительно 20°С), либо на масляную баню с температурой 100°С, и определяют количество конъюгата, которое подверглось гидролизу в указанных условиях. Результаты приведены в таблице 1, и они показывают, что конъюгаты не высвобождают гидрокодон при температуре окружающей среды или при нагревании в воде вплоть до температуры 100°С в течение одного часа.
Кроме того, образцы конъюгатов гидрокодона по настоящему изобретению испытывают и сравнивают с образцами других конъюгатов гидрокодона не по настоящему изобретению (адипат-HC) на их способность гидролизоваться в гидрокодон после разбавления в 1N растворе хлористоводородной кислоты (HCl) в течение 1 час при температуре окружающей среды (~20°С) или на масляной бане при 100°С. Процент указывает, как много исходного конъюгата гидролизуется в указанных условиях. Результаты приведены в таблице 2.
Образцы каждого конъюгата растворяют в 5%-ном растворе NaHCO3 в течение одного часа при температуре окружающей среды (~20°С) или на масляной бане при 100°С. Процент указывает, как много исходного конъюгата гидролизуется в указанных условиях, результаты приведены в таблице 3 для конъюгатов по настоящему изобретению и конъюгатов для сравнения не по настоящему изобретению (Tyr-Tyr-Phe-Phe-Ile-гидрокодон (YYFFI-HC) или адипат-HC).
Пример 2: Пероральные фармакокинетические профили конъюгированного гидрокодона по настоящему изобретению
Кривые фармакокинетического профиля при пероральном введении определяют для бензоат-гидрокодон (Bz-HC), пролекарства по настоящему изобретению, в сравнении с двумя конъюгатами не по настоящему изобретению: YYFFI-HC и дигликолят-HC. Крысам перорально вводят количество конъюгата, эквивалентное 2 мг/кг гидрокодона в виде свободного основания, и концентрацию в плазме высвобожденного гидрокодона и активного метаболита, гидроморфона, с течением времени определяют методом ЖХ-МС/МС. Как показано на фигуре 5, кривые фармакокинетического профиля при пероральном введении для высвобожденного гидрокодона в известной степени аналогичны для Bz-HC и YYFFI-HC, однако концентрации в плазме гидрокодона, выделяемого из Bz-HC, в основном значительно выше, чем концентрации гидрокодона, выделяемого из дигликолят-HC (AUC и Cmax для Bz-HC, соответственно, приблизительно на 40% и 50% больше). Кроме того, Bz-HC высвобождает более высокие концентрации в плазме более действенного активного метаболита, гидроморфона (фигура 6), чем оба YYFFI-HC (AUC и Cmax для гидроморфона, образовавшегося из Bz-HC, соответственно, на 60% и 80% больше) и дигликолят-HC (AUC и Cmax для гидроморфона, образовавшегося из Bz-HC, соответственно, на 55% и 180% больше). Указанное наблюдение заставляет предположить, что все три соединения выбирают различные пути обмена и что Bz-HC потенциально обладает более высокой способностью купировать боль, чем любое из приведенных примерных соединений.
Пример 3: Интраназальные фармакокинетические профили конъюгатов гидрокодона
Конъюгат гидрокодона по настоящему изобретению испытывают на способность препятствовать злоупотреблению, исследуя эффективность гидролиза при назначении путями, отличными от перорального. Крысам интраназально вводят конъюгат в количестве, эквивалентном 2 мг/кг гидрокодона в виде свободного основания, и концентрацию в плазме крыс высвобожденного гидрокодона и активного метаболита, гидроморфона, с течением времени определяют методом ЖХ-МС/МС. Концентрации гидрокодона в плазме были значительно ниже для Bz-HC (AUC и Cmaxдля гидроморфона, выделившегося из адипат-HC, приблизительно на 280% и 60% больше, соответственно), как показано на фигуре 7. Кроме того, Bz-HC дают очень низкую концентрацию гидроморфона в плазме по сравнению с адипат-HC (AUC и Cmax для гидроморфона, выделившегося из адипат-HC, приблизительно на 750% и 660% больше, соответственно), как показано на фигуре 8.
Пролекарства по настоящему изобретению дают концентрации гидрокодона и гидроморфона в плазме, которые значительно ниже, чем соответствующие концентрации в плазме для несвязанного гидрокодон·BT или для других классов пролекарств, когда введение проводят интраназально.
Пример 4: Примерные внутривенные фармакокинетические профили конъюгатов по настоящему изобретению
Конъюгаты гидрокодона по настоящему изобретению являются гидрофобными, например, Bz-HC, никотинат-HC, 4-MeO-Bz-HC, пиперонилат-HC, 4-OH-Bz-HC, салицилат-HC, 3-OH-4-MeO-Bz-HC, 3-OH-Bz-HC и галлат-HC. Поэтому указанные составы нельзя применять внутривенно в дозах, эквивалентных пероральному введению, поскольку они не растворяются в приемлемом на практике количестве воды, поскольку составы для инъекции должны полностью находиться в растворенном состоянии, т.к. любая твердая частица может вызвать эмболию. Количество воды, необходимое для растворения требуемого количества конъюгата, делает инъекцию невозможной, и, таким образом, композиции и пролекарства по настоящему изобретению потенциально способны воспрепятствовать злоупотреблению лекарственными средствами, в отличие от других конъюгатов гидрокодона, которые растворимы в воде, таких как адипат-HC и дигликолят-HC, и которые можно вводить внутривенно в дозах, эквивалентных пероральному введению.
Пример 5: Сравнение пероральных фармакокинетических профилей конъюгатов гидрокодона
Концентрации в плазме гидрокодона, высвобожденного из Bz-HC и никотинат-HC, сравнивают с концентрациями в плазме гидрокодона, образующегося из неконъюгированного гидрокодон·BT после перорального введения крысам. Крысам вводят конъюгированное или неконъюгированное лекарственное средство в количестве, эквивалентном 2 мг/кг гидрокодона в виде свободного основания, и концентрацию в плазме гидрокодона и гидроморфона определяют методом ЖХ-МС/МС, как показано на фигурах 9 и 10, соответственно. Концентрация в плазме гидрокодона, высвободившегося из Bz-HC, при пероральном введении, увеличивается аналогично концентрациям гидрокодона в плазме, которые наблюдаются для гидрокодон·BT, до тех пор, пока она не достигнет значения Cmax (величина Cmax приблизительно равна для обоих соединений). После Tmax концентрация гидрокодона в плазме для Bz-HC уменьшается медленнее и более управляемо, чем для неконъюгированного гидрокодон·BT (фигура 9 и фигура 10). Bz-HC имеет большее значение AUC (AUC приблизительно на 25% больше, фигура 9) по сравнению гидрокодон·BT, и аналогичные результаты наблюдались для концентраций в плазме активного метаболита, гидроморфона (фигура 10).
Никотинат-HC образует концентрации гидрокодона и гидроморфона в плазме, которые ниже соответствующих концентраций, наблюдаемых для конъюгированного гидрокодон·BT. Тем не менее, соответствующие величины AUC находятся в диапазоне биоэквивалентности для той же дозы (в пересчете на гидрокодон в виде свободного основания).
2-ABz-HC демонстрирует другой профиль высвобождения после перорального введения крысам, чем Bz-HC или неконъюгированный гидрокодон·BT. Крысам вводят количество, эквивалентное 2 мг/кг гидрокодона в виде свободного основания, и концентрацию в плазме гидрокодона или гидроморфона с течением времени определяют методом ЖХ-МС/МС, как показано на фигуре 11 или фигуре 12, соответственно. 2-ABz-HC высвобождает гидрокодон очень медленно, о чем свидетельствует постепенное повышение концентрации в плазме с последующим плавным уменьшением (фигура 11). Это приводит к сглаживанию фармакокинетической кривой по сравнению с кривой для гидрокодон·BT (Tmax для 2-ABz-HC имеет приблизительно в четыре раза большее значение, AUC и Cmax приблизительно на 35% и 60% меньше, соответственно). В целом, фармакокинетическая кривая для 2-ABz-HC тоже более плоская, чем для гидрокодон·BT (фигура 12), однако показывает небольшой первоначальный всплеск (AUC и Cmax для 2-ABz-HC приблизительно на 25% и 50% меньше, соответственно).
Пример 6: Определение изменений концентраций в плазме бензоат-гидрокодон
Чтобы определить изменчивость концентрации в плазме для гидрокодона (HC) и гидроморфона (HM), рассчитывают коэффициент вариации (CV) для индивидуальных животных, которым водят дозы бензоат-гидрокодон или неконъюгированного битартрата гидрокодона (BT) в количестве, эквивалентном 2 мг/кг гидрокодона в виде свободного основания, и концентрации в плазме гидрокодона или гидроморфона с течением времени определяют методом ЖХ-МС/МС. Значения CV рассчитывают, разделив величину среднеквадратичного отклонения концентраций в плазме для индивидуальных животных на величины средних концентраций в плазме для всех животных, которым вводили дозы, для данной временной точки. "Среднее CV" обозначает среднее значение CV для всех временных точек, как указано в таблице 4.
Меньшее среднее значение CV для Bz-HC показывает, что указанное пролекарство обладает меньшей относительной изменчивостью концентрации в плазме для гидрокодона и гидроморфона по всем животным, которым вводили дозы, и по всем временным точкам, по сравнению с неконъюгированным лекарственным средством, битартратом гидрокодона.
Пример 7: Синтез конъюгатов гидрокодона
Синтез свободного основания бензоат-гидрокодон:
К раствору свободного основания гидрокодона (0,596 г, 1,99 ммол) в тетрагидрофуране (25 мл) добавляют 1М раствор LiN(SiMe3)2 в тетрагидрофуране (5,98 мл). Полученную оранжевую суспензию перемешивают при температуре окружающей среды в течение 30 мин, после чего добавляют бензоат-янтарный эфир (1,25 г, 5,98 ммол). Образовавшуюся смесь оставляют перемешиваться на ночь при температуре окружающей среды, а через 18 час реакцию прерывают, добавив 100 мл насыщенного раствора хлорида аммония, и перемешивают еще в течение 2 час. К смеси добавляют этилацетат (100 мл) и промывают насыщенным раствором хлорида аммония (3×100 мл) и водой (1×100 мл). Органические экстракты сушат над безводным MgSO4, растворитель удаляют и остаток растворяют в 2-изопропаноле (50 мл). Добавляют воду до образования твердого вещества. Полученную смесь охлаждают, фильтруют и сушат, получая свободное основание бензоат-гидрокодон (0,333 г, 0,826 ммол, выход 42%) в виде твердого вещества темно-коричневого цвета. Приведенный синтез изображен на фигуре 13A.
Синтез сукцината 2-Boc-аминобензойной кислоты:
2-Boc-аминобензойную кислоту (2,56 г, 10,8 ммол) и N-гидроксисукцинимид (1,37 г, 11,88 ммол) растворяют в 25 мл ТГФ. В один прием добавляют DCC (2,45 г, 11,88 ммол). Реакционную смесь оставляют перемешиваться на ночь. Твердое вещество отфильтровывают и промывают ацетоном (2×10 мл). Фильтрат упаривают досуха и остаток растворяют в 100 мл ацетона. Образовавшийся осадок (DCU) отфильтровывают, и фильтрат концентрируют, получая твердое вещество, которое собирают, промывают метанолом (3×4 мл) и получают 3,26 г (90%) продукта белого цвета.
Синтез сложного эфира гидрокодона с 2-Boc-аминобензойной кислотой:
К гидрокодону в виде свободного основания (0,449 г, 1,5 ммол), растворенному в 20 мл безводного ТГФ, добавляют раствор LiHMDS в ТГФ (1М, 4,5 мл, 4,5 ммол) в течение 20 мин. Смесь перемешивают в течение 30 мин, и в один прием добавляют сукцинат 2-Boc-аминобензойной кислоты (1,50 г, 4,5 ммол). Реакционную смесь перемешивают в течение 4 час, а затем прерывают реакцию, добавив 100 мл насыщенного раствора NH4Cl. Смесь перемешивают 1 час и экстрагируют 200 мл этилацетата. Слой этилацетата промывают насыщенным раствором NaHCO3 (2×80 мл) и 5%-ным раствором соли (80 мл), сушат над безводным Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (7% MeOH/CH2Cl2) и получают 449 мг (58%) аморфного твердого вещества.
Синтез хлористоводородной соли сложного эфира гидрокодона с 2-Boc-аминобензойной кислотой:
Сложный эфир гидрокодона и 2-Boc-аминобензойной кислоты (259 мг, 0,5 ммол) перемешивают в 4 мл 4N раствора HCl/диоксан в течение 4 час. Растворитель упаривают досуха и к остатку добавляют 5 мл этилацетата. Твердое вещество собирают и промывают этилацетатом, получая 207 мг (84%) продукта.
Синтез 2-МОМ-салицил сукцината:
2-МОМ-салициловую кислоту (3,2 г, 17,6 ммол) и N-гидроксисукцинимид (2,23 г, 19,36 ммол) растворяют в 40 мл ТГФ. В один прием добавляют DCC (3,99 г, 19,36 ммол). Реакционную смесь оставляют перемешиваться на ночь. Твердые вещества отфильтровывают и промывают ацетоном (2×10 мл). Фильтрат концентрируют, и остаток перекристаллизовывают из 10 мл метанола, получая 2,60 г (53%) твердого вещества белого цвета.
Синтез сложного эфира гидрокодона и 2-MOM-салициловой кислоты:
К гидрокодону в виде свободного основания (0,449 г, 1,5 ммол), растворенному в 20 мл безводного ТГФ, добавляют раствор LiHMDS в ТГФ (1М, 4,5 мл, 4,5 ммол) в течение 20 мин. Смесь перемешивают в течение 30 мин, и в один прием добавляют сукцинат 2-MOM-салициловой кислоты (1,26 г, 4,5 ммол). Реакционную смесь перемешивают в течение 4 час, а затем прерывают реакцию, добавив 100 мл насыщенного раствора NH4Cl. Смесь перемешивают 1 час и экстрагируют 200 мл этилацетата. Слой этилацетата промывают насыщенным раствором NaHCO3 (2×80 мл) и 5%-ным раствором соли (80 мл), сушат над безводным Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (8% MeOH/CH2Cl2) и получают 381 мг (58%) сиропообразного вещества.
Синтез хлористоводородной соли сложного эфира гидрокодона с салициловой кислотой:
К сложному эфиру гидрокодона и 2-MOM-салициловой кислоты (380 мг, 0,82 ммол) в 12 мл метанола добавляют 0,5 мл концентрированной HCl (12N). Реакционную смесь перемешивают в течение 6 час. Раствор концентрируют, и остаточную воду удаляют совместным испарением с метанолом (5×5 мл). Полученное твердое вещество растворяют в 1 мл метанола, а затем добавляют 20 мл этилацетата. Полученную мутную смесь концентрируют до объема приблизительно 4 мл. Образовавшееся твердое вещество собирают и промывают этилацетатом, получая 152 мг (41%) продукта.
Пример 8: Пероральные фармакокинетические профили конъюгированного гидрокодона, гидрокодона и гидроморфона у крыс
После перорального введения бензоат-гидрокодон (Bz-HC) крысам получают фармакокинетические кривые для исходного Bz-HC, гидрокодона и активного метаболита, гидроморфона. Крысам перорально вводят количество конъюгата, эквивалентное 2 мг/кг гидрокодона в виде свободного основания, и концентрации в плазме исходного Bz-HC, высвобожденного гидрокодона и активного метаболита, гидроморфона, с течением времени определяют методом ЖХ-МС/МС. Как показано на фигуре 14, воздействие исходного пролекарства Bz-HC намного меньше, чем воздействие гидрокодона или гидроморфона (AUC для исходного Bz-HC составляет приблизительно 10% и 3% от значения AUC для гидрокодона и гидроморфона, соответственно).
Пример 9: Пероральные фармакокинетические профили конъюгированного гидрокодона, гидрокодона и гидроморфона у крыс
После перорального введения бензоат-гидрокодон (Bz-HC) или гидрокодон·BT собакам получают фармакокинетические кривые для исходного Bz-HC (лишь ветвь Bz-HC), гидрокодона и активного метаболита, гидроморфона. Собакам перорально вводят количество гидрокодон·BT или конъюгата, эквивалентное 2 мг/кг гидрокодона в виде свободного основания. Концентрации в плазме исходного Bz-HC, высвобожденного гидрокодона и активного метаболита, гидроморфона, с течением времени определяют методом ЖХ-МС/МС.
Сравнение концентраций в плазме гидрокодона, высвобожденного из Bz-HC и гидрокодон·BT, приведено на фигуре 15. В целом, концентрации в плазме гидрокодона, генерированные обоими соединениями, весьма сходны. Системное действие гидрокодона несколько снижается для Bz-HC по сравнению с гидрокодон·BT (величина AUC гидрокодона для Bz-HC составляет приблизительно 72% от значения AUC для гидрокодон·BT). Значение Cmax гидрокодона для Bz-HC составляет приблизительно 92% от величины Cmax для гидрокодон·BT.
Сравнение концентраций в плазме активного метаболита, гидроморфона, после перорального введения Bz-HC или гидрокодон·BT приведены на фигуре 16. Системное действие и максимальные концентрации в плазме гидроморфона аналогичны для обоих соединений. AUC и значения Cmax гидрокодона для Bz-HC составляют приблизительно 103% и 109% от соответствующих значений для гидрокодон·BT.
Сравнение концентраций в плазме исходного Bz-HC и гидрокодона, высвобожденного из Bz-HC, приведено на фигуре 17. Аналогично результатам, наблюдаемым для крыс, концентрации в плазме исходного пролекарства Bz-HC имеют более низкие значения по сравнению с концентрацией в плазме гидрокодона (значение AUC для исходного Bz-HC приблизительно на 10% меньше, чем значение AUC для гидрокодона).
Пример 10: Внутривенные фармакокинетические профили конъюгированного гидрокодона, гидрокодона и гидроморфона у крыс
Крысам вводят внутривенно Bz-HC (0,30 мг/кг). Вследствие его плохой растворимости в воде (или растворимости в забуференном фосфатом физиологическом растворе), 0,30 мг/кг близко к максимальной дозе, которую можно ввести крысам внутривенно. Определяют фармакокинетические кривые для исходного Bz-HC, гидрокодона и активного метаболита, гидроморфона. Концентрации в плазме исходного Bz-HC, высвобожденного гидрокодона и активного метаболита, гидроморфона, с течением времени определяют методом ЖХ-МС/МС. Полученные фармакокинетические кривые приведены на фигуре 18.
Пример 11: Пероральные фармакокинетические профили гидрокодона и гидроморфона после различных дозировок Bz-HC у крыс
Bz-HC перорально вводят крысам с дозами 0,25; 0,50; 1,00; 2,00; 3,00 или 4,00 мг/кг. Концентрации в плазме гидрокодона или гидроморфона определяют методом ЖХ-МС/МС, как указано на фигуре 19 и 20, соответственно. Воздействие (AUC) гидрокодона и гидроморфона для доз Bz-HC в диапазоне 0,25 и 4,00 мг/кг практически линейны. Тем не менее, соответствующие значения Cmax более изменчивы, в особенности для гидроморфона. Максимальные концентрации в плазме гидроморфона не значительно изменяются для доз Bz-HC выше 2,00 мг/кг.
В данном описании применение единственного числа предполагает, если специально не указано, использование множественного числа.
Композиции, пролекарства и способы, приведенные в настоящем описании, могут быть проиллюстрированы следующими вариантами осуществления настоящего изобретения, которые приведены ниже в пронумерованных параграфах.
1. Композиция, содержащая по меньшей мере один конъюгат гидрокодона и по меньшей мере одной бензойной кислоты или производного бензойной кислоты, ее соли или их комбинации, при этом по меньшей мере одна бензойная кислота или производное бензойной кислоты имеет следующую формулу I:

где
X, Y и Z независимо выбраны из группы, которая включает H, O, S, NH и -(CH2)X-;
R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил;
o, p, q независимо выбраны из 0 или 1; и
x обозначает целое число в диапазоне от 1 до 10.
2. Композиция, содержащая по меньшей мере один конъюгат гидрокодона и по меньшей мере одной бензойной кислоты или ее производного или их комбинации.
3. Композиция, содержащая бензоатный конъюгат, где бензоатный конъюгат включает по меньшей мере один гидрокодон, конъюгированный по меньшей мере с одной бензойной кислотой или производным бензойной кислоты.
4. Композиция по пункту 1, где по меньшей мере одной бензойной кислотой или производным бензойной кислоты является аминобензоат, гидроксибензоат, аминогидроксибензоат, их производное или их комбинация.
5. Композиция по пункту 4, где аминобензоат выбран из группы, которая включает антраниловую кислоту, 3-аминобензойную кислоту, 4,5-диметилантраниловую кислоту, N-метилантраниловую кислоту, N-ацетилантраниловую кислоту, фенамовые кислоты (например, толфенамовую кислоту, мефенамовую кислоту, флуфенамовую кислоту), 2,4-диаминобензойную кислоту (2,4-DABA), 2-ацетиламино-4-аминобензойную кислоту, 4-ацетиламино-2-аминобензойную кислоту, 2,4-диацетиламинобензойную кислоту, их производные и их комбинации.
6. Композиция по пункту 4, где гидроксибензоат выбран из группы, которая включает салициловую кислоту, ацетилсалициловую кислоту (аспирин), 3-гидроксибензойную кислоту, 4-гидроксибензойную кислоту, 6-метилсалициловую кислоту, o,м,п-крезотиновую кислоту, анакардиновые кислоты, 4,5-диметилсалициловую кислоту, o,м,п-окси-парацимолкарбоновую кислоту, дифлузинал, o,м,п-анисовую кислоту, 2,3-дигидробензойную кислоту (2,3-DHB), α,β,γ-резорциновую кислоту, протокатеховую кислоту, гентизиновую кислоту, пиперониловую кислоту, 3-метоксисалициловую кислоту, 4-метоксисалициловую кислоту, 5-метоксисалициловую кислоту, 6-метоксисалициловую кислоту, 3-гидрокси-2-метоксибензойную кислоту, 4-гидрокси-2-метоксибензойную кислоту, 5-гидрокси-2-метоксибензойную кислоту, ванилиновую кислоту, изованилиновую кислоту, 5-гидрокси-3-метоксибензойную кислоту, 2,3-диметоксибензойную кислоту, 2,4-диметоксибензойную кислоту, 2,5-диметоксибензойную кислоту, 2,6-диметоксибензойную кислоту, вератровую кислоту (3,4-диметоксибензойную кислоту), 3,5-диметоксибензойную кислоту, галловую кислоту, 2,3,4-тригидроксибензойную кислоту, 2,3,6-тригидроксибензойную кислоту, 2,4,5-тригидроксибензойную кислоту, 3-O-метилгалловую кислоту (3-OMGA), 4-O-метилгалловую кислоту (4-OMGA), 3,4-O-диметилгалловую кислоту, сиреневую кислоту, 3,4,5-триметоксибензойную кислоту, их производные и их комбинации.
7. Композиция по пункту 4, где аминогидроксибензоат выбран из группы, которая включает 4-аминосалициловую кислоту, 3-гидроксиантраниловую кислоту и 3-метоксиантраниловую кислоту, их производные и их комбинации.
8. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат представляет собой композицию, предназначенную для лечения или предотвращения заболевания, которую применяют для лечения злоупотребления наркотиками или опиоидами или для предупреждения синдрома отмены лекарственного средства.
9. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат представляет собой композицию, предназначенную для купирования боли.
10. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат представляет собой композицию, предназначенную для купирования умеренной и жестокой боли.
11. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат уменьшает или предотвращает злоупотребление лекарствами, которые назначают перорально, интраназально или внутривенно.
12. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат обеспечивает устойчивость к злоупотреблению пероральными, интраназальными или парентеральными лекарственными средствами.
13. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат показывает улучшенную скорость высвобождения с течением времени и величину AUC по сравнению с неконъюгированным гидрокодоном за тот же самый период времени.
14. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат показывает меньшую изменчивость перорального фармакокинетического профиля по сравнению с неконъюгированным гидрокодоном.
15. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат обладает меньшими побочными эффектами по сравнению с неконъюгированным гидрокодоном.
16. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат предотвращает злонамеренное использование лекарственных средств путем как физического, так и химического манипулирования.
17. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат готовят в виде лекарственной формы, выбранной из группы, которая включает: таблетку, капсулу, таблетку в форме капсулы, суппозиторий, пастилку, лепешку, назначаемый перорально порошок, раствор, тонкопленочную пероральную форму, пластинку, суспензию и взвесь.
18. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC, по сравнению с неконъюгированным гидрокодоном.
19. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC и величину Cmax, по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона.
20. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC и меньшую величину Cmax, по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона.
21. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 0,5 мг или больше.
22. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 2,5 мг или больше.
23. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 5 мг или больше.
24. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 10 мг или больше.
25. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 20 мг или больше.
26. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 50 мг или больше.
27. Композиция по пункту 1, 2, 3 или 4, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 100 мг или больше.
28. Способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует связывания опиоида или которое опосредуется связыванием опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной бензойной кислоты или производного бензойной кислоты, ее соли или их комбинации, при этом бензойная кислота или производное бензойной кислоты имеет формулу I:
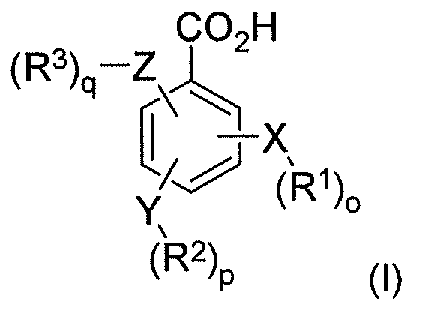
где
X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-;
R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил;
o, p, q независимо выбраны из 0 или 1; и
x обозначает целое число в диапазоне от 1 до 10.
29. Способ по пункту 28, где по меньшей мере один конъюгат показывает меньшую скорость высвобождение с течением времени и большее значение AUC по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона за тот же самый период времени.
30. Способ по пункту 28, где по меньшей мере один конъюгат показывает меньшую изменчивость перорального фармакокинетического профиля по сравнению с неконъюгированным гидрокодоном.
31. Способ по пункту 28, где по меньшей мере один конъюгат обладает меньшими побочными эффектами по сравнению с неконъюгированным гидрокодоном.
32. Способ по пункту 28, где по меньшей мере один конъюгат готовят в виде лекарственной формы, выбранной из группы, которая включает: таблетку, капсулу, таблетку в форме капсулы, суппозиторий, пастилку, лепешку, назначаемый перорально порошок, раствор, тонкопленочную пероральную форму, пластинку, суспензию и взвесь.
33. Способ по пункту 28, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC, по сравнению с неконъюгированным гидрокодоном.
34. Способ по пункту 28, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC и величину Cmax, по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона.
35. Способ по пункту 28, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC и меньшую величину Cmax, по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона.
36. Способ по пункту 28, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 0,5 мг или больше.
37. Способ по пункту 28, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 2,5 мг или больше.
38. Способ по пункту 28, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 5 мг или больше.
39. Способ по пункту 28, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 10 мг или больше.
40. Способ по пункту 28, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 20 мг или больше.
41. Способ по пункту 28, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 50 мг или больше.
42. Способ по пункту 28, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 100 мг или больше.
43. Способ по пункту 28, где по меньшей мере один конъюгат обратимо связывается с рецепторами опиоида пациента.
44. Способ по пункту 28, где по меньшей мере один конъюгат обратимо связывается с рецепторами опиоида пациента, не оказывая при этом угнетающего воздействия на ЦНС.
45. Способ по пункту 28, где по меньшей мере один конъюгат препятствует или снижает по меньшей мере один вызывающий запор побочный эффект неконъюгированного гидрокодона.
46. Способ по пункту 28, где по меньшей мере один конъюгат снижает или препятствует возникновению вызывающих запор побочных эффектов по сравнению с неконъюгированным гидрокодоном.
47. Способ по пункту 28, где по меньшей мере один конъюгат необратимо связывается с рецепторами опиоида пациента.
48. Способ по пункту 28, где по меньшей мере один конъюгат необратимо связывается с рецепторами опиоида пациента, не оказывая при этом угнетающего воздействия на ЦНС.
49. Способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует ингибирования связывания опиоида или которое опосредуется ингибированием связывания опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной бензойной кислоты или производного бензойной кислоты, ее соли или их комбинации, при этом бензойная кислота или производное бензойной кислоты имеет формулу I:

где
X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-;
R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил;
o, p, q независимо выбраны из 0 или 1; и
x обозначает целое число в диапазоне от 1 до 10.
50. Способ по пункту 49, где по меньшей мере один конъюгат обратимо ингибирует связывание опиоида с рецепторами опиоида пациента.
51. Способ по пункту 49, где по меньшей мере один конъюгат обратимо ингибирует связывание опиоида с рецепторами опиоида пациента, не оказывая при этом угнетающего воздействия на ЦНС.
52. Способ по пункту 49, где по меньшей мере один конъюгат препятствует или снижает по меньшей мере один вызывающий запор побочный эффект самого гидрокодона.
53. Способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует связывания опиоида или которое опосредуется связыванием опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной бензойной кислоты, ее соли, ее производного или их комбинации.
54. Способ по пункту 53, где по меньшей мере один конъюгат показывает меньшую скорость высвобождение с течением времени и большее значение AUC по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона за тот же самый период времени.
55. Способ по пункту 53, где по меньшей мере один конъюгат показывает меньшую изменчивость перорального фармакокинетического профиля по сравнению с самим гидрокодоном.
56. Способ по пункту 53, где по меньшей мере один конъюгат обладает меньшими побочными эффектами по сравнению с самим гидрокодоном.
57. Способ по пункту 53, где по меньшей мере один конъюгат готовят в виде лекарственной формы, выбранной из группы, которая включает: таблетку, капсулу, таблетку в форме капсулы, суппозиторий, пастилку, лепешку, назначаемый перорально порошок, раствор, тонкопленочную пероральную форму, пластинку, суспензию и взвесь.
58. Способ по пункту 53, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC, по сравнению с самим гидрокодоном.
59. Способ по пункту 53, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC и величину Cmax, по сравнению с самим гидрокодоном.
60. Способ по пункту 53, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC, по сравнению с самим гидрокодоном, с меньшей величиной Cmax.
61. Способ по пункту 53, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC, по сравнению с самим гидрокодоном, но не эквивалентную величину Cmax.
62. Способ по пункту 53, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 0,5 мг или больше
63. Способ по пункту 53, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 2,5 мг или больше
64. Способ по пункту 53, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 5 мг или больше.
65. Способ по пункту 53, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 10 мг или больше.
66. Способ по пункту 53, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 20 мг или больше.
67. Способ по пункту 53, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 50 мг или больше.
68. Способ по пункту 53, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 100 мг или больше.
69. Способ по пункту 53, где по меньшей мере один конъюгат обратимо связывается с рецепторами опиоида пациента.
70. Способ по пункту 53, где по меньшей мере один конъюгат обратимо связывается с рецепторами опиоида пациента, не оказывая при этом угнетающего воздействия на ЦНС.
71. Способ по пункту 53, где по меньшей мере один конъюгат препятствует или снижает по меньшей мере один вызывающий запор побочный эффект самого гидрокодона.
72. Способ по пункту 53, где по меньшей мере один конъюгат снижает или препятствует возникновению вызывающих запор побочных эффектов.
73. Способ по пункту 53, где по меньшей мере один конъюгат долговременно связывается с рецепторами опиоида пациента.
74. Способ по пункту 53, где по меньшей мере один конъюгат долговременно связывается с рецепторами опиоида пациента, не оказывая при этом угнетающего воздействия на ЦНС.
75. Способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует ингибирования связывания опиоида или которое опосредуется ингибированием связывания опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной бензойной кислоты, ее соли, ее производного или их комбинации.
76. Способ по пункту 75, где по меньшей мере один конъюгат обратимо ингибирует связывание опиоида с рецепторами опиоида пациента.
77. Способ по пункту 75, где по меньшей мере один конъюгат обратимо ингибирует связывание опиоида с рецепторами опиоида пациента, не оказывая при этом угнетающего воздействия на ЦНС.
78. Способ по пункту 75, где по меньшей мере один конъюгат препятствует или снижает по меньшей мере один вызывающий запор побочный эффект самого гидрокодона.
79. Фармацевтический набор реагентов, включающий:
определенное количество индивидуальных дозировок в упаковке, которые содержат фармацевтически эффективное количество по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной бензойной кислоты или производного бензойной кислоты, ее соли или их комбинации, при этом бензойная кислота или производное бензойной кислоты имеет формулу I:

где
X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-;
R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил;
o, p, q независимо выбраны из 0 или 1; и
x обозначает целое число в диапазоне от 1 до 10.
80. Набор реагентов по пункту 79, где указанный набор дополнительно включает:
(ii) инструкции по использованию указанного набора реагентов в способе лечения или предотвращения симптомов отмены лекарственного средства или купирования боли у пациента-человека или пациента-животного.
81. Набор реагентов по пункту 80, где указанным пациентом является пациент-ребенок.
82. Набор реагентов по пункту 80, где указанным пациентом является пожилой пациент.
83. Набор реагентов по пункту 80, где указанным пациентом является обычный пациент.
84. Фармацевтический набор реагентов, включающий:
определенное количество индивидуальных дозировок в упаковке, которые содержат фармацевтически эффективное количество по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной бензойной кислоты, ее соли, ее производного или их комбинации.
85. Набор реагентов по пункту 84, где указанный набор дополнительно включает:
(ii) инструкции по использованию указанного набора реагентов в способе лечения или предотвращения симптомов отмены лекарственного средства или купирования боли у пациента-человека или пациента-животного.
86. Набор реагентов по пункту 85, где указанным пациентом является пациент-ребенок.
87. Набор реагентов по пункту 85, где указанным пациентом является пожилой пациент.
88. Набор реагентов по пункту 85, где указанным пациентом является обычный пациент.
89. Набор реагентов по пункту 79, 80, 84 или 85, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 0,5 мг или больше по меньшей мере одного конъюгата.
90. Набор реагентов по пункту 79, 80, 84 или 85, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 2,5 мг или больше по меньшей мере одного конъюгата.
91. Набор реагентов по пункту 79, 80, 84 или 85, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 5,0 мг или больше по меньшей мере одного конъюгата.
92. Набор реагентов по пункту 79, 80, 84 или 85, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 10 мг или больше по меньшей мере одного конъюгата.
93. Набор реагентов по пункту 79, 80, 84 или 85, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 20 мг или больше по меньшей мере одного конъюгата.
94. Набор реагентов по пункту 79, 80, 84 или 85, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 50 мг или больше по меньшей мере одного конъюгата.
95. Набор реагентов по пункту 79, 80, 84 или 85, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 100 мг или больше по меньшей мере одного конъюгата.
96. Набор реагентов по пункту 79, 80, 84 или 85, где указанный набор реагентов содержит от приблизительно 1 до приблизительно 60 индивидуальных дозировок.
97. Набор реагентов по пункту 79, 80, 84 или 85, где указанный набор реагентов содержит от приблизительно 10 до приблизительно 30 индивидуальных дозировок.
98. Композиция, содержащая по меньшей мере один конъюгат гидрокодона и по меньшей мере одной гетероарилкарбоновой кислоты, ее производного или их комбинации.
99. Композиция по пункту 98, где по меньшей мере, одна гетероарилкарбоновая кислота выбрана из формулы II, формулы III и формулы IV, где формула II, формула III или формула IV имеют следующие структуры:
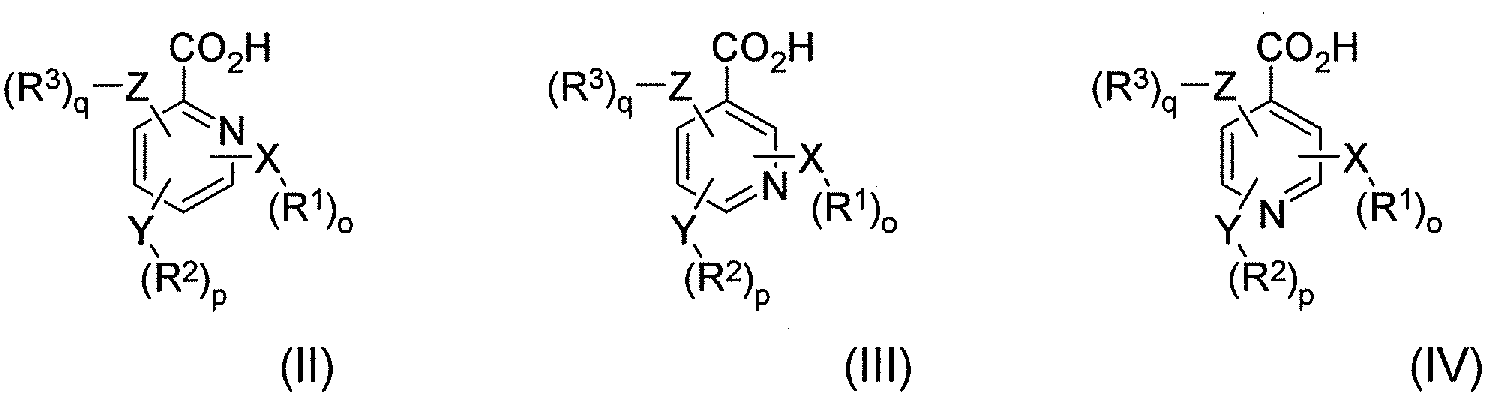
где
X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-;
R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил;
o, p, q независимо выбраны из 0 или 1; и
x обозначает целое число в диапазоне от 1 до 10.
100. Композиция, содержащая по меньшей мере один конъюгат гидрокодона и по меньшей мере одной никотиновой кислоты, ее производного или их комбинации.
101. Композиция по пункту 98, где по меньшей мере одной гетероарилкарбоновой кислотой является производное пиридина.
102. Композиция по пункту 98, где гетероарилкарбоновая кислота выбрана из группы, которая включает изоникотиновую кислоту, пиколиновую кислоту, 3-гидроксипиколиновую кислоту, 6-гидроксиникотиновую кислоту, цитразиновую кислоту, 2,6-дигидроксиникотиновую кислоту, кинуреновую кислоту, ксантуреновую кислоту, 6-гидроксикинуреновую кислоту, 8-метоксикинуреновую кислоту, 7,8-дигидроксикинуреновую кислоту, 7,8-дигидро-7,8-дигидроксикинуреновую кислоту их производные и их комбинации.
103. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат применяют при лечении от злоупотребления лекарственными средствами, наркотиками или опиоидами или для предотвращения синдрома отмены лекарственного средства.
104. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат применяют для купирования боли.
105. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат применяют для купирования умеренной или жестокой боли.
106. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат уменьшает или предотвращает злоупотребление пероральными, интраназальными или внутривенными лекарственными средствами.
107. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат придает стойкость к злоупотреблению пероральными, интраназальными или внутривенными лекарственными средствами.
108. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат предотвращает злонамеренное использование лекарственных средств путем как физического, так и химического манипулирования.
109. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат показывает улучшенную скорость высвобождения с течением времени и величину AUC по сравнению с самим гидрокодоном за тот же самый период времени.
110. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат показывает меньшую изменчивость перорального фармакокинетического профиля по сравнению с эквивалентным молярным количеством самого гидрокодона.
111. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат обладает меньшими побочными эффектами по сравнению с самим гидрокодоном.
112. Композиция по пункту 98, 99 или 100, где указанную композицию готовят в виде лекарственной формы, выбранной из группы, которая включает: таблетку, капсулу, таблетку в форме капсулы, суппозиторий, пастилку, лепешку, назначаемый перорально порошок, раствор, тонкопленочную пероральную форму, пластинку, суспензию и взвесь.
113. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC, по сравнению с эквивалентным молярным количеством самого неконъюгированного гидрокодона.
114. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC и величину Cmax, по сравнению с самим гидрокодоном.
115. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC, по сравнению с самим гидрокодоном, с меньшей величиной Cmax.
116. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 0,5 мг или больше.
117. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 2,5 мг или больше.
118. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 5 мг или больше.
119. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 10 мг или больше.
120. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 20 мг или больше.
121. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 50 мг или больше.
122. Композиция по пункту 98, 99 или 100, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 100 мг или больше.
123. Способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует связывания опиоида или которое опосредуется связыванием опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной гетероарилкарбоновой кислоты.
124. Способ по пункту 123, где по меньшей мере одна гетероарилкарбоновая кислота выбрана из формулы II, формулы III и формулы IV, где формула II, формула III или формула IV имеют следующие структуры:
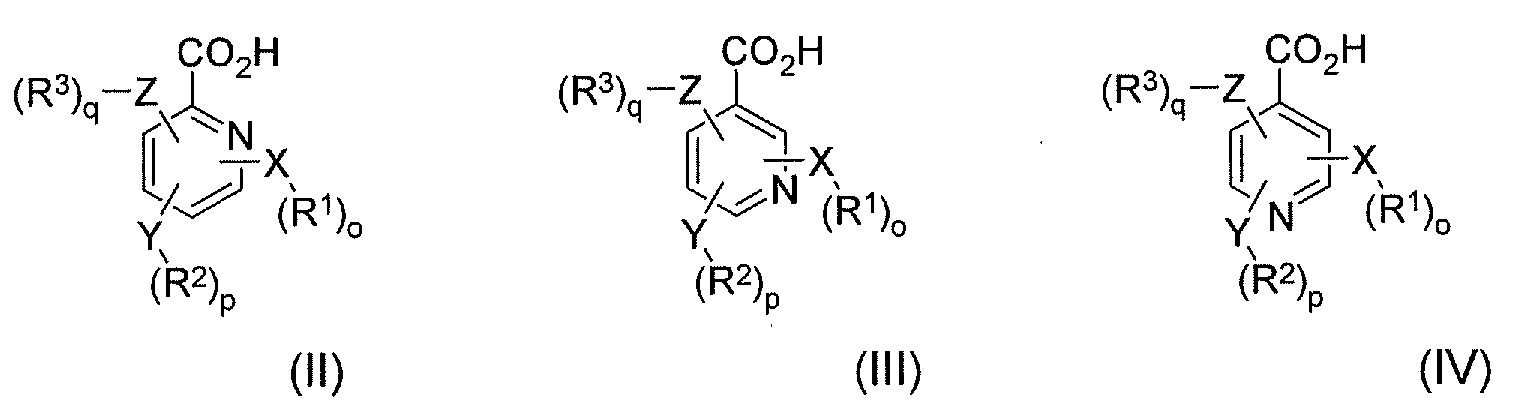
где
X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-;
R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил;
o, p, q независимо выбраны из 0 или 1; и
x обозначает целое число в диапазоне от 1 до 10.
125. Способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует связывания опиоида или которое опосредуется связыванием опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной никотиновой кислоты, ее производного или их комбинации.
126. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат показывает улучшенную скорость высвобождения с течением времени и величину AUC по сравнению с самим гидрокодоном за тот же самый период времени.
127. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат показывает меньшую изменчивость перорального фармакокинетического профиля по сравнению с самим гидрокодоном.
128. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат обладает меньшими побочными эффектами по сравнению с самим гидрокодоном.
129. Способ по пункту 123, 124 или 125, где указанную композицию готовят в виде лекарственной формы, выбранной из группы, которая включает: таблетку, капсулу, таблетку в форме капсулы, суппозиторий, пастилку, лепешку, назначаемый перорально порошок, раствор, тонкопленочную пероральную форму, пластинку, суспензию и взвесь.
130. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC, по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона.
131. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC и величину Cmax, по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона.
132. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC и меньшую величину Cmax, по сравнению с эквивалентным молярным количеством неконъюгированного гидрокодона.
133. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат назначают в количестве, достаточном для того, чтобы получить терапевтически биоэквивалентное значение AUC, по сравнению с самим гидрокодоном, но не эквивалентное значение Cmax.
134. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 0,5 мг или больше.
135. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 2,5 мг или больше.
136. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 5 мг или больше.
137. Композиция по пункту 123, 124 или 125, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 10 мг или больше.
138. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 20 мг или больше.
139. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 50 мг или больше.
140. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат присутствует в количестве от приблизительно 100 мг или больше.
141. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат обратимо связывается с рецепторами опиоида пациента.
142. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат обратимо связывается с рецепторами опиоида пациента, не оказывая при этом угнетающего воздействия на ЦНС.
143. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат препятствует возникновению побочного эффекта или снижает по меньшей мере один побочный эффект самого гидрокодона, вызывающий запор.
144. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат снижает или препятствует возникновению вызывающих запор эффектов.
145. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат долговременно связывается с рецепторами опиоида пациента.
146. Способ по пункту 123, 124 или 125, где по меньшей мере один конъюгат долговременно связывается с рецепторами опиоида пациента, не оказывая при этом угнетающего воздействия на ЦНС.
147. Способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует ингибирования связывания опиоида или которое опосредуется ингибированием связывания опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной гетероарилкарбоновой кислоты.
148. Способ по пункту 147, где по меньшей мере одна гетероарилкарбоновая кислота выбрана из формулы II, формулы III и формулы IV, где формула II, формула III или формула IV имеют следующие структуры:
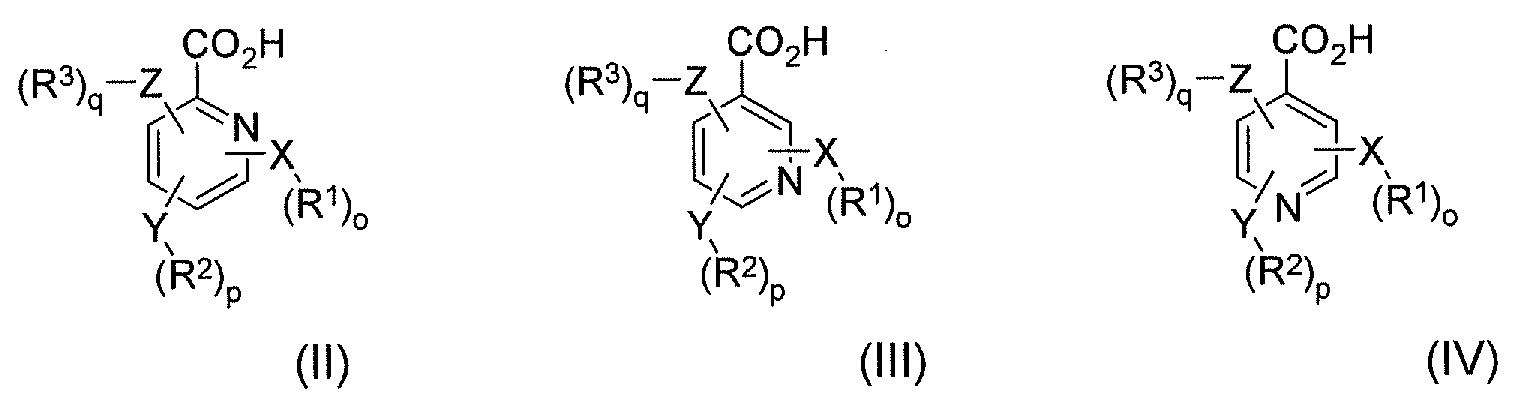
где
X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-;
R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил;
o, p, q независимо выбраны из 0 или 1; и
x обозначает целое число в диапазоне от 1 до 10.
149. Способ лечения пациента, имеющего заболевание, расстройство или состояние, которое требует ингибирования связывания опиоида или которое опосредуется ингибированием связывания опиоида с рецепторами опиоида пациента, включающий пероральное введение указанному пациенту фармацевтически эффективного количества по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной никотиновой кислоты, ее производного или их комбинации.
150. Способ по пункту 147, 148 или 149, где по меньшей мере один конъюгат обратимо ингибирует связывание опиоида с рецепторами опиоида пациента.
151. Способ по пункту 147, 148 или 149, где по меньшей мере один конъюгат обратимо ингибирует связывание опиоида с рецепторами опиоида пациента, не оказывая при этом угнетающего воздействия на ЦНС.
152. Способ по пункту 147, 148 или 149, где по меньшей мере один конъюгат препятствует или снижает по меньшей мере один вызывающий запор побочный эффект самого гидрокодона.
153. Фармацевтический набор реагентов, включающий:
определенное количество индивидуальных дозировок в упаковке, которые содержат фармацевтически эффективное количество по меньшей мере одного конъюгата гидрокодона и по меньшей мере одной гетероарилкарбоновой кислоты, ее производного или их комбинации, где по меньшей мере, одна гетероарилкарбоновая кислота выбрана из формулы II, формулы III и формулы IV, где формула II, формула III или формула IV имеют следующие структуры:

где
X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-;
R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил;
o, p, q независимо выбраны из 0 или 1; и
x обозначает целое число в диапазоне от 1 до 10.
154. Набор реагентов по пункту 153, где указанный набор дополнительно включает:
(ii) инструкции по использованию указанного набора реагентов в способе лечения или предотвращения симптомов отмены лекарственного средства или купирования боли у пациента-человека или пациента-животного.
155. Набор реагентов по пункту 154, где указанным пациентом является пациент-ребенок.
156. Набор реагентов по пункту 154, где указанным пациентом является пожилой пациент.
157. Набор реагентов по пункту 154, где указанным пациентом является обычный пациент.
158. Набор реагентов по пункту 153 или 154, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 0,5 мг или больше по меньшей мере одного конъюгата.
159. Набор реагентов по пункту 153 или 154, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 2,5 мг или больше по меньшей мере одного конъюгата.
160. Набор реагентов по пункту 153 или 154, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 5,0 мг или больше по меньшей мере одного конъюгата.
161. Набор реагентов по пункту 153 или 154, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 10 мг или больше по меньшей мере одного конъюгата.
162. Набор реагентов по пункту 153 или 154, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 20 мг или больше по меньшей мере одного конъюгата.
163. Набор реагентов по пункту 153 или 154, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 50 мг или больше по меньшей мере одного конъюгата.
164. Набор реагентов по пункту 153 или 154, где указанные индивидуальные дозировки содержат по меньшей мере приблизительно 100 мг или больше по меньшей мере одного конъюгата.
165. Набор реагентов по пункту 153 или 154, где указанный набор реагентов содержит от приблизительно 1 до приблизительно 60 индивидуальных дозировок.
166. Набор реагентов по пункту 153 или 154, где указанный набор реагентов содержит от приблизительно 10 до приблизительно 30 индивидуальных дозировок.
167. Пролекарство, включающее по меньшей мере один конъюгат гидрокодона и по меньшей мере одной бензойной кислоты или производного бензойной кислоты, ее соли или их комбинации, при этом бензойная кислота или производное бензойной кислоты имеет следующую формулу I:

где
X, Y и Z независимо выбраны из группы, которая включает H, O, S, NH и -(CH2)X-;
R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил;
o, p, q независимо выбраны из 0 или 1; и
x обозначает целое число в диапазоне от 1 до 10.
168. Пролекарство, включающее по меньшей мере один конъюгат гидрокодона и по меньшей мере одной бензойной кислоты, ее производного или их комбинации.
169. Пролекарство, включающее бензоатный конъюгат, где бензоатный конъюгат представляет собой по меньшей мере один гидрокодон, конъюгированный по меньшей мере с одной бензойной кислотой или с одним производным бензойной кислоты.
170. Пролекарство, включающее по меньшей мере один конъюгат гидрокодона и по меньшей мере одной гетероарилкарбоновой кислоты, ее производного или их комбинации.
171. Пролекарство по пункту 170, где гетероарилкарбоновая кислота выбрана из формулы II, формулы III и формулы IV, где формула II, формула III или формула IV имеют следующие структуры:
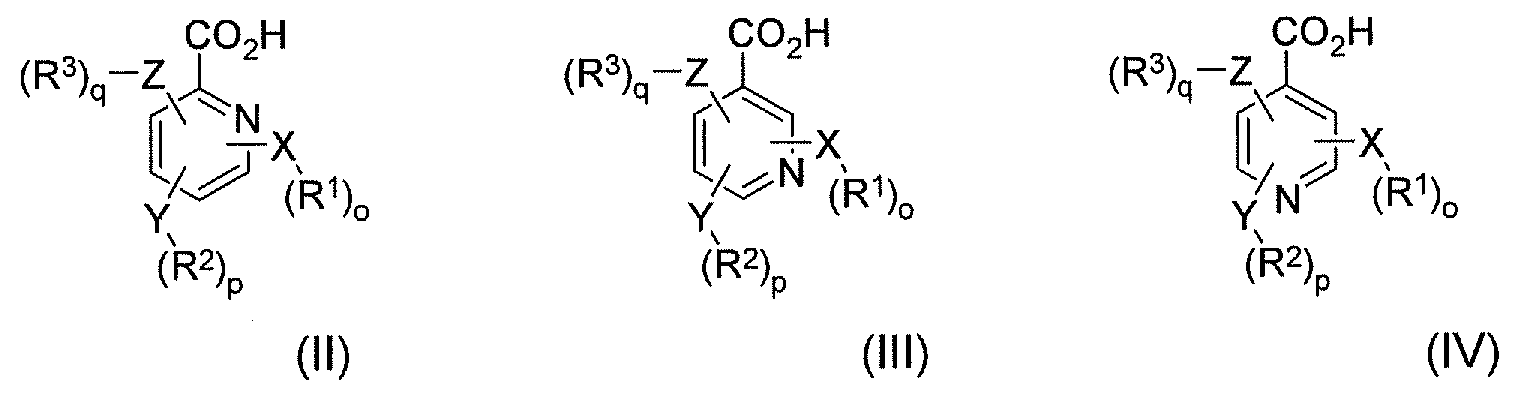
где
X, Y и Z независимо выбраны из группы, включающей H, O, S, NH и -(CH2)X-;
R1, R2 и R3 независимо выбраны из группы, которая включает Н, алкил, алкокси, арил, алкенил, алкинил, атом галогена, галогензамещенный алкил, алкиларил, арилалкил, гетероцикл, арилалкокси, циклоалкил, циклоалкенил и циклоалкинил;
o, p, q независимо выбраны из 0 или 1; и
x обозначает целое число в диапазоне от 1 до 10.
172. Пролекарство, включающее по меньшей мере один конъюгат гидрокодона и по меньшей мере одной никотиновой кислоты, ее производного или их комбинации.
173. Пролекарство по пункту 167, где производным бензойной кислоты является аминобензоат, гидроксибензоат, аминогидроксибензоат, их производное или их комбинация.
174. Композиция по пункту 1 или 2, где по меньшей мере один конъюгат показывает меньшую изменчивость интраназальных фармакокинетических профилей по сравнению с неконъюгированным гидрокодоном.
175. Композиция по пункту 1 или 2, где по меньшей мере один конъюгат, показывает меньшую изменчивость парентеральных фармакокинетических профилей по сравнению с неконъюгированным гидрокодоном.
176. Композиция по пункту 1 или 2, где по меньшей мере один конъюгат показывает меньшую изменчивость внутривенных фармакокинетических профилей по сравнению с неконъюгированным гидрокодоном.
Приведенное в данном описании изобретение рассмотрено в таких исчерпывающих, ясных, четких и точных терминах с тем, чтобы позволить любому специалисту в данной области техники осуществить настоящее изобретение. Следует понимать, что выше приведены предпочтенные варианты осуществления настоящего изобретения и что в них могут быть внесены изменения, которые не противоречат сущности изобретения и входят в объем настоящего изобретения, как указано в приведенной ниже формуле изобретения.
Реферат
Изобретение относится к фармацевтической композиция для лечения или предотвращения злоупотребления лекарственным средством, симптомов отмены лекарственного средства или для купирования боли, содержащей конъюгат и биологически приемлемый носитель, где конъюгат представляет собой бензоат-гидрокодон, имеющий структуру:Изобретение также относится к применению фармацевтической композиции для получения лекарственного средства для лечения пациента, имеющего заболевание, расстройство или состояние, опосредуемое связыванием опиоида с рецепторами опиоида пациента. 2 н. и 8 з.п. ф-лы, 11 пр., 4 табл., 20 ил.
Формула

показывает меньшую изменчивость перорального фармакокинетического профиля по сравнению с неконъюгированным гидрокодоном; или дает меньше побочных эффектов по сравнению с неконъюгированным гидрокодоном.

Комментарии