Композиции для лечения кандидозных инфекций - RU2732244C2
Код документа: RU2732244C2
Чертежи
Описание
Область изобретения
Настоящее изобретение относится к комбинированному применению высоких концентраций лактобацилл со специфическими концентрациями серосодержащего соединения для лечения, в частности терапии первой линии, кандидоза и рецидивирующего кандидоза. Комбинация в соответствии с изобретением может заменить лечение при помощи химического противогрибкового средства.
Например, изобретение подходит для лечения, в частности терапии первой линии, вагинального кандидоза и рецидивирующего вагинального кандидоза.
Область техники
У здоровых женщин урогенитальная флора содержит почти 50 различных видов микроорганизмов. Среди этих микроорганизмов 95% популяции состоит из различных штаммов лактобацилл, также названных как "палочки Дедерлейна". Эти лактобациллы помогают защите от патогенов при помощи различных механизмов, включая продуцирование перекиси водорода, молочной кислоты и бактериоцинов, подавление адгезии и распространения патогенов. В частности, эти лактобациллы поддерживают кислый рН вследствие продуцирования молочной кислоты из гликогена, присутствующего в слизистой оболочке влагалища. Поэтому подавляется рост многочисленных патогенов вагинальной микробиоты, таких как Gardnerella vaginalis, Prevotella bivia, Neisseria gonorrhoeae, Mycoplasma и Mobiluncus.
Таким образом, нормальная вагинальная микробиота в основном состоит из лактобацилл, образующих защитную биопленку на поверхности слизистой оболочки. Лактобациллы, наиболее часто обнаруживаемые во влагалище, в частности представляют собой Lactobacillus crispatus, Lactobacillus jensenii, Lactobacillus vaginalis, Lactobacillus iners и Lactobacillus gasseri.
Вульвовагинальный кандидоз (VVC) представляет собой грибковую инфекцию, связанную с чрезмерным ростом грибов в нормальной микробиоте. 85-95% случаев VVC связаны с Candida albicans. Вульвовагинальный кандидоз поражает 70-75% женщин по меньшей мере один раз в течение репродуктивного периода (1); приблизительно 40-50% испытывают второй эпизод. Частота рецидивирующего вульвовагинального кандидоза (определенная как по меньшей мере 4 эпизода в год, включая два эпизода, подтвержденные микологическим исследованием) оценивается на уровне 5-8%. Это доброкачественное состояние оказывает очень негативное влияние на качество жизни пациента и вызывает существенные медицинские расходы. Такую патологию трудно лечить по причине многофакторного патогенеза данного поражения.
Проявление VVC и его склонность к рецидиву представляют собой реальные проблемы для здравоохранения и приводят к существенным расходам на поддержание здоровья. Современные методы лечения VVC, основанные на применении противогрибковых средств, часто ассоциируются с побочными действиями, такими как развитие бактериального вагиноза, и вызывают множественные рецидивы (2).
Разработка новых методов терапии должна быть направлена на более широкое понимание патологии, учитывая ее специфическое окружение и причины ее возникновения. Таким образом, в течение последних нескольких лет специально исследовали характеристики вагинальной микробиоты. В этой микробиоте преобладает род Lactobacillus, представленный приблизительно у 70% женщин, где каждый отдельный вид в нем составляет 99% риботипов, обнаруженных у женщин (3). Пробиотические продукты были разработаны и протестированы в отношении предупреждения рецидивов VVC (4, 5, 6) путем восстановления баланса вагинальной микробиоты. Эти продукты не действуют непосредственно на патоген, ответственный за патологию, а предотвращают новый дисбиоз, который может быть вызван самим лечением противогрибковым средством или другими внешними элементами.
Описано пероральное или вагинальное введение «полезных» лактобацилл, способствующих оздоровлению влагалища. В частности, в заявках на патенты WO 84/04675, WO 2000/035465, US 2002/0044926 и WO 2006/045475 описано пероральное или вагинальное введение лактобактерий, способствующих здоровью влагалища и предупреждающих рецидивы вульвовагинального кандидоза.
Предпочтительные лактобациллы представляют собой Lactobacillus rhamnosus, Lactobacillus crispatus и Lactobacillus vaginalis. В патентах США US 6093394, US 6468526 и US 7807440 и в заявке на патент США US 2010/0151026 описано введение специфических штаммов Lactobacillus crispatus.
Эти лактобациллы могут быть введены в лиофилизированной форме или в растворе, и возможно в комбинации с другими активными агентами.
В заявках на патенты WO 2014/009349 и WO 2014/009330 описано применение тиосульфата для усиления антипатогенного действия лактобацилл. В этих заявках на изобретение тиосульфат добавляют в культуральной среде для лактобацилл до лиофилизации в оптимальной концентрации 113 г/л к приблизительно 108 КОЕ/мл лактобацилл (композиция А). Такое добавление дает возможность для усиления антипатогенного действия лактобацилл после предварительной стадии культивирования. Во всех тестах инокулум готовят в соответствии со следующим протоколом:
- Приготовление инокулума:
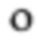
- Приведение в контакт с инокулумом: 5 мл патогенного штамма помещают в 5 мл штамма пробиотика;
- Измерения: патоген и пробиотик подсчитывают в моменты времени Т0, Т4 ч, Т24 ч и Т28 ч. Количество штаммов лактобацилл остается постоянным, а количество патогена уменьшается.
В этих заявках продемонстрировано, что добавление тиосульфата в культуральную среду до лиофилизации штамма лактобацилл в концентрации, находящейся в диапазоне от 1 г/л до 113 г/л делает возможным усиление антипатогенного действия этих лактобацилл, которые были приготовлены заранее путем предварительного культивирования за 48 часов до приведения в контакт с патогеном. Без этой стадии предварительного культивирования никакое ингибирование не может быть обнаружено в период времени совместного культивирования.
В этих заявках продемонстрировало, что добавление тиосульфата делает возможным предусмотреть применение усиленных лактобацилл для повторной колонизации вагинальной микробиоты и для предупреждения повторного роста патогенных агентов и возникновения рецидивов за счет этого. Они не дают возможности предусмотреть применения усиленных лактобацилл, приготовленных в фармацевтической композиции, в терапии первой линии VVC в силу необходимости предварительного культивирования штамма до применения, что представляет собой неадаптивность композиции для немедленного действия на патоген (и, таким образом, для проявления целебного действия в качестве противогрибкового средства) и, наоборот, адаптивность композиции для проявления барьерного действия в отношении повторной колонизации патогеном после лечения противогрибковым средством.
В этих заявках указанные концентрации лактобацилл как правило находятся в диапазоне от 107 до 1010 КОЕ/г композиции, где концентрация 108 КОЕ/мл до лиофилизации представляет собой предпочтительную концентрацию, используемую в примерах (композиция А).
Несмотря на это применение при предупреждении рецидивов VVC применение для терапии первой линии штаммов лактобацилл в качестве заменителя противогрибковых средств не допускается, в частности в связи с тем, что доля лактобацилл не изменяется во время развития патогена и при патологии.
Неожиданно заметили, что фармацевтическая композиция, содержащая специфическую концентрацию лактобацилл и серосодержащее соединение может быть использована в терапии первой линии кандидоза и рецидивирующего кандидоза. В изобретении описан, в частности, вульвовагинальный кандидоз и рецидивирующий вульвовагинальный кандидоз.
Кроме того, современные способы химической терапии (антибиотики и противогрибковые средства) не поддерживают баланс микробиоты и могут способствовать возникновению побочных действий, таких как развитие бактериального вагиноза и многочисленные рецидивы (2). Настоящее изобретение делает это возможным за счет композиции по изобретению, предупреждающей риски рецидивов. Таким образом, разработанное изобретение обеспечивает возможность для применения пробиотического штамма для специфического подавления патогенов, ответственных за эти патологии, при поддержании лактобациллярной микробиоты, характерной для здоровых женщин (2). Применение природного биологического продукта, отличающегося от химических продуктов, не вызывает дисбиоз, вызванный современными методами терапии, и, таким образом, способствует предупреждению рецидивов.
Краткое изложение сущности изобретения
Изобретение относится к применению специфической концентрации лактобацилл (концентрация ≥2⋅1010 КОЕ на дозу), находящейся за пределами обычного использования этих продуктов, в комбинации с серосодержащим соединением. Настоящее изобретение позволяет предложить терапию первой линии кандидоза при помощи схемы введения лекарственного средства, эквивалентной схемам введения используемых в настоящее время противогрибковых средств.
Подробное описание изобретения
Настоящее изобретение относится к фармацевтической композиции, содержащей
1) в качестве терапевтически активного агента по меньшей мере 2⋅1010 КОЕ лактобацилл и
2) серосодержащее соединение, в виде комбинированных продуктов для применения в качестве терапии первой линии кандидоза и рецидивирующего кандидоза. В частности, в изобретении описан вульвовагинальный кандидоз и рецидивирующий вульвовагинальный кандидоз.
Термин "кандидоз" относится к грибковой инфекции, вызываемой дрожжами рода Candida. Candida albicans, представляющий собой наиболее распространенный вид, является частью обычной флоры ротоглотки и пищеварительного тракта, и также может быть представлен в небольших количествах в нормальной вагинальной микробиоте. Вульвовагинальный кандидоз является весьма распространенным и может быть предрасположен к нескольким рецидивам.
Под "терапией первой линии кандидоза и рецидивирующего кандидоза" понимают терапевтическое лечение, которое является преимущественно целебным, обладая фунгицидными свойствами для лечения этих кандидозов, и, за счет этого, если говорить конкретнее, для уничтожения патогенов при возникновении инфекции. В случае настоящего изобретения лечение также обладает фунгистатическими свойствами, характеризующимися подавлением роста указанных патогенов.
В соответствии с изобретением, патогены представляют собой члены рода Candida, и предпочтительно видов Candida albicans, Candida glabrata, Candida tropicalis, более предпочтительно видов Candida albicans. Candida albicans представляет собой наиболее обычный и наиболее хорошо известный из видов дрожжей рода Candida. Он вызывает грибковые инфекции (кандидоз), например слизистых мембран женского полового тракта.
Примеры кандидоза включают:
- Кожно-слизистый кандидоз, в частности
- Кандидоз пищевода
- Системный кандидоз
Термин "лактобациллы" относится ко всем бактериям рода Lactobacillus, которые представляют собой неподвижные, факультативно аэро-анаэробные, грамположительные бактерии различных форм и размеров. Большинство лактобацилл превращают лактозу и другие простые сахара в молочную кислоту. В примере лечения VVC лактобациллы заселяют влагалище и составляют важный компонент вагинальной микробиоты. Таким образом, настоящее изобретение может относиться к лактобациллам, составляющим вагинальную микробиоту, в частности Lactobacillus casei и Lactobacillus rhamnosus.
Термин "КОЕ" относится к единице измерения, как правило рассматриваемой специалистом в данной области техники для количественного подсчета бактерий, способных образовывать колонию, и точнее означает "колониеобразующую единицу". Она выражена относительно общей массы фармацевтической композиции.
Термин "фармацевтическая композиция" относится к терапевтическому средству, вводимому пациенту. Как правило, "фармацевтическая композиция" соответствует дозе медицинского продукта. Тем не менее, отдельные единицы, отобранные одновременно, и которые совокупно могут содержать продукты по изобретению в заявленных концентрациях, не выходят за пределы объема изобретения. В контексте описания настоящего изобретения концентрации приведены для композиции, соответствующей однократной дозе, и в других случаях могут быть адаптированы.
Термин "комбинированные продукты" означает, что лактобациллы и серосодержащее соединение, в частности тиосульфат, приготовлены в одной и той же композиции или в двух отдельных композициях, вводимых пациенту одновременно, т.е. в одно и то же время в течение суток.
Любой интервал величин, обозначенный выражением "между а и b" представляет диапазон величин от более чем а до не менее чем b (т.е. пределы а и b исключены), тогда как любой интервал величин, указанный выражением "от а до b" представляет диапазон величин от а до b (т.е. включая строгие пределы а и b).
Если не указано иное, то все процентные величины представляют собой процентные величины по массе.
Неожиданно обнаружили, что когда эти лактобациллы используют в фармацевтической композиции в концентрации больше чем или равной 2⋅1010 КОЕ в присутствии серосодержащего соединения, тогда эта композиция обладает способностью быстро и специфически подавлять дрожжи рода Candida. Таким образом, в противоположность любому ожиданию, в этой концентрации лактобациллы, усиленные серосодержащим соединением, могут быть использованы в качестве терапевтического активного агента, обладающего противогрибковым действием. Если конкретизировать, то композиции в соответствии с изобретением можно предложить для лечения кандидоза, такого как вульвовагинальный кандидоз и рецидивирующий вульвовагинальный кандидоз, вместо химического противогрибкового средства. Лечение даже может состоять из введения композиции в соответствии с изобретением самой по себе без введения, включая предварительное введение, химического противогрибкового средства, такого как флуконазол или кетоконазол. Химические противогрибковые средства вызывают, например, дисбаланс микробиоты. Таким образом, композиции по изобретению могут заменить противогрибковые средства, обычно вводимые при лечении этих состояний. Таким образом, изобретение также относится к композиции по изобретению для применения в качестве заменителя химического противогрибкового средства при лечении кандидоза, такого как вульвовагинальный кандидоз и рецидивирующий вульвовагинальный кандидоз.
Композиция по изобретению может быть использована для подавления в течение меньше чем 24 часов и без предварительного культивирования патогенов рода Candida, в частности Candida albicans или Candida glabrata.
В соответствии с изобретением терапевтический активный агент, обладающий действием противогрибкового средства, представляет собой комбинацию лактобацилл и серосодержащего соединения. Эта комбинация может принимать форму одной композиции (одновременное применение) или двух композиций, вводимых одновременно (комбинированное применение).
Серосодержащее соединение может быть выбрано из обширного перечня соединений, которые подходят для введения людям или животным.
Примеры серосодержащих соединений включают:
- Сульфаты, тиосульфаты и политионаты (такие как тетратионаты), которые в частности являются щелочными (натрий, калий);
- Серосодержащие аминокислоты, в частности цистеин, метионин, гомоцистеин; их окисленные производные (например, цистеин-8-сульфонат, метионин сульфоксид); серосодержащие аминокислоты, связанные вместе при помощи дисульфидной мостиковой связи (например, цистин); серосодержащие аминокислоты, связанные через дисульфидную мостиковую связь с тиосульфатом, с сульфатом, с тиолом; производные этих соединений, где функциональная группа -NH- аминокислоты заменена на функциональную группу -О- или -N(CH3)-;
- Конденсированные аминокислоты (предпочтительно до 5 аминокислот, более предпочтительно до 3 аминокислот), содержащие по меньшей мере одну серосодержащую аминокислоту, определенную выше (например, глутатион);
- Витамины, содержащие серу в своей химической структуре, такие как витамин В1 или витамин В8;
- и их смеси.
Когда серосодержащее соединение представляет собой тиосульфат, тогда композиция содержит от 15 до 300 мг тиосульфата. Количество серосодержащего соединения, отличающегося от тиосульфата, будет определяться специалистом в данной области техники на этой основе для обеспечения эквивалентного количества серы.
В соответствии с одним аспектом изобретения серосодержащее соединение представляет собой тиосульфат, который может быть выбран из тиосульфата натрия или тиосульфата калия. Предпочтительно, используют тиосульфат натрия. Тиосульфат натрия состоит из ионов натрия и ионов тиосульфата.
Композиция предпочтительно содержит от 15 до 300 мг тиосульфата, более предпочтительно от 30 до 300 мг, еще более предпочтительно от 45 до 120 мг, еще более предпочтительно от 45 до 80 мг, и идеально 60 мг.
Количество тиосульфата ниже 15 мг не является достаточным для того, чтобы усиливать лактобациллы. В количестве выше 300 мг тиосульфат начинает оказывать пагубное подавляющее действие в отношении эндогенных или экзогенных лактобацилл.
Фармацевтическая композиция содержит больше чем 2⋅1010 КОЕ лактобацилл, в частности по меньшей мере 3⋅1010 КОЕ, даже по меньшей мере 4⋅1010 КОЕ лактобацилл, предпочтительно по меньшей мере 5⋅1010 КОЕ лактобацилл, более предпочтительно больше чем 1⋅1011 КОЕ лактобацилл. Количество лактобацилл предпочтительно варьирует от 2⋅1010 до 1⋅1012 КОЕ, более предпочтительно от 5⋅1010 до 1⋅1012 КОЕ, более предпочтительно от 1⋅1011 до 1⋅1012 КОЕ.
В количестве меньше 2⋅1010 КОЕ лактобацилл не обнаружено никакого подавляющего действия в отношении патогенов без предварительного культивирования штамма, что делает невозможным предполагать действие при лечении, в частности в терапии первой линии.
В частности, для количеств лактобацилл приблизительно 5⋅1010 КОЕ или больше подавляющее действие обнаруживается в течение 24 часов. В соответствии с конкретным воплощением изобретения фармацевтическая композиция содержит от 3⋅1010 КОЕ до 7⋅1010 КОЕ лактобацилл, более предпочтительно приблизительно 5⋅1010 КОЕ.
Эти количества соответствуют общему случаю композиции, соответствующей разовой дозе, и могут быть адаптированы для других случаев.
Композицию предпочтительно готовят из лиофилизата, содержащего лактобациллы, и серосодержащего соединения, предпочтительно тиосульфата.
В первом варианте серосодержащее соединение, предпочтительно тиосульфат, включают во время лиофилизирования лактобацилл.
Предпочтительно, композиция содержит от 250 до 2500 мг лиофилизата, более предпочтительно от 500 до 1500 мг лиофилизата; где лиофилизат содержит лактобациллы и серосодержащее соединение, предпочтительно тиосульфат.
Специалист в данной области техники, представляющий собой специалиста в области лиофилизации, будет способен адаптировать количество серосодержащего соединения, добавляемого до лиофилизации, для получения желаемого количества в окончательном порошке, получаемом после лиофилизации.
Во втором варианте лактобациллы лиофилизируют в отсутствии серосодержащего соединения, предпочтительно тиосульфата, который включают в фармацевтическую композицию или вводят одновременно с композицией, содержащей лиофилизат лактобацилл.
Предпочтительно, фармацевтическая композиция содержит
- от 250 до 2500 мг лиофилизата, более предпочтительно от 500 до 1500 мг лиофилизата; где лиофилизат содержит лактобациллы;
- от 15 до 300 мг тиосульфата, более предпочтительно от 30 до 300 мг, еще более предпочтительно от 45 до 120 мг, еще более предпочтительно от 45 до 80 мг и идеально 60 мг тиосульфата.
В третьем варианте комбинируют первый и второй варианты: часть серосодержащего соединения включают во время лиофилизации, другую часть включают во время приготовления фармацевтической композиции. Специалист в данной области техники способен адаптировать количества на основе количеств, описанных выше в первом и втором вариантах.
В соответствии с предпочтительным аспектом изобретения лактобациллы представляют собой Lactobacillus rhamnosus, и/или Lactobacillus crispatus, и/или Lactobacillus casei, и/или Lactobacillus vaginalis. Предпочтительно, лактобациллы представляют собой Lactobacillus rhamnosus, и/или Lactobacillus crispatus, и/или Lactobacillus casei. Предпочтительный штамм представляет собой L. rhamnosus Lcr35® (7).
Предпочтительно, лактобациллы находятся в лиофилизированной форме. Штамм может представлять собой единственный лиофилизированный элемент композиции, но предпочтительно штамм лиофилизирован в среде, содержащей дополнительные компоненты, которые добавляют до или после стадии лиофилизации. В одном из вариантов серосодержащее соединение может быть добавлено до лиофилизации. В еще одном варианте серосодержащее соединение добавляют после лиофилизации во время приготовления фармацевтической композиции.
В соответствии с еще одним конкретным аспектом изобретения фармацевтическая композиция дополнительно содержит консервирующую матрицу и/или эксципиенты, хорошо известные специалистам в данной области техники, и возможно другие активные ингредиенты, обладающие комплементарным действием.
В частности, эта композиция может содержать следующие активные ингредиенты: гормоны (эстриол, прогестерон и т.п.), противовоспалительные агенты. Специалист в данной области техники способен определить то, какие активные ингредиенты могут предпочтительно сочетаться с лактобациллами. Эта композиция также содержит в соответствии с конкретным аспектом изобретения несколько штаммов лактобацилл.
Эти фармацевтические композиции предпочтительно готовят для вагинального, перорального или местного введения, более предпочтительно вагинального введения для вульвовагинального кандидоза. В частности, используемая лекарственная форма представляет собой капсулы, таблетки, кремы, жидкие или масляные суспензии или любое другое подходящее медицинское устройство. Предпочтительно, используемая лекарственная форма представляет собой капсулы или таблетки. Специалист в данной области техники способен адаптировать подходящую форму для ожидаемого терапевтического действия.
Фармацевтическая композиция по изобретению предпочтительно представляет собой фармацевтическую композицию с немедленным высвобождением, в частности таблетку или капсулу с немедленным высвобождением, или фармацевтическую композицию, модифицированную в соответствии с желаемым действием.
Оптимальные способы введения, схемы введения и лекарственные формы соединений и композиций по изобретению могут быть определены в соответствии с критериями, обычно принимаемыми во внимание при назначении фармацевтического лечения, подходящего для пациента, такими как, например возраст или масса пациента, тяжесть общего состояния пациента, переносимость лечения и обнаруженные побочные действия. Этот пациент может представлять собой человека или животное, предпочтительно человека.
Изобретение также относится к фармацевтической композиции, содержащей по меньшей мере 2⋅1010 КОЕ лактобацилл, предпочтительно по меньшей мере приблизительно 5⋅1010 КОЕ лактобацилл, и серосодержащее соединение, предпочтительно тиосульфат, в частности от 15 до 300 мг тиосульфата.
Количество серосодержащего соединения, отличающегося от тиосульфата, адаптировано на этом основании в эквивалентах серы.
Лактобациллы и тиосульфат или другое серосодержащее соединение предпочтительно являются такими, как описано выше.
Фармацевтическая композиция предпочтительно содержит от 30 до 300 мг, более предпочтительно от 45 до 120 мг, более предпочтительно от 45 до 80 мг и идеально 60 мг тиосульфата.
Фармацевтическая композиция предпочтительно содержит больше чем 5⋅1010 КОЕ лактобацилл, более предпочтительно больше чем 1⋅1011 КОЕ лактобацилл. В композиции содержание лактобацилл предпочтительно варьирует от 2⋅1010 до 1⋅1012 КОЕ, более предпочтительно от 5⋅1010 до 1⋅1012 КОЕ, более предпочтительно от 1⋅1011 до 1⋅1012 КОЕ.
В соответствии с конкретным воплощением изобретения композиция содержит приблизительно 5⋅1010 КОЕ лактобацилл.
Фармацевтическая композиция предпочтительно содержит:
- от 250 до 2500 мг лиофилизата, более предпочтительно от 500 до 1500 мг лиофилизата, указанный лиофилизат содержит лактобациллы, и композиция содержит больше чем 2⋅1010 КОЕ лактобацилл, предпочтительно по меньшей мере приблизительно 5⋅1010 КОЕ лактобацилл;
- от 15 до 300 мг тиосульфата, более предпочтительно от 30 до 300 мг, еще более предпочтительно от 45 до 120 мг, еще более предпочтительно от 45 до 80 мг и идеально 60 мг тиосульфата
Фармацевтическая композиция предпочтительно представляет собой фармацевтическую композицию с немедленным высвобождением, в частности таблетку или капсулу с немедленным высвобождением. В соответствии с еще одним воплощением изобретения фармацевтическая композиция предпочтительно представляет собой фармацевтическую композицию с контролируемым высвобождением, в частности таблетку или капсулу с контролируемым высвобождением.
Под "контролируемым высвобождением", в частности, понимают, что высвобождение штамма Lactobacillus является быстрым и также постепенным в течение по меньшей мере 24 часов. Термины "контролируемое высвобождение" и "длительное высвобождение" иногда используют взаимозаменяемо.
В конкретном воплощении таблетку с немедленным высвобождением в соответствии с изобретением комбинируют с композицией с длительным высвобождением, также содержащей лактобациллы в соответствии с изобретением.
Таким образом, изобретение также относится к многослойной таблетке, содержащей:
- по меньшей мере один слой с немедленным высвобождением, содержащий относительно общей массы всех слоев с немедленным высвобождением, больше чем 2⋅1010 КОЕ лактобацилл, предпочтительно по меньшей мере приблизительно 5⋅1010 КОЕ лактобацилл, и от 15 до 300 мг тиосульфата (или эквивалентное количество серосодержащего соединения);
- по меньшей мере один слой с длительным высвобождением, содержащий относительно общей массы всех слоев с длительным высвобождением, 1⋅105, предпочтительно от 1⋅107 до 1⋅1010 КОЕ лактобацилл.
Слой(и) с длительным высвобождением также может(гут) содержать тиосульфат, предпочтительно в комбинированном количестве 60 мг на композицию.
Слой(и) с длительным высвобождением предпочтительно содержит(ат) подходящий эксципиент, обеспечивающий указанные свойства таблеток, а именно адгезию к слизистой оболочке стенки влагалища и длительное высвобождение.
Примеры эксципиентов, которые могут быть подходящими, описаны в Advanced Drug Delivery System Reviews, 57 (2005), 1692-1712. Эксципиент может быть выбран из хитозана и его производных, пектинов, полиэтиленгликолей, альгината натрия, полиакриловых кислот, производных целлюлозы, таких как натриевая карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза или микрокристаллическая целлюлоза, смол, полимеров Carbopol® и их комбинаций. Предпочтительно, таблетка в соответствии с настоящим изобретением содержит производное целлюлозы, в частности гидроксипропилметилцеллюлозу (НРМС).
В контексте настоящего изобретения предпочтительно применение гидроксипропилметилцеллюлозы высокой вязкости. Таким образом, предпочтительно используют гидроксипропилметилцеллюлозу, обладающую динамической вязкостью больше чем 10000 мПа⋅с, предпочтительно от 11000 мПа⋅с до 21000 мПа⋅с, более предпочтительно приблизительно 15000 мПа⋅с.
Вязкость этого хорошо известного эксципиента измеряют в соответствии с Европейским или Американским стандартом для 2% (масс./об.) водного раствора гидроксипропилметилцеллюлозы при 20°С.
Слой с длительным высвобождением обычно содержит от 10 до 40% по массе относительно общей массы указанного слоя эксципиента, придающего таблеткам свойства адгезии к слизистой оболочке стенки влагалища и длительного высвобождения. Предпочтительно, этот слой содержит от 10 до 30% по массе относительно общей массы указанного слоя указанного эксципиента, более предпочтительно от 10 до 25% по массе, еще более предпочтительно от 10 до 20% по массе, несомненно он содержит 10% по массе указанного эксципиента. Указанный эксципиент предпочтительно представляет собой НРМС (гидроксипропилметилцеллюлозу).
Слой(и) с немедленным высвобождением предпочтительно содержит(ат) соединения, описанные выше для фармацевтической композиции в количествах, указанных выше.
Изобретение также относится к способу лечения кандидоза, предпочтительно вульвовагинального кандидоза и рецидивирующего вульвовагинального кандидоза, включающему введение, предпочтительно введение первой линии, пациенту, нуждающемуся в таком введении, фармацевтической композиции, описанной выше.
Лечение кандидоза, предпочтительно вульвовагинального кандидоза и рецидивирующего вульвовагинального кандидоза, осуществляют предпочтительно путем введения одной дозы в сутки. Доза может быть повторена, например через 2, 3, 4 или 5 суток после введения первой дозы.
Лечение кандидоза, предпочтительно вульвовагинального кандидоза, и его рецидива может заключаться в:
- введении первой линии композиции в соответствии с изобретением в виде разовой дозы, возможно с повтором, например через 2, 3, 4 или 5 суток после введения первой дозы;
- введении для предотвращения рецидива композиции, содержащей лактобациллы, усиленные тиосульфатом, в концентрации от 107 до 1010 КОЕ/г.
Описание графических материалов
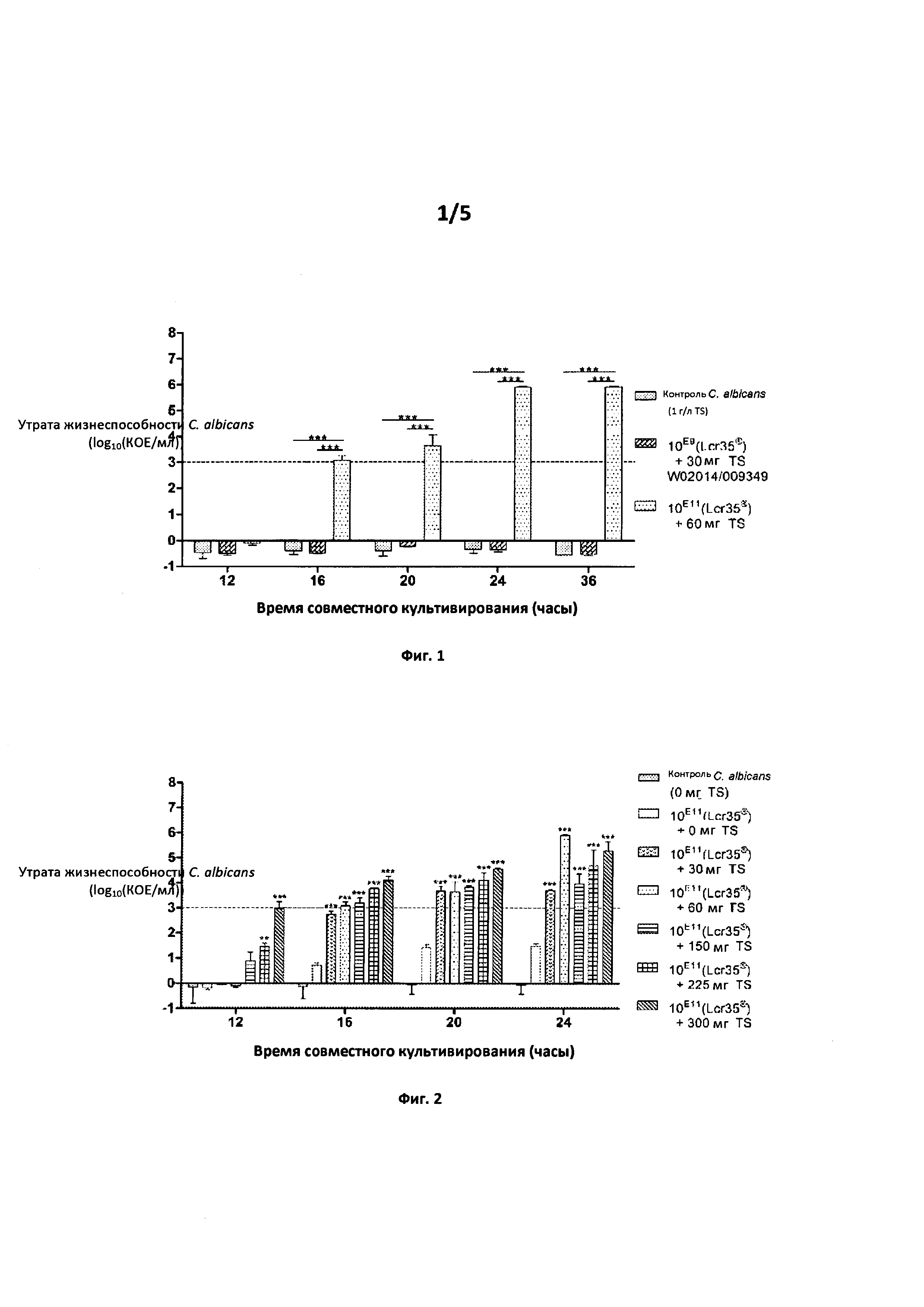
Фиг. 1. Влияние стандартной концентрации (WO 2014/009349 по сравнению с изобретением)
Утрата жизнеспособности С. albicans (log10(KOE/мл)) в зависимости от времени совместного культивирования (часы)



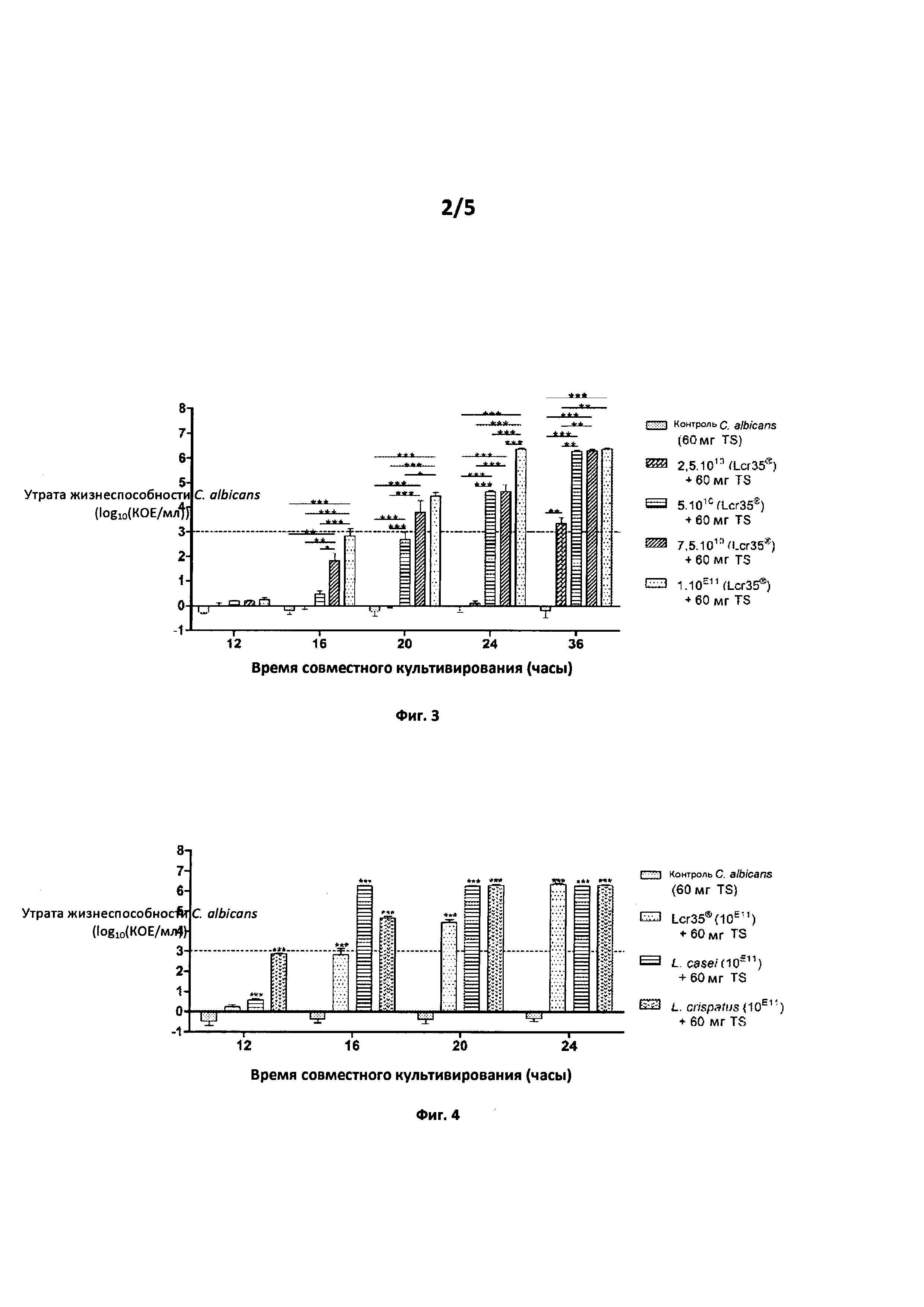
Фиг.2. Действие комбинации L. rhamnosus Lcr35® при 1011 КОЕ+тиосульфат в различных концентрациях
Утрата жизнеспособности С. albicans (log10(KOE/мл)) в зависимости от времени совместного культивирования (часы)





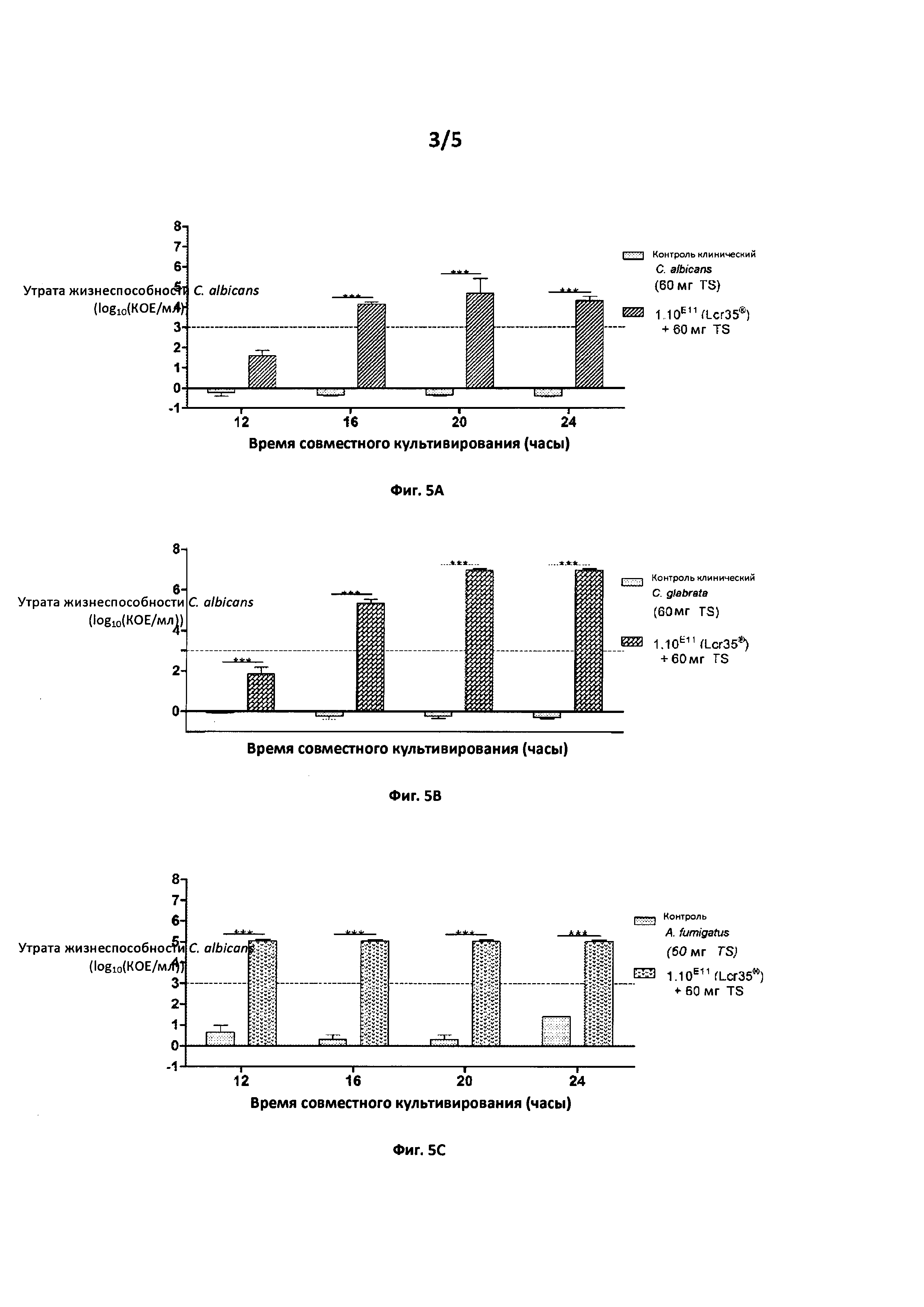
Фиг. 3. Действие комбинации L. rhamnosus Lcr35® в различных концентрациях+60 мг тиосульфата
Утрата жизнеспособности С. albicans (log10(KOE/мл)) в зависимости от времени совместного культивирования (часы)




Фиг. 4. Действие комбинации Lactobacillus spp.при 1011 КОЕ+60 мг тиосульфата на Candida albicans.
Утрата жизнеспособности С. albicans (log10(KOE/мл)) в зависимости от времени совместного культивирования (часы)




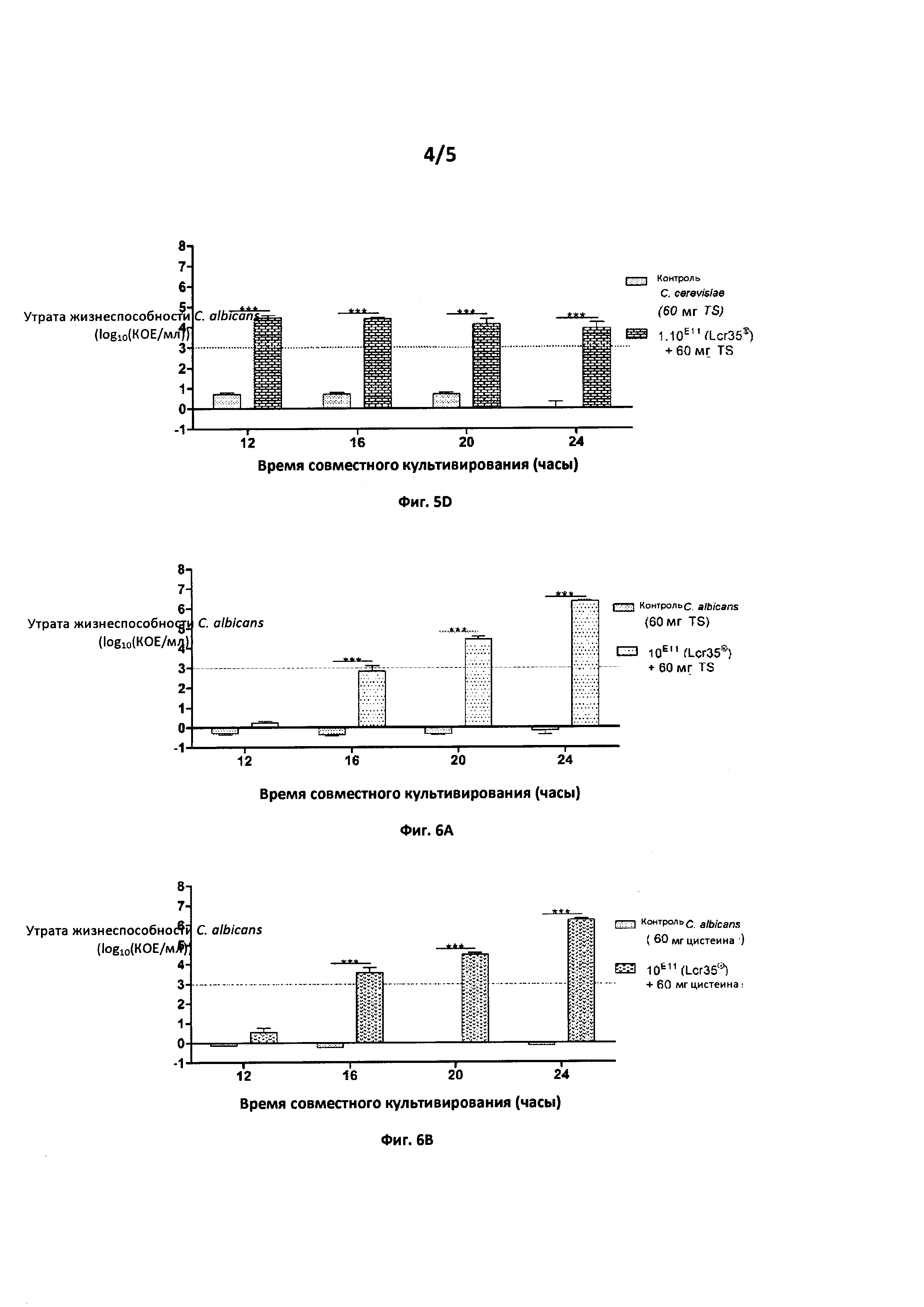
Фиг.5. Действие комбинации L. rhamnosus Lcr35® при 1011 КОЕ+60 мг тиосульфата на Candida spp.
5А: Утрата жизнеспособности клинического штамма Candida albicans (log10(KOE/мл)) в зависимости от времени совместного культивирования (часы)

5 В: Утрата жизнеспособности клинического штамма Candida glabrata (log10(KOE/мл)) в зависимости от времени совместного культивирования (часы)


5С: Утрата жизнеспособности Aspergillus fumigatus (log10(КОЕ/мл)) в зависимости от времени совместного культивирования (часы)

5D: Утрата жизнеспособности Saccharomyces cerevisiae (log10(KOE/мл)) в зависимости от времени совместного культивирования (часы)

Фиг. 6. Действие комбинации L. rhamnosus Lcr35® при 1011 КОЕ+серосодержащие molecules on Candida albicans.
Утрата жизнеспособности С. albicans (log10(КОЕ/мл)) в зависимости от времени совместного культивирования (часы)
6А: Действие комбинации Lcr35® при 1011 КОЕ+60 мг тиосульфата

6 В: Действие комбинации Lcr35® при 1011 КОЕ+60 мг цистеина


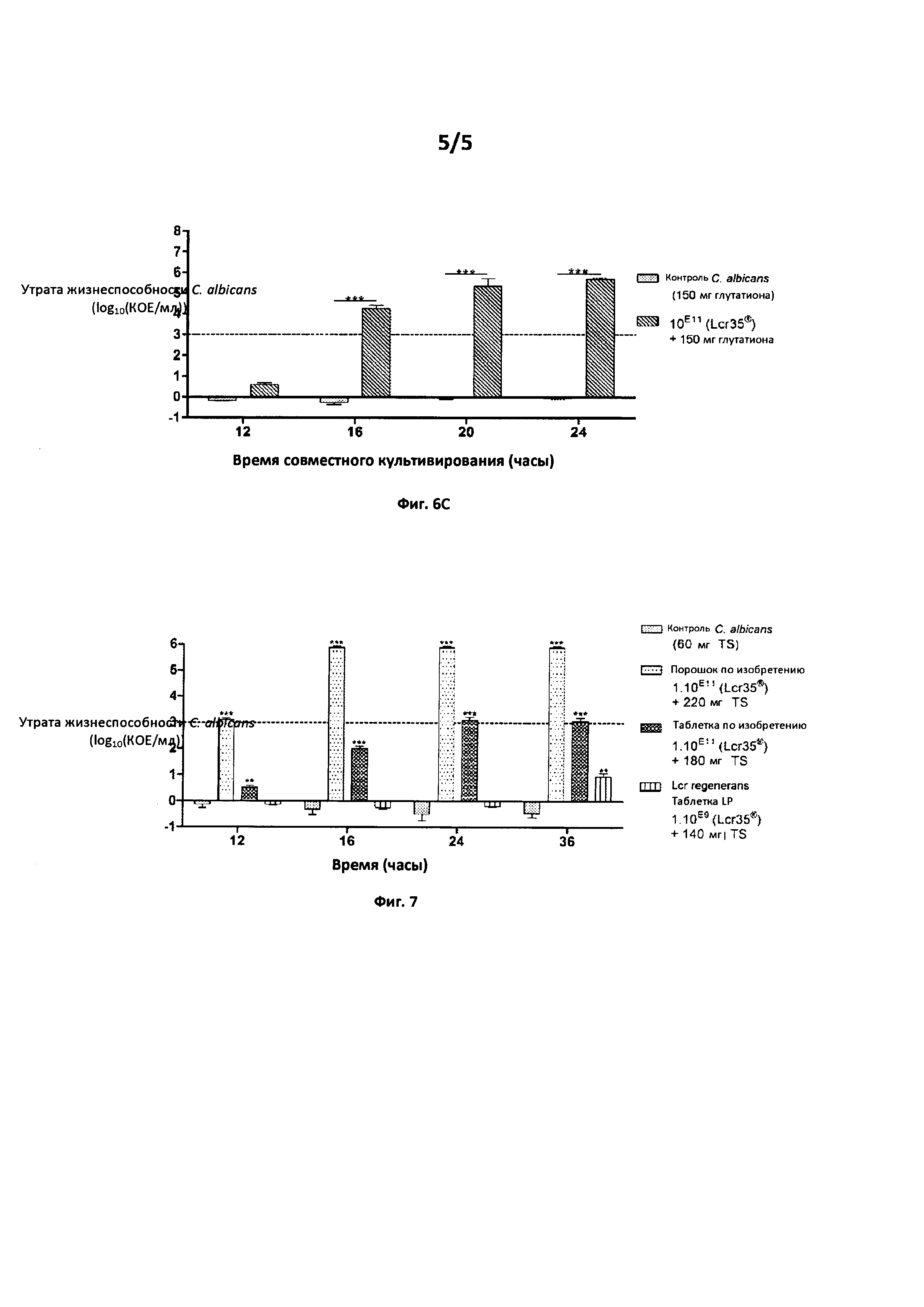
6С: Действие комбинации Lcr35® при 1011 КОЕ+150 мг глутатиона

Фиг. 7. Активность изобретения в форме таблетки
Утрата жизнеспособности С. albicans (log10(KOE/мл)) в зависимости от времени совместного культивирования (часы) для таблеточной формы



Примеры
Действие комбинации L. rhamnosus Lcr35® + тиосульфат на патогены различных видов Candida.
Материалы и методы:
После предварительного культивирования в бульоне Сабуро патоген помещают в количестве приблизительно 1⋅108 КОЕ/мл в 30 мл SVF (среда для стимулирования вагинального окружения - рН 4,2) и приводят в непосредственный контакт с лактобациллами в лиофилизированной форме после стадии ферментации и лиофилизации и серосодержащей молекулой (тиосульфат или цистеин) (без предварительного культивирования, таким образом, чтобы приблизиться к условиям применения in vivo). Патоген подсчитывают на агаре в моменты Т0, Т12 ч, T16 ч, Т20 ч, Т24 ч и дополнительно Т36 чв случае Фиг. 1, 3 и 7. Эти результаты выражены в виде логарифмического уменьшения между исходным подсчетом (Т0) и моментами отбора образцов. Активность противогрибкового средства определена таким образом, чтобы быть специфической для уменьшения на 3 log (в 1000 раз). Контроль жизнеспособности патогена готовят параллельно в тех же самых условиях без присутствия соединений по изобретению.
Выражение "композиция А по изобретению WO 2014/009349" относится к композиции штамма L. rhamnosus Lcr35®, приготовленного при помощи способа, описанного в примере 4 заявки на изобретение WO 2014/009349, т.е. в присутствии 113 г/л тиосульфата натрия во время лиофилизации. В следующих примерах композиция А содержит 1⋅109 КОЕ L. rhamnosus Lcr35® (по сравнению с 1⋅108 КОЕ для примеров в WO 2014/009349).
Тестировали четыре концентрации лактобацилл: 2,5⋅1010 КОЕ, 5⋅1010 КОЕ, 7,5⋅1010КОЕ и >1⋅1011 КОЕ, или на мл: 8⋅108 КОЕ/мл, 1,6⋅109 КОЕ/мл, 2,5⋅109 КОЕ/мл и 3,3⋅109 КОЕ/мл, а также концентрация, обнаруженная в композиции А согласно WO 2014/009349, составляющая 109 КОЕ или 3,3⋅107 КОЕ/мл.
Тестировали различные концентрации тиосульфата натрия в тестируемой культуральной среде: 0, 1, 2,5, 7,5 и 10 г/л.
Тестировали несколько патогенов, полученных из клинических образцов: Candida albicans, Candida glabrata, Candida tropicalis, Aspergillus fumigatus, а также референсный штамм дрожжей Saccharomyces cerevisiae.
Тестировали несколько видов лактобацилл: L. crispatus, L. casei.
Результаты представлены на Фиг.1-6.
Приготовление таблеток
Таблетка по настоящему изобретению представляет собой однослойную таблетку, приготовленную так, чтобы достичь контролируемое высвобождение штамма Lactobacillus rhamnosus Lcr35® в концентрации больше чем или равной 1⋅1011 КОЕ/г и количестве тиосульфата 180 мг. Масса таблетки составляет приблизительно 950 мг.
Таблетки готовят с использованием промышленного таблетировочного пресса с сжимающей силой, имеющей порядок 20 кН.
Выводы:
Фиг. 1: Изобретение дает возможность для подавления больше чем на 3 log через 20 часов совместного культивирования, тогда как продукт в соответствии с предшествующим изобретением (композиция А, описанная в WO 2014/009349) не приводит к противогрибковому действию средства в отношении патогена Candida albicans АТСС10231.
Фиг. 2. При количестве 1 г/л тиосульфата (диапазон тестирован от 1 до 10 г/л) изобретение дает возможность для подавления больше чем на 3 log после 20 часов совместного культивирования. В оптимальной концентрации 2 г/л этот уровень действия противогрибкового средства достигается через 16 часов совместного культивирования средства по изобретению и патогена Candida albicans АТСС10231.
Фиг. 3: Активность противогрибкового средства на уровне 3 log достигается в течение 24 часов, начиная с концентрации Lcr35® 5⋅1010 КОЕ (или 1,6⋅109 КОЕ/мл). Для концентрации 2,5⋅1010 КОЕ (или 8⋅108 КОЕ/мл) активность этого противогрибкового средства достигается через 36 часов совместного культивирования средства по изобретению и патогена Candida albicans АТСС10231.
Фиг. 4: Активность противогрибкового средства по изобретению продемонстрирована в течение 20 часов для различных видов лактобацилл для патогена Candida albicans АТСС10231 в совместной культуре.
Фиг. 5: Активность противогрибкового средства по изобретению продемонстрирована в течение 16 часов для различных видов: два патогенных клинических штамма: Candida albicans и Candida glabrata; один патогенный штамм: Aspergillus fumigatus; и один дрожжевой штамм: Saccharomyces cerevisiae.
Фиг. 6: Активность противогрибкового средства по изобретению продемонстрирована в течение 16 часов для различных источников серосодержащих молекул (тиосульфат, цистеин, глутатион) по сравнению с патогеном Candida albicans АТСС10231 в совместной культуре.
Фиг. 7: Активность противогрибкового средства сохраняется после приготовления в виде таблеток с контролируемым высвобождением.
Библиографические ссылки
Публикации
1. Sobel JD. Recurrent vulvovaginal candidiasis. A prospective study of the efficacy of maintenance ketoconazole therapy. N Engl J Med 1986; 315: 1455-58.
2. Fischer G. Chronic vulvovaginal candidiasis: what we know and what we have yet to learn. Australas J Dermatol, 2012 Nov; 53(4):247-54. doi: 10.1111/j. 1440-0960.2011.00860.x. Epub 2012 Sep 24
3. Petrova et al. Lactobacillus species as biomarkers and agents that can promote various aspects of vaginal health. Frontiers in Physiology. 2015.
4. Kern et al. Preventive treatment of vulvovaginal candidosis with vaginal probiotic (Gynophilus® - Lcr Regenerans®) results of the observational study candiflore. La letter du

5. Yue et al. The dynamic changes of vaginal microecosystem in patients with recurrent vulvovaginal candidiasis; a retrospective study of 800 patients. Arch Gynecol Obstet DOI 10.1007/s00404-015-3774-2
6. Murina et al. Can Lactobacillus fermentum LF10 and Lactobacillus acidophilus LA02 in a slow-release vaginal product be useful for prevention of recurrent vulvovaginal candidiasis? A clinical study. J Clin Gastroenterol. Volume 48, sup.1; November/December 2014
7. Sophie Coudeyras et al. Taxonomic and strain-specific identification of the probiotic strain Lactobacillus rhamnosus 35 within the Lactobacillus casei group, Appl. Environ. Microbiol, doi: 10.1128/AEM.02286-07, 2008.
Патенты и заявки на патенты
US 6093394
US 6468526
US 7807440
US 2010/0151026
WO 84/04675
WO 2000/035465
US 2002/0044926
WO 2006/045475
WO 2014/009349
WO 2014/009330
Реферат
Настоящее изобретение относится к композиции, содержащей в качестве противогрибкового средства по меньшей мере 2⋅10КОЕ лактобацилл в виде разовой дозы и сульфосодержащее соединение для применения в качестве терапии первой линии против кандидозных инфекций и рецидивирующих кандидозных инфекций. 2 н. и 11 з.п. ф-лы, 7 ил.

Комментарии