Способ получения сульфатированного производного 3,5-дийод-o-[3-йодфенил]-l-тирозина - RU2708244C1
Код документа: RU2708244C1
Чертежи


Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу получения сульфатированных производных тиреоидных гормонов или их солей.
УРОВЕНЬ ТЕХНИКИ
Тиреоидный гормон трийодтиронин (3,5-дийод-O-[3-йодфенил]-L-тирозин, или T3) является метаболически наиболее активным тиреоидным гормоном. Как и тироксин (T4), он физиологически продуцируется щитовидной железой и хранится вместе с ним в форме тиреоглобулина, гликопротеина-предшественника. Одна молекула тиреоглобулина в среднем содержит 3 или 4 остатка T4 и самое большее 1 остаток T3. Продуцирование TSH активирует протеолиз тиреоглобулина с помощью ферментов катепсина D, B и L с высвобождением тиреоидных гормонов T3 и T4. Однако образование T3 не ограничивается этим механизмом: в действительности, в периферических тканях тироксин превращается в трийодтиронин (80% трийодтиронина продуцируется из тироксина в периферических тканях и 20% продуцируется внутри щитовидной железы).
Важность T3 обусловлена не только тем, что он является наиболее активным тиреоидным гормоном. В действительности, в связи с этим известно, что его дефицит приводит к различным патологическим состояниям. В частности, например, в нервной ткани во время эмбрионального развития и в детстве дефицит T3 приводит к уменьшению роста головного мозга и коры мозжечка, пролиферации аксонов, миграции клеток, миелинизации, ветвления дендритов и генеза синапсов. При дефиците T3 на начальных стадиях жизни наблюдается задержка развития центральной нервной системы с последующими нарушениями познавательной способности и моторики, которые могут привести к клинической картине, называющейся кретинизмом. Кроме того, для взрослых с помощью позитронно-эмиссионной томографии головного мозга показано, что при уменьшении содержания трийодтиронина уменьшается кровоток в головном мозге и метаболизм глюкозы в головном мозге. Эти данные могут объяснить дефицит психомоторики у страдающих гипотиреозом индивидуумов.
В дополнение к проявлениям, наблюдающимся в нервной ткани, известны проявления и в костной ткани, когда эндохондральное окостенение стимулируется трийодтиронином, что делает кости линейно длиннее вследствие созревания костных центров в эпифизе. Даже если трийодтиронин не является необходимым для линейного роста костей после рождения, он важен для надлежащего развития костей плода.
Кроме того, доказано влияние T3 на ткани эпидермиса, когда трийодтиронин не только участвует в их созревании и придатках кожи, но и в их деградации, тем самым стимулируя регенерацию клеток. Поэтому и избыток, и дефицит этого гормона может привести к кожным нарушениям.
Поэтому тиреоидный гормон T3 с определенностью можно считать плейотропным гормоном, который в дополнение к указанных воздействиям влияет на кроветворную ткань, в которой он увеличивает продуцирование эритропоэтина и, следовательно, гемопоэз; на жировые ткани, в которых он стимулирует созревание преадипоцитов в адипоциты, усиливает липолиз жирных кислот и, кроме того, регулирует метаболизм холестерина.
Гипотиреоз, очень часто вызываемый аутоиммунными патологиями, является довольно распространенным: в действительности, среди итальянцев он встречается примерно у 1,5% женщин и 1% мужчин. Он удовлетворительно лечится фармакологически с помощью заместительной терапии, в основном основанной на синтетическом левотироксине (T4), обычно использующимся лекарственным средством вследствие очень небольшого периода полувыведения более активной формы, т.е. T3, которую по этой причине нельзя использовать стандартным образом.
Однако и лечение левотироксином обладает некоторыми недостатками, связанными с тем фактом, что, когда сохраняется плазматический эутиреоз, тканевый протекает не всегда. Исследование фармакологических альтернатив, таких как предложенные на основе тиромиметической активности T3, описанной в EP 1560575 B, может стать желательной альтернативой выбирающимся в настоящее время средствам.
Однако применительно к T3S основным недостатком, видимо, являются трудности крупномасштабного синтеза. В действительности, до настоящего времени T3S могли получать только в лаборатории.
В связи с этим получение T3S из T3 с помощью сульфатирующих реагентов, например, концентрированной серной кислоты (H2SO4) или хлорсульфоновой кислоты (ХСК), взятых в большом избытке, описано, например, в US2970165 и Biochim. Biophys. Acta, 33, 461 (1959), где представлено получение T3S из T3 в твердой форме путем прямого добавления концентрированной серной кислоты при низких температурах.
В Endocrinology, Vol.117, № 1, 1-7 (1985) и Endocrinology, Vol.117, № 1, 8-12 (1985) описан синтез T3S из T3 путем проводимого при охлаждении добавления раствора хлорсульфоновой кислоты (ХСК) в диметилформамиде с последующей стадией очистки с помощью Sephadex LH-20.
Однако до настоящего времени ни один из способов предшествующего уровня техники невозможно было использовать для получения граммовых количеств конечного продукта в чистом виде, в основном по той причине, что в описанных методиках очистки необходимо использовать чрезвычайно большие объемы.
Установлено, что реакция сульфатирования, начинающаяся с использования трийодтиронинхлорсульфоновой кислоты (ХСК) в качестве сульфатирующего реагента, в присутствии диметилацетамида (ДМАЦ) приводит к высоким степеням превращения. Кроме того, очистку можно проводить с использованием меньших объемов, чем указанные для известных способов предшествующего уровня техники. В конечном счете продукт T3S можно очистить до степени, необходимой для клинического применения и получить необходимые количества (сотни граммов) и при условиях, подходящих для производства в промышленном масштабе.
Кроме того, поскольку, до настоящего времени описаны только радиоактивные анализы определения уровней T3S в выворотке, такие как RIA (радиоиммуноанализ), описанный у Chopra et al. (J. Clin. Endocrinol. Metab., 1992, 75: 189-194), необходимы более безопасные методики иммунологического анализа, основанные, например, на нерадиоактивных реагентах. Применение таких реагентов также позволит клиническим и/или исследовательским структурам проводить эти измерения. Для этого разработаны методики иммунологического анализа, и они являются частью настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Диаграмма a) калибровочная кривая для T3S, полученная с помощью конкурентного ELISA; диаграмма b) калибровочная кривая полученная с помощью DELFIA. Определение T3S проводили при 33,6, 56, 93,3, 155,5, 259, 432, 720, 1200, 2000 пг/мл.
Фиг. 2. Схема синтеза моноамида диэтилентриаминпентауксусной кислоты-T3S (ДТПК-T3S).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу получения монокатионной соли 3,5-дийод-O-[3-йод-4-(сульфоокси)фенил]-L-тирозина формулы II (T3S) с использованием в качестве исходного вещества 3,5-дийод-O-(4-гидрокси-3-йодфенил)-L-тирозина формулы I или его соли, по схеме:

где M означает щелочной металл, предпочтительно Na,
включающему стадии:
a) сульфатирование соединения формулы I или их солей хлорсульфоновой кислотой (ХСК) в присутствии диметилацетамида (ДМАЦ) в качестве растворителя;
b) образование соли сульфатированного производного, полученного на стадии a), с получением соединения формулы II (T3S) путем добавления реакционной смеси, полученной на стадии a), к водному раствору неорганической соли щелочного металла, предпочтительно монокатионной соли натрия, еще более предпочтительно NaHCO3.
В особенно предпочтительном варианте осуществления соединение формулы I (T3) получают йодированием соединения формулы III (T2):

йодирующим агентом, предпочтительно с помощью NaI и I2, в присутствии алифатического амина, предпочтительно выбранного из числа линейных моноалкил(C1-C4)-алифатических аминов, из которых предпочтительным является этиламин.
Добавление йодирующего агента проводят в присутствии водного растворителя, предпочтительно воды, предпочтительно при температуре, ниже чем 25°C. Предпочтительно, если йодирующий агент содержится в молярном отношении, составляющем от 0,9 до 1,1 моль/моль соединения III (T2).
Таким образом, способ получения T3S включает получение T3 йодированием T2 при описанных выше условиях и последующее сульфатирование хлорсульфоновой кислотой в диметилацетамиде, что лучше описано в подробном описании.
Кроме того, другим объектом настоящего изобретения также является приготовление активного вещества, T3S, в виде фармацевтических композиций, предпочтительно твердых, при котором T3S, предпочтительно в порошкообразной форме, смешивают с разбавляющим агентом и затем агентом, улучшающим сыпучесть, смазывающим агентом, предпочтительно глицериндибегенатом, и разрыхляющим агентом, предпочтительно кроскармеллозой или ее производными, добавляют к смеси в просеянном виде и дополнительно перемешивают с разбавляющей смесью, содержащей активное вещество.
Таким образом, в соответствии с этим вариантом осуществления способ включает стадию, на которой разбавитель, например, микрокристаллическую целлюлозу, добавляют одной или большим количеством порций, их перемешивают, затем получают смесь, содержащую агент, улучшающий сыпучесть, предпочтительно глицериндибегенат, смазывающий агент, предпочтительно стеарат магния или цинка, гидратированный коллоидный диоксид кремния, коллоидный диоксид кремния и предпочтительно также разрыхляющий агент, предпочтительно кроскармеллозу или ее производные; затем их просеивают и затем дополнительно перемешивают со смесью, содержащей активное вещество вместе с разбавителем. Затем можно добавить другие эксципиенты, стабилизаторы и разбавители (такие как, например, карбонат кальция) и перемешать в течение подходящего времени.
Особенно предпочтительным объектом настоящего изобретения также является таблетка, полученная описанным выше способом, содержащая T3S в качестве активного вещества в количестве, равном от 1 до 1000 мкг, и содержащая следующие разбавители, эксципиенты, вещества, придающие скользкость и смазывающие вещества: карбонат кальция, глицериндибегенат, натриевая соль кроскармеллозы, гидратированный коллоидный диоксид кремния, стеарат магния, микрокристаллическая целлюлоза. Предпочтительные количества для одной дозы указаны в приведенной ниже таблице:
Другим вариантом осуществления настоящего изобретения являются нерадиоактивные иммуноанализы.
Предпочтительно, если иммунологическим анализом является иммуноферментный анализ (ELISA), более предпочтительно конкурентный ELISA, наиболее предпочтительно проводимый в многолуночном планшете с использованием в качестве детектируемого фрагмента флуоресцентной группы или фермента (например, пероксидазы хрена (HRP), щелочной фосфатазы и т.п.) или фрагмента, детектирующего производное авидина (т.е. биотина).
В качестве дальнейшего развития нерадиоактивных анализов по определению T3S, разработаны реагенты для лантанидного флуоресцентного иммунологического анализа. Этот анализ, синтезированные реагенты и наборы для количественного определения T3S на основе этих новых реагентов являются другим объектом настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Объектом настоящего изобретения является способ получения сульфатированной формы тиреоидного гормона T3, 3,5-дийод-O-[3-йод-4-(сульфоокси)фенил]-L-тирозина (T3S), имеет формулу II, в виде монокатионной соли с использованием в качестве исходного вещества 3,5-дийод-O-[4-гидрокси-3-йодфенил]-L-тирозина формулы I или его производного-соли:

где M означает щелочной металл, предпочтительно Na, который включает стадии:
a) сульфатирование соединения формулы I (T3) хлорсульфоновой кислотой (ХСК) в присутствии диметилацетамида (ДМАЦ) в качестве растворителя,
b) образование соли сульфатированного производного, полученного на стадии a), с получением соединения формулы II. Образование соли обычно проводят путем добавления полученной реакционной смеси в a) водный раствор неорганической соли щелочного металла, предпочтительно натриевой соли, еще более предпочтительно Na2CO3 или NaHCO3.
Для задач настоящего изобретения T3S означает соединение формулы II, представляющее собой сульфатированную форму трийодтиронина или его монокатионных солей (соединение формулы II).
Стадию a) проводят путем добавления ХСК к суспензии T3 в ДМАЦ при охлаждении при постоянном энергичном перемешивании раствора.
Температуру поддерживают при значениях, равных ниже примерно 10°C, более предпочтительно от -10°C до 8°C, более предпочтительно от -8°C до 6°C, еще более предпочтительно от -5°C до 5°C.
Добавление ХСК к суспензии выполняют медленно, предпочтительно в течение периода времени, равного от 30 до 60 мин, в зависимости от количеств использующихся реагентов и предпочтительно в инертной атмосфере, например, в атмосфере азота или аргона.
В предпочтительном варианте осуществления отношение количества молей ХСК к количеству молей T3 превышает 4, предпочтительно равно от 4,5 до 10, еще более предпочтительно равно от 7 до 9. Еще более предпочтительно равно от 7,5 до 8,5 моля ХСК/моль T3. Концентрация T3 в ДМАЦ, выраженная в молях T3/л ДМАЦ, равна от 0,06 до 0,15 моль/л, более предпочтительно от 0,12 до 0,14 моль/л. Следовательно, отношение количества ХСК к количеству растворителя может равняться от 0,35 до 1,28 моля ХСК/л ДМАЦ, предпочтительно от примерно 0,8 до 1,15 моль/л, еще более предпочтительно от примерно 0,96 до 1,1 моля ХСК/л ДМАЦ.
После добавления ХСК реакции в смеси дают протекать в течение периода времени, не превышающего 4-5 ч, обычно без охлаждения, давая температуре достичь комнатной температуры (20-25°C).
Сульфатирование обычно завершается при заданных условиях, когда более 85%, предпочтительно более 90%, еще более предпочтительно более 95% T3 превратилось в T3S.
В особенно предпочтительном варианте осуществления перед стадией a) способа проводят добавление ХСК к раствору T3 в ДМАЦ при концентрации, равной 0,12-0,14 моля T3/л ДМАЦ, и предпочтительное отношение составляет примерно 8 молей ХСК на 1 моль T3, при температуре, равной от примерно -5°C до примерно 5°C, в течение периода времени, равного 30-40 мин. После окончания добавления охлаждение обычно прекращают и температуре дают повышаться до комнатной температуры (равной от примерно 15 до 25°C) в течение не более 4-5 ч, предпочтительно не более 2-3 ч.
Затем в соответствии со стадией образование соли b) сульфатирующую смесь добавляют к водному раствору неорганической соли щелочного металла, предпочтительно монокатионной, где Na является особенно предпочтительным катионом, в таком количестве, чтобы нейтрализовать содержащуюся хлорсульфоновую кислоту.
Образование соли предпочтительно проводят в водном растворе карбоната натрия (Na2CO3) или гидрокарбоната натрия (NaHCO3), взятом в количестве, зависящем от количества хлорсульфоновой кислоты, использующейся на предыдущей стадии, и по меньшей мере достаточном для нейтрализации полученного раствора. Обычно при использовании Na2CO3 достаточным является количество, равное примерно 1,5 моля на 1 моль ХСК. В этом варианте осуществления концентрация раствора Na2CO3равна примерно 0,7 моль/л. При таких условиях после нейтрализации обеспечивается значение pH раствора, равное от 6,5 до 7,5.
В этом варианте осуществления соответствующая полученная монокатионная соль соединения T3S описывается формулой II, в которой M предпочтительно означает Na.
Добавление реакционной смеси в соответствии со стадией b) проводят в течение периода времени, который является переменным, обычно составляя от 1 ч до 3 ч, при поддержании температуры равной ниже 30°C.
Соединение T3S формулы II, полученное в растворе в виде монокатионной соли в соответствии с описанной выше стадией b), очищают с помощью хроматографии в соответствии со следующей стадией c). Перед хроматографией необязательно проводят осаждение и/или фильтрование, например, гравитационное или в вакууме реакционной смеси, полученной на стадии b), для уменьшение количества неорганических солей, которые образуются в качестве побочных продуктов.
Хроматографию (c) проводят на адсорбирующей смоле полимерного типа. Предпочтительно, если эта смола образует макросетчатую ароматическую полимерную матрицу. Примерами предпочтительных смол являются XADTM AmberlitesTM, еще более предпочтительно AmberliteTM XADTM 1600.
Как хорошо известно, перед использованием смолу активируют по методикам, известным в данной области техники, таким как, например, промывка водой, ацетоном и т.п. (общее описание приведено в публикации Rohm and Haas in “Laboratory Column Procedures and Testing of Amberlite and Duolite Polymeric Adsorbents”, section “Preparation of Resins”). В способе, предлагаемом в настоящем изобретении, смолу предпочтительно активируют растворителем, выбранным для последующего элюирования (т.е. ацетоном или смесью вода/ацетон).
T3S предпочтительно элюируют из смолы элюирующей смесью растворителей с полярностью, уменьшающейся в градиентном режиме, начиная со смеси, обладающей наибольшей полярностью. В предпочтительном варианте осуществления указанной элюирующей смесью сначала является вода, затем ее последовательно разбавляют подходящим полярным органическим растворителем, в подходящих обратных отношениях.
Предпочтительными элюирующими смесями являются смеси вода/ацетонитрил и вода/ацетон в отношениях, составляющих от 1:0 до 0,7:0,3. Предпочтительно, если элюирующей смесью является смесь воды и ацетона в отношении, составляющем от 1:0 до 0,85:0,15, и скорость элюирования через колонку обычно равна от 0,9 до 1,1 объемов колонки/ч.
Фракции, элюирующиеся из колонки и содержащие конечный продукт, обладающий чистотой, превышающей 95%, более предпочтительно превышающей 96%, 98%, 99% (определено по аналитическим методикам, хорошо известным в данной области техники, таким как, например, УФ-детектирование и анализ с помощью ВЭЖХ (высокоэффективная жидкостная хроматография)), собирают и объединяют, и активное вещество можно выделить путем выпаривания растворителя, т.е. в вакууме, с помощью сушки вымораживанием или по другим известным методикам.
Однако в предпочтительном варианте осуществления элюирующиеся фракции концентрируют, например, путем частичного выпаривания в вакууме до концентрации, равной примерно 10 г/кг раствора.
При этой концентрации значение pH раствора доводят до значений, равных менее 6,5, предпочтительно равных от 5,5 до 6,5, путем добавления разбавленного раствора сильной неорганической кислоты, предпочтительно кислоты, представляющей собой серной кислоту или хлористоводородную кислоту, хлористоводородная кислота является особенно предпочтительной, и используют в разбавленном виде при концентрации, равной от 0,9 до 1,1 н.
Раствор дополнительно концентрируют примерно в 10-15 раз и T3S можно выделить в виде твердого вещества например, с помощью сушки вымораживанием, распылительной сушки или, предпочтительно путем обработки органическим растворителем, предпочтительно полярного типа и затем необязательно дополнительно микронизируют.
Таким образом, в этом предпочтительном варианте осуществления соединение формулы II выделяют в твердой форме путем обработки растворителем, выбранным из группы, включающей: ацетон, ацетонитрил и C1-C4-спирты. Однако можно использовать другие растворители, которые выбраны из группы, включающей: ароматические алканы, простые эфиры, хлорированные растворители, сложные эфиры, диметилформамид, нитрометан, диметилсульфоксид, 2-метоксиэтанол или их смеси, которые позволяют получить и выделить соль в твердой форме и.
Таким образом, при подробном описании после хроматографии и концентрирования содержащих T3S фракций до концентрации, равной примерно 10 г/кг раствора, установления значений pH, равных ниже 6,5, предпочтительно равных от 5,5 до 6,5, и дополнительного выпаривания до концентрации соединения формулы II, равной от 170 до 500 г/кг суспензии или геля, концентрированный раствор обрабатывают органическим растворителем. Предпочтительно, если указанный растворитель является полярным органическим растворителем, выбранным из группы, включающей: ацетон, низшие спирты, такие как, например, этанол, пропанол, изопропанол и т.п., и ацетонитрил, ацетон является особенно предпочтительным.
Добавление ацетона к концентрированному раствору T3S проводят при температуре, равной от 20 до 25°C, предпочтительно при выдерживании смеси при перемешивании в течение 1-3 ч при температуре, равной от 0 до 25°C, для обеспечения полного осаждения твердой формы монокатионной соли T3S.
Добавление растворителя к суспензии проводят в известных отношениях: если используют ацетон, его добавляют в количестве, равном 1-11 г ацетон/г T3S, при температуре, равной 20-25°C.
Таким образом монокатионное производное формулы II или, более предпочтительно, его натриевую соль получают в твердой форме после отделения жидкой фазы от твердой, например, фильтрованием, по данным ВЭЖХ обладающее чистотой, превышающей 95%, более предпочтительно, превышающей 96%, 98% или даже >99%.
Таким образом, в целом способ, предлагаемый в настоящем изобретении, позволяет обеспечить выделение конечного продукта (T3S) с высокими выходами (суммарный выход: ≥60%) и высокой чистоты (по данным ВЭЖХ >99%).
В действительности, что является улучшением по сравнению со способами предшествующего уровня техники, уже на стадии сульфатирования смеси a) в присутствии ДМАЦ содержание побочных продуктов составляет менее 10%, обычно менее 7%.
Высокая степень превращения в реакции сульфатирования и последующего образования соли позволяет получить продукт в чистом виде с помощью промышленно применимой стадии хроматографирования и с использованием ограниченных объемов.
T3S эффективно отделяется от побочных продуктов и обладает достаточной чистотой (>99%), даже если его получают в количестве, составляющем сотни граммов, что делает возможным применение этого производного трийодтиронина в клинической практике.
Для приготовления препаратов, предназначенных для клинического применения, T3S в твердой форме и чистотой до 99% для уменьшения размера частиц предпочтительно дополнительно микронизируют, например, под давлением в атмосфере азота.
Особенно предпочтительными являются частицы размером менее 25 мкм (по меньшей мере 90%, более предпочтительно по меньшей мере 95% частиц с размерами, равными менее 25 мкм), что обеспечивает стабильность в течение по меньшей мере месяца при ускоренных испытаниях стабильности в климатической камере.
Поэтому в соответствии с предпочтительным вариантом настоящего изобретения способ включает микронизацию твердого T3S в чистой форме с получением частиц указанного выше размера и их применение для приготовления твердых составов, предназначенных для перорального введения.
В соответствии с этим вариантом после микронизации T3S готовят вместе с подходящими дополнительными компонентами в виде порошкообразных смесей, также необязательно в гранулированной или микрогранулированной форме, предпочтительно готовят в виде таблетки или пилюли, полученной путем прямого прессования порошкообразной смеси.
Препарат T3S в твердой форме или, более предпочтительно, в виде таблетки, получают путем добавления к микронизированному активному веществу (или веществам, если предпочтительна комбинация с левотироксином) сначала части необходимого конечного разбавителя, предпочтительно 30, 40 или предпочтительно по меньшей мере 50% разбавителя, и их смешивания с получением смеси a).
Предпочтительным разбавителем является целлюлоза или ее производные, например, микрокристаллическая целлюлоза. Другими подходящими разбавляющими агентами являются каолин, крахмал или неорганические соли щелочного металла, такие как карбонат магния или кальция. Особенно предпочтительным является карбонат кальция, более предпочтительно вместе с микрокристаллической целлюлозой.
Затем смесь a) смешивают со смесью b), содержащей дополнительные компоненты, обычно: агент, придающий скользкость, смазывающий агент и разрыхляющий агент, которую просеивают и затем смешивают со смесью a), содержащей активное вещество.
Из разрыхляющих агентов, особенно предпочтительной является кроскармеллоза или ее производные. Другими подходящими для этой цели агентами являются кросповидон, полиметакрилаты, мальтодекстрины, натриевая соль гликолята крахмала, предварительно желатинизированный крахмал, альгинат натрия.
Из агентов, придающих скользкость, особенно предпочтительным является глицериндибегенат. Другими подходящими веществами, придающими скользкость являются: трикальцийфосфат, тальк, крахмал или его производные.
Из смазывающих агентов особенно предпочтительными являются стеарат магния или цинка, коллоидный гидратированный диоксид кремния, коллоидный диоксид кремния. Другие эксципиенты, стабилизаторы и разбавители (такие как, например, карбонат кальция) можно последовательно добавлять и перемешивать в течение разного времени. Затем конечную смесь отмеряют и таблетки предпочтительно получают прямым прессованием.
T3S содержится в твердых дозированных формах в количествах, равных от 1 до 1000 мкг, более предпочтительно от 2,5 до 500 мкг, еще более предпочтительно от 5 до 250 мкг, в виде единственного активного вещества, или в комбинации с другими активными веществами, предпочтительно с T4 (левотироксин). В этом варианте осуществления T4 содержится в количествах, равных от 1 до 800 мкг, или 5-400 мкг, более предпочтительно 10-200 мкг. Затем при изготовлении таблеток, содержащих и T3, и T4 в качестве активных веществ, их смешивают с предпочтительным разбавителем (разбавителями) в смеси a) и дополнительно смешивают с другими компонентами, которые, в свою очередь, предварительно перемешаны, как описано выше.
Поэтому предпочтительным объектом настоящего изобретения является таблетка, приготовленная описанным выше способом, содержащая T3S в качестве активного вещества, в количестве, равном от 1 до 1000 мкг, вместе со следующими дополнительными компонентами:
- разбавитель, выбранный из целлюлозы или ее производных, предпочтительно вместе со вторым разбавителем, предпочтительно карбонатом кальция, содержание которого составляет до 35% от всего разбавителя (мас./мас.);
- агент, придающий скользкость, выбранный из глицериндибегената (наиболее предпочтительный), талька, производных диоксида кремния, из которых трисиликат магния, амиды, трикальцийфосфат обычно содержатся в композиции в количестве, находящемся в диапазоне от 1 до 10%, наиболее предпочтительно 4 до 6% (мас./мас.);
- разрыхлитель, выбранный из крахмала, натриевой соли кроскармеллозы и кросповидона. Предпочтительной является натриевая соль кроскармеллозы в количестве, находящемся в диапазоне от 0,5 до 10%, еще более предпочтительно в количестве, равном 1-5%, наиболее предпочтительно в количестве, равном от 2 до 4% (мас./мас.);
- смазывающее вещество, выбранное из стеарата магния, гидратированного коллоидного диоксида кремния и талька, более предпочтительно стеарата магния и коллоидного диоксида кремния, содержащихся в полном количестве, находящемся в диапазоне от 0,1 до 7% еще более предпочтительно, если первый содержится в количестве, равном от 0,1 до 2%, и второй содержится в количестве, равном от 0,5 до 5% (мас./мас.).
Особенно предпочтительными в качестве эксципиентов являются следующие ингредиенты: карбонат кальция, глицериндибегенат, натриевая соль кроскармеллозы, гидратированный коллоидный диоксид кремния, стеарат магния, микрокристаллическая целлюлоза, содержащиеся в следующих предпочтительных количествах:
В более предпочтительном варианте осуществления композиция содержит от 2,5 до 500 мкг T3S или, более предпочтительно, 5-250 мкг T3S.
В комбинированных композициях, в которых также содержится T4, T3S предпочтительно содержится в количестве, равном 2,5-500 мкг, и T4 в количестве, равном от 1 до 800 мкг, или, еще более предпочтительно: T3S: 5-250 мкг и T4: 5-400 мкг, или T3S: 10-100 мкг и T4 10-200 мкг.
Следует понимать, что указанные выше количества относятся к разовым дозированным формам, предпочтительно к таблеткам массой примерно 110 мг, предпочтительно предназначенным для ежедневного введения разовой дозы, хотя специалист в данной области техники может представить себе альтернативные формы композиции, массы таблетки и/или схемы медикаментозного лечения.
Таблетки, соответствующие предпочтительному варианту осуществления, обладают оптимальными скоростями растворения (см. приведенную ниже таблицу) и оптимальной стабильностью активного вещества (веществ) (в течение по меньшей мере 24 месяцев).
Приведенные ниже характеристики определены при условиях, соответствующих требованиям руководств Международной конференции по гармонизации:
Для способа, предлагаемого в настоящем изобретении, все реагенты, включая T3 (соединение формулы I), имеются в продаже.
Однако в особенно предпочтительном варианте осуществления T3 получают йодированием соединения формулы III (3,5-дийодтиронин, леводити, или T2):

йодирующим агентом, предпочтительно NaI и I2, в присутствии алифатического амина, предпочтительно выбранного из числа линейных моноалкил(C1-C4)-алифатических аминов, из которых предпочтительным является этиламин. T2 предпочтительно получают так, как описано.
Добавление йодирующего агента проводят в присутствии водного растворителя, предпочтительно воды, при температуре предпочтительно равной ниже 25°C.
Предпочтительно, если йодирующий агент содержится в молярном отношении, составляющем от 0,9 до 1,1 моль/моль соединения III (T2).
После йодирования T3 отделяют, предпочтительно фильтрованием, в виде натриевой соли, затем превращают в кислотную форму путем повторного суспендирования в воде и подкисления кислотой, предпочтительно уксусной кислотой или серной кислотой.
Кислотную форму отделяют, предпочтительно фильтрованием, также путем повторного суспендирования в воде для удаления солей и фильтрования.
T3 в виде влажного твердого вещества суспендируют в N,N-диметилацетамиде, суспензию обезвоживают и вводят в реакцию сульфатирования.
В соответствии с предпочтительным вариантом осуществления отношение количества молей ХСК к количеству молей T3 превышает 4, предпочтительно равно от 4,5 до 10, еще более предпочтительно равно от 7 до 9. Еще более предпочтительно равно от 7,5 до 8,5 моля ХСК/моль T3. Концентрация T3 в ДМАЦ, выраженная в виде количества молей T3/л ДМАЦ, равна от 0,10 до 0,15 моль/л, более предпочтительно от 0,12 до 0,14 моль/л. Отсюда следует, что отношение количества ХСК к количеству растворителя может составлять от 0,58 до 1,28 моля ХСК/л ДМАЦ, предпочтительно от 0,89 до 1,15 моль/л, еще более предпочтительно от 0,96 до 1,09 моля ХСК/л ДМАЦ.
После добавления ХСК смеси дают взаимодействовать в течение периода времени, не превышающего 4-5 ч, обычно без охлаждения, давая температуре повыситься до комнатной температуры.
При описанных условиях сульфатирование обычно завершается, когда более 85%, предпочтительно более 90%, еще более предпочтительно более 95% T3 превращается в T3S.
В особенно предпочтительном варианте осуществления перед стадией a) способа проводят добавление ХСК к раствору T3 в ДМАЦ при концентрации, равной 0,12-0,14 моля T3/л ДМАЦ, и предпочтительное соотношение составляет примерно 8 молей ХСК на 1 моль T3 при температуре, равной от примерно -5°C до примерно 10°C, в течение периода времени, равного 30-40 мин. После окончания добавления охлаждение обычно прекращают и температуре дают повышаться до комнатной температуры (равной от примерно 15 до 25°C) в течение не более 4-5 ч, предпочтительно не более 2-3 ч.
Затем в соответствии со стадией b) образование соли сульфатирующую смесь добавляют к водному раствору неорганической соли щелочного металла, предпочтительно дикатионной, где Na является особенно предпочтительным катионом, в таком количестве, чтобы нейтрализовать содержащуюся хлорсульфоновую кислоту.
Образование соли предпочтительно проводят в водном растворе Na2CO3 или NaHCO3, взятом в количестве, зависящем от количества использующейся хлорсульфоновой кислоты, по меньшей мере достаточном для нейтрализации полученного раствора. Обычно при использовании Na2CO3 достаточным является количество соли, равное примерно 1,5 молей на 1 моль ХСК. Если в соответствии с особенно предпочтительным вариантом неорганической солью щелочного металла является Na2CO3, ее конечная концентрация в растворе равна по меньшей мере 0,7 моль/л. При таких условиях после нейтрализации обеспечивается значение pH раствора, равное от 6,5 до 7,5.
В этом варианте осуществления соответствующая полученная монокатионная соль соединения T3S описывается формулой II, в которой M предпочтительно означает Na.
Добавление реакционной смеси в соответствии со стадией b) проводят в течение периода времени, который является переменным, обычно составляя от 1 ч до 3 ч, при поддержании температуры равной ниже 30°C.
Соединение T3S формулы II получают в растворе в виде монокатионной соли в соответствии со стадиями b) и c), как это описано выше.
Способ, предлагаемый в настоящем изобретении, насколько известно заявителям, впервые описывает получение T3S из T3 или T2 с чистотой, составляющей по меньшей мере 95%, более предпочтительно по меньшей мере 96%, 98% или >99%, предназначенной для клинического применения.
В другом варианте осуществления настоящее изобретение также относится нерадиоактивному иммунологическому анализу, по определению T3S, основанному на колориметрическом, флуоресцентном или хемолюминесцентном детектировании.
Предпочтительно, если иммунологическим анализом является иммуноферментный анализ (ELISA), более предпочтительно конкурентный ELISA, в котором увеличивающиеся количества T3S конкурируют за связывание со связанными с твердой фазой антителами к T3S (например, поликлональными, описанными в публикации Chopra et al., J. Clin. Endocrinol. Metab., 1992, 75: 189-194), при фиксированном количестве T3S, конъюгированного с детектируемым фрагментом, таким как флуоресцентная группа или фермент (например, пероксидаза хрена, щелочная фосфатаза и т.п.) или вещество, связывающееся с производным авидина (т.е. биотин), необязательно связанное с детектируемым фрагментом.

Формула A’
Производные T3S применяющиеся в нерадиоактивных анализах, обычно описываются общей формулой A:

Формула A
в которой R выбран из группы, включающей:
a) детектируемый фрагмент, выбранный из группы, включающей: флуоресцентную группу или фермент, выбранный из группы, включающей: пероксидазу хрена, щелочную фосфатазу,
c) вещество, связывающееся с производным авидина, необязательно связанное с детектируемым фрагментом,
d) агент, образующий хелат с лантанидом.
Если R означает агент, образующий хелат с лантанидом, то производным T3S предпочтительно является соединение формулы IV.
Анализ предпочтительно проводят в многолуночном планшете. Предпочтительно, если детектируемым фрагментом является флуоресцентная группа или фермент (например, пероксидаза хрена, щелочная фосфатаза и т.п.) или вещество, связывающееся с производным авидина (т.е. биотин). В последнем варианте осуществления предпочтительно проводят детектирование производного авидина, предпочтительно стрептавидина, содержащего фермент, такой как щелочная фосфатаза или пероксидаза хрена, предпочтительно HRP, который превращает специфические субстраты в окрашенные, флуоресцирующие или люминесцирующие продукты. Использование взаимодействия биотин-авидин совместно с различными методиками детектирования люминесценции для проявления сигнала обеспечивает усиление сигнала и чувствительность, повышенную по сравнению с методикой RIA (см. Chopra et al., J. Clin. Endocrinol. Metab., 1992, 75: 189-194), но без использования радиоактивных веществ, что является явным преимуществом по сравнению с предшествующим уровнем техники.
Анализ ELISA, производные T3S, такие как производное биотина, их синтез и наборы для количественного определения T3S, содержащие такие реагенты, являются другими объектами настоящего изобретения.
В качестве альтернативного варианта осуществления разработан нерадиоактивный иммунологический анализ, по определению T3S, для флуоресцентной методики, под названием "лантанидный флуоресцентный иммунологический анализ", описанный в публикации Hemmilä I et al. Anal Biochem. 1984 Mar;137(2): 335-43, с помощью которого обеспечивается чувствительность, равная 1-1000 пг/мл T3S. Этот анализ, разработанный для определения T3S, синтезированные реагенты и наборы для количественного определения T3S, содержащие такие реагенты, являются другим объектом настоящего изобретения.
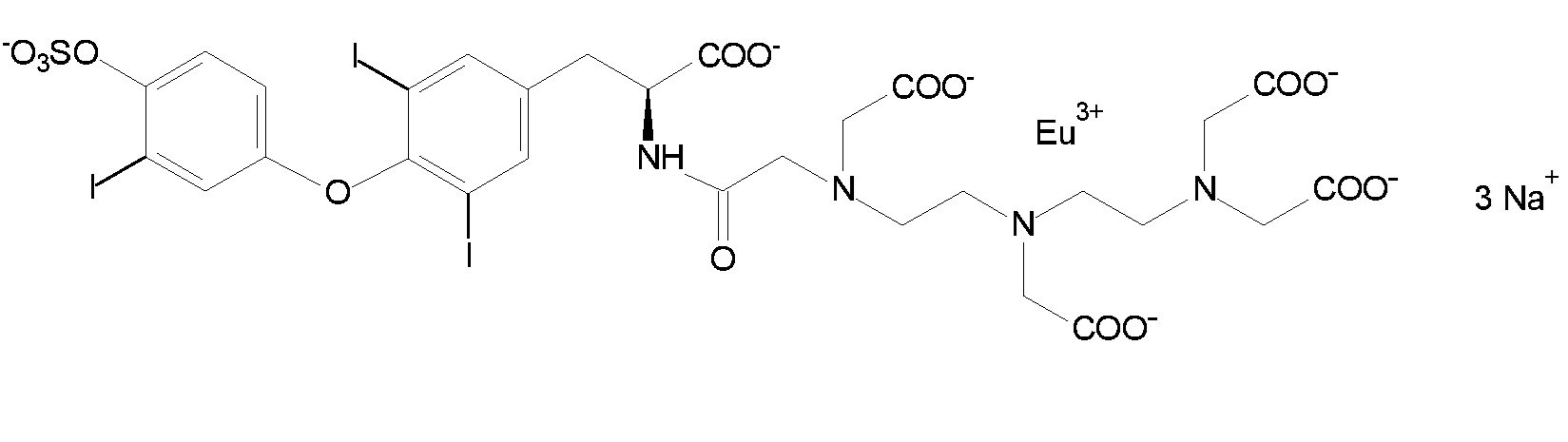
Таким образом, моноамид ДТПК-T3S (3,5-дийод-N-[[(карбоксиметил)[2-[(карбоксиметил)[2-[бис(карбоксиметил)амино]этил]амино]этил]амино]ацетил]-O-[3-йод-4-(сульфоокси)фенил]-L-тирозин) формулы IV представляет собой хелатное соединение, соответствующее предпочтительному варианту осуществления:

Формула IV
Специалист в данной области техники может предложить и синтезировать другие молекулы путем конъюгации T3S с различными хелатными фрагментами, в том числе с подходящими для образования комплексов с ионами лантанидов, такими как, например, нитрилотриуксусная кислота (НТК), этилендиаминтетрауксусная кислота (ЭДТК), этилендиамин-N,N'-бис(2-гидроксифенилуксусная кислота) (ЭДГФК), пропандиаминтетрауксусная кислота (ПДТК), диэтилентриаминтетрауксусная кислота (ДТТК), диэтилентриаминпентауксусная кислота (ДТПК) и аналогичные молекулы. Конъюгацию хелатного агента с T3S можно провести по различным методикам, известным специалисту в данной области техники, включая прямое образование амидной связи, пример которого приведен в экспериментальной части, или использование бифункциональных хелатных агентов, которые даже могут иметься в продаже, таких как (S)-1-p-изотиоцианатобензилдиэтилентриаминпентауксусная кислота (изотиоцианат ДТПК - Invitrogen cat. I24221) или аналогичные продукты.
Подходящие для использования в качестве хелатных меток лантаниды выбраны из группы, включающей: самарий, тербий, диспрозий и европий.
Особенно предпочтительным является хелат европия с 3,5-дийод-N-[[(карбоксиметил)[2-[(карбоксиметил)[2-[бис(карбоксиметил)амино]этил]амино]этил]амино]ацетил]-O-[3-йод-4-(сульфоокси)фенил]-L-тирозином (формула V).

Формула V
Схема его синтеза приведена на фиг. 2. Методику можно описать следующим образом: диангидрид ДТПК частично гидролизуют путем добавления примерно эквимолярного количества воды, растворенной в подходящем органическом растворителе, затем продукт, в основном представляющий собой моноангидрид ДТПК, вводят в реакцию с T3S в присутствии подходящего органического или неорганического основания. После выпаривания растворителя маслообразный остаток разбавляют водой. Полученный осадок собирают, промывают водой и растворяют в смеси вода/ацетон. Неочищенный продукт реакции очищают на колонке с Amberlite XAD1600 или аналогичной смолой, элюируя смесями вода/ацетон или в градиентном режиме. Фракции, содержащие продукт, собирают и выпаривают досуха и получают искомый ДТПК-T3S моноамид.
Комплексы с лантанидами получают по известным методикам путем добавления эквимолярного количества соли лантанида к раствору моноамида в воде и установления значения pH, равного 7, подходящим основанием (например, NaOH). Содержащий лантанид хелатный продукт необязательно можно обессолить путем адсорбции в колонке на смоле (например, Amberlite XAD1600) и элюирования смесями вода/растворитель.
И в этом случае обеспечивается чувствительность, сравнимая с чувствительностью известного анализа RIA (см. Chopra et al., ibidem), но без использования радиоактивных изотопов, что является явным преимуществом по сравнению с анализом предшествующего уровня техники.
На основе приведенного выше описания специалист в данной области техники может разработать альтернативные варианты ELISA, которые, тем не менее, входят в объем настоящего изобретения. Например, целевой гормон T3S можно ковалентно связать с подложкой и антителами, необязательно связать с ферментом-индикатором или использовать в комбинации с антителами, связанными с ферментом-индикатором, использовать для конкурентного определения содержания T3S в неизвестном образце. В другом варианте осуществления индикатором является сам антиген (T3S), химически связанный с определяемым ферментом (например, щелочной фосфатазой или пероксидазой хрена) по методике, известной специалисту в данной области техники, также поставляющийся в виде готового к применению набора для конъюгации.
В другом варианте осуществления настоящее изобретение относится к набору для введения T3S и его дозирования в сыворотку, где указанный набор включает дозированный набор для иммунологического определения T3S с помощью описанных выше нерадиоактивных анализов, и набор для введения/лечения, содержащий целый ряд суточных доз T3S или композиции T3S и T4 (т.е. для введения раз в неделю, раз в две недели, раз в месяц, два раза в месяц), предпочтительно в форме таблеток, описанных выше.
Дозированный набор для нерадиоактивного иммунологического определения T3S, может включать в соответствии с первым предпочтительным вариантом осуществления поликлональные антитела, связывающиеся с производным авидина T3S, где конъюгатом предпочтительно является T3S-биотин и детектируемым фрагментом производного авидина является стрептавидин. Более предпочтительно, производным авидина является стрептавидин и детектируемый фрагмент представляет собой фрагмент хемилюминесцентного фермента (такого как щелочная фосфатаза или пероксидаза хрена), предпочтительно HRP.
Для разработанного варианта осуществления лантанидного флуоресцентного иммунологического анализа набор наряду с антителами может содержать реагенты, специально разработанные для такого детектирования, такие как производные хелатных комплексов лантанидов с T3S, в которых металл выбран из группы, включающей: самарий, тербий, диспрозий и европий. Особенно предпочтительным является хелат европия с 3,5-дийод-N-[[(карбоксиметил)[2-[(карбоксиметил)[2-[бис(карбоксиметил)амино]этил]амино]этил]амино]ацетил]-O-[3-йод-4-(сульфоокси)фенил]-L-тирозином (соединение формулы V).
Набор также может включать стандарты T3S для построения калибровочной кривой. Стандарт может быть предварительно разбавленным и готовым к применению в виде раствора надлежащей концентрации или быть предназначенным для солюбилизации в подходящем растворителе. Набор также может включать другие реагенты, выбранные из группы, включающей: разбавитель, краситель, буфер, консервант, антитела к T3S, листок-вкладыш с инструкцией.
Настоящее изобретение ниже описано с помощью приведенных примеров, которые являются только поясняющими и их не следует рассматривать в качестве ограничивающих объем настоящего изобретения.
ЭКСПЕРИМЕНТАЛЬНЫЙ РАЗДЕЛ
Пример 1. Получение T3S в ДМАЦ
Все количества неочищенных материалов приведены в пересчете на 100 г T3.
3,5-Дийод-O-(4-гидрокси-3-йодфенил)-L-тирозин (100 г; 0,154 моля) суспендировали в ДМАЦ (2,0 л) в атмосфере азота и энергично перемешивали для исключения осаждения твердого вещества. После охлаждения до -5°C в течение 40 мин по каплям добавляли ХСК (142,2 г; 1,229 моля), поддерживая температуру в диапазоне -5÷5°C. После окончания добавления охлаждение прекращали и реакционную смесь перемешивали в течение примерно 4 ч. Реакционную смесь при перемешивании в течение 1,5 ч по каплям добавляли к водному раствору бикарбоната натрия (335,5 г; 3,994 моля в воде, 4,5 л). После окончания добавления из полученного таким образом раствора со временем наблюдалось осаждение кристаллического твердого вещества, представляющего собой смесь неорганических солей. Это твердое вещество отфильтровывали, затем полученный раствор очищали на AmberliteTM XADTM1600 путем элюирования смесями вода/ацетон, обладающими уменьшающейся полярностью, и собирали фракции элюата. Фракции, содержащие продукт, обладающие достаточной чистотой, выпаривали в вакууме до концентрации, равной 10 г/кг. Значение pH такой суспензии устанавливали равным 6,2 с помощью 1 н HCl. Суспензию дополнительно концентрировали до отношения количества твердого вещества к количеству оставшейся воды, составляющего примерно 1:3. Такой остаток при охлаждении обрабатывали ацетоном в течение 2 ч, затем отфильтровывали и промывали ацетоном. Продукт сушили при 40°C в вакууме. Получали 74 г T3S в виде белого твердого вещества. Выход в пересчете на безводное основание: 62%.
Пример 2. Получение T3S из T2 (леводити)
Схема реакции приведена ниже:
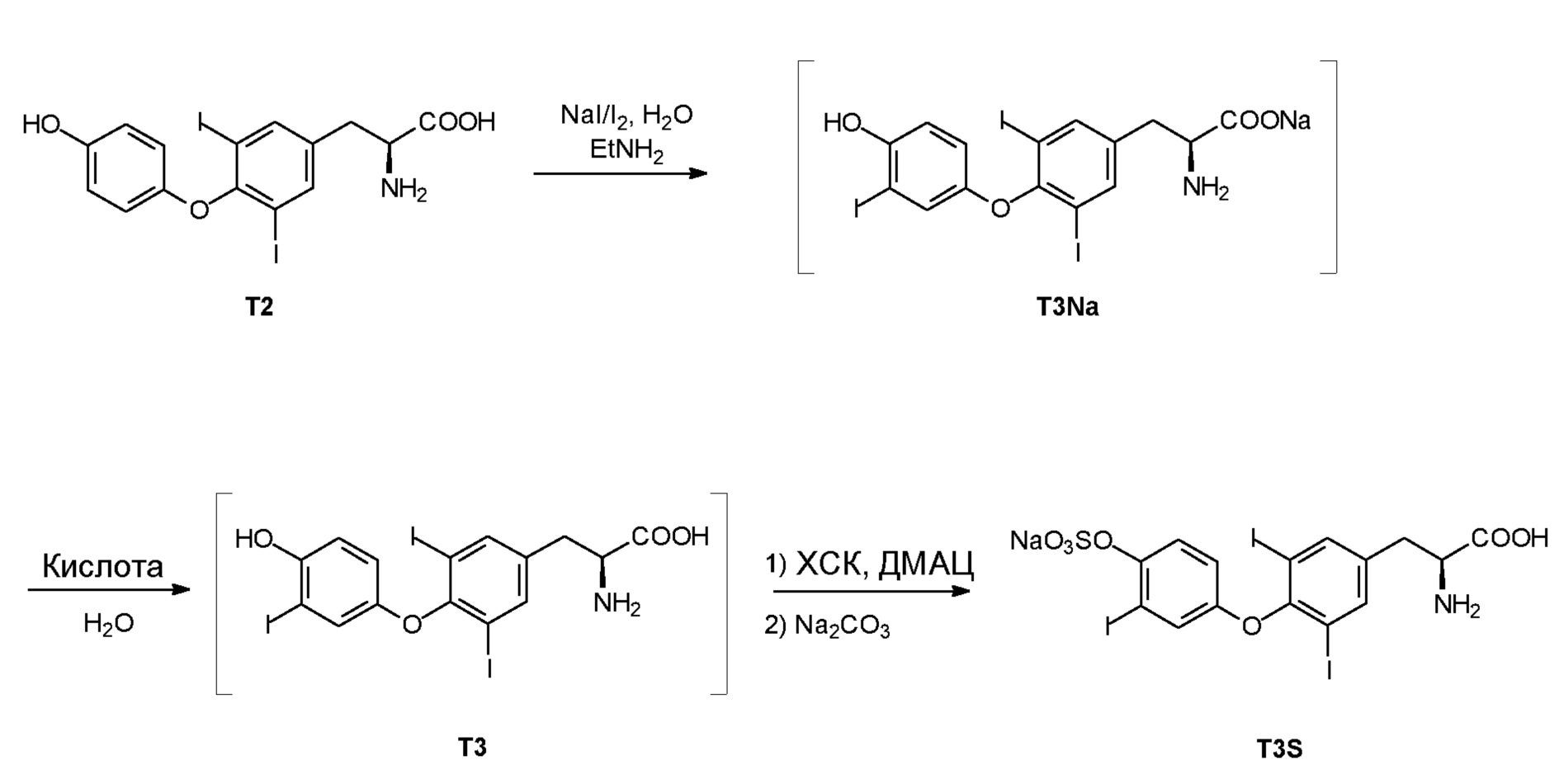
Все количества неочищенных материалов приведены в пересчете на 1 кг леводити.
Йод (примерно 0,48 кг, источник: SQM), NaI (примерно 0,65 кг, источник: Ajay - SQM) и воду помещали в реактор при 18-22°C и перемешивали до полного растворения. Полученную йодирующую смесь до использования держали при комнатной температуре при перемешивании.
Леводити, полученный из L-тирозина по методике, описанной в публикации: Chalmers, J. R. et al. A. J. Chem. Soc. 1949, 3424-3433), NaI (примерно 0,32 кг) и воду помещали в другой реактор и добавляли 70% моноэтиламин.
К реакционной смеси добавляли йодирующую смесь.
Полученную суспензию перемешивали в течение по меньшей мере 6 ч при 18-22°C, затем охлаждали до 0°C за 1 ч, перемешивали в течение 3-4 ч и фильтровали. Осадок на фильтре промывали водой.
Влажное твердое вещество суспендировали в воде и к смеси добавляли уксусную кислоту и перемешивали. Суспензию фильтровали и осадок на фильтре промывали водой.
Влажное твердое вещество повторно суспендировали в воде перемешивали, фильтровали и промывали водой.
Затем осадок на фильтре суспендировали в ДМАЦ (примерно 12,15 кг) и суспензию обезвоживали путем перегонки в вакууме.
Суспензию охлаждали до 5-10°C и в атмосфере азота медленно добавляли ХСК (примерно 1,54 кг) и температуру поддерживали равной ниже 15°C.
Раствор нагревали при 18-22°C в течение 1 ч и выдерживали в течение еще 1 ч, затем добавляли в реактор, содержащий предварительно приготовленный раствор Na2CO3 (примерно 2,27 кг) в воде (примерно 29,02 кг), поддерживая температуру равной ниже 30°C.
Раствор очищали на колонке Amberlite XAD 1600 (12,5 л) путем элюирования водой (87,5 л) и смесями вода/ацетон (125 л), обладающими уменьшающейся полярностью, от 95:5 до 70:30. Фракции, по данным ВЭЖХ обладающие достаточной чистотой, собирали и перегоняли в вакууме до получения необходимого состава (примерно 0,04 кг T3S /л суспензию).
Суспензию охлаждали до 40°C и добавляли этанол (примерно 5,22 кг), получая раствор.
Смесь охлаждали до 0°C в течение 2 ч, что приводило к осаждению, перемешивали в течение еще 1 ч и затем фильтровали. Осадок на фильтре промывали смесью этанол/вода при комнатной температуре.
Влажное твердое вещество сушили примерно при 40°C в вакууме.
Получали 0,98 кг чистой натриевой соли сульфата T3 (по данным ВЭЖХ площадь % >99%) в виде белого твердого вещества.
Суммарный выход T2 (в пересчете на безводное основание): 68,5%.
Пример 3. Приготовление таблетки T3S
Активное вещество, также в комбинации с различными количествами левотироксина, предварительно перемешивали в течение 15 мин с составляющим 50% количеством микрокристаллической целлюлозы.
К этой предварительно приготовленной смеси в указанном порядке добавляли следующие ингредиенты: глицериндибегенат, коллоидный гидратированный диоксид кремния, натриевую соль кроскармеллозы, стеарат магния и карбонат кальция (предварительно просеянный через чистое прозрачное сито с отверстиями размером 0,6 мм) вместе с оставшимися 50% микрокристаллической целлюлозы и перемешивали в течение еще 20 мин.
Равномерность распределения активного вещества в смеси проверяли путем отбора проб из 6 положений смесителя; исследование показало, что активное вещество (или активные вещества) равномерно распределено в смеси, также и в случае препарата с левотироксином.
Затем порошкообразную смесь прессовали с помощью ротационного таблетирующего пресса, снабженного плоским круглым штампом, и для таблеток исследовали ломкость, времена распада и распределение активного вещества или веществ.
Результаты исследований смешивания и прессования подтвердили их воспроизводимость для доз T3S массой от 25 до 200 мкг. Кроме того, показано, что полученные таким образом таблетки характеризуются параметрами, соответствующими требованиям официальной Европейской Фармакопеи (VI издание).
Состав таблетки
Таблетки, приготовленные, как это описано выше, использовали в фазе I клинического исследования индивидуумов с удаленной щитовидной железой, и показано, что их можно использовать для заместительной терапии тиреоидного гормона (см. US 2011/0245342).
В действительности, показано, что T3S всасывается (преодолевает желудочно-кишечный барьер), обнаруживается в сыворотке после перорального введения и превращается в клинически активный T3 зависимым от дозы образом. Наличие T3 в сыворотке все еще обнаруживается через 48 ч после введения одной дозы.
Пример 4. Количественное определение T3S с помощью иммунологического анализа с детектированием по хемилюминесценции
Синтез производного T3S биотина
Вкратце, Производное T3S биотина синтезировали следующим образом: N-гидроксисукцинимидил-d-биотин-15-амидо-4,7,10,13-тетраоксапентадецилат A (50 мг; 0,0849 ммоля) солюбилизировали в ДМАЦ (2 мл), к которому добавляли ДИПЭА (N,N,N-диизопропилэтиламин) (14,5 мкл; 0,0866 ммоля) при непрерывном перемешивании реакционной смеси при 0°C. Затем добавляли T3S (68,4 мг; 0,0908 ммоля, полученный, как это описано в публикации Mol & Visser, Endocrinology 1985, 117:1-7), и через несколько минут суспензии давали нагреться до комнатной температуры и получали прозрачный раствор. Его перемешивали в течение 2 ч, затем выдерживали в течение ночи при такой же температуре. ДМАЦ выпаривали при пониженном давлении (10 мбар; 40°C) и получали бесцветное масло. Полученное таким образом неочищенное вещество растворяли в H2O и очищали с помощью полупрепаративной ВЭЖХ. Фракции, содержащие продукт, собирали, концентрировали и в заключение лиофилизировали и получали T3S-биотин в виде белого твердого вещества (59,6 мг; 0,0495 ммоля). Выход 58%.
Поликлональную антисыворотку к T3S получали в кроликах, как это описано в публикации Chopra et al., J. Clin. Endocrinol. Metab., 1992, 75: 189-194.
Анализ основан на конкурентном ELISA, в котором в белом 96-луночном планшете T3S в увеличивающихся количествах конкурирует за связывание с антителами с T3S, конъюгированном с биотином, использующемся в фиксированном количестве. Использование взаимодействия биотин-авидин, которое позволяет усиливать сигнал, вместе с люминесценцией, как средством образования сигнала, обеспечивает чувствительность, сравнимую с чувствительностью анализа RIA (описанного в публикации Chopra et al., J. Clin. Endocrinol. Metab., 1992, 75: 189-194).
Стандартные растворы T3S готовили при следующих концентрациях: 1000, 200, 40, 8, 1,6 пг/мл в буфере для разведения: ЗФФ (забуференный фосфатом физиологический раствор), 0,05% Tween, 0,3% БСА (бычий сывороточный альбумин).
Раствор индикатора (T3S-биотин, 180,6 мкМ) готовили в указанном выше буфере для разведения. Раствор антител: кроличью антисыворотку к T3S разводили в соотношении 1:50000 в буфере для разведения с добавлением 8 мМ АНС (1-анилино-8-нафталинсульфонат), 1,2 мг/мл салицилата натрия.
На белый 96-луночный планшет в течение ночи при 4°C наносили по 100 мкл/лунка 2 мкг/мл антикроличьего IgG, разведенного в фосфатном буфере, при pH 7,8. Одновременно стандартные растворы меченого биотином T3S объединяли с разведенной антисывороткой и раствором T3S-биотин, как это указано в таблице A. Смешанные образцы инкубировали в течение ночи при комнатной температуре в темноте. На следующий день планшет четырежды промывали промывочным буфером (0,05% Tween 20 в ЗФФ), затем инкубировали в блокирующем буфере (2% БСА в промывочном буфере) в течение 1 ч при комнатной температуре.
Затем планшет четырежды промывали промывочным буфером, в группы по 3 лунки добавляли по 100 мкл/лунка смешанных образцов и планшет инкубировали 3 ч при комнатной температуре.
Затем планшет трижды промывали промывочным буфером и инкубировали со стрептавидином-поли-HRP (10 нг/мл в RASA, 100 мкл/лунка) в течение 1 ч при комнатной температуре.
После еще 6 промывок планшет инкубировали с субстратом SuperSignal ELISA Femto Maximum Sensitivity Substrate (100 мкл/лунка) в течение 5 мин в темноте и испускаемое излучение считывали в виде количества импульсов в секунду (CPS) с помощью устройства считывания люминесценции планшетов.
Калибровочную кривую строили с использованием буфера с применением 5 концентраций исследуемого вещества в диапазоне 1,6-1000 пг/мл. Кривая приведена на фиг. 1, диаграмма a).
Пример 5. Количественное определение T3S с помощьюлантанидного флуоресцентного иммунологического анализа
Получение соединения формулы V:
[[3,5-дийод-N-[[(карбоксиметил)[2-[(карбоксиметил)[2-[бис(карбоксиметил)амино]этил]амино]этил]амино]ацетил]-O-[3-йод-4-(сульфоокси)фенил]-L-тирозинат(6-)]европиата(3-)] (формула V).
Синтез моноамида Eu-ДТПК-T3S
Схема реакции синтеза 3,5-дийод-N-[[(карбоксиметил)[2-[(карбоксиметил)[2-[бис(карбоксиметил)амино]этил]амино]этил]амино]ацетил]-O-[3-йод-4-(сульфоокси)фенил]-L-тирозина (моноамида ДТПК-T3S) приведена на фиг. 2.
Раствор H2O (0,282 мл; 15,64 ммоля) в ДМАЦ (43 мл) при комнатной температуре по каплям добавляли к суспензии N,N-бис[2-(2,6-диоксиленол оранжевый-4-морфолинил)этил]глицина A (4,27 г; 11,94 ммоля) в ДМАЦ (85 мл). После окончания добавления смесь нагревали при 80°C. Через 4,5 ч реакционную смесь охлаждали до 25°C и в течение 20 мин по каплям добавляли раствор T3S/1 (3 г; 3,98 ммоля) и ДИПЭА (2,71 мл; 15,92 ммоля) в ДМАЦ (85 мл). ДМАЦ выпаривали при пониженном давлении (10 мбар; 40°C). Маслообразный остаток разбавляли с помощью H2O (200 мл), что приводило к осаждению желтоватого твердого вещества, которое отфильтровывали, промывали с помощью H2O и сушили. Полученное таким образом неочищенное вещество растворяли в смеси ацетон/H2O 20:80 (об./об.), раствор (pH=2,97) загружали в колонку со смолой Amberlite® XAD-1600 (200 мл; диаметр 6 см) и элюировали смесью ацетон/H2O в градиентном режиме. Фракции, содержащие продукт, обладающие сходным составом, собирали и выпаривали и получали лиганд ДТПК-T3S в виде твердого вещества (1,27 г; 1,15 ммоля). Выход 26%.
Гексагидрат хлорида европия (0,17 г, 0,46 ммоля) порциями добавляли к раствору лиганда ДТПК-T3S (0,51 г; 0,46 ммоля) в H2O (50 мл) при 20°C (pH 2,93); после каждого добавления суспензию перемешивали до полного растворения. После завершения комплексообразования значение pH доводили до 7 с помощью 0,1 н NaOH и раствор обессоливали путем элюирования смесью вода/ацетон из колонки со смолой Amberlite® XAD-1600 (100 мл; диаметр 3 см). Фракции, содержащие искомый продукт и не содержащие солей, собирали и выпаривали и получали соединение формулы IV (0,37 г, 0,28 ммоля), желтое твердое вещество. Выход: 61%.
Методику иммунологического анализа разрабатывали в соответствии с публикацией: Hemmilä I et al. Anal Biochem. 1984 Mar;137(2): 335-43. Использовали растворы, описанные в примере 4, со следующими отличиями: промывочный раствор DELFIA® Wash (Perkin Elmer) использовали вместо указанного выше промывочного буфера. Исходный раствор индикатора содержал 100 мкМ европия и его хранили при +4°C в защищенном от света месте. Непосредственно перед использованием его разбавляли в отношении 1:300000 буфером для анализа с получением конечной концентрации, равной 440 пг/мл.
Анализ проводили в желтых планшетах DELFIA® (Perkin Elmer).
После инкубации в течение 3 ч со смешанными образцами во все лунки добавляли разведенный раствор соединения формулы V (50 мкл/лунка). Затем планшеты герметизировали липкими пластиковыми листами и при перемешивании инкубировали в течение 1 ч при 37°C.
После трех промывок планшеты путем постукивания высушивали на впитывающей бумаге и добавляли подкрепляющий раствор Delfia Enhancement (Perkin Elmer) (200 мкл). Через 1 ч при 25°C планшеты считывали с помощью считывающего устройства Victor3 в соответствии с методикой изготовителя "Europium".
Калибровочную кривую строили с использованием 9 концентраций исследуемого вещества в диапазоне 30-2000 пг/мл. Кривая приведена на фиг. 1, диаграмма b).
Пример 6. Синтез моноамида HRP-T3S
Конъюгат готовили с использованием имеющегося в продаже набора, содержащего активированный HRP (например, HOOK™ HRP PLUS Labeling Kit - G-Biosciences). 1-2 мг T3S растворяли в 1 мл входящего в набор карбонатного буфера, затем этот раствор подавали в сосуд, содержащий лиофилизированный активированный HRP, осторожно перемешивали путем повторяющегося набора всасывания и выпуска пипеткой для восстановления активированного фермента. Примерно через 1 ч при комнатной температуре добавляли 20 мкл входящего в набор раствора цианоборогидрида натрия (NaCNBH3), затем реакции давали протекать в течение примерно 15 мин при комнатной температуре. В заключение добавляли 50 мкл останавливающего буфера, затем инкубировали при осторожном взбалтывании или встряхивании в течение 15 мин. Конечный конъюгат обессоливали и буфер заменяли в ЗФФ путем диализа или обессоливания в колонке. Подходящие разведения конъюгата T3S-HRP получали и использовали в качестве индикатора для одностадийного ELISA, как описано в примере 4, исключая стадию инкубации с системой стрептавидин-HRP.

Сравнительный пример: Синтез T3S в ДМФ (диметилформамид) и исследования элюирования.

Реакцию проводили в ДМФ в соответствии с приведенной выше схемой.
Вкратце: T3 (40 мг) растворяли в насыщенном аммиаком этаноле
Этот раствор выпаривали в потоке азота.
К остатку добавляли 2 мл горячего раствора хлорсульфоновой кислоты (полученного смешиванием 2,5 мл 99% хлорсульфоновой кислоты и 8 мл N,N-ДМФ). Затем смеси при перемешивании давали охладиться до комнатной температуры и реакцию продолжали проводить в течение ночи.
Смесь разбавляли водой (5 мл) и затем элюировали на колонке с Sephadex LH-20 (5 мл) и получали фракцию A. Элюирование продолжали с помощью 0,1 н HCl (5 мл) и получали фракцию B.
Эти фракции повторно загружали в колонку и очищали с помощью серийно разведенной 0,1 н HCl (примерно 4 мл), воды и абсолютного этанола.
Однако для очистки использовать пять разных количеств воды и абсолютного этанола. Выходы T3S и чистота, обеспечиваемая при этих пяти условиях, представлены в таблице B.
В таблице B показано, что при проведении синтеза при описанных выше условиях и использовании ДМФ в качестве растворителя можно обеспечить высокую степень превращения, однако суммарный выход является довольно низким.
Реферат
Изобретение относится к нерадиоактивному конъюгату 3,5-дийод-O-[3-йод-4-(сульфоокси)фенил]-L-тирозин (TS), выбранному из группы, состоящей из:a) конъюгата TS-биотин формулы A’b) конъюгата TS-HRP (пероксидаза хрена) ис) хелатирующий агент TS-европий формулы VТехнический результат: получены новые конъюгаты 3,5-дийод-O-[3-йод-4-(сульфоокси)фенил]-L-тирозина для применения в нерадиоактивном иммунологическом анализе, предназначенные для определения TS и количественного определения TS. 2 з.п. ф-лы, 3 ил., 6 табл., 6 пр.
Формула



Комментарии