Быстродиспергирующаяся лекарственная форма, не содержащая желатин - RU2242968C2
Код документа: RU2242968C2
Описание
Область техники
Изобретение относится к фармацевтической композиции для перорального введения в виде быстродиспергирующейся лекарственной формы. Новая лекарственная форма по существу не содержит желатин млекопитающих и содержит, по меньшей мере, один агент, образующий матрицу (основу) и модифицированный лактозой крахмал.
Предпосылки создания изобретения
Наиболее распространенными фармацевтическими лекарственными формами являются таблетки. К основным недостаткам таблеток относится плохое соблюдение больными схемы приема лекарства из-за трудности глотания таблеток и плохая биодоступность активного компонента вследствие неэффективного растворения таблетки. Следовательно, в медицинском сообществе существует потребность в быстрорастворимых лекарственных формах. Для преодоления недостатков таблеток был использован ряд методик, включая создание шипучих таблеток, разжевываемых таблеток, использование диспергирующих агентов и агентов, увеличивающих впитываемость.
Недавно с использованием быстрорастворимых матриц на основе желатина были приготовлены быстродиспергирующиеся лекарственные формы, которые высвобождают активный ингредиент в ротовой полости. Эти лекарственные формы хорошо известны и могут быть использованы для доставки широкого круга лекарственных средств. В большинстве быстродиспергирующихся лекарственных форм используют желатин в качестве носителя или образующего структуру агента. Обычно желатин используют для придания достаточной прочности лекарственной форме, чтобы предупредить разрушение при извлечении из упаковки, но при попадании в рот желатин обеспечивает немедленное растворение лекарственной формы.
Желатин ВР (Британская фармакопея), который обычно применяется в таких препаратах, определяют как белок, полученный путем частичного гидролиза животных коллагеновых тканей, таких как кожа, сухожилия, связки и кости. Однако, полученный от млекопитающих желатин имеет слабый вкус и, следовательно, требует использования в таких быстродиспергирующихся лекарственных формах подслащивающих агентов и вкусовых веществ, чтобы скрыть вкус активного ингредиента. Когда обычный животный желатин используют при получении таких быстродиспергирующихся лекарственных форм, необходимо нагревать раствор желатина для того, чтобы содействовать растворению. Такая стадия нагревания увеличивает время технологического процесса и влечет за собой затраты на нагревание, увеличивая таким образом суммарную стоимость процесса.
Традиционные технологические процессы могут потребовать времени выдерживания до 48 часов. Установлено, что в течение этого времени вязкость смеси на основе желатина может увеличиться, приводя к технологическим проблемам. Кроме того, использование желатина млекопитающих дает лекарственные формы, которые легко абсорбируют воду, что может привести к усушке лекарственной формы в течение обычного периода хранения.
Другая известная проблема, связанная с быстрорастворимыми лекарственными формами на основе желатина, заключается в недостаточной гомогенности и седиментации жидкой смеси в течение периода выдерживания, так как некоторые смеси включают активное вещество в виде суспендированных частиц. Использование желатина, полученного из млекопитающих, приводит к осаждению активного ингредиента из-за низкой вязкости желатина, полученного из млекопитающих. Одно из преимуществ настоящего изобретения состоит в том, что с помощью описываемых модифицированных крахмалов в значительной степени преодолеваются проблемы гомогенности и седиментации, связанные с использованием желатина, полученного из млекопитающих.
Другое преимущество, связанное с использованием модифицированных крахмалов в рецептурах быстрорастворимых лекарственных форм, основано на открытии, что лекарственная форма с модифицированным крахмалом способна содержать более высокие лекарственные нагрузки. Это выгодно потому, что для данной дозы активного ингредиента лекарственная форма с модифицированным крахмалом может быть значительно меньше, чем обычная желатиновая лекарственная форма.
Были попытки использовать другие материалы вместо желатина в быстродиспергирующихся лекарственных формах, но, хотя они могут образовывать прочные продукты (пониженная склонность к образованию трещин и измельчению), они обычно медленно диспергируются или образуют во рту клейкую массу. В настоящее время установлено, что для приготовления быстродиспергирующихся лекарственных форм вместо желатина млекопитающих могут быть использованы модифицированные крахмалы.
Таким образом, настоящее изобретение предлагает фармацевтическую композицию для перорального введения в виде быстродиспергирующейся лекарственной формы для быстрого высвобождения активного ингредиента в ротовой полости, отличающуюся тем, что по существу не содержащая желатин композиция содержит модифицированный крахмал и, по меньшей мере, один агент, образующий матрицу.
Изобретение создает возможность уменьшения или предпочтительно исключения желатина из быстродиспергирующихся лекарственных форм (БДЛФ). Модифицированные крахмалы могут быть использованы в БДЛФ в качестве основного структурообразующего агента с образованием физически прочных продуктов, сохраняя при этом желаемые характеристики быстрого диспергирования продуктов. При соответствующем выборе модифицированного крахмала можно получать особенно желаемые свойства растворимости в холодной воде, отсутствие изменения вязкости раствора во времени, улучшенную стабильность и физическую прочность лекарственной формы. Применение модифицированного крахмала позволяет уменьшить или исключить содержание подслащивающих агентов/вкусовых веществ, которые ранее использовались для улучшения вкуса лекарственной формы. Использование материала ботанического происхождения вместо материала животного происхождения также дает положительный эффект за счет исключения воздействия таких агентов, как BSE.
Крахмал может быть рассмотрен как продукт полимерной конденсации глюкозы. Такие глюкозные составляющие присутствуют в виде ангидроглюкозных остатков (АГЗ). Если крахмал обработан или кислотами, или некоторыми ферментами, он может быть полностью разрушен за счет гидролиза гликозидных связей до его составляющих глюкозных звеньев. Большинство крахмалов состоит из двух типов полимеров глюкозы, каждый из которых имеет широкий интервал размеров молекул:
(i) молекула с линейной цепочкой, называемая амилозой, которая может содержать до 6000 звеньев глюкозы, связанных 1-4 связями, и
(ii) высоко разветвленный полимер, называемый амилопектином, состоящий из коротких цепочек (от 10 до 60 глюкозных звеньев), соединенных μ-1,6-связями.
Глюкозные звенья молекул крахмала содержат первичную гидроксильную группу на углероде-6 и вторичную гидроксильную группу на углероде-2 и углероде-3. Такие молекулы имеют множество гидроксильных групп, которые придают крахмалу гидрофильные свойства и приводят к диспергируемости крахмала при нагревании с водой. Однако эти гидроксильные группы также обладают тенденцией притягиваться друг к другу, образуя водородные связи между соседними молекулами крахмала и препятствуя растворению в холодной воде.
Природный крахмал может быть изменен с помощью физической, химической или ферментативной обработки с целью изменения его свойств или придания ему новых свойств. Свойства таких модифицированных крахмалов включают соотношения твердые компоненты-вязкость, характеристики желатинизации и варки, устойчивость к падению вязкости под действием кислот, нагревания и/или механического сдвига, ионный характер и гидрофильный характер.
Ряд модифицированных крахмалов является коммерчески доступным и полезным в настоящем изобретении, и включает:
Предварительно желатинизированные крахмалы, полученные сушкой в барабане или экструзией:
Низковязкие крахмалы, полученные контролируемым гидролизом гликозидных связей;
Декстрины, полученные прокаливанием сухого крахмала в присутствии небольшого количества кислоты;
Крахмалы, модифицированные кислотой, полученные суспендированием в разбавленной кислоте до достижения требуемой вязкости;
Окисленные крахмалы, когда окисляющие агенты вызывают введение карбонильных и карбоксильных групп с деполимеризацией, приводящей к пониженным способностям к ретроградации и желатинизации;
Ферментативно модифицированные крахмалы, полученные контролируемой ферментативной деструкцией для достижения требуемых физико-химических свойств;
Поперечно-сшитые крахмалы, когда би- или полифункциональные реагенты реагируют с гидроксильными группами для образования поперечных связей; примерами конкретных реагентов являются оксихлорид фосфора, триметафосфат натрия и эпихлоргидрин; и
Стабилизированные крахмалы, когда крахмалы реагируют с агентами простой или сложной этерификации в присутствии щелочного катализатора с образованием широкого спектра продуктов.
Уровень техники
В патенте США №5120549 описана быстродиспергирующаяся лекарственная форма, которая получена путем первичного отверждения образующей матрицу системы, диспергированной в первом растворителе, и последующего контактирования отвержденной матрицы со вторым растворителем, который по существу может смешиваться с первым растворителем при температуре, ниже температуры отверждения первого растворителя, причем образующие матрицу элементы и активный ингредиент по существу нерастворимы во втором растворителе, в результате чего первый растворитель по существу удаляется, давая быстродиспергирующуюся лекарственную форму.
В патенте США №5079018 описана быстродиспергирующаяся лекарственная форма, содержащая пористую скелетную структуру растворимых в воде, способных к гидратации геля или пенообразующего материала, которые были гидратированы водой, стали жесткими в гидратированном состоянии с помощью усилителя жесткости и дегидратированы жидким органическим растворителем при температуре приблизительно 0°С или ниже, чтобы оставить промежутки вместо гидратирующей жидкости.
В публикации международной заявки № WO 93/12769 (PCT/JP 93/01631) описаны быстродиспергируемые лекарственные формы очень низкой плотности, полученные желатинизацией с агаром, водными системами, содержащими образующие матрицу элементы и активным ингредиентом, а затем удалением воды воздухом под давлением или вакуумной сушкой.
В патенте США №5298261 раскрыта быстродиспергирующаяся лекарственная форма, содержащая частично “схлопнувшуюся” матричную структуру, которая была подвергнута вакуумной сушке при температуре выше температуры схлопывания матрицы. Однако предпочтительно матрица, по меньшей мере, частично высушена при температуре ниже температуры полного замерзания матрицы.
Опубликованная международная заявка № WO 91/04757 (PCT/US 90/05206) раскрывает быстродиспергирующиеся лекарственные формы, которые содержат шипучий диспергирующий агент, приготовленный таким образом, что он вспенивается при контакте со слюной, обеспечивая быстрое диспергирование лекарственной формы и образование дисперсии активного ингредиента в ротовой полости.
В патенте США №5595761 для использования при изготовлении быстрорастворимой таблетки предложена поддерживающая матрица в форме частиц, содержащая:
первый полипептидный компонент, имеющий полный заряд, когда он находится в растворе, например, негидролизованный желатин;
второй полипептидный компонент, имеющий полный заряд того же знака, что и полный заряд первого полипептидного компонента, когда он находится в растворе, например, гидролизованный желатин; и
наполнитель, и где первый полипептидный компонент и второй полипептидный компонент вместе составляют приблизительно от 2 до 20% масс. поддерживающей матрицы в форме частиц и где наполнитель составляет приблизительно от 60 до 96% масс. поддерживающей матрицы в форме частиц; и
где второй полипептидный компонент имеет растворимость в водном растворе больше, чем растворимость первого полипептидного компонента, и где масса (массовое отношение первого полипептидного компонента ко второму полипептидному компоненту) составляет приблизительно от 2:1 до 1:14; и
где, когда поддерживающую матрицу вводят в водную окружающую среду, поддерживающая матрица распадается в пределах менее чем 20 секунд.
В публикации ЕР-В-0690747 описаны частицы, содержащие наполнитель, образующий матрицу, и, по меньшей мере, один активный ингредиент, равномерно распределенный в массе матрицы, которые получены способом, включающем стадии получения гомогенной пастообразной смеси с вязкостью ниже 1 Па· сек, измеренной при комнатной температуре (15-20°С), из, по меньшей мере, одного активного ингредиента, физиологически приемлемого гидрофильного наполнителя и воды; экструдирования полученной гомогенной смеси и разрезания экструдата с получением влажных частиц; замораживания полученных частиц по мере их опускания под действием силы тяжести через поток инертного газа при температуре ниже 0°С; и сушки частиц путем вымораживания.
Австралийский патент №666666 описывает таблетку из множества частиц, содержащую смесь наполнителей, в которой активное вещество присутствует в форме микрокристаллов с покрытием или необязательно микрогранул с покрытием. Такие таблетки распадаются во рту за исключительно короткое время, обычно менее чем за 60 секунд.
В патенте США №5382437 описан пористый несущий материал, имеющий достаточную жесткость для перенесения и введения активного материала, который способен быстро растворяться слюной и который получен замораживанием раствора сжиженного аммиака, содержащего жидкий аммиак, растворимый в жидком аммиаке гель или вспененный материал и усилитель жесткости для геля или вспененного материала, выбранный из группы, включающей моносахарид, полисахарид или их сочетание, и деаммонизацией полученного таким способом замороженного материала за счет того, что материал заставляют переводить аммиак из замороженного состояния в газ, оставляя посредством этого промежутки в несущем материале вместо замороженного аммиака.
Опубликованная международная заявка № WO 93/13758 (PCT/US 92/07497) описывает таблетки с повышенной физической прочностью, которые получены путем смешения и прессования способного плавиться связующего вещества, наполнителей и фармацевтически активного агента в таблетку, плавлением связующего вещества в таблетке с последующим отверждением связующего вещества. В одном из вариантов изобретения используется диспергирующий агент для повышения скорости диспергирования таблетки после перорального приема. В другом варианте используется летучий компонент с образованием пористой таблетки. Некоторые варианты изобретения распадаются во рту менее чем за 10 секунд.
В патентах США №№3885026 и 4134943 также описаны быстродиспергирующиеся пористые таблетки и способ повышения их физической прочности путем первоначального прессования таблетки, а затем испарения легколетучего твердого адъюванта, введенного в таблетку для достижения желаемой пористости.
Опубликованная международная заявка № WO 94/14422 описывает способ сушки замороженных дискретных элементов, в котором растворитель удаляют при условиях, когда растворитель испаряется из твердого вещества через жидкую фазу до газа, а не путем сублимации из твердого состояния до газа как при лиофилизации. Это достигается вакуумной сушкой при температуре ниже точки полного замораживания композиции, при которой растворитель (такой как вода) меняет фазу.
Публикация ЕР-0693281 (Lilly S.A.) относится к фармацевтическим препаратам флуоксетина или его кислотно-аддитивных солей, которые помещены в диспергируемые таблетки путем прямого прессования. Эта ссылка фактически раскрывает применение натриевой соли гликолата крахмала в качестве диспергирующего агента. Натриевая соль гликолата крахмала используется в этой работе в концентрациях, превышающих 5% масс., предпочтительно в концентрациях между 9,5 и 17% масс. В этой ссылке фактически не раскрываются быстродиспергирующаяся твердая лекарственная форма, которая содержит, по меньшей мере, 20% масс., по меньшей мере, одного модифицированного крахмала, и способ получения лекарственной формы, в котором растворитель удаляют из смеси, содержащей активный ингредиент, модифицированный крахмал и образующий матрицу агент.
Публикация ЕР-0599767 относится к методике получения диспергируемых таблеток Диклофенака. Методика отличается прессованием смеси, содержащей гранулы, включающие гидрофильное смазывающее вещество и дезинтегрирующий агент, активный ингредиент и другие наполнители. Наполнители представляют собой микрокристаллическую целлюлозу, кукурузный крахмал и лактозу. Примеры также указывают на использование карбоксиметилкрахмала. Эта ссылка не предполагает и не раскрывает быстродиспергирующуюся лекарственную форму, которая содержит, по меньшей мере, один активный ингредиент, по меньшей мере, один модифицированный крахмал в концентрации от 20 до 90% масс. из расчета на твердую лекарственную форму и, по меньшей мере, один образующий матрицу агент. Кроме того, способ, описанный в этой ссылке, отличается от способа получения твердой лекарственной формы данного изобретения, где растворитель удаляют из смеси путем сушки вымораживанием.
Публикация ЕР-0159631 (National Starch & Chemical Corporation) относится к прессуемым крахмалам в качестве связующих веществ для таблеток или капсул. В этой ссылке раскрывается ряд химически модифицированных крахмалов, которые подходят для использования в качестве связующих веществ при операциях таблетирования, особенно при прямом прессовании, и которые, вероятно, полезны как связующие вещества, разбавители и т.д. при наполнении капсул. В этой ссылке фактически не предполагается или не раскрывается использование таких модифицированных крахмалов в быстродиспергирующихся твердых лекарственных формах, которые могут быть получены путем удаления растворителя из смеси, содержащей активный ингредиент, модифицированный крахмал и образующий матрицу агент.
Публикация GB-2172006 относится к наполнителям для применения при прямом прессовании таблеток. Эта ссылка раскрывает наполнители, которые получают диспергированием целлюлозного порошка и порошка гидроксипропилкрахмала в водном растворе и последующей распылительной сушкой дисперсии. Этот препарат описан как полезный при прямом прессовании таблеток. При этом не предложена или не описана быстродиспергирующаяся твердая лекарственная форма, которая содержит, по меньшей мере, один модифицированный крахмал в концентрациях от 20 до 90% масс. из расчета на лекарственную форму, и где лекарственную форму получают путем удаления растворителя из смеси, содержащей активный ингредиент, модифицированный крахмал и образующий матрицу агент.
Патент США №5629003 (Horstmann et al.) относится к быстродиспергирующимся пластиноподобным препаратам, которые содержат от 20 до 60%, по меньшей мере, одного пленкообразующего агента, то есть маннита, от 2 до 40% масс., по меньшей мере, одного гелеобразующего агента, то есть модифицированного крахмала, активное вещество и до 40% масс., по меньшей мере, одного инертного наполнителя. Продукт, полученный в патенте, распределяют на обработанной силиконом бумаге и сушат при 80°С в течение 15 минут. В этой работе не подразумевается или не раскрывается быстродиспергирующаяся твердая лекарственная форма, которая содержит, по меньшей мере, один модифицированный крахмал в концентрации от 20 до 90% масс. из расчета на лекарственную форму, и где твердую дозированную лекарственную форму получают путем удаления растворителя из смеси, содержащей активный ингредиент, модифицированный крахмал и образующий матрицу агент.
Реферат в Chemical Abstracts под названием “Preparation of Emulsifying Agents for Pharmaceuticals, Cosmetics and Foods”, Vol.110, №10, Abstract №82495, раскрывает модифицированные крахмалы в качестве эмульгирующего агента в фармацевтических препаратах. В этой работе не подразумевается или не раскрывается быстродиспергирующаяся твердая лекарственная форма, которая содержит, по меньшей мере, один модифицированный крахмал в концентрации от 20 до 90% масс. из расчета на лекарственную форму, и где твердую лекарственную форму получают путем удаления растворителя из смеси, содержащей активный ингредиент, модифицированный крахмал и образующий матрицу агент.
Сущность изобретения
В изобретении раскрыта быстродиспергирующаяся твердая лекарственная форма, созданная для быстрого высвобождения активного ингредиента в ротовой полости, отличающаяся тем, что указанная твердая лекарственная форма по существу не содержит желатина млекопитающих и содержит:
по меньшей мере, один активный ингредиент;
по меньшей мере, один модифицированный крахмал в концентрации от 20 до 90% масс. из расчета на указанную твердую лекарственную форму; и
по меньшей мере, один образующий матрицу агент,
где указанная твердая лекарственная форма получена путем удаления растворителя из смеси, содержащей указанный активный ингредиент, указанный модифицированный крахмал и указанный образующий матрицу агент.
В одном из вариантов осуществления изобретения твердая лекарственная форма содержит, по меньшей мере, один модифицированный крахмал, выбранный из группы, включающей крахмалы, гидроксильные группы которых эстерифицированы, гидроксипропил-дикрахмалфосфат, ферментативно модифицированный крахмал, предварительно желатинизированный дикрахмалфосфат, гидроксиэтилкрахмал и предварительно желатинизированный очищенный крахмал.
В предпочтительном варианте осуществления изобретения твердая лекарственная форма в соответствии с настоящим изобретением содержит от 50 до 90% масс. модифицированного крахмала.
Хотя представлено много конкретных примеров полезных модифицированных крахмалов, их общая характеристика в быстродиспергирующейся твердой лекарственной форме настоящего изобретения состоит в том, что они легко растворимы или диспергируемы в воде при обычной температуре. Другой положительный эффект, связанный с модифицированными крахмалами, полезными в настоящем изобретении, состоит в том, что смесь активного ингредиента, модифицированного крахмала и образующего матрицу агента имеет фактически постоянную вязкость в течение приблизительно 24 часов. Предпочтительным растворителем в соответствии с настоящим изобретением является вода. Предпочтительным образующим матрицу агентом является маннит.
Быстродиспергирующиеся твердые лекарственные формы в соответствии с настоящим изобретением также могут содержать красящие агенты, агенты, улучшающие вкус и запах (корригенты), наполнители, множество терапевтических агентов и т.д. В одном из вариантов осуществления изобретения удаление растворителя из смеси предпочтительно осуществляют путем сушки вымораживанием.
Подробное описание изобретения
Используемое в описании и в формуле изобретения определение “быстродиспергирующаяся лекарственная форма (БДЛФ)” относится к композициям, которые при попадании в ротовую полость распадаются/диспергируются в пределах от 1 до 60 секунд, предпочтительно от 1 до 30 секунд, более предпочтительно от 1 до 10 секунд и в особенности от 2 до 8 секунд. Лекарственная форма настоящего изобретения аналогична лекарственной форме, описанной в Британском патенте №1548022, то есть твердой быстродиспергирующейся лекарственной форме, содержащей сетчатую структуру активного ингредиента и растворимого в воде или диспергируемого в воде носителя, который инертен по отношению к активному ингредиенту, причем сетчатая структура получена путем сублимации растворителя из композиции в твердом состоянии, и эта композиция содержит активный ингредиент и раствор носителя в растворителе. Отличие состоит в том, что в качестве носителя используется модифицированный крахмал вместо обычного желатина, полученного из млекопитающих.
Быстродиспергирующаяся лекарственная форма в соответствии с настоящим изобретением также может содержать, помимо активного ингредиента и модифицированного крахмала, другие образующие матрицу агенты и вторичные компоненты. Образующие матрицу агенты, подходящие для использования в настоящем изобретении, включают материалы, полученные из животных или растительных протеинов, такие как желатины, полученные не от млекопитающих, декстрины и протеины семян сои, пшеницы и psyllium; камеди, такие как аравийская камедь, кизельгур, агар и ксантан; полисахариды; альгинаты; карбоксиметилцеллюлозы; каррагенаны; декстраны; пектины; синтетические полимеры, такие как поливинилпирролидон; и полипептид/протеиновые или полисахаридные комплексы, такие как комплексы желатин-аравийская камедь.
Образующие матрицу агенты, подходящие для применения в настоящем изобретении, включают сахара, такие как маннит, декстроза, лактоза, галактоза и трегалоза; циклические сахара, такие как циклодекстрин; неорганические соли, такие как фосфат натрия, хлорид натрия и алюмосиликаты; и аминокислоты, содержащие от 2 до 12 атомов углерода, такие как глицин, L-аланин, L-аспарагиновая кислота, L-глутаминовая кислота, L-гидрокси-пролин, L-изолейцин, L-лейцин и L-фенилаланин.
Один или более образующих матрицу агентов могут быть введены в раствор или в суспензию до отверждения. Образующий матрицу агент может присутствовать в дополнение к поверхностно-активному веществу или вместо поверхностно-активного вещества. Помимо образования матрицы образующий матрицу агент может способствовать сохранению дисперсии любого активного ингредиента в пределах раствора, суспензии или смеси. Это особенно полезно в случае активных ингредиентов, которые незначительно растворимы в воде, и поэтому должны быть суспендированы, а не растворены.
Вторичные компоненты, такие как консерванты, антиоксиданты, поверхностно-активные вещества, агенты, повышающие вязкость, красящие агенты, корригенты, рН-модификаторы, подслащивающие агенты или агенты, маскирующие вкус, могут быть также введены в композицию. Подходящими красящими агентами являются красный, черный и желтый оксиды железа и красители FD & С, такие как FD & С Голубой №2 и FD & С Красный №40. Подходящими вкусовыми ароматизирующими веществами являются мятная, малиновая, солодковая, апельсиновая, лимонная, грейпфрутовая, карамельная, ванилиновая, вишневая и виноградная вкусовая ароматизирующая добавка и их комбинации. Подходящими рН-модификаторами являются лимонная кислота, винная кислота, фосфорная кислота, соляная кислота, малеиновая кислота и гидроксид натрия. Подходящими подслащивающими агентами являются аспартам, ацесульфам К и тауматин. Подходящими маскирующими вкус агентами являются бикарбонат натрия, ионообменные смолы, соединения включения циклодекстрина, адсорбенты или микрокапсулированные активные соединения.
В общем случае модифицированный крахмал будет составлять от 5 до 99,5% масс. твердых компонентов БДЛФ, нормально от 20 до 90%, обычно от 50 до 90%.
Любое лекарственное средство может быть использовано в качестве активного ингредиента в композиции настоящего изобретения. Примерами подходящих лекарственных средств являются, но не ограничиваются только ими, лекарственные средства, перечисленные ниже:
Анальгетики и противовоспалительные агенты: алоксиприн, ауранофин, азапропазон, бенорулат, дифлунизал, этодолак, фенбуфен, фенопрофен-кальций, флурбипрофен, ибупрофен, индометацин, кетопрофен, меклофенаминовая кислота, мефенаминовая кислота, набуметон, напроксен, оксапрозин, оксифенбутазон, фенилбутазон, пироксикам, сулиндак.
Антигельминты; албендазол, бефениум гидроксинафтоат, камбендазол, дихлорофен, ивермектин, мебендазол, оксамниквин, оксфендазол, оксантел эмбонат, празиквантел, пирантел эмбонат, тиабендазол.
Антиаритмические агенты: амиодарон-HCl, дизопирамид, флекаинид ацетат, хинидин сульфат.
Антибактериальные агенты: бенетамин пенициллин, циноксацин, ципрофлоксацин-HCl, кларитромицин, клофазимин, клоксациллин, демеклоциклин, доксициклин, эритромицин, этионамид, имипенем, налидиксиловая кислота, нитрофурантоин, рифампицин, спирамицин, сульфабензамид, сульфадоксин, сульфамеразин, сульфацетамид, сульфадиазин, сульфафуразол, сульфаметоксазол, сульфапиридин, тетрациклин, триметоприм.
Антикоагулянты: дикумарол, дипиридамол, никумалон, фениндион.
Антидепрессанты: амоксапин, циклазиндол, мапротилин-HCl, миансерин-HCl, нортриптилин-HCl, тразодон-HCl, тримипрамин малеат.
Антидиабетические средства: ацетогексамид, хлорпропамид, глибенкламид, гликлазид, глипизид, толазамид, толбутамид.
Антиэпилептические средства: бекламид, карбамазепин, клоназепам, этотоин, метоин, метсуксимид, метилфенобарбитон, окскарбазепин, параметадион, фенацемид, фенобарбитон, фенитоин, фенсуксимид, примидон, султиам, валпроиновая кислота.
Противогрибковые агенты: амфотерицин, бутоконазол нитрат, клотримазол, эконазол нитрат, флуконазол, флуцитозин, гризеофульвин, итраконазол, кетоконазол, миконазол, натамицин, нистатин, сулконазол нитрат, тербинафин-HCl, терконазол, тиоконазол, ундеценовая кислота.
Агенты против подагры: аллопуринол, пробенецид, сулфинпиразон.
Гипотензивные агенты: амлодипин, бенидипин, дародипин, дилтиазем-HCl, диазоксид, фелодипин, гуанабензацетат, индорамин, израдипин, миноксидил, никардипин-HCl, нифедипин, нимодипин, феноксибензамин-HCl, празозин-HCl, резерпин, теразозин-НСl.
Противомалярийные агенты: амодиаквин, хлороквин, хлорпрогуанил-HCl, галофантрин-HCl, мефлоквин-НСl, прогуанил-HCl, пириметамин, хининсульфат.
Противомигреневые агенты: дигидроэрготамин мезилат, эрготамин тартрат, метисергид малеат, пизотифен малеат, суматриптан сукцинат.
Противомускариновые агенты: атропин, бензгексол-HCl, бипериден, этопропазин-HCl, гиосцинбутилбромид, гиосцинамин, мепензолатбромид, орфенадрин, оксифенцилцимин-HCl, тропикамид.
Противоопухолевые агенты и иммунодепрессанты: аминоглутетимид, амсакрин, азатиоприн, бусульфан, хлорамбуцил, циклоспорин, дакарбазин, эстрамустин, этопозид, ломустин, мелфалан, меркаптопурин, метотрексат, митомицин, митотан, митозантрон, прокарбазин-HCl, тамоксифен цитрат, тестолактон.
Антипротозойные агенты: бензнидазол, клиохинол, декохинат, дийодгидроксихинолин, дилоксанид фуроат, динитолмид, фурзолидон, метронидазол, ниморазол, нитрофуразон, орнидазол, тинидазол.
Антитироидные агенты: карбимазол, пропилтиоурацил.
Анксиолитики, седативные, снотворные и успокаивающие агенты: алпразолам, амилобарбитон, барбитон, бентазепам, бромазепам, бромперидол, бротизолам, бутобарбитон, карбромал, хлордиазепоксид, хлорметиазол, хлорпромазин, клобазам, клотиазепам, клозапин, диазепам, дроперидол, этинамат, флунанизон, флунитразепам, флуопромазин, флупентиксол деканоат, флуфеназин деканоат, флуразепам, галоперидол, лоразепам, лорметазепам, медазепам, мепробамат, метаквалон, мидазолам, нитразепам, оксазепам, пентобарбитон, перфеназин пимозид, прохлорперазин, сульпирид, темазепам, тиоридазин, триазолам, зопиклон.
β-Блокаторы: ацебутолол, алпренолол, атенолол, лабеталол, метопролол, надолол, окспренолол, пиндолол, пропранолол.
Сердечные инотропные агенты: амринон, дигитоксин, дигоксин, эноксимон, ланатозид С, медигоксин.
Кортикостероиды: беклометазон, бетаметазон, будезонид, кортизон ацетат, дезоксиметазон, дексаметазон, флудрокортизон ацетат, флунизолид, флукортолон, флутиказон пропионат, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон.
Диуретики: ацетазоламид, амилорид, бендрофлуазид, буметанид, хлортиазид, хлорталидон, этакриновая кислота, фуросемид, метолазон, спиронолактон, триамтерен.
Ферменты
Агенты против паркинсонизма: бромокриптин мезилат, лизурид малеат.
Желудочно-кишечные агенты: бисакодил, циметидин, цизаприд, дифеноксилат-HCl, домперидон, фамотидин, лоперамид, мезалазин, низатидин, омепразол, онданзетрон-HCl, ранитидин-НСl, сульфазалазин.
Антагонисты Н, -рецептора гистамина: акривастин, азтемизол, циннаризин, циклизин, ципрогептадин-HCl, дименгидринат, флунаризин-HCl, лоратадин, меклозин-HCl, оксатомид, терфенадин, трипролидин.
Агенты, регулирующие липидный обмен: безафибрат, клофибрат, фенофибрат, гемфиброзил, пробукол.
Местные анестезирующие агенты:
Нервно-мышечные агенты: пиридостигмин.
Нитраты и другие агенты против стенокардии: амилнитрат, тринитроглицерин, изосорбид динитрат, изосорбид мононитрат, пентаэритрит тетранитрат.
Питательные агенты: бета-каротин, витамин А, витамин В2, витамин Д, витамин Е, витамин К.
Наркотические анальгетики: кодеин, декстропропиоксифен, диаморфин, дигидрокодеин, мептазинол, метадон, морфин, налбуфин, пентазоцин.
Пероральные вакцины:
Вакцины, созданные для предупреждения или ослабления симптомов заболеваний, из которых следующие являются типичными, но не исключительными:
грипп, туберкулез, менингит, гепатит, коклюш, полиомиелит, столбняк, дифтерия, малярия, холера, герпес, брюшной тиф, ВИЧ, СПИД, корь, болезнь Луме, Travellers' диарея, гепатит А, В и С, воспаление среднего уха, лихорадка Денге, бешенство, парагрипп, краснуха, желтая лихорадка, дизентерия, болезнь легионеров, токсоплазмоз, Q-лихорадка, геморрагическая лихорадка, аргентинская геморрагическая лихорадка, кариес, болезнь Шагаса, инфекция мочевых путей, вызванная Е. coli, пневмококковое заболевание, свинка и чикунгунья (лихорадка).
Вакцины для предупреждения или ослабления симптомов других болезненных синдромов, для которых перечислены типичные, но не исключительные, патогенные микроорганизмы:
Vibrio species. Salmonella species, Bordetella species, Haemophilus species, Toxoplasmosis gondii, Cytomegalovirus, Chlamydia species, Streptococcal species, Norwalk Virus, Escherischia coli, Helicobacter pylori, Rotavirus, Neisseria gonorrhae, Neisseria meningiditis, аденовирус, вирус Епштейна-Барра, вирус японского энцефалита, Pneumocystic carini, вирус герпеса простого, Clostridia species, респираторно-синцитиальный вирус, Klebsielia species, Shigella species, Pseudominas aeruginosa, парвовирус, Campylobacter species, риккетсии, Varicella zoster, Yersinia species, вирус Ross River, вирус J.C., Rhodococcus equi, Moraxella catarrhalis, Borrelia burgdorferi и Pasteurella haemolytica.
Вакцины, относящиеся к неинфекционным иммуномодулируемым болезненным состояниям, таким как местные и системные аллергические состояния, такие как полиноз, астма, ревматридный артрит и карциномы.
Вакцины для ветеринарного применения, которые нацелены на коксидиоз, болезнь Ньюкасла, энзоотическую пневмонию, лейкемию Feline, атрофический ринит, рожистое воспаление, заболевания ног и ротовой полости, свинка, пневмония и другие болезненные состояния и другие инфекции и болезненные аутоиммунные состояния у домашних и хозяйственных животных.
Протеины, пептиды и рекомбинантные лекарственные средства: инсулин (гексамерная/димерная/мономерная формы), глюкагон, ростовой гормон (соматотропин), полипептиды или их производные (предпочтительно с молекулярным весом от 1000 до 300000), кальцитонины и их синтетические модификации, энкефалины, интерферон (особенно альфа-2-интерферон для лечения обычных простуд), LHRH и аналоги (нафарелин, бузерелин, золидекс), GHRH (рилизинг-гормон гормона роста), секретин, антагонисты брадикина, GRF (ростовой рилизинг-фактор), THF, TRH (тиреотропин, высвобождающий гормон), АСТН-аналоги, IGF (инсулиноподобный фактор роста), CGRP (пептид, связанный с геном кальцитонина), атриальный natriurectic пептид, вазопрессин и его аналоги (DDAVP, липрессин), фактор VIII, G-CSF (гранулоцит-колониестимулирующий фактор), ЕРО (эритропоитин).
Половые гормоны: кломифен цитрат, даназол, этинилэстрадиол, медроксипрогестерон ацетат, местранол, метилтестостерон, норэтистерон, норгестрел, эстрадиол, конъюгированные эстрогены, прогестерон, станозолол, стибоэстрол, тестостерон, тиболон.
Средства, разрушающие сперматозоиды: ноноксинол 9.
Стимуляторы: амфетамин, дексамфетамин, дексфенфлурамин, фенфлурамин, мазиндол, пемолин.
Точное количество активного ингредиента будет зависеть от выбранного лекарственного средства. Однако активный ингредиент в общем случае присутствует в количестве от 0,2 до 95% масс., обычно от 1 до 20% масс. от общей массы композиции высушенной лекарственной формы.
Изобретение дополнительно иллюстрируется следующими примерами, которые являются иллюстративными и не ограничивают изобретение. В следующих примерах БДЛФ получены и испытаны в отсутствие активного ингредиента.

Amylogum CLS представляет собой крахмал, в котором гидроксильные группы этерифицированы. Он является коммерчески доступным продуктом компании Avebe U.K., Ltd., South Huberside, Англия. Маннит поставляет компания Roquette Ltd., Kent, Англия.
Крахмал добавляют к очищенной воде и нагревают до 60°С при перемешивании. Полученную смесь выдерживают при 60°С в течение 10 минут для растворения и затем охлаждают до комнатной температуры. После достаточного охлаждения смеси добавляют маннит и перемешивают до полного растворения. Смесь дозируют в блистерные упаковки из ПВХ/ПВДХ (PVC/PVdC) с массой заполнения 500 мг. Полученные элементы замораживают в токе холодного газообразного азота и затем сушат, постепенно поднимая температуру от -10°С до +20°С при давлении 0,5 мбар.

Perfectagel MPT представляет собой фосфат гидроксипропилдикрахмала и является коммерчески доступным продуктом компании Avebe U.K., Ltd.

Paselli MD10 представляет собой ферментативно модифицированный крахмал и является коммерчески доступным продуктом компании Avebe U.K., Ltd.
Воду перемешивают при помощи ручного электрического миксера и при перемешивании добавляют крахмал и маннит. Для данного крахмала не требуется нагрева. Раствор перемешивают 1/5 часа для достижения равновесия.
Диспергирование лекарственных форм во рту происходит мягко и быстро, и они имеют сладкий вкус.

Avebe MD20 представляет собой ферментативно модифицированный крахмал и является коммерчески доступным продуктом компании Avebe U.K., Ltd.
Лекарственные формы примеров 1-4 обеспечивают быстрое диспергирование во рту менее чем 10 секунд.

Используемые модифицированные крахмалы:
Paselli Easygel, который представляет собой предварительно желатинизированный дикрахмалфосфат.
Paselli ВС, который представляет собой предварительно желатинизированный ацетилированный дикрахмалфосфат.
Paselli WA4, который представляет собой предварительно желатинизированный очищенный крахмал.
Все эти модифицированные крахмалы являются коммерчески доступными продуктами фирмы Avebe, U.K., Ltd.
Порошки смешивают сухим способом и добавляют в воронку перемешиваемой очищенной воды. Затем смеси нагревают до 50°С и гомогенизируют с помощью Silverson L4R (небольшой головной адаптер). Загрузкам дают охладиться до температуры окружающей среды при непрерывном перемешивании. Измерения вязкости проводят через 1-3 часа перемешивания и через 22 часа с использованием вискозиметра Хаака при 500 сек-1.
Результаты:

Не наблюдается значительного изменения вязкости в течение 22-часового периода. Такое свойство является очень желательным при получении БДЛФ. Такое свойство улучшает эффективность получения и снижает потери из-за отходов.
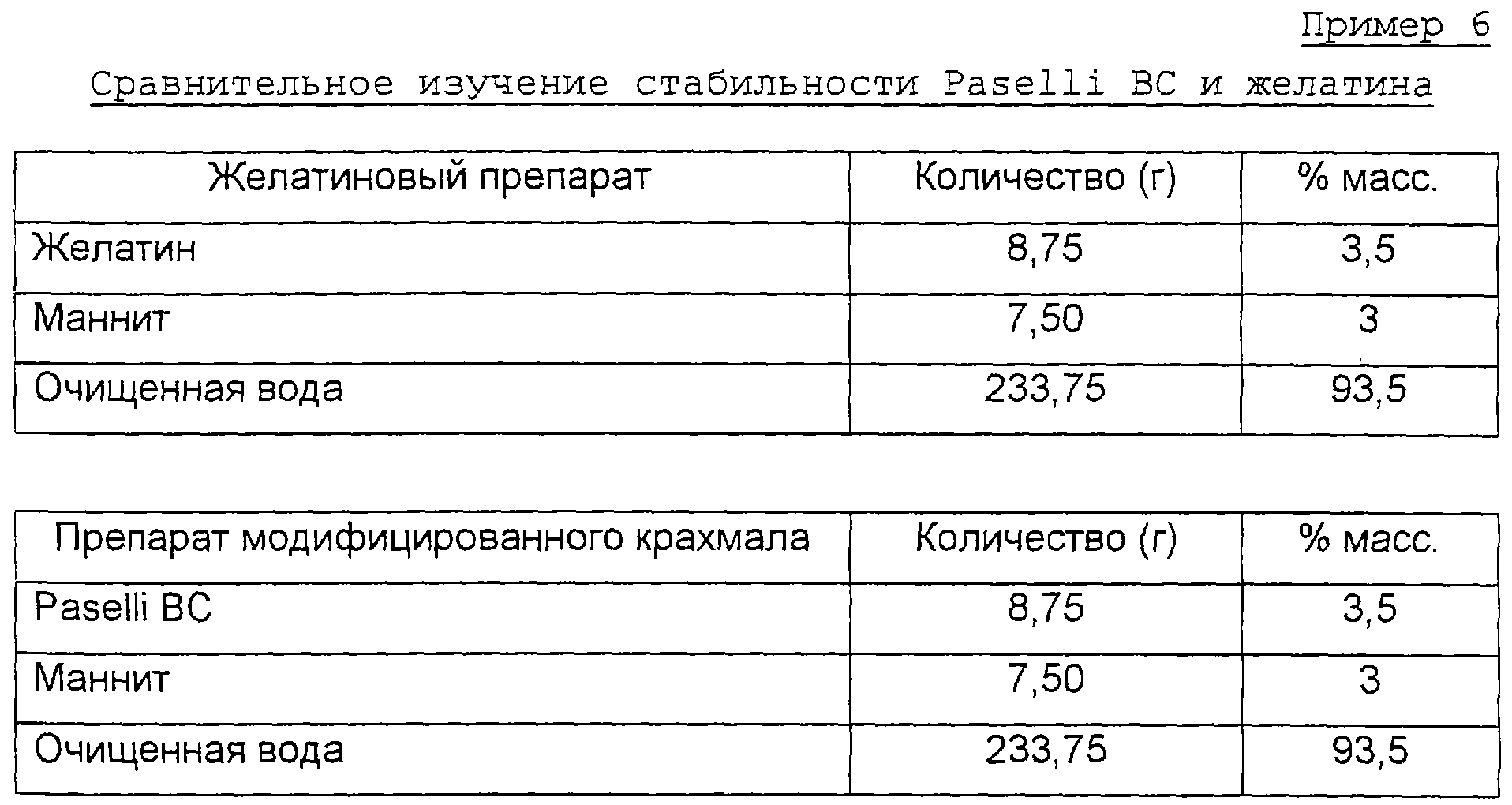
Paselli ВС представляет собой предварительно желатинизированный ацетилированный дикрахмалфосфат, коммерчески доступный продукт фирмы Croda Colloids, Ltd., Cheshire, Англия.
Желатиновый препарат
Желатин и маннит добавляют в воронку перемешиваемой очищенной воды и нагревают до 60°С для растворения. Затем до дозирования смесь охлаждают до 25°С.
Препарат модифицированного крахмала
Маннит и Paselli ВС смешивают сухими и затем постепенно добавляют в воронку перемешиваемой очищенной воды при обычной температуре. Полученную смесь затем гомогенизируют с использованием Silverson L4R (небольшой головной адаптер) в течение приблизительно 1 минуты.
Смеси дозируют в блистерные упаковки из ПВХ/ПВДХ, диаметр 16 мм, масса заполнения 500 мг, с использованием программируемого дозирующего устройства Hamilton Microlab M. Блистерные упаковки замораживают в токе холодного газообразного азота перед сушкой вымораживанием путем постепенного повышения температуры от -10 до +20°С при давлении 0,5 мбар.
Элементы помещают, незакрытыми, в камеры со стабильными условиями 40°С и относительной влажностью 75% на 20 часов, определяя после этого времени диаметр элементов.
Результаты:

Можно заметить, что БДЛФ, в которых используется модифицированный крахмал, имеют 50%-ное уменьшение усадки в сравнении с обычными БДЛФ, содержащими желатин. Это представляет собой неожиданный и удивительный результат.
Пример 7
Сравнительный - желатиновая БДЛФ относительно БДЛФ с модифицированным крахмалом
В статье под названием “Drug Delivery Products and Zydis Fast Dissolving Dosage Form” (H. Seagers et al., J. Pharm Pharmacol., 1998) обсуждаются проблемы, связанные с высоко растворимыми в воде лекарствами в БДЛФ. Zydis® представляет собой зарегистрированный товарный знак R.P. Scherer Corporation, Basking Ridge, N,J., США. Н. Seagers с соавторами установил, что доза растворимых в воде лекарств обычно ограничена верхним значением приблизительно 60 мг на лекарственную форму. Величина дозы регулируется поведением лекарства во время процесса замораживания и характеристиками его сушки. Могут быть получены эвтектические смеси, которые не могут адекватно замораживаться или могут плавиться при более высоких температурах, используемых в процессах сушки вымораживанием. Также возможно, что растворенное лекарство может образовывать аморфное твердое вещество при замораживании и что это твердое вещество может “схлопываться” в процессе сушки из-за сублимации льда и потери поддерживающей структуры.
Схлопывание структуры, образованной растворимыми в воде лекарственными средствами, как известно, уменьшается за счет включения образующего кристаллы наполнителя. Эти материалы также известны как образующие матрицу агенты. Эти материалы способствуют кристалличности и, следовательно, жесткости аморфных продуктов. Другая методика состоит в связывании растворимого в воде соединения с ионообменной смолой с образованием нерастворимого в воде комплекса. Еще одна методика заключается в дозировании неводного раствора активного ингредиента в предварительно сформированные элементы плацебо-БДЛФ. Органический растворитель затем упаривают, а перекристаллизованное лекарство оседает в порах Zydis-матрицы.
Другая методика, которая известна для преодоления проблемы, связанной с высоко растворимыми в воде активными соединениями, заключается в уменьшении отношения лекарства к наполнителю и увеличении за счет этого массы наполнения блистерной упаковки. Это эффективно ослабляет влияние активного растворимого соединения при той же дозе лекарства, но при большем количестве наполнителя. Такое возможное решение имеет очевидные недостатки в том, что требует большего количества наполнителя, дает в большей степени “менее приятную для пациента” лекарственную форму и понижает производительность из-за ограничений по размерам.
Также известно, что растворимость лекарственного средства может быть изменена за счет регулирования рН. Пониженная растворимость, как известно, облегчает введение более высокой дозы активного соединения в БДЛФ. Один из аспектов настоящего изобретения основан на открытии, что использование по существу не содержащих желатина БДЛФ, в которых применяется модифицированный крахмал, позволяет ввести большее количество растворимых в воде лекарств, чем в случае обычных желатиновых систем. Этот пример представлен для того, чтобы показать такой неожиданный результат.
В этом примере три (3) высоко растворимых в воде активных ингредиента были приготовлены в виде БДЛФ. Растворимость этих активных соединений в воде представлена ниже:
Диклофенак-натрий - 1:30 вода
Правастатин-натрий - 1:3 вода
Фенилпропаноламин-HCl - 1:2,5 вода
В соответствии с таблицей 1 приготовлены следующие образцы.

Образцы 1, 3 и 5 (образцы, содержащие желатин) приготовлены путем добавления желатина и маннита в воронку перемешиваемой очищенной воды. Смесь затем нагревают до температуры 60°С (±1°С), чтобы перевести желатин и маннит в раствор. Затем раствор охлаждают до температуры 24°С (±1°С) и добавляют требуемое количество активного материала. Каждую загрузку до дозирования в блистерную упаковку выдерживают в течение как минимум одного (1) часа. Образцы 2, 4 и 6 (образцы с модифицированным крахмалом) готовят путем добавления крахмала и маннита в чистый, сухой химический стакан и перемешивания всухую с помощью шпателя. Затем к этой смеси добавляют очищенную воду и гомогенизируют с использованием Silverson L4R - Небольшой Головной Адаптер - при половинной скорости в течение двух (2) минут. К этому раствору добавляют указанный активный материал и оставляют до дозирования в течение как минимум одного (1) часа. Никакого нагревания загрузок не требуется и не предпринимается.
Каждый образец дозируют в 20 блистерных упаковок с использованием дозирующего устройства Hamilton Microlab, которое помещает 500 мг смеси (±2%) в алюминиевые блистерные карманы. Блистерные упаковки затем замораживают при -110°С с использованием жидкого азота при времени пребывания 3,2 минуты. Замороженные образцы до сушки вымораживанием хранят при -25°С. Сушку вымораживанием проводят с использованием температурного цикла от -10 до 10°С при 0, 5 мбар. Образцы сушат в течение ночи в день изготовления.
После сушки вымораживанием каждую упаковку извлекают и осматривают. Каждый образец блистера проверяют на образование трещин. Такое образование трещин является визуально заметным при осмотре БДЛФ и показывает, что 90% образца 1 явно образуют трещины, тогда как для образца 2 (содержащего модифицированный крахмал) отмечено 0%. Образец 3, содержащий желатин, показывает 45-50% образования трещин, тогда как образец 4 на основе крахмальной рецептуры, не образует трещин.
Образец 5, содержащий 2,5% масс. фенилпропаноламина и 4% масс. желатина дает степень образования трещин 60-70%. Это означает, что 60-70% 20-ти блистерных заполнений для этого образца растрескивается и крошится при попытках извлечения из блистерной упаковки. Напротив, использование крахмала в образце 6 приводит к степени растрескивания только 10-20%.
Этот опыт ясно показывает, что использование модифицированного крахмала в БДЛФ обеспечивает более высокое содержание высоко растворимых в воде активных соединений, которые могут быть введены в БДЛФ без образования трещин и снижения физической стабильности, наблюдаемых в случае обычных желатиновых препаратов.
Пример 8
Сравнительный
Из работы, проведенной в примере 7, очевидно, что использование модифицированного крахмала в БДЛФ обеспечивает более высокий уровень нагрузки лекарственной формы при отсутствии образования трещин и/или физического разрушения. Были предприняты попытки определения, как много дополнительного материала будет необходимо, чтобы получить БДЛФ на основе желатина, содержащие такое же количество активного ингредиента на одну лекарственную форму. По существу этот опыт проведен для того, чтобы определить, можно ли приготовить рецептуры на основе желатина, содержащие высоко активные растворимые соединения, без оплавления (абсорбции паров воды и падения физической стабильности) и проблемы образования трещин. Получены следующие препараты:

Эти образцы изготовлены так, как указано в примере 7, за исключением того, что используется заполнение 750 мл. После извлечения образцов со стадии сушки вымораживанием визуальный осмотр показывает отсутствие образцов, имеющих трещины. Этот пример показывает, что необходимы более крупные дозирующие формы, если при получении быстродиспергирующихся лекарственных форм используется желатин. Этот неожиданный результат дает преимущество в том, что более мелкие лекарственные формы, в которых используется модифицированный крахмал, будут улучшать соблюдение пациентами схемы приема и снижать стоимость производства.
Промышленная применимость
Настоящее изобретение относится к быстродиспергирующимся лекарственным формам для перорального введения. Преимуществами быстродиспергирующихся лекарственных форм являются язычное, подъязычное и трансбуккальное введение лекарственных средств. В настоящее время наиболее коммерчески популярной формой является быстрорастворимая твердая лекарственная форма, которую готовят путем введения аликвоты суспензии терапевтического агента, растворителя, желатина и других наполнителей в предварительно полученные дисперсии. Жидкость затем замораживают, после чего растворитель удаляют сублимацией, обычно сушкой вымораживанием. Получаемые таблетки имеют открытую пористую матрицу, которая легко растворяется при контакте со слюной.
Использование обычных БДЛФ имеет некоторые недостатки, например: 1) использование желатина, полученного из млекопитающих; 2) ограниченная нагрузка высоко растворимых в воде активных соединений в БДЛФ; 3) недостаточная механическая прочность; 4) неприятный вкус; 5) невозможность обеспечить гомогенность смеси; 6) невозможность предотвратить осаждение частиц активного вещества; и 7) минимальное растворение в холодной воде. Настоящее изобретение является шагом вперед в области БДЛФ за счет открытия, что некоторые модифицированные крахмалы могут быть использованы для приготовления БДЛФ, которые имеют улучшенную физическую стабильность; неожиданную способность содержать более высокие нагрузки хорошо растворимых в воде лекарственных средств; улучшенный вкус; улучшенную физическую стабильность (устойчивость к поглощению влаги и последующей усадке при сравнении с желатиновыми матричными системами); и существенное уменьшение скорости осаждения активных частиц в смеси.
Следует понимать, что описание и примеры являются иллюстративными, и не ограничивают настоящее изобретение, и что другие варианты осуществления изобретения в рамках сути и объема изобретения будут предложены квалифицированными в данной области специалистами.
Реферат
Изобретение относится к быстродиспергирующейся твердой лекарственной форме, которая растворяется в ротовой полости в пределах шестидесяти (60), более предпочтительно тридцати (30), наиболее предпочтительно десяти (10) секунд. Новый признак твердой лекарственной формы в соответствии с изобретением основан на том факте, что композиция по существу не содержит или совершенно не содержит желатин, полученный из млекопитающих. Установлено, что использование некоторых модифицированных крахмалов в концентрации от 20 до 90% масс. от массы твердой лекарственной формы дает лекарственные формы, которые являются механически и химически стабильными и способны переносить более высокие концентрации активного ингредиента, чем быстродиспергирующиеся твердые лекарственные формы на основе желатина. Кроме того, твердые лекарственные формы в соответствии с изобретением получают удалением растворителя, такого как вода, из смеси, содержащей активный ингредиент, модифицированный крахмал и образующий матрицу агент, посредством сушки вымораживанием. 8 з.п. ф-лы, 2 табл.

Комментарии