Средство, обладающее антиаритмическим действием - RU2630967C9
Код документа: RU2630967C9
Описание
Изобретение относится к медицине, а именно к химико-фармацевтической промышленности, в частности к средствам и фармацевтическим композициям на основе соответствующих средств, обладающим антиаритмическим действием для коррекции функционального состояния миокарда.
Известно противоаритмическое средство «Аллапинин», представляющее собой бромгидрат алкалоида лаппаконитина (SU 1335293, прототип), которое изготавливается из растения борец северный (борец высокий).
Известный препарат относится к мембраностабилизирующим препаратам I С класса. В основе механизма действия препарата лежит его способность блокировать встроенные в наружную клеточную мембрану кардиомиоцитов быстрые трансмембранные потенциалзависимые Na+ каналы и тем самым препятствовать поступлению ионов Na+ в цитозоль кардиомиоцитов [Валеев А.Е. с соавт. Нейрофизиология. 1990. №2. С. 201-206]. Показано, что препарат замедляет проведение возбуждения и сокращает рефрактерный период в предсердиях, атриовентрикулярном узле, пучке Гиса и волокнах Пуркинье [Машковский М.Д. Лекарственные средства. М.: Новая волна, 2002. Т. 1. С. 371]. В клинике препарат применяется при наджелудочковой и желудочковой экстрасистолии; пароксизмах мерцания и трепетания предсердий; пароксизмальной наджелудочковой тахикардии (в т.ч. при синдроме WPW); пароксизмальной желудочковой тахикардии (при отсутствии органических поражений сердца).
Аллапинин относится к препаратам I С класса и является высокоэффективным антиаритмическим средством при различных формах нарушений ритма сердца и особенно эффективен при лечении симптоматичных доброкачественных желудочковых аритмий (ЖА), пароксизмальной мерцательной аритмии и при хронической монофокусной предсердной тахикардии.
Внезапная сердечная смерть по-прежнему остается одной из основных нерешенных проблем, стоящих перед современной кардиологией, в том числе и кардиофармакологией.
Снижение сократительной способности сердца, в частности у пациентов, страдающих коронарной болезнью сердца, тем более, если это заболевание осложнено нарушением сердечного ритма, обусловленным фибрилляцией желудочков, ассоциируется с повышением риска внезапной сердечной смерти. Показано, что у этой категории больных при снижении фракции сердечного выброса, например, с 40% до 30% риск внезапной сердечной смерти возрастает в 5 раз [Santangeli P. et al. Hellenic J. Cardiol. 2007. V. 48. Р. 72-79].
Кроме того, явление аритмии часто наблюдается у пациентов, страдающих хронической обструктивной болезнью легких (ХОБЛ). Лечение аритмии существующими препаратами у таких пациентов затруднено ввиду и без того высокой лекарственной нагрузки на организм. Само протекание ХОБЛ у пациента может сопровождаться симптомами, характерными на фоне общей гипоксии как для ХОБЛ, так и для аритмии. Если такой пациент для снятия симптомов прибегнет к применению лекарственных препаратов, предназначенных для лечения ХОБЛ, то они, в свою очередь, в качестве побочного эффекта могут вызвать приступы аритмии, что еще в большей степени усугубляет состояние больного.
В настоящее время отсутствуют данные, подтверждающие эффективность препарата Аллапинин при профилактике внезапной сердечной смерти и при лечении аритмий у больных с ХОБЛ. В этой связи представляется актуальным поиск эффективного и безопасного лекарственного препарата, который можно было бы использовать у такой категории больных.
Технической проблемой, разрешаемой настоящей группой изобретений, является отсутствие эффективного и безопасного кардиопротекторного средства для профилактики и лечения группы взаимосвязанных патологических процессов.
Техническим результатом, обеспечивающим разрешение указанной проблемы, является создание эффективного и безопасного кардиопротекторного средства для профилактики и лечения аритмии, снижения риска внезапной сердечной смерти, возможности лечения аритмии у больных с хронической обструктивной болезнью легких (ХОБЛ) и эпилепсией, а также расширение арсенала кардиопротекторных средств, обладающих высокой антиаритмической активностью при различных формах аритмии.
Наряду с высокой антиаритмической активностью при различных формах аритмии, предложенное средство обладает дополнительными лечебными свойствами, а именно бронхолитическими, противоэпилептическими, противовоспалительными и местноанестезирующими.
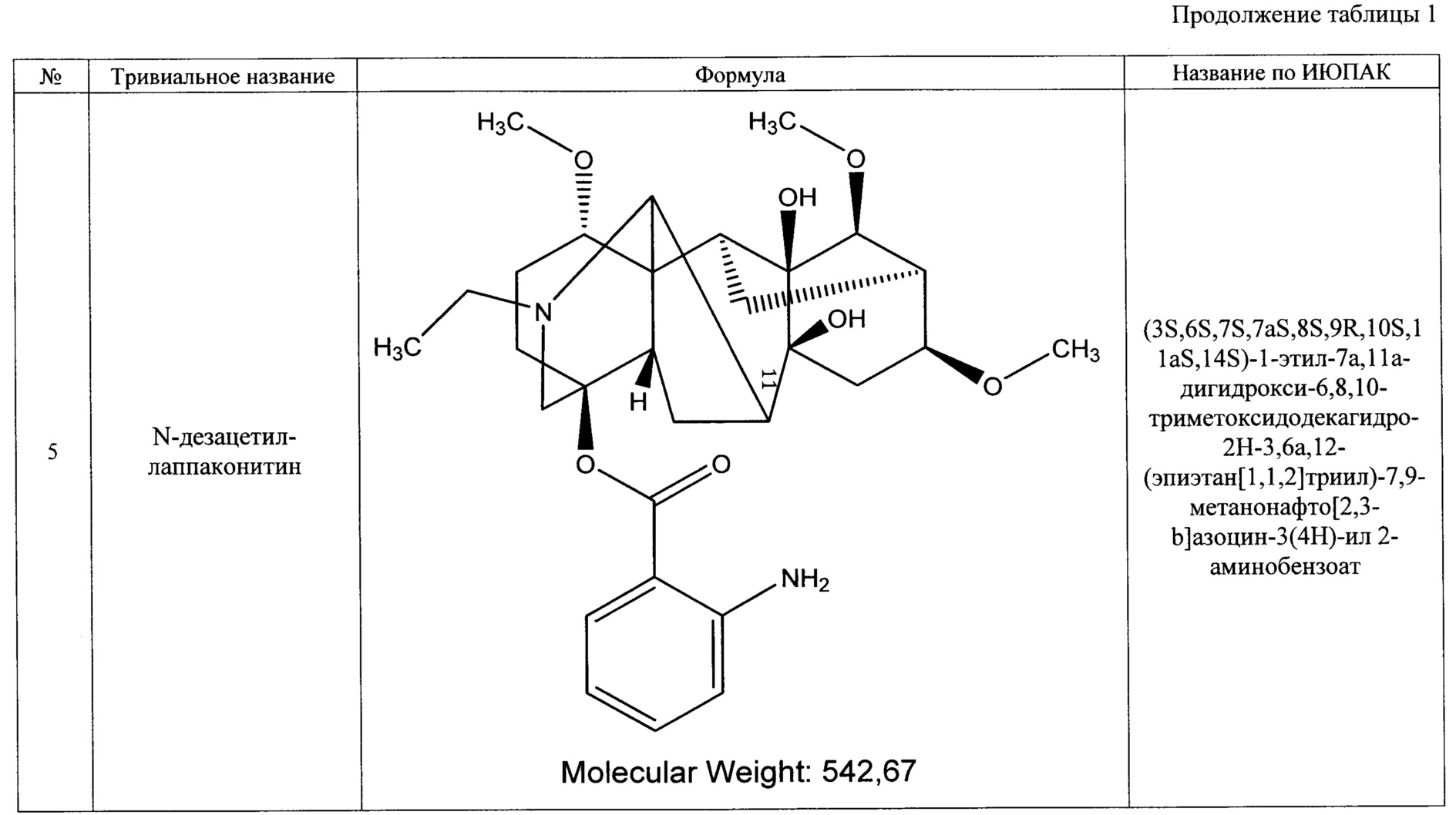
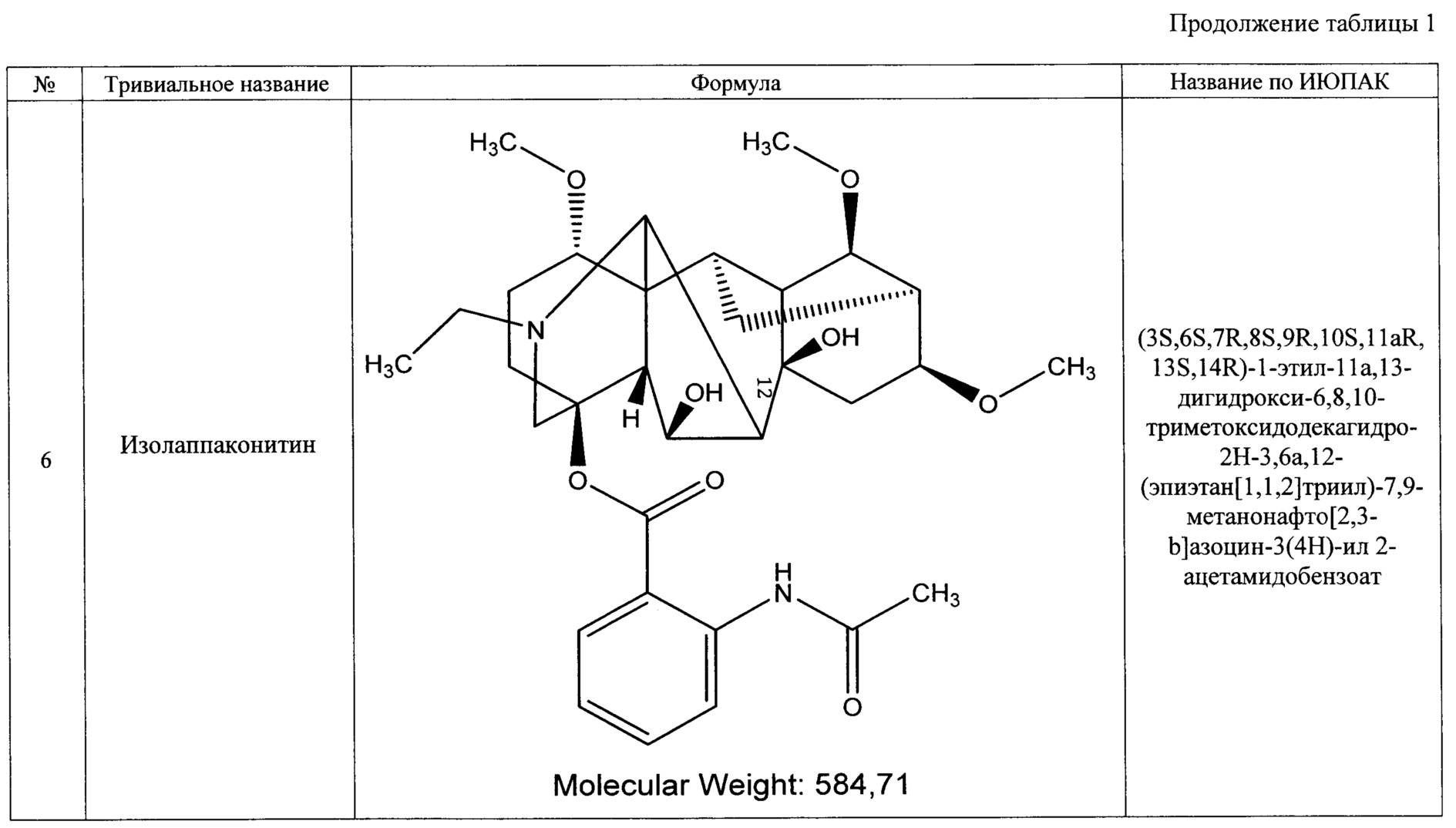
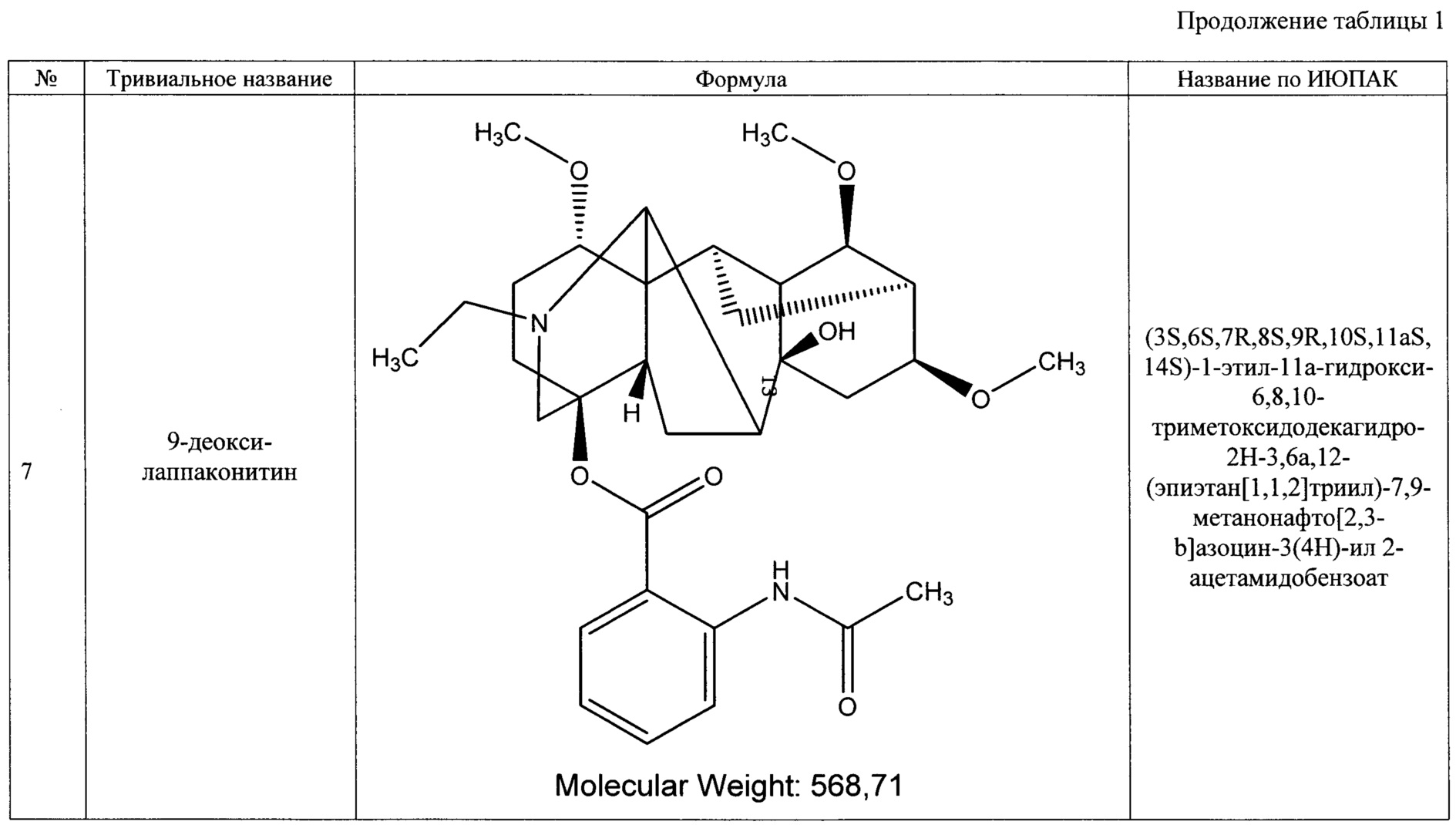
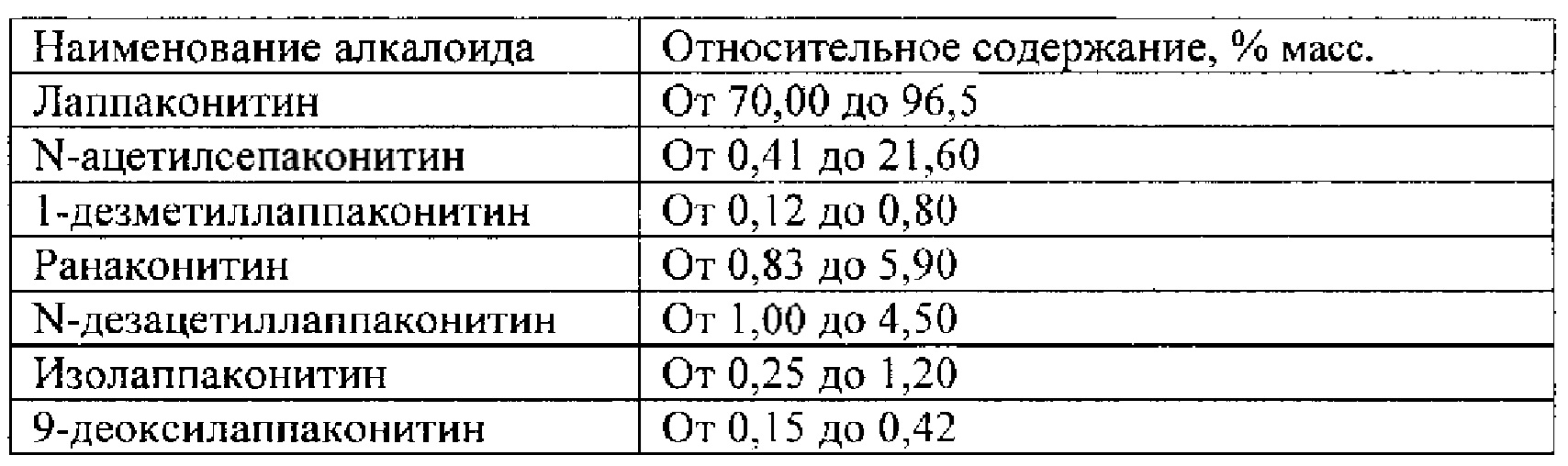
Технический результат достигается тем, что получено средство, обладающее антиаритмическим действием, представляющее собой субстанцию, выделенную из растений рода Aconitum (борец) семейства Ranunculaceae (лютиковые), и содержащее семь основных алкалоидов: лаппаконитин, N-ацетилсепаконитин, 1-дезметиллаппаконитин, ранаконитин, N-дезацетиллаппаконитин, изолаппаконитин, 9-деоксилаппаконитин или их фармацевтически приемлемые соли.
Фармацевтически приемлемые соли могут быть выбраны из группы широко известных из соответствующей специальной литературы фармацевтически приемлемых солей: гидробромиды, гидрохлориды, сульфаты, сукцинаты, фумараты, оксалаты, малонаты, тартраты и малеаты.
Средство, в предпочтительном случае реализации, содержит алкалоиды в виде бромистоводородных солей лаппаконитина, N-ацетилсепаконитина, 1-дезметиллаппаконитина, ранаконитина, N-дезацетиллаппаконитина, изолаппаконитина, 9-деоксилаппаконитина.
В частных случаях реализации средство может быть выделено из корневищ с корнями растения борца северного (борца высокого) - Aconitum septentrionale Koelle, семейства лютиковые - Ranunculaceae.
В иных частных случаях реализации средство может быть выделено из корневищ с корнями растения борца белоустого - Aconitum leucostomum, семейства лютиковые - Ranunculaceae.
В иных частных случаях реализации средство может быть выделено из травы растения борца белоустого - Aconitum leucostomum, семейства лютиковые - Ranunculaceae.
Технический результат также достигается созданием фармацевтической композиции для перорального применения, обладающей антиаритмическим действием, которая содержит вышеописанное средство, содержащее семь основных алкалоидов: лаппаконитин, N-ацетилсепаконитин, 1-дезметиллаппаконитин, ранаконитин, N-дезацетиллаппаконитин, изолаппаконитин, 9-деоксилаппаконитин или их фармацевтически приемлемые соли в эффективном количестве и фармацевтически приемлемый носитель.
Предпочтительно, фармацевтически приемлемый носитель содержит крахмал, сахарозу и стеарат кальция, а также дополнительно содержит кросскармеллозу натрия.
Объектом изобретения является средство, представляющее собой фармацевтическую субстанцию, состоящую из родственных по структуре алкалоидов или их фармацевтически приемлемых солей, выделяемых из растений рода Aconitum (борец) семейства Ranunculaceae (лютиковые), в частности борец северный (борец высокий) - Aconitum septentrionale Koelle, борец белоустый - Aconitum leucostomum и т.д. Все растения указанного рода содержат в своем составе алкалоиды дитерпеноидного типа. При этом может быть использована как надземная часть растения - трава, так и корневища с корнями.
Указанная фармацевтическая субстанция получена способом, разработанным авторами настоящей группы изобретений (№2016121618 от 01.06.2016 г.). Данный способ позволяет получить фармацевтическую субстанцию, содержащую семь основных алкалоидов: лаппаконитин, N-ацетилсепаконитин, 1-дезметиллаппаконитин, ранаконитин, N-дезацетиллаппаконитин, изолаппаконитин, 9-деоксилаппаконитин или их фармацевтически приемлемые соли.
Проводят четырехкратную экстракцию алкалоидов из указанного сырья с использованием спирта этилового (этанола) на батарее из трех экстракторов с получением водно-спиртовых извлечений и использованием первого извлечения от каждой загрузки каждого экстрактора для упаривания, а второго, третьего и четвертого извлечений каждой загрузки - в качестве экстрагента для первого, второго и третьего извлечений очередных загрузок, причем четвертое извлечение каждой загрузки производится спиртом. В пусковой период в первом, втором и третьем экстракторах проводятся первая, вторая и третья загрузки сырья соответственно; первое извлечение первой загрузки проводят спиртом и направляют на упаривание, второе извлечение первой загрузки проводят спиртом и направляют во второй экстрактор для получения первого извлечения второй загрузки, которое направляют на упаривание, третье извлечение первой загрузки проводят спиртом и направляют во второй экстрактор для получения второго извлечения второй загрузки, которое направляют в третий экстрактор для получения первого извлечения третьей загрузки, которое направляют на упаривание, четвертое извлечение первой загрузки проводят спиртом и направляют во второй экстрактор для получения третьего извлечения второй загрузки, которое направляют в третий экстрактор для получения второго извлечения третьей загрузки, которое направляют на рабочий период, четвертое извлечение второй загрузки проводят спиртом и направляют в третий экстрактор для получения третьего извлечения третьей загрузки, которое направляют на рабочий период, четвертое извлечение третьей загрузки проводят спиртом и направляют на рабочий период, при котором в первом, втором и третьем экстракторах проводят четвертую, пятую, шестую и так далее загрузки сырья соответственно; причем первое извлечение каждой загрузки направляют на упаривание, а второе, третье и четвертое - на получение первого, второго и третьего извлечений каждой последующей загрузки. Проводят упаривание под вакуумом первого водно-спиртового извлечения и очистку полученного при этом водного кубового остатка от балластных веществ этилацетатом, с подкислением при помощи минеральных или органических кислот, например бромистоводородной кислотой, водного кубового остатка, насыщенного этилацетатом и неоднократную экстракцию хлороформом при контроле рН среды, которое не должно превышать значения 2, упаривание хлороформных извлечений под вакуумом и вытеснение хлороформа спиртом этиловым с получением суспензии готового продукта, который фильтруют, промывают спиртом этиловым и сушат.
Причем на первую экстракцию алкалоидов первой загрузки пускового периода в первый экстрактор подают спирт этиловый 80% при соотношении сырья и экстрагента 1:8 и проводят первую экстракцию в течение 3 часов при комнатной температуре и перемешивании, с последующей регенерацией спирта из отработанного сырья, очистку этилацетатом первого извлечения от балластных веществ после упаривания проводят этилацетатом, насыщенным водой, четырехкратно в течение 30 минут при перемешивании.
Водный раствор экстракта, насыщенный этилацетатом, упаривают под вакуумом, охлаждают до комнатной температуры, фильтруют и сушат. В результате получают субстанцию, содержащую семь основных алкалоидов в нативном виде, т.е. в виде оснований: лаппаконитин, N-ацетилсепаконитин, 1-дезметиллаппаконитин, ранаконитин, N-дезацетиллаппаконитин, изолаппаконитин, 9-деоксилаппаконитин.
Для получения субстанции, содержащей алкалоиды в виде солей, водный раствор экстракта, насыщенный этилацетатом, упаривают под вакуумом, охлаждают до комнатной температуры, подкисляют при помощи минеральных или органических кислот до рН среды, не превышающего значения 2, проводят выдержку при работающей мешалке, а по окончании выдержки проводят обработку хлороформом. Обработку хлороформом производят четырехкратно с получением четырех хлороформных извлечений, которые упаривают под вакуумом, а для вытеснения хлороформа подают спирт этиловый ректификованный и снова упаривают до полного удаления хлороформа.
Полученный как изложено выше технический продукт содержит алкалоиды в виде солей, образованных с соответствующей минеральной или органической кислотой. Содержание алкалоидов в пересчете на соответствующую соль лаппаконитина составляет 87-94%.
Технический продукт растворяют в метаноле при комнатной температуре, добавляют бутанол в количестве 11% от объема полученного раствора. Затем проводят упаривание полученного раствора при вакуумметрическом давлении от 91 до 95 кПа и температуре не выше 70°С до полного удаления метанола.
Полученную суспензию фильтруют и сушат.
Количественное содержание в субстанции семи основных компонентов варьируется в зависимости от используемой партии растительного сырья, морфологической части растений.
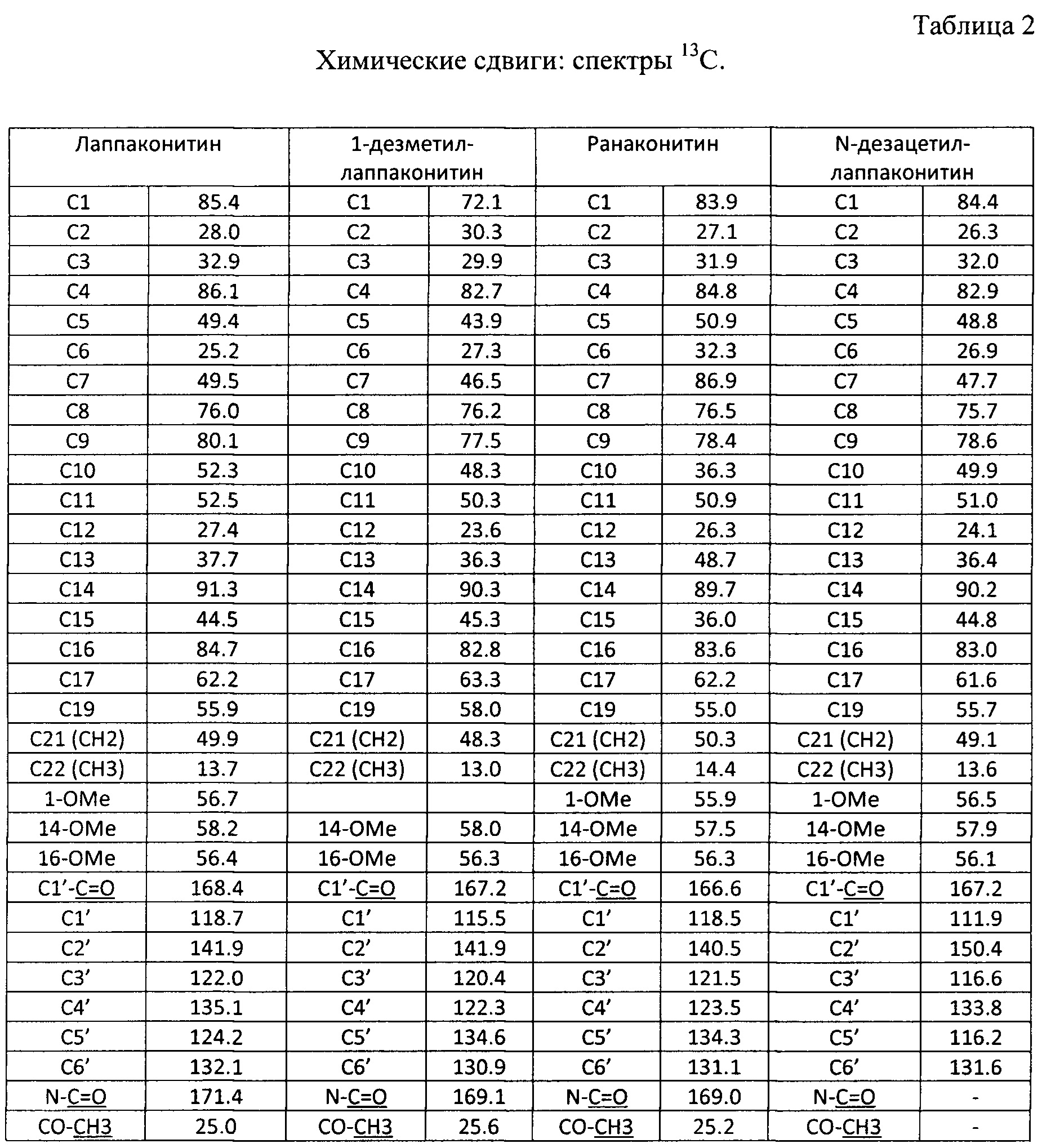
В результате реализации описанного способа получена субстанция, включающая семь основных компонентов, описание которых приведено в таблице 1. Характеристики ЯМР-спектров компонентов представлены в таблицах 2 и 3.
Допускается также наличие минорных компонентов и примесей, содержание которых сложно поддается количественному определению и зависит от конкретного вида используемого сырья.
Преобладающим компонентом субстанции является лаппаконитин (1). Сопутствующие алкалоиды включают в себя N-ацетилсепаконитин (2), 1-дезметиллаппаконитин (3), ранаконитин (4), N-дезацетиллаппаконитин (5), изолаппаконитин (6), 9-деоксилаппаконитин (7). Все компоненты субстанции могут быть получены в виде солей: гидробромидов, гидрохлоридов, сульфатов, сукцинатов, фумаратов, оксалатов, малонатов, тартратов и малеатов. Количественное содержание алкалоидов колеблется в зависимости от конкретного вида и партии используемого сырья.
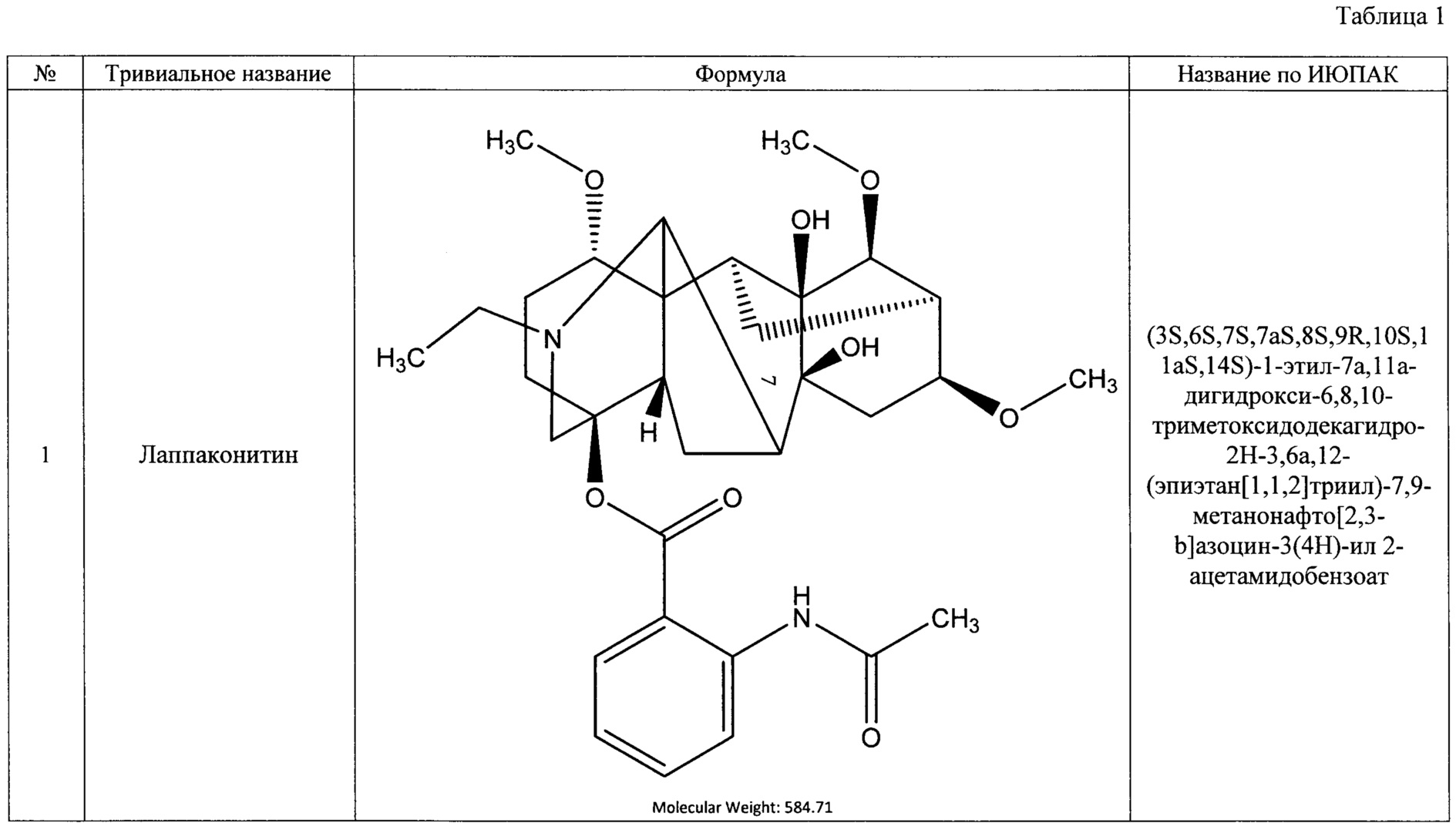
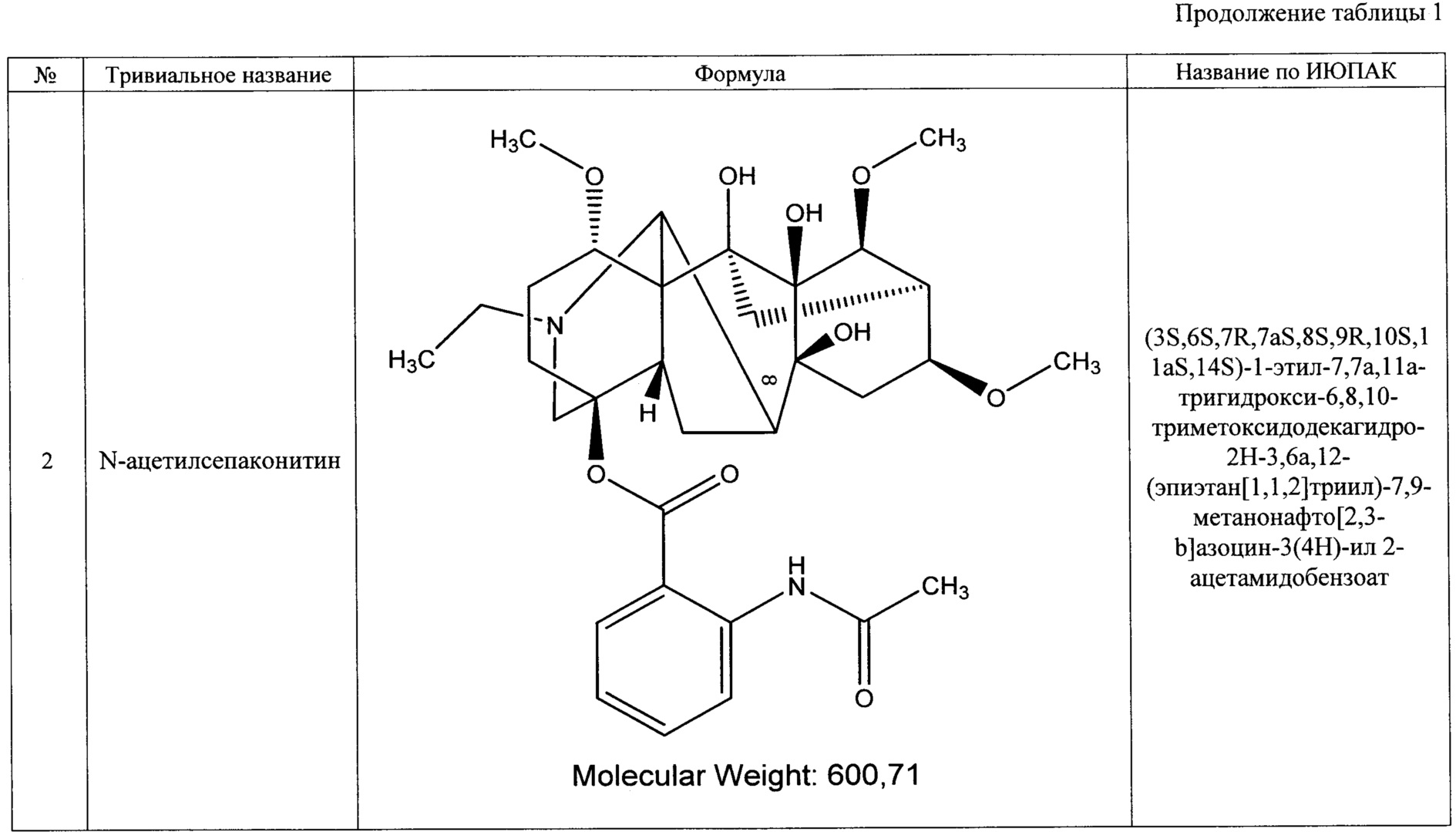
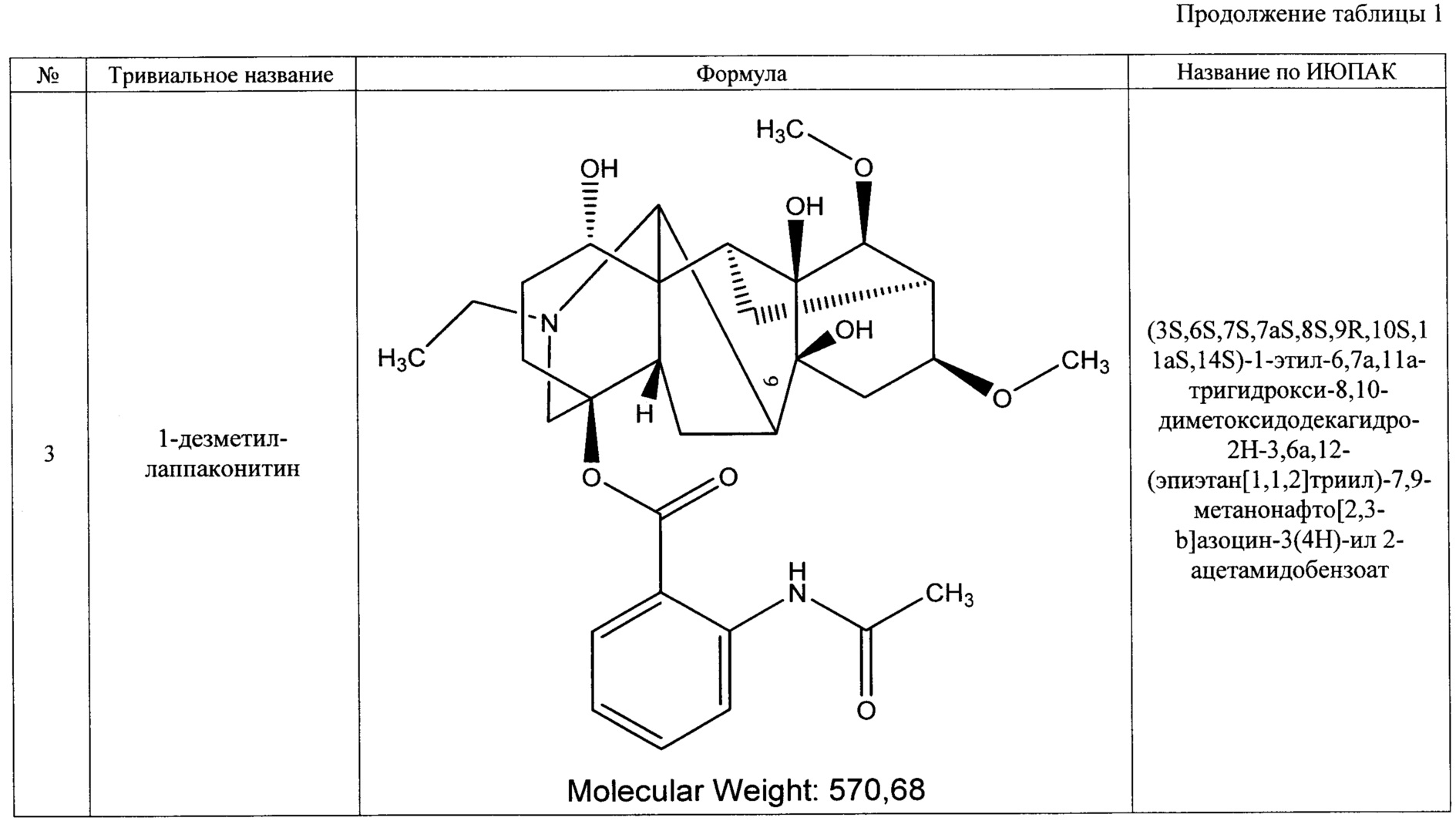
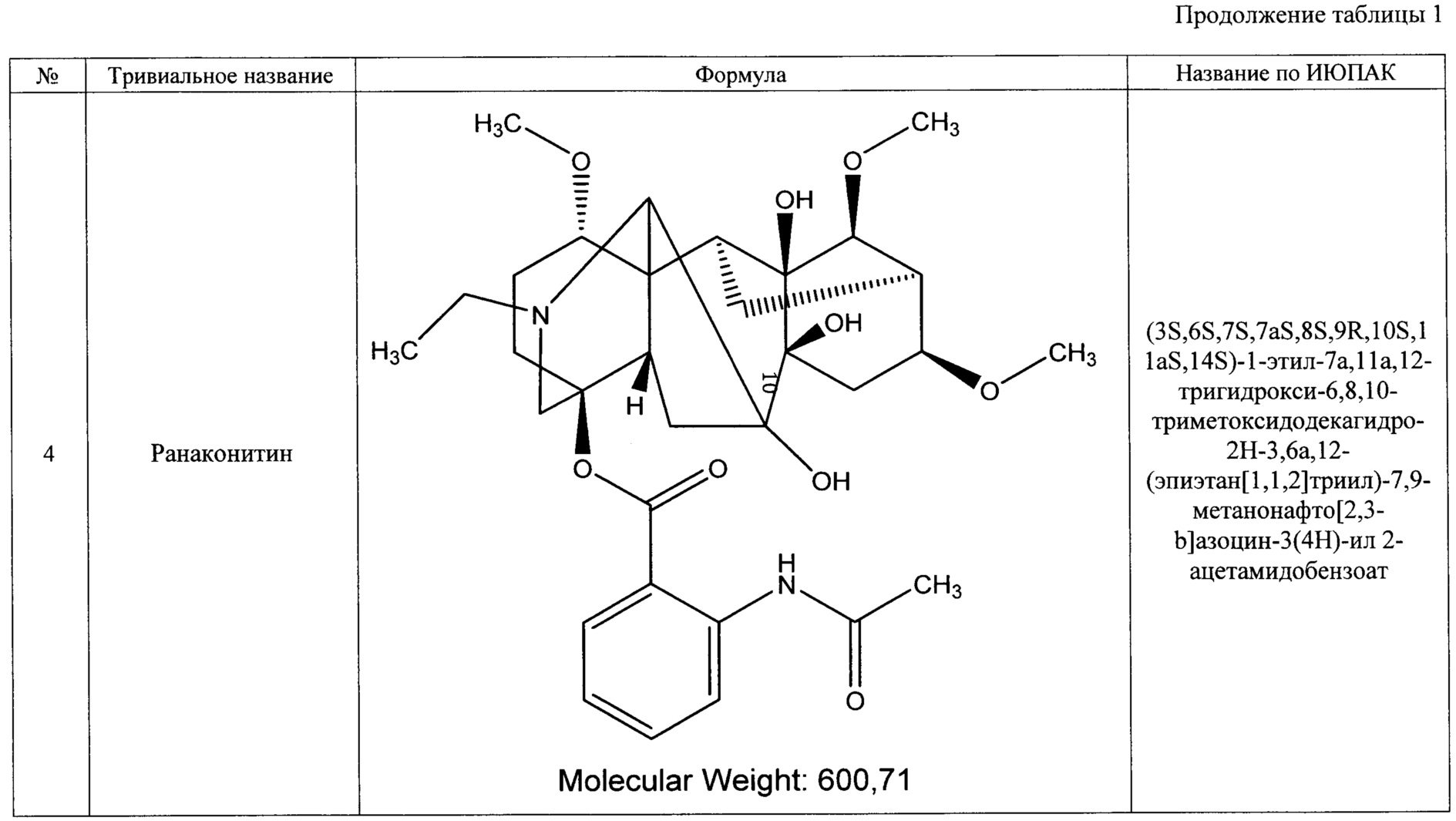
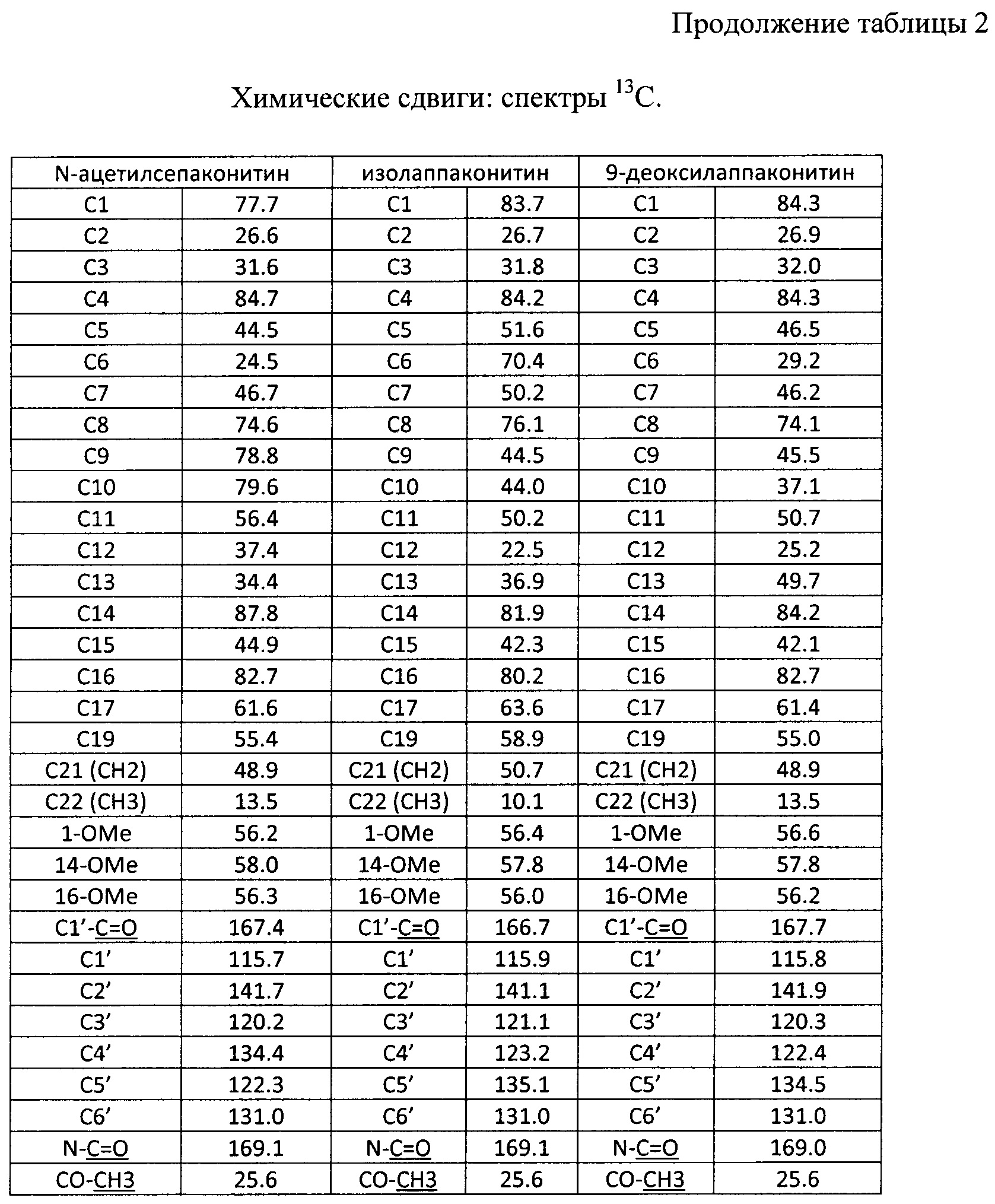
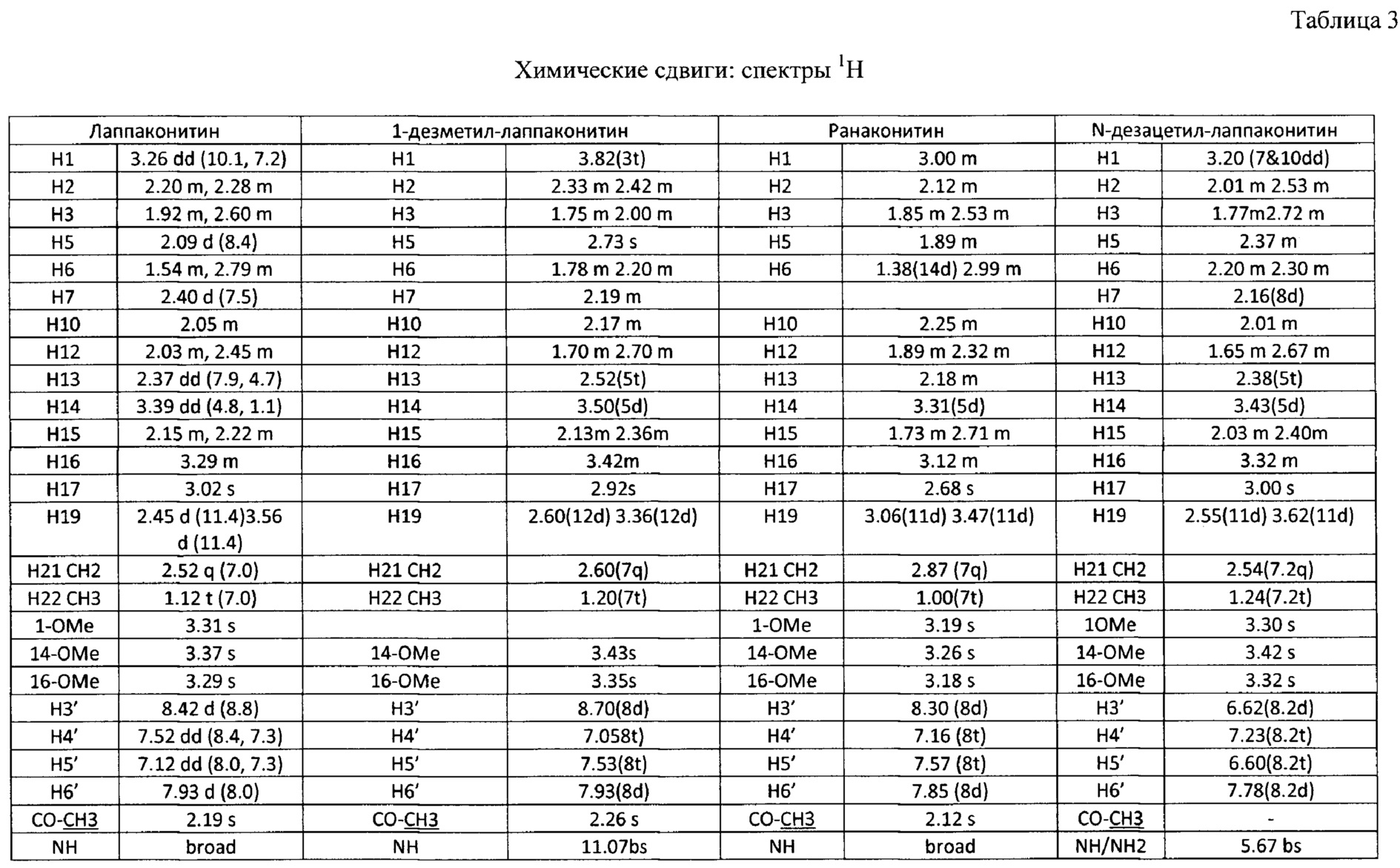
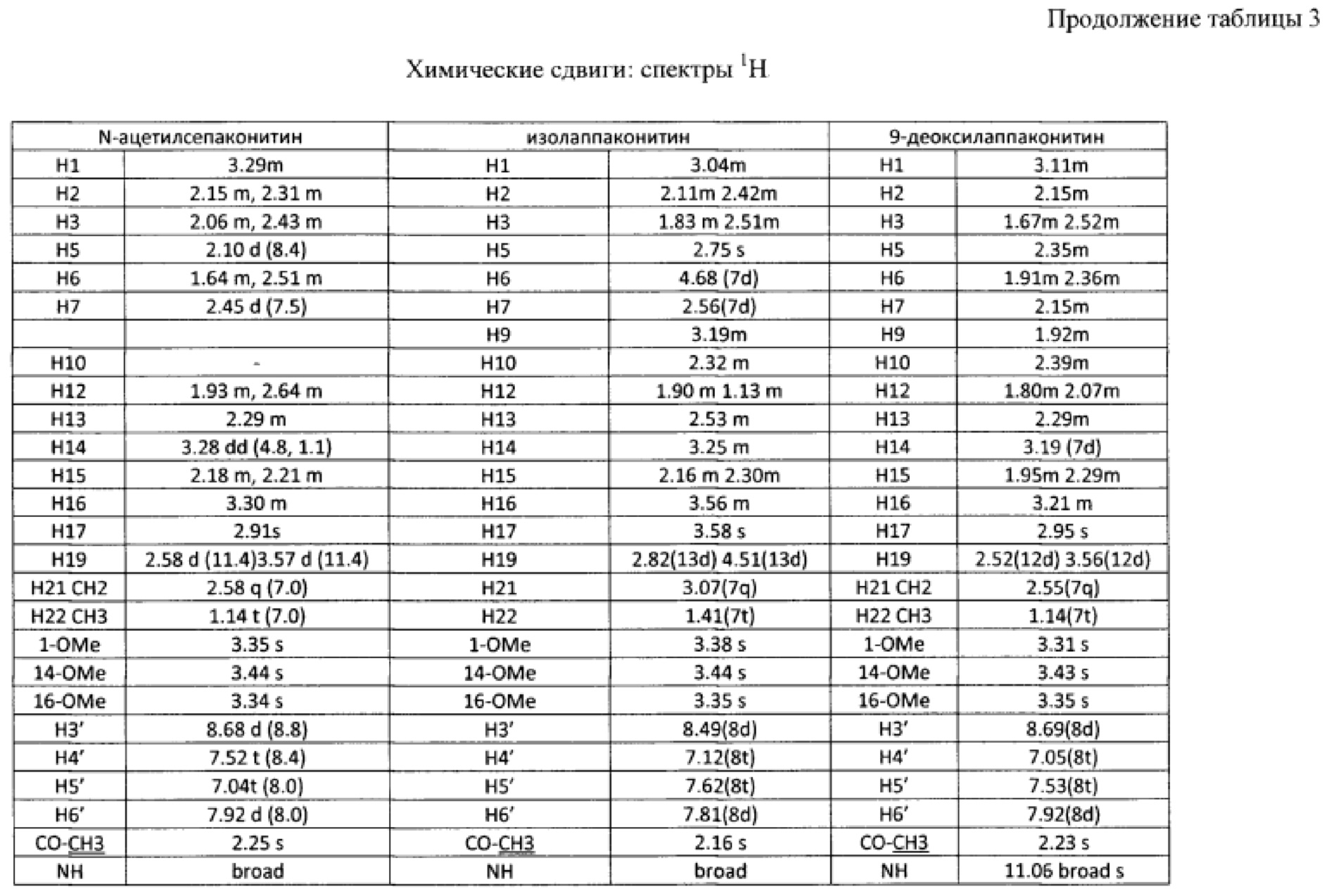
Состав фармацевтической субстанции установлен и описан при помощи высокочувствительного инструментального метода анализа - высокоэффективной жидкостной хроматографии с использованием диодно-матричного детектора и масс-детектора, позволяющего определить не только времена удерживания, но и молекулярные массы компонентов (далее - методика определения компонентов).
Вышеуказанные параметры позволяют с высокой точностью идентифицировать все семь основных компонентов, из которых состоит заявленное средство. Кроме того, методика определения компонентов позволяет определить относительное массовое содержание каждого компонента. В таблице 4 приведены характеристики компонентов фармацевтической субстанции, относящиеся к заявляемому средству, реализованному как композиция, содержащая алкалоиды лаппаконитин, N-ацетилсепаконитин, 1-дезметиллаппаконитин, ранаконитин, N-дезацетиллаппаконитин, изолаппаконитин, 9-деоксилаппаконитин в несвязанном виде, так и к заявляемому средству, реализованному как композиция, содержащая фармацевтически приемлемые соли указанных алкалоидов, т.е. вне зависимости от типа соли.
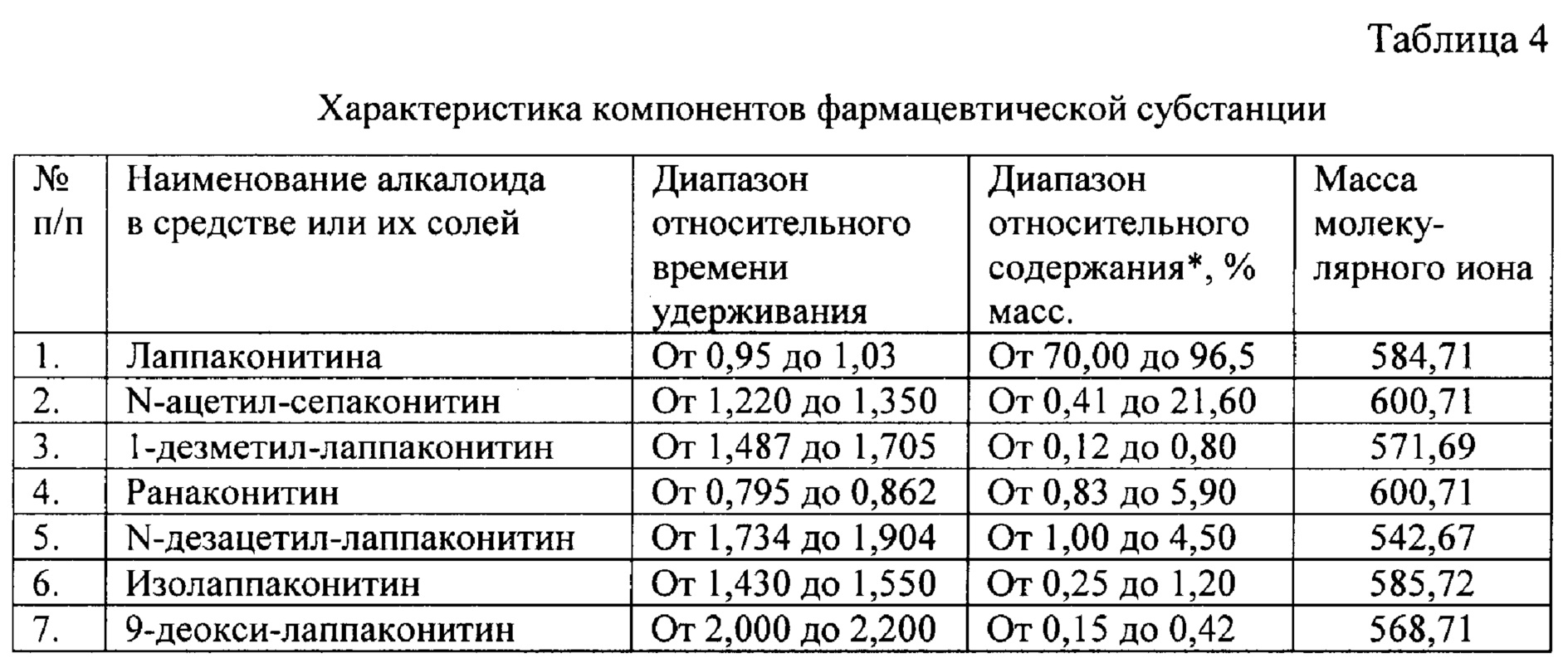
* Примечание к таблице 4:
Диапазон относительного содержания алкалоидов выражен в массовых процентах, поскольку определение этих величин опосредованно связано с массой молекулярного иона. Следует также отметить, что в данном случае речь идет не о физической массе компонентов, как таковой, а о величине площади пика, возникающего на хроматограмме испытуемого раствора при проведении анализа в соответствии с описанной в заявке методикой определения компонентов. При этом площадь пика рассчитывается прибором (ультрафиолетовым, диодно-матричным или масс-детектором) как произведение условных единиц (A.U.) и времени элюирования компонента из хроматографической колонки:
Sпика=I*t,
где Sпика - площадь пика на хроматограмме, условные единицы в секунду,
I - величина отклика детектора на компонент анализируемой смеси, выраженная в условных единицах,
t - время элюирования компонента из хроматографической колонки, в секундах.
При этом относительное массовое содержание компонента рассчитывается как отношение площади пика этого компонента к сумме площадей пиков всех остальных компонентов субстанции за исключением пиков, соответствующих самому растворителю:
(Sпика компонета/∑Sпиков всех компонентов)*100%
Следует также отметить, что интенсивность сигнала прибора не всегда линейно зависит от количества, т.е. от массового содержания конкретного компонента в субстанции, а определяется также особенностями его химического строения.
Заявленное средство может быть выполнено в различных пероральных лекарственных формах, таких как таблетки, капсулы, гранулы и т.д.
Указанные формы могут быть получены известными способами с применением известных вспомогательных веществ, стандартно используемых в фармацевтической промышленности.
Вспомогательные вещества, которые используются в твердых препаративных формах для перорального применения, как правило, включают наполнители или разбавители, связывающие вещества, дезинтегрирующие вещества, смазывающие вещества, антиадгезивные вещества, скользящие, увлажняющие и поверхностно-активные вещества, красители, ароматизаторы, подсластители, адсорбенты и вещества, улучшающие органолептические свойства.
Наполнители или разбавители добавляют к активному веществу с целью увеличения объема таблетки. К ним относится лактоза, которая может быть либо кристаллической, либо аморфной. Другие разбавители включают в себя сахара, например сахарозу. Также к разбавителям и наполнителям относят и крахмал, и производные крахмала. Другие крахмалы включают прежелатинизированный крахмал и крахмал, модифицированный гликолатом натрия. Крахмалы и производные крахмалов могут быть использованы в качестве дезинтегрирующих веществ. Другие разбавители включают в себя неорганические соли, такие как двухосновный фосфат кальция, трехосновный фосфат кальция и сульфат кальция. Разбавителями также могут служить такие полиолы, как маннит, сорбит и ксилит. Многие разбавители также действуют как дезинтегрирующие вещества и связующие вещества, и эти дополнительные свойства должны быть приняты в расчет при разработке состава. Дезинтегрирующие вещества включают в таблетированные составы для распадения таблеток на частицы активного фармацевтического компонента и вспомогательные вещества, что будет облегчать растворение активного компонента и увеличивать биодоступность активного компонента. Дезинтегрирующими веществами являются крахмал, желатинизированный крахмал, кросскармеллоза натрия, кросповидон, микрокристаллическая целлюлоза и т.д.
Связующие вещества используются при влажной грануляции. Связующее вещество выполняет функцию текучести порошка и для прессования. Связующие вещества - это производные целлюлозы, такие как микрокристаллическая целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза натрия, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза и гидроксипропилцеллюлоза. Другими связующими веществами являются поливинилпирролидон, желатин, природные камеди, прежелатинизированный крахмал, сахароза, полиэтиленгликоли и альгинат натрия, и т.д.
Смазывающие вещества используются в таблетированных препаративных формах для предотвращения склеивания таблетки с ударной поверхностью и для уменьшения трения во время стадий прессования. Смазывающие вещества обычно включают в себя растительные масла, например кукурузное масло, минеральные масла, полиэтиленгликоли, соли стеариновой кислоты, такие как, например, стеарат кальция, стеарат магния и стеарилфумарат натрия, минеральные соли, например тальк, неорганические соли, например хлорид натрия, органические соли, например бензоат натрия, ацетат натрия и олеат натрия, и поливиниловые спирты.
Скользящие вещества используют в твердых лекарственных формах для улучшения текучести таблетируемой массы. Обычно для этого используют микрокристаллическую целлюлозу, стеараты щелочных металлов, например стеарат магния или стеарат кальция; силикатные соли, например, силикат магния, силикат кальция; крахмал и разновидности крахмалов и/или их производные; тальк; коллоидный диоксид кремния, например известный Аэросил®.
В предпочтительном варианте пероральная лекарственная форма включает заявленное средство в эффективном количестве и фармацевтически приемлемый носитель, включающий сахарозу, крахмал и стеарат кальция. Согласно другому варианту осуществления носитель дополнительно включает кросскармеллозу натрия.
Технический результат заключается в создании эффективного и безопасного кардиопротекторного средства для профилактики и лечения аритмии, обладающего расширенными возможностями предупреждения потенциально злокачественных и злокачественных желудочковых аритмий, фибрилляции желудочков и снижения фракции выброса (индекс сократимости миокарда), являющихся непосредственной причиной внезапной сердечной смерти, а также новыми функциональными возможностями комплексного лечения аритмии, отягченной хронической обструктивной болезнью легких (ХОБЛ) и эпилепсией, а также расширение арсенала кардиопротекторных средств, обладающих высокой антиаритмической активностью при различных формах аритмии.
Достигаемый технический результат проверялся в соответствии с примерами, изложенными ниже.
Пример 1
В результате реализации способа получения заявленного средства, описанного выше, из корневищ с корнями борца северного получены фармацевтические субстанции 1, 2, 3, 4, 5, 6, 7, 8, 9, включающие в себя алкалоиды: лаппаконитин, N-ацетилсепаконитин, 1-дезметиллаппаконитин, ранаконитин, N-дезацетиллаппаконитин, изолаппаконитин, 9-деоксилаппаконитин в несвязанном виде, относительные массовые содержания которых представлены в таблице 5.
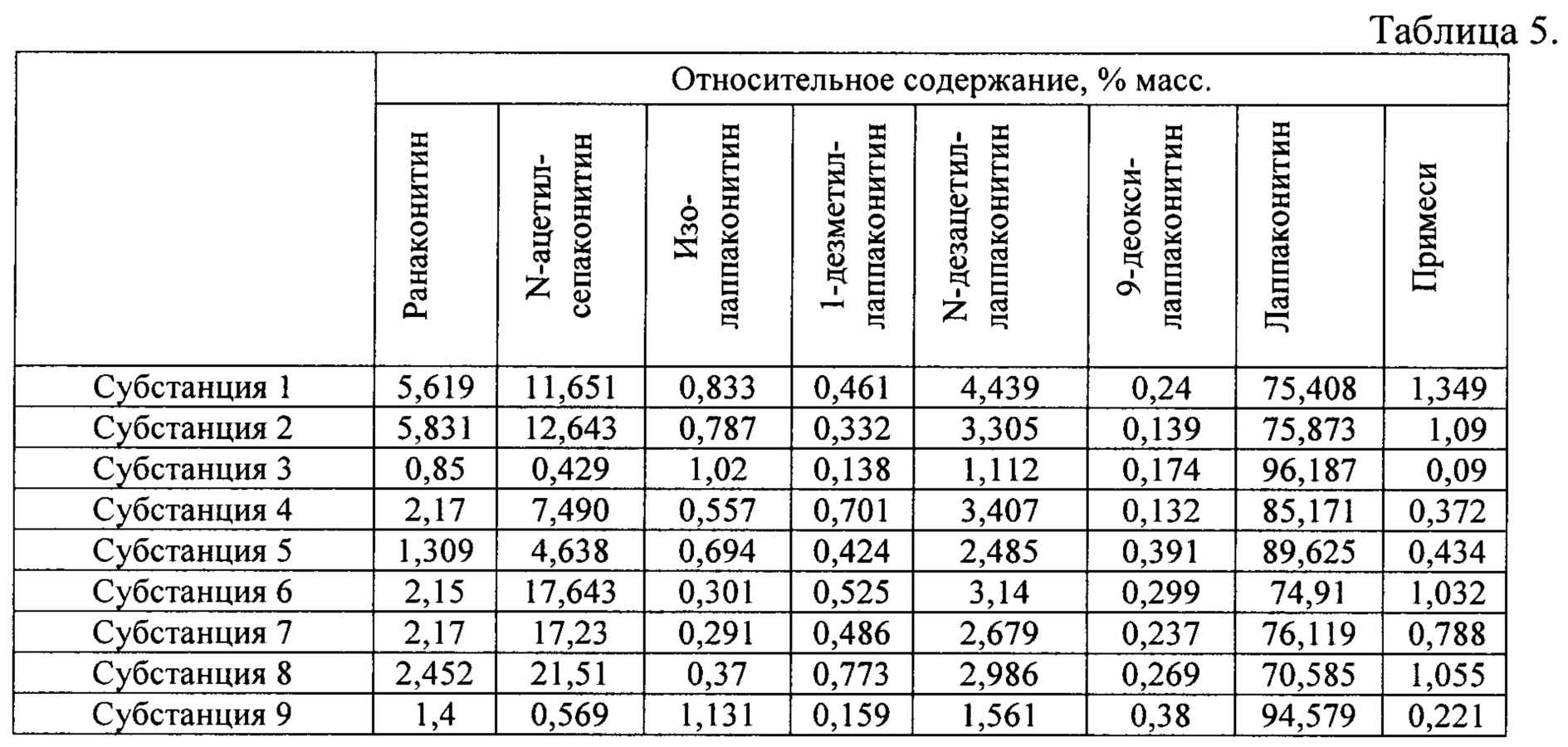
Пример 2
В результате реализации способа получения заявленного средства, описанного выше, из корневищ с корнями борца северного получены фармацевтические субстанции: 1а, 2а, 3а, 4а, 5а, 6а, 7а, 8а, 9а, включающие в себя гидробромиды алкалоидов: лаппаконитина, N-ацетилсепаконитина, 1-дезметиллаппаконитина, ранаконитина, N-дезацетиллаппаконитина, изолаппаконитина, 9-деоксилаппаконитина, относительные массовые содержания которых представлены в таблице 6.
В условиях проведения анализа согласно методике определения компонентов сигнал, регистрируемый прибором, определяется структурой самих алкалоидов и не зависит от типа соли.
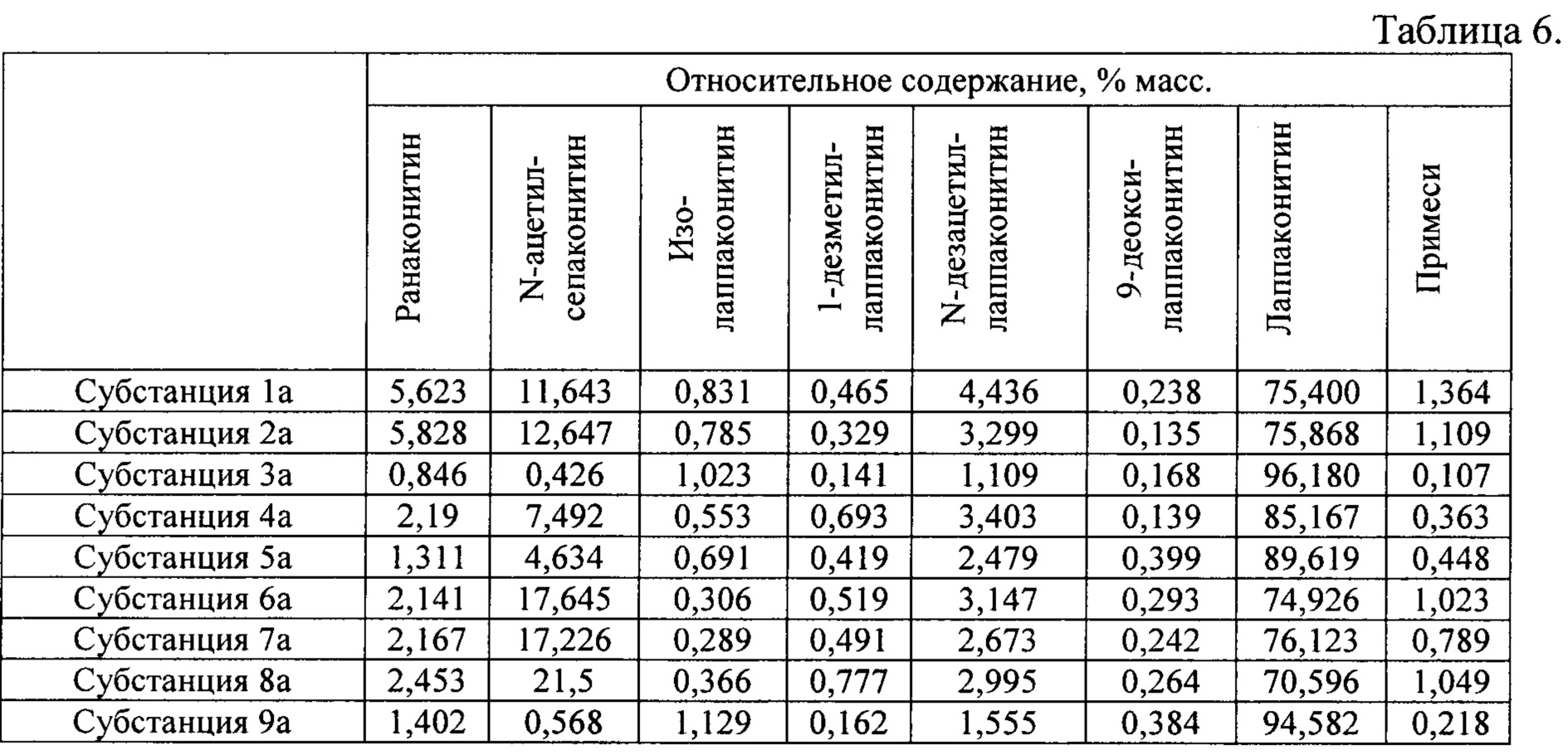
Пример 3
В результате реализации способа получения заявленного средства, описанного выше, из корневищ с корнями борца северного получены фармацевтические субстанции: 1б, 2б, 3б, 4б, 5б, 6б, 7б, 8б, 9б, включающие в себя гидрохлориды алкалоидов: лаппаконитина, N-ацетилсепаконитина, 1-дезметиллаппаконитина, ранаконитина, N-дезацетиллаппаконитина, изолаппаконитина, 9-деоксилаппаконитина, относительные массовые содержания которых представлены в таблице 7.
В условиях проведения анализа согласно методике определения компонентов сигнал, регистрируемый прибором, определяется структурой самих алкалоидов и не зависит от типа соли.
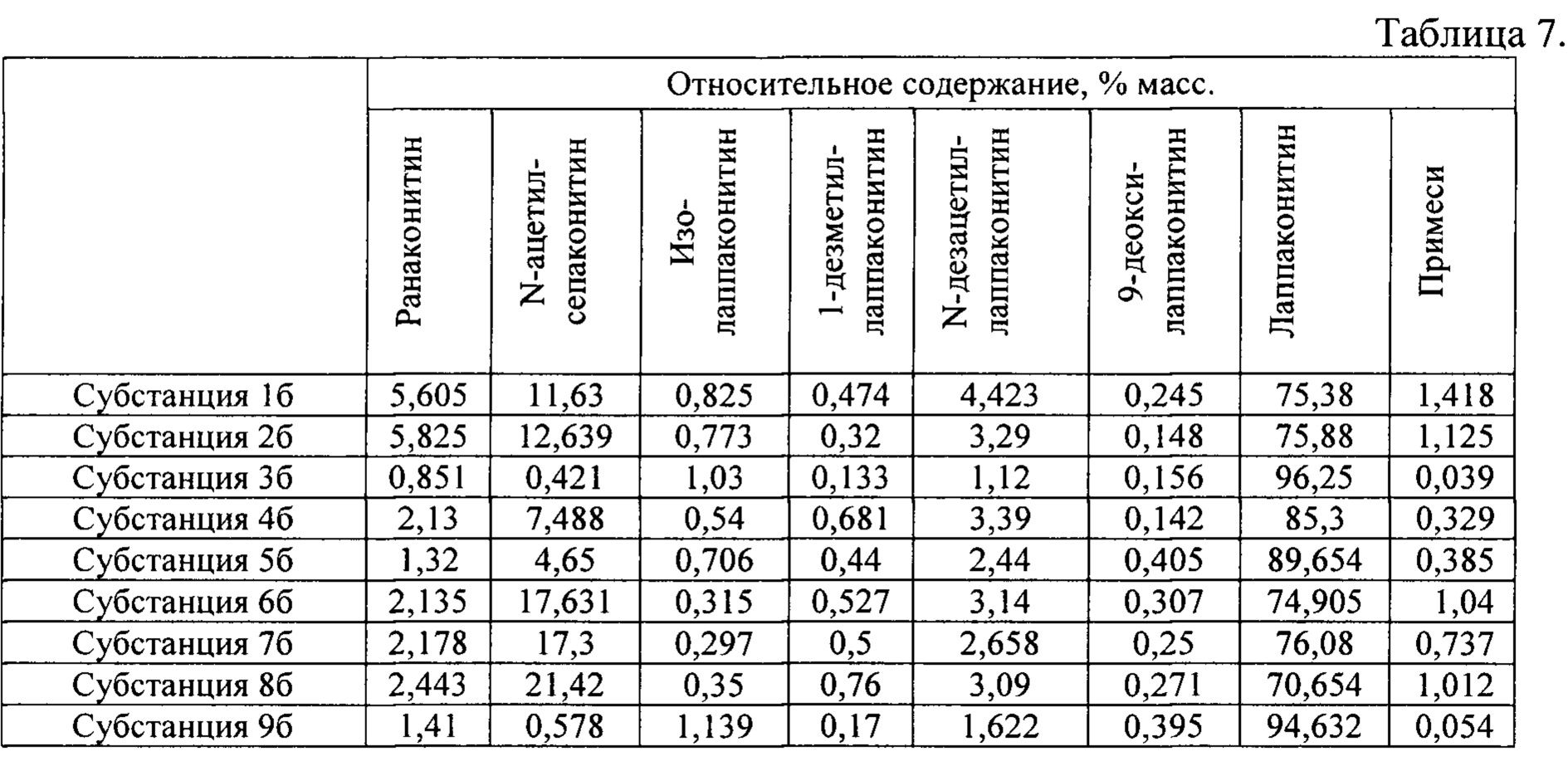
Пример 4
В результате реализации способа получения заявленного средства, описанного выше, из корневищ с корнями борца северного получены фармацевтические субстанции: 1в, 2в, 3в, 4в, 5в, 6в, 7в, 8в, 9в, включающие в себя сульфаты алкалоидов: лаппаконитина, N-ацетилсепаконитина, 1-дезметиллаппаконитина, ранаконитина, N-дезацетиллаппаконитина, изолаппаконитина, 9-деоксилаппаконитина, относительные массовые содержания которых представлены в таблице 8.
В условиях проведения анализа согласно методике определения компонентов сигнал, регистрируемый прибором, определяется структурой самих алкалоидов и не зависит от типа соли.
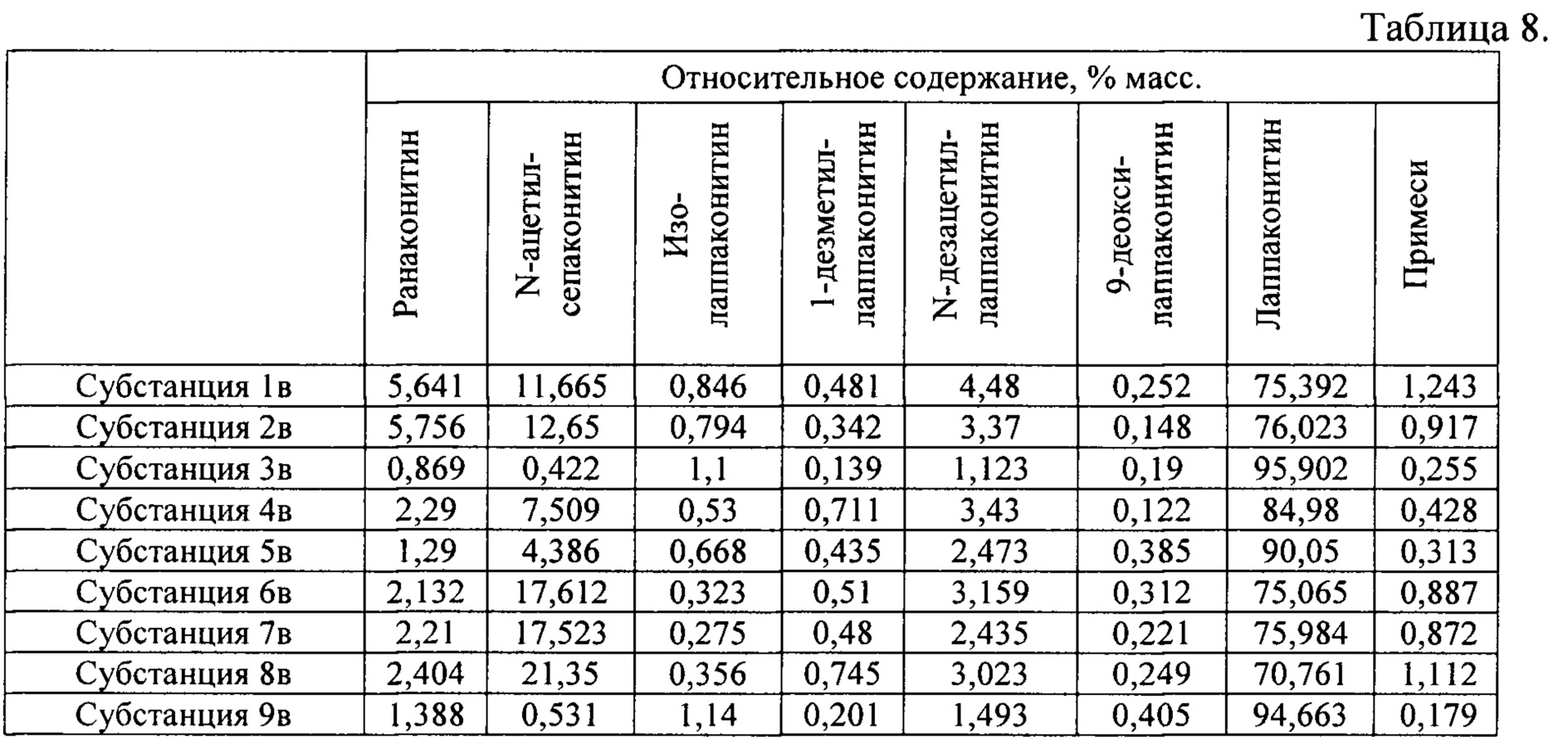
Пример 5
В результате реализации способа получения заявленного средства, описанного выше, из корневищ с корнями борца северного получены фармацевтические субстанции: 1г, 2г, 3г, 4г, 5г, 6г, 7г, 8г, 9г, включающие в себя сукцинаты алкалоидов: лаппаконитина, N-ацетилсепаконитина, 1-дезметиллаппаконитина, ранаконитина, N-дезацетиллаппаконитина, изолаппаконитина, 9-деоксилаппаконитина, относительные массовые содержания которых представлены в таблице 9.
В условиях проведения анализа согласно методике определения компонентов сигнал, регистрируемый прибором, определяется структурой самих алкалоидов и не зависит от типа соли.
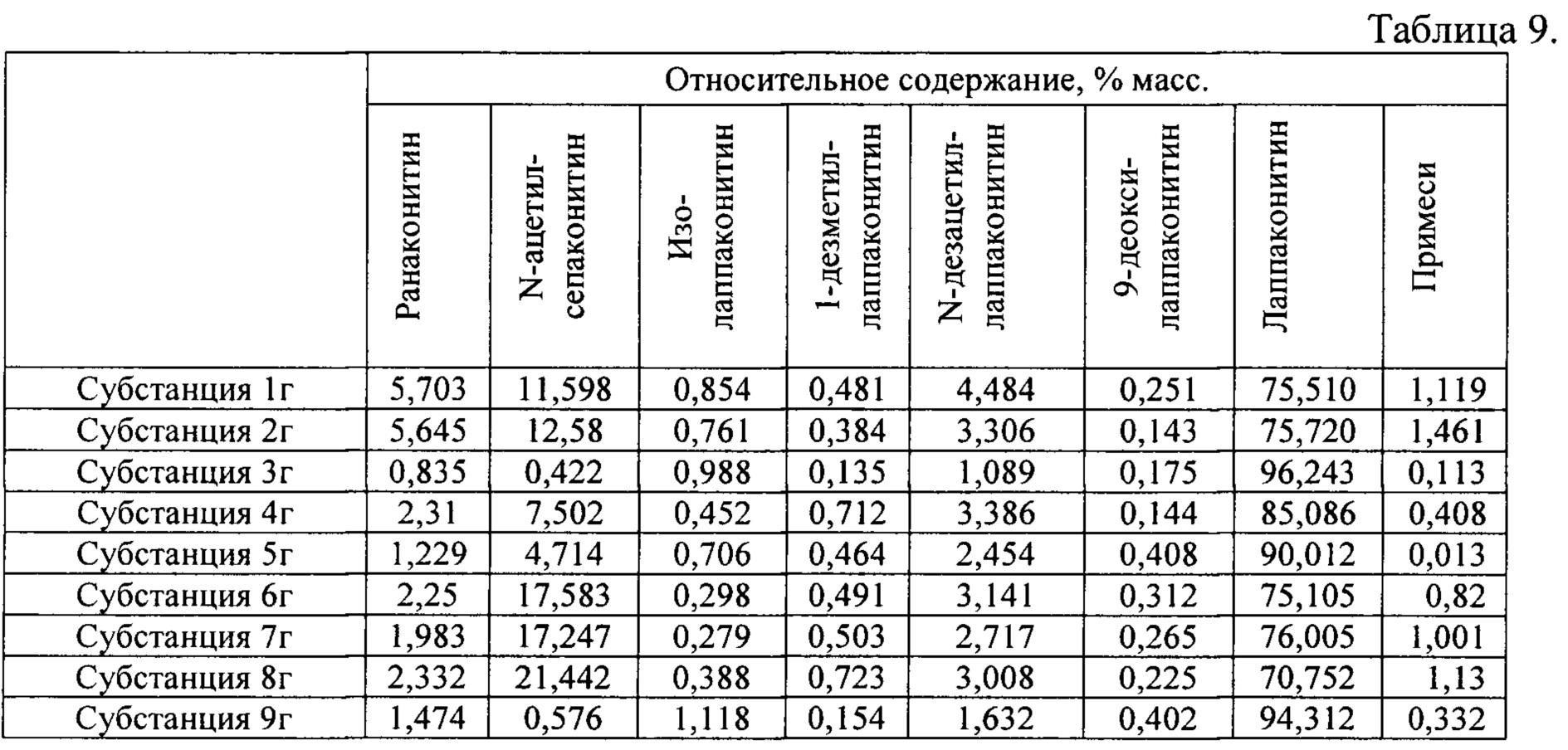
Пример 6
В результате реализации способа получения заявленного средства, описанного выше, из корневищ с корнями борца северного получены фармацевтические субстанции: 1д, 2д, 3д, 4д, 5д, 6д, 7д, 8д, 9д, включающие в себя фумараты алкалоидов: лаппаконитина, N-ацетилсепаконитина, 1-дезметиллаппаконитина, ранаконитина, N-дезацетиллаппаконитина, изолаппаконитина, 9-деоксилаппаконитина, относительные массовые содержания которых представлены в таблице 10.
В условиях проведения анализа согласно методике определения компонентов сигнал, регистрируемый прибором, определяется структурой самих алкалоидов и не зависит от типа соли.
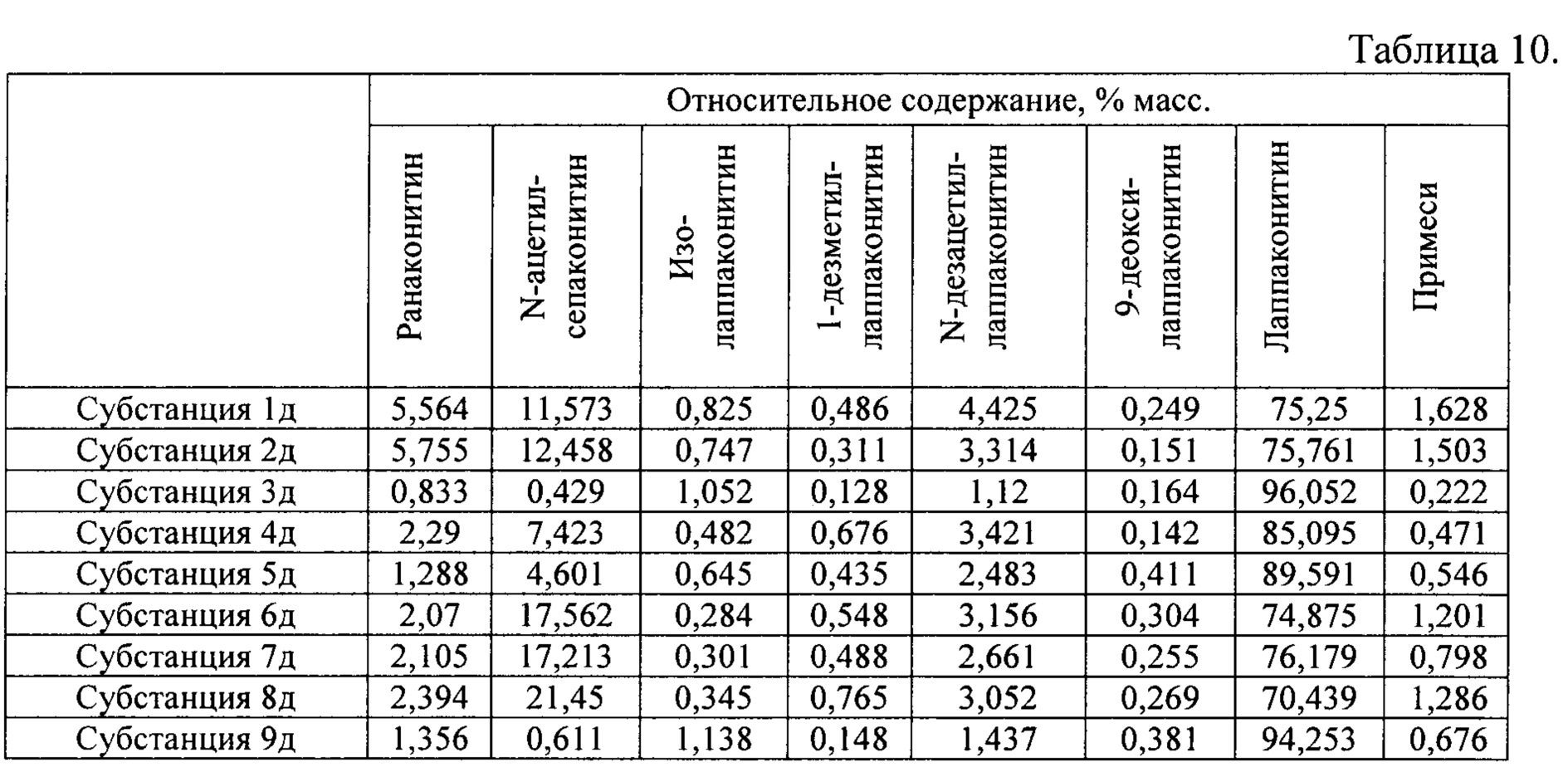
Пример 7
В результате реализации способа получения заявленного средства, описанного выше, из корневищ с корнями борца северного получены фармацевтические субстанции: 1е, 2е, 3е, 4е, 5е, 6е, 7е, 8е, 9е, включающие в себя оксалаты алкалоидов: лаппаконитина, N-ацетилсепаконитина, 1-дезметиллаппаконитина, ранаконитина, N-дезацетиллаппаконитина, изолаппаконитина, 9-деоксилаппаконитина, относительные массовые содержания которых представлены в таблице 11.
В условиях проведения анализа согласно методике определения компонентов сигнал, регистрируемый прибором, определяется структурой самих алкалоидов и не зависит от типа соли.
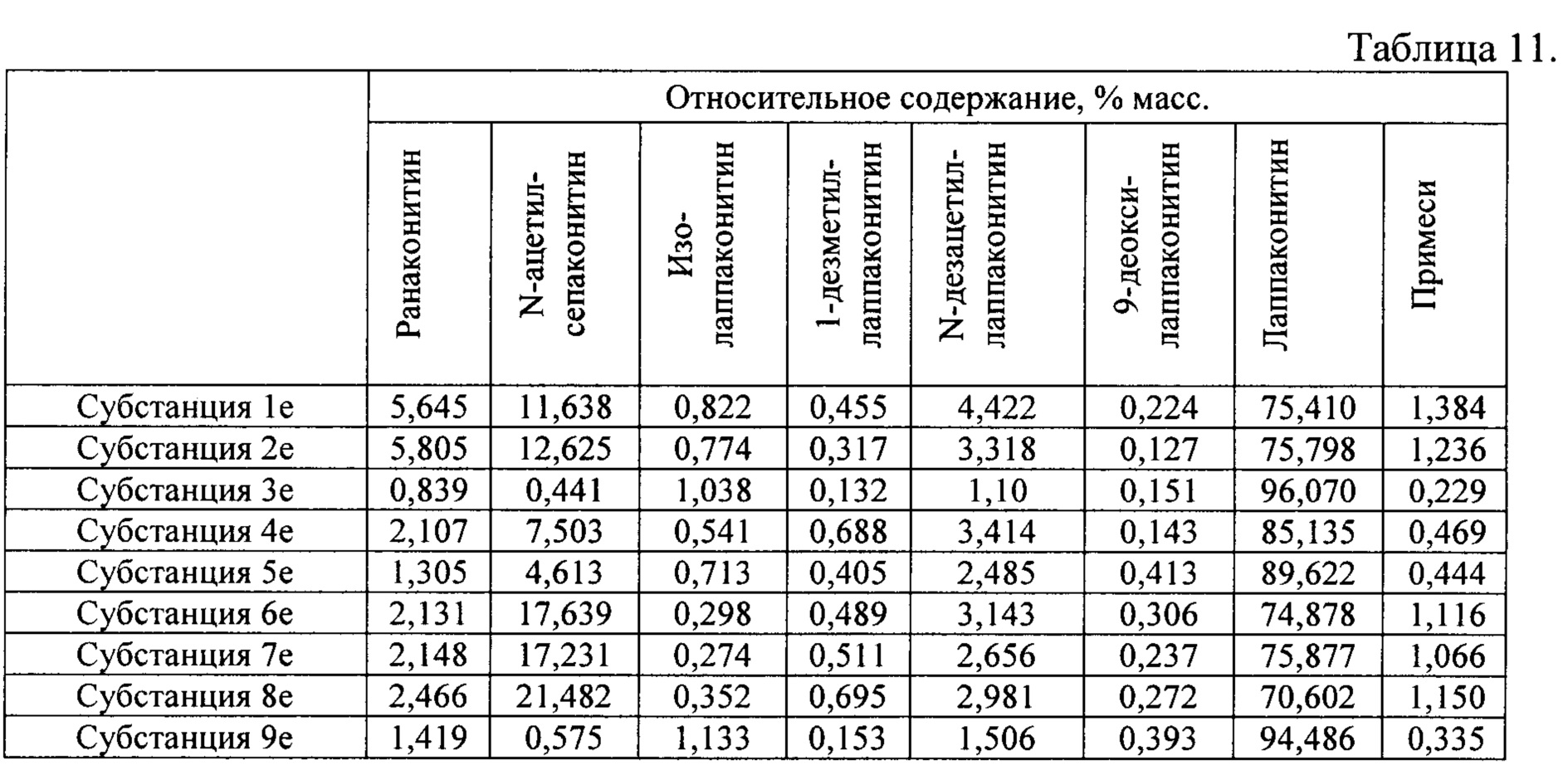
Пример 8
В результате реализации способа получения заявленного средства, описанного выше, из корневищ с корнями борца северного получены фармацевтические субстанции: 1ж, 2ж, 3ж, 4ж, 5ж, 6ж, 7ж, 8ж, 9ж, включающие в себя малонаты алкалоидов: лаппаконитина, N-ацетилсепаконитина, 1-дезметиллаппаконитина, ранаконитина, N-дезацетиллаппаконитина, изолаппаконитина, 9-деоксилаппаконитина, относительные массовые содержания которых представлены в таблице 12.
В условиях проведения анализа согласно методике определения компонентов сигнал, регистрируемый прибором, определяется структурой самих алкалоидов и не зависит от типа соли.
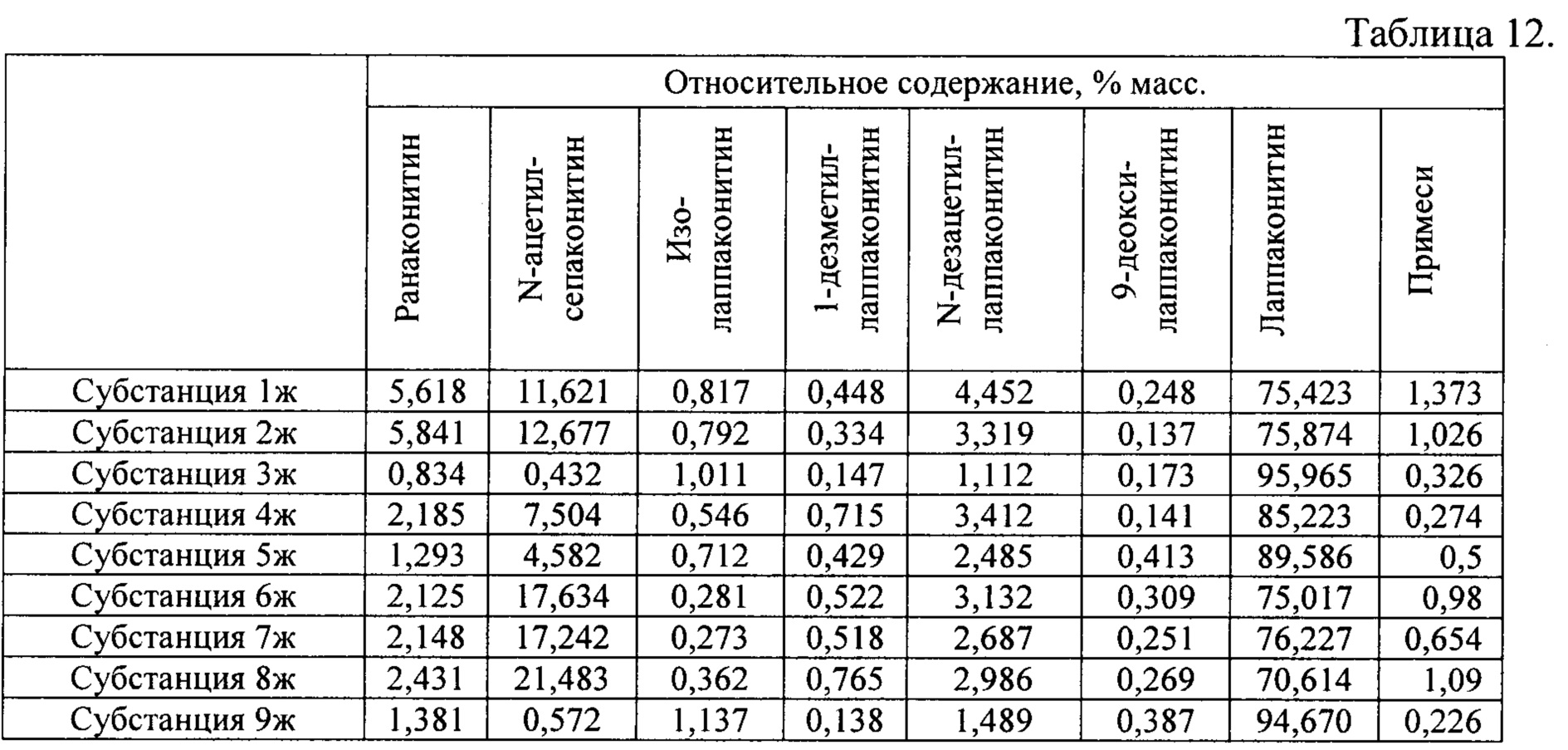
Пример 9
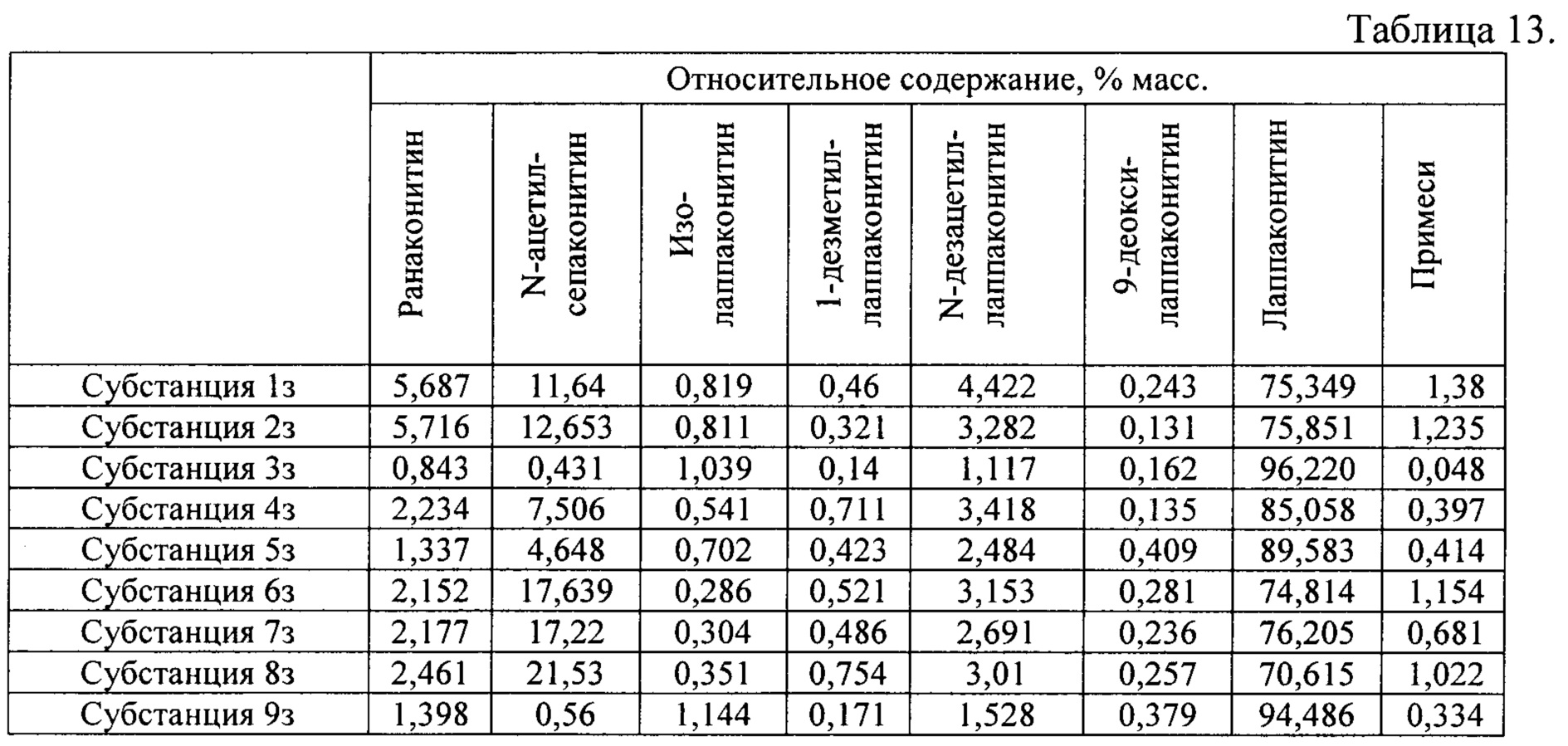
В результате реализации способа получения заявленного средства, описанного выше, из корневищ с корнями борца северного получены фармацевтические субстанции: 1з, 2з, 3з, 4з, 5з, 6з, 7з, 8з, 9з, включающие в себя тартраты алкалоидов: лаппаконитина, N-ацетилсепаконитина, 1-дезметиллаппаконитина, ранаконитина, N-дезацетиллаппаконитина, изолаппаконитина, 9-деоксилаппаконитина, относительные массовые содержания которых представлены в таблице 13.
В условиях проведения анализа согласно методике определения компонентов сигнал, регистрируемый прибором, определяется структурой самих алкалоидов и не зависит от типа соли.
Пример 10
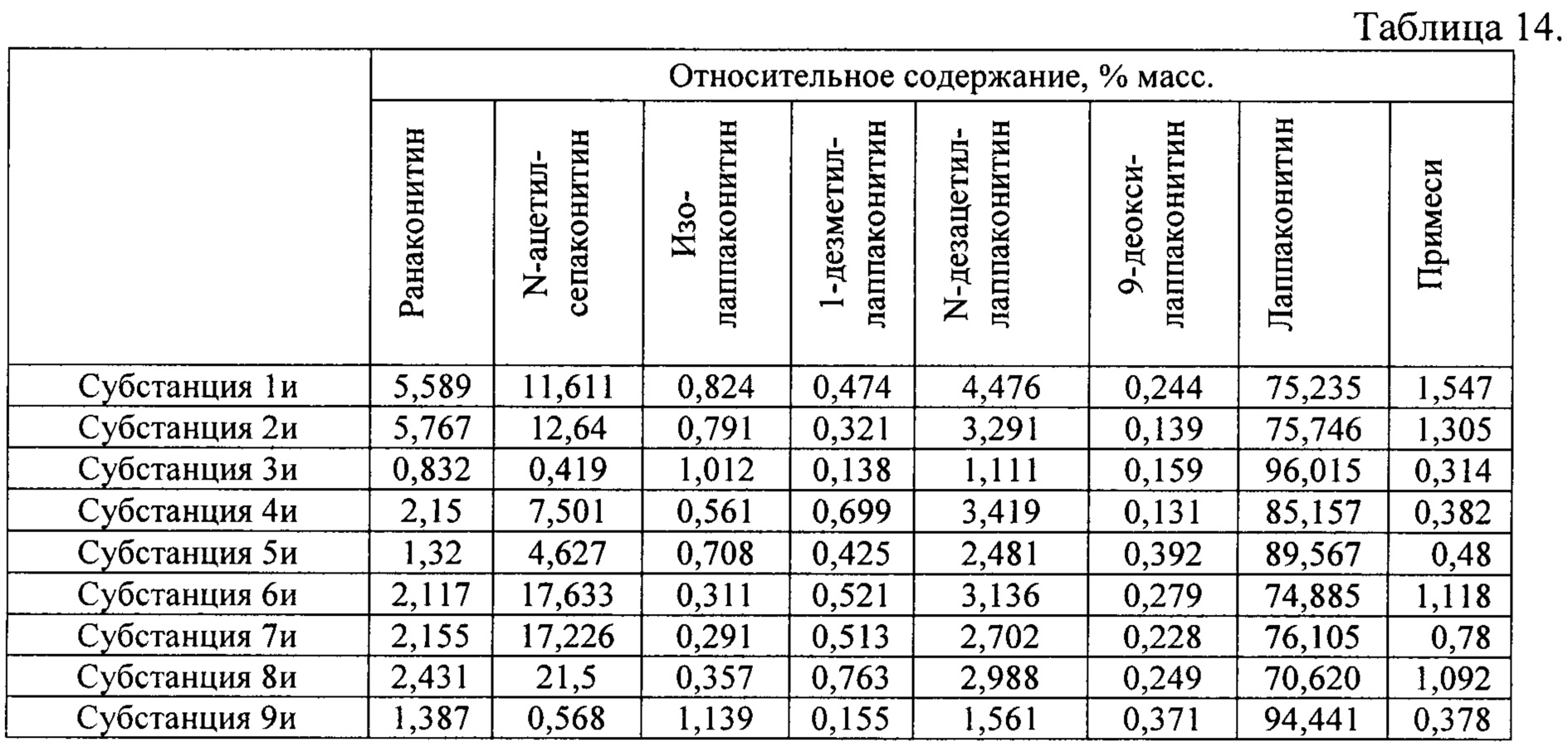
В результате реализации способа получения заявленного средства, описанного выше, из корневищ с корнями борца северного получены фармацевтические субстанции: 1и, 2и, 3и, 4и, 5и, 6и, 7и, 8и, 9и, включающие в себя малеаты алкалоидов: лаппаконитина, N-ацетилсепаконитина, 1-дезметиллаппаконитина, ранаконитина, N-дезацетиллаппаконитина, изолаппаконитина, 9-деоксилаппаконитина, относительные массовые содержания которых представлены в таблице 14.
В условиях проведения анализа согласно методике определения компонентов сигнал, регистрируемый прибором, определяется структурой самих алкалоидов и не зависит от типа соли.
Пример 11
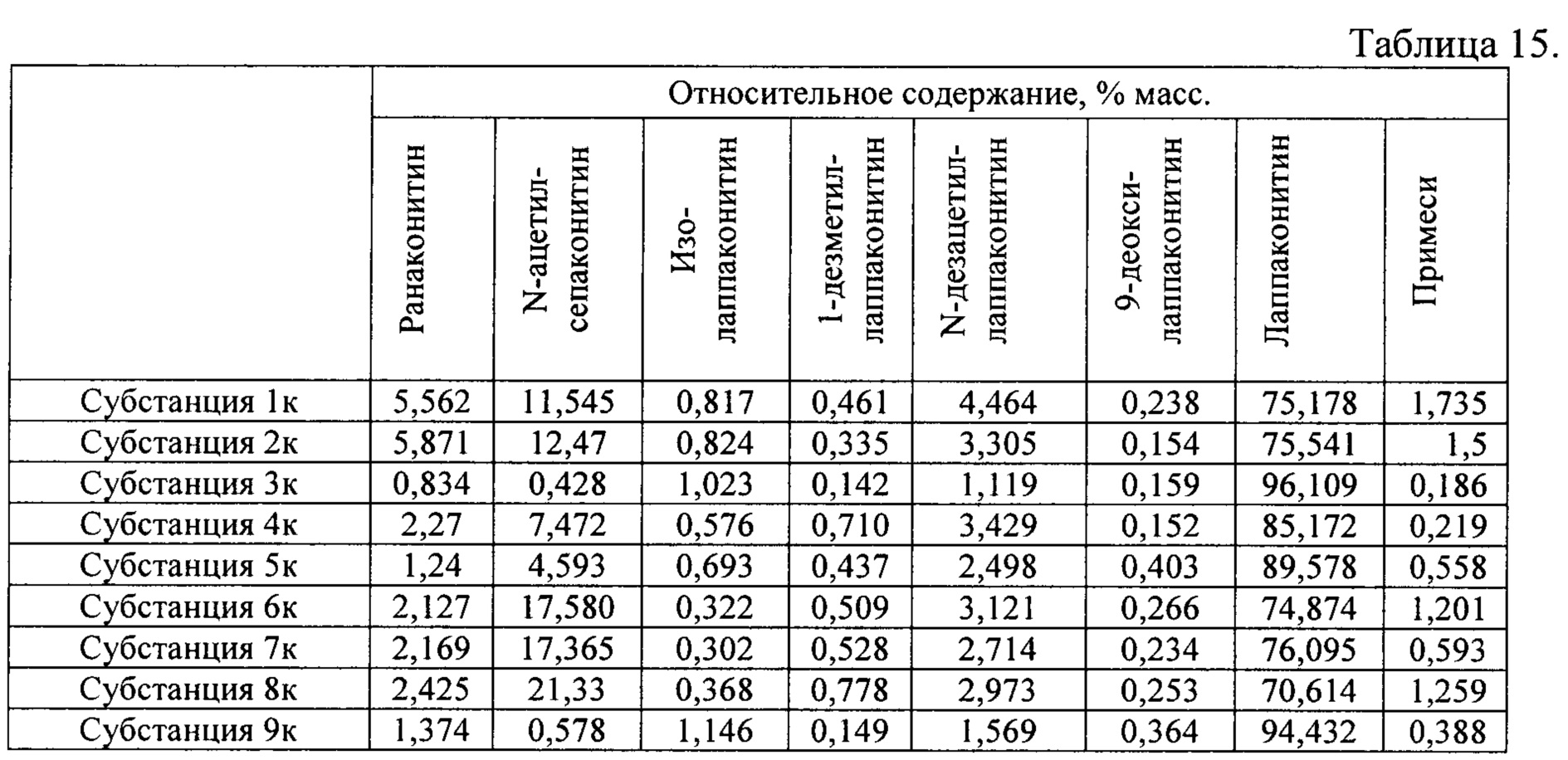
В результате реализации способа получения заявленного средства, описанного выше, из травы борца белоустого получены фармацевтические субстанции: 1к, 2к, 3к, 4к, 5к, 6к, 7к, 8к, 9к, включающие в себя гидробромиды алкалоидов: лаппаконитина, N-ацетилсепаконитина, 1-дезметиллаппаконитина, ранаконитина, N-дезацетиллаппаконитина, изолаппаконитина, 9-деоксилаппаконитина, относительные массовые содержания которых представлены в таблице 15.
В условиях проведения анализа согласно методике определения компонентов сигнал, регистрируемый прибором, определяется структурой самих алкалоидов и не зависит от типа соли.
Пример 12
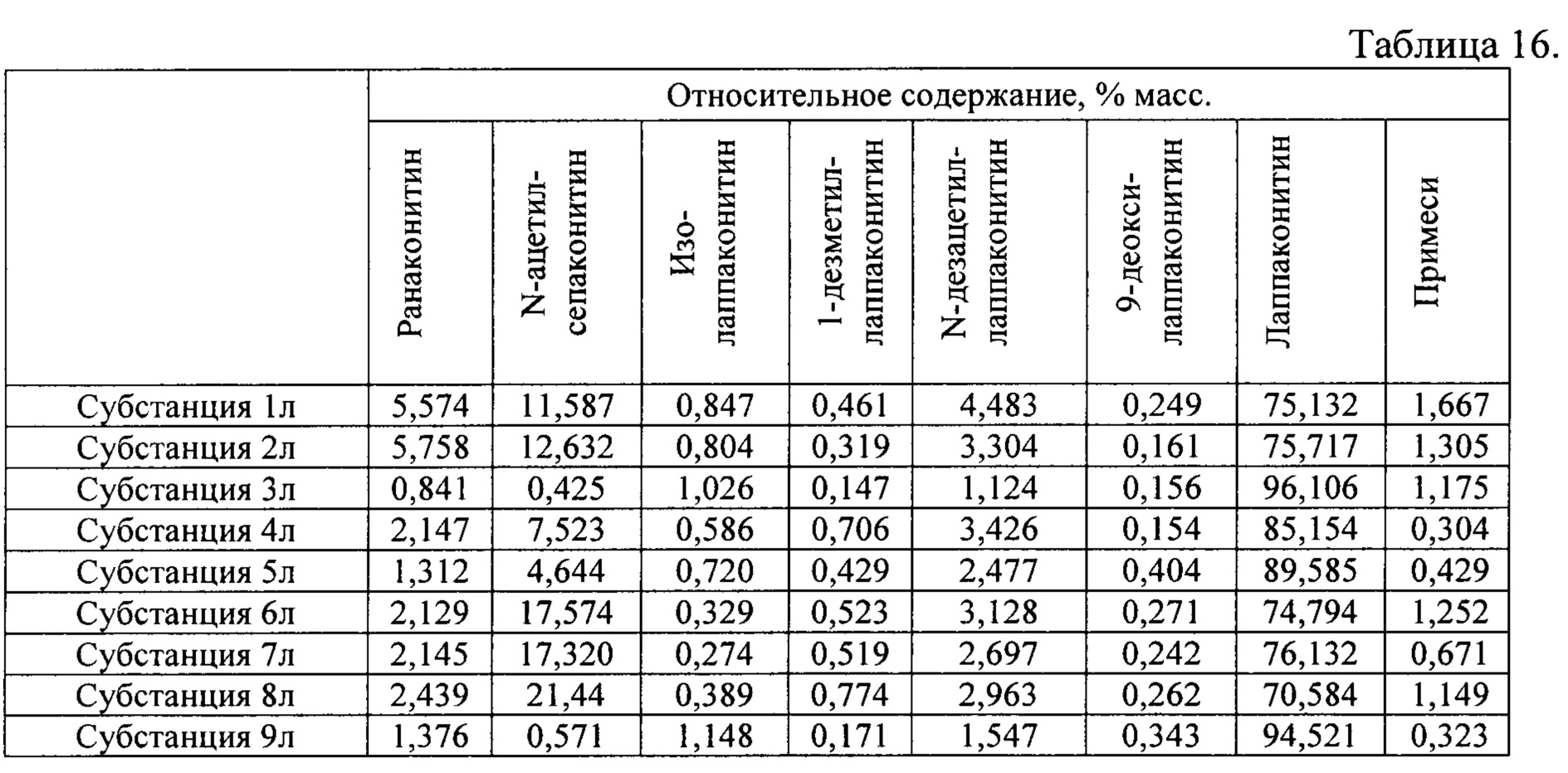
В результате реализации способа получения заявленного средства, описанного выше, из корневищ с корнями борца белоустого получены фармацевтические субстанции: 1л, 2л, 3л, 4л, 5л, 6л, 7л, 8л, 9л, включающие в себя гидробромиды алкалоидов: лаппаконитина, N-ацетилсепаконитина, 1-дезметиллаппаконитина, ранаконитина, N-дезацетиллаппаконитина, изолаппаконитина, 9-деоксилаппаконитина, относительные массовые содержания которых представлены в таблице 16.
В условиях проведения анализа согласно методике определения компонентов сигнал, регистрируемый прибором, определяется структурой самих алкалоидов и не зависит от типа соли.
Из примеров 1-12 видно, что приведенные в таблице 4 количественные характеристики компонентов фармацевтической субстанции относятся к заявляемому средству, реализованному как композиция, содержащая алкалоиды лаппаконитин, N-ацетилсепаконитин, 1-дезметиллаппаконитин, ранаконитин, N-дезацетиллаппаконитин, изолаппаконитин, 9-деоксилаппаконитин в несвязанном виде, так и к заявляемому средству, реализованному как композиция, содержащая фармацевтически приемлемые соли указанных алкалоидов, т.е. вне зависимости от типа соли.
Пример 13
Результаты доклинических исследований
Все представленные в примерах 1-12 субстанции были исследованы на предмет наличия различных видов биологической и фармакологической активности на животных.
Таким образом, в приведенных ниже контрольных опытах заявляемое средство применялось как композиция, содержащая алкалоиды лаппаконитин, N-ацетилсепаконитин, 1-дезметиллаппаконитин, ранаконитин, N-дезацетиллаппаконитин, изолаппаконитин, 9-деоксилаппаконитин в несвязанном виде, так и к заявляемое средство, реализованное как композиция, содержащая фармацевтически приемлемые соли указанных алкалоидов, в частности в виде солей из группы гидробромиды, гидрохлориды, сульфаты, сукцинаты, фумараты, оксалаты, малонаты, тартраты и малеаты.
Влияние на развитие аконитиновой аритмии
В контрольных опытах, проведенных на 30 анестезированных крысах, внутривенное введение аконитина в дозе 20 мкг/кг в 100% случаев вызывало аллоритмическую экстрасистолическую аритмию продолжительностью от 59 до 156 минут.
Для создания модели аконитиновой аритмии животным внутривенно вводили аконитин через 10 минут после внутривенного введения исследуемой субстанции. В результате эксперимента на 40 белых беспородных крысах был выявлен антиаритмический эффект исследуемых субстанций в дозе от 0,028 мкг/кг. В дозах 0,23-1,05 мг/кг исследуемые субстанции предотвращали возникновение аконитиновой аритмии у 100% животных.
Таким образом, при внутривенном введении исследуемые субстанции предотвращали возникновение различных нарушений ритма и проводимости сердца, вызванных введением аконитина, что характеризует выраженное профилактическое антиаритмическое действие исследуемых субстанций.
Антиаритмическая активность на модели аконитиновой аритмии
Исследование было проведено на 50 белых беспородных крысах. Аконитин вводили внутривенно в дозе 15-20 мкг/кг и через 5 минут на фоне возникшей аритмии внутривенно вводили исследуемую субстанцию. В результате исследования было выявлено, что исследуемые субстанции обладают выраженным антиаритмическим действием в дозах 0,34-0,50 мг/кг, что приводит к полному устранению аритмии и восстановлению нормального синусового ритма в течение 20 минут после введения исследуемых субстанций.
Влияние на смертельную фибрилляцию сердца, индуцированную аконитином у крыс
В рамках исследования были проведены контрольные опыты, в которых введение аконитина интактным крысам в дозе 40 мкг/кг, в среднем через 23,5±5,6 секунд приводило к возникновению желудочковой экстрасистолии, которая трансформировалась в трепетание и фибрилляцию желудочков, заканчиваясь в течение 10-15 мин 100% летальным исходом.
В результате профилактического введения крысам исследуемых субстанций в дозе 0,2 мг/кг отмечалась 60% (6 из 10) выживаемость животных, что свидетельствует о том, что исследуемые субстанции предупреждают развитие смертельной фибрилляции сердца.
В результате профилактического введения крысам исследуемых субстанций в дозах 1-2 мг/кг отмечалась 100% (10 из 10) выживаемость животных, что свидетельствует о том, что в данном диапазоне доз исследуемые субстанции проявляют выраженный противофибрилляторный эффект и полностью предупреждают смертельную фибрилляцию предсердий.
Продолжительность антиаритмического действия
Исследование было проведено на 60 белых беспородных крысах. Растворы исследуемых субстанций вводили внутрижелудочно в дозах 2 и 4 мг/кг за 2, 4, 6, 8, 10, 12, 24 часов до введения аконитина. В результате исследования было показано, что внутрижелудочное введение растворов исследуемых субстанций в обеих исследуемых дозах за 2, 4, 6, 8, 10, 12, 24 часов до введения аконитина предотвращает аритмогенное действие аконитина.
Таким образом, было выявлено, что антиаритмический эффект исследуемых субстанций сохраняется на протяжении 24 часов.
Влияние на порог электрической фибрилляции желудочков сердца крыс
Исследование было проведено на 20 белых беспородных крысах массой 350-400 г. Животные были рандомизированы в 2 группы: контроль (n=10) и животные, которым внутривенно вводили исследуемые субстанции (n=10). Животных интубировали, после чего переводили на искусственное дыхание и производили процедуры стернэктомии и перикардотомии. В миокард левого желудочка на расстоянии 0,5 см друг от друга имплантировали два позолоченных электрода. Порог электрической фибрилляции сердца определялся повторяющимся сканированием уязвимого периода сердечного цикла серией из 20 прямоугольных импульсов постоянного тока увеличивающейся интенсивности (длительность стимула - 4 мс, частота - 50 имп/с). За порог фибрилляции желудочков принимали минимальную силу тока, вызывающую при двукратном повторении фибрилляцию желудочков. В опыт отбирали только тех животных, у которых фибрилляция желудочков наступала при силе тока не более 6 мА. В течение всего эксперимента регистрировали ЭКГ (II стандартное отведение).
Исследуемые субстанции животным вводили внутривенно в дозе 1 мг/кг с постоянной скоростью и в постоянном объеме. Животным контрольной серии внутривенно вводили 1 мл 0,9% раствора хлорида натрия. Порог электрической фибрилляции сердца определяли через 5, 10, 20, 30, 40 и 60 минут после окончания внутривенного введения препарата.
В контрольной серии опытов порог электрической фибрилляции сердца не изменялся в течение всего периода наблюдения. В результате эксперимента было выявлено, что у всех животных, которым внутривенно вводили исследуемые субстанции, происходило статистически значимое (Р<0,05) увеличение порога электрической фибрилляции сердца.
Таким образом, в результате исследования было показано, что исследуемые субстанции обладают выраженной противофибрилляторной активностью.
Влияние на порог электрической фибрилляции желудочков сердца крыс в условиях острой ишемии миокарда.
Порог электрической фибрилляции желудочков сердца крыс определяли тем же методом, что и при изучении влияния исследуемых субстанций на порог электрической фибрилляции желудочков сердца крыс. Острую ишемию миокарда вызывали одномоментной перевязкой левой коронарной артерии на 1-2 мм ниже ее выхода из-под ушка сердца.
Во время исследования субстанции вводили внутривенно в дозе 1 мг/кг с постоянной скоростью и в постоянном объеме через 30 минут после перевязки коронарной артерии. Порог электрической фибрилляции сердца определяли за 5 минут до перевязки коронарной артерии, через 25 после ее перевязки и через 10, 20, 30 минут после окончания внутривенного введения исследуемой субстанции.
В результате исследования было показано, что одномоментная перевязка левой коронарной артерии вызывает статистически значимое (Р<0,05) снижение порога электрической фибрилляции сердца. Исследуемые субстанции, вводимые через 30 минут после перевязки коронарной артерии, значимо (Р<0,05), практически до исходного уровня, повышают порог электрической фибрилляции сердца и таким образом и в условиях ишемии миокарда проявляют выраженную противофибрилляторную активность.
Влияние на фракцию выброса левого желудочка сердца у интактных крыс
Исследование было проведено на наркотизированных 20 белых беспородных крысах массой 350-400 г. Животные были рандомизированы на 2 группы: контрольная (n=10) и животные, которым внутривенно вводили исследуемую субстанцию (n=10). Для эхокардиографических исследований наркотизированных животных фиксировали в положении на спине. Измерения производили в условиях закрытой грудной клетки и спонтанного дыхания. Измерения производили в одномерном М- и двухмерном В-модальных режимах при положении датчика эхокардиографа в парастернальной позиции по длинной оси сердца. В М-модальном режиме оценивали конечно-систолический (КСР) и конечно-диастолический (КДР) размеры левого желудочка сердца, и затем по методу Тейхольца рассчитывали такие показатели насосной функции сердца, как фракция выброса (ФВ), фракция укорочения (ФУ), конечно-систолический объем (КСО), конечно-диастолический объем (КДО) левого желудочка, а также ударный объем сердца. Оценку эхокардиографических показателей проводили, как минимум, по пяти последовательным сердечным циклам.
Исследуемую субстанцию вводили внутривенно в дозе 1 мг/кг с постоянной скоростью и в постоянном объеме. Животным контрольной серии внутривенно вводили 1 мл 0,9% раствора хлорида натрия.
Состояние внутрисердечной гемодинамики оценивали через 10, 30, 45 и 60 минут после окончания в/в введения препарата.
В результате исследования было показано, что внутривенное введение исследуемых субстанций в дозе 1 мг/кг не влияет на состояние внутрисердечной гемодинамики, в частности сократительный статус левого желудочка сердца.
Таким образом, заявленное средство, в отличие от эталонных антиаритмических лекарственных средств I и III классов по классификации Vaughan Williams, не обладает отрицательным инотропным действием, т.е. не понижает сократимость миокарда.
Сравнение антиаритмической и противофибрилляторной активности исследуемых субстанций с Хинидином, Прокаинамидом, Этмозином, Верапамилом, Пропранололом и Аллапинином.
В рамках доклинического исследования были проведены несколько сравнительных экспериментов.
Эксперимент 1
Эксперимент был проведен на анестезированных белых беспородных крысах. Целью эксперимента являлось исследование эффективности внутривенного введения исследуемых субстанций и известных антиаритмических средств на модели аконитиновой аритмии, у анестезированных крыс.
Исследуемые субстанции и препараты сравнения вводили в активных дозах за 5-10 минут до внутривенного введения аконитина.
В результате эксперимента было показано, что исследуемые субстанции превосходят известные антиаритмические средства (Хинидин, Прокаинамид, Этмозин, Верапамил, Пропранолол и Аллапинин) по антиаритмической активности и широте антиаритмического действия. Среди эталонных антиаритмических средств при данной форме аритмии наибольшую эффективность показал Этмозин и Аллапинин. Наименее эффективным оказался Верапамил. Лидокаин обладал наименее кратковременным действием.
Необходимо отметить, что внутривенное применение Хинидина, Прокаинамида, Этмозина и Пропранолола в дозах, оказывающих антиаритмическое действие у 50% крыс, приводило к угнетению исходной частоты сердечных сокращений и проводимости, что выражалось в удлинении интервалов R-R, PQ и QT.
В отличие от известных антиаритмических средств исследуемые субстанции в дозах 0,03-0,30 мг/кг, т.е. в дозах, оказывающих антиаритмический эффект у 50-100% крыс, не оказывали значимого влияния на функции синусового узла и предсердно-желудочковую проводимость.
Эксперимент 2
Целью исследования являлось изучение антиаритмической активности сравниваемых соединений при их применении внутрь. Эксперимент проводился на белых беспородных крысах. Исследуемую субстанцию и препараты сравнения вводили в желудок за 60 минут до внутривенного введения аконитина.
В результате исследования было установлено, что исследуемые субстанции по антиаритмической активности и эффективности значительно превосходят известные антиаритмические средства (Хинидин, Прокаинамид, Этмозин, Верапамил, Пропранолол и Аллапинин) при их применении внутрь. Внутрижелудочное введение крысам исследуемых субстанций в дозах 0,4-1 мг/кг за 60 минут до внутривенного введения аритмогенной дозы аконитина (20 мкг/кг) полностью предупреждает развитие нарушений ритма сердца у 50-100% животных.
Эксперимент 3
Целью исследования являлось сравнение профилактической эффективности исследуемых субстанций и известных антиаритмических средств (Хинидин, Прокаинамид, Этмозин, Верапамил, Пропранолол и Аллапинин) при необратимой фибрилляции сердца, вызванной введением аконитина в абсолютно смертельной дозе 200 мкг/кг (ЛД100). Опыты проводились на бодрствующих мышах массой 20-24 г. Препараты вводили внутрибрюшинно в активных дозах за 25-30 минут до внутривенного введения аконитина. В качестве критерия оценки широты терапевтического (антиаритмического) действия использовали соотношение ЛД50/ЭД50.
В результате исследования в 80 контрольных опытах внутривенное введение мышам аконитина в дозе 200 мкг/кг приводило к развитию необратимой фибрилляции сердца и гибели 100% животных в течение первых 60 минут.
Предварительное внутрибрюшинное введение мышам исследуемых субстанций в дозах 0,3-0,5-1-2-5 мг/кг до внутривенного введения абсолютно смертельной дозы аконитина предупреждает наступление необратимой фибрилляции сердца и предохраняет от гибели 30-50-80-80-95% животных, соответственно.
По противофибрилляторной активности, эффективности и широте противофибрилляторного действия исследуемые субстанции значительно превосходят известные антиаритмические средства.
Таким образом, результаты сравнительных исследований показали, что исследуемые субстанции при различных способах применения превосходят Хинидин, Прокаинамид, Этмозин, Верапамил, Пропранолол и Аллапинин по антиаритмической активности и широте терапевтического (антиаритмического) действия.
Исследуемые субстанции в эффективных антиаритмических дозах в отличие от большинства антиаритмических средств не оказывают угнетающего влияния на функцию синусового узла и проводимость.
Влияние исследуемых субстанций в сравнении с хинидином и прокаинамидом на аритмию сердца, вызванную бария хлоридом
Исследование проводилось на 60 белых беспородных крысах. В контрольных опытах сразу же после введения раствора бария хлорида в общем состоянии крыс отмечались кратковременные фибриллярные, фасцикулярные и спастические сокращения мышц, нарушения со стороны дыхания, резкая бледность, а затем цианоз видимых слизистых, непроизвольное мочеиспускание, диарея. Из 15 контрольных животных, получивших бария хлорид в дозе 20 мг/кг, 60% (12/15) крыс погибли.
По результатам ЭКГ через 30-60 секунд после введения бария хлорида отмечалась брадикардия и аритмия. Нарушения ритма в основном были желудочкового типа, в виде желудочковой бигеминии, тригеминии, групповых экстрасистол, кратковременной асистолии желудочков, трепетания и фибрилляции желудочков. Кроме того, отмечались различные виды нарушения проводимости и повышение сегмента ST выше изолинии.
Внутривенное введение исследуемых субстанций в дозах 0,05-0,1 мг/кг за 10 мин до введения бария хлорида предупреждало развитие аритмии у 60-90% крыс. Антиаритмический эффект исследуемых субстанций сочетается с антитоксическим действием, по отношению к летальности от бария хлорида. Так, антитоксический эффект исследуемых субстанций в дозе 0,05 мг/кг отмечается у 40%, а в дозе 0,1 мг/кг - у 60% крыс.
У крыс, предварительно получивших исследуемые субстанции, внешние явления картины интоксикации от введения бария хлорида были слабо выражены или же полностью отсутствовали.
В аналогичных условиях опыта Хинидин в дозах 5 мг/кг и 10 мг/кг по антиаритмическому и антитоксическому эффекту примерно соответствовал таковому для исследуемых субстанций в дозах 0,05 мг/кг и 0,1 мг/кг.
Прокаинамид на данной модели аритмии сердца проявил наиболее слабую антиаритмическую и антитоксическую активность, что соответствует и литературным данным.
Таким образом, исследуемые субстанции на модели аритмии сердца желудочкового типа, вызванной бария хлоридом, по активности значительно превосходит Хинидин и Прокаинамид.
Экспериментально было установлено, что повышенная антиаритмическая активность предложенного средства достигается за счет наличия в субстанции всех семи основных алкалоидов: лаппаконитин, N-ацетилсепаконитин, 1-дезметиллаппаконитин, ранаконитин, N-дезацетиллаппаконитин, изолаппаконитин, 9-деоксилаппаконитин или их фармацевтически приемлемых солей.
Для подтверждения этого факта дополнительно была получена субстанция 3а, из субстанции по Примеру 2, которая была подвергнута дополнительной физико-химической обработке с целью удаления одного из компонентов - гидробромида алкалоида 9-деоксилаппаконитина. В результате получена субстанция 3а', включающая в себя гидробромиды алкалоидов: лаппаконитина, N-ацетилсепаконитина, 1-дезметиллаппаконитина, ранаконитина, N-дезацетиллаппаконитина, изолаппаконитина, относительные массовые содержания которых представлены в таблице 17.

Исследования, проведенные на различных моделях аритмии, показали, что субстанция 3а' проявляет меньший антиаритмический и антитоксический эффект, чем субстанция 3а, содержащая семь алкалоидов.
Местноанестезирующее действие
Местноанестезирующее действие исследуемых субстанций изучали на 10 кроликах. Влияние на терминальную анестезию исследовали методом Ренье-Валета путем определения роговичного рефлекса на механическое раздражение каждые 5-10 мин после закапывания 2 капель 0,1%-0,25%-0,5% растворов исследуемых субстанций.
Способность препарата вызывать инфильтрационную анестезию изучали на кроликах методом Бюльбринга-Вайда (болевым методом).
Определяли время наступления анестезии, ее глубину и продолжительность. Сравнение активности исследуемых субстанций при поверхностной анестезии проводили по отношению к дикаину; при инфильтрационной - по отношению к новокаину.
Результаты исследования показали, что исследуемые субстанции вызывают поверхностную анестезию. Время наступления поверхностной анестезии при инсталляции в конъюнктивальный мешок кролику 0,1%, 0,25% и 0,5% растворов исследуемых субстанций составило 6,3±2,9 минут.
Длительность терминальной анестезии глаза кролика, вызванной 0,1% раствором исследуемых субстанций, составила около 3 часов; при инсталляции 0,25% и 0,5% растворов - 4 часа и 6 часов соответственно.
В аналогичном эксперименте дикаин в концентрациях 0,1% и 0,5% через 1-2 мин вызывает терминальную анестезию роговицы глаза кролика, длительностью в среднем 37 мин и 52 мин соответственно. Следовательно, исследуемые субстанции обладают выраженным анестезирующим действием. По анестезирующей активности исследуемые субстанции равны дикаину, но по длительности эффекта они превосходят дикаин. По глубине анестезии исследуемые субстанции уступают дикаину.
Результаты исследования способности исследуемых субстанций вызывать инфильтрационную анестезию показали, что через 10-15 мин после внутрикожного введения кролику 0,05% и 0,1% растворов наступает анестезия, характеризующаяся увеличением порога болевого раздражения, продолжительность действия которого составляет 24-48 часов.
В одинаковых условиях опыта местноанестезирующее действие 0,5% раствора новокаина длится в среднем 90 мин.
Таким образом, исследуемые субстанции обладают выраженным и длительным местноанестезирующим действием.
Влияние на асептическое воспаление, вызванное у животных введением формалина, гистамина, полиглюкина и серотонина
Противовоспалительную активность исследуемых субстанций изучали в опытах на белых беспородных крысах.
Асептическое воспаление вызывали субплантарным введением в правую заднюю лапку крыс раствора формалина (0,2 мл 1%), гистамина (0,1 мл 0,01%), полиглюкина (0,1 мл 6%) и серотонина (0,1 мл 0,01%). Объем лапы измеряли онкометрически. Исследуемые субстанции вводили внутрибрюшинно за 2-3 ч до воспроизведения асептического воспаления. О противовоспалительной активности судили по разнице объема лапок контрольных и подопытных животных.
Результаты опытов показали, что исследуемые субстанции в дозах 1-5 мг/кг обладают выраженным противовоспалительным эффектом, наиболее выраженным на модели гистаминового воспаления.
Исследование противосудорожной активности (противоэпилептический эффект)
Исследования прогнозируемой противосудорожной активности выполнены на белых нелинейных крысах-самцах массой 150-180. Животным опытных групп (n=10) интрагастрально однократно вводили исследуемые субстанции в дозах 1-5 мг/кг. Судорожное состояние у животных моделировали путем однократного подкожного введения пентилентетразола (коразола) в дозе 80 мг/кг. Определение времени тестирования базировалось на данных о пике противосудорожной активности препаратов. О выраженности противосудорожного действия судили по динамике латентного периода судорог, характеру и длительности судорог в минутах, а также показателю летальности. Исследуемые субстанции вводили за 1 час до введения конвульсанта. Интенсивность судорожного приступа оценивали при помощи 5-бальной шкалы: 0 - отсутствие судорожной активности; 1 - гиперкинезия; 2 - дрожание, подергивание; 3 - клонические судороги передних лап с подъемом на задние лапы; 4 - выраженные тонико-клонические судороги, падение животного на бок, наличие фазы тонической экстензии; 5 - повторные клонико-тонические судороги, утрата позы, гибель. Противосудорожным действием считали защиту животных от развития клонических, тонических судорог и летальности.
Результаты показали, что в контрольной группе животных после введения коразола длительность латентного периода судорог составила в среднем 5,75 мин, а длительность судорог - 6,00 мин. Судорожный синдром, который развивался у крыс этой группы, сопровождался выраженными тонико-клоническими конвульсиями, которые периодически повторялись, присутствовала четко выраженная фаза тонической экстензии (опистотонус). Летальность в данной группе составила 100%. Исследуемые субстанции препятствовали развитию судорожного синдрома у 64%) животных и способствовали предупреждению летальности у 90% животных.
Исследование бронхолитического эффекта (ХОБЛ)
В опытах, проведенных на кроликах с моделью ХОБЛ бронхиальной астмы (n=6), после введения исследуемых субстанций через 15 минут отмечалось уменьшение частоты дыхания в среднем на 13 в 1 минуту, уменьшалось количество хрипов. Бронхолитический эффект продолжался в течение 2 часов.
Исследование острой токсичности
Изучение острой токсичности исследуемых субстанций проводили при однократном введении мышам и крысам внутривенно, внутрибрюшинно и внутрь в диапазоне доз от минимально смертельных до абсолютно смертельной. Острая токсичность исследуемых субстанций у различных животных при разных способах введения представлена в таблице 18.

Картина острого отравления у лабораторных животных характеризуется вялостью, адинамией, заторможенностью, снижением мышечного тонуса, нарушением координации движений, угнетением дыхания. Затем начинаются клонические судороги, смерть наступает при явлениях асфиксии.
Исследование хронической токсичности
При изучении хронической токсичности использовалось ежедневное введение исследуемых субстанций в течение 6 месяцев внутрижелудочно крысам в дозах 1-10 мг/кг. Длительное введение в указанных дозах не вызывало гибели животных, изменений в поведении, приросте массы, в гистоморфологии внутренних органов, картине периферической крови и функциональном состоянии почек.
При макроскопическом осмотре внутренних органов животных опытных и контрольных групп видимых патологических изменений не обнаружено. Морфологическими исследованиями тканей внутренних органов и мозга животных, получавших исследуемые субстанции в течение указанного срока, выявлены: неравномерное полнокровие сосудов внутренних органов, зернистая дистрофия клеток печени, почек и сердца, наблюдаемые и в контрольной группе.
В органах крыс, получавших исследуемые субстанции внутрь в дозе 10 мг/кг (доза, превышающая терапевтическую, в 10-20 раз) в течение 6 месяцев, отмечены резкий отек ткани мозга и отслоение на большом протяжении мягкой мозговой оболочки. В сердце выявлены очаговые, местами диффузные кровоизлияния между мышечными волокнами; в печени - деструкция и микронекрозы паренхимы; в почках - картина некротического нефроза; в желудочно-кишечном тракте - очаги геморрагии в подслизистом и мышечных слоях, дистония и плазморрагия стенок сосудов.
Пример 14
Получена фармацевтическая композиция для перорального применения, представляющая собой плоскоцилиндрическую таблетку, состав которой приведен в таблице 19.

Проведенные исследования показали, что заявленное средство обладает антиаритмической активностью на моделях, воспроизводящих различные нарушения ритма сердца, включая наиболее опасную для жизни - фибрилляцию.
Антиаритмические свойства заявленного средства изучали на аконитиновой и хлорид-бариевой моделях аритмии сердца. В качестве препаратов сравнения использовали ряд известных антиаритмических средств. Проведенные исследования показали, что заявленное средство обладает высокой антиаритмической активностью на моделях, воспроизводящих различные нарушения ритма сердца, включая наиболее опасную для жизни - фибрилляцию желудочков и сократительную способность миокарда. Заявленное средство проявляет выраженную высокую эффективность на обеих моделях аритмий, но в отличие от эталонных антиаритмических лекарственных средств I и III классов по классификации Vaughan Williams не обладает отрицательным инотропным действием, т.е. не понижает сократимость миокарда.
Проведенные исследования также показали, что заявленное средство в эксперименте с животными на модели ХОБЛ показало бронхолитические свойства и, как следствие, может рассматриваться в качестве потенциального средства терапии при ХОБЛ и сопровождающих его аритмиях. В исследовании было показано, что заявленное средство также обладает противоэпилептическим эффектом, противовоспалительным действием, выраженным и длительным местноанестезирующим действием.
Результаты доклинических исследований подтвердили наличие у заявляемого средства биологической и фармакологической активности, в частности антиаритмического, бронхолитического, противоэпилептического, противовоспалительного и местноанестезирующого действия, как в случае применения в виде композиции, содержащей алкалоиды лаппаконитин, N-ацетилсепаконитин, 1-дезметиллаппаконитин, ранаконитин, N-дезацетиллаппаконитин, изолаппаконитин, 9-деоксилаппаконитин в несвязанном виде, так и в виде композиции, содержащей фармацевтически приемлемые соли указанных алкалоидов, в частности в виде солей из группы гидробромиды, гидрохлориды, сульфаты, сукцинаты, фумараты, оксалаты, малонаты, тартраты и малеаты.
Пример 15
Методика определения компонентов фармацевтической субстанции
Анализ состава фармацевтической субстанции проводят методом высокоэффективной жидкостной хроматографии на жидкостном хроматографе любого типа, снабженном ультрафиолетовым детектором и масс-детектором (тип детектора - ионная ловушка).
Необходимые приборы, реактивы и материалы.
- Жидкостный хроматограф любого типа;
Хроматографическая система, необходимая для анализа, должна содержать, по крайней мере, следующие элементы:
Один насос высокого давления, проточный дегазатор для подвижной фазы, автоинжектор для автоматического ввода проб, хроматографическую колонку и ультрафиолетовый детектор. Наличие второго насоса (для промывки колонки), термостата для проведения анализов при постоянной температуре и масс-детектора для идентификации компонентов.
- Аналитическая хроматографическая колонка ReproSil - Pur Basic С18, 5 мкм 250*4,6 мм производства Dr. Maisch GmbH с предколонкой;
- рН метр с точностью измерения уровня рН до сотых долей, откалиброванный;
- Магнитная мешалка с мешальником;
- Стеклянные мерные цилиндры и стаканы для приготовления растворов;
- Стеклянные (темного стекла) бутыли с крышками для хранения растворов;
- Мерные колбы на 50 мл для приготовления растворов анализируемых субстанций;
- Ацетонитрил высокого качества, например Acetonitrile for UHPLC Supergradient фирмы Panreac или аналогичного качества;
- Вода высокой степени очистки, пригодная для работы в UHPLC;
- Формиат аммония фармакопейного качества;
- Муравьиная кислота фармакопейного качества (в виде примерно 1% раствора в воде);
- Трифторуксусная кислота.
Подготовка хроматографической системы к анализу.
Для подготовки хроматографической системы к анализу необходимо взять свежеприготовленную подвижную фазу и тщательно заполнить ею гидравлическую линию до колонки. Рекомендуется прокачка подвижной фазой со скоростью 5 мл в мин в течение 30 минут. После этого необходимо уравновесить оставшуюся часть гидравлической линии (колонку, капилляры и детектор) подвижной фазой. Прокачивать подвижную фазу необходимо по всей гидравлической системе со скоростью 1 мл в минуту в течение 120 минут. Если после этого базовая линия на хроматограмме дает дрейф менее 10 mAU за 10 минут, то система готова к проведению анализов.
Определение объема вводимой пробы.
Оптимальный объем вводимой пробы должен быть установлен на каждом приборе индивидуально, так как качество получаемой хроматограммы (высота и ширина пиков) зависит от объема вводимой пробы и геометрических параметров ячейки детектора. Необходимо экспериментально установить оптимальный объем вводимой пробы, при котором высота пика основного компонента будет составлять от 300 до 1000 mAU, а величины пиков интересующих примесей от 20 до 200 mAU. Эти значения не являются строгими и даны как рекомендуемые. Предположительно, объем вводимой пробы должен быть в диапазоне от 2 до 10 мкл. В дальнейшем указывается усредненное значение данного параметра - 5 мкл.
Проведение анализа.
По 5 мкл испытуемого раствора и стандартного раствора попеременно хроматографируют на жидкостном хроматографе, получая не менее 2 хроматограмм для каждого раствора в следующих условиях.
- используется хроматографическая колонка ReproSil - Pur Basic C18, 5 мкм 250*4,6 мм производства Dr.Maisch GmbH;
- Подвижная фаза приготовлена согласно требованиям раздела «Приготовление подвижной фазы» (см. ниже) из 1 объема ацетонитрила и 3 объемов формиатно-аммонийного буферного раствора (приготовление см. ниже);
- элюирование проводят в изократическом режиме;
- скорость потока подвижной фазы 1,0 мл в мин;
- время интегрирования 40 минут (длительность цикла анализа);
- детектирование при длине волны 220 нм;
- чувствительность детектора устанавливается опытным путем.
Промывка колонки.
После проведения каждых 8-12 циклов анализа колонка нуждается в промывке, что становится заметно по возрастающему уровню давления.
Промывка осуществляется раствором для промывки в течение не менее 60 минут при скорости 1 мл в минуту. Колонка считается промытой, если после 60 минут промывки базовая линия не дает отклонения от «нулевого значения» более 10 mAU. После промывки для проведения анализов необходимо провести процедуру «Подготовка хроматографической системы к анализу (см. выше).
Примечания.
Приготовление формиатно-аммонийного буферного раствора для приготовления подвижной фазы.
200 мг (точная навеска) формиата аммония взвешивают в стеклянном стакане на аналитических весах с точностью до 0,2 мг. 1000 мл чистой воды отмеряют, пользуясь мерным цилиндром. Полностью смывают 1000 мл воды взвешенный формиат аммония из стеклянного стакана для взвешивания в емкость для приготовления буферного раствора. В емкость для приготовления буферного раствора помещают магнитный мешальник, помещают емкость на магнитную мешалку.
После 3-5 минут перемешивания, когда формиат аммония полностью растворится, в емкость опускают электрод рН метра и замеряют полученный уровень рН. Доводят уровень рН до значения 5,00 с помощью 1% раствора муравьиной кислоты. После получения раствора с необходимым уровнем рН содержимое стакана переливают в бутылку объемом 1 л из темного стекла с герметичной крышкой. Готовый формиатно-аммонийный буферный раствор годен для употребления в течение 24 часов при хранении в темном месте при комнатной температуре.
Приготовление подвижной фазы.
В чистый сухой мерный цилиндр объемом 500 мл наливается 100 мл ацетонитрила. После этого ацетонитрил из цилиндра переливается (как можно более полно) в емкость для получения подвижной фазы. Далее, в этот же цилиндр, наливается 300 мл формиатно-аммонийного буферного раствора для приготовления подвижной фазы. Буферный раствор из цилиндра переливается (как можно более полно) в емкость для получения подвижной фазы. Содержимое емкости для получения подвижной фазы перемешивается. Полученная подвижная фаза переливается в бутылку из темного стекла с герметичной крышкой. Подвижная фаза годна для употребления в течение 24 часов.
Приготовление раствора субстанции с идентифицированными примесями (стандартный раствор).
Около 50 мг (точная навеска) субстанции с идентифицированными (методом LCMS или с помощью внешних стандартов) примесями вносят в мерную колбу вместимостью 50 мл и растворяют в подвижной фазе, доводят объем до метки тем же растворителем и перемешивают.
Приготовление раствора испытуемой субстанции (испытуемый раствор).
Около 50 мг (точная навеска) испытуемой субстанции вносят в мерную колбу вместимостью 50 мл и растворяют в подвижной фазе, доводят объем до метки тем же растворителем и перемешивают.
Приготовление раствора для промывки.
В 500 мл ацетонитрила добавляют 500 мкл трифторуксусной кислоты и перемешивают.
Переливают в бутылку темного стекла. Раствор для промывки годен для употребления в течение 1 месяца с момента приготовления.
Методика определения компонентов фармацевтической субстанции в готовой лекарственной форме.
Данная методика разработана для определения компонентов фармацевтической субстанции в составе готовой лекарственной форме в виде таблеток, содержащих 25 мг фармацевтической субстанции. Анализ проводят методом высокоэффективной жидкостной хроматографии на жидкостном хроматографе любого типа, снабженном ультрафиолетовым детектором и масс-детектором (тип детектора - ионная ловушка). В основе данной методики лежит методика определения компонентов фармацевтической субстанции, дополненная необходимой методикой пробоподготовки.
Необходимые приборы, реактивы и материалы.
- Жидкостный хроматограф любого типа;
Хроматографическая система, необходимая для анализа, должна содержать следующие элементы:
Один насос высокого давления, проточный дегазатор для подвижной фазы, автоинжектор для автоматического ввода проб, хроматографическую колонку и ультрафиолетовый детектор. Наличие второго насоса (для промывки колонки), термостата для проведения анализов при постоянной температуре и масс-детектора для идентификации компонентов.
- Аналитическая хроматографическая колонка ReproSil - Pur Basic С18, 5 мкм 250*4,6 мм производства Dr.Maisch GmbH с предколонкой;
- рН метр с точностью измерения уровня рН до сотых долей, откалиброванный;
- Магнитная мешалка с мешальником;
- Ультразвуковая баня любого типа;
- Лабораторная центрифуга, создающая ускорение не менее 15-18 g.
- Стеклянные мерные цилиндры и стаканы для приготовления растворов;
- Стеклянные (темного стекла) бутыли с крышками для хранения растворов;
- Мерные колбы с пробками на 25 мл для приготовления растворов анализируемых образцов;
Автоматические пипетки (с носиками) на 100 мкл и 1000 мкл (откалиброванные);
- Одноразовые пластиковые пробирки с крышками на 1,5 мл или 2,0 мл;
- Ацетонитрил высокого качества, например Acetonitrile for UHPLC Supergradient фирмы Panreac или аналогичного качества;
- Вода высокой степени очистки, пригодная для работы в UHPLC;
- Формиат аммония фармакопейного качества;
- Муравьиная кислота фармакопейного качества (в виде примерно 1% раствора в воде);
- Трифторуксусная кислота.
Пробоподготовка.
Для подготовки анализируемого образца необходимо одну таблетку, содержащую от 20 до 30 мг заявленной фармацевтической субстанции, поместить в мерную колбу объемом 25 мл. После этого в колбу налить 15-20 мл подвижной фазы и поместить колбу во включенную ультразвуковую баню на 7-10 минут. После озвучивания в колбе должна находиться однородная суспензия белого цвета, без видимых кусочков растворяемой таблетки. Далее колба до метки доливается подвижной фазой, закрывается пробкой и несколько раз встряхивается для полного перемешивания.
Далее, с помощью автоматической мерной пипетки, 1 мл суспензии переносится в одноразовую пластиковую пробирку. Пробирка закрывается крышкой и помещается в предварительно уравновешенную центрифугу. Далее пробирка с суспензией центрифугируется в течениеи 7-10 минут при ускорении 15-18 g. После центрифугирования содержимое пробирки должно представлять небольшое количество белого осадка и бесцветный раствор над ним. Далее, с помощью автоматической мерной пипетки 500 мкл бесцветного раствора переносится в виалу хроматографа. Делать это необходимо аккуратно, не допуская попадания осадка в отбираемый объем.
Подготовка хроматографической системы к анализу.
Для подготовки хроматографической системы к анализу необходимо взять свежеприготовленную подвижную фазу и тщательно заполнить ею гидравлическую линию до колонки. Рекомендуется прокачка подвижной фазой со скоростью 5 мл в мин в течение 30 минут. После этого необходимо уравновесить оставшуюся часть гидравлической линии (колонку, капилляры и детектор) подвижной фазой. Рекомендуется прокачивать подвижную фазу по всей гидравлической системе со скоростью 1 мл в минуту в течение 150 минут. Если после этого базовая линия на хроматограмме дает дрейф менее 10 mAU за 10 минут, то система готова к проведению анализов.
Определение объема вводимой пробы.
Оптимальный объем вводимой пробы должен быть установлен на каждом приборе индивидуально, так как качество получаемой хроматограммы (высота и ширина пиков) зависит от объема вводимой пробы и геометрических параметров ячейки детектора. Необходимо экспериментально установить оптимальный объем вводимой пробы, при котором высота пика основного компонента будет составлять от 300 до 1000 mAU, а величины пиков интересующих примесей от 20 до 200 mAU. Эти значения не являются строгими и даны как рекомендуемые. Предположительно, объем вводимой пробы должен быть в диапазоне от 2 до 10 мкл. В дальнейшем указывается усредненное значение данного параметра - 5 мкл.
Проведение анализа.
По 5 мкл раствора испытуемого образца и стандартного раствора попеременно хроматографируют на жидкостном хроматографе, получая не менее 2 хроматограмм для каждого раствора в следующих условиях:
- используется хроматографическая колонка ReproSil - Pur Basic С18, 5 мкм 250*4,6 мм производства Dr. Maisch GmbH;
- Подвижная фаза приготовлена согласно требованиям раздела «Приготовление подвижной фазы» (см. ниже) из 1 объема ацетонитрила и 3 объемов формиатно-аммонийного буферного раствора (приготовление см. ниже);
- элюирование проводят в изократическом режиме;
- скорость потока подвижной фазы 1,0 мл в мин;
- время интегрирования 40 минут (длительность цикла анализа);
- детектирование при длине волны 220 нм;
- чувствительность детектора устанавливается опытным путем.
Промывка колонки.
После проведения каждых 12-15 циклов анализа колонка нуждается в промывке, что становится заметно по возрастающему уровню давления.
Промывка осуществляется раствором для промывки в течение не менее 60 минут при скорости 1 мл в минуту. Колонка считается промытой, если после 60 минут промывки базовая линия не дает отклонения от «нулевого значения» более 10 mAU. После промывки для проведения анализов необходимо провести процедуру подготовки хроматографической системы к анализу (см. выше).
Примечания.
Приготовление формиатно-аммонийного буферного раствора для приготовления подвижной фазы.
200 мг (точная навеска) формиата аммония взвешивают в стеклянном стакане на аналитических весах с точностью до 0,2 мг. 1000 мл чистой воды отмеряют, пользуясь мерным цилиндром. Полностью смывают 1000 мл воды взвешенный формиат аммония из стеклянного стакана для взвешивания в емкость для приготовления буферного раствора. В емкость для приготовления буферного раствора помещают магнитный мешальник, помещают емкость на магнитную мешалку.
После 3-5 минут перемешивания, когда формиат аммония полностью растворится, в емкость опускают электрод рН метра и замеряют полученный уровень рН. Доводят уровень рН до значения 5,00 с помощью 1% раствора муравьиной кислоты. После получения раствора с необходимым уровнем рН содержимое стакана переливают в бутылку объемом 1 л из темного стекла с герметичной крышкой. Готовый формиатно-аммонийный буферный раствор годен для употребления в течение 24 часов при хранении в темном месте при комнатной температуре.
Приготовление подвижной фазы.
В чистый сухой мерный цилиндр объемом 500 мл наливается 100 мл ацетонитрила. После этого, ацетонитрил из цилиндра переливается (как можно более полно) в емкость для получения подвижной фазы. Далее, в этот же цилиндр, наливается 300 мл формиатно-аммонийного буферного раствора для приготовления подвижной фазы. Буферный раствор из цилиндра переливается (как можно более полно) в емкость для получения подвижной фазы. Содержимое емкости для получения подвижной фазы перемешивается. Полученная подвижная фаза переливается в бутылку объемом 1 л из темного стекла с герметичной крышкой. Подвижная фаза годна для употребления в течение 24 часов.
Приготовление раствора субстанции с идентифицированными примесями (стандартный раствор).
Около 25 мг (точная навеска) вещества с заранее идентифицированными компонентами вносят в мерную колбу вместимостью 25 мл и растворяют в подвижной фазе, доводят объем до метки подвижной фазой и перемешивают.
Приготовление раствора испытуемого образца.
Получение данного раствора описано в пункте «Пробоподготовка»
Приготовление раствора для промывки.
В 500 мл ацетонитрила добавляют 500 мкл трифторуксусной кислоты и перемешивают.
Переливают в бутылку темного стекла. Раствор для промывки годен для употребления в течение 1 месяца с момента приготовления.
В результате настоящего изобретения создано эффективное и безопасное кардиопротекторное средство и фармацевтическая композиция на основе этого средства для профилактики и лечения аритмии, обладающие расширенными возможностями предупреждения потенциально злокачественных и злокачественных желудочковых аритмий, фибрилляции желудочков и снижения фракции выброса (индекс сократимости миокарда), являющихся непосредственной причиной внезапной сердечной смерти, а также новыми функциональными возможностями комплексного лечения аритмии, отягченной хронической обструктивной болезнью легких (ХОБЛ) и эпилепсией, а также расширение арсенала кардиопротекторных средств, обладающих высокой антиаритмической активностью при различных формах аритмии.
Реферат
Изобретение относится к фармацевтической промышленности, а именно к средству, обладающему антиаритмическим действием. Средство, обладающее антиаритмическим действием, представляет собой субстанцию, выделенную из растений рода Aconitum (борец) семейства Ranunculaceae (лютиковые), содержащее алкалоиды лаппаконитин, N-ацетилсепаконитин. 1-дезметиллаппаконитин, ранаконитин, N-дезацетиллаппаконитин, изолаппаконитин, 9-деоксилаппаконитин или их фармацевтически приемлемые соли. Фармацевтическая композиция для перорального применения, обладающая антиаритмическим действием. Вышеописанное средство является эффективным и безопасным антиаритмическим средством, снижает риск внезапной сердечной смерти, может применяться в лечении аритмии у больных с хронической обструктивной болезнью легких (ХОБЛ) и эпилепсией, обладает высокой антиаритмической активностью при различных формах аритмии. Предложенное средство, а также композиция на его основе обладают дополнительными лечебными свойствами, а именно бронхолитическими, противоэпилептическими, противовоспалительными и местноанестезирующими. 2 н. и 7 з.п. ф-лы, 19 табл., 15 пр.
Формула

Комментарии