Композиция с высокой степенью чистоты, содержащая(7α,17α)-17-гидрокси-7-метил-19-нор-17-прегн-5(10)-ен-20-ин-3-он, способ ее получения, фармацевтические стандартные лекарственные формы - RU2220975C2
Код документа: RU2220975C2
Чертежи













Показать все 14 чертежа(ей)
Описание
Текст описания в факсимильном виде (см. графическую часть)а
Реферат
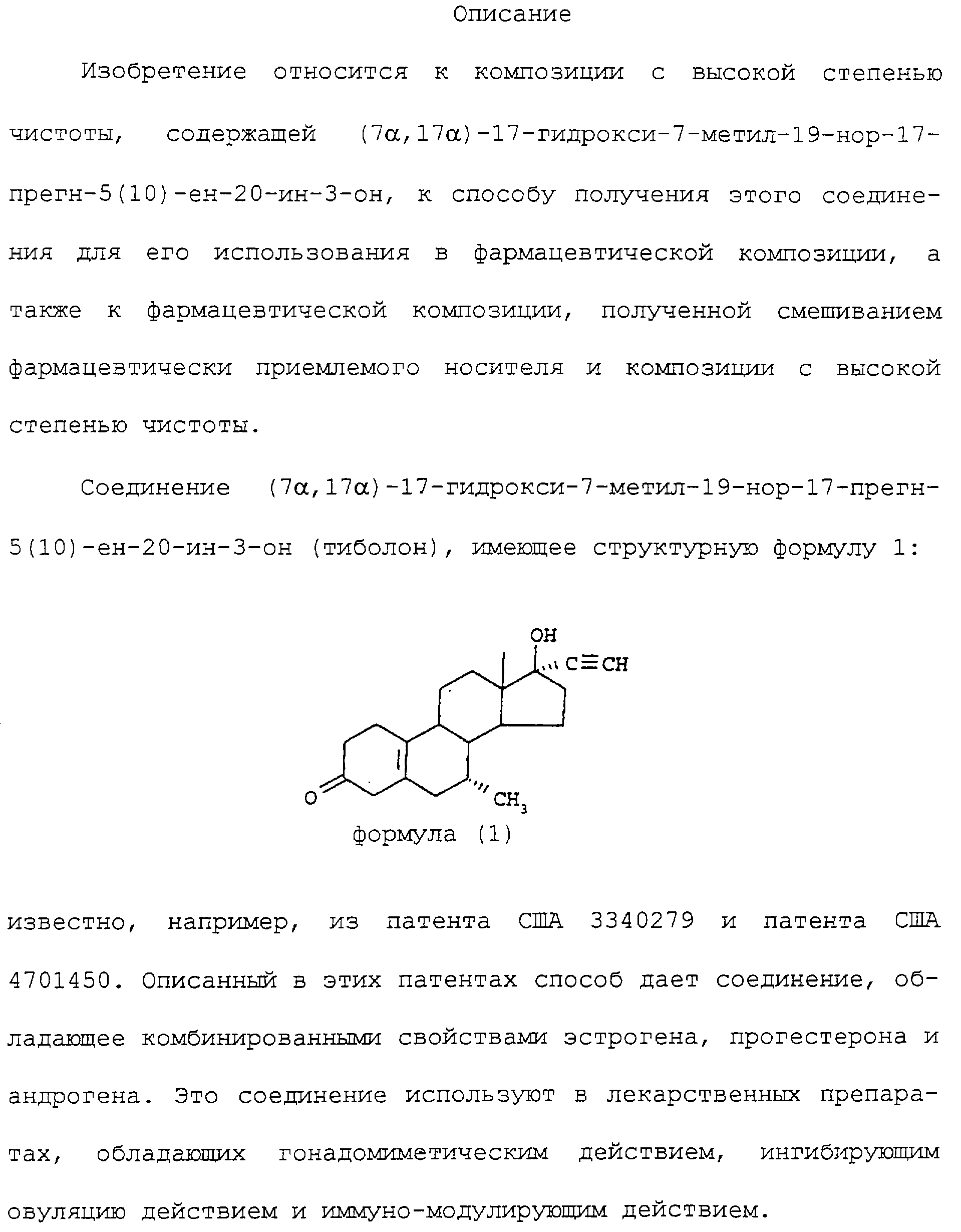
Изобретение относится к способу получения композиции (7α,17α)-17-гидрокси-7-метил-19-нор-17-прегн-5(10)-ен-20-ин-3-она с высокой степенью чистоты. Настоящим способом получают композицию с содержанием (7α,17α)-17-гидрокси-7-метил-19-нор-17-прегн-4-ен-20-ин-3-она менее 0,5%, которая может быть использована в качестве источника для приготовления устойчивых фармацевтических стандартных лекарственных форм. 5 с. и 9 з.п. ф-лы, 3 табл.
Формула
1. Композиция с высокой степенью чистоты,
содержащая (7α,17α
)-17-гидрокси-7-метил-19-нор-17-прегн-5(10)ен-20-ин-3-он, отличающаяся тем, что вышеуказанная композиция содержит (7α,17α
)-17-гидрокси-7-метил-19-нор-17-прегн-4-ен-20-ин-3-он в
количестве менее 0,5%.
2. Композиция по п.1, отличающаяся тем, что количество (7α,
17α)-17-гидрокси-7-метил-19-нор-17-прегн-4-ен-20-ин-3-она
составляет 0,25% или менее.
3. Композиция по п.1, отличающаяся тем, что количество
(7α,17α
)-17-гидрокси-7-метил-19-нор-17-прегн-4-ен-20-ин-3-она составляет 0,1% или менее.
4. Способ получения композиций с высокой степенью
чистоты по пп.1-3,
отличающийся тем, что кристаллы (7α,17α)-17-гидрокси-7-метил-19-нор-17-прегн-5(10)ен-20-ин-3-она оставляют дозревать в присутствии воды в течение, по крайней мере, 24
ч.
5. Способ по п.4, в котором дозревание длится в течение 3-6 дней.
6. Способ по п.4 или 5, отличающийся
тем, что
кристаллы образуются на последней стадии синтеза тиболона, включающего следующие стадии:
а. взаимодействие (7α,17α)-3,
3-диметокси-17-гидрокси-7-метил-19-норпрегн-5(10)ен-20-ин-3-она в органическом растворителе со слабо кислым водным раствором,
b. выливание раствора в воду, которую слабо
подщелачивают,
с. промывание кристаллов водой, которую слабо подщелачивают.
7. Фармацевтическая стандартная лекарственная форма,
которую получают смешиванием фармацевтически приемлемого твердого носителя и композиции по любому из пп.1-3.
8. Фармацевтическая стандартная
лекарственная форма, которую получают смешиванием фармацевтически приемлемого твердого носителя и композиции, полученной способом по любому одному из пп.4-6.
9. Стандартная лекарственная форма, включающая фармацевтически приемлемый твердый носитель и (7α,17α)-17-гидрокси-7-метил-19-нор-17-прегн-5(10)ен-20-ин-3-он в количестве
менее 2,50 мг и имеющая определенный срок годности, при содержании (7α,17α)-17-гидрокси-7-метил-19-нор-17-прегн-4-ен-20-ин-3-она менее 5%.
10. Стандартная лекарственная форма по п.9, отличающаяся тем, что (7α,17α)-17-гидрокси-7-метил-19-нор-17-прегн-5(10)ен-20-ин-3-он содержится в количестве 1,25 мг или
менее.
11. Стандартная лекарственная форма по п.9, отличающаяся тем, что (7α,17α)-17-гидрокси-7-метил-19-нор-17-прегн-5(10)ен-20-ин-3-он
содержится в
количестве 0,625 мг или менее.
12. Стандартная лекарственная форма по любому из пп.9-11, у которой срок годности составляет 1,5 года,
более
предпочтительно 2 года.
13. Стандартная лекарственная форма по пп.9-11, у которой при сроке годности 6 месяцев количество (7α,17α
)-17-гидрокси-7-метил-19-нор-17-прегн-4-ен-20-ин-3-она составляет 3% или менее, более предпочтительно 2% или менее.
14. Стандартная лекарственная форма
по п.13, у которой срок годности составляет 1 год, предпочтительно 1,5 года, более предпочтительно 2 года.

Комментарии