Производные изохинолина, стимулирующие нейрогенез - RU2673549C2
Код документа: RU2673549C2
Описание
Настоящее изобретение относится к применению соединений общей формулы

где
R1 представляет собой фенил или пиридинил, который возможно замещен галогеном, циано или низшим алкилом, замещенным галогеном, или представляет собой дигидро-пиран-4-ил;
R2 представляет собой водород или низший алкил;
R3 представляет собой -(CHR)n-фенил, возможно замещенный низшим алкокси или S(O)2-низшим алкилом,
или представляет собой гетероциклоалкил, возможно замещенный =O и низшим алкилом,
или представляет собой -(СН2)n-пяти или шестичленный гетероарил, возможно замещенный низшим алкилом,
или представляет собой водород, низший алкил, низший алкил, замещенный галогеном, низший алкил, замещенный гидрокси, -NR-S(O)2-низший алкил, -(СН2)n-циклоалкил или -(СН2)n-S(O)2-низший алкил; или
R2 и R3 образуют вместе с атомом азота, к которому они присоединены, гетероциклоалкильное кольцо, выбранное из группы, состоящей из 1,1-диоксо-тиоморфолинила, морфолинила, или пирролидинила, возможно замещенного гидрокси;
R представляет собой водород или низший алкил;
n представляет собой 0, 1 или 2;
или их фармацевтически приемлемым кислотно-аддитивным солям, рацемическим смесям или их соответствующим энантиомерам и/или оптическим изомерам,
для лечения шизофрении, обсессивно-компульсивного расстройства личности, депрессии, биполярного расстройства, тревожных расстройств, нормального старения, эпилепсии, дегенерации сетчатки, черепно-мозговой травмы, повреждений спинного мозга, посттравматического стресса, панического расстройства, болезни Паркинсона, деменции, болезни Альцгеймера, болезни умеренных когнитивных нарушений, вызванной химиотерапией когнитивной дисфункции («Химический мозг»), Синдрома Дауна, нарушений аутистического спектра, потери слуха, шума в ушах, спиноцеребеллярной атаксии, латерального амиотрофического склероза, рассеянного склероза, болезни Хантингтона, инсульта, и нарушений в результате лучевой терапии, хронического стресса, оптической нейропатии или дегенерации желтого пятна, или злоупотребления нейроактивных препаратов, таких как алкоголь, опиаты, метамфетамин, фенциклидин или кокаин.
Аналогичные соединения с изохинолиновым структурным ядром, обладающие стимулирующим действием на остеогенез, описаны в заявке WO 2010/116915.
Было показано, что соединения по настоящему изобретению стимулирует нейрогенез из нервных стволовых клеток (НСК). Нейрогенез наблюдается как в развивающемся, так и во взрослом мозге. Концептуально, данный процесс нейрогенеза можно разделить на четыре стадии: (I) пролиферации НСК; (II) определение нейронального предназначения НСК; (III) выживание и созревание новых нейронов; и (IV) функциональная интеграция новых нейронов в нейронную сеть.
Нейрогенез у взрослых - это процесс развития, который происходит на протяжении жизни во взрослом мозге в результате чего образуются новые функциональные нейроны из взрослых нервных стволовых клеток. Конститутивный взрослый нейрогенез в физиологических условиях наблюдается в основном в двух "нейрогенных" областях мозга, 1) в субгранулярной зоне (SGZ) в зубчатой извилине гиппокампа, где образуются новые зубчатые зернистые клетки, 2) в субвентрикулярной зоне (SVZ) боковых желудочков, где новые нейроны образуются и затем мигрируют через ростральный миграционный тракт (RMS) в обонятельную луковицу, чтобы стать интернейронами.
Многочисленные свидетельства предполагают, что нейрогенез гиппокампа у взрослых играет важную роль в когнитивных и эмоциональных состояниях, хотя его точная функция остается неясной. Было высказано мнение, что относительно небольшое число новообразованных зернистых нейронов может повлиять на общую функцию мозга вследствие того, что они иннервируют много интернейронов в зубчатой извилине, каждый из которых ингибирует сотни зрелых зернистых клеток, приводящих к нейрогенез-зависимому ингибированию обратной связи. В сочетании с низким порогом возбуждения новообразованные нейроны вызывают ответы на очень тонкие изменения в окружении. Нарушения в этом процессе поведенчески могут проявляться в дефиците разделения паттернов, связанных с психическими заболеваниями. Например, нейрогенез взрослого гиппокампа коррелирует с познавательной и эмоциональной способностью, например, физические упражнения, контакт с обогащенной средой и типичные антидепрессанты одновременно способствуют нейрогенезу взрослого гиппокампа и познанию и/или эмоциональному состоянию, в то время как хронический стресс, депрессия, лишение сна и старение снижают нейрогенез и ассоциируются с когнитивными и/или эмоциональными состояниями (Neuron 70, May 26, 2011, рр 582-588 и рр 687-702; WO 2008/046072). Интересно, что антидепрессанты способствуют нейрогенезу гиппокампа и для их влияния на определенное поведение требуется стимуляция нейрогенеза. Нейрогенез в других взрослых регионах ЦНС, как правило, считается очень ограниченным в нормальных физиологических условиях, но может быть вызван после травмы, такой как инсульт, и повреждения центрального и периферического отделов головного мозга.
Таким образом, предполагается, что такая стимуляция нейрогенеза у взрослых представляет собой нейрорегенеративную терапевтическую цель при нормальном старении и, в частности, при различных нейродегенеративных и нейропсихиатрических, включая шизофрению, обсессивно-компульсивное расстройство личности, депрессию, биполярные расстройства, тревожные расстройства, эпилепсию, дегенерацию сетчатки, черепно-мозговую травму, повреждения спинного мозга, посттравматический стресс, панические расстройства, болезнь Паркинсона, деменцию, болезнь Альцгеймера, болезни умеренных когнитивных нарушений, вызванную химиотерапией когнитивную дисфункцию («Химический мозг»), синдром Дауна, нарушения аутистического спектра, потерю слуха (Neuroscience, 167 (2010) 1216-1226; Nature Medicine, Vol. 11, number 3, (2005), 271-276) шум в ушах, спиноцеребеллярную атаксию, латеральный амиотрофический склероз, рассеянный склероз, болезнь Хантингтона, инсульт, и нарушения в результате лучевой терапии, хронический стресс, или злоупотребления нейроактивных препаратов, таких как алкоголь, опиаты, метамфетамин, фенциклидин или кокаин (US 2012/0022096).
Стимуляция нейрогенеза у взрослых также является терапевтической целью при оптической нейропатии (S. Isenmann, A. Kretz, A. Cellerino, Progress in Retinal and Eye Research, 22, (2003) 483) и дистрофии желтого пятна (G. Landa, О. Butovsky, J. Shoshani, M. Schwartz, A. Pollack, Current Eye Research 33, (2008) 1011).
Следовательно, химическая стимуляция нейрогенеза у взрослых предлагает новый путь и возможности для развития новых лекарств для лечения неврологических заболеваний и нейропсихиатрических нарушений.
Таким образом, объектом настоящего изобретения является идентификация соединений, которые модулируют нейрогенез. Было установлено, что соединения формулы I являются активными в данной области и, таким образом, они могут применяться для лечения шизофрении, обсессивно-компульсивного расстройства личности, депрессии, биполярного расстройства, тревожных расстройств, нормального старения, эпилепсии, дегенерации сетчатки, черепно-мозговой травмы, повреждений спинного мозга, посттравматического стресса, панического расстройства, болезни Паркинсона, деменции, болезни Альцгеймера, болезни умеренных когнитивных нарушений, вызванной химиотерапией когнитивной дисфункции («Химический мозг»), Синдрома Дауна, нарушений аутистического спектра, потери слуха, шума в ушах, спиноцеребеллярной атаксии, латерального амиотрофического склероза, рассеянного склероза, болезни Хантингтона, инсульта, и нарушений в результате лучевой терапии, хронического стресса, оптической нейропатии или дегенерации желтого пятна, или злоупотребления нейроактивных препаратов, таких как алкоголь, опиаты, метамфетамин, фенциклидин или кокаин.
Наиболее предпочтительными показаниями для соединений формулы I являются болезнь Альцгеймера, депрессия, тревожные расстройства и инсульт.
Одним воплощением настоящего изобретения является применение соединений формулы I для лечения вышеупомянутых заболеваний. Указанные соединения перечислены в Таблицах 1 и 2. Эти соединения представляют собой:
N-бензил-4-(пиридин-4-ил)изохинолин-6-карбоксамид
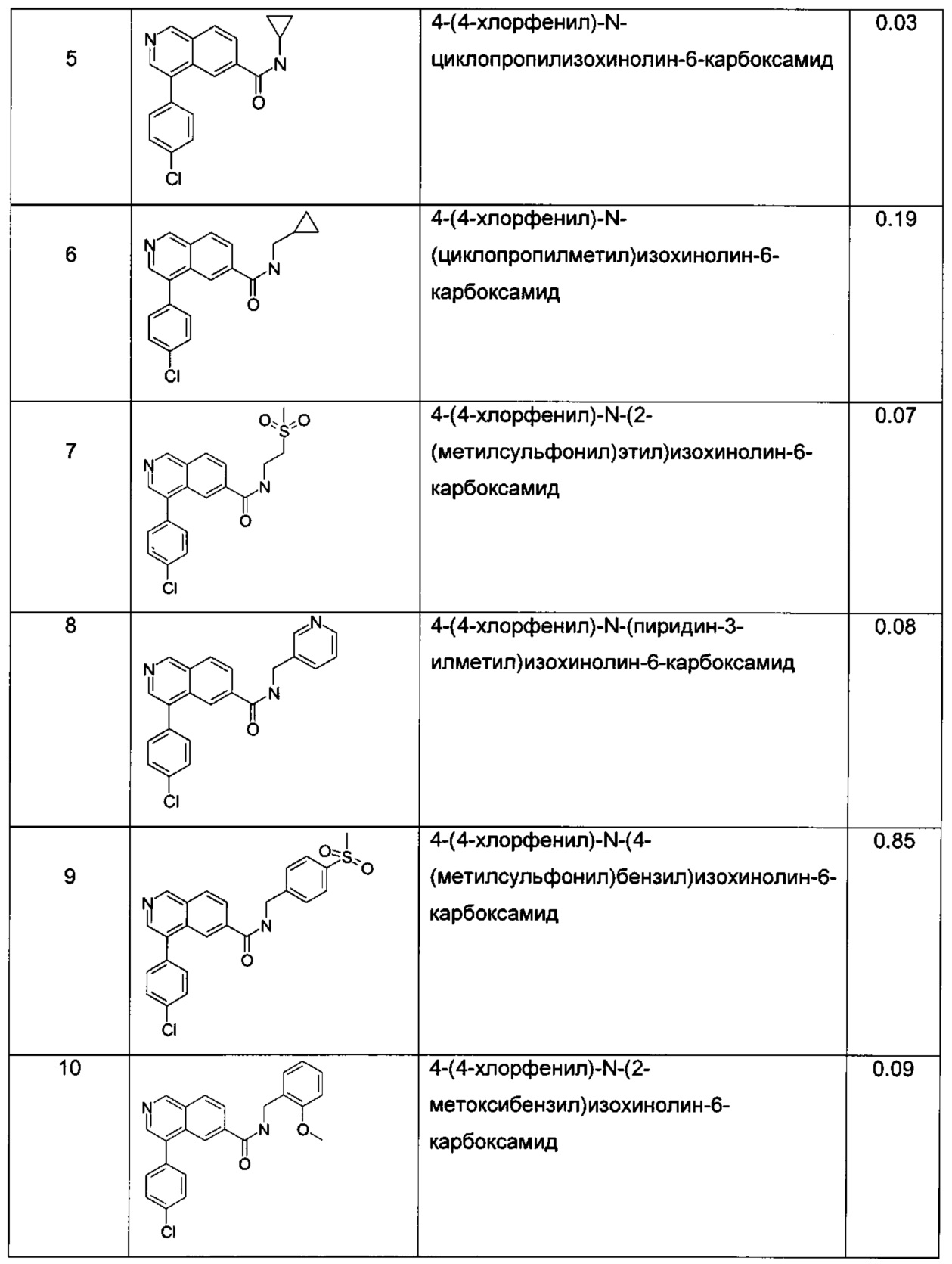
N-бензил-4-(4-хлорфенил)изохинолин-6-карбоксамид
[4-(4-хлор-фенил)-изохинолин-6-ил]-(1,1-диоксо-тиоморфолин-4-ил)-метанон
4-(4-хлор-фенил)-изохинолин-6-карбоновой кислоты (2,2-диметил-пропил)-амид
4-(4-хлорфенил)-N-циклопропилизохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(циклопропилметил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(2-(метилсульфонил)этил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(пиридин-3-илметил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(4-(метилсульфонил)бензил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(2-метоксибензил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(пиридин-2-илметил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(3-(метилсульфонил)бензил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-фенилизохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(2,2,2-трифторэтил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-изопропилизохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(тетрагидрофуран-3-ил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(1-гидрокси-2-метилпропан-2-ил)изохинолин-6-карбоксамид
(4-(4-хлорфенил)изохинолин-6-ил)(морфолино)метанон
(4-(4-хлорфенил)изохинолин-6-ил)(4-метилпиперазин-1-ил)метанон
4-(4-хлорфенил)-N-((2-метил-5-оксопирролидин-2-ил)метил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(циклопропилметил)-N-метилизохинолин-6-карбоксамид
(4-(4-хлорфенил)изохинолин-6-ил)(3-гидроксипирролидин-1-ил)метанон
N-трет-бутил-4-(4-хлорфенил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(3,3,3-трифторпропил)изохинолин-6-карбоксамид
N'-(4-(4-хлорфенил)изохинолин-6-карбонил)метансульфоногидразид
4-(4-хлорфенил)-N-(1-метил-1Н-пиразол-4-ил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(1-(3-(метилсульфонил)фенил)этил)изохинолин-6-карбоксамид
N'-(4-(4-хлорфенил)изохинолин-6-карбонил)-N-метилметансульфоногидразид
4-(3,6-дигидро-2Н-пиран-4-ил)изохинолин-6-карбоксамид
4-(4-цианофенил)изохинолин-6-карбоксамид
4-(2,4-дихлорфенил)изохинолин-6-карбоксамид
4-(6-хлорпиридин-3-ил)изохинолин-6-карбоксамид
4-(4-хлорфенил)изохинолин-6-карбоксамид (CAS1248555-68-1) и
4-(4-(трифторметил)фенил)изохинолин-6-карбоксамид (CAS1248554-05-3).
Также настоящее изобретение относится к новым соединениям формул I-1 и I-2 и к конкретным новым соединениям формулы I, к способу их получения, а также к применению соединения формулы I при лечении или предотвращении нарушений, связанных с нейрогенезом, шизофрении, обсессивно-компульсивного расстройства личности, депрессии, биполярного расстройства, тревожных расстройств, нормального старения, эпилепсии, дегенерации сетчатки, черепно-мозговой травмы, повреждений спинного мозга, посттравматического стресса, панического расстройства, болезни Паркинсона, деменции, болезни Альцгеймера, болезни умеренных когнитивных нарушений, вызванной химиотерапией когнитивной дисфункции («Химический мозг»), Синдрома Дауна, нарушений аутистического спектра, потери слуха, шума в ушах, спиноцеребеллярной атаксии, латерального амиотрофического склероза, рассеянного склероза, Болезни Хантингтона, инсульта, и нарушений в результате лучевой терапии, хронического стресса, оптической нейропатии или дегенерации желтого пятна, или злоупотребления нейроактивных препаратов, таких как алкоголь, опиаты, метамфетамин, фенциклидин или кокаин и к фармацевтическим композициям, содержащим новые соединения формулы I.
Одним воплощением настоящего изобретения являются новые соединения формулы I, которые представляют собой
N-бензил-4-(пиридин-4-ил)изохинолин-6-карбоксамид
N-бензил-4-(4-хлорфенил)изохинолин-6-карбоксамид
[4-(4-хлор-фенил)-изохинолин-6-ил]-(1,1-диоксо-тиоморфолин-4-ил)-метанон
4-(4-хлор-фенил)-изохинолин-6-карбоновой кислоты (2,2-диметил-пропил)-амид
4-(4-хлорфенил)-N-циклопропилизохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(циклопропилметил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(2-(метилсульфонил)этил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(пиридин-3-илметил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(4-(метилсульфонил)бензил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(2-метоксибензил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(пиридин-2-илметил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(3-(метилсульфонил)бензил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-фенилизохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(2,2,2-трифторэтил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-изопропилизохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(тетрагидрофуран-3-ил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(1-гидрокси-2-метилпропан-2-ил)изохинолин-6-карбоксамид
(4-(4-хлорфенил)изохинолин-6-ил)(морфолино)метанон
(4-(4-хлорфенил)изохинолин-6-ил)(4-метилпиперазин-1-ил)метанон
4-(4-хлорфенил)-N-((2-метил-5-оксопирролидин-2-ил)метил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(циклопропилметил)-N-метилизохинолин-6-карбоксамид
(4-(4-хлорфенил)изохинолин-6-ил)(3-гидроксипирролидин-1-ил)метанон
N-трет-бутил-4-(4-хлорфенил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(3,3,3-трифторпропил)изохинолин-6-карбоксамид
N'-(4-(4-хлорфенил)изохинолин-6-карбонил)метансульфоногидразид
4-(4-хлорфенил)-N-(1-метил-1Н-пиразол-4-ил)изохинолин-6-карбоксамид
4-(4-хлорфенил)-N-(1-(3-(метилсульфонил)фенил)этил)изохинолин-6-карбоксамид
N-(4-(4-хлорфенил)изохинолин-6-карбонил)-N-метилметансульфоногидразид
4-(3,6-дигидро-2Н-пиран-4-ил)изохинолин-6-карбоксамид
4-(4-цианофенил)изохинолин-6-карбоксамид
4-(2,4-дихлорфенил)изохинолин-6-карбоксамид или
4-(6-хлорпиридин-3-ил)изохинолин-6-карбоксамид.
Одним объектом настоящего изобретения являются соединения формулы I-1

где
R1 представляет собой пиридинил, который возможно замещен галогеном, циано или низшим алкилом, замещенным галогеном, или представляет собой дигидро-пиран-4-ил;
R2 представляет собой водород или низший алкил;
R3 представляет собой -(CHR)n-фенил, возможно замещенный низшим алкокси или S(O)2-низшим алкилом, или представляет собой гетероциклоалкил, возможно замещенный =O и низшим алкилом,
или представляет собой -(СН2)n-пяти или шестичленный гетероарил, возможно замещенный низшим алкилом,
или представляет собой водород, низший алкил, низший алкил, замещенный галогеном, низший алкил, замещенный гидрокси, -NR-S(O)2-низший алкил, -(СН2)n-циклоалкил или -(СН2)n-S(O)2-низший алкил; или
R2 и R3 образуют вместе с атомом азота, к которому они присоединены, гетероциклоалкильное кольцо, выбранное из группы, состоящей из 1,1-диоксо-тиоморфолинила, морфолинила, или пирролидинила, возможно замещенного гидроксилом;
R представляет собой водород или низший алкил;
n представляет собой 0, 1 или 2;
или его фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь или соответствующий энантиомер и/или его оптический изомер, например, следующие соединения
N-бензил-4-(пиридин-4-ил)изохинолин-6-карбоксамид
4-(3,6-дигидро-2Н-пиран-4-ил)изохинолин-6-карбоксамид или
4-(6-хлорпиридин-3-ил)изохинолин-6-карбоксамид.
Одним дополнительным объектом настоящего изобретения являются соединения формулы I-2

где
R1 представляет собой фенил или пиридинил, который возможно замещен галогеном, циано или низшим алкилом, замещенным галогеном, или представляет собой дигидро-пиран-4-ил;
R2 и R3 образуют вместе с атомом азота, к которому они присоединены, гетероциклоалкильное кольцо, выбранное из группы, состоящей из 1,1-диоксо-тиоморфолинила, морфолинила, или пирролидинила, возможно замещенного гидроксилом;
R представляет собой водород или низший алкил;
n представляет собой 0, 1 или 2;
или его фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь или соответствующий энантиомер и/или его оптический изомер, например, следующие соединения
[4-(4-хлор-фенил)-изохинолин-6-ил]-(1,1-диоксо-тиоморфолин-4-ил)-метанон
(4-(4-хлорфенил)изохинолин-6-ил)(морфолино)метанон
(4-(4-хлорфенил)изохинолин-6-ил)(4-метилпиперазин-1-ил)метанон или
(4-(4-хлорфенил)изохинолин-6-ил)(3-гидроксипирролидин-1-ил)метанон.
Одним дополнительным воплощением настоящего изобретения является фармацевтическая композиция, содержащая новые соединения, подпадающие под объем формулы I, которые перечислены в Таблице 1.
Одним воплощением настоящего изобретения является применение соединения формулы I для получения лекарственного средства для терапевтического и/или профилактического лечения шизофрении, обсессивно-компульсивного расстройства личности, депрессии, биполярного расстройства, тревожных расстройств, нормального старения, эпилепсии, дегенерации сетчатки, черепно-мозговой травмы, повреждений спинного мозга, посттравматического стресса, панического расстройства, болезни Паркинсона, деменции, болезни Альцгеймера, болезни умеренных когнитивных нарушений, вызванной химиотерапией когнитивной дисфункции («Химический мозг»), Синдрома Дауна, нарушений аутистического спектра, потери слуха, шума в ушах, спиноцеребеллярной атаксии, латерального амиотрофического склероза, рассеянного склероза, Болезни Хантингтона, инсульта, и нарушений в результате лучевой терапии, хронического стресса, оптической нейропатии или дегенерации желтого пятна, или злоупотребления нейроактивных препаратов, таких как алкоголь, опиаты, метамфетамин, фенциклидин или кокаин, указанные соединения перечислены в Таблицах 1 и 2.
Дополнительным воплощением изобретения является способ лечения шизофрении, обсессивно-компульсивного расстройства личности, депрессии, биполярного расстройства, тревожных расстройств, нормального старения, эпилепсии, дегенерации сетчатки, черепно-мозговой травмы, повреждений спинного мозга, посттравматического стресса, панического расстройства, болезни Паркинсона, деменции, болезни Альцгеймера, болезни умеренных когнитивных нарушений, вызванной химиотерапией когнитивной дисфункции («Химический мозг»), Синдрома Дауна, нарушений аутистического спектра, потери слуха, шума в ушах, спиноцеребеллярной атаксии, латерального амиотрофического склероза, рассеянного склероза, Болезни Хантингтона, инсульта, и нарушений в результате лучевой терапии, хронического стресса, оптической нейропатии или дегенерации желтого пятна, или злоупотребления нейроактивных препаратов, таких как алкоголь, опиаты, метамфетамин, фенциклидин или кокаин который включает введение эффективного количества соединения формулы I, например, соединений, раскрытых в Таблицах 1 и 2.
Следующие определения общих терминов, используемые в настоящем описании, применяются независимо от того, используются ли они самостоятельно или в комбинации.
Как здесь используется, термин "низший алкил" обозначает насыщенную, т.е. алифатическую углеводородную группу, включая линейную или разветвленную цепь с 1-4 атомами углерода. Примерами "алкила" являются метил, этил, н-пропил, и изопропил.
Термин "алкокси" обозначает группу -O-R', где R' представляет собой низший алкил, как определено выше.
Термин "низший алкил, замещенный галогеном" обозначает низшую алкильную группу, как определено выше, где по меньшей мере один атом водорода заменен на атом галогена. Предпочтительной группой является CF3.
Термин "низший алкил, замещенный гидрокси" обозначает низшую алкильную группу, как определено выше, где по меньшей мере один атом водорода заменен на гидрокси.
Термин "гетероциклоалкил" включает неароматические кольца, содержащие по меньшей мере один гетероатом, выбранный из N, О или S. Такими группами являются тетрагидрофуранил, пиперидинил, морфолинил, пирролидинил, пиперазинил или 1,1-ди-оксо-тиоморфолин.
Термин "пяти или шестичленный гетероарил" включает ароматические кольца, содержащие по меньшей мере один гетероатом, выбранный из N, О или S. Такими группами являются пиридинил, имидазолил, пиразолил, пиразинил, пиримидинил или тиазолил.
Термин "галоген" обозначает хлор, бром, фтор или йод.
Термин "фармацевтически приемлемая соль" или "фармацевтически приемлемая кислотно-аддитивная соль" охватывает соли с неорганическими или органическими кислотами, такие как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.д.
Предложенные новые соединения формулы I согласно настоящему изобретению и их фармацевтически приемлемые соли могут быть получены способами, известными в уровне техники, например, методиками, описанными ниже, которые содержат
а) взаимодействие соединения формулы

с соединением формулы

с получением соединения формулы

и, если необходимо, превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли, или
b) взаимодействие соединения формулы 3
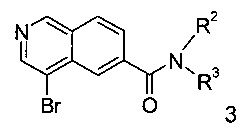
с соединением формулы
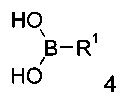
с получением соединения формулы

и, если необходимо, превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли, где заместители являются такими, как описано выше.
Получение соединений формулы I согласно настоящему изобретению может проводиться в соответствии с последовательными или конвергентными путями синтеза. Синтез соединений согласно настоящему изобретению показан на следующей схеме 1. Навыки, необходимые для осуществления реакций и очистки полученных соединений известны квалифицированным специалистам. Заместители и индикаторы, используемые в данных ниже описаниях способов получения, прежде всего, имеют значения данные здесь, если не указано иного.
Более детально, соединения формулы I могут быть получены способами, описанными ниже, способами, приведенными в примерах или аналогичными способами. Подходящие реакционные условия для индивидуальных реакций известны квалифицированным специалистам. Последовательности реакций не ограничены показанными на схеме 1, однако, в зависимости от исходного материала и его соответствующей химической активности последовательности реакционных стадий может быть изменена без ограничений. Исходные материалы являются как коммерчески доступными, так и могут быть получены согласно способам аналогичным описанным здесь, способами, описанными в примерах или способами известными в уровне техники.

Смесь 4-бромо-изохинолин-6-карбоновой кислоты формулы 5, N,N-диизопропилэтиламина и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU) в диметилформамиде перемешивают при комнатной температуре в течение 10 минут. Добавляют соответствующий амин формулы 2 и перемешивание продолжают в течение двух дней с получением соединения формулы 3.
Затем, к суспензии амида 4-бромо-изохинолин-6-карбоновой кислоты формулы 3 и бороновой кислоты формулы 4 и карбоната цезия в диоксане и воде добавляют бис(дифенилфосфино)ферроцен-палладий(II)дихлорид. Смесь перемешивают при 80°С в течение 3 часов. Удаление растворителя посредством дистилляции и хроматографии дает соединение формулы I.
Реакции образования амидной связи могут быть проведены с использованием как порционных реакций, так и потоковых реакций. Синтез в потоковом режиме осуществляется с помощью специально разработанного единого потокового синтеза и очистки с помощью препаративной ВЭЖХ системы. Коммерческий модуль потокового реактора R4 от компании Vapourtec соединен с системой очистки препаративной ВЭЖХ, которая является частью системы из автодозатора Gilson LH 215, двух инъекционных Gilson 819, двух помп Agilent 1100 серии, одного детектора DADA Agilent 1200 серии, двух помп Varian Prepstar, одного детектора УФ Dionex, одного детектора светорассеяния Polymer Laboratory и одной помпы Dionex Р-680. Реагенты и исходные вещества вводятся через автодозатор LH 215 в петли для реагентов потокового реактора (инъекционные модули Gilson 819) и из них в PFA (перфторалкоксиполимер) трубку реактора (10 мл) оснащенную регулятором обратного давления 100 фунт/кв. дюйм (BPR). С целью ограничить дисперсионные эффекты и поддерживать подходящую концентрацию внутри реакционной зоны поскольку она проходит через потоковый реактор, маленькие пузырьки воздуха вводятся перед и после реакционного сегмента. После завершения реакции в потоке, неочищенную реакционную смесь сразу загружают в петлю препаративной ВЭЖХ для очистки с помощью ВЭЖХ. Очищенные соединения собирают посредством автодозатора LH 215. Весь процесс контролируется с использованием программного обеспечения для управления хроматографической системой Chromeleon версии 6.80 от компании Dionex.
Выделение и очистка соединений
Выделение и очистка соединений и промежуточных соединений, описанных здесь, может быть осуществлена, если необходимо, с помощью любым подходящим способом разделения или очистки, таких как, например, фильтрации, экстракции, кристаллизации, колоночной хроматографии, тонкослойной хроматографии, хроматография в толстом слое, препаративная жидкостная хроматография низкого или высокого давления или комбинации этих способов. Конкретные иллюстрации подходящих методик разделения и выделения могут быть даны со ссылкой на способы и примеры, изложенные ниже. Тем не менее, другие эквивалентные процедуры разделения или выделения, конечно, также могут быть использованы. Рацемические смеси хиральных соединений формулы I могут быть разделены с помощью хиральной ВЭЖХ.
Соли соединений формулы I
Соединения формулы I являются основными и могут быть превращены в соответствующие кислотно-аддитивные соли. Превращение осуществляют путем обработки по меньшей мере стехиометрическим количеством соответствующей кислоты, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и органической кислоты, такой как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п.. Как правило, свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и т.п., и добавляют кислоту в аналогичном растворителе. Температуру поддерживают в пределах от 0°С до 50°С. Полученная соль выпадает в осадок самопроизвольно или может быть выделена из раствора с помощью менее полярного растворителя.
Кислотно-аддитивные соли основных соединений формулы I могут быть превращены в соответствующие свободные основания обработкой по меньшей мере стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак, и т.д.
Соединения формулы I и их фармацевтически приемлемые аддитивные соли обладают ценными фармакологическими свойствами. В частности, было обнаружено, что соединения настоящего изобретения обладают активностью в качестве нейрогенных агентов.
Соединения были исследованы в соответствии с тестом, приведенным далее.
Анализ нейрогенеза
Анализ пролиферации нервных стволовых клеток
Нейрогенные свойства малых молекул определяли на основе пролиферации нервных стволовых клеток (НСК), полученных из эмбриональных стволовых клеток человека, которые получили посредством ингибирования сигнального пути SMAD, как ранее было описано (Chambers, S.M., et al., Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling, Nature biotechnology, 2009. 27(3): p. 275-80.)
Ответ соединений измеряют посредством увеличения в клетках на основании уровней АТФ (Promega : CellTiterGlo®) после периода инкубирования в течение 4 дней.
НСК оттаивали и увеличивали их количество за 3 пассажа. На 14-й день НСК посеяли в покрытые полиорнитином/ламинином 384 луночные планшеты при плотности клеток 21'000 клетка/см2 в 38 мкл среды.
Через 4 часа после посева, добавили растворы соединений в объеме 2 мкл. Стоковые растворы соединений (вода, 5% ДМСО) разбавили для получения кривой доза-ответ (11 точек, коэффициент разбавления 2), в диапазоне от 8 мкМ до 8 нМ. Контроли использовали для достоверного определения нейрогенных свойств клеток:
Отрицательный контроль (нейтральный) представлял собой среду для культивирования клеток (конечная концентрация ДМСО: 0.25%). Положительными контролями являлись:
1. среда для культивирования клеток + 100 нг/мл FGF2 (конечная концентрация ДМСО: 0.1%)
2. среда для культивирования клеток + 20 нг/мл EGF (конечная концентрация ДМСО: 0.1%)
3. среда для культивирования клеток + 100 нг/мл Wnt3a (конечная концентрация ДМСО: 0.1%)
Через 4 дня инкубации при 37°С, 5% CO2, подсчитывали количество АТФ в каждой лунке. Концентрация АТФ пропорциональна количеству клеток. АТФ подсчитывали с помощью набора Promega CellTiterGlo®. Реагенты CellTiterGlo® содержат буфер для клеточного лизиса, термостабильную люциферазу (рекомбинантная люцифераза UltraGlo™), магний и люциферин. Люциферин взаимодействует с АТФ с получением оксилюциферина, АМФ и света. Люминесцентный сигнал пропорционален содержанию АТФ.
Значение отрицательного (нейтрального) контроля определялись для каждого тестируемого планшета с использованием среднего для 16 лунок с отрицательным контролем. Нейрогенный ответ соединений рассчитывался для каждого соединения как (соединение/отрицательный контроль)*100.
Значения ЕС150 из кривой доза-ответ определялись для каждого тестируемого соединения. Значение ЕС150 представляет собой концентрацию соединения при котором достигается 150% активность по сравнению с контролем (100%).
Предпочтительные соединения показали значения EC150 (мкМ) в диапазоне <2.5 мкМ, как показано в Таблице 1 ниже.
Фармацевтические композиции
Соединения формулы I, а также их фармацевтически приемлемые соли могут применяться в качестве лекарственных средств, например, в форме фармацевтических препаратов. Фармацевтические препараты могут вводится перорально, например, в форме таблеток, покрытых оболочкой таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Введение, однако, может быть также осуществлено ректально, например, в форме суппозиториев, или парентерально, например, в виде растворов для инъекций.
Соединения формулы I и их фармацевтически приемлемые соли могут перерабатываться вместе с фармацевтически инертными, неорганическими или органическими эксципиентами для производства таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.д. могут применяться в качестве таких эксципиентов, например, для таблеток, драже и твердых желатиновых капсул. Подходящими эксципиентами для мягких желатиновых капсул являются, например, растительные масла, воска, жиры, полутвердые и жидкие полиолы и т.д.
Подходящими эксципиентами для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.д. Подходящими эксципиентами для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.д. Подходящими эксципиентами для суппозиториев являются, например, природные или гидрогенизированные масла, воска, жиры, полужидкие или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать другие терапевтически ценные вещества.
Дозировка может варьироваться в широких пределах и, конечно, будет адаптироваться к индивидуальным требованиям в каждом конкретном случае. В общем, в случае перорального введения должна быть подходящей суточная доза от 10 до 1000 мг соединения формулы I на человека, хотя верхний предел также может быть превышен в случае необходимости.
Примерами композиций согласно настоящему изобретению, без ограничения, являются:
Таблетки следующего состава производятся обычным способом:

Технология изготовления
1. Смешивают ингредиенты 1, 2, 3 и 4 и гранулируют очищенной водой.
2. Высушивают гранулы при 50°С.
3. Пропускают гранулы через подходящее оборудование для измельчения.
4. Добавляют ингредиент 5 и перемешивают три минуты; прессуют на подходящем прессе.
Изготовили капсулы следующего состава:

Технология изготовления
1. Смешивают ингредиенты 1, 2 и 3 в подходящем миксере в течение 30 минут.
2. Добавляют ингредиенты 4 и 5 и смешивают в течение 3 минут.
3. Наполняют подходящие капсулы.
Соединение формулы I, лактозу и кукурузный крахмал сначала смешивают в миксере, а затем в измельчителе. Смесь возвращают в миксер, добавляют к ней тальк (и стеарат магния) и тщательно перемешивают. Смесью заполняют с помощью подходящего оборудования в капсулы, например, твердые желатиновые капсулы.
Изготавливают раствор для инъекций следующего состава:

Технология изготовления
Соединения формулы I растворяют в смеси полиэтиленгликоля 400 и воды для инъекций (одна часть). Доводят рН до 5.0 уксусной кислотой. Объем смеси доводят до 1.0 мл добавлением оставшегося количества воды. Раствор фильтруют, и наполняют им ампулы с использованием необходимого избытка и стерилизуют.
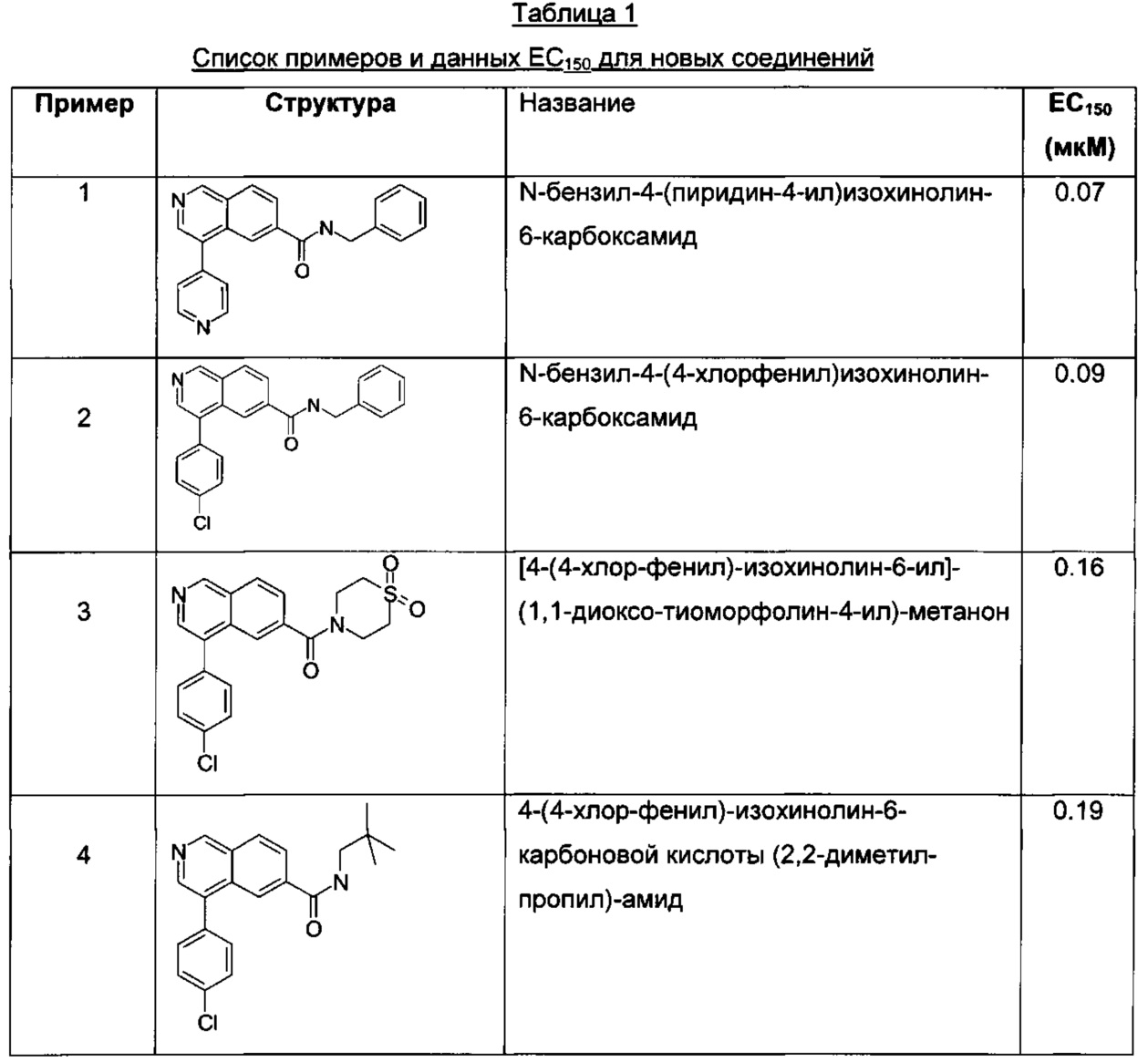



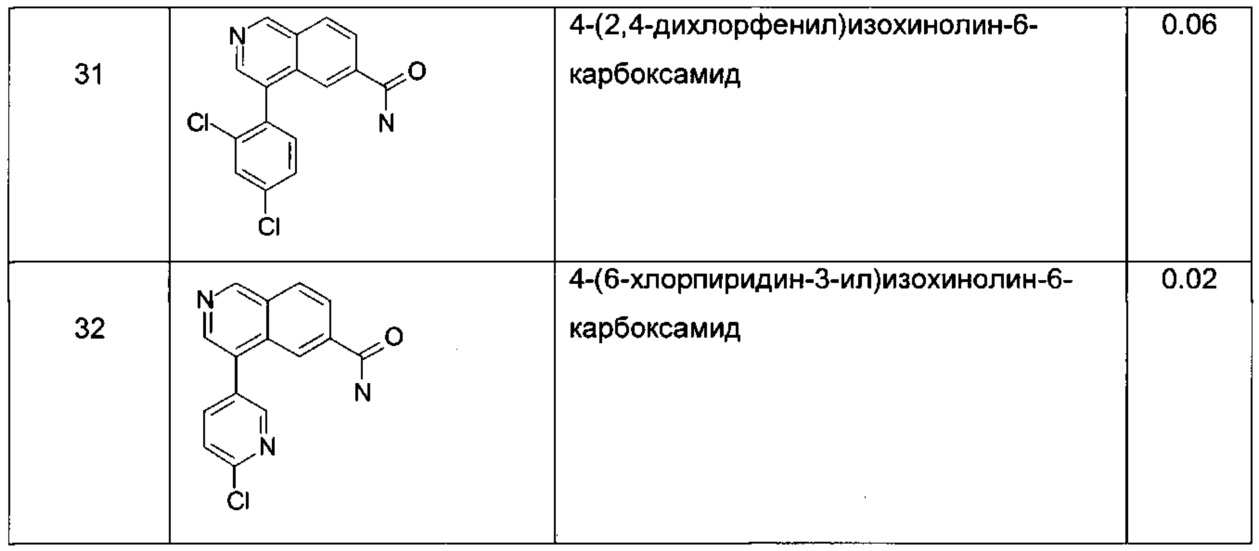
Пример 1
N-бензил-4-(пиридин-4-ил)изохинолин-6-карбоксамид
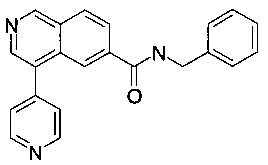
а) 4-Бромизохинолин-6-карбоновая кислота
Изохинолин-6-карбоновую кислоту (CAS106778-43-2, 100 мг, 577 мкмоль) объединили с уксусной кислотой (3 мл) с получением светло-коричневой суспензии. Добавили N-бромсукцинимид (123 мг, 693 мкмоль). Реакционную смесь нагрели до 90°С, перемешивали в течение 2 часов и охладили до комнатной температуры. Осадок отфильтровали через спеченное стекло, промыли водой (2×3 мл) и метанолом (2×3 мл) и высушили под вакуумом с получением соединения, указанного в заголовке, в виде коричневого осадка (49 мг, 34%). MS: m/e=252.3, 254.3 [М+Н]+.
b) N-бензил-4-бромизохинолин-6-карбоксамид

Смесь 4-бромизохинолин-6-карбоновой кислоты (250 мг, 992 мкмоль), N,N-диизопропилэтиламина (156 мг, 211 мкл, 1.21 ммоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, 460 мг, 1.21 ммоль) в диметилформамиде (12.5 мл) перемешивали при комнатной температуре в течение 10 минут. Фенилметанамин (106 мг, 108 мкл, 992 мкмоль) добавили и перемешивание продолжили в течение 2 часов. Экстрагирование водой/этил ацетатом и хроматография (силикагель, этилацетат/гептан = 30:70 до 100:0) дали соединение, указанное в заголовке, в виде желтого осадка (306 мг, 90%). MS: m/e=341.2, 343.3 [М+Н]+.
c) N-бензил-4-(пиридин-4-ил)изохинолин-6-карбоксамид

К суспензии N-бензил-4-бромизохинолин-6-карбоксамида (150 мг, 440 мкмоль) и пиридин-4-илбороновой кислоты (54.0 мг, 440 мкмоль) и карбоната цезия (158 мг, 484 мкмоль) в диоксане (20 мл) и воде (2 мл) добавили бис(дифенилфосфино)ферроцен-палладий(II)дихлорид (16.1 мг, 22.0 мкмоль). Смесь перемешивали при 80°С в течение 3 часов. Удаление растворителя посредством дистилляции и хроматографии (силикагель, этилацетат/гептан = 50:50 до 100:0) и тритурирование с диэтиловым эфиром / пентаном дали соединение, указанное в заголовке, в виде светло-коричневого осадка (117 мг, 78%). MS: m/e=340.4 [М+Н]+.
Пример 2
N-бензил-4-(4-хлорфенил)изохинолин-6-карбоксамид

К суспензии N-бензил-4-бромизохинолин-6-карбоксамида (150 мг, 440 мкмоль) и 4-хлорфенилбороновой кислоты (68.7 мг, 440 мкмоль) и карбоната цезия (158 мг, 484 мкмоль) в диоксане (20 мл) и воде (2 мл) добавили бис(дифенилфосфино)ферроцен-палладий(II)дихлорид (16.1 мг, 22.0 мкмоль). Смесь перемешивали при 80°С в течение 3 часов. Удаление растворителя посредством дистилляции и хроматографии (силикагель, этилацетат/гептан = 50:50 до 100:0) и тритурирование с диэтиловым эфиром / пентаном дали соединение, указанное в заголовке, в виде светло-коричневого осадка (117 мг, 71%). MS: m/e=373.3 [М+Н]+.
Пример 3
[4-(4-хлор-фенил)-изохинолин-6-ил]-(1,1-диоксо-тиоморфолин-4-ил)-метанон
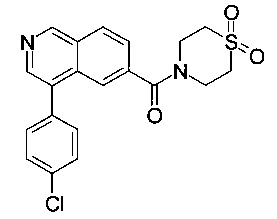
а) 4-(4-хлорфенил)изохинолин-6-карбоновая кислота

К суспензии 4-бромизохинолин-6-карбоновой кислоты (1.25 г, 4.96 ммоль) и 4-хлорфенилбороновой кислоты (775 мг, 4.96 ммоль) и карбоната цезия (1.78 г, 5.45 ммоль) в диоксане (35 мл) и воде (3.5 мл) добавили бис(дифенилфосфино)ферроцен-палладий(II)дихлорид (181 мг, 248 мкмоль). Смесь перемешивали при 80°С в течение 4 часов. Удаление растворителя с помощью дистилляции, экстрагирование этилацетатом/водой (рН=3-4) и тритурирование с диэтиловым эфиром / пентаном дали соединение, указанное в заголовке, в виде серого осадка (1.23 г, 87%).
MS: m/e=282.3 [М-Н]-.
b) [4-(4-хлор-фенил)-изохинолин-6-ил]-(1,1-диоксо-тиоморфолин-4-ил)-метанон

Смесь 4-(4-хлорфенил)изохинолин-6-карбоновой кислоты (70 мг, 247 мкмоль), N,N-диизопропилэтиламина (38.9 мг, 52.6 мкл, 301 мкмоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, 114 мг, 301 мкмоль) в диметилформамиде (2 мл) перемешивали при комнатной температуре в течение 1 часа. Добавили тиоморфолин-1,1-диоксид (36.7 мг, 271 мкмоль) и перемешивание продолжили в течение ночи. Экстрагирование водой/ этилацетатом и хроматография (силикагель, этилацетат/гептан = 50:50 до 100:0; затем ВЭЖХ, С18 обратная фаза, метанол/вода (0.1% муравьиная кислота) = 30:70 до 98:2) дали соединение, указанное в заголовке, в виде светло-желтого осадка (35 мг, 35%). MS: m/e=401.3 [М+Н]+.
Пример 4
4-(4-хлор-фенил)-изохинолин-6-карбоновой кислоты (2,2-диметил-пропил)-амид
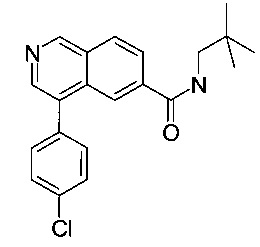
Смесь 4-(4-хлорфенил)изохинолин-6-карбоновой кислоты (70 мг, 247 мкмоль), N,N-диизопропилэтиламин (38.9 мг, 52.6 мкл, 301 мкмоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, 114 мг, 301 мкмоль) в диметилформамиде (2 мл) перемешивали при комнатной температуре в течение 1 часа. Добавили 2,2-диметилпропан-1-амин (21.5 мг, 28.5 мкл, 247 мкмоль) и перемешивание продолжили в течение 3 часов. Удаление растворителя посредством дистилляции и хроматографии (силикагель, этилацетат/гептан = 50:50 до 100:0; затем ВЭЖХ, С18 обратная фаза, метанол/вода (0.1% муравьиная кислота) = 30:70 до 98:2) дали соединение, указанное в заголовке, в виде серо-белого осадка (57 мг, 66%). MS: m/e=353.4 [М+Н]+.
Пример 5
4-(4-хлорфенил)-N-циклопропилизохинолин-6-карбоксамид

Смесь 4-(4-хлорфенил)изохинолин-6-карбоновой кислоты (70 мг, 247 мкмоль), N,N-диизопропилэтиламина (38.9 мг, 52.6 мкл, 301 мкмоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, 114 мг, 301 мкмоль) в диметилформамиде (2 мл) перемешивали при комнатной температуре в течение 1 часа. Добавили циклопропанамин (14.1 мг, 17.3 мкл, 247 мкмоль) и перемешивание продолжили в течение 3 часов. Удаление растворителя посредством дистилляции и хроматографии (силикагель, этилацетат/гептан = 50:50 до 100:0; затем ВЭЖХ, С18 обратная фаза, метанол/вода (0.1% муравьиная кислота) = 30:70 до 98:2) дали соединение, указанное в заголовке, в виде серо-белого осадка (45 мг, 57%). MS: m/e=323.3 [М+Н]+.
Пример 6
4-(4-хлорфенил)-N-(циклопропилметил)изохинолин-6-карбоксамид
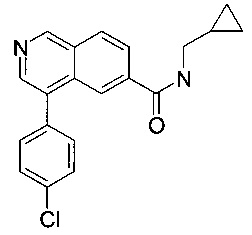
Смесь 4-(4-хлорфенил)изохинолин-6-карбоновой кислоты (70 мг, 247 мкмоль), N,N-диизопропилэтиламина (38.9 мг, 52.6 мкл, 301 мкмоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, 114 мг, 301 мкмоль) в диметилформамиде (2 мл) перемешивали при комнатной температуре в течение 1 часа. Добавили циклопропилметанамин (17.5 мг, 21.1 мкл, 247 мкмоль) и перемешивание продолжили в течение выходных. Удаление растворителя с помощью дистилляции, экстрагирование водой/этилацетатом и хроматография (ВЭЖХ, С18 обратная фаза, метанол/вода (0.1% муравьиная кислота) = 30:70 до 98:2) дали соединение, указанное в заголовке, в виде светло-коричневого осадка (41 мг, 49%). MS: m/e=337.4 [М+Н]+.
Пример 7
4-(4-хлорфенил)-N-(2-(метилсульфонил)этил)изохинолин-6-карбоксамид
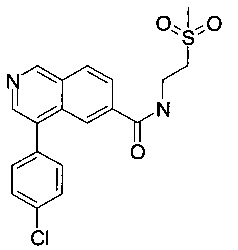
Смесь 4-(4-хлорфенил)изохинолин-6-карбоновой кислоты (70 мг, 247 мкмоль), N,N-диизопропилэтиламина (38.9 мг, 52.6 мкл, 301 мкмоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, 114 мг, 301 мкмоль) в диметилформамиде (2 мл) перемешивали при комнатной температуре в течение 1 часа. Добавили 2-(метилсульфонил)-этанамин (30.4 мг, 247 мкмоль) и перемешивание продолжили в течение выходных. Удаление растворителя с помощью дистилляции, экстрагирование водой/этилацетатом и хроматография (ВЭЖХ, С18 обратная фаза, метанол/вода (0.1% муравьиная кислота) = 30:70 до 98:2) дали соединение, указанное в заголовке, в виде светло-коричневого осадка (42 мг, 44%). MS: m/e=389.3 [М+Н]+.
Пример 8
4-(4-хлорфенил)-N-(пиридин-3-илметил)изохинолин-6-карбоксамид

Смесь 4-(4-хлорфенил)изохинолин-6-карбоновой кислоты (70 мг, 247 мкмоль), N,N-диизопропилэтиламина (38.9 мг, 52.6 мкл, 301 мкмоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, 114 мг, 301 мкмоль) в диметилформамиде (2 мл) перемешивали при комнатной температуре в течение 1 часа. Пиридин-3-илметанамин (26.7 мг, 25.0 мкл, 247 мкмоль) добавили и перемешивание продолжили в течение ночи. Удаление растворителя с помощью дистилляции, экстрагирование водой/этилацетатом и хроматография (ВЭЖХ, С18 обратная фаза, метанол/вода (0.1% муравьиная кислота) = 30:70 до 98:2) дали соединение, указанное в заголовке, в виде светло-коричневого осадка (52 мг, 56%). MS: m/e=374.4 [М+Н]+.
Пример 9
4-(4-хлорфенил)-N-(4-(метилсульфонил)бензил)изохинолин-6-карбоксамид

Смесь 4-(4-хлорфенил)изохинолин-6-карбоновой кислоты (70 мг, 247 мкмоль), N,N-диизопропилэтиламина (38.9 мг, 52.6 мкл, 301 мкмоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, 114 мг, 301 мкмоль) в диметилформамиде (2 мл) перемешивали при комнатной температуре в течение 1 часа. (4-(Метилсульфонил)-фенил)метанамин (45.7 мг, 247 мкмоль) добавили и перемешивание продолжили в течение ночи. Удаление растворителя с помощью дистилляции, экстрагирование водой/ этилацетатом и хроматография (ВЭЖХ, С18 обратная фаза, метанол/вода (0.1% муравьиная кислота) = 30:70 до 98:2) дали соединение, указанное в заголовке, в виде светло-коричневого осадка (43 мг, 39%). MS: m/e=451.4 [М+Н]+.
Пример 10
4-(4-хлорфенил)-N-(2-метоксибензил)изохинолин-6-карбоксамид

Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (10 мг, 35.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 13.6 мг, 42.3 мкмоль) и N,N-диизопропилэтиламин (13.7 мг, 18.5 мкл, 106 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий (2-метоксифенил)метанамин (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 100°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% муравьиная кислота) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде серо-белого осадка (7.6 мг, 54%). MS: m/e=403.5 [М+Н]+.
Пример 11
4-(4-хлорфенил)-N-(пиридин-2-илметил)изохинолин-6-карбоксамид
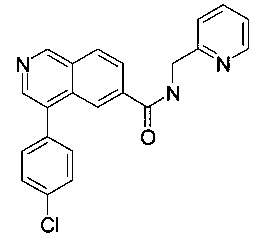
Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (10 мг, 35.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 13.6 мг, 42.3 мкмоль) и N,N-диизопропилэтиламин (13.7 мг, 18.5 мкл, 106 мкмоль) в диметилформамиде (230 мкл), и раствор реагентов В, содержащий пиридин-2-илметанамин (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде белого осадка (7.9 мг, 56%). MS: m/e=374.4 [М+Н]+.
Пример 12
4-(4-хлорфенил)-N-(3-(метилсульфонил)бензил)изохинолин-6-карбоксамид

Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (10 мг, 35.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 13.6 мг, 42.3 мкмоль) и N,'-диизопропилэтиламин (13.7 мг, 18.5 мкл, 106 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий (3-(метилсульфонил)фенил)метанамин (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде белого осадка (6.3 мг, 44%). MS: m/e=451.4 [М+Н]+.
Пример 13
4-(4-хлорфенил)-N-фенилизохинолин-6-карбоксамид

Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий анилин (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде белого осадка (5.1 мг, 36%). MS: m/e=359.4 [М+Н]+.
Пример 14
4-(4-хлорфенил)-N-(2,2,2-трифторэтил)изохинолин-6-карбоксамид
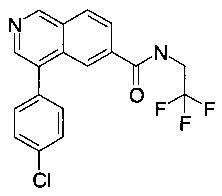
Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий 2,2,2-трифтор-этиламин (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде белого осадка (5.9 мг, 42%). MS: m/e=365.4 [М+Н]+.
Пример 15
4-(4-хлорфенил)-N-изопропилизохинолин-6-карбоксамид
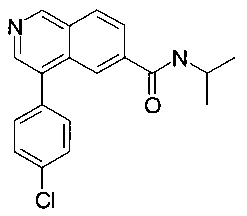
Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий изопропиламин (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.0 5% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде светло-коричневого масла (3.4 мг, 24%). MS: m/e=325.4 [М+Н]+.
Пример 16
4-(4-хлорфенил)-N-(тетрагидрофуран-3-ил)изохинолин-6-карбоксамид
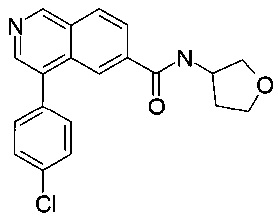
Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий тетрагидрофуран-3-иламин (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде бесцветного масла (2.2 мг, 16%). MS: m/e=353.4 [М+Н]+.
Пример 17
4-(4-хлорфенил)-N-(1-гидрокси-2-метилпропан-2-ил)изохинолин-6-карбоксамид

Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий 2-амино-2-метил-пропан-1-ол (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде бесцветного масла (6.2 мг, 44%). MS: m/e=355.4 [М+Н]+.
Пример 18
(4-(4-хлорфенил)изохинолин-6-ил)(морфолино)метанон

Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий морфолин (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде светло-коричневого масла (6.4 мг, 45%). MS: m/e=353.4 [М+Н]+.
Пример 19
(4-(4-хлорфенил)изохинолин-6-ил)(4-метилпиперазин-1-ил)метанон
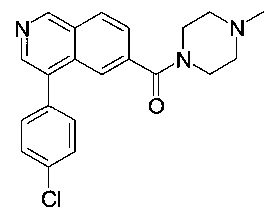
Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий 1-метил-пиперазин (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде бесцветного масла (6.0 мг, 42%). MS: m/e=366.5 [М+Н]+.
Пример 20
4-(4-хлорфенил)-N-((2-метил-5-оксопирролидин-2-ил)метил)изохинолин-6-карбоксамид

Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий 5-аминометил-5-метил-пирролидин-2-он (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде белого осадка (4.0 мг, 28%). MS: m/e=394.0 [М+Н]+.
Пример 21
4-(4-хлорфенил)-N-(циклопропилметил)-N-метилизохинолин-6-карбоксамид

Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий циклопропилметил-метил-амин (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде бесцветного масла (2.5 мг, 18%). MS: m/e=351.0 [М+Н]+.
Пример 22
(4-(4-хлорфенил)изохинолин-6-ил)(3-гидроксипирролидин-1-ил)метанон
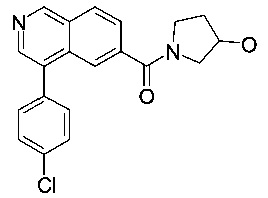
Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий пирролидин-3-ол (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде серо-белого осадка (6.9 мг, 49%). MS: m/e=352.9 [М+Н]+.
Пример 23
N-трет-бутил-4-(4-хлорфенил)изохинолин-6-карбоксамид
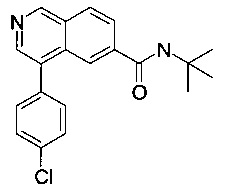
Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий трет-бутиламин (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде серо-белого осадка (5.3 мг, 37%). MS: m/e=339.0 [М+Н]+.
Пример 24
4-(4-хлорфенил)-N-(3,3,3-трифторпропил)изохинолин-6-карбоксамид

Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий 3,3,3-трифтор-пропиламин (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде серо-белого осадка (5.9 мг, 42%). MS: m/e=379.4 [М+Н]+.
Пример 25
N'-(4-(4-хлорфенил)изохинолин-6-карбонил)метансульфоногидразид
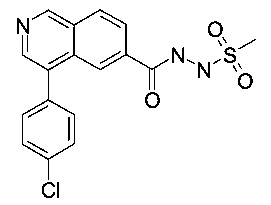
Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновую кислоту (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий гидразид метансульфоновой кислоты (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде белого осадка (1.7 мг, 12%). MS: m/e=376.4 [М+Н]+.
Пример 26
4-(4-хлорфенил)-N-(1-метил-1Н-пиразол-4-ил)изохинолин-6-карбоксамид

Синтез проводился в потоке. Раствор реагентов А, содержащий 4-(4-хлорфенил)изохинолин-6-карбоновой кислоты (8 мг, 28.2 мкмоль), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU, 10.9 мг, 33.8 мкмоль) и N,N-диизопропилэтиламин (10.9 мг, 14.8 мкл, 84.6 мкмоль) в диметилформамиде (230 мкл) и раствор реагентов В, содержащий 1-метил-1Н-пиразол-4-иламин (106 мкл 0.4 М стокового раствора в диметилформамиде, 42.3 мкмоль) в диметилформамиде (144 мкл). Два раствора реагентов вводили (0.250 мл каждого раствора) с помощью автоматического дозатора Gilson LH 215 в реакторные петли для образцов (Gilson 819). Затем оба потока реагентов объединили в Т-образном соединителе, и смесь реагентов нагревали при 120°С в течение 5 мин в 10 мл ПФА трубке реакторной спирали. Неочищенный поток продукта реакции очистили на линии с помощью препаративной ВЭЖХ (С18 обратная фаза, ацетонитрил/вода (0.05% триэтиламин) = 2:98 до 98:2) с получением соединения, указанного в заголовке, в виде белого осадка (0.5 мг, 4%). MS: m/e=363.5 [М+Н]+.
Пример 27
4-(4-хлорфенил)-N-(1-(3-(метилсульфонил)фенил)этил)изохинолин-6-карбоксамид

Смесь 4-(4-хлорфенил)изохинолин-6-карбоновой кислоты (100 мг, 352 мкмоль), N,N-диизопропилэтиламина (101 мг, 137 мкл, 782 мкмоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, 164 мг, 430 мкмоль) в диметилформамиде (3 мл) перемешивали при комнатной температуре в течение 1 часа. Добавили 1-(3-(Метилсульфонил)фенил)этанамина гидрохлорид (83.1 мг, 352 мкмоль) и перемешивание продолжили в течение ночи. Удаление растворителя с помощью дистилляции, экстрагирование водой/ этилацетатом и хроматография (ВЭЖХ, С18 обратная фаза, метанол/вода (0.1% муравьиная кислота) = 30:70 до 98:2) дали соединение, указанное в заголовке, в виде серо-белого осадка (78 мг, 48%). MS: m/e=465.3 [М+Н]+.
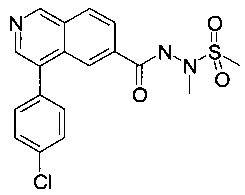
Пример 28
N'-(4-(4-хлорфенил)изохинолин-6-карбонил)-N-метилметансульфоногидразид
а) N'-(4-Бромизохинолин-6-карбонил)-N-метилметансульфоногидразид
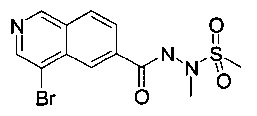
Смесь 4-бромизохинолин-6-карбоновой кислоты (300 мг, 1.19 ммоль), N, N-диизопропилэтиламина (341 мг, 461 мкл, 2.64 ммоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, 552 мг, 1.45 ммоль) в диметилформамиде (4 мл) перемешивали при комнатной температуре в течение 1 часа. Добавили метансульфоновой кислоты 1-метилгидразид (148 мг, 1.19 ммоль) и перемешивание продолжили в течение 2 часов. Экстрагирование водой/ этилацетатом и хроматография (силикагель, этилацетат/гептан = 50:50 до 100:0) дали соединение, указанное в заголовке, в виде серо-белого осадка 113 мг, 21%). MS: m/e=358.1, 360.3 [М+Н]+.
b) N'-(4-(4-хлорфенил)изохинолин-6-карбонил)-N-метилметансульфоногидразид
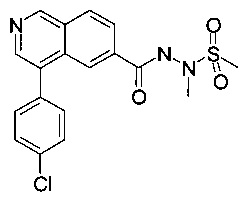
К суспензии N-(4-бромизохинолин-6-карбонил)-N-метилметансульфоногидразида (100 мг, 223 мкмоль) и 4-хлорфенилбороновой кислоты (34.9 мг, 223 мкмоль) и карбоната цезия (80.0 мг, 246 мкмоль) в диоксане (10 мл) и воде (1 мл) добавили бис(дифенилфосфино)ферроцен-палладий(II)дихлорид (8.17 мг, 11.2 мкмоль). Смесь перемешивали при 80°С в течение 15 часов. Удаление растворителя посредством дистилляции и хроматографии (силикагель, этилацетат/гептан = 50:50 до 100:0) и тритурирование с диэтиловым эфиром / пентаном дали соединение, указанное в заголовке, в виде серо-белого осадка (47 мг, 54%). MS: m/e=390.3 [М+Н]+.
Пример 29
4-(3,6-дигидро-2Н-пиран-4-ил)изохинолин-6-карбоксамид

а) 4-Бромизохинолин-6-карбоксамид

Смесь 4-бромизохинолин-6-карбоновой кислоты (500 мг, 1.98 ммоль), 1,1'-карбонилдиимидазола (354 мг, 2.18 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 30 минут. Растворитель удалили с помощью дистилляции и остаток растворили в диоксане (20 мл). Добавили хлорид аммония (531 мг, 9.92 ммоль) и триэтиламин (1.00 г, 1.37 мл, 9.92 ммоль) и перемешивание продолжили в течение ночи. Экстрагирование водой/этилацетатом и тритурирование с диэтиловым эфиром / этилацетатом дали соединение, указанное в заголовке, в виде серо-белого осадка (304 мг, 61%). MS: m/e=251,2, 253.2 [М+Н]+.
b) 4-(3,6-дигидро-2Н-пиран-4-ил)изохинолин-6-карбоксамид

К суспензии 4-бромизохинолин-6-карбоксамида (100 мг, 398 мкмоль) и 2-(3,6-дигидро-2Н-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (83.7 мг, 398 мкмоль) и карбоната цезия (143 мг, 438 мкмоль) в диоксане (3 мл) и воде (0.75 мл) добавили бис(дифенилфосфино)ферроцен-палладий(II)дихлорид (14.6 мг, 19.9 мкмоль). Смесь перемешивали при 80°С в течение 30 минут. Удаление растворителя посредством дистилляции и хроматографии (силикагель, этилацетат/гептан = 50:50 до 100:0) дали соединение, указанное в заголовке, в виде светло-коричневого осадка (75 мг, 74%). MS: m/e=255.4 [М+Н]+.
Пример 30
4-(4-цианофенил)изохинолин-6-карбоксамид

К суспензии 4-бромизохинолин-6-карбоксамида (50.0 мг, 199 мкмоль) и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрила (45.6 мг, 199 мкмоль) и карбоната цезия (71.4 мг, 219 мкмоль) в диоксане (10 мл) и воде (1 мл) добавили бис(дифенилфосфино)ферроцен-палладий(II)дихлорид (7.29 мг, 9.96 мкмоль). Смесь перемешивали при 80°С в течение 2 часов. Удаление растворителя посредством дистилляции и хроматографии (силикагель, этилацетат/гептан = 50:50 до 100:0) дали соединение, указанное в заголовке, в виде серо-белого осадка (52 мг, 96%). MS: m/e=274.4 [М+Н]+.
Пример 31
4-(2,4-дихлорфенил)изохинолин-6-карбоксамид

К суспензии 4-бромизохинолин-6-карбоксамида (50.0 мг, 199 мкмоль) и 2,4-дихлорфенилбороновой кислоты (38.0 мг, 199 мкмоль) и карбоната цезия (71.4 мг, 219 мкмоль) в диоксане (10 мл) и воде (1 мл) добавили бис(дифенилфосфино)ферроцен-палладий(II)дихлорид (7.29 мг, 9.96 мкмоль). Смесь перемешивали при 80°С в течение 2 часов. Удаление растворителя посредством дистилляции и хроматографии (силикагель, этилацетат/гептан = 50:50 до 100:0) дали соединение, указанное в заголовке, в виде серо-белого осадка (62 мг, 98%). MS: m/e=317.3, 319.3 [М+Н]+.
Пример 32
4-(6-хлорпиридин-3-ил)изохинолин-6-карбоксамид
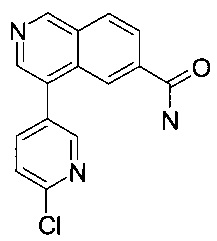
К суспензии 4-бромизохинолин-6-карбоксамида (50.0 мг, 199 мкмоль), 6-хлорпиридин-3-илбороновой кислоты (31.3 мг, 199 мкмоль) и карбоната цезия (71.4 мг, 219 мкмоль) в диоксане (10 мл) и воде (1 мл) добавили бис(дифенилфосфино)ферроцен-палладий(II)дихлорид (7.29 мг, 9.96 мкмоль). Смесь перемешивали при 80°С в течение 2 часов. Удаление растворителя посредством дистилляции и хроматографии (силикагель, этилацетат/гептан = 50:50 до 100:0) дали соединение, указанное в заголовке, в виде серо-белого осадка (44 мг, 67%). MS: m/e=284.3 [М+Н]+.
Пример 33
4-(4-хлорфенил)изохинолин-6-карбоксамид (CAS1248555-68-1)

Смесь 4-(4-хлорфенил)изохинолин-6-карбоновой кислоты (100 мг, 352 мкмоль) и 1,1'-карбонилдиимидазола (62.9 мг, 388 мкмоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 30 минут. Добавили раствор аммония в метаноле (55.4 мкл, 388 мкмоль) и перемешивание продолжили в течение ночи. Экстрагирование водой (рН14) / этилацетатом и хроматография (силикагель, этилацетат/гептан = 50:50 до 100:0) и тритурирование с диэтиловым эфиром / пентаном дали соединение, указанное в заголовке, в виде серо-белого осадка (45 мг, 45%). MS: m/e=283.3 [М+Н]+.
Пример 34
4-(4-(трифторметил)фенил)изохинолин-6-карбоксамид (CAS1248554-05-3)
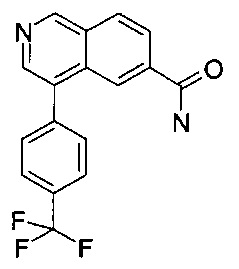
К суспензии 4-бромизохинолин-6-карбоксамида (60 мг, 239 мкмоль), 4-(трифторметил)фенилбороновой кислоты (45.4 мг, 239 мкмоль) и карбоната цезия (85.6 мг, 263 мкмоль) в диоксане (9 мл) и воде (0.9 мл) добавили бис(дифенилфосфино)ферроцен-палладий(II)дихлорид (8.74 мг, 11.9 мкмоль). Смесь перемешивали при 80°С в течение 2 часов. Удаление растворителя посредством дистилляции и хроматографии (силикагель, этилацетат/гептан = 50:50 до 100:0) дали соединение, указанное в заголовке, в виде серо-белого осадка (62 мг, 82%). MS: m/e=317.4 [М+Н]+.
Реферат
Изобретение относится к применению соединений общей формулы I, в которой Rпредставляет собой фенил или пиридинил, которые возможно замещены галогеном, циано или C-алкилом, замещенным галогеном, или представляет собой дигидро-пиран-4-ил; Rпредставляет собой водород или С-алкил; Rпредставляет собой -(CHR)-фенил, возможно замещенный C-алкокси или S(O)-С-алкилом, или представляет собой пятичленный гетероциклоалкил, содержащий один гетероатом, выбранный из О, или представляет собой -(СН)-пяти- или шестичленный гетероарил, содержащий один-два гетероатома, выбранных из N, возможно замещенный С-алкилом, или представляет собой водород, С-алкил, C-алкил, замещенный галогеном, C-алкил, замещенный гидроксилом, -NR-S(O)-С-алкил, -(СН)- Сциклоалкил или -(СН)-S(O)-С-алкил; или Rи Rобразуют вместе с атомом азота, к которому они присоединены, гетероциклоалкильное кольцо, выбранное из группы, состоящей из 1,1-диоксо-тиоморфолинила, морфолинила или пирролидинила, замещенного гидроксилом; R представляет собой водород или С-алкил; n представляет собой 0, 1 или 2; или их фармацевтически приемлемых кислотно-аддитивных солей для лечения заболеваний, при которых полезно стимулирование нейрогенеза из нервных стволовых клеток, включая болезнь Паркинсона, потерю слуха, латеральный амиотрофический склероз и болезнь Хантингтона. Изобретение также относится к применению соединений, выбранных из группы для лечения заболеваний, при которых полезно стимулирование нейрогенеза из нервных стволовых клеток, к соединению, выбранному из группы, к соединению формулы I, к фармацевтической композиции. Технический результат: предложено применение соединений общей формулы I для лечения заболеваний, при которых полезно стимулирование нейрогенеза из нервных стволовых клеток. 6 н. и 5 з.п. ф-лы, 2 табл., 34 пр.
Формула



Документы, цитированные в отчёте о поиске
Циклическое соединение, содержащее гетероатом

Комментарии