Микробиологическая композиция для обогащения торфяного грунта агрономически полезными бактериями (pgp-бактериями) и способ увеличения плодородия торфяного грунта - RU2781930C1
Код документа: RU2781930C1
Чертежи

Описание
Изобретение относится к области биотехнологии и касается обогащенных микробиологической композицией торфяных грунтов и способа для увеличения плодородия торфяных грунтов.
Из уровня техники известно комплексное микробиологическое удобрение, включающее питательную среду, бактериальную маточную культуру АМБ и культивируемую естественную ассоциацию микроорганизмов, причем культивируемая естественная ассоциация микроорганизмов представлена аэробной, анаэробной, денитроцитирующей, аммонифицирующей, лактобактериальной, микромицетом, актиномицетами и водорослями (см. ЕА 5716, опубл. 28.04.2005).
Из документа UZ 2430, опубл. 30.06.2004, известно комплексное микробиологическое удобрение, содержащее ассоциации природных микроорганизмов, в том числе роды Bacillus, Pseudomonas и Azotobacter chroococcum.
Известны, также, и биопрепараты - биологические почвенные фунгициды на основе почвенного гриба Trichoderma harzianum.
Техническим результатом заявленных изобретений является:
- высокая ростостимулирующая активность овощных и культурных растений;
- высокая всхожесть семян;
-высокая антагонистическая активность по отношению к фитопатогенным грибам;
- увеличение агрохимических показателей чистого торфа.
Сущность изобретения заключается в том, что торфяной грунт обогащается микробиологической композицией PGP – бактерий состава: Azotobacter chroococcum, Bacillus subtilis, Pseudomonas asplenii с общим количеством живых бактериальных клеток и спор не менее 109 КОЕ/см3. Также состав обогащенного торфяного грунта может содержать следующие вспомогательные вещества: гумат калия, аминокислоты и элементы минерального питания растений.
Сущность способа увеличения плодородия торфяных грунтов заключается в том, что в биомассу микробиологической композиции в жидком виде добавляют диатомит из расчета 0,5 г на 1 л раствора, далее наносят на торфяной грунт путем мелкодисперсного опрыскивания в количестве 1 литр на 1 тонну торфяного грунта. Применение вышеуказанных PGP – бактерий и способа обогащения, позволяет с высокой эффективностью повысить плодородие торфяных грунтов.
Микробиологическая композиция для обогащения торфяного грунта, имеющая состав: Pseudomonas asplenii 2-3×109 КОЕ/см3, Bacillus subtilis 2-3×109 КОЕ/см3, Azotobacter chroococcum 2-5×109 КОЕ/см3 и диатомит из расчета 0,5 г на 1 л раствора микробиологической композиции.
Способ увеличения плодородия торфяного грунта включает:
- приготовление раствора микробиологической композиции, которая содержит вегетативные клетки и споры Pseudomonas asplenii 2-3×109КОЕ/см3; Bacillus subtilis 2-3×109КОЕ/см3; Azotobacter chroococcum 2-5×109КОЕ/см3, вспомогательные вещества;
- добавление диатомита из расчета 0,5 г на 1 л раствора;
- нанесение на торфяной грунт путем распыления в количестве 1 литр на тонну торфяного грунта.
Достижение технических результатов заявленным изобретением иллюстрируется следующими примерами.
Далее в примерах термин «Трихоцин» означает биологический почвенный фунгицид на основе полезного почвенного гриба Trichoderm aharzianum (Агробиотехнология, Россия); термин «заявляемый биопрепарат» означает состав PGP – бактерий: Pseudomonas asplenii 2-3×109КОЕ/см3; Bacillus subtilis 2-3×109КОЕ/см3; Azotobacter chroococcum 2-5×109КОЕ/см3, вспомогательные вещества.
Пример 1. Обогащение торфяных грунтов микроорганизмами
В качестве источников агрополезных микроорганизмов использовались заявляемый биопрепарат и коммерческий биопрепарат Трихоцин СП на основе гриба Trichodermaharzianum (Агробиотехнология, Россия). Биопрепараты использовались в виде рабочих растворов. Нанесение раствора биопрепарата Трихоцин осуществляли методом распыления, обеспечивающим мелкодисперсное равномерное нанесение жидкого вещества. Для нанесения раствора заявляемого биопрепарата готовили раствор заявляемого биопрепарата, добавляли диатомит из расчета 0,5 г на 1 л раствора; наносили на торфяной грунт путем распыления.
Пример 2. Определение количества микроорганизмов в торфяном грунте
Усредненную пробу навески торфяного грунта в количестве 1 грамм смешивали со стерильной дистиллированной водой. 1 грамм торфяного грунта в 9 мл воды. Встряхивали 1 минуту и далее 1 мл полученной суспензии снова переносили в пробирку с 9 мл воды и так далее (метод последовательных десятикратных разведений). 1 мл из разведения 4, 5, 6, 7, 8, 9 (-4, -5, -6, -7, -8, -9 степени) пробирки сеяли поверхностным методом в чашки Петри на агаризованные среды КГА или глюкозопептонную среду. Подсушивали и инкубировали в течение 2 суток и производили подсчет колоний, учитывая, что каждая колония – результат размножения одной жизнеспособной клетки микроорганизма.
При учете результатов определяют среднее количество колоний, выросших при посеве каждого разведения. Для получения достоверных результатов отбирают чашки, где число колоний бактерий находится в пределах от 30 до 300, а колоний грибов – от 10 до 100. Если чашки из двух последовательных разведений попадают в эту область, количество колониеобразующих единиц (КОЕ) в 1 мл рассчитывают, как их среднее значение.
Рассчитывают среднее количество КОЕ (N) в 1 мл по формуле:
N= c/ (n1+0,1х n2) х d
где: c – сумма подсчитанных колоний на всех чашках;
n1 – количество чашек первого разведения;
n2 – количество чашек второго разведения;
d – коэффициент первого разведения; 0,1 – коэффициент, учитывающий кратность первого и второго разведения.
Гриб препарата Трихоцин фиксировали на чашках Петри с картофелеглюкозным агаром. Так как грибы не образуют колонии, то оценку обогащенности грибом проводили по точкам нарастания конидий, до образования спор. Распространение зоны зарастания чашки конидиями гриба оценивали по шкале от 1 до 10, где 0 – отсутствие зон, 10 – сплошной рост гриба по всей площади агара.
Пример 3. Исследование фитотоксичности/фитостимуляции микроорганизмами
Принципиальная способность исследуемых микроорганизмов угнетать/стимулировать рост растений исследовалась согласно ГОСТ 33777-2016 “Вещества поверхностно-активные. Метод определения фитотоксичности на семенах высших растений”. Для этого готовилась серия 10 кратных разведений биопрепаратов вплоть до разведения в 1000000 раз. Приготовленные растворы добавлялись по 2 мл в чашки Петри, выстланные 1 слоем писчей бумаги. В каждую чашку Петри высевалось по 15 семян овса посевного или редьки масличной. Затем чашки инкубировались в термостате при температуре 22℃ в течение 3-х суток, после чего измерялась длина главного корня проросших семян. Контролем служили семена, проросшие на чистой водопроводной воде.
После измерения длины главного корня всех проросших семян в одной чашке Петри их длины суммировались, а затем полученная сумма делилась на количество посеянных семян, то есть на 15.
Таким образом, выводился интегральный показатель, объединяющий среднюю длину всех проросших семян со всхожестью всех посеянных семян.
Пример 4. Определение индолилуксусной кислоты, продуцируемой микроорганизмами
Для изучения способности микроорганизмов синтезировать ауксины их выращивали на среде LB с добавлением 1 мг/мл D,L-триптофана в течение 2 суток в двух повторностях, после чего культуру центрифугировали 5 мин при 1300 об/мин, затем к супернатанту добавляли реактив Сальковского в соотношении 1:2. Определение уровня ауксинов в супернатанте проводили колориметрическим методом по калибровочной кривой, построенной с использованием растворов ИУК с концентрацией 0, 1, 2, 3, 4, 5, 10, 15, 20, 35, 50 мкг/мл.
Пример 5. Исследование invitro антагонистической активности микроорганизмов
Антагонизм штаммов по отношению к грибам определяли методом агаровых блоков (Нетрусов, 2005). В чашки Петре на агаризованную картофелеглюкозную среду наносили культуральную жидкость гриба с мицелием. Чашки инкубировали сутки в термостате при 25°С. При появлении роста гриба на чашки раскладывали агаровые блоки с бактериальной культурой. Чашки инкубировали 48 часов, визуально контролируя рост бактериальных и грибных колоний.
Для определения антагонистической активности бактерий учитывали площадь зоны роста гриба вокруг блока либо зоны подавления прорастания конидий в мм. Погрешность составляла -+ 1 мм.
Пример 6. Объекты исследования и условия выращивания
Объектами исследования являлись гибриды огурцов “F1 Времена года”, томаты сорта “Спиридоновский” и петуния многоцветковая “Ягодный коктейль”. Растения выращивались на торфяном грунте в ящиках емкостью 7 литров на светоплощадках под освещением в ~7000 люкс и 14-часовом фотопериоде. В один ящик высевалось по 10 семян огурцов или томатов. Семена петунии высевались “самосевным” методом.
Пример 7. Оценка всхожести семян
Всхожесть огурцов и томатов оценивалась после появления у растений первой пары настоящих листьев. После оценки всхожести для каждой культуры проводилась процедура прореживания растений, после которой во всех вариантах опыта оставалось одинаковое количество растений.
Пример 8. Определение биометрических показателей и индекса качества рассады
Измерялись длина побегов, а также их сырая масса, после чего определялся индекс качества рассады - отношение массы надземной части растений к ее длине.
Пример 9. Разработка технологии обогащения торфяных грунтов грибом Trichoderma и заявляемым биопрепаратом
При подборе дозы микробиологических препаратов для обогащения торфяного грунта руководствовались литературными данными и предыдущим опытом авторов настоящей работы. Для работы были выбраны концентрации 0,25/0,5/1 литр микробиологических препаратов на тонну торфяного грунта.
Оптимальные дозы микроорганизмов определялись по результатам приживаемости грибной и бактериальных культур начиная с 14 дней хранения в нормальных условиях, а также при хранении в разных температурных режимах -20°С, 5-10°С, 30°С.
В результате проведенного опыта выяснилось, что внесенные штаммы микроорганизмов приживаются в торфяном грунте. Количество клеток меняется в зависимости от дозы внесения и температуры хранения (Таблицы 1-3).
Таблица 1. Определение приживаемости бактериальной и грибной культур в зависимости от дозы нанесения (после 14 дней обработки препаратами)
Таблица 2. Количество живых бактериальных клеток в торфяном грунте через 4 недели после обогащения заявляемым биопрепаратом при различных дозах внесения и температурах хранения
Таблица 3. Количество мицелиальных клеток в торфяном грунте через 4 недели после обогащения биологическим препаратом Трихоцин при различных дозах внесения и температурах хранения
Так, концентрация живых бактериальных клеток через 14 дней после внесения составляет: для заявляемого биопрепарата в дозе 0,25 л/т – 2×104, в дозе 0,5 л/т – 2×104, в дозе 1 л/т – 3×105клеток в 1 см3торфяного грунта. Для Трихоцина в дозе 0,25 л/т мицелий гриба распространился на 50% площади чашки Петри, в дозе 1 л/т наблюдается сплошной зарост чашки Петри с агаризованной средой (8 баллов по шкале).
Титр клеток в торфяном грунте возрастает в зависимости от температуры хранения. Так, при t = -20°С наблюдается снижение концентрации препарата от первоначальной дозы, но не абсолютную гибель их в торфяном грунте - остаточное количество 2×102.
При температуре выше 25°С наблюдается рост и размножение как грибной, так и бактериальной культуры. Титр клеток заявляемого биопрепарата в торфяном грунте через 4 недели после обогащения при температуре хранения 5-10°С увеличился с 2×104 до 3×106КОЕ, а при той же дозе, но при температуре хранения 30°С, титр клеток увеличился до 5×108.
Грибная культура лучше сохраняется в торфяном грунте при температуре 5-10°С и мало зависит от дозы обогащения.
Исходя из полученных данных можно сделать следующий вывод: рекомендуется проводить обогащение торфяного грунта заявляемым биопрепаратом в дозе 1 л/т, Трихоцин 1 л/т и хранить не менее 14 дней при положительных температурах для размножения клеток в смеси.
Пример 10. Оценка биологических факторов плодородия торфяных грунтов, обогащенных грибом Trichoderma и заявляемым биопрепаратом
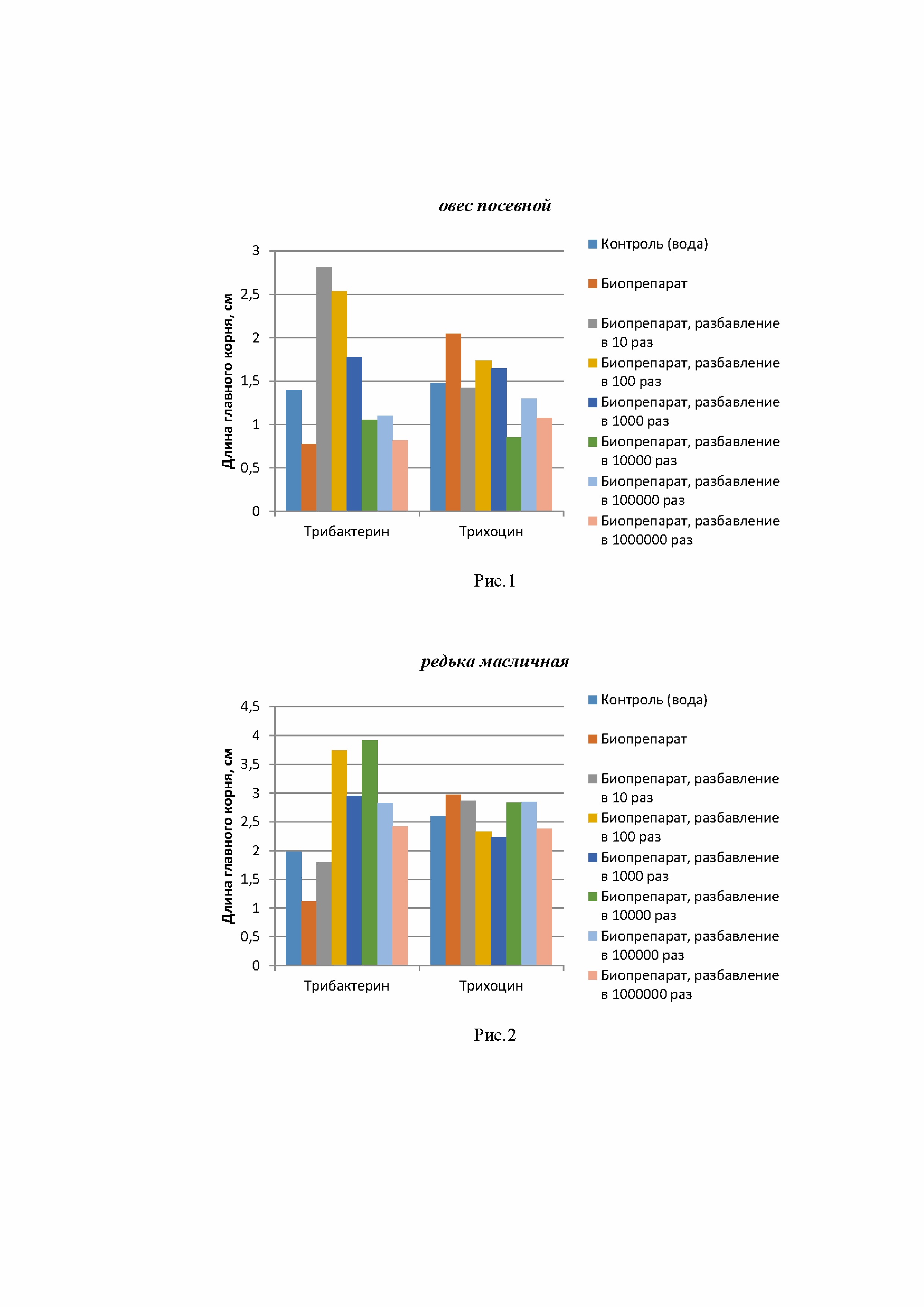
Прежде чем исследовать свойства обогащенных биопрепаратами торфяных грунтов, необходимо было установить принципиальный характер влияния биопрепаратов в чистом виде на способность стимулировать или, наоборот, угнетать рост и развитие высших растений. В связи с этим было исследовано влияние биопрепаратов на длину главного корня овса посевного (однодольные растения) и редьки масличной (двудольные растения). Результаты исследования приведены в таблице 4.
Таблица 4. Влияние биопрепаратов в диапазоне разбавлений 10-1000000 раз на длину главного корня 3-х суточных проростков однодольных и двудольных растений
Влияние заявляемого биопрепарата и биопрепарата Трихоцин в диапазоне разбавлений от 10 до 1000000 раз на рост главного корня тест-растений представлено на рис. 1 и рис. 2, где видно, что оба препарата в зависимости от дозировки оказали как стимулирующее влияние на рост главного корня, так и ингибирующее. При этом стимулирующее действие заявляемый биопрепарат в оптимальных рост стимулирующих концентрациях было более выражено.
Необходимо отметить, что проявление ингибирующего влияния культуральных жидкостей микроорганизмов в отдельных концентрациях на рост и развитие растений – явление, широко описанное в научной литературе. Это не является препятствием для использования микроорганизмов, поскольку в почве они находятся в оптимальном, для установления симбиотических отношений с растениями, количестве.
Пример 11. Определение индолилуксусной кислоты, продуцируемой микроорганизмами
Для выявления механизмов, лежащих в основе ростостимулирующего действия заявляемого биопрепарата далее, с помощью метода Сальковского, была исследована способность микроорганизмов, входящих в его состав, продуцировать ауксины (таблица 5).
Таблица 5. Продукция индолилуксусной кислоты микроорганизмами, входящими в состав заявляемого биопрепарата
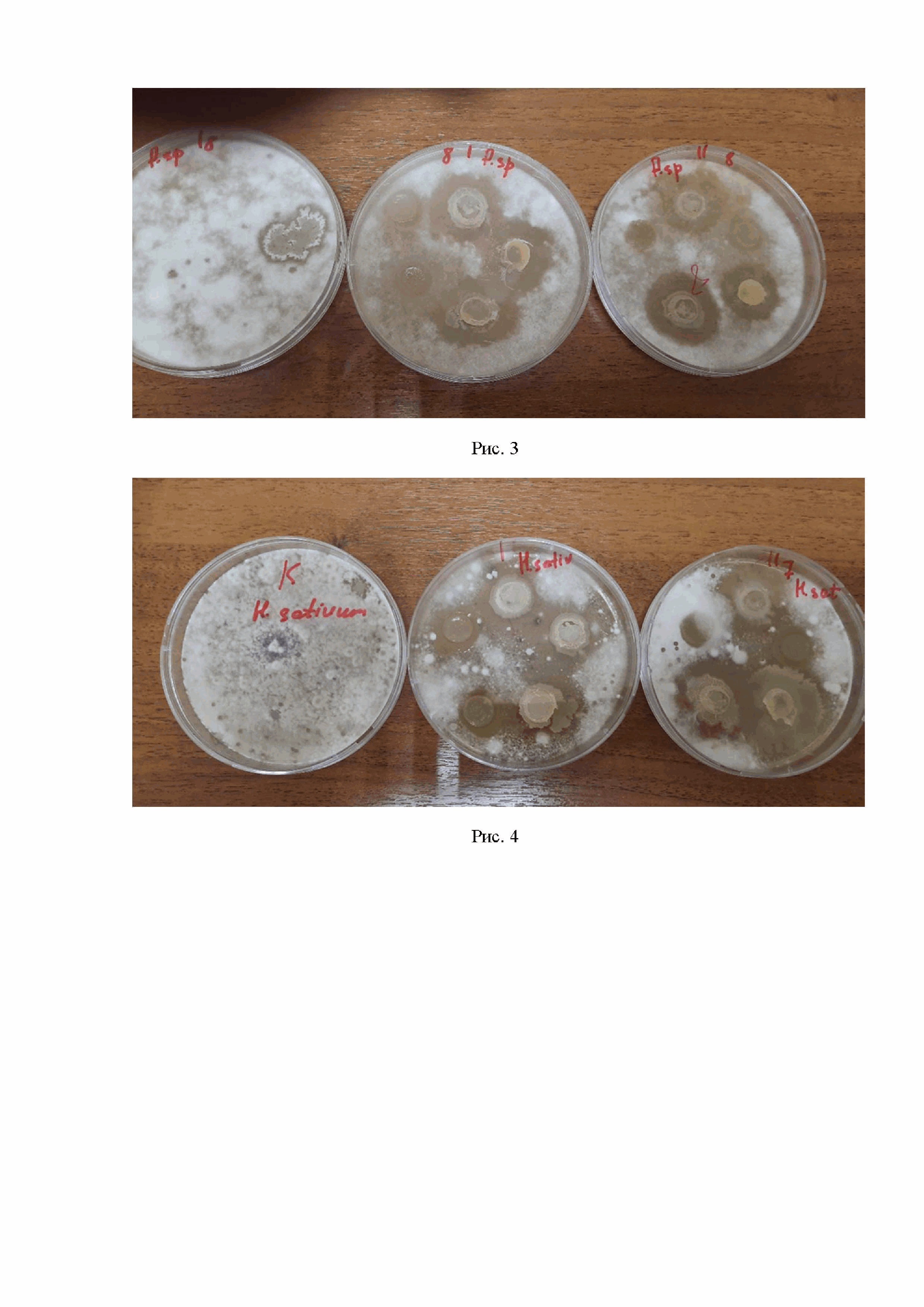
Пример 12. Исследование in vitro антагонистической активности микроорганизмов в отношении фитопатогенных грибов - возбудителей корневых гнилей родов Helminthosporium и Fusarium
Анатагонистическая активность штаммов бактерий родов Pseudomonas, Bacillus и Azotobacter в отношении гриба Fusarium oxisporum (фото сверху) и Helminthosporium sativum (фото снизу) на рис.3 и 4, представлены фотографии чашки Петри с агаровыми блоками. На контрольной чашке наблюдается сплошной рост гриба. На опытных чашках вокруг бактериальных блоков видны зоны подавления роста гриба различной степени. Результаты измерения площадей зон подавления роста грибов под влиянием микроорганизмов представлены в таблице 6.
Таблица 6. Зона подавления грибов Fusarium oxisporum и Helminthosporium sativum бактериальными штаммами
Наиболее сильным был штамм Pseudomonas asplenii – зона подавления гриба Fusarium oxisporum составила 25×27 мм, в то время как зона подавления эталонного фунгицидного штамма 26Д составляла 16×15 мм. Зона подавления гриба Helminthosporium sativum составила 40×50 мм, при этом зона подавления гриба штаммом 26Д - 20×20 мм.
Штамм Azotobacter chroococcum проявил высокую антагонистическую активность к грибу Helminthosporium sativum, зона подавления 30×40 м, что почти в 2 раза превышает эталонного штамма 26 Д (зона подавления 20×20 мм).
Штамм Bacillus subtilis проявлял высокую активность против гриба Helminthosporium sativum, зона подавления – 35×40 мм
Чашки с лева на право – Контроль Мицелий гриба без бактериальных блоков, Опыт гриб с блоками, Опыт гриб с блоками повтор.
1 - Bacillus subtilis, 2 - Azotobacter chroococcum, 3 - Pseudomonas asplenii, 4 - эталонный штамм 26Д, 5 - эталонный штамм H12.
Таким образом, все три штамма заявляемого биопрепарата проявляли антагонистическую активность к фитопатогенным грибам, превышающую контрольные фунгицидные штаммы 26Д и Н12. Следует отметить, что способность микроорганизмов эффективно осуществлять био-контроль фитопатогенов не всегда может быть обнаружена в классических тестах invitro, поскольку такие опыты не позволяют выявить все возможные способы взаимодействия между микроорганизмами, в частности, конкуренцию за экологическую нишу или источники питания.
Пример 13. Оценка эффективности микробиологического обогащения торфяных грунтов для получения рассады овощных культур
Влияние заявляемого биопрепарата и биопрепарата Трихоцин в концентрациях 0,25 и 1 л/т на всхожесть семян томата сорта “Спиридоновский” на рис.5 видно, что добавление микроорганизмов в торфяные грунты положительно сказалось на всхожести семян растений томата.
При этом действие заявляемого биопрепарата на этот показатель было лучше действия Трихоцина. Кроме того, заявляемый биопрепарат увеличивал всхожесть семян в обеих использованных концентрациях, в то время как Трихоцин проявлял свой стимулирующий эффект только в концентрации 0,25 л/т.
Что касается растений огурца, то добавление микроорганизмов в грунт не оказало никакого эффекта на всхожесть семян (рис.6). Вероятно, это связано с тем, что использованные семена огурца изначально обладали высокой всхожестью, что видно по количеству взошедших семян на торфяных грунтах без добавления микроорганизмов (рис.6, контроль).
Необходимо отметить, что несмотря на то, что в чистом виде биопрепараты в отдельных концентрациях оказывали ингибирующее влияние на рост главного корня овса посевного и редьки масличной, при внесении в грунт подобного эффекта не наблюдалось. Это свидетельствует о том, что в почве количество микроорганизмов находится в сбалансированном состоянии, оптимальным для установления симбиотических отношений с растениями.
В заключение необходимо отметить, что влияние биопрепаратов на всхожесть растений петунии не оценивалось, поскольку они были посеяны “самосевным” способом.
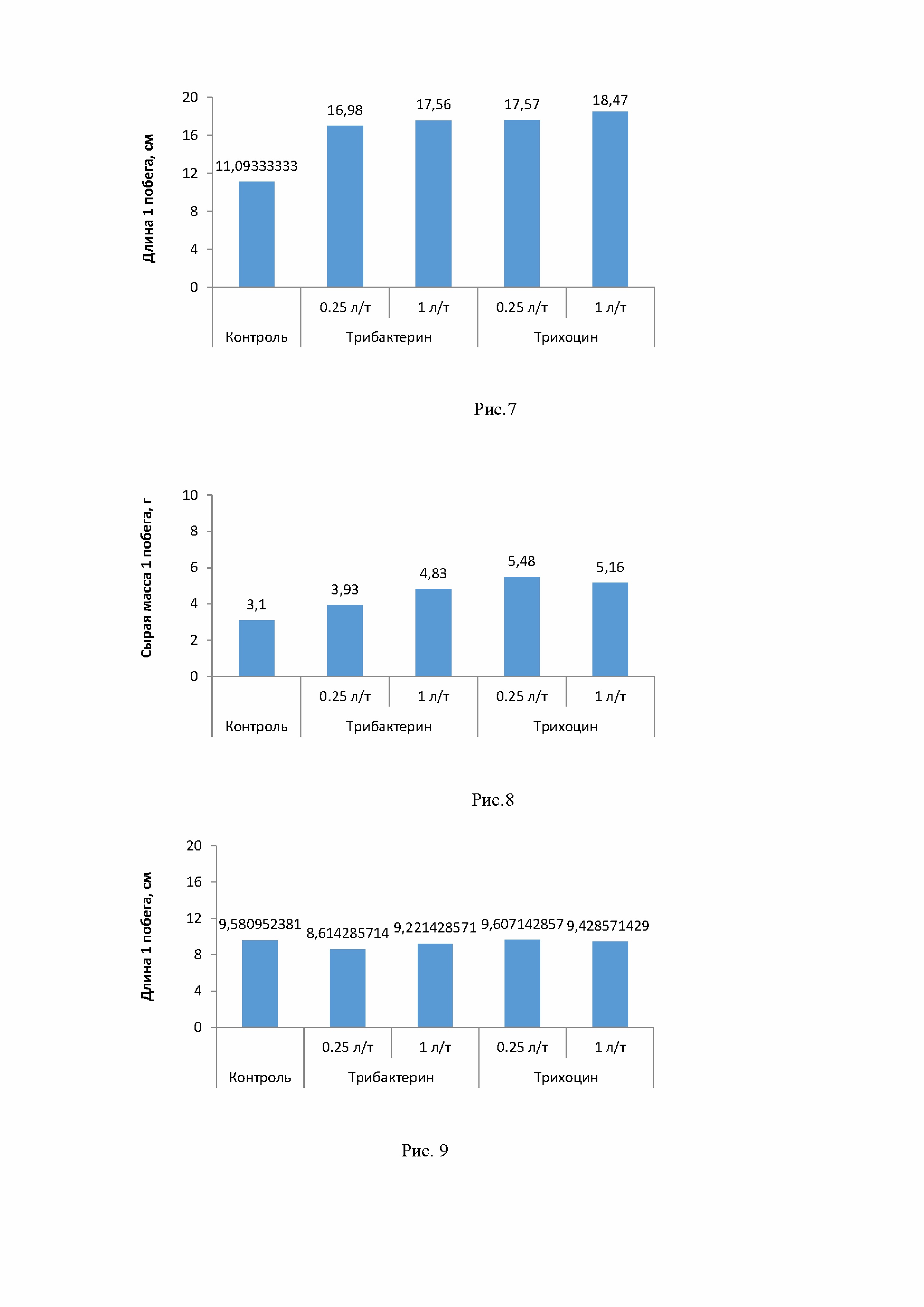
По достижении растениями томата возраста 4-х недель, они были извлечены из грунта, корни отмыты, растения сфотографированы, после чего были произведены биометрические замеры. Из таблицы 7 видно, что биопрепараты положительно повлияли как на увеличение длины надземной части растений, так и на увеличение сырой массы. При этом если в отношении длины побега оба препарата оказали примерно одинаковое влияние, то на увеличение сырой массы надземной части лучшее влияние оказал препарат Трихоцин на основе гриба Trichodermaharzianum в концентрации 0,25 л/т (рис. 7, 8).

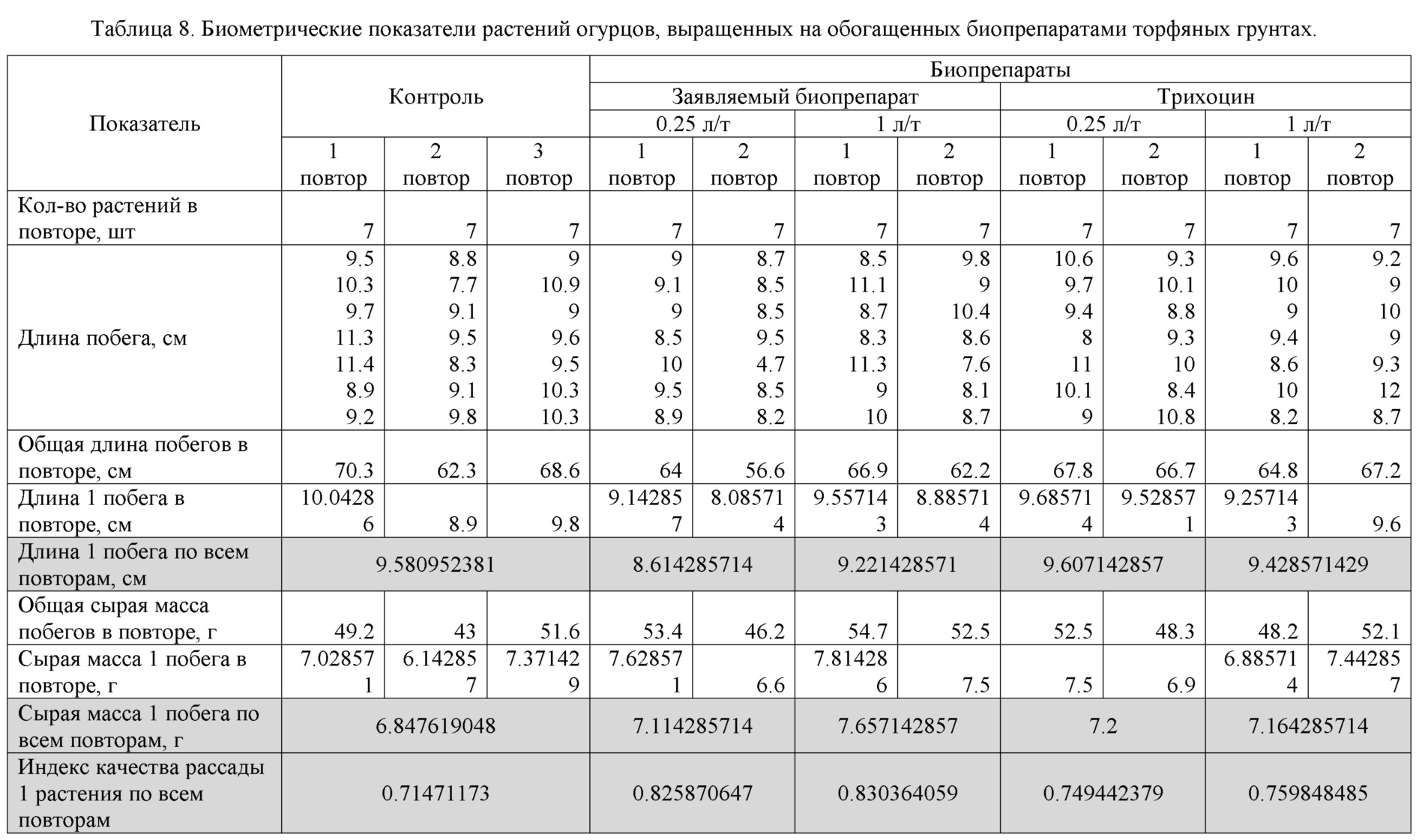
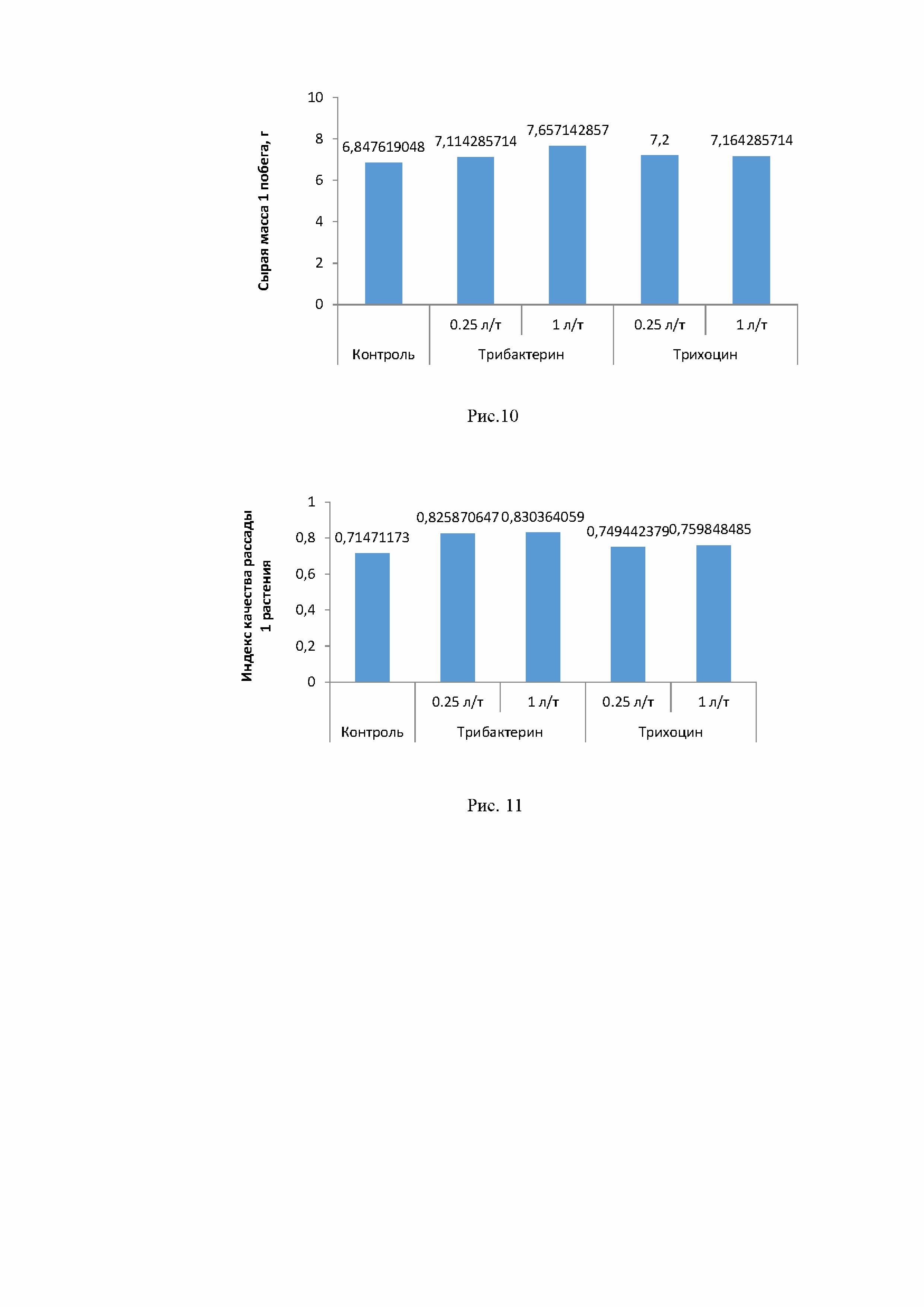
Что касается растений огурца, то они были извлечены из грунта через 3 недели после посадки по достижении фазы 1-2 пары настоящих листьев. Влияние заявляемого биопрепарата и биопрепарата Трихоцин в концентрациях 0,25 и 1 л/т на среднюю длину и массу 1 побега 3-х недельных гибридов огурца “F1 Времена года” показано на рис.9-10, где видно, что биопрепараты не оказали влияния на длину побегов, но увеличили их массу.
Увеличение массы побегов положительно сказалось и на индексе качества рассады.
Влияние заявляемого биопрепарата и биопрепарата Трихоцин в концентрациях 0,25 и 1 л/т на индекс качества рассады гибрида огурца “F1 Времена года” показано, на рис.11, где видно, что под влиянием биопрепаратов этот показатель улучшился. По совокупности влияния использованных концентраций лучшее влияние оказал заявляемый биопрепарат в концентрации 1 л/т (таблица 8).
Пример 14. Оценка эффективности микробиологического обогащения торфяных грунтов для получения рассады декоративных культур
Опыты с Петунией многоцветковой проводились с 6-недельными растениями. Из таблицы 9 видно, что культивирование растений на обогащенных биопрепаратами грунтах способствовало формированию коренастой сильной рассады. При этом лучшее влияние на биометрические показатели рассады оказал биопрепарат Трихоцин в концентрации 1 л/т.
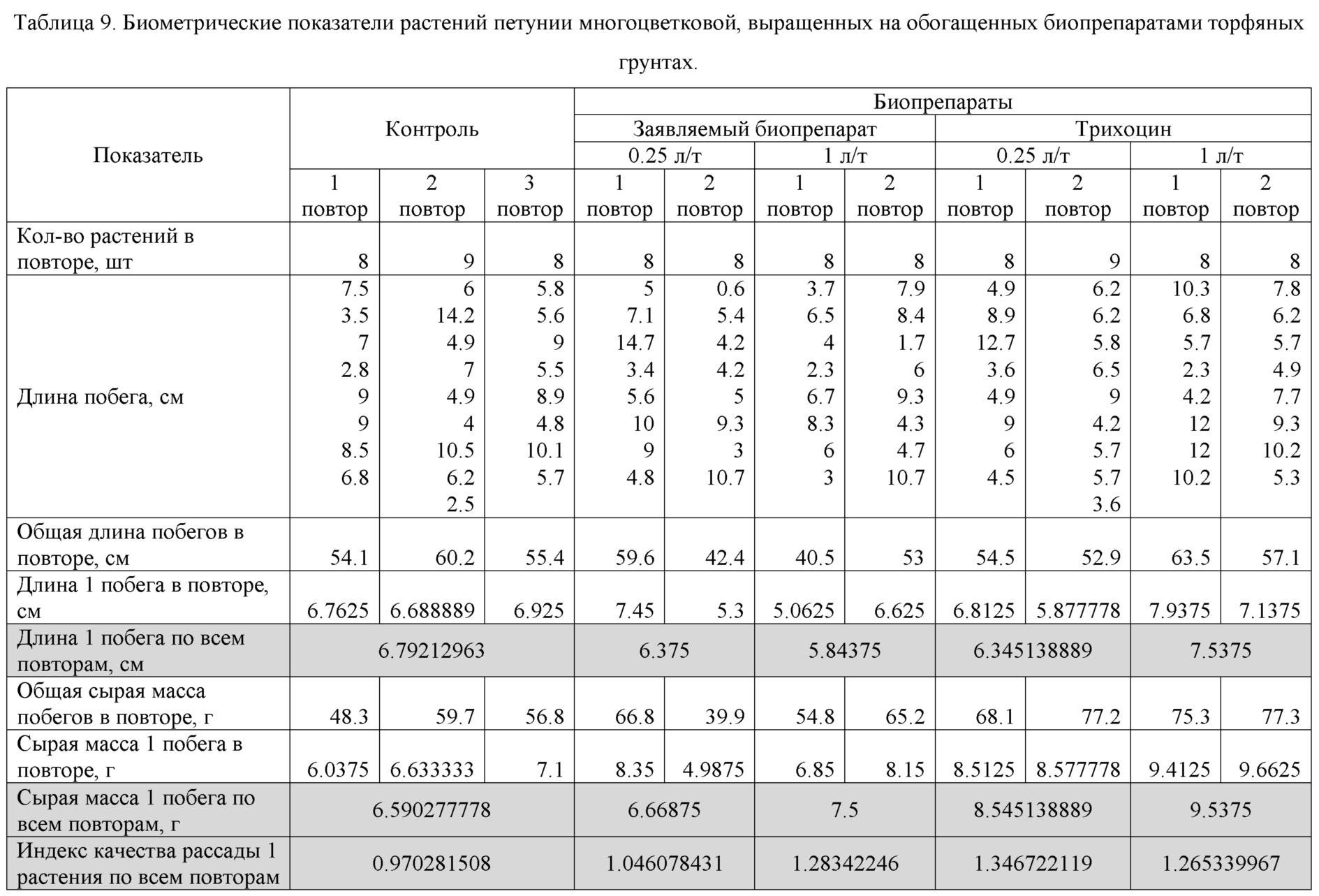
Таким образом, полученные данные указывают на то, что агрополезные микроорганизмы положительно влияют на рост и развитие растений при добавлении их в торфяные грунты.
Добавление агрополезных микроорганизмов в торфяные грунты оказывает положительное влияние на культивирование рассады томатов, огурцов и петунии многоцветковой, что выражается в положительном влиянии на всхожесть растений, а также увеличении их биометрических показателей. Причем, улучшается и качество рассады, что выражается в получении более коренастых крепких растений. При этом в зависимости от культуры, хорошо себя проявили оба биопрепарата.
В целом же, учитывая данные, полученные при применении микроорганизмов в чистом виде на семенах высших растений, можно сделать вывод, что лучшее влияние на рост и развитие растений оказывает заявляемый биопрепарат.
Реферат
Изобретение относится к области биотехнологии и сельского хозяйства, в частности, к обогащению торфяных грунтов агрохимически полезными бактериями. Микробиологическая композиция для торфяного грунта имеет содержит Pseudomonas asplenii 2-3×109КОЕ/см3; Bacillus subtilis 2-3×109КОЕ/см3; Azotobacter chroococcum 2-5×109КОЕ/см3 и диатомит из расчета 0,5 г на 1 л раствора микробиологической композиции. Микробиологическую композицию для торфяного грунта наносят путем мелкодисперсного распыления в количестве 1 л на тонну торфяного грунта. Предлагаемая микробиологическая композиция для торфяного грунта позволяет обогатить торфяной грунт агрохимически полезными бактериями и обеспечивает высокую ростостимулирующую активность овощных и культурных растений, высокую всхожесть семян, высокую антагонистическую активность по отношению к фитопатогенным грибам, увеличение агрохимических показателей чистого торфа. 2 н.п. ф-лы, 11 ил., 9 табл., 14 пр.

Комментарии