Способ регулируемого выделения активного вещества из состава - RU2079301C1
Код документа: RU2079301C1
Чертежи






Описание
Изобретение относится к контролирующей эрозию системе освобождения активных соединений и способу ее изготовления. Система применима для различных типов активных соединений и описывается на примере наиболее предпочтительной области ее применения, т.е. регуляции освобождения лекарственных средств. Система особенно рекомендуется для различных фармацевтических препаратов, предназначенных для перорального введения, в составе которых она контролирует освобождение различных активных соединений, в частности, обладающих низкой растворимостью. При использовании с активными соединениями, обладающими низкой и высокой растворимостью, система вызывает лишь незначительную задержку выделения последних, что создает преимущество при комбинированной терапии.
Идеальное медленно действующее фармацевтическое средство должно обеспечивать такую задержку выделения активного ингредиента на протяжении определенного периода, которая определяется задачами терапии и состоянием организма. Концентрация активного соединения в крови в течение этого периода должна поддерживаться на требуемом уровне.
При изготовлении лекарственных средств активное соединение вводится в лекарственную форму таким образом, чтобы обеспечить его освобождение с заданной скоростью.
В медленно действующие фармацевтические препараты обычно вводятся такие активные соединения, прием которых по терапевтическим соображениям производится несколько раз в сутки, либо потому, что они слишком быстро выводятся из организма, либо потому, что из-за небольшого числа введений и соответствующего повышения дозировок их концентрация в крови претерпевает колебания, недопустимые при данном состоянии больного.
Существующие способы, описанные в справочниках, монографиях и патентных описаниях (см. например Pharmazentische Technology edited by H. Sucker, stuttgort, 1978; Volgt, Lehrbuch der Pharmazentischen Technologie, Berlin, 1988), позволяют регулировать освобождение активных соединений в зависимости от их свойств и дозировок с помощью специфических гидрофильных адьювантов (например, гельобразующих производных целлюлозы, способных к набуханию, таких как метилцеллюлоза, оксипропилметилцеллюлоза, натрийкарбоксиметилцеллюлоза, поливиниловый спирт и т.п.) или гидрофобных адъювантов (например ацетилатов, силиконов, жиров, жирных кислот и их солей, полиэтилена, ПВС и т. п.). При включении активного соединения в гидрофильную матрицу освобождение из нее регулируется препятствующим диффузии гелевым слоем, который образуется в случае контакта матрицы с водой или пищеварительными жидкостями. При включении активного соединения в гидрофобные адъюванты или его окружении такими адъювантами последние образуют барьер, препятствующий диффузии.
Как правило, хорошо растворимые в воде соединения совместимы с адъювантами, характеризующимися слабой растворимостью и медленной деградацией, а плохо растворимые в воде активные соединения совместимы с адъювантами, обладающими высокой растворимостью и подверженными быстрому разрушению.
Эти адъюванты, задерживающие освобождение, активные соединений иногда используются самостоятельно, но чаще в комбинации с другими вспомогательными лекарственными веществами, без которых невозможно функционирование фармацевтической композиции. При использовании низких дозировок активных соединений особенно важен выбор подходящих наполнителей, которые увеличивают общий вес таблетированной композиции, но оказывают минимальное воздействие на характер освобождения входящего в ее состав активного соединения, как в случаях стандартного, так и медленно действующего лекарственного средств. В настоящее время в стандартных фармацевтических средствах в качество наполнителя, помимо лактозы, широко применяют крахмал. При таблетировании порошков наиболее подходящими наполнителями являются микрокристаллические целлюлозы. Кроме того, целлюлоза нередко используется в качестве связующего материала благодаря ее волокнистой структуре. Однако изготовленные на основе микроцеллюлозы таблетки характеризуются очень коротким периодом существования (Pharmazeutische Technologie, edited by H. Sucker, Stuttgart, 1978, с. 373). В связи с этим применение микрокристаллической целлюлозы в медленно действующих фармацевтических препаратах представляются неоправданным. Это объясняется, в частности, тем, что она обладает ограниченной способностью к набуханию, что вызывает быстрое разрушение таблеток при контакте с водой или пищеварительными жидкостями, и непригодна для создания препятствующего диффузии гелевого барьера в отличие от замещенных, хорошо растворимых и способных к набуханию производных целлюлозы (например, метилцеллюлозы, пропилцеллюлозы, оксипропилцеллюлозы, натрийкарбоксиметилцеллюлозы и т.п.).
Таким образом, необходимо разработать твердое фармацевтические средство и способ изготовления такого активного препарата, который обеспечивал бы полное и контролируемое освобождение входящего в его состав действующего начала или комбинации активных ингредиентов на протяжении заданного по физиологическим и терапевтическим показателям периода. Способ изготовления должен основываться на использовании коммерчески доступных адъювантов, хорошо поддающихся технологической и фармацевтической обработке и не обладающих токсичностью.
Цель изобретения создание системы для эрозионного контроля освобождения активных соединений и способа ее изготовления, позволяющего получать медленно действующую лекарственную форму для слабо растворимого активного ингредиента, для комбинации слабо растворимых активных ингредиентов или для комбинации, по крайней мере, одного слабо растворимого активного ингредиента, по крайней мере, с одним хорошо растворимым активным соединением, каковая форма обеспечивает задержку освобождения слабо растворимых активных компонентов практически в отсутствие задержки выделения хорошо растворимых активных компонентов при наличии в ней последних.
Изобретение обеспечивает достижение этой цели.
Предметом изобретения является способ изготовления системы для эрозионного контроля освобождения активного соединения, отличающийся тем, что активное соединение или соединения таблетируют существующими методами с использованием, по крайней мере, одного способного к набуханию адъюванта и, по крайней мере, одного адъюванта (регулятора набухания), обладающего более высоким сродством к воде, чем способный к набуханию адъювант, при необходимости дополнительно добавляя другие адъюванты.
Рис. 1. Концентрация нифедицина в плазме крови трех добровольцев после введения таблеток по примеру 9 ("введение А"). Средние величины. 1 - концентрация (нг мл), 2 "введение А", 3 время (часы).
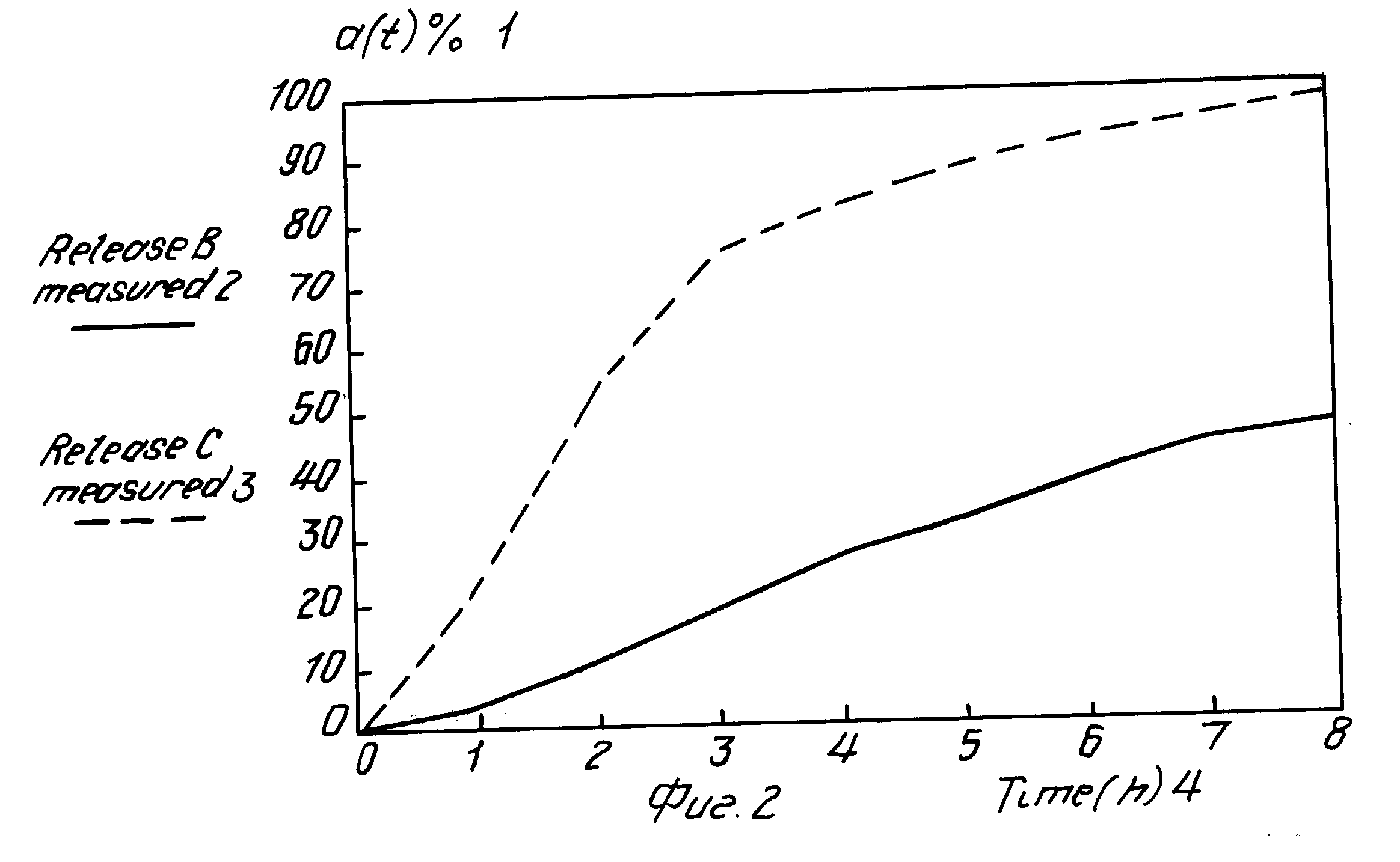
Рис. 2. Освобождение нифедипина после введения 6 таблеток по примеру 10 ("освобождение Б") и примеру 11 ("освобождение В"). Средние величины. На рис. обозначено: 1 в процентах от общего количества, 2 "освобождение Б", 3 "освобождение В", 4 время (часы).
Рис. 3. Средняя концентрация нифедипина после введения трем добровольцам таблеток по перимеру 10 ("введение Б") и примеру 11 ("введение В") в сопоставлении с введением коммерческого стандарта ("введение Р"): 1 - концентрация (нг мл), 2 "введение Б", 3 "введение В", 4 "введение Р", 5 время (часы).
Рис. 4. Средняя концентрация первичного метаболита нифедипина (НПО) в крови трех добровольцев после введения по примеру 10 ("введение Б") и примеру 11 ("введение В") в сопоставлении с коммерческим стандартом ("введение Р"): 1 концентрация (нг мл), 2 "введение Р", 3 "введение Б", 4 "введение В", 5 время (часы).
Рис. 5 и 6 соответствуют рис.4, иллюстрируя изменения во времени на протяжении 4 часов (рис. 5) и 2 часов (рис. 6) в отсутствие введения стандартного препарата.
В существующих системах эрозионного контроля выделение слабо растворимых фармацевтических средств регулируется медленно растворяющим адъювантом, медленной эрозией геля или разрушением перевариваемого адъюванта. В предлагаемом изобретении эрозия такой системы контролируется добавлением регулятора набухания. Применение последнего позволяет контролировать увеличение объема способных к набуханию адъювантов. Вода или переваривающая жидкость, вступающие в контакт с системой, предварительно связываются регулятором набухания. Это означает, что концентрированный или насыщенный "раствор" регулятора набухания образуется внутри системы. Таким путем предотвращается набухание способного к нему адъюванта. В то же время регулятор набухания растворяется в наружной зоне системы. Следовательно, здесь имеется достаточное количество воды для обеспечения набухания способного к нему адъюванта, в результате чего начинается эрозия фармацевтического средства. Эрозия распространяется от наружной к внутренней зоне системы и зависит от соотношения регулятора набухания и способного к набуханию адъюванта, а также от наличия факторов смачиваемости, например гидрофобизирующих адъювантов. Предлагаемая система допускает применение адъювантов, способных к ограниченному набуханию, таких как микрокристаллическая целлюлоза и крахмал, которым в настоящее время отдается предпочтение при изготовлении быстро действующих оральных средств или лекарственных форм на основе систем эрозионного контроля.
Добавление адъювантов, влияющих на жидкостной обмен между внутренней зоной таблеток и окружающим ее объемом, расширяет возможности системы с точки зрения регуляции выделения активного ингредиента. Например, введение в нее факторов смачиваемости (гидрофобизирующих или смачивающих агентов) и растворимых адъювантов обеспечивает дополнительные способы изменения характера контролируемого освобождения лекарственного средства. Эти адъюванты регулируют выщелачивание и таким образом уменьшают концентрацию регулятора набухания в матрице в процессе положительного или отрицательного воздействия на обмен жидкостей. Что касается понятия растворимости активных ингредиентов, то термин "слабо растворимое вещество" относится к таким веществам, одна весовая часть которых растворяется в объеме растворителя (воды) не менее 30 весовых частей. Соответственно, для растворения одной весовой части хорошо растворимого вещества требуется менее 30 весовых частей растворителя. (См. Arzneibuch der DDR, Akademie Verlag, Berlin 1985, 1114.0).
Под адъювантами, способными к набуханию, понимают также вещества, которые способны растворяться и таким образом увеличиваться в объеме при контакте с растворителями, особенно с водой и переваривающими жидкостями. Адъюванты с ограниченной способностью к набуханию характеризуются тем, что увеличение их объема прекращается после уравнивания сил связывания сцепления в их молекулах или молекулярных агрегатах и сил, вызывающих увеличение объема посредством механизма сорбции связывания воды. В веществах с неограниченной способностью к набуханию эти силы являются следствием взаимодействия между растворителем и макромолекулами и превосходят силы связывания сцепления в молекулах или молекулярных агрегатах. При достаточно большом количестве растворителя адъюванты с неограниченной способностью к набуханию полностью растворяются, вызывая образование в качестве промежуточного продукта более или менее выраженной гелевой фазы.
Вещества с более высоким сродством к воде по сравнению со способными к набуханию адъювантами характеризуются тем, что при ограниченном количестве воды, например в насыщенном или высоко концентрированном растворе (более 50% ), они предотвращают гидратацию способного к набуханию адъ ванта или вызывают дегидратацию такого адъюванта.
Новым и непредвиденным в данном изобретении является образование форм, характеризующихся очень медленной и контролируемой эрозией, которые, вопреки ожиданию, очень быстро разрушаются и освобождают активный ингредиент, который тут же всасывается.
Способ гарантирует получение фармацевтического средства, не дающего осложнений, с использованием существующих фармацевтических и технологических операций. Предлагаемые системы освобождения активных соединений и способ ее изготовления обеспечивают оптимальную биологическую доступность активных соединений.
Примерами соединений с низкой растворимостью, пригодных для системы освобождения, служат теофиллин, нифедипин, празозин, ибупрофен и карбамазепин. В соответствии с настоящей заявкой эти активные соединения обеспечивают получение лекарственных средств с эффективной системой эрозионного контроля освобождения рекомендуемых соотношений адъювантов.
Сальбутамол, тербуталин и фолэдрин служат примерами активных соединений с хорошей растворимостью.
Примерами адъювантов с ограниченной способностью к набуханию являются крахмалы и микрокристаллические целлюлозы, такие как коммерческие продукты хьютен (Veb Freibergen Zelestoff und Papierfabrie Weisenborn, GDR ), авицель (FMc Corp. Philadelphia, PA, 19103), эльцема (Degissa, 6000 Frankfurt ) M, F.R.G. и витацель (J.Rettenmaier-Sohne, 7091, Holzmuhle, F.R.G).
Наилучшие марки микрокристаллической целлюлозы характеризуется способностью к набуханию в воде до 100% их объема. Наилучшие марки крахмала характеризуются способностью образовывать гель в количестве менее 100% той части объема, которая набухает при включении в нее воды. Конкретно, в воде происходит увеличение специфического объема крахмала, а объем образующегося геля меньше степени увеличения объема крахмала (при следующих условиях: температура от 22 до 25o, определение через 24 часа).
Известные производные целлюлозы, например метилцеллюлоза, гуммицеллюлоза, оксипропилцеллюлоза и оксипропилметилцеллюлоза представляют собой примеры адъювантов с неограниченной способность к набуханию (см. Pharmazeutische Technologie, Ed.H.Sucker, Stuttgart, 1978, pp. 321-354).
Понятие регулятор набухания применительно к данному изобретению означает адъювант, обладающий более выраженным сродством к воде, чем способный к набуханию компонент фармацевтического сродства. Характерным примером такого вещества служат полиэтиленгликоли разной молярной массы, предпочтительно от 400 до 35000, или высокоактивные гидратирующие неорганические соединения (т. е. быстро и легко растворяющиеся в воде), как сернокислый калий, хлористый калий или хлористый натрий.
Изготовление таблеток, содержащих систему освобождения активного ингредиента, согласно предлагаемому изобретению, осуществляются общепринятыми методами получения галеновых препаратов, т.е. смешиванием составляющих компонентов, непосредственным таблетированием или таблетированием с предшествующим гранулированием смеси. В связи с этим регулятор набухания должен вводится в раствор, используемый для гранулирования составных частей лекарственного средства. Типичными примерами применяемых при таблетировании адъювантов служат тальк и обычные адъюванты, влияющие на смачиваемость, в частности адъюванты, создающие гидрофобные условия (например жирные кислоты, металлические соли жирных кислот и/или силиконы), или благоприятствующие смачиванию. Такие адъюванты выполняют также функцию любрикантов. Их применяют в количествах от 0 до 50 весовых процентов, предпочтительно от 0 до 10 весовых процентов от общей массы.
Способные к набуханию адъюванты и регуляторы набухания используют в весовых соотношениях от 1:3 до 100:1, предпочтительно от 1:1 до 50:1, особенно 2:1 25:1. Соотношение остальных компонентов системы (активных ингредиентов и других адъювантов) со способными к набуханию адъювантами и регуляторами набухания не имеет решающего значения. При выборе его можно исходить из условий практического применения лекарственного средства и режима терапии (дозировок, фармакокинетического профиля, целей терапии).
Предлагаемая система может изготавливаться в виде общепринятой лекарственной формы, например в виде таблеток или капсул. Она может также входить в состав обычных многокомпонентных средств или применяться в виде микроформы, например, для заполнения капсул. Многокомпонентная форма предполагает разделение общей дозы между несколькими меньшими формами (микроформами, такими, как, например, микрокапсулы, таблетки и микропилюли; при этом малые формы, размер которых обычно не превышает 3 мм, получают разнообразными способами, включая консервацию, экструзию, компрессию, таблетирование).
Предлагаемая композиция и способ ее изготовления с использованием теофиллина в качестве плохо растворимого активного ингредиента иллюстрируется следующими примерами.
Таблетки получают обычными методами таблетирования.
Сравнительный пример 1:
теофиллин 200,0 мг
хьютен 12 100,0 мг (микрокристаллическая целлюлоза)
стеарат магния 5,0 мг
Результаты оценки освобождения (среднее по 5 определениям методом Moldenhaner, Kala and Erbe
(Pharmazie, Vol. 30, 1975, p. 720) приведены в табл. 1.
Поведение таблеток по сравнительному примеру 1 соответствует ожидавшемуся. Активный ингредиент быстро и полностью выводится из лекарственного средства в соответствии с известной способностью микрокристаллической целлюлозы усиливать процессы деградации.
Сравнительный пример 2:
теофиллин 200,0 мг
хьютен 12 20,0 мг
стеарат магния 5,0 мг
Результаты определения
освобождения (среднее по 5 определениям) приведены в табл. 2.
При низком содержании хьютена в фармацевтическом препарате освобождение активного ингредиента уменьшается из-за очень низкой растворимости теофиллина, что является характерной чертой динамики выделения активного ингредиента.
Добавление таких веществ, как полиэтиленгликоли, применяемых в качестве растворителей или для улучшения растворимости плохо растворимых активных соединений, не вызывает задержки выделения последних из системы, как показано в сравнительных примерах 1 и 2.
Пример 1:
теофиллин 200,0 мг
хьютен 12 100,0 мг
полиэтилен-гликоль 35000 5,0 мг
стеарат магния 5,0 мг
Результаты определения освобождения (среднее по 5
определениям) приведены в таблице 3.
Увеличение содержания хорошо растворимого в воде полиэтиленгликоля 35000 ведет к дальнейшему увеличению задержки освобождения.
Пример 2:
теофиллин 200,0 мг
хьютен 12 100,0 мг
ПЭГ 35000x 15,0
мг
стеарат магния 5,0 мг
Полиэтиленгликоль со средней молярной массой 35000.
Результаты определения освобождения (среднее по 5 определениям) приведены в табл. 4
Пример 3:
теофиллин 200,0 мг
хьютен 12 100,0 мг
ПЭГ 35000 50,0
мг
стеарат магния 5,0 мг
Результаты определения освобождения (среднее по 5
определениям) приведены в табл. 5.
В комбинации с активно гидратирующим адъювантом даже небольшие количества способной к ограниченному набуханию микроцеллюлозы могут вызывать задержки плохо растворимых активных соединений (см. сравнительный пример 2).
Пример 4:
теофиллин 200,0 мг
хьютен 20,0 мг
ПЭГ 35000 5,0 мг
стеарат магния 5,0
мг
Результаты определения освобождения (среднее по 5 определениям) приведены в табл. 6.
Очевидно, что вопреки ожиданию добавление полиэтиленгликоля не вызывает ускорения освобождения теофиллина, напротив, скорее увеличивает его задержку.
Влияние других адъювантов иллюстрируется на примерах использования адъюванта, способного к ограниченному набуханию, регулятора набухания и смачивающего вещества.
Пример 5:
теофиллин 200,0
мг
хьютен 12 100,0 мг
ПЭГ 35000 5,0 мг
стеарат магния 0,0 мг
Результаты определения освобождения (среднее по 5 определениям) приведены в табл. 7.
Пример 6:
теофиллин 200,0 мг
хьютен 12 100,0 мг
ПЭГ 35000 5,0 мг
стеарат магния 2,0 мг
Результаты определения освобождения (среднее по 5 определениям)
приведены в табл. 8.
Пример 7:
теофиллин 200,0 мг
хьютен 12 100,
0 мг
ПЭГ 35000 5,0 мг
стеарат магния 10,0 мг
Результаты определения
освобождения (среднее по 5 определениям) приведены в табл. 9.
Пример 8:
теофиллин 200,0 мг
хьютен 12 100,00 мг
ПЭГ 35000 5,0 мг
стеарат магния 50,0
мг
Результаты определения освобождения (среднее по 5 определениям) приведены в табл.
10.
Влияние добавления адъюватов, способных к неограниченному набуханию, можно иллюстрировать также на примере предлагаемого способа по задержке освобождения нифедипина из фармацевтических препаратов. Для этой цели с помощью общепринятых методик готовят таблетки, имеющие состав по примерам 9, 10 или 11. Характер освобождения активного соединения оценивают в опытах ин виво и ин витро.
Пример 9:
нифедипин 20,0 мг
авицель ПГ 101 150,0 мг
стеарат магния 5,0 мг
ПГ 35000 5,0 мг
Пример 10:
нифедипин 20,
0 мг
авицель ПГ 101 70,0 мг
стеарат магния 5,0 мг
метилцеллюлоза 400 5,0 мг
ПЭГ 35000 10,0 мг
Результаты определения освобождения (среднее по 6
определениям) приведены в табл. 11.
Пример 11:
нифедипин 20,0 мг
авицель ПГ 101 55,
0 мг
стеарат магния 5,0 мг
метилцеллюлоза 400 20,0 мг
ПЭГ 35000 10,0 мг
Результаты определения освобождения (среднее по 6 определениям) приведены в табл. 12.
Пример доказывает, что в предлагаемой системе освобождение активного соединения из фармацевтического средства ин виво может происходить настолько медленно, что его концентрация в плазме крови трех добровольцев в возрасте от 18 до 40 лет после однократной дозы не обеспечивает эффективной терапии (сроки взятия крови и методика анализа приведены ниже).
Рис. 1. Концентрация нифедипина в плазме крови после приема таблеток по примеру 9 ("введение А").
При проведении открытого выборочного исследования с тройным перекрестным контролем проведено сравнение последствий измерения в составе фармацевтического препарата (изменение содержания адъюванта с неорганической способностью к набуханию) для зависимой от времени биологической доступности активного соединения, концентрации нифедипина в плазме крови и, в качестве контроля, его первичного метаболита НПО, с одной стороны, и аналогичными показателями для медленно действующего коммерческого препарата, применяющегося в той же дозировке, с другой стороны. В обоих случаях добровольцы получали по одной таблетке (20 мг). Принята следующая схема проведения испытаний, результаты которых представлены на рисунках 3 6.
Стандартный препарат ("введение Р" 20 мг в форме медленно действующего таблетированного средства (зарегистрированное лекарственное средство).
Активный ингредиент: 20 мг нифедипина.
Испытываемое средство
("введение Б" 20 мг нифодипин-ретарда, таблетки по примеру 10
Активный ингредиент: 20 мг нифедипина
Испытываемое средство ("введение В" 20 мг нифедипин-ретарда, таблетки по примеру
11.
Количественное определение нифедипина и его первичного метаболита НПО в плазме крови проводят с помощью специфичной высокоэффективной жидкостной хроматографии, обеспечивающей получение достоверных результатов при чувствительности определения 1 нг мл. Исследования проведены на трех добровольцах в возрасте от 42 до 47 лет. Во всех случаях исследование завершено в соответствии с протоколом. В открытом исследовании по методу случайной выборки с тройным перекрестным контролем проведено трехкратное введение добровольцам нифедипина с двумя перерывами. Потребление пищи прекращалось в течение 10 часов перед и до 4 часов после каждого введения препарата. Непосредственно перед введением и через 20, 40, 60, 90, 120, 150 мин, 3, 4, 6, 8, 11 и 15 час после него отбирали пробы венозной крови объемом 10 мл и получали плазму для определения нефидипина и НПО.
На рисунках 3, 5 и 6 показаны кривые средних концентраций нифедипина, а на рисунке 4 концентрация продукта его обмена НПО. Очевидно, что фармацевтические препараты, согласно изобретению, обеспечивают контролируемое освобождение активных соединений в намеченную в соответствии с требованиями терапии область.
Приведенные результаты показывают, что введение в систему растворимого адъюванта с повышенной способностью к набуханию (в данном случае, например, метил- целлюлозы) усиливает освобождение.
Эти результаты представляются неожиданными (метилцеллюлоза проявляет выраженное задерживающее действие, которое широко применяется для формирования гелевого слоя, препятствующего диффузии, при использовании как самой метилцеллюлозы, так и ее комбинации с плохо растворимыми полимерами). Они обусловлены значительным уменьшением плотности связывающих структур при набухании и разрушении метилцеллюлозы. Таким образом, при увеличении количества растворимых, в данном случае гель- образующих, адъювантов происходит ускорение освобождения и, следовательно, биологической доступности активных соединений ин виво.
Поведение фармацевтических препаратов по примерам 10 и 11 иллюстрируются следующими рисунками.
Рисунок 2. Освобождение нифедипина из таблеток по примерам 10 ("освобождение Б") и 11 ("освобождение Б").
Рисунок 3. Концентрация нифедипина в плазме крови после введения таблеток по примеру 10 ("введение Б") и примеру 11 ("введение В") в сопоставлении с концентрацией коммерческого стандартного препарата.
Рисунок 4. Концентрация в плазме крови первичного метаболита нифедипина НПО после введения таблеток по примеру 10 ("введение Б") и примеру 11 ("введение В") в сопоставлении со стандартным коммерческим препаратом.
Контролируемая лаг-фаза, имеющая место перед освобождением активного соединения (что хорошо видно на рисунках 5 и 6, где его концентрация в плазме крови показана в ином масштабе), может быть с успехом использована при особых режимах введения.
Рисунок 5. Концентрация нифедипина в плазме крови после введения таблеток по примеру 10 ("введение Б") и примеру 11 ("введение В") до 4 часов после введения.
Рисунок 6. Концентрация нифедипина до 2 часов после введения таблеток по примеру 10 ("введение Б") и примеру 11 ("введение В").
Характер освобождения хорошо растворимых активных соединений слабо зависит от используемого в предлагаемом изобретении принципа задержки. Это открывает широкие перспективы его применения по целому ряду показателей.
Ниже приводятся примеры преимуществ использования предлагаемого изобретения для контроля освобождения двух активных соединений, отличающихся степенью растворимости, в именно теофиллина и салбутамола.
Пример 12:
теофиллин 250,0 мг
салбутамолсульфат 9,6 мг
авицель ПГ 101 60,
0 мг
ПЭГ 35000 10,0 мг
стеарат
магния 10,0 мг
Результаты определения освобождения (среднее по 5 определениям) приведены в табл. 13 и 14.
В течение первого часа освобождения более 50% высокорастворимого активного соединения. Салбутамол практически полностью выводится в условиях контроля в соответствии с кинетической нулевого порядка.
Теоретически вышеописанная система может использоваться для введения различных лекарственных средств. В дополнение к регуляции освобождения активных соединений, применяемых в сельском хозяйстве, например удобрений, фитопротекторов (инсектицидов) и регуляторов роста, она может быть особенно рекомендована для введения лекарственных препаратов, используемых в медицине и ветеринарии.
Реферат
Изобретение относится к химико-фармацевтической промышленности и касается способа регулируемого выделения активного вещества. Сущность изобретения заключается в том, что активное вещество, включающее соединение с низкой растворимостью и при необходимости соединение с высокой растворимостью, смешивают, по крайней мере, с одним адъювантом, обладающим способностью к набуханию в воде и гелеобразованию, и адъювантом, обладающим высоким сродством к воде. 1 з.п. ф-лы, 14 табл., 6 ил.


Комментарии