Фармацевтические составы ингибиторов hif-гидроксилазы - RU2681304C2
Код документа: RU2681304C2
Чертежи

Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет в соответствии с § 119(e) раздела 35 Свода законов США на основании предварительной заявки на патент США №61/831909, поданной 6 июня 2013 г. и включенной в настоящее описание посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Настоящее изобретение в целом относится к фармацевтическим составам [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты.
[0003] [(4-Гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусная кислота (также именуемая в настоящем описании как соединение А) представляет собой высокоактивный ингибитор пролилгидроксилазы индуцируемого гипоксией фактора (HIF, англ.: hypoxia inducible factor), описанного в патенте США №7323475. Ингибиторы HIF-пролилгидроксилазы подходят для повышения стабильности и/или активности HIF и подходят, среди прочего, для лечения и предотвращения расстройств, связанных с HIF, включая анемию и расстройства, связанные с ишемией или гипоксией.
[0004] Недавно было обнаружено, что соединение А разлагается под воздействием света. До сих пор еще не были предложены фармацевтические составы соединения А, которые обеспечивают необходимую фотостабильность соединения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0005] Настоящее описание позволяет удовлетворить потребность в обеспечении фотостабильности соединения А и других соединений путем обеспечения фармацевтического состава, содержащего [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту, фармацевтически приемлемое вспомогательное вещество и эффективное количество фотостабилизирующего агента. В одном из вариантов реализации фармацевтический состав содержит менее чем примерно 0,2% масс/масс. продукта фоторазложения [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты (в расчете на количество активного фармацевтического ингредиента («АФИ»)). В другом варианте реализации фотостабилизирующий агент препятствует прохождению света в диапазоне длин волн примерно от 200 нм и примерно до 550 нм.
[0006] В одном из вариантов реализации фотостабилизирующий агент содержит диоксид титана и по меньшей мере один дополнительный краситель. В одном из вариантов реализации фотостабилизирующий агент препятствует прохождению света в диапазоне длин волн от примерно 200 нм до примерно 550 нм. В одном из вариантов реализации краситель выбран из группы, состоящей из черного красителя, синего красителя, зеленого красителя, красного красителя, оранжевого красителя, желтого красителя и их комбинаций. В другом варианте реализации краситель выбран из группы, состоящей из красного красителя, оранжевого красителя, желтого красителя и их комбинаций.
[0007] В одном из вариантов реализации краситель выбран из группы, состоящей из красителя красного очаровательного АС, алюминиевого лака красителя красного очаровательного АС, оксида железа красного, оксида железа желтого, красителя желтого «солнечный закат» FCF, алюминиевого лака красителя желтого «солнечный закат» FCF, индиготина, алюминиевого лака индиготина и их комбинаций.
[0008] В одном из вариантов реализации фармацевтический состав содержит от примерно 20 мг до примерно 200 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты. В другом варианте реализации фармацевтический состав содержит примерно 20 мг, примерно 50 мг или примерно 100 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты.
[0009] В одном из вариантов реализации твердая лекарственная форма содержит фармацевтический состав, и указанная твердая лекарственная форма выбрана из капсулы, таблетки, шарика, гранулы, пеллеты, пастилки для рассасывания, пилюли или жевательной резинки. В другом варианте реализации твердая лекарственная форма представляет собой таблетку. В другом варианте реализации твердая лекарственная форма представляет собой капсулу.
[0010] В настоящем описании предложена таблетка, содержащая [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту, фармацевтически приемлемое вспомогательное вещество и эффективное количество фотостабилизирующего агента. В одном из вариантов реализации таблетка содержит ядро таблетки и покрытие. В некоторых вариантах реализации фотостабилизирующий агент включен в таблетку или ядро таблетки. В других вариантах реализации ядро таблетки содержит [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту и фармацевтически приемлемое вспомогательное вещество, и покрытие содержит фотостабилизирующий агент.
[0011] В одном из вариантов реализации покрытие присутствует в таблетке в количестве, составляющем от примерно 3% до примерно 8% масс/масс. в расчете на массу ядра таблетки. В другом варианте реализации ядро таблетки содержит от примерно 22% до примерно 28% масс/масс. [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты (в расчете на массу ядра таблетки). В еще одном варианте реализации фармацевтически приемлемое вспомогательное вещество содержит моногидрат лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния.
[0012] В одном из вариантов реализации покрытие содержит фотостабилизирующий агент от примерно 0,1% до примерно 50% масс/масс. (в расчете на массу покрытия). В некоторых вариантах реализации фотостабилизирующий агент содержит диоксид титана и по меньшей мере один дополнительный краситель, выбранный из группы, состоящей из красителя красного очаровательного АС, алюминиевого лака красителя красного очаровательного АС, оксида железа красного, оксида железа желтого, красителя желтого «солнечный закат» FCF, алюминиевого лака красителя желтого «солнечный закат» FCF, индиготина, алюминиевого лака индиготина и их комбинаций. В другом варианте реализации фотостабилизирующий агент содержит диоксид титана и алюминиевый лак красителя красного очаровательного АС.
[0013] В настоящем описании предложена капсула, содержащая [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту, фармацевтически приемлемое вспомогательное вещество и эффективное количество фотостабилизирующего агента. В одном из вариантов реализации капсула содержит наполнитель капсулы и оболочку капсулы. В одном из вариантов реализации наполнитель капсулы содержит [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту и фармацевтически приемлемое вспомогательное вещество, а оболочка капсулы содержит фотостабилизирующий агент.
[0014] В одном из вариантов реализации наполнитель капсулы содержит примерно от 12% до примерно 15% масс/масс. [(4-гидрокси- 1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты (в расчете на массу наполнителя капсулы). В другом варианте реализации фармацевтически приемлемое вспомогательное вещество содержит моногидрат лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния.
[0015] В одном из вариантов реализации оболочка капсулы содержит фотостабилизирующий агент в количестве, от примерно 1,8% до примерно 6% масс/масс. (в расчете на массу оболочки капсулы). В некоторых вариантах реализации фотостабилизирующий агент содержит диоксид титана и по меньшей мере один дополнительный краситель, выбранный из группы, состоящей из красителя красного очаровательного АС, оксида железа красного, оксида железа желтого и их комбинаций.
[0016] В отдельном варианте реализации предложен способ ингибирования фоторазложения [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты. Указанный способ включает приготовление состава [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты с эффективным количеством фотостабилизирующего агента. В другом варианте реализации фотостабилизирующий агент содержит диоксид титана и по меньшей мере один дополнительный краситель.
[0017] В еще одном варианте реализации предложен способ лечения, предварительного лечения или задержки возникновения или прогрессирования состояния, опосредованного по меньшей мере частично индуцируемым гипоксией фактором (HIF). Указанный способ согласно настоящему изобретению включает введение нуждающемуся в этом пациенту фармацевтического состава, таблетки или капсулы, представленных в настоящем описании.
[0018] В еще одном варианте реализации предложен способ лечения, предварительного лечения или задержки возникновения или прогрессирования анемии. Указанный способ включает введение нуждающемуся в этом пациенту фармацевтического состава, таблетки или капсулы, представленных в настоящем описании.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
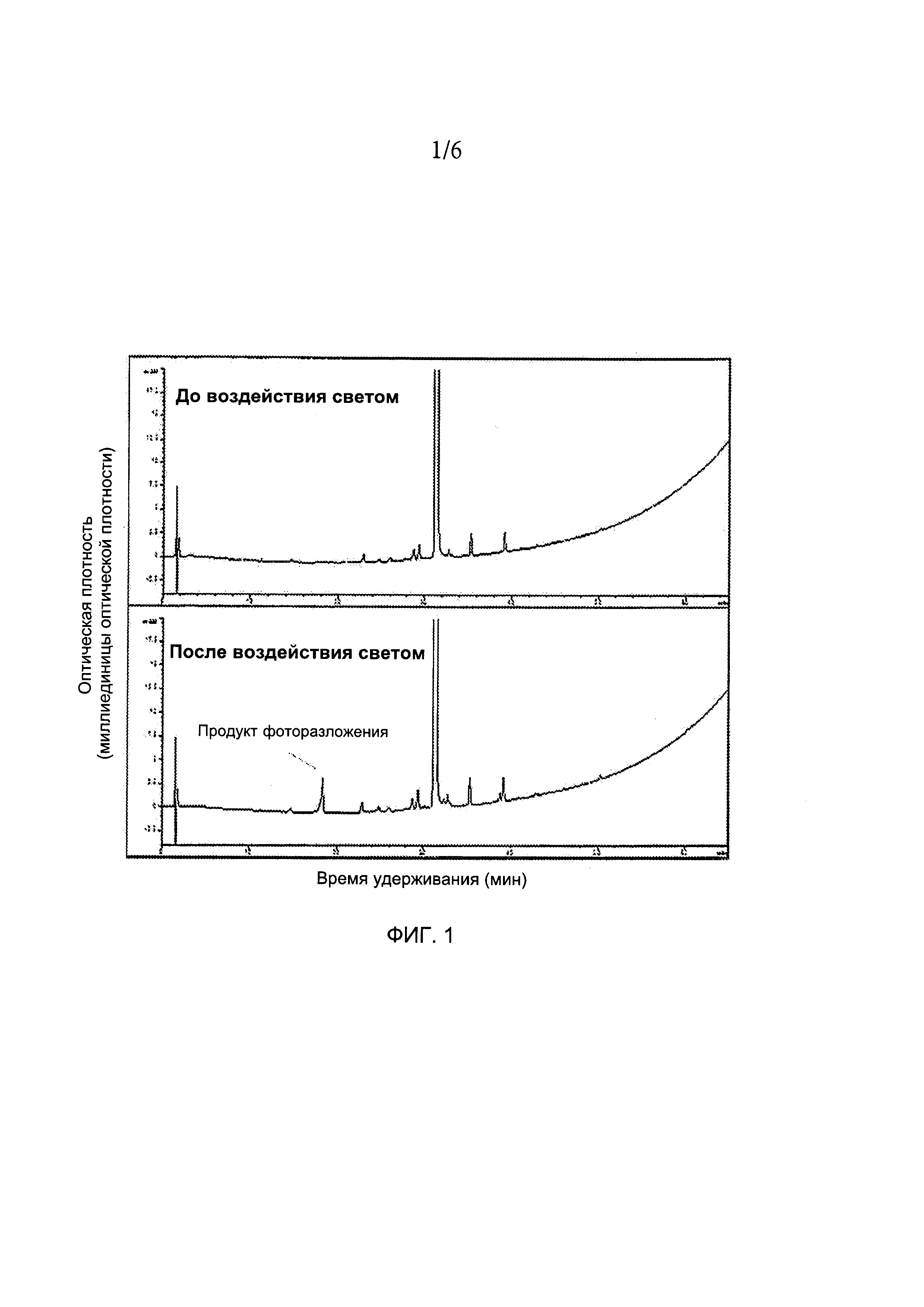
[0019] ФИГ. 1 иллюстрирует хроматограммы ВЭЖХ порошков соединения А до и после воздействия солнечных лучей. Для получения более подробной информации см. пример 1.
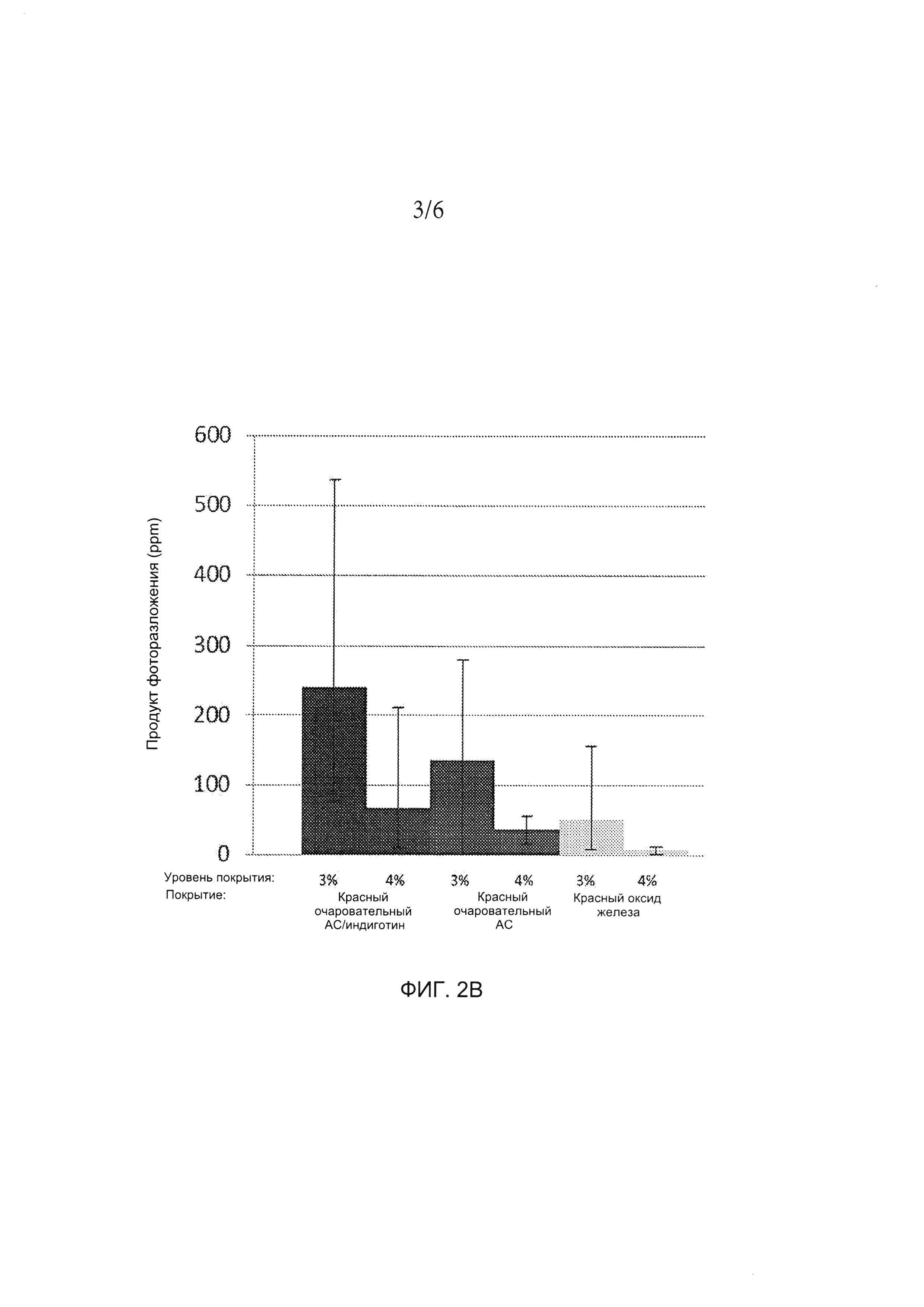
[0020] ФИГ. 2А и 2B иллюстрируют количество продукта фоторазложения в таблетках, содержащих либо 20 мг (ФИГ. 2А), либо 100 мг (ФИГ. 2B) соединения А при воздействии света. На таблетки нанесено покрытие с составом, содержащим краситель красный очаровательный АС/индиготин /диоксид титана (обозначен на фигурах как краситель красный очаровательный АС/индиготин), краситель красный очаровательный АС/диоксид титана (обозначен на фигурах как краситель красный очаровательный АС) или оксид железа красный/диоксид титана (обозначен на фигурах как красный оксид железа). Для получения более подробной информации см. пример 2.
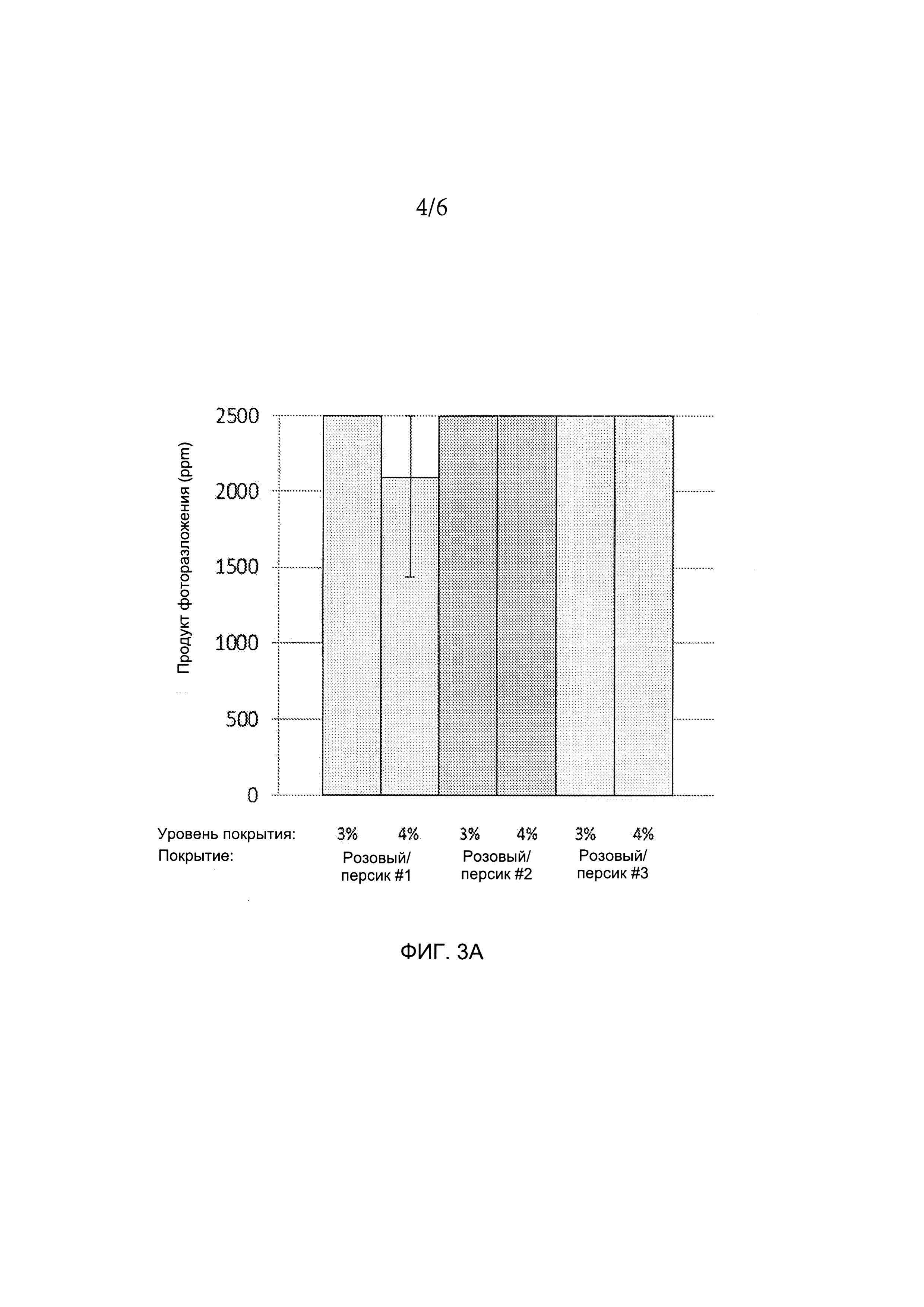
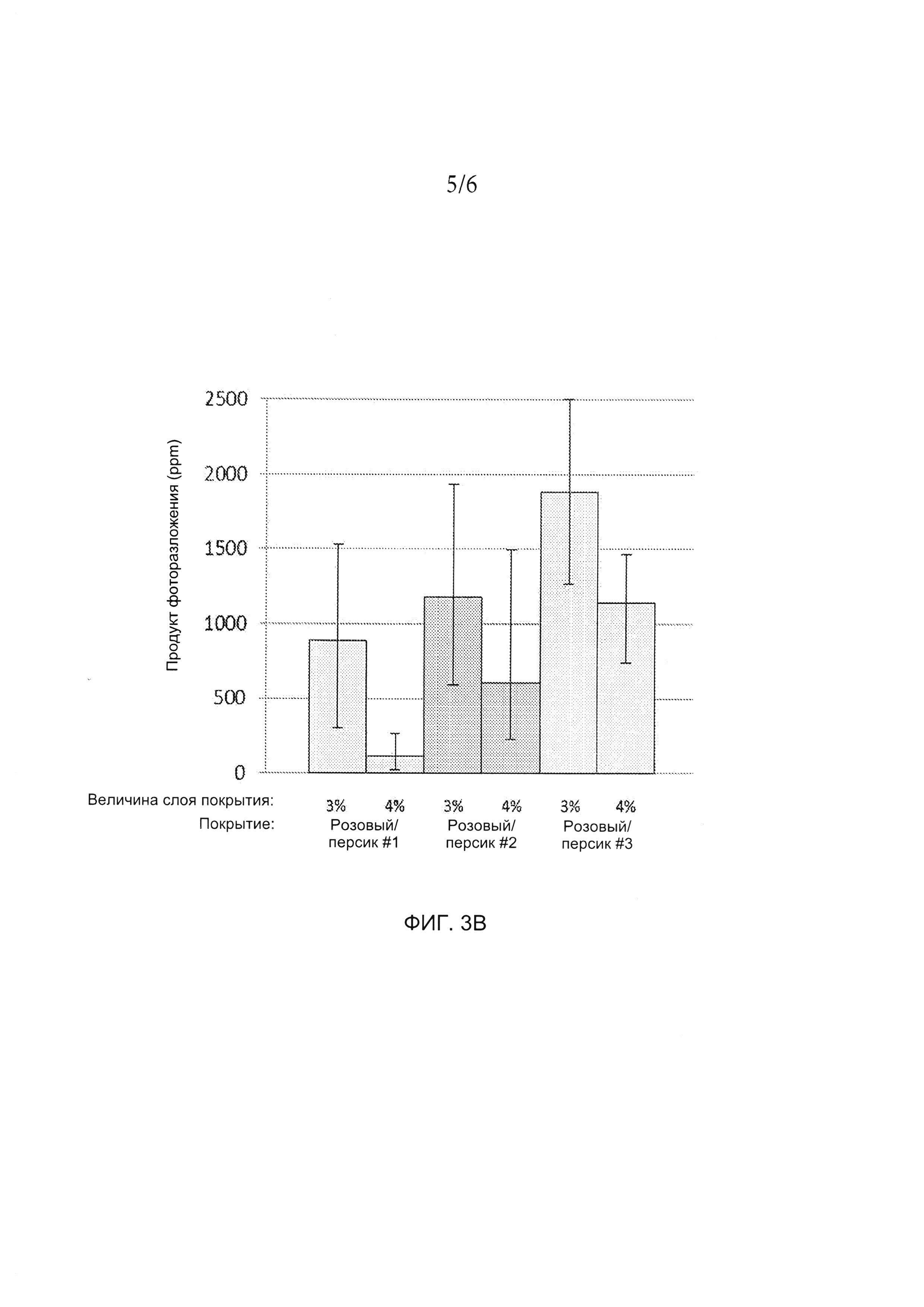
[0021] ФИГ. 3А и 3B иллюстрируют количество продукта фоторазложения в таблетках, содержащих либо 20 мг (ФИГ. 3А), либо 100 мг (ФИГ. 3B) соединения А при воздействии света. На таблетки нанесены различные составы розового/персикового покрытия. Для получения более подробной информации см. пример 2.
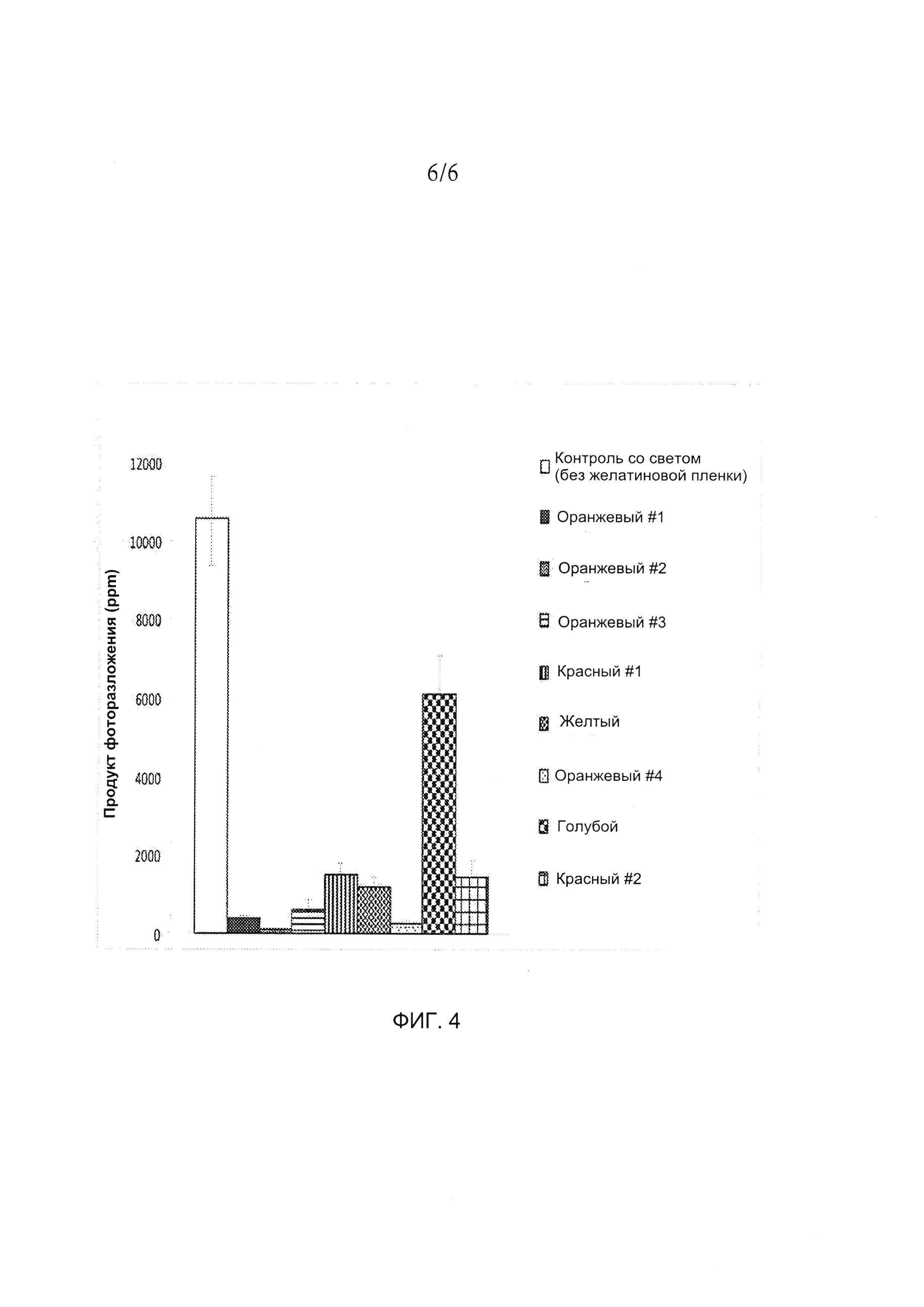
[0022] ФИГ. 4 демонстрирует количество продукта фоторазложения в капсулах, покрытых пленками желатина, содержащих различные фотостабилизирующие агенты, под действием света. Для получения более подробной информации см. пример 3.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[0023] Следующие термины, применяемые в настоящем описании, имеют приведенные ниже значения.
[0024] Неопределенные и определенные формы единственного числа включают формы множественного числа, если контекстом явно не обусловлено иное. Таким образом, например, упоминание слова «соединение» включает как одно соединение, так и множество различных соединений.
[0025] Термин «примерно», используемый перед числовым значением, например, температуры, времени, количества и концентрации, в том числе и диапазона, означает приближения, которые могут варьироваться в пределах ±10%, ±5% или ±1%.
[0026] Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют значения, которые обычно предполагает средний специалист в области техники, к которой принадлежит настоящее изобретение. Несмотря на то, что некоторые способы и материалы аналогичны или эквивалентны способам и материалам, приведенным в настоящем описании, их можно использовать на практике или при испытании настоящего изобретения, в настоящем описании приведены предпочтительные способы, устройства и материалы. Все публикации, процитированные в настоящем описании, полностью включены в настоящее описание посредством ссылки с целью описания и раскрытия методологических принципов, реагентов и средств, о которых говорится в публикациях, которые можно применять в отношении настоящего изобретения. Ничто из содержащегося в настоящем описании не должно рассматриваться как допущение того, что настоящее изобретение не вправе быть датированным раньше, чем такое раскрытие, на основании предыдущего изобретения.
[0027] При осуществлении настоящего изобретения на практике специалистом в данной области техники будут применяться, если не указано иное, традиционные методы химии, биохимии, молекулярной биологии, клеточной биологии, генетики, иммунологии и фармацевтических наук. Такие методы подробно описаны в литературе. См., например, Gennaro, A.R., ed. (1990) Remington’s Pharmaceutical Sciences, 18th ed., Mack Publishing Co.; Colowick, S. et ah, eds., Methods In Enzymology, Academic Press, Inc.; D.M. Weir, и C.C. Blackwell, eds. (1986) Handbook of Experimental Immunology, Vols. I-IV, Blackwell Scientific Publications; Maniatis, T. et al., eds. (1989) Molecular Cloning: A Laboratory Manual, 2nd edition, Vols. I-III, Cold Spring Harbor Laboratory Press; Ausubel, F.M. et al., eds. (1999) Short Protocols in Molecular Biology, 4th edition, John Wiley & Sons; Ream et al., eds. (1998) Molecular Biology Techniques: An Intensive Laboratory Course, Academic Press; Newton & Graham eds. (1997) PCR (Introduction to Biotechniques Series), 2nd ed., Springer Verlag; European Pharmacopoeia (Ph. Eur.), 7th edition; The United States Pharmacopeia (USP) и the National Formulary (NF), USP 35 - NF 30.
[0028] Термин «АФИ» представляет собой аббревиатуру «активный фармацевтический ингредиент». В настоящем описании АФИ относится к соединению А или [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоте.
[0029] Термин «препятствовать прохождению света» относится к предотвращению или уменьшению пропускания света посредством поглощения, отражения, преломления, дифракции, дисперсии и/или рассеивания света. Когда краситель препятствует прохождению света в определенном диапазоне длин волн, краситель предотвращает или уменьшает пропускание света в данном диапазоне длин волн посредством поглощения, отражения, преломления, дифракции, дисперсии и/или рассеивания света.
[0030] Термин «капсула» относится к твердой лекарственной форме фармацевтического состава, которая содержит оболочку капсулы и наполнитель капсулы.
[0031] Термин «наполнитель капсулы» относится к материалу, заключенному в оболочку капсулы. Как правило, наполнитель капсулы содержит активный фармацевтический ингредиент (АФИ) и один или более фармацевтически приемлемых вспомогательных веществ. Количество АФИ в наполнителе капсулы может быть выражено в виде массовых процентов АФИ в расчете на общую массу наполнителя капсулы (масс./масс. %).
[0032] Термин «оболочка капсулы» относится к внешнему слою капсулы. Оболочка капсулы содержит желатин, полимеры на основе целлюлозы или другие подходящие вещества, которые будут способны доставлять АФИ. Оболочка капсулы может представлять собой твердую оболочку, состоящую из раздвижного колпачка и основной части стандартных размеров. После добавления наполнителя капсулы, колпачок и основная часть могут быть герметизированы. Такие капсулы с твердой оболочкой, как правило, применяют для доставки сухого порошкообразного АФИ в наполнителе капсулы. Оболочка капсулы может представлять собой цельную мягкую оболочку, применяемую для доставки АФИ в виде раствора или суспензии в наполнителе капсулы. В одном из вариантов реализации оболочка капсулы может содержать фотостабилизирующий агент. Количество фотостабилизирующего агента в оболочке капсулы может быть выражено в массовых процентах фотостабилизирующего агента в расчете на общую массу оболочки капсулы (% масс./масс). В одном из вариантов реализации оболочка капсулы содержит желатин (желатиновая оболочка). В другом варианте реализации оболочка капсулы содержит гидроксипропилметилцеллюлозу (ГПМЦ) (ГПМЦ-оболочка).
[0033] Термин «краситель», применяемый во всем описании, включает истинные красители (согласно определению в химии цвета и красителей), лаки красителей и пигменты. Истинный краситель (согласно определению в химии цвета и красителей) представляет собой окрашенное вещество (включая белый цвет), растворимое в воде и/или органическом растворителе, и имеет сродство к субстрату, по отношению к которому его применяют для придания окраски субстрату. Лак красителя представляет собой твердую, не растворимую в воде, форму истинного красителя. Лак красителя производят посредством смешения истинного красителя с инертным материалом, таким как гидроксид алюминия (широко используемый алюминиевый лак), сульфат бария, сульфат кальция, оксид алюминия (глинозем, корунд). Количество истинного красителя в лаке выражается как «концентрация красителя». Пигмент представляет собой окрашенное вещество, не растворимое в воде или в органическом растворителе.
[0034] Красители проявляются в виде цвета, поскольку они поглощают свет в видимой области спектра (400-700 нм) и пропускают, отражают или рассеивают свет при других длинах волн в видимой области спектра. «Желтый краситель» поглощает преимущественно синий свет и окрашен в желтый цвет. «Оранжевый краситель» поглощает преимущественно зелено-синий свет и окрашен в оранжевый цвет. «Красный краситель» поглощает преимущественно сине-зеленый свет и окрашен в красный цвет. «Синий краситель» поглощает преимущественно желтый свет и окрашен в синий цвет. «Зеленый краситель» поглощает преимущественно красный и оранжевый свет и окрашен в зеленый цвет. «Черный краситель» поглощает свет всей видимой области спектра и окрашен в черный цвет. Примеры красного красителя, желтого красителя, зеленого красителя, синего красителя и черного красителя представлены в приведенной ниже таблице. Дополнительно к поглощению света указанные красители могут препятствовать прохождению света посредством отражения, преломления, дифракции, диспергирования и/или рассеяния света.
[0035] Посредством смешивания двух или более красителей могут быть получены различные цвета. Например, оранжевые красители различных оттенков могут быть получены путем смешивания различных количеств красного и желтого красителей.
[0036] Красители, описанные в настоящей заявке, носят свои основные названия. Специалист в данной области техники сможет легко определить название красителя в США и название по ИЦ (индексу цвета). Неограничивающие примеры красителей приведены в следующей таблице.
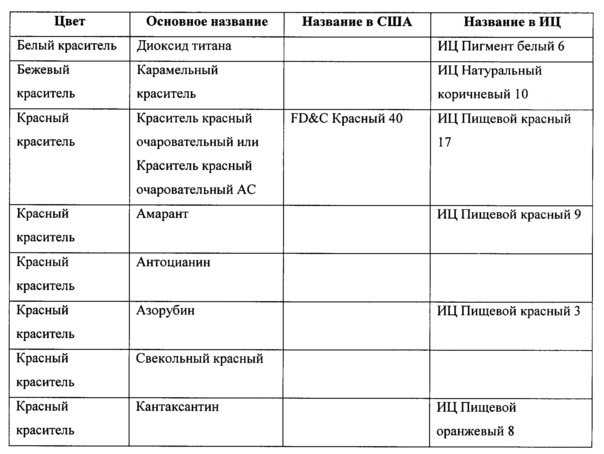


[0037] Термин «фармацевтически приемлемый» означает, что материал не обладает свойствами, из-за которых специалист в данной области техники мог бы избегать введения материала пациенту, принимая во внимание подлежащее лечению заболевание или состояния и соответствующий способ введения. Кроме того, данный материал считается безопасным при введении людям или животным.
[0038] Термин «вспомогательное вещество» или «фармацевтически приемлемое вспомогательное вещество» относится к фармакологически неактивным веществам, которые добавляют к лекарственному средству в дополнение к активному фармацевтическому компоненту. Вспомогательные вещества могут брать на себя функцию несущей среды, разбавителя, высвобождающего вещества, вещества, способствующего распаду или растворителя модифицирующего агента, интенсификатора поглощения, стабилизатора или, наряду с прочим, производственного вспомогательного вещества. Вспомогательные вещества могут содержать наполнители (разбавители), связующие вещества, разрыхляющие агенты, смазывающие агенты и агенты, способствующие скольжению. Примеры часто применяемых классов вспомогательных веществ перечислены ниже.
[0039] Термин «разбавитель или наполнитель» относится к веществам, которые применяют для разбавления активного фармацевтического компонента до доставки. Разбавители могут также выступать в качестве стабилизаторов. Неограничивающие примеры разбавителей включают крахмал, сахариды, дисахариды, сахарозу, лактозу, полисахариды, целлюлозу, простые эфиры целлюлозы, гидроксипропил целлюлозу, сахарные спирты, ксилитол, сорбитол, мальтитол, микрокристаллическую целлюлозу, карбонаты кальция или натрия, лактозу, моногидрат лактозы, кальций фосфорнокислый двузамещенный, целлюлозу, прессуемые сахара, дегидрат двухосновного фосфата кальция, маннитол, микрокристаллическую целлюлозу и трехосновный фосфат кальция.
[0040] Термин «связующее вещество» относится к любым фармацевтически приемлемым веществам, которые можно применять для связывания активных или инертных компонентов вместе для сохранения прилипающих и отдельных участков. Неограничивающие примеры связующих веществ включают гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, повидон и этилцеллюлозу.
[0041] «Разрыхлитель или разрыхляющие агенты» относятся к веществам, которые при добавлении их к твердому препарату облегчают его разложение или разрыхление после введения и допускают как можно более эффективное высвобождение действующего вещества для его быстрого растворения. Неограничивающие примеры разрыхлителей включают кукурузный крахмал, крахмалгликолят натрия, кроскармеллозу натрия, кросповидон, микрокристаллическую целлюлозу, модифицированный кукурузный крахмал, карбоксиметилкрахмал натрия, повидон, прежелатинизированный крахмал и альгиновую кислоту.
[0042] «Смазывающий агент» относится к вспомогательному веществу, которое добавляют к порошковой смеси для предотвращения прессования массы порошка, возникающего вследствие прилипания к оборудованию в процессе таблетирования или инкапсулирования. Они способствуют извлечению таблетки из штампа и могут нормализовать поток порошка. Неограничивающие примеры смазывающих агентов включают стеарат магния, стеариновую кислоту, кремнезем, жиры, стеарат кальция, полиэтиленгликоль, стеарилфумарат натрия, тальк или жирные кислоты, включая лауриновую кислоту, олеиновую кислоту и C8/C10 жирную кислоту.
[0043] Термин «агент, способствующий скольжению», применяемый в настоящем описании, предназначен для обозначения агентов, применяемых в составах таблеток и капсул для улучшения сыпучести в процессе прессования таблеток и для предотвращения образования комков. Неограничивающие примеры агентов, способствущих скольжению, включают коллоидный диоксид кремния, тальк, пирогенный диоксид кремния, крахмал, производные крахмала и бентонит.
[0044] Термин «готовить состав» или «приготовление состава» относится к объединению активного фармацевтического ингредиента с одним или более другими компонентами, например, включая без ограничения, одно или более фармацевтически приемлемых вспомогательных веществ, стабилизирующих агентов, фотостабилизирующих агентов, покрытий, оболочек капсул и т.д., в процессе получения конечного лекарственного продукта. Примеры лекарственного продукта включают, но не ограничиваются ими, таблетки, пилюли, драже, капсулы, гели, сиропы, кашки (slurries), суспензии, распыляемые аэрозоли и растворы для инъекций.
[0045] Термин «желатин» относится к твердому веществу, полученному из коллагена, которое может быть получено из различных побочных продуктов животного происхождения. Желатин широко используют в качестве желирующего агента в фармацевтике.
[0046] Термин «облучение светом» относится к любому облучению светом, включая солнечный свет (или естественный свет), внутреннее освещение и облучение светом в условиях Международной конференции по гармонизации (МКГ). «Облучение светом по МКГ» означает подвергать воздействию света в условиях МКГ, которые могут представлять собой Вариант 1 МКГ или Вариант 2 МКГ. В условиях МКГ образцы подвергают воздействию света, обеспечивая общее освещение не менее 1,2 млн. люкс-часов и составляет энергию близкой ультрафиолетовой области не менее 200 ватт-часов/кв. м. с использованием одного или двух вариантов, описанных ниже в виде источников света (MKГ Q1B).
a. Вариант 1 МКГ:
Любой источник света, предназначенный для получения выходного излучения, сходного со стандартом излучения D65/ID65, такой как люминесцентная лампа искусственного освещения, объединяющая выходной излучение в видимой и ультрафиолетовой (УФ) областях, ксенон или металлогалогенную лампу. D65 представляет собой международно признанный стандарт для дневного света как определено в ISO 10977 (1993). ID65 представляет собой стандарт эквивалентного не прямого дневного света в помещении. Для источника света, испускающего сильное излучение ниже 320 нанометров (нм), может быть установлен подходящий фильтр (-ы) для устранения такого излучения.
b. Вариант 2 МКГ:
Холодная белая люминесцентная лампа предназначена для получения выходного излучения аналогичного тому, который определен в ISO 10977 (1993); и
Лампа ближнего УФ флуоресцентного излучения обладает спектральным распределением от 320 нм до 400 нм с максимумом испускаемой энергии между длинами волн 350 нм и 370 нм; значительная доля УФ излучения должна быть в обоих полосах от 320 до 360 нм и от 360 до 400 нм.
[0047] Термин «фотостабилизирующий агент» представляет собой агент, который предотвращает или снижает фоторазложение или фотодеструкцию молекулы под воздействием излучения (свет в условиях MKГ, солнечный свет, внутреннее освещение и т.д.). Другими словами, фотостабилизирующий агент используется для предотвращения или уменьшения выработки продуктов фоторазложения. Обычно фотостабилизирующий агент предотвращает или уменьшает фоторазложение светочувствительной молекулы препятствуя прохождению света через молекулу в диапазоне длин волн. Неограничивающие примеры фотостабилизирующих агентов включают пигменты, красители, лаки красителей и т.п.
[0048] Термины «фоторазложение» и «фотодеструкция» применяются взаимозаменяемо во всем описании.
[0049] Термин «эффективное количество» фотостабилизирующего агента относится к количеству фотостабилизирущего агента в фармацевтическом составе, которое достаточно для предотвращения или уменьшения фоторазложения активных фармацевтических компонентов (АФИ), таких, что количество получаемого продукта(ов) фоторазложения ограничено требуемым максимальным уровнем при определенных условиях освещения. В вариантах реализации, приведенных в настоящем описании, эффективное количество фотостабилизирующего агента представляет собой то количество, которое достаточно для ограничения количество продукта фоторазложения соединения А, которое получают до уровня, составляющего менее чем примерно 0,2% масс/масс. соединения А (или 2000 ppm), в условиях МКГ. В некоторых вариантах реализации эффективное количество фотостабилизирующего агента может ограничить количество продукта фоторазложения соединения А, которое получают до уровня, составляющего менее чем примерно 0,15%) масс/масс. соединения А, менее чем примерно 0,1% масс/масс. соединения А или менее 0,05% масс/масс. соединения А. Специалисту в области приготовления составов будет очевидно, что эффективное количество стабилизирующего агента будет изменяться в зависимости от конкретного применяемого агента. Используя настоящее описание, в частности аналитические методы, описанные в примерах, и общие знания в области составов, средний специалист в данной области техники может легко определить количество любого конкретного агента (или комбинации агентов), при помощи которого будет обеспечен уровень фотозащитного действия (т.е. снижение образования продукта фоторазложения), необходимого для ограничения количества продукта фоторазложения до требуемого максимального уровня.
[0050] Термин «продукт фоторазложения», применяемый в настоящем описании, относится к новой молекуле, которая образуется из соединения А при воздействии света на соединение А. Продукт фоторазложения можно зафиксировать посредством различных стандартных аналитических методов (например, высоко эффективной жидкостной хроматографией (ВЭЖХ), жидкостной хромато-масс-спектрометрией (ЖХ-МС), газовой хроматографией (ГХ), ядерным магнитным резонансом (ЯМР), ИК-спектроскопией с преобразованием Фурье (ИК-Фурье спектроскопия) и т.д.). В одном из вариантов реализации продукт фоторазложения можно зафиксировать и измерить посредством ВЭЖХ, как описано далее в примере 1.
[0051] Термин «таблетка» относится к твердой лекарственной форме фармацевтического состава, в котором АФИ смешан с одним или более фармацевтически приемлемым вспомогательным веществом и спрессован в отдельные готовые твердые лекарственные формы. Таблетки могут быть изготовлены самых разных размеров, форм и маркировок на поверхности. Таблетки могут не содержать покрытия, или на них может быть нанесено посредством различных способов, хорошо известных в данной области техники. Обычно таблетка содержит ядро таблетки и покрытие.
[0052] Термин «ядро таблетки» относится к внутренней части таблетки, содержащей АФИ и одно или более фармацевтически приемлемое вспомогательное вещество, спрессованной в заданную форму за исключением покрытия. Количество АФИ в ядре таблетки может быть выражено как процент от массы АФИ в пересчета на общую массу ядра таблетки, % масс/масс.
[0053] Термин «покрытие» относится к внешней части таблетки. Для таблеток, приведенных в настоящем описании, покрытие нанесено на внешнюю поверхность ядра таблетки и обычно прилипает к ней. Покрытие может обеспечивать, среди прочего, одно или более следующих свойств: маскировка вкуса, защита АФИ (-ов) от фоторазложения, легкость введения, модификация высвобождение АФИ (-ов), защита от пыли или уникальный внешний вид (цвета). Неограничивающие примеры материалов покрытий включают соединения на основе поливинилового спирта, гидроксиэтилцеллюлозу, гидроксипропилметилцеллюлозу, натрий карбоксиметилцеллюлозу, полиэтиленгликоль 4000 и ацетат-фталат целлюлозы. В одном из вариантов реализации покрытие представляет собой покрытие на основе поливинилового спирта. Количество покрытия, наносимого на внешнюю поверхность ядра таблетки, может быть выражено в процентах от массы покрытия в расчете на массу ядра таблетки, % масс/масс. В одном из вариантов реализации покрытие может содержать фотостабилизирующий агент, такой как краситель. Количество красителя в покрытии таблетки может быть выражено в процентах от массы красителя в расчете на массу покрытия % масс/масс. В другом варианте количество красителя в покрытии таблетки может быть выражено как количество нанесенного красителя на единицу площади поверхности ядра таблетки, мг/см2.
[0054] Термин «анемия», применяемый в настоящем описании, относится к любому отклонению от нормы гемоглобина или эритроцитов, приводящему к снижению содержания кислорода в крови. Анемия может быть связана с неправильным образованием, преобразованием или свойствами эритроцитов и/или гемоглобина. Термин «анемия» относится к любому уменьшению количества эритроцитов и/или уровню гемоглобина в крови по сравнению с нормальными показателями крови. Анемия может возникнуть в таких условиях, как острая или хроническая болезнь почек, инфекции, воспаление, рак, облучение, токсины, диабет и хирургическое вмешательство. Инфекции могут быть вызваны, например, вирусом, бактериями и/или паразитами и т.д. Воспаление может быть вызвано инфекцией, аутоиммунными расстройствами, такими как ревматоидный артрит и т.д. Анемия также может быть связана с потерей крови из-за, например, язвы желудка, язвы двенадцатиперстной кишки, геморроя, рака желудка или толстой кишки, травмы, повреждения, хирургического вмешательства и т.д. Анемия также связана с лучевой терапией, химиотерапией и диализом почек. Анемия также связана с ВИЧ-инфицированными пациентами, проходящими лечение азидотимидином (зидовудином) или другими ингибиторами обратной транскриптазы, и может развиваться у пациентов, больных раком, которые проходят курс химиотерапии, например циклическими цисплатинсодержащими или не содержащими цисплатина химиотерапевтическими препаратами. Синдром апластической анемии и миелодиспластический синдром представляют собой заболевания, связанные с недостаточностью костного мозга, которая приводит к снижению образования эритроцитов. Кроме того, анемия может быть результатом дефектных или ненормальных гемоглобина или эритроцитов, как, например, при нарушениях, включая микроцитарную анемию, гипохромную анемию и т.д. Анемия может быть результатом нарушений транспорта железа, преобразования и утилизации, см., например, сидеробластную анемию и т.д.
[0055] Термины «расстройства» («нарушения»), «заболевания» и «состояния» используются включительно в настоящем описании и относятся к любому состоянию, отклоняющемуся от нормы.
[0056] Термины «лечение», «проведение лечения» и «лечить» определяются как воздействие на заболевание, расстройство или состояние агентом, уменьшающим или смягчающим опасные или любые другие неблагоприятные эффекты заболевания, расстройства или состояния и/или его симптомы. Термин «лечение», используемый в настоящем описании, предусматривает лечение пациента-человека и включает: (а) снижение риска возникновения состояния у пациента, предрасположенного к заболеванию, но еще не диагностированного, (b) препятствие развитию состояния и/или (с) облегчение состояния, т.е. обеспечение ремиссии состояния и/или облегчение одного или более симптомов состояния.
[0057] «Введение» относится к введению агента пациенту. Может быть введено терапевтическое количество агента, которое может быть определено лечащим врачом или т.п. Для соединения А предпочтительным является пероральное введение. Родственные термины и фразы «введение (англ.: administering)» и «введение (англ.: administration of)», при использовании их применительно к соединению или фармацевтическому составу (и их грамматическим эквивалентам), относятся к прямому введению пациенту медицинским специалистом или самостоятельно и/или непрямому введению, которое может быть произведено путем назначения лекарственного средства. Например, врач, который инструктирует пациента самостоятельно вводить лекарственное средство и/или предоставляет пациенту рецепт на лекарственное средство, вводит лекарственное средство пациенту. В любом случае, введение предусматривает доставку лекарственного средства пациенту.
[0058] Индуцируемый гипоксией фактор (HIF) представляет собой транскрипционный активатор PAS (Per/Arnt/Sim) вида основная спираль-петля-спираль (оСПС), который опосредует изменения в экспрессии генов в ответ на изменения концентрации кислорода в клетках. HIF представляет собой гетеродимер, содержащий регулируемую кислородом α-субъединицу (HIFα) и конститутивно экспрессируемую β-субъединицу (HIFβ/ARNT). В насыщенных кислородом (нормоксических) клетках HIFα субъединицы быстро разрушаются по механизму, включающему убиквитинирование Е3-лигазным комплексом супрессора опухоли фон Гиппель-Линдау (pVHL). В условиях гипоксии HIFα не разрушается, и активный комплекс HIFα/β накапливается в клеточных ядрах и активирует экспрессию нескольких генов, включая гликолитические ферменты, переносчики глюкозы, эритропоэтин (ЭПО) и фактор роста эндотелия сосудов (ФРЭС). (Jiang et al. (1996) J. Biol. Chem. 271:17771-17778; Iliopoulus et al. (1996) Proc. Natl. Acad. Sci. USA, 93:10595-10599; Maxwell et al. (1999) Nature 399:271-275; Sutter et al. (2000) Proc. Natl. Acad. Sci. USA 97:4748-4753; Cockman et al. (2000). J. Biol. Chem. 275:25733-25741 и Tanimoto et al. (2000) EMBOJ. 19:4298-4309.)
[0059] Термины «состояния, связанные с HIF» и «состояния, по меньшей мере частично опосредованные HIF» используются включительно и относятся к любому состоянию, которое может быть связано с модуляцией HIF ниже нормы, ненормальной или неподходящей модуляцией HIF. Состояния, связанные с HIF, включают любое состояние, в котором увеличение уровня HIF обеспечит лечебное действие. Состояния, связанные с HIF, включают состояния анемии и повреждение тканей или расстройства, связанные с ишемическими или гипоксическими состояниями.
[0060] Термины «HIF-пролилгидроксилаза», «PHD», «EGLN» и «HIF-ПГ» относятся к любому ферменту, который модифицирует альфа-субъединицу белка HIF путем гидроксилирования одного или более остатков пролина. HIF-ПГ включает представителей семейства генов Egl-Nine (EGLN), описанных автором Taylor (2001, Gene 275:125-132) и охарактеризованных авторами Aravind и Koonin (2001, Genome Biol 2: RESEARCH 0007), Epstein et al. (2001, Cell 107:43-54), a также Bruick и McKnight (2001, Science 294:1337-1340). HIF-ПГ2, используемая в иллюстративных анализах, приведенных в настоящем описании (ниже), может представлять собой любую НIF-ПГ2, также называемую PHD2, например, EGLN1 человека (номер доступа в GenBank № AAG 33965; Dupuy et al. (2000) Genomics 69:348-54), EGLN1 мыши (номер доступа в GenBank № САС 42515), EGLN1 крысы (номер доступа в GenBank № Р 59722) и т.д. В другом варианте в данном анализе может применяться иная HIF-ПГ. Такие HIF-ПГ ферменты включат, но не ограничиваясь HIF-ПГ1, также называемой PHD1, например, изоформу 1 EGLN2 человека (номер доступа в GenBank № САС 42510; Taylor, выше), изоформу 3 EGLN2 человека (номер доступа в GenBank № NP_542770), EGLN2 мыши (номер доступа в GenBank № САС 42516) и EGLN2 крысы (номер доступа в GenBank № ААО 46039) и т.д.; и любую HIF-ПГ3, также называемую PDH3, например EGLN3 человека (номер доступа в GenBank № САС 42511; Taylor, выше), EGLN3 мыши (номер доступа в GenBank № САС 42517) и EGLN3 крысы (SM-20) (номер доступа в GenBank № AAA 19321). В других вариантах реализации настоящего описания EGLN может включать EGL-9 Caenorhabditis elegans (номер доступа в GenBank № AAD 56365) и продукт гена CG1114 Drosophila melanogaster (номер доступа в GenBank № AAF 52050).
Фармацевтические составы
[0061] Соединение [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты (соединение А) представляет собой сильный ингибитор пролилгидроксилазы индуцируемого гипоксией фактора (HIF) и имеет следующую формулу:
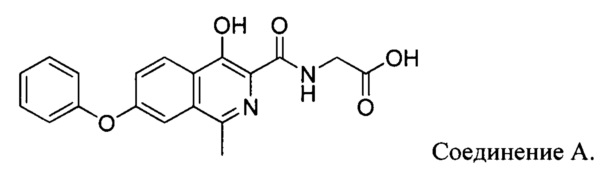
[0062] Как описано в примерах настоящего описания, недавно было обнаружено, что после воздействия излучения соединение А подвергается фоторазложению с преобразованием в продукт фоторазложения. В настоящем изобретении предложены композиции (составы) и способы, которые позволяют предотвратить или уменьшить фоторазложение соединения А и ограничить количество продукта фоторазложения.
[0063] Фармацевтические составы, приведенные в настоящем описании, защищают соединение А от фоторазложения. Таким образом, в одном из вариантов реализации согласно настоящему изобретению предложен фармацевтический состав, содержащий [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту, фармацевтически приемлемое вспомогательное вещество и эффективное количество фотостабилизирующего агента. В другом варианте реализации согласно настоящему изобретению предложен фармацевтический состав, содержащий [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту, фармацевтически приемлемое вспомогательное вещество и эффективное количество фотостабилизирующего агента, где фармацевтический состав содержит менее чем примерно 0,2% масс/масс. продукта фоторазложения [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты (в расчете на количество АФИ, [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты).
[0064] В одном из вариантов реализации фармацевтический состав содержит менее чем примерно 0,2% масс/масс. (эквивалент 2000 ppm, в расчете на количество АФИ) продукта фоторазложения [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты после воздействия света на состав в условиях МКГ. Количество продукта фоторазложения может легко определить любой средний специалист в данной области техники руководствуясь настоящим описанием с использованием обычных методов анализа. Если проведены многократные измерения количества продукта фоторазложения, среднее суммарное количество продукта фоторазложения из многократных измерений составляет не более чем приблизительно 0,2% масс/масс. Условия, при которых производится воздействие светом (тип источника света, мощность источника света и продолжительность воздействия светом), представляют собой условия МКГ, представленные в настоящем описании. Количество получаемого продукта фоторазложения легко определить посредством способов, приведенных в настоящем описании, в частности посредством ВЭЖХ. Специалист в области приготовления составов может легко определить эффективное количество фотостабилизирующего агента, достаточное для ограничения количества продукта фоторазложения, на основании пояснений и примеров, приведенных в настоящем описании.
[0065] В одном из вариантов реализации фотостабилизирующий агент выбран для предотвращения или уменьшения фоторазложения соединения А. В одном из вариантов реализации фотостабилизирующий агент предотвращает или уменьшает фоторазложение за счет эффективного блокирования прохождения света. В одном из вариантов реализации фотостабилизирующий агент предотвращает или уменьшает фоторазложение посредством эффективного препятствования прохождению света в диапазоне длин волн примерно от 100 нм до примерно 800 нм, примерно от 150 нм до примерно 700 нм, примерно от 200 нм до примерно 550 нм или примерно от 360 нм до примерно 440 нм. Согласно одному из вариантов реализации в настоящем изобретении предложен фармацевтический состав, содержащий [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту, фармацевтически приемлемое вспомогательное вещество и эффективное количество фотостабилизирующего агента, причем фотостабилизирующий агент содержит диоксид титана и по меньшей мере один дополнительный краситель. В одном из вариантов реализации краситель препятствует прохождению света в диапазоне длин волн от примерно 100 нм до примерно 800 нм, от примерно 150 нм до примерно 700 нм, от примерно 200 нм до примерно 550 нм или от примерно 360 нм до примерно 440 нм.
[0066] В некоторых вариантах реализации фотостабилизирующий агент содержит растворимый краситель, лак красителя, пигмент или их комбинацию. В одном из вариантов реализации фотостабилизирующий агент содержит диоксид титана и по меньшей мере один дополнительный краситель. В одном из вариантов реализации краситель выбран из группы, состоящей из красителя черного цвета, красителя синего цвета, красителя зеленого цвета, красителя красного цвета, красителя оранжевого цвета, красителя лилового цвета, красителя фиолетового цвета, красителя желтого цвета и их комбинаций. В другом варианте реализации краситель выбран из группы, состоящей из красителя черного цвета, красителя синего цвета, красителя зеленого цвета, красителя красного цвета, красителя оранжевого цвета, красителя желтого цвета и их комбинаций. В еще одном варианте реализации краситель выбран из группы, состоящей из красителя красного цвета, красителя оранжевого цвета, красителя желтого цвета и их комбинаций.
[0067] В другом варианте реализации дополнительный краситель выбран из группы, состоящей из карамельного красителя, оксида железа черного, оксида железа красного, оксида железа желтого, красителя красного очаровательного АС, алюминиевого лака красителя красного очаровательного АС, кармина, эритрозина, бета-каротина или смесей каротинов, куркумина, красителя желтого «солнечный закат» FCF, алюминиевого лака красителя желтого «солнечный закат» FCF, тартразина, хлорофиллов и хлорофиллинов или их медных комплексов, красителя зеленого стойкого FCF, красителя бриллиантового синего FCF, индиготина, алюминиевого лака индиготина и их комбинаций.
[0068] В одном из вариантов реализации дополнительный краситель выбран из группы, состоящей из оксида железа черного, оксида железа красного, оксида железа желтого, красителя красного очаровательного АС, алюминиевого лака красителя красного очаровательного АС, кармина, эритрозина, бета-каротина или смесей каротинов, красителя желтого «солнечный закат» FCF, алюминиевого лака красителя желтого «солнечный закат» FCF, хлорофиллов и хлорофиллинов или их медных комплексов, красителя зеленого стойкого FCF, индиготина, алюминиевого лака индиготина и их комбинаций.
[0069] В одном из вариантов реализации дополнительный краситель выбран из группы, состоящей из оксида железа черного, оксида железа красного, оксида железа желтого, красителя красного очаровательного АС, алюминиевого лака красителя красного очаровательного АС, кармина, бета-каротина или смесей каротинов, красителя желтого «солнечный закат» FCF, алюминиевого лака красителя желтого «солнечный закат» FCF, индиготина, алюминиевого лака индиготина и их комбинаций.
[0070] В другом варианте реализации дополнительный краситель выбран из группы, состоящей из красителя красного очаровательного АС, алюминиевого лака красителя красного очаровательного АС, оксида железа красного, оксида железа желтого, красителя желтого «солнечный закат» FCF, алюминиевого лака красителя желтого «солнечный закат» FCF, индиготина, алюминиевого лака индиготина и их комбинаций.
[0071] В одном из вариантов реализации фотостабилизирующий агент содержит диоксид титана и алюминиевый лак красителя красного очаровательного АС. В одном из вариантов реализации фотостабилизирующий агент содержит оксид железа красный и диоксид титана. В одном из вариантов реализации фотостабилизирующий агент содержит краситель красный очаровательный АС, оксид железа желтый и диоксид титана. В одном из вариантов реализации фотостабилизирующий агент содержит оксид железа красный, краситель красный очаровательный АС, оксид железа желтый и диоксид титана. В одном из вариантов реализации фотостабилизирующий агент содержит оксид железа красный, оксид железа желтый и диоксид титана. В одном из вариантов реализации фотостабилизирующий агент содержи оксид железа желтый и диоксид титана.
[0072] В некоторых вариантах реализации фотостабилизирующий агент содержит диоксид титана. В некотором варианте реализации фотостабилизирующий агент содержит краситель, выбранный из группы, состоящей из красителя черного цвета, красителя синего цвета, красителя зеленого цвета, красителя красного цвета, красителя оранжевого цвета, красителя лилового цвета, красителя фиолетового цвета, красителя желтого цвета и их комбинаций. В другом варианте реализации фотостабилизирующий агент содержит краситель, выбранный из группы, состоящей из красителя черного цвета, красителя синего цвета, красителя зеленого цвета, красителя красного цвета, красителя оранжевого цвета, красителя желтого цвета и их комбинаций. В еще одном варианте реализации фотостабилизирующий агент содержит краситель, выбранный из группы, состоящей из красителя красного цвета, красителя оранжевого цвета, красителя желтого цвета и их комбинаций.
[0073] В одном из вариантов реализации фотостабилизирующий агент содержит краситель, выбранный из группы, состоящей из карамельного красителя, оксида железа черного, оксида железа красного, оксида железа желтого, красителя красного очаровательного АС, алюминиевого лака красителя красного очаровательного АС, кармина, эритрозина, бета-каротина или смесей каротинов, куркуминов, красителя желтого «солнечный закат» FCF, алюминиевого лака красителя желтого «солнечный закат» FCF, тартразина, хлорофиллов и хлорофиллинов или их медных комплексов, красителя зеленого стойкого FCF, красителя бриллиантового синего FCF, индиготина, алюминиевого лака индиготина и их комбинаций.
[0074] В одном из вариантов реализации фармацевтический состав содержит от примерно 1 мг до примерно 400 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты. В другом варианте реализации фармацевтический состав содержит от примерно 20 мг до примерно 200 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты. В другом варианте реализации фармацевтический состав содержит примерно 1 мг, примерно 5 мг, примерно 10 мг, примерно 15 мг, примерно 20 мг, примерно 25 мг, примерно 50 мг, примерно 75 мг, примерно 100 мг, примерно 125 мг, примерно 150 мг, примерно 175 мг, примерно 200 мг, примерно 250 мг, примерно 300 мг, примерно 350 мг или примерно 400 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты. В еще одном варианте реализации фармацевтический состав содержит примерно 20 мг, примерно 50 мг или примерно 100 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты. В еще одном варианте реализации фармацевтический состав содержит примерно 20 мг или примерно 50 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты.
[0075] В одном из вариантов реализации фармацевтический состав содержит от примерно 1% до примерно 90% масс/масс. [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты. В другом варианте реализации фармацевтический состав содержит фотостабилизирующий агент от примерно 0,1% до примерно 50% масс/масс. В другом варианте реализации фармацевтический состав содержит фотостабилизирующий агент от примерно 1% до примерно 1% масс/масс. В каждом варианте реализации фармацевтический состав содержит фармацевтически приемлемое вспомогательное вещество. Фармацевтически приемлемое вспомогательное вещество может содержать наполнители, такие как сахара, включая лактозу, моногидрат лактозы, сахарозу, маннитол или сорбитол; целлюлозные препараты, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовую камедь, метилцеллюлозу, гидроксипропилметилцеллюлозу, натрий карбоксиметилцеллюлозу, микрокристаллическую целлюлозу и/или поливинилпирролидон (ПВП или повидон), разрыхляющие агенты, такие как сшитый поливинилпирролидон, агар, кроскармеллоза натрия или альгиновая кислота или ее соль, такая как альгинат натрия, и смачивающие агенты, такие как додецилсульфат натрия или смазывающие агенты, такие как стеарат магния. В одном из вариантов реализации фармацевтический состав содержит одно или более фармацевтически приемлемых вспомогательных веществ, выбранных из моногидрата лактозы, микрокристаллической целлюлозы, повидона, кроскармеллозы натрия или стеарата магния.
[0076] В одном из вариантов реализации твердая лекарственная форма содержит фармацевтический состав и твердая лекарственная форма выбрана из капсулы, таблетки, шарика, гранулы, пеллеты, пастилки для рассасывания (lozenge), пилюли (pill) или жевательной резинки (gum). В другом варианте реализации твердая лекарственная форма представляет собой таблетку. В другом варианте реализации твердая лекарственная форма представляет собой капсулу.
Таблетка
[0077] В описании настоящего изобретения предложена таблетка, содержащая [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту, фармацевтически приемлемое вспомогательное вещество и эффективное количество фотостабилизирующего агента. В одном из вариантов реализации таблетка содержит ядро таблетки и покрытие.
[0078] В некоторых вариантах реализации фотостабилизирующий агент включен (blended) в таблетку или ядро таблетки. Таблетку или ядро таблетки получают путем смешивания АФИ с одним или более вспомогательными веществами, такими как наполнители (разбавители), связующие вещества, разрыхляющие агенты, смазывающие агенты и агенты, способствующие скольжению, с последующим прессованием смеси. В тех вариантах реализации, когда фотостабилизирующий агент включен в таблетку или ядро таблетки, фотостабилизирующий агент смешивают (включают) с АФИ и вспомогательным веществом, и затем полученную смесь прессуют с получением таблетки или ядра таблетки. Способы получения таких спрессованных таблеток и ядер таблеток хорошо известны в фармацевтической области.
[0079] В одном из вариантов реализации таблетка содержит ядро таблетки и покрытие, где ядро таблетки содержит [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту и фармацевтически приемлемое вспомогательное вещество, а покрытие содержит фотостабилизирующий агент.
[0080] Основываясь на данном описании и примерах, приведенных в настоящем описании, и отработанных практических приемов, применяемых при приготовлении составов, специалист в данной области техники сможет определить необходимое количество покрытия, содержащего фотостабилизирующий агент, по величине плотности и толщины для обеспечения фотостабилизации. В одном из вариантов реализации покрытие присутствует в таблетке в количестве от примерно 3% до примерно 8% масс/масс. в расчете на массу ядра таблетки. Например, от примерно 7% до примерно 8% масс/масс. покрытия может быть нанесено на 80 мг ядра таблетки; от примерно 5% до примерно 6% масс/масс. покрытия может быть нанесено на 200 мг ядра таблетки или от примерно 4% до примерно 5% масс/масс. покрытия может быть нанесено на 400 мг ядра таблетки. Количество фотостабилизирующего агента в этих покрытиях может меняться, и такое количество приведено в настоящем описании (например, см. пример 2). Неограничивающие примеры покрытия включают покрытия на основе поливинилового спирта, гидроксиэтилцеллюлозу, гидроксипропилметилцеллюлозу, натрий карбоксиметилцеллюлозу, полиэтиленгликоль 4000 и покрытия на основе ацетат-фталата целлюлозы. В одном из вариантов реализации покрытие представляет собой покрытие на основе поливинилового спирта.
[0081] В одном из вариантов реализации фотостабилизирующий агент в таблетке содержит диоксид титана и по меньшей мере один дополнительный краситель, выбранный из группы, состоящей из красителя красного очаровательного АС, алюминиевого лака красителя красного очаровательного АС, оксида железа красного, оксида железа желтого, красителя желтого «солнечный закат» FCF, алюминиевого лака красителя желтого «солнечный закат» FCF, индиготина, алюминиевого лака индиготина и их комбинаций. В другом варианте реализации фотостабилизирующий агент содержит диоксид титана и алюминиевый лак красителя красного очаровательного АС.
[0082] Специалист в данной области техники сможет определить эффективное количество фотостабилизирующего агента, требуемого для предотвращения или уменьшения фоторазложения. Количество фотостабилизирующего агента в покрытии может определяться как % масс/масс. т.е. процентная масса фотостабилизирующего агента в расчете на массу покрытия. В одном из вариантов реализации покрытие содержит от примерно 0,1% до примерно 50% масс/масс. фотостабилизирующего агента (в расчете на массу покрытия). В другом варианте реализации покрытие содержит от примерно 0,5% до примерно 40% масс/масс. фотостабилизирующего агента (в расчете на массу покрытия). В другом варианте реализации покрытие содержит от примерно 2% до примерно 35% фотостабилизирующего агента (в расчете на массу покрытия).
[0083] Количество фотостабилизирующего агента в покрытии также может определяться как масса фотостабилизирующего агента, нанесенного на единицу площади поверхности ядра таблетки (мг/см2). Для определения количества фотостабилизирующего агента, необходимого для предотвращения или уменьшения фоторазложения, ядро таблетки можно покрыть различным количеством покрытий и каждое покрытие может содержать различные красители в разных количествах. Фоторазложение можно контролировать по появлению продукта фоторазложения, при наличии такового, при воздействии света (либо в условиях МКГ или при воздействии солнечного света). Пример 2 описывает некоторые покрытия с различными композициями красителей и их фотостабилизирующие результаты. В тех покрытиях, в которых краситель присутствует в форме алюминиевого лака, количество красителя относится к общему количеству чистого красителя в его алюминиевом лаке, не включая других компонентов алюминиевого лака.
[0084] В одном из вариантов реализации фотостабилизирующий агент в покрытии содержит по меньшей мере примерно 0,1 мг/см2 диоксида титана и по меньшей мере один дополнительный краситель выбранный из группы, состоящей из:
по меньшей мере примерно 0.1 мг/см2 красителя красного очаровательного АС;
по меньшей мере примерно 0,1 мг/см2 красителя красного очаровательного АС в алюминиевом лаке;
по меньшей мере примерно 0,004 мг/см2 оксида железа красного;
по меньшей мере примерно 0,009 мг/см2 оксида железа желтого;
по меньшей мере примерно 0,01 мг/см2 красителя желтого «солнечный закат» FCF и
по меньшей мере примерно 0,01 мг/см2 красителя желтого «солнечный закат» FCF в алюминиевом лаке;
где указанное количество фотостабилизирующего агента приведено из расчета на площадь поверхности ядра таблетки.
[0085] В другом варианте реализации фотостабилизирующий агент в покрытии содержит от примерно 0,1 до примерно 2 мг/см2 диоксида титана и по меньшей мере один дополнительный краситель, выбранный из группы, состоящей из;
от примерно 0,1 до примерно 0,4 мг/см2 красителя красного очаровательного;
от примерно 0,1 до примерно 0,4 мг/см2 красителя красного очаровательного АС в алюминиевом лаке;
от примерно 0,004 до примерно 0,4 мг/см2 оксида железа красного;
от примерно 0,009 до примерно 0,2 мг/см2 оксида железа желтого;
от примерно 0,01 до 0,03 мг/см2 красителя желтого «солнечный закат» FCF и
от примерно 0,01 до 0,03 мг/см2 красителя желтого «солнечный закат» FCF в алюминиевом лаке;
где указанное количество фотостабилизирующего агента приведено из расчета на площадь поверхности ядра таблетки.
[0086] В еще одном варианте реализации фотостабилизирующий агент в покрытии содержит, располагаясь на площади поверхности ядра таблетки, от примерно 0,1 до примерно 2 мг/см2 или от примерно 0,1 до примерно 0,4 мг/см2 диоксида титана и от примерно 0,1 до примерно 0,4 мг/см2красителя красного очаровательного АС или красителя красного очаровательного АС в алюминиевом лаке.
[0087] Другие примеры различных подходящих количеств фотостабилизирующий агентов, применимых в ядре таблетки, приведены в примере 2.
[0088] В некоторых вариантах реализации ядро таблетки содержит от примерно 1% до примерно 90% масс/масс., от примерно 5% до примерно 80%) масс/масс., от примерно 5% до примерно 40% масс/масс., от примерно 11% до примерно 30% масс/масс., от 20% до примерно 30% масс/масс., или от примерно 22% до примерно 28% масс/масс. [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемое вспомогательное вещество.
[0089] В некоторых вариантах реализации ядро таблетки содержит от примерно 1 мг до примерно 400 мг или от примерно 20 мг до примерно 200 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемое вспомогательное вещество. В других вариантах реализации ядро таблетки содержит примерно 1 мг, примерно 5 мг, примерно 10 мг, примерно 15 мг, примерно 20 мг, примерно 25 мг, примерно 50 мг, примерно 75 мг, примерно 100 мг, примерно 125 мг, примерно 150 мг, примерно 175 мг, примерно 200 мг, примерно 250 мг, примерно 300 мг, примерно 350 мг или примерно 400 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемое вспомогательное вещество. В других вариантах реализации ядро таблетки содержит примерно 20 мг, примерно 50 мг или примерно 100 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемое вспомогательное вещество.
[0090] Подходящие вспомогательные вещества представляют собой, например, наполнители, такие как сахара, включая лактозу, моногидрат лактозы, сахарозу, маннитол или сорбитол; целлюлозные препараты, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовую камедь, метилцеллюлозу, гидроксипропилметилцеллюлозу, натрий карбоксиметилцеллюлозу, микрокристаллическую целлюлозу и/или поливинилпирролидон (ПВП или повидон). При необходимости, можно добавить разрыхляющие агенты, такие как сшитый поливинилпирролидон, агар, кроскармеллозу натрия или альгиновая кислота или ее соль, такая как альгинат натрия. Также могут быть включены смачивающие агенты, такие как додецилсульфат натрия, или смазывающие агенты, такие как стеарат магния.
[0091] В одном из вариантов реализации фармацевтически приемлемое вспомогательное вещество содержит моногидрат лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния.
[0092] В описании настоящего изобретения предложена таблетка, содержащая ядро таблетки и покрытие, где ядро таблетки содержит [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту и фармацевтически приемлемое вспомогательное вещество и покрытие содержит эффективное количество фотостабилизирующего агента, где покрытие присутствует в количестве от примерно 3% до примерно 8% масс/масс., (в расчете на массу ядра таблетки).
[0093] В одном из вариантов реализации ядро таблетки содержит от примерно 22% до примерно 28% масс/масс. [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты (в расчете на массу ядра таблетки) и фармацевтически приемлемое вспомогательное вещество. В одном из вариантов реализации фармацевтически приемлемое вспомогательное вещество содержит моногидрат лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния. В другом варианте реализации ядро таблетки содержит от примерно 20 мг до примерно 200 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты. В другом варианте реализации ядро таблетки содержит примерно 20 мг, примерно 50 мг или примерно 100 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты.
[0094] В одном из вариантов реализации фотостабилизирующий агент содержит диоксид титана и по меньшей мере один дополнительный краситель, выбранный из группы, состоящей из красителя красного очаровательного АС, алюминиевого лака красителя красного очаровательного АС, оксида железа красного, оксида железа желтого, красителя желтого «солнечный закат» FCF, алюминиевого лака красителя желтого «солнечный закат» FCF, индиготина, алюминиевого лака индиготина и их комбинаций. В другом варианте реализации фотостабилизирующий агент содержит диоксид титана и алюминиевый лак красителя красного очаровательного АС. В еще одном варианте реализации покрытие содержит от примерно 0,1 до примерно 0,4 мг/см2 диоксида титана и от примерно 0,1 до примерно 0,4 мг/см2 красителя красного очаровательного АС в алюминиевом лаке, причем количество диоксида титана и красителя красного очаровательного АС в алюминиевом лаке располагается на площади поверхности ядра таблетки.
[0095] В описании настоящего изобретения предложена таблетка, содержащая ядро таблетки и покрытие, где ядро таблетки содержит [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту и фармацевтически приемлемое вспомогательное вещество, а покрытие содержит эффективное количество фотостабилизирующего агента, причем покрытие присутствует в количестве от примерно 3% до примерно 8% масс/масс. (в расчете на массу ядра таблетки), где ядро таблетки содержит примерно 20 мг, примерно 50 мг или примерно 100 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты, моногидрата лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния и где фотостабилизирующий агент содержит от примерно 0,1 до примерно 0,4 мг/см2 диоксида титана и от примерно 0,1 до примерно 0,4 мг/см2 красителя красного очаровательного АС в алюминиевом лаке, где количество диоксида титана и красителя красного очаровательного АС в алюминиевом лаке располагается на площади поверхности ядра таблетки.
Капсула
[0096] В описании настоящего изобретения предложена капсула, содержащая [(4-гидрокси-1-метил-7-феноксиизохинол ин-3-карбонил)-амино]-уксусную кислоту, фармацевтически приемлемое вспомогательное вещество и эффективное количество фотостабилизирующего агента. В одном из вариантов реализации капсула содержит наполнитель капсулы и оболочку капсулы, где наполнитель капсулы содержит [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту и фармацевтически приемлемое вспомогательное вещество, а оболочка капсулы содержит фотостабилизирующий агент.
[0097] В некоторых вариантах реализации наполнитель капсулы содержит фотостабилизирующий агент, [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту и фармацевтически приемлемое вспомогательное вещество. В этих вариантах реализации наполнитель капсулы готовят перемешиванием (смешиванием) фотостабилизирующего агента с АФИ и вспомогательными веществами.
[0098] В некоторых вариантах реализации фотостабилизирующий агент в капсуле содержит диоксид титана и по меньшей мере один дополнительный краситель, выбранный из группы, состоящей из красителя красного очаровательного АС, оксида железа красного, оксида железа желтого и их комбинаций. В другом варианте реализации фотостабилизирующий агент содержит оксид железа красный и диоксид титана. В другом варианте реализации фотостабилизирующий агент содержит оксид железа красный, краситель красный очаровательный АС, оксид железа желтый и диоксид титана. В еще одном варианте реализации фотостабилизирующий агент содержит оксид железа красный, оксид железа желтый и диоксид титана. В еще одном варианте реализации фотостабилизирующий агент содержит краситель красный очаровательный АС, оксид железа желтый и диоксид титана. В еще одном варианте реализации фотостабилизирующий агент содержит оксид железа желтый и диоксид титана.
[0099] На основании настоящего описания и обычных экспериментов специалист в данной области техники легко сможет определить эффективное количество фотостабилизирующего агента, требуемое для предотвращения или фоторазложения соединения А в капсуле. Количество фотостабилизирующего агента в оболочке капсулы можно описать как % масс/масс., т.е. массный процент фотостабилизирующего агента в расчете на массу оболочки капсулы. Для определения количества фотостабилизирующего агента, необходимого для предотвращения или уменьшения фоторазложения соединения А, капсулы с оболочкой капсулы, содержащие различные красители в различных количествах, могут быть исследованы на предмет фотостабилизации. В качестве вариантного решения, наполнители капсулы, содержащие соединение А, могут быть покрыты желатиновыми пленками, содержащими различные красители в различных количествах и фоторазложение соединения А, если оно имеет место, можно проконтролировать воздействием света (либо в условиях MKГ воздействием солнечного света). Пример 3 описывает несколько желатиновых пленок с различными композициями красителей и их результаты фотостабилизации.
[0100] В одном из вариантов реализации оболочка капсулы содержит фотостабилизирующего агента от примерно 1% масс/масс. до примерно 7% масс/масс., от примерно 1,8% масс/масс. до примерно 6% масс/масс., от примерно 2% масс/масс. до примерно 4% масс/масс. или от примерно 2% масс/масс. до примерно 3,5% масс/масс. (в расчете на массу оболочки капсулы). В другом варианте реализации оболочка капсулы содержит фотостабилизирующего агента от примерно 1,8% масс/масс. до примерно 6% масс/масс. (в расчете на массу оболочки капсулы). В другом варианте реализации оболочка капсулы содержит фотостабилизирующего агента от примерно 2% масс/масс. до примерно 3,5% масс/масс (в расчете на массу оболочки капсулы).
[0101] В одном из вариантов реализации оболочка капсулы представляет собой желатиновую оболочку. В другом варианте реализации оболочка капсулы представляет собой гидроксипропилметилцеллюлозную (ГПМЦ) оболочку.
[0102] В одном из вариантов реализации оболочка капсулы содержит примерно 2% масс/масс. оксида железа красного и примерно 0,9% масс/масс. диоксида титана (в расчете на массу оболочки капсулы); или примерно 0,3% масс/масс. красителя красного очаровательного АС, примерно 1% масс/масс. оксида железа желтого и примерно 1% масс/масс. диоксида титана (в расчете на массу оболочки капсулы); или примерно 0,7% масс/масс. оксида железа красного, примерно 0,3% масс/масс. красителя красного очаровательного АС, примерно 1% масс/масс. оксида железа примерно и примерно 1% масс/масс. диоксида титана (в расчете на массу оболочки капсулы); или примерно 1% масс/масс. оксида железа красного, примерно 1% масс/масс. оксида железа желтого и примерно 1% масс/масс. диоксида титана (в расчете на массу оболочки капсулы); или примерно 1% масс/масс. красителя красного очаровательного, примерно 1% масс/масс. оксида железа желтого и примерно 1% масс/масс. диоксида титана (в расчете на массу оболочки капсулы); или примерно 2% масс/масс. оксида железа красного и примерно 1% масс/масс. диоксида титана (в расчете на массу оболочки капсулы); или примерно 2% масс/масс. оксида железа желтого и примерно 1% масс/масс. диоксида титана (в расчете на массу оболочки капсулы).
[0103] В некоторых вариантах реализации наполнитель капсулы содержит [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту в количестве от примерно 1% до примерно 90% масс/масс., от примерно 5% до примерно 80% масс/масс., от примерно 5% до примерно 40% масс/масс., от примерно 8% до примерно 30% масс/масс., от 10% до примерно 30% масс/масс. или от примерно 12% до примерно 15% масс/масс. (в расчете на массу наполнителя капсулы) и фармацевтически приемлемое вспомогательное вещество.
[0104] В некоторых вариантах реализации наполнитель капсулы содержит от примерно 1 мг до примерно 400 мг, от примерно 5 мг до примерно 250 мг, от примерно 20 мг до примерно 200 мг, от примерно 20 мг до примерно 100 мг или от примерно 20 мг до примерно 50 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемое вспомогательное вещество. В других вариантах реализации наполнитель капсулы содержит примерно 1 мг, примерно 5 мг, примерно 10 мг, примерно 15 мг, примерно 20 мг, примерно 25 мг, примерно 50 мг, примерно 75 мг, примерно 100 мг, примерно 125 мг, примерно 150 мг, примерно 175 мг, примерно 200 мг, примерно 250 мг, примерно 300 мг, примерно 350 мг или примерно 400 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемое вспомогательное вещество. В других вариантах реализации наполнитель капсулы содержит примерно 20 мг или примерно 50 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемое вспомогательное вещество.
[0105] Подходящие вспомогательные вещества представляют собой, например, наполнители, такие как сахара, включая лактозу, моногидрат лактозы, сахарозу, маннитол или сорбитол; целлюлозные препараты, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий карбоксиметилцеллюлоза, микрокристаллическая целлюлоза и/или поливинилпирролидон (ПВП или повидон). При необходимости могут быть добавлены разрыхляющие агенты, такие как сшитый поливинилпирролидон, агар, кроскармеллоза натрия или альгиновая кислота или ее соль, такая как альгинат натрия. Также, могут быть включены смачивающие агенты, такие как додецилсульфат натрия, или смазывающие агенты, такие как стеарат магния.
[0106] В одном из вариантов реализации фармацевтически приемлемое вспомогательное вещество в капсуле содержит моногидрат лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния.
[0107] В описании настоящего изобретения предложена капсула, содержащая наполнитель капсулы и оболочку капсулы, где наполнитель капсулы содержит от примерно 12% до примерно 15% масс./масс. [(4-гидрокси-1-метил-7-феноксиизохинол ин-3-карбонил)-амино]-уксусной кислоты (в расчете на массу наполнителя капсулы) и фармацевтически приемлемое вспомогательное вещество и где оболочка капсулы содержит эффективное количество фотостабилизирующего агента. В одном из вариантов реализации фармацевтически приемлемое вспомогательное вещество содержит моногидрат лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния. В другом варианте реализации наполнитель капсулы содержит примерно 20 мг или примерно 50 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты. В еще одном варианте реализации оболочка капсулы содержит фотостабилизирующего агента от примерно 2% масс/масс. до примерно 3,5% масс/масс. (в расчете на массу наполнителя капсулы).
[0108] В одном из вариантов реализации наполнитель капсулы содержит примерно 20 мг или примерно 50 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемые вспомогательные вещества, содержащие моногидрат лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния и где оболочка капсулы представляет собой желатиновую оболочку, содержащую примерно 2% масс/масс. оксида железа красного и примерно 0,9% масс/масс. диоксида титана (в расчете на массу оболочку капсулы).
[0109] В одном из вариантов реализации наполнитель капсулы содержит примерно 20 мг или примерно 50 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемые вспомогательные вещества, содержащие моногидрат лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния и где оболочка капсулы представляет собой а желатиновую оболочку, содержащую примерно 0,3% масс/масс. красителя красного очаровательного АС, примерно 1% масс/масс. оксида железа желтого и примерно 1% масс/масс. диоксида титана (в расчете на массу оболочки капсулы).
[0110] В одном из вариантов реализации наполнитель капсулы содержит примерно 20 мг или примерно 50 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемые вспомогательные вещества, содержащие моногидрат лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния и где оболочка капсулы представляет собой желатиновую оболочку, содержащую примерно 0,7% масс/масс, оксида железа красного, примерно 0,3% масс/масс. красителя красного очаровательного АС, примерно 1% масс/масс. оксида железа желтого и примерно 1% масс/масс. диоксида титана (в расчете на массу оболочки капсулы).
[0111] В одном из вариантов реализации наполнитель капсулы содержит примерно 20 мг или примерно 50 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемые вспомогательные вещества, содержащие моногидрат лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния и где оболочка капсулы представляет собой а желатиновую оболочку, содержащую примерно 1% масс/масс. оксида железа красного, примерно 1% масс/масс. оксида железа желтого и примерно 1% масс/масс. диоксида титана (в расчете на массу оболочки капсулы).
[0112] В одном из вариантов реализации наполнитель капсулы содержит примерно 20 мг или примерно 50 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемые вспомогательные вещества, содержащие моногидрат лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния и где оболочка капсулы представляет собой желатиновую оболочку, содержащую примерно 1% масс/масс. красителя красного очаровательного АС, примерно 1% масс/масс. оксида железа желтого и примерно 1% масс/масс. диоксида титана (в расчете на массу оболочки капсулы).
[0113] В одном из вариантов реализации наполнитель капсулы содержит примерно 20 мг или примерно 50 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемые вспомогательные вещества, содержащие моногидрат лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния и где оболочка капсулы представляет собой желатиновую оболочку, содержащую примерно 2% масс/масс. оксида железа красного и примерно 1% масс/масс. диоксида титана (в расчете на массу оболочки капсулы).
[0114] В одном из вариантов реализации наполнитель капсулы содержит примерно 20 мг или примерно 50 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты и фармацевтически приемлемые вспомогательные вещества, содержащие моногидрат лактозы, микрокристаллическую целлюлозу, повидон, кроскармеллозу натрия и стеарат магния и где оболочка капсулы представляет собой желатиновую оболочку, содержащую примерно 2% масс./масс. оксида железа желтого и примерно 1% масс/масс. диоксида титана (в расчете на массу оболочки капсулы).
Способы введения
[0115] Подходящие способы введения могут включать, например, пероральное, ректальное, чрезслизистое, назальное или интестинальное введение и поступление лекарственного средства при парентеральном введении, включая внутримышечное, подкожное, костномозговое введения, а также субарахноидальное, прямое внутрижелудочковое, внутривенное, внутрибрюшинное, интраназальное или внутриглазное введения. Фармацевтический состав можно ввести скорее местно, чем системно. Например, фармацевтический состав может быть доставлен посредством введения или при помощи системы направленной доставки лекарств, такого как вещество замедленного всасывания или состав с замедленным высвобождением. В одном из вариантов реализации способ введения представляет собой пероральное введение. Если фармацевтический состав назначают принимать перорально, он может быть введен в виде таблетки или капсулы.
[0116] Фармацевтические составы согласно настоящему описанию могут быть получены любым из способов, хорошо известных в данной области техники, например, посредством обычных процессов смешивания, растворения, гранулирования, изготовления драже, растирания в порошок, эмульгирования, инкапсулирования, включения или лиофилизации. Как отмечено выше, композиции могут включать одно или более фармацевтически приемлемых вспомогательных веществ, которые облегчают обработку активных молекул с получением препаратов фармацевтического применения.
[0117] Подходящий состав зависит от выбранного способа введения. Композицию для введения, например, можно приготовить в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнкса, раствор Рингера или физиологический солевой буфер. В составе для чрезслизистого или назального введения, применяют смачивающие агенты, подходящие для преодоления перегородки. Такие смачивающие агенты общеизвестны в данной области техники. В одном из вариантов реализации настоящего описания фармацевтические составы предназначены для перорального введения. Для перорального введения, можно легко получить фармацевтические составы, комбинируя соединение А с фармацевтически приемлемыми вспомогательными веществами хорошо известными в данной области техники. Такие вспомогательные вещества способствуют получению соединения А для перорального приема внутрь субъектом в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, кашек (slurries), суспензий (suspensions) и т.п. Фармацевтический состав также может входить в состав ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащие обычные суппозитории на такой основе, как масло какао или другие глицериды.
[0118] Лекарственные средства для перорального применения можно получить с использованием твердых вспомогательных веществ с необязательным измельчением получающейся смеси и обработкой смеси гранул, после добавления вспомогательных веществ, если требуется, для получения таблеток или ядер таблеток. Подходящие вспомогательные вещества хорошо известны в данной области техники и представлены в данном описании и в другом документе.
[0119] Лекарственные средства для перорального введения включают твердые капсулы, изготовленные из желатина, ГПМЦ и других подходящих материалов, а также мягкие, герметичные капсулы, изготовленные из желатина и смягчителя, таких как глицерин или сорбитол. Твердые капсулы могут содержать активные компоненты в смеси с наполнителем, таким лактоза, связующими веществами, такими как крахмалы, и/или смазывающими агентами, такими как тальк или стеарат магния и, необязательно, со стабилизатором. В мягких капсулах, активные компоненты могут быть растворены или суспендированы в подходящих жидкостях, таки как жирные масла, медицинское парафиновое масло или жидкие полиэтиленгликоли. Помимо этого могут быть добавлены стабилизаторы.
[0120] Фармацевтические составы также могут быть приготовлены в виде препаратов пролонгированного действия. Такие составы пролонгированного действия можно вводить посредством имплантации (например, подкожно или внутримышечно) или внутримышечной инъекцией. Таким образом, например, фармацевтические составы могут быть получены с применением подходящих полимерных или гидрофобных материалов (например, в виде эмульсии в подходящем масле) или ионообменных смол или в виде умеренно растворимых производных, например, в виде умеренно растворимой соли.
[0121] Для любой композиции, применяемой в различных способах лечения, реализованных в настоящем описании, эффективную дозу (или терапевтически эффективную дозу) можно сначала измерить с применением различных методов, хорошо известных в данной области техники. Например, при анализе клеточной культуры, дозу можно определить по животным моделям для достижения диапазона циркулирующих концентраций, который включает IC50 как определено в клеточной культуре. Диапазоны доз, подходящие для испытуемых людей, можно определить, например, с использованием данных, полученных по результатам анализа клеточных культур и исследования на животных, не принадлежащих к человеческому роду. В одном из вариантов реализации доза может составлять от примерно 0,05 мг/кг до примерно 700 мг/кг. Обычно доза может составлять от примерно 0,05 мг/кг до примерно 500 мг/кг; от примерно 0,1 мг/кг до примерно 250 мг/кг; от примерно 0,2 мг/кг до примерно 100 мг/кг; от примерно 0,3 мг/кг до примерно 10 мг/кг; от примерно 0,5 мг/кг до примерно 5 мг/кг или от примерно 1 мг/кг до примерно 2 мг/кг. Например, доза может составлять примерно 0,5 мг/кг; примерно 0,7 мг/кг; 1,0 мг/кг; примерно 1,2 мг/кг; примерно 1,5 мг/кг; примерно 2,0 мг/кг; примерно 2,5 мг/кг; примерно 3,0 мг/кг; примерно 3,5 мг/кг; примерно 4,0 мг/кг; примерно 4,5 мг/кг или примерно 5,0 мг/кг. Дозы можно вводить с различными интервалами, например, каждый день, через день, 1, 2 или 3 раза в неделю и т.д. Обычно дозы вводят 2 или 3 раза в неделю.
[0122] Терапевтически эффективная доза соединения относится к тому количеству соединения, которое приводит к уменьшению интенсивности симптомов или продолжительности жизни субъекта. Токсичность и терапевтическую эффективность таких молекул можно определить стандартными фармацевтическими исследованиями клеточных культур или опытных животных, например, определением ЛД50 (летальная доза для 50% популяции) и ЭД50 (терапевтически эффективная доза для 50% популяции). Соотношение доз токсичности к терапевтическим эффектам представляет собой терапевтический индекс, который можно выразить как отношение ЛД50/ЭД50. Соединения, обладающие высоким терапевтическим индексом, являются предпочтительными.
[0123] Дозировки преимущественно находятся в пределах циркулирующих концентраций, которые включают ЭД50 при небольшой токсичности или при ее отсутствии. Дозировки могут варьироваться в пределах, зависящих от применяемой лекарственной формы и реализуемых способов введения. Точный состав, способ введения и дозировку следует выбирать в соответствии со способами, известными в данной области техники, учитывая специфику состояния субъекта.
[0124] Размер дозировки и интервал введения могут подбираться индивидуально для обеспечения регулирования требуемого параметра, например, уровней эндогенного эритропоэтина в плазме, т.е. минимальной эффективной концентрации (МЭК). МЭК может варьироваться для каждого соединения, но может быть оценена, например, по данным in vitro. При местном введении или выборочного усвоения, эффективная локальная концентрация лекарственного средства может быть не связана с концентрацией плазмы. В другом варианте, регулирование требуемого параметра, например, стимуляция эндогенного эритропоэтина, можно достичь посредством 1) введения ударной дозы с последующим введением поддерживающей дозы, 2) введения индукционной дозы, необходимой для быстрого достижения требуемого параметра, например, уровня эритропоэтина в целевом диапазоне, с последующим введением более низкой поддерживающей дозой для поддержания, например, гематокрита в требуемом целевом диапазоне или 3) повторным периодическим введением.
[0125] Количество вводимого соединения или композиции будет, несомненно, зависеть от многообразия факторов, включающих пол, возраст и массу субъекта, подвергающегося лечению, степени тяжести заболевания, способа введения и мнения лечащего врача.
[0126] Композиции настоящего изобретения, если требуется, могут быть представлены в упаковке или дозирующем устройстве, содержащем одну или более единичных лекарственных форм, содержащих активный компонент. Такие упаковки или устройства могут, например, содержать металлическую или пластиковую пленку, такую как блистерная упаковка. К упаковке или дозирующему устройству могут быть приложены инструкции по введению. Также могут быть приготовлены фармацевтические составы настоящего описания, составленные с совместимым фармацевтическим вспомогательным веществом, помещены в соответствующий контейнер и промаркированы для лечения обозначенного состояния. Подходящие условия, указанные на маркировке, могут включать лечение состояний, расстройств или болезней, в которых анемия представляет собой основной симптом.
Способы
[0127] В описании настоящего изобретения предложен способ ингибирования (предотвращения и/или уменьшения) фоторазложения [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты (соединения А). В одном из вариантов реализации способ включает состав [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты с эффективным количеством фотостабилизирующего агента. Эффективное количество фотостабилизирующего агента представляет собой количество, достаточное для ограничения количества продукта фоторазложения соединения А, который вырабатывается до уровня, менее чем примерно 0,2% масс./масс. соединения А (или 2000 ppm), в условиях MKГ. В одном из вариантов реализации фотостабилизирующий агент содержит диоксид титана. В одном из вариантов реализации фотостабилизирующий агент содержит краситель. В некоторых вариантах реализации способ включает состав [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты с диоксидом титана и по меньшей мере одним дополнительным красителем. В другом варианте реализации фотостабилизирующий агент препятствует прохождению света в диапазоне длин волн от примерно 220 до примерно 550 нм. В других вариантах реализации краситель выбран из группы, состоящей из красителя черного цвета, красителя синего цвета, красителя зеленого цвета, красителя красного цвета, красителя оранжевого цвета, красителя желтого цвета и их комбинаций. В другом варианте реализации краситель выбран из группы, состоящей из красителя красного цвета, красителя оранжевого цвета, красителя желтого цвета и их комбинаций. В настоящем изобретении также предложен способ ингибирования (предотвращения и/или уменьшения) фоторазложения [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты (соединения А), включающий приготовление состава [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты с эффективным количеством фотостабилизирующего агента и фармацевтически приемлемое вспомогательное вещество. В настоящем описании приведены различные составы, содержащие фотостабилизирующие агенты.
[0128] Соединение А можно объединить с фотостабилизирующий агентом любым традиционным способом, например, перемешиванием или смешением между собой соединения А фотостабилизирующего агента в однородный сухой порошок, прессованием в форму твердых таблеток, заполнением капсул и т.д. В другом варианте, соединение А можно объединить с фотостабилизирующим агентом посредством покрытием ядра таблетки, содержащим соединение А покрытием, содержащим фотостабилизирующий агент или включением наполнителя капсулы, содержащего соединение А в оболочку капсулы, содержащую фотостабилизирующий агент.
[0129] В других вариантах реализации способ ингибирования фоторазложения соединения А можно достичь посредством фотостабилизирующей упаковки, либо, в качестве альтернативы, либо в качестве добавки к фотостабилизирующему составу. Примеры фотостабилизирующей упаковки для таблеток или капсул включают, но не ограничиваясь ими, светонепроницаемую упаковку или обертку, такие как бутылка коричневого цвета, бутылка с черными пятнами, флакон желтого цвета, непрозрачная блистерная упаковка, блистерная упаковка, изготовленная из блистерной пленки, содержащей фотостабилизирующий агент, и ламинированную упаковку.
[0130] В одном из аспектов настоящего описания предложено применение фармацевтических составов для получения лекарственного средства для лечения различных состояний или расстройств, приведенных в настоящем описании. Также предложены способы применения фармацевтического состава, или композиции, или лекарственного средства на их основе для лечения, предварительного лечения или задержки прогрессирования или возникновения различных состояний или расстройств, приведенных в настоящем описании.
[0131] Лекарственные средства или композиции можно применять для регулирования стабильности и/или активности HIF и, тем самым, активировать экспрессию гена, регулируемого HIF. В одном аспекте лекарственные средства или композиции можно применять для ингибирования или снижения активности фермента гидроксилазы HIF, в частности фермента HIF-пролилгидроксилазы, например, EGLN1, EGLN2 и EGLN3 (также известного как PHD2, PHD1 и PHD3 соответственно), описанных автором Taylor (2001,Gene 275:125-132) и охарактеризованных авторами Aravind и Koonin (2001, Genome Biol 2:RESEARCH0007), Epstein et al. (2001, Cell 107:43-54) и Bruick и McKnight (2001, Science 294:1337-1340).
[0132] Фармацевтические составы, приведенные в настоящем описании, можно применять в способах лечения, предварительного лечения или задержки прогрессирования или возникновения состояний, связанных с HIF, включая, но не ограничиваясь ими, состояния анемии, ишемии и гипоксии. В различных вариантах реализации фармацевтический состав вводят сразу после проявления состояния, вызывающего острую ишемию, например, инфаркта миокарда, эмболии легочной артерии, интестинального инфаркта, ишемического инсульта и ишемически-реперфузионного повреждения почек. В другом варианте реализации фармацевтический состав вводят пациенту, у которого диагностировано состояние, связанное с развитием хронической ишемии, например цирроза сердца, макулярной дегенерации, эмболии легочной артерии, острой дыхательной недостаточности, острого респираторного дистресс-синдрома новорожденных и застойной сердечной недостаточности. В еще одном варианте реализации фармацевтический состав вводят сразу после травмы или повреждения. В других вариантах реализации фармацевтический состав можно вводить субъекту на основании предрасполагающих состояний, например гипертензии, диабета, окклюзионного заболевания артерий, хронической венозной недостаточности, болезни Рейно, хронических кожных язв, цирроза, застойной сердечной недостаточности и системного склероза. В других вариантах реализации фармацевтический состав можно вводить в целях предварительного лечения субъекта для снижения или предотвращения развития повреждения ткани, связанного с ишемией или гипоксией. В других вариантах реализации фармацевтические составы и композиции можно применять в способах лечения или задержки прогрессирования воспалительного заболевания кишечника, включая различные формы колита (например, неспецифические язвенные колиты) и болезнь Крона.
[0133] Фармацевтические составы и композиции можно применять в способе лечения анемии для увеличения уровня гемоглобина в крови и/или увеличения гематокрита у нуждающегося в этом субъекта. В одном аспекте фармацевтические составы и композиции можно применять в способе лечения анемии для увеличения уровня гемоглобина в крови и/или увеличения гематокрита у субъекта с хронической почечной недостаточностью или конечной стадией нарушения функции почек. В одном аспекте фармацевтические составы и композиции можно применять в способе лечения анемии для увеличения уровня гемоглобина в крови и/или увеличения гематокрита у субъекта с анемией хронического заболевания.
[0134] Фармацевтические составы и композиции также можно применять в способах контролирования метаболизма глюкозы и достижения гомеостаза глюкозы. Способы снижения уровня глюкозы в крови, снижения инсулиновой резистентности, уменьшения уровня гликированного гемоглобина, уменьшения уровня триглицеридов в крови и улучшения гликемического контроля у субъекта также реализованы посредством введения составов или композиций, приведенных в настоящем описании. Предложены способы лечения или предотвращения диабета, гипергликемии и других состояний, связанных с увеличенным уровнем глюкозы в крови, как и способы лечения или предотвращения состояний, связанных с диабетом, например, состояний, которые представляют собой факторы риска или которые развиваются параллельно или представляют собой результат диабета.
[0135] Фармацевтический состав также можно применять для увеличения эндогенного эритропоэтина (ЭПО). Фармацевтический состав можно вводить для предотвращения, предварительного лечения или лечения состояний, связанных с ЭПО, включая, например, состояния, связанные с анемией и неврологическими расстройствами. Состояния, связанные с анемией, включают заболевания, такие как острая или хроническая почечная недостаточность, диабет, рак, язва, вирусная инфекция, например, ВИЧ, бактерии или паразиты, воспалительный процесс и т.д. Состояние анемии могут также включать состояния, связанные с исследованиями или лечением, включающим, например, лучевую терапию, химиотерапию, диализ и хирургическое вмешательство. Заболевания, связанные с анемией, помимо этого включают в себя аномальный гемоглобин и/или эритроциты, среди которых микроцитарная анемия, гипохромная анемия, апластическая анемия и т.д.
[0136] В одном аспекте фармацевтические составы и композиции можно применять в способе индуцирования увеличенного или полного эритропоэза у субъекта.
[0137] Настоящее описание также относится к применению фармацевтического состава для лечения, предварительного лечения или задержки возникновения состояния, связанного с заболеванием, выбранным из группы, состоящей из анемического расстройства; неврологического расстройства и/или повреждения, включая случаи приступа, травмы, эпилепсии и нейродегенеративного заболевания; сердечной ишемии, включая, но не ограничиваясь ими, инфаркт миокарда и застойную сердечную недостаточность; ишемии печени, включая, но не ограничиваясь ими, сердечный цирроз; почечной ишемии, включая, но не ограничиваясь ими, острую почечную недостаточность и хроническую почечную недостаточность; периферийные нарушения сосудов, язвы, ожоги и затяжные раны; эмболии легочной артерии и ишемически-реперфузионного повреждения. В одном аспекте составы и композиции подходят для способов лечения рассеянного склероза и/или повышенного нейрогенеза.
[0138] В еще одном аспекте составы и композиции можно применять в способах снижения кровяного давления или предотвращения увеличения кровяного давления и для лечения или предотвращения артериальной гипертензии или прогипертензии у любого субъекта, включая, но не ограничиваясь ими, субъекты с почечной болезнью.
[0139] В другом варианте реализации в настоящем изобретении предложено применение составов и композиций в способе улучшения функции почек у субъекта или риска возникновения нарушении функции почек и способ, включающий введение субъекту высокоактивного ингибитора пролилгидроксилазы индуцируемого гипоксией фактора (HIF).
[0140] В другом аспекте составы и композиции можно применять в способе управления преобразованием железа и лечения/предотвращения, состояний, связанных с отсутствием железа и/или преобразования железа. В некоторых аспектах изобретение предполагает применения составов и композиций в способах увеличения содержания сывороточного железа, увеличения насыщения трансферрином, повышения уровня растворимого трансферринового рецептора и повышения уровня ферритина сыворотки в крови у субъекта.
[0141] В другом аспекте составы и композиции можно применять в способах лечения повышенного уровня холестерина в крови посредством снижения уровня циркулирующего в крови общего холестерина, в частности снижением уровня циркулирующего холестерина липопротеинов низкой плотности и/или холестерина липопротеинов очень низкой плотности и/или увеличения соотношения холестерин липопротеинов высокой плотности/холестерин липопротеинов низкой плотности.
[0142] Способы применения ингибиторов HIF пролилгидроксилазы и, в частности, соединения А, для лечения различных состояний и заболеваний, описанных в многочисленных публикациях, включая публикации патентной заявки США №№2003/0176317, 2003/0153503, 2004/0204356, 2004/0235082, 2005/0020487, 2007/0042937, 2007/0004627, 2006/0276477, 2007/0293575, 2012/0149712, 2007/0259960, 2007/0292433, 2011/0039878, 2011/0039885, 2010/0144737, 2011/0039879, и 2011/0263642; публикации заявки РСТ № WO 2012/097329, WO 2012/097331 и WO 2013/070908; международную заявку № PCT/US 2013/029851.
[0143] Настоящее описание также относится к способу ингибирования активности по меньшей мере одного фермента гидроксилазы, который модифицирует альфа-субъединицу индуцируемого гипоксией фактора. Фермент HIF-гидроксилаза может представлять собой пролилгидроксилазу, включая, но не ограничиваясь ими, группу, состоящую из EGLN1, EGLN2 и EGLN3 (также известных как PHD2, PHD1 и PHD3 соответственно), описанных автором Taylor (2001, Gene 275:125-132) и охарактеризованных авторами Aravind и Koonin (2001, Genome Biol 2:RESEARCH0007), Epstein et al. (2001, Cell 107:43-54) и Bruick и McKnight (2001, Science 294:1337-1340). Способ включает приведение фермента в контакт с соединением А. В некоторых вариантах реализации фермент HIF-гидроксилаза представляет собой аспаргинилгидроксилазу или пролилгидроксилазу. В других вариантах реализации фермент HIF-гидроксилаза представляет собой фактор ингибирования HIF, человеческие EGLN1, EGLN2 или EGLN3.
[0144] Несмотря на то, что настоящее описание приведено в комплексе с конкретными вариантами реализации и примерами, среднему специалисту в данной области техники, обладающему собственными знаниями в данной области и имеющему доступ к настоящему описанию, будет очевидно, что эквиваленты конкретно описанных материалов и способов будут также применимы к настоящему описанию, и такие эквиваленты предназначены для включения в последующую формулу изобретения.
ПРИМЕРЫ
Пример 1. Воздействие солнечного света на соединение А в твердом состоянии
[0145] Приблизительно 500 мг сухого порошка соединения А помещали в полиэтиленовый пакет вместимостью 1 галлон и подвергали воздействию солнечного света в течение двух месяцев последовательно в светлое время суток. Порошок представлял собой очень тонкий слой, и пакет часто встряхивали чтобы убедиться в том, что весь порошок, а не только верхний слой, подвергается воздействию солнечного света. Контрольный образец порошка соединения хранили во флаконе из темного стекла в темноте в течение того же промежутка времени для сравнения. По прошествии двух месяцев, визуальная проверка двух образцов показала, что образец, который подвергали воздействию излучения, стал грязно-белым, а контрольный образец был желтого цвета. Образец, который подвергали воздействию излучения, и контрольный образец анализировали методом ВЭЖХ для оценки различий их состава. В методе обращенно-фазовой ВЭЖХ применяли Zorbax Eclipse XDB-C8, 3,5 мкм, с размерами колонки 4,6×150 мм. Подвижная фаза состоит из смеси воды и ацетонитрила, подкисленной трифторуксусной кислотой. Градиентное элюирование с повышением концентрации ацетонитрила позволило получить хроматограммы контрольного образца соединения А (ФИГ. 1, до воздействия излучения) и образца соединения А, которого подвергали излучению (фиг. 1, после воздействия излучения) с УФ детектированием при 230 нм. ВЭЖХ образца, которого подвергали излучению, показала присутствие нового пика, отнесенного к «продукту фоторазложения» на ФИГ. 1.
[0146] До воздействия солнечного света порошок соединения А имеет степень чистоты порядка 99,1% по данным обращенно-фазовой ВЭЖХ и единичные примеси присутствуют в количестве, не превышающем 0,2% масс/масс. (2000 ppm). После воздействия солнечного света порошок соединения А имел несколько меньшее значение чистоты, составляющее 98,4%. После воздействия солнечного света на хроматограмме появился новый пик, свидетельствующий о новой молекуле. Новый пик имел площадь 0,34%. То обстоятельство, что процент площади соединения А снизился под воздействием солнечного света и появилась новая молекула, показывает, что часть соединения А преобразовано в новую молекулу, продукт фоторазложения.
Пример 2. Фотостабилизирующее покрытие таблетки
[0147] Было обнаружено, что таблетки, содержащие [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту подвергаются фоторазложению под воздействием излучения. Для уменьшения фоторазложения соединения А в форме таблеток были протестированы различные покрытия на предмет их фотостабилизирующих свойств.
[0148] Составы тестируемого покрытия Розовый/Персик включали покрытие, содержащее:
Состав 1: оксид железа красный, оксид железа желтый и диоксид титана («розовый/персик #1»);
Состав 2: краситель желтый «солнечный закат» FCF, оксида железа красный и диоксид титана («розовый/персик #2») или
Состав 3: оксид железа красный, оксид железа желтый и диоксид титана («розовый/персик #3»).
[0149] Составы тестируемого красного покрытия включали покрытие, содержащее:
Состав 4: алюминиевые лаки красителя красного очаровательного АС и индиготина и диоксид титана («Красный очаровательный АС/индиготин»);
Состав 5: алюминиевый лак красителя красного очаровательного АС и диоксид титана («красный очаровательный АС») или
Состав 6: оксид железа красный и диоксид титана («оксид железа красный»).
[0150] Таблетки, содержащие либо 20 мг, либо 100 мг [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты покрывали равномерно распределенным слоем с различным количеством фотостабилизирующего агента на площади поверхности таблетки (мг/см2) в емкости для нанесения покрытия при пониженном освещении. В таблице 1 приведены примеры покрытий таблеток при различных величинах слоя покрытия с различными составами покрытий. Величины слоя покрытия, составляющие 3%, 4%, 4,5% или 7,5%, представляют собой процент массы материала покрытия относительно массы покрываемого ядра таблетки.


[0151] Покрытые таблетки подвергали воздействию излучения (Вариант 2 МКГ) и тестировали на предмет фоторазложения посредством измерения количества присутствующего продукта фоторазложения, с применением обращенно-фазовой ВЭЖХ. Контроль в темноте обернули алюминиевой фольгой. Метод обращенно-фазовой ВЭЖХ, применяемый для количественного определения продукта фоторазложения, имеет верхний предел количественного определения 0,25% или 2500 ppm. В случае если подтверждены значения свыше 0,25% или 2500 ppm, применяли метод модифицированной обращенно-фазовой ВЭЖХ с более высоким пределом количественного определения, но с более низкой чувствительностью. Таблицы 2 и 3 показывают средние значения (n=10) продукта фоторазложения (в ppm относительно соединения А) для каждой тестируемой партии покрытых красным таблеток. «ND» обозначает «не определенное значение». «NA» обозначает «не предусмотрено».

[0152] Представленные результаты показаны графически на ФИГ. 2А (таблетка дозировкой 20 мг) и 2B (таблетка дозировкой 100 мг).
[0153] Результаты фоторазложения для таблеток, покрытых составом розовый/персик при величине слоя покрытия 3% или 4% (в расчете на массу ядра таблетки), после воздействия в условиях варианта 2 МКГ представлены на ФИГ. 3А и в таблице 4 для таблеток с дозировкой 20 мг и на ФИГ. 3B и в таблице 5 для таблеток с дозировкой 100 мг.

Пример 3. Фотостабилизирующая желатиновая капсула
[0154] Соединение А в желатиновых капсулах также подвергается фоторазложению при воздействии излучения. Покрытия в виде желатиновых пленок, содержащее комбинации различных красителей, изучали на предмет их фотостабилизирующих свойств.
[0155] Желатиновые капсулы, содержащие [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту в бесцветных прозрачных оболочках твердых желатиновых капсул, покрывали желатиновой пленкой, содержащей различные фотостабилизирующие агенты, подвергали воздействию излучения в условиях варианта 2 МКГ, приведенных в настоящем описании, и изучали на предмет фоторазложения [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты посредством измерения количества продукта фоторазложения с применением обращенно-фазовой ВЭЖХ, описанной в примере 1. Результаты представляют собой среднее значение продукта фоторазложения, измеренного для 10 капсул.
[0156] Составы изученных твердых желатиновых пленок представлены в таблице 6 ниже.

[0157] Как показано в таблице 7 и на ФИГ. 4, оранжевые красители обеспечивали лучшую фотостабилизацию соединения А в твердых желатиновых капсулах.

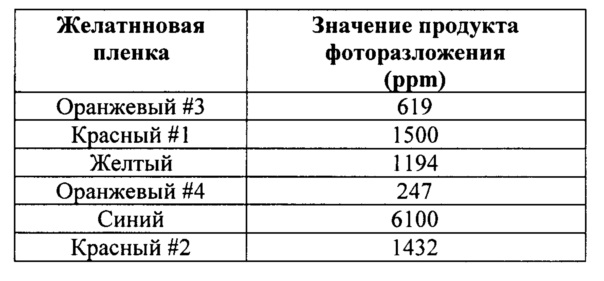
Реферат
Группа изобретений относится к химико-фармацевтической промышленности и представляет собой фармацевтический состав для лечения, предварительного лечения или задержки возникновения или прогрессирования состояний, связанных с анемией, ишемией или гипоксией, содержащий [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусную кислоту, вспомогательное вещество, фотостабилизирующий агент, который препятствует прохождению света в диапазоне длин волн от 200 нм до 550 нм, указанный фотостабилизирующий агент содержит диоксид титана и дополнительный краситель. Также изобретения включают твёрдую лекарственную форму, содержащую указанный фармацевтический состав, представляющую собой таблетку, а также твёрдую лекарственную форму, содержащую указанный фармацевтический состав, представляющую собой капсулу. Изобретения представлены способом ингибирования фоторазложения [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты, включающим приготовление состава [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты с эффективным количеством фотостабилизирующего агента, который содержит диоксид титана и по меньшей мере один дополнительный краситель, способом лечения, предварительного лечения или задержки возникновения или прогрессирования состояния, опосредуемого по меньшей мере частично фактором, индуцируемым гипоксией (HIF), включающим введение нуждающемуся в этом пациенту указанного фармацевтического состава или указанных твердых лекарственных форм, а также способом лечения, предварительного лечения или задержки возникновения или прогрессирования анемии, включающим введение нуждающемуся в этом пациенту указанного фармацевтического состава или указанных твердых лекарственных форм. Группа изобретений обеспечивает повышение фотостабильности [(4-гидрокси-1-метил-7-феноксиизохинолин-3-карбонил)-амино]-уксусной кислоты. 6 н. и 21 з.п. ф-лы, 4 ил., 8 табл., 3 пр.
Формула
Документы, цитированные в отчёте о поиске
Таблетки с пленочным покрытием, содержащие оксакарбазепин

Комментарии