Стабильные фармацевтические составы, которые содержат интерфероны гамма и альфа в синергичных соотношениях - RU2403057C2
Код документа: RU2403057C2
Чертежи







Описание
Область техники
Настоящее изобретение относится к биотехнологии и медицине, в частности к стабильным фармацевтическим составам, которые содержат рекомбинантные интерфероны гамма и альфа в синергичных соотношениях, для подавления роста клеток в различных тканях и органах людей.
Предпосылки изобретения
Разнообразие эффектов интерферонов I типа (IFNs) создает широкий терапевтический потенциал по их применению. Применение IFNs является благоприятным для лечения различных видов рака, включая лейкемии (US 5830455), базально-клеточную эпителиому (US 5028422), плоскоклеточную карциному (US 5256410), рак молочной железы (US 5024833), опухоли желудочно-кишечного тракта (US 5444064; 5814640) и старческий кератоз (US 5002764). Различные типы клеток проявляют разную чувствительность к IFNs, и ингибирующие их рост концентрации могут варьировать в широких пределах (Borden E., et al. (1981) Progress in Hematology. vol XII, Brown EB., editor, 299-339) для IFNs, для которых показаны различия в их способности ингибировать рост клеток (Dahl H. (1983). Human interferon and cell growth inhibition. VII. Reversibility of interferon activities. J Interferon Animal, 3:327-332; Willson J.K.V., Bittner G., et al. (1984) Antiproliferative activity of human interferons against ovarian cancer cells grown in human tumor stem cell assay. J Interferon Animal, 4:441-447; Hu R., Gan Y., et al. (1993) Evidence for multiple binding sites for several components of human lymphoblastoid interferon-alpha. J. Biol. Chem., 268:12591-12595), and to the activity antitumoral (Quesada J.R., Talpaz M., et al. (1986) Clinical toxicity of interferons in cancer patients: to review. J. Clin. Oncol, 4:234-243). Применение IFNs при лечении рака не оправдало ожиданий, основанных на исследованиях in vitro и на свойствах, которыми обладают эти сильнодействующие биологические молекулы. Были проверены различные схемы лечения без отчетливых благоприятных эффектов и импульсов (Strander H., and Oberg K., (1992) Clinical use of interferons. Solid tumors INTERFERON. Principles and Medical Applications. Publishing Baron S., Coppenhaver D.H., Dianzani F., Fleischmann WR., Jr. Hughes T.K., Jr. Klimpel G.R., Niesel D.W., Staton G.J., and Tyring S.K., 533-561).
С целью достижения лучших эффектов при лечениях IFNs применяли в увеличенных дозах, однако благоприятный потенциальный ожидаемый ответ не проявлялся из-за различных факторов, среди которых побочные действия, вызываемые указанными дозами (Lane H. С (1990) Interferon-alpha in patients with asymptomatic human immunodeficiency virus (HIV) infection. A randomized, placebo-controlled trial. Annals of internal Medicate, 112:805-811).
Кроме того, IFNs применяли в комбинированном виде, используя их синергичные эффекты. Комбинация IFN альфа и IFN гамма была описана в исследованиях in vitro с культурами келоидных фибробластов (Tredget Е.Е., Wang R., et al. (2000) Transforming growth factor-beta mRNA and protein in hypertrophic scar tissues and fibroblasts: antagonism by IFN-alpha and IFN-gamma in vitro and in vivo. J. Interferon Cytokine Animal, 20:143-151). В этой работе отмечено совместное использование IFNs альфа и гамма, однако приводимые данные получены из экспериментов in vitro и на клетках, происходящих из келоидов у детей. Эти авторы не проводили никакого клинического испытания и не оценивали эффект сочетания IFNs на клетки келоидов взрослых, которые слабо реагируют на интерфероны.
Патент EP 0107498 демонстрирует комбинацию интерферонов альфа и гамма на линии клеток меланомы Hs294T, но не описывает его действие на другие виды клеток типа первичной культуры базально-клеточной эпителиомы, или глиобластомы (GL-5), или ларенгиальной карциномы (HEp-2).
Также было описано альтернативное использование натурального IFN альфа и рекомбинантного IFN гамма для лечения ренальных и легочных метастазов (Fujii A., Yui-In K., et al. (1999) Preliminary results of the alternating administration of natural interferon-alpha and recombinant interferon-gamma for metastasic renal cell carcinoma BJU Int.; 84:399-404). Комбинация IFN альфа2, или альфа4 или гибрида δ4 альфа2 Bgl II альфа1 с IFN гамма была описана на клеточной линии RT4 (карцинома цисты) и на A2182 (аденокарцинома легкого) и обладала большим антипролиферативным эффектом, чем IFNs I типа или IFN гамма по отдельности (Hubbell H.R., Craft J.TO., et al. (1987) Synergistic antiproliferative effect of recombinant alpha-interferons with recombinant gamma-interferon. J Biol Response Mod, 6:141-153). Синергичный эффект IFN гамма (1000 IU/мл) и IFN альфа 2 (1000 IU/мл) был продемонстрирован на линии клеток A459 (альвеолярная опухоль) (Martyre M. C., Beaupain R., et al. (1987) Potentiation of antiproliferative activity by mix of human recombinant IFN-alpha 2 and -gamma on growth of human cancer nodules maintained in continuous organotypic culture. Eur J. Cancer Clin Oncol, 23:917-920), а также на линиях клеток, полученных из немелкоклеточной анапласической карциномы легких (Hand A., Pelin K., et al. (1993) Interferon-alpha and interferon-gamma combined with chemotherapy: in vitro sensitivity studies in non-small cell lung-cancer cell lines. Anticancer Drugs, 4:365-368).
Комбинация IFN альфа и IFN гамма была описана при исследовании линии клеток HepG2 ((Mizukoshi E., Kaneko S., et al. (1999) Up-regulation of type I interferon receptor by IFN-gamma. J Interferon Cytokine Animal, 19:1019-1023) и на линии клеток AVA5 (Okuse C, Rinaudo J. A., et al. (2005) Enhancement of antiviral activity against hepatitis С virus in vitro by interferon combination therapy. Antiviral Animal, 65:23-34). Эти авторы не выявили ни антипролиферативного эффекта, ни более эффективных соотношений при сочетании интерферонов альфа и гамма на линии клеток HepG2. Кроме того, синергичный эффект был изучен для TNF альфа и IFN гамма на линии клеток Hepa1-6 гепатомы мыши (Sasagawa Т., Hlaing M., et al. (2000) Synergistic induction of apoptosis in murine hepatoma Hepa1-6 cells by IFN-GAMMA and TNF-alpha. Biochem Biophys Common Animal, 272:674-680).
В патенте US 5190751 описано ингибирование роста лейкемийных линий клеток типа В и типа T комбинацией IFN альфа и гамма. Ни для одной из исследованных линий T клеток не наблюдался эффект усиления ингибирования роста, и при определенных экспериментальных условиях эффекты комбинаций были противоположными. В патенте EP 010749 и в публикации (Czarniecki С. W., Fennie C. W., et al. (1984) Synergistic antiviral and antiproliferative activities of Escherichia coli-derived human alpha, beta, and gamma interferons. J Virol. 49:490-496) также показано, что комбинация IFNs альфа и гамма не всегда является синергичной и может быть антагонистической. Отмечена эффективность комбинаций в очень широком диапазоне, однако это не приведено.
Эти данные свидетельствуют о том, что использование комбинаций IFN альфа и гамма следует оценивать для экспериментального определения, которое позволяет идентифицировать, какое из условий подходит для установления оптимальной комбинации для лечения нарушенного роста клеток в определенных тканях и органах. По этой причине для выбора лечения и соответствующей дозировки следует проводить оценку в экспериментах in vitro и в контролируемых клинических испытаниях.
В исследовании с линиями клеток глиом IFN гамма оказывал влияние на параметры злокачественного новообразования, такие как пролиферация и перемещение исследуемых опухолевых клеток (Knupfer M. M., Knupfer H., et al. (2001) Interferon-gamma inhibits growth and migration of A172 human glioblastoma cells. Anticancer Animal, 21:3989-3994). С другой стороны, сообщалось об отрицательных результатах применения IFN гамма при лечении глиом (Mahaley M. S., Bertsch L., Jr. et al. (1988) Systemic gamma-interferon therapy for recurrent gliomas. J. Neurosurg, 69:826-829). Одновременное использование IFN гамма и IFN β оказалось эффективным для ингибирования роста линии клеток GBM-18 астроцитомы с множественной устойчивостью (Reddy P. G., et al. (1991) Systemic gamma-interferon therapy for recurrent gliomas. J. Natl Cancer Inst, 83:1307-1315). Кроме того, была описана комбинация IFN гамма с альфа-дифторметилорнитином (DFMO) для лечения таких опухолей (US 4499072). В патенте US 5002879 описана сходная терапия с использованием DFMO после киллерных клеток, активированных лимфокинами и IL-2. Что касается IFN альфа, то его комбинации с другими лекарственными средствами не оказывали благоприятных эффектов при лечении глиом и обладали токсичностью (Buckner J. C, Burch P. A., et al (1998) Phase II trial of recombinant interferon-alpha-2a and eflornithine in patients with recurrent glioma. J Neurooncol. 36:65-70; Chang S. M., Barker F. G., et al. (1998) High dose oral tamoxifen and subcutaneous interferon alpha-2a for recurrent glioma. J Neurooncol, 37:169-176). Затем лечению этого типа опухоли может способствовать комбинированное применение IFN альфа и IFN гамма, исходя из соответствующего подбора соотношений их комбинаций, основанных на экспериментах in vitro и на клинических испытаниях.
Гортань является вторым из наиболее часто встречающихся после полости рта участком рака верхнего отдела дыхательных путей и пищеварительного тракта. Карцинома гортани представляет собой наиболее часто встречающуюся опухоль головы и шеи, и наиболее распространенным раком гортани является плоскоклеточная карцинома (95% всех случаев). Выживаемость при случаях опухолей гортани T3 и T4 составляет только 5 лет у приблизительно 30% больных, подвергшихся ларингектомии (Djordjevic V., Milovanovic J., et al. (2004) Radical surgery of the malignant laryngeal tumors. Minutes Chir Lugosl, 51:31-35). Было показано, что лучевая терапия и химиотерапия для лечения этой карцинома (Chen W., Guo X., et al. (2004) Long-term follow-up observation of clinical therapy for laryngeal carcinoma recurrence and cervical metastasis Lin Chuang Er Bi Yan Hou Ke Za Zhi. 18:536-537).
Тем не менее, полихимиотерапия совместно с применением IFN альфа оказались благотворными при лечении рака гортани (Mantz C. A., Vokes E. E., (2001) Sequential induction chemotherapy and concomitant chemoradiotherapy in the management of locoregionally advanced laryngeal cancer Ann Oncol, 12:343-347). Комбинация IL-2 и IFN альфа оценивалась в фазе II исследования в качестве терапии карциномы гортани, однако результаты были удовлетворительными (Clayman G. L, Young G., et al. (1992) Detection of regulatory factors of lymphokine-activated killer cell activity in head and neck cancer patients treated with interleukin-2 and interferon alpha. Ann Otol Rhinol Laryngol, 101:909-915). В терапии опухолей гортани достигнуты незначительные успехи. Комбинированное применение IFNs альфа и гамма может способствовать улучшению существующих методов лечения для борьбы с этим типом опухолей.
Патент US 5503828 описывает композицию интерферонов, характеризующуюся содержанием не менее 50% аллелей IFN альфа 2 и IFN альфа 8 и одним или несколькими дополнительными видами IFNs группы, образованной IFN альфа 4, альфа 7, альфа 10, альфа 16, альфа 17 и альфа 21. В то же время патент US 4503035 демонстрирует изготовление некоторых видов IFN альфа, но которые не включают альфа 1, альфа 5, альфа 14, и al IFN омега. Эти патенты не описывают состав, образуемый комбинацией рекомбинантных IFN гамма и IFN альфа 2.
Патент US 5762923 подробно описывает жидкую композицию интерферона, растворенного в воде с неионным детергентом и бензиловым спиртом в количестве, достаточном для стабилизирования IFN альфа, которая, кроме этого, содержит кислый буфер. С другой стороны, патент US 4847079 описывает фармацевтическую композицию интерферона и тимерозала, тогда как патент US 4675184 демонстрирует состав интерферона с многоатомным спиртом и органическим буфером в качестве стабилизатора и типового носителя или разбавителей с pH 3-6. Композиция может дополнительно иметь анионный сурфактант и/или альбумин в качестве стабилизатора. В патентах US 5236707 и US 5431909 описаны амины в качестве стабилизаторов (алифатические первичные амины) и органические соли лития, которые предохраняют интерферон от деградации и стабилизируют его.
Патент US 4496537 относится к жидким стабильным составам интерферона-альфа, которые содержат композицию сывороточного альбумина человека, и аланин или глицин, воду и буферную систему, способную поддерживать pH между 6,5 и 8,0.
Патент US 5935566 описывает стабильные составы интерферона альфа, которые содержат в своей композиции буферную систему, способную поддерживать pH в диапазоне от 4,5 до 7,1, полисорбат 80 в качестве стабилизатора, EDTA в качестве хелатирующего агента, хлорид натрия в качестве изотонизирующего агента и м-крезол в качестве противомикробной защиты.
Патент US 0170207 описывает стабильные составы интерферона альфа, которые содержат в своей композиции буферную систему, способную поддерживать pH в диапазоне от 4,5 до 9,0, стабилизирующее вещество, неионный сурфактант и регулятор осмотического давления.
В заявке WO 89/04177 описаны жидкие фармацевтические составы интерферона гамма, которые содержат буферный раствор, поддерживающий pH в диапазоне от 4,0 до 6,0, полигидроксильный сахар в качестве стабилизатора и неионный детергент. Патент US 4895716 относится к композициям и способам стабилизации интерферона гамма лактобионовой кислотой в буферном глицин/ацетатном растворе.
Патент US 5676942 описывает фармацевтические композиции, образованные подтипами интерферонов I типа, полученных из натуральных источников, но без комбинации с интерфероном гамма и не определяет соотношения этих комбинаций, только описывает эти комбинации для вирусных инфекций и не для лечения опухолей. Ни в одном из описанных ранее сообщений не применяли, характеризовали или упоминали фармацевтический состав, который одновременно содержит рекомбинантные IFNs гамма и альфа2 в синергичных комбинациях. Потенциальные возможности в комбинированном использовании существуют для IFN гамма и IFNs I типа, когда они смешаны в определенных пропорциях для лечения клеточного роста различной степени устойчивости к установленным методам лечения и/или их комбинациям.
Принимая во внимание эти предпосылки, необходимо разработать стабильные фармацевтические составы, которые содержат эти IFNs в соотношениях, которые позволят их безопасное, эффективное, простое и широкое применение у индивидуумов с доброкачественными или злокачественными опухолевыми образованиями. Это позволит более оптимально использовать комбинации и сделает более плодотворным применение в терапии больных, зависящих от этих лечений.
Пояснение изобретения
Настоящее изобретение разрешает ранее поставленную проблему, предоставляя стабильные фармацевтические составы для применения парентеральным (жидкие или лиофилизированные) или местным способом (гель, мазь или крем). Они содержат различные количества рекомбинантных интерферонов гамма и альфа в синергичных соотношениях для лечения патологических явлений, которые предполагают нефизиологический доброкачественный или злокачественный рост ткани или органов и которые, кроме этого, содержат фармацевтически приемлемые наполнители или носители.
Эти составы представляют собой результат анализов in vitro линий клеток с различной чувствительностью к IFNs и клинических испытаний с различными вариантами опухолей, а также оценки биологической и физико-химической устойчивости рекомбинантных IFNs гамма и альфа2 в присутствии различных фармацевтически приемлемых наполнителей или носителей.
Лиофилизированные стабильные фармацевтические составы состоят их рекомбинантных IFN гамма и альфа2, смешанных в буферном растворе, способном поддерживать pH между 4,9 и 7,5, который может быть ацетатом аммония или натрия, сукцинатом натрия, фосфатом натрия и/или калия или цитратом/фосфатом натрия.
Такие составы также состоят, по меньшей мере, из компонента, выбранного из соединений невосстанавливающих сахаров, аминокислот, сурфактантов и стабилизирующих полимеров. Невосстанавливающие сахара могут представлять собой сахарозу или трегалозу; аминокислоты могут представлять собой глицин, гистидин или лейцин; в то время как сурфактанты характеризуются полисорбатом 20 или полисорбатом 80 и в качестве стабилизирующего полимера - полиэтиленгликолем, декстраном или гидроксиэтилкрахмалом.
Осуществление изобретения определяло, что буферный раствор следует применять в диапазоне концентраций между 10 и 20 мМ. Сахарозу или трегалозу следует использовать в концентрации от 5 до 100 мг/мл; глицин, гистидин или лейцин следует применять в диапазоне концентраций между 1 и 20 мг/мл. Полисорбат следует применять в концентрации от 0,01 до 1 мг/мл, что касается полиэтиленгликоля, декстрана, и гидроксиэтилкрахмала, их применяют в диапазоне концентраций между 5 и 50 мг/мл.
Некоторые осуществления изобретения описывают лиофилизированные стабильные фармацевтические составы, которые содержат рекомбинантный IFN гамма в диапазоне концентраций между 5,6×108 IU и 1,4×108 IU и рекомбинантный IFN альфа2 в диапазоне концентраций между 6,8×108 IU и 1,7×108 IU. Или рекомбинантный IFN гамма в диапазоне концентраций между 2,0×108 IU и 0,5×108 IU и рекомбинантный IFN альфа2 в диапазоне концентраций между 12,0×108 IU и 3,0×108 IU. Или рекомбинантный IFN гамма в диапазоне концентраций между 4,0×108 IU и 1,0×108 IU и рекомбинантный IFN альфа2 в диапазоне концентраций между 80×108 IU и 20×108 IU. Cоставы дополнительно содержат 0,0802 г фосфорнокислого калия, 0,249 г 2-водного фосфорнокислого динатрия, 4 г сахарозы, 0,8 г глицина, 0,03 г Tween 20, 1 г полиэтиленгликоля 6000 и воду для инъекций в достаточном количестве по 100 мл и по 0,5 мл, 1 мл, 5 мл и 10 мл в соответствующих эквивалентных пропорциях.
Определение смешивать рекомбинантные IFN гамма и IFN альфа в диапазоне определенной комбинации было получено после изоболограммного анализа. Концентрация рекомбинантного IFN гамма между 5,6×108 IU и 1,4×108 IU и рекомбинантного IFN альфа2 в диапазоне концентраций между 6,8×108 IU и 1,7×108 IU в одном из лиофилизированных стабильных фармацевтических составов была выявлена из анализа изучения ингибирования роста первичной культуры, полученной из келоидов (Kel 5a, Kel 17a) и из CBC III. В результате изоболограммного анализа была выявлена комбинация из 100 IU/мл (10 нг/мл) рекомбинантного IFN гамма со 100 IU/мл (0,5 нг/мл) рекомбинантного IFN альфа 2b, которая уменьшает рост клеток in vitro на 21%, 43% и 47%, соответственно, (см. примеры 1, 2 и 3, фиг. 1, Таблица 1).
Смесь рекомбинантного IFN гамма в диапазоне концентраций между 2,0×108 IU и 0,5×108 IU и рекомбинантного IFN альфа2 в диапазоне концентраций между 12,0×108 IU и 3,0×108 IU для состава была определена при помощи клинического испытания и на основании выписки из истории болезни с облегчением. Рандомизированным, контролируемым, проведенным в трех повторностях вслепую клиническим испытанием оценивали эффективность лечения введением внутрь пораженных тканей (I.L.) больных базально-клеточной эпителиомой определенного выше устойчивого лиофилизированного состава (см. примеры 7, таблицы 9, 10, 11 и 12).
По выписке из истории болезни с облегчением, которая также способствовала определению этих соотношений, подвергались лечению больные с плоскоклеточным раком (больной 1) и больной с множественными рецидивирующими плоскоклеточными раками и с предварительными прививками (больной 2) (см. пример 8 фиг. 5 b, c, d; больной 1, и фиг. 6 b, c; больной 2, соответственно).
Состав, который содержит рекомбинантный IFN гамма в диапазоне концентраций между 4,0×108 IU и 1,0×108 IU и рекомбинантный IFN альфа2 в диапазоне концентраций между 80×108 IU и 20×108 IU, был определен по анализу результатов исследования ингибирования роста клеток глиобластомы (GL-5) при помощи 50 IU/мл (5 нг/мл) рекомбинантного IFN гамма с 100 IU/мл (0,5 нг/мл) рекомбинантного IFN альфа 2b. Таким образом, достигнуто ингибирование роста на 55% (пример 3). Кроме того, был учтен анализ исследования с линией клеток HEp-2. В этом случае количества IFNs составляют 5 IU/мл (0,5 нг/мл) рекомбинантного IFN гамма с 75 IU/мл (0,375 нг/мл) рекомбинантного IFN альфа 2b. При этом достигнута оптимальная комбинация для уменьшения клеточного роста in vitro на 76% (см. примеры 1, 2 и 3).
Кроме того, были разработаны фармацевтические стабильные жидкие составы. В этих составах соотношения рекомбинантных IFNs гамма и альфа поддерживались, как описано для лиофилизированных составов, однако их фармацевтические составляющие варьировали для достижения большей устойчивости этих смесей IFNs.
Как следствие этой работы, осуществление изобретения описывает жидкие стабильные фармацевтические составы, которые содержат буферный раствор и, по меньшей мере, компонент, выбранный из невосстанавливающих сахаров, аминокислот, сурфактантов, стабилизирующих полимеров, антиоксидантов/хелатирующих компонентов и изотонизирующих веществ. В этих составах применяют водные растворители, которые могут содержать или не содержать консерванты, такие как смесь метил- и пропилпарабена.
Другое осуществление изобретения создает условия для определения жидких стабильных фармацевтических составов, в которых применяют буферный раствор, способный поддерживать pH между 4,9 и 6,5. Этот буфер может быть ацетатом аммония или натрия, сукцинатом натрия, фосфатом натрия и/или калия, цитратом/фосфатом. В этих составах в качестве сурфактантов можно применять полисорбат 20 или полисорбат 80; в качестве антиоксиданта/хелатирующего вещества - EDTA или ацетилцистеин; тогда как в качестве аминокислот можно включать гистидин, L-аргинин, L-аланин, глицин или лизин. В качестве стабилизирующего полимера установлено применение гидроксиэтилкрахмала или декстрана, а в качестве изотонизирующего вещества - хлорид натрия, хлорид калия, пропиленгликоль, маннит, глицерин, сахарозу или трегалозу.
Осуществление изобретения позволяет сделать вывод, что в жидких стабильных фармацевтических составах применяют буферный раствор в диапазоне концентраций между 10 и 100 мМ. В этом составе полисорбат применяют в диапазоне концентраций между 0,01 и 1 мг/мл; EDTA или ацетилцистеин применяют в диапазоне концентраций между 0,01 и 1 мг/мл. Аминокислоты гистидин, L-аргинин, L-аланин, глицин или лизин - в концентрации между 1 и 20 мг/мл; гидроксиэтилкрахмал и декстран применяют в диапазоне концентраций между 5 и 50 мг/мл и изотонизирующие вещества присутствуют в количестве, достаточном для получения изотонического раствора.
Другие осуществления разъясняют количества всех фармацевтических ингредиентов жидких стабильных фармацевтических составов, необходимых для физико-химической и биологической устойчивости описанных ранее смесей рекомбинантных IFNs гамма и альфа. Эти жидкие составы содержат, кроме IFNs, 0,708 г натрия ацетат, 0,079 мл уксусной кислоты, 0,01 г Tween 20, 5 г маннита и воду для инъекций в достаточном количестве по 100 мл и по 0,5 мл, 1 мл, 5 мл и 10 мл в соответствующих эквивалентных пропорциях.
Данное изобретение определяет соотношения смесей IFNs гамма и альфа, которые могут быть эффективны для лечения доброкачественного или злокачественного чрезмерного роста клеток. Это должно способствовать применению меньших доз, меньшему времени лечения и поддержанию неизменных терапевтических эффектов или достижению эффектов, превосходящих те, которые были достигнуты к настоящему времени с применением интерферонов при лечении опухолей или других аберрантных событий клеточного роста. Снижение дозы позволит ожидать уменьшения побочных эффектов или ослабления их интенсивности, что приведет к улучшению качества жизни больных и позволит им получить пользу от применения этих сильнодействующих лекарственных средств. Изобретение характеризует составы смесей рекомбинантных IFN гамма и IFN альфа2, которые не были описаны ранее, которые облегчают менеджмент и клиническое применение этой терапевтической комбинации и их коммерциализацию.
Лиофилизированные и жидкие стабильные фармацевтические составы, которые содержат описанные в изобретении смеси рекомбинантных IFNs гамма и альфа2 в синергичных соотношениях для ингибирования пролиферации, обладают широким спектром клинического применения. При использовании этих составов in vivo показано, что при значительных онкологических заболеваниях эффективно одновременное и внутриопухолевое применение комбинации рекомбинантных IFN гамма и IFN альфа2.
Эта комбинация способна оказывать равные лечебные эффекты на опухоли за более короткое время и с большим эстетическим эффектом по сравнению с эффектами, полученными для ее отдельных компонентов. Применение этих комбинаций позволит охватывать большие терапевтические возможности для борьбы с раком. Это накоплено в осуществлении изобретения, в котором раскрыто, что лиофилизированные или жидкие составы можно применять при лечении однородных доброкачественных или злокачественных опухолей, использовать в независимых формах или сочетать с химиотерапией, лучевой терапией или комбинацией обеих.
Использование этих составов в комбинации с другими терапевтическими веществами подтверждено результатами, полученными при лечении больного с гигантской базально-клеточной опухолью комбинацией рекомбинантных IFN гамма и IFN альфа2 вместе с цисплатином (см. пример 10 и фиг. 9).
В изобретении описано, как комбинированное применение интерферонов гамма и альфа2 позволяет уменьшить и/или вылечить опухоли с крайне неблагоприятным прогнозом и искажающими эстетическими проявлениями.
На основании характерных особенностей некоторых доброкачественных и онкологических нарушений, у которых преобладает неконтролируемый рост клеток, они могут быть восприимчивы к лечению этими составами. Среди них имеются: опухоли клеток из гематопоэтической ткани, такие как острая или хроническая миелоидная лейкемия, острый или хронический лимфолейкоз, а также лейкемии T или В клеток и лимфома центральной нервной системы. Также можно лечить карциномы гортани, папиломатоз гортани, липому, эпидермоид и интрадермальную цисту, липосаркому, нейробластому и жировую гиперплазию. Может быть полезно применение этих фармацевтических составов при опухолях периферической и центральной нервной системы, как, например, астроцитомы, полиморфные глиобластомы, эпендимомы, ганглионевромы, пилоцитарные астроцитомы, разнородные глиомы, олигодендроглиомы, глиомы зрительного нерва, эмбриональные эктодермальные опухоли, акустические нейромы, кордомы, краниофарингиомы, медулабластомы, менингиомы, нейрофиброматоз, ложные опухоли головного мозга, туберозные уплотнения, метастазирующие опухоли мозга. Другие чувствительные к лечению опухоли представляют собой кавернозные гемангиомы, гепатоцеллюлярные аденомы, очаговую узелковую гиперплазию, пинеальные опухоли, аденомы гипофиза, васкулярные опухоли, менингиальный карциноматоз, вишнеподобные ангиомы, жировую гиперплазию лимфатических узлов. Опухоли кожи, как, например, базально-клеточная эпителиома, плоскоклеточная карцинома, дерматофиброма, пиогенная гранулема, невоидная опухоль кожи, а также себорейный и актиничный квератоз могут иметь благоприятное воздействие при лечении этими фармацевтическими составами.
Другое осуществление изобретения описывает, что эти составы также можно применять для лечения пролиферативных явлений, как, например, фиброз, дисплазия и гиперплазия.
На основании результатов клинических испытаний, проведенных и описанных в примерах 7, 8 и 10, в качестве осуществления изобретения определены внутримышечные, внутриопухолевые и околоопухолевые способы применения составов. Другие осуществления описывают применение местных стабильных фармацевтических составов, которые содержат IFN гамма в диапазоне концентраций между 0,32×106IU и 0,08×106 IU и al IFN альфа2 в диапазоне концентраций между 2,0×106IU и 0,5×106 IU на грамм полутвердого состава. Составы представляют собой крем, состоящий из 2,2% IFN гамма, 0,58% IFN альфа, 4% цетилового спирта, 10% вазелина, 2% Tween 60 и 0,2% метилпарабена, пропилпарабена. Кроме того, композиция мази была определена как 2,2% IFN гамма, 0,58% IFN альфа, 60% белого твердого вазелина, 10% вязкого жидкого вазелина, 3% span 20, и 0,2% метилпарабена и пропилпарабена. Наконец, состав геля состоит из 2,2% IFN гамма, 0,58% IFN альфа, 0,5% Carbopol 940, 0,2% метилпарабена и пропилпарабена, 0,2% гидрохлорида натрия, 0,01% динатрийэтилендиаминотетраацетата кальция и 2% этанола.
Все эти составы стабильны к колебаниям температуры, что полезно для производства продукта, его транспортировки и хранения. Они препятствуют агрегации интерферонов и поэтому представляют уменьшенный риск получения аллергии во время длительного применения продукта. Полутвердые составы больные могут применять самостоятельно в неинвазивной и безопасной форме. В качестве другого осуществления изобретения было определено применение этих местных стабильных составов при лечении солидных доброкачественных или злокачественных опухолей кожи или слизистых оболочек, используемых в независимых формах или в сочетании с химиотерапией, лучевой терапией или комбинацией обеих.
Другое осуществление изобретения описывает, что местные стабильные фармацевтические составы можно применять для лечения липомы, эпидермоидной и интрадермальной цисты, липосаркомы, нейробластомы, жировой гиперплазии, гемангиом, очаговой узелковой гиперплазии, эпендимом, ганглионевром, пилоцитарных астроцитом, менингиом, пинеальных опухолей, аденом гипофиза, васкулярных опухолей, менингиального карциноматоза, нейрофиброматоза, вишнеподобных ангиом, гиперплазии сальных желез, базально-клеточной эпителиомы, плоскоклеточной карциномы, дерматофибромы, пиогенной гранулемы, родимых пятен на коже, себорейного и актиничного квератоза и кондилом.
Другое осуществление изобретения описывает устройство набора, который содержит ампулу с рекомбинантным IFN гамма, ампулу с рекомбинантным IFN альфа в описанных выше концентрациях и соотношениях, ампулы с достаточным количеством воды для инъекций, разведения и/или растворения IFNs. Набор содержит шприцы и соответствующие иглы для одновременного введения IFNs, предварительно смешиваемых в одной из ампул, которая содержат один из IFNs.
Краткое описание фигур:
Фиг. 1. Ингибирование роста первичной культуры клеток фибробластов, происходящей из биопсии келоидов взрослых больных, 1000 IU/мл рекомбинантного IFN гамма или IFN альфа2.
Фиг. 2. Изоболограмма ингибирования роста клеток комбинацией рекомбинантных IFN гамма и IFN альфа 2b на первичной культуре клеток фибробластов из келоидов (Kel5a).
Фиг. 3. Изоболограмма ингибирования роста клеток комбинацией рекомбинантных IFN гамма и IFN альфа 2b на первичной культуре клеток фибробластов из келоидов (Kel17a).
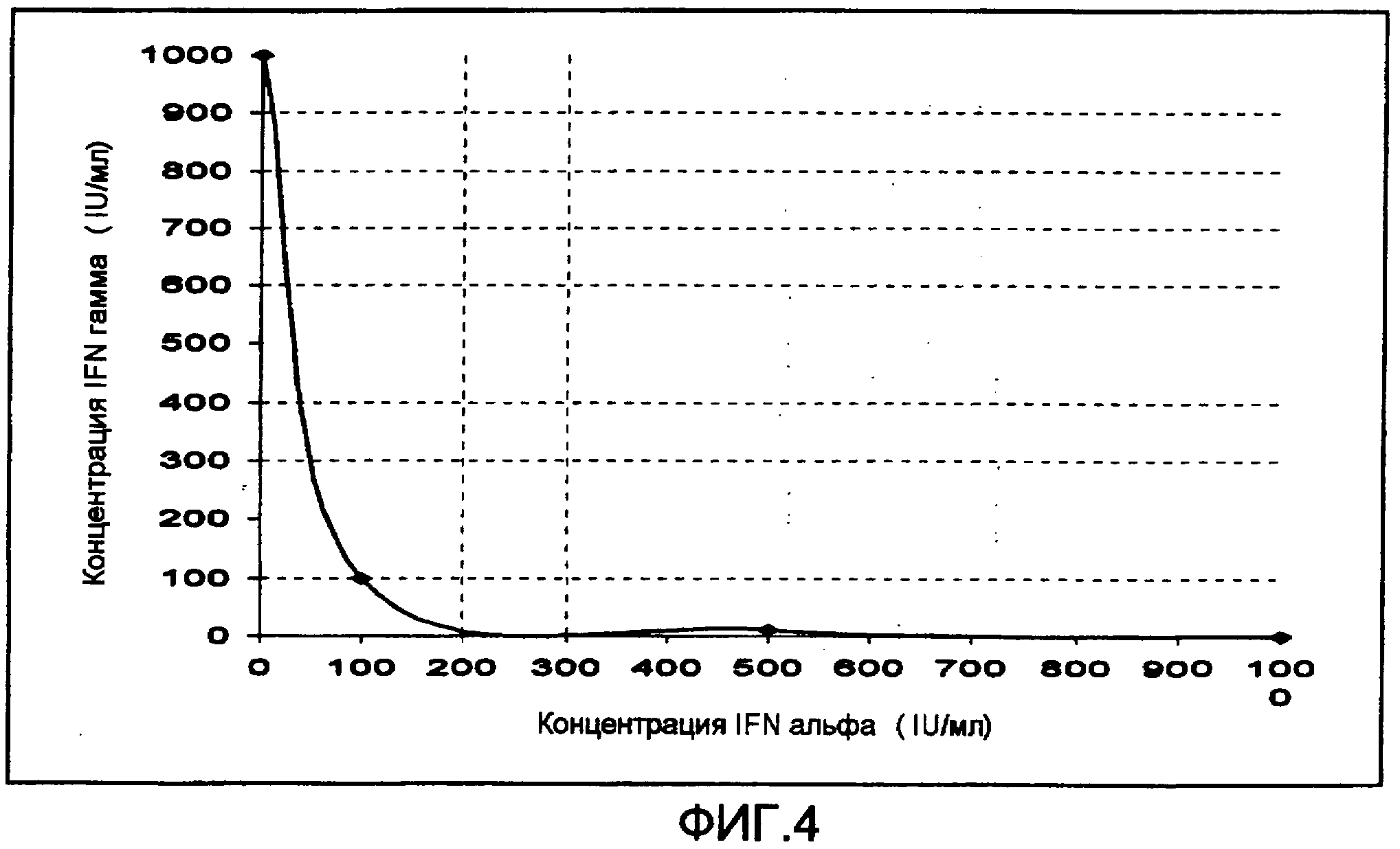
Фиг. 4. Изоболограмма ингибирования роста клеток комбинацией рекомбинантных IFN гамма и IFN альфа 2b на первичной культуре клеток фибробластов из базально-клеточной эпителиомы (CBC III).
Фиг. 5. Изоболограмма ингибирования роста клеток комбинацией рекомбинантных IFN гамма и IFN альфа 2b на клеточной линии глиобластомы GL-5.
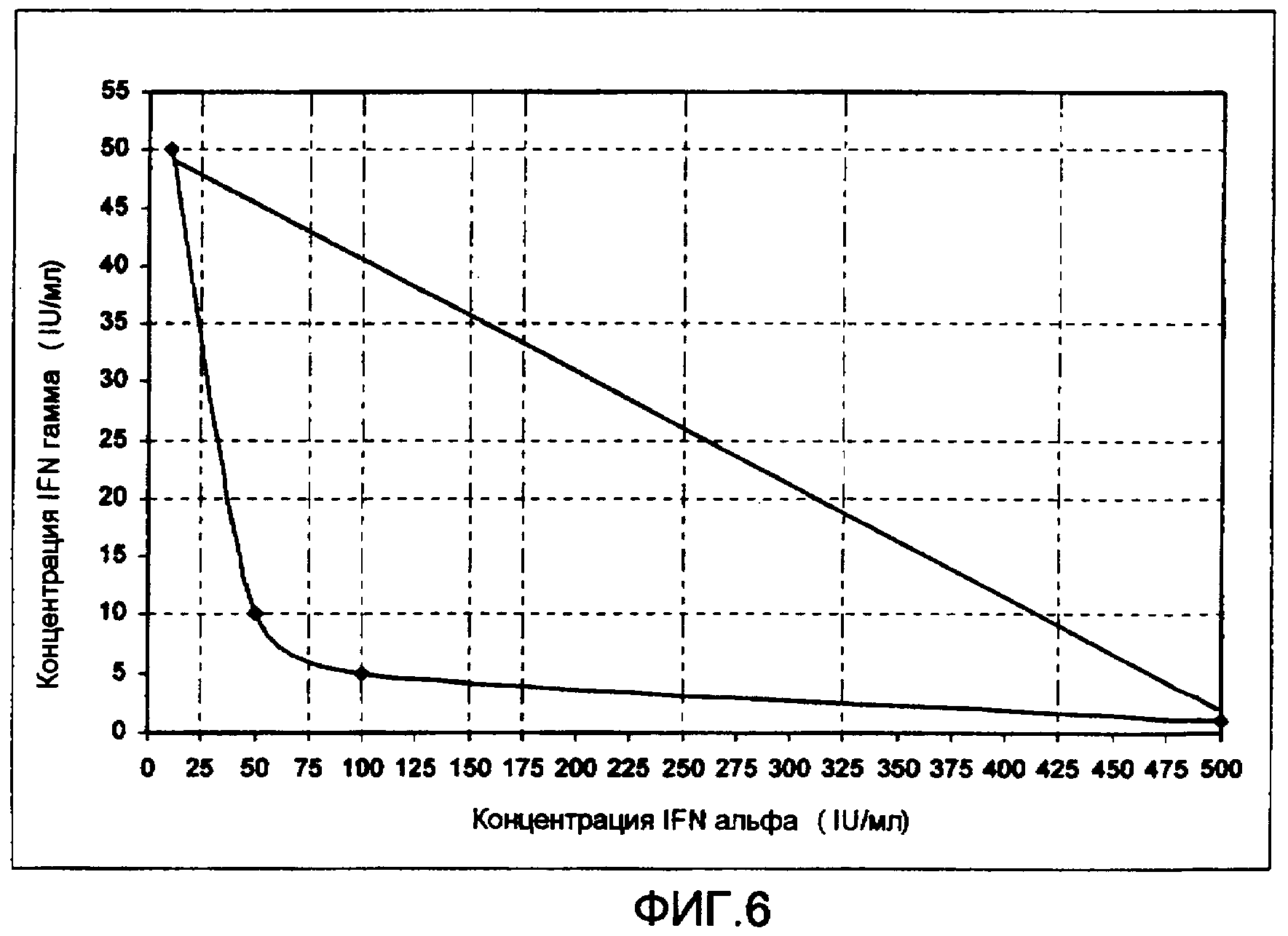
Фиг. 6. Изоболограмма ингибирования роста клеток комбинацией рекомбинантных IFN гамма и IFN альфа 2b на клеточной линии HEp-2 гортани.
Фиг. 7. Больной эпидермоидальной карциномой, подвергавшийся лечению комбинацией рекомбинантных IFN гамма и IFN альфа 2b.
Фиг. 8. Больной с рецидивирующей базально-клеточной эпителиомой, подвергавшийся лечению комбинацией рекомбинантных IFN гамма и IFN альфа 2b.
Фиг. 9. Больной с рецидивирующей базально-клеточной эпителиомой, подвергавшийся лечению комбинацией рекомбинантных IFN гамма и IFN альфа 2b и цисплатина. A: до лечения, B: после 1 года лечения.
Подробное изложение способов выполнения/Примеры
Пример 1. Ингибирование роста клеток рекомбинантными IFNs гамма или альфа в первичной клеточной культуре.
Биопсии кожи были получены из нормальной кожи и от больных, у которых развивались базально-клеточная эпителиома или келоиды, последние явились результатом повреждения, полученного при хирургической операции или ожогов. Образец ткани был немедленно помещен в среду DMEM и фрагментирован для получения первичной культуры способом эксплантации. Для оценки антипролиферативного эффекта рекомбинантных IFNs гамма и альфа оценивали следующие первичные культуры: первичная культура фибробластов (CPF) из келоидов (1, 2, 5, 7, 8, 15, 17, 19, 20, 24, 26, 27, 31, 32), CPF из базально-клеточной эпителиомомы (CBC III) и CPF из нормальной кожи (FibN3 и FibN5). CPF наращивали в смеси культуральных сред RPMI-1640/DMEM, которая содержала гентамицин (50 мкг/мл) и 12% сыворотки теленка (CBS). Все культуры инкубировали при 37°C в CO2-инкубаторе при 5% влажности. Для определения антипролиферативного эффекта IFNs клетки засевали с концентрацией 5×104 клеток/мл в 96-микролуночный планшет. Их синхронизировали путем замены среды на свежую через 24 часа после посева. В конце 96 часов инкубации в присутствии различных концентраций IFNs была определена жизнеспособность 3 повторностей оцениваемых экспериментальных условий способом окрашивания кристаллическим фиолетовым при помощи измерения поглощения при 580 нм и использования планшетов для ридера. Результаты были определены как % роста, основанный на числе жизнеспособных клеток:
% роста=(AT72h-AC0h/AC72h-AC0h)×100.
AT72h = Поглощение клеток, обработанных 72 часа.
AC72h = Поглощение контрольных клеток, обработанных 72 часа.
AC0h = Поглощение клеток до обработки IFN.
На фиг. 1 показано антипролиферативное действие рекомбинантного IFNs гамма или альфа на рост келоидных CPF. Как можно видеть, IFN гамма или альфа 2b ингибирует клеточную пролиферацию у различных первичных культур, в то время как у других они стимулируют их рост. В качестве контрольных оценивались первичные культуры FibN3 и FibN5, а также первичная культура из биопсии линий клеток CBCIII, и HEp-2, U1752 и GL-5.
Пример 2: Ингибирование клеточного роста рекомбинантами рекомбинантных IFNs гамма или альфа у определенных линий клеток.
Были исследованы линии клеток человека: Jurkat (ATCC, TIB-152), GL-5 (Perea S. and., et al. (1993) Minutes Cient Venez, 44:22-27), HEp-2 (ATCC, CCL23). Клетки GL-5 культивировали в DMEM, а HEp-2 - в MEM-CANE, содержащей гентамицин (50 мкг/мл) и 10% CBS. Клетки Jurkat инкубировали в среде RPMI с гентамицином и 10% CBS. Все культуры инкубировали при 37°C в CO2инкубаторе при 5% влажности. Для оценки антипролиферативного эффекта клетки GL-5 и HEp-2 засевали при концентрации 3×104 клеток/мл. В случае клеток Jurkat засев проводили при концентрации 105 клеток/мл. После 72 часов инкубации в присутствии различных концентраций IFNs выживаемость оценивали способом окрашивания кристаллическим фиолетовым при помощи измерения поглощения при 580 нм и использования планшетов для ридера. Результаты были определены как % роста, основанный на подсчете жизнеспособных клеток, как описано в примере 1. Как видно из Таблицы 1 и на фигуре 1, линии клеток HEp-2 (карцинома гортани) и GL-5 (из глиобластомы) являются очень чувствительными к IFN гамма и не чувствительными к IFN альфа.
В Таблице 1 подмечено, что линия HepG2 (Гепатома) не чувствительна к этим IFNs и что для линии клеток Jurkat (лимфома T) IFN альфа является наиболее эффективным, результат, который согласуется с успешным применением IFN альфа2 при лечении опухоли лимфоидной ткани.
Пример 3: Комбинации рекомбинантных IFNs гамма и альфа с наиболее эффективным антипролиферативным воздействием на первичную культуру и линии клеток.
С использованием CBC-III и келоидных (Kel-5a и Kel-17a) CPF и линий клеток HEp-2 и GL-5 проводили изучение комбинаций рекомбинантных IFNs гамма и альфа 2b для определения оптимальной смеси с синергичной активностью ингибирования клеточного роста. Полученные в исследовании данные были проанализированы построением изоболограмм. Из исследования изоболограмм CPF, полученных из биопсии келоидов (kel 5a и kel 17a) взрослых было определено, что оптимальная синергичная комбинация для ингибирования роста должна составлять 100 IU/мл (10 нг/мл) IFN гамма и 100 IU/мл (0,5 нг/мл) IFN альфа 2b. С этой комбинацией рост клеток уменьшается in vitro на 21% (Kel 5a) и на 43% (kel 17a) (фиг. 2 и 3).
На изоболограмме фиг. 4 показано, что комбинация 100 IU/мл (10 нг/мл) IFN гамма с 100 IU/мл (0,5 нг/мл) IFN альфа 2b является синергичной и является наиболее эффективной при уменьшении роста клеток in vitro для CBC III на 47%.
В соответствии с изоболограммой, представленной на фигуре 5, оптимальная синергичная комбинация для ингибирования роста клеток GL-5 составляет 50 IU/мл (3 нг/мл) IFN гамма с 600 IU/мл (5 нг/мл) IFN альфа 2b. С этой комбинацией рост клеток in vitro уменьшается на 55%.
На изоболограмме, представленной на фигуре 6, показана оптимальная синергичная комбинация IFN гамма и альфа для достижения наилучшего антипролиферативного эффекта на клетках HEp-2. Количества IFNs составляют 5 IU/мл (0,5 нг/мл) IFN гамма и 75 IU/мл (0,375 нг/мл) IFN альфа 2b. С этой оптимальной комбинацией достигается уменьшение роста клеток in vitro на 76%.
Пример 4: Эффект pH, видов ионов и концентрации буферного раствора на устойчивость смеси интерферонов альфа 2b и гамма в водном растворе.
Для исследования устойчивости жидких и лиофилизированных составов синергичных композиций рекомбинантных интерферонов гамма и альфа IFNs разведены из их соответствующего Активного Фармацевтические Ингредиента (IFA) в различных пробных составах: буферные растворы, смесь буферных растворов с отдельными наполнителями и смесь буферных растворов с различными наполнителями. Характерные образцы ампул с различными составами были представлены для различных обработок для оценки устойчивости интерферонов: циклы замораживания-оттаивания, лиофилизирование, встряхивание при 37°C, воздействие света и температуры. После различных обработок физико-химическую устойчивость оценивали при помощи различных методов: физических свойств, электрофореза в натрийдодецилсульфат-полиакриламидном геле (SDS-PAGE), обращено-фазной жидкостной хроматографии (RP-HPLC) и хроматографии молекулярного исключения (ME-HPLC). Биологическую устойчивость оценивали при помощи иммуноферментного анализа (ELISA), специфического для каждого интерферона, и биологических анализов ингибирования вирусного цитопатогенного эффекта.
Все эти исследования планирования составов проводили со смесью промежуточных концентраций интерферонов (0,5 MIU IFN гамма и 3,0 MIU IFN альфа 2b). С окончательными вариантами полученных составов (полученных в повторностях) готовили синергичные композиции и оценивали их устойчивость.
Органолептические характеристики: Был проанализирован внешний вид состава (сохранение бесцветности, прозрачности и отсутствие агрегации белков). В лиофилизированных составах также был проанализирован внешний вид лиофилизированного продукта.
Влажность: Содержание остаточной влажности лиофилизированного продукта определяли при помощи методики иодометрического титрования Karl Fischer с использованием измерителя влажности Radiometer (Model TIM 550).
Химическая устойчивость: Чистоту белков и степень деградации определяли при помощи RP-HPLC на колонке C8 Vydac, оснащенной оберегающей колонкой C8 Vydac (Vydac, Hesperia, CA), используя систему HPLC Merck-Hitachi, оснащенную системой высвобождения растворителя, детектором с диодной матрицей, камерой и системой обработки данных. Степень гомогенности белков также определяли при помощи SDS-PAGE.
Определение агрегатов: Агрегацию рекомбинантных IFN гамма и IFN альфа 2b определяли при помощи HPLC молекулярного исключения с использованием колонки с Superdex-75 HR 10/30 (Amersham Pharmacia Biotech AB, Sweden) и системы HPLC Merck-Hitachi, оснащенной системой высвобождения растворителя, детектором с диодной матрицей, камерой и системой обработки данных. Содержание ковалентных агрегатов определяли при помощи SDS-PAGE.
ELISA для интерферона альфа: Этот тест был разработан в нашей лаборатории (H. Santana., Espino Y., et al. (1999) A sandwich-type enzyme-linked immunosorbent assay for the analysis of recombinant human interferon a-2b. Biotechnology Techniques, 13, 341-346). В тесте использовали моноклональные антитела, и его проводили, следуя описанной методологии. Измерения представлены здесь как процентное отношение остаточной ELISA-активности интерферона альфа-2b в различных образцах из каждого варианта состава, принимая за 100% ELISA-активность в исходном образце.
ELISA для интерферона гамма: Этот тест был разработан в нашей лаборатории (Bouyon R., Santana H., et al. (2003) Development and validation of an enzyme-linked immunosorbent assay (ELISA) for recombinant human gamma interferon. Journal of Immunoassay and Immunochemistry, 24:1-10). В тесте использовали моноклональные антитела, и его проводили, следуя описанной методологии. Измерения представлены здесь как процентное отношение остаточной активности интерферона гамма в тесте ELISA в различных образцах из каждого варианта составов, принимая за 100% активность в тесте ELISA в исходном образце.
Количественный анализ антивирусной биологической активности: Измерение биологической активности проводили, как описано в Ferrero J., Ochagavia ME., et al. (1994, Titulacion de la actividad antiviral del interferon utilizando el sistema de equipos SUMA. Biotecnologia Aplicada, 11:34-42). Расчет биологической активности проводили, как описано в Ferrero J., Duany L., et al. (1997, Nuevo programa de calculo, cuantificacion de la actividad antiviral de interferones mediante la inhibicion del efecto citopatogenico utilizando el sistema de equipos SUMA. Biotecnologia Aplicada, 14: 267-269). Биологическая активность представлена здесь как процентное отношение остаточной активности, принимая за 100% биологическую активность в исходном образце. Для выяснения эффекта pH на устойчивость действующих компонентов были приготовлены различные составы, содержащие 0,5 MIU IFN гамма и 3,0 MIU IFN альфа 2b в различных буферных растворах; которые представляют собой, например, цитрат/фосфатный буфер, фосфатный буфер, цитратный буфер и ацетатный буфер. Составы, содержащие смеси рекомбинантных IFN гамма и IFN альфа 2b в буферных растворах, подвергали циклам замораживания-оттаивания или хранения при 45°C и анализировали при помощи ELISA с различными временными интервалами. Составы приготовили так, чтобы они имели pH между 4 и 8, и все буферные растворы имели концентрацию 0,1 M. Таблицы 2, 3 и 4 представляют результаты анализов, проведенных после 3 циклов замораживания-оттаивания и с различными интервалами времени, от 3 до 12 дней при 45°C.
IFN/4 = состав в цитрат/фосфатном буфере pH 4,0
IFN/5 = состав в цитрат/фосфатном буфере pH 5,0
IFN/6 = состав в цитрат/фосфатном буфере pH 6,0
IFN/7 = состав в цитрат/фосфатном буфере pH 7,0
IFN/8 = состав в цитрат/фосфатном буфере pH 8,0
IFN/5 = состав в фосфатном буфере pH 5,0
IFN/6 = состав в фосфатном буфере pH 6,0
IFN/7 = состав в фосфатном буфере pH 7,0
IFN/8 = состав в фосфатном буфере pH 8,0
Данные из этих Таблиц (2, 3, 4) показывают, что составы со значениями pH между 5 и 8 обладают соответствующей устойчивостью во время циклов замораживания-оттаивания, предпочтительно для pH, близких к 5 и 7, и в ацетатном, фосфатном и цитрат-фосфатном буферах. Термоустойчивость в водном растворе была выше для значений pH между 5 и 5,6, предпочтительно в ацетатном и фосфатном буферах.
Данные из Таблицы 5 показывают, что составы с увеличенными концентрациями буфера демонстрируют большую устойчивость во время циклов замораживания-оттаивания, чем составы с уменьшенными концентрациями с pH 5,5, особенно для IFN гамма в различных оцениваемых буферах. Тем не менее, результаты термоустойчивости были лучше для pH 5,5 в ацетатном буфере, за которым следует фосфатный. Зависимость от концентрации не наблюдали. Термоустойчивость в цитрат-фосфатном буфере была выше в буфере с низкой концентрацией.
IFN/С4 = состав в цитратном буфере pH 4,0
IFN/С5 = состав в цитратном буфере pH 5,0
IFN/С6 = состав в цитратном буфере pH 6,0
IFN/А4 = состав в ацетатном буфере pH 4,0
IFN/А5 = состав в ацетатном буфере pH 5,0
IFN/А5,6 = состав в ацетатном буфере pH 5,6
IFN/C-F25: состав в цитрат-фосфатном буфере рН 5,5, 25 мМ;
IFN/C-F50 состав в цитрат-фосфатном буфере рН 5,5, 50 мМ;
IFN/C-F100 состав в цитрат-фосфатном буфере рН 5,5, 100 мМ;
IFN/Fk25: состав в калий-фосфатном буфере рН 5,5, 25 мМ;
IFN/Fk50: состав в калий-фосфатном буфере рН 5,5, 20 мМ;
IFN/Fk100: состав в фосфатном буфере рН 5,5, 100 мМ;
IFN/FNa25: состав в натрий-фосфатном буфере рН 5,5, 25 мМ;
IFN/FNa50: состав в натрий-фосфатном буфере рН 5,5, 50 мМ;
IFN/FNa100: состав в натрий-фосфатном буфере рН 5,5, 100 мМ;
IFN/А25: состав в ацетатном буфере рН 5,5, 25 мМ;
IFN/А50: состав в ацетатном буфере рН 5,5, 50 мМ;
IFN/А100: состав в ацетатном буфере рН 5,5, 100 мМ.
Пример 5. Лиофилизированный состав (1,4×106 IU IFN гамма и 1,7×106IU INF альфа 2b на ампулу).
Композиция: IFN гамма - 2,8×108 IU, IFN альфа 2b - 3,4×108 IU, калий фосфорнокислый однозамещенный - 0,0802 г, натрий фосфорнокислый двузамещенный 2-водный - 0,249 г, сахароза - 4 г, глицин - 0,8 г, Tween 20 - 0,03 г, полиэтиленгликоль 6000 - 1 г, вода для инъекции в достаточном количестве - 100 мл.
Все компоненты, за исключением интерферонов, были дозированы и разведены водой для инъекции. pH раствора проверяли и при необходимости доводили до значения 7,2±0,2 разбавленной (1:2) уксусной кислотой или 1M NaOH. Были добавлены активные фармацевтические ингредиенты интерферонов IFN гамма и IFN альфа 2b и разведены до соответствующей концентрации. Раствор фильтровали в стерильную форму и ампулы заполняли и затыкали пробками для лиофилизирования в зоне со 100 ячейками, где производился процесс. Наконец, ампулы закрывали и опечатывали; и продукт хранили при температуре от 2 до 8°C. Таблица 6 демонстрирует основные параметры применяемого цикла лиофилизирования.
С определенными временными интервалами образцы отбирали и анализировали содержание остаточной влажности продукта, содержание IFN гамма и IFN альфа 2b (при помощи ELISA), биологической активности, степень гомогенности при помощи RP-HPLC и внешний вид лиофилизированного продукта, а также продукта после растворения. Результаты представлены в Таблице 7.
Пример 6. Лиофилизированный состав (0,5×106 IU IFN гамма и 3,0×106IU IFN альфа 2b на ампулу).
Композиция: IFN гамма - 1,0×108 UI, IFN альфа 2b - 6,0×108 UI, калий фосфорнокислый однозамещенный - 0,0802 г, натрий фосфорнокислый двузамещенный 2-водный - 0,249 г, сахароза - 4 г, глицин - 0,8 г, Tween 20 - 0,03 г, полиэтиленгликоль 6000 - 1 г, вода для инъекции в достаточном количестве - 100 мл. Cпособ приготовления был тот же, что и для лиофилизированного состава в примере 5.
С определенными временными интервалами образцы отбирали и анализировали содержание остаточной влажности продукта, содержание IFN гамма и IFN альфа 2b (при помощи ELISA), биологической активности, степень гомогенности при помощи RP-HPLC и внешний вид лиофилизированного продукта, а также продукта после растворения. Результаты представлены в Таблице 8.
Пример 7: Клиническое испытание устойчивого лиофилизированного фармацевтического состава (0,5×106 IU IFN гамма и 3,0×106 IU IFN альфа 2b на ампулу). Применение внутриопухолевое в CBC.
Стабильный лиофилизированный фармацевтический состав, описанный в примере 6, применяли при проведении в трех повторностях вслепую контролируемого, рандомизированного клинического испытания, в которых участвовало 59 больных с клиническим и гистологическим диагнозами CBC любых локализаций и любого типа кожи с опухолями диаметром менее четырех сантиметров. Больные были разделены случайным образом на три группы лечения. Опухоли обрабатывали внутриопухолево половиной доз рекомбинантного IFN альфа 2b (1,5×106IU/мл); или рекомбинантного IFN гамма (0,25×106 IU/мл) или устойчивого лиофилизированного состава (0,5×106 IU IFN гамма и 3,0×106 IU IFN альфа 2b на ампулу) для групп I, II и III, соответственно. IFN применяли три раза в неделю, во время трех последующих недель, в продолжении 9 недель, раз в неделю, или до полного исчезновения опухоли, до момента, в который оценивалась клиническая эффективность лечения. 9,5%, 35,3% и 5,3% опухолей группы с IFN альфа 2b, IFN гамма и составом (0,5×106 IU IFN гамма и 3,0×106IU IFN альфа 2b на ампулу), соответственно, уменьшились в своем размере менее чем на 50%. У оставшихся опухолей наблюдали 90,5%, 57,9% и 94,7% (группа I, II и III, соответственно) объективный ответ (полное исчезновение или уменьшение на более чем 50% от первоначального размера). Ни одна из опухолей не прогрессировала (см. Таблицу 9). В группе «больных, которые не закончили лечение» наблюдали преимущество при лечении составом, который содержит рекомбинантные IFNs гамма и альфа 2b с синергичным антипролиферативным эффектом (17% различия по отношению к лечению IFN альфа 2b и 27% различия по отношению к IFN гамма). В группе «больных, с лечением менее 11 недель» наблюдали преимущество состава. Приблизительно 30% различия в отношении IFN гамма и 27% в отношении IFN альфа 2b. Соотношение полного ответа было выше (>40% преимущества в отношении лечения IFN альфа 2b и >30% в отношении лечения IFN гамма). У больных, получивших менее 12 инъекций, был достигнут 100%-й благоприятный ответ (среди них 50% - RC) в группе лечения составом. В других 2 группах лечения процентное соотношение благоприятного ответа составляло 67% (среди них 33,3% - RC), которые свидетельствует о достижении приблизительно 33%-ного различия в пользу комбинированного лечения. См. Таблицу 9.
Как можно видеть из Таблицы 10, с стабильным лиофилизированным составом, который содержит рекомбинантные IFNs гамма и альфа 2b, можно достичь клинический полный ответ за более короткий период времени, чем с интерферонами по отельности, с различием на приблизительно 4 недели раньше в сравнении с IFN альфа.
При отсутствии лечения наблюдали образование келоидов, и наоборот, во всех случаях лечения имело место образование хорошего рубцевания опухоли с нормальной чувствительностью, нормальной или слегка уменьшенной упругостью и отсутствием сухости, слабости и шероховатости. Что касается цвета, то у большинства больных, подвергавшихся лечению составом, наблюдался нормальный цвет участка лечения (47,4%), вдвое по сравнению с группой с IFN альфа (28,6%). В конце испытания в группе, подвергавшейся лечению составом, наблюдали более высокое процентное соотношение плоских насечек (63,2%) по сравнению с группой, подвергавшейся лечению только IFN альфа 2b (52,4%), что демонстрирует Таблица 11.
Комбинация интерферонов не усиливает побочные эффекты, поскольку не были отмечены статистические различия между группами лечения в отношении их появления или интенсивности. В большинстве случаев они были незначительными (71,2%) или умеренными и хорошо переносимыми. Сами они не наблюдали ни побочных серьезных, ни очень серьезных эффектов. (Таблица 12).
Как можно видеть из этой таблицы, наиболее частыми побочными эффектами в каждой группе лечения были: лихорадочное состояние (38,5%; 60,8% и 26,2%), мышечная боль (38,5%; 3,9% и 31%) и озноб (12,8%; 19,6% и 21,4%) для IFN альфа, IFN гамма и комбинации, соответственно. Общее число наблюдаемых побочных эффектов было немного выше в группе больных, подвергшихся лечению IFN гамма.
В целом, комбинированное лечение дает 32%-е преимущество в отношении полного ответа, приблизительно на 4 недели раньше и на 25% меньшим количеством инъекций по сравнению с группой IFN альфа. Комбинация не вызывала побочных эффектов и каких-либо рецидивов в течение одного года после завершения лечения у больных с полным клиническим ответом. С косметической точки зрения результат был очень хорошим, приводя, главным образом, к плоским и нормохромным ранам.
Пример 8: Результаты применения (из сострадания) смеси рекомбинантных IFNs гамма и альфа 2b у больных с опухолями кожи, нечувствительными к стандартному лечению. История болезни.
Больной 1
Больной EPR: HC: 302396 Возраст: 82 года, Пол: Мужской, персональный антецедент патологий (APP): n/r Направлен в National Institute of Oncology и Radiology (INOR) 17/10/01 с опухолью кожи в передней области груди, прошел электрофорестизационное лечение, опухоль после этого переросла в ульцерозную форму, удалена хирургическим путем 03/07/01. Результат: Не полностью удаленная спиноцеллюларная карцинома. Больной получил стойкое опухолевое образование в 3 см на месте первоначальной опухоли, с высокой кромкой. При физикальном обследовании метастазирующее кистообразное образование не обнаружено. Была показана лучевая терапия опухоли, которая закончилась 29/01/02: 60co 50 Gy+X-Rays 12 Gy. Суммарная доза составила 62gy на опухоль.
Месяцем позже у больного наблюдалась неизменяемая опухоль в области ключицы и на нижней трети эстерноклейдомастоидной мышцы. Через короткое время опухоль возобновила быстрый рост, образовав 04/03/02 сильноязвенную рану 10×8 см на внутренней трети правой ключицы, в области шеи и части грудины, все в направлении предыдущей части груди. Ему было предложено хирургическое вмешательство. В проведении хирургического вмешательства было отказано из-за его 82-летнего возраста и из-за высокого операционного риска. Затем было рекомендовано внутриопухолевое введение IFN.
Опухоль большого размера (12,5×9 см и 1-1,5 см в толщину) была фиксирована на кости и мышце. Применение IFN было запланировано в трех секторах периметра. Каждый сектор пропитывали 1,5 мл раствора в приблизительно 5 см3 марли (1,5×1,5×1,5) с дозой в 0,5×106 IU IFN гамма + 6×106 IU IFN альфа 2b в 6 мл воды для инъекции, три раза в неделю в течение трех недель (фиг. 7a). После пятого применения продукта (вторая неделя) было принято решение применить увеличенную дозу IFN гамма (двойная, 1×106 IU). Предложение увеличить дозу было сделано с целью попытки достижения лучшего результата для такой большой опухоли из-за отсутствия побочных эффектов от предыдущих дозировок и из предшествующей информации о клиническом исследовании, в котором был продемонстрирован синергичный эффект обоих интерферонов.
В целом больной получил 27 применений с общей дозой 25×106 IU IFN гамма + 162×106 IU IFN альфа 2b за два месяца лечения. При пятом применении был оценен уровень кромки раны в сравнении с уровнем нормальной кожи (фиг. 7b). Через месяц после начала лечения больной ссылается на сильную боль в верхней правой конечности, отмечено проникновение в плечевое нервное сплетение, выдержка, некроз и трещина ключицы. При применении #20 наблюдали, что рост опухоли прекратился в участке инъекции, но не в центре опухоли, где она росла в дольчато-подобном виде (фиг. 7c). Это состояние наблюдали даже при применении 24. Кроме того, в центре опухолевой язвы появился сепсис и некроз. Ровно через два месяца после начала лечения (применение #27) больной испытал интенсивное артериальное кровотечение из подключичной артерии; гемоглобин у больного понизился до 80 г/л, и лечение было прервано на 15 дней, по окончании которых оно было продолжено из-за продолжающегося кровотечения и наступления нарастающей слабости. Больной скончался через два месяца от разрыва артерии. Участок инъекций оставался без роста опухоли. Во время первых восьми применений были отмечены побочные эффекты типа лихорадочного состояния (39°C), озноба, околоопухолевой эритемы и астении, но все они со слабой интенсивностью и кратковременные. Заключения: Клинический ответ был достигнут в участках инъекции, продолжался в течение, по меньшей мере, двух месяцев, побочные эффекты были незначительными.
Больной 2
Больной LGR: HC: 158390 возраст: 65 лет Пол: Женский, APP: n/r. Больной, который страдает от множественных карцином, расположенных по всему лицу. Больной несколько раз подвергался хирургическому вмешательству и облучению нижнего века левого глаза с пересадками. Сейчас демонстрирует рецидив опухоли диаметром 5 мм на краю века и другую плоскую штамоподобную рану под веком в направлении скулы (фиг. 8a). Альтернативным лечением могла бы быть новая хирургическая операция, нежелательная в случае уже проведенного множественного лечения. На верхнем веке того же глаза имеется другая базально-клеточная эпителиома в 7 мм, которую ранее не лечили.
08/05/02 предложено лечение при помощи внутриопухолевого введения IFN (0,5×106 IU IFN гамма + 3×106 IU IFN альфа 2b) в 4 мл, три раза в неделю в течение трех недель. В целом больной получил 10 применений с общей дозой 35×106 IU интерферона (5×106 IU IFN гамма + 30×106 IU IFN альфа 2b). После проведения одной четверти введений штамоподобная рана исчезла и на веке на участке опухоли образовалась некротическая язва (фиг. 8b). Через два месяца после лечения опухоль на веке не наблюдалась и исчезла штамоподобная плоская рана скулы (фиг. 8c). Был получен локально-местный эффект. Наблюдали 50%-е уменьшение базально-клеточной эпителиомы верхнего века левого глаза, которую не обрабатывали непосредственно IFN, которая затем была удалена хирургическим путем. Спустя три года больному все еще под контролем пропитывали опухоль IFN. Были отмечены некоторые побочные эффекты со слабой интенсивностью и кратковременные, типа лихорадочного состояния (39°C), озноба и хемоза подвергнутого лечению глаза, которые облегчали при помощи холодных компрессов.
Заключение: Больной с полным клиническим ответом до августа 2005 года (последняя проверка), минимальный побочный эффект.
Пример 9. Лиофилизированный состав (0,5×106 IU IFN гамма и 10×106IU IFN альфа 2b на ампулу).
Композиция: IFN гамма - 1,0×108 UI, IFN альфа 2b - 20×108 UI, калий фосфорнокислый однозамещенный - 0,0802 г, натрий фосфорнокислый двузамещенный 2-водный - 0,249 г, сахароза - 4 г, глицин - 0,8 г, Tween 20 - 0,03 г, полиэтиленгликоль 6000 - 1 г, вода для инъекции в достаточном количестве - 100 мл.
Cпособ приготовления был тот же, что и для лиофилизированного состава в примере 5.
С определенными временными интервалами образцы отбирали и анализировали содержание остаточной влажности продукта, содержание IFN гамма и IFN альфа 2b (при помощи ELISA), биологической активности, степень гомогенности при помощи RP-HPLC и внешний вид лиофилизированного продукта, а также продукта после растворения. Результаты представлены в Таблице 13.
Пример 10. Применение устойчивого лиофилизированного состава, составленного из 0,5 MIU IFN гамма и 10,0 MIU IFN альфа 2b/ампулу в комбинация с цисплатином. История болезни.
Больной 3
Больной JGA: HC: возраст: 33 года, Пол: Мужской, APP: Больной n/r помещен в INOR с базально-клеточной эпителиомой, которая пронизывает внутренний угол левого глаза, с несколькими хирургическими вмешательствами, и подвергавшийся облучению. В настоящее время больной имеет изъязвленную опухоль, которая достигает костей основания скулы (фиг. 9a). При проверке с помощью аксиальной компьютерной томографии (TAC) наблюдали полость в собственных костях носа и внутренней стенке глазницы, невыносимо дурнопахнущую, которая переходит в левую ноздрю, и гнойное желтое выделение в том же участке.
Из-за углубления раны было принято решение провести комбинированное лечение с системной химиотерапией с цисплатином с дозировкой в 6 циклов с интервалами в 21 день и в то же время введением состава (0,5 MIU IFN гамма и 10,0 MIU IFN альфа 2b/ампулу) локально 3 раза в неделю в течение трех недель.
В конце третьего применения уже наблюдали существенный частичный клинический ответ, который давал возможность пальпебрального открытия и уменьшения зловония. Одновременно имел место хемоз умеренной интенсивности. Полный клинический ответ оценивали через месяц. Этот ответ сохранялся до окончания химиотерапии. Побочных эффектов было немного, некоторое лихорадочное состояние и озноб и боль в участке шрама от раны. Через год у больного сохранялся полный клинический ответ (фиг. 9b).
Пример 11. Жидкий стабильный фармацевтический состав (1,4×106 IU INF гамма и 1,7×106 IU INF альфа 2b на ампулу).
Композиция: IFN гамма - 2,8×108 IU, IFN альфа 2b - 3,4×108 IU, ацетат натрия - 0,708 г, уксусная кислота - 0,079 мл, Tween 20 0,01 г, маннит - 5 г, вода для инъекции в достаточном количестве - 100 мл.
Все компоненты, за исключением интерферонов, отмеряли и суспендировали в воде для инъекций. pH раствора проверяли и при необходимости доводили до значения 7,2 ± 0,2 разбавленной (1:2) уксусной кислотой или 1M NaOH. Были добавлены активные фармацевтические ингредиенты интерферонов IFN гамма и IFN альфа 2b и разведены до соответствующей концентрации.
Раствор фильтровали в стерильных условиях. Ампулы заполняли составом и закрывали и запечатывали в зоне со 100 ячейками. Наконец, продукт хранили при температуре от 2 до 8°C. Некоторые образцы отбирали из произведенного состава и хранили при температуре от 2 до 8°C в течение шести месяцев.
С определенными временными интервалами образцы отбирали и анализировали содержание остаточной влажности продукта, содержание IFN гамма и IFN альфа 2b (при помощи ELISA), биологической активности, степень гомогенности при помощи RP-HPLC и внешний вид лиофилизированного продукта, а также продукта после растворения. Результаты представлены в Таблице 14.
Пример 12. Жидкий стабильный фармацевтический состав (0,5×106 IU INF гамма и 3,0×106 IU INF альфа 2b на ампулу).
Композиция: IFN гамма - 2,0×108 IU, IFN альфа 2b - 12,0×108 IU, ацетат натрия - 0,708 г, уксусная кислота - 0,079 мл, Tween 20 0,01 г, маннит - 5 г, вода для инъекции в достаточном количестве - 100 мл.
Способ приготовления был тот же, что и описанный для лиофилизированного состава в примере 11.
С определенными временными интервалами образцы отбирали и анализировали содержание остаточной влажности продукта, содержание IFN гамма и IFN альфа 2b (при помощи ELISA), биологической активности, степень гомогенности при помощи RP-HPLC и внешний вид лиофилизированного продукта, а также продукта после растворения. Результаты представлены в Таблице 15.
Пример 13. Жидкий стабильный фармацевтический состав (0,5×106 IU INF гамма и 10×106 IU INF альфа 2b на ампулу).
Композиция: IFN гамма - 2,0×108 IU, IFN альфа 2b - 40,0×108 IU, ацетата натрия 0,708 г, уксусной кислоты 0,079 мл, Tween 20 0,01 г, маннита 5 г, вода для инъекции в достаточном количестве - 100 мл.
Способ приготовления был тот же, что и описанный для лиофилизированного состава в примере 11.
С определенными временными интервалами образцы отбирали и анализировали содержание остаточной влажности продукта, содержание IFN гамма и IFN альфа 2b (при помощи ELISA), биологической активности, степень гомогенности при помощи RP-HPLC и внешний вид лиофилизированного продукта, а также продукта после растворения. Результаты представлены в Таблице 16.
Пример 14. Полутвердый фармацевтический состав (0,16×106 IU INF гамма и 1,0×106 IU INF альфа 2b на грамм полутвердого).
Фармацевтический состав для местного применения, предпочтительно в виде крема, мази или геля. Фармацевтический препарат содержит рекомбинантные интерферон гамма и альфа интерферон 2 в качестве действующего начала. Композиция представляет собой 1,6×107 IU INF гамма и 1×108 IU INF альфа 2b, достаточное количество для 100 грамм полутвердого.
Приготовление крема: Для приготовления крема твердый вазелин и цетиловый спирт растапливают при 75°C и перемешивают с постоянным покачиванием, поддерживая до окончания процесса. Гомогенизированный один раз Tween 60 объединяют со смесью. С другой стороны, метилпарабен и пропилпарабен растворяют в воде при 90°C и объединяют с предыдущей смесью, когда температура уменьшается до 75°C. Затем эмульсию медленно охлаждают до 37°C и объединяют с водным раствором, который содержит рекомбинантный IFN гамма и IFN альфа 2b. Образовавшийся крем хранят при 4°C в 15 г тюбиках (см. Таблицу 17).
Приготовление мази: В резервуаре парааминобензойные кислоты растворяют в воде при 90°C и затем оставляют охлаждаться до 37°C. В другом резервуаре при постоянном взбалтывании перемешивают жидкий вазелин и Span 20. Затем содержание обоих резервуаров смешивают и, когда температура опустится ниже 37°C, объединяют с рекомбинантными IFN гамма и IFN альфа 2b, поддерживая непрерывное взбалтывание. Затем его объединяют с белым вазелином до получения гомогенизации. Образовавшуюся мазь хранят при 4°C в 15 г тюбиках (см. Таблица 18).
Приготовление геля: EDTA, парабены и спирт растворяют в отдельном резервуаре и затем добавляют пропиленгликоль. Затем эти растворы смешивают при постоянном взбалтывании и медленно добавляют карбопол 940 с энергичным взбалтыванием до получения густой дисперсии без присутствия комков. Отдельно в соответствующем резервуаре готовят раствор 1N гидрохлорида натрия и медленно добавляют с взбалтыванием к дисперсии, которая содержит остальные компоненты состава. Затем при слабом перемешивании добавляют IFN гамма и IFN альфа 2b. После приготовления гель разливают в 15 г тюбики при 4°C (см. Таблицу 19).
Реферат
Изобретение относится к медицине и фармакологии и представляет собой стабильный фармацевтический состав для парентерального применения, который содержат в одном резервуаре фиксированные дозы рекомбинантных интерферонов гамма и альфа 2b для лечения патологических явлений, характеризующихся доброкачественным нефизиологическим или злокачественным клеточным ростом тканей или органов, и который дополнительно содержат фармацевтически приемлемые наполнители или носители. Изобретение обеспечивает повышенную эффективность лечения опухолей за счет синергетического воздействия компонентов состава, а также стабильность составов. 2 н. и 16 з.п. ф-лы, 19 табл., 9 ил.
Формула
Документы, цитированные в отчёте о поиске
Способы и препараты для лечения заболеваний интерфероном, характеризующиеся сниженными побочными эффектами

Комментарии