Производное даидзеина, его фармацевтически приемлемая соль и способ получения, а также содержащая его фармацевтическая композиция - RU2586978C2
Код документа: RU2586978C2
Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к области фармацевтической химии, в частности к производному дайдзеина, его фармацевтически приемлемой соли, способу его получения и к фармацевтическому применению этого соединения для защиты от сердечно-сосудистых заболеваний.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Сердечно-сосудистые заболевания, также известные как заболевания системы кровообращения, представляют собой группу заболеваний, вызванных повреждениями сердца и сосудов. Специфичные симптомы сердечно-сосудистых заболеваний включают боли в сердце, гипертензию и гиперлипидемию и т.д. Сердечно-сосудистые заболевания являются серьезным заболеванием, угрожающим здоровью человека, и являются второй после рака причиной смерти. Кроме того, десятки тысяч людей утратили трудоспособность в связи с тем, что ежегодно страдают от сердечно-сосудистых нарушений.
В настоящее время лекарственное средство на основе изофлавонов является сравнительно важным видом лекарственных средств среди лекарственных средств для лечения сердечно-сосудистых заболеваний. Исследования показали, что лекарственное средство на основе изофлавонов не только обладает эффектами расширения коронарной артерии, бедренной артерии и мозговой артерии, но также обладает различными эффективностями, такими как увеличение объемного кровотока головного мозга, усиление кровообращения в конечностях, снижение вязкости крови, ослабление сосудистого сопротивления, снижение потребления кислорода в миокарде, улучшение функции сердца, усиление микроциркуляции, усиление периферического объемного кровотока, изменение реологии крови, снижение кровяного давления и улучшение частоты сердечных сокращений и т.д.
Пуэрарин и дайдзеин являются представителями в данных лекарственных средствах на основе изофлавонов, тем не менее, поскольку они ограничены природными источниками, выход пуэрарина и дайдзеина, экстрагируемых естественным путем, низок и чистота продукта мала. Кроме того, эти два лекарственных средства с трудом всасываются организмом человека вследствие их слабой растворимости в воде, что приводит в результате к низкой биодоступности.
Хотя в документе US 6121010 A раскрыт 7-O-N,N-диметил-аминобутирил-дайдзеин, это соединение функционирует только как ингибитор ферментативной системы некоторых нейротрансмиттеров (таких как 5-гидрокситриптамин 5-ГТ и дофамин ДА), используемых для ингибирования окисления ацетальдегида (образующегося посредством метаболизма 5-ГТ или ДА посредством моноаминоксидазы), и применяется для лечения алкогольной зависимости и злоупотребления алкоголем, данный патент не относится к применению этого соединения для лечения сердечно-сосудистых заболеваний.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В целях решения вышеописанных задач целью настоящего изобретения является разработка нового соединения, которое можно применять для лечения сердечно-сосудистых заболеваний, и, по сравнению с предшествующим уровнем техники, это новое соединение обладает более высокой растворимостью и лучшим терапевтическим эффектом в отношении сердечно-сосудистых заболеваний.
Другая цель настоящего изобретения состоит в разработке способа получения этого соединения.
Другая цель настоящего изобретения, кроме того, состоит в разработке фармацевтической композиции, содержащей это соединение.
Другая цель настоящего изобретения, кроме того, состоит в разработке фармацевтического применения этого соединения и фармацевтической композиции.
Технические решения настоящего изобретения состоят в следующем.
В одном аспекте в настоящем изобретении предложено производное дайдзеина, имеющее структуру, представленную формулой (I), или его фармацевтически приемлемая соль:
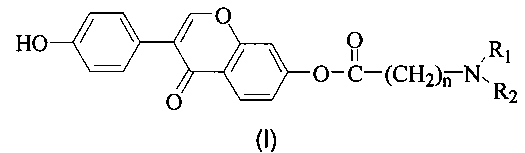
где R1 и R2, каждый независимо, представляют собой Н, замещенный или незамещенный С1-10 алкил или R1 и R2 вместе с атомом N, с которым они связаны, образуют замещенную или незамещенную 5-10-членную гетероциклическую группу, и, при наличии заместителей, С1-10 алкил или 5-10-членная гетероциклическая группа имеет заместитель, выбранный из С1-10 алкила, гидроксила, карбоксила или галогена; n равно 0, 1, 2, 3, 4 и 5 и производное дайдзеина не включает 7-O-N,N-диметил-аминобутирил-дайдзеин.
Предпочтительно R1 и R2, каждый независимо, представляют собой Н, замещенный или незамещенный С1-10 алкил, где при его замещении С1-10 алкил имеет заместитель, выбранный из гидроксила, карбоксила или галогена.
Кроме того, предпочтительно R1 и R2, каждый независимо, представляют собой Н или незамещенный С1-10 алкил; где С1-10 алкил предпочтительно представляет собой С1-6 алкил и более предпочтительно С1-4 алкил.
Предпочтительно n равно 1, 2 или 3.
Согласно конкретным воплощениям настоящего изобретения С1-4 алкил представляет собой, например, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил или гептил; 5-10-членная гетероциклическая группа представляет собой, например, пирролидинил, пиперидинил или морфолинил.
Далее в настоящем изобретении предложена фармацевтически приемлемая соль производного дайдзеина, имеющего структуру, представленную формулой (I). Фармацевтически приемлемая соль представляет собой соль, образованную производным дайдзеина, имеющим структуру, представленную формулой (I), и органической кислотой или неорганической кислотой; предпочтительно органическая кислота выбрана из группы, состоящей из уксусной кислоты, трифторуксусной кислоты, метансульфоновой кислоты, толуолсульфоновой кислоты, малеиновой кислоты, янтарной кислоты, винной кислоты, лимонной кислоты или фумаровой кислоты; неорганическая кислота выбрана из группы, состоящей из соляной кислоты, бромисто-водородной кислоты, азотной кислоты, серной кислоты или фосфорной кислоты.
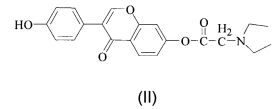
Согласно конкретным воплощениям настоящего изобретения производное дайдзеина имеет структуру, как показано в формуле (II):

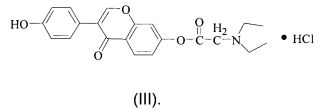
фармацевтически приемлемая соль представляет собой гидрохлорид, имеющий структуру, как показано в формуле (III):

В другом аспекте в настоящем изобретении дополнительно предложен способ получения производного дайдзеина или его фармацевтически приемлемой соли, включающий следующие стадии:
а) взаимодействие дайдзеина и галогенированного алкилацилгалогенида с получением галогенированного алкилацилдайдзеина:

где X представляет собой F, Cl, Br или I;
b) взаимодействие галогенированного алкилацилдайдзеина и амина, представленного формулой (IV), с получением производного дайдзеина:

и
с) возможно преобразование производного дайдзеина в его фармацевтически приемлемую соль;
R1, R2 и n являются такими, как определено выше.
Где стадия а) конкретно включает:
взаимодействие дайдзеина и галогенированного алкилацилгалогенида с пиридином в качестве катализатора в первом органическом растворителе с получением галогенированного алкилацилдайдзеина.
Предпочтительно первый органический растворитель представляет собой органический растворитель, выбранный из спиртов, галогенированных углеводородов, простых эфиров, кетонов или сложных эфиров либо их смеси; где органический растворитель, выбранный из спиртов, выбран из одного или более из группы, состоящей из метанола, этанола, изопропанола, н-пропанола, н-бутанола и трет-бутанола; органический растворитель, выбранный из галогенированных углеводородов, выбран из одного или более из группы, состоящей из дихлорметана, хлороформа и 1,2-дихлорэтилена; органический растворитель, выбранный из простых эфиров, выбран из одного или более из группы, состоящей из тетрагидрофурана, диэтилового эфира, изопропилового эфира, анизола и метил-трет-бутилового эфира; органический растворитель, выбранный из кетонов, выбран из одного или более из группы, состоящей из ацетона, метилизобутилкетона, бутанона и метил-н-бутилкетона; органический растворитель, выбранный из сложных эфиров, выбран из одного или более из группы, состоящей из этилацетата, изобутилацетата, бутилацетата и изопропилацетата; более предпочтительно первый органический растворитель представляет собой ацетон.
Согласно настоящему изобретению во время взаимодействия дайдзеина и галогенированного алкилацилгалогенида температура реакционной смеси составляет 0°С-25°С, более предпочтительно 1°С-15°С и более предпочтительно 2°С-5°С; время реакции предпочтительно составляет 1-10 ч, более предпочтительно 2-8 ч и более предпочтительно 3-7 ч.
Массовое отношение первого органического растворителя и пиридина в настоящем изобретении конкретно не ограничено. Массовое отношение дайдзеина и галогенированного алкилацилгалогенида составляет 1:10-2:5 и более предпочтительно 1:8-3:6. Концентрация дайдзеина в первом органическом растворителе в настоящем изобретении конкретно не ограничена, и концентрация дайдзеина в первом органическом растворителе предпочтительно составляет 0,05 моль/л - 0,2 моль/л, более предпочтительно 0,08 моль/л - 0,18 моль/л, более предпочтительно 0,09 моль/л - 0,15 моль/л и наиболее предпочтительно 0,1 моль/л - 0,12 моль/л.
Согласно настоящему изобретению после того, как галогенированный алкилацилдайдзеин получен посредством вышеописанной реакции, продукт реакции фильтруют, промывают и высушивают. Операции фильтрования, промывания и высушивания можно выполнять согласно способу, хорошо известному специалистам в данной области техники, который в настоящем изобретении конкретно не ограничен. Полученный галогенированный алкилацилдайдзеин может быть дополнительно очищен согласно способу перекристаллизации, хорошо известному специалистам в данной области техники.
Согласно настоящему изобретению на стадии b) галогенированный алкилацилдайдзеин далее подвергают взаимодействию с амином, соответствующим формуле

с получением производного дайдзеина, где стадия b) конкретно включает:
растворение галогенированного алкилацилдайдзеина, полученного на стадии а), во втором органическом растворителе, добавление карбоната калия и йодида калия, а затем добавление

нагревание с обратным холодильником с получением производного дайдзеина в результате взаимодействия.
Предпочтительно второй органический растворитель представляет собой органический растворитель, выбранный из спиртов, галогенированных углеводородов, простых эфиров, кетонов или сложных эфиров либо их смеси; где органический растворитель, выбранный из спиртов, выбран из одного или более из группы, состоящей из метанола, этанола, изопропанола, н-пропанола, н-бутанола и трет-бутанола; органический растворитель, выбранный из галогенированных углеводородов, выбран из одного или более из группы, состоящей из дихлорметана, хлороформа и 1,2-дихлорэтилена; органический растворитель, выбранный из простых эфиров, выбран из одного или более из группы, состоящей из тетрагидрофурана, диэтилового эфира, изопропилового эфира, анизола и метил-трет-бутилового эфира; органический растворитель, выбранный из кетонов, выбран из одного или более из группы, состоящей из ацетона, метилизобутилкетона, бутанона и метил-н-бутилкетона; органический растворитель, выбранный из сложных эфиров, выбран из одного или более из группы, состоящей из этилацетата, изобутилацетата, бутилацетата и изопропилацетата; также предпочтительно второй органический растворитель идентичен первому органическому растворителю на стадии а); более предпочтительно второй органический растворитель представляет собой ацетон.
Согласно настоящему изобретению время реакции с обратным холодильником предпочтительно составляет по меньшей мере 1 ч, более предпочтительно по меньшей мере 2 ч и наиболее предпочтительно по меньшей мере 3 ч.
После того как производное дайдзеина получено посредством вышеописанной реакции, смесь после реакции охлаждают до комнатной температуры, фильтруют, промывают и концентрируют. Предпочтительно после концентрирования к полученному продукту добавляют ацетон для перегонки, затем промывают безводным этанолом, а затем высушивают безводным сульфатом натрия.
Далее в настоящем изобретении предложена фармацевтически приемлемая соль дайдзеина, предпочтительно гидрохлорид. Согласно настоящему изобретению на стадии с) полученное производное дайдзеина может быть использовано для получения гидрохлорида производного дайдзеина, где стадия с) конкретно включает:
растворение производного дайдзеина, полученного на стадии b), в третьем органическом растворителе, затем добавление органической или неорганической кислоты, так что производное дайдзеина может взаимодействовать с кислотой с образованием фармацевтически приемлемой соли производного дайдзеина; затем соль может быть получена путем фильтрования и концентрирования;
предпочтительно растворение производного дайдзеина, полученного на стадии b), в третьем органическом растворителе, а затем пропускание сухого газа HCl или добавление соляной кислоты и проведение фильтрования и концентрирования с получением гидрохлорида производного дайдзеина,
где третий органический растворитель представляет собой органический растворитель, выбранный из спиртов, галогенированных углеводородов, простых эфиров, кетонов или сложных эфиров либо их смеси; где органический растворитель, выбранный из спиртов, выбран из одного или более из группы, состоящей из метанола, этанола, изопропанола, н-пропанола, н-бутанола и трет-бутанола; органический растворитель, выбранный из галогенированных углеводородов, выбран из одного или более из группы, состоящей из дихлорметана, хлороформа и 1,2-дихлорэтилена; органический растворитель, выбранный из простых эфиров, выбран из одного или более из группы, состоящей из тетрагидрофурана, диэтилового эфира, изопропилового эфира, анизола и метил-трет-бутилового эфира; органический растворитель, выбранный из кетонов, выбран из одного или более из группы, состоящей из ацетона, метилизобутилкетона, бутанона и метил-н-бутилкетона; органический растворитель, выбранный из сложных эфиров, выбран из одного или более из группы, состоящей из этилацетата, изобутилацетата, бутилацетата и изопропилацетата; также предпочтительно третий органический растворитель идентичен первому органическому растворителю на стадии а); более предпочтительно третий органический растворитель представляет собой метанол.
Согласно настоящему изобретению полученная фармацевтически приемлемая соль производного дайдзеина может быть также перекристаллизована согласно способу, хорошо известному специалистам в данной области техники для проведения дополнительной очистки.
Еще в одном другом аспекте в настоящем изобретении предложена фармацевтическая композиция, содержащая вышеописанное производное дайдзеина или его фармацевтически приемлемую соль. В фармацевтической композиции по настоящему изобретению применяют производное дайдзеина или его фармацевтически приемлемую соль, предпочтительно гидрохлорид, в качестве активного ингредиента, и она может быть получена в виде таблеток, пилюль, порошков, гранул, капсул, сиропов, эмульсий и других фармацевтических препаратов, хорошо известных специалистам в данной области техники. Фармацевтическая композиция может дополнительно содержать фармацевтически приемлемый носитель, хорошо известный специалистам в данной области техники, такой как наполнитель, связующее вещество, разрыхлитель, ароматизатор, средство для уничтожения запаха, эмульгирующий агент, разбавитель, сорастворитель и т.д., который в настоящем изобретении конкретно не ограничен.
Еще в одном другом аспекте в настоящем изобретении предложено применение вышеописанного производного дайдзеина или его фармацевтически приемлемой соли и фармацевтической композиции при получении лекарственного средства для лечения сердечно-сосудистого заболевания; предпочтительно сердечно-сосудистое заболевание представляет собой гипертензию, сердечную недостаточность, стабильную или нестабильную стенокардию, заболевание сердечных и периферических сосудов, аритмию, тромбоэмболическое заболевание и локальную ишемию, а также заболевание, требующее улучшения или усиления способности к перенесению гипоксии; где локальная ишемия предпочтительно представляет собой инфаркт миокарда, удар, транзиторную ишемическую атаку, заболевание периферического кровообращения, атеросклероз или фибротическое заболевание.
По сравнению с предшествующим уровнем техники производное дайдзеина по настоящему изобретению обладает лучшим терапевтическим эффектом в отношении сердечно-сосудистых заболеваний, а фармацевтически приемлемая соль производного дайдзеина, особенно гидрохлорид производного дайдзеина, обладает более высокой растворимостью.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение проиллюстрировано со ссылкой на конкретные примеры. Специалистам в данной области техники понятно, что эти примеры предназначены только для иллюстрации настоящего изобретения без какого-либо ограничения настоящего изобретения.
Все экспериментальные методы в приведенных ниже примерах представляют собой традиционные методы, если явным образом не указано иное; все экспериментальные материалы, использованные в нижеследующих примерах, приобретены в обычных магазинах биохимических реагентов, если явным образом не указано иное.
Пример 1. Получение 7-О-хлорацетилдайдзеина
10,0 г дайдзеина и 25 мл безводного пиридина растворяли в 400 мл ацетона с получением первого смешанного раствора и первый смешанный раствор перемешивали механически и поддерживали при 0°С, а затем к нему медленно добавляли по каплям 27,3 хлорацетилхлорид и после завершения добавления по каплям первый смешанный раствор поддерживали при 0°С и продолжали подвергать взаимодействию в течение 2 ч и затем естественным путем подогревали до комнатной температуры и продолжали подвергать взаимодействию в течение 2 ч, а затем брали образец первого смешанного раствора и определяли с помощью тонкослойной хроматографии (ТСХ) (об. (петролейный эфир) : об. (этилацетат) = 1:1), и результат определения показал, что реакция завершена.
Смесь после взаимодействия фильтровали и фильтровальный кек промывали водой, чтобы значение pH достигло рН=7,0, а затем высушивали в вакууме с получением 12,0 г 7-О-хлорацетилдайдзеина при выходе 93%.
Путь реакции является таким, как показано ниже:

Пример 2. Получение 7-O-N,N-диэтил-аминоацетилдайдзеина гидрохлорида
При комнатной температуре 8,8 г 7-О-хлорацетилдайдзеина, полученного в Примере 1, 12,0 г карбоната калия и 10,0 г йодида калия растворяли в 300 мл ацетона, и смесь перемешивали механически, затем к ней добавляли 20 мл диэтиламина (ДЭА), а затем полученную в результате смесь нагревали до 80°С и кипячение с обратным холодильником выполняли в течение 4 ч, ТСХ (об. (петролейный эфир) : об. (этилацетат) = 1:1) показала, что реакция завершена. Смесь охлаждали, фильтровали и промывали ацетоном в процессе фильтрования и фильтраты объединяли, промывали и концентрировали, затем в смесь добавляли 20 мл ацетона и продолжали перегонять до тех пор, пока она более не содержала жидкости, затем добавляли 40 мл безводного этанола и 6,0 г безводного сульфата натрия и высушивали в течение ночи. Смесь фильтровали, в фильтрат вводили сухой газ HCl до тех пор, пока твердое вещество более не осаждалось. Смесь фильтровали и перекристаллизовали безводным этанолом и высушивали в вакууме с получением 8,6 г твердого вещества, представляющего собой белый порошок, при выходе 80%.
1Н ЯМР (400 МГц, d6-ДМСО): 10.65 (s, 1Н, Н-4′), 8.46 (s, 1Н, Н-2), 7.98 (d, 1Н, J=8.8 Гц), 7.68 (d, 2Н, J=8.6 Гц, Н-2′, Н-6′), 7.32 (d, 2Н, J=8.6 Гц, Н3′, Н-5′), 6.97-7.02 (m, 2Н, Н-6, Н-8), 4.52 (s, 2Н, NCH2C=O), 3.31 (q, 4Н, J=7.2 Гц, -СН2СН3), 1.30 (t, 6Н, J=7.2 Гц, -СН2СН3). Масс-спектрометрия с ионизацией электрораспылением (ИЭР-МС): m/z=368,15 [М+1]+, 406,10 [М+39]+.
Путь реакции является таким, как показано ниже:

Пример 3. Лиофилизированный порошок 7-O-N,N-диэтил-аминоацетилдайдзеина гидрохлорида
Пропись:
Способ получения на основании прописи описан ниже.
Сначала бикарбонат натрия и гидроксид натрия в количестве на основании приведенной выше прописи взвешивали и растворяли в воде для инъекций, охлаждали до температуры ниже 5°С с помощью ледяной бани, а затем добавляли образец Примера 2 в количестве на основании приведенной выше прописи и растворяли и значение pH смеси доводили до 7,5 раствором гидроксида натрия, фильтровали и лиофилизировали с получением лиофилизированного порошка.
Пример 4. Эксперимент по растворимости
Экспериментальные материалы:
7-О-хлорацетилдайдзеин, полученный в Примере 1;
7-O-N,N-диэтил-аминоацетилдайдзеин, полученный в Примере 2;
7-O-N,N-диэтил-аминоацетилдайдзеина гидрохлорид, полученный в Примере 2;
дайдзеин.
В водяной бане при 25±5°С на вышеописанных материалах проводили эксперимент по равновесию в растворителе в течение по меньшей мере 20 часов путем использования 1 мл метанола, затем раствор фильтровали и высушивали на воздухе в течение 10 минут, после чего растворитель выпаривали в вакууме, соответствующие растворимости вышеуказанных веществ в растворителе измеряли посредством гравиметрического анализа, результаты которого представлены в таблице 1.

На основании результатов таблицы 1 видно, что 7-O-N,N-диэтил-аминоацетилдайдзеина гидрохлорид, полученный в настоящем изобретении, обладает более высокой растворимостью.
Пример 5. Фармакологический эксперимент
I. Эксперимент 1 - Эксперимент по антитромботическому действию с 7-O-N,N-диэтил-аминоацетилдайдзеина гидрохлоридом
i) Тестируемое лекарственное средство: лиофилизированный порошок, полученный в Примере 3, который растворяют дистиллированной водой при введении в живой организм и растворяют физиологическим раствором при введении in vitro и соответственно готовят в виде растворов желаемых концентраций.
ii) Подопытные животные: крыс линии Вистар массой 242±11,2 г, представляющих собой самцов крыс замкнутой системы неродственного разведения, приобретают в Институте изучения лабораторных животных Китайской академии медицинских наук, животных делят на 5 групп по 10 животных в каждой группе.
iii) Экспериментальный метод:
1. Общий кровоток артерия - яремная вена in vitro у крыс методом шунтирования (ссылка на статьи ″Journal of Changchun University of Traditional Chinese Medicine″, 2011, Volume 27, Issue 4, Pages 514-518, Yunfei Sun, Min Shi, ″Study on the Effect of Pueraria Injection on Thrombosis Formation, Cerebral Ischemia and Platelet Aggregation in Rats);
2. Метод определения тромбоза in vitro с помощью прибора (ссылка на статьи ″ACTA ACADEMIAE MEDICINAE PRIMAE SHANGHAI″, 1979, Volume 6, Issue 3, Pages 205-206, Chengzhu Li, Shichun Yang, Fengdi Zhao, ″Simple in vitro thrombosis apparatus and measuring method″).
iv) Схема дозировки, вычисленная в соответствии с эффективной дозой 7-O-N,N-диэтил-аминоацетилдайдзеина гидрохлорида:
1. Эксперимент в живом организме: доза составляет 50 мг/кг, 100 мг/кг, 200 мг/кг, и дозу вводят животным внутрижелудочно один раз в сутки в количестве 1 мл/100 г крысы в течение 3 последовательных суток;
2. Эксперимент in vitro: доза составляет 1,56 мг/кг, 3,12 мг/кг, 6,25 мг/кг, и эту дозу вводят непосредственно животным однократно.
v) Контроль эксперимента:
1. Холостая проба: животным вводят такой же объем дистиллированной воды в эксперименте на живом организме и вводят такой же объем физиологического раствора в эксперименте in vitro;
2. Положительный контроль: животным вводят ацетилсалициловую кислоту (производимую Northwest Second Synthetic Pharmaceutical Factory) в дозе 45 мг/кг в эксперименте на живом организме.
vi) Результаты эксперимента:
Антитромботические эффекты 7-O-N,N-диэтил-аминоацетилдайдзеина гидрохлорида представлены в таблице 2 и таблице 3:


На основании результатов таблицы 2 и таблицы 3 видно, что 7-O-N,N-диэтил-аминоацетилдайдзеина гидрохлорид, полученный по настоящему изобретению, обладает хорошим антитромботическим эффектом.
II. Эксперимент 2 - Эффекты соединений на толерантность к гипоксии мышей при нормальном давлении
Экспериментальные материалы:

Соединение примера по настоящему изобретению

4,7-двузамещенный дайдзеин

4-замещенный дайдзеин

Соединение, раскрытое в US 612101 OA (далее в настоящем описании называемое ″соединением Фармакопеи США (USP; от англ. US Pharmacopoeia)″)

Дайдзеин пуэрарии
70 мышей было отобрано и случайным образом разделено на семь групп; за исключением группы холостой пробы, которой не вводили ничего, и группы физиологического раствора, которой вводили такой же объем физиологического раствора, остальным пяти группам соответственно инъецировали интраперитонеально 25 мг/кг дайдзеина пуэрарии, 36 мг/кг соединения примера по настоящему изобретению, 47 мг/кг 4,7-двузамещенного дайдзеина, 36 мг/кг 4-замещенного дайдзеина и 36 мг/кг соединения USP (преобразованная доза каждого соединения эквивалентна дозе дайдзеина; поскольку дайдзеин с трудом растворяется в воде, для растворения использовали 50% водный раствор пропиленгликоля, а другие соединения растворяли в воде до достижения подходящей концентрации), через 20 мин после введения мышей помещали в банку с притертой пробкой на 250 мл (где было помещено 10 г натронной извести), по одной мыши в каждую банку, и после помещения мыши в банку ее плотно закрывали, затем сразу регистрировали время выживания мыши с помощью секундомера. Результаты представлены в таблице 4.

На основании результатов таблицы 4 видно, что соединение примера может значимо пролонгировать время толерантности к гипоксии мышей и обладает лучшим эффектом по сравнению с дайдзеином, и слабый эффект дайдзеина может быть вызван неполным всасыванием после введения вследствие его слабой растворимости в воде. Другие соединения для сравнения обладают слабыми эффектами. Это может быть связано с тем фактом, что эти соединения с трудом претерпевают гидролиз до дайдзеина, эффект которого осуществляется после проникновения в кровеносные сосуды.
III. Эксперимент 3 - Действия соединений на острую церебральную ишемию у мышей
70 мышей было отобрано и случайным образом разделено на семь групп; за исключением группы холостой пробы, которой не вводили ничего, и группы физиологического раствора, которой вводили такой же объем физиологического раствора, остальным пяти группам соответственно инъецировали интраперитонеально 25 мг/кг дайдзеина пуэрарии, 36 мг/кг соединения примера по настоящему изобретению, 47 мг/кг 4,7-двузамещенного дайдзеина, 36 мг/кг 4-замещенного дайдзеина и 36 мг/кг соединения USP (преобразованная доза каждого соединения эквивалентна дозе дайдзеина; поскольку дайдзеин с трудом растворяется в воде, для растворения использовали 50% водный раствор пропиленгликоля, а другие соединения растворяли в воде до достижения подходящей концентрации), через 20 мин после введения мышей подвергали быстрой декапитации, начиная сзади от уха, затем регистрировали время от декапитации до терминального вздоха. Результаты представлены в таблице 5.


На основании результатов таблицы 5 видно, что соединение примера может значимо пролонгировать время толерантности к острой ишемии мышей и обладает лучшим эффектом по сравнению с дайдзеином, и слабый эффект дайдзеина может быть вызван неполным всасыванием после введения вследствие его слабой растворимости в воде. Другие соединения для сравнения обладают слабыми эффектами. Это может быть связано с тем фактом, что эти соединения с трудом претерпевают гидролиз до дайдзеина, эффект которого осуществляется после проникновения в кровеносные сосуды.
IV. Эксперимент 4 - Действия соединений на время лизиса эуглобулина: исследование 1 антитромботического эффекта
30 морских свинок было отобрано и случайным образом разделено на пять групп; каждой группе вводили внутрижелудочно 25 мг/кг дайдзеина пуэрарии, 36 мг/кг соединения примера по настоящему изобретению, 47 мг/кг 4,7-двузамещенного дайдзеина, 36 мг/кг 4-замещенного дайдзеина и 36 мг/кг соединения USP (преобразованная доза каждого соединения эквивалентна дозе дайдзеина; поскольку дайдзеин с трудом растворяется в воде, для растворения использовали 50% водный раствор пропиленгликоля, а другие соединения растворяли в воде до достижения подходящей концентрации); 1,5 мл крови брали из сердца перед введением, и после 7 последовательных суток введения 1,5 мл крови брали из сердца через 30 минут после последнего введения и помещали в антисвертывающую пробирку с цитратом натрия и плазму отделяли центрифугированием, затем отбирали 0,5 мл плазмы и добавляли к ней 9 мл дистиллированной воды и 0,1 мл 1% раствора уксусной кислоты и смесь центрифугировали после охлаждения в холодильнике в течение 30 минут, затем полученный в результате осадок растворяли 0,5 мл натрийборатного буфера (pH 9,0) и время растворения регистрировали как время лизиса эуглобина, которое может быть получено путем вычисления на основании того, что фибринолитическая активность ферментов (ед.) = 10000/оптимальное время растворения (мин). Результаты представлены в таблице 6.

На основании результатов таблицы 6 видно, что дайдзеин обладает слабым антитромботическим эффектом после перорального введения. Это, главным образом, связано с тем, что дайдзеин с трудом всасывается посредством перорального введения. Соединение примера улучшает как растворимость лекарственного средства, так и его концентрацию в крови, обладая, таким образом, значимой эффективностью. Другие соединения обладают слабыми эффектами, вероятно, за счет всасывания, гидролиза и других причин.
V. Эксперимент 5 - Исследование 2 антитромботического эффекта соединений
30 кроликов было отобрано и случайным образом разделено на пять групп; каждой группе вводили внутрижелудочно 15 мг/кг дайдзеина пуэрарии, 36 мг/кг соединения примера по настоящему изобретению, 28 мг/кг 4,7-двузамещенного дайдзеина, 22 мг/кг 4-замещенного дайдзеина и 22 мг/кг соединения USP (преобразованная доза каждого соединения эквивалентна дозе дайдзеина; поскольку дайдзеин с трудом растворяется в воде, для растворения использовали 50% водный раствор пропиленгликоля, а другие соединения растворяли в воде до достижения подходящей концентрации), 2 мл крови брали из сердца перед введением и после 7 последовательных суток введения 2 мл крови брали из сердца через 30 минут после последнего введения и сразу впрыскивали во вращающееся кольцо прибора для определения тромбоза и вращали при 15-17 об/мин при 37°С и регистрировали время вращения одного тромба с кольцом, которое определяют как время образования тромба из фибрина, вращение останавливали через 15 минут, тромб извлекали и измеряли длину тромба. Результаты представлены в таблице 7.

На основании результатов таблицы 7 видно, что дайдзеин обладает слабым антитромботическим эффектом после перорального введения. Это, главным образом, связано с тем, что дайдзеин с трудом всасывается посредством перорального введения. Соединение примера улучшает как растворимость лекарственного средства, так и его концентрацию в крови, обладая, таким образом, значимой эффективностью, поскольку время образования тромба значимо пролонгировано, а длина тромба очевидно уменьшена. Другие соединения обладают слабыми эффектами, вероятно, за счет всасывания, гидролиза и других причин.
Выше приведено подробное описание производного дайдзеина и его фармацевтически приемлемой соли, предложенных настоящим изобретением. Настоящее изобретение иллюстрирует принцип и воплощения настоящего изобретения с помощью конкретных примеров, и описание приведенных выше примеров предназначено только для того, чтобы помочь понять способ и его основную концепцию настоящего изобретения. Следует отметить, что обычными специалистами в данной области техники может быть проведен ряд усовершенствований и модификаций настоящего изобретения без отклонения от принципа настоящего изобретения и эти усовершенствования и модификации также находятся в пределах объема защиты формулы настоящего изобретения.
Реферат
Изобретение относится к производному дайдзеина, представленному формулой (I), или его фармацевтически приемлемой соли, где Rи Rкаждый независимо представляют собой Н или Cалкил; n равно 1, 2, 3, 4 или 5 и производное дайдзеина не включает 7-O-N,N-диметил-аминобутирил-дайдзеин, а также к способу его получения, фармацевтической композиции на основе заявленных соединений и применению их для лечения сосудисто-сердечных заболеваний. По сравнению с известным гидрохлоридом производного дайдзеина, полученный по настоящему изобретению 7-O-N,N-диэтил-аминоацетилдайдзеина гидрохлорид обладает лучшей растворимостью и лучшим эффектом при лечении сердечно-сосудистых заболеваний. 4 н. и 7 з.п. ф-лы, 7 табл., 5 пр.
Формула

где R1 и R2 каждый независимо представляют собой Н или C1-10алкил; n равно 1, 2, 3, 4 или 5;
и производное дайдзеина не включает 7-O-N,N-диметил-аминобутирил-дайдзеин.
C1-10 алкил представляет собой C1-6 алкил, предпочтительно C1-4 алкил.
предпочтительно органическая кислота выбрана из группы, состоящей из уксусной кислоты, трифторуксусной кислоты, метансульфоновой кислоты, толуолсульфоновой кислоты, малеиновой кислоты, янтарной кислоты, винной кислоты, лимонной кислоты или фумаровой кислоты; неорганическая кислота выбрана из группы, состоящей из соляной кислоты, бромисто-водородной кислоты, азотной кислоты, серной кислоты или фосфорной кислоты.
предпочтительно фармацевтически приемлемая соль представляет собой гидрохлорид, имеющий структуру, как показано в формуле (III):
а) взаимодействие дайдзеина и галогенированного алкилацилгалогенида с получением галогенированного алкилацилдайдзеина:

где X представляет собой галоген;
b) взаимодействие галогенированного алкилацилдайдзеина и амина, представленного формулой (IV), с получением производного дайдзеина:

и
с) возможно, преобразование производного дайдзеина в его фармацевтически приемлемую соль;
R1, R2 и n являются такими, как определено в любом из пп. 1-5.
взаимодействие дайдзеина и галогенированного алкилацилгалогенида с пиридином в качестве катализатора в первом органическом растворителе с получением галогенированного алкилацилдайдзеина;
предпочтительно первый органический растворитель представляет собой органический растворитель, выбранный из спиртов, галогенированных углеводородов, простых эфиров, кетонов или сложных эфиров или их смеси; где органический растворитель, выбранный из спиртов, выбран из одного или более из группы, состоящей из метанола, этанола, изопропанола, н-пропанола, н-бутанола и трет-бутанола; органический растворитель, выбранный из галогенированных углеводородов, выбран из одного или более из группы, состоящей из дихлорметана, хлороформа и 1,2-дихлорэтилена; органический растворитель, выбранный из простых эфиров, выбран из одного или более из группы, состоящей из тетрагидрофурана, диэтилового эфира, изопропилового эфира, анизола и метил-трет-бутилового эфира; органический растворитель, выбранный из кетонов, выбран из одного или более из группы, состоящей из ацетона, метилизобутилкетона, бутанона и метил-н-бутилкетона; органический растворитель, выбранный из сложных эфиров, выбран из одного или более из группы, состоящей из этилацетата, изобутилацетата, бутилацетата и изопропилацетата; более предпочтительно первый органический растворитель представляет собой ацетон;
предпочтительно во время взаимодействия дайдзеина и галогенированного алкилацилгалогенида температура реакционной смеси составляет 0°C-25°C, более предпочтительно 1°C-15°C и более предпочтительно 2°C-5°C; время реакции предпочтительно составляет 1-10 ч, более предпочтительно 2-8 ч и более предпочтительно 3-7 ч;
предпочтительно массовое отношение дайдзеина и галогенированного алкилацилгалогенида составляет 1:10-2:5 и более предпочтительно 1:8-3:6;
предпочтительно концентрация дайдзеина в первом органическом растворителе составляет 0,05 моль/л - 0,2 моль/л, более предпочтительно 0,08 моль/л - 0,18 моль/л, более предпочтительно 0,09 моль/л - 0,15 моль/л и наиболее предпочтительно 0,1 моль/л - 0,12 моль/л.
растворение галогенированного алкилацилдайдзеина, полученного на стадии а), во втором органическом растворителе, добавление карбоната калия и йодида калия, а затем добавление

нагревание с обратным холодильником с получением производного дайдзеина в результате взаимодействия;
предпочтительно второй органический растворитель представляет собой органический растворитель, выбранный из спиртов, галогенированных углеводородов, простых эфиров, кетонов или сложных эфиров либо их смеси; где органический растворитель, выбранный из спиртов, выбран из одного или более из группы, состоящей из метанола, этанола, изопропанола, н-пропанола, н-бутанола и трет-бутанола; органический растворитель, выбранный из галогенированных углеводородов, выбран из одного или более из группы, состоящей из дихлорметана, хлороформа и 1,2-дихлорэтилена; органический растворитель, выбранный из простых эфиров, выбран из одного или более из группы, состоящей из тетрагидрофурана, диэтилового эфира, изопропилового эфира, анизола и метил-трет-бутилового эфира; органический растворитель, выбранный из кетонов, выбран из одного или более из группы, состоящей из ацетона, метилизобутилкетона, бутанона и метил-н-бутилкетона; органический растворитель, выбранный из сложных эфиров, выбран из одного или более из группы, состоящей из этилацетата, изобутилацетата, бутилацетата и изопропилацетата; также предпочтительно второй органический растворитель идентичен первому органическому растворителю на стадии а); более предпочтительно второй органический растворитель представляет собой ацетон;
время реакции с обратным холодильником предпочтительно составляет по меньшей мере 1 ч, более предпочтительно по меньшей мере 2 ч и наиболее предпочтительно по меньшей мере 3 ч.
растворение производного дайдзеина, полученного на стадии b), в третьем органическом растворителе, затем добавление органической или неорганической кислоты, так что производное дайдзеина может взаимодействовать с кислотой с образованием фармацевтически приемлемой соли производного дайдзеина;
предпочтительно растворение производного дайдзеина, полученного на стадии b), в третьем органическом растворителе, а затем пропускание сухого газа HCl или добавление соляной кислоты и проведение фильтрования и концентрирования с получением гидрохлорида производного дайдзеина;
где третий органический растворитель представляет собой органический растворитель, выбранный из спиртов, галогенированных углеводородов, простых эфиров, кетонов или сложных эфиров или их смеси; где органический растворитель, выбранный из спиртов, выбран из одного или более из группы, состоящей из метанола, этанола, изопропанола, н-пропанола, н-бутанола и трет-бутанола; органический растворитель, выбранный из галогенированных углеводородов, выбран из одного или более из группы, состоящей из дихлорметана, хлороформа и 1,2-дихлорэтилена; органический растворитель, выбранный из простых эфиров, выбран из одного или более из группы, состоящей из тетрагидрофурана, диэтилового эфира, изопропилового эфира, анизола и метил-трет-бутилового эфира; органический растворитель, выбранный из кетонов, выбран из одного или более из группы, состоящей из ацетона, метилизобутилкетона, бутанона и метил-н-бутилкетона; органический растворитель, выбранный из сложных эфиров, выбран из одного или более из группы, состоящей из этилацетата, изобутилацетата, бутилацетата и изопропилацетата; также предпочтительно третий органический растворитель идентичен первому органическому растворителю на стадии а); более предпочтительно третий органический растворитель представляет собой метанол.
предпочтительно фармацевтически приемлемый носитель выбран из одного или более чем одного из группы, состоящей из эксципиента, связующего вещества, разрыхлителя, ароматизатора, средства для уничтожения запаха, эмульгирующего агента, разбавителя и сорастворителя.
предпочтительно сердечно-сосудистое заболевание представляет собой гипертензию, сердечную недостаточность, стабильную или нестабильную стенокардию, заболевание сердечных и периферических сосудов, аритмию, тромбоэмболическое заболевание и локальную ишемию, а также заболевание, требующее улучшения или усиления способности к перенесению гипоксии; где локальная ишемия предпочтительно представляет собой инфаркт миокарда, удар, транзиторную ишемическую атаку, заболевание периферического кровообращения, атеросклероз или фибротическое заболевание.

Комментарии