Антитела против 5t4 и конъюгаты антитело-лекарственное средство - RU2736720C2
Код документа: RU2736720C2
Чертежи
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к антителам против (онкофетального) антигена 5T4 и соответствующим конъюгатам антитело-лекарственное средство (ADC).
Предшествующий уровень техники, к которому относится настоящее изобретение
Онкофетальный антиген 5T4 представляет собой гликопротеин 72 кДа из мембраны микроворсинок плацентарного синцитиотрофобласта человека, распознаваемый моноклональным антителом, индуцированным против гликопротеинов, выделяемых из агглютинина зародышей пшеницы. Это моноклональное антитело (mAb) назвали 5T4 в WO89/07947. Несмотря на то, что антиген 5T4 характеризуется ограниченной экспрессией в нормальной ткани, он экспрессируется (на повышенном уровне) злокачественными клетками различных типов. Это делает антиген 5T4 специфической мишенью злокачественной опухоли и возможной и перспективной терапевтической мишенью. Тем не менее, несмотря на то, что мишень открыли в конце восьмидесятых, одобренные терапевтические антитела все еще недоступны.
В WO2006/031653 описано исходное 5T4 mAb, т.е. H8 и его гуманизированный вариант, которые не дают перекрестной реакции по отношению к различным видам животных, не являющимся человеком, как правило, используемые доклинических исследованиях (токсичности) in vivo. Целью этих доклинических исследований является идентификация начальной безопасной дозы для последующей схемы увеличения дозы у людей; идентификация здоровых тканей или органов, которые являются возможными мишенями обратимых или необратимых токсических эффектов, и идентификация параметры безопасности для клинического мониторинга. Для биофармацевтических препаратов, таких как моноклональные антитела, в соответствии с нормативными рекомендация необходимо тестирования по меньшей мере на одном релевантном виде (например, нормативная рекомендация ICH S6). Вид не является релевантным в случае, если моноклональное антитело не дает перекрестной реакции у вида, и, таким образом, является недостаточно сильнодействующим для указанного вида. В таких случаях можно использовать альтернативную модель на животных, например, генетически модифицированный вид. Однако для этого потребуются не только значительные усилия для разработки модели, но и для обеспечения приемлемого научного обоснования для регулирующих органов.
В WO2007/106744 описаны антитела против 5T4 A1, A2 и A3, но, несмотря на то, что эти три антитела обладают определенной перекрестной реактивностью у видов животных, не являющихся человеком, например, яванского макака, их аффинности к 5T4 человека намного ниже, чем аффинность H8 к 5T4 человека.
Антитела против 5T4 H8, A1, A2 и A3, связанные через 4-(4'-ацетилфенокси)-бутановую кислоту с калихимицином описаны в WO2007/106744 на с. 73. В WO2012/131527 описан A1, связанный с малеимидокапроновая кислота-монометилауристатин F (A1-mc-MMAF).
Только несколько видов терапии, направленной на антиген 5T4, дошли до стадии клинических испытаний. Вакцина, содержащая вектора на основе модифицированного вируса оспавакцины Анкара (MVA), кодирующий антиген 5T4, индуцирует образование эндогенных антител против антигена 5T4, но ее исследование III фазы на метастатической злокачественной опухоли почки не достигло первичной конечной точки повышенной выживаемости. Другим примером является наптумомаб эстафенатокс, который представляет собой фрагмент Fab mAb 5T4, конъюгированный с модифицированным энтеротоксином Staphylococcal E. Предполагают, что этот конъюгат активирует T-клеточный ответ в непосредственной близости от опухоли. Однако рандомизированное исследование II/III фазы наптумомаба эстафенатокса плюс IFN-О± в сравнении с IFN-О± при почечноклеточной карциноме на поздней стадии не достигло первичной конечной точки длительного выживания. Также недавно было прекращено клиническое исследование по оценке ADC A1-mc-MMAF. В настоящее время нет активных клинических испытаний, указанных в реестре клинических исследований US и EU.
В WO 2015/155345 описаны новые антитела против 5T4 и соответствующие ADC, где антитело против 5T4 является (сайт-специфически) связанным с димером пирролобензодиазепина (PDB) или с тубулизином. Однако клинические данные пока еще недоступны.
Указанное выше приводит к заключению, что протестированные в клинике виды терапии, направленной на 5T4, т.е. антитела, конъюгаты антитело-лекарственное средство и вакцины не соответствуют требованиям, предъявляемым к терапевтическим средствам против злокачественной опухоли. Таким образом, существует необходимость в новых антителах против антиген 5T4 и в соответствующих конъюгатах антитело-лекарственное средство для терапии злокачественной опухоли. Для определения пригодности этих антител и соответствующих ADC в доклинических условиях, такие антитела должны давать перекрестную реакцию с антигеном 5T4 от вида животного, не являющегося человеком, подходящего для доклинических исследований лекарственного средства-кандидата.
Краткое описание настоящего изобретения
Настоящее изобретение относится к антителам против онкофетального антигена 5T4 человека и соответствующим ADC, которые являются подходящими для тестирования в клинических испытаниях. Подходящие антитела и соответствующие ADC в доклинических условиях должны давать перекрестную реакцию с антигеном 5T4 видом животного, не являющегося человеком, подходящего для доклинических исследований лекарственного средства-кандидата.
Предпочтительно антитела дают перекрестную реакцию у людей и яванских макак и обладают аффинностью к антигену 5T4 человека (hu 5T4), которая является того же порядка что и аффинность к антигену 5T4 яванского макака (cyno 5T4).
Кроме того, изобретение относится к использованию антител и соответствующих ADC при лечении солидных опухолей и гематологических злокачественных новообразований.
Краткое описание чертежей
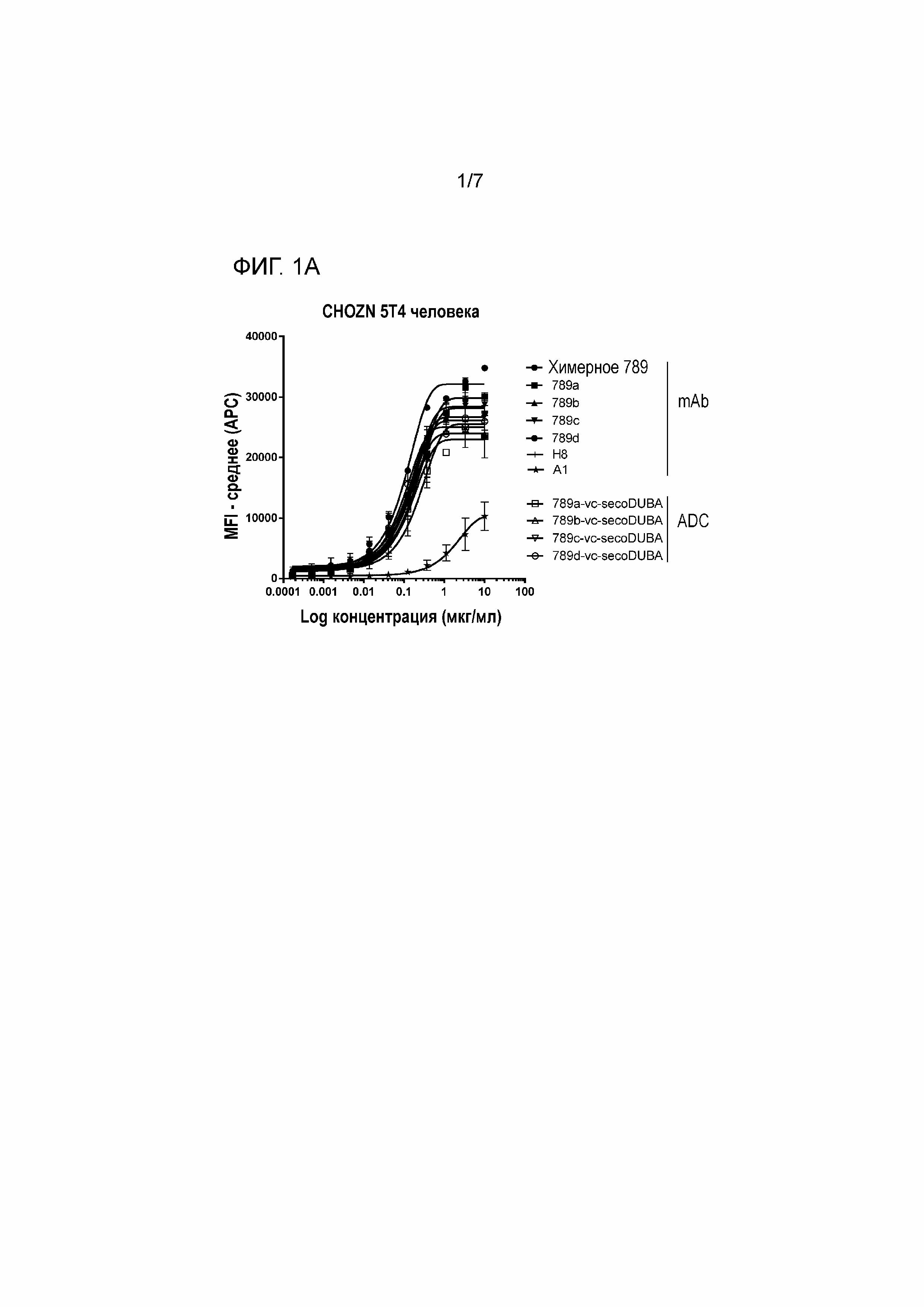
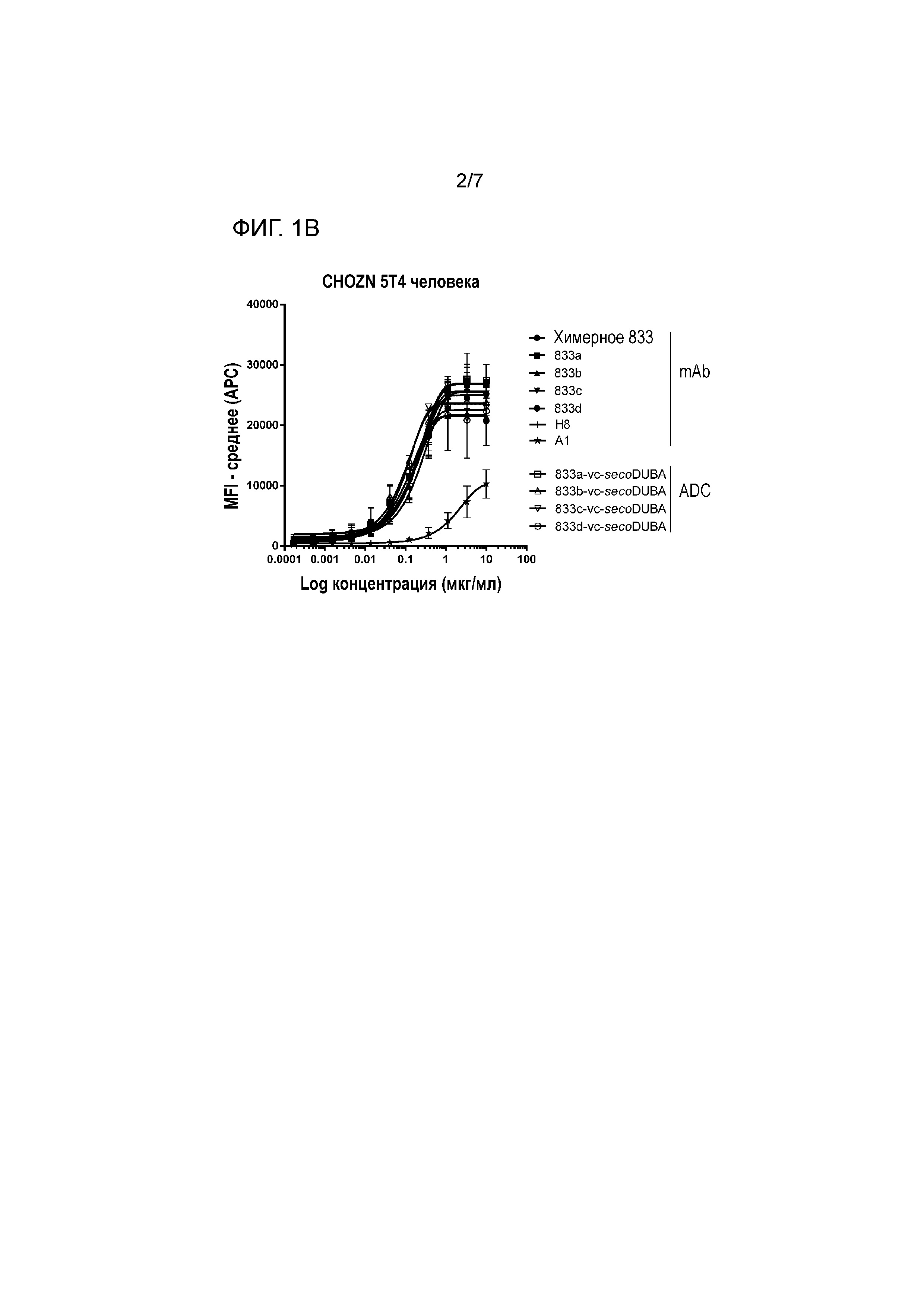
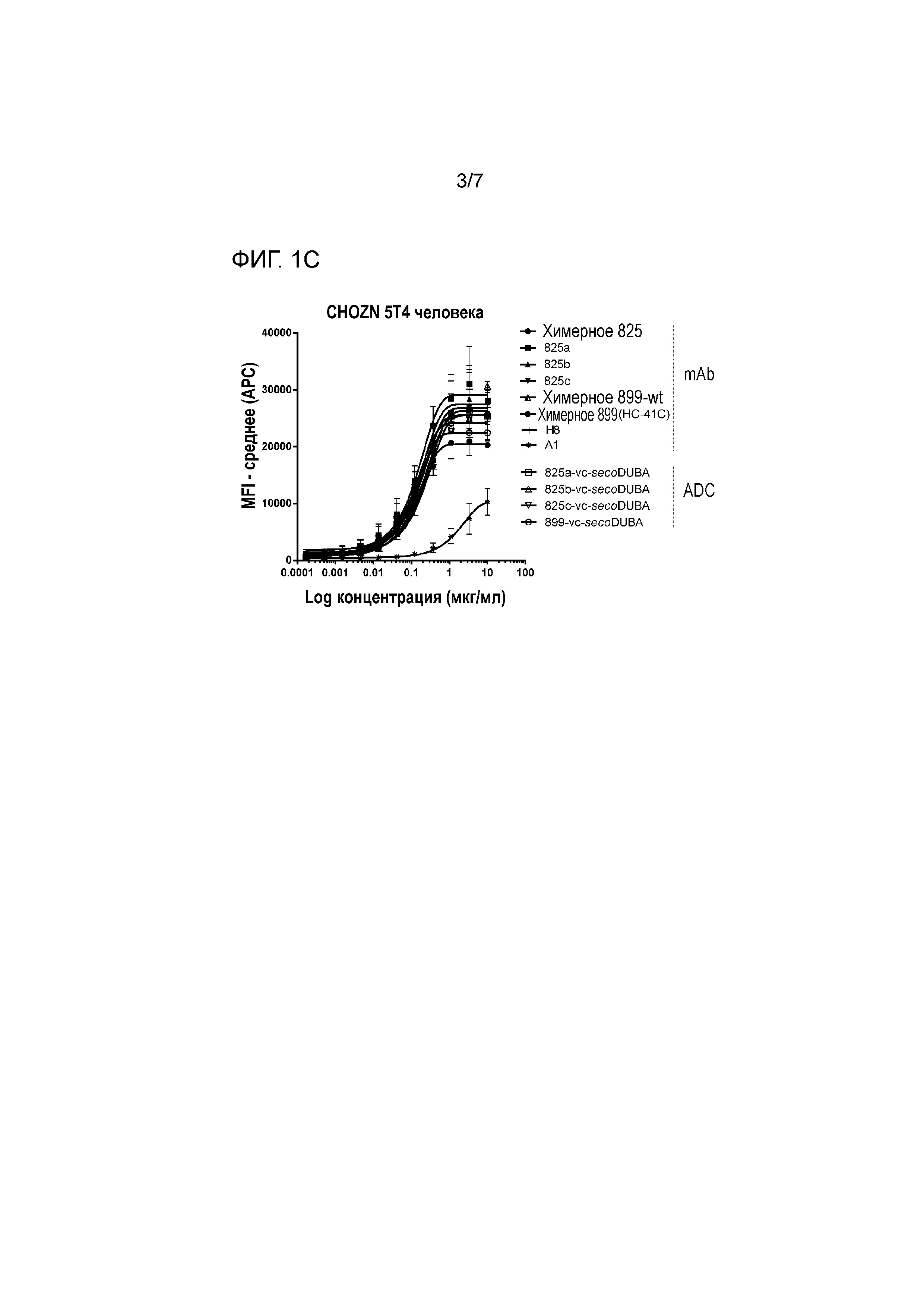
На фигуре 1 представлено связывание химерных mAb, гуманизированных mAb с мутацией HC-41C и соответствующих ADC к 5T4 с экспрессирующими hu 5T4 клетками CHO (CHOZN) в равнении со связыванием H8 и A1 (фигура 1A клон 789, фигура 1B клон 833, фигура 1C клон 825).
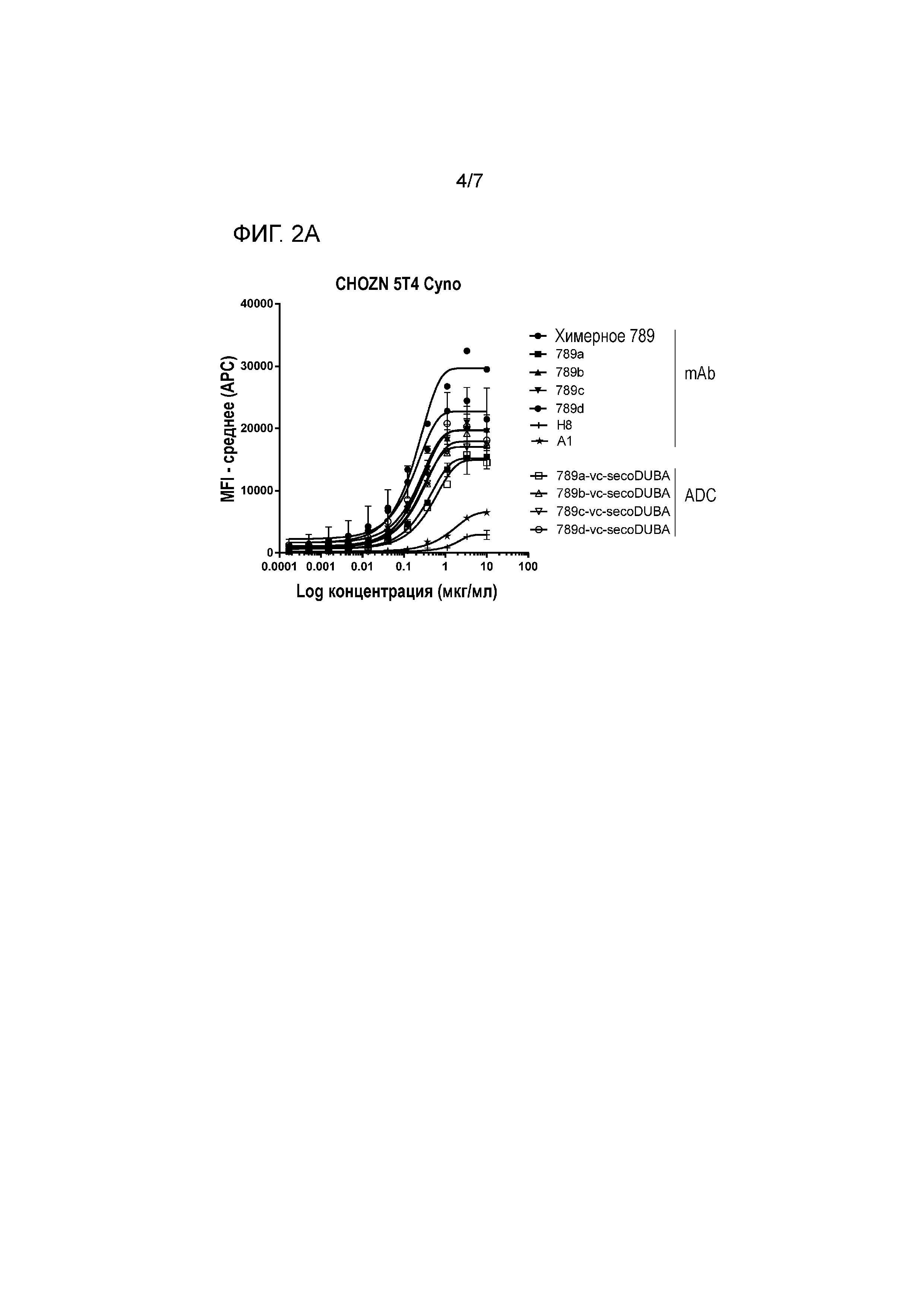
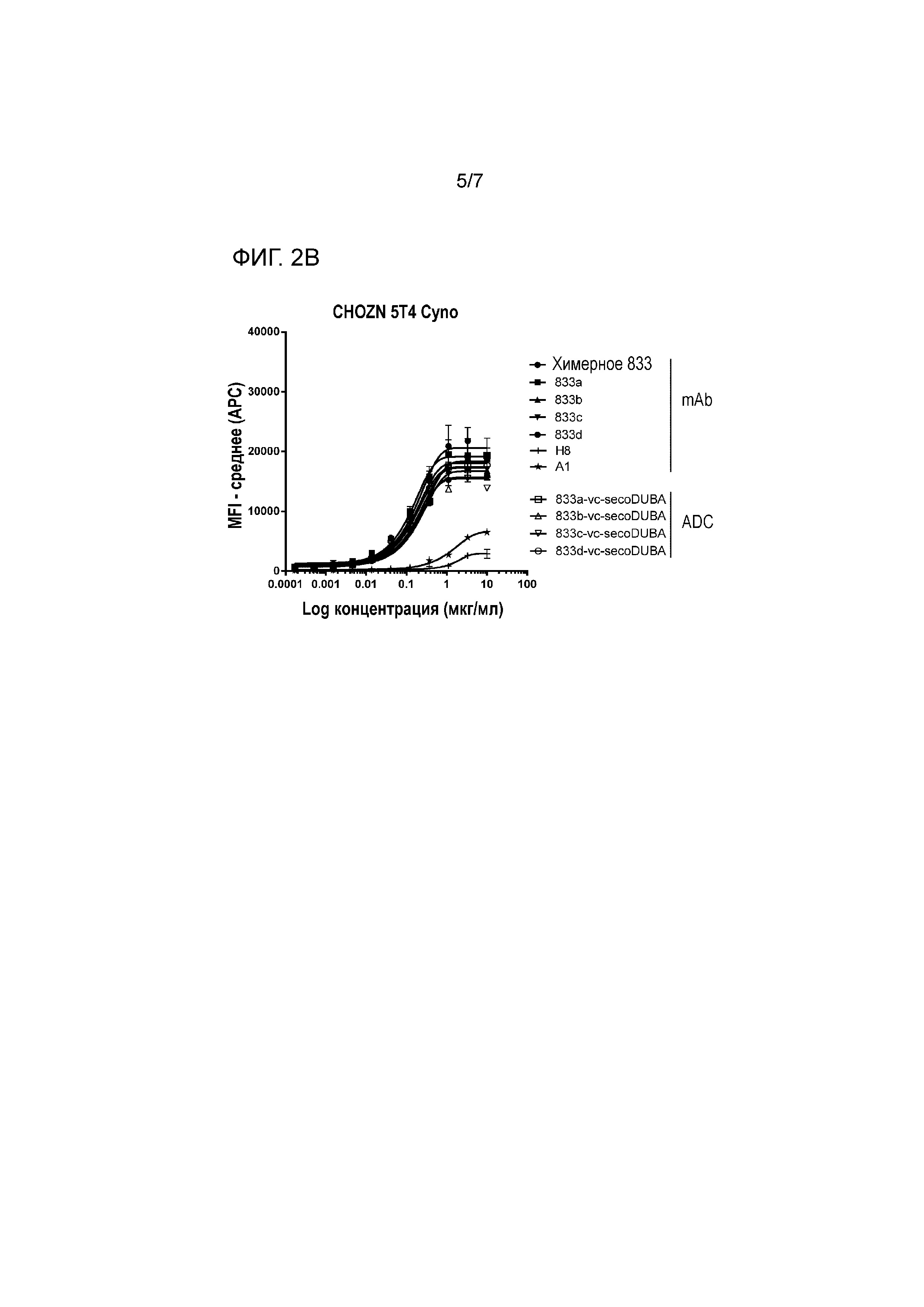
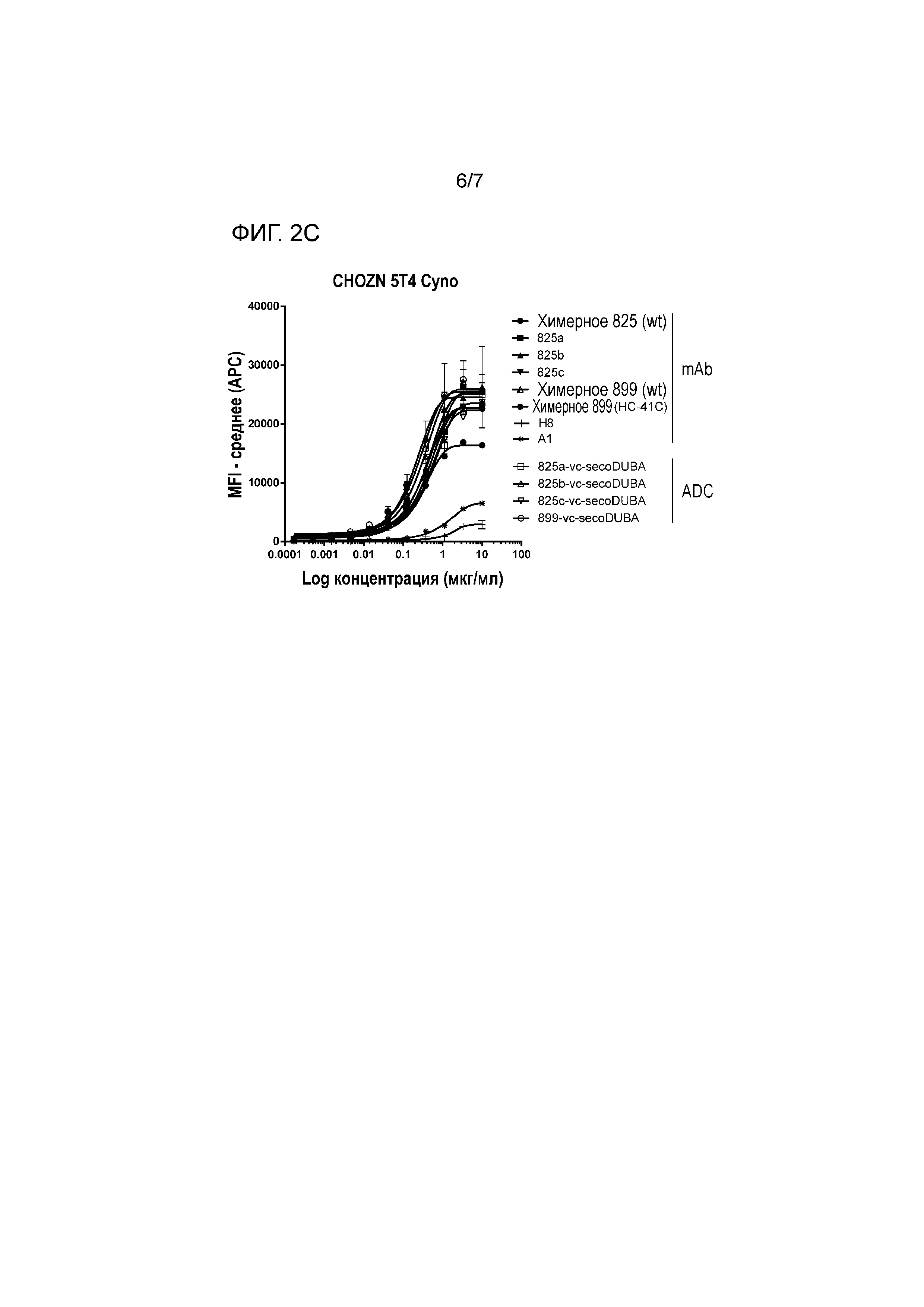
На фигуре 2 представлено связывание химерных mAb, гуманизированныз mAb с мутацией HC-41C и соответствующих ADC к 5T4 с экспрессирующими cyno 5T4 клетками CHO (CHOZN) в равнении со связыванием H8 и A1 (фигура 2A клон 789, фигура 2B клон 833, фигура 2C клон 825).
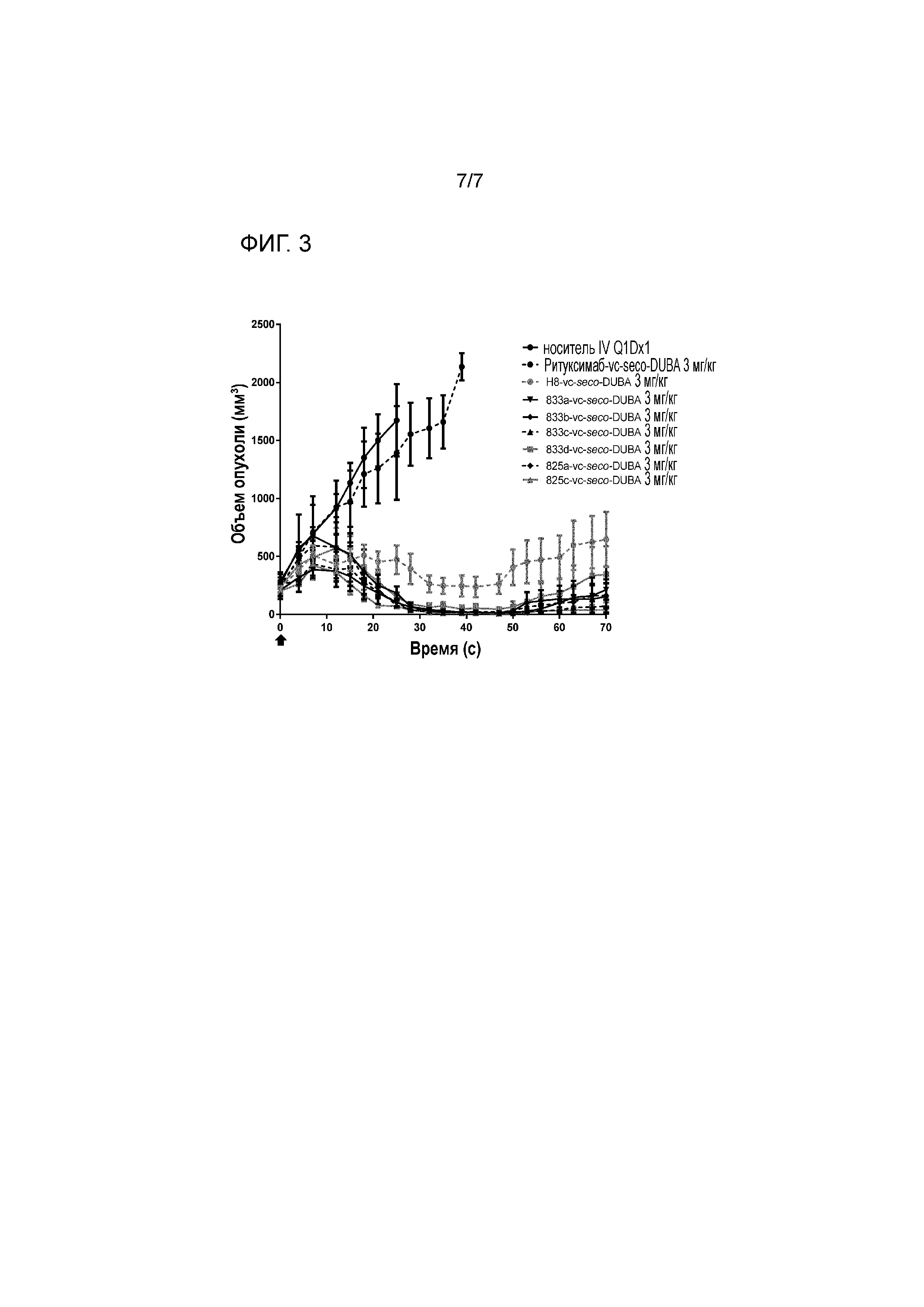
На фигуре 3 представлена эффективность in vivo ADC к 5T4 833a-, 833b-, 833c-, 833d-, 825a-, 825c-vc-seco-DUBA в равнении с H8-vc-seco-DUBA и несвязывающимся контролем ритуксимаб-vc-seco-DUBA в ксенотрансплантате положительных по 5T4 линии клеток BT474 у иммуннодефицитных мышей.
Подробное описание настоящего изобретения
Вследствие того, что онкофетальный антиген 5T4 имеет ограниченную экспрессию в нормальных тканях, он (сверх)экспрессируется различными злокачественными клетками, таким образом, делая антиген 5T4 специфической мишенью злокачественной опухоли и возможной и перспективной терапевтической мишенью. Тем не менее, несмотря на то, что мишень открыли в конце восьмидесятых, одобренные терапевтические антитела все еще недоступны.
Настоящее изобретение относится к антителам против антиген 5T4 и соответствующим конъюгатам антитело-лекарственное средство (ADC), которые дают перекрестную реакцию с cyno 5T4, а также обладают прекрасной аффинностью к hu антигену 5T4. Антитела против 5T4 и ADC по изобретению обладают аффинностью к cyno антигену 5T4 с тем же порядком величины, что и аффинность к hu 5T4. Термин "тот же порядок величины" означает, что аффинности к hu и cyno антигену 5T4 отличаются менее чем менее чем в десять раз друг от друга. Антитела против 5T4 по изобретению обладают улучшенной аффинностью к hu антигену 5T4 по сравнению с предшествующий уровнем техники антитела против 5T4 A1 и A3 и улучшенной аффинностью к cyno антигену 5T4 по сравнению с предшествующий уровень техники антитела против 5T4 H8. Аффинность предпочтительно измеряют как EC50 в мкг/мл в клеточном анализе, в котором используют клетки, экспрессирующие антиген 5T4 hu или cyno. Авторы настоящего изобретения измеряли EC50 на различных клетках, так как MDA-MB-468, PA-1 и клетки китайского хомяка (CHO), сконструированных экспрессировать hu 5T4 или cyno 5T4. Антитела по изобретению, как правило, характеризуются EC50 ниже 0,8 мкг/мл, как измеряют с использованием клеток, экспрессирующих антиген hu 5T4 или cyno 5T4, после инкубации клеток с антителами в течение 30 минут при 4°C.
Антитело против 5T4 A1 предшествующего уровня техники характеризуется вариабельной областью (VR) тяжелой цепи (HC) аминокислотной последовательности мыши A1 из US8044178, SEQ ID NO:2, положения 20-138, и VR легкой цепи (LC) аминокислотной последовательности A1 мыши из US8044178, SEQ ID NO:4, положения 21-127. Антитело против 5T4 A3 предшествующего уровня техники характеризуется HCVR аминокислотной последовательности мыши A3 из US8044178, SEQ ID NO:10, положения 20-141 и LCVR аминокислотной последовательности мыши A3 из US8044178, SEQ ID NO:12, положения 21-127. Антитело против 5T4 H8 предшествующего уровня техники характеризуется HCVR SEQ ID NO:52 и LCVR SEQ ID NO:53.
Термин "антитело" как используют на всем протяжении настоящего описания относится к моноклональному антителу (mAb), содержащему две тяжелые цепи и две легкие цепи или их антигенсвязывающий фрагмент, например, фрагмент Fab, Fab' или F(ab')2, одноцепочечное (sc) антитело, scFv, однодоменное (sd) антитело, диатело или миниантитело. Антитела могут быть любого изотипа, такого как антитела IgG, IgA или IgM. Предпочтительно антитело представляет собой антитело IgG, более предпочтительно антитело IgG1 или IgG2. Антитела могут являться химерными, гуманизированными или принадлежать человеку. Предпочтительно антитела по изобретению являются гуманизированными. Даже более предпочтительно антитело представляет собой гуманизированное антитело IgG или антитело IgG человека, наиболее предпочтительно гуманизированное mAb IgG1 или mAb IgG1 человека. Антитело могут содержать κ- (каппа) или λ- (лямбда) легкие цепи, предпочтительно κ- (капа) легкие цепи, т.е. гуманизированное IgG1-κ или антитело IgG1-κ человека.
В гуманизированных антителах антигенсвязывающие определяющие комплементарность области (CDR) в вариабельных областях HC и LC получают из антител от не являющегося человеком вида, как правило, мыши, крысы или кролика. Такие не принадлежащие человеку CDR можно размещать в каркасной области человека (FR1, FR2, FR3 и FR4) вариабельных областей HC и LC. Выбранные аминокислоты в FR человека можно заменять на соответствующие исходные аминокислоты от не являющегося человеком вида для улучшения аффинности связывания при сохранении низкой иммуногенности. Альтернативно выбранные аминокислоты исходных FR не являющего человеком вида заменяют на соответствующие им аминокислоты человека для уменьшения иммуногенности при сохранении аффинности связывания антитела. Таким образом, гуманизированные вариабельные области объединяют с константными областями человека.
Настоящее изобретение в частности относится к антителу против 5T4, содержащему CDR HCVR и LCVR, выбранные из группы, состоящей из:
a. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:1 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:2;
b. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:3 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:4;
c. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:5 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:6;
d. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:7 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:8;
e. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:9 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:10;
f. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:11 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:12;
g. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:13 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:14;
h. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:15 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:16;
i. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:17 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:18;
j. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:19 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:20;
k. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:21 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:22;
l. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:23 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:24;
m. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:25 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:26;
n. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:27 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:28;
o. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:29 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:30;
p. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:31 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:32, и
q. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:33 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:34.
Для ясности последовательности CDR1, CDR2 и CDR3 HCVR и последовательности CDR1, CDR2 и CDR3 LCVR антител, перечисленных в пунктах от a до q в указанном выше описании, подчеркнуты в списках последовательностей, приводимых в конце настоящего описания.
В одном из вариантов осуществления антитело против 5T4 по изобретению содержит CDR HCVR и LCVR, выбранные из группы, состоящей из:
a. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:1 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:2;
b. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:5 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:6;
c. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:11 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:12;
d. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:13 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:14;
e. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:17 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:18, и
f. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:25 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:26.
В предпочтительном варианте осуществления антитело против 5T4 по изобретению содержит CDR HCVR и LCVR, выбранные из группы, состоящей из:
a. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:1 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:2;
b. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:5 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:6, и
c. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:11 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:12.
В более предпочтительном варианте осуществления антитело против 5T4 по изобретению содержит CDR HCVR и LCVR, выбранные из группы, состоящей из:
a. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:5 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:6, и
b. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:11 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:12.
В другом варианте осуществления изобретение относится к гуманизированному антителу против 5T4, содержащему HCVR и LCVR, выбранные из группы, состоящей из:
a. аминокислотной последовательности HCVR SEQ ID NO:35 и аминокислотной последовательности LCVR SEQ ID NO:45;
b. аминокислотной последовательности HCVR SEQ ID NO:36 и аминокислотной последовательности LCVR SEQ ID NO:45;
c. аминокислотной последовательности HCVR SEQ ID NO:37 и аминокислотной последовательности LCVR SEQ ID NO:44;
d. аминокислотной последовательности HCVR SEQ ID NO:37 и аминокислотной последовательности LCVR SEQ ID NO:46;
e. аминокислотной последовательности HCVR SEQ ID NO:40 и аминокислотной последовательности LCVR SEQ ID NO:51;
f. аминокислотной последовательности HCVR SEQ ID NO:41 и аминокислотной последовательности LCVR SEQ ID NO:51;
g. аминокислотной последовательности HCVR SEQ ID NO:42 и аминокислотной последовательности LCVR SEQ ID NO:49;
h. аминокислотной последовательности HCVR SEQ ID NO:43 и аминокислотной последовательности LCVR SEQ ID NO:50;
i. аминокислотной последовательности HCVR SEQ ID NO:38 и аминокислотной последовательности LCVR SEQ ID NO:47;
j. аминокислотной последовательности HCVR SEQ ID NO:39 и аминокислотной последовательности LCVR SEQ ID NO:47, и
k. аминокислотной последовательности HCVR SEQ ID NO:39 и аминокислотной последовательности LCVR SEQ ID NO:48.
В первом варианте осуществления изобретения гуманизированное антитело против 5T4 содержит аминокислотную последовательность HCVR SEQ ID NO:35 и аминокислотную последовательность LCVR SEQ ID NO:45.
Во втором варианте осуществления изобретения гуманизированное антитело против 5T4 содержит аминокислотную последовательность HCVR SEQ ID NO:36 и аминокислотную последовательность LCVR SEQ ID NO:45.
В третьем варианте осуществления изобретения гуманизированное антитело против 5T4 содержит аминокислотную последовательность HCVR SEQ ID NO:37 и аминокислотную последовательность LCVR SEQ ID NO:44.
В четвертом варианте осуществления изобретения гуманизированное антитело против 5T4 содержит аминокислотную последовательность HCVR SEQ ID NO:37 и аминокислотную последовательность LCVR SEQ ID NO:46.
В пятом предпочтительном варианте осуществления изобретения гуманизированное антитело против 5T4 содержит аминокислотную последовательность HCVR SEQ ID NO:40 и аминокислотную последовательность LCVR SEQ ID NO:51.
В шестом предпочтительном варианте осуществления изобретения гуманизированное антитело против 5T4 содержит аминокислотную последовательность HCVR SEQ ID NO:41 и аминокислотную последовательность LCVR SEQ ID NO:51.
В седьмом предпочтительном варианте осуществления изобретения гуманизированное антитело против 5T4 содержит аминокислотную последовательность HCVR SEQ ID NO:42 и аминокислотную последовательность LCVR SEQ ID NO:49.
В восьмом предпочтительном варианте осуществления изобретения гуманизированное антитело против 5T4 содержит аминокислотную последовательность HCVR SEQ ID NO:43 и аминокислотную последовательность LCVR SEQ ID NO:50.
В девятом предпочтительном варианте осуществления изобретения гуманизированное антитело против 5T4 содержит аминокислотную последовательность HCVR SEQ ID NO:38 и аминокислотную последовательность LCVR SEQ ID NO:47.
В десятом варианте осуществления изобретения гуманизированное антитело против 5T4 содержит аминокислотную последовательность HCVR SEQ ID NO:39 и аминокислотную последовательность LCVR SEQ ID NO:47.
В одиннадцатом предпочтительном варианте осуществления изобретения гуманизированное антитело против 5T4 содержит аминокислотную последовательность HCVR SEQ ID NO:39 и аминокислотную последовательность LCVR SEQ ID NO:48.
Настоящее изобретение дополнительно относится к ADC, где лекарственное средство-линкер конъюгируют с антителом против 5T4 по изобретению.
В одном из вариантов осуществления настоящее изобретение относится к ADC, где лекарственное средство-линкер случайным образом конъюгируют с антителом против 5T4 по изобретению через нативный цистеин, освобождаемый в результате восстановления межцепьевых дисульфидных связей.
В другом варианте осуществления настоящее изобретение относится к ADC, где лекарственное средство-линкер сайт-специфически конъюгируют с антителом против 5T4 по изобретению через конструируемый цистеин (сайт-специфический ADC).
Антитела против 5T4, содержащие по меньшей мере один сконструированный цистеин в HC или LC, обладают несколькими преимуществами. Антитела, содержащие сконструированные цистеины, обеспечивают возможность получения сайт-специфических ADC, могут предоставлять положения конъюгации, которые характеризуются хорошей реакционной способностью с лекарственным средством-линкером, и одновременно характеризуются сниженным риском образования дополнительных дисульфидных связей между антителами (приводящих к агрегации) или нарушению структуры антитела. Дополнительное преимущество наличия цистеинов в конкретных положениях в HC или LC заключается в эффекте пониженной гидрофобности получаемых ADC.
Идентифицировано много подходящих положений конъюгации для прикрепления лекарственное средство-линкер в полостях и в непосредственной близости от них, которые присутствуют во всех структурах антитела, т.е. с хорошей доступностью к сконструированным цистеинам в этих положениях, как описывают и заявляют в WO2015/177360.
Когда лекарственные средства-линкеры конъюгированы в конкретных положениях антител против 5T4, как заявляют в настоящем описании, указанный лекарственное средство-линкер соответствует полости Fab, которая сформирована константной 1 областью тяжелой цепи (CH1), вариабельной областью тяжелой цепи (VH), вариабельной областью легкой цепи (VL) и константной областью легкой цепи (CL) антитела. В результате лекарственное средство-линкер (большая часть токсины/лекарственные средства-линкеры являются гидрофобными) защищена от водной среды, окружающей антитело, и ADC по существу является в меньшей степени гидрофобным по сравнению с ADC, где лекарственное средство-линкер конъюгировано через нативные цистеины межцепьевые дисульфидные связи антитела и является в большей степени гидрофобным по сравнению с ADC, где лекарственное средство-линкер сайт-специфически конъюгировано в различных положениях, где лекарственное средство-линкер выводят на внешнюю сторону антитела, т.е. подвергается большему воздействию гидрофильной водной среды.
В предпочтительном варианте осуществления настоящего изобретения антитело против 5T4 по изобретению содержит по меньшей мере один сконструированный цистеин в положении в FR вариабельной области HC или FR вариабельной области LC. Термин "сконструированный цистеин", как используют на всем протяжении настоящего описания, означает замену не являющейся цистеином аминокислоты в HC или LC антитела цистеином. Как известно специалисту в данной области, это модно проводить на уровне аминокислоты или на уровне ДНК, например, посредством сайт-специфического мутагенеза. Предпочтительно такой сконструированный цистеин вводят посредством конкретных точечных мутаций, заменяющих существующую аминокислоту в исходном/родительском антителе.
Предпочтительно по меньшей мере один сконструированный цистеин присутствует в одном или нескольких положениях антител против 5T4 по изобретению, выбранных из 40, 41 и 89 HC (в соответствии с нумерацией по Kabat); и 40 и 41 LC (в соответствии с нумерацией по Kabat). Выражение "нумерация по Kabat" относится к системе нумерации общепринято используемой для вариабельных областей HC или вариабельных областей LC сборке антител согласно Kabat E.A. et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991). С использованием этой системы нумерации фактическая линейная аминокислотная последовательность может содержать меньшее количество или дополнительные аминокислоты, соответствующие укорочению или вставки в FR или CDR вариабельной области. Нумерацию по Kabat остатков можно определять для данного антитела выравниванием в областях гомологии последовательности антитела со "стандартной" пронумерованной по Kabat последовательностью.
В дополнение к антителу против 5T4, содержащему CDR HCVR и LCVR, и гуманизированным антителам, содержащим HCVR и LCVR, как описано выше в настоящем описании, настоящее изобретение также относится к указанным антителам, содержащим в HC и/или LC по меньшей мере один сконструированный цистеин в положении, выбранном из 40, 41 и 89 HC, и 40 и 41 LC.
В предпочтительном варианте осуществления антитело против 5T4 по изобретению содержит по меньшей мере один сконструированный цистеин в положении, выбранном из 40, 41 и 89 HC, и 40 и 41 LC, и содержит CDR HCVR и HCVR, выбранные из группы, состоящей из:
a. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:1 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:2;
b. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:5 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:6, и
c. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:11 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:12.
В другом предпочтительном варианте осуществления изобретение относится к гуманизированному антителу против 5T4, содержащему по меньшей мере один сконструированный цистеин в положении, выбранном из 40, 41 и 89 HC, и 40 и 41 LC, и содержащему HCVR и LCVR, выбранные из группы, состоящей из:
a. аминокислотной последовательности HC SEQ ID NO:40 и аминокислотной последовательности LC SEQ ID NO:51;
b. аминокислотной последовательности HC SEQ ID NO:41 и аминокислотной последовательности LC SEQ ID NO:51;
c. аминокислотной последовательности HC SEQ ID NO:42 и аминокислотной последовательности LC SEQ ID NO:49;
d. аминокислотной последовательности HC SEQ ID NO:43 и аминокислотной последовательности LC SEQ ID NO:50;
e. аминокислотной последовательности HC SEQ ID NO:38 и аминокислотной последовательности LC SEQ ID NO:47, и
f. аминокислотной последовательности HC SEQ ID NO:39 и аминокислотной последовательности LC SEQ ID NO:48.
Положения 40, 41 и 89 HC и 40 и 41 LC располагаются в FR вариабельных областей антитела, а также в части Fab антитела.
В предпочтительном варианте осуществления настоящее изобретение относится к ADC, где лекарственное средство-линкер сайт-специфически конъюгируют с антителом против 5T4 по изобретению через сконструированный цистеин в одном или более положений указанного антитела против 5T4, выбранных из 40, 41 и 89 HC (в соответствии с нумерацией по Kabat) и 40 и 41 LC (в соответствии с нумерацией по Kabat).
Авторы настоящего изобретения неожиданно обнаружило, что сайт-специфически конъюгированные ADC по настоящему изобретению обладают улучшенными физико-химическими, фармакологическими и/или фармакокинетическими свойствами по сравнению с общепринятыми ADC, в которых лекарственное средство-линкер являются конъюгированным через нативные цистеины межцепьевой дисульфидной связи антитела против 5T4.
Модификации вариабельной части антитела, как правило, избегают, т.к. она может приводить к частичной или полной потери аффинностей связывания антигена. Однако в отличие от общих ожиданий, выявлено, что конкретные остатки в FR HC и LC антитела являются подходящими для конъюгации и не приводят к (существенному) уменьшению связывания антигена после конъюгации лекарственного средства-линкера. В особенно предпочтительном варианте осуществления настоящее изобретение относится к ADC, где указанный сконструированный цистеин находится в одном или более положений указанного антитела против 5T4, выбранных из HC 40 и 41, и 40 и 41 LC (в части Fab указанного антитела). Предпочтительно указанный сконструированный цистеин находится в положении 41 HC или 40 и 41 LC, более предпочтительно в 41 HC.
Как известно из литературы, опухолеассоциированные протеазы в микроокружении опухоли могут частично расщеплять константные домены Fc в шарнирной области, конъюгация в части Fab является более предпочтительной, чем конъюгация в части Fc. Расщепление константных доменов Fc приводит к потере Fc-коньюгированных лекарственных средств-линкеров, что в свою очередь может приводить к пониженной активности ADC in vivo. (Fan et al., Breast Cancer Res. 2012; 14: R116 и Brezsky et al., PNAS 2009; 106: 17864-17869). Кроме того, конъюгация в этих положениями в части Fab также обеспечивает использование антигенсвязывающих фрагментов антител против 5T4, описываемых в настоящем описании.
(Сайт-специфические) ADC в соответствии с настоящим изобретением обладают аффинностями связывания, аналогичными "голым" антителам и высокой активностью in vitro, и обладают улучшенным профилем in vivo по сравнению с ADC, направленными на 5T4, известными из предшествующего уровня техники. Ожидают, что сайт-специфические ADC в соответствии с настоящим изобретением характеризуется низкой неспецифической токсичностью in vivo по сравнению с направленными на 5T4 ADC предшествующего уровня техники. В ADC к 5T4 по изобретению лекарственное средство-линкер является защищенным (что делает ADC в меньшей степени подверженными расщеплению внеклеточными протеазами) и, таким образом, лекарственное средство с меньшей вероятностью высвобождается преждевременно.
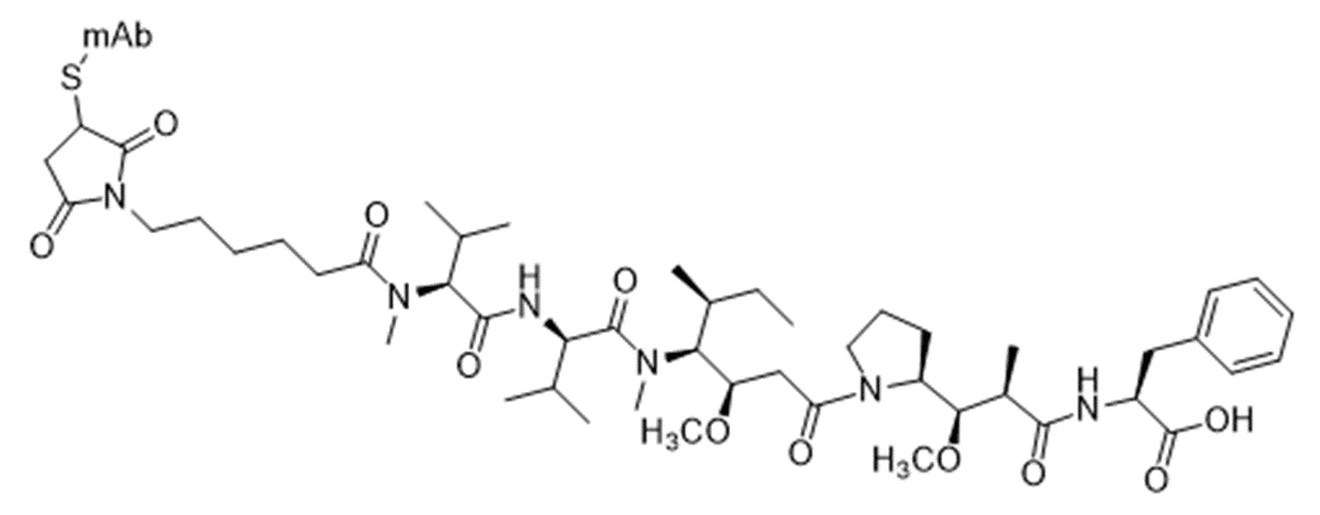
В соответствии с настоящим изобретением любое лекарственное средство-линкер, известное в данной области ADC, можно использовать для (сайт-специфической) конъюгации с антителами по настоящему изобретению, при условии, что оно содержит химическую группу, которая может взаимодействовать с тиольной группой нативного или сконструированного цистеина, как правило, малеинимидноц или галоацетильной группой. Подходящие лекарственные средства-линкеры в качестве цитотоксического лекарственного средства могут содержать производное дуокармицинр, калихимицинр, димерр пирролобензодиазепина (PBD), майтанзиноидр или ауристатинр. В соответствии с настоящим изобретением можно использовать расщепляемый или нерасщепляемый линкер. Предпочтительно цитотоксическое лекарственное средство представляет собой производное дуокармицина, майтанзиноида или ауристатина. Подходящие примеры лекарственных средств на основе майтанзиноида включают DM1 и DM4. Подходящие примеры лекарственных средств на основе ауристатина включают MMAE и MMAF.
Эти сокращенные обозначения хорошо известны специалисту в данной области. Примеры подходящих лекарственных средств-линкеров, известных специалисту в данной области, включают mc-vc-PAB-MMAE (также сокращенно обозначаемый как mc-vc-MMAE и vc-MMAE), mc-MMAF и mc-vc-MMAF. Предпочтительно используемый линкер представляет собой расщепляемый линкер, содержащий валин-цитруллин (vc) или валин-аланин (va).
Родовые молекулярные структуры (сайт-специфических) vc-MMAE ADC и mc-MMAF ADC в соответствии с настоящим изобретением описаны ниже.
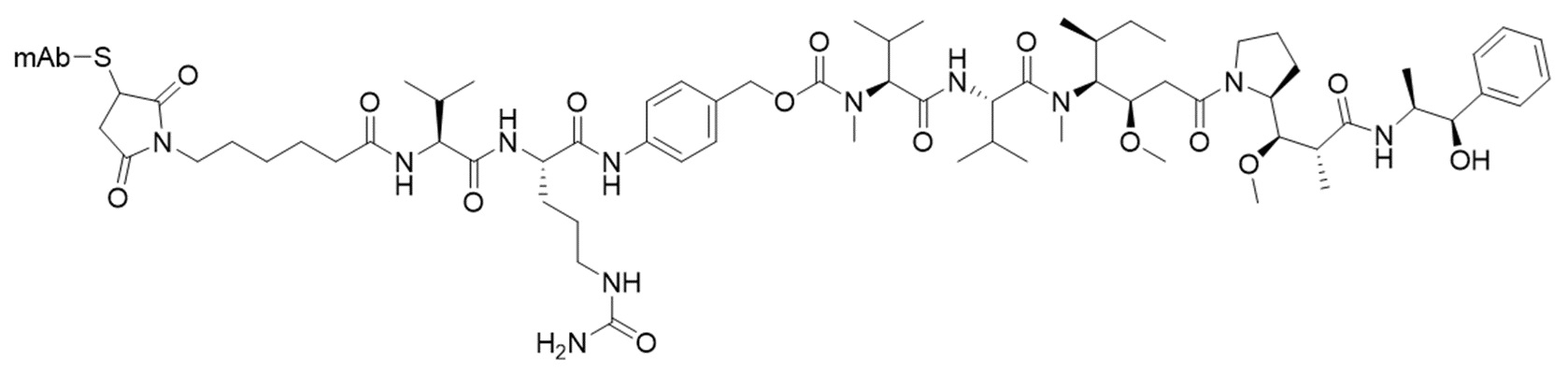
Молекулярная структура vc-MMAE, связанного с mAb
Молекулярная структура mc-MMAF, связанного с mAb
В одном из вариантов осуществления настоящее изобретение относится к ADC, где лекарственное средство-линкер содержит производное дуокармицина.
Дуокармицины, первые выделенные из культурального бульона вида Streptomyces, являются представителями семейства противоопухолевых антибиотиков, которые включают дуокармицин A, дуокармицин SA и CC-1065. Дуокармицины связываются с малой бороздкой ДНК, и затем вызывают необратимое алкилирование ДНК. Это нарушает архитектуру нуклеиновой кислоты, что в конечном счете приводит к гибели опухолевой клетки.
В WO2011/133039 описана серия лекарственных средств-линкеров, содержащих производное дуокармицина CC-1065. Подходящие линкер-производные дуокармицина, используемые в соответствии с настоящим изобретением описаны на страницах 182-197. Химический синтез ряда таких лекарственных средств-линкеров описан в примерах 1-12 WO2011/133039.
В одном из вариантов осуществления настоящее изобретение относится к ADC формулы (I)
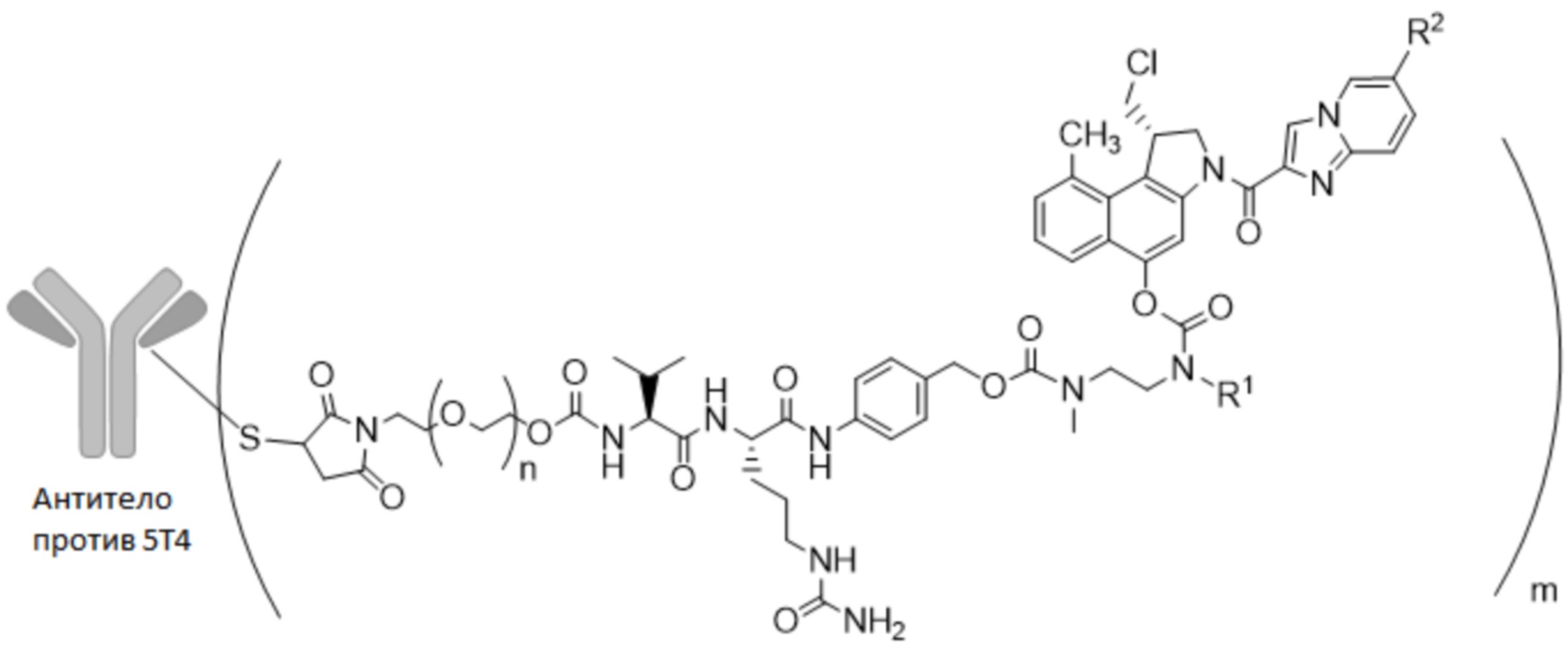
где
"антитело против 5T4" представляет собой антитело против 5T4 по настоящему изобретению без или по меньшей мере с одним сконструированным цистеином в HC или LC, как описано в настоящем описании,
n представляет собой 0-3, предпочтительно 0-1,
m представляет собой среднее DAR от 1 до 6, предпочтительно от 1 до 4,
R1 выбран из
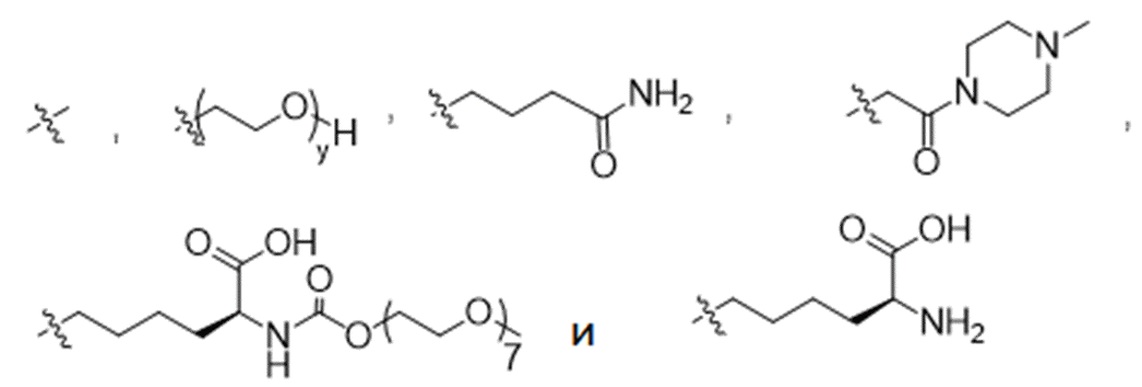
y представляет собой 1-16, и
R2 выбран из
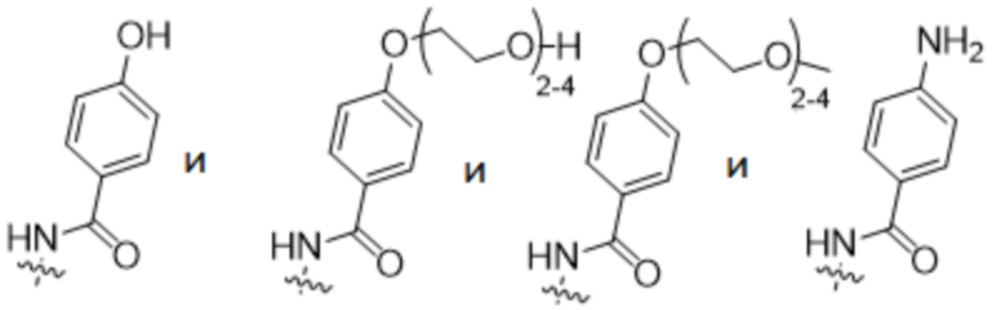
В предпочтительном варианте осуществления ADC формулы (I) содержит антитело против 5T4 по настоящему изобретению, содержащее по меньшей мере один сконструированный цистеин в HC или LC, где лекарственное средство-линкер сайт-специфически конъюгируют с антителом против 5T4 через сконструированный цистеин. Предпочтительно сконструированный цистеин находится в положении 40, 41 или 89 HC или 40 или 41 LC, более предпочтительно в 41 или 40 HC или 41 LC, наиболее предпочтительно в 41 HC.
В структурных формулах, приведенных в настоящем описании, n представляет собой целое число от 0 до 3, при этом m представляет собой среднее отношение лекарственного средства к антителу (DAR) от 1 до 6. Как известно в данной области, Распределение DAR и нагрузка лекарственным средством можно определять, например, с использованием хроматографии на основе гидрофобных взаимодействий (HIC) или высокоэффективной жидкостной хроматографии с обращенными фазами (ОФ-ВЭЖХ). HIC является особенно подходящей для определения среднего DAR.
ADC формулы (I) в соответствии с настоящим изобретением можно получать способами и процедурами, которые хорошо известны специалисту в данной области.
Подходящий способ неспецифической (случайной) конъюгации лекарственных средств-линкеров на основе дуокармицина, т.е. конъюгации в нативный цистеин, описан в примере 15 WO2011/133039, в тоже время Doronina et al. Bioconjugate Chem. 17 (2006): 114-124 описывают неспецифическую конъюгацию с mc-MMAF.
Подходящие способы сайт-специфически конъюгированных лекарственных средствах-линкеров можно найти, например, в примерах 7 и 8 WO2005/084390, в которых описаны стратегии полного восстановления для (частичной) нагрузки антител лекарственным средством vc-MMAE-линкером, и в примерах 11 и 12 WO2006/034488, в которых описана сайт-специфическая конъюгация содержащего майтанзиноид (DM1) лекарственного средства-линкера.
В конкретном варианте осуществления настоящее изобретение относится к ADC формулы (I), как описано выше в настоящем описании, где n представляет собой 0-1, m представляет собой среднее DAR от 1 до 6, предпочтительно от 1 до 4, более предпочтительно от 1 до 2, даже более предпочтительно от 1,5 до 2, наиболее предпочтительно от 1,8 до 2,
R1 выбран из
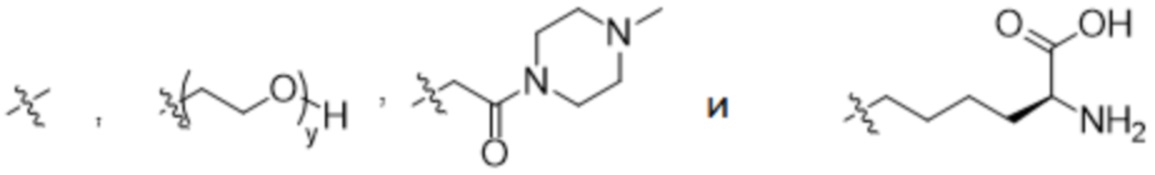
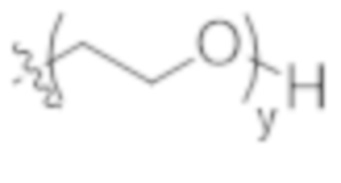
y представляет собой 1-16, предпочтительно 1-4, и
R2 выбран из
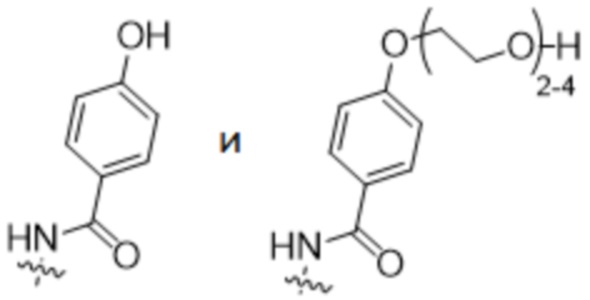
В конкретном варианте осуществления настоящее изобретение относится к ADC структурной формулы (I), как описано выше в настоящем описании, где n представляет собой 0-1, m представляет собой среднее DAR от 1,5 до 2, предпочтительно от 1,8 до 2, R1 представляет собой
y представляет собой 1-4, и R2 выбран из

В особенно предпочтительном варианте осуществления настоящее изобретение относится к ADC формулы (II)
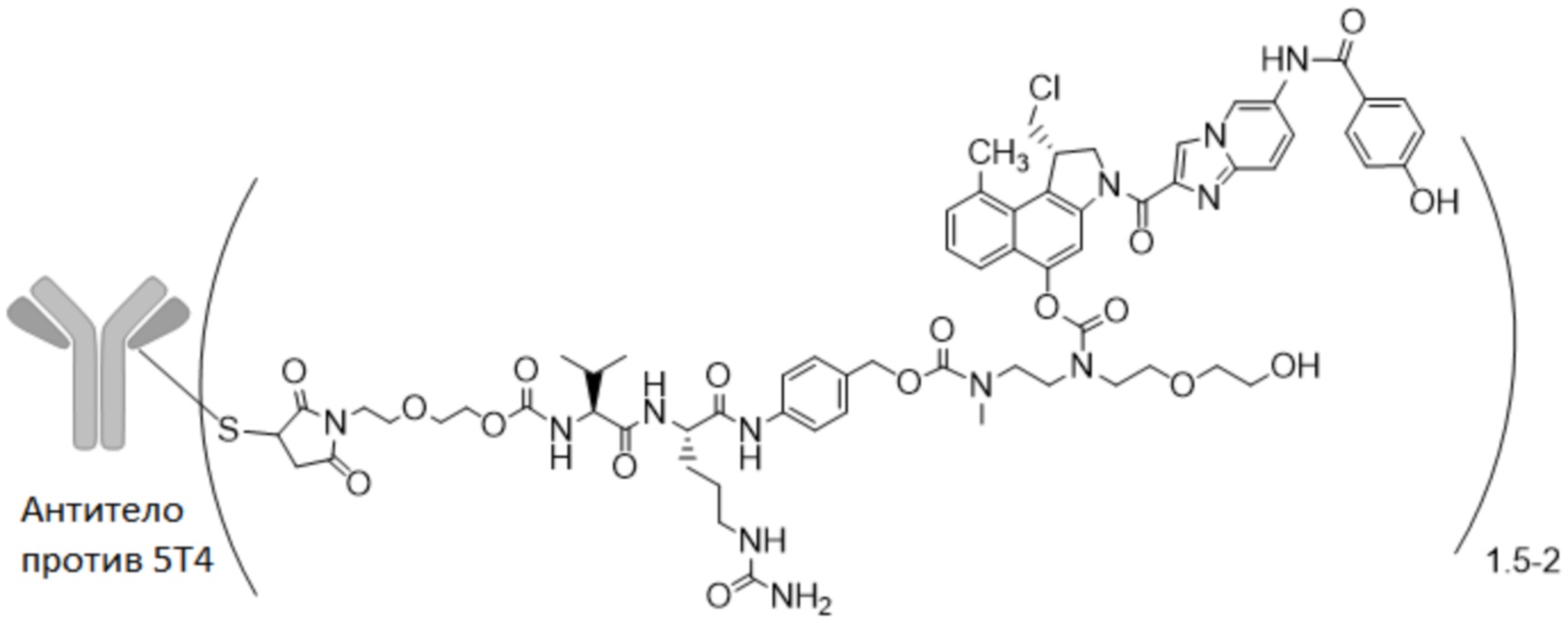
где "антитело против 5T4" представляет собой антитело против 5T4 по настоящему изобретению без или по меньшей мере с одним сконструированным цистеином в HC или LC, как описано в настоящем описании, и m представляет собой среднее DAR от 1,5 до 2, предпочтительно от 1,8 до 2.
В предпочтительном варианте осуществления ADC формулы (II) содержит антитело против 5T4 по настоящему изобретению, содержащее по меньшей мере один сконструированный цистеин в HC или LC, где лекарственное средство-линкер сайт-специфически конъюгируют с антителом через сконструированный цистеин. Предпочтительно указанный сконструированный цистеин находится в положении 40, 41 или 89 HC или 40 или 41 LC, более предпочтительно в 41 или 40 HC или 41 LC, наиболее предпочтительно в 41 HC.
В предпочтительном варианте осуществления настоящее изобретение относится к ADC формулы (II), содержащему антитело против 5T4, содержащее CDR HCVR и LCVR, выбранные из группы, состоящей из:
a. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:1 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:2;
b. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:5 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:6, и
c. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:11 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:12.
В более предпочтительном варианте осуществления настоящее изобретение относится к ADC формулы (II), содержащему гуманизированное антитело против 5T4, содержащее HCVR и LCVR, выбранные из группы, состоящей из:
a. аминокислотной последовательности HC SEQ ID NO:40 и аминокислотной последовательности LC SEQ ID NO:51;
b. аминокислотной последовательности HC SEQ ID NO:41 и аминокислотной последовательности LC SEQ ID NO:51;
c. аминокислотной последовательности HC SEQ ID NO:42 и аминокислотной последовательности LC SEQ ID NO:49;
d. аминокислотной последовательности HC SEQ ID NO:43 и аминокислотной последовательности LC SEQ ID NO:50;
e. аминокислотной последовательности HC SEQ ID NO:38 и аминокислотной последовательности LC SEQ ID NO:47, и
f. аминокислотной последовательности HC SEQ ID NO:39 и аминокислотной последовательности LC SEQ ID NO:48.
Даже в более предпочтительном варианте осуществления настоящее изобретение относится к ADC формулы (II), содержащему антитело против 5T4 по настоящему изобретению, содержащее по меньшей мере один сконструированный цистеин в одном или более положений, выбранных из HC 40 и 41, и LC 40 и 41, где лекарственное средство-линкер сайт-специфически конъюгируют с антителом против 5T4 через сконструированный цистеин. Предпочтительно указанный сконструированный цистеин находится в положении 41 или 40 HC или 41 LC, наиболее предпочтительно в 41 HC.
В наиболее предпочтительном варианте осуществления настоящее изобретение относится к ADC формулы (II), содержащему гуманизированное антитело против 5T4, содержащее HCVR и LCVR, выбранные из группы, состоящей из:
a. аминокислотной последовательности HCVR SEQ ID NO:61 и аминокислотной последовательности LCVR SEQ ID NO:51;
b. аминокислотной последовательности HCVR SEQ ID NO:62 и аминокислотной последовательности LCVR SEQ ID NO:51;
c. аминокислотной последовательности HCVR SEQ ID NO:63 и аминокислотной последовательности LCVR SEQ ID NO:49;
d. аминокислотной последовательности HCVR SEQ ID NO:64 и аминокислотной последовательности LCVR SEQ ID NO:50;
e. аминокислотной последовательности HCVR SEQ ID NO:59 и аминокислотной последовательности LCVR SEQ ID NO:47, и
f. аминокислотной последовательности HCVR SEQ ID NO:60 и аминокислотной последовательности LCVR SEQ ID NO:48;
где лекарственное средство-линкер сайт-специфически конъюгируют с антителом против 5T4 через сконструированный цистеин в положении 41 HC.
Настоящее изобретение дополнительно относится к фармацевтической композиции, содержащей антитело против 5T4 или ADC против 5T4, как описано выше в настоящем описании, и один или более фармацевтически приемлемых эксципиентов. Характерные фармацевтические составы терапевтических белков, таких как mAb и (моноклональных) ADC, принимают форму лиофилизированных осадков (лиофилизированных порошков), для которых необходимо (водное) растворение (т.е. восстановление) перед внутривенной инфузией, или замороженных (водных) растворов, для которых необходимо оттаивание перед использованием.
Как правило, фармацевтическая композиция предоставлена в форме лиофилизированного осадка. Подходящие фармацевтически приемлемые эксципиенты для введения в фармацевтическую композицию (перед сушкой вымораживанием) в соответствии с настоящим изобретением, включают буферные растворы (например, содержащие цитрат, гистидин или сукцинат соли в воде), лиопротекторы (например, сахарозу, трегалозу), модификаторы тоничности (например, хлорид натрия), поверхностно-активные вещества (например, полисорбат) и наполнители (например, маннит, глицин). Эксципиенты, используемые для высушенных заморозкой белковых составов выбирают в зависимости от их способности предотвращать денатурацию белков во время процесса сушки вымораживанием, а также во время хранения. В качестве примера, стерильный одноразовый состав на основе лиофилизированного порошка Kadcyla™ (Roche) содержит - при восстановлении бактериостатической или стерильной водой для инъекций (BWFI или SWFI) - 20 мг/мл адо-трастузумаб эмтазин, 0,02% масс./об. полисорбата 20, 10 мМ сукцината натрия и 6% масс./об. сахарозы при pH 5,0.
Настоящее изобретение дополнительно относится к антителу против 5T4, ADC или фармацевтической композиции, как описано выше в настоящем описании, для применения в качестве лекарственного средства.
В одном из вариантов осуществления настоящее изобретение относится к антителу против 5T4, ADC или фармацевтической композиции, как описано выше в настоящем описании, для применения в лечении солидных опухолей и гематологических злокачественных новообразований человека, предпочтительно солидных опухолей человека.
В предпочтительном варианте осуществления настоящее изобретение относится к антителу против 5T4, ADC или фармацевтической композиции, как описано выше в настоящем описании, в частности к ADC, содержащему лекарственное средство-линкер на основе производного дуокармицина, для применения в лечении солидных опухолей человека, выбранных из группы, состоящей из рака молочной железы, рака желудка, колоректального рака, рака яичника, рака легких (особенно немелкоклеточного рака легких (NSCLC) и мелкоклеточного рака легких (SCLC)), и (злокачественной плевральной) мезотелиомы.
В дополнительном варианте осуществления настоящее изобретение относится к антителу против 5T4, ADC или фармацевтической композиции, как описано выше в настоящем описании, в частности к ADC, содержащему лекарственное средство-линкер на основе производного дуокармицина для применения в лечении гематологических злокачественных новообразований человека, в частности лейкоза, выбранного из группы, состоящей из острого лимфобластного лейкоза и миелоидного лейкоза (ALL и AML, соответственно).
Настоящее изобретение дополнительно относится к использованию последовательно или одновременно вводимой комбинации антитела против 5T4, ADC антитела против 5T4 или фармацевтической композиции, как описано выше в настоящем описании, с терапевтическим, химиотерапевтическим средство, и/или ADC против связанной со злокачественной опухолью мишенью, отличной от антигена 5T4, для лечения солидных опухолей и гематологических злокачественных новообразований человека, как описано выше в настоящем описании.
В одном из вариантов осуществления настоящего изобретения в частности в случае ADC против 5T4, содержащего производное лекарственное средство-линкер на основе дуокармицина, терапевтическое антитело представляет собой бевацизумаб, цетуксимаб, ниволумаб или рамицируиа, и химиотерапевтическое средство представляет собой алкилирующее средство, в частности циклофосфамид, ифосфамид или триазин, в частности темозоломид, или лекарственное средство на основе платины, более конкретно цисплатин или карбоплатин, антиметаболит, в частности гемцитабин или пеметрексед, ингибитор топоизомеразы II, в частности этопозид, ингибитор митоза, в частности таксан, более конкретно паклитаксел или доцетаксел, или алкалоид барвинка, более конкретно винбластин или винорелбин, или ингибитор сигнального каскада, в частности ингибитор тирозинкиназы, более конкретно иматиниб, эрлотиниб, серитиниб, кризотиниб или афатиниб.
В дополнительном варианте осуществления настоящего изобретения в частности в случае ADC против 5T4, содержащем производное лекарственного средства-линкер на основе дуокармицина, терапевтическое антитело представляет собой бевацизумаб, и химиотерапевтическое средство представляет собой алкилирующее средство, в частности азотистый иприт, в частности ифосфамид или циклофосфамид, лекарственное средство на основе платины, в частности цисплатин или карбоплатин, или триазин, в частности темозоломид, противоопухолевый антибиотик, в частности доксорубицин, антиметаболит, в частности гемцитабин, ингибитор топоизомеразы I или II, конкретно топотекан, иринотекан или этопозид, или ингибитор митоза, в частности таксан, более конкретно паклитаксел или доцетаксел, или алкалоид барвинка, более конкретно винкристин или винорелбин.
В еще одном дополнительном варианте осуществления настоящего изобретения, в частности в случае ADC против 5T4, содержащем производное лекарственное средство-линкер на основе дуокармицина, терапевтическое антитело представляет собой аматуксимаб, и химиотерапевтическое средство представляет собой алкилирующее средство, в частности лекарственное средство на основе платины, более конкретно цисплатин или карбоплатин, антиметаболит, в частности гемцитабин или пеметрексед, или ингибитор митоза, в частности алкалоид барвинка, более конкретно винорелбин.
Терапевтически эффективное количество антитела против 5T4 или ADC в соответствии с настоящим изобретением находится в диапазоне приблизительно от 0,01 приблизительно до 15 мг/кг массы тела, в частности в диапазоне приблизительно от 0,1 приблизительно до 10 мг/кг массы тела, более конкретно в диапазоне приблизительно от 0,3 приблизительно до 10 мг/кг массы тела. Этот последний диапазон приблизительно соответствует постоянной дозе в диапазоне от 20 до 800 мг антитела или ADC. Соединение по настоящему изобретению можно вводить еженедельно, два раза в неделю, три раза в неделю, каждый месяц или шесть раз в неделю. Подходящие схемы лечения зависят от тяжести заболевания, возраста пациента, вводимого соединения, и таких других факторов, как остается на усмотрение лечащего врача.
Примеры
Протокол иммунизации и отбор
Кроликов повторно иммунизировали смесью белка hu5T4/cyno5T4 (2 кролика) и клетками MDA-MB-468 (2 кролика). В различные моменты времени собирали приблизительно 20 мл крови. Одиночные B-клетки вносили в отдельные лунки планшетов для микротитрования. Эти B-клетки культивировали в течение нескольких суток в присутствии кондиционированной среды и фидерных клеток. В течение этого периода времени они продуцировали и высвобождали моноклональные антитела в культуральную среду (супернатанты B-клеток). Супернатанты этих одиночных B-клеток анализировали на продукцию IgG, затем определяли специфическое связывание антигена 5T4 hu и cyno и связывание с экспрессирующими 5T4 клетками MDA-MB-468. Выбирали 160 супернатантов от B-клеток и секвенировали, т.к. эти антитела связывались с антигеном 5T4 человека и cyno, а также с клетками MDA-MB-468. Получали 131 уникальные вариабельные области тяжелых и легких цепей антитела, синтезировали ген и клонировали в константные части иммуноглобулина человека подкласса IgG1. Клетки HEK 293 транзиторно трансфицировали содержащими последовательности иммуноглобулина плазмидами с использованием автоматизированной процедуры на платформе Tecan Freedom Evo. Иммуноглобулины выделяли из клеточного супернатанта с использованием аффинной очистка (белок A) на системе ВЭЖХ Dionex Ultimate 3000 с планшетным автодозатором. Исключали 4 образца с очень слабой продуктивностью, получая в итоге 127 антител для повторного тестирования. Антитела выбирали в зависимости от их специфического связывания антигена 5T4 человека и cyno и от связывания экспрессирующих 5T4 человека клеток MDA-MB-468.
Связывание с антигеном 5T4 hu и cyno определяли следующим ниже способом. Планшет для микротитрования формата 384 лунки покрывали антигеном 5T4 hu или cyno. Добавляли антитело сравнения, супернатанты B-клеток или рекомбинантно полученное антитело и детектировали связывание посредством антитела к POD кролика или человека.
Для связывания с клетками MDA-MB-468 клетки высевали черные планшеты для микротитрования для культивирования клеток (Corning). Специфические антитела, получаемые из супернатанты B-клеток, или антитела сравнения оставляли взаимодействовать с клетками. Связывание детектировали с использованием меченного Alexa Fluor 488 антитела. Флуоресценцию считывали с использованием устройства CellInsight (Thermo Fischer).
Выбирали 17 антител и измеряли аффинность к антигену 5T4 измеряли с использованием клеток MDA-MB-468, клетки PA-1 и клетки китайского хомяка (CHO) млекопитающих, экспрессирующие антиген 5T4 человека или cyno (таблица 2). В текущей заявке используемые клетки CHO обозначают как CHOZN, т.к. эти клетки CHO, экспрессирующие антиген 5T4 человека или cyno, получали с использованием платформы CHOZN® от Sigma-Aldrich. Клетки CHOZN (SAFC) транзиторно трансфицировали с использованием устройства нуклеофектор Amaxa (Lonza) по инструкциям производителя. Использовали стандарт, коммерчески доступные экспрессирующие векторы млекопитающих (SAFC, Life Technologies), которые содержали полноразмерную кодирующую последовательность антигена 5T4 человек и cyno (под номером доступа NP_006661.1 и Q4R8Y9 соответственно), которой предшествует промотор CMV человека. Перед использованием в исследованиях связывания антитела транзиторно трансфицированные клетки CHOZN культивировали по инструкциям производителя. Выбранные 17 антитела характеризуются аминокислотными последовательностями в соответствии со следующей ниже таблицей (таблица 1).
Таблица 1. Моноклональные антитела против химерного 5T4
Протокол оценки аффинности in vitro
Клетки MDA-MB-468, клетки PA-1 или клетки CHOZN, экспрессирующие антиген 5T4 человека или cyno, (100000 клеток/лунку в 96-луночном планшете) отмывали три раза ледяным буфером FACS (1×PBS (Lonza), содержащим 0,2% об./мас. BSA (Sigma-Aldrich, St. Louis, MO)) и 0,02% об./мас. NaN3 (Sigma-Aldrich) с последующим добавлением каждого первичного mAb (50 мкл/лунку) в диапазоне концентраций, разведенного в ледяном буфере FACS. После инкубации 30 минут при 4°C клетки отмывали три раза ледяным буфером FACS и добавляли 50 мкл/лунку фрагмента вторичного mAb (AffiniPure F(ab')2 козы против IgG-APC человека, разведенного 1:6000 dilution, Jackson Immuno Research). Через 30 минут при 4°C клетки дважды отмывали и ресуспендировали в 150 мкл буфер FACS. Интенсивности флуоресценция определяли проточной цитометрией (BD FACSVerse, Fanklin Lakes, NJ) и обозначали в виде средней интенсивности флуоресценции (MFI). Проводили аппроксимацию кривых посредством нелинейной регрессии с использованием уравнения сигмоидальной зависимости доза-ответ с переменным наклоном (четыре параметра) в GraphPad Prism (версия 5.01/6.01 для Windows, GraphPad, San Diego, CA). Величины EC50 рассчитывали как концентрацию в мкг/мл, которая дает ответа посередине между нижней и верхней частью кривой при использовании 4 параметрической логистической аппроксимации.
Аффинность химерных антител, измеряемых на экспрессирующих антиген 5T4 человека (hu 5T4) клетках MDA-MB-468, находится в диапазоне EC50 от 0,040 мкг/мл до 0,730 мкг/мл, сравнимом с величиной EC50 H8, которая составляет 0,19 мкг/мл. Однако антитело A1 характеризуются связыванием с 5T4 hu с более низкой аффинностью (величина EC50 составляет 4,72 мкг/мл), как измеряют на клетках MDA-MB-468. Аффинность химерных антител к 5T4 hu также измеряли на клетках PA-1 и на клетках CHOZN, экспрессирующих 5T4 hu. Величины EC50 химерных антител вновь находились в том же диапазоне, что и величины EC50 H8, тогда как для A1 демонстрировали по меньшей мере в 3 раза более низкую аффинность связывания к 5T4 hu (таблица 2). Величины EC50 A3 для трех типов клеток, экспрессирующих 5T4 hu, являлись ниже, чем величины EC50 химерных антител для соответствующих типов клеток.
Химерные антитела против 5T4 обладают схожей аффинностью к 5T4 hu и к cyno 5T4 при измерении с использованием клеток CHOZN, экспрессирующих 5T4 hu, или клеток CHOZN, экспрессирующих cyno 5T4, как приведено в таблице 2. По сравнению со связыванием H8 с cyno 5T4, связывание характеризуется 32-кратным увеличением для большей части химерных антитела, за исключением 846 (в 10 раз) и 828 (в 7 раз).
Таблица 2. Аффинность химерных mAb, как измеряют на клетках, экспрессирующих 5T4 hu и 5T4 cyno
Гуманизация
Гуманизированные антитела получали пересадкой CDR, как описано ниже.
CDR клонов 789, 825 и 833 идентифицировали с использованием определений CDR из системы нумерации IMGT (LEFRANC, MP, The IMGT unique numbering for immunoglobulins, T cell receptors and Ig-like domains. The Immunologist, 7 (1999), pp. 132-136) и Kabat.
Проводили поиск в общедоступных в режиме реального времени базы данных последовательностей IgG человека с использованием домена VH кролика, с использованием алгоритмов поиска BLAST, и вариабельные домены-кандидаты человека выбрали из первых в списке 200 результатов BLAST. Выбирали пять кандидатов на основании критериев, таких как гомология каркаса, сохранение ключевых каркасных остатков, каноническая структура петли и иммуногенность. Аналогичную процедуру повторяли для домена VL антитела. Все гуманизированные варианты VH комбинировали со всеми гуманизированными вариантами VL, что приводило к 25 гуманизированным вариантам для каждого антитела.
Гуманизированные варианты, содержащие мутацию HC-41C, синтезировали в соответствии с описанным ниже способом и измеряли их аффинность к 5T4 человека и cyno с использованием клеток CHOZN, экспрессирующих 5T4 человека или cyno. Для дальнейшей оценки выбирали 11 вариантов.
Транзиторная экспрессия антител
a) Получение конструкций ДНК и экспрессирующих векторов
Каждую из HCVR аминокислотной последовательности A1 мыши из US8044178, SEQ ID NO:2, положения 20-138, HCVR аминокислотной последовательности A3 мыши из US8044178, SEQ ID NO:10, положения 20-141, и HCVR аминокислотной последовательности гуманизированного варианта 1 H8 из SEQ ID NO:52 присоединяли на N-конце к лидерной последовательности HAVT20 (SEQ ID NO:54), и на C-конце к константному домну HC IgG1 человека в соответствии с SEQ ID NO:55. Получаемые химерные аминокислотные последовательности обратно транслировали в последовательность кДНК, оптимизированную по кодону для экспрессии в клетках человека (Homo sapiens).
Аналогично получали химерную последовательность кДНК для LC конструкции путем присоединения последовательностей подходящего сигнала секреции (также лидерной последовательности HAVT20), LCVR аминокислотной последовательности A1 мыши из US8044178, SEQ ID NO:4, положения 21-127, LCVR аминокислотной последовательности A3 мыши из US8044178, SEQ ID NO:12, положения 21-127, или LCVR аминокислотной последовательности гуманизированного варианта 1 H8 SEQ ID NO:53, и константной области κ-легкой цепи IgG человека (SEQ ID NO:56), и обратной трансляции получаемых аминокислотных последовательностей в последовательность кДНК, оптимизированную по кодону для экспрессии в клетках человека (Homo sapiens).
Последовательности кДНК для LC и HC гуманизированных вариантов с мутацией HC-41C получали аналогичным способом, однако в этом случае последовательности HC и LC присоединяли к N-концу лидерных последовательностей кролика (SEQ ID NO:57 и 58, соответственно) и к C-концу константного домена HC IgG1 человека в соответствии с SEQ ID NO:55. Использовали последовательности в соответствии со следующей ниже таблицей, содержащие цистеин в положении 41 HCVR в соответствии с нумерацией по Kabat (таблица 3).
Таблица 3. HCVR и LCVR гуманизированных вариантов HC-41C
b) Стратегия конструкции вектора и клонирования
Для экспрессии цепей антитела использовали производное коммерчески доступного (Thermo Fisher) экспрессирующего вектора млекопитающих pcDNA3.3, который содержит экспрессирующую кассету CMV:BGHpA. Этот вектор незначительно адаптировали посредством замены участка множественного клонирования ниже промотора CMV таким образом, чтобы он содержал участки рестрикции AscI и NheI, получая экспрессирующий вектор 0080pcDNA3.3-SYN.
кДНК для HC и LC конструкции лигировали непосредственно в вектор 0080pcDNA3.3-SYN с использованием участков рестрикции AscI и NheI. Конечные векторы, содержащие экспрессирующую кассету HC или LC (CMV:HC:BGHpA и CMV:LC-BGHpA, соответственно) переносили и амплифицировали в клетках NEB 5-альфа E. coli. Крупномасштабное производство конечных экспрессирующих векторов для трансфекции проводили с использованием наборов Maxi- или Megaprep (Qiagen).
c) Транзиторная экспрессия в клетках млекопитающих
Коммерчески доступные клетки ExpI293F (Thermo Fisher) трансфицировали экспрессирующими векторами с использованием средства для трансфекции ExpiFectamine по инструкциям производителя так, как указано ниже: 75×107 клеток высевали в 300 мл среды FortiCHO, 300 мкг экспрессирующего вектора комбинировали с 800 мкл средства для трансфекции ExpiFectamine и добавляли к клеткам. Через одни сутки после трансфекции к культуре добавляли 1,5 мл энхансера 1 и 15 мл энхансера 2. Через шесть суток после трансфекции собирали супернатант культуры клеток центрифугированием при 4000g в течение 15 минут и фильтрованием осветленного сбора через фильтры для бутылок PES/фильтры MF 75 (Nalgene).
Измерения аффинности с использованием анализа на основе клеток
Гуманизированные антитела против 5T4 обладают сходной аффинностью к 5T4 hu и 5T4 cyno, как измеряют на клетках CHOZN, экспрессирующих 5T4 hu или 5T4 cyno, за исключением гуманизированных антител против 5T4 825a, 825b и 825c, которые характеризуются в 2-3 раза более низким связыванием с 5T4 cyno по сравнению с 5T4 hu (таблица 4). По сравнению со связыванием H8 с 5T4 cyno связывание является в 4-17 раз выше для гуманизированных антител против 5T4. По сравнению с A1 связывание, аналогично, повышается. Аффинность гуманизированных антител против 5T4 к экспрессирующим 5T4 hu клеткам CHOZN является сравнимой с H8.
Таблица 4. Аффинность гуманизированных mAb с мутацией HC-41C и одного химерного mAb с мутацией HC-41C, как измеряют на экспрессирующих 5T4 hu и 5T4 cyno клетках CHOZN
1 95% CI представляет собой 95% доверительный интервал
Протокол общей сайт-специфической конъюгации
К раствору антитела против 5T4 с конструированным цистеином (5-10 мг/мл в 4,2 мМ гистидина, 50 мМ трегалозы, pH 6) добавляли EDTA (25 мМ в воде, 4% об./об.). pH доводили до ~7,4 с использованием TRIS (1 M в воде, pH 8), после чего добавляли TCEP (10 мМ в воде, 20 эквивалентов) и инкубировали получаемую смесь при комнатной температуре в течение 1-3 часов. Избыток TCEP удаляли посредством колонки для обессоливания PD-10 или центрифужного концентратора Vivaspin (граница пропускания 30 кДа, PES) с использованием 4,2 мМ гистидина, 50 мМ трегалозы, pH 6. pH получаемого раствора антитела поднимал до ~7,4 с использованием TRIS (1 M в воде, pH 8), после чего добавляли дегидроаскорбиновую кислоту (10 мМ в воде, 20 эквивалентов) и инкубировали получаемую смесь при комнатной температуре в течение 1-2 часов. Добавляли DMA, затем раствор лекарственного средства-линкера (10 мМ в DMA). Конечная концентрация DMA составляла 5-10%. Получаемую смесь инкубировали при к смеси при комнатной температуре в течение 1 часа. Уголь удаляли с использованием фильтра 0,2 мкм PES и получаемые ADC формулировали в 4,2 мМ гистидина, 50 мМ трегалозы, pH 6 с использованием центрифужного концентратора Vivaspin (граница пропускания 30 кДа, PES). В заключении, раствор ADC фильтровали в стерильных условиях с использованием фильтра PES 0,22 мкм.
Протокол общей (случайной) конъюгации для конъюгации через частично восстановленные нативные цистеины межцепьевой дисульфидной связи (дикого типа или конъюгация wt)
К раствору антитела против 5T4 (5-10 мг/мл в 4,2 мМ гистидина, 50 мМ трегалозы, pH 6) добавляли EDTA (25 мМ в воде, 4% об./об.). pH доводили до ~7,4 с использованием TRIS (1 M в воде, pH 8), после чего добавляли TCEP (10 мМ в воде, 1-3 эквивалентов в зависимости от антитела и желаемого DAR) и инкубировали получаемую смесь при комнатной температуре в течение 1-3 часов. Добавляли DMA с последующим добавлением раствора лекарственного средства-линкера (10 мМ в DMA). Конечная концентрация DMA составляла 5-10%. Получаемую смесь инкубировали при комнатной температуре в отсутствие света в течение 1-16 часов. Для удаления избытка лекарственного средства-линкера добавляли активированный уголь и инкубировали смесь при комнатной температуре в течение 1 часа. Удаляли уголь с использованием фильтра PES 0,2 мкм и получаемый ADC формулировали в 4,2 мМ гистидина, 50 мМ трегалозы, pH 6 с использованием центрифужного концентратора Vivaspin (граница пропускания 30 кДа, PES). В заключении раствор ADC фильтровали в стерильных условиях с использованием фильтра PES 0,22 мкм.
Указанными выше общими способами синтезировали ADC с конструированным цистеином и ADC дикого типа на основе vc-seco-DUBA (SYD980; т.е., соединение 18b, n=1 в примере 10 на странице 209 of WO2011/133039), и характеризовали с использованием аналитической хроматографии на основе гидрофобных взаимодействий (HIC), эксклюзионной хроматографии (SEC), экранированной хроматографии с гидрофобной фазой (SHPC), ОФ-ВЭЖХ и теста LAL с эндотоксином.
Для аналитической HIC 5-10 мкл образца (1 мг/мл) инъецировали в колонку TSKgel Butyl-NPR (4,6 мм ID×3,5 см L, Tosoh Bioscience, кат. ном. 14947). Способ элюирования заключался в линейном градиенте от 100% буфера A (25 мМ фосфата натрия, 1,5 M сульфата аммония, pH 6,95) до 100% буфера B (25 мМ фосфата натрия, pH 6,95, 20% изопропанола) при 0,4 мл/мин в течение 20 минут. Использовали систему СЭЖХ Waters Acquity H-Class, оснащенную детектором PDA и программным обеспечением Empower. Измеряли оптическую плотность при 214 нм и определяли время удержания ADC.
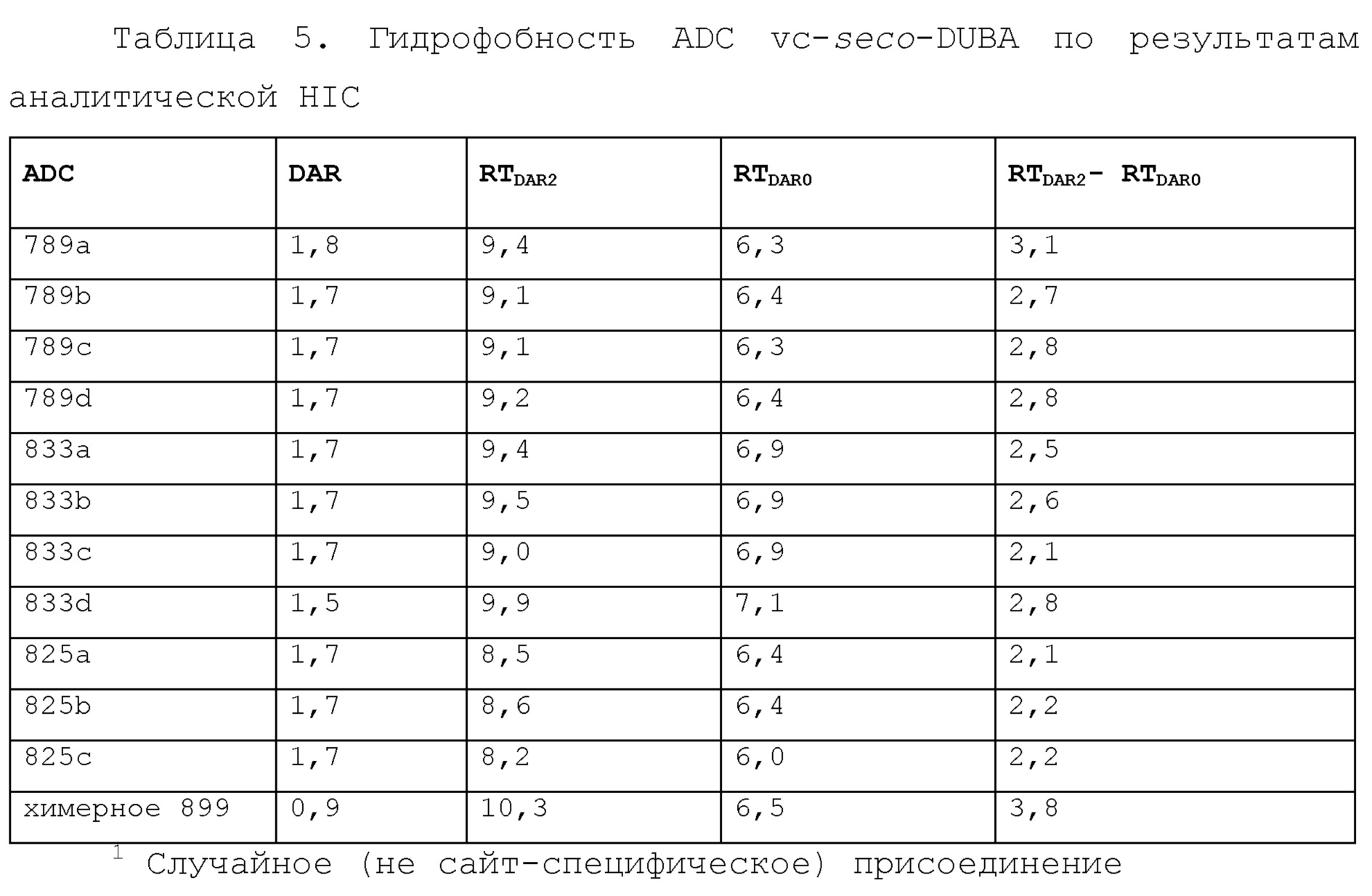
Как стало очевидно из аналитической HIC существовали различия во времени удержания (RT) для вида DAR2 различных ADC с сконструированными цистеинами. Также RT вида DAR2 большей части сконструированных ADC являлось ниже, чем RT конъюгата H8 wt (таблица 5), и увеличение времени удержания (RTDAR2-RTDAR0) при конъюгации двух лекарственных средств-линкеров являлось ниже для сконструированных гуманизированных ADC HC-41C по сравнению с увеличением для H8-vc-seco-DUBA wt. Все сконструированные гуманизированные ADC имеют значение RTDAR2-RTDAR0 2,1-3,1, которое является ниже, чем значение RTDAR2-RTDAR0 H8-vc-seco-DUBA wt 3,5, что указывает на то, что сконструированные гуманизированные ADC обладают пониженной гидрофобностью.
Цитотоксичность in vitro
На аффинности связывания антигена (сайт-специфических) ADC к 5T4 не оказывало влияние прикрепляемое производное лекарственное средство-линкер на основе дуокармицина, как измеряли на клетках CHOZN, экспрессирующих 5T4 hu или 5T4 cyno (фигуры 1 и 2). Как и ожидалось, несвязывающий контрольный ADC (ритуксимаб-vc-seco-DUBA) влиял на рост экспрессирующих 5T4 опухолевых клеток только при высоких концентрациях. Все гуманизированные ADC к 5T4 являлись неактивными (IC50>10 нМ) на SK-MEL-30, отрицательной по 5T4 линии опухолевых клеток человека (приблизительно 400 связывающих антиген 5T4 участка на клетку).
Активности сконструированных гуманизированных ADC к 5T4 являлись сравнимыми с активностью общепринято конъюгированных H8-wt ADC на экспрессирующих 5T4 hu клетках MDA-MB-468 и клетках PA-1 (таблица 6). Однако серия 833-ADC оказалась неспособной полностью снижать жизнеспособность клеток PA-1 (эффективность 65-72%). Кроме того, сконструированные гуманизированные ADC к 5T4 являлись более чем в 2,5 раза более эффективными, чем A3-vc-seco-DUBA и более чем в 14 раз более эффективными, чем A1-vc-seco-DUBA.
Таблица 6. Цитотоксичность in vitro ADC vc-seco-DUBA в опухолевых клетках человека, экспрессирующих 5T4
1 95% CI представляет собой 95% доверительный интервал
2 н/п неприменимо
Исследование эффективности in vivo
Эффективность in vivo ADC против 5T4 оценивали на модели ксенотрансплантата линии клеток BT474 (инвазивная протоковая карцинома молочной железы от пациента женского пола в возрасте 60 лет кавказской расы пациент) на мышах B6;D2-Ces1ce Foxn1nu/J мыши. Иммуногистохимическое окрашивание подтверждало присутствие 5T4 hu на клеточной мембране линии клеток BT474.
Опухоли индуцировали подкожно инъекцией 2×107 клеток BT-474 в 200 мкл среды RPMI 1640, содержащей матригель (50:50, об.:об.) в правый бок 110 самкам голых мышей Ces1ce, через 24-72 часа после облучения всего организма γ-источником (2 Гр,60Co, BioMep, Dijon, France). Когда опухоли достигали среднего объема 200-300 мм3, мышам дозировали однократную инъекцию 3 мг/кг ADC H8-, 833a-, 833b-, 833c-, 833d-, 825a- или 825c-vc-seco-DUBA. В качестве контролей использовали носитель и несвязывающий ADC ритуксимаб-vc-seco-DUBA. Мышей с активностью Ces1c в плазме исключали из анализа.
Все сайт-специфически конъюгированные ADC против 5T4 уменьшали объем опухоли более, чем предшествующий уровень техники H8-vc-seco-DUBA (фигура 3), что указывает на улучшенную эффективность in vivo.
Фармакокинетика in vivo
Исследование фармакокинетики проводили с использованием ADC против 5T4 на линии мышей B6(Cg)-Ces1ctm1.1Loc/J. У этих мышей отсутствует экзон 5 гена Ces1c, что приводит к отмене функции фермента. Мышей дозировали ADC против 5T4 (3 мг/кг, в/в в хвостовую вену) и собирали плазму через 0,25, 1, 6, 24, 48, 96, 168, 336 и 504 часа после дозирования. Анализы на основе ELISA использовали для количественной оценки общего антитела и конъюгированного антитела. В анализе конъюгированных антител улавливают виды ADC, которые содержат по меньшей мере одно соединение лекарственное средство-линкер. Результаты, приведенные в таблице 7, демонстрируют, что сайт-специфические ADC являются очень стабильными, медленно выводятся и обладают большим периодом полужизни по сравнению с ADC H8-vc-seco-DUBA предшествующего уровня техники.
Таблица 7 Фармакокинетика ADC против 5T4 у мышей Ces1c KO
н/о не определяли
Списки последовательностей с подчеркнутыми аминокислотными последовательностями CDR1, CDR2 и CDR3 в HCVR и аминокислотными последовательностями LCVR
SEQ ID NO:1 (HCVR клона/лунку 789 - кролик)
1 QSVEESGGRL VTPGTPLTLT CTASGFSLSS YWMSWVRQAP GKGLEWIGII
51 AGRGSTYYAS wakgrctISK TSTTVDLKIT SPTTEDTAAY FCARVSSIYY
101 TFNLWGQGTL VTVSS
SEQ ID NO:2 (LCVR клона/лунку 789 - кролик)
1 AQVLTQTPSS VSAAVGGTVT INCQSSQSVY SNNELSWYQQ KPGQPPKLLI
51 YYASTLASGV PSRFKGSGSG TQFTLTISGV QSDDAATYYC QGSYYSGSGW
101 YYAFGGGTEVVVK
SEQ ID NO:3 (HCVR клона/лунку 811 - кролик)
1 QSVEESGGRL VTPGTSLTLT CTASGFSLST YAMIWVRQAP GKGLEWIGII
51 NSSGYTYYAN WAKGRFTISK TSTTVDLKIT SPTTEDTATY FCARGNAGIS
101 YDVSFNLWGQ GTLVTVSS
SEQ ID NO:4 (LCVR клона/лунку 811 - кролик)
1 AYDMTQTPAS VEAGVGGTVT INCQASESIS SWLAWYQQKP GQPPNLLIYE
51 ASKLASGVPS RFSGSGSGTE FTLTISGVES ADAATYYCQQ GWTSSNIDNA
101 FGGGTEVVVK
SEQ ID NO:5 (HCVR клона/лунку 825 - кролик)
1 QSVEESGGRL VTPGTPLTLT CTVSGIDLSS YGMGWVRQAP GKGLEYIGII
51 SRNSVTYYAT WAKGRFTISK TSTTVDLKMT SPTTEDTATY FCARRATYSG
101 ALGYFDIWGP GTLVTVSF
SEQ ID NO:6 (LCVR клона/лунку 825 - кролик)
1 GYDMTQTPAS VSAAVGGTVT INCQASENIY STLAWYQQKP GQPPKVLIYDВ В
51 AFDLASGVPS RFKGSGSGTE YTLTISGVQS DDAATYYCQQ GYSGTNVDNAВ
В 104В В В FGGGTEVVVK
SEQ ID NO:7 (HCVR клона/лунку 828 - кролик)
1 QSVEESGGRL VTPGTPLTLT CTVSEIDLST YAMSWVRQAP GKGLEWIGII
51 SAGGSAYYAS WAKGRFTISR TSTTVDLKMT SLTTEDTATY FCARGAAYAG
101 YTYGFSFFDI WGPGTLVTVS L
SEQ ID NO:8 (LCVR клона/лунку 828 - кролик)
1 В DIVMTQTPSS VSAAVGGTVT INCQASQNIY SNLAWYQQKP GQRPKLLIYG
51 ASNLESGVPS RFKGSGSGTE YTLTISDLES DDAATYYCQS IDYGNNYLGS
101 FGGGTEVVVK
SEQ ID NO:9 (HCVR клона/лунку 829 - кролик)
1 QSLEESGGRL VTPGTPLTLT CTASGFSLSS YDMSWVRQAP GKGLEYIGWI
51 NSDDGAYYAN WAKGRFTISR TSTTVDLKIT SPTTEDTATY FCARDAGSTY
101 LYGLDPWGPG TLVTVSS
SEQ ID NO:10 (LCVR клона/лунку 829 - кролик)
1 DVVMTQTPSS VSAGVGGTVT IKCQASQSIS SYLAWYQQKP GQRPKLLIYA
51 ASTLASGVSS RFKGSGSGTE YTLTINDLES ADAATYYCQC TYYGGTYNTF
101 GGGTEVVVK
SEQ ID NO:11 (HCVR клона/лунку 833 - кролик)
1 QSLEESGGGL VTPGGSLTLT CTGSGIDLSH YVVGWVRQAP GKGLEWIGII
51 YGSGRTYYAN WAKGRFTISK TSTTVDLRIA RPTAEDTATY FCARDASVSVВ
101 YYWGYFDLWG QGTLVTVSS
SEQ ID NO:12 (LCVR клона/лунку 833 - кролик)
1 AYDMTQTPVS VEVAVGGTVT IKCQASQSIG SELAWYQQKP GQPPKLLIYR
51 ASTLESGVPS RFSGSGSGTE FTLTISGVES ADAATYYCQQ GYTYSEIDNA
101 FGGGTEVVVK
SEQ ID NO:13 (HCVR клона/лунку 834 - кролик)
1 QSVEESGGRL VTPGTPLTLT CTVSGFSLST YSMSWVRQAP GKGLEWIGVI
51 SRGGSAYYAS WAKGRFTISK TSTTVDLKVT SPTTEDTATY FCARGAISSG
101 YYVYDGMDLW GPGTLVTVSS
SEQ ID NO:14 (LCVR клона/лунку 834 - кролик)
1 DIVMTQTPGS VEAAVGGTVT IKCQASESIS SYLAWYQQKP GQPPKFLIYS
51 ASTLASGVPS RFKGSGSGTE FTLTISDLES ADAATYYCQC TDYGSDYMGAВ
101 FGGGTGVVVK
SEQ ID NO:15 (HCVR клона/лунку 835 - кролик)
1 QSVEESGGRL VTPGTPLTLT CTVSGIDLSS GAMGWVRQAP GKGLEWIGLI
51 SSSPITYYAN WARGRFTISK TSTTVDLKIT SPTTADTATY FCARGYDDYG
101 EIWFNIWGPG TLVTVSL
SEQ ID NO:16 (LCVR клона/лунку 835 - кролик)
1 AIEMTQSPPS LSASVGETVR IRCLAGEDIY SSISWYQQKP GKPPTLLIYG
51 ASNLESGVPP RFSGSGSGTD YTLTIGGVQA EDAATYYCLG GWSYSSSLTF
101 GAGTKVEIK
SEQ ID NO:17 (HCVR клона/лунку 841 - кролик)
1 QSLEESGGRL VTPGTPLTLT CKASGFSLS TYWMSWVRQA PGKGLEWIGI
51 MLSYGNTVYA NWAKGRFTIS KTSSTTVDLK ITSPTTEDTA TYFCARGLYG
101 GYPNYGVYDL WGQGTLVTVS S
SEQ ID NO:18 (LCVR клона/лунку 841 - кролик)
1 DVVMTQTPAS VEAAVGGTVT IKCQASQSIS SYLSWYQQKP GQPPKLLIYA
51 ASNLASGVSS RFKGSRSGTE YTLTISDLES ADAATYYCQC TDYGSNYVGA
101 FGGGTEVVVK
SEQ ID NO:19 (HCVR клона/лунку 843 - кролик)
1 QSLEESGGRL VTPGTPLTLT CTASGFSLNN AYMNWVRQAP GKGLEWIGII
51 NTYGSTYFAT WAKGRFTFSK TSTTVDLKIT SPTTEDTATY FCARAYAPFS
101 TYSHYYGMDL WGPGTLVTVS S
SEQ ID NO:20 (LCVR клона/лунку 843 - кролик)
1 DVVMTQTPSS VSAAVGGTVT IKCQASESIG SWLSWYQQKP GQPPKLLIYE
51 ASKLTSGVPS RFKGSGSGTE YTLTISDLES ADAATYYCQY TDYGSNYLGT
101 FGGGTEVVVK
SEQ ID NO:21 (HCVR клона/лунку 845 - кролик)
1 QSLEESGGRL VTPGTPLTLT CTVSGIDLSS YTMNWVRQAP GKGLEWIGVI
51 TSHNTYYASW AKGRFTISKT STTVDLKITS PTTEDTATYF CARSNYGSTI
101 YYMGGMDPWG PGTLVTVSS
SEQ ID NO:22 (LCVR клона/лунку 845 - кролик)
1 DVVMTQTPAS VSAAVGGTVT INCQASQSIG SYLAWYQHQP GQPPKLLIYS
51 ASTLESGVSS RFEGSRSGTE YTLTISDLDS ADAATYYCQC TDYGASYLGA
101 FGGGTEVVVK
SEQ ID NO:23 (HCVR клона/лунку 847 - кролик)
1 QSVEESGGRL VTPGTPLTLT CTVSGFSLSS YDMSWVRQAP GKGLEYIGYI
51 NSDGSAYYAS WAKGRFTISK TSSTTVDLKI TSPTTEDTAT YFCARDAGST
101 YLYGMDPWGP GTLVTVSS
SEQ ID NO:24 (LCVR клона/лунку 847 - кролик)
1 DVVMTQTPAS VSEPVGGTVT INCQASQSIY SYLAWYQQKP GQRPKLLIYA
51 ASTLASGVSS RFKGSGSGTQ FTLTISDLES ADAATYYCQC TYYGGTFNTF
101 GGGTEVVVK
SEQ ID NO:25 (HCVR клона/лунку 848-кролик)
1 QSVEESGGRL VTPGTPLTLT CTVSGFSLSS YTMSWVRQAP GKGLEWIGII
51 SSIGSIWYAS WAKGRFTISK TSTTVDLKMT SLTTEDTATY FCARDGTGSK
101 YYTWDRLDLW GQGTLVTVSS
SEQ ID NO:26 (LCVR клона/лунку 848 - кролик)
1 NIVMTQTPSP VSGAVGGTVT INCQASQSIY NELSWYQQKP GQPPKLLIYY
51 TSTLASGVSS RFKGSGSGTQ FTLTISGVES VDAATYYCQQ GYSSSDVDNVF
101 GGGTEVVVK
SEQ ID NO:27 (HCVR клона/лунку 849 - кролик)
1 QSVEESGGRL VTPGTPLTLT CTVSGFSLSR YDMSWVRQAP GKGLEYIGYI
51 NRDGSAYYAN WAKGRFTISK TSTTVDLKIT SPTTDDTATY FCARHAGSTY
101 LYGMDPWGPG TLVTVSS
SEQ ID NO:28 (LCVR клона/лунку 849 - кролик)
1 DVVMTQTPSS VSAAVGGTVT IKCQASQSIS NYLAWYQQKP GQPPKLLIYA
51 ASTLASGVSS RFKGSGSGTE FTLTISDLES ADAATYYCQC TYFGDTYNVF
101 GGGTEVVVK
SEQ ID NO:29 (HCVR клона/лунку 868 - кролик)
1 QSVEESGGRL VTPGTPLTLT CTASGFSLSD YTMGWVRQAP GKGLEWIGII
51 NGYGSTYYAN WAKGRFAISK TSTTVDLKIT SPATEDTATY FCARGDTGRT
101 YDMHFNLWGQ GTLVTVSS
SEQ ID NO:30 (LCVR клона/лунку 868 - кролик)
1 AYDMTQTPAS VSAAVGGTVT IKCQASESIR SWLAWYQQKP GQPPKLLIYS
51 ASTLASGVSS RFKGSGSGTQ FTLTIGDLES ADAATYYCQQ GYTSSNLDNA
101 FGGGTEVLVK
SEQ ID NO:31 (HCVR клона/лунку 899 - кролик)
1 QSVEESGGRL VTPGTPLTLT CTVSGFSLSS YTMSWVRQAP GKGLEYIGII
51 SSSDGTWYAN WVKGRFTISK TSTTVDLKMT SLTTEDTATY FCARDGTGNK
101 YYTWDRLDLW GQGTLVTVSS
SEQ ID NO:32 (LCVR клона/лунку 899 - кролик)
1 NIVMTQTPSP VSGAVGGTVT INCQASQSIY NELSWYQQKP GQPPKLLIYY
51 ASTLASGVSS RFKGSGSGTQ FTLTISGVES VDAATYYCQQ GYSSSNVDNV
101 FGGGTEVVVK
SEQ ID NO:33 (HCVR клона/лунку 908 - кролик)
1 QSVEESGGRL VTPGTPLTLT CTVSGFSLSN FAMSWVRQAP GKGLEWIGII
51 NGYGSIYYAT WAKGRFTISK TSTTVDLKIT SPTTEDTATY FCARGDAGRT
101 YNHYFNIWGP GTLVTVSL
SEQ ID NO:34 (LCVR клона/лунку 908 - кролик)
1 DVVMTQTPAS VEAAVGGTVT IKCQASQSIS SWLSWYQQKP GQRPKLLIYA
51 ASNLASGVPS RFKGSGSGTQ FTLTISDLES DDAATYYCQQ GYTSYNVDNA
101 FGGGTEVVVK
Гуманизированные аминокислотные последовательности HCVR с подчеркнутыми предпочтительными положениями мутации цистеина 40, 41 и 89
SEQ ID NO:35 (HCVR 789 гуманизированный вариант 1)
1 EVKVEESGGG LVQPGGSLRL SCAASGFSLS SYWMSWVRQA PGKGLEWVSI
51 IAGRGSTYYA SWAKGRFTIS KDNSEGMVYL QMNSLRAEDT AVYYCARVSS
101 IYYTFNLWGQ GTTVTVSS
SEQ ID NO:36 (HCVR 789 гуманизированный вариант 2)
1 EVQLLESGGS LVLPGGSLRL SCAASGFSLS SYWMSWVRQA PGKGLEWVSI
51 IAGRGSTYYA SWAKGRFTIS RDNSKNTLYM QMNSLRAEDT ALYFCARVSS
101 IYYTFNLWGQ GTLVTVSS
SEQ ID NO:37 (HCVR 789 гуманизированный вариант 3)
1 QSVEESGGGL VQPGGSLRLS CAASGFSLSS YWMSWVRQAP GKGLEWIGII
51 AGRGSTYYAS WAKGRFTISR DNSKNTLYLQ MNSLRAEDTA VYYCARVSSI
101 YYTFNLWGQG TLVTVSS
SEQ ID NO:38 (HCVR 825 гуманизированный вариант 1)
1 EVQLVESGGD LAQPGGSLRL SCAVSGIDLS SYGMGWVRQA PGKGLEWVSI
51 ISRNSVTYYA TWAKGRFTIS RDNSKNTVYL QMTSLRAEDT ALYFCARRAT
101 YSGALGYFDI WGQGTLVTVS S
SEQ ID NO:39 (HCVR 825 гуманизированный вариант 2)
1 EVQLEESGGG LVKPGGSLRL SCAASGIDLS SYGMGWVRQA PGKGLEWVSI
51 ISRNSVTYYA TWAKGRFTIS RDNSKNTLYL QMNSLRAEDT AVYYCARRAT
101 YSGALGYFDI WGRGTLVTVS S
SEQ ID NO:40 (HCVR 833 гуманизированный вариант 1)
1 EVQLVESGGG LIQPGGSLRL SCAASGIDLS HYVVGWVRQA PGKGLEWVSI
51 IYGSGRTYYA NWAKGRFTIS KDNSKNTLYV RMNSLRAEDT AVYYCARDAS
101 VSVYYWGYFD LWGQGTLVTV SS
SEQ ID NO:41 (HCVR 833 гуманизированный вариант 2)
1 EVQLVESGGG LVQPGGSLRL SCAASGIDLS HYVVGWVRQA PGKGLEWVSI
51 IYGSGRTYYA NWAKGRFTIS RDNSKNTLFL RMNSLRVEDT AVYFCARDAS
101 VSVYYWGYFD LWGQGTLVTV SS
SEQ ID NO:42 (HCVR 833 гуманизированный вариант 3)
1 EVQLEESGGG LVKPGGSLRL SCAASGIDLS HYVVGWVRQA PGKGLEWVSI
51 IYGSGRTYYA NWAKGRFTIS RDNSKNTLYL QMNSLRAEDT AVYYCARDAS
101 VSVYYWGYFD LWGRGTLVTV SS
SEQ ID NO:43 (HCVR region 833 гуманизированный вариант 4)
1 QSLEESGGGL VQPGGSLRLS CAASGIDLSH YVVGWVRQAP GKGLEWIGII
51 YGSGRTYYAN WAKGRFTISR HNSKNTLYLQ MNSLRAEDTA VYYCARDASV
101 SVYYWGYFDL WGQGTLVTV SS
Гуманизированные аминокислотные последовательности LCVR с подчеркнутыми предпочтительными положениями мутации цистеина 40 и 41
SEQ ID NO:44 (LCVR 789 гуманизированный вариант 1)
1 DIVMTQSPDS LAVSLGERAT INCQSSQSVY SNNELSWYQQ KPGQPPKLLI
51 YYASTLASGV PDRFSGSGSG TDFTLTISSL QAEDVAVYYC QGSYYSGSGW
101 YYAFGGGTKL EIK
SEQ ID NO:45 (LCVR 789 гуманизированный вариант 2)
1 EIVLTQSPSS LSASVGDRVT ITCQSSQSVY SNNELSWYQQ KPGKAPKLLI
51 YYASTLASGV PSRFSGSGSG TDFTLTISSL QPEDFATYYC QGSYYSGSGWВ
101 YYAFGQGTKL EIK
SEQ ID NO:46 (LCVR 789 гуманизированный вариант 3)
1 AQVLTQSPSS LSASVGDRVT ITCQSSQSVY SNNELSWYQQ KPGKAPKLLIВ В
51 YYASTLASGV PSRFSGSGSG TDFTLTISSL QPEDFATYYC QGSYYSGSGW
101 YYAFGGGTKV EIK
SEQ ID NO:47 (LCVR 825 гуманизированный вариант 1)
1 EIVMTQSPSS LSASVGDRVT ITCQASENIY STLAWYQQKP GKAPKLLIYD
51 AFDLASGVPS RFSGSGSGTD YTLTISSLQP EDFATYYCQQ GYSGTNVDNA
101 FGQGTKLEIK
SEQ ID NO:48 (LCVR 825 гуманизированный вариант 2)
1 GYDMTQSPSS VSASVGDRVT ITCQASENIY STLAWYQQKP GKAPKLLIYD
51 AFDLASGVPS RFKGSGSGTE YTLTISSLQP EDFATYYCQQ GYSGTNVDNA
101 FGGGTKVEIK
SEQ ID NO:49 (LCVR 833 гуманизированный вариант 1)
1 DIQMTQSPST LSASVGDRVT ITCQASQSIG SELAWYQQKP GKAPKLLIYR
51 ASTLESGVPS RFSGSGSGTE FTLTISSLQP DDFATYYCQQ GYTYSEIDNA
101 FGQGTKVEIK
SEQ ID NO:50 (LCVR 833 гуманизированный вариант 2)
1 DIQMTQSPSS LSASVGDRVT ITCQASQSIG SELAWYQQKP GQAPKLLIYR
51 ASTLESGVPS RFSGSGSGTE FTFTISSLQP EDLATYYCQQ GYTYSEIDNA
101 FGQGTKLEIK
SEQ ID NO:51 (LCVR 833 гуманизированный вариант 3)
1 AYDMTQSPSS VSASVGDRVT ITCQASQSIG SELAWYQQKP GKAPKLLIYR
51 ASTLESGVPS RFSGSGSGTD FTLTISSLQP EDFATYYCQQ GYTYSEIDNA
101 FGGGTKVEIK
SEQ ID NO:52 (H8 HC)
1 QVQLVQSGAE VKKPGASVKV SCKASGYSFT GYYMHWVKQS PGQGLEWIGR
51 INPNNGVTLY NQKFKDRVTM TRDTSISTAY MELSRLRSDD TAVYYCARST
101 MITNYVMDYW GQGTLVTVSS
SEQ ID NO:53 (H8 LC)
1 DIVMTQSPDS LAVSLGERAT INCKASQSVS NDVAWYQQKP GQSPKLLISY
51 TSSRYAGVPD RFSGSGSGTD FTLTISSLQA EDVAVYFCQQ DYNSPPTFGG
101 GTKLEIK
SEQ ID NO:54 (HAVT20 лидерная последовательность)
1 MACPGFLWAL VISTCLEFSM A
SEQ ID NO:55 (константная область HC антитела IgG1 человека)
1 ASTKGPSVFP LAPSSKSTSG GTAALGCLVK DYFPEPVTVS WNSGALTSGV
51 HTFPAVLQSS GLYSLSSVVT VPSSSLGTQT YICNVNHKPS NTKVDKKVEP
101 KSCDKTHTCP PCPAPELLGG PSVFLFPPKP KDTLMISRTP EVTCVVVDVS
В 151В В В HEDPEVKFNW YVDGVEVHNA KTKPREEQYN STYRVVSVLT VLHQDWLNGK
В 201В В В EYKCKVSNKA LPAPIEKTIS KAKGQPREPQ VYTLPPSRDE LTKNQVSLTC
В 251В В В LVKGFYPSDI AVEWESNGQP ENNYKTTPPV LDSDGSFFLY SKLTVDKSRW
В 301В В В QQGNVFSCSV MHEALHNHYT QKSLSLSPGK
SEQ ID NO:56 (κ-константная область LC антитела IgG человека)
1 RTVAAPSVFI FPPSDEQLKS GTASVVCLLN NFYPREAKVQ WKVDNALQSG
51 NSQESVTEQD SKDSTYSLSS TLTLSKADYE KHKVYACEVT HQGLSSPVTK
101 SFNRGEC
SEQ ID NO:57 (лидерная последовательность HC кролика)
1 MGWTLVFLFL LSVTAGVHS
SEQ ID NO:58 (лидерная последовательность LC кролика)
1 MVSSAQFLGL LLLCFQGTRC
Гуманизированные аминокислотные последовательности HCVR с мутациями цистеина в положении 41 в соответствии с системой нумерации Kabat
SEQ ID NO:59 (гуманизированный вариант 1 41C HCVR 825)
1 EVQLVESGGD LAQPGGSLRL SCAVSGIDLS SYGMGWVRQA CGKGLEWVSI
51 ISRNSVTYYA TWAKGRFTIS RDNSKNTVYL QMTSLRAEDT ALYFCARRAT
101 YSGALGYFDI WGQGTLVTVS S
SEQ ID NO:60 (гуманизированный вариант 2 41C HCVR 825)
1 EVQLEESGGG LVKPGGSLRL SCAASGIDLS SYGMGWVRQA CGKGLEWVSI
51 ISRNSVTYYA TWAKGRFTIS RDNSKNTLYL QMNSLRAEDT AVYYCARRAT
101 YSGALGYFDI WGRGTLVTVS S
SEQ ID NO:61 (гуманизированный вариант 1 41C HCVR 833)
1 EVQLVESGGG LIQPGGSLRL SCAASGIDLS HYVVGWVRQA CGKGLEWVSI
51 IYGSGRTYYA NWAKGRFTIS KDNSKNTLYV RMNSLRAEDT AVYYCARDAS
101 VSVYYWGYFD LWGQGTLVTV SS
SEQ ID NO:62 (гуманизированный вариант 2 41C HCVR 833)
1 EVQLVESGGG LVQPGGSLRL SCAASGIDLS HYVVGWVRQA CGKGLEWVSI
51 IYGSGRTYYA NWAKGRFTIS RDNSKNTLFL RMNSLRVEDT AVYFCARDAS
101 VSVYYWGYFD LWGQGTLVTV SS
SEQ ID NO:63 (гуманизированный вариант 3 41C HCVR 833)
1 EVQLEESGGG LVKPGGSLRL SCAASGIDLS HYVVGWVRQA CGKGLEWVSI
51 IYGSGRTYYA NWAKGRFTIS RDNSKNTLYL QMNSLRAEDT AVYYCARDAS
101 VSVYYWGYFD LWGRGTLVTV SS
SEQ ID NO:64 (гуманизированный вариант 4 41C HCVR 833)
1 QSLEESGGGL VQPGGSLRLS CAASGIDLSH YVVGWVRQAC GKGLEWIGII
51 YGSGRTYYAN WAKGRFTISR HNSKNTLYLQ MNSLRAEDTA VYYCARDASV
101 SVYYWGYFDL WGQGTLVTV SS
Реферат
Изобретение относится к антителу против онкофетального антигена 5T4 человека и соответствующим конъюгатам антитело-лекарственное средство, которые являются подходящими для тестирования в клинических испытаниях. Антитела дают перекрестную реакцию у людей и яванских макак и обладают аффинностью к антигену 5T4 человека, которая является такой же величины, как и их аффинность к антигену 5T4 яванского макака. Кроме того изобретение относится к использованию антител и соответствующих ADC для лечения солидных опухолей и гематологических злокачественных новообразований. 4 н. и 6 з.п. ф-лы, 3 ил., 7 табл., 7 пр.
Формула
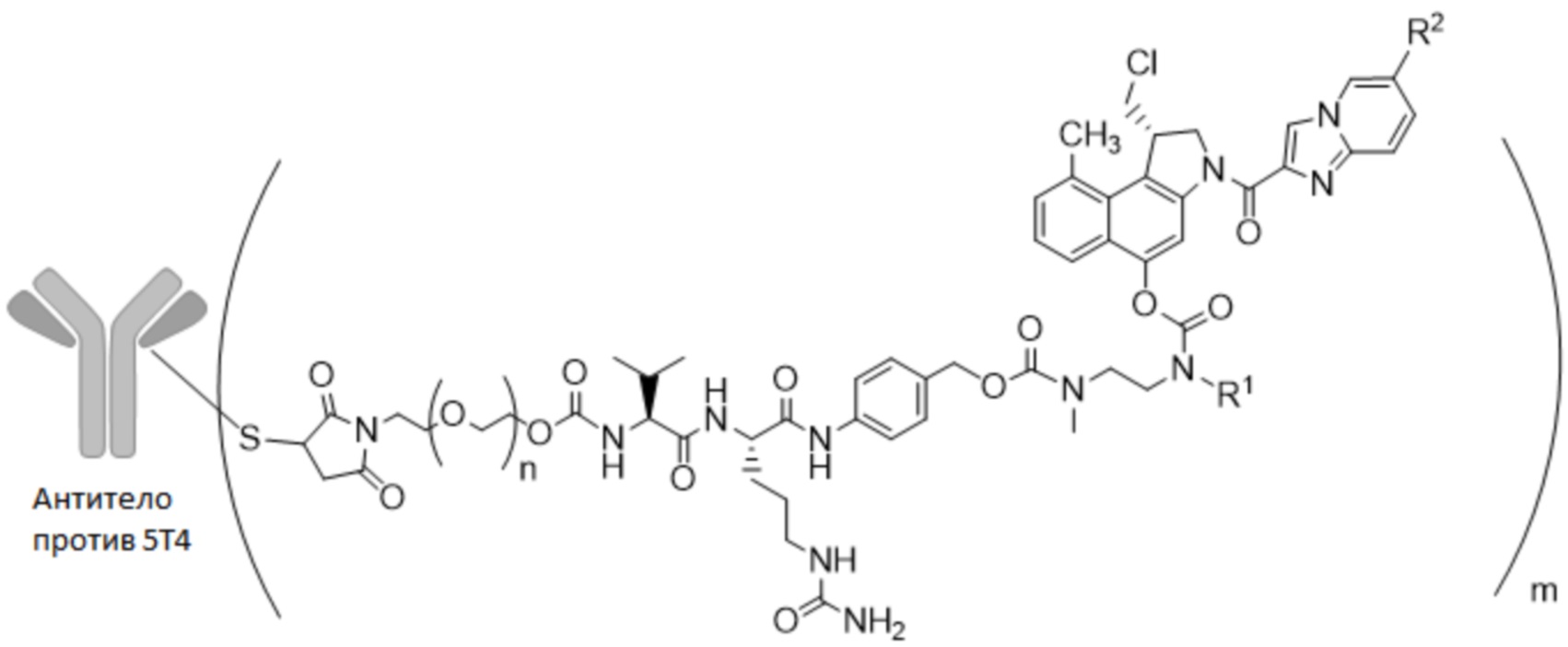
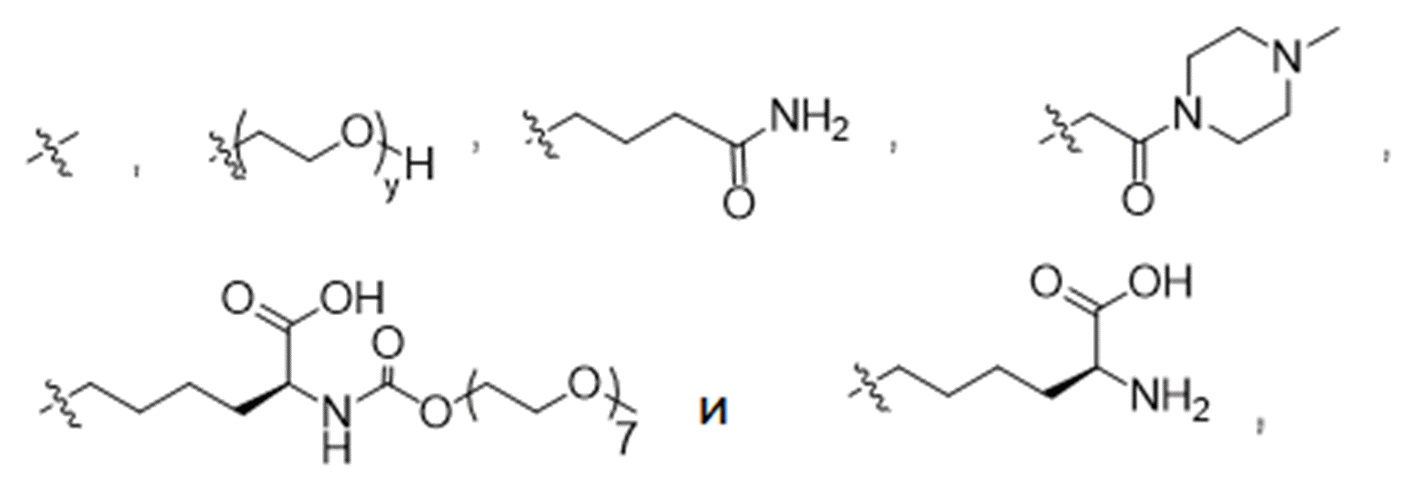
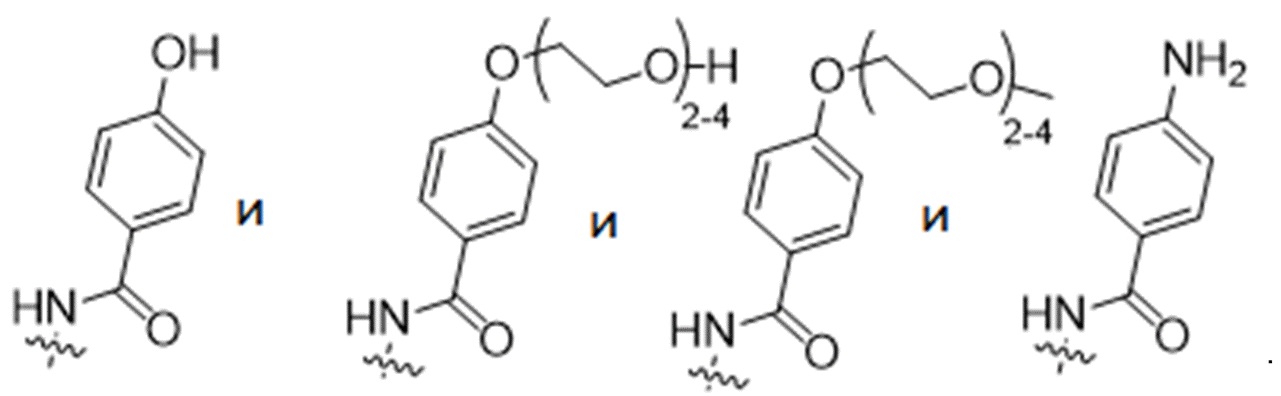
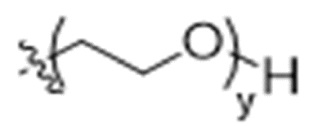
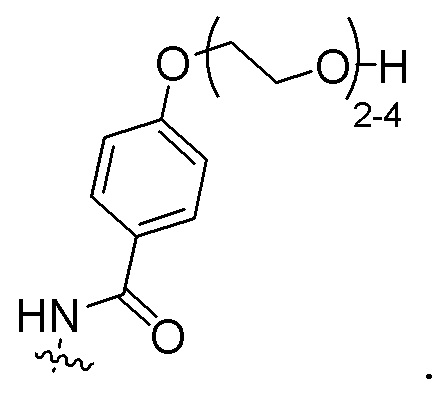
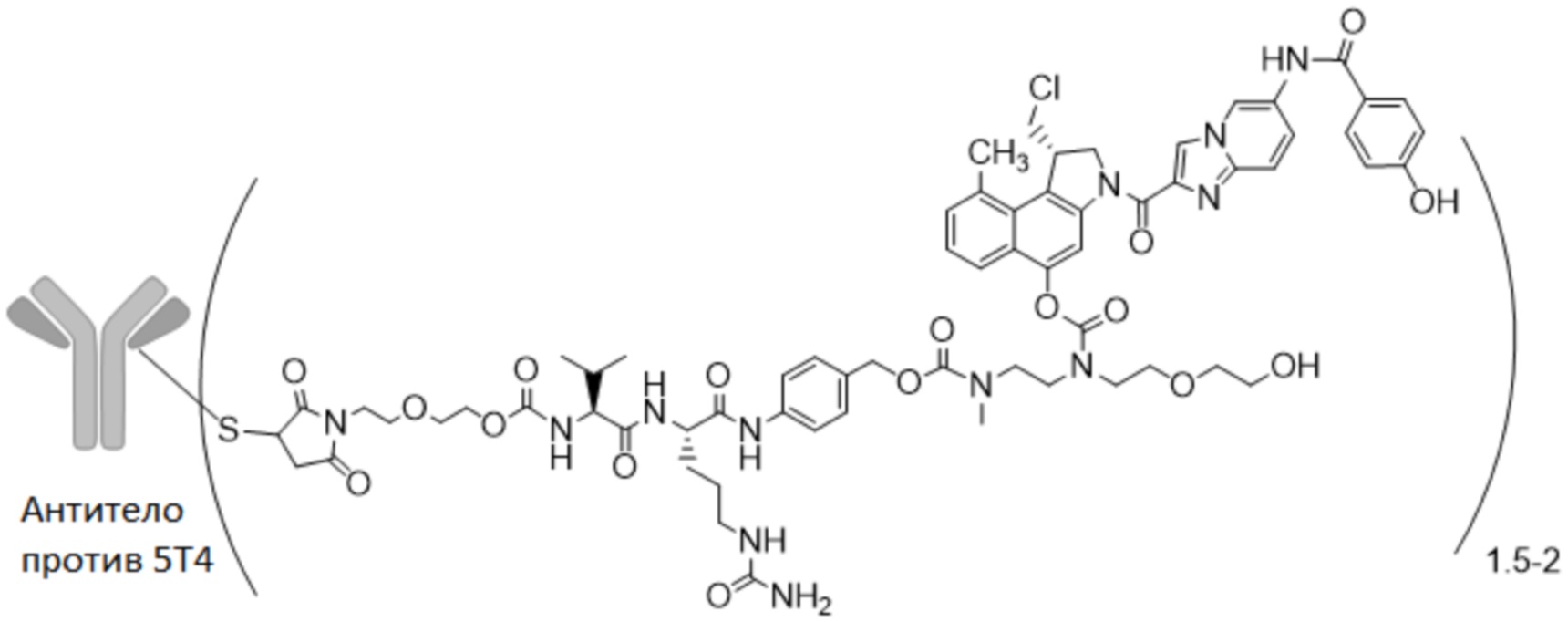
Документы, цитированные в отчёте о поиске
Конъюгаты "антитело-лекарственное средство"

Комментарии