Комбинации лекарственных средств - RU2708246C2
Код документа: RU2708246C2
Чертежи






Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА
Эта заявка заявляет приоритет предварительной заявки на патент США № 61/887165, поданной 4 октября 2013 г., и предварительной заявки на патент США № 61/771525, поданной 1 марта 2013 г., каждая из которых включена в данный документ посредством ссылки во всей их полноте.
УРОВЕНЬ ТЕХНИКИ
Эпигенетическая модификация генома, и в частности метилирование ДНК, играет важную роль в злокачественных опухолях человека путем воздействия на важнейшие клеточные пути в инициации и развитии рака (в том числе контроль клеточного цикла, апоптоз, инвазивный и метастатический потенциал и ангиогенез). Метилирование ДНК опосредуется ферментом ДНК метилтрансферазой и приводит к присоединению метильной группы к цитозину, когда цитозин находится в составе динуклеотида CpG.
Метилирование ДНК промотор-связанных CpG островков приводит к глушению соответствующего гена - обычно, промотор-связанные CpG островки являются неметилированными в доброкачественных клетках. Следовательно, аберрантное гиперметилирование ДНК в опухолевых клетках является функциональным эквивалентом инактивации генов-супрессоров опухолей в результате мутации и поэтому способствует ускользанию опухоли от иммунного распознавания через понижающую регуляцию различных компонентов комплекса распознавания опухоли в опухолевых клетках (в том числе, антигены HLA класса I, антигены и CTA и соучасники/костимулирующие молекулы). Это приводит к снижению клинической эффективности подходов иммунотерапии к лечению рака.
Агенты гипометилирующие ДНК (АГД) вызывают глобальное и ген-специфическое гипометилирование ДНК. Это способствует повторной экспрессии связанных с опухолью антигенов и, таким образом, повышает иммунораспознавание. Примеры включают 5-азацитидин, 5-аза-2'-дезоксицитидин (децитабин) и Зебуларин: 5 азацитидин и 5-аза-2'-дезоксицитидин в настоящее время одобрен в США Администрацией по контролю за продуктами питания и лекарствами для лечения пациентов с миелодиспластическим синдромом, а децитабин в настоящее время разрабатывается в качестве лекарственного средства для лечения хронического миелогенного лейкоза (ХМЛ), миелодиспластического синдрома (МДС), немелкоклеточного рака легкого (НМКРЛ), серповидно-клеточной анемии и острого миелобластного лейкоза (ОМЛ).
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
Все публикации, патенты и патентные заявки, упомянутые в этом описании, включены в данный документ посредством ссылки в такой же степени, как если бы каждая отдельная публикация, патент или патентные заявки были специально и отдельно указаны как включенные посредством ссылки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В некоторых вариантах реализации, изобретение предлагает комбинацию, содержащую соединение Формулы I или его фармацевтически приемлемую соль:
(5-азацитозиновая группа)-L-(гуаниновая группа) (I)
в которой L представляет собой фосфорсодержащий линкер, в котором количество атомов фосфора в L равно 1;
и один или более вспомогательных терапевтических компонент(ов) выбранных из:
агента, активирующего T-клетки;
противораковой вакцины; и
адъюванта.
В альтернативном варианте, изобретение предлагает комбинацию, содержащую соединение Формулы I или его фармацевтически приемлемую соль:
(5-азацитозиновая группа)-L-(гуаниновая группа) (I)
в которой L представляет собой фосфорсодержащий линкер, в котором количество атомов фосфора в L равно 1;
и один или более вспомогательных терапевтических компонент(ов) выбранных из:
агента, активирующего T-клетки;
противораковой вакцины;
ингибитора ИДО; и
адъюванта.
В некоторых вариантах реализации, в соединении Формулы I, L представляет собой Формулу (II):

в которой R1 и R2 представляют собой независимо H, OH, алкокси группу, алкоксиалкокси группу, ацилокси группу, карбонатную группу, карбаматную группу или галоген; R3 представляет собой H или R3 вместе с атомом кислорода, с которым R3 связан, образует простой эфир, сложный эфир, карбонат или карбамат; R4 представляет собой H или R4 вместе с атомом кислорода, с которым R4 связан, образует простой эфир, сложный эфир, карбонат или карбамат; и X вместе с атомами кислорода, с которыми X связан, образует фосфодиэфир, фосфортиоатдиэфир, боранофосфатдиэфир или метилфосфонатдиэфир. В некоторых вариантах реализации, R1 и R2 представляют собой независимо H, OH, OMe, OEt, OCH2CH2OMe, OBn или F, и X вместе с атомами кислорода, с которыми X связан, образует фосфодиэфир. В некоторых вариантах реализации, R1 и R2 представляют собой H.
В некоторых вариантах реализации, соединение Формулы I представляет собой любое соединение из I-(1-44). В некоторых вариантах реализации, соединение Формулы I представляет собой:

В некоторых вариантах реализации, соединение Формулы I представляет собой формулу:

или его фармацевтически приемлемую соль. В некоторых вариантах реализации, соль является натриевой солью.
Соединение или его соль может быть в форме рецептуры, например, растворенной в, по сути, безводном растворителе, содержащем от около 45% до около 85% пропиленгликоля; от около 5% до около 45% глицерина и от 0% до около 30% этанола. В таких вариантах реализации, упомянутый растворитель может содержать от около 65% до около 70% пропиленгликоля; от около 25% до около 30% глицерина и от 0% до около 10% этанола, например: (a) от 65% до 70% пропиленгликоля и от 25% до 30% глицерина, любой остаток является этанолом; (b) около 65% пропиленгликоля; около 25% глицерина и около 10% этанола; (c) 65% пропиленгликоля; 25% глицерина и 10% этанола; (d) около 70% пропиленгликоля и около 30% глицерина, а этанол отсутствует; (e) от 45% до 85% пропиленгликоля; от 5% до 45% глицерина и от 0% до 30% этанола; (f) от 65% до 70% пропиленгликоля; от 25% до 30% глицерина и от 0% до 10% этанола. Рецептура может дополнительно содержать ДМСО, необязательно с соотношением ДМСО:соединение 2:1; 1:1; 0,5:1; 0,3:1 или 0,2-0,3:1. Комбинация может быть пригодна для введения путем подкожной инъекции.
Когда присутствует как часть рецептуры, соединение может присутствовать в концентрации от около 80 мг/мл до около 110 мг/мл, необязательно около 100 мг/мл.
В некоторых вариантах реализации, изобретение предлагает набор, содержащий:
(a) первую емкость, содержащую соединение или его соль, как описано в данном документе;
(b) вторую емкость, содержащую, по сути, безводный растворитель, как описано в данном документе; и
(c) один или более вспомогательных терапевтических компонент(ов), как описано в данном документе.
Соединение может присутствовать в наборе в форме, по сути, безводного порошка, например, лиофилизированного. В некоторых вариантах реализации, первая емкость может содержать от около 80 мг до около 110 мг упомянутого соединения, например, около 100 мг упомянутого соединения, и может дополнительно содержать инструкции по введению путем подкожной инъекции.
В некоторых вариантах реализации, изобретение предлагает способ получения фармацевтической композиции, где способ включает растворение соединения или его соли, как определено выше, в по сути безводном растворителе, как также определено выше, и последующее объединение растворенного соединения с одним или более вспомогательных терапевтических компонент(ов), как также определено выше. В некоторых вариантах реализации, способ дополнительно включает подготовительные стадии:
(a) растворение упомянутого соединения в ДМСО с получением раствора упомянутого соединения в ДМСО; и
(b) лиофилизацию упомянутого раствора со стадии (a) с получением упомянутого соединения в форме, по сути, безводного порошка.
В некоторых вариантах реализации, изобретение предлагает способ получения фармацевтической композиции, содержащей соединение или его соль, как определено выше, в форме, по сути, безводного порошка, где способ включает растворения упомянутого соединения в ДМСО с получением раствора в ДМСО, лиофилизацию упомянутого раствора, с получением упомянутого соединения в форме, по сути, безводного порошка, и последующее объединение порошка с одним или более вспомогательных терапевтических компонент(ов). В некоторых вариантах реализации, упомянутый, по сути, безводный порошок содержит остаточный ДМСО, например: (a) присутствует в количестве ≤2000 или от около 0,1 до около 2000 мг/г упомянутого соединения; или (b) присутствует в количестве ≤1000 или от около 0,1 до около 1000 мг/г; ≤600 или от около 0,1 до около 600 мг/г; ≤500 или от около 0,1 до около 500 мг/г; ≤400 или от около 0,1 до около 400 мг/г; ≤300 или от около 0,1 до около 300 мг/г; или около 200 - около 300 мг/г упомянутого соединения; или (c) присутствует в количестве 200-300 мг/г упомянутого соединения.
В некоторых вариантах реализации, изобретение предлагает по сути безводный порошок в основном состоящий из соединения или его соли, как определено выше, и ДМСО, где ДМСО присутствует в количестве ≤200 или от около 0,1% до около 200% масс., в комбинации с одним или более вспомогательных терапевтических компонент(ов), как определено выше. В таких вариантах реализации, ДМСО присутствует в количестве ≤100% или от около 0,1% до около 100%, ≤60% или от около 0,1% до около 60%, ≤50% или от около 0,1% до около 50%, ≤40% или от около 0,1% до около 40% или ≤30% или от около 0,1% до около 30% масс. ДМСО/соединение, например, в количестве около 20 - около 30% масс. ДМСО/соединение.
Также предлагается фармацевтическая композиция, получаемая или полученная с помощью способов изобретения.
В некоторых вариантах реализации, вспомогательный терапевтический компонент содержит агент, активирующий T-клетки.
В некоторых вариантах реализации, вспомогательный терапевтический компонент содержит противораковую вакцину.
В некоторых вариантах реализации, вспомогательный терапевтический компонент содержит адъювант.
В некоторых вариантах реализации, вспомогательный терапевтический компонент содержит агент, активирующий T-клетки, и противораковую вакцину.
В некоторых вариантах реализации, вспомогательный терапевтический компонент содержит агент, активирующий T-клетки, например, выбранный из агонистов или антител для: ICOS, GITR, MHC, CD80, CD86, Galectin 9 и LAG-3.
В других вариантах реализации, агент, активирующий T-клетки, представляет собой антитело, например выбранное из: (a) агониста CD137; (b) агониста CD40; (c) агониста OX40; (d) PD-1 mAb; (e) PD-L1 mAb; (f) PD-L2 mAb; (g) CTLA-4 mAb; и (h) комбинаций (a)-(g).
В некоторых вариантах реализации, вспомогательный терапевтический компонент представляет собой Тремелимумаб или Ипилимумаб.
В некоторых вариантах реализации, вспомогательный терапевтический компонент содержит CTА противораковую вакцину, например, базируется на CTA антигене выбранном из: NY-ESO-1, LAGE-1, MAGE-A1, -A2, -A3, -A4, -A6, -A10, -A12, CT7, CT10, GAGE1-6, GAGE 1-2, BAGE, SSX1-5, SSX 2, HAGE, PRAME, RAGE-1, XAGE-1, MUC2, MUC5B, B7,1/2, CD28, B7-H1, HLA, CD40L и HMW-MAA, например, базируется на MAGE-A3 (например, recMAGE-A3), NY-ESO-1 и PRAME.
В некоторых вариантах реализации, вспомогательный терапевтический компонент содержит ингибитор ИДО, например, выбранный из INCB24360, 1 метил триптофана и NLG919.
В некоторых вариантах реализации, изобретение предлагает способ иммунотерапии или лечения заболевания выбранного из:
миелодиспластического синдрома (МДС);
рака;
гематологического расстройства; или
заболевания, связанного с ненормальным синтезом гемоглобина,
где способ включает введение комбинации, набора, способа, порошка или композиции изобретения субъекту, нуждающемуся в этом или желающего этого. В некоторых вариантах реализации, соединение или его соль, как определено выше, можно вводить до, одновременно с или после введения одного или более вспомогательных терапевтических компонент(ов). В некоторых вариантах реализации, соединение Формулы I или его соль вводят первым (в качестве инициирующего лечения) с последующим введением вспомогательного терапевтического компонента(ов).
МДС может быть выбран из МДС с низким-, средним- или высоким-риском развития и миелопролиферативных новообразований.
Гематологическим расстройством может быть лейкоз, например, выбранный из: острого миелоидного лейкоза (ОМЛ), острого промиелоцитарного лейкоза, острого лимфобластного лейкоза и хронического миелогенного лейкоза. В некоторых вариантах реализации, ОМЛ может быть выбрани из ОМЛ престарелых, первого рецидива ОМЛ и второго рецидива ОМЛ.
Рак может быть выбран из рака молочной железы, рака кожи, рака кости, рака предстательной железы, рака печени, рака легких, немелкоклеточного рака легкого, плоскоклеточной немелкоклеточной аденокарциномы легкого, рака головного мозга, рака гортани, рака желчного пузыря, поджелудочной железы, прямой кишки, паращитовидной железы, щитовидной железы, надпочечников, нервной ткани, головы и шеи, толстой кишки, желудка, бронхов и почек, базально-клеточной карциномы, плоскоклеточной карциномы как язвенного, так и папиллярного типа, метастатического рака кожи, остеосаркомы, саркомы Юинга, ретикулярно-клеточной саркомы, миеломы, гигантоклеточной опухоли, мелкоклеточной опухоли легких, камней в желчном пузыре, инсуломы, первичной опухоли головного мозга, острых и хронических лимфоцитных и гранулоцитных опухолей, волосатоклеточной опухоли, аденомы, гиперплазии, медуллярного рака, феохромоцитомы, слизистой нейромы, кишечной ганглионейромы, гиперпластической опухоли нерва роговицы, опухоли марфаноидного вида, опухоли Вильмса, семиномы, опухоли яичников, рака яичников устойчивого к платине, лейомиоматозной опухоли, дисплазии шейки матки и in situ карциномы, нейробластомы, ретинобластомы, саркомы мягких тканей, злокачественного карциноида, местного поражения кожи, фунгоидного микоза, рабдомиосаркомы, саркомы Капоши, остеогенной саркомы, злокачественной гиперкальциемии, опухоли клеток почек, истинной полицитемии, аденокарциномы, мультиформной глиобластомы, лейкоза, лимфомы, меланомы, эпидермоидной карциномы, гепатоцеллюлярной карциномы и солидных опухолей.
В некоторых вариантах реализации, рак выбран из рака поджелудочной железы, рака яичников, меланомы и рака легких.
В некоторых вариантах реализации, заболевание связанное с ненормальным синтезом гемоглобина выбрано из серповидно-клеточной анемии и β-талассемии.
В некоторых вариантах реализации, изобретение предлагает комбинацию, набор, способ, порошок или композицию, как определено в формуле изобретения, приложенной к данному документу, или как описано в данном документе для применения в лечении или профилактике, например, для применения в иммунотерапии или лечении заболевания, как определено в формуле изобретения, приложенной к данному документу, и описано выше или в данном документе.
В некоторых вариантах реализации, изобретение предлагает применение комбинации, набора, способа, порошка или композиции, как определено в формуле изобретения, приложенной к данному документу, или как описано в данном документе, для изготовления медикамента для применения в иммунотерапии или в способе лечения заболевания, как определено в формуле изобретения, приложенной к данному документу, и описано выше или в данном документе.
Комбинация, набор, способ, порошок или композиция изобретения может быть введена субъекту согласно со схемой приема: (a) один раз, дважды, трижды, четырежды, пять раз, шесть раз или семь раз в неделю; или (b) каждый день на протяжении 5, 6, 7, 8, 9 или 10 дней; или (c) каждый день на протяжении до 10 дней; или (d) каждый день на протяжении от 5 до 10 дней; или (e) каждый день на протяжении 5 дней, сразу после этого два дня без введения дозы и затем каждый день на протяжении последующих 5 дней. Введение может быть подкожным.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ. 1 иллюстрирует значение концентраций в плазме соединения I-1 у самцов и самок яванских макак, получавших еженедельно подкожно дозы соединения I-1 в фармакокинетическом исследовании.
ФИГ. 2 иллюстрирует значение концентраций в плазме децитабина у самцов и самок яванских макак, получавших еженедельно подкожно дозы децитабина в фармакокинетическом исследовании.
ФИГ. 3 иллюстрирует снижение уровней метилирования LINE1, наблюдаемых в образцах крови отобранных у яванских макак в разные дни (Д) после предварительного исследования.
ФИГ. 4 иллюстрирует общее изменение родственных соединений к натриевой соли соединения Формулы I-1 в разных ДМСО и ДМСО/вода композициях.
ФИГ. 5 иллюстрирует противоопухолевое действие SGI-110 в комбинации с антимышиным CTLA-4.
ФИГ. 6 иллюстрирует противоопухолевое действие двух циклов последовательного введения SGI-110 с последующим антимышиным CTLA-4 mAb 9H10.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Комбинации настоящего изобретения активируют экспрессию или сильно активируют конститутивные уровни экспрессии компонентов комплекса распознавания опухоли в опухолевых клетках различных гистотипов. Поэтому они могут быть использованы в качестве иммуномодулирующих агентов для увеличения иммуногенности и иммунного распознавания опухолевых клеток. Это, в свою очередь, должно обеспечить более лучшие терапевтические результаты с точки зрения контроля и регрессии опухоли, продлить безрецидивное развитие и улучшить общую выживаемость.
Второе поколение АГД, полученных из децитабина, включающих агент гипометилирующий ДНК, соединение I-1 (динуклеотид 5-аза-2'-дезоксицитидина и дезоксигуанозина), описано в WO2007/041071 (который включен в данный документ посредством ссылки во всей его полноте).
Соединения Формулы I для применения в комбинациях изобретения
В некоторых вариантах реализации, изобретение предлагает комбинации, содержащие соединение Формулы I или его фармацевтически приемлемую соль:
(5-азацитозиновая группа)-L-(гуаниновая группа) (I),
в которой L представляет собой фосфорсодержащий линкер, где количество атомов фосфора в L равно 1.
L представляет собой группу пригодную для связывания 5-азацитозиновой группы с гуаниновой группой. В некоторых вариантах реализации, L содержит углевод. В некоторых вариантах реализации, L содержит более чем один углевод. В некоторых вариантах реализации, L содержит два углевода. Когда L содержит более чем один углевод, углеводы могут быть одинаковыми или разными. Углевод может быть моносахаридом в форме замкнутого кольца, таким как в форме пиранозы или фуранозы. Углевод может быть замещен в любом положении или деоксигенирован в любом положении, что будет окисленной встречающейся в природе формой углевода. В некоторых вариантах реализации, углевод представляет собой рибозу. В некоторых вариантах реализации, углевод представляет собой 2-дезоксирибозу. Рибоза или 2-дезоксирибоза могут быть замещены в любом положении.
Фофатный атом L может присутствовать в любой встречающейся в природе или синтетической функциональной группе, содержащей атом фосфора. Неограничивающие примеры таких функциональных групп включают фосфодиэфиры, фосфототиоатдиэфиры, боранофосфатдиэфиры и метилфосфонатдиэфиры.
В некоторых вариантах реализации, L содержит Формулу II. В некоторых вариантах реализации, L представляет собой Формулу II.

в которой R1 и R2 представляют собой независимо H, OH, алкокси группу, алкоксиалкокси группу, ацилокси группу, карбонатную группу, карбаматную группу или галоген; R3 представляет собой H или R3 вместе с атомом кислорода, с которым R3 связан, образует простой эфир, сложный эфир, карбонат или карбамат; R4 представляет собой H или R4 вместе с атомом кислорода, с которым R4 связан, образует простой эфир, сложный эфир, карбонат или карбамат; и X вместе с атомами кислорода, с которыми X связан, образует фосфодиэфир, фосфортиоатдиэфир, боранофосфатдиэфир или метилфосфонатдиэфир.
5-азацитозиновая группа может быть связана с любым концом L, а гуаниновая группа может быть связана с другим концом L так, что соединение содержит одну 5-азацитозиновую группу и одну гуаниновую группу. Таким образом, могут быть получены структурные изомеры путем обмена присоединения 5-азацитозиновой группы и гуаниновой группы.
R1 и R2 могут быть одинаковыми или разными. В некоторых вариантах реализации, R1 и R2 представляют собой независимо H, OH, OMe, OEt, OPh, OCH2CH2OMe, OCH2CH2OEt, OCH2CH2OBn,OBn, OAc, OBz, OCOOMe, OCOOEt, OCOOBn, OCONH2, OCONMe2, OCONEt2, OCONBn2, OCONHMe, OCONHEt, OCONHBn, F, Cl, Br или I. В некоторых вариантах реализации, R1 и R2 представляют собой независимо H, OH, OMe, OEt, OCH2CH2OMe, OBn или F. В некоторых вариантах реализации, R1 и R2 представляют собой независимо H или OH. В некоторых вариантах реализации, R1 и R2 представляют собой H. В некоторых вариантах реализации, R1 и R2 представляют собой OH.
R3 и R4 могут быть одинаковыми или разными.
В некоторых вариантах реализации, R3 представляет собой H или R3 вместе с атомом кислорода, с которым R3 связан, образует OH, OMe, OEt, OPh, OCH2CH2OMe, OCH2CH2OEt, OCH2CH2OBn,OBn, OAc, OBz, OCOOMe, OCOOEt, OCOOBn, OCONH2, OCONMe2, OCONEt2, OCONBn2, OCONHMe, OCONHEt или OCONHBn. В некоторых вариантах реализации, R3 представляет собой H или R3 вместе с атомом кислорода, с которым R3 связан, образует OH, OMe, OEt, OCH2CH2OMe или OBn. В некоторых вариантах реализации, R3 представляет собой H.
В некоторых вариантах реализации, R4 представляет собой H или R4 вместе с атом кислорода, с которым R4 связан, образует OH, OMe, OEt, OPh, OCH2CH2OMe, OCH2CH2OEt, OCH2CH2OBn,OBn, OAc, OBz, OCOOMe, OCOOEt, OCOOBn, OCONH2, OCONMe2, OCONEt2, OCONBn2, OCONHMe, OCONHEt или OCONHBn. В некоторых вариантах реализации, R4 представляет собой H или R4 вместе с атомом кислорода, с которым R4 связан, образует OH, OMe, OEt, OCH2CH2OMe или OBn. В некоторых вариантах реализации, R4 представляет собой H.
В некоторых вариантах реализации, X представляет собой P(O)OH, P(O)SH, P(→O)BH3- или P(O)Me. В некоторых вариантах реализации, X представляет собой P(O)OH. В некоторых вариантах реализации, X вместе с атомами кислорода, с которыми X связан, образует фосфодиэфир.
Неограничивающие примеры алкила включают неразветвленные, разветвленные и циклические алкильные группы. Неограничивающие примеры неразветвленных алкильных групп, включают метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил и децил.
Разветвленные алкильные группы включают любую неразветвленную алкильную группу, замещенную любым количеством алкильных групп. Неограничивающие примеры разветвленных алкильных групп включают изопропил, изобутил, втор-бутил и т-бутил.
Неограничивающие примеры циклических алкильных групп, включают циклопропильную, циклобутильную, циклопентильную, циклогексильную, циклогептильную и циклооктильную группы. Циклические алкильные группы также включают конденсированные-, мостиковые- и спиро-бициклические и высшие конденсированные-, мостиковые- и спиро-системы. Циклическая алкильная группа может быть замещена любым количеством неразветвленных или разветвленных алкильных групп.
Гало-алкильная группа может быть любой алкильной группою замещенной любым количеством атомов галогенов, например, атомы фтора, хлора, брома и йода.
Алкокси группой может быть, например, атом кислорода, замещенный любой алкильной группой. Эфир или эфирная группа содержит алкокси группу. Неограничивающие примеры алкокси группы включают метокси, этокси, пропокси, изопропокси и изобутокси.
Алкоксиалкокси группой может быть, например, алкокси группа замещенная в любом положении любой алкокси группой. Неограничивающие примеры алкоксиалкокси групп включают метоксиэтокси, этоксиэтокси, этоксиэтоксиэтокси, группы производные от глима любого порядка и группы производные от полиэтиленгликоля.
Арильная группа может быть гетероциклической или негетероциклической. Арильная группа может быть моноциклической или полициклической. Арильная группа может быть замещенной любым количеством углеводородных групп, алкильных групп и атомов галогена. Неограничивающие примеры арильных групп включают фенил, толил, нафтил, пирролил, пиридил, имидазолил, тиофенил и фурил.
Арилокси группой может быть, например, атом кислорода, замещенный любой арильной группой, такой как фенокси.
Аралкильной группой может быть, например, любая алкильная группа, замещенная любой арильной группой, такой как бензил.
Арилалкокси группой может быть, например, атом кислорода, замещенный любой аралкильной группой, такой как бензилокси.
Гетероциклом может быть любое кольцо, содержащее кольцевой атом отличный от углерода. Гетероцикл может быть замещен любым количеством алкильных групп и атомов галогена. Неограничивающие примеры гетероциклов включают пиррол, пирролидин, пиридин, пиперидин, сукцинамид, малеимид, морфолин, имидазол, тиофен, фуран, тетрагидрофуран, пиран и тетрагидропиран.
Ацильной группой может быть, например, карбонильная группа замещенная углеводородом, алкилом, углеводородокси, алкокси, арилом, арилокси, аралкилом, арилалкокси или гетероциклом. Неограничивающие примеры ацила включают ацетил, бензоил, бензилоксикарбонил, феноксикарбонил, метоксикарбонил и этоксикарбонил.
Ацилокси группой может быть атом кислорода, замещенный ацильной группой. Сложный эфир или сложноэфирная группа содержит ацилокси группу.
Карбонатной группой может быть атом кислорода замещенный углеводородоксикарбонилом, алкоксикарбонилом, арилоксикарбонилом или арилалкоксикарбонилом.
Карбаматной группой может быть атом кислорода замещенный карбамоильной группой, в которой атом азота карбамоильной группы незамещен, монозамещен или дизамещен одним или более углеводородов, алкилов, арилов, геитероциклов или аралкилов. Когда атом азота дизамещен, два заместителя вместе с атомом азота могут образовывать гетероцикл.
Любая функциональная группа соединения описанного в данном документе может быть необязательно защищена защитной группой. Для ознакомления с защитными группами, см. Greene's Protective Groups In Organic Synthesis, 4th Ed. (Wiley 2006) (1980) и Protecting Groups, 3d Ed. (Thieme 2005) (1994), каждая из которых включена посредством ссылки во всей их полноте.
Неограничивающие примеры пригодных защитных групп для гидроксильной группы включают алкильную, галоалкильную, арильную, аралкильную, карбонатную, карбаматную и ацильную группы.
Неограничивающие примеры пригодных защитных групп для азотсодержащих групп включают алкильную, арильную, аралкильную, ацильную группу, алкоксикарбонильную группу, арилоксикарбонильную группу и аминокарбонильную группу. Защитная группа вместе с атомом азота, с которым связана защитная группа, может образовывать, например, амид, карбамат, уретан, гетероцикл или амин. Две защитные группы связанные с одним атомом азота могут вместе с атомом азота образовывать гетероцил.
Изобретение предлагает фармацевтически приемлемые соли любого соединения описанного в данном документе. Фармацевтически приемлемые соли включают, например, кислотно-аддитивные соли и основно-аддитивные соли. Кислота, прибавляемая к соединению с образованием кислотно-аддитивной соли, может быть органической кислотой или неорганической кислотой. Основание, прибавляемое к соединению с образованием основно-аддитивной соли, может быть органическим основанием или неорганическим основанием. В некоторых вариантах реализации, фармацевтически приемлемая соль является солью металла. В некоторых вариантах реализации, фармацевтически приемлемая соль является аммониевой солью.
Кислотно-аддитивные соли могут возникать при добавлении кислоты к соединению, описанному в данном документе. В некоторых вариантах реализации, кислота является органической. В некоторых вариантах реализации, кислота является неорганической. Неограничивающие примеры подходящих кислот включают хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, азотную кислоту, азотистую кислоту, серную кислоту, сернистую кислоту, фосфорную кислоту, никотиновую кислоту, изоникотиновую кислоту, молочную кислоту, салициловую кислоту, 4-аминосалициловую кислоту, винную кислоту, аскорбиновую кислоту, гентизиновую кислоту, глюконовую кислоту, глюкуроновую кислоту, сахарную кислоту, муравьиную кислоту, бензойную кислоту, глутаминовую кислоту, пантотеновую кислоту, уксусную кислоту, пропионовую кислоту, масляную кислоту, фумаровую кислоту, янтарную кислоту, лимонную кислоту, щавелевую кислоту, малеиновую кислоту, гидроксималеиновую кислоту, метилмалеиновую кислоту, гликолевую кислоту, яблочную кислоту, коричную кислоту, миндальную кислоту, 2-феноксибензойную кислоту, 2-ацетоксибензойную кислоту, эмбоновую кислоту, фенилуксусную кислоту, N-циклогексилсульфамовую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, бензолсульфоновую кислоту, п-толуолсульфоновую кислоту, 2-гидроксиэтансульфоновую кислоту, этан-1,2-дисульфоновую кислоту, 4-метилбензолсульфоновую кислоту, нафталин-2-сульфоновую кислоту, нафталин-1,5-дисульфоновую кислоту, 2-фосфоглицериновую кислоту, 3-фосфоглицериновую кислоту, глюкозо-6-фосфорную кислоту и аминокислоту.
Неограничивающие примеры пригодных кислотно-аддитивных солей включают гидрохлоридную соль, гидробромидную соль, гидройодидную соль, нитратную соль, нитритную соль, сульфатную соль, сульфитную соль, соль, фосфатную соль, гидрофосфатную соль, дигидрофосфатную соль, карбонатную соль, бикарбонатную соль, никотинатную соль, изоникотинатную соль, лактатную соль, салицилатную соль, 4-аминосалицилатную соль, тартратную соль, аскорбатную соль, соль гентизинатную соль, глюконатную соль, глюкаронатную соль, сахаратную соль, формиатную соль, бензоатную соль, глутаматную соль, пантотенатную соль, ацетатную соль, пропионатную соль, бутиратную соль, фумаратную соль, сукцинатную соль, цитратную соль, оксалатную соль, малеатную соль, гидроксималеатную соль, метилмалеатную соль, гликолятную соль, малатную соль, циннаматную соль, манделатную соль, 2-феноксибензоатную соль, 2-ацетоксибензоатную соль, эмбонатную соль, фенилацетатную соль, N- циклогексилсульфаматную соль, метансульфонатную соль, этансульфонатную соль, бензолсульфонатную соль, п-толуолсульфонатную соль, 2-гидроксиэтансульфонатную соль, этан-1,2-дисульфонатную соль, 4-метилбензолсульфонатную соль, нафталин-2-сульфонатную соль, нафталин-1,5-дисульфонатную соль, 2-фосфоглицератную соль, 3-фосфоглицератную соль, глюкозо-6-фосфатную соль и соль аминокислоты.
Соли металлов могут образовываться в результате добавления неорганического основания к соединению, описанному в данном документе. Неорганическое основание состоит из катиона металла в паре с основным противоионом, таким как, например, гидроксид, карбонат, бикарбонат или фосфат. Металл может быть щелочным металлом, щелочноземельным металлом, переходным металлом или металлом основной группы. Неограничивающие примеры подходящих металлов включают литий, натрий, калий, цезий, церий, магний, марганец, железо, кальций, стронций, кобальт, титан, алюминий, медь, кадмий и цинк.
Неограничивающие примеры подходящих солей металлов включают соль лития, соль натрия, соль калия, соль цезия, соль церия, соль магния, соль марганца, соль железа, соль кальция, соль стронция, соль кобальта, соль титана, соль алюминия, соль меди, соль кадмия и соль цинка.
Соли аммония могут возникнуть при добавлении аммиака или органических аминов к соединению, описанному в данном документе. Неограничивающие примеры подходящих органических аминов включают триэтиламин, диизопропиламин, этаноламин, диэтаноламин, триэтаноламин, морфолин, N-метилморфолин, пиперидин, N-метилпиперидин, N-этилпиперидин, дибензиламин, пиперазин, пиридин, пирразол, пипирразол, имидазол, пиразин, пипиразин, этилендиамин, N,N'-дибензилэтилендиамин, прокаин, хлорпрокаин, холин, дициклогексиламин и N-метилглюкамин.
Неограничивающие примеры подходящих солей аммония включают триэтиламиновую соль, диизопропиламиновую соль, этаноламиновую соль, диэтаноламиновую соль, триэтаноламиновую соль, морфолиновую соль, N-метилморфолиновую соль, пиперидиновую соль, N-метилпиперидиновую соль, N-этилпиперидиновую соль, дибензиламиновую соль, пиперазиновую соль, пиридиновую соль, пирразольную соль, пипирразольную соль, имидазольную соль, пиразиновую соль, пипиразиновую соль, этилендиаминовую соль, N,N'-дибензилэтилендиаминовую соль, прокаиновую соль, хлорпрокаиновую соль, холиновую соль, дициклогексиламиновую соль и N-метилглюкаминовую соль.
Неограничивающие примеры соединений Формулы I включают:


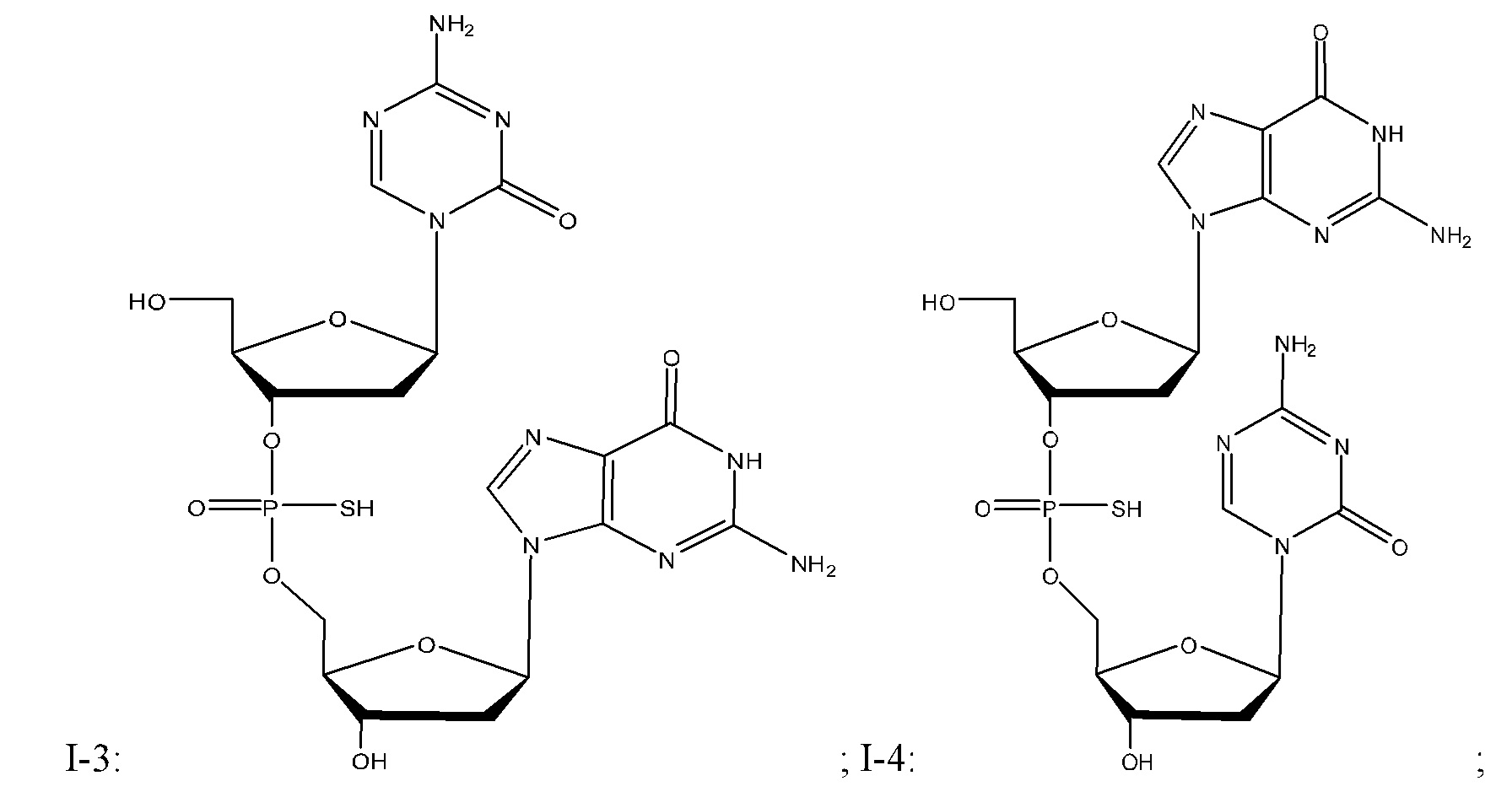


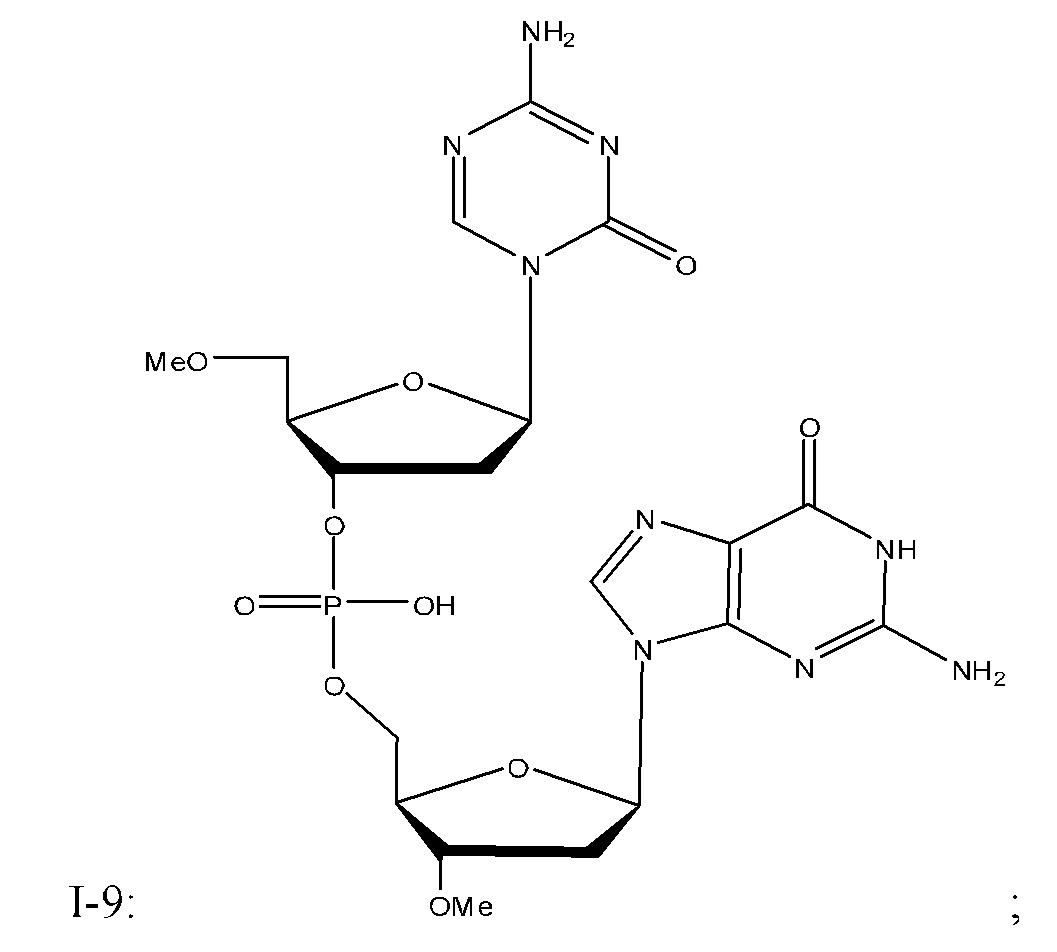

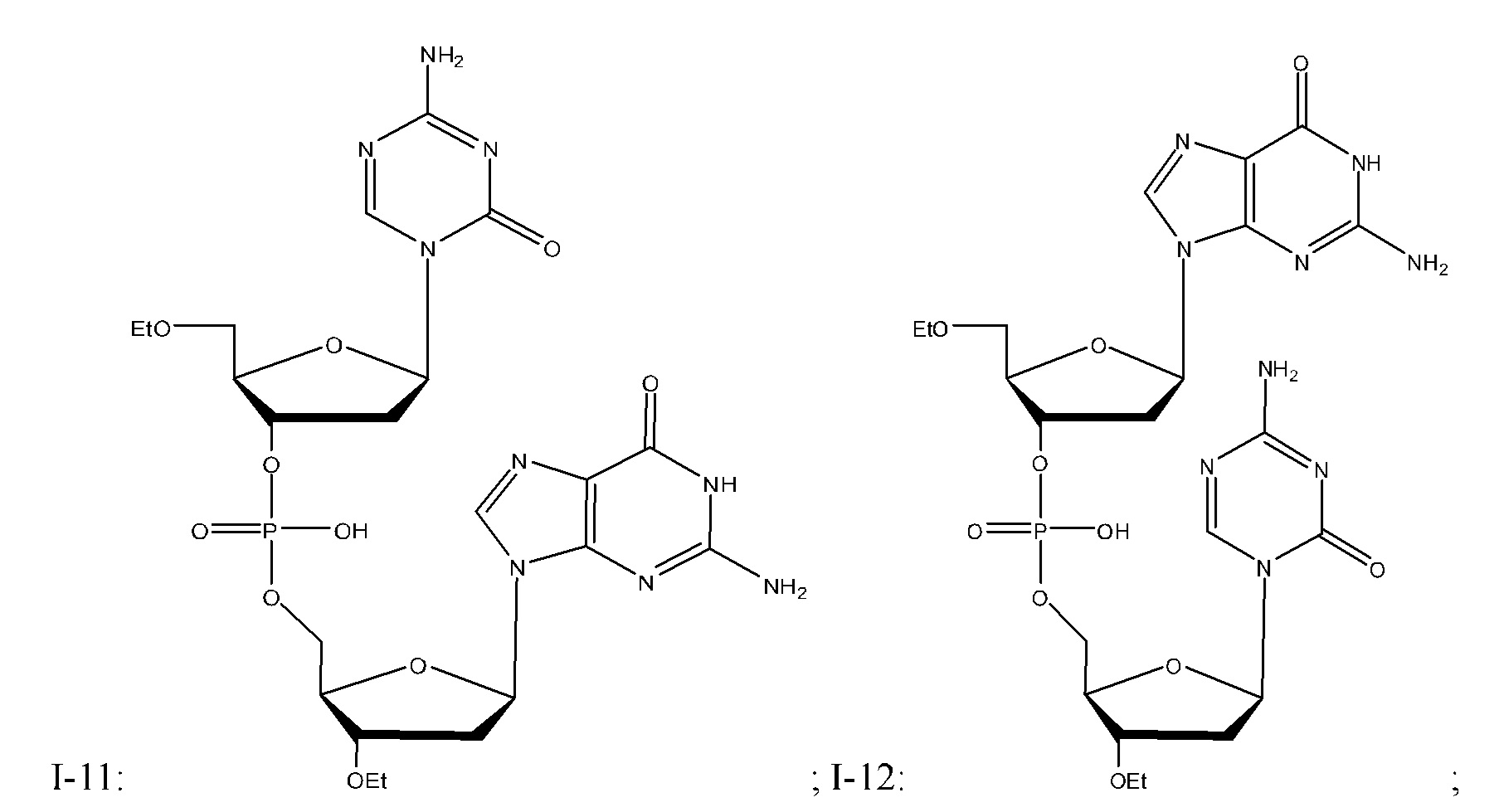


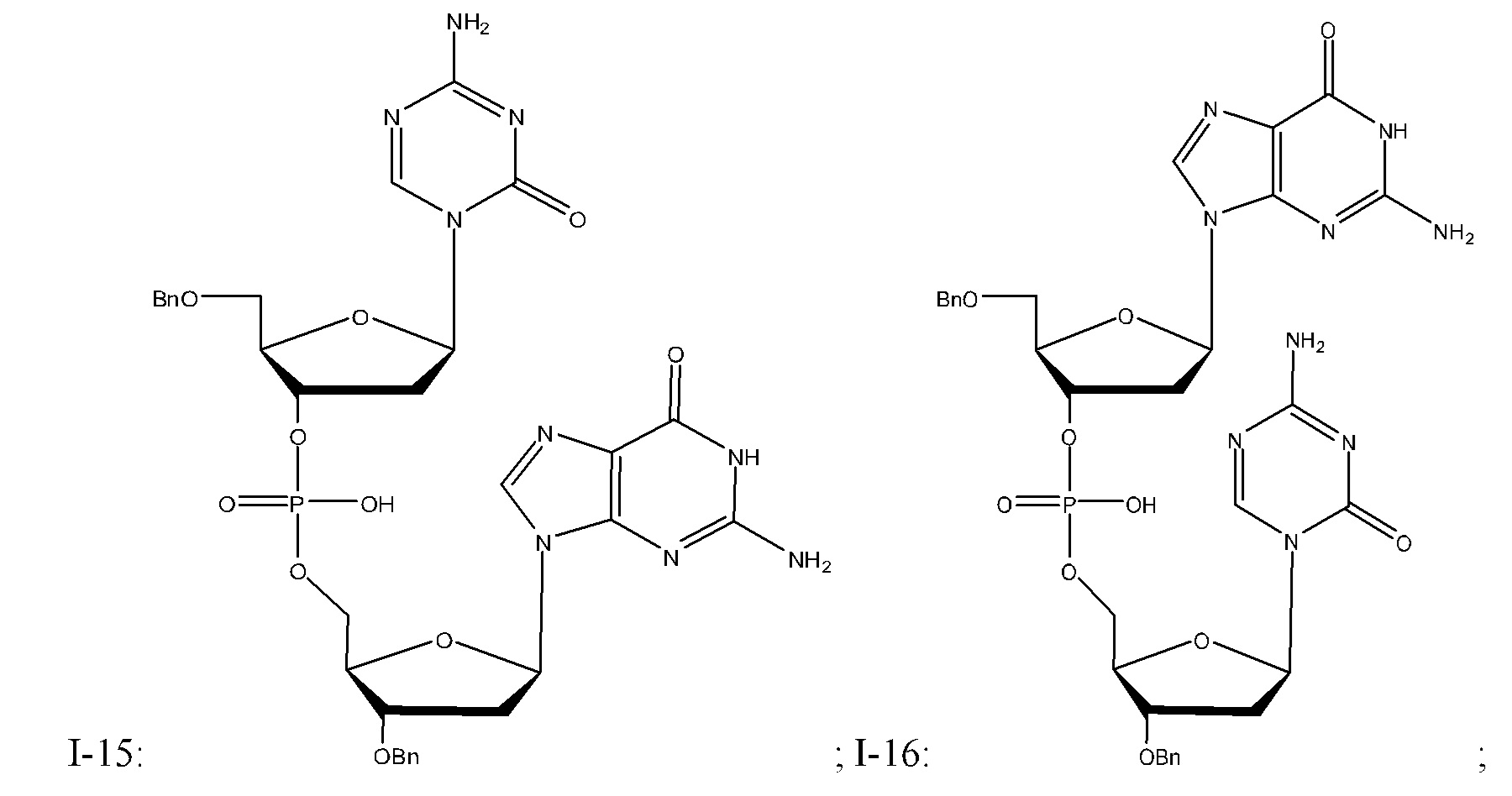





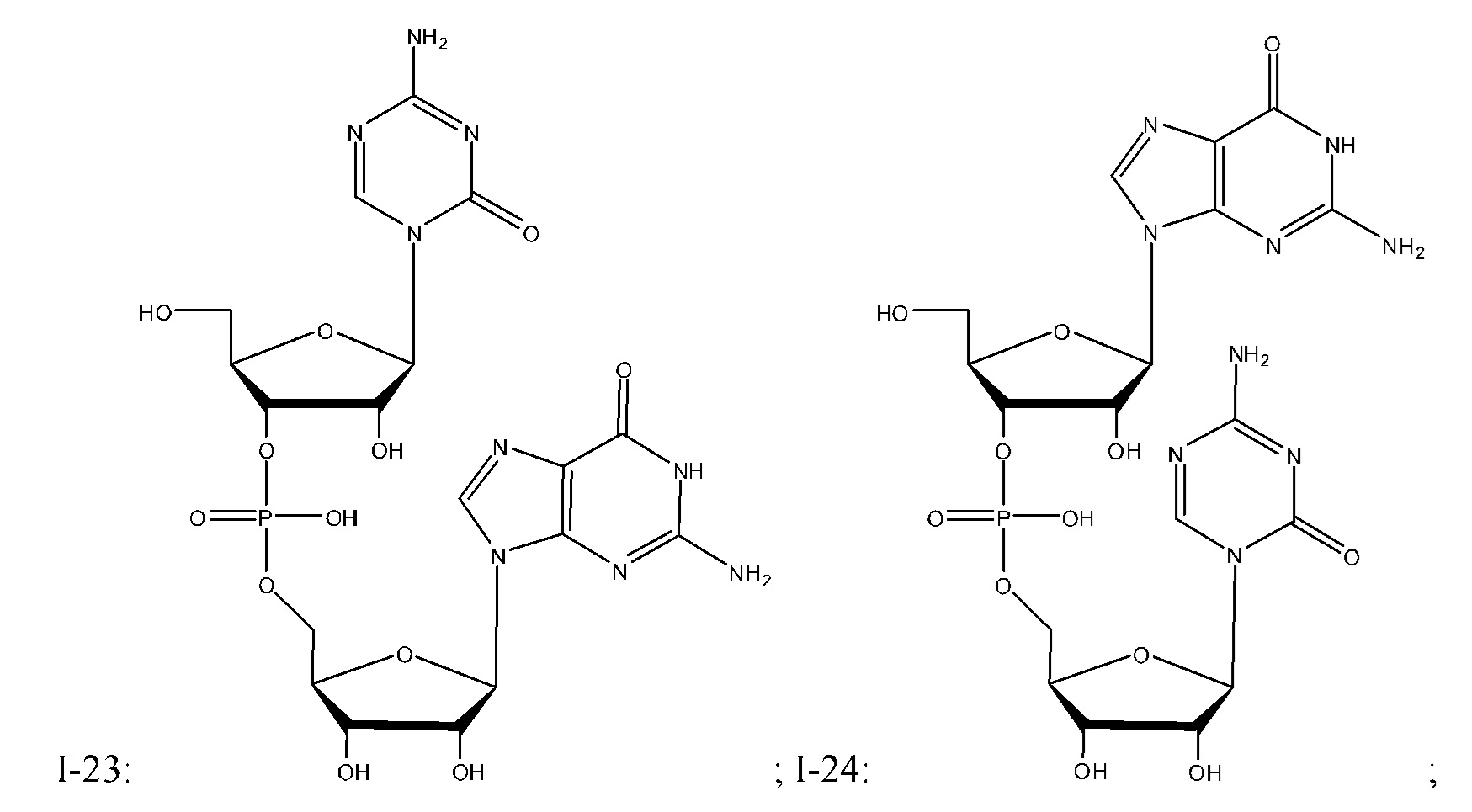
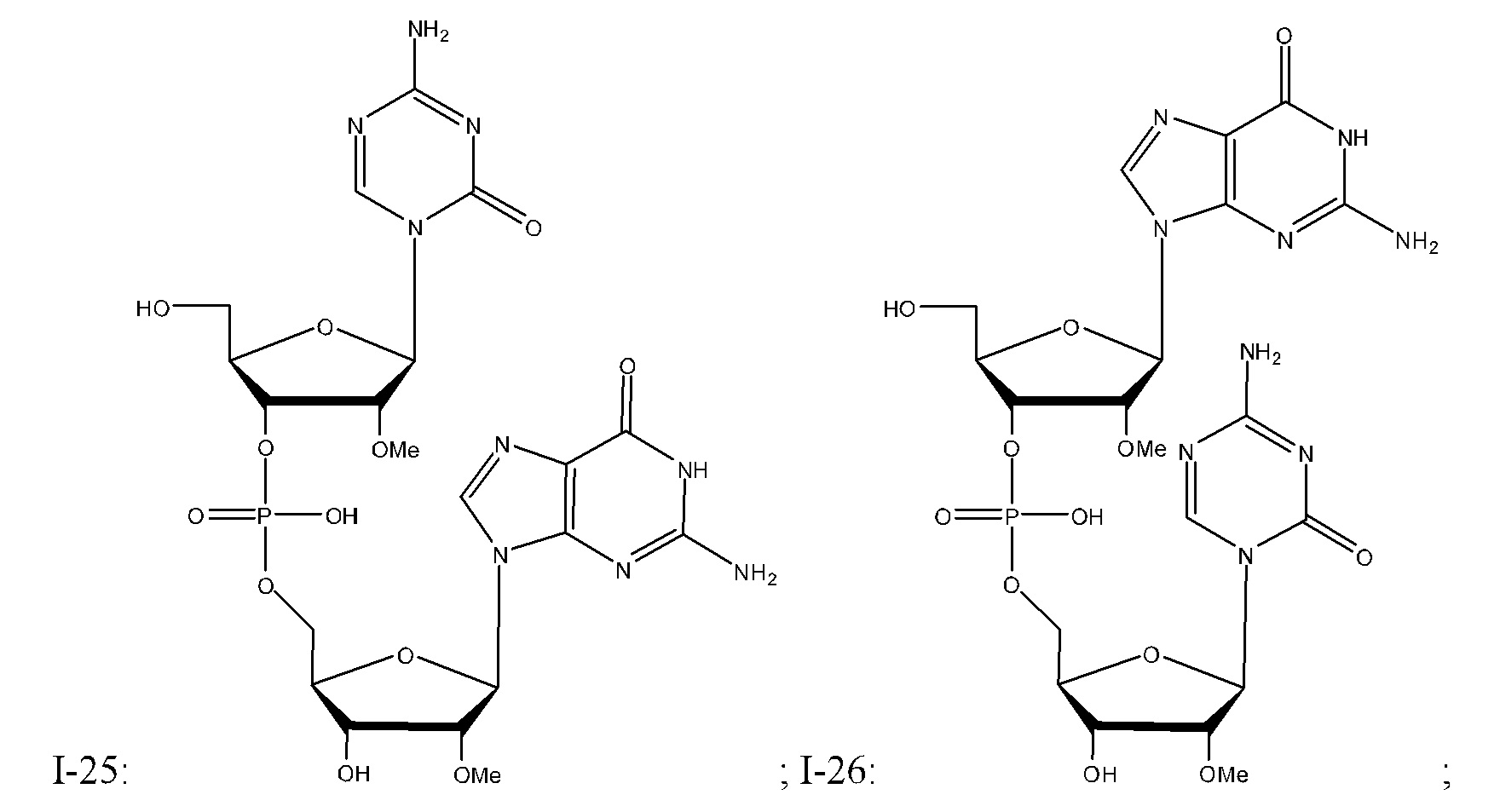
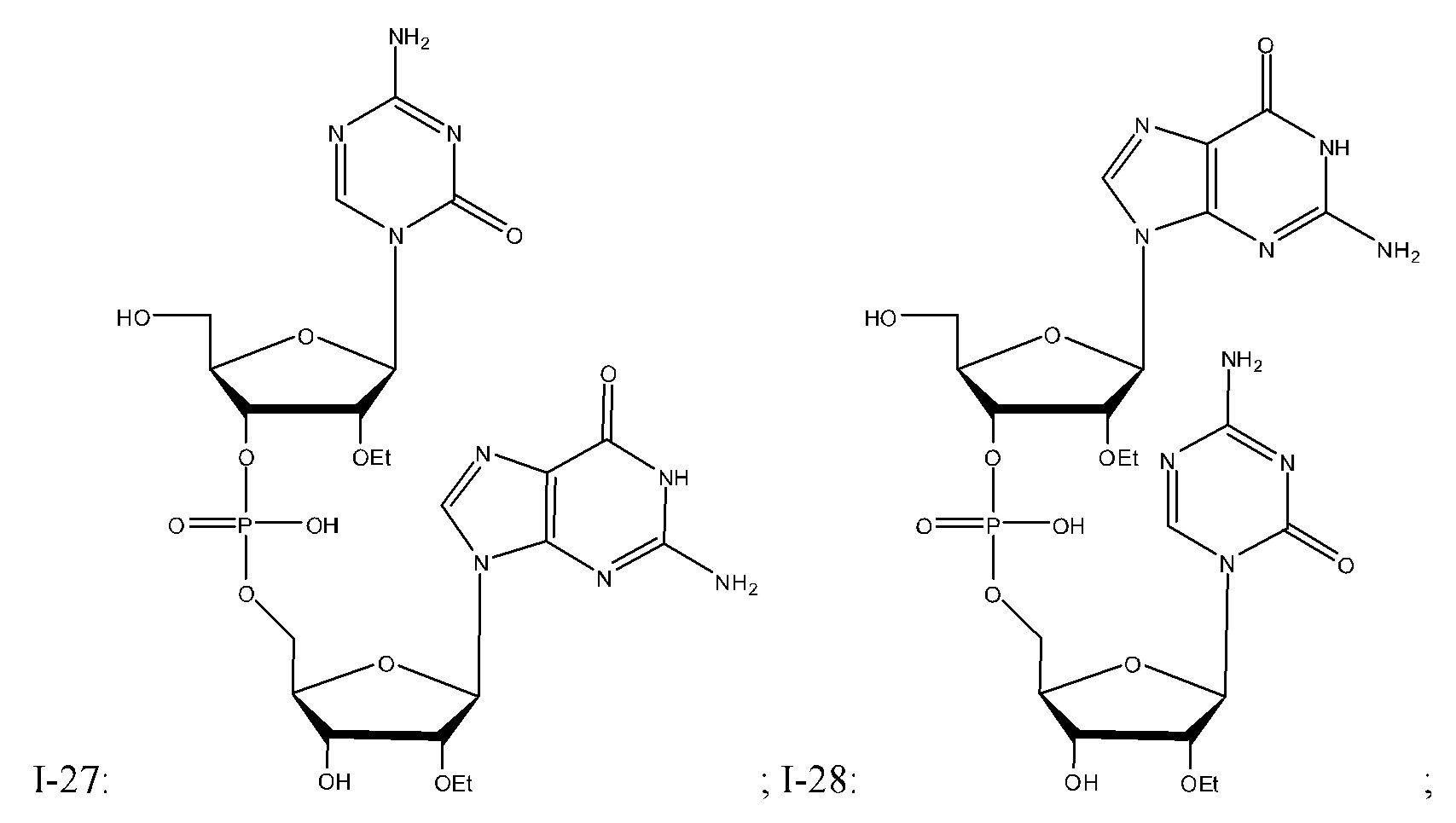
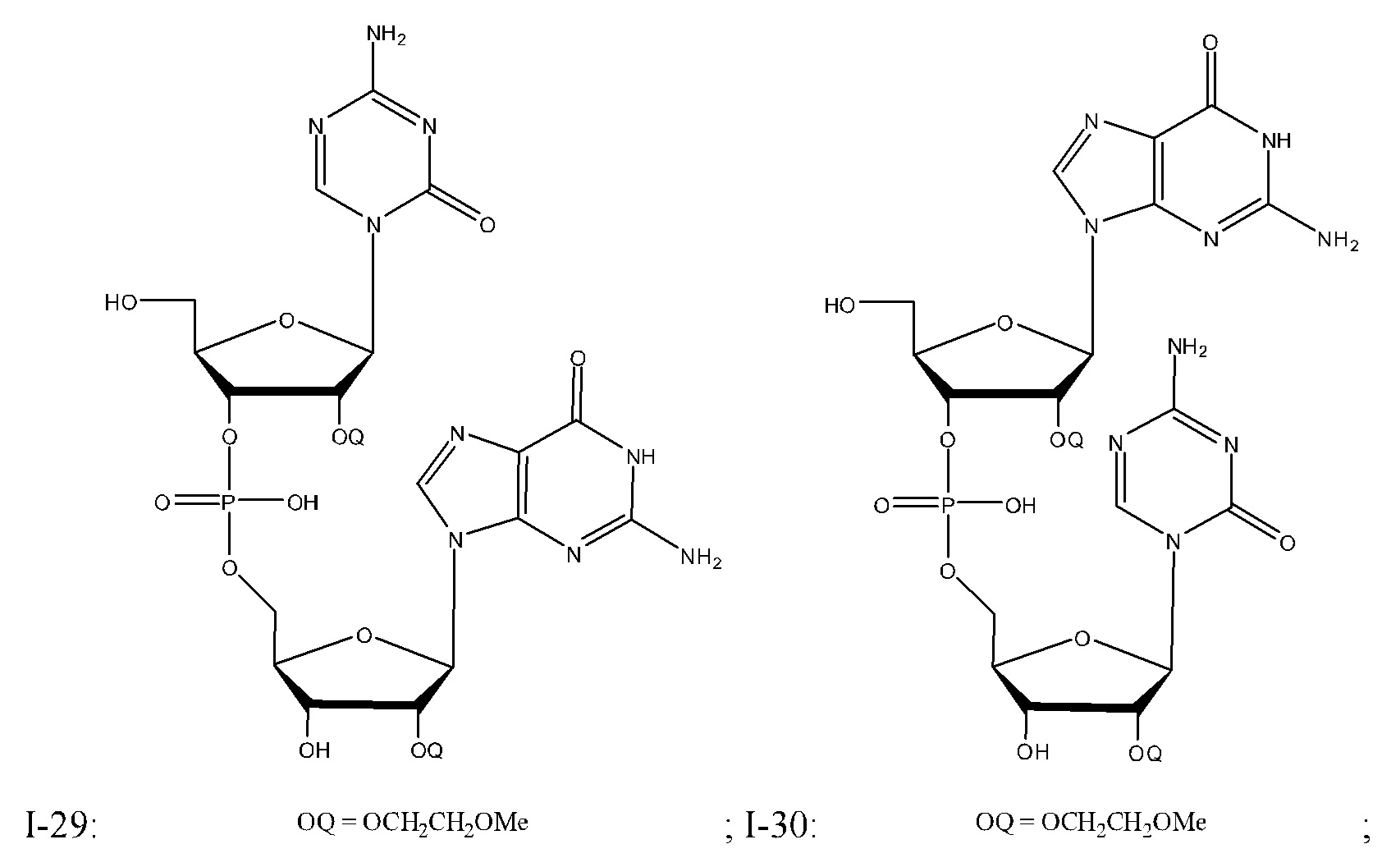




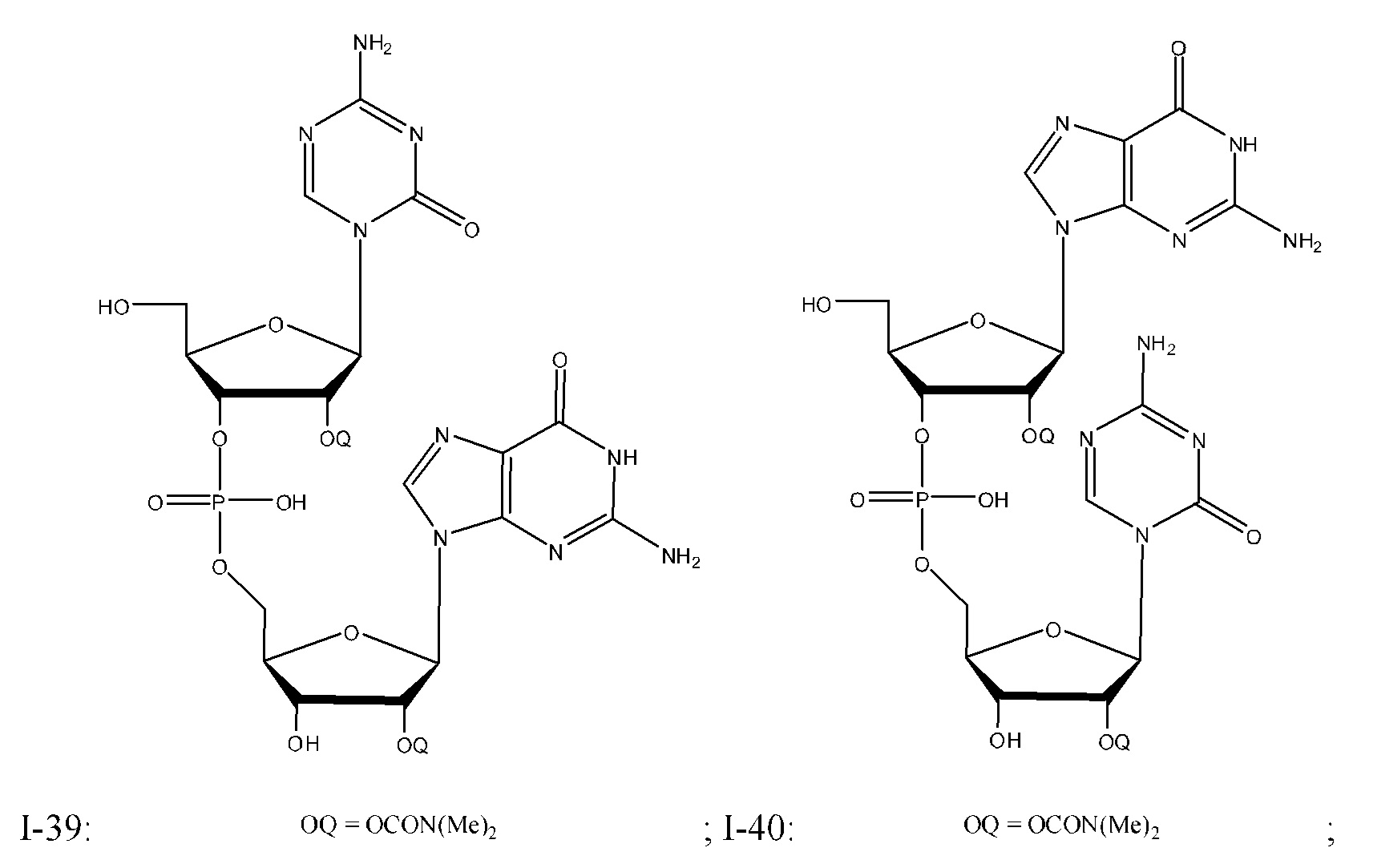
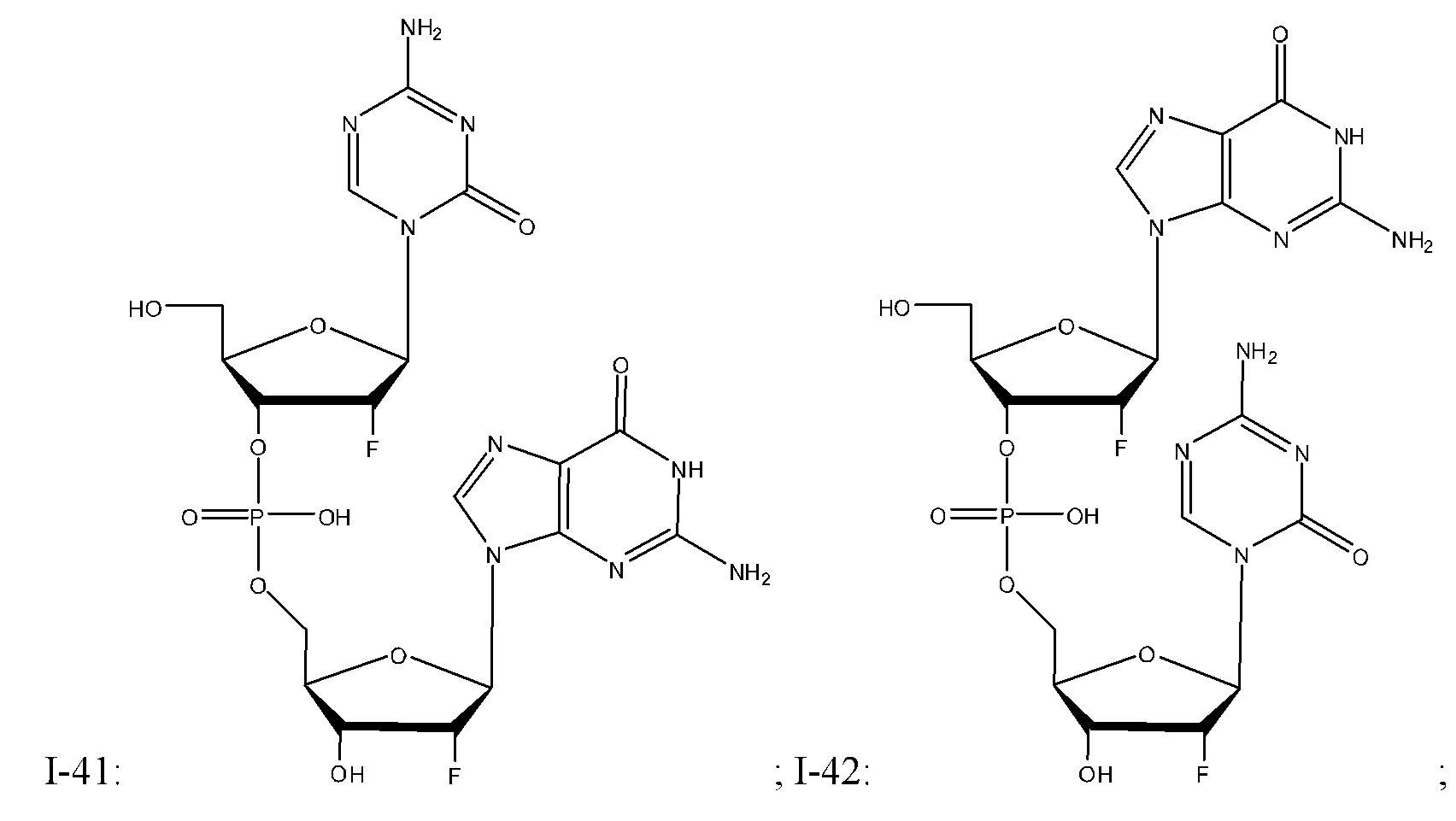

и фармацевтически приемлемые соли любого из упомянутых выше. В некоторых вариантах реализации, солью является натриевая соль любого из упомянутых выше.
Соединения, описанные в данном документе, могут быть синтезированы с помощью способов известных в этой области техники, например, синтез в растворе или в твердой фазе. Для ознакомления с описаниями синтеза соединений изобретения и описанием механизмов действия соединений изобретения, см. WO2007/041071, которая включена в данный документ посредством ссылки во всей ее полноте.
Рецептуры для применения в комбинациях изобретения
Соединения для применения в комбинациях изобретения могут быть предложены в любой форме и могут быть сформулированы в в соотвествии с известными методиками (см., например, Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA, USA). Примеры пригодных рецептур описаны в WO2007/041071 на страницах 13-23, информация из которой включена в данный документ посредством ссылки.
Эффективная терапия может обеспечить выгодные эффекты, такие как аддитивность, синергизм, уменьшение побочных эффектов, снижения токсичности, увеличение времени до прогрессирования заболевания, увеличение времени выживания, сенсибилизацию или десенсибилизацию одного агента другим или улучшение коэффициента ответа. Преимущественно, эффективное действие может позволить более низкие дозы каждого или одного компонента вводимого пациенту, тем самым уменьшая токсичность химиотерапии и в то же время обеспечивая и/или сохраняя тот же самый терапевтический эффект.
Коэффициент ответа можно описать процентом пациентов, достигших статуса ответа. Таким образом, например, коэффициент ответа 50% означает, что половина из пациентов, подвергшихся лечению, достигли статуса ответа. Статус ответа может относиться к типу злокачественности, например, является солидной или гематологической. В первом случае это, как правило, определяется в соответствии с критериями КООСО (Критерии оценки ответа солидных опухолей), в то время как в последнем используется другой критерий ответа (в основном тот, что предлагается МРГ (Международная рабочая группа)).
Синергический эффект может быть терапевтическим эффектом, производимым комбинацией, который больше, чем сумма терапевтических эффектов компонентов комбинации, когда представлены по отдельности.
Аддитивный эффект может быть терапевтическим эффектом, производимым комбинацией, который больше, чем терапевтический эффект любого из компонентов комбинации, когда они представлены по отдельности.
Неограничивающие примеры фармацевтических композиций включают любую композицию пригодную для введения пациенту, будучи, например, в форме, концентрации и/или уровне чистоты, пригодной(ом) для введения человеку или животному. В некоторых вариантах реализации, фармацевтические композиции являются стерильными и/или апирогенными. Апирогенные фармацевтические композиции не вызывает нежелательных воспалительных реакций при введении пациенту.
Неограничивающие примеры фармацевтического набора включают совокупность из одной или более единичных доз фармацевтической композиции вместе с дозирующим устройством (например, измерительный прибор), и/или устройством доставки (например, ингалятор или шприц), необязательно, все содержащиеся в общей внешней упаковке. В фармацевтических наборах, содержащих комбинацию из двух или более соединений/агентов, индивидуальные соединения/агенты могут быть единичными или неединичными рецептурами. В некоторых вариантах реализации, единичная доза(ы) может содержаться в блистерной упаковке. В некоторых вариантах реализации, фармацевтический набор дополнительно содержит инструкции по применению.
Фармацевтическая упаковка может быть совокупностью из одной или более единичных доз фармацевтической композиции, необязательно находящейся внутри общей внешней упаковки. В фармацевтических упаковках, содержащих комбинацию из двух или более соединений/агентов, отдельные соединения/агенты могут быть единичными или неединичными рецептурами. Единичная доза(ы) может содержаться в блистерной упаковке. В некоторых вариантах реализации, фармацевтическая упаковка дополнительно содержит инструкции по применению.
Пакетом пациента может быть упаковка, назначенная пациенту, которая содержит фармацевтические композиции для всего курса лечения. Пакеты пациентов могут содержать одну или более блистерных упаковок. Пакеты пациентов имеют преимущество по сравнению с традиционными предписаниями, где фармацевт выделяет предписанный пациенту фармацевтический препарат из массы, так что пациент всегда имеет доступ к вкладышу, содержащемуся в пакете пациента, как правило, отсутствующих в предписаниях пациенту. Было показано, что включение вкладыша улучшает соблюдение пациентом инструкции врача.
Неограничивающие примеры физически несвязанных комбинированных соединений/агентов включают:
материал (например, неединичная рецептура), содержащий, по меньшей мере, одно из двух или более соединений/агентов вместе с инструкциями для немедленного объединения, по меньшей мере, одного соединения/агента с образованием физической комбинации из двух или более соединений/агентов;
материал (например, неединичная рецептура), содержащий по меньшей мере одно из двух или более соединений/агентов вместе с инструкциями для комбинационной терапии двумя или более соединениями/агентами;
материал, содержащий по меньшей мере одно из двух или более соединений/агентов вместе с инструкциями для введения популяции пациентов, в котором вводили (или вводят) другое(ие) из двух или более соединений/агентов;
материал, содержащий по меньшей мере одно из двух или более соединений/агентов в количестве или в форме, которая специально адаптирована для применения в комбинации с другим(и) из двух или более соединений/агентов.
Неограничивающие примеры комбинированных терапий включают терапии, которые включают применение комбинации из двух или более соединений/агентов (как определено выше). Соединения можно вводить как часть той же общей схемы лечения. Таким образом, дозировки каждого из двух или более соединений/агентов могут отличаться: каждое из них может вводиться одновременно или в разное время. В некоторых вариантах реализации, соединения/агенты комбинации могут вводиться последовательно (например, до или после) или одновременно, или в одной фармацевтической рецептуре (т.е. вместе), или в разных фармацевтических рецептурах (т.е. отдельно). Одновременно в той же самой рецептуре происходит в форме единой рецептуры, тогда как одновременно в разных фармацевтических рецептурах происходит не в одной форме. В некоторых вариантах реализации, соединение Формулы I или его соль вводят первым (в качестве инициирующего лечения), с последующим введением вспомогательного терапевтического компонент(ов). Позологии каждого из двух или более соединений/агентов в комбинационной терапии могут также отличаться исходя из пути введения.
В некоторых вариантах реализации, комбинации изобретения обеспечивают терапевтически эффективное действие, по сравнению с терапевтическим действием индивидуальных соединений/агентов, вводимых раздельно.
Вспомогательным терапевтическим компонентом может быть соединение/агент, который дает эффективную комбинацию при объединении с соединением формулы (I). Вспомогательный компонент может способствовать эффективности комбинация (например, обеспечивая синергический или аддитивный эффект или повышая коэффициент ответа).
Противоопухолевая эффективность комбинаций может быть оценена по отношению к эффективности метилирования ДНК и/или модуляции иммунологического профиля опухоли. Глобальное или ген-специфическое метилирование ДНК можно контролировать с помощью анализа ДНК обработанной бисульфитом натрия с использованием пиросеквенирования, количественной метилирование-специфической ПЦР или ОТ-ПЦР и количественной ОТ-ПЦР в реальном времени. Иммунологический профиль опухоли можно характеризовать с помощью иммуногистохимии (ИГХ) на наличие и относительную частоту активированных Т-клеток. Иммуномодулирующая активность комбинаций также может быть оценена с помощью анализов ОТ-ПЦР и количественной ПЦР в режиме реального времени индукции или модуляции антигенов рака яичка (АРЯ), таких как NY-ESO-1 или MAGE семейство антигенов. Эффективность лечения комбинацией также может быть определена по иммунному ответу на анти-опухолевую активность комбинаций. Например, модуляция противоопухолевого T клеточного ответа может быть оценена с помощью исследований Реакции Смешанных Лимфоцитов Опухолевых Клеток (РСЛОК). Дополнительные детали таких аналитических методов представлены, например, в Coral et al. (2012) Immunomodulatory activity of SGI-110, a 5-aza-2'-deoxycytidine-containing demethylating dinucleotide Cancer Immunol. Immunother. DOI 10.1007/s00262-012-1365-7.
Неограничивающие примеры антител включают:
i) целые антитела (включающие поликлональные антитела и моноклональные антитела (mАbs));
ii) фрагменты антител, включая F(ab), F(аb'), F(аb')2, Fv, Fc3 и одноцепочечные антитела (и их комбинации), которые могут быть получены с помощью методов рекомбинантной ДНК или путем ферментативного или химического расщепления интактных антител;
iii) биспецифические или бифункциональные антитела, которые являются синтетическими гибридными антителами, имеющими две разные пары тяжелой/легкой цепи и два различных сайта связывания;
iv) химерные антитела (антитела, имеющие константный иммуноглобулиновый домен антитела человека связанный с одним или более вариабельных иммуноглобулиновых доменов нечеловеческого антитела или их фрагментами);
v) минитела (см. WO 94/09817), одноцепочечные Fv-Fc слияния и человеческие антитела, произведенные трансгенными животными; и
vi) мультимерные антитела и комплексы белков высшего порядка (например, гетеродимерные антитела). Биспецифические антитела могут быть получены с помощью различных методов, включая слияние гибридом или связывание фрагментов Fab'. В некоторых вариантах реализации, химерные антитела являются гуманизированными антителами.
Неограничивающие примеры иммунотерапии включают вмешательство (например, введение комбинации изобретения субъекту), которое лечит, улучшает или уменьшает симптомы заболевания или удаляет (или уменьшает воздействие) его причин(ы), и которая, опосредована, по меньшей мере частично, компонентами иммунной системы хозяина. Иммунотерапия может быть достигнута путем иммуномодуляции, может быть простимулирована и/или подавлена одним или более компонентов или деятельностью иммунной системы.
Рецептуры, описанные в данном документе, предлагают соединения, описанные в данном документе, в форме с высокой растворимостью, низким объемом впрыска и хорошей химической стабильностью и сроком годности. Эти свойства предлагают рецептуры, которые сохраняют высокий процент начальной эффективности и обеспечивают терапевтически эффективное количество соединение, даже после хранения при комнатной температуре или ниже в течение длительного периода времени.
В некоторых вариантах реализации, изобретение предлагает комбинации, содержащие рецептуру, содержащую: a) соединение Формулы I или его фармацевтически приемлемую соль:
(5-азацитозиновая группа)-L-(гуаниновая группа) (I),
в которой L представляет собой фосфорсодержащий линкер, в котором количество атомов фосфора в L равно 1; и b) растворитель, содержащий: от около 45% до около 85% пропиленгликоля; от около 5% до около 45% глицерина и от 0% до около 30% этанола; и c) необязательно, фармацевтически приемлемый наполнитель.
Пригодные рецептуры могут быть растворами или суспензиями соединения в растворителе или смеси растворителей. Неограничивающие примеры пригодных растворителей включают пропиленгликоль, глицерин, этанол и любую комбинацию упомянутых выше. Рецептуры могут быть получены в форме неводных рецептур. Рецептуры могут быть безводными или по существу безводными.
Смесь растворителей может содержать пропиленгликоль, выраженный в массовых процентах или объемных процентах. В некоторых вариантах реализации, процент пропиленгликоля может быть по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере около 10%, по меньшей мере около 20%, по меньшей мере около 30%, по меньшей мере около 40% или по меньшей мере около 50%. В некоторых вариантах реализации, процент пропиленгликоля может быть самое большее 90%, самое большее 80%, самое большее 70%, самое большее 60%, самое большее около 90%, самое большее около 80%, самое большее около 70% или самое большее около 60%. В некоторых вариантах реализации, процент пропиленгликоля может быть от 30% до 90%, от 45% до 85%, от 55% до 75%, от 60% до 70%, от около 30% до около 90%, от около 45% до около 85%, от около 55% до около 75% или от около 60% до около 70%. В некоторых вариантах реализации, процент пропиленгликоля может быть 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, около 30%, около 35%, около 40%, около 45%, около 50%, около 55%, около 60%, около 65%, около 70%, около 75%, около 80%, около 85% или около 90%.
Смесь растворителей может содержать глицерин, выраженный в массовых процентах или объемных процентах. В некоторых вариантах реализации, процент глицерина может быть по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере около 5%, по меньшей мере около 10%, по меньшей мере около 15%, по меньшей мере около 25% или по меньшей мере около 30%. В некоторых вариантах реализации, процент глицерина может быть самое большее 70%, самое большее 60%, самое большее 50%, самое большее 40%, самое большее 30%, самое большее около 70%, самое большее около 60%, самое большее около 50%, самое большее около 40% или самое большее около 30%. В некоторых вариантах реализации, процент глицерина может быть от 0% до 50%, от 5% до 45%, от 15% до 35%, от 20% до 30%, от 0% до около 50%, от около 5% до около 45%, от около 15% до около 35% или от около 20% до около 30%. В некоторых вариантах реализации, процент глицерина может быть 0%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, около 5%, около 10%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45% или около 50%.
Смесь растворителей может содержать этанол, выраженный в массовых процентах или объемных процентах. В некоторых вариантах реализации, процент этанола может быть по меньшей мере 1%, по меньшей мере 3%, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере около 1%, по меньшей мере около 3%, по меньшей мере около 5%, по меньшей мере около 10% или по меньшей мере около 15%. В некоторых вариантах реализации, процент этанола может быть самое большее 30%, самое большее 25%, самое большее 20%, самое большее 15%, самое большее 10%, самое большее около 30%, самое большее около 25%, самое большее около 20%, самое большее около 15% или самое большее около 10%. В некоторых вариантах реализации, процент этанола может быть от 0% до 30%, от 0% до 25%, от 0% до 20%, от 5% до 15%, от 0% до около 30%, от 0% до около 25%, от 0% до около 20% или от около 5% до около 15%. В некоторых вариантах реализации, процент этанола может быть 0%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9%, около 10%, около 11%, около 12%, около 13%, около 14% или около 15%.
В некоторых вариантах реализации, растворитель или смесь растворителей содержит от 45% до 85% пропиленгликоля, от 5% до 45% глицерина и от 0% до 30% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей содержит от около 45% до около 85% пропиленгликоля, от около 5% до около 45% глицерина и от 0% до около 30% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей состоит по сути из от 45% до 85% пропиленгликоля, от 5% до 45% глицерина и от 0% до 30% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей состоит по сути из от около 45% до около 85% пропиленгликоля, от около 5% до около 45% глицерина и от 0% до около 30% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей содержит от 45% до 85% пропиленгликоля, от 5% до 45% глицерина и от 0% до 30% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей содержит от около 45% до около 85% пропиленгликоля, от около 5% до около 45% глицерина и от 0% до около 30% этанола.
В некоторых вариантах реализации, растворитель или смесь растворителей содержит от 55% до 75% пропиленгликоля, от 15% до 35% глицерина и от 0% до 20% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей содержит от около 55% до около 75% пропиленгликоля, от около 15% до около 35% глицерина и от 0% до около 20% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей состоит по сути из от 55% до 75% пропиленгликоля, от 15% до 35% глицерина и от 0% до 20% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей состоит по сути из от около 55% до около 75% пропиленгликоля, от около 15% до около 35% глицерина и от 0% до около 20% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей содержит от 55% до 75% пропиленгликоля, от 15% до 35% глицерина и от 0% до 20% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей содержит от около 55% до около 75% пропиленгликоля, от около 15% до около 35% глицерина и от 0% до около 20% этанола.
В некоторых вариантах реализации, растворитель или смесь растворителей содержит от 60% до 70% пропиленгликоля; от 20% до 30% глицерина и от 5% до 15% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей содержит от около 60% до около 70% пропиленгликоля; от около 20% до около 30% глицерина и от около 5% до около 15% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей состоит по сути из от 60% до 70% пропиленгликоля; от 20% до 30% глицерина и от 5% до 15% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей состоит по сути из около 60% до около 70% пропиленгликоля; от около 20% до около 30% глицерина и от около 5% до около 15% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей содержит от 60% до 70% пропиленгликоля; от 20% до 30% глицерина и от 5% до 15% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей содержит от около 60% до около 70% пропиленгликоля; от около 20% до около 30% глицерина и отоколо 5% до около 15% этанола.
В некоторых вариантах реализации, растворитель или смесь растворителей содержит 65% пропиленгликоля; 25% глицерина и 10% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей содержит около 65% пропиленгликоля; около 25% глицерина и около 10% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей состоит по сути из 65% пропиленгликоля; 25% глицерина и 10% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей состоит по сути из около 65% пропиленгликоля; около 25% глицерина и около 10% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей содержит 65% пропиленгликоля; 25% глицерина и 10% этанола. В некоторых вариантах реализации, растворитель или смесь растворителей содержит около 65% пропиленгликоля; около 25% глицерина и около 10% этанола.
Рецептуры для применения в комбинациях изобретения могут быть получены, хранится, транспортироваться и перерабатываться в безводной или по сути безводной форме. Растворитель может быть удален перед получением композиции и соединение может быть высушено, например, путем лиофилизации. В ходе получения, хранения, транспортировки или переработки может быть использован осушитель или десикант для регулировки содержание воды. Неограничивающие примеры осушителей включают силикагель, сульфат кальция, хлорид кальция, фосфат кальция, хлорид натрия, бикарбонат натрия, сульфат натрия, фосфат натрия, монтмориллонит, молекулярные сита (шарики или порошок), оксид алюминия, диоксид титана, диоксид циркония и пирофосфат натрия. Осушитель может контактировать с композицией непосредственно, быть включеным в рецептуру в виде пакета с мембраной или храниться с рецептурой в замкнутом пространстве, например, в эксикаторе, так что осушитель и рецептура одновременно находятся в одной и той же контролируемой атмосфере. Осушитель может быть удален из композиции, например, путем фильтрации или катетеризации. Кроме того, композиция может храниться в закрытом контейнере в контролируемой атмосфере, по сути, состоящей из или обогащенной азотом или аргоном.
Безводные или практически безводные условия, выгодные для срока годности композиции, раскрыты в данном документе для комнатной и пониженной температур. Это преимущество позволяет снизить расходы, связанные с хранением, транспортировкой и порчей композиции, повышает удобство хранения и переработки и позволяет избежать необходимости введения холодной рецептуры, тем самым улучшая толерантность субъекта и соответствие схеме рецептуры изобретения.
Рецептуры также могут включать фармацевтически приемлемый наполнитель. Неограничивающие примеры наполнителей включают манит, сорбит, лактозу, декстрозу и циклодекстрины. Наполнители могут прибавляться для модулирования плотности, реологии, однородности и вязкости рецептуры.
Рецептуры могут включать кислотные или основные наполнители для модулирования кислотности или основности рецептура. Неограничивающие примеры кислот, пригодных для увеличения кислотности композиции, включают хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, серную кислоту, фосфорную кислоту, азотную кислоту, аскорбиновую кислоту, лимонную кислоту, винную кислоту, молочную кислоту, щавелевую кислоту, муравьиную кислоту, бензолсульфоновую кислоту, бензойную кислоту, малеиновую кислоту, глутаминовую кислоту, янтарную кислоту, аспарагиновую кислоту, диатризоевую кислоту и уксусную кислоту. Неограничивающие примеры подходящих оснований для повышения основности композиции включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, бикарбонат натрия, фосфат натрия, фосфат калия, ацетат натрия, бензоат натрия, ацетат тетрабутиламмония, бензоат тетрабутиламмония и триалкиламины. Полифункциональные наполнители, такие как этилендиаминтетрауксусная кислота (ЭДТА) или ее соль, также могут быть использованы для модуляции кислотности или основности.
Соединение Формулы I, как определено выше в данном документе, может присутствовать в рецептуре в любом количестве. В некоторых вариантах реализации, соединение присутствует в концентрации от 1 мг/мл до 130 мг/мл, от 10 мг/мл до 130 мг/мл, от 40 мг/мл до 120 мг/мл, от 80 мг/мл до 110 мг/мл, от около 1 мг/мл до около 130 мг/мл, от около 10 мг/мл до около 130 мг/мл, от около 40 мг/мл до около 120 мг/мл или от около 80 мг/мл до около 110 мг/мл. В некоторых вариантах реализации, соединение присутствует в концентрации 10 мг/мл, 20 мг/мл, 30 мг/мл, 40 мг/мл, 50 мг/мл, 60 мг/мл, 70 мг/мл, 80 мг/мл, 90 мг/мл, 100 мг/мл, 110 мг/мл, 120 мг/мл, 130 мг/мл, 140 мг/мл, 150 мг/мл, 160 мг/мл, 170 мг/мл, 180 мг/мл, 190 мг/мл, 200 мг/мл, около 10 мг/мл, около 20 мг/мл, около 30 мг/мл, около 40 мг/мл, около 50 мг/мл, около 60 мг/мл, около 70 мг/мл, около 80 мг/мл, около 90 мг/мл, около 100 мг/мл, около 110 мг/мл, около 120 мг/мл, около 130 мг/мл, около 140 мг/мл, около 150 мг/мл, около 160 мг/мл, около 170 мг/мл, около 180 мг/мл, около 190 мг/мл или около 200 мг/мл. В некоторых вариантах реализации, соединение присутствует в концентрации 100 мг/мл. В некоторых вариантах реализации, соединение присутствует в концентрации около 100 мг/мл.
Рецептура может быть получена в результате приведения в контакт соединения описанного в данном документе с растворителем или смесью растворителей. В альтернативном варианте, соединение может быть приведено в контакт с одним растворителем, а другие растворители могут быть добавлены позже в виде смеси или последовательно. Когда конечная рецептура является раствором, полное растворение может быть достигнуто на любой стадии способа пригодного для получения. Необязательные наполнители могут быть добавлены к рецептуре на любой стадии способа пригодного для получения.
Получению рецептуры может необязательно способствовать перемешивание, нагревание или увеличение периода растворения. Неограничивающие примеры перемешивания включают взбалтывание, обработку ультразвуком, смешивание, перемешивание, встряхивание и их комбинации.
В некоторых вариантах реализации, рецептуру необязательно стерилизуют. Неограничивающие примеры способов стерилизации включают фильтрацию, химическую дезинфекцию, облучение и нагревание.
Диметилсульфоксид (ДМСО)
Применение ДМСО в качестве растворителя при получении рецептур для применения в комбинациях изобретения позволяет снизить объем раствора и объемы наполнения (как объем раствора, так и объемы наполнения могут быть снижена до 1/5 от тех, которые используются с водными системами) и уменьшает временные и температурные ограничения в масштабе. Кроме того, применение по сути безводного ДМСО значительно увеличивает стабильность: увеличение концентрации воды коррелирует с уменьшением стабильности (как показано на ФИГ. 4, на которой показано % изменение общего количества родственных соединений к натриевой соли соединения Формулы I-1, когда хранятся в ДМСО или ДМСО/вода (вода для инъекций, "ВДИ") при 25°C/60% ОВ в течение 24 часов).
Любой источник ДМСО может быть использован в соответствии с изобретением. В некоторых вариантах реализации, источник ДМСО пригодный для применений в области охраны здоровья и высвобождения лекарственного средства, например, соответствуют монографиям Фармакопеи США (USP) или Фармакопеи Евросоюза (Ph. Eur) и изготавливается в соответствии Текущими правилами организации производства и контроля качества лекарственных средств и АФИ. В соответствии с изобретением могут быть использованы такие марки, как безводный или фармацевтический растворитель.
ДМСО для применения согласно изобретению может иметь очень низкие уровни содержание примесей, например, <0,2% воды по методу КФ, <0,01% нелетучего остатка и <0,1% родственных соединений.
В некоторых вариантах реализации, ДМСО может включать его изостеры , включая, а частности, изостеры ДМСО, в которых один или более атом(ов) замен(ы) родственным изотопом, например, водород на дейтерий.
Дозировки и Введение
Пригодные дозы рецептур изобретения могут быть введены субъекту с помощью способов известных в этой области техники и примеры дозировок и параметры введения описаны в WO2007/041071, информация из которой включена в данный документ посредством ссылки во всей ее полноте.
Таким образом, неограничивающие примеры способов введения включают подкожную инъекцию, внутривенную инъекцию и вливание. В некоторых вариантах реализации, субъект нуждается или хочет рецептуру. В некоторых вариантах реализации, введение является подкожным введением.
Терапевтически эффективное количество соединения изобретения может быть выражено в мг соединения на кг массы тела субъекта. В некоторых вариантах реализации, терапевтически эффективное количество составляет 1-1000 мг/кг, 1-500 мг/кг, 1-250 мг/кг, 1-100 мг/кг, 1-50 мг/кг, 1-25 мг/кг или 1-10 мг/кг. В некоторых вариантах реализации, терапевтически эффективное количество составляет 5 мг/кг, 10 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг, 100 мг/кг, 150 мг/кг, 200 мг/кг, 250 мг/кг, 300 мг/кг, 400 мг/кг, 500 мг/кг, 600 мг/кг, 700 мг/кг, 800 мг/кг, 900 мг/кг, 1000 мг/кг, около 5 мг/кг, около 10 мг/кг, около 25 мг/кг, около 50 мг/кг, около 75 мг/кг, около 100 мг/кг, около 150 мг/кг, около 200 мг/кг, около 250 мг/кг, около 300 мг/кг, около 400 мг/кг, около 500 мг/кг, около 600 мг/кг, около 700 мг/кг, около 800 мг/кг, около 900 мг/кг или около 1000 мг/кг.
Терапевтически эффективное количество соединения изобретения также может быть выражено в мг соединения на квадратный метр площади тела субъекта. В некоторых вариантах реализации, комбинации изобретения могут быть введены подкожно в диапазоне доз, например от 1 до 1500 мг (0,6-938 мг/м2) или от 2 до 800 мг (1,25-500 мг/м2) или от 5 до 500 мг (3,1-312 мг/м2) или от 2 до 200 мг (1,25-125 мг/м2) или от 10 до 1000 мг (6,25-625 мг/м2), конкретные примеры доз включают 10 мг (6,25 мг/м2), 20 мг (12,5 мг/м2), 50 мг (31,3 мг/м2), 80 мг (50 мг/м2), 100 мг (62,5 мг/м2), 200 мг (125 мг/м2), 300 мг (187,5 мг/м2), 400 мг (250 мг/м2), 500 мг (312,5 мг/м2), 600 мг (375 мг/м2), 700 мг (437,5 мг/м2), 800 мг (500 мг/м2), 900 мг (562,5 мг/м2) и 1000 мг (625 мг/м2).
Комбинация может быть введена один раз или более чем один раз в день. Комбинацию обычно вводят постоянно (т.е. принимают каждый день без перерыва на протяжении всего курса лечения).
В некоторых вариантах реализации, терапевтически эффективное количество может быть введено 1-35 раз в неделю, 1-14 раз в неделю или 1-7 раз в неделю. В некоторых вариантах реализации, терапевтически эффективное количество может быть введено 1-10 раз в день, 1-5 раз в день, 1 раз, 2 раза или 3 раза в день.
В некоторых вариантах реализации, материалы изобретения могут быть введены согласно с режимом дозировки: (a) один раз, дважды, трижды, четырежды, пять раз, шесть раз или семь раз в неделю; или (b) каждый день на протяжении 5, 6, 7, 8, 9 или 10 дней; или (c) каждый день на протяжении до 10 дней; или (d) каждый день на протяжении от 5 до 10 дней; или (e) каждый день на протяжении 5 дней, сразу после этого два дня без введения дозы и затем каждый день на протяжении последующих 5 дней. В некоторых вариантах реализации, введение является подкожным.
Терапевтическое применение
Комбинации настоящего изобретения могут быть использованы для лечения широкого перечня заболеваний.
Признаки состояний, которые могут быть подвергнуты лечению, включают признаки, которые содержат нежелательную или неконтролируемую пролиферацию клеток. Такие признаки включают доброкачественные опухоли, различные виды рака, такие как первичные опухоли и метастазы опухолей, рестеноз (например, коронарных, сонных и церебральных поражений), гематологические расстройства, аномальное возбуждение эндотелиальных клеток (атеросклероз), инсульты ткани тела из-за операции, аномальное заживление ран, нарушение ангиогенеза, заболевания, которые проводят к фиброзу ткани, нарушения повторяющихся движений, нарушения тканей, которые не сильно васкуляризированы, и пролиферативные реакции, связанные с трансплантацией органов.
Как правило, клетки в доброкачественной опухоли сохраняют свои дифференцированные особенности и не делятся полностью неконтролируемым образом. Доброкачественная опухоль обычно локализуется и неметастазирует. Конкретные виды доброкачественных опухолей, которые могут быть подвергнуты лечению с помощью настоящего изобретения включают гемангиому, гепатоцеллюлярную аденому, кавернозную гемангиому, фокальную нодулярную гиперплазию, акустические невриномы, нейрофиброму, аденому желчных протоков, цистаному желчных протоков, фиброму, липому, лейомиому, мезотелиому, тератому, миксому, нодулярную регенеративную гиперплазию, трахому и гнойную гранулему.
В злокачественной опухоли клетки становятся недифференцированными, не реагируют на сигналы управления ростом организма и размножаются неконтролируемым образом. Злокачественная опухоль является инвазивной и способна распространяется на отдаленные участки (метастазировать). Злокачественные опухоли, как правило, делятся на две категории: первичные и вторичные. Первичные опухоли возникают непосредственно из тканей, в которых они находятся. Вторичные опухоли или метастаз представляет собой опухоль, которая возникла в другом месте в теле, но в настоящее время распространилась на удаленный орган. Обычными путями для метастазирования является непосредственный рост в смежные структуры, распространение через сосудистую или лимфатическую системы и движение вдоль слоев ткани и пространств тела (жидкость брюшной полости, спинномозговая жидкость и т.д.).
Конкретные виды рака или злокачественных опухолей, первичные или вторичные, который могут быть подвергнуты лечению с помощью настоящего изобретения включают рак молочной железы, рак кожи, рак кости, рак простаты, рак печени, рак легких, рак мозга, рак гортани, рак желчного пузыря, поджелудочной железы, прямой кишки, паращитовидной железы, щитовидной железы, надпочечников, нервной ткани, головы и шеи, толстой кишки, желудка, бронхов, почек, базально-клеточную карциному, плоскоклеточную карциному как язвенного, так и папиллярного типа, метастатический рак кожи, остеосаркому, саркому Юинга, ретикулярно-клеточную саркому, миелому, гигантоклеточную опухоль, мелкоклеточную опухоль легких, камни в желчном пузыре, инсулому, первичную опухоль головного мозга, острые и хронические лимфоцитные и гранулоцитные опухоли, волосатоклеточную опухоль, аденому, гиперплазию, медуллярный рак, феохромоцитому, слизистую нейрому кишечную ганглионейрому, гиперпластическую опухоль нерва роговицы, опухоль марфаноидного вида, опухоль Вильмса, семиному, опухоль яичников, лейомиоматозную опухоль, дисплазию шейки матки и in situ карциному, нейробластому, ретинобластому, саркому мягких тканей, злокачественный карциноид, местное поражение кожи, фунгоидный микоз, рабдомиосаркому , саркому Капоши, остеогенную и другую саркому, злокачественную гиперкальциемию, опухоль клеток почек, истинную полицитемию, аденокарциному, мультиформную глиобластому, лейкоз, лимфому, доброкачественную меланому, эпидермоидную карциному и другие карциномы и саркомы.
Гематологические расстройства включают ненормальный рост клеток крови, который может привести к диспластическим изменениям в клетках крови и злокачественным гематологическим заболеваниям, таким как различные виды лейкоза. Примеры гематологических расстройств включают, но не ограничиваются ими, острый миелоидный лейкоз, острый промиелоцитарный лейкоз, острый лимфобластный лейкоз, хронический миелогенный лейкоз, миелодиспластические синдромы и серповидно-клеточная анемия.
Лечение ненормальной клеточной пролиферации вследствие повреждений ткани тела во время операции может быть возможно для различных хирургических процедур, в том числе операции на суставе, операции на кишечнике и келоидном рубце. Заболевания, которые приводят к образованию фиброзной ткани, включают эмфизему. Расстройства от повторяющихся движений, которые могут быть подвергнуты лечению с помощью настоящего изобретения, включают кистевой туннельный синдром. Пример клеточных пролиферативных расстройств, которые могут быть подвергнуты лечению с использованием изобретения, представляют собой опухоль кости.
Пролиферативные ответы, связанные с трансплантацией органа, которые могут быть подвергнуты лечению с помощью этого изобретения, включают те пролиферативные ответы, которые способствуют отторжению потенциальных органов или связанных с ним осложнений. В частности, эти пролиферативные ответы могут встречаться во время трансплантации сердца, легких, печени, почек и других органов или систем органов.
Ненормальный ангиогенез, который может быть подвергнут лечению с помощью настоящего изобретения, включают, например, ненормальный ангиогенез, сопровождающий ревматоидный артрит, ишемическую реперфузию, связанную с отеком и травмой головного мозга, кортикальную ишемию, гиперплазию и гиперваскуляризацию яичников, (синдром поликистоза яичников), эндометриоз, псориаз, диабетическую ретинопатию и другие заболевания кровеносных сосудов глаз, такие как ретинопатия недоношенных (ретролентальная фиброплазия), мышечная дистрофия, отторжение трансплантата роговицы, неоваскулярная глаукома и синдром Остера-Уэббера.
Заболевания, связанные с ненормальным ангиогенезом требуют или вызывают рост сосудов. Например, ангиогенез роговицы включает в себя три фазы: пре-васкулярный латентный период, активная неоваскуляризация и созревание и регрессия сосудов.
В некоторых вариантах реализации, рецептуры и композиции настоящего изобретения могут быть использованы для лечения заболеваний, связанных с нежелательным или ненормальным ангиогенезом. Способ включает введение пациенту, страдающему от нежелательного или ненормального ангиогенеза фармацевтических рецептур настоящего изобретения в одиночку или в комбинации с противоопухолевым агентом, на чью активность в качестве противоопухолевого агента в in vivo отрицательно влияют высокие уровни метилирования ДНК. Конкретная доза этих агентов, необходимых для ингибирования ангиогенеза и/или заболеваний кровеносных сосудов может зависеть от тяжести состояния, способа введения и других факторов, может быть определена лечащим врачом. Обычно, принятые и эффективные ежедневные дозы являются количеством, достаточным для эффективного ингибирования ангиогенеза и/или заболеваний кровеносных сосудов.
В некоторых вариантах реализации, фармацевтические рецептуры настоящего изобретения могут быть использованы для лечения различных заболеваний связанных с нежелательным ангиогенезом, таких как неоваскуляризация сетчатки/сосудистой оболочки и неоваскуляризация роговицы. Примеры неоваскуляризации сетчатки/сосудистой оболочки включают, но не ограничиваются ими, болезнь Беста, близорукости, ямка диска зрительного нерва, болезнь Старгарта, болезни Педжета, окклюзия вен, закупорка артерии, серповидно-клеточная анемия, саркоидоз, сифилис, эластическая псевдоксантома, обструктивное заболевание сонной артерии, хронический увеит/витрит, микобактериальные инфекции, болезни Лайма, системная красная волчанка, ретинопатия недоношенных, болезнь Илса, диабетическая ретинопатия, дегенерация желтого пятна, болезнь Бечета, инфекции, вызывающие ретинит или хороидит, предпологаймый гистоплазмоз глаз, парспланит, хроническое отслоение сетчатки, синдромы гипервязкости, токсоплазмоз, травма и постлазерные осложнения, заболевания, связанные с покраснением радужки (неоваскуляризация угла) и заболеваний, вызванные ненормальной пролиферацией фиброваскулярной или фиброзной ткани, включая все формы пролиферативной витреоретинопатии.
Неограничивающие примеры неоваскуляризации роговицы включают, но не ограничиваются ими, эпидемический кератоконъюнктивит, дефицит витамина А, переутомление от ношения контактных линз, атопический кератит, верхний лимбальный кератит, крыловидной синдром сухого глаза, синдром Шегрена, розовые угри, фликтенулез, диабетическая ретинопатия, ретинопатии недоношенных, отторжение трансплантата роговицы, язва Мурена, краевая дегенерация Терриена, краевой кератолиз, полиартрит, саркоидоз Вегенера, склерит, радиальная кератотомия по поводу рубцующего пемфигоида, неоваскулярная глаукома и ретролентальная фиброплазия, сифилис, микобактериальные инфекции, дегенерация липида, химические ожоги, бактериальные язвы, грибковые язвы, инфекция простого герпеса, инфекция опоясывающего герпеса, протозойные инфекции и саркома Капоши.
В некоторых вариантах реализации, фармацевтические рецептуры настоящего изобретения могут быть использованы для лечения хронических воспалительных заболеваний, связанных с ненормальным ангиогенезом. Способ включает введение пациенту, страдающему от хронических воспалительных заболеваний, связанных с ненормальным ангиогенезом фармацевтических рецептур настоящего изобретения отдельно в или комбинация с противоопухолевым агентом, на чью активность в качестве противоопухолевого агента in vivo отрицательно влияют высокие уровни метилирования ДНК. Хроническое воспаление зависит от непрерывного образования капиллярных ростков поддерживающих приток воспалительных клеток. Приток и наличие воспалительных клеток проводит к гранулеме и, таким образом, поддерживает хроническое воспалительное состояние. Ингибирование ангиогенеза с помощью фармацевтических рецептур настоящего изобретения может предотвратить образование гранулем и, тем самым, облегчить заболевание. Примеры хронических воспалительных заболеваний включают в себя, но не ограничиваются ими, воспалительные заболевания кишечника, такие как болезнь Крона и язвенный колит, псориаз, саркоидоз и ревматоидный артрит.
Воспалительные заболевания кишечника, такие как болезнь Крона и неспецифический язвенный колит, характеризуются хроническим воспалением и ангиогенезом в различных местах желудочно-кишечного тракта. Например, болезнь Крона протекает как хроническое трансмуральное воспалительное заболевание, которое наибольше поражает дистальную и подвздошную кишку, но также может встречаться в любой части желудочно-кишечного тракта от ротовой полости до заднего прохода и перианальной области. Пациенты с болезнью Крона, как правило, страдают от хронической диареи, связанной с болью в животе, лихорадки, анорексии, потери веса и вздутия живота. Язвенный колит также является хроническим, неспецифическим, воспалительным и язвенным заболеванием, возникающим на слизистой оболочке толстой кишки и характеризующимся наличием кровавой диареи. Эти воспалительные заболевания кишечника, как правило, вызваны хроническим гранулематозным воспалением в желудочно-кишечном тракте, включая новые капиллярные ростки окруженные цилиндром из воспалительных клеток. Ингибирование ангиогенеза фармацевтическими рецептурами настоящего изобретения должно подавлять образование ростков и препятствовать образованию гранулем. Воспалительные заболевания кишечника также проявляют дополнительные кишечные проявления, такие как поражения кожи. Такие поражения характеризуются воспалением и ангиогенезом и могут встречаться на многих участках отличных от желудочно-кишечного тракта. Ингибирование ангиогенеза фармацевтическими рецептурами настоящего изобретения должно уменьшить приток воспалительных клеток и предотвратить образование поражения.
Саркоидоз, другое хроническое воспалительное заболевание, характеризуется как мультисистемное гранулематозное расстройство. Гранулемы этого заболевания могут образовывать в любой части тела и, таким образом, симптомы зависят от места гранулем и является ли заболевание активным. Гранулемы создаются ангиогенными капиллярными ростками обеспечивающими постоянное снабжение воспалительными клетками. При использовании фармацевтических рецептур настоящего изобретения ингибируют ангиогенез и образование таких гранулем может быть заблокировано. Псориаз, также хроническое рецидивирующее и воспалительное заболевание, характеризуется папулами и бляшками различных размеров. Лечение с помощью фармацевтических рецептур настоящего изобретения должно предотвратить образование новых кровеносных сосудов, необходимых для поддержания характерных повреждений и обеспечить облегчение симптомов у пациента.
Ревматоидный артрит (РА) также является хроническим воспалительным заболеванием, характеризующимся неспецифическим воспалением периферийных суставов. Считается, что кровеносные сосуды в синовиальной выстилке суставов подвергаются ангиогенезу. В дополнение к образованию новых сетей сосудов, эндотелиальные клетки выделяют факторы и реактивные формы кислорода, которые приводят к росту паннуса и разрушению хряща. Факторы, участвующие в ангиогенеза, могут активно способствовать и помогать, поддерживая хронические воспаленные состояния ревматоидного артрита. Лечение с помощью фармацевтических рецептур настоящего изобретения отдельно или в комбинации с другими противоревматоидными агентами может предотвратить образование новых кровеносных сосудов, необходимых для поддержания хронического воспаления и обеспечить облегчение симптомов пациентов с РА.
В некоторых вариантах реализации, фармацевтические рецептуры настоящего изобретения могут быть использованы для лечения заболеваний связанных с ненормальным синтезом гемоглобина. Способ включает введение фармацевтических рецептур настоящего изобретения пациенту, страдающему от заболевания связанного с ненормальным синтезом гемоглобина. Децитабинсодержащие рецептуры стимулируют синтез фетального гемоглобина, так как механизм включения в ДНК связан с гипометилированием ДНК. Примеры заболеваний, связанных с ненормальным синтезом гемоглобина, включают, но не ограничиваются ими, серповидно-клеточной анемия и бета-талассемия.
В некоторых вариантах реализации, фармацевтические рецептуры настоящего изобретения могут быть использованы для контроля внутриклеточной экспрессии гена. Способ включает введение фармацевтических рецептур настоящего изобретения пациенту, страдающему от заболевания, связанного с ненормальными уровнями экспрессии гена. Метилирование ДНК связано с контролем экспрессии гена. В частности, метилирование в пределах или вблизи промоторов ингибирует транскрипцию, в то время как деметилирование восстанавливает экспрессию. Примеры возможных применений описанных механизмов включают, но не ограничиваются ими, терапевтически модулированное ингибирование роста, индукция апоптоза и дифференциация клеток.
Активация генов, облегченная фармацевтическими рецептурами настоящего изобретения, может индуцировать дифференциацию клеток в терапевтических целях. Клеточная дифференциация вызывается с помощью механизма гипометилирования. Примеры морфологической и функциональной дифференциации, включают, но не ограничиваются ими дифференциация приводящая к образованию мышечных клеток, мышечных трубочек, клеток эритроидной и лимфоидной линий.
Миелодиспластические синдромы (МДС) являются гетерогенными клональными расстройствами кроветворных стволовых клеток, связанными с наличием диспластических изменений в одной или нескольких гемопоэтических линиях, включая диспластические изменения в миелоидной, эритроидной и мегакариоцитарной серии. Эти изменения приводят к цитопении в одной или более из трех линий. У субъектов, страдающих от МДС, обычно развиваются осложнения, связанные с анемией, нейтропенией (инфекции) или тромбоцитопенией (кровотечение). В целом, у от около 10% до около 70% пациентов с МДС развивается острый лейкоз. Представители миелодиспластических синдромов включают острый миелоидный лейкоз, острый промиелоцитарный лейкоз, острый лимфобластный лейкоз и хронический миелогенный лейкоз.
Острый миелоидный лейкоз (ОМЛ) является наиболее распространенным типом острого лейкоза у взрослых. Несколько наследственных генетических расстройств и иммунодефицитных состояний связано с повышенным риском ОМЛ. Эти состояния включают расстройства с дефектами в стабильности ДНК, приводящими к случайным хромосомным разрывам, таким как синдром Блума, анемия Фанкони, синдром Ли-Фраумени, атаксия-телеангиэктазия и сцепленная с Х-хромосомой агаммаглобулинемия.
Острый промиелоцитарный лейкоз (ОПМЛ) представляет собой отличную подгруппу ОМЛ. Этот подтип характеризуется промиелоцитарными бластами, содержащими 15; 17 хромосомную транслокацию. Эта транслокация приводит к генерации слитого транскрипта содержащего последовательность рецептора ретиноевой кислоты и последовательность промиелоцитарного лейкоза.
Острый лимфобластный лейкоз (ОЛЛ) является гетерогенным заболевание с различными клиническими признаками, проявляющимися в различных подтипах. Повторяющиеся цитогенетические аномалии были продемонстрированы во всех ОЛЛ. Наиболее распространенной, связанной с цитогенетической аномалией, является 9; 22 транслокация, приводящая к развитию филадельфийской хромосомы.
Хронический миелогенный лейкоз (ХМЛ) является клональным миелопролиферативным расстройством плюрипотентных стволовых клеток, как правило, вызванным ионизирующим излучением. ХМЛ характеризуется специфической хромосомной аномалией включающей транслокацию хромосом 9 и 22, создавая филадельфийскую хромосому.
Соединения, описанные в данном документе, и их рецептуры могут быть использованы для обеспечения лечения МДС. В некоторых вариантах реализации, соединение или его рецептура может обеспечить лечение более чем одного МДС при одном введении.
В некоторых вариантах реализации, изобретение предлагает способ лечения миелодиспластического синдрома (МДС). В некоторых вариантах реализации, изобретение предлагает способ лечения одного или более миелодиспластических синдромов, лейкоза или солидных опухолей. В некоторых вариантах реализации, изобретение предлагает способ лечения острого миелоидного лейкоза (ОМЛ). В некоторых вариантах реализации, изобретение предлагает способ лечения острого промиелоцитарного лейкоза (ОПМЛ) у субъекта. В некоторых вариантах реализации, изобретение предлагает способ лечения острого лимфобластного лейкоза (ОЛЛ). В некоторых вариантах реализации, изобретение предлагает способ лечения хронического миелогенного лейкоза (ХМЛ).
В некоторых вариантах реализации, миелодиспластическим синдромом является острый миелоидный лейкоз (ОМЛ), острый промиелоцитарный лейкоз (ОПМЛ), острый лимфобластный лейкоз (ОЛЛ) или хронический миелогенный лейкоз (ХМЛ).
В некоторых вариантах реализации, введение является подкожным.
При лечении любого состояния, описанного выше, такого как рост опухоли, миелодиспластический синдром или ангиогенез-зависимого состояния может быть достигнут некоторый уровень эффективности. Уровень эффективности может быть около 5%, около 10%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45%, около 50%, около 55%, около 60%, около 62,9%, около 65%, около 70%, около 75%, около 80%, около 84,4%, около 85%, около 90%, около 95%, около 97%, около 98%, около 99% или около 100%. Уровень эффективности может быть по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 62,9%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 84,4%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99%.
Комбинированная терапия
Соединения, композиции и рецептуры настоящего изобретения используются в комбинации с одним или более вспомогательных терапевтических компонентов выбранных из следующих классов:
Агенты, активирующие T-клетки, включая иммуномодулирующие антитела;
Противораковые вакцины;
Ингибиторы индоламин 2,3-диоксигеназы (ИДО);
Адъюванты; и
Комбинации двух или более вышеупомянутых классов, включая, в частности, комбинации агентов активирующих T-клетки и противораковых вакцин.
В альтернативном варианте, соединения, композиции и рецептуры настоящего изобретения используются в комбинации с одним или более вспомогательных терапевтических компонентов выбранных из следующих классов:
1. Агенты, активирующие T-клетки, включая иммуномодулирующие антитела;
2. Противораковые вакцины;
3. Адъюванты; и
4. Комбинации двух или более вышеупомянутых классов, включая, в частности, комбинации агентов активирующих T-клетки и противораковых вакцин.
В некоторых вариантах реализации, вспомогательный агент может быть ионной формой, солью, сольватом, изомером, таутомером, N-оксидом, эфиром, пролекарственной формой, изотопмеченной или защищенной формой вспомогательного агента (например, его соли, или таутомеры, или изомеры, или N-оксиды, или сольваты).
1. Агенты, активирующие T-клетки, включая иммуномодулирующие антитела
Пригодные вспомогательные терапевтические компоненты для применения в комбинациях изобретения включают агенты, активирующие T-клетки.
Такие агенты включают, например, те которые содействуют активации T-клеток и представляют Т-эффекторные клетки устойчивые к Т-регуляторным клеткам (Tregs), включая агенты, которые блокируют CTLA-4.
Анти-CTLA-4mAb лечение представляет противоопухолевую стратегию вовлеченную в увеличение клеточноопосредованной иммунной системы путем блокирования ингибирующих путей активации Т-клеток (O'Day SJ, et al. Cancer 2007; 10:2614-2627). Было показано, что блокада CTLA-4 сигналов вызывает отторжение опухоли в животных моделях, при использовании в одиночку или в комбинации с другими стратегиями иммунотерапии (Leach DR, et al. Science 1996; 271:1734-1736; Weber J, Semin Oncol 2010;37:430-439). Анти-CTLA-4 mAb оказываются эффективными в стимулировании длительного клинического ответа и улучшения выживаемости пациентов с метастатической меланомой кожи (Hodi FS, et al. N Engl J Med 2010; 363:711-23; Di Giacomo A, et al. Cancer Immunol Immunother 2011;60:467-77).
В вариантах реализации, в которых вспомогательный терапевтический компонент содержит агент, блокирующий CTLA-4 сигнализацию (например, анти-CTLA-4 mAb как описано ниже), соединение Формулы I или его соль предпочтительно вводят первым (как инициирующее лечение), после чего вводят агент, блокирующий CTLA-4 (например, анти-CTLA mAb).
Неограничивающие примеры пригодных анти-CTLA-4 mAb включают Тремелимумаб (CP675,206) (Pfizer), IgG2 изотип моноклонального антитела и Ипилимумаб (MDX-010) (BMS/Medarex), IgG1 изотип моноклонального антитела.
Тремелимумаб описан в, например, WO00/037504 (описание которой включено в данный документ посредством ссылки) и; и в WO2006/048749 (описание которой также включено в данный документ посредством ссылки).
Ипилимумаб описан в, например, WO01/014424 (описание которой включено в данный документ посредством ссылки); и в WO2012/033953 (описание которой также включено в данный документ посредством ссылки).
Другим классом агентов, активирующих Т-клетки, пригодных для применения как вспомогательных терапевтических компонентов являются агенты, которые устраняют или подавляют периферическую толерантность и/или уменьшают число Tregs в месте опухоли. Примеры таких агентов включают агенты, которые блокируют рецептор программируемой смерти-1 (ПС-1), лиганд рецептора программируемой смерти-1 (ПС-Л1) и лиганд рецептора программируемой смерти-2 (РС-Л2), включая антитела против ПС-1, ПС-Л1 и ПС-Л2.
Протеин программируемой смерти 1 (ПС-1), ко-ингибирующий рецептор Т-клеток и его лиганды, ПС-Л1 и ПС-Л2, играют решающую роль в способности опухолевых клеток в уклонении от иммунной системы хозяина. Блокада взаимодействия между ПС-1 и ПС-Л1/2 опосредует противоопухолевую активность в доклинических моделях (Iwai Y et al., Proc Natl Acad Sci USA (2002) 99: 12293-12297). Исследования выявили клиническую активность и анти-ПС-1, и анти-ПС-Л1 mAb у пациентов с развитым раком, включая немелкоклеточный рак легких, маланому и почечно-клеточный рак (Brahmer JR, et al. N Engl J Med. 2012 Jun 2; Topalian SL, et al. N Engl J Med. 2012 Jun 2).
Неограничивающие примеры пригодных анти-ПС-1 и анти-ПС-Л1 mAb включают BMS-936558 (Ниволумаб, ONO 4538), полностью человеческое моноклональное IgG4 антитело против ПС-1 и BMS-936559 (полностью человеческое, ПС-Л1-специфическое, IgG4 (S228P) моноклональное антитело, ингибирующее связывание ПС-Л1 с ПС-1 и CD80) описано в WO2007/005874. Эти mAb могут быть введены согласно с рекомендациями производителей и пригодные дозировки Ниволумаба описаны в WO2006/121168, который специально включен в данный документ посредством ссылки.
Другие анти-ПС-1 агенты включают MK-3475 (Ламбролизумаб), гуманизированное анти-ПС-1 IgG4 моноклональное антитело. Пригодные дозировки Ламбролизумаба включают 10 мг/кг каждые 2 недели.
Другие анти-ПСЛ-1 агенты включают MED14736 (человеческое IgG1 моноклональное антитело против ПСЛ-1) и MPDL3280A (человеческое моноклональное антитело IgG, FC-домен которого был специально сконструирован для предотвращения антитело-зависимой клеточно-опосредованной цитотоксичности). Эти mAb можно вводить в соответствии с рекомендациями производителей.
Другие классы агентов, активирующих T-клетки, пригодные для применения в качестве вспомогательных терапевтических компонентов, включают агонисты для CD137, CD40 и OX40. Примеры таких агентов включают моноклональные антитела, которые действуют как агонисты CD137, CD40 или OX40.
CD137, также известен как рецептор 4-1BB (4-1BBR), гликопротеин, который является представителем суперсемейства рецептора фактора некроза опухоли 1-4 и связывает с высоким сродством лиганд (4-1BBL), экспрессированный на нескольких антигенпрезентирующих клетках, таких как макрофаги и активированные В-клетки. Пригодным агонистом CD137 является PF-05082566, полностью человеческий IgG2 mAb, который связывает внешнеклеточный домен человеческого CD137 с высоким сродством и специфичностью (см. Fisher et al. (2012) Cancer Immunology, Immunotherapy, Volume 61, Issue 10, pp 1721-1733).
Другие классы агентов, активирующих T-клетки, пригодных для применения в качестве вспомогательных терапевтических компонентов включают агонисты для ICOS, GITR, MHC, CD80, CD86, Galectin 9 и LAG-3. Примеры таких агентов включают моноклональные антитела, которые действуют как агонисты ICOS, GITR, MHC, CD80, CD86, Galectin 9 и LAG-3.
В качестве вспомогательных терапевтических компонентов для применения согласно изобретению также могут быть использованы комбинации двух или более агентов, активирующих T-клетки (например, комбинации CTLA-4-блокирующих антител и/или антитела против ПС-1 и ПС-Л1 и/или ПС-Л2).
2. Противораковые вакцины
Противораковые вакцины, которые стимулируют адаптивный иммунный ответ, находят применение в качестве вспомогательных терапевтических компонентов для применения в комбинациях изобретения.
Противораковые вакцины содержат опухолеспецифический антиген(ы) (ОСА) для иммунной системы хозяина, чтобы подсказать хозяину подготовить терапевтический адаптивный клеточный и/или гуморальный иммунный ответ, например, с помощью активации Т-клеток и/или активации дендритных клеток (ДК). Противораковые вакцины могут базироваться на цельных опухолевых клетках, экстрактах опухолевых клеток или фракциях. Также пригодными для применения согласно изобретению являются субъединицы противораковых вакцин, конъюгаты противораковых вакцин и ДНК вакцины.
Любой пригодный антиген или комбинация ОСА может быть использован в вакцинах изобретения, включая, например, нуклеиновую(ые) кислоту(ы) (ДНК или РНК), которые кодируют один или более ОСА; белок(белки) или пептид(ы); гликопротеин(ы); полисахарид(ы) и другие углевод(ы)); слитый белок(белки); липид(ы); гликолипид(ы); пептидомиметик(и) полисахаридов; углевод(ы) и белок(белки) в смеси; конъюгаты углевод-белок; клетки или их экстракты или опухолевые клетки или их экстракты.
Субъединичные вакцины базируется на синтетических или выделенных антигенах, созданные с помощью (био)химических и/или рекомбинантных методов (например, синтез или очистка рекомбинантных пептидов, белков и/или углеводов). Конъюгированные вакцины включают связь (как правило, путем химического сшивания) относительно неиммуногенных (обычно на основе углевода) антигенов с более сильными иммуногенными белками-носителями. ДНК/РНК вакцины высвобождаются в форме кодирующей нуклеиновой кислоты и таким образом надеются на эндогенную экспрессию кодирующей последовательности после введения антигена(ов). Такие вакцины обычно требуют соответствующий вектор (например, плазмиду, вирусную или липидную визикулу), для доставки кодирующей нуклеиновой кислоты к соответствующему месту хозяина.
Пригодные противораковые вакцины для применения в комбинациях с композициями, рецептурами и соединениями изобретения могут быть классифицированы в соответствии с природой ОСА и вакцины антигена рака яичка (АРЯ).
Антигены рака яичка (АРЯ) являются высокоиммуногенными при отсутствии или крайне ограниченной экспрессии в нормальных тканях (яичка и плаценты). Примеры включают вакцины, базирующиеся на: NY-ESO-1, LAGE-1, MAGE-A1, -A2, -A3, -A4, -A6, -A10, -A12, CT7, CT10, GAGE1-6, GAGE 1-2, BAGE, SSX1-5, SSX 2, HAGE, PRAME, RAGE-1, XAGE-1, MUC2, MUC5B, B7,1/2, CD28, B7-H1, HLA, CD40L и HMW-MAA. В некоторых вариантах реализации, АРЯ вакцины включают вакцины базирующиеся на MAGE-A1, MAGE-A3 (например, recMAGE-A3), NY-ESO-1 и PRAME. Упомянутые выше АРЯ могут быть использованы отдельно или в комбинации, например, может быть использована смесь двух или более MAGE-A1, MAGE-A3 (например, recMAGE-A3), NY-ESO-1 и/или PRAME.
MAGE-A1 описан в, например, WO2002/094859 (описание которой включено в данный документ посредством ссылки). Он может быть использован без адъюванта или с адъювантом.
MAGE-A3 (и, в частности, recMAGE-A3) или Аступротимут-R) описан в, например, WO1999/040188 (описание которой включено в данный документ посредством ссылки). Он может быть использован без адъюванта или с адъювантом, например, в форме Аступротимут-R. Он может быть использован в дозе от около 1 до около 1000 мкг белка. В некоторых вариантах реализации, их доза составляет около 30 - около 300 мкг.
NY-ESO-1 описан в, например, WO2005/032475 (описание которой включено в данный документ посредством ссылки). Он может быть использован без адъюванта или с адъювантом и может быть использован с другими химиотерапевтическими агентами (включая, например, доксорубицин).
PRAME (также известный как селективный антиген меланомы, MAPE, DAGE и OIP4) описан в, например, WO2006/071983 (описание которой включено в данный документ посредством ссылки). Он может быть использован без адъюванта или с адъювантом.
Различные АРЯ антигены, описанные выше, могут быть использованы в контексте различных клеточных вакцин, например, дендритных клеточных вакцин. Например, в одной концепции лечения дендритными клетками, клетки загружают (активированные, примированные или маркированные) определенным антигеном или антигенами (например, MAGE-А1, MAGE-А3 (например, recMAGE-A3), NY-ESO-1 или PRAME) и затем вводят для вызывания иммунного ответа. Этот подход может быть использован в комбинации с различными адъювантами, включая, например, агонисты ТПР (например, Имиквимо).
В иллюстративном примере концепции лечения с использованием клеток, пациент получает на протяжении 3 месячных циклов соединение Формулы I (или его соль) в течение 5 дней, с каждым циклом, затем 2 недели вакцины, содержащие аутологичные дендритные клетки, маркированные перекрывающимися пептидами, производными от непроцесированных MAGE-A1, MAGE-A3 и NY-ESO-1 (JPT Peptide Technologies, Berlin, Germany). Имиквимод вводят на месте вакцины до и после вакцинации для содействия инфильтрации иммунных клеток в месте вакцинации.
Другим пригодным классом противораковых вакцин являются вакцины, базирующиеся на дифференцировочных антигенах, включая MART-1, тирозиназа и Gp100.
В некоторых вариантах реализации, противораковые вакцины используются в комбинации с одним или более адъювантов в качестве дополнительных вспомогательных терапевтических компонентов для применения в комбинациях изобретения, как описано ниже.
3. Ингибиторы ИДО
Пригодные вспомогательные терапевтические компоненты для использования с комбинациями изобретения включают ингибиторы индоламин 2,3-диоксигеназы (ИДО).
ИДО является важным иммунным регулятором, имеющим ключевую роль в иммунном надзоре за опухолью. Ускользание от иммунного ответа является основной чертой рака, в котором цитокин интерферона-γ Th1-типа (IFN-γ), как предполагают, играет ключевую роль. Среди других биохимических путей уничтожающих опухоли, IFN-γ индуцирует ИДО в различных клетках включая макрофаги, дендритные клетки (ДК) и опухолевые клетки. ИДО действует путем предотвращения активации T клеток и блокирует иммунный ответ на раковые клетки. В то время как пути, ответственные за истощение триптофана неизвестны, гиперметилирование может быть одним из каузативных механизмов, которые приводят к неспособности развития иммунного ответа.
Ингибиторы ИДО могут, следовательно, увеличить эффективность противоопухолевой иммунотерапии и могут быть использованы в комбинациях изобретения для предотвращения ИДО-опосредованной иммунологической толерантности/ускользания от иммунного ответа (см., например, Sucher et al. (2010) IDO-Mediated Tryptophan Degradation in the pathogenesis of Malignant Tumor Disease. International Journal of Tryptophan Research: 3, 113-120).
Любой пригодный ингибитор ИДО может быть использован согласно изобретению. Также пригодными являются ингибиторы изоферментов ИДО, включая, например, триптофан (2,3)-диоксигеназа (TДO) и/или ИДО2. Таким образом, ингибитор ИДО для применения с комбинациями изобретения может ингибировать, прямо или косвенно, ИДО, и/или TДO, и/или ИДО2.
Пригодные ингибиторы ИДО включают ингибиторы базирующиеся на природных продуктах, такие как экстракт капусты брассинин, экстракт морской гидры аннулин В и экстракт морской губки эксигуамин A, включая их синтетические производные.
Другие пригодные ингибиторы ИДО включают молекулярные аналоги его субстрата, триптофана. Такие ингибиторы включают миметик триптофан 1-метилтриптофан (1-MT). 1-MT существует в виде двух стереоизомеров: L изомер значительно ингибирует ИДО1, в то время как D изомер более специфичен к ИДО2. D изомер (D-1-MT, индоксимод) недавно был исследован в двухфазном, дважды слепом, рандомизированном, плацебо-контролируемом исследовании.
Другие пригодные ИДО ингибиторы включают INCB24360, гидроксиамидиновый низкомолекулярный ингибитор. Непохожие с ингибиторами на основе 1-MT, гидроксиамидиновые ингибиторы также ингибируют триптофан (2,3)-диоксигеназу (TДO), фермент с идентичной активностью к ИДО.
Еще одним пригодным ингибитором ИДО является NLG919.
Агенты, которые не ингибируют фермент ИДО непосредственно, а скорее понижающе, блокируя активацию ИДО, также подходят для применения с комбинациях изобретения. Такие ингибиторы пути ИДО охватываются термином "ингибиторы ИДО", используемым в данном документе.
4. Адъюванты
Пригодные вспомогательные терапевтические компоненты для применения с комбинациями изобретения включают адъюванты.
Адъювант представляет собой любое соединение или композицию, которое повышает силу и/или продолжительность иммунного ответа на чужеродный антиген, по сравнению с ответом, вызванным только антигеном. Поэтому, основные функциональные характеристики адъюванта включают его способность усиливать соответствующий иммунный ответ на целевой антиген, долгосрочная безопасность в широко распространенном применении и гибкость при использовании с различными применениями антиген/заболевание. Адъювантом может быть, например, агент, который не содержит специфический антиген, но повышает силу и/или длительность иммунного ответа (включая, например, врожденный иммунный ответ) антигена вводимого с ним.
Когда адъювант используется в качестве вспомогательного терапевтического компонента, соединение и адъювант могут быть введены вместе, т.е. одновременно или последовательно. Когда адъюванты вводят одновременно, они могут быть введены в той же или отдельной рецептурах, и в последнем случае на тех же или отдельных участках, но могут быть введены в то же самое время. Адъюванты могут быть введены последовательно, когда вводятся, по меньшей мере, два адъюванта в разное время. Разделение во времени между введениями двух адъювантов может быть несколько минут или более. Разделение во времени может быть меньше, чем 14 дней, меньше, чем 7 дней, или меньше, чем на 1 день. Разделение во времени также может быть, например, с одним адъювантом в прайме и одним в бусте или один в прайме и комбинация в бусте или комбинация одного в прайме и одного в бусте.
Неограничивающие примеры пригодных адъювантов/классов адъюванта включают лиганды Патоген-Распознающих Рецепторов (ПРР). Включают лиганды/агонисты для RIG-1 рецепторов, лиганды NOD-протеина, лиганды Толл-подобного рецептора (ТПР) и лиганды лектина C-типа. Пригодные ПРР лиганды связывают один или более ТПР1, ТПР2, ТПР3, ТПР4, ТПР5, ТПР6, ТПР7, ТПР8, ТПР9, ТПР10 и ТПР11, то есть, ТПР лиганды. В некоторых вариантах реализации, лиганд представляет собой ТПР9 или ТПР4 лиганд. В некоторых вариантах реализации, лиганд представляет собой адъюванты, которые содержит ТПР лиганды для двух или более разных ТПР, включая, например, адъюванты, которые содержат двойные или тройные ТПР лиганды, например, ТПР2, и/или ТПР6, и/или ТПР3, и/или ТПР9. В некоторых вариантах реализации, тройной ТПР лиганд содержит лиганд ТПР2, ТПР3 и ТПР9. В некоторых вариантах реализации, адъювант содержит комбинацию: (i) ТПР 7/8 агониста с ТПР 9 агонистом; (ii) ТПР 7/8 агониста с ТПР 4 агонистом; или (iii) ТПР 9 агониста с ТПР 3 агонистом.
ТПР адъюванты рассмотрены в Steinhagen et al. (2011) TLR-Based Immune Adjuvantss Vaccine 29(17): 3341-3355, описание которой включено в данный документ посредством ссылки.
Комбинации изобретения также могут быть использованы в качестве вспомогательного средства с другими химиотерапевтическими и/или не-химиотерапевтическими способами лечения, такими как лучевая терапия, хирургическое вмешательство и трансплантация стволовых клеток. Например, комбинации изобретения могут быть использованы после операции и/или лучевой терапии первичной опухоли для предупреждения или задержки рецидива/метастазов. В случае вспомогательного использования с трансплантацией стволовых клеток, комбинации могут быть использованы в качестве "моста к трансплантации", где комбинации изобретения используются для достижения достаточной скорости ответа (например, лечебного) для трансплантации стволовых клеток. Комбинации также могут быть использованы с более низкой поддерживающей дозой после трансплантации стволовых клеток, чтобы уменьшить/предотвратить рецидив.
ПРИМЕРЫ
ПРИМЕР 1: Молекулярное, фенотипическое и функциональное in vivo действие SGI-110, комбинированное с иммуностимулирующей mAb в мышиной модели рака
Сингенную модель мышиного рака использовали для оценки на преклиническом уровне молекулярного, фенотипического и функционального in vivo действий натриевой соли соединения Формулы I-1 (SGI-110), вводимого отдельно или в комбинации анти-мышиным иммуностимулирующим mAb.
В исследовании анализируется: (a) терапевтическая эффективность комбинированного введения SGI-110 и иммуностимулирующего mAb при мышином раке; и (б) вовлечение иммунного ответа хозяина в потенциальное противоопухолевое действие более эффективного терапевтического введения SGI-110 и иммуностимулирующее mAb.
In vitro иммуномодулирующая активность SGI-110 при мышином раке
Проводили предварительные in vitro эксперименты для исследования иммуномодулирующего действия SGI-110 на клетки карциномы молочной железы мышей, TS/A, отбирали по их иммунофенотипу, скорости роста и отбора опухоли у мышей. Клетки обрабатывали in vitro согласно со стандартным планом и анализы ОТ-ПЦР и количественную ОТ-ПЦР в режиме реального времени исследовали эффективность лечения для стимулирования и/или понижающего регулирования мышиного АРЯ (включая P1A, семейство Mage-a) в раковых клетках.
Терапевтическая эффективность SGI-110 в комбинации с иммуностимулирующим mAb при мышином раке
Иммуностимулирующее mAb лечение назначается либо одновременно, либо последовательно со схемами SGI-110 в соответствии с режимом дозирования, описанным ниже. BALB/с мышам (6 в группе) прививали в боковую область ТС/А клетки и обрабатывали SGI-110, вводя отдельно или в комбинации с анти-мышиными CTLA-4 или анти-мышиными ПС-1 mAb. Эффективность и переносимость лечения оценивали по объему опухоли и измерениям массы тела, соответственно.
День -6: Мышиные TS/A клетки инокулировали подкожно в боковую область всех мышей.
День 0: После инкубационного периода 7 дней, мышей, несущих четко ощутимые и видимые трансплантаты опухоли (диаметр ≥ 0,2 см) разделяли на разные группы для лечения (6 животных в группе).
Схема лечения: подкожное (ПК) введение на протяжении 5 дней (“ПК5”)
Группа 1: Растворитель qdx5 ПК в день 1-5
Группа 2: SGI-110, 3 мг/кг qdx5 ПК в день 1-5
Группа 3: анти-мышиный CTLA-4 в день 2, 5, 8
Группа 4: анти-мышиный CTLA-4 в день 8, 11, 14
Группа 5: SGI-110, 3 мг/кг qdx5 ПК (в день 1-5) + анти-мышиный CTLA-4 (в день 2, 5, 8) (сопутствующая схема)
Группа 6: SGI-110, 3мг/кг qdx5 ПК (в день 1-5) + анти-мышиный CTLA-4 (в день 8, 11, 14) (последовательная схема)
Группа 7: анти-мышиный ПС-1 в день 2, 5, 8
Группа 8: анти-мышиный ПС-1 в день 8, 11, 14
Группа 9: SGI-110, 3 мг/кг qdx5 ПК (в день 1-5) + анти-мышиный ПС-1 (в день 2, 5, 8) (сопутствующая схема)
Группа 10: SGI-110, 3 мг/кг qdx5 ПК (в день 1-5) + анти-мышиный ПС-1 (в день 8, 11, 14) (последовательная схема)
Схема лечения: и.п. еженедельно
Группа 11: Растворитель (3 и.п. инъекции каждые 3 часа) в день 1 и 8
Группа 12: SGI-110, 36,6 мг/кг день (3 и.п. инъекции каждые 3 часа) в день 1 и 8
Группа 13: анти-мышиный CTLA-4 в день 3, 6, 9
Группа 14: SGI-110, 36,6 мг/кг день (3 и.п. инъекции каждые 3 часа) в день 1 и 8 + анти-мышиный CTLA-4 (в день 3, 6, 9)
Терапевтическая эффективность ПК5 схемы
Базируется на результатах полученных при in vivo введении SGI-110 согласно со схемой ПК5 (смотри выше), тестировали схему введения одна доза “ПК еженедельно” SGI-110 в комбинация с иммуностимулирующим mAb. mAb лечение назначали или одновременно, или последовательно относительно схемы SGI-110. С этой целью, BALB/с мышам (6 на группу) прививали в боковую область ТС/А клетки и обрабатывали SGI-110, вводя отдельно или в комбинации с анти-мышиными CTLA-4 или анти-мышиными ПС-1 mAb. Эффективность и переносимость лечения оценивали по объему опухоли и измерениям массы тела, соответственно.
Схема лечения: ПК еженедельно.
Группа 1: Растворитель ПК еженедельно в день 1, 8, 15
Группа 2: SGI-110, 24,4 мг/кг ПК еженедельно в день 1, 8, 15
Группа 3: анти-мышиный CTLA-4 в день 3, 6, 9
Группа 4: анти-мышиный CTLA-4 в день 17, 20, 23
Группа 5: SGI-110, 24,4 мг/кг ПК еженедельно (в день 1, 8, 15) + анти-мышиный CTLA-4 (в день 3, 6, 9) (сопутствующая схема)
Группа 6: SGI-110, 24,4 мг/кг ПК еженедельно (в день 1, 8, 15) + анти-мышиный CTLA-4 (в день 17, 20, 23) (последовательная схема)
Группа 7: анти-мышиный ПС-1 в день 3, 6, 9
Группа 8: анти-мышиный ПС-1 в день 17, 20, 23
Группа 9: SGI-110, 24,4 мг/кг ПК еженедельно (в день 1, 8, 15) + анти-мышиный ПС-1 (в день 3, 6, 9) (сопутствующая схема)
Группа 10: SGI-110, 24,4 мг/кг ПК еженедельно (в день 1, 8, 15) + анти-мышиный ПС-1 (в день 17, 20, 23) (последовательная схема)
Схема лечения: и.п. еженедельно.
Группа 11: Растворитель (3 и.п. инъекции каждые 3 часа) в день 1 и 8
Группа 12: SGI-110, 36,6 мг/кг день (3 и.п. инъекции каждые 3 часа) в день 1 и 8
Группа 13: SGI-110, 36,6 мг/кг день (3 и.п. инъекции каждые 3 часа) в день 1 и 8 + анти-мышиный CTLA-4 (в день 3, 6, 9)
Молекулярные, фенотипические и функциональные корреляции SGI-110 объединенные с иммуностимулирующим mAb
Исследовали модификации, вызванные in vivo наиболее эффективным терапевтическим лечением с использованием SGI-110, комбинированным с иммуностимулирующим mAb на опухолях и группах невосприимчивых хозяев. В завершение, базируясь на результатах, полученных га Стадии 2, BALB/с мышей (6 в группе) прививали в боковую область TS/A клетки и обрабатывали с помощью наиболее эффективного терапевтического режима SGI-110, вводимого в комбинации с одним иммуностимулирующим mAb.
Оценивали гипометилирование ДНК, также как и модуляцию иммунного профиля тканей мышиных опухолей, вырезанных из контрольных и обработанных мышей, с помощью молекулярных анализов (включая количественную метилирование-специфическую ПЦР, ОТ-ПЦР и количественную ОТ-ПЦР в режиме реального времени). Иммунные инфильтраты из опухолевых тканей характеризуются наличием и относительной частотой активированных Т-клеток с помощью иммуногистохимии (ИГХ). Кроме того, нормальные ткани от контрольных и обработанных мышей удаляли хирургическим путем и должным образом консервировали для следующих экспериментальных анализов (см. ниже).
In vivo иммуномодулирующее действие комбинированного введения SGI-110 и иммуностимулирующего mAb, в доброкачественных тканях
Исследовали комбинирование in vivo иммуномодулирующей активности с системным феноменом аутоиммунности (включая индукцию и/или модуляцию иммунных генов в нормальных тканях).
Оценивали присутствие и уровни экспрессии мышиного АРЯ (т.е. P1A, семейство Mage-a) с помощью анализов ОТ-ПЦР и количественной ОТ-ПЦР в режиме реального времени в, по меньшей мере, 4 доброкачественных образцах (включая сердце, легкие, печень, кишечник, почки, мышцы и кожу). Кроме того, иммунные инфильтраты нормальных тканей охарактеризовали присутствием и относительной частотой активированных Т-клеток с помощью ИГХ.
Вклад иммунного ответа в противоопухолевую активность исследуемых комбинированных терапий
Исследовали участие иммунного ответа хозяина в потенциальном противоопухолевом действии выбранных комбинированных режимов. И иммунокомпетентным (т.е. BALB/c), и иммунодефицитным (т.е. Т-клетки-дефицитные бестимусные голые мыши и Т-клетки-, B-клетки- и природные клетки-киллеры- дефицитные SCID/Beige) линиям мышей (6 мышей в группе) прививали в боковую область TS/A клетки и лечили с помощью выбранного терапевтического режима. Оценивали эффективность лечения исходя из оценки объема опухоли, сравнительный анализ которого позволяет определить вклад T, B и NK клеток в иммунитет к предполагаемой противоопухолевой активности комбинированных химиотерапевтических иммунотерапий.
Модуляция противоопухолевого Т-клеточного ответа может быть оценена через MLTC, пролиферацию клеток, высвобождение IFN-g и/или цитотоксичность.
ПРИМЕР 2: Ингибирование метилирования ДНК соединениями изобретения
Исследовали деметилирующую активность соединений в клеточном исследовании зеленого флуоресцентного белка (ЗФБ). В исследовании, снижение метилирования в результате воздействия ингибитора метилирования приводит к экспрессии ЗФБ и легко регистрируется.
Для анализа на реактивацию экспрессии ЗФБ с помощью проточной цитометрии была использована линия клеток CMV-EE210, содержащая эпигенетически заглушенный ЗФБ трансген. CMV-EE210 получали путем трансфекции клеток NIH-3T3 плазмидой pTR-UF/UF1/ UF2, которая содержала PBS(+) (Stratagene, Inc.) с промотором цитомегаловируса (ЦМВ) управляющим гуманизированным геном ЗФБ, адаптированным для экспрессии в клетках млекопитающего. После трансфекции сначала отбирали клетки с высокой экспрессией ЗФБ с помощью FACS анализа и сортировки с использованием цитометра MoFlo (Cytomation, Inc.).
Децитабин, сильный ингибитор DNMT1 млекопитающих, использовали как позитивный контроль. Для скрининга реактивации CMV-EE210, децитабин (1 мкM) или тестируемое соединение (30-50 мкM) добавляли к полной среде (DMEM несодержащей красного фенола (Gibco, Life Technologies), дополненной 10% фетальной бычьей сыворотки (Hyclone)). Клетки затем высевали до 30% слияния (~5000 клеток/лунку) в 96-луночные планшеты, содержащие тестируемые соединения, и выращивали три дня при 37°C в 5% CO2.
Планшеты исследовали под флуоресцентным микроскопом используя 450-490 фильтр возбуждения (I3 filter cube, Leica, Deerfield Ill.). Лунки обозначали g1 позитивные, g2 позитивные или g3, если ЗФБ был выражен в 10%, 30%, >75% жизнеспособных клеток, соответственно.
В Таблице 1 приведены результаты исследования децитабина и тестируемых соединений в качестве ингибиторов метилирования ДНК. ЗФБ50 представляет собой концентрацию ингибитора, при которой уровень экспрессии Зеленого Флуоресцентного Белка (ЗФБ) снижается с g3 до g1/2. Таблица 1 демонстрирует, что тестируемые соединения эффективно ингибировали метилирование ДНК при низких концентрациях, в результате реактивации транскрипции гена ЗФБ.
ПРИМЕР 3: Стабильность показательного соединения в жидких рецептурах
Исследовали стабильность соединения изобретения в разных рецептурах при разных условиях хранения. Стабильность определяли с помощью ВЭЖХ через определенные промежутки времени. Результаты сведены в Таблице 2 для рецептур содержащих натриевую соль соединения I-1 (т.e. SGI-110):

Раствор SGI-110 в воде при pH 7, pH при котором соединения этого класса являются наиболее стабильными, приводит к быстрому разложению в течение нескольких часов, даже при пониженных температурах, делая его непригодным для способа получения. Применение ДМСО/вода (1:1) дает немного лучшие результаты при повышенных температурах. Незначительное улучшение отмечали при использовании 3:1 рецептуры ДМСО/вода. Упомянутое соединение является стабильным в безводном ДМСО, поэтому этот растворитель выбирают для способа производства.
В отношении выбора фармацевтически приемлемых растворителей для конечной рецептуры готовой к введению, безводная система пропиленгликоль/глицерин обеспечивает лучшую стабильность. Получали конечную рецептуру путем замещения небольших количеств пропиленгликоля и глицерина этанолом, чтобы получить пропиленгликоль/глицерин/этанол (65:25:10). Эта рецептура была только одной из нескольких, которые исследовали, что бы получить улучшение растворимости и стабильности соединения при повышенных и пониженных температурах.
Основываясь на экспериментах, проведенных в воде, 10-кратное улучшение стабильности можно было бы ожидать при изменении температуры хранения от комнатной до пониженной (2-8°С). Тем не менее, в системе пропиленгликоль/глицерин/этанол (65:25:10) изменение условий хранения от теплых до холодных наблюдается 40-кратное улучшение стабильности. Объединенное влияние охлаждение плюс добавление этанола в систему пропиленгликоль/глицерин обеспечивает 66-кратное улучшение стабильности. Такие значительные улучшения стабильности SGI-110 во время хранения были неожиданными.
Система пропиленгликоль/глицерин/этанол (65:25:10) обеспечивает раствор SGI-110, который является мягким, легкотекучим и пригодным для прохождения через иглу 23-gague без осложнений или засорения. Определенная максимальная растворимость соединение в этой среде была около 130-150 мг/мл, что выгодно отличается от растворимости в воде 20 мг/мл. Хорошая химическая стабильность вместе с превосходной растворимостью определена для системы гликоль/глицерин/этанол (65:25:10) как рецептуры для применения в экспериментах на животных.
ПРИМЕР 4: Исследования на животных с помощью рецептуры ПРИМЕРА 3
Рецептуру гликоль/глицерин/этанол (65:25:10) ПРИМЕРА 3, содержащую 100 мг/мл свободного основания эквивалентного натриевой соли соединения I-1, вводили живым животным. Для сравнения использовали аналогичную рецептуру децитабина (50 мг лиофилизированного порошка децитабина в бутылочке восстановленного до 10 мг/мл водой для инъекции и вводили в форме инфузий путем разведения в инфузионных пакетах).
Введение единичной дозы рецептур обезьянам (10 мг/кг) обеспечивает повышенные физиологические концентрации соединения I-1 (Cмакс 1,130 нг/мл; ППК 1,469 нг⋅ч/мл) по сравнению с децитабином (Cмакс 160 нг/мл; ППК 340 нг⋅ч/мл).
В исследовании с повторением дозы обезьянам вводили дозу 3→ еженедельно подкожно (3 мг/кг). В день 15, системное действие соединения I-1 (Cмакс 181 нг/мл; ППК 592 нг⋅ч/мл) было выше по сравнению с децитабином (Cмакс 28 нг/мл; ППК 99 нг⋅ч/мл). Фармакокинетические параметры соединения значительно не изменялись к 22 дню наблюдений и наблюдалось минимальное аккумулирование. (ФИГ. 1 и 2). Контролировали фармакодинамические свойства (не показаны) и они были приемлемыми. Периодические отбирали образцы крови для исследования LINE-1 метилирования ДНК.
Наблюдали снижение в LINE-1 метилирования ДНК, что является индикатором биологической активности и снижение продолжалось до окончания исследования в день 22. Наблюдаемое с помощью LINE-1 метилирование значительно отличалось (ρ<0,05) от уровня метилирования наблюдаемого до начала лечения. (ФИГ. 3.)
Рецептура хорошо переносится исследуемыми видами. Были оценены три схемы: а) один раз в день подкожно крысам и кроликам в течение 5 дней; б) один раз в неделю подкожно кроликам и яванским макакам в течение 28 дней, как толерантный; и с) дважды в неделю подкожно крысам в течение 28 дней, как толерантный. Кролики переносили 5-дневную схему вплоть до дозы 1,5 мг/кг/день, что эквивалентно 18 мг/кг/ день для людей и еженедельную схему вплоть до дозы 1,5 мг/кг/неделю в течение 3 недель.
Яванские макаки хорошо переносили еженедельную схему вплоть до дозы 3,0 мг/кг/неделю в течение 3 недель, что эквивалентно 36 мг/кг/неделю. Крысы переносили гораздо более высокие дозы: 30 мг/кг/день в течение 5 дней; и 20 мг/кг дважды в неделю в течение 4 недель.
Основной токсичностью во всех экспериментах была миелосуппрессия. Тем не менее, исследование подкожной рецептуры показало меньшую миелосуппрессию и более быстрое восстановление.
ПРИМЕР 5: Получение набора для применения согласно изобретению
Первая емкость: Соединение Формулы I-1 для инъекции, 100 мг
Натриевую соль соединения формулы:

(также упоминается в данном документе как “SGI-110”) получали как описано в US 7700567 (содержание которого включено в данный документ посредством ссылки - см., в частности, колонку 41, два последних параграфа) путем конденсации 1s (где R1 = карбаматзащитная группа) с фосфорамидитным билденг-блоком 1d:

Защищенный 2'-деоксигуанозин-связанный СКП носителем для твердофазного синтеза 1s (где R1 = трет-бутилфеноксиацетил) конденсировали с 2-2,5 эквивалентами феноксиацетилдецитабинфосфорамидита (1d, где R1 = феноксиацетил) в присутствии 60% 0,3 M бензилтиотетразольного активатора (в ацетонитриле) на протяжении 10 минут. СКП носитель для твердофазного синтеза, содержащий защищенный динуклеотид DpG, обрабатывали 20 мл 50 мM K2CO3 в метаноле на протяжении 1 часа и 20 минут. Конденсированный продукт окисляли, защитную группу удаляли, промывали, фильтровали и очищали с помощью ВЭЖХ ÄKTA Explorer 100 с препаративной колонкой Gemini C18 (Phenomenex), 250x21,2 мм, 10 мкм с защитной колонкой (Phenomenex), 50x21,2 мм, 10 мкм, используя 50 мM ацетат триэтиламмония (pH 7) в MilliQ вода (Подвижная Фаза A) и 80% ацетонитрила в MilliQ воде (Подвижная Фаза B), с от 2% до 20/25% Подвижной Фазы B в объемах колонок.
ЭСИ-MС (-ve) динуклеотида DpG 2b:

где X+ = триэтиламмоний (рассчитанная точная масса для нейтрального соединения C18H24N9O10P составляет 557,14), наблюдается m/z 556,1 [M-H]- и 1113,1 для [2M-H]- (см. масспектр на ФИГ. 31 в US 7700567).
Получали натриевую соль соединения Формулы I-1 (т.e. динуклеотида DpG 2b, где X+=натрий; SGI-110) путем повторного растворения триэтиламмониевой соли в 4 мл воды в 0,2 мл 2M раствора NaClO4. При добавлении 36 мл ацетона динуклеотид выпадал в осадок. Раствор хранили при -20°C на протяжении нескольких часов и центрифугировали при 4000 об/мин в течение 20 минут. Надосадочную жидкость отбрасывали и твердое вещество промывали 30 мл ацетона после чего дополнительно центрифугировали при 4000 об/мин в течение 20 минут. Осадок растворяли в воде и лиофилизировали, осадок имел m/z 556,0 [M-H]- (см. масспектр на ФИГ. 36 в US7700567).
Смешивание и наполнение нерасфасованной рецептуры
Базируется на исследовании значения SGI-110, рассчитывали и взвешивали необходимые количества SGI-110 и ДМСО согласно запланированному размеру партии.
2. SGI-110 растворяли в ДМСО, используя верхнюю мешалку, в емкости из нержавеющей стали (НС) приемлемого размера.
3. После полного растворения лекарственного средства в ДМСО, образцы нерасфасованого раствора исследовали с помощью способа УФ или ВЭЖХ для определения, что количество SGI-110 находится в рамках 95-105% целевой концентрации.
4. Нерасфасованный раствор фильтровали через ряд дважды стерилизованных 0,2 микронных стерилизующих фильтра, которые являются ДМСО совместимыми, и собирали в 2 л буферную емкость из НС.
Скорость фильтрации непрерывно регулировали с помощью визуального контроля количества доступного для наполнения буферной емкости.
Один грамм отфильтрованного нерасфасованного раствора заливали в каждую из 5 см3 депирогенных прозрачных стеклянных флаконов и операцию продолжали до завершения разлива всего отфильтрованного нерасфасованного раствора.
Каждый флакон автоматически и частично закрывали на линии заполнения, используя предварительно стерилизованную хлорбутиловую резиновую пробку lyo с фторполимерным покрытием.
Флаконы с продуктом переносили в лиофилизатор в асептических условиях переноса для начала цикла лиофилизации.
Лиофилизация и укупоривание флаконов
Флаконы лиофилизировали с использованием параметров цикла, как показано ниже.
2. После завершения цикла лиофилизации, лиофилизатор промывали азотом и флаконы полностью и автоматически укупоривали.
3. Флаконы асептически переносили в изолятор, где каждый флакон автоматически закрывали голубым алюминиевым обжимным колпачком.
4. Флаконы визуально проверяли, прежде чем приступить к отбору образцов для тестирования и операции нанесения маркировки и упаковки. Флаконы хранили при температуре 2-8°С до готовности.
Маркировка и упаковка
Каждый флакон маркировали в соответствии с утвержденным содержанием и упаковывали по отдельности в термосварные мешки из алюминиевой фольги с осушителем в вакууме. Мешочек из фольги маркировали снаружи той же меткой, которая была использована для флакона с продуктом. Маркированные и упакованные флаконы хранили при температуре 2-8°С до дальнейшего распространения.
Остаточный ДМСО
Получали четыре партии одного и того же размера 3000 флаконов/партия с использованием того же самого способа, что описан выше. ДМСО последовательно удаляли до следующих остаточных уровней, получая твердый белый порошок, для демонстрации того, что лиофилизации SGI-110 из ДМСО, как описано выше, дает безопасные и химически стабильный порошок SGI-110:
Вторая емкость: Разбавитель для восстановления SGI-110, 3 мл
Смешивание и наполнение нерасфасованной рецептуры
Рассчитанные количества (см. таблицу ниже) пропиленгликоля, этанола и глицерина в упомянутом выше порядке добавляли в емкость из нержавеющей стали приемлемого размера с верхней мешалкой.
2. Периодическое перемешивание во время добавления компонентов продолжали, по меньшей мере, 30 минут после смешивания с получением хорошо смешанного раствора.
3. Нерасфасованный раствор фильтровали через ряд дважды стерилизованных 0,2 микронных стерилизующих фильтра и собирали в 2 л буферную емкость из НС.
4. Скорость фильтрации непрерывно регулировали с помощью визуального контроля количества доступного для наполнения буферной емкости.
По меньшей мере 3,15 г, что эквивалентно 3,0 мл, фильтрованного нерасфасованного раствора заливали в каждую из 5 см3 депирогенных прозрачных стеклянных флаконов и после чего автоматически укупоривали используя стерилизованую хлорбутиловую резиновую пробку с фторполимерным покрытием.
Укупоренные флаконы закрывали белыми алюминиевыми обжимными колпачками.
Флаконы визуально проверяли, прежде чем приступить к отбору образцов для тестирования высвобождения и операции нанесения маркировки и хранили при температуре 2-30°С до готовности.
Маркировка и упаковка
Каждый флакон с разбавителем маркировали в соответствии с утвержденным содержанием. Маркированные флаконы хранили при 2-30°C до дальнейшего распространения.
ПРИМЕР 6: Противоопухолевая активность SGI-110 в комбинации с анти-CTLA-4 антителом
Оценивали противоопухолевое действие SGI-110 в комбинации с анти-мышиным CTLA-4 в мышиной модели рака молочной железы.
Материалы и Методы
TS/A представляет собой мышиную карциному молочной железы, возникающую из умеренно дифференцированной слабо иммуногенной аденокарциномы молочной железы спонтанно возникающей у 20 месячных самок BALB/с мышей.
Антимышиным CTLA-4 было CTLA-4 mAb 9H10, полученное от BioXCell (West Lebanon, NH, USA), в дозировке 100 мкг/мышь в 200 мкл (ип).
Balb/c мышам (6/группу) с помощью подкожной инъекции в боковую область вводили клетки карциномы молочной железы мышей TS/A (2×105).
Мышам, несущим ощутимые трансплантаты опухолей (диаметр ≥0,2 см) подкожно вводили 3 мг/кг восстановленного SGI-110 QDx5 (ежедневно в течение пяти дней) в дни 1-5, отдельно или в комбинации с 100 мкг/анти-мышиного CTLA-4 моноклонального антитела (mAb) хомячка, или одновременно (в день 2, 5 и 8), или последовательно (в день 8, 11 и 14).
Контрольным мышам вводили разбавитель для восстановления. Эффективность и переносимость лечения оценивали по объему опухоли и измерениям массы тела, соответственно.
Результаты и выводы
Результаты приведены на Фиг. 5. Лучшее противоопухолевое действие было достигнуто у мышей, получавших SGI-110 с последующим введением анти-CTLA-4 mAb. В этом случае, наблюдаемая масса опухоли была значительно (р<0,05) меньше, чем у контрольных мышей, на что указывает, в день 26, ингибирование роста опухоли на 84,4%. Кроме того, произошло значительно, но ниже, уменьшение массы опухоли у мышей обработанных SGI-110, по сравнению с контрольными мышами, с ингибированием роста опухоли на 62,9% на день 26. Не наблюдалось никакой разницы в ингибировании роста опухоли у мышей, получавших одновременно комбинацию SGI-110 с анти-CTLA-4 mAb, по сравнению с мышами, обработанными только SGI-110. Не наблюдалась потеря массы тела (данные не показаны) во всех исследованных мышей, что говорит о хорошей переносимости всех исследованных терапевтических схем.
Таким образом, эпигенетическое инициирование с помощью SGI-110 с последующей CTLA-4 блокадой обеспечивает улучшенную противоопухолевую активность.
ПРИМЕР 7: Противоопухолевая активность двух циклов последовательного введения SGI-110 и анти-CTLA-4
Также оценивали противоопухолевую активность двух циклов последовательного введения SGI-110 с последующим введением антимышиного CTLA-4 mAb 9H10 в мышиной модели TS/A.
Материалы и Методы
Balb/c мышам (6/группу) с помощью подкожной инъекции в боковую область вводили клетки карциномы молочной железы мышей TS/A (2×105).
Мышей, несущих ощутимые трансплантаты опухолей (диаметр ≥0,2 см), лечили двумя циклами 3 мг/кг восстановленного SGI-110 QDx5 (подкожная инъекция ежедневно в течение пяти дней) в дни 1-5 и 21-25, отдельно или в комбинации с двумя циклами 100 мкг/анти-мышиного CTLA-4 моноклонального антитела (mAb) хомячка, в дни 8, 11, 14, 28, 31 и 34).
Контрольным мышам вводили разбавитель для восстановления. Эффективность и переносимость лечения оценивали по объему опухоли и измерениям массы тела, соответственно.
Результаты и выводы
Результаты показаны на ФИГ. 6: два цикла последовательного введения SGI-110 и анти-CTLA 4 антитела являются эффективными и улучшают противоопухолевое действие антитела. Измерения массы тела (не показаны) показали, что лечение хорошо переносилось.
Реферат
Группа изобретений относится к медицине и может быть использована для иммунотерапии. Для этого применяют комбинацию производных децитабина и антитела анти-CTLA4. Также предложены набор для иммунотерапии, способы лечения рака, применение комбинации или набора для получения лекарственного средства. Группа изобретений позволяет проводить иммунотерапию, лечение рака у пациентов. 6 н. и 32 з.п. ф-лы, 6 ил., 5 табл., 7 пр.
Формула


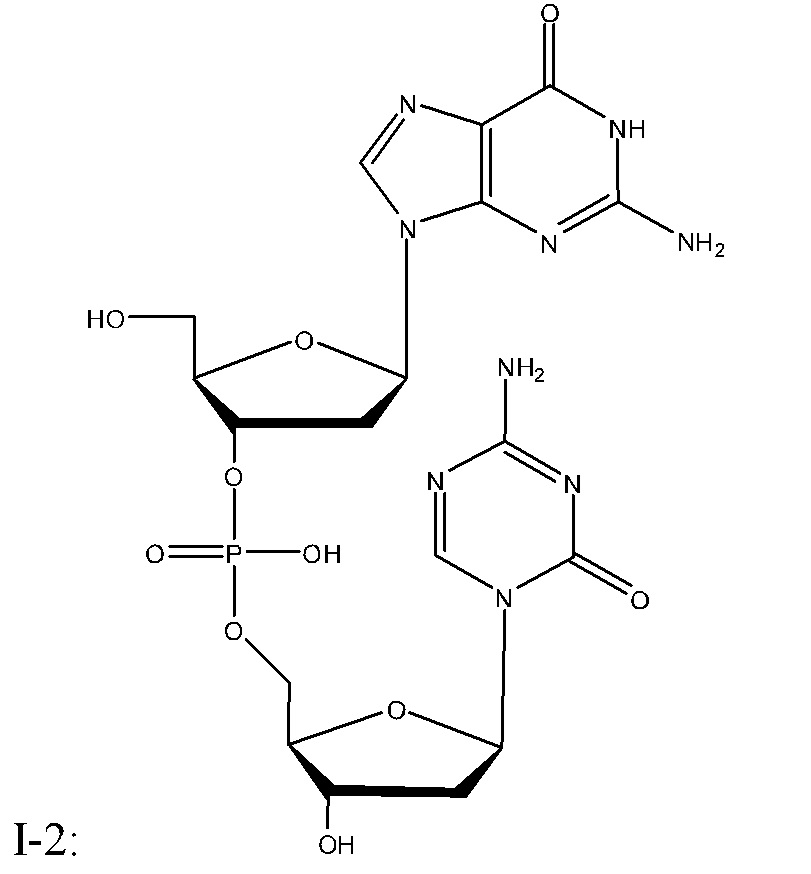

Комментарии