Дуокармициновые adc, демонстрирующие улучшенную противоопухолевую активность in vivo - RU2689779C2
Код документа: RU2689779C2
Чертежи








Описание
Область техники
Настоящее изобретение относится к содержащим дуокармицин конъюгатам антитело-лекарственное средство (ADC) для применения в лечении человеческих солидных опухолей и гематологических злокачественных опухолей, экспрессирующих человеческий рецептор эпидермального фактора роста 2 (HER2), в частности, рака молочной железы, рака желудка, рака мочевого пузыря, рака яичников, рака легких, рака простаты, рака поджелудочной железы, колоректального рака, плоскоклеточного рака головы и шеи, остеосаркомы и острого лимфобластного лейкоза.
Уровень техники
Ранее антитела были конъюгированы со множеством цитотоксических лекарственных средств, включая малые молекулы, которые алкилируют или перекрестно связывают ДНК (напр., дуокармицины и калихеамицины или димеры пиррол-бензодиазепин, соответственно), или разрушают микротрубочки (напр., майтанзиноиды и ауристатины), или связывают ДНК (напр., антрациклины). Один такой ADC, содержащий гуманизированное анти-CD33 антитело, конъюгированное с калихеамицином, Mylotarg™ (гемтузумаб озогамицин, Wyeth), был одобрен в 2000 для острой миелоидной лейкимии. В 2011 Администрация США по пищевым продуктам и лекарственным веществам (FDA) одобрила Adcetris™ (бретуксимаб ведотин, Seattle Genetics), ADC, содержащий химерное антитело к CD30, конъюгированное с монометилуристатином Ε (MMAE), для лечения лимфомы Ходжкина и анапластической крупноклеточной лимфомы.
Дуокармицины, впервые выделенные из культуральной жидкости видов Streptomyces, являются членами семейства противоопухолевых антибиотиков, которые включают дуокармицин A, дуокармицин SA и CC-1065. Биологическая активность этих чрезвычайно сильнодействующих агентов предположительно происходит от способности селективно по отношению к последовательности алкилировать ДНК в N3 положении аденина в малой бороздке, что иницирует каскад событий, приводящих к смерти опухолевых клеток.
W02011/133039A раскрывает ряд новых аналогов алкилирующего ДНК агента CC-1065 и их нацеливающие к HER2 ADC. В примере 15, ряд конъюгатов трастузумаб-дуокармицин тестировали против N87 (т.е., HER2 IHC (иммуногистохимия) 3+ опухоль желудка) ксенотрансплантатов в голых мышах. Результаты показаны на фигурах 4A, 4B и 4C. После лечения с однократной дозой 12 мг/кг все шесть ADC снижали объем опухоли и улучшали выживаемость по сравнению с антителом трастузумабом изолированно, и при этом контрольный носитель не воздействовал негативно на массу тела. Был сделан вывод, что конъюгаты, которые содержат относительно короткий линкер, имеют большую (противоопухолевую) эффективность, чем соответствующий конъюгат с относительно длинным линкером, и было продемонстрировано, что как природа линкера, так и природа лекарственного средства оказывает эффект на эффективность.
Рак молочной железы остается наиболее распространенной злокачественной опухолью среди женщин во всем мире. Рак молочной железы представляет собой гетерогенное заболевание, которое проявляет широкий диапазон клинических поведений и прогнозов. Рак молочной железы представляет собой аномальный злокачественный рост эпителиальных клеток молочных долек или протоков молочной железы. Раковая ткань может быть расположена исключительно в месте происхождения (рак in situ) или может распространяться через базальную мембрану в окружающую ткань (инвазивный рак). Метастатический рак происходит сразу после того, как раковые клетки распространились через лимфатические и кровеносные сосуды в другие органы. Гистологическую дифференциацию и характеризацию клеток рака молочной железы выполняли с применением биомаркеров.
Молекулярная классификация рака молочной железы для выбора метода лечения главным образом состоит из оценки состояния экспрессии эстрогенного рецептора (ER), прогестеронового рецептора (PR) и человеческого рецептора эпидермального фактора роста 2 (HER2). Это подразумевает, что в целом могут быть выделены три типа рака молочной железы: (1) рак ткани молочной железы с экспрессией гормон-рецептора (ER или PR) без сверхэкспрессии HER2, (2) рак ткани молочной железы с сверхэкспрессией HER2, с или без экспрессии гормон-рецептора (HR), и (3) рак ткани молочной железы, который не имеет терапевтически значимую экспрессию гормон-рецептора или HER2 рецептора, так называемый трижды негативный рак молочной железы (TNBC).
Пациенты с раком молочной железы c раковой тканью с положительным статусом гормон-рецептора (HR) (приблизительно 60-70% всех пациентов с раком молочной железы) имеют лучший прогноз, чем пациенты без или с минимальным статусом рецептора гормона. С другой стороны, пациенты, опухоль которых имеет IHC 3+ или IHC 2+/FISH (флуоресцентная гибридизация in situ) положительный статус раковой ткани (происходящие у приблизительно 20% всех случаев рака молочной железы), имеют более плохой прогноз по сравнению с пациентами с раком молочной железы, опухоль которых имеет более низкую степень мембранной экспрессии HER2 или негативную степень FISH амплификации. В настоящее время для таких пациентов с гормон-рецептор позитивным и сверхэкспрессирующим HER2 раком ткани молочной железы существует вариант нацеленной терапии, трижды негативный рак молочной железы подразумевает наихудший прогноз, так как для пациентов, опухоль которых является ER, PR и HER2-негативной, доступна только химиотерапия с ограниченной эффективностью.
Herceptin™ (трастузумаб), рекомбинантное гуманизированное моноклональное антитело IgG1 против HER2, был одобрено в США FDA в 1998 в качестве адъювантного лечения сверхэкспрессирующего HER2 рака молочной железы и для лечения метастатического сверхэкспрессирующего HER2 рака молочной железы и рака желудка, т.е., HER2 IHC 3+ или HER2 IHC 2+/FISH позитивного. Лекарственное средство было одобрено в Европе EMA в 2000.
Клинические исследования с пациентами, которые имеют метастатическое раковое заболевание молочной железы, продемонстрировали, что клинически значимая эффективность лечения с трастузумабом имеет место, только если пациент имеет опухоль с HER2 IHC сверхэкспрессией или FISH позитивной амплификацией гена. По этой причине, существующие в настоящее время алгоритмы тестирования HER2 нацелены на идентифицирование таких пациентов, для которых более вероятно достижение значительной выгоды от нацеливания к HER2. Несмотря на то, что мембранная экспрессия HER2 является биологически неотделимой от низкой до высокой сверхэкспрессии, одобренные IHC тесты, подобно HercepTest™ (Dako, Glostrup, Denmark), классифицируют статус HER2 по полуколичественной шкале, варьирующейся от 0 до 3+. Оценка IHC 3+ присваивается, если имеет место сильное периферическое окрашивание мембраны в >10% раковых клеток. FISH позитивная амплификация гена присваивается, если степень амплификации относительно центромеры составляет >2,0. Это идентифицирует пациентов, которые могут иметь выгоду от лечения с трастузумабом или другими нацеленными на HER2 агентами. Обзор 6556 раков молочной железы выявил, что приблизительно 92% опухолей с HER2 оценкой 3+ имели FISH позитивную амплификацию гена. Напротив, амплификацию HER2 наблюдали с более низкими степенями в опухолях с оценками 2+ (23,3%), 1+ (7,4%), и 0 (4,1%). С HER2 амплификацией в качестве установленного прогностического параметра ответа на нацеленные на HER2 агенты, существующий в настоящее время алгоритм предусматривает FISH тестирования опухолей с оценкой HER2 IHC 2+.
Адо-трастузумаб эмтанзин или трастузумаб эмтанзин (Kadcyla™, T-DM1) представляет собой ADC, в котором трастузумаб конъюгирован с цитотоксическим антитубулиновым агентом майтансин DM1. T-DM1 имеет противоопухолевую активность в ксенотрансплантатных моделях опухолей, которые являются не отвечающими на терапию с трастузумабом в качестве единственного агента. В фазе 3 испытания EMILIA пациентов с HER2 позитивным раком молочной железы на поздней стадиии, предварительно подвергавшихся лечению с трастузумабом и таксаном, рандомизированно разделяли для получения T-DM1 или комбинации лапатиниб плюс капецитабин. Лечение с T-DM1 предоставляло значительно более продолжительную выживаемость без прогрессирования и общее время выживаемости по сравнению с лечением контрольной группы.
Kadcyla™ (T-DM1) был одобрен в США FDA в феврале 2013 для лечения пациентов с HER2-позитивным метастатическим раком молочной железы, которые получали предшествующее лечение с трастузумабом и таксаном. Лекарственное средство было одобрено в Японии MHLW (Ministry of Health, Labour and Welfare) в сентябре 2013 и в Европе EMA в ноябре 2013. Одобренная в настоящее время схема приема содержит дозировку 3,6 мг/кг массы тела внутривенно каждые три недели. Дозировка 2,4 мг/кг массы тела внутривенно еженедельно исследуется в проводящейся в настоящее время Фазе II исследования с комбинацией T-DM1 и капецитабин для 2ой линии лечения пациентов с раком молочной железы или раком желудка и в проводящейся в настоящее время Фазе III исследования для изучения T-DM1 против таксана в качестве 2ойлинии лечения пациентов с раком желудка. Фаза III исследования также проводится в настоящее время для комбинации T-DM1 с пертузумабом для лечения пациентов с HER2 позитивным, местно-распространенным или метастатическим раком молочной железы.
Несмотря на улучшение, которое привнесло введение T-DM1 в клиническую практику по сравнению с трастузумабом для лечения HER2-позитивного метастатического рака молочной железы, применение T-DM1 связано с рядом существенных побочных эффектов, самыми главными из которых являются тромбоцитопения, гепатотоксичность и невропатия (необратимая аксональная дегенерация). Кроме того, ни трастузумаб, ни T-DM1 не являются разрешенными для лечения человеческих солидных опухолей и гематологических злокачественных опухолей с умеренной или низкой экспрессией HER2, т.е., IHC 2+ или 1+ и/или FISH негативным статусом HER2 амплификации раковой ткани.
По аналогии с раком молочной железы экспрессия HER2 указывает на плохой прогноз для пациентов с раком яичников (A. Berchuck et al., 1990, Cancer Res., 50, 4087-4091; H. Meden and W. Kuhn, 1997, Eur. J. Obstet. & Gynecol. Reprod. Biol., 71, 173-179). Клетки SKOV3 получены из асцитной жидкости пациента с аденокарциномой яичника. Эта клеточная линия является сврхэкспрессирующей HER2, и ее часто применяют для in vitro и in vivo диагностического исследования нацеленных на HER2 агентов. Трастузумаб и пертузумаб имеют некоторые противораковые эффекты в этой клеточной линии (N. Gaborit et al., 2011, J. Biol. Chem., 286, 13, 11337-11345). Монотерапия с анти-HER2 антителами трастузумабом и пертузумабом к настоящему моменту имела умеренную эффективность (G.M. Mantia-Smaldone et al., 2011, Cancer Management Res. 3, 25-38; S.P. Langdon et al., 2010, Expert Opin. Biol. Ther. 10:7, 1113-1120). Противоопухолевый эффект бывает заметно повышен, если нацеленное на HER2 антитело было комбинировано с химиотерапией (S. Makhija et al., 2010, J. Clin. Oncol., 28:7, 1215-1223; I. Ray-Coquard et al., 2008, Clin. Ovarian Cancer, 1:1, 54-59).
Кроме того, существует высокая медицинская потребность в лечении ракового заболевания мочевого пузыря на поздней стадии. Химиотерапия, напр., комбинация цисплатина и гемцитабина для рака на поздней стадии или метастатического рака мочевого пузыря, имеет ограниченную эффективность, так как она приводит к средней частоте ответа ниже 50%, тогда как пациенты имеют общее время выживаемости от 6 до 12 месяцев. В случае невосприимчивости к химиотерапии не существует никакого варианта стандартной терапии. HER2 позитивность была в значительной мере связана со сниженными частотами общего ответа (50% по сравнению с 81%, p=0,026) после химиорадиации (A. Chakravarti et al., 2005, Int. J. Radiation Oncology Biol. Phys., 62:2, 309-317). Добавление трастузумаба в схему приема паклитаксела и карбоплатина в качестве терапии первой линии HER2 позитивного рака мочевого пузыря на поздней стадии продемонстрировало частоту общего ответа 70% и общее время выживаемости 14,1 месяцев в фазе II исследования (M.H.A. Hussain et al., 2007, J. Clin. Oncol., 25:16, 2218-24). При казуистическом применении пациент с рецидивом опухоли после стандартной химиотерапии отвечал на комбинацию трастузумаба, паклитаксела и карбоплатина (D. Amsellem-Ouazana et al., 2004, Ann. Oncol., 15, 3, 538).
В случае инвазивной немелкоклеточной аденокарциномы легких мутация HER2 и амплификация связаны с неблагоприятным исходом (M. Suzuki et al., 2014, Lung Cancer, http://dx.doi.Org/10.1016/j.lungca.2014.10.014). У пациентов с раком легких с HER2 мутацией может быть достигнута частота контроля заболевания 93% с терапиями на основе трастузумаба (J. Mazieres et al., 2013, J. Clin. Oncol., 31:16, 1997-2004). Хеморезистентность рака легких часто связана с усиленной экспрессией HER2 (C.-M. Tsai et al., 1993, J. Natl. Рак Inst., 85:11, 897-901; Z. Calikusu et al., 2009, J. Exp. Clin. Cancer Res., 28:97) и невосприимчивость к ингибиторам тирозинкиназы коррелирует с усиленной HER2 амплификацией (K. Takezawa et al., 2012, Cancer Discov. 2(10), 922-33).
Пациенты с ранней или поздней стадией рака простаты главным образом получают нацеленную на андрогенный рецептор терапию. Существует взаимное влияние сигнальных функций андрогенного рецептора и HER2 (F.-N. Hsu et al., 2011, Am. J. Physiol. Endocrinol. Metab., 300:E902-E908; L. Chen et al., 2011, Clin. Cancer Res., 17(19), 6218-28). Активация HER2 подавляет экспрессию андрогенного рецептора (C. Cai et al., 2009, Cancer Res., 69(12), 5202-5209), повышенная экспрессия HER2 связана с прогрессированием PSA, быстрой пролиферацией и неблагоприятным прогнозом (S. Minner et al., 2010, Clin. Cancer Res., 16(5), 1553-60; S.F. Shariat et al., 2007, Clin. Cancer Res., 13(18), 5377-84). Повышенная экспрессия HER2, по-видимому, задействована в прогрессировании в андрогенную независимость в приблизительно четверти случаев рака простаты (J.M.S. Bartlett et al., 2005, J. Pathol., 205, 522-529).
Рак поджелудочной железы является одной из наиболее наиболее летальных человеческих солидных опухолей из-за начала заболевания без явных симптомов и невосприимчивости к терапии. Гемцитабин или комбинация 5-FU, лейковорина, иринотекана и оксалиплатина может помогать продлению жизни пациентов с заболеванием на поздней стадии (H. Burris и A.M. Storniolo, 1997, Eur. J. Cancer 33(1):S 18-S22; T. Conroy et al., 2011, N. Engl. J. Med. 364(19): 1817-25). В последнее время сообщалось о том, что экспрессия HER2 также является превалирующей в раке поджелудочной железы с равной пропорцией 10%, обозначенной HER2 2+ и 3+. На основании этого факта нацеленное на HER2 лечение, содержащее трастузумаб, считается целесообразным вариантом для этой популяции пациентов на основании эффектов, наблюдаемых в предклинических моделях [C. Larbouret et al., 2012, Neoplasia 14(2), 121-130).
Применяя допускаемое окрашивание и способы оценки наблюдали сверхэкспрессию HER2 у приблизительно 6% пациентов с колоректальным раком (CRC) (A.N. Seo et al., 2014, PLoS ONE, 9(5): e98528). На основании этого нацеленное на HER2 лечение может быть эффективно для этой подгруппы пациентов с CRC. В двух клинических испытаниях исследовали выгоду содержащей трастузумаб комбинацинной терапии при CRC на поздней стадии или метастатическом CRC и при этом клинические ответы, наблюдаемые в этих испытаниях, предоставляли обоснование эффективности лечения (R.K. Ramanathan et al., 2004, Cancer Invest. 22(6): 858-865; J. Clark et al., 2003, Proc. Am. Soc. Clin. Oncol. 22: abstr 3584). Кроме того, в одном исследовании предполагалось включение терапии с трастузумабом в качестве части режимов лечения (анти-EGFR моноклональное антитело) устойчивых к цетуксимабу CRC пациентов (A. Bertotti et al., 2011, Cancer Discov. 1(6): 508-523).
Контроль течения плоскоклеточного рака головы и шеи на поздней стадии или карциномы (HNSCC) состоит из терапии с множеством способов воздействия с хирургией, облучением и химиотерапией. Beckhardt et al. сообщили о высокой сверхэкспрессии HER2 в 16% образцов клеточных линий, и умеренной и низкой экспрессией HER2 в 31% и 35% образцов, соответственно (R.N. Beckhardt et al., 1995, Arch. Otolaryngol. Head Neck Surg. 121:1265-1270). Это иллюстрирует потенциальный терапевтический потенциал лечения трастузумабом при HNSCC.
В 1999, Gorlick et al. сообщили о сверхэкспрессии HER2 в 20 из 47 образцов остеосаркомы, и продемонстрировали, что эти пациенты имели плохой ответ на терапию и сниженную степень выживаемости по сравнению с пациентами, опухоли которых не имеют сверхэкспрессии этого антигена (R. Gorlick et al., 1999, J. Clin. Oncol. 17:2781-8). Поэтому, начали рассматривать HER2 в качестве потенциально успешного кандидата для нацеленной биологической терапии при этих показаниях. Недавние обнаружения в клинических исследованиях с применением трастузумаба указывают, что анти-HER2 лечение может быть безопасно доставлено в комбинации с химиотерапией на основании антрациклина и дексразоксана (D. Ebb et al., 2012, J. Clin. Oncol. 30(20), 2545-2551).
Дополнительно, сверхэкспрессия HER2 наблюдается у приблизительно одной трети пациентов с острым лимфобластным лейкозом (ALL), даже более часто в присутствии транслокации Филадельфия. Ингибирование HER2 индуцирует апоптоз клеток лейкемии in vitro (M.E. Irwin et al., 2013, PLoS ONE, 8:8, e70608). В фазе II исследования было продемонстрировано, что лечение с трастузумабом невосприимчивых или рецидивирующих взрослых пациентов B-ALL с HER2 сверхэкспрессией в злокачественных B-клетках приводило в результате к частоте общего ответа 13%, что демонстрирует ответ этого заболевания на нацеленный на HER2 агент (P. Chevalier et al., Blood, 2012, DOI 10.1182/blood-2011-11-390781).
Таким образом, существует потребность в новых нацеленных на HER2 терапиях, особенно для лечения пациентов с опухолями и злокачественными новообразованиями, которые имеют (i) умеренный или низкий статус IHC, и/или (ii) негативный статус FISH, и/или (iii) негативный статус гормон-рецептора (HR) раковой ткани. В частности, существует потребность в новых одобренных регуляторными органами терапиях для нацеленного лечения трижды негативного рака молочной железы (TNBC).
Краткое описание настоящего изобретения
Настоящее изобретение относится к содержащим дуокармицин конъюгатам антитело-лекарственное средство (ADC) для применения в лечении человеческих солидных опухолей и гематологических злокачественных опухолей, экспрессирующих HER2, в частности рака молочной железы, рака желудка, рака мочевого пузыря, рака яичников, рака легких, рака простаты, рака поджелудочной железы, колоректального рака, плоскоклеточного рака головы и шеи, остеосаркомы и острого лимфобластного лейкоза.
Краткое описание чертежей
Фигура 1. Противоопухолевая активность SYD985 по сравнению с T-DM1 в MAXF-1162 модели PDX (рак молочной железы, аденокарцинома, HER2 IHC 3+, HER2 FISH позитивный) (CRO: Oncotest).
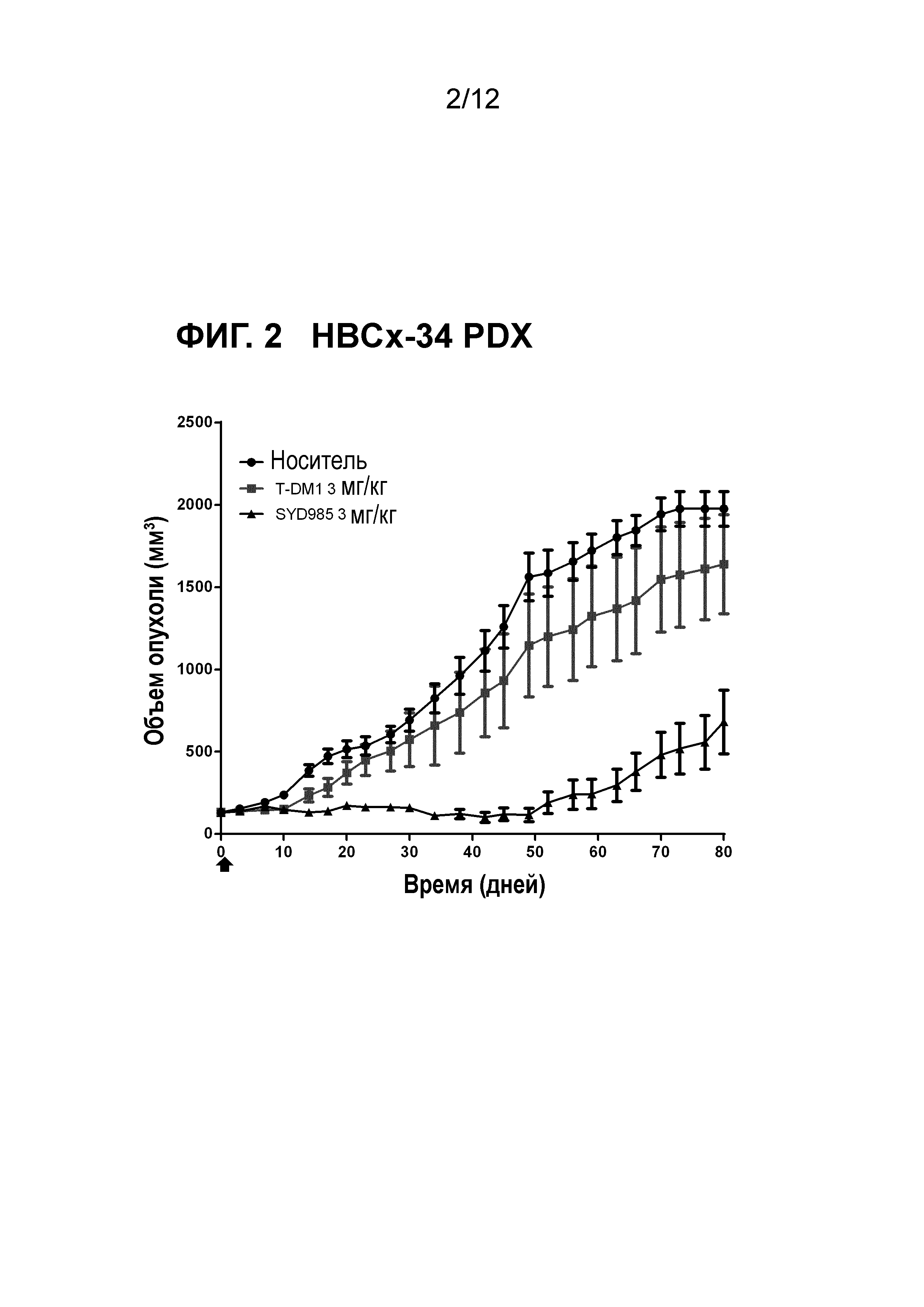
Фигура 2. Противоопухолевая активность SYD985 по сравнению с T-DM1 в HBCx-34 модели PDX (рак молочной железы, проточная карцинома, HER2 IHC 2+, HER2 FISH негативный, ER и PR позитивный) (CRO: XenTech).
Фигура 3. Противоопухолевая активность SYD985 по сравнению с T-DM1 в MAXF 449 модели PDX (рак молочной железы, инвазивная проточная карцинома, HER2 IHC 1+, HER2 FISH негативный, ER и PR негативный, т.е., трижды негативный рак молочной железы) (CRO: Oncotest).
Фигура 4. Противоопухолевая активность SYD985 по сравнению с T-DM1 в HBCx-10 модели PDX (рак молочной железы, проточная аденокарцинома, HER2 IHC 1+, HER2 FISH негативный, ER и PR негативный, т.е., трижды негативный рак молочной железы) (CRO: XenTech).
Фигура 5. Противоопухолевая активность SYD985 по сравнению с T-DM1 в MAXF-MX1 модели PDX (рак молочной железы, инвазивная проточная карцинома, HER2 IHC 1+, HER2 FISH негативный, ER и PR негативный, т.е., трижды негативный рак молочной железы) (CRO: Oncotest).
Фигура 6. Противоопухолевая активность SYD985 по сравнению с T-DM1 в ST313 модели PDX (рак молочной железы, HER2 IHC 2+, HER2 FISH негативный, ER и PR позитивный) (CRO: Start).
Фигура 7. Противоопухолевая активность SYD985 по сравнению с T-DM1 в GXA3057 модели PDX (рак желудка, HER2 IHC 1+, HER2 FISH негативный) (CRO: Oncotest).
Фигура 8. Противоопухолевая активность SYD985 по сравнению с T-DM1 в GXA3067 модели PDX (рак желудка, HER2 IHC 2+, HER2 FISH позитивный) (CRO: Oncotest).
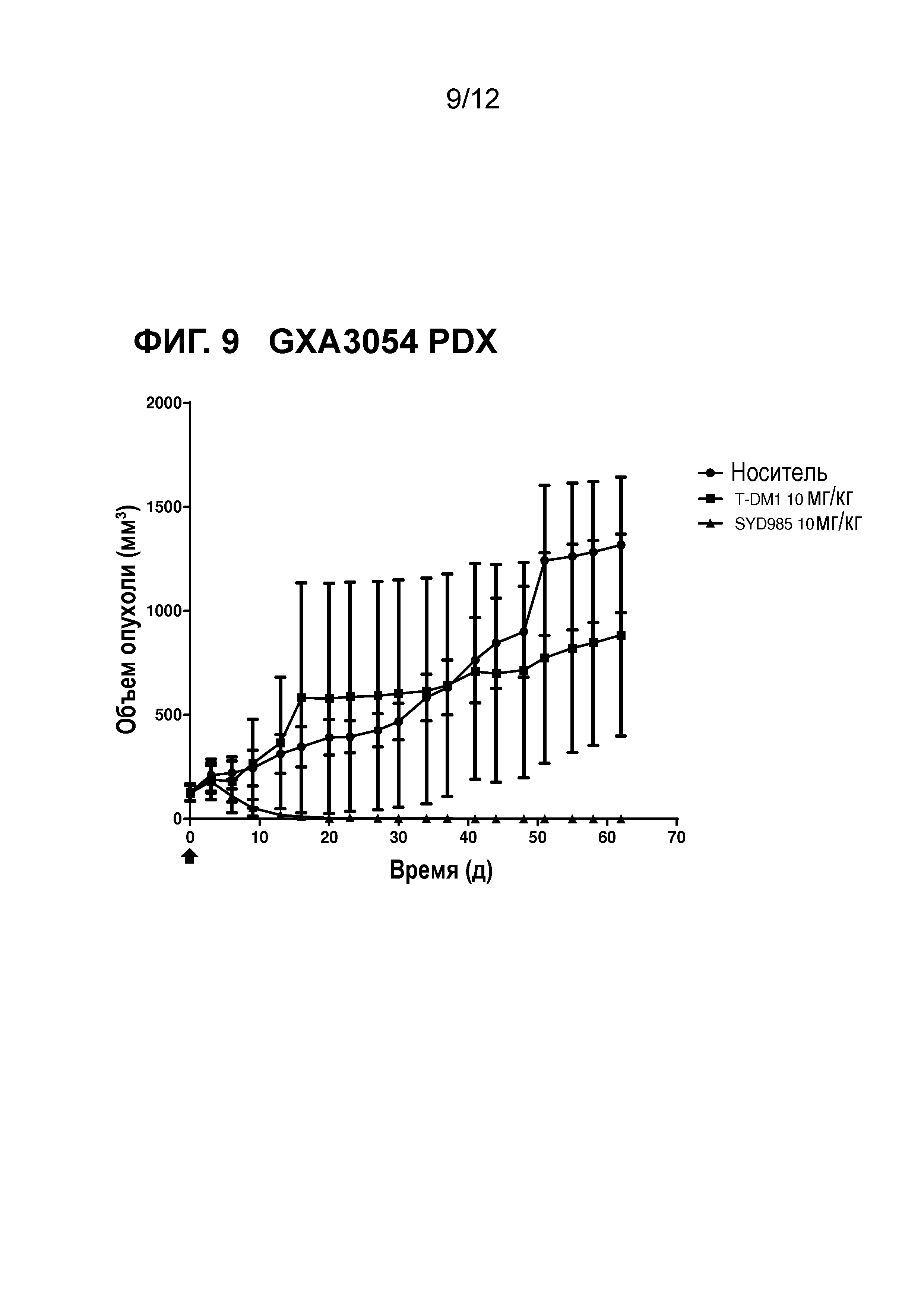
Фигура 9. Противоопухолевая активность SYD985 по сравнению с T-DM1 в GXA3054 модели PDX (рак желудка, HER2 IHC 3+, HER2 FISH позитивный) (CRO: Oncotest).
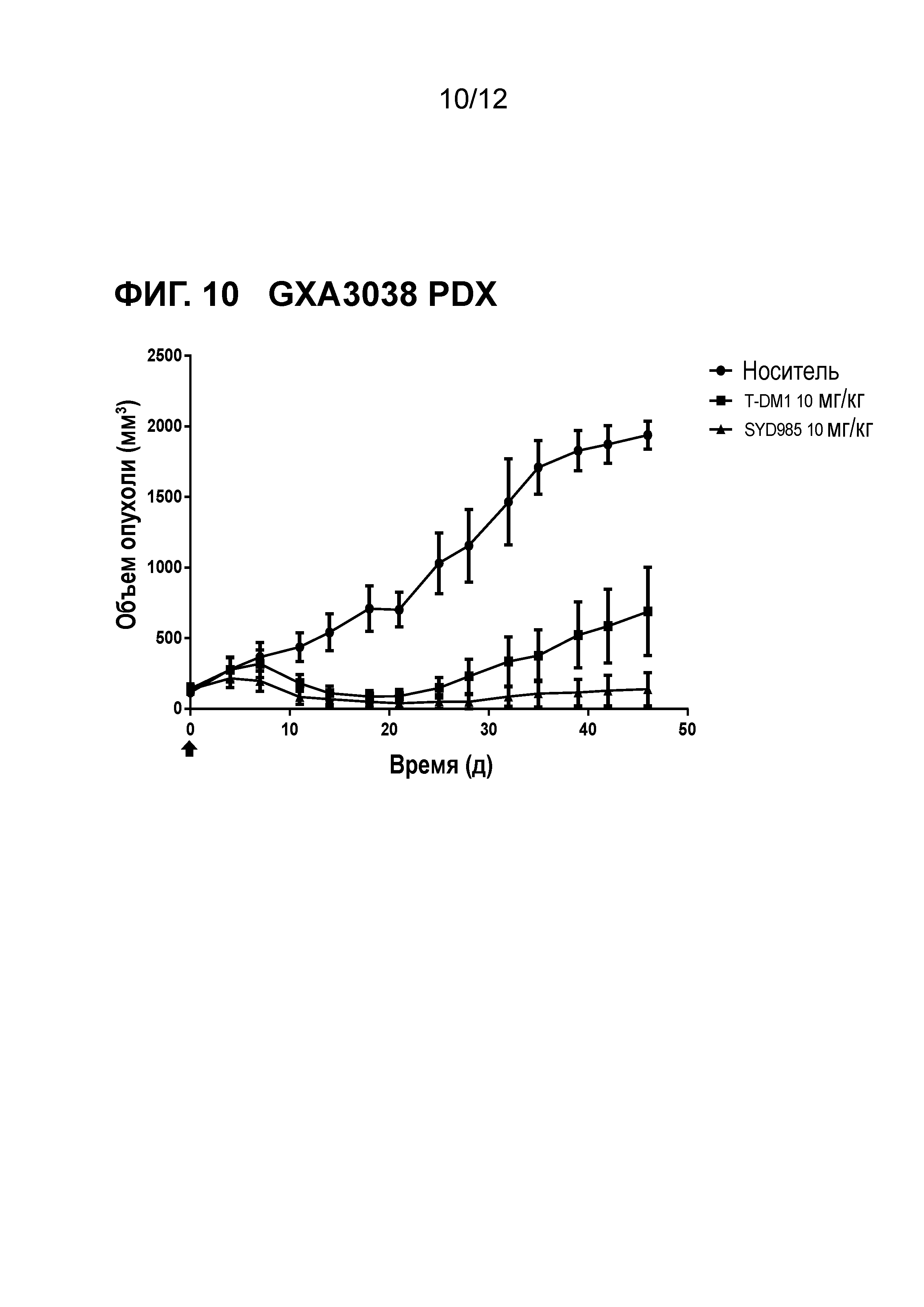
Фигура 10. Противоопухолевая активность SYD985 по сравнению с T-DM1 в GXA3038 модели PDX (рак желудка, HER2 IHC 2+, HER2 FISH негативный) (CRO: Oncotest).
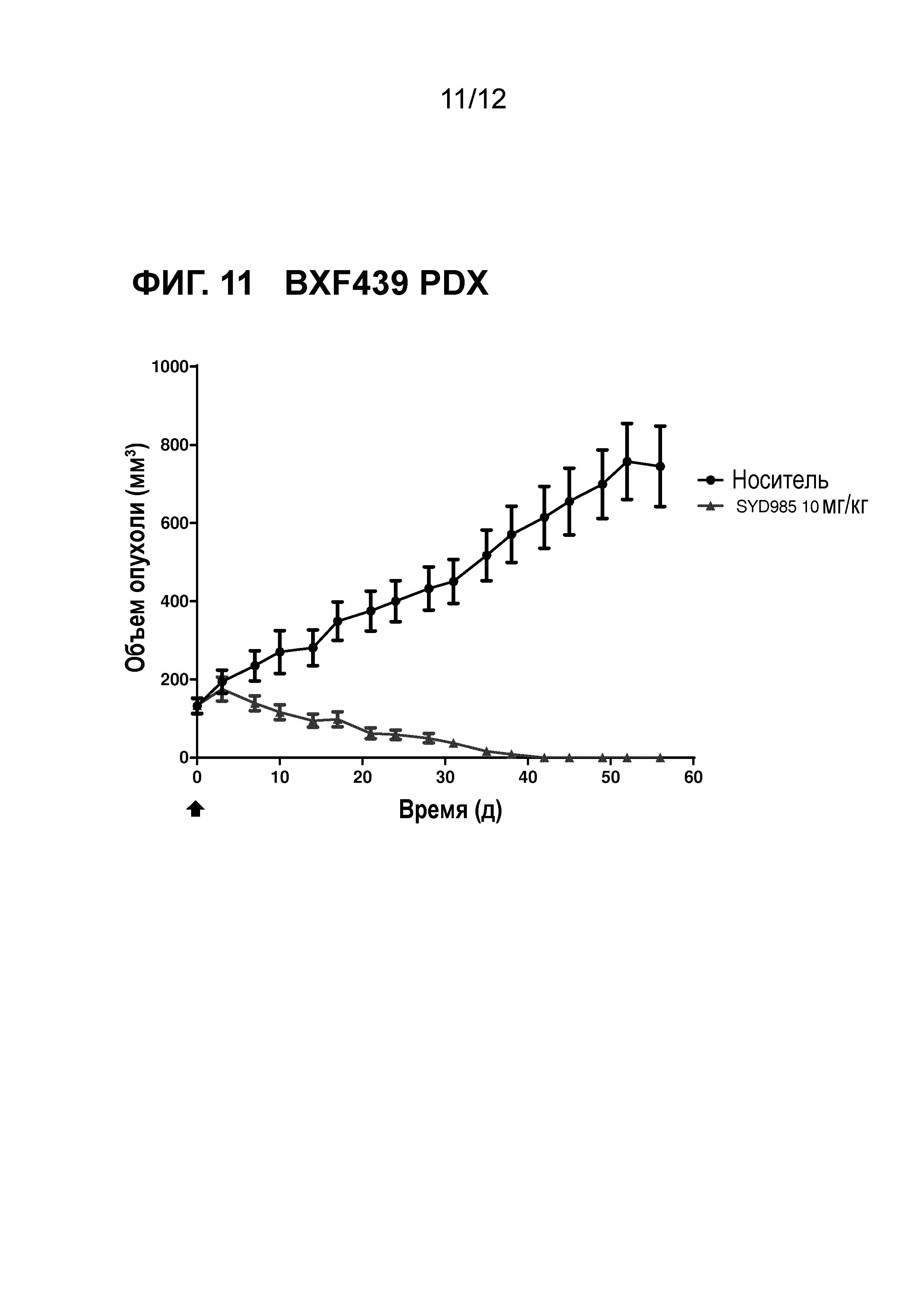
Фигура 11. Противоопухолевая активность SYD985 в BXF439 модели PDX (рак мочевого пузыря, HER2 IHC 3+, HER2 FISH позитивный) (CRO: Oncotest).
Фигура 12. Противоопухолевая активность SYD983 в полученной из клеточной линии SKOV3 ксенотрансплантатной модели (рак яичников, HER2 IHC 2+, HER2 FISH позитивный) (CRO: Piedmont).
Подробное описание настоящего изобретения
Настоящее изобретение относится к содержащим дуокармицин ADC для применения в лечении человеческих солидных опухолей и гематологических злокачественных опухолей, экспрессирующих HER2.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I):

в которой
Ат анти-HER2 представляет собой анти-HER2 антитело или фрагмент антитела,
n составляет 0-3, предпочтительно 0-1,
m представляет среднее DAR (соотношение лекарственное средство/антитело) от 1 до 4,
R1 выбран из

2
y составляет 1-16, и
R2 выбран из

для применения в лечении человеческих солидных опухолей и гематологических злокачественных новообразований, экспрессирующих HER2, в частности для применения в лечении человеческих солидных опухолей.
В другом варианте осуществления настоящее изобретение относится к соединению формулы (I), в которой анти-HER2 Ат представляет собой анти-HER2 антитело или фрагмент антитела, n составляет 0-1, m представляет среднее DAR от 1 до 4, предпочтительно от 2 до 3, R1 выбран из

y составляет 1-16, предпочтительно 1-4, и R2 выбран из

В дополнительном варианте осуществления настоящее изобретение относится к соединению формулы (I), в которой анти-HER2 Ат представляет собой моноклональное анти-HER2 антитело, n представляет собой 0-1, m представляет собой среднее DAR от 2 до 3, предпочтительно от 2,5 до 2,9, R1 выбран из

y составляет 1-4, и R2 выбран из

В еще одном варианте осуществления настоящее изобретение относится к соединению формулы (I), в которой анти-HER2 Ат представляет собой трастузумаб или его биоаналог, n представляет собой 0-1, m представляет собой среднее DAR от 2 до 3, предпочтительно от 2,5 до 2,9, R1 выбран из

y составляет 1-4, и R2 выбран из

В предпочтительном варианте осуществления настоящее изобретение относится к соединению формулы (II), содержащей трастузумаб или его биоаналог.

Соединение формулы (II), которое называется в данном описании SYD985, имеет среднее DAR от 2,6 до 2,9. SYD983 формулы (II) имеет среднее DAR 2,0.
В структурной формуле, показанной в настоящем описании, n представляет собой целое число от 0 до 3, тогда как m представляет собой среднее соотношение лекарственное средство/антитело (DAR) от 1 до 4. Как хорошо известно в данной области DAR и распределение нагрузки лекарственного средства могут быть определены, например, посредством применения хроматографии гидрофобных взаимодействий (ХГВ) или обращенно-фазной высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ). В частности ХГВ пригодна для определения среднего DAR.
Примеры человеческих солидных опухолей, которые могут быть подвергнуты лечению в соответствии с настоящим изобретением, являются рак молочной железы, рак желудка, рак мочевого пузыря, рак яичников, рак легких, рак простаты, рак поджелудочной железы, колоректальный рак, плоскоклеточный рак головы и шеи и остеосаркома, в частности рак молочной железы, рак желудка, рак мочевого пузыря, рак яичников, рак легких и рак простаты, в наиболее частном случае рак молочной железы, рак желудка, и рак мочевого пузыря (см. также S. Scholl et al., 2001, Ann. Oncol., 12(1): S81-S87). Примером гематологической злокачественной опухоли, которая может быть подвержена лечению в соответствии с настоящим изобретением, является острый лимфобластный лейкоз (ALL). Однако объем настоящего изобретения не ограничен этими конкретными примерами.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I) или (II) для применения в лечении рака молочной железы, рака желудка или рака мочевого пузыря, в частности рака молочной железы или рака желудка, в наиболее частном случае рака молочной железы. Указанный рак молочной железы является или гормон-рецептор (ER и/или PR) позитивным или негативным, преимущественно ER и PR негативным.
В другом варианте осуществления настоящее изобретение относится к соединению формулы (I) или (II) для применения в лечении человеческих солидных опухолей, демонстрирующих умеренную или низкую экспрессию HER2 (т.е., HER2 IHC 2+ или 1+).
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы (I) или (II) для применения в лечении человеческих солидных опухолей без амплификации гена HER2 (т.е., HER2 FISH негативные).
Неожиданно авторы настоящего изобретения обнаружили, что содержащие дуокармицин ADC соединения настоящего изобретения могут быть применены в частности для лечения человеческих солидных опухолей, в особенности рака молочной железы и рака желудка, с умеренной или низкой экспрессией HER2 (т.е., HER2 IHC 2+ или 1+) и/или без амплификации гена HER2 (т.е., HER2 FISH негативный). Ни для трастузумаба, ни для T-DM1 не было получено разрешение для продажи для лечения пациентов, имеющих такие опухоли. Кроме того, как показано в примерах и на фигурах далее в данном описании, у T-DM1 отсутствует эффективность в таких опухолях. Поэтому, содержащие дуокармицин ADC соединения настоящего изобретения могут быть применены для лечения групп пациентов, для которых в настоящее время не существует нацеленной на HER2 терапии. Содержащие дуокармицин ADC соединения, которые тестировали на мышах, несущих N87 (т.е., HER2 IHC 3+ опухоль желудка) ксенотрансплантат в примере 15 W02011/133039A, действительно демонстрировали эффективность после одиночной внутривенной дозы 12 мг/кг. Однако, ничто в данном документе не предполагает, что специалист в данной области не может протестировать отдельно для обнаружения эффективности в экспрессирующих HER2 в меньшей степени опухолях (т.е., HER2 IHC 2+ или 1+) и/или без амплификации гена HER2 (т.е., HER2 FISH негативный), уже с дозой 3 мг/кг.
Авторы настоящего открытия дополнительно неожиданно обнаружили, что содержащие дуокармицин ADC соединения формулы (I) или (II) демонстрируют улучшенную противоопухолевую активность in vivo в животных опухолевых моделях по сравнению с T-DM1 (см. примеры и фигуры) и трастузумабом при введении с такой же дозой. Стоит отметить, что было обнаружено, что улучшение было наиболее высоким в опухолевой модели с наиболее низкой степенью экспрессии HER2 (т.е., IHC HER2 1+), в частности в (трижды негативном) раке молочной железы и раке желудка.
В одном варианте осуществления настоящего изобретения, обеспечено преимущество, заключающееся в том, что человеческая солидная опухоль представляет собой рак молочной железы или рак желудка, демонстрирующие умеренную или низкую экспрессию HER2 (т.е., HER2 IHC 2+ или 1+) без амплификации гена HER2 (т.е., HER2 FISH негативный).
В частном варианте осуществления настоящего изобретения обеспечено преимущество, заключающееся в том, что человеческий солидная опухоль представляет собой трижды негативный рак молочной железы (т.е., HER2 IHC 2+ или 1+, HER2 FISH негативный, и ER и PR негативный).
Как правило, противоопухолевая активность бывает оценена сперва в (человеческой) линии опухолевых клеток in vitro с последующей оценкой in vivo. Противоопухолевая активность ADC, попадающих в объем настоящего изобретения с обеспечением преимущества, бывает оценена на животных моделях, как правило, на иммунодефицитных мышах, несущих подкожный ксенотрансплантат. Ксенотрансплантат может представлять собой (человеческую) линию опухолевых клеток или полученную у пациента (первичную) опухоль. Предпочтительно, животная модель представляет собой модель полученного у пациента опухолевого ксенотрансплантата (PDX).
Человеческие опухоли в моделях PDX сохраняют биологические характеристики исходной опухоли, как оценено посредством микроскопического исследования. Модели PDX в настоящее время применяют рутинно во многих научных учреждениях, и их предлагают на коммерческой основе Контрактно-исследовательские организации (CRO), включая Jackson Lab (USA), Oncotest (Germany), Molecular Response (USA), Charles River (USA), Oncodesign (France), XenTech (France), Champions Oncology (USA) и Start (USA). Многие продемонстрировали сохранение характеристик морфологических и иммуногистохимических свойств исходной человеческой опухоли в ксенотрансплантате. Помимо близкого сходства с точки зрения биологических характеристик модели PDX имеют очень хорошее прогностическое значение для терапевтических клинических результатов. В целом, можно констатировать, что сообщения из различных источников указывают, на по меньшей мере 90% корректной репликации при ответе на терапию в PDX по сравнению с репликацией у пациента, как с точки зрения чувствительности, так и невосприимчивости опухоли на терапию (Website Champions Oncology, http://www.championsoncology.com/translational-oncology-solutions/predictive-value; Fiebig et al., 1984, Behring Inst. Mitt. 74:343-352; Hidalgo et al., 2011, Mol. Cancer Ther. 10:1311-1316).
В соответствии с настоящим изобретением анти-HER2 антитело или фрагмент антитела может представлять собой любое антитело или фрагмент антитела, способные связывать HER2, напр., антитело, IgG1 имеющее определяющие комплементарность области (CDR) трастузумаба, или антитело, которое демонстрирует конкурентное связывание с трастузумабом. Предпочтительное антитело представляет собой моноклональное анти-HER2 антитело. Особенно предпочтительное моноклональное антитело представляет собой трастузумаб или его биоаналог.
Конъюгатные соединения антитело-лекарственное средство (ADC) формулы (I) и (II) в соответствии с настоящим изобретением имеют линкерное лекарственное средство конъюгированное с антителом через атом S цистеинового остатка, т.е., они представляют собой связанные цистеином конъюгаты антитело-лекарственное средство. Цистеиновый остаток может представлять собой или природный цистеиновый остаток, который представлен в тяжелой и/или легкой цепи антитела (Ab) и образует внутрицепочечные дисульфидные связи, или сконструированный цистеиновый остаток, который введен в Ат в одном или более пригодных положений в тяжелой и/или легкой цепи. Настоящее изобретение в частности относится к ADC соединениям, в которых линкерное лекарственное средство конъюгировано через внутрицепочечные дисульфидные связи Ат, в наиболее частном случае моноклональных Ат (мАт). Антитела различных классов антител содержат различные количества внутрицепочечных дисульфидных связей. Например, антитела IgG1, как правило, имеют четыре внутрицепочечные дисульфидные связи, при этом все четыре расположены в шарнирной области, и после (частичного) восстановления дисульфидных связей линкерное лекарственное средство бывает случайным образом присоединено к свободным тиольным группам.
Соединения формулы (I) и (II) для применения в соответствии с настоящим изобретением могут быть получены в соответствии со способами и процедурами, хорошо известными специалисту в данной области. Конъюгирование посредством внутрицепочечных дисульфидных связей может происходить после полного или частичного восстановления указанных дисульфидных связей. Пригодные способы для приготовления таких соединений можно обнаружить в описании и примерах заявителя W02011/133039A. В частности, пример 15 W02011/133039A описывает частичное восстановление трастузумаба для генерирования 2 свободных тиольных групп в расчете на мАт и конъюгирование с набором линкерных лекарственных средств к ADC, имеющих среднее DAR прибл. 2. Специалист в данной области без труда поймет, как получить ADC, имеющие среднее DAR от 1 до 4. Примеры 7 и 8 W02005/084390A описывают стратегии частичного восстановления, частичного восстановления/частичного повторного окисления, и полного восстановления для (частичной) нагрузки антител с линкерным лекарственным средством vcMMAE.
Статус IHC и FISH опухолевой ткани бывает определен с применением известных тестов, процедур и оборудования. В соответствии с настоящим изобретением амплификация гена HER2 может быть измерена с применением или флуоресценции (FISH), или хромогенного (CISH), или любого другого гибридизационного теста in situ. Пригодные тесты для определения статуса мембранной экспрессии HER2 опухолевой ткани, подобные HercepTest™ (Dako Denmark), доступны коммерчески. Дополнительно IHC тесты HER2 продаются Ventana Medical Systems (PATHWAY анти-HER2/neu), Biogenex Laboratories (InSite™ HER2/neu) и Leica Biosystems (Bond Oracle™ HER2 IHC). Тесты FISH/CISH могут быть получены у Abbott Molecular (PathVysion HER2 DNA Probe Kit), Life Technologies (SPOT-Light® HER2 CISH Kit), Dako Denmark (HER2 CISH PharmDx™ Kit), Dako Denmark (HER2 FISH PharmDx™ Kit), и Ventana Medical Systems (INFORM HER2 Dual ISH ДНК Probe Cocktail). FISH позитивный означает соотношение FISH амплификации >2,0 (напр., посредством применения тестового набора Dako HER2 FISH PharmDX™). FISH негативный означает соотношение FISH амплификации <2,0.
Экспрессирующие HER2 опухоли, которые могут быть с преимуществом подвергнуты лечению в соответствии с настоящим изобретением представляют собой рак молочной железы и рак желудка, в частности рак молочной железы, в наиболее частном случае о трижды негативный рак молочной железы. Неожиданно, авторы настоящего открытия обнаружили, что ADC соединения в соответствии с настоящим изобретением были особенно эффективны в моделях рака молочной железы PDX, которые представляют собой HER2 IHC 2+ или 1+ и FISH негативные, в трижды негативных моделях рака молочной железы PDX и в моделях рака желудка PDX, которые представляют собой HER2 IHC 2+ или 1+ и FISH негативные, как показано в примерах и фигурах далее в данном описании. Принимая во внимание факт, что модели PDX имеют очень хорошее прогностическое значение для терапевтических клинических результатов, эти обнаружения в частности предлагают новый вариант нацеленного на HER2 лечения для рака молочной железы и желудка, для которых в настоящее время не существует такого одобренного варианта лечения.
Настоящее изобретение также относится к применению соединения формулы (I) или (II) для лечения пациентов, имеющих человеческие солидные опухоли или гематологические злокачественные опухоли, экспрессирующие HER2, в частности человеческие солидные опухоли, которые представляют собой HER2 IHC 2+ или 1+ и/или которые представляют собой HER2 FISH негативные, как описано в данном описании выше.
Настоящее изобретение дополнительно относится к применению комбинации соединения формулы (I) или (II) с терапевтическим антителом и/или химиотерапевтическим агентом, для лечения человеческих солидных опухолей и гематологических злокачественных опухолей, экспрессирующих HER2, в частности человеческих солидных опухолей, в наиболее частном случае для лечения трижды негативного рака молочной железы.
В одном варианте осуществления настоящего изобретения терапевтическое антитело представляет собой пертузумаб, бевацизумаб, рамуцирумаб или трастузумаб и химиотерапевтический агент представляет собой i) таксан, в частности доцетаксел, паклитаксел, набпаклитаксел или кабазитаксел, ii) ингибитор митоза, в частности эрибулин, винорелбин или винбластин, iii) разрушающий ДНК агент, в частности 5-фторурацил, капецитабин, гемцитабин, темозоломид, цисплатин, карбоплатин, оксалиплаин, циклофосфамид или ифосфамид, iv) антифолат, в частности пеметрексед или метотрексат, v) антрациклин, в частности митоксантрон, доксорубицин, липосомальный доксорубицин, эпирубицин, даунорубицин или валрубицин, в наиболее частном случае доксорубицин, vi) mTOR (мишень рапамицина в клетках млекопитающих) ингибитор, в частности темсиролимус или эверолимус, vii) ингибитор топоизомеразы, в частности иринотекан или топотекан, viii) ингибитор тирозинкиназы, в частности гефинитиб, эрлотиниб, пазопаниб, кризотиниб, лапатиниб или афатиниб, ix) модулирующий андрогенный рецептор агент, в частности энзалутамид или ацетат абиратерона, x) стероидный гормон, в частности преднизон, xi) гормональный терапевтический агент, в частности тамоксифен, xii) ингибирующий ароматазу или стероидный модифицирующий агент, в частности анастрозол, летрозол, фулвестрант или эксеместан, или xiii) ингибитор PARP, в частности олапариб. Специалист в данной области не испытает затруднений при выборе пригодных комбинационных терапий для применения в лечении человеческих солидных опухолей и гематологических злокачественных опухолей, экспрессирующих HER2.
В другом варианте осуществления настоящего изобретения терапевтическое антитело представляет собой пертузумаб и химиотерапевтический агент представляет собой таксан, в частности доцетаксел или паклитаксел, или антрациклин, в частности доксорубицин, эпирубицин, даунорубицин или валрубицин, в наиболее частном случае доксорубицин.
Настоящее изобретение дополнительно относится к применению комбинации соединений формулы (I) или (II) с другим ADC, таким как, например, T-DM1, для лечения человеческих солидных опухолей и гематологических злокачественных опухолей, экспрессирующих HER2, в частности человеческих солидных опухолей, экспрессирующих HER2.
Настоящее изобретение дополнительно относится к фармацевтической композиции, содержащей соединение формулы (I) или (II) или комбинацию с терапевтическим антителом и/или его химиотерапевтическим агентом, как описано в данном описании выше, и одно или более фармацевтически приемлемых вспомогательных веществ.
Характерные фармацевтические составы терапевтических белков, такие как моноклональные антитела и (моноклональные) конъюгаты антитело-лекарственное средство, имеют форму лиофилизированных порошков или таблеток, для которых требуется (водное) растворение (т.е., ресуспендирование) перед внутривенным вливанием, или замороженные (водные) растворы, для которых требуется оттаивание перед применением. В частности, в соответствии с настоящим изобретением фармацевтическая композиция представлена в форме лиофилизированной таблетки.
Пригодные фармацевтически приемлемые вспомогательные вещества для включения в фармацевтическую композицию (перед высушиванием вымораживанием) в соответствии с настоящим изобретением включают буферные растворы (напр., содержащие цитрат, гистидин или сукцинат соли в воде), лиопротекторы (напр., сахароза, трегалоза), регуляторы тоничности (напр., хлорид натрия), поверхностно-активные вещества (напр., полисорбат) и объемообразующие агенты (напр., маннит, глицин). Вспомогательные вещества, применяемые для высушенных вымораживанием белковых составов, выбраны исходя из их способности предотвращать денатурацию белка во время процесса высушивания вымораживанием, а также во время хранения.
Стерильный, лиофилизированный порошок многодозового состава Herceptin™ содержит 440 мг трастузумаба, 400 мг дигидрата α,α-трегалозы, 9,9 мг L-гистидин HCl, 6,4 мг L-гистидина и 1,8 мг полисорбата 20, USP. Ресуспендирование с 20 мл бактериостатической или стерильной воды для инъекции (BWFI или SWFI) приводит в результате к многодозовому раствору, содержащему 21 мг/мл трастузумаба при pH приблизительно 6. Стерильный лиофилизированный порошковый состав однократного использования Kadcyla™ содержит при ресуспендировании 20 мг/мл адотрастузумаб эмтанзина, 0,02% мас./об. полисорбата 20, 10 мМ сукцината натрия и 6% мас./об. сахарозы с pH 5,0.
Терапевтически эффективное количество соединения формулы (I) или (II) для применения в соответствии с настоящим изобретением лежит в диапазоне от приблизительно 0,01 до приблизительно 15 мг/кг масса тела, в частности в диапазоне от приблизительно 0,1 до приблизительно 10 мг/кг, в наиболее частном случае в диапазоне от приблизительно 0,3 до приблизительно 10 мг/кг масса тела. Этот последний диапазон ориентировочно соответствует фиксированной дозе в диапазоне от 20 до 800 мг соединения ADC. Соединение настоящего изобретения вводят еженедельно, раз в две недели, раз в три недели или раз в месяц, например, еженедельно в первые 12 недель и затем каждые три недели пока заболевание прогрессирует. Альтернативные режимы лечения могут быть применены в зависимости от тяжести заболевания, возраста пациента, вводимого соединения и таких других факторов, которые посчитает соответствующими лечащий врач.
Примеры
Тестирование амплификации гена PDX HER2
Амплификацию гена HER2 определяли гибридизацией in situ (ISH) зафиксированных в формалине, залитых парафином образцов ткани человеческого рака молочной железы с применением одобренных FDA тестов от Ventana Medical Systems (INFORM HER2 Dual ISH DNA Probe Cocktail) или Abbott Molecular (PathVysion HER2 DNA Probe Kit). Примененные протоколы были такими, как подробно описано поставщиками тестов.
Окрашивание PDX HER2 IHC
Готовили тканевые срезы фиксированных в формалине, залитых парафином ксенотрансплантатных опухолевых образцов. HER2 связывали посредством применения пригодного Ат, к примеру поликлонального кроличьего анти-человеческого HER2 (DAKO Cat# A0485) антитела и детектировали пригодным вторичным Ат, к примеру биотинилированным козьим анти-кроличьим IgG (Jacksonlmmuno research, Cat# 111-065-04) и набором Biozol (Cat # VEC-PK-4000) ABC. Окрашивание оценивали полуколичественно на пригодном микроскопе, к примеру, с применением микроскопа Zeiss Axiovert 35. Окрашивание интерпретирвали как иммунореактивность, на основании количества окрашенных опухолевых клеток, а также завершенности и интенсивности окрашивания мембраны.
0: <10% опухолевых клеток проявляют мембранное окрашивание.
1: >10% опухолевых клеток проявляют мембранное окрашивание, но неполное окрашивание поверхности.
2: >10% опухолевых клеток проявляют слабое или умеренное мембранное окрашивание, распределенное по всей поверхности.
3: >30% опухолевых клеток проявляют сильное мембранное окрашивание, распределенное по всей поверхности.
Известные HER2 позитивные (IHC 3+) и HER2 негативные (IHC 0) препараты контрольных опухолей включали в каждую процедуру HER2 окрашивания.
PDX и исследования на животных полученного из клеточных линий ксенотрансплантата
Все исследования на животных были одобрены местными этическими комитетами по работе с животными и выполнены в соответствии с местными этическими рекомендациями для экспериментирования на животных. Применяли самок иммунодефицитных мышей nu/nu (возрастом 4-6 недели) или мышей SCID от специализированных разводителей животных, подобных Harlan или Charles River, и выполняли рандомизацию в соответствии с подробными протоколами соответствующих CRO, как описано, к примеру, в Fiebig et al. Cancer Genomics & Proteomics 4: 197-210, 1997.
Все исследования молочной железы и желудочные PDX исследования выполняли с тестированием SYD985 непосредственно с T-DM1, так как последний ADC был одобрен для лечения пациентов с HER2-позитивным метастатическим раком молочной железы, и разрешением для T-DM1 при HER2-позитивном раке желудка. Исследования при других показаниях (мочевой пузырь и яичники) осуществляли с применением только SYD985, так как T-DM1 не является разрешенным лекарственным средством при этих показаниях. Мышей подвергали лечению или с носителем, 3 мг/кг SYD985, или с 3 мг/кг T-DM1 во всех моделях PDX молочной железы (Фигуры 1-6) и с носителем, 10 мг/кг SYD985 или 10 мг/кг T-DM1 во всех желудочных моделях PDX (Фигуры 7-10). Мышей подвергали лечению с носителем или 10 мг/кг SYD985 в модели PDX мочевого пузыря (Фигура 11) и с носителем или 15 мг/кг SYD983 в полученной из клеточных линий яичниковой ксенотрансплантатной модели (Фигура 12). Все обработки осуществляли в день 0 посредством введения одиночной дозы внутривенной инъекцией в хвостостовую вену. Данные отображены в виде среднего объема опухоли±S.D., состоят из 6-8 животных на экспериментальную группу. Массу тела и размер опухоли измеряли два раза в неделю. Объем опухоли определяли посредством двухразмерного измерения с мерными вилками. Критерии окончания включали в себя среди прочего объем опухоли >2000 мм или потерю массы тела >30%. Размер опухоли индивидуальных животных обрабатывали с применением GraphPad Prism. Результаты показаны на фигурах 1-12.
Первое клиническое исследование на людях
Фаза I первого клинического исследования на людях из двух частей (размноженные когорты) с конъюгатом антитело-лекарственное средство SYD985 (трастузумаб vc-seco-DUBA) выполняется для оценки безопасности, фармакокинетики и эффективности на пациентах с местно-распространенными или метастатическими солидными опухолями (т.е., NCT02277717). Часть I представляет собой часть с эскалацией дозы, в которой низкая доза SYD985 приведена для трех пациентов с раком (самки и самцы, имеющие солидные опухоли любого происхождения). Если это хорошо переносится, более высокая доза SYD985 будет введена трем другим пациентам с раком. Это будет продолжаться до тех пор, когда дополнительное повышение больше не будет являться безопасным. В части II исследования некоторые группы пациентов с конкретным типом рака (включая опухоли молочной железы и желудочные опухоли) получат дозу SYD985, выбранную для дополнительной разработки. Все пациенты из обеих частей исследования (по оценкам, в общем, будут задействованы 76 пациентов) получат SYD985 (внутривенные) вливания каждые три недели вплоть до развития прогрессии рака или неприемлемой токсичности.
Реферат
Изобретение относится к применению содержащих дуокармицин конъюгатов антитело-лекарственное средство (ADC) формулы (II) для лечения человеческих солидных опухолей, экспрессирующих HER2, при этом указанная человеческая солидная опухоль, экспрессирующая HER2, представляет собой HER2 IHC 2+ или 1. Преимущество конъюгатов заявленного изобретения заключается в возможности их применения для лечения трижды негативного рака молочной железы (TNBC). 7 з.п. ф-лы, 12 ил., 1 пр.
Формула

Документы, цитированные в отчёте о поиске
Новые конъюгаты аналогов сс-1065 и бифункциональные линкеры

Комментарии