Рекомбинантные белки эластазы и способы их получения и применения - RU2611200C2
Код документа: RU2611200C2
Чертежи



















































































































Описание
В настоящем изобретении испрашивается приоритет предварительной заявки на патент США № 60/992319, поданной 4 декабря 2007, содержание которой во всей своей полноте вводится в настоящее описание посредством ссылки.
1. Область, к которой относится изобретение
Настоящее изобретение относится к рекомбинантным способам изготовления и получения белков эластазы, применяемым для лечения и предупреждения заболеваний биологических каналов. Настоящее изобретение также относится к новым рекомбинантным белкам эластазы и к фармацевтическим композициям, содержащим указанные белки. Кроме того, настоящее изобретение относится к применению фармацевтических композиций, содержащих рекомбинантные белки эластазы, для лечения и предупреждения заболеваний биологических каналов.
2. Предшествующий уровень техники
Эластин представляет собой белок, способный к спонтанному образованию тяжей после его растяжения. Перекрестно-связанный эластин представляет собой главный структурный компонент эластичных волокон, которые сообщают ткани эластичность. Протеиназа может называться эластазой, если она обладает способностью солюбилизировать зрелый перекрестно-связанный эластин (Bieth, JG “Elastases: catalytic and biological properties,” at pp. 217-320 (Mecham Edition, Regulation of Matrix Accumulation, New York, Academic Press, 1986). В нескольких опубликованных патентных заявках (WO 2001/21574; WO 2004/073504; и WO 2006/036804) указывается, что эластаза, взятая отдельно и в комбинации с другими агентами, может оказывать благоприятное действие при лечении заболеваний биологических каналов, включая биологические каналы, которые подвергаются, или могут подвергаться обструкции и вазоспазмам. При лечении человека с применением эластазы, в целях снижения риска иммунной реакции на не-человеческую эластазу, желательно использовать эластазу человека.
Однако в настоящее время не существует каких-либо коммерчески доступных способов получения биологически активной эластазы в достаточно чистой форме и в количестве, достаточном для ее клинического применения. Поскольку эластазы являются эффективными протеазами, которые могут гидролизовать различные белки, не являющиеся эластином, то протеолитическая активность эластазы может создавать проблемы при ее продуцировании рекомбинантными методами. Так, например, активность зрелой эластазы может приводить к повреждению клеток-хозяев, экспрессирующих эту эластазу, к ее собственной деградации или к расщеплению агентов, используемых для облегчения продуцирования или характеризации данной эластазы.
Эластазы часто экспрессируются как препробелки, содержащие сигнальный пептид, пептид активации и зрелую активную часть. Отщепление сигнальной последовательности после секреции приводит к образованию пробелка, который может обладать незначительной ферментативной активностью или вообще не обладать такой активностью, и который имеет аминокислотную последовательность, содержащую пептид активации и зрелый белок. Вообще говоря, при рекомбинантной экспрессии, вместо зрелого активного фермента может быть экспрессирован неактивный предшественник во избежание повреждения клеток, которые экспрессируют этот фермент. Так, например, в патенте США No. 5212068 описано клонирование кДНК панкреатической эластазы человека (называемой там эластазой «IIA», «IIB», «IIIA» и «IIIB»). Различные эластазы были экспрессированы как полноразмерные кДНК, включающие нативные сигнальные последовательности, в COS-1 млекопитающих. Кроме того, сконструированные варианты эластазы, содержащие сигнальную последовательность B. subtilis и сигнальную последовательность β-галактозидазы, были также экспрессированы в B. subtilis и E. coli, соответственно. В патенте США No. 5212068 было также высказано предположение о возможности экспрессии эластаз в S. cerevisiae. В общих чертах, рабочие примеры экспрессии эластазы, приведенные в патенте США No. 5212068 показали, что выделенная эластаза, обладает низкой активностью, либо для получения активной эластазы требуется проведение стадии активации, включающей обработку трипсином. Кроме того, при экспрессии в E. coli, эластазы в большом количестве присутствуют в тельцах включения и лишь небольшое количество экспрессированных эластаз являются растворимыми и активными. Ни один из эластазных препаратов, описанных в патенте США No. 5212068, не был очищен до фармацевтически приемлемой чистоты.
Таким образом, необходимо разработать методы рекомбинантного продуцирования, которые позволяли бы получать терапевтическое количество биологически активных эластаз фармацевтической чистоты и, предпочтительно, позволяли бы избежать проведения стадии активации трипсином, которая является слишком дорогостоящей для ее крупномасштабного применения и может приводить к загрязнению конечного продукта трипсином. Введение трипсинсодержащей эластазы пациенту может приводить к активации активированных протеазой рецепторов 1 и 2, что будет снижать некоторые благоприятные эффекты при лечении эластазы.
Цитирование любой работы или ссылка на нее в разделе 2 или в любом другом разделе настоящей заявки не должно быть истолковано как указание на то, что цитируемая работа является прототипом настоящего изобретения.
3. Описание сущности изобретения
Настоящее изобретение относится к новым эффективным способам получения рекомбинантных белков эластазы и к применению таких рекомбинантных белков в композициях, например, в фармацевтических композициях, эластазных препаратах или лекарственных формах, в целях лечения и предупреждения заболеваний биологических каналов.
Настоящее изобретение относится к аутоактивированным пробелкам эластазы; к нуклеиновым кислотам, кодирующим аутоактивированные пробелки эластазы; к клеткам-хозяевам, содержащим указанные нуклеиновые кислоты; к способам получения аутоактивированных пробелков эластазы и к применению аутоактивированных пробелков эластазы в целях получения зрелых биологически активных белков эластазы, например, к их применению в фармацевтических композициях. Используемый здесь термин «ауто-активированный» (или «аутоактивированный») является синонимом термина «аутоактивирующийся», «самоактивирующийся» и «самоактивированный», и означает, что в данном случае не проводится какая-либо стадия активации. Используемый здесь термин «активация» является синонимом термина «превращение» и не означает, что белок, полученный в результате «активации», обязательно должен обладать ферментативной активностью.
Используемый ниже термин «эластаза», если это не оговорено особо, по существу, означает зрелый белок эластазы, обладающий эластазной активностью, а также незрелый белок эластазы, включая незрелый белок проэластазы (также называемый здесь белком проэластазы) и незрелые белки препроэластазы (также называемые здесь белками препроэластазы).
Предпочтительными эластазами согласно изобретению являются панкреатические эластазы типа I, например, панкреатическая эластаза типа I человека и панкреатическая эластаза типа I свиней. Панкреатические эластазы типа I иногда называются здесь «эластаза-1», «эластаза I», «эластаза типа 1», или «ELA-1». Панкреатическая эластаза типа I человека также называется здесь hELA-1 или ELA-1 человека, а панкреатическая эластаза типа I свиней также называется здесь pELA-1 или ELA-1 свиней.
Зрелый белок эластазы согласно изобретению обычно имеет аминокислотную последовательность, кодируемую природным геном эластазы, или вариант такой последовательности. Предпочтительные варианты последовательностей, включая варианты, содержащие аминокислотные замены, описаны в настоящей заявке. Белок проэластазы представляет собой крупный неактивный предшественник зрелого белка эластазы, а белок препроэластазы также содержит сигнальную последовательность для секреции белка. Пре- и про-последовательности белков эластазы согласно изобретению обычно не являются нативными для генов эластазы, кодирующих зрелые белки эластазы согласно изобретению. Таким образом, в известным смысле, незрелые белки эластазы согласно изобретению являются «химерными» белками, где их зрелые части кодируются природным геном эластазы, а их незрелые части кодируются не-эластазными генными последовательностями.
Для облегчения сравнения, белки эластазы согласно изобретению и их компоненты коровой последовательности представлены на фигуре 2. Как показано на фигуре 2, аминокислотные остатки в последовательности проэластазы, которые являются N-концевыми по отношению к расщепляемой связи (то есть связи, которая расщепляется с образованием зрелого белка эластазы), обозначаются здесь как PX, ..., Р5, P4, P3, P2 и P1, где P1 находится непосредственно у N-конца по отношению к расщепляемой связи, а аминокислотные остатки, расположенные у С-конца по отношению к расщепляемой связи (и у N-конца) зрелого белка эластазы, обозначены P1′, P2′, P3′,...,PX′, где P1′ находится непосредственно у С-конца по отношению к расщепляемой связи и представляет собой N-концевой аминокислотный остаток зрелого белка. На фигуре 2 также приводятся нижеследующие компоненты:
(1) Сигнальная последовательность: Последовательность, которая увеличивает количество экспрессируемых молекул, секретирующихся из клетки. Характерной последовательностью являются аминокислоты 1-22 SEQ ID NO:50 или 51.
(2) Пропептид+спейсер: необязательная, но предпочтительная, не-эластазная пропептидная последовательность (такая как пропропептид α-фактора дрожжей), которая может также, но необязательно, включать одну или несколько спейсерных последовательностей (пропептидные последовательности α-фактора дрожжей и спейсерные последовательности Kex2 и STE13, представленные на фигуре 1B). В конкретном варианте изобретения, пропептидная последовательность не включает спейсер.
(3) Пропептид эластазы: Пептид, который, в том случае, если он присутствует у N-конца эластазы, делает данную молекулу неактивной или менее активной по сравнению с соответствующим зрелым белком эластазы. Пропептид эластазы может быть смежным с пептидом активации, либо он может содержать дополнительные аминокислоты, связанные с пептидом активации. Характерными пропептидными последовательностями эластазы являются аминокислоты 1-10 SEQ ID NO:64 и 69.
(4) Пептид активации: Используемый здесь термин «пептид активации», который употребляется в данном описании как синонимом термина «последовательность активации», означает компонент пропептида эластазы, и может быть смежным с эластазным пропептидом. Как показано на фигуре 2, пептид активации содержит аминокислотные остатки P10-P1. Характерная консенсусная последовательность пептида активации представляет собой SEQ ID NO:80; а другими примерами последовательностей пептида активации являются SEQ ID NO: 23, 72 и 73.
(5) Последовательность распознавания: Последовательностью распознавания является компонент пропептида эластазы. Как показано на фигуре 2, последовательность распознавания содержит аминокислотные остатки Р3-Р1. Характерные консенсусные последовательности распознавания представляют собой SEQ ID NO:11-13 и 93, а характерной последовательностью распознавания является SEQ ID NO:20.
(6) Домен расщепления: Область в белке проэластазы, которая охватывает расщепляемую связь. Как показано на фигуре 2, домен расщепления содержит аминокислотные остатки P5-P3′. Характерными последовательностями домена расщепления являются SEQ ID NO:42, 43, 48, 49, 53, 53, 54 и 55.
(7) Сайт расщепления: Другая область в белке проэластазы, которая также охватывает расщепляемую связь. Как показано на фигуре 2, сайт расщепления содержит аминокислотные остатки P4-P4′. Характерной последовательностью сайта расщепления является SEQ ID NO:27.
(8) Белок препроэластазы: Белок, который может содержать все части-компоненты. Характерный белок препроэластазы может содержать пептиды SEQ ID NO:50, 51, 96 или 97, за которыми следует функционально связанный белок SEQ ID NO:64 или SEQ ID NO:69.
(9) Белок проэластазы: Белок, который содержит зрелый белок эластазы, пропептид эластазы и, необязательно, пропептид и спейсерные последовательности. Характерными последовательностями проэластазы являются SEQ ID NO:64 и 69.
(10) Зрелый белок эластазы: Белок, который, при его «правильном» процессинге, обладает эластазной активностью. Характерными зрелыми последовательностями являются SEQ ID NO:1 (последовательность человека) и SEQ ID NO:39 (последовательность свиньи).
Компоненты белка эластазы могут рассматриваться как модульные структурные элементы белков эластазы, белков проэластазы и белков препроэластазы. Так, например, настоящее изобретение относится к белку проэластазы, содержащему последовательность пропептида эластазы и зрелый белок эластазы. Пропептид эластазы может содержать пептид активации. Пропептид эластазы может также содержать последовательность распознавания эластазы. Настоящее изобретение также относится к белку проэластазы, содержащему домен расщепления или сайт расщепления в области, охватывающей область стыка между пропептидом эластазы и зрелым белком эластазы. Белки проэластазы могут также содержать сигнальную последовательность для секреции. Такие белки рассматриваются как белки препроэластазы. Белки препроэластазы могут также содержать пропептид альфа-фактора дрожжей и, необязательно, спейсерную последовательность, расположенную между сигнальной последовательностью и пропептидом эластазы. Белки эластазы согласно изобретению могут также, помимо коровых модульных компонентов, проиллюстрированных на фигуре 2, содержать и другие компоненты. Так, например, белок эластазы может содержать эпитопную метку или гистидиновую метку для очистки. Следует также отметить, что белки эластазы согласно изобретению необязательно должны содержать все компоненты, представленные на фигуре 2, а обычно, они содержат по меньшей мере один из таких компонентов (включая, например, но не ограничиваясь ими, зрелую последовательность эластазы или последовательность проэластазы), представленных на фигуре 2. Характерные белки эластазы согласно изобретению описаны в вариантах осуществления 1-12, 28-39 и 68-69 в нижеприведенном разделе 8, включая характерные белки проэластазы типа I, описанные в вариантах осуществления 13-27 в нижеприведенном разделе 8.
Настоящее изобретение охватывает нуклеиновые кислоты, кодирующие белки эластазы согласно изобретению; способы получения и очистки таких белков; рекомбинантные клетки и супернатанты клеточных культур; композиции, содержащие белки эластазы (например, фармацевтические композиции, лекарственные формы, препараты), применение белков в терапевтических целях; наборы, включающие белки, препараты; фармацевтические композиции и лекарственные формы. Нуклеиновые кислоты, кодирующие белки эластазы согласно изобретению, проиллюстрированы в вариантах осуществления 40-67 в нижеприведенном разделе 8, включая векторы (см., например, варианты осуществления 70-72). В разделе 8 также проиллюстрированы рекомбинантные клетки (см., например, варианты 73-84) и клеточные супернатанты, содержащие белки эластазы (см., например, вариант осуществления 88). Способы получения белков эластазы описаны в вариантах осуществления 89-224, 261-276 и 347-373 в разделе 8. Способы получения эластазных препаратов описаны в вариантах осуществления 225-260 в разделе 8. Способы получения фармацевтических композиций описаны в вариантах осуществления 374-385 в разделе 8. Фармацевтичсекие композиции, содержащие белки эластазы, описаны в вариантах осуществления 277-313 и 386 в разделе 8, а лекарственные формы описаны в вариантах осуществления 415-420 в разделе 8. Препараты белков эластазы описаны в вариантах осуществления 324-346 в разделе 8. Применение белков эластазы в терапевтических целях описано в вариантах осуществления 387-414 в разделе 8. Наборы, содержащие белки, описаны в вариантах осуществления 421-424 в разделе 8.
Различные аспекты изобретения, относящиеся к белкам проэластазы, имеющим последовательности SEQ ID NO:64 и 69, приводятся в разделе 8 под заголовком «Конкретные варианты осуществления изобретения», однако такие варианты осуществления могут относиться и к другим описанным здесь последовательностям белков эластазы.
Описанные здесь способы получения часто включают стадию активации, в которой пептид активации затем удаляют из проэластазной последовательности/отделяют от зрелой эластазной последовательности с получением зрелого белка эластазы. Описанными здесь стадиями активации могут быть стадии аутоактивации, то есть стадии, осуществляемые благодаря эластазной активности, или стадия, не являющаяся стадией аутоактивации, то есть стадия активации, не опосредуемая эластазой, например, стадия, осуществляемая с использованием трипсина.
В некоторых своих аспектах, настоящее изобретение относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую белок эластазы (включая, но не ограничиваются ими, белок, представленный любой из последовательностей SEQ ID NO:6-9, 64-69, 88-91 или 98-103), содержащий (i) пропептид эластазы, содержащий последовательность пептида активации, содержащую последовательность распознавания эластазы, функционально связанную с (ii) аминокислотной последовательностью белка, обладающего эластазной активностью. Этот белок также содержит, но необязательно, сигнальную последовательность, такую как сигнальный пептид α-фактора дрожжей, и представлен аминокислотной последовательностью SEQ ID NO:34, функционально связанной с указанным пропептидом эластазы. α-Фактор иногда называется здесь «альфа-фактором» или «альфа-фактором скрещивания» или «α-фактором скрещивания». В некоторых конкретных вариантах осуществления изобретения, белок содержит не-эластазный пропептид, такой как пропептид α-фактора дрожжей. В некоторых конкретных вариантах осуществления изобретения, белок может содержать одну или несколько спейсерных последовательностей. Спейсерными последовательностями могут быть, но не ограничиваются ими, сайты расщепления протеазой Kex2 и STE13. В конкретном варианте осуществления изобретения может быть использован спейсер Kex2. В другом варианте осуществления изобретения, спейсер Kex2 может быть функционально связан со спейсером STE13, как показано на фигуре 1B. Сигнальная пептидная последовательность и не-эластазная пропептидная последовательность представлены аминокислотными последовательностями SEQ ID NO:51 или 97. Пептид, содержащий сигнальную пептидную последовательность, не-эластазную пропептидную последовательность и спейсерную последовательность, представлен аминокислотными последовательностями SEQ ID NO:50 или 96.
В других конкретных вариантах осуществления изобретения, сигнальной последовательностью является секреторная сигнальная последовательность млекопитающего, такая как сигнальная последовательность эластазы типа I свиньи или человека (используемые как синонимы термина «панкреатическая эластаза типа I»).
Предпочтительно, последовательность распознавания эластазы представляет собой панкреатическую последовательность распознавания эластазы типа I.
В конкретных вариантах осуществления изобретения, белком, обладающим эластазной активностью типа I, является зрелая эластаза типа I человека, например, белок с аминокислотными последовательностями SEQ ID NO:1, 4, 5, 84 или 87.
Настоящее изобретение также относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую белок, содержащий: (i) сигнальную последовательность, функционирующую в Pichia pastoris и функционально связанную с (ii) последовательностью активации (включая, но не ограничиваясь ими, аминокислотные последовательности SEQ ID NO:23, 72, 73, или 80), содержащей последовательность распознавания протеазы (включая, но не ограничиваясь ими, любую из аминокислотных последовательностей SEQ ID NO:11-23 и 93), которая, в свою очередь, функционально связана с (iii) аминокислотной последовательностью зрелой эластазы типа I человека. В предпочтительном варианте осуществления изобретения, последовательностью распознавания протеазы является последовательность распознавания эластазы типа I человека, а наиболее предпочтительно, последовательность распознавания эластазы SEQ ID NO:20.
Настоящее изобретение также относится к белкам проэластазы (необязательно содержащим сигнальную последовательность, и таким образом, представляющим собой белки препроэластазы) и к зрелым белкам эластазы, кодируемым нуклеиновыми кислотами согласно изобретению, а также к композициям (например, к фармацевтическим композициям, препаратам и лекарственным формам), содержащим указанные зрелые белки эластазы.
В предпочтительном варианте осуществления изобретения, белок проэластазы или зрелый белок эластазы не имеют N-концевого метионинового остатка. Однако в другом варианте осуществления изобретения белок проэластазы или зрелый белок эластазы имеют такой N-концевой метиониновый остаток.
В нижеприведенной таблице 1 систематизированы идентификаторы последовательностей, используемые в описании настоящего изобретения. Предпочтительные белки согласно изобретению содержат любые, или состоят из любых последовательностей SEQ ID NO:1-32, 34, 37-73, 77, 78, 82-92 и 98-105, перечисленных ниже в таблице 1, либо они частично или полностью кодируются нуклеотидными последовательностями SEQ ID NO:33 и SEQ ID NO:81.
Существует по меньшей мере 5 подтвержденных полиморфизмов в белке эластазы типа I человека в положениях 10 (Q или H); 44 (W или R); 59 (M или V); 220 (V или L); и 243 (Q или R). Полноразмерный белок (препроэастазы) имеет длину 258 аминокислот. Первые 8 аминокислот соответствуют сигнальной или «пре»-пептидной последовательности, которая отщепляется с образованием неактивного пробелка, а другая «про»-пептидная последовательность (содержащая или состоящая из 10 аминокислот, соответствующих аминокислотам пептида активации) отщепляется с образованием активного зрелого белка. Таким образом, полиморфизм в положении 10 присутствует в пробелке, но не в зрелом белке.
В соответствии с этим, в таблице 2 представлены все возможные комбинации 5 полиморфизмов эластазы типа I человека. Настоящее изобретение относится к белкам препроэластазы и проэластазы (включая, но не ограничиваясь ими, описанные здесь варианты белков препроэластазы и проэластазы), таким как белки, описанные в вариантах осуществления изобретения 1-39 и 68-69, или белки, которые были получены или могут быть получены способом, описанным в любом из вариантов осуществления изобретения 89-224, 261-276 и 347-373, представленных в разделе 8, и имеющие любую комбинацию полиморфизмов, указанных ниже в таблице 2.
Кроме того, в таблице 3 представлены все возможные комбинации 4 полиморфизмов эластазы типа I человека, которые могут присутствовать в зрелом белке эластазы. Настоящее изобретение относится к зрелым белкам эластазы (включая, но не ограничиваясь ими, описанные здесь варианты зрелых белков эластазы), таким как зрелые белки эластазы, которые были получены или могут быть получены способом, описанным в любом из вариантов осуществления изобретения 89-224, 261-276 и 347-373, представленных в разделе 8, и имеющие любую комбинацию полиморфизмов, указанных ниже в таблице 3.
Зрелые эластазы типа I согласно изобретению могут быть очищены, например, для их применения в фармацевтических композициях. В конкретных вариантах осуществления изобретения, эластазы имеют чистоту по меньшей мере 70%, 80%, 90%, 95%, 98% или 99%.
Зрелые эластазы типа I согласно изобретению, предпочтительно, обладают специфической активностью, составляющей более чем 1, более чем 5, более чем 10, более чем 20, более чем 25 или более чем 30 ед./мг белка, как было определено путем измерения скорости гидролиза небольшого пептидного субстрата N-сукцинил-Ala-Ala-Ala-п-нитроанилида (SLAP), который катализируется при добавлении эластазы. Одна единица активности определяется как количество эластазы, которое катализирует гидролиз 1 микромоля субстрата в минуту при 30°С, а специфическая активность определяется как активность на мг белка эластазы (ед./мг). Предпочтительно, зрелая эластаза типа I человека обладает специфической активностью в интервале, нижний предел которого составляет 1, 2, 3, 4, 5, 7, 10, 15 или 20 ед./мг белка, а верхний предел независимо составляет 5, 10, 15, 20, 25, 30, 35, 40 или 50 ед./мг белка. В характерных вариантах осуществления изобретения, специфическая активность составляет в интервале от 1 до 40 ед./мг белка, от 1 до 5 ед./мг белка, от 2 до 10 ед./мг белка, от 4 до 15 ед./мг белка, от 5 до 30 ед./мг белка, от 10 до 20 ед./мг белка, от 20 до 40 ед./мг белка, или в любом другом интервале, верхний и нижний пределы которого выбраны из любых вышеуказанных величин. Зрелая эластаза типа I свиней предпочтительно, обладает специфической активностью в интервалах, нижний предел которого составляет 1, 2, 3, 4, 5, 7, 10, 15, 20, 30, 40, 50, 60, или 75 ед./мг белка, а верхний предел независимо составляет 5, 10, 15, 20, 25, 30, 35, 40, 50, 60, 75, 90, 95 или 100 ед./мг белка. В характерных вариантах осуществления изобретения, специфическая активность эластазы свиней составляет в интервалах от 10 до 50 ед./мг белка, от 20 до 60 ед./мг белка, от 30 до 75 ед./мг белка, от 30 до 40 ед./мг белка, от 20 до 35 ед./мг белка, от 50 до 95 ед./мг белка, от 25 до 100 ед./мг белка, или в любом другом интервале, верхний и нижний пределы которого выбраны из любых вышеуказанных величин.
В соответствии с этим, в некоторых своих аспектах, настоящее изобретение относится к композициям, таким как фармацевтические композиции, эластазные препараты и лекарственные формы, которые описаны в вариантах осуществления 277-314, 346, 386 и 415-420, или которые были получены или могут быть получены способом, описанным в любом из вариантов осуществления 261-276 и 374-385 в нижеприведенном разделе 8.
В некоторых вариантах осуществления изобретения, композиции согласно изобретению содержат активированные трипсином белки эластазы, например, активированные трипсином белки, полученные любым из описанных здесь способов. В других вариантах осуществления изобретения, указанные композиции содержат аутоактивированные белки эластазы, например, аутоактивированные белки эластазы, полученные любым из описанных в данном описании способов. В некоторых аспектах изобретения, композиция согласно изобретению обладает по меньшей мере одним, по меньшей мере двумя, по меньшей мере тремя, по меньшей мере четырьмя, по меньшей мере пятью, по меньшей мере шестью или по меньшей мере семью нижеследующими свойствами, а именно: (a) данная композиция не содержит трипсина; (b) данная композиция, в основном, не содержит трипсина; (c) данная композиция не содержит каких-либо белков, состоящих из SEQ ID NO:70 и 71; (d) данная композиция, в основном, не содержит каких-либо белков, состоящих из SEQ ID NO:2 и 3; (e) данная композиция не содержит бактериальных белков; (f) данная композиция, в основном, не содержит бактериальных белков; (g) данная композиция не содержит белков млекопитающих, не являющихся указанным зрелым белком эластазы; (h) данная композиция, в основном, не содержит белков млекопитающих, не являющихся указанным зрелым белком эластазы; (i) данная композиция не содержит или, в основном, не содержит одного, двух, трех или всех четырех белков, состоящих из SEQ ID NO:85, 86, 94 и 95; (j) данная композиция не содержит или, в основном, не содержит одного, двух или всех трех белков, состоящих из SEQ ID NO:106, 107 и 108; (k) данная композиция содержит фармацевтически приемлемые уровни эндотоксинов (например, 10 ЭЕ/мг эластазы или менее, или 5 ЭЕ/мг эластазы или менее); (l) зрелый белок эластазы в данной композиции обладает специфической активностью, составляющей от 1 до 40 ед./мг белка или имеющей значение в пределах любого другого интервала значений, описанных в настоящей заявке; (m) трипсиновая активность в указанной композиции соответствует менее чем 4 нг на 1 мг зрелого белка эластазы или значению в пределах любого другого интервала значений трипсиновой активности, описанных в настоящей заявке; (n) данная композиция содержит полисорбат-80; (o) данная композиция содержит декстран; (p) данная композиция содержит ионы натрия, ионы калия, ионы фосфата, ионы хлорида и полисорбат-80; (q) данная композиция содержит ионы натрия, ионы калия, ионы фосфата, ионы хлорида и декстран; (r) данная композиция содержит ионы натрия, ионы калия, ионы фосфата, ионы хлорида, полисорбат-80 и декстран; (s) зрелый белок эластазы в указанной композиции обладает определенной степенью стабильности, описанной в настоящей заявке, например, сохраняет 60%-100% своей специфической активности после хранения по меньшей мере в течение недели при 4°C, по меньшей мере в течение месяца при 4°C, по меньшей мере в течение двух месяцев при 4°C, по меньшей мере в течение трех месяцев при 4°C, или по меньшей мере в течение шести месяцев при 4°C; и (t) данная композиция содержит лекарственную форму, составляющую от 0,0033 мг до 200 мг указанного зрелого белка эластазы или любую другую лекарственную форму описанного здесь зрелого белка эластазы.
В некоторых аспектах изобретения, данная композиция обладает по меньшей мере тремя свойствами, по меньшей мере четырьмя свойствами или пятью свойствами, независимо выбранными из нижеследующих групп (i)-(v):
(i) (a), (b) или (m)
(ii) (e) или (f)
(iii) (g) или (h)
(iv) (k)
(v) (l)
В конкретных вариантах осуществления изобретения, два из указанных по меньшей мере трех или по меньшей мере указанных четырех свойств выбраны из групп (i) и (iv) или (v). В других вариантах осуществления изобретения, три из указанных по меньшей мере четырех свойств выбраны из групп (i), (iv) и (v).
В конкретных вариантах осуществления изобретения, настоящее изобретение относится к композиции, включая но не ограничиваясь ими, фармацевтическую композицию, эластазный препарат или лекарственную форму, содержащие (i) терапевтически эффективное количество эластазы типа I человека, не содержащей трипсина, и (ii) фармацевтически приемлемый носитель. Альтернативно, настоящее изобретение относится к композиции, включающей (i) терапевтически эффективное количество эластазы типа I человека, в основном, не содержащей трипсина, и (ii) фармацевтически приемлемый носитель. В конкретных вариантах осуществления изобретения, эластаза типа I человека и/или указанная композиция содержат менее чем 5 нг/мл трипсиновой активности, менее чем 4 нг/мл трипсиновой активности, менее чем 3 нг/мл трипсиновой активности, менее чем 2 нг/мл трипсиновой активности, или менее чем 1,56 нг/мл трипсиновой активности. В вышеуказанных примерах, трипсиновая активность (нг/мл) может быть проанализирована в жидкой композиции или в жидком препарате на основе эластазы типа I человека, содержащих 1 мг/мл белка эластазы типа I человека. Таким образом, трипсиновая активность может быть также выражена в миллиграммах белка эластазы, например, менее чем 3 нг трипсиновой активности/мг белка эластазы, менее чем 1,56 нг трипсиновой активности/мг белка эластазы, и т.п. Настоящее изобретение также относится к композиции, содержащей (i) терапевтически эффективное количество эластазы типа I человека и (ii) фармацевтически приемлемый носитель, где указанная композиция содержит менее чем 5 нг трипсиновой активности/мг эластазы, менее чем 4 нг трипсиновой активности/мг эластазы, менее чем 3 нг трипсиновой активности/мг эластазы, менее чем 2 нг трипсиновой активности/мг эластазы или менее чем 1,56 нг трипсиновой активности/мг эластазы.
Настоящее изобретение также относится к способам повышения качества зрелых белков эластазы, полученных методами активации трипсином (например, методами, описанными в варианте осуществления 145 в разделе 8, приведенном ниже), где указанные способы включают очистку зрелого белка эластазы на колонке со смолой Macro-Prep High S. Авторами настоящего изобретения было обнаружено, что зрелые белки эластазы, очищенные на колонке со смолой Macro-Prep High S, позволяют получить эластазные композиции с уровнями трипсиновой активности, соответствующими 20-25 нг трипсиновой активности/мг белка эластазы, а зрелые белки эластазы, очищенные на колонке Poros (поли(стирол-дивинилбензоле)), позволяют получить эластазные композиции с уровнями трипсиновой активности, соответствующими приблизительно 1000 нг трипсиновой активности/мг белка эластазы. Настоящее изобретение также относится к эластазным композициям, содержащим зрелые белки эластазы, полученные путем очистки активированных трипсином белков эластазы на колонке со смолой Macro-Prep High S. Смола Macro-Prep High S поставляется фирмой Biorad (Hercules, CA), которая поставляет колонки с жесткими метакрилатными носителями с незначительной усадкой и с небольшим уровнем набухания. Могут быть использованы и другие аналогичные катионообменные колонки того же самого класса и/или с тем же самым размером сфер (примерно 50 мкм), например, подходящими могут быть и другие колонки с метакрилатом.
В других своих аспектах, настоящее изобретение относится к композициям, включая но не ограничиваясь ими, фармацевтические композиции, эластазные препараты или лекарственные формы, содержащие панкреатическую эластазу типа I свиней. В своих конкретных вариантах осуществления, настоящее изобретение относится к композиции, включающей: (i) терапевтически эффективное количество панкреатической эластазы типа I свиней, не содержащей трипсина, и (ii) фармацевтически приемлемый носитель. Альтернативно, настоящее изобретение относится к композиции, включающей (i) терапевтически эффективное количество панкреатической эластазы типа I свиней, в основном, не содержащей трипсина, и (ii) фармацевтически приемлемый носитель. В конкретных вариантах осуществления изобретения, панкреатическая эластаза типа I свиней и/или указанная композиция содержат менее чем 100 нг/мл трипсиновой активности, менее чем 75 нг/мл трипсиновой активности, менее чем 50 нг/мл трипсиновой активности, менее чем 25 нг/мл трипсиновой активности, менее чем 15 нг/мл трипсиновой активности, менее чем 10 нг/мл трипсиновой активности, менее чем 5 нг/мл трипсиновой активности, менее чем 4 нг/мл трипсиновой активности, менее чем 3 нг/мл трипсиновой активности, менее чем 2 нг/мл трипсиновой активности или менее чем 1,56 нг/мл трипсиновой активности. В вышеуказанных примерах, трипсиновая активность (нг/мл) может быть проанализирована в жидкой композиции или в жидком препарате на основе панкреатической эластазы типа I свиней, содержащих 1 мг/мл панкреатической эластазы типа I свиней. Таким образом, трипсиновая активность может быть также выражена в миллиграммах белка эластазы, например, менее чем 25 нг трипсиновой активности/мг белка эластазы, менее чем 5 нг трипсиновой активности/мг белка эластазы и т.п. Настоящее изобретение также относится к композиции, содержащей (i) терапевтически эффективное количество эластазы типа I свиней и (ii) фармацевтически приемлемый носитель, где указанная композиция содержит менее чем 100 нг трипсиновой активности/мг эластазы, менее чем 75 нг трипсиновой активности/мг эластазы, менее чем 50 нг трипсиновой активности/мг эластазы, менее чем 25 нг трипсиновой активности/мг эластазы, менее чем 15 нг трипсиновой активности/мг эластазы, менее чем 10 нг трипсиновой активности/мг эластазы, менее чем 5 нг трипсиновой активности/мг эластазы, менее чем 4 нг трипсиновой активности/мг эластазы, менее чем 3 нг трипсиновой активности/мг эластазы, менее чем 2 нг трипсиновой активности/мг эластазы или менее чем 1,56 нг трипсиновой активности/мг эластазы.
В других вариантах осуществления, настоящее изобретение относится к композициям белков эластазы, таких как зрелые белки эластазы, включая, но не ограничиваясь ими, фармацевтические композиции, эластазные препараты или лекарственные формы, которые не содержат N-концевых вариантов, соответствующих одной, двум, трем или всем четырем SEQ ID NO:70, 71, 104, 105. В некоторых своих вариантах осуществления, настоящее изобретение относится к фармацевтической композиции, содержащей (i) терапевтически эффективное количество зрелой эластазы типа I человека, и (ii) фармацевтически приемлемый носитель, где указанная фармацевтическая композиция не содержит каких-либо белков SEQ ID NO:70, 71, 104, 105.
В других вариантах осуществления, настоящее изобретение относится к композиции, включая, но не ограничиваясь ею, фармацевтическую композицию, эластазный препарат или лекарственную форму, содержащие (i) терапевтически эффективное количество эластазы типа I человека, не содержащей или, в основном, не содержащей вариантов белков, включающих специфические дополнительные аминокислоты у N-конца зрелого белка эластазы (SEQ ID NO: 37, 38, 70, 71, 94, 95, 104, 105) и (ii) фармацевтически приемлемый носитель. В других своих вариантах осуществления, настоящее изобретение относится к композиции, включающей: (i) терапевтически эффективное количество эластазы типа I человека, не содержащей или, в основном, не содержащей вариантов белков, в которых отсутствуют N-концевые аминокислоты зрелого белка эластазы (SEQ ID NO:2, 3, 37, 38, 70, 71, 85, 86, 94, 95, 104, 105, 106, 107, 108) и (ii) фармацевтически приемлемый носитель. В конкретных вариантах осуществления изобретения, эластаза типа I человека и/или указанная композиция содержит менее чем 25% N-концевых вариантов, менее чем 20% N-концевых вариантов, менее чем 15% N-концевых вариантов, менее чем 10% N-концевых вариантов, менее чем 5% N-концевых вариантов, менее чем 4% N-концевых вариантов, менее чем 3% N-концевых вариантов, менее чем 2% N-концевых вариантов, менее чем 1% N-концевых вариантов, менее чем 0,5% N-концевых вариантов, 0% N-концевых вариантов, либо она содержит N-концевые варианты в количестве, составляющем в интервалах между любыми двумя вышеупомянутыми значениями (например, 2%-25% N-концевых вариантов, 0,5%-10% N-концевых вариантов, 5%-15% N-концевых вариантов, 0%-2% N-концевых вариантов, и т.п.). Используемый здесь термин «менее чем X% N-концевых вариантов» означает количество N-концевых вариантов, выраженное в процентах от всего количества белка эластазы.
В других вариантах осуществления, настоящее изобретение относится к композиции, включая, но не ограничиваясь ими, фармацевтическую композицию, эластазный препарат или лекарственную форму, содержащие (i) терапевтически эффективное количество зрелой эластазы типа I человека и (ii) фармацевтически приемлемый носитель, где указанная фармацевтическая композиция, в основном, не содержит бактериальных белков и/или, в основном, не содержит белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека. В конкретных вариантах осуществления изобретения, эластаза типа I человека и/или указанная композиция содержат менее чем 25% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, менее чем 20% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, менее чем 15% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, менее чем 10% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, менее чем 5% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, менее чем 4% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, менее чем 3% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, менее чем 2% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, менее чем 1% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, менее чем 0,5% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, 0% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, или они содержат бактериальные белки и/или белки млекопитающих, не являющиеся указанной зрелой эластазой типа I человека, в количестве, составляющем в интервалах между любыми двумя вышеупомянутыми величинами процентов (например, 2%-25% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, 0,5%-10% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, 5%-15% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, 0%-2% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека, и т.п.). Используемый здесь термин «менее чем X% бактериальных белков и/или белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека» означает количество таких белков, выраженное в процентах от всего количества белка в эластазном препарате или в указанной композиции. В некоторых вариантах осуществления изобретения, эластаза составляет по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99%, по меньшей мере 99,5% или по меньшей мере 99,8% от всего количества белков в указанных композициях или препаратах.
Настоящее изобретение также относится к способам лечения и предупреждения заболеваний биологических каналов, где указанные способы включают введение пациенту, нуждающемуся в этом, композиций (например, фармацевтических композиций, эластазных препаратов или лекарственных форм), содержащих очищенную зрелую эластазу типа I человека согласно изобретению.
Настоящее изобретение также относится к векторам, включающим нуклеиновые кислоты, кодирующие любой из белков эластазы согласно изобретению («нуклеиновые кислоты согласно изобретению») и к клеткам-хозяевам, сконструированным для экспрессии нуклеиновых кислот согласно изобретению. В конкретных вариантах осуществления изобретения, указанные векторы также содержат нуклеотидную последовательность, регулирующую экспрессию белка эластазы. Так, например, нуклеотидная последовательность, кодирующая белок согласно изобретению, может быть функционально связана с индуцируемым метанолом промотором. Другие подходящие промоторы описаны ниже в разделе 5.3.
В своих конкретных вариантах осуществления, настоящее изобретение относится к вектору, содержащему нуклеотидную последовательность, кодирующую открытую рамку считывания, содержащую сигнальный пептид α-фактора дрожжей или сигнальный пептид эластазы типа I (например, сигнальный пептид эластазы свиней), функционально связанный с последовательностью белка пропроэластазы типа I человека. Вектор может также содержать, но необязательно, индуцируемый метанолом промотор, функционально связанный с открытой рамкой считывания.
Настоящее изобретение также относится к клеткам-хозяевам, содержащим указанные нуклеиновые кислоты и векторы согласно изобретению. В некоторых вариантах осуществления изобретения, вектор или нуклеиновая кислота интегрируются в геном клетки-хозяина, а в других вариантах осуществления изобретения, вектор или нуклеиновая кислота являются внехромосомными. Предпочтительной клеткой-хозяином является клетка Pichia pastoris. Другие подходящие клетки-хозяева описаны ниже в разделе 5.3.
В своем конкретном варианте осуществления, настоящее изобретение относится к клеткам-хозяевам Pichia pastoris, генетически сконструированным так, чтобы они кодировали открытую рамку считывания, содержащую сигнальный пептид α-фактора дрожжей или сигнальный пептид эластазы свиней, функционально связанные с последовательностью профермента эластазы типа I человека. Открытая рамка считывания находится, но необязательно, под контролем индуцируемого метанолом промотора.
Настоящее изобретение также относится к способам получения незрелого или зрелого белка эластазы согласно изобретению, включающим культивирование клетки-хозяина, сконструированной для экспрессии нуклеиновой кислоты согласно изобретению, в условиях, благоприятствующих продуцированию белка проэластазы. В некоторых вариантах осуществления, настоящее изобретение также относится к продуцированию зрелого белка эластазы.
Предпочтительные условия культивирования для продуцирования проэластазных и зрелых белков согласно изобретению, а в частности, культивирования клеток-хозяев Pichia pastoris, включают период роста при низком pH. Обычно, низкий pH имеет значение 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, или любое значение в интервале между любыми парами вышеуказанных значений. В конкретных вариантах осуществления изобретения, низкий pH имеет значение в пределах от 2,0 до 6,0, от 2,0 до 5,0, от 3,0 до 6,0, от 3,0 до 5,0, от 4,0 до 6,0, или от 3,0 до 4,0. По окончании периода культивирования, pH культуры может быть доведен предпочтительно до 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0, 10,5, 11,0 или до значений pH, составляющих в пределах между любыми двумя вышеуказанными величинами, в целях отделения последовательности активации от зрелого белка эластазы, или удаления этой последовательности из указанного белка. В конкретных вариантах осуществления изобретения, pH данной культуры доводят до 7,5-10,0 или 8,0-9,0, а наиболее предпочтительно, до pH 8,0.
Если экспрессия белка проэластазы согласно изобретению находится под контролем индуцируемого метанолом промотора, то условия продуцирования незрелого или зрелого белка эластазы согласно изобретению могут также включать период индуцирования метанолом.
Способы получения эластазы согласно изобретению могут также включать стадию выделения белка, экспрессируемого клеткой-хозяином. В некоторых случаях, выделенным белком является проэластаза, содержащая последовательность активации. В других случаях, выделенным белком является зрелая эластаза, не содержащая последовательности активации. При определенных условиях могут быть получены белки эластазы и зрелые белки эластазы.
В частности, предпочтительно, если желательно избежать аутоактивации аутоактивируемой проэластазы, то условия культивирования, благоприятствующие экспрессии проэластазы, могут включать период роста и индуцирования при низком рН. Обычно, низкий рН составляет 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5 или 6,0, или любое значение в интервале между любыми парами вышеуказанных значений. В конкретных вариантах осуществления изобретения, низким pH является pH в пределах от 2,0 до 3,0, от 4,0 до 5,0, от 5,0 до 6,0, или от 6,0 до 7,0. В конкретных вариантах осуществления изобретения, рН составляет от 4,0 до 6,0, а наиболее предпочтительно, 5,5.
В частности, если желательно избежать аутоактивации аутоактивируемой проэластазы, то предпочтительные условия культивирования, благоприятствующие экспрессии проэластазы, могут включать период роста и индуцирования в присутствии цитрата натрия, сукцината натрия или ацетата натрия. В конкретных вариантах осуществления изобретения используется концентрация 5-50 мМ, 7,5-100 мМ, 10-15 мМ, 50-200 мМ, 75-175 мМ, 100-150 мМ, 75-125 мМ или концентрация в любом интервале, верхний и нижний предел которых выбран из любых вышеуказанных величин (например, 50-75 мМ, 75-100 мМ и т.п.). В предпочтительном варианте осуществления изобретения, концентрация цитрата натрия, сукцината натрия или ацетата натрия составляет 90-110 мМ, а наиболее предпочтительно, 100 мМ.
Кроме того, в частности, если желательно избежать аутоактивации аутоактивируемой проэластазы или ауторасщепления под действием зрелой эластазы, то условия культивирования, благоприятствующие экспрессии незрелого белка эластазы, могут включать период роста и индуцирования при температуре, равной нижнему пределу температурного интервала, подходящего для культивирования рассматриваемых клеток-хозяев. Так, например, если клеткой-хозяином является клетка-хозяин Pichia pastoris, то предпочтительным температурным интервалом является интервал примерно 22-28°C. В конкретном варианте осуществления изобретения, клетку-хозяина Pichia pastoris культивируют при 28°C.
Кроме того, в частности, если желательно избежать расщепления белка под действием протеаз клеток-хозяев, то условия культивирования, благоприятствующие экспрессии незрелого белка эластазы, могут включать период роста и индуцирования при температуре, равной нижнему пределу температурного интервала, подходящего для культивирования рассматриваемых клеток-хозяев. Так, например, если клеткой-хозяином является клетка-хозяин Pichia pastoris, то предпочтительным температурным интервалом является интервал примерно 22-28°C. В конкретном варианте осуществления изобретения, клетку-хозяина Pichia pastoris культивируют при 28°C.
Активация аутоактивируемого белка проэластазы согласно изобретению может быть инициирована путем добавления чужеродной эластазы в небольшом (каталитическом) количестве. В некоторых вариантах осуществления изобретения, каталитическое количество чужеродной эластазы составляет менее чем 10%, менее чем 5%, менее чем 2%, менее чем 1%, менее чем 0,5% или менее чем 0,1% в расчете на молярную или молекулярную массу эластазы в образце, к которому добавляют каталитическую эластазу.
Альтернативно или одновременно, рН аутоактивируемой проэластазы может быть доведен до pH 7–11 (а наиболее предпочтительно, до pH 8), а затем, аутоактивированный пептид активации проэластазы удаляют, не прибегая к воздействию трипсина, в результате чего получают зрелую активную эластазу. В конкретных вариантах осуществления изобретения, при проведении стадии активации добавляют основание Tris до концентрации 50-200 мМ, 75-175 мМ, 100-150 мМ, 75-125 мМ, или любого значения в указанных интервалах, верхние и нижние пределы которых выбраны из любых вышеупомянутых величин (например, 50-75 мМ, 75-100 мМ и т.п.). В предпочтительных вариантах осуществления изобретения, основание Tris добавляют до концентрации 90-110 мМ, а наиболее предпочтительно, 100 мМ. pH основания Tris составляет, предпочтительно, 7-11; в конкретных вариантах осуществления изобретения, основание Tris имеет рН 7,0-11,0, 7-9, 7,5-9,5, 7,5-10, 8-10, 8-9 или любое значение в указанных интервалах, верхние и нижние пределы которых выбраны из любых вышеупомянутых величин. В предпочтительном варианте осуществления изобретения, основание Tris имеет pH 7,5-8,5, а наиболее предпочтительно, 8,0.
Экспрессия последовательности незрелой эластазы в некоторых случаях может приводить к образованию смеси белков проэластазы и зрелых белков эластазы, а также N-концевых вариантов белков эластазы. Таким образом, настоящее изобретение относится к композиции, содержащей по меньшей мере два из указанных белков, таких как (1) белок проэластазы, (2) зрелый белок эластазы и (3) N-концевой вариант белков эластазы.
После продуцирования зрелой эластазы, она может быть лиофилизована, например, для получения фармацевтических препаратов. В характерном варианте осуществления, настоящее изобретение относится к способам выделения лиофилизованной зрелой эластазы типа I, где указанные способы включают стадии:
(a) культивирования клетки-хозяина, такой как клетка-хозяин Pichia pastoris, сконструированная так, чтобы она экспрессировала молекулу нуклеиновой кислоты, кодирующую открытую рамку считывания препроэластазы в условиях, при которых экспрессируется открытая рамка считывания, где, в конкретном варианте осуществления изобретения, указанная открытая рамка считывания включает нуклеотидные последовательности, кодирующие, в направлении 5’→3’ (i) сигнальный пептид, например, сигнальный пептид, функционирующий в Pichia pastoris; (ii) последовательность активации, содержащую последовательность распознавания эластазы; и (iii) последовательность зрелого белка эластазы типа I и, тем самым, продуцирования белка проэластазы;
(b) создания условий для аутоактивации белка проэластазы, и тем самым, продуцирования зрелой эластазы типа I, где указанные условия аутоактивации включают одно из нижеследующих условий или их комбинацию, а именно:
(i) изменение pH раствора (которым может быть супернатант клеточной культуры), содержащего белок проэластазы, например, до pH 6,5-11, предпочтительно, 8-9;
(ii) очистку белка проэластазы, например, с помощью ионообменной хроматографии, и пролонгированной конверсии раствора в целях удаления N-концевых вариантов и, тем самым, продуцирования зрелой эластазы типа I человека;
(iii) концентрирование белка проэластазы (например, повышения его концентрации в 2 раза, 3 раза, 5 раз, 8 раз, 10 раз, 12 раз или в любое количество раз в интервале значений, верхние и нижние пределы которого независимо выбраны из вышеуказанных уровней концентрирования);
(iv) повышение температуры белка проэластазы (например, до 29°C, 30°C, 32°C, 35°C, 40°C, 45°C или 40°C, или в любом интервале, верхние и нижние пределы которого независимо выбраны из вышеуказанных температур);
(v) очистку белка проэластазы (например, с использованием смолы Macro-Prep High S) из супернатанта клеточной культуры и инкубирование раствора, содержащего очищенный белок проэластазы, при температуре окружающей среды (например, 22°C-26°C) в течение по меньшей мере одного дня (например, в течение одного дня, двух дней, трех дней, четырех дней, пяти дней или шести дней или в интервалах, верхний и нижний предел которых независимо выбран из вышеуказанных значений) (такие условия определяются присутствием цитрата/ацетата, концентрацией, температурой и значением pH раствора и могут быть легко определены специалистом в данной области).
(c) очистки, но необязательно, зрелой эластазы типа I человека, например, путем проведения стадии ионообменной хроматографии, которая применяется для глубокой очистки (полиш-хроматографии); и
(d) лиофилизации зрелой эластазы типа I и тем самым, выделения лиофилизованной зрелой эластазы типы I человека. Зрелой эластазой типа I предпочтительно, является эластаза типа I человека. В некоторых аспектах изобретения, лиофилизованная зрелая эластаза типа I предпочтительно имеет чистоту более чем 95%, а в конкретных вариантах осуществления изобретения, лиофилизованная зрелая эластаза типа I имеет чистоту более чем 98% или более чем 99%.
Белки зрелой эластазы согласно изобретению могут быть включены в фармацевтические композиции. Таким образом, в характерных вариантах осуществления, настоящее изобретение относится к способу получения фармацевтической композиции, содержащей зрелую эластазу типа I человека, где указанный способ включает (i) выделение лиофилизованной зрелой эластазы типа I человека способами, описанными выше; и (ii) разведение лиофилизованной зрелой эластазы типа I человека в фармацевтически приемлемом носителе. Зрелые эластазы типа I человека согласно изобретению обладают специфической активностью, составляющей более чем 1, более чем 5, более чем 10, более чем 20, более чем 25 или более чем 30 ед./мг белка, как было определено путем измерения скорости гидролиза небольшого пептидного субстрата N-сукцинил-Ala-Ala-Ala-п-нитроанилида (SLAP), который катализируется при добавлении эластазы. Одна единица активности определяется как количество эластазы, которое катализирует гидролиз 1 микромоля субстрата в минуту при 30°С, а специфическая активность определяется как активность на мг белка эластазы (ед./мг). Предпочтительно, зрелая эластаза типа I человека согласно изобретению обладает специфической активностью в интервалах, нижний предел которых составляет 1, 2, 3, 4, 5, 7, 10, 15 или 20 ед./мг белка, а верхний предел независимо составляет 5, 10, 15, 20, 25, 30, 35, 40 или 50 ед./мг белка. В характерных вариантах осуществления изобретения, специфическая активность составляет в интервалах 1-40 ед./мг белка, 1-5 ед./мг белка, 2-10 ед./мг белка, 4-15 ед./мг белка, 5-30 ед./мг белка, 10-20 ед./мг белка, 20-40 ед./мг белка, или в любом интервале, верхний и нижний пределы которых выбраны из любых вышеуказанных величин (например, 1-10 ед./мг, 5-40 ед./мг и т.п.).
Фармацевтические композиции согласно изобретению, предпочтительно, являются стабильными. В конкретных вариантах осуществления изобретения, фармацевтическая композиция (например, фармацевтическая композиция, полученная путем лиофилизации и разведения, описанных выше) сохраняет по меньшей мере 50%, более предпочтительно, по меньшей мере 60%, а наиболее предпочтительно, по меньшей мере 70% своей специфической активности после хранения в течение недели при 4°С. В конкретных вариантах осуществления изобретения, фармацевтическая композиция сохраняет по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85% или по меньшей мере 95% своей специфической активности после разведения и хранения в течение недели при 4°С.
Настоящее изобретение также относится к белкам, содержащим аминокислотную последовательность белка проэластазы типа I, включающую последовательность домена расщепления эластазы. Другими доменами расщепления, которые могут быть использованы в настоящем изобретении, являются любые последовательности, представленные как консенсусная последовательность домена расщепления (SEQ ID NO:74) Xaa1 Xaa2 Xaa3 Xaa4 Xaa5 Xaa6 Xaa7 Xaa8, где Xaa1=P5, Xaa2=P4, Xaa3=P3, Xaa4=P2, Xaa5=P1, Xaa6=P′1, Xaa7=P′2 и Xaa8=P′3, где:
- Xaa1 представляет собой глутамин, гистидин, пролин, глицин, аспарагин, лизин или аланин, или, необязательно, их аналог;
- Xaa2 представляет собой треонин, аланин, пролин или гистидин или, необязательно, их аналог;
- Xaa3 представляет собой аланин, лейцин, изолейцин, метионин, лизин, аспарагин или валин, или, необязательно, их аналог, но предпочтительно, не глицин или не пролин;
- Xaa4 представляет собой пролин, аланин, лейцин, изолейцин, глицин, валин или треонин, или, необязательно, их аналог;
- Xaa5 представляет собой аланин, лейцин, валин, изолейцин или серин, но не глицин, не тирозин, не фенилаланин, не пролин, не аргинин, не глутамин или не лизин, или, необязательно, их аналог;
- Xaa6 представляет собой аланин, лейцин, валин, изолейцин или серин, или необязательно, их аналог;
- Xaa7 представляет собой глицин, аланин или валин, или, необязательно, их аналог; и
- Xaa8 представляет собой валин, треонин, фенилаланин, тирозин или триптофан, или, необязательно, их аналог.
Настоящее изобретение также относится к способу выделения зрелой эластазы типа I человека, где указанный способ включает: (a) культивирование, в подходящих условиях, клетки-хозяина, содержащей нуклеотидную последовательность, которая кодирует пробелок, содержащий (i) последовательность активации, содержащую последовательность распознавания трипсином, функционально связанную с (ii) аминокислотной последовательностью белка, обладающего эластазной активностью, в указанных условиях культивирования, где указанные условия культивирования включают период роста или индуцирования при pH 2-6; (b) выделение экспрессированного пробелка; (c) контактирование выделенного белка с каталитическим количеством трипсина при рН, при котором трипсин является активным; и (d) выделение зрелой эластазы типа I человека. В этом способе, зрелая эластаза типа I человека может состоять, в основном, из SEQ ID NO: 1, 4, 5, 84 или 87. В некоторых вариантах осуществления изобретения, указанные условия могут включать (a) период роста или индуцирования при pH 4-6; (b) период роста или индуцирования при 22°-28°C; или (c) концентрации цитрата натрия, сукцината натрия или ацетата натрия, составляющие примерно от 50 мМ до 200 мМ, или концентрацию цитрата натрия, составляющую от 90 мМ и примерно до 110 мМ в среде для культивирования указанных клеток-хозяев.
Слово «или», используемое в настоящей заявке, как и во всех патентных заявках, употребляется как разделительный союз «или» или соединительный союз «и».
Все публикации, упомянутые в настоящей заявке, вводятся в настоящее описание посредством ссылки. Любое обсуждение документов, актов, материалов, статей или т.п., которое включено в настоящую заявку, приводится лишь в целях описания предшествующего уровня настоящего изобретения. При этом, не следует считать, что любой из рассматриваемых материалов или все эти материалы составляют часть известного уровня техники или общедоступных сведений в области, к которой относится настоящее изобретение, и которые были уже известны на дату подачи настоящей заявки.
Все отличительные признаки и преимущества настоящего изобретения будут более очевидны для специалистов исходя из подробного описания его вариантов осуществления.
4. Краткое описание графического материала
Фигуры 1A-1B: На фигуре 1A проиллюстрирована синтезированная (то есть рекомбинантная) последовательность ELA-1.2A человека. Последовательность рекомбинантной эластазы-1 человека (то есть панкреатической эластазы типа I человека) содержит кодирующую область из 750 пар оснований. Выбранные сайты рестриктирующих ферментов подчеркнуты. Замены оснований подчеркнуты двойной чертой и выделены жирным шрифтом, а содержащие их кодоны подчеркнуты только двойной чертой. Стоп-кодоны заштрихованы серым цветом (но не подчеркнуты). Пропептидная последовательность показана курсивом. Кодирующая область образует белок из 250 аминокислот. После отщепления пропептида из 10 аминокислот образуется зрелый фермент из 240 аминокислот. На Фигуре 1B показана слитая область трансляции pPROT24. На этой фигуре показана слитая область трансляции между вектором и ELA-1-кодирующей областью. ПЦР-амплификацию последовательности ELA-1 проводят в целях включения сигнальных доменов расщепления Kex2 и STE13 для получения секретируемого продукта с предполагаемой N-концевой первой аминокислотой (жирный шрифт) последовательности активации (курсив).
Фигура 2: Схематически показаны, начиная с N-конца и до С-конца, коровые (перекрывающиеся) компоненты белков эластазы согласно изобретению, где пронумерованные компоненты означают: (1) сигнальную последовательность (вертикальные полосы); (2) необязательную пропептидную/спейсерную последовательность (кирпичики); (3) пропептид эластазы (диагональные полосы, заштриховано серым и ромбы); (4) пептид активации (заштриховано серым и ромбы); (5) последовательность распознавания (ромбы); (6) домен расщепления (заштриховано серым, ромбы и левая часть горизонтальных полос); (7) сайт расщепления (заштриховано серым, ромбы и левая часть горизонтальных полос); (8) белок препроэластазы (вся схема); (9) белок проэластазы (диагональные полосы, заштриховано серым, ромбы и горизонтальные полосы); и (10) зрелый белок эластазы (горизонтальные полосы). В таблице приводятся схематические обозначения аминокислот области, протяженность которой показана стрелкой. Схема не масштабирована. Номенклатура приводится лишь в целях иллюстрации и не относится к конкретным функциям, активности или механизму.
Фигура 3. Диаграмма вектора pPROT24-V. Термин «секреция α-фактора» относится к кассете, содержащей сигнальный пептид и пропептид α-фактора дрожжей, за которой следуют повторы сайта Kex2 и STE13.
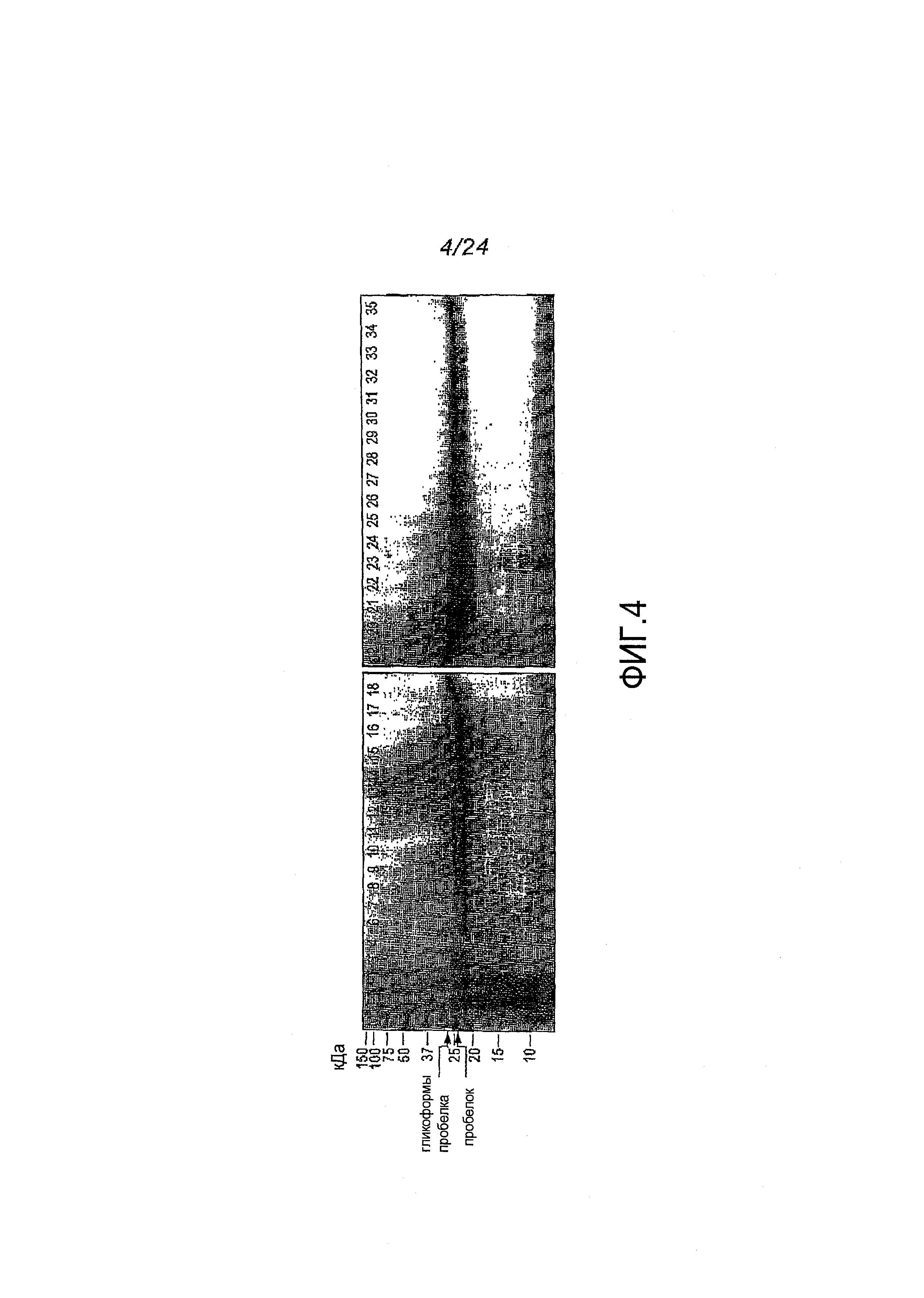
Фигура 4: ДСН-ПААГ-анализ фракций, полученных после проведения хроматографии методом «захвата», для культуры 201-24-266-VU, содержащей активированный трипсином про-PRT-201. Число дорожек соответствует числу фракций. Фракции 6-18, главным образом, состоят из гликозилированнного профермента (верхняя полоса) и негликозилированнного профермента (нижняя полоса). Фракции 19-35, главным образом, состоят из негликозилированнного профермента. M = маркеры молекулярной массы. FT = проточная колонка.
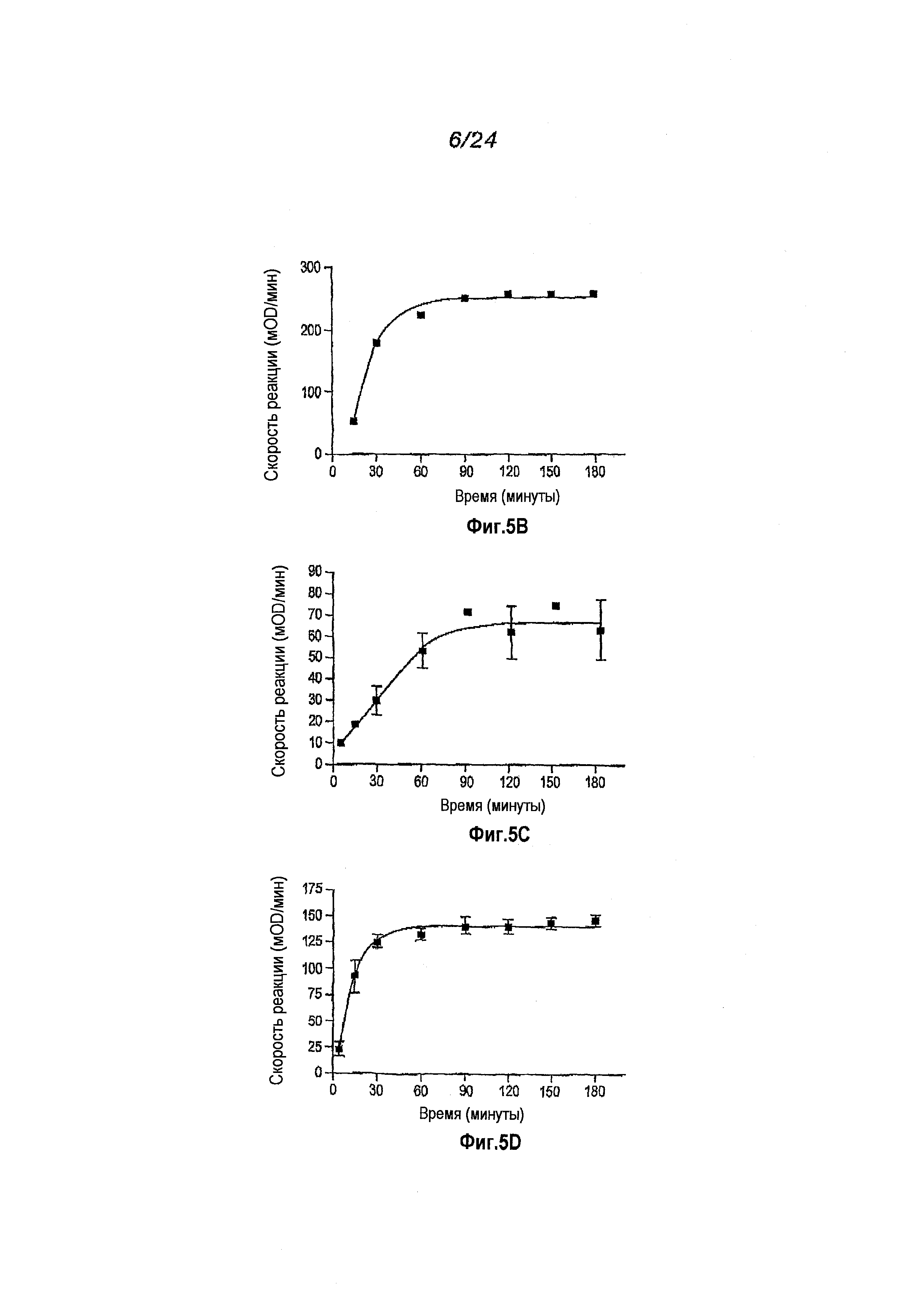
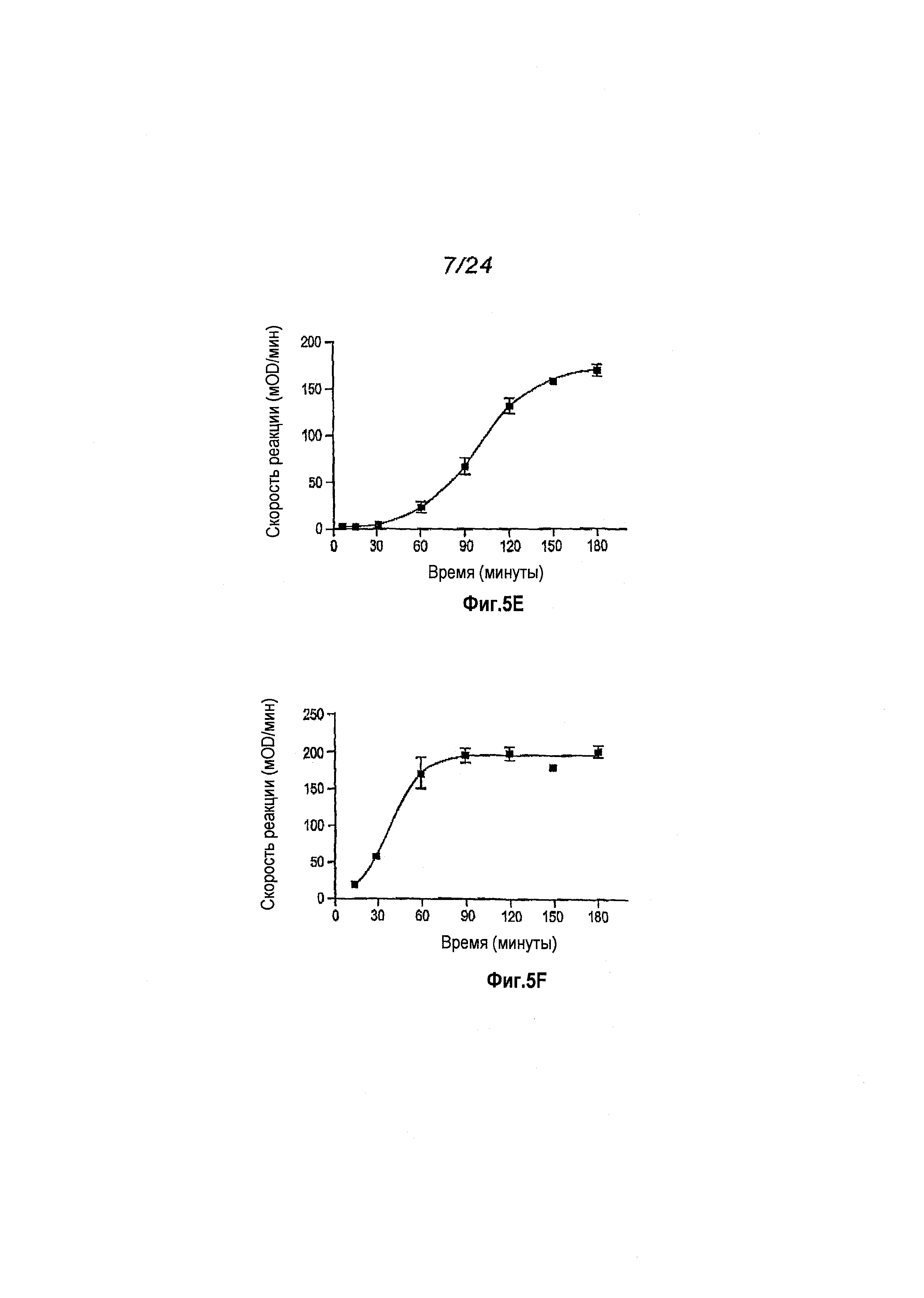
Фигура 5: Таблица данных для аутоактивированного пробелка. Пропептидные последовательности перечислены в первом столбце. Электрофорез в ДСН-ПААГ для супернатантов, проведенный через 1, 2 и 3 дня после индуцирования (дорожки 1, 2 и 3, соответственно) проиллюстрирован во втором столбце. Относительные выходы пробелка, полученного на ДСН-ПААГ, приводятся в третьем столбце. Относительные стабильности пробелка в течение 3 дней после индуцирования, определенные с помощью электрофореза в ДСН-ПААГ, приводятся в четвертом столбце. Пробелки с пропептидными последовательностями 42 и 48 определены как имеющие низкую стабильность, обусловленную присутствием зрелого белка в процессе индуцирования (наблюдаемую через 1, 2 и 3 дня для варианта 42 и через 2 и 3 дня для варианта 48). Скорости относительного превращения пробелков, определяемые по времени достижения максимальной скорости SLAP-реакции, приводятся в пятом столбце. Вычисленные проценты превращенного белка, содержащего N-концевые варианты зрелого белка эластазы, приводятся в шестом столбце.
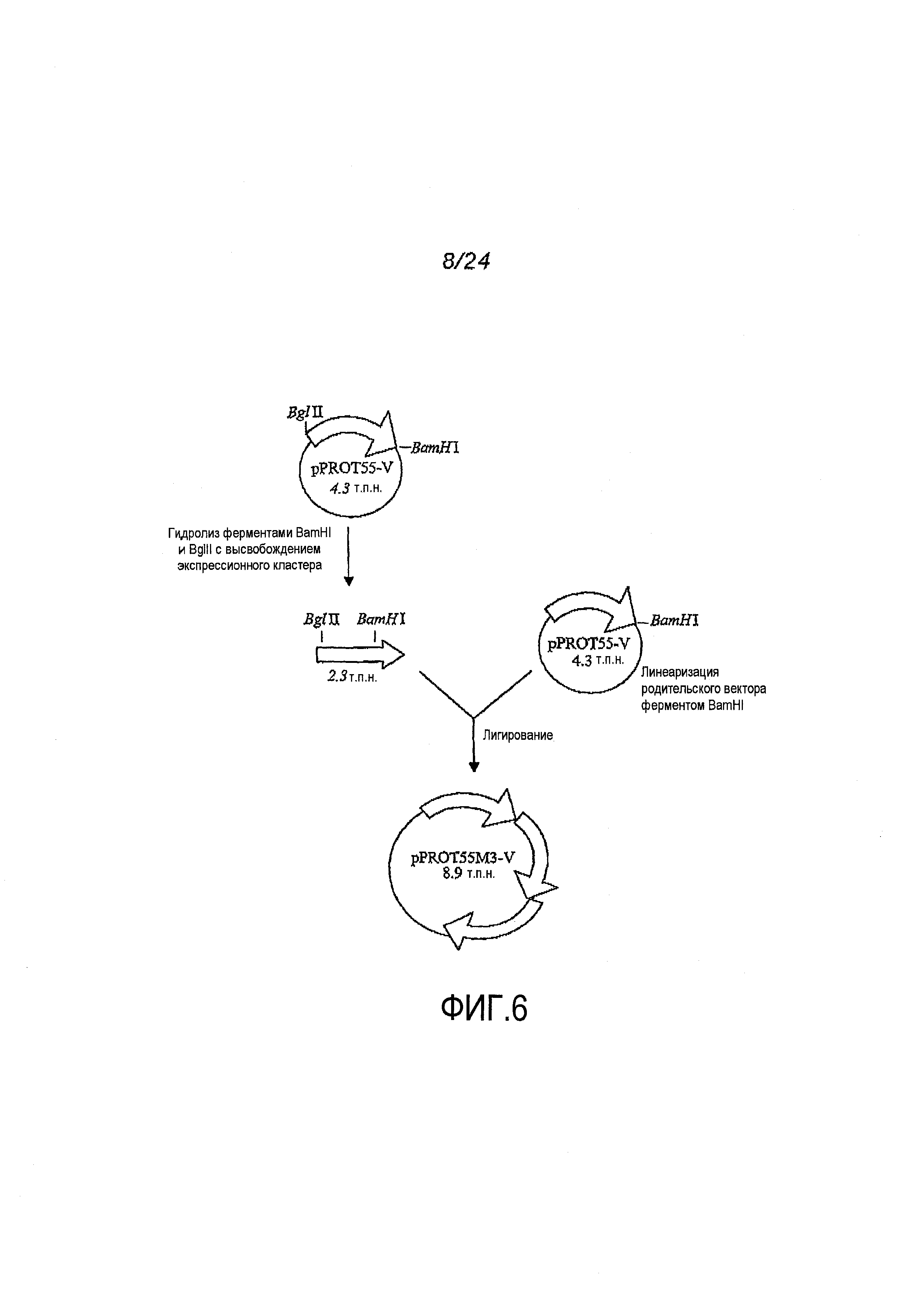
Фигура 6. Схема клонирования pPROT55M3-V. pPROT55M3-V был сконструирован in vitro путем лигирования двух дополнительных экспрессионных кассет в остов 4,3 т.п.н.-вектора pPROT55-V с получением всего трех тандемных экспрессионных кассет. 2,3 т.п.н.-фрагмент экспрессионной кассеты выделяли из pPROT55-V путем гидролиза рестриктирующими ферментами BglII и BamHI и очищали, а затем две копии экспрессионной кассеты лигировали с вектором pPROT55-V, линеаризованным ферментом BamHI.
Фигура 7: Оптимизация клона 201-55M3-006-VU в шейкерных колбах. Была получена стандартная среда для индуцирования, BKME, в которую добавляли цитрат натрия для достижения конечных концентраций 0, 12,5, 25 и 50 мМ цитрата натрия, pH 5,5. Эту среду использовали для ресуспендирования клеточного осадка в фазе роста в отношении 1 г сырой клеточной массы на 10 мл среды для индуцирования. Клеточные суспензии, 25 мл каждой, помещали в 250 мл-колбы без перегородок и инкубировали при 22°C или 25°C в течение 3 дней со встряхиванием при 275 об/мин. Метанол добавляли два раза в день до конечной концентрации 0,5% по объему. Затем в течение 3 дней брали аликвоты супернатантов и анализировали на экспрессию белка с помощью электрофореза в ДСН-ПААГ и окрашивания кумасси. На панели А проиллюстрированы образцы, индуцированные при 22°C, а на панели B проиллюстрированы образцы, индуцированные при 25°C. На обеих панелях, дорожки 1-3 соответствуют супернатантам, полученным через 1, 2 и 3 дня после индуцирования, соответственно, и не содержащим (0%) цитрата натрия; дорожки 4-6 являются аналогичными, за исключением присутствия 12,5% цитрата натрия; дорожки 7-9 являются аналогичными, за исключением присутствия 25% цитрата натрия; и дорожки 10-12 являются аналогичными, за исключением присутствия 50 мМ цитрата натрия.
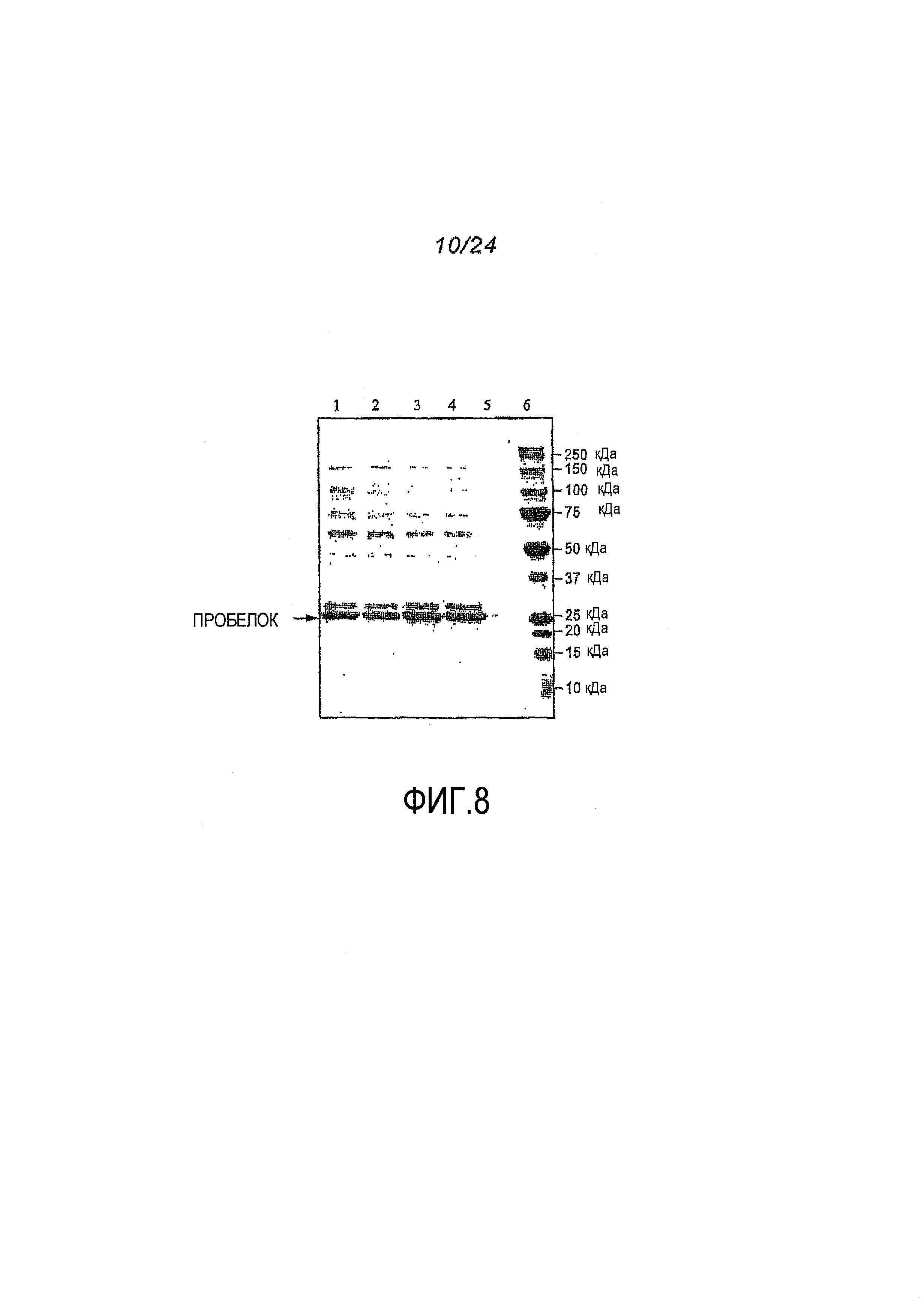
Фигура 8.Анализ супернатантов ферментированных культур 201-55-001-VU и 201-55M3-003-VU проводили с помощью электрофореза в ДСН-ПААГ. Дорожки 1, 2: супернатант 201-55-001-VU; дорожки 3, 4: супернатант 201-55M3-003-VU; дорожка 5: пустая; дорожка 6: маркеры молекулярной массы.
Фигура 9. ДСН-ПААГ-анализ фракций, полученных с помощью хроматографии методом «захвата» для пробелка pPROT55M3-V. Всего 30 микролитров каждой проэлюированной фракции смешивали с 10 микролитрами 4X буфера для загрузки образцов Лэммли, в который был добавлен бета-меркаптоэтанол. Белки подвергали электрофорезу в 8-16% линейном градиенте геля с последующим окрашиванием кумасси. Были обнаружены две преобладающих формы PRT-201: пробелок (фракции 15-43) и зрелый белок PRT-201, образованный путем спонтанного превращения (фракции 15-44). Число дорожек соответствует числу фракций. M, маркер молекулярной массы. BC, образец перед загрузкой на колонку (предварительная загрузка).
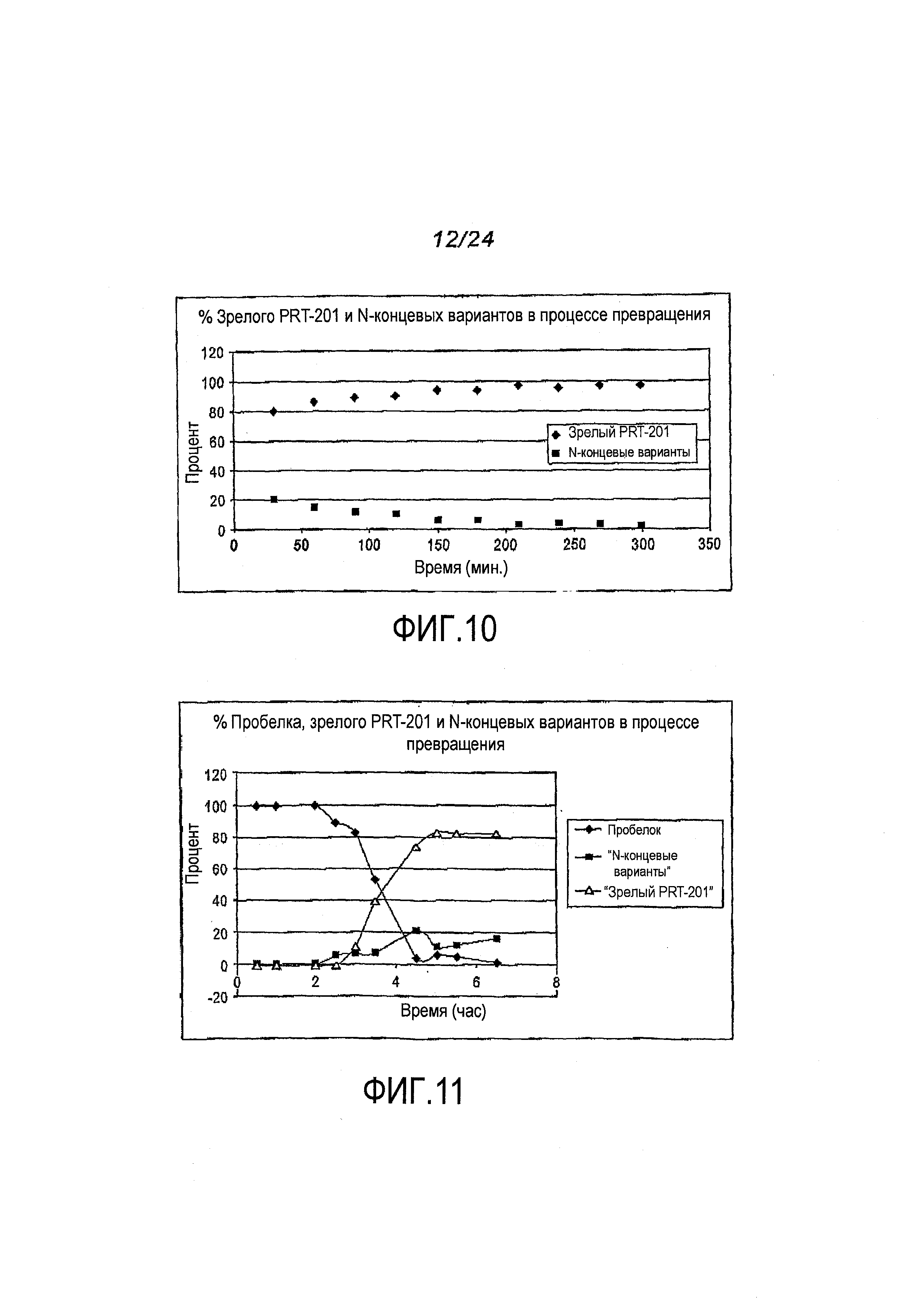
Фигура 10: ГХ-ВЭЖХ-анализ превращения очищенного пробелка. Очищенный про-PRT-201-55M3-003-VU подвергали реакции превращения при 26°C. На графике указаны относительные количества зрелого (полноразмерного) PRT-201 и N-концевых вариантов, полученных в процессе превращения.
Фигура 11: ГХ-ВЭЖХ-анализ превращения пробелка в супернатанте ферментированных культур, проводимый путем фильтрации в тангенциальном потоке. Осветленный супернатант ферментированной культуры 201-55M3-003-VU подвергали фильтрации в тангенциальном потоке с 100 мМ Tris, pH 8,0, путем проведения диафильтрации в постоянном объеме на регенерированных целлюлозных мембранах при температуре окружающей среды. На графике указаны относительные количества пробелка, зрелого (полноразмерного) PRT-201 и N-концевых вариантов, полученных в различные периоды времени в процессе превращения.
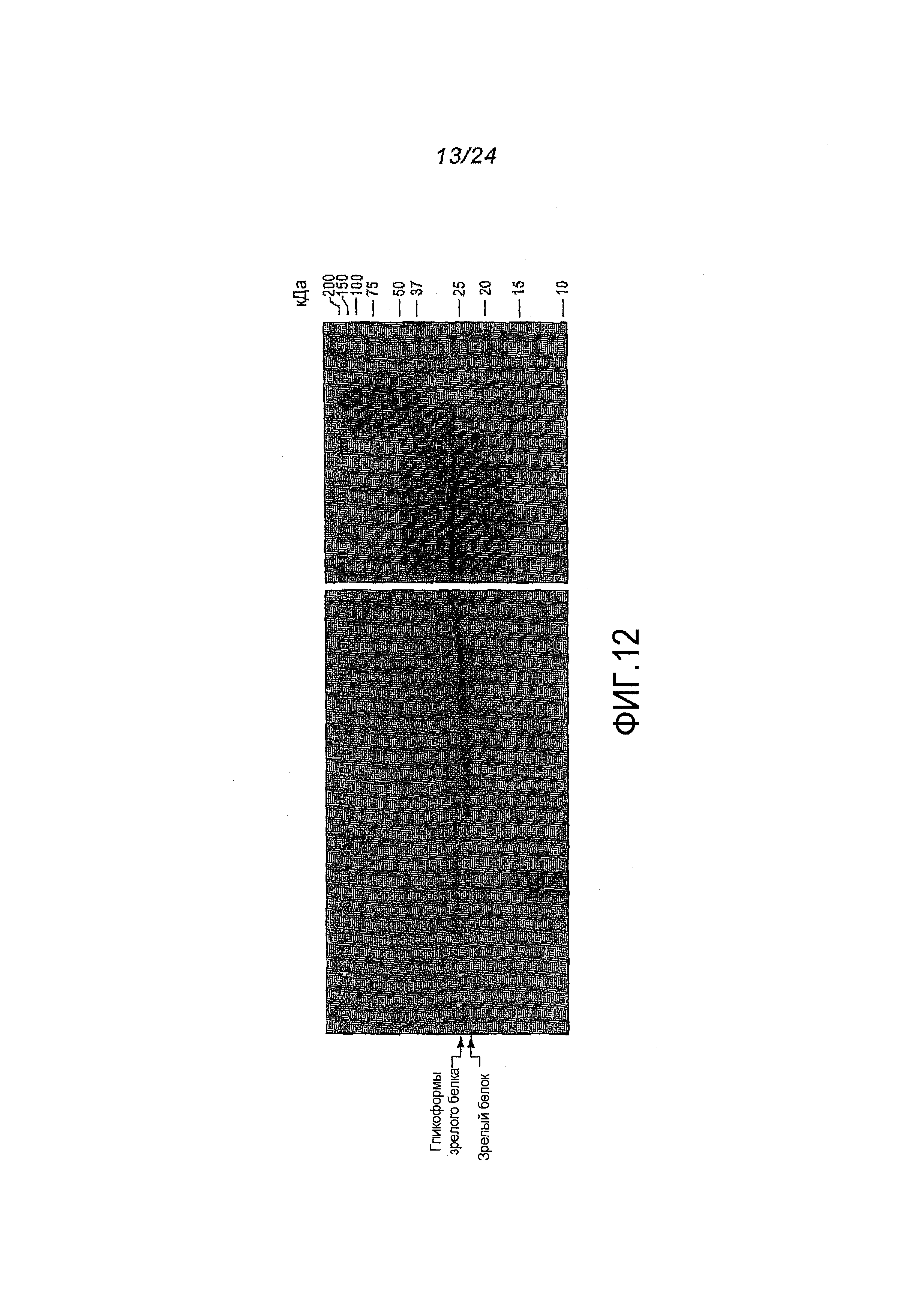
Фигура 12. ДСН-ПААГ-анализ фракций, полученных с помощью хроматографии методом «захвата» для процессированнного pPROT55M3-V. Всего 30 микролитров каждой проэлюированной фракции смешивали с 10 микролитрами 4X буфера для загрузки образцов Лэммли, в который был добавлен бета-меркаптоэтанол. Белки подвергали электрофорезу в 8-16% линейном градиенте геля с последующим окрашиванием кумасси. Были обнаружены две преобладающих формы PRT-201: гликозилированная зрелая форма (фракции 35-70) и не-гликозилированная зрелая форма (фракции 75-160). Число дорожек соответствует числу фракций. M, маркер молекулярной массы. BC, образец перед загрузкой на колонку (предварительная загрузка).
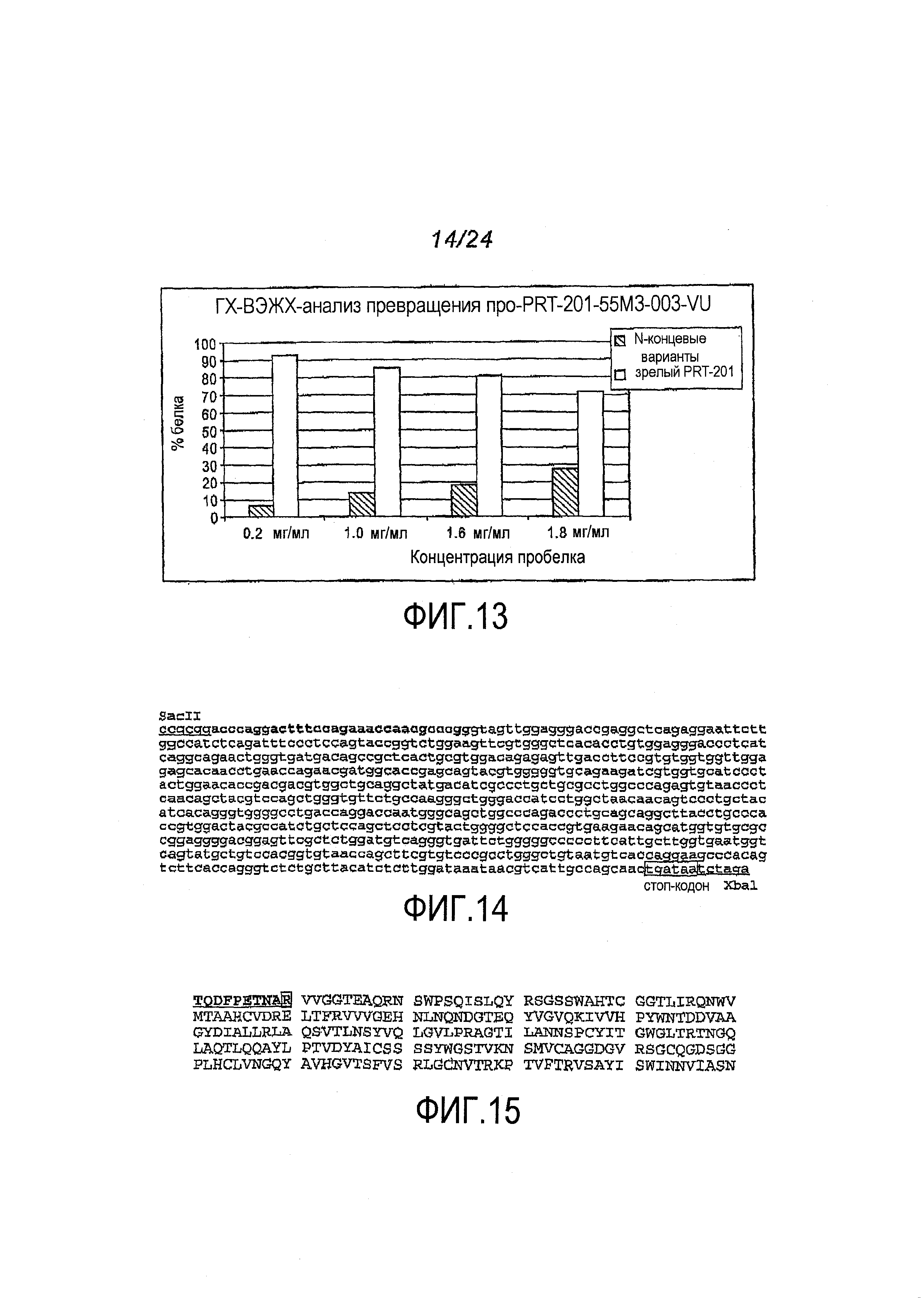
Фигура 13: Зависимость превращения пробелка от концентрации. Очищенный про-PRT-201, выделенный из клона 201-55M3-003-VU (про-PRT-201-55M3-003-VU), подвергали превращению при концентрациях 0,2, 1,0, 1,6 и 1,8 мг/мл. Мониторинг реакций превращения, осуществляемый с помощью ГХ-ВЭЖХ в реальном времени, проводили до тех пор, пока пробелок не составлял ≤ 1% от всего количества белка. На графике показаны относительные количества зрелого (полноразмерного) PRT-201 (слабо заштрихованные столбцы) и N-концевых вариантов (ярко заштрихованные столбцы), полученных в процессе реакции превращения.
Фигура 14. Последовательность ДНК синтезированной (то есть рекомбинантной) панкреатической эластазы типа 1 свиней. Рекомбинантная последовательность содержит кодирующую область из 750 пар оснований. Рестрикционные Sacll- и Xbal-сайты, подчеркнутые на данной фигуре, были включены для облегчения клонирования. Стоп-кодоны выделены. Последовательность пропептида выделена жирным шрифтом.
Фигура 15. Аминокислотная последовательность синтезированной (то есть рекомбинантной) панкреатической эластазы типа I свиней. Область пропептида показана жирным шрифтом, а сайт расщепления трипсином выделен. После отщепления пропептида из 10 аминокислот был получен зрелый фермент из 240 аминокислот.
Фигура 16. Схема клонирования панкреатической эластазы типа I свиней в вектор PV-1. После синтеза области, кодирующей пробелок панкреатической эластазы типа I свиней, эту область клонировали в вектор pUC Blue Heron. Помимо амплификации кодирующей последовательности панкреатической эластазы типа I свиней проводили ПЦР-реакцию для включения рестрикционных XhoI- и SacII-сайтов в целях клонирования в вектор PV-1. ПЦР-продукт гидролизовали, подвергали гель-очистке и лигировали с вектором PV-1, гидролизованным ферментами XhoI и SacII, в результате чего получали экспрессионный вектор pPROT101-24-V, кодирующий активированный трипсином пробелок панкреатической эластазы типа I свиней.
Фигура 17. Анализ экспрессии аутоактивированного клона pPROT101-42-V и активированного трипсином клона pPROT101-24-V в процессе индуцирования метанолом, проводимый с помощью электрофореза в ДСН-ПААГ. Супернатанты в шейкерных колбах, полученные через 1 день после индуцирования, анализировали в 8-16% градиенте геля с последующим окрашиванием кумасси. Дорожки 1-10 содержат супернатанты от десяти различных клонов, трансформированных вектором pPROT101-42-V. Дорожки 11-12 содержат супернатанты от двух различных клонов, трансформированных вектором pPROT101-24-V. M, маркеры молекулярной массы.
Фигура 18. Анализ экспрессии аутоактивированного клона pPROT101-49-V и клона pPROT101-55L-V в процессе индуцирования метанолом, проводимый с помощью электрофореза в ДСН-ПААГ. Супернатанты в шейкерных колбах, полученные через 1 и 2 дня после индуцирования, анализировали в 8-16% градиенте геля с последующим окрашиванием кумасси. Дорожки 1-2 содержат супернатанты от клона pPROT101-49-V, полученные через 1 и 2 дня после индуцирования, соответственно. Дорожки 3-4 содержат супернатанты от клона pPROT101-55L-V, полученные через 1 и 2 дня после индуцирования, соответственно. M, маркеры молекулярной массы.
Фигура 19. Активация белков pPROT101-49-V и pPROT101-55L-V в зависимости от времени в лабораторном анализе на превращение, определяемое по SLAP-реакции на эластазную активность. Величина ошибки дана как ± ср.кв.ош. среднего (n=4).
Фигура 20. ДСН-ПААГ-анализ супернатантов pPROT101-49-V и pPROT101-55L-V, проводимый до и после лабораторного анализа на превращение. Перед проведением электрофореза, образцы смешивали с лимонной кислотой, с восстановителем TCEP и с буфером для образцов LDS (Invitrogen, CA). Образцы нагревали при 70°C в течение 10 минут. Дорожки 1-2: pPROT101-49-V до и после проведения анализа супернатанта на превращение, соответственно; дорожки 3-4: pPROT101-55L-V до и после проведения анализа супернатанта на превращение, соответственно. M, маркеры молекулярной массы.
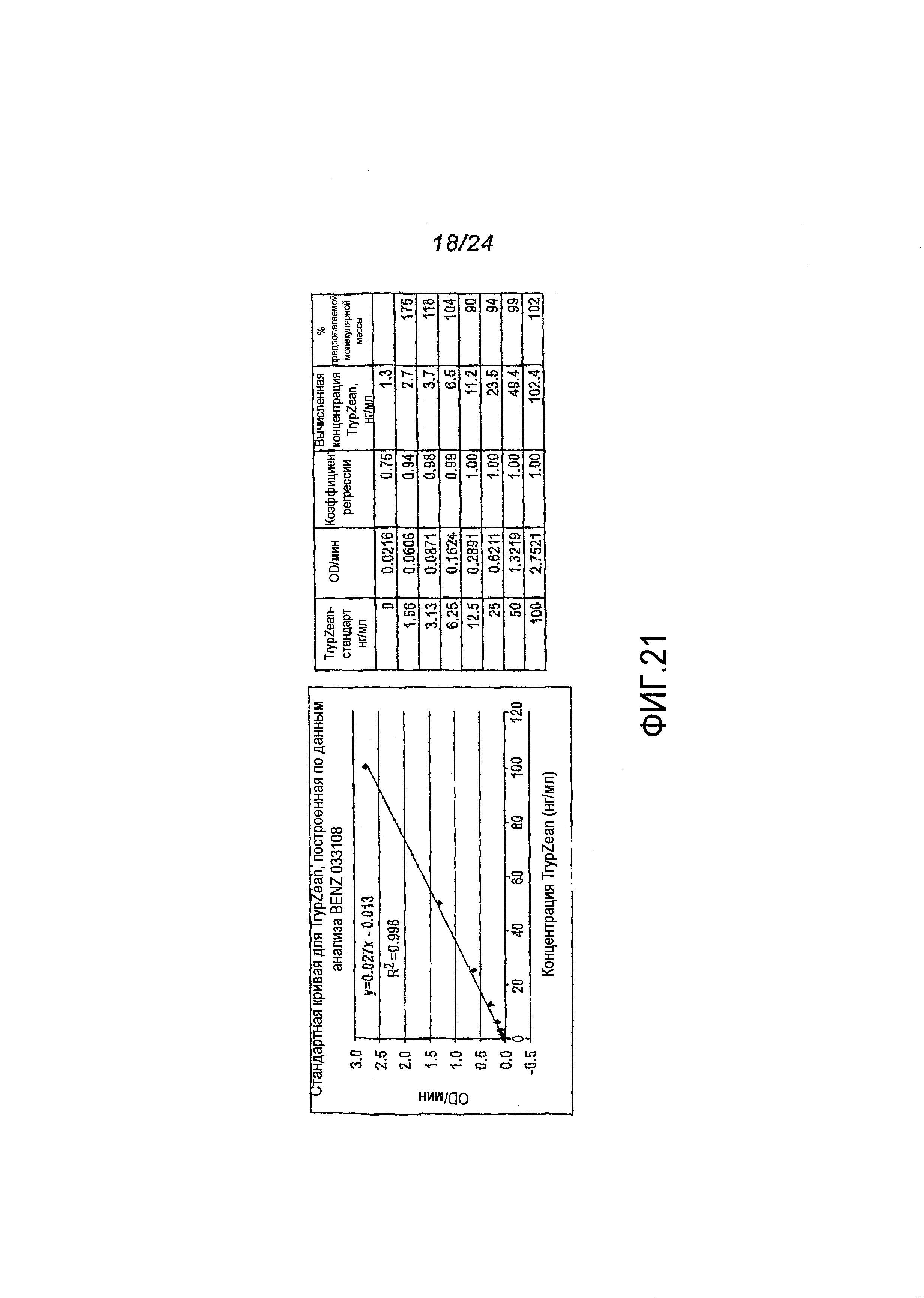
Фигура 21.Стандартнаякривая для TrypZean.
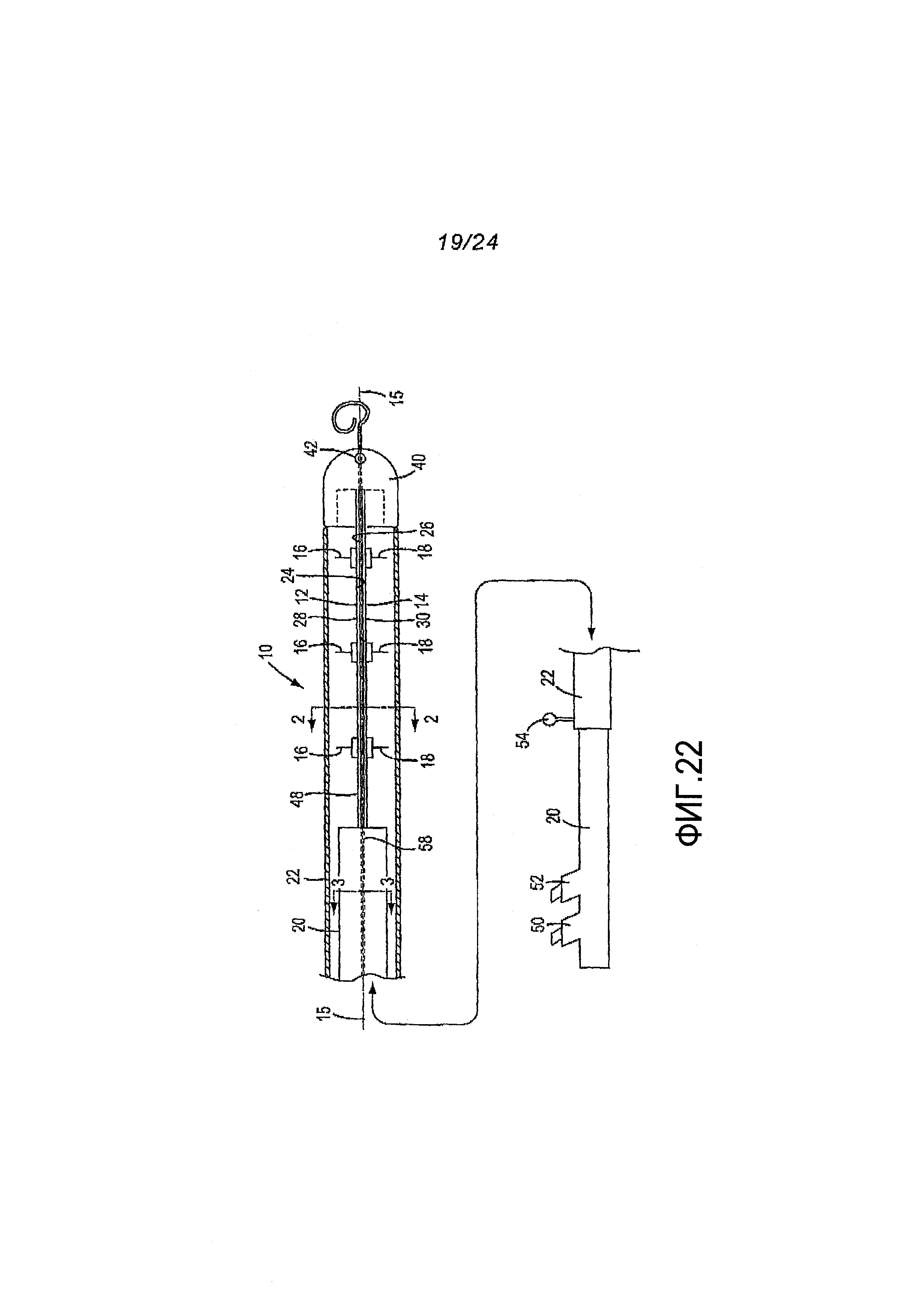
Фигура 22. Вид сбоку, в частном разрезе,одного из вариантов медицинского устройства, описанного в разделе 5.9.
Фигура 23. Вид устройства, аналогичный представленному на фигуре 22, где проиллюстрировано движение приводов медицинского устройства.
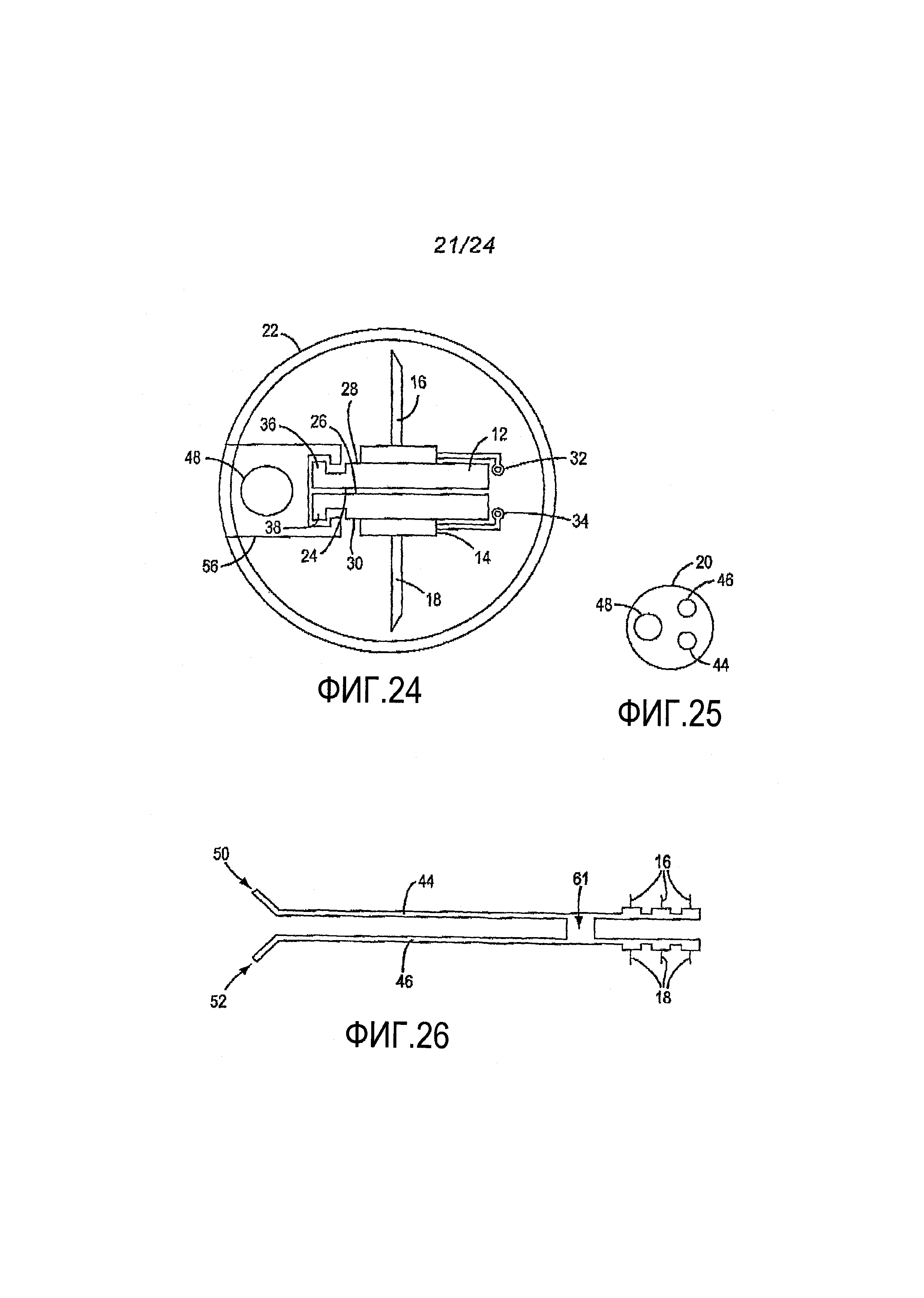
Фигура 24. Вид в разрезе с торца в плоскости линии 2-2 на фигуре 22.
Фигура 25. Вид в разрезе с торца в плоскости линии 3-3 на фигуре 22.
Фигура 26. Диаграмма пути прохождения жидкости в медицинском устройстве, изображенном на фигуре 22, где указанный путь проходит от люэровских наконечников через каналы для доставки жидкости в резервуар, а затем в тканевые пенетраторы.
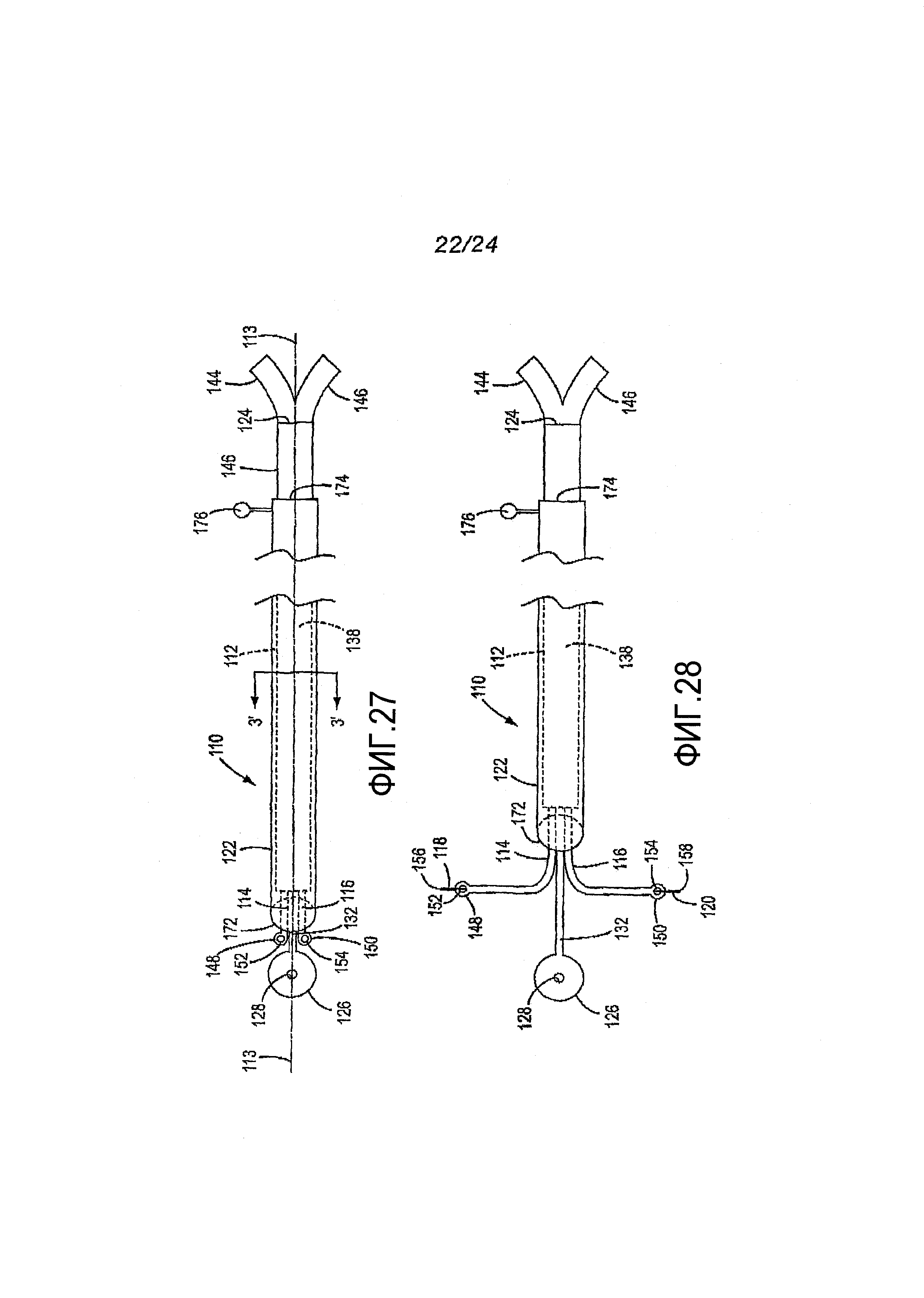
Фигура 27. Вид сбоку, в частном разрезе,второго варианта медицинского устройства согласно изобретению, иллюстрирующий приводы в их ограничительных конфигурациях.
Фигура 28. Вид устройства, аналогичный представленному на фигуре 27, где проиллюстрированы приводы в их неограничительных конфигурациях.
Фигура 29. Вид с торца перспективного изображения устройства вдоль линии 3’-3’, как показано на фигуре 27.
Фигура 30. Вид с торца перспективного изображения устройства вдоль линии 4’-4’, как показано на фигуре 29, иллюстрирующей тканевые пенетраторы.
Фигура 31. Вид сбоку, подробно иллюстрирующий проксимальный конец устройства, показанный справа на фигурах 27 и 28.
Фигура 32. Изображение с частным разрезом внешнего вида медицинского устройства, представленного на фигуре 22 в его ограничительном положении.
Подробное описание изобретения
Настоящее изобретение относится к способам рекомбинантной экспрессии и продуцирования зрелых биологически активных белков эластазы. Настоящее изобретение относится к новым эффективным способам получения белков эластазы путем культивирования клеток-хозяев, включая предпочтительные клетки-хозяева Pichia pastoris, содержащих нуклеиновые кислоты, кодирующие белки проэластазы и белки препроэластазы. Настоящее изобретение также относится к применению таких рекомбинантных белков в целях получения фармацевтических композиций для лечения и предупреждения заболеваний биологических каналов (включая артерии или вены).
В некоторых своих аспектах, настоящее изобретение относится к рекомбинантным аутоактивированным белкам проэластазы и к родственным нуклеиновым кислотам, к клеткам-хозяевам и к способам их получения. Такие аутоактивированные белки проэластазы были сконструированы так, чтобы они содержали сайт распознавания эластазы, расположенный непосредственно у N-конца по отношению к первому остатку зрелого белка эластазы. Конкретные условия культивирования, такие как условия, описанные ниже в разделе 6, позволяют снижать уровень аутоактивации вплоть до желаемого уровня активации. Аутоактивацию можно также снижать до момента, когда проэластаза не будет удалена из клеточной культуры.
Настоящее изобретение относится к эффективным способам экспрессии и очистки, применяемым для продуцирования белков эластазы фармацевтической чистоты. Настоящее изобретение также относится к способам лечения или предупреждения заболеваний биологических каналов, проводимым с использованием белков эластазы согласно изобретению.
Описание в разделе 5 настоящей заявки применимо к вариантам осуществления изобретения, приведенным в разделе 8. Таким образом, ссылка на белок эластазы согласно изобретению, включает, но не ограничиваются ими, белок эластазы согласно любому из вариантов осуществления изобретения 1-39 и 68-69, или белок эластазы, который был получен или может быть получен способом, описанным в любом из вариантов осуществления 89-224, 261-276 и 347-373. Аналогичным образом, ссылка на нуклеиновую кислоту согласно изобретению включает, inter alia, нуклеиновую кислоту согласно любому из вариантов осуществления 40-67; ссылка на вектор включает, inter alia, вектор согласно любому из вариантов осуществления 70-72; ссылка на клетки включает, inter alia, клетки согласно любому из вариантов осуществления 73-87, ссылка на супернатант клеточной культуры включает, inter alia, супернатант клеточной культуры согласно варианту осуществления 88; ссылка на композиции, такие как фармацевтические композиции, эластазные препараты и лекарственные формы включает, например, указанные композиции, препараты и формы, которые описаны в вариантах осуществления 277-314, 346, 386 и 415-420, или которые были получены или могут быть получены способом, описанным в любом из вариантов осуществления 261-276 и 374-385, а ссылки на способы терапии также включают способы терапии, описанные в любом из вариантов осуществления 387-414, ссылка на набор включает, inter alia, набор согласно любому из вариантов осуществления 421-425 раздела 8.
5.1. Белки эластазы
Настоящее изобретение относится, inter alia, к способам рекомбинантной экспрессии и к способам получения зрелых биологически активных белков эластазы. Белки эластазы, в основном, экспрессируются как препробелки, содержащие, помимо других последовательностей, сигнальный пептид, пептид активации и зрелую часть, обладающую биологической активностью. Подходящие последовательности зрелого белка эластазы описаны ниже в разделе 5.1.1. Подходящие последовательности пептида активации белка описаны ниже в разделе 5.1.2. Подходящие последовательности описаны ниже в разделе 5.1.3.
В соответствии с некоторыми аспектами изобретения, белками эластазы согласно изобретению являются белки препроэластазы. Удаление сигнальной последовательности из препробелка после секреции, обычно приводит к образованию неактивного пробелка, содержащего пептид активации и зрелый белок. Используемые здесь термины «последовательность активации» и «пептид активации» являются синонимами. Таким образом, в других аспектах изобретения, белки эластазы согласно изобретению представляют собой белки проэластазы, содержащие пептид активации, который функционально связан со зрелым белком эластазы. В характерном варианте осуществления изобретения, пептид активации или последовательность панкреатической эластазы дикого типа I человека включают первые 10 N-концевых аминокислот белка проэластазы типа I человека (SEQ ID NO:22). В некоторых вариантах осуществления изобретения, пептидом активации является пептид SEQ ID NO:80. Пептидами активации или последовательностями, используемыми для осуществления настоящего изобретения, также являются, но не ограничиваются ими, SEQ ID NO:23, 72 и 73. Другие последовательности активации, используемые для осуществления настоящего изобретения, могут происходить от N-концевых остатков 1-10 SEQ ID NO:64-69 и 98-103.
Удаление пептида активации из последовательности проэластазы приводит к образованию зрелого белка эластазы. Стадия, посредством которой пептид активации удаляется из последовательности проэластазы/отделяется от зрелой последовательности эластазы с образованием зрелого белка эластазы, называется здесь стадией активации. Таким образом, в других аспектах изобретения, белками эластазы согласно изобретению являются зрелые белки эластазы.
Аминокислотные остатки, составляющие С-конец (то есть карбокси-конец) пептида активации и N-конец (то есть амино-конец) зрелого белка, которые окружают расщепляемую связь, представлены на фигуре 2, а также идентифицированы ниже. Остатки, локализованные у С-конца пептида активации, обозначены PX, ... P5, P4, P3, P2 и P1, где P1 представляет собой С-концевой остаток пептида активации. Остатки, локализованные у N-конца зрелого белка обозначены P1′, P2′, P3′,...PX′, где P1′ представляет собой N-концевой аминокислотный остаток зрелого белка. Расщепляемая связь, которая расщепляется в результате протеолиза (называемая на фигуре 2 «расщепляемой связью»), представляет собой пептидную связь между остатком P1 пептида активации и остатком P1′ зрелого белка.
Область, охватывающая 4 аминокислоты, начиная от С-конца пептида активации (остатки P4-P1), и простирающаяся до первых 4 аминокислот N-конца зрелого белка (остатки P1′-P4′), называется здесь «сайтом расщепления».
Область, охватывающая приблизительно 5 аминокислот, начиная от С-конца пептида активации (то есть остатки P5-P1), и простирающаяся приблизительно до первых 3 аминокислот N-конца зрелого белка (то есть остатки P1′-P3′), называется здесь «доменом расщепления». Примерами доменов расщепления, которые могут быть использованы в описании настоящего изобретения, являются, но не ограничиваются ими, SEQ ID NO: 42, 43, 48, 49, 52, 53, 54 или 55. Другими доменами расщепления, которые могут быть использованы в настоящем изобретении, являются любые последовательности, представленные консенсусной последовательностью домена расщепления Xaa1 Xaa2 Xaa3 Xaa4 Xaa5 Xaa6 Xaa7 Xaa8, где Xaa1=P5, Xaa2=P4, Xaa3=P3, Xaa4=P2, Xaa5=P1, Xaa6=P1′, Xaa7=P2′ и Xaa8=P3′, где:
- Xaa1 представляет собой глутамин, гистидин, пролин, глицин, аспарагин, лизин или аланин, или, необязательно, их аналог;
- Xaa2 представляет собой треонин, аланин, пролин или гистидин или, необязательно, их аналог;
- Xaa3 представляет собой аланин, лейцин, изолейцин, метионин, лизин, аспарагин или валин, или, необязательно, их аналог, но предпочтительно, не глицин или не пролин;
- Xaa4 представляет собой пролин, аланин, лейцин, изолейцин, глицин, валин или треонин, или, необязательно, их аналог;
- Xaa5 представляет собой аланин, лейцин, валин, изолейцин или серин, но не глицин, тирозин, фенилаланин, пролин, аргинин, глутамин или лизин, или, необязательно, их аналог;
- Xaa6 представляет собой аланин, лейцин, валин, изолейцин или серин, или необязательно, их аналог;
- Xaa7 представляет собой глицин, аланин или валин, или, необязательно, их аналог; и
- Xaa8 представляет собой валин, треонин, фенилаланин, тирозин или триптофан, или, необязательно, их аналог.
Область из трех аминокислот, охватывающая остатки P3, P2 и P1 пептида активации, называется здесь «сайтом распознавания эластазы». Примерами сайтов распознавания, которые могут быть использованы в описании изобретения, являются, но не ограничиваются ими, SEQ ID NO:14-16 и 18-21. Другими сайтами распознавания, рассматриваемыми в настоящем изобретении, является любой сайт распознавания, представленный консенсусными сайтами распознавания SEQ ID NO:11, 12, 13 или 93. Консенсусная последовательность 1 распознавания эластазы SEQ ID NO:11 представлена пептидной последовательностью Xaa1 Xaa2 Xaa3, где Xaa1=P3, Xaa2=P2, Xaa3=P1, где:
- Xaa1 представляет собой аланин, лейцин, изолейцин, метионин, лизин, аспарагин или валин, или, необязательно, их аналог, но предпочтительно, не глицин или не пролин;
- Xaa2 представляет собой пролин, аланин, лейцин, изолейцин, глицин, валин или треонин, или, необязательно, их аналог;
- Xaa3 представляет собой аланин, лейцин, валин, изолейцин или серин, или, необязательно, их аналог, но предпочтительно, не глицин, не тирозин, не фенилаланин, не пролин, не аргинин, не глутамин или не лизин.
Консенсусная последовательность 2 распознавания эластазы SEQ ID NO:12 представлена последовательностью Xaa1 Pro Xaa2, где:
- Xaa1 представляет собой аланин, лейцин, изолейцин, метионин, лизин или валин, или, необязательно, их аналог, но предпочтительно, не глицин или не пролин;
- Pro представляет собой пролин или, необязательно, его аналог;
- Xaa2 представляет собой аланин, лейцин, валин, изолейцин или серин, или, необязательно, их аналог, но предпочтительно, не глицин, не тирозин, не фенилаланин, не пролин, не аргинин, не глутамин или не лизин.
Консенсусная последовательность 3 распознавания эластазы SEQ ID NO:13 представлена пептидной последовательностью Xaa1 Xaa2 Xaa3, где Xaa1=P3, Xaa2=P2, Xaa3=P1, где Xaa1 представляет собой аспарагин или аланин, или, необязательно, их аналог; где Xaa2 представляет собой пролин или аланин, или, необязательно, их аналог, а Xaa3 представляет собой аланин, лейцин или валин, или, необязательно их аналог.
Консенсусная последовательность 4 распознавания эластазы SEQ ID NO:93 представлена последовательностью Xaa1 Pro Xaa2, где:
- Xaa1 представляет собой аланин, лейцин, изолейцин, метионин, лизин, аспарагин или валин, или, необязательно, их аналог, но предпочтительно, не глицин или не пролин;
- Pro представляет собой пролин или, необязательно, его аналог;
- Xaa2 представляет собой аланин, лейцин, валин, изолейцин или серин, или, необязательно, их аналог, но предпочтительно, не глицин, не тирозин, не фенилаланин, не пролин, не аргинин, не глутамин или не лизин.
Ссылки на последовательности, называемые здесь «последовательностью расщепления», «доменом расщепления», «последовательностью активации», «последовательностью распознавания эластазы» и т.п., приводятся лишь для простоты описания, но, при этом, не имеется в виду какая-либо функция данной последовательности или какой-либо механизм, посредством которого данная последовательность распознается или процессируется.
Белки согласно изобретению обычно состоят из аминокислот и могут также включать один или несколько (например, до 2, 3, 4, 5, 6, 7, 8, 9, 10, 12 или 15) аминокислотных аналогов. В общих чертах, используемый здесь термин «аминокислота» означает природный L-стереоизомер. Аминокислотный аналог означает D-стереоизомер, химически модифицированную аминокислоту или другую не-природную аминокислоту. Так, например, не-природными аминокислотами являются, но не ограничиваются ими, азетидинкарбоновая кислота, 2-аминоадипиновая кислота, 3-аминоадипиновая кислота, β-аланин, аминопропионовая кислота, 2-аминомасляная кислота, 4-аминомасляная кислота, 6-аминокапроевая кислота, 2-аминогептановая кислота, 2-аминоизомасляная кислота, 3-аминоизомасляная кислота, 2-аминопимелиновая кислота, трет-бутилглицин, 2,4-диаминоизомасляная кислота, десмозин, 2,2'-диаминопимелиновая кислота, 2,3-диаминопропионовая кислота, N-этилглицин, N-этиласпарагин, гомопролин, гидроксилизин, алло-гидроксилизин, 3-гидроксипролин, 4-гидроксипролин, изодесмозин, алло-изолейцин, N-метилаланин, N-метилглицин, N-метилизолейцин, N-метилпентилглицин, N-метилвалин, нафталанин, норвалин, норлейцин, орнитин, пентилглицин, пипеколиновая кислота и тиопролин. Химически модифицированная аминокислота представляет собой аминокислоту, которая является обратимо или необратимо химически блокированной, и/или которая является модифицированной в одной или нескольких боковых группах, у α-углеродных атомов, у концевой аминогруппы или у концевой карбоксильной группы. Химическая модификация включает присоединение химических групп, создание новых связей и удаления химических групп. Примерами химически модифицированных аминокислот являются, например, сульфоксид метионина, метионинсульфон, S-(карбоксиметил)-цистеин, S-(карбоксиметил)цистеинсульфоксид и S-(карбоксиметил)цистеинсульфон. Модификациями в аминоксилотных боковых группах являются ацилирование ε-аминогрупп лизина; N-алкилирование аргинина, гистидина или лизина; алкилирование карбоксильных групп глутаминовой или аспарагиновой кислоты; и дезамидирование глутамина или аспарагина. Модификациями концевых аминогрупп являются модификации дез-аминогруппы, N-низшего алкила, N-ди-низшего алкила и N-ацила. Модификациями концевых карбокси-групп являются модификации амида, низшего алкиламида, диалкиламида и низшего алкилового эфира. Низшим алкилом является C1-C4-алкил. Кроме того, одна или несколько боковых групп или концевых групп могут быть защищены защитными группами, известными среднему специалисту в области химии белков. α-Углерод аминокислоты может быть моно- или диметилированным.
Белки согласно изобретению могут быть модифицированы или дериватизированы, например, они могут быть модифицированы путем фосфорилирования или гликозилирования, либо они могут быть дериватизированы путем конъюгирования, например, конъюгирования с липидом или с другим белком (например, для доставки лекарственного средства или для стабилизации) или т.п.
В большинстве случаев, настоящее изобретение относится к «выделенному» или «очищенному» белку эластазы. Выделенным белком эластазы является белок, удаленный из его клеточной среды. Очищенный белок эластазы, по существу, не содержит клеточного материала или других примесных белков, присутствующих в клеточных или тканевых источниках, от которых происходит данный белок эластазы, или, по существу, не содержит химических предшественников или других химических веществ, образующихся при химическом синтезе. Термин «по существу, не содержит клеточного материала» относится к препаратам белка эластазы, где белок отделен от компонентов клетки, из которых он был рекомбинантно продуцирован. Таким образом, термин «белок эластазы, который, по существу, не содержит клеточного материала», включает препараты белка эластазы, содержащие менее чем примерно 30%, 20%, 10% или 5% (в расчете на сухую массу) гетерологичного белка (также называемого здесь «примесным белком»). Если белок эластазы был получен посредством его секреции в культуральную среду, то такой белок также, предпочтительно, по существу, не содержит культуральной среды, то есть содержание культуральной среды составляет менее чем примерно 20%, 10% или 5% по объему препарата белка эластазы.
В некоторых вариантах осуществления изобретения, выделенная или очищенная эластаза также не содержит или, по существу, не содержит клеточной ДНК. В конкретных вариантах осуществления изобретения, геномная ДНК клетки-хозяина присутствует в количестве менее чем 10 пикограммов, менее чем 5 пикограммов, менее чем 3 пикограмма, менее чем 2 пикограмма, или менее чем 1 пикограмм ДНК на миллиграмм белка эластазы в препарате выделенного или очищенного белка эластазы или в композиции, содержащей выделенный или очищенный белок эластазы. В одном из вариантов осуществления изобретения, ДНК клетки-хозяина представляет собой ДНК Pichia pastoris.
Подходящие последовательности белка эластазы представлены в таблице 1. В своем конкретном варианте осуществления, настоящее изобретение относится к белку проэластазы (включая, но не ограничиваясь им, белок любой из последовательностей SEQ ID NO:6-9, 64-69, 88-91 и 98-103), включающему (i) последовательность активации, содержащую последовательность распознавания эластазы, функционально связанную с (ii) аминокислотной последовательностью белка, обладающего эластазной активностью типа I. Некоторые полиморфизмы эластазы типа I человека известны специалистам. При этом, рассматривается любая комбинация полиморфизмов в последовательностях белка проэластазы согласно изобретению, включая, но не ограничиваясь ими, комбинации полиморфизмов, представленные в таблице 2. Данный белок также содержит, но необязательно, сигнальную последовательность, функционально связанную с указанной последовательностью активации. В некоторых вариантах осуществления изобретения, сигнальной последовательностью является последовательность, функционирующая в Pichia pastoris, например, сигнальный пептид α-фактора дрожжей, представленный аминокислотной последовательностью SEQ ID NO:34. Альтернативные последовательности, содержащие сигнальный пептид представлены последовательностями SEQ ID NO:50 и 96 (содержащими сигнальный пептид, не-пропептид эластазы и спейсерную последовательность) и SEQ ID NO:51 и 97 (содержащими сигнальный пептид и не-эластазный пропептид). В других конкретных вариантах осуществления изобретения сигнальной последовательностью является сигнальная последовательность, секретирующаяся у млекопитающего, такая как сигнальная последовательность эластазы свиней. Предпочтительно, последовательностью распознавания эластазы является последовательность распознавания эластазы типа I, а наиболее предпочтительно, последовательность распознавания эластазы типа I человека.
Настоящее изобретение также охватывает варианты белков эластазы согласно изобретению. Варианты могут содержать аминокислотные замены в одном или нескольких предсказанных остатках заменимых аминокислот. Предпочтительно, вариант включает не более чем 15, не более чем 12, не более чем 10, не более чем 9, не более чем 8, не более чем 7, не более чем 6, не более чем 5, не более чем 4, не более чем 3, не более чем 2 или не более чем 1 консервативную аминокислотную замену по сравнению с природной зрелой эластазой и/или не более чем 5, не более чем 4, не более чем 3, или не более чем 2 не-консервативных аминокислотных замены или не более чем 1 не-консервативную аминокислотную замену по сравнению с природной зрелой эластазой.
В конкретных вариантах осуществления изобретения, указанный вариант имеет не более чем 10 или предпочтительно, не более чем пять консервативных аминокислотных замен по сравнению со зрелой эластазой, проэластазой или препроэластазой согласно изобретению, например, по сравнению со зрелой эластазой SEQ ID NO:1 или SEQ ID NO:84, или белком проэластазы SEQ ID NO:6-9, 64-69, 88-91 и 98-103. Аминокислотные последовательности SEQ ID NO:1 и 84 содержат одно или несколько положений, соответствующих положениям с возможным полиморфизмом в последовательности зрелой эластазы, а именно положения 44 (W или R); 59 (M или V); 220 (V или L); и 243 (Q или R) (положения относятся к препробелку). Таким образом, настоящее изобретение охватывает зрелые белки эластазы с любой комбинацией из четырех полиморфизмов, идентифицированных в SEQ ID NO:84. Каждая из таких комбинаций представлена выше в таблице 3. Последовательности SEQ ID NO:88-91 и 98-103 могут также иметь полиморфизм в пропептидной последовательности в положении 10 (Q или H). Настоящее изобретение также охватывает последовательности препроэластазы и последовательности проэластазы, содержащие любую комбинацию из пяти полиморфизмов, идентифицированных в SEQ ID NO:88-91 и 98-103. Каждая из таких комбинаций представлена выше в таблице 2.
Термин «консервативная аминокислотная замена» означает замену, при которой аминокислотный остаток заменен аминокислотным остатком, имеющим аналогичную боковую цепь. Семейства аминокислотных остатков, имеющих аналогичные боковые цепи, определены в литературе. К таким семействам относятся аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), с кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), с незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), с неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), с бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан).
Варианты белков эластазы согласно изобретению могут включать аминокислотные замены аминокислотными аналогами, а также аминокислотами, описанными в настоящей заявке.
В конкретных вариантах осуществления изобретения, белок согласно изобретению содержит или, по существу, состоит из них, вариант зрелой эластазы типа I человека, например, вариант, который, по меньшей мере примерно на 75%, 85%, 90%, 93%, 95%, 96%, 97%, 98% или 99% идентичен белкам проэластазы или зрелым эластазным белкам, перечисленным в таблице 1, таким как, но не ограничивающимся ими, белки проэластазы SEQ ID NO:6-9, 64-69, 88-91 и 98-103, и который сохраняет эластазную активность при его экспрессии с образованием зрелого белка эластазы SEQ ID NO:1, 4, 5, 84 или 87.
Для определения процента идентичности двух аминокислотных последовательностей или двух нуклеиновых кислот, такие последовательности выравнивают для оптимального сопоставления (например, для оптимального выравнивания первой аминокислотной последовательности или последовательности нуклеиновой кислоты со второй аминокислотной последовательностью или последовательностью нуклеиновой кислоты, в данные последовательности могут быть введены пробелы). Затем проводят сравнение аминокислотных остатков или нуклеотидов в соответствующих положениях аминокислот или нуклеотидов. Если положение в первой последовательности занято таким же аминокислотным остатком или нуклеотидом, как и соответствующее положение во второй последовательности, то такие молекулы являются идентичными в этом положении. Процент идентичности между двумя последовательностями зависит от числа идентичных положений двух сравниваемых последовательностей (% идентичности =(число (#) идентичных положений/общее число (#) перекрывающихся положений)×100). В одном из вариантов осуществления изобретения, две последовательности имеют одну и ту же длину. В других вариантах осуществления изобретения, две последовательности имеют различные длины, отличающиеся не более чем на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% или 10%.
Определение процента идентичности двух последовательностей может быть осуществлено с использованием математического алгоритма. Предпочтительным и неограничивающим примером математического алгоритма, используемого для сравнения двух последовательностей, является алгоритм Karlin и Altschul (1990) Proc. Natl. Acad. Sci. USA 87:2264-2268, модифицированного как описано в работе Karlin & Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877. Такой алгоритм был введен в компьютерные программы NBLAST и XBLAST, разработанные Altschul, et al. (1990) J. Mol. Biol. 215:403-410. Поиск нуклеотидов в BLAST может быть осуществлен с помощью программы NBLAST, где «баллы» = 100, длина слова = 12, в целях получения нуклеотидных последовательностей, гомологичных молекулам нуклеиновой кислоты согласно изобретению. Поиск белков в BLAST может быть осуществлен с помощью программы XBLAST, где «баллы» = 50, длина слова = 3, в целях получения аминокислотных последовательностей, гомологичных молекулам белка согласно изобретению. Для выравнивания последовательностей с введением пробелов для сравнения этих последовательностей, может быть использована программа BLAST с пробелами, описанная Altschul et al. (1997) Nucleic Acids Res. 25:3389-3402. Альтернативно, для осуществления итеративного поиска, позволяющего детектировать отдаленное родство между молекулами, может быть использована программа PSI-Blast (Id.). При применении программ BLAST, BLAST с пробелами и PSI-Blast могут быть использованы параметры по умолчанию, имеющиеся в соответствующих программах (например, XBLAST и NBLAST). См. http://www.ncbi.nlm.nih.gov.
Другим предпочтительным неограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм Myers и Miller, CABIOS (1989). Такой алгоритм включен в программу ALIGN (версия 2.0), которая является частью пакета программ выравнивания последовательностей CGC. При применении программы ALIGN для сравнения аминокислотных последовательностей могут быть использованы таблица «взвешенных» остатков PAM120, штраф за пробел-удлинение 12, и штраф за пробел-пропуск 4. Другими алгоритмами для анализа последовательностей, известными специалистам, являются ADVANCE и ADAM, описанные в публикации Torellis and Robotti, 1994, Comput. Appl. Biosci. 10:3-5; и FASTA, описанный в публикации Pearson and Lipman, 1988, Proc. Natl. Acad. Sci.85:2444-8. В FASTA, ktup представляет собой контрольную опцию, которая устанавливает чувствительность и скорость поиска. Если ktup=2, то аналогичные области двух сравниваемых последовательностей обнаруживают путем оценки пар выравниваемых остатков; а если ktup=1, то при выравнивании оцениваются одиночные аминокислотные остатки. Опция ktup может быть установлена на 2 или 1 для последовательностей белка, или на 1-6 для последовательностей ДНК. Если опция ktup не задана, то по умолчанию, она может быть установлена на 2 для белков и 6 для ДНК. Дополнительное описание параметров FASTA можно найти на сайте http://bioweb.pasteur.fr/docs/man/man/fasta.1.html#sect2, содержание которого вводится в настоящее описание посредством ссылки.
Процент идентичности между двумя последовательностями может быть определен методами, аналогичными методам, описанным выше, с введением или без введения допустимых пробелов. При вычислении процента идентичности обычно подсчитывают точное число соответствий.
Белки эластазы согласно изобретению могут иметь посттрансляционные модификации, включая, но не ограничиваясь ими, гликозилирование (например, N-связанное или O-связанное гликозилирование), миристилирование, пальмитилирование, ацетилирование и фосфорилирование (например, серина/треонина или тирозина). В одном из вариантов осуществления изобретения, белки эластазы согласно изобретению имеют пониженные уровни O-связанного гликозилирования и/или N-связанного гликозилирования по сравнению с эндогенно экспрессируемыми эластазами. В другом варианте осуществления изобретения, белки эластазы согласно изобретению не обнаруживают O-связанного гликозилирования или N-связанного гликозилирования.
5.1.1. Последовательность зрелой эластазы
Последовательностями зрелой эластазы согласно изобретению, предпочтительно, являются последовательности эластазы млекопитающих, а наиболее предпочтительно, последовательности эластазы человека. В других вариантах осуществления изобретения, последовательности зрелой эластазы млекопитающих происходят от других млекопитающих, таких как мыши, крысы, свиньи, коровы или лошади.
В способах и композициях согласно изобретению, используемой последовательностью зрелой эластазы, предпочтительно, является панкреатическая эластаза типа I, которая преимущественно расщепляет последовательности гидрофобного белка, предпочтительно, со стороны карбокси-конца небольших гидрофобных остатков, таких как аланин. Примерами панкреатических эластаз типа I являются фермент эластаза I человека (NCBI рег. № NP_001962), которая экспрессируется в коже, и фермент панкреатическая эластаза I свиней (NCBI рег. № CAA27670), которая экспрессируется в поджелудочной железе. SEQ ID NO:1 и SEQ ID NO:84 являются примерами последовательностей зрелой эластазы типа I человека.
Альтернативно, может быть использована эластаза типа II, которая может расщеплять последовательности гидрофобного белка, предпочтительно, со стороны карбокси-конца от средних до крупных гидрофобных аминокислотных остатков. Примерами эластаз типа II являются фермент эластаза IIA человека (NCBI рег. № NP254275) и фермент эластаза II свиней (NCBI рег. № A26823), которые оба экспрессируются в поджелудочной железе.
Настоящее изобретение также относится к вариантам зрелого белка эластазы согласно изобретению. Такими вариантами являются белки, содержащие аминокислотные последовательности, которые являются достаточно идентичными аминокислотной последовательности зрелого белка эластазы согласно изобретению или происходят от такой последовательности, а также обладают эластазной биологической активностью. Биологически активной частью зрелого белка эластазы согласно изобретению может быть белок, который имеет, например, длину по меньшей мере 150, 160, 175, 180, 185, 190, 200, 210, 220, 230, 231, 232, 233, 234, 235, 236, 237, 238 или 239 аминокислот. Кроме того, другие биологически активные части, в которых другие области белка являются делетированными, могут быть получены рекомбинантными методами и оценены на одну или несколько функциональных активностей нативной формы зрелого белка эластазы согласно изобретению.
Кроме того, зрелые белки эластазы, включающие любую комбинацию из четырех полиморфизмов эластазы типа I человека, представлены в SEQ ID NO:84. Возможные комбинации приводятся выше в таблице 3.
5.1.2. Последовательности активации проэластазы
Последовательностью активации эластазы является любая последовательность, удаление которой из белка проэластазы, приводит к образованию биологически активного зрелого белка эластазы.
Последовательности активации обычно содержат сайты распознавания протеазы, смежные с последовательностью пробелка, который отщепляется с образованием зрелых биологически активных белков. Последовательность активации может быть сконструирована в целях присоединения сайта распознавания протеазы или эластазы, либо она может быть сконструирована в целях замены имеющегося сайта распознавания протеазы другим сайтом распознавания протеазы. Пептидами или последовательностями активации, используемыми для осуществления изобретения, являются, но не ограничиваются ими, SEQ ID NO:23, 72 и 73. Другие последовательности активации, используемые для осуществления изобретения, могут быть получены из N-концевых остатков 1-10 SEQ ID NO:64-68. В предпочтительных аспектах изобретения, последовательность активации проэластазы конструируют так, чтобы она содержала последовательность распознавания эластазы типа I или типа II. Более предпочтительно, последовательность распознавания эластазы распознается зрелой эластазой, с которой она функционально связана. Таким образом, в вариантах, относящихся к эластазе типа II, последовательностью распознавания, наиболее предпочтительно, является последовательность распознавания эластазы типа II. И наоборот, в вариантах осуществления, относящихся к эластазе типа I, последовательностью распознавания, наиболее предпочтительно, является последовательность распознавания эластазы типа I. В предпочтительном варианте осуществления изобретения, последовательностью распознавания является последовательность распознавания эластазы типа I человека. Характерными последовательностями распознавания типа I являются аминокислотные последовательности SEQ ID NO:14-16 и 18-21. Другими сайтами распознавания, рассматриваемыми в настоящем изобретении, являются любые сайты распознавания, представленные консенсусными сайтами распознавания SEQ ID NO: 11, 12 или 13.
5.1.3. Сигнальные последовательности
Белки проэластазы согласно изобретению могут также содержать сигнальную последовательность, которая повышает уровень секреции белка проэластазы в культуральной среде клеток-хозяев, в которой он экспрессируется.
Нативная сигнальная последовательность белка эластазы может быть использована, в частности, для экспрессии в клетках-хозяевах млекопитающих. В других вариантах осуществления изобретения, нативная сигнальная последовательность белка эластазы согласно изобретению может быть удалена из другого белка и заменена сигнальной последовательностью этого другого белка, такой как сигнальная последовательность эластазы типа I свиней, сигнальная последовательность эластазы типа I человека или сигнальная последовательность α-фактора дрожжей. В некоторых конкретных вариантах осуществления изобретения, сигнальный пептид α-фактора дрожжей может также включать (1) пропептид α-фактора дрожжей или (2) пропептид α-фактора дрожжей и спейсерную последовательность, где каждый из этих компонентов представлен аминокислотной последовательностью SEQ ID NO:50 и 96 или SEQ ID NO:51 и 97, соответственно. Альтернативно, в качестве гетерологичной сигнальной последовательности может быть использована секреторная последовательность белка оболочки бакуловируса gp67 (Current Protocols в Molecular Biology (Ausubel et al., eds., John Wiley & Sons, 1992)). Другими примерами эукариотических гетерологичных сигнальных последовательностей являются секреторные последовательности меллитина и щелочной фосфатазы плаценты человека (Stratagene; La Jolla, California). В другом примере, подходящими прокариотическими гетерологичными сигнальными последовательностями являются сигнальная последовательность секреции phoA (Sambrook et al., supra) и сигнальная последовательность секреции белка А (Pharmacia Biotech; Piscataway, New Jersey).
5.2. Нуклеиновые кислоты эластазы
В одном из своих аспектов, настоящее изобретение относится к рекомбинантным молекулам нуклеиновой кислоты, кодирующим рекомбинантный белок эластазы согласно изобретению. Используемый здесь термин «молекула нуклеиновой кислоты» включает молекулы ДНК (например, кДНК или геномной ДНК) и молекулы РНК (например, мРНК) и аналоги ДНК или РНК, полученные с использованием нуклеотидных аналогов. Молекулой нуклеиновой кислоты может быть одноцепочечная или двухцепочечная ДНК, предпочтительно, двухцепочечная ДНК.
Настоящее изобретение относится к нуклеиновым кислотам, кодирующим белки эластазы согласно изобретению. Так, например, в некоторых своих вариантах осуществления, настоящее изобретение относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую белок проэластазы (включая, но не ограничиваясь им, белок любой из последовательностей SEQ ID NO:6-9, 64-69, 88-91, или 98-103), содержащий (i) последовательность активации, содержащую последовательность распознавания эластазы, функционально связанную с (ii) аминокислотной последовательностью белка, обладающего эластазной активностью типа I. В других вариантах осуществления, настоящее изобретение также относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую белок, содержащий (i) сигнальную последовательность, действующую в Pichia pastoris и функционально связанную с (ii) последовательностью активации (включая, но не ограничиваясь ею, аминокислотную последовательность SEQ ID NO:23, 72 или 73), содержащей последовательность распознавания протеазы, которая, в свою очередь, функционально связана с (iii) аминокислотной последовательностью зрелой эластазы типа I человека.
Нуклеиновая кислота согласно изобретению может быть очищенной. «Очищенная» молекула нуклеиновой кислоты, такая как молекула кДНК, может, по существу, не содержать другого клеточного материала или культуральной среды при продуцировании этой молекулы рекомбинантными методами, или она может, по существу, не содержать химических предшественников, либо других химических веществ при ее химическом синтезе.
В случаях, когда молекулой нуклеиновой кислоты является кДНК или РНК, например, мРНК, то такие молекулы могут включать поли-А-«хвост», либо, альтернативно, они могут не содержать такого 3’-хвоста.
Молекула нуклеиновой кислоты согласно изобретению может быть амплифицирована с использованием кДНК, мРНК или геномной ДНК, используемой в качестве матрицы, и соответствующих олигонуклеотидных праймеров в соответствии со стандартными методами ПЦР-амплификации. Амплифицированная таким образом нуклеиновая кислота может быть клонирована в соответствующий вектор и охарактеризована с помощью анализа последовательности ДНК. Кроме того, олигонуклеотиды, соответствующие всей молекуле нуклеиновой кислоты согласно изобретению или ее части, могут быть получены стандартными методами синтеза, например, на автоматическом синтезаторе ДНК.
5.3. Рекомбинантные экспрессионные векторы и клетки-хозяева
Настоящее изобретение также относится к векторам, содержащим любую из нуклеиновых кислот согласно изобретению, или к клеткам-хозяевам, сконструированным для экспрессии нуклеиновых кислот согласно изобретению. В конкретных вариантах осуществления изобретения, такие векторы содержат нуклеотидную последовательность, регулирующую экспрессию белка, кодируемого нуклеиновой кислотой согласно изобретению. Так, например, нуклеотидная последовательность, кодирующая белок согласно изобретению, может быть функционально связана с промотором, индуцируемым метанолом.
Настоящее изобретение также относится к клеткам-хозяевам, содержащим нуклеиновые кислоты и векторы согласно изобретению. В некоторых вариантах осуществления изобретения, вектор или нуклеиновую кислоту интегрируют в геном клетки-хозяина, а в других вариантах осуществления изобретения, вектор или нуклеиновая кислота являются внехромосомными. Предпочтительной клеткой-хозяином является клетка Pichia pastoris.
Используемый здесь термин «вектор» означает молекулу нуклеиновой кислоты, способную осуществлять перенос другой нуклеиновой кислоты, с которой она связана. Одним типом векторов является «плазмида», которая представляет собой кольцевую двухцепочечную ДНК-петлю, в которую могут быть лигированы дополнительные ДНК-сегменты. Вектором другого типа является вирусный вектор, в вирусный геном которого могут быть лигированы дополнительные ДНК-сегменты. Некоторые векторы обладают способностью автономно реплицироваться в клетке-хозяине, в которую они были введены (например, бактериальные векторы, имеющие бактериальный ориджин репликации, и эписомные векторы млекопитающих). Другие векторы (например, не-эписомные векторы млекопитающих) интегрируются в геном клетки-хозяина после их введения в клетку-хозяина и реплицируются вместе с геномом хозяина. Кроме того, некоторые векторы, а именно экспрессионные векторы обладают способностью направлять экспрессию кодирующих последовательностей, с которыми они функционально связаны. В основном, экспрессионные векторы, используемые в методах рекомбинантных ДНК, часто присутствуют в форме плазмид (векторов).
Рекомбинантные экспрессионные векторы согласно изобретению содержат нуклеотидную последовательность, кодирующую зрелую эластазу, проэластазу или препроэластазу согласно изобретению в форме, подходящей для экспрессии в клетке-хозяине. Это означает, что рекомбинантные экспрессионные векторы включают одну или несколько регуляторных последовательностей, выбранных с учетом клеток-хозяев, используемых для экспрессии, где указанные последовательности функционально связаны с экспрессируемой последовательностью нуклеиновой кислоты. Термин «функционально связанный», если он относится к рекомбинантному экспрессионному вектору, означает, что представляющая интерес нуклеотидная последовательность связана с регуляторной(ым) последовательностью(ями) так, чтобы она обеспечивала экспрессию нуклеотидной последовательности (например, в в vitro системе транскрипции/трансляции, или в клетке-хозяине при введении данного вектора в эту клетку-хозяина). Термин «регуляторная последовательность» включает промоторы, энхансеры и другие элементы регуляции экспрессии (например, сигналы полиаденилирования). Такие регуляторные последовательности описаны, например, в публикации Goeddel, Gene Expression Technology: Methods в Enzymology 185 (Academic Press, San Diego, CA, 1990). Регуляторными последовательностями являются последовательности, которые направляют конститутивную экспрессию нуклеотидной последовательности в клетки-хозяева многих типов, и последовательности, которые направляют экспрессию нуклеотидной последовательности только в некоторые клетки-хозяева (например, тканеспецифические регуляторные последовательности). Для специалиста в данной области очевидно, что схема конструирования экспрессионного вектора может зависеть от таких факторов, как выбор трансформируемой клетки-хозяина, желаемый уровень экспрессии белка эластазы и т.п. Экспрессионные векторы согласно изобретению могут быть введены в клетки-хозяева в целях продуцирования белков эластазы, кодируемых описанными здесь нуклеиновыми кислотами.
Рекомбинантные экспрессионные векторы согласно изобретению могут быть сконструированы для экспрессии белка эластазы согласно изобретению в прокариотических клетках (например, в E.coli) или в эукариотических клетках (например, в клетках насекомых (с использованием бакуловирусных экспрессионных векторов), в клетках дрожжей или в клетках млекопитающих). Подходящие клетки-хозяева более подробно обсуждаются в публикации Goeddel, см. выше. Альтернативно, рекомбинантный экспрессионный вектор может транскрибироваться и транслироваться in vitro, например, с использованием регуляторных последовательностей промотора T7 и полимеразы T7.
Экспрессия белков в прокариотах чаще всего осуществляется в E.coli с использованием векторов, содержащих конститутивные или индуцибельные промоторы, направляющие экспрессию слитых или не-слитых белков. Слитые векторы добавляют определенное число аминокислот к белку, кодируемому этими векторами, обычно у амино-конца рекомбинантного белка. Такие слитые векторы обычно используются в трех целях: 1) для повышения уровня экспрессии рекомбинантного белка эластазы; 2) для повышения растворимости рекомбинантного белка эластазы и 3) для облегчения очистки рекомбинантного белка эластазы благодаря его действию в качестве лиганда для аффинной очистки. В большинстве случаев, в слитых экспрессионных векторах, домен протеолитического расщепления вводят в участок стыка между слитой молекулой и рекомбинантным белком, что позволяет отделять рекомбинантный белок от слитой молекулы после очистки слитого белка. Таким образом, слитая молекула и домен протеолитического расщепления вместе могут действовать как последовательность активации, включающая сайт распознавания протеазы для рекомбинантной экспрессии белка эластазы. Ферментами, способными активировать такие слитые белки и их когнатные последовательности распознавания, являются фактор Xa, тромбин и энтерокиназа. Типичными слитыми экспрессионными векторами являются pGEX (Pharmacia Biotech Inc.; Smith and Johnson, 1988, Gene 67:31-40), pMAL (New England Biolabs, Beverly, MA) и pRIT5 (Pharmacia, Piscataway, NJ), которые присоединяют глутатион-S-трансферазу (GST), связывающийся с мальтозой белок E или белок А, соответственно, к рекомбинантному белку-мишени.
Примерами подходящих индуцибельных не-слитых экспрессионных векторов E.coli являются pTrc (Amann et al., 1988, Gene 69:301-315) и pET-11d (Studier et al., 1990, Gene Expression Technology: Methods в Enzymology185, Academic Press, San Diego, California, 185:60-89). Экспрессия гена-мишени из вектора pTrc зависит от уровня транскрипции РНК-полимеразы хозяина из слитого промотора trp-lac. Экспрессия гена-мишени из вектора pET-11d зависит от уровня транскрипции из слитого промотора T7 gn10-lac, опосредуемой ко-экспрессированной вирусной РНК-полимеразой (T7 gn1). Эта вирусная полимераза обеспечивается штаммами-хозяевами BL21(DE3) или HMS174(DE3), происходящими от профага-резидента λ, содержащего ген T7 gn1, находящийся под транскрипционным контролем промотора lacUV 5.
Одной из стратегий максимизации уровня экспрессии рекомбинантного белка эластазы в E. coli является экспрессия белка в бактериях-хозяевах, обладающих нарушенной способностью к протеолитическому расщеплению рекомбинантного белка (Gottesman, 1990, Gene Expression Technology: Methods в Enzymology 185, Academic Press, San Diego, California 185:119-129). Другой стратегией является модификация последовательности нуклеиновой кислоты, встраиваемой в экспрессионный вектор, где указанная модификация позволяет использовать отдельные кодоны для каждой аминокислоты преимущественно для экспрессии в E.coli (Wada et al., 1992, Nucleic Acids Res. 20:2111-2118). Такая модификация последовательностей нуклеиновой кислоты согласно изобретению может быть осуществлена стандартными методами стандартного синтеза ДНК.
В другом варианте осуществления изобретения, экспрессионным вектором является дрожжевой экспрессионный вектор. Примерами векторов для экспрессии в дрожжах S. cerevisiae или в P. pastoris являются pYepSec1 (Baldari et al., 1987, EMBO J. 6:229-234), pMFa (Kurjan and Herskowitz, 1982, Cell 30:933-943), pJRY88 (Schultz et al., 1987, Gene 54:113-123), pYES2 (Invitrogen Corporation, San Diego, CA), и pPicZ (Invitrogen Corp, San Diego, CA). Для экспрессии в дрожжах, предпочтительным является промотор, индуцируемый метанолом. В настоящем изобретении также рассматриваются модификации последовательности нуклеиновой кислоты, которые были введены в экспрессионный вектор так, чтобы этот вектор содержал отдельные кодоны для каждой аминокислоты, которые преимущественно используются в P. pastoris. Более конкретно, кодоны SEQ ID NO:33 или SEQ ID NO:81 могут быть заменены на кодоны, которые преимущественно используются в P. pastoris.
Альтернативно, экспрессионным вектором является бакуловирусный экспрессионный вектор. Бакуловирусными векторами, подходящими для экспрессии белков в культивированных клетках насекомых (например, в клетках Sf9), являются векторы серии pAc (Smith et al., 1983, Mol. Cell Biol. 3:2156-2165) и серии pVL (Lucklow and Summers, 1989, Virology 170:31-39). Другой стратегией является модификация нуклеотидной последовательности нуклеиновой кислоты, встраиваемой в экспрессионный вектор так, чтобы присутствовали отдельные кодоны для каждой аминокислоты, которые преимущественно используются в клетках насекомых.
В другом варианте осуществления изобретения, белок эластазы экспрессируется в клетках млекопитающих благодаря присутствию экспрессионного вектора млекопитающих. Примерами экспрессионных векторов млекопитающих являются pCDM8 (Seed, 1987, Nature 329(6142):840-2) и pMT2PC (Kaufman et al., 1987, EMBO J. 6:187-195). Если экспрессионный вектор используется в клетках млекопитающих, то его регуляторные функции часто обеспечиваются вирусными регуляторными элементами. Так, например, наиболее часто используемые промоторы происходят от полиомы, аденовируса 2, цитомегаловируса и обезьяньего вируса 40. Описание других подходящих экспрессионных систем для прокариотических и эукариотических клеток можно найти в главах 16 и 17 руководства Sambrook et al., см. выше.
В другом варианте осуществления изобретения, рекомбинантный экспрессионный вектор млекопитающего обладает способностью направлять экспрессию нуклеиновой кислоты преимущественно в клетки конкретных типов (например, для экспрессии нуклеиновой кислоты используются тканеспецифические регуляторные элементы). Тканеспецифические регуляторные элементы известны специалистам. Неограничивающими примерами подходящих тканеспецифических промоторов являются промотор альбумина (печень-специфический; Pinkert et al., 1987, Genes Dev.1:268-277), лимфоид-специфические промоторы (Calame and Eaton, 1988, Adv. Immunol. 43:235-275), в частности, промоторы Т-клеточных рецепторов (Winoto and Baltimore, 1989, EMBO J. 8:729-733) и иммуноглобулинов (Banerji et al., 1983,Cell 33:729-740; Queen and Baltimore, 1983,Cell 33:741-748), нейрон-специфические промоторы (например, промотор нервных волокон; Byrne and Ruddle, 1989, Proc. Natl. Acad. Sci. USA86:5473-5477), промоторы, специфичные для поджелудочной железы (Edlund et al., 1985, Science 230:912-916), и промоторы, специфичные для молочной железы (например, промотор молочной сыворотки; патент США No. 4873316 и публикация европейской заявки No. EP264166). Настоящее изобретение также охватывает стадиеспецифические промоторы, например, промоторы гена hox мыши (Kessel and Gruss, 1990, Science 249:374-379) и промотор бета-фетопротеина (Campes and Tilghman, 1989, Genes Dev. 3:537-546).
В некоторых аспектах изобретения, уровень экспрессии белка согласно изобретению может быть увеличен путем увеличения дозы соответствующего гена, например, использования высококопийного экспрессионного вектора, или путем амплификации гена. Амплификация гена может быть осуществлена в дефицитных по дегидрофолат-редуктазе (“dhfr-”) клетках CHO путем котрансфекции представляющего интерес гена и геном dhfr и обработки селективной средой с постадийным увеличением концентраций метотрексата. См., например, Ausubel et al., Current Protocols в Molecular Biology Unit 16.14, (John Wiley & Sons, New York, 1996). Альтернативным методом увеличения числа копий генов являются мультимеризация экспрессионной кассеты (например, промотора с кодирующей последовательностью), кодирующего представляющий интерес белок эластазы в векторе с последующим введением данного вектора в клетку-хозяина. Методы и векторы, как известно, используются для осуществления мультимеризации экспрессионных кассет в системах клеток-хозяев дрожжей и млекопитающих (см., например, Monaco, Methods в Biotechnology 8:Animal Cell Biotechnology, at pp. 39-348 (Humana press, 1999); Vassileva et al., 2001, Protein Expression and Purification 21:71-80; Mansur et al., 2005, Biotechnology Letter 27(5):339-45. Кроме того, наборы для экспрессии многокопийных генов являются коммерчески доступными. Так, например, набор для экспрессии многокопийных генов Pichia может быть получен от Invitrogen (Carlsbad, California). Мультимеризация экспрессионной кассеты проиллюстрирована ниже в примере 6.
В соответствии с этим, в других своих аспектах, настоящее изобретение относится к клеткам-хозяевам, в которые был встроен рекомбинантный экспрессионный вектор согласно изобретению. Используемые здесь термины «клетка-хозяин» и «рекомбинантная клетка-хозяин» являются взаимозаменяемыми. Следует отметить, что эти термины означают не только конкретную клетку индивидуума, но также их потомство или потенциальное потомство. Поскольку некоторые модификации могут происходить в последующих генерациях, что обусловлено либо мутацией, либо влиянием окружающей среды, то такое потомство фактически не может быть идентичным родительской клетке, но тем не менее, оно входит в объем используемого здесь термина.
Клеткой-хозяином может быть любая прокариотическая клетка (например, E. coli) или эукариотическая клетка (например, клетки насекомых, клетки дрожжей или клетки млекопитающих).
Векторная ДНК может быть введена в прокариотические или эукариотические клетки стандартными методами трансформации или трансфекции. Используемые здесь термины «трансформация» и «трансфекция» означают различные известные методы введения чужеродной нуклеиновой кислоты в клетку-хозяина, включая копреципитацию фосфатом кальция или хлоридом кальция, трансфекцию, опосредуемую DEAE-декстраном, липофекцию или электропорацию. Описание подходящих методов трансформации или трансфекции клеток-хозяев можно найти в руководстве Sambrook et al. (см. выше) и в других лабораторных руководствах.
Известно, что для стабильной трансфекции клеток млекопитающих достаточно, чтобы лишь небольшая фракция клеток млекопитающих могла интегрировать в свой геном чужеродную ДНК, и это зависит от используемого экспрессионного вектора и применяемого метода трансфекции. Для идентификации и отбора этих интегрантов, последовательность, кодирующую селективный маркер (например, маркер резистентности к антибиотикам), обычно вводят в клетки-хозяева вместе с представляющей интерес открытой рамкой считывания. Предпочтительными селективными маркерами являются маркеры, которые сообщают резистентность к лекарственным средствам, таким как G418, гигромицин, зеоцин и метотрексат. Клетки, стабильно трансфецированные введенной нуклеиновой кислотой, могут быть идентифицированы путем отбора с применением лекарственного средства (например, клетки, в которые была включена последовательность, кодирующая селективный маркер, выживают, а другие клетки погибают).
В другом варианте осуществления изобретения, характер экспрессии последовательности, кодирующей эндогенную эластазу, в клетке, в клеточной линии или в микроорганизме, может быть изменен путем встраивания регуляторного элемента ДНК, гетерологичного последовательности, кодирующей эластазу, в геном клетки, стабильной клеточной линии или клонированного микроорганизма, так, чтобы встроенный регуляторный элемент был функционально связан с эндогенным геном.
Гетерологичная последовательность, содержащая регуляторный элемент, может быть встроена в стабильную клеточную линию или в клонированный микроорганизм так, чтобы указанный элемент был функционально связан с эндогенным геном эластазы и активировал экспрессию указанного гена, где указанное встраивание проводят такими методами, как направленная гомологична рекомбинация, которые хорошо известны специалистам и описаны, например, Chappel в патенте США No. 5272071; в публикации PCT WO 91/06667, опубликованной 16 мая 1991. Гетерологичная последовательность может также включать сигнальные пептиды, последовательности расщепления и/или последовательности активации согласно изобретению.
5.4. Способы получения зрелых белков эластазы
Клетка-хозяин согласно изобретению, такая как прокариотическая или эукариотическая клетка-хозяин в культуре, может быть использована для продуцирования белка эластазы согласно изобретению. В соответствии с этим, настоящее изобретение также относится к способам получения белка эластазы согласно изобретению с использованием клеток-хозяев согласно изобретению. В одном из вариантов осуществления изобретения, указанный способ включает культивирование клетки-хозяина согласно изобретению (в которую вводят рекомбинантный экспрессионный вектор, кодирующий белок эластазы согласно изобретению) в среде, подходящей для продуцирования белка эластазы. В другом варианте осуществления изобретения, указанный способ также включает выделение белка эластазы из среды или клетки-хозяина.
Настоящее изобретение также относится к способам получения незрелых белков эластазы согласно изобретению, включающим культивирование клетки-хозяина, сконструированной для экспрессии нуклеиновой кислоты согласно изобретению, в условиях, благоприятствующих продуцированию пробелка эластазы. В некоторых своих вариантах осуществления, настоящее изобретение также относится к продуцированию белка препроэластазы. Настоящее изобретение также относится к способам получения зрелых белков эластазы согласно изобретению включающим культивирование клетки-хозяина, сконструированной для экспрессии нуклеиновой кислоты согласно изобретению, в условиях, благоприятствующих продуцированию белка проэластазы и создания условий активации, благоприятствующих превращению белка проэластазы в зрелый белок эластазы.
Предпочтительные условия культивирования для продуцирования незрелых и зрелых белков согласно изобретению, в частности, культивирования клеток-хозяев Pichia pastoris, включают период роста при низком pH. В конкретных вариантах изобретения, низкий pH составляет 2-6, 2-5, 3-6, 3-5, 4-6, 3-4, или любое значение в интервале, верхний и нижний пределы которого выбраны из любых вышеуказанных значений. По окончании периода культивирования, предпочтительно, pH культуры может быть доведен до значений 7-11, а наиболее предпочтительно, до рН 8.
Если экспрессия белка проэластазы согласно изобретению находится под контролем индуцируемого метанолом промотора, то условия продуцирования незрелого или зрелого белка эластазы согласно изобретению могут также включать период индуцирования метанолом.
Способы получения эластазы согласно изобретению могут также включать стадию выделения белка, экспрессируемого клеткой-хозяином. В некоторых случаях, выделенным белком является проэластаза, содержащая последовательность активации. В других случаях, выделенным белком является зрелая эластаза, не содержащая последовательности активации. В некоторых случаях получают проэластазные и зрелые белки эластазы. В других случаях получают препроэластазу.
В частности, если желательно избежать аутоактивации аутоактивированной проэластазы, то предпочтительные условия культивирования, благоприятствующие экспрессии проэластазы, могут включать период роста в присутствии цитрата натрия, сукцината натрия или ацетата натрия. В конкретных вариантах осуществления изобретения используется концентрация примерно 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 75-175 мМ, 100-150 мМ, 75-125 мМ или любой интервал, верхний и нижний предел которого выбран из любых вышеуказанных величин. В предпочтительном варианте осуществления изобретения, концентрация цитрата натрия, сукцината натрия или ацетата натрия составляет 90-110 мМ, а наиболее предпочтительно, 100 мМ.
Кроме того, в частности, если желательно избежать расщепления белка, то условия культивирования, благоприятствующие экспрессии проэластазы включают период роста и индуцирования при температуре, равной нижнему пределу температурного интервала, подходящего для культивирования рассматриваемых клеток-хозяев. Так, например, если клеткой-хозяином является клетка Pichia pastoris, то предпочтительным температурным интервалом является интервал примерно 22-28°C. В конкретных вариантах осуществления изобретения, клетку-хозяина Pichia pastoris культивируют при температуре примерно 28°C. Рост и индуцирование необязательно осуществлять при одной и той же температуре, например, в тех вариантах осуществления изобретения, в которых Pichia pastoris используют в качестве клетки-хозяина, ее культивирование может быть осуществлено при 28°C, а индуцирование при 22°С.
Активация аутоактивируемого белка проэластазы согласно изобретению может быть инициирована путем добавления чужеродной эластазы в небольшом (каталитическом) количестве. Альтернативно или одновременно, активация аутоактивируемого белка проэластазы согласно изобретению может быть инициирована путем повышения рН раствора, содержащего аутоактивированный белок проэластазы. рН предпочтительно, составляет 7–11, в некоторых вариантах осуществления изобретения, рН раствора составляет 7-10, 7-9, 8-10, 8-9 или любое значение в интервале, верхний и нижний предел которого выбран из любых вышеуказанных величин. В предпочтительном варианте осуществления изобретения, рН раствора составляет 7-9, наиболее предпочтительно, 8.
В конкретных вариантах осуществления изобретения, при проведении стадии активации, аутоактивированная проэластаза может быть обработана основанием Tris. В конкретных вариантах осуществления изобретения, основание Tris добавляют до концентрации 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 75-175 мМ, 100-150 мМ, 75-125 мМ или до любого значения в интервале, верхний и нижний предел которого выбран из любых вышеуказанных значений. В предпочтительном варианте осуществления изобретения, основание Tris добавляют до концентрации 90-110 мМ, а наиболее предпочтительно, 100 мМ. pH основания Tris составляет, предпочтительно, 7-11; в конкретных вариантах осуществления изобретения, основание Tris имеет рН 7-10, 7-9, 8-10, 8-9 или любое значение в указанных интервалах, верхние и нижние пределы которых выбраны из любых вышеупомянутых величин. В предпочтительном варианте осуществления изобретения, основание Tris имеет pH 7-9, а наиболее предпочтительно, 8.
В некоторых аспектах изобретения, температурой для аутоактивации эластазы является температура окружающей среды, например, температура от 22°C до 26°C. В некоторых вариантах осуществления изобретения, стадию активации эластазы предпочтительно осуществляют с использованием проэластазы при низкой исходной концентрации, например, 0,1-0,3 мг/мл, для достижения оптимальной точности реакции расщепления и минимального образования N-концевых вариантов.
В некоторых вариантах осуществления изобретения, для превращения аутоактивированной проэластазы в зрелую эластазу не требуется добавления каталитического количества эластазы, поскольку проэластаза может подвергаться аутопротеолизу. В некоторых вариантах осуществления изобретения, скорость аутопротеолиза не зависит от концентрации. Не ограничиваясь какой-либо конкретной теорией следует лишь отметить, что независимый от концентрации аутопротеолиз некоторых аутоактивированных пробелков эластазы опосредуется внутримолекулярным процессом, благодаря которому молекула проэластазы сама расщепляется посредством внутримолекулярной реакции. Однако в других вариантах осуществления изобретения активация аутоактивированной проэластазы зависит от концентрации. Не ограничиваясь какой-либо конкретной теорией следует лишь отметить, что зависимый от концентрации аутопротеолиз некоторых аутоактивированных белков проэластазы опосредуется межмолекулярной реакцией, в результате которой проэластаза расщепляется под действием другой проэластазы и/или зрелой эластазы. В других вариантах осуществления изобретения, некоторые аутоактивированные белки проэластазы активируются как в зависимости от концентрации, так и независимо от концентрации. В тех случаях, при которых аутоактивация зависит от концентрации, пробелок может сохраняться в форме, разведенной в более высокой степени, если это желательно для снижения активации. Активация белков проэластазы, содержащих домен расщепления пропептида эластазы SEQ ID NO:55, и включающих, но не ограничивающихся ими, пробелок SEQ ID NO:69, может регулироваться путем сохранения таких пробелков в разведенной форме.
Также известно, что некоторые нежелательные варианты N-концевой последовательности зрелой эластазы могут аккумулироваться в процессе продуцирования зрелых белков эластазы согласно изобретению. Более конкретно, белки проэластазы, содержащие домен расщепления пропептида эластазы SEQ ID NO:42 и включающие пробелок SEQ ID NO:6, могут способствовать образованию вариантов N-концевой последовательности, в которых расщепление происходит по пептидной связи, находящейся у С-конца по отношению к любому из остатков в положениях P3 или P2. Однако вероятность образования таких нежелательных N-концевых вариантов может быть снижена путем введения некоторых аминокислот в определенные положения последовательности активации. Так, например, если пролин присутствует в положении P2, то продуцирование N-концевых вариантов с одной или двумя дополнительными N-концевыми аминокислотами либо происходит на низком уровне, либо вообще не происходит. Кроме того, отсутствие потребности в трипсине для активации позволяет снижать уровень продуцирования или вообще избежать продуцирования варианта, в котором отсутствуют девять N-концевых остатков. Кроме того, вероятность образования нежелательных N-концевых вариантов может быть снижена или устранена благодаря проведению реакции активации в определенных условиях.
Более конкретно, в некоторых вариантах осуществления изобретения, условия активации включают стадию «пролонгированного превращения», в процессе которого N-концевые варианты, продуцируемые в начальном периоде реакции превращения, затем подвергаются селективной деградации. Мониторинг относительных количеств молекул белков во время «пролонгированного превращения» может быть проведен в реальном времени с помощью ГХ-ВЭЖХ. Селективная деградация нежелательных N-концевых вариантов приводит к увеличению количества полноразмерной зрелой PRT-201 в реакции превращения и к снижению количества N-концевых вариантов. Для белков проэластазы, содержащих домен расщепления пропептида эластазы SEQ ID NO:55, стадию пролонгированного превращения осуществляют в течение 4-8 часов, предпочтительно, примерно в течение 6 часов. Для других белков проэластазы, время проведения стадии пролонгированного превращения может быть увеличено или уменьшено, в зависимости от количества N-концевых вариантов, по отношению к количеству зрелой (полноразмерной) эластазы сразу после превращения всей проэластазы. Если превращение происходит в комплексной среде, такой как ферментативный бульон, то период пролонгированного превращения может быть увеличен из-за конкуренции в активном центре зрелой эластазы с другими белками и пептидами в растворе. Альтернативно, смесь зрелой эластазы и N-концевого варианта эластазы может быть выделена из комплексной среды, а затем подвергнута стадии пролонгированного превращения с последующим снижением конкуренции в активном центре и уменьшением периода времени, необходимого для удаления молекул N-концевых вариантов.
Как упоминалось выше, при проведении реакции превращения для про-PRT-201-55M3-003-VU, происходит побочная реакция, приводящая к продуцированию N-концевых вариантов. В частности, в случае про-PRT-201-55M3-003-VU, эти N-концевые варианты не содержат первых двух валинов и обладают незначительной эластазной активностью, либо вообще не обладают такой активностью. В случае других мутантных пробелков продуцируются дополнительные N-концевые варианты, некоторые из которых имеют добавления, а некоторые из них имеют различные делеции. Была проведена стадия удаления N-концевых вариантов, которая позволяет снизить содержание N-концевых вариантов до 0-2%. Такая стадия удаления была разработана исходя из различных экспериментов и наблюдений. Как упоминалось ранее, при проведении экспериментов по оптимизации условий превращения для про-PRT-201-42 было обнаружено, что более длительные реакции превращения часто дают очень низкий процент N-концевых вариантов. Затем было обнаружено, что более длительные реакции превращения позволяют осуществлять селективное разложение N-концевых вариантов под действием зрелого PRT-201. Обнаружение способности PRT-201 селективно разлагать N-концевые варианты в определенных условиях явилось значительным прогрессом и привело к упрощению продуцирования более чистого продукта PRT-201 с меньшим количеством N-концевых вариантов. Такая стадия удаления N-концевого варианта была осуществлена в способе крупномасштабного продуцирования путем создания условий, позволяющих превращать про-PRT-201 в зрелый PRT-201 с последующим разложением N-концевых вариантов под действием зрелого PRT-201.
Характерный пример осуществления такой стадии проиллюстрирован на фигуре 10, где мониторинг указанной стадии был проведен в реальном времени с помощью ГХ-ВЭЖХ. Приблизительно через 50 минут, 100% про-PRT-201-55M3 полностью превращался приблизительно на 86% в зрелый PRT-201 и на 14% в N-концевые варианты. Время реакции превращения было увеличено, что позволяло осуществлять селективное разложение N-концевых вариантов под действием зрелого PRT-201 и, тем самым, снижать количество этих вариантов с 14% до 2%. При более длительном инкубировании, N-концевые варианты могут селективно разлагаться до недетектирумого уровня. Если уровень N-концевых вариантов является достаточно низким, то активность PRT-201 подавляется добавлением цитрата натрия и коррекцией рН реакции до 5,0.
После получения очищенной зрелой эластазы, активный фермент может быть введен в раствор, в котором белок эластазы является относительно неактивным, и помещен в буфер для проведения последующей колоночной хроматографии, например, катионообменной хроматографии, и стадий очистки. В общих чертах, белок эластазы может быть помещен в цитрат натрия в концентрации примерно 5-25 мМ и pH примерно 2-5. В конкретном варианте осуществления изобретения, эластазу помещают в 20 мМ цитрата натрия, pH 5. Затем элюированные фракции анализируют, но необязательно, путем проведения одного, более чем одного или всех нижеследующих анализов, таких как (1) спектрофотометрия при A280 для определения концентрации, (2) электрофорез в ДСН-ПААГ для оценки чистоты, (3) анализ на активность, например, SLAP-анализ для оценки специфической активности эластазы и (4) ГХ-ВЭЖХ для детектирования мутантной эластазы и N-концевых вариантов, и сбор фракций с подходящими свойствами (например, с приемлемой специфической активностью, приемлемо низкими уровнями детектируемых гликоформ (предпочтительно, их отсутствием) и приемлемо низкими уровнями детектируемых N-концевых вариантов (предпочтительно, их отсутствием)).
После получения очищенной зрелой эластазы, активный фермент может быть введен в подходящий раствор для лиофилизации. В общих чертах, белок эластазы, до его лиофилизации, может быть помещен в буфер, содержащий 1 х забуференный фосфатом физиологический раствор (“PBS”) (137 мМ хлорид натрия, 10 мМ фосфат натрия, 2,7 мМ фосфат калия, pH 7,4). В некоторых вариантах осуществления изобретения, белок эластазы, до его лиофилизации, может быть помещен в буфер, содержащий 0,1 X PBS (13,7 мМ хлорид натрия, 1,0 мМ фосфат натрия, 0,27 мМ фосфат калия, pH 7,4).
В некоторых случаях, экспрессия последовательности проэластазы может давать смесь белков проэластазы и зрелых белков эластазы. Таким образом, настоящее изобретение относится к композиции, содержащей белок проэластазы и зрелый белок эластазы.
5.5. Фармацевтические композиции
Зрелые белки эластазы согласно изобретению могут быть включены в фармацевтические композиции, подходящие для введения. Такие композиции обычно включают белок эластазы и фармацевтически инертные ингредиенты, например, фармацевтически приемлемый носитель. Используемый здесь термин «фармацевтически приемлемый носитель” включает любые из имеющихся растворителей, дисперсионных сред, материалов для покрытий, антибактериальных и фунгицидных агентов, агентов, придающих изотоничность и замедляющих абсорбцию, и т.п., совместимых с выбранным способом введения фармацевтических средств. В настоящем изобретении также рассматриваются фармацевтически инертные ингредиенты, которые представляют собой стандартные эксципиенты, носители, наполнители, связующие агенты, дезинтеграторы, растворители, солюбилизирующие агенты и красители. Применение таких сред и агентов вместе с фармацевтически активными веществами хорошо известно специалистам. В настоящем изобретении рассматривается их применение в указанных композициях, за исключением каких-либо стандартных сред или агентов, которые являются несовместимыми со зрелым белком эластазы. В указанные композиции могут быть также включены активные соединения-добавки.
В соответствии с этим, в некоторых своих аспектах, настоящее изобретение относится к фармацевтическим композициям. В своих конкретных вариантах осуществления, настоящее изобретение относится к композиции, содержащей (i) терапевтически эффективное количество зрелой эластазы типа I человека и (ii) фармацевтически приемлемый носитель. Зрелой эластазой типа I человека, которая может быть использована в данной композиции, являются, но не ограничиваются ими, белки SEQ ID NO:1, 4, 5, 84, 87. Зрелая эластаза типа I человека может содержать любую комбинацию полиморфизмов, представленных выше в таблице 3.
В других своих вариантах осуществления, настоящее изобретение относится к фармацевтической композиции, содержащей (i) терапевтически эффективное количество зрелой эластазы типа I человека и (ii) фармацевтически приемлемый носитель, где указанная фармацевтическая композиция не содержит трипсина или фрагментов трипсина. В других вариантах осуществления изобретения, указанная фармацевтическая композиция, в основном, не содержит трипсина или фрагментов трипсина. Используемый здесь термин «не содержит трипсина» относится к композиции, на любой стадии продуцирования которой не используется трипсин. Используемый здесь термин «в основном, не содержит трипсина» относится к композиции, в которой конечное содержание трипсина, выраженное в процентах (то есть масса трипсина/общую массу композиции), составляет не более чем примерно 0,0025% или более предпочтительно, менее чем примерно 0,001% масс. Используемый здесь термин «не содержит» трипсина относится к композиции, в которой содержание вариантов не детектируется, например, с помощью ферментного анализа или ELISA.
В некоторых аспектах изобретения, композиция согласно изобретению обладает трипсиновой активностью, которая ниже активности эквивалента 3 нг/мл трипсина, измеренной с помощью BENZ-анализа, предпочтительно, ниже активности эквивалента 2,5 нг/мл трипсина, измеренной с помощью BENZ-анализа, а еще более предпочтительно, ниже активности эквивалента 2 нг/мл трипсина, измеренной с помощью BENZ-анализа. В конкретном варианте осуществления, настоящее изобретение относится к композиции, содержащей терапевтически эффективное количество белка эластазы, в которой трипсиновая активность эквивалентна менее чем 1,6 нг/мл трипсина, как было измерено с помощью BENZ-анализа. Примеры эластазных композиций, в которых трипсиновая активность ниже активности эквивалента 1,6 нг/мл трипсина, как было определено с помощью BENZ-анализа, приводятся ниже в примере 8. В некоторых вариантах осуществления изобретения, трипсиновая активность, нг/мл, может быть проанализирована в жидкой композиции эластазы типа I человека или в препарате, содержащем 1 мг/мл белка эластазы типа I человека. Таким образом, трипсиновая активность может быть также выражена в миллиграммах белка эластазы, например, менее чем 3 нг трипсиновой активности/мг белка эластазы, менее чем 1,56 нг трипсиновой активности/мг белка эластазы и т.п.
Настоящее изобретение также относится к фармацевтическим композициям, которые либо не содержат, либо, по существу, не содержат нежелательных N-концевых вариантов зрелой эластазы. Нежелательными N-концевыми вариантами являются, но не ограничиваются ими, варианты, продуцируемые путем расщепления пептидной связи, расположенной у С-конца по отношению к любому из остатков в положениях P5, P4, P3, P2, P′1, P′2, P′3, P′4, P′6, и/или P′9. Некоторые нежелательные N-концевые варианты продуцируются посредством активации трипсином, а другие варианты продуцируются в результате аутоактивации последовательностей проэластазы, не содержащих оптимизированных последовательностей активации.
В некоторых вариантах осуществления изобретения, фармацевтическая композиция не содержит или, по существу, не содержит одного, более чем одного или всех N-концевых вариантов зрелой эластазы, которой являются, но не ограничиваются ими, SEQ ID NO:2, 3, 37, 38, 70, 71, 85, 86, 94, 95, 104, 105, 106, 107, 108. В некоторых вариантах осуществления, настоящее изобретение относится к фармацевтической композиции, содержащей (i) терапевтически эффективное количество зрелой эластазы типа I человека и (ii) фармацевтически приемлемый носитель, где указанная фармацевтическая композиция не содержит или, по существу, не содержит какого-либо белка SEQ ID NO:2, 3, 37, 38, 70, 71, 85, 86, 94, 95, 104, 105, 106, 107 или 108. В других вариантах осуществления изобретения, фармацевтическая композиция, по существу, не содержит N-концевых вариантов зрелой эластазы, которой являются, но не ограничиваются ими, SEQ ID NO:2, 3, 37, 38, 70, 71, 85, 86, 94, 95, 104, 105, 106, 107 или 108. Используемый здесь термин «не содержит» конкретного варианта относится к композиции, в которой данный вариант не детектируется, например, в анализе, проводимом с помощью катионообменной ВЭЖХ, в анализе, проводимом с помощью гидрофобной ВЭЖХ, или в анализе, проводимом с использованием комбинации спектрометрии и жидкостной хроматографии. Используемый в данном описании термин «в основном не содержит» относится к композиции, в которой конечное содержание N-концевого варианта, выраженное в процентах (то есть масса N-концевого варианта/общую массу композиции), составляет менее чем примерно 0,5%. В некоторых предпочтительных вариантах осуществления изобретения, композицией, которая, в основном, не содержит N-концевого варианта, является композиция, в которой концентрация N-концевого варианта составляет менее чем примерно 0,1% или менее чем примерно 0,01% или еще более предпочтительно, менее чем примерно 0,001% масс. В некоторых аспектах изобретения, присутствие N-концевых вариантов детектируют в анализе, проводимом с помощью катионообменной ВЭЖХ, в анализе, проводимом с помощью гидрофобной ВЭЖХ, или в анализе, проводимом с использованием комбинации спектрометрии и жидкостной хроматографии.
В некоторых конкретных вариантах осуществления изобретения, фармацевтическую композицию, не содержащую N-концевых вариантов SEQ ID NO:70, 71, 104 и 105, получают путем активации проэластазы, не содержащей аргинина в положении P1 и/или аланина в положении P2.
В других вариантах осуществления изобретения, настоящее изобретение относится к фармацевтической композиции, содержащей (i) терапевтически эффективное количество зрелой эластазы типа I человека и (ii) фармацевтически приемлемый носитель, где указанная фармацевтическая композиция, по существу, не содержит бактериальных белков и/или, по существу, не содержит белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека. Используемые здесь термины «по существу, не содержит белков млекопитающих» или «по существу, не содержит бактериальных белков» относятся к композиции, в которой конечное содержание данных белков, выраженное в процентах (то есть масса белков млекопитающих (не являющихся эластазой, и необязательно, белком-носителем, таким как альбумин) или бактериальных белков/общую массу композиции), составляет менее чем примерно 0,5%. В некоторых предпочтительных вариантах осуществления изобретения, указанной композицией, которая, по существу, не содержит таких белков, является композиция, в которой концентрация нежелательного белка составляет менее чем примерно 0,1% или менее чем примерно 0,01% или еще более предпочтительно, менее чем примерно 0,001% масс.
В некоторых аспектах изобретения, фармацевтическая композиция, которая «не содержит белков млекопитающих» (не являющихся эластазой), содержит эластазу, продуцируемую из рекомбинантной клеточной линии, не являющейся клетками млекопитающих, где на любой стадии способа получения не присутствует белок, имеющий последовательность, характерную для белка млекопитающих, или, в основном, характерную для белка млекопитающих. В некоторых аспектах изобретения, фармацевтическая композиция, которая «не содержит бактериальных белков», содержит эластазу, продуцируемую из рекомбинантной клеточной линии, не являющейся бактериальной клеткой, где на любой стадии способа получения не присутствует белок, имеющий последовательность, характерную для бактериального белка, или, в основном, характерную для бактериального белка.
Зрелые эластазы типа I человека (включая варианты) согласно изобретению имеют, предпочтительно, наиболее высокую степень очистки, подходящую для их применения в фармацевтических композициях. В конкретных вариантах осуществления изобретения, эластазы имеют чистоту по меньшей мере 70%, 80%, 90%, 95%, 96%, 97%, 98% или 99%. В других конкретных вариантах осуществления изобретения, эластазы имеют чистоту до 98%, 98,5%, 99%, 99,2%, 99,5% или 99,8%.
Зрелые эластазы типа I человека согласно изобретению, подходящие для их включения в фармацевтические композиции, предпочтительно, должны обладать специфической активностью, которая превышает более чем 1, более чем 5, более чем 10, более чем 20, более чем 25 или более чем 30 ед./мг белка, как было определено путем измерения скорости гидролиза небольшого пептидного субстрата N-сукцинил-Ala-Ala-Ala-п-нитроанилида (SLAP), который катализируется при добавлении эластазы. Одна единица активности определяется как количество эластазы, которое катализирует гидролиз 1 микромоля субстрата в минуту при 30°С, а специфическая активность определяется как активность на мг белка эластазы (ед./мг). Предпочтительно, фармацевтическая композиция содержит зрелую эластазу типа I человека, обладающую специфической активностью в интервалах, нижний предел которых составляет 1, 2, 3, 4, 5, 7, 10, 15 или 20 ед./мг белка, а верхний предел независимо составляет 5, 10, 15, 20, 25, 30, 35, 40 или 50 ед./мг белка. В характерных вариантах осуществления изобретения, специфическая активность имеет значения в интервалах 1-40 ед./мг белка, 1-5 ед./мг белка, 2-10 ед./мг белка, 4-15 ед./мг белка, 5-30 ед./мг белка, 10-20 ед./мг белка, 20-40 ед./мг белка, или в любом другом интервале, верхний и нижний пределы которых выбраны из любых вышеуказанных величин.
Фармацевтические композиции согласно изобретению, предпочтительно, являются стабильными. В конкретных вариантах осуществления изобретения, фармацевтическая композиция (например, фармацевтическая композиция, полученная путем лиофилизации, описанной выше) сохраняет по меньшей мере 50%, более предпочтительно, по меньшей мере 60%, а наиболее предпочтительно, по меньшей мере 70% своей специфической активности после хранения в течение недели, более предпочтительно, в течение месяца, еще более предпочтительно, в течение 3 месяцев, а наиболее предпочтительно, в течение 6 месяцев при 4°С. В конкретных вариантах осуществления изобретения, фармацевтическая композиция сохраняет по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% своей специфической активности после хранения в течение недели, более предпочтительно, в течение месяца, еще более предпочтительно, в течение 3 месяцев, а наиболее предпочтительно, в течение 6 месяцев при 4°С.
Фармацевтическую композицию приготавливают так, чтобы она была совместимой с нужным способом введения. Способы введения эластаз для лечения или предупреждения заболеваний биологических каналов описаны в WO 2001/21574; WO 2004/073504; и WO 2006/036804. Наиболее предпочтительным способом введения является парентеральное введение, например, прямое введение в стенки сосудов, включая местное введение во внешнюю адвентициальную поверхность хирургически доступных сосудов и местное введение в стенку сосуда с использованием катетера для доставки лекарственного средства. Растворы или суспензии, используемые для парентерального введения, могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, забуференный фосфатом физиологический раствор, сахара, такие как сахароза или декстраны, жирные масла, полиэтиленгликоли, глицерин, пропиленгликоль, полисорбат-80 (также известный как твин-80) или другие синтетические растворители; антибактериальные средства, такие как метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатообразующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как фосфаты, и агенты для коррекции тоничности, такие как хлорид натрия или декстроза. pH может быть скорректирован с использованием кислот или оснований, таких как соляная кислота или гидроксид натрия. Парентеральный препарат может быть заключен в ампулы, одноразовые шприцы, или во флаконы для однократного или многократного приема доз, изготовленные из стекла или пластика. Парентеральный препарат может быть также введен в катетер для доставки лекарственных средств. Во всех случаях, композиция должна быть стерильной.
В конкретных вариантах осуществления изобретения, фармацевтической композицией согласно изобретению является жидкий препарат, содержащий один или несколько из нижеследующих наполнителей, таких как: декстроза (например, 2-10% масс./об); лактоза (например, 2-10% мас./об.); маннит (например, 2-10% мас./об.); сахароза (например, 2-10% мас./об.); трегалоза (например, 2-10% мас./об.); аскорбиновая кислота (например, 2-10 мМ); хлорид кальция (например, 4-20 мМ); декстран-70 (например, 2-10% мас./об.); полоксамер 188 (например, 0,2-1% мас./об.); полисорбат-80 (например, 0,001-5% мас./об., более предпочтительно, 0,1-5%); глицерин (например, 0,2-5% мас./об.); аргинин (например, 2-10% мас./об.); глицин (например, 2-10% мас./об.); декстран-44 (например, 2-10% мас./об.); и декстран-18 (например, 2-10% мас./об.). В некоторых вариантах осуществления изобретения, концентрация декстрозы, лактозы, маннита, сахарозы, трегалозы, декстрана-70, глицерина, аргинина, глицина, декстрана-44 или декстрана-18, взятых отдельно или в комбинации, имеет значения в интервале, нижний предел которого составляет 2,5, 4, 5 или 7% мас./об., а верхний предел независимо составляет 4, 5, 6, 8 или 10% мас./об.
Жидкий препарат может быть получен путем добавления воды к сухому препарату, содержащему зрелый белок эластазы, один или несколько буферных реагентов и/или один или несколько наполнителей. Сухой препарат может быть получен путем лиофилизации раствора, содержащего зрелый белок эластазы, один или несколько буферных реагентов и/или один или несколько наполнителей.
Жидкий препарат может быть получен, например, путем разведения лиофилизованных белков эластазы согласно изобретению стерильной водой или буферным раствором. Примерами буферных растворов являются стерильные физиологические растворы или забуференные фосфатом физиологические растворы. В конкретном варианте осуществления изобретения, после разведения сухого препарата, содержащего зрелый белок эластазы, до получения нужной концентрации белка, данный раствор будет содержать приблизительно 137 мМ хлорида натрия, 2,7 мМ фосфата калия, 10 мМ фосфата натрия (концентрация забуференного фосфатом физиологического раствора рассматривается как 1х), а pH раствора будет составлять приблизительно 7,4. В некоторых аспектах изобретения, сухой препарат, содержащий зрелый белок эластазы, также содержит ионы натрия, хлорида и фосфата в таких количествах, при которых для разведения требуется только добавление воды.
Жидкий препарат может быть также получен, например, путем разведения лиофилизованных белков эластазы буферным раствором, содержащим один или несколько наполнителей. Примерами наполнителей являются полисорбат-80 и декстран. В конкретном варианте осуществления изобретения, после разведения сухого препарата, содержащего зрелый белок эластазы, до получения нужной концентрации белка, полученный раствор будет содержать приблизительно 137 мМ хлорида натрия, 2,7 мМ фосфата калия, 10 мМ фосфата натрия, 0,01% полисорбата-80, а pH раствора будет составлять приблизительно 7,4. Один или несколько наполнителей могут быть смешаны со зрелым белком эластазы до или после лиофилизации, но перед разведением. Таким образом, в некоторых аспектах изобретения, сухой препарат, содержащий зрелый белок эластазы, также содержит наполнители, такие как полисорбат-80 или декстран.
В некоторых своих аспектах, настоящее изобретение относится к жидкому препарату, содержащему: 0,001-50 мг/мл зрелого белка эластазы в растворе, включающем 137 мМ хлорида натрия, 2,7 мМ фосфата калия, 10 мМ фосфата натрия, и содержащему 5-10%, а более предпочтительно, 6-9% наполнителя, выбранного из декстрозы, лактозы, маннита, сахарозы, трегалозы, декстрана-70, глицерина, аргинина, глицина, декстрана-44 или декстрана-18.
В своем конкретном варианте осуществления, настоящее изобретение относится к жидкому препарату, содержащему: 0,001-50 мг/мл зрелого белка эластазы в растворе, включающем 137 мМ хлорида натрия, 2,7 мМ фосфата калия, 10 мМ фосфата натрия, при pH 7,4.
В другом своем конкретном варианте осуществления, настоящее изобретение относится к жидкому препарату, содержащему: 0,001-50 мг/мл зрелого белка эластазы в растворе, включающем 137 мМ хлорида натрия, 2,7 мМ фосфата калия, 10 мМ фосфата натрия, и содержащему 0,01% полисорбата-80, при pH 7,4.
В другом своем конкретном варианте осуществления, настоящее изобретение относится к жидкому препарату, содержащему: 0,001-50 мг/мл зрелого белка эластазы в растворе, включающем 137 мМ хлорида натрия, 2,7 мМ фосфата калия, 10 мМ фосфата натрия, и содержащему 0,01% полисорбата-80 и 8% декстрана-18, при pH 7,4.
В другом своем конкретном варианте осуществления, настоящее изобретение относится к жидкому препарату, содержащему: 0,001-50 мг/мл зрелого белка эластазы в растворе, включающем 137 мМ хлорида натрия, 2,7 мМ фосфата калия, 10 мМ фосфата натрия, и содержащему 8% декстрана-18, при pH 7,4.
Жидкие препараты согласно изобретению, предпочтительно, содержат зрелые белки эластазы в конечной концентрации в интервале значений, нижний предел которого составляет 0,1, 0,5, 1, 2,5, 5, 10, 15 или 20 мг/мл, а верхний предел независимо составляет 0,5, 1, 2,5, 5, 10, 25, 50, 100, 250, 500, 1000 или 1500 мг/мл.
В некоторых своих аспектах, настоящее изобретение относится к жидкому препарату, содержащему: 0,0001-500 мг/мл (более предпочтительно, 1-100 мг/мл, а еще более предпочтительно, 0,5-20 мг/мл) зрелого белка эластазы в растворе 0,5X PBS-1,5X PBS (более предпочтительно, 1X PBS), где указанный раствор включает 5-10% (более предпочтительно, 6-9%) наполнителя, выбранного из декстрозы, лактозы, маннита, сахарозы, трегалозы, декстрана-70, глицерина, аргинина, глицина, декстрана-44 или декстрана-18, и имеет рН 6,5–8,5. В конкретном варианте осуществления изобретения, жидкий препарат включает 0,5 мг/мл зрелого белка эластазы и 8% дектрана-18 в 1 х PBS, pH 7,4. В конкретном варианте осуществления изобретения, жидкий препарат включает 5 мг/мл зрелого белка эластазы и 8% дектрана-18 в 1 х PBS, pH 7,4.
Жидкий препарат согласно изобретению, предпочтительно, имеет осмомоляльность в интервале значений, нижний предел которого составляет 100, 125, 150, 175, 200, 250 или 275 мОсм/кг, а верхний предел независимо составляет 500, 450, 400, 350, 325, 300, 275 или 250 мОсм/кг. В конкретных вариантах осуществления изобретения, осмомоляльность жидкого препарата согласно изобретению предпочтительно, составляет 125-500 мОсм/кг, а более предпочтительно, примерно 275-325 мОсм/кг, как было определено, например, методом снижения температуры замерзания раствора (то есть криоскопическим методом).
При получении композиций для парентерального введения, основным преимуществом является то, что такие композиции могут быть приготовлены в виде жидких препаратов согласно изобретению, в лекарственной форме для облегчения введения и равномерного распределения вводимой дозы. Используемый здесь термин «лекарственная форма» означает физически дискретные единицы, подходящие для использования в качестве одноразовой дозы, которую вводят индивидууму, подвергаемому лечению, где каждую единицу, содержащую предварительно определенное количество зрелого белка эластазы в комбинации с необходимым фармацевтическим носителем, вычисляют в целях достижения желаемого терапевтического эффекта.
Как определено в настоящей заявке, терапевтически эффективное количество зрелого белка эластазы (то есть эффективная доза) составляет примерно 0,0033 мг – 200 мг. Для сосудов меньшего диаметра и с более тонкими стенками, таких как лучекраниальные артериовенозные свищи, предпочтительно, использовать меньшие дозы (такие как 0,0033 мг – 2,0 мг). Для сосудов большего диаметра и с более толстыми стенками, таких как бедренные артерии, предпочтительно, использовать более высокие дозы (такие как 2,05 – 100 мг).
В некоторых вариантах осуществления изобретения, фармацевтические композиции могут быть помещены в контейнер, упаковку, раздаточное устройство или катетер. В других вариантах осуществления изобретения, фармацевтические композиции могут быть помещены в контейнер, упаковку, раздаточное устройство или катетер вместе с инструкциями по их применению. Инструкции по введению указанных композиций могут быть представлены в виде печатной формы, вложенной или наклеенной на контейнер, упаковку, раздаточное устройство или катетер. Альтернативно, инструкции по введению указанных композиций могут быть вложены или наклеены на контейнер, упаковку, раздаточное устройство или катетер в виде ссылки на другое печатное устройство или на доступный сайт в Интернете, на котором можно найти данные инструкции.
В некоторых вариантах осуществления изобретения, фармацевтические композиции могут быть помещены в контейнер, упаковку или раздаточное устройство. В других вариантах осуществления изобретения, фармацевтические композиции могут быть помещены в контейнер, упаковку или раздаточное устройство вместе с инструкциями по их применению. Инструкции по введению указанных композиций могут быть представлены в виде печатной формы, вложенной или наклеенной на контейнер, упаковку или раздаточное устройство. Альтернативно, инструкции по введению указанных композиций могут быть вложены или наклеены на контейнер, упаковку или раздаточное устройство в виде ссылки на другое печатное устройство или на доступный сайт в Интернете, на котором можно найти данные инструкции.
Настоящее изобретение включает способы получения фармацевтических композиций. После получения зрелой эластазы в соответствии с настоящим изобретением, она может быть лиофилизована и может храниться до ее разведения с получением фармацевтического препарата, подходящего для введения. В своем характерном варианте осуществления, настоящее изобретение относится к способу выделения лиофилизованной зрелой эластазы типа I человека, включающему: (a) культивирование клетки-хозяина, такой как клетка-хозяин Pichia pastoris, сконструированной так, чтобы она экспрессировала молекулу нуклеиновой кислоты, кодирующую открытую рамку считывания препроэластазы в условиях, при которых экспрессируется указанная открытая рамка считывания, где указанная открытая рамка считывания включает нуклеотидные последовательности, кодирующие, в направлении 5’→3’ (i) сигнальный пептид, функционирующий в Pichia pastoris; (ii) последовательность активации, содержащую последовательность распознавания эластазы; и (iii) последовательность зрелого белка эластазы типа I, и тем самым продуцирование белка проэластазы; (b) создание условий для аутоактивации белка проэластазы, и, тем самым, продуцирование зрелой эластазы типа I, где указанные условия аутоактивации включают, например, (i) изменение pH раствора, содержащего белок проэластазы, например, до pH 6,5-11, а предпочтительно, 8-9; или (ii) очистку белка проэластазы, например, с помощью ионообменной хроматографии, и пролонгированную реакцию превращения раствора в целях удаления N-концевых вариантов и, тем самым, продуцирование зрелой эластазы типа I человека; (c) необязательную очистку зрелой эластазы типа I человека, например, путем проведения стадии ионообменной хроматографии глубокой очистки (полиш-хроматографии); и (d) лиофилизацию зрелой эластазы типа I и, тем самым, выделение лиофилизованной зрелой эластазы типы I человека. Зрелой эластазой типа I предпочтительно, является эластаза типа I человека. В некоторых аспектах изобретения, лиофилизованная зрелая эластаза типа I предпочтительно имеет чистоту более чем 95%, а в конкретных вариантах осуществления изобретения, лиофилизованная зрелая эластаза типа I имеет чистоту более чем 98% или более чем 99%.
Белки зрелой эластазы согласно изобретению могут быть включены в фармацевтические композиции. Таким образом, в своих характерных вариантах осуществления, настоящее изобретение относится к способу получения фармацевтической композиции, содержащей зрелую эластазу типа I человека, где указанный способ включает (i) выделение лиофилизованной зрелой эластазы типа I человека способами, описанными выше (например, в разделе 5.4); и (ii) разведение лиофилизованной зрелой эластазы типа I человека в фармацевтически приемлемом носителе.
5.6. Эффективная доза
В общих чертах, настоящее изобретение относится к преимуществам парентерального, а предпочтительно, местного введения рекомбинантных белков эластазы, взятых отдельно или в комбинации с другими агентами, для лечения или предупреждения заболеваний биологических каналов.
В некоторых вариантах осуществления изобретения, в качестве альтернативы парентеральному введению может быть проведено пероральное введение агентов для лечения или предупреждения заболевания биологических каналов.
Токсичность и терапевтическая эффективность белков эластазы, используемых в способах согласно изобретению, могут быть определены с помощью стандартных фармацевтических процедур в клеточных культурах или у экспериментальных животных, например, для определения LD50 (дозы, которая является летальной для 50% индивидуумов) и ED50 (дозы, которая является терапевтически эффективной для 50% индивидуумов). Отношение дозы, дающей токсический эффект, к дозе, дающей терапевтический эффект, называется терапевтическим индексом и такое отношение может быть выражено как LD50/ED50. Такая информация может быть использована для более точного определения доз, подходящих для введения человеку.
5.7. Способы введения
Настоящее изобретение относится к фармацевтическим композициям, содержащим новые белки эластазы и к способам их применения для предупреждения или лечения заболеваний биологических каналов. Такие фармацевтические композиции могут быть приготовлены стандартным методом, описанным выше в разделе 5.5.
Композиции, содержащие эластазу согласно изобретению, могут быть введены в нужный сегмент биологического канала, подвергаемого лечению, с помощью устройства, которое, как известно специалистам, может быть пригодным для доставки растворов в стенку артерии или вены, например, с помощью шприца, кататера для доставки лекарственных средств, иглы для доставки лекарственных средств, имплантируемого полимера для доставки лекарственных средств, такого как препарат в виде пластины или микросферы, имплантируемого катетера или сосудистого стента, покрытого полимером, а предпочтительно, саморасширяющегося стента.
В некоторых вариантах осуществления изобретения, введение в нужный сегмент может направленно осуществлено просто визуально, с помощью ультразвука, компьютерной томографии (КТ), рентгенологического контроля, магнитно-резонансной томографии (МРТ) или эндоскопического контроля.
В некоторых аспектах настоящего изобретения, введение эластазы в биологический канал включает нанесение жидкого эластазного препарата непосредственно на внешнюю адвентициальную поверхность хирургически доступных артерий или вен. В конкретных аспектах изобретения, введение осуществляют с помощью шприца.
В некоторых аспектах настоящего изобретения, введение эластазы в биологический канал включает установку устройства для доставки в непосредственной близости от сегмента подвергаемого лечению биологического канала. В некоторых вариантах осуществления изобретения, в процессе доставки белка эластазы с помощью устройства для такой доставки, часть устройства для доставки может быть введена в стенку биологического канала. В некоторых вариантах осуществления изобретения, просвет биологического канала может быть сужен, и в этот суженный сегмент биологического канала вводят белок эластазы. В некоторых вариантах осуществления изобретения, просвет биологического канала сужают путем механического воздействия. В некоторых вариантах осуществления изобретения, просвет биологического канала сужают с помощью баллонного катетера. В некоторых вариантах осуществления изобретения, давление на внутреннюю стенку биологического канала обеспечивается саморасширяющимся элементом, который является частью катетера или устройства. В некоторых вариантах осуществления изобретения, введение белка эластазы и сужение канала осуществляют с помощью одного и того же устройства. В некоторых вариантах осуществления изобретения, биологический канал является хирургически доступным, и в просвет этого биологического канала или на внешнюю поверхность этого канала вводят белок эластазы в vivo. В тех вариантах осуществления, которые включают внутрипросветную доставку, поток крови через данный сосуд может быть прекращен с помощью зажима для осуществления контакта эластазы со стенками сосудов в течение более длительного периода времени и для предупреждения ингибирования эластазы сывороткой. В некоторых вариантах осуществления изобретения, биологический канал хирургически удаляют и на поверхность просвета и/или во внешнюю поверхность канала вводят эластазу in vitro. В некоторых вариантах осуществления изобретения, обработанный канал может быть затем возвращен в организм пациента.
В других аспектах изобретения, введение эластазы в биологический канал включает применение полимерного препарата, который помещают в обрабатываемый сосуд в качестве стента, зажима или пластины, наносимой на внешнюю поверхность биологического канала, или оберточного материала, который накладывают на обрабатываемый сосуд или которым обертывают этот сосуд, или другого устройства, помещаемого в обрабатываемый сосуд или охватывающего этот сосуд, и или возле этого сосуда
В других аспектах настоящего изобретения, эластазу чрескожно инъецируют в определенную область ткани для расширения артерий и/или вен в этой области, включая коллатеральные артерии. В других аспектах изобретения, эластазу чрескожно инъецируют непосредственно в стенку артерии или вены или в окружающие ткани в целях расширения конкретного сегмента сосуда. В вариантах осуществления, относящихся к лечению сосудов сердца, белок эластазы может быть чрескожно введен в перикардиальное пространство или непосредственно введен в хирургически доступные коронарные сосуды.
Медицинские устройства, которые могут быть использованы для введения белков эластазы согласно изобретению в кровеносные сосуды, описаны ниже в разделе 5.9.
5.8. Наборы
Настоящее изобретение относится к наборам для осуществления способов согласно изобретению. «Терапевтический» набор согласно изобретению включает, в одном или нескольких контейнерах, одно или несколько описанных здесь лекарственных средств, которые могут быть использованы для лечения или предупреждения заболевания биологических каналов, необязательно вместе с любыми агентами, облегчающими доставку этих лекарственных средств. Альтернативный набор согласно изобретению, то есть «промышленный» набор, содержит, в одном или нескольких контейнерах, одно или несколько описанных здесь лекарственных средств, подходящих для получения рекомбинантных белков эластазы.
Терапевтический набор согласно изобретению может, но необязательно, содержать дополнительные компоненты, подходящие для осуществления способов согласно изобретению. Так, например, терапевтический набор может содержать фармацевтические носители, подходящие для приготовления лекарственных средств согласно изобретению. Терапевтический набор может также включать устройство или компонент устройства, используемого для осуществления терапевтических способов согласно изобретению, например, шприца или иглы. В настоящем изобретении также рассматриваются терапевтические наборы, включающие такие устройства, такие как катетеры для интрамуральной или периваскулярной инъекции, или катетеры для внутрипросветной инъекции. В некоторых вариантах осуществления изобретения, лекарственные средства согласно изобретению могут быть получены в лекарственной форме. Кроме того, или альтернативно, наборы согласно изобретению могут включать инструкции, в которых описаны принципы осуществления одного или нескольких способов согласно изобретению, или уведомление в форме предписания, данного Регуляторными органами, осуществляющими контроль за приготовлением, применением или продажей фармацевтических препаратов или биологических продуктов, где к указанному уведомлению приложено разрешение Регуляторных органов на получение, применение или продажу препаратов для введения человеку. В один или несколько контейнеров данного набора могут быть включены инструкции в печатной форме, либо такие инструкции могут быть наклеены на эти контейнеры. Альтернативно, инструкции по введению указанных композиций могут быть вложены или наклеены на контейнер в виде ссылки на другое печатное устройство или на доступный сайт в Интернете, на котором можно найти данные инструкции.
В конкретных вариантах осуществления изобретения, набор согласно изобретению включает медицинское устройство, описанное ниже в разделе 5.9.
Промышленный набор согласно изобретению может включать, но необязательно, дополнительные компоненты, подходящие для осуществления способов согласно изобретению.
5.9. Медицинские устройства, используемые для введения белков эластазы
Настоящее изобретение относится к медицинским устройствам, которые могут быть использованы для введения белков эластазы согласно изобретению в биологические каналы, такие как артерии или вены. Такие устройства описаны ниже и в предварительной заявке 61/025084, поданной 31 января 2008, в предварительной заявке 61/025463, поданной 1 февраля 2008, и в предварительной заявке 61/075710, поданной 25 июня 2008, каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки. Белки эластазы согласно изобретению могут быть также введены в биологические каналы с помощью стандартных катетеров.
В одном из вариантов осуществления изобретения, медицинское устройство для введения белков эластазы имеет центральную продольную ось и включает один или несколько приводов, где указанные один или несколько приводов могут находиться в ограничительной конфигурации, и по своей длине ориентированы, в основном, параллельно продольной оси указанного медицинского устройства, а также они могут находиться в не-ограничительной конфигурации, при которой по меньшей мере часть длины указанного одного или нескольких приводов ориентированы, в основном, не параллельно центральной продольной оси данного устройства. После установки устройства в нужный участок, смежный со стенкой биологического канала, один или несколько приводов (а если необходимо, то и все приводы), могут освобождаться от ограничительной конфигурации и принимать неограничительную конфигурацию, что позволяет им контактировать со стенкой биологического канала. Один или несколько приводов могут иметь любую форму, а в предпочтительных вариантах осуществления изобретения, переход одного или несколько приводов из ограничительной конфигурации в неограничительную конфигурацию осуществляется после снятия поддерживающей силы оператором данного устройства, но без применения данным оператором какой-либо деформирующей силы к указанному устройству или к ткани-мишени.
В первом конкретном варианте осуществления изобретения, проиллюстрированном на фигуре 22, устройство представляет собой катетер для доставки жидкости 10, содержащий один или несколько приводов, сконструированных в виде пары удлиненных пазов 12, 14, промежуточные области которых движутся между ограничительной конфигураций, которая ориентирована, в основном, параллельно центральной продольной оси 15 данной катетерной системы, и неограничительной конфигурацией, в которой, по меньшей мере часть пары пазов ориентирована, в основном, не параллельно указанной центральной продольной оси (см. левую часть L и правую часть R длины пазов на фигуре 23). Один или несколько пазов 12, 14 могут быть сконструированы в виде удлиненных лент или проволок, каждая из которых имеет противоположные проксимальные и дистальные концы. В предпочтительном варианте осуществления, указанные пазы имеют плоские внутренние поверхности 24, 26, и плоские лицевые внешние поверхности 28, 30. В этом варианте осуществления изобретения, пазы 12, 14 могут перемещаться между ограничительными положениями и неограничительными положениями, как соответственно показано на фигурах 22 и 23. В одном из вариантов осуществления изобретения, указанная пара пазов, в своих ограничительных конфигурациях, расположена вплотную, как показано на фигуре 22.
Катетер 10 также содержит один или несколько тканевых пенетраторов 16, 18, прикрепленных к одной или нескольким поверхностям одного или нескольких пазов 12, 14; центральный компонент катетера 20 удлиненной формы, и внешний компонент катетера 22, который может защищать тканевый(е) пенетратор(ы) в процессе движения катетера в биологическом канале.
Тканевые пенетраторы 16, 18 могут быть изготовлены из любого подходящего материала. Предпочтительными примерами таких материалов являются, но не ограничиваются ими, никель, алюминий, сталь и ее сплавы. В конкретном варианте осуществления изобретения, тканевые пенетраторы изготовлены из нитинола.
Центральный компонент катетера 20 и внешний компонент катетера 22 могут быть изготовлены из материалов, которые обычно применяются для изготовления катетеров. Примерами таких материалов являются, но не ограничиваются ими, силикон, полиуретан, найлон, дакрон и PEBAXTM.
Приводы, предпочтительно, изготавливают из эластичного, упругого материала. В предпочтительном варианте осуществления изобретения, указанный эластичный упругий материал обладает способностью сжиматься под воздействием поддерживающей силы, например, если приводы находятся в ограничительной конфигурации и принимают свою исходную неограничительную форму при снятии такой поддерживающей силы, например, если приводы находятся в неограничительной конфигурации. При этом, может быть использован любой эластичный упругий материал, включая, но не ограничиваясь ими, хирургическая сталь, алюминий, полипропилен, олефиновые материалы, полиуретан и другие синтетические каучуковые или пластиковые материалы. Наиболее предпочтительно, один или несколько приводов изготавливают из материалов с конфигурационной памятью. Примерами таких материалов с конфигурационной памятью являются, но не ограничиваются ими, сплавы меди-цинка-алюминия-никеля, сплавы меди-алюминия-никеля и сплавы никеля-титана (NiTi). В предпочтительном варианте осуществления изобретения, таким материалом с конфигурационной памятью является нитинол. В предпочтительном варианте осуществления изобретения, в случае, если пара пазов принимает неограничительную конфигурацию, то такие запоминающие свойства материала, из которого изготовлен каждый паз, позволяют получать нужные пазы без приложения какой-либо внешней деформирующей силы, благодаря изгибам, радиально отходящих друг от друга в одной плоскости, как показано на фигуре 23.
Один или несколько пазов (а предпочтительно, каждый из этих пазов) имеет гибкий канал для доставки жидкостей 32, 34, который проходит по всей длине паза или находятся в самом пазе, как показано на фигуре 24. Поскольку пазы 12, 14 движутся от их прямой ограниченной конфигурации в их изогнутую неограничительную конфигурацию, то каналы для доставки жидкостей 32, 34 могут также переходить от их прямой конфигурации в изогнутую конфигурацию. В одном из вариантов осуществления изобретения, каналы для доставки жидкостей 32, 34 представляют собой отдельные трубчатые каналы, которые по всей своей длине прикреплены к паре пазов 12, 14. В другом варианте осуществления изобретения, каналы для доставки жидкости представляют собой каналы, сформованные в материал пазов или включенные в материал пазов.
Один или несколько пазов (а предпочтительно, каждый из пазов 12,14) также образует рельс типа «застежки молнии» 36, 38, которые простираются по всей длине паза (Фигура 24). Рельсы типа «застежки молнии» 36, 38 изготовлены либо из такого же материала, как и пазы 12, 14, либо из материала, который придает гибкость пазам 12, 14.
Один или несколько тканевых пенетраторов 16, 18 прикреплены к внешним поверхностям 28, 30 пары пазов 12, 14 (Фигура 24). Тканевые пенетраторы 16, 18 соединены и сообщаются с каналами для доставки жидкости 32, 34, которые простираются по всей длине пазов 12, 14. Тканевые пенетраторы 16, 18 расположены так, что они являются, в основном, перпендикулярны внешним поверхностям 28, 30 пазов 12, 14. Эти тканевые пенетраторы 16, 18 имеют полые внутренние каналы, которые сообщаются с каналами для доставки жидкости 32, 34 из данных пазов. Дистальные концы тканевых пенетраторов имеют входные отверстия для доставки жидкости, которые сообщаются с внутренними каналами тканевых пенетраторов.
Данное устройство позволяет осуществлять доставку жидкостей в один или несколько отдельных слоев или через один или несколько отдельных слоев стенки биологического канала, например, стенки сосудов. Стенка сосудов содержит множество структур и слоев, включая эндотелиальный слой и базальный мембранный слой (в собирательном значении, внутренний слой), внутреннюю эластичную пластинку, медиальный слой и адвентициальный слой. Эти слои расположены так, что эндотелий обращен к просвету сосуда и к базальной мембране, внутренней эластичной пластинке, медиальному слою и адвентициальному слою эндотелия, которые последовательно расположены в эндотелии в виде слоев, как описано в публикации патентной заявки США No. 2006/0189941A1. Что касается медицинских устройств согласно изобретению, то глубина, на которую могут быть введены тканевые пенетраторы 16, 18, определяется длиной каждого тканевого пенетратора 16, 18. Так, например, если слоем-мишенью является адвентициальный слой, то используются тканевые пенетраторы 16, 18, имеющие определенную длину, достаточную для их проникновения на соответствующую глубину адвентициального слоя после включения данного устройства. Аналогичным образом, если слоем-мишенью является медиальный слой, то используются тканевые пенетраторы 16, 18, имеющие определенную длину, достаточную для их проникновения на соответствующую глубину медиального слоя после включения данного устройства.
В конкретных вариантах осуществления изобретения, длина тканевых пенетраторов 16, 18 для введения в сосуды может составлять примерно от 0,3 мм до 5 мм, либо, для введения в другие биологические пространства или каналы, например, для введения в толстую кишку примерно до 20 мм или даже 30 мм. Предпочтительно, тканевые пенетраторы 16,18 имеют диаметр примерно от 0,2 мм (калибр 33) до 3,4 мм (калибр 10), а более предпочтительно от 0,2 мм до 1,3 мм (калибр примерно 33-21). Дистальные концы тканевых пенетраторов могут иметь стандартный скос, короткий скос или истинно короткий скос. В альтернативном варианте осуществления изобретения, тканевые пенетраторы, соединенные с любым пазом, имеют неодинаковые длины, но могут иметь такую конфигурацию, при которой их дистальные концы расположены на одинаковом расстоянии от стенок биологического канала, если такое медицинское устройство находится в неограничительном положении, например, в процессе его работы.
Центральный компонент катетера 20 имеет удлиненную форму с противоположными проксимальным и дистальным концами, как показано на фигуре 22, слева и справа, соответственно. В одном из вариантов осуществления изобретения, центральный компонент катетера 20 имеет цилиндрическую внешнюю поверхность, простирающуюся по всей его длине. Проксимальные концы пазов 12, 14 прикреплены, например, путем спайки или клеем к дистальному концу центрального компонента катетера 20, а дистальные концы пазов 12, 14 прикреплены, например, путем спайки или клеем к направляющему концу катетера 40. Конец 40 имеет гладкую внешнюю поверхность, созданную для облегчения введения в биологический канал. Направляющий проволочный канал 48 простирается по всей длине центрального катетера 20 и до конца 40. Канал направляющего кабеля имеет размер, позволяющий направляющей проволоке легко проходить через указанный канал.
Пара просветов для доставки жидкости 44, 46 проходит через внутреннюю часть центрального компонента катетера 20 по всей его длине (фигура 25). У дистального конца центрального компонента катетера 20, пара просветов для доставки жидкости 44, 46 сообщается с парой каналов для доставки жидкостей 32, 34, которые простираются по всей длине пазов 12, 14 до тканевых пенетраторов 16, 18. Направляющий проволочный канал 48 также проходит через внутреннюю часть центрального компонента катетера 20 от проксимального конца до дистального конца центрального компонента катетера (Фигура 25). Проксимальный конец центрального компонента катетера 20 снабжен парой люэровских наконечников 50, 52 (Фигура 22). В одном из вариантов осуществления изобретения, каждый люэровский наконечник 50,52 сообщается с одним из просветов для доставки жидкости 44, 46, простирающихся по всей длине центрального катетера. Каждый люэровский наконечник 50,52 сконструирован так, что он соединяется с источником доставки жидкости и пропускает жидкость через каждый люэровский наконечник 50,52, затем через каждый просвет для доставки жидкости 44, 46, простирающийся через центральный компонент катетера 20, а затем через каждый канал для доставки жидкостей 32, 34, простирающийся по всей длине пары пазов 12, 14, и наконец, через тканевые пенетраторы 16, 18, соединенные с парой пазов. В другом варианте осуществления изобретения, каждый люэровский наконечник 50,52 независимо сообщается с обоими просветами для доставки жидкости 44, 46, простирающимися по всей длине центрального компонента катетера. При такой конфигурации, первая жидкость может доставляться через первый люэровский наконечник в оба тканевых пенетратора 16, 18, а вторая жидкость может доставляться через второй люэровский наконечник в оба тканевых пенетратора 16, 18. Доставка жидкости в оба тканевых пенетратора из каждого люэровского наконечника может осуществляться по независимому каналу, простирающемуся от каждого люэровского наконечника до общего дистального резервуара 61, как показано на фигуре 32. Этот резервуар сообщается с обоими тканевыми пенетраторами 16, 18. Альтернативно, в другом варианте осуществления изобретения, медицинское устройство согласно изобретению содержит только один люэровский наконечник, соединенный с одним просветом для доставки жидкости, который простирается через центральный катетер и соединен с дистальным общим резервуаром, что позволяет доставлять одну из жидкостей в оба тканевых пенетратора 16, 18.
Внешний компонент катетера 22 имеет трубчатую конфигурацию, окруженную парой пазов 12, 14 и большей частью центрального катетера 20 (фигура 22). Компонент катетера 22 имеет удлиненную форму и расположен между противоположными проксимальным и дистальным концами компонента катетера, показанных на фигуре 22, слева и справа, соответственно. Дистальный конец компонента катетера имеет размер, позволяющий ему входить в жесткое сцепление с направляющим наконечником 40, причем, внешняя поверхность наконечника 40 объединена с внешней поверхностью компонента катетера 22, в том случае, если дистальный конец компонента катетера входит в зацепление с наконечником. Трубчатая конфигурация компонента катетера 22 имеет такой размер, который позволяет внутренней поверхности компонента катетера 22 находиться на далеком расстоянии от множества тканевых пенетраторов 16, 18, находящихся на паре пазов 12, 14 в ограничительных положениях этой пары пазов. Проксимальный конец центрального катетера 20 выступает за пределы проксимального конца компонента катетера 22, если дистальный конец компонента катетера сцеплен с направляющим наконечником катетера 40.
Между внешним проксимальным концом компонента катетера 22 и проксимальным концом центрального компонента катетера 20 обеспечивается механическое соединение 54, которое позволяет внешнему компоненту катетера двигаться обратно по длине пары пазов 12, 14, а центральный компонент катетера 20 позволяет дистальному концу внешнего компонента катетера 22 отсоединяться от направляющего наконечника 40 и проходить по всей паре пазов 12, 14, и двигаться вперед по всей длине центрального компонента катетера 20 и по всей длине пары пазов 12, 14 с последующим сцеплением дистального конца внешнего компонента катетера 22 с наконечником 40 (фигура 22). Механическое соединение 54 может быть осуществлено вручную или нажатием кнопки, которая позволяет вручную передвигать внешний компонент катетера 22 по центральному компоненту катетера 20. Соединение 54 может также обеспечиваться дисковым переключателем или пусковым устройством. Кроме того, соединение 54 может обеспечиваться звуковым или тактильным индикатором (таким как щелчок) пошагового передвижения внешнего компонента катетера 22 по отношению к центральному компоненту катетера 20.
В одном из вариантов осуществления изобретения, внешний компонент кататера 22 снабжен одной дорожкой типа «застежки-молнии» 56, которая простирается по всей длине с одной стороны внешнего компонента катетера 22 на внутренней поверхности внешнего компонента катетера (фигура 24). Дорожка типа «застежки-молнии» 56 во внутренней части внешнего компонента катетера 22 входит в плавное сцепление с рельсами типа «застежки-молнии» 36, 38 с одной стороны каждого из пазов 12, 14. Перемещение внешнего компонента катетера вперед по длине центрального компонента катетера 20 и пары пазов 12, 14 по направлению к направляющему наконечнику 40 катетерного устройства позволяет дорожке типа «застежки-молнии» 56 внешнего компонента катетера скользить по рельсам 36, 38 пары пазов 12, 14. Это приводит к переходу пары пазов 12, 14 из их изогнутой неограничительной конфигурации, показанной на фигуре 23, вплотную к их ограничительной конфигурации, показанной на фигуре 22. Сцепление рельсов пазов 36, 38 на дорожке типа «застежки-молнии» 56 внешнего компонента катетера 22 удерживает пару пазов в их положении вплотную по отношению к положениям, показанным на фигуре 22. Когда внешний компонент катетера 22 продвигается вперед вдоль центрального компонента катетера 20 и пары пазов 12, 14 до того положения, где дистальный конец внешнего компонента катетера 22 сцеплен с направляющим наконечником 40, то тканевые пенетраторы 16, 18 закрываются, и катетерное устройство согласно изобретению может безопасно двигаться вперед и назад по биологическому каналу. Внешний компонент катетера 22 закрывает тканевые пенетраторы 16, 18, выступающие из пары пазов 12, 14 и сцепление внешнего компонента катетера 22 с дистальным направляющим наконечником 40 придает катетерному устройству гладкую внешнюю поверхность, что облегчает введение катетерного устройства в биологический канал или его прохождение через биологический канал, такой как кровеносный сосуд. В другом варианте осуществления изобретения, внешний компонент катетера 22 снабжен двумя дорожками типа «застежки-молнии», расположенными по углом 180° по отношению друг к другу и простирающимися по всей длине внешнего компонента катетера 22 на внутренней поверхности, а пазы по обеим сторонам имеют рельсы.
В катетерном устройстве используется направляющий кабель 58 (фигура 22). Направляющий кабель 58 простирается по каналу направляющего кабеля центрального компонента катетера 48 вдоль пазов 12, 14 и через выпускное отверстие направляющего наконечника 42. В некоторых вариантах осуществления изобретения, направляющий кабель 58 имеет твердую сердцевину, например, из нержавеющей стали или сверхэластичного нитинола. Направляющий кабель может быть изготовлен из рентгеноконтрастного материала, либо полностью, либо в его дистальной части (например, в наиболее удаленной части, находящейся на расстоянии 1 мм - 25 мм или на расстоянии 3 мм-10 мм). На направляющий кабель 58 может быть, но необязательно, нанесено инертное с медицинской точки зрения покрытие, такое как TEFLON®.
При применении такого устройства, направляющий кабель 58 вводят в биологический канал методами, известными специалистам. Направляющий кабель 58 проходит по биологическому каналу через выпускное отверстие для направляющего кабеля 42 в наконечнике 40 данного устройства, через внешний экранирующий катетер 22, расположенный за тканевыми пенетраторами 16, 18, и через канал направляющего кабеля 48 центрального компонента катетера 20. В других вариантах осуществления изобретения, катетерным устройством является катетерное устройство для быстрой замены лекарственных средств, где просвет направляющего кабеля 40 данного катетера, находится на дистальном конце направляющего наконечника 40, но не проходит по всей длине данного медицинского устройства.
После позиционирования направляющего кабеля, это устройство вводят в биологический канал вместе с предварительно позиционированным направляющим кабелем 58. Для мониторинга положения данного устройства в биологическом канале, это устройство может быть снабжено, но необязательно, одним или несколькими рентгеноконтрастными маркерами. Любой материал, который предупреждает проникновение электромагнитного излучения, рассматривается как рентгеноконтрастный, и такой материал является подходящим для использования. Предпочтительными рентгеноконтрастными материалами являются, но не ограничиваются ими, платина, золото или серебро. Рентгеноконтрастный материал может быть нанесен на поверхность всего наконечника 40 или его части, всех пазов 12, 14 или их частей, или других приводов, на направляющий кабель 58, или на некоторые комбинации вышеупомянутых структур. Альтернативно, наконечник 40 может быть снабжен кольцом из рентгеноконтрастного материала. Данное устройство может быть, но необязательно, снабжено автономным визуализирующим устройством, таким как устройство для внутрисосудистой ультразвуковой или оптической когерентной томографии. Наконечник данного устройства может быть снабжен, но необязательно, оптическим устройством, используемым для определения положения данного катетера или свойств окружающего его биологического канала.
Если данное устройство находится в нужном положении в биологическом канале, то оператор использует механическое соединение 54 для отведения внешнего компонента катетера 22 назад от направляющего наконечника 40. В предпочтительном варианте осуществления изобретения, по мере удаления внешнего компонента катетера 22 от тканевых пенетраторов 16, 18, дорожка типа «застежки-молнии» 56 внешнего компонента катетера 22 двигается по рельсам 36, 38 пары пазов 12, 14. Это перемещение освобождает пару пазов 12, 14 от ограничительной конфигурации впритык, как показано на фигуре 22, и позволяет запоминающему материалу пазов 12, 14 принимать свою неограничительную, изогнутую конфигурацию, показанную на фигуре 23. Поскольку пазы 12, 14 принимают свою неограничительную, изогнутую конфигурацию, то эти пазы входят в контакт с внутренней поверхностью стенки(ок) биологического канала, а тканевые пенетраторы 16, 18 на внешних поверхностях 28, 30 пазов 12, 14 вдавливаются во внутреннюю поверхность биологического канала в данном положении устройства.
После проникновения тканевых пенетраторов 16, 18 в нужный слой стенки биологического канала, жидкость может доставляться через просветы 44, 46 в центральном компоненте катетера 20, через каналы для доставки жидкости 32, 34, расположенные на паре пазов 12, 14, и через тканевые пенетраторы 16, 18. По окончании доставки жидкости, оператор использует механическое соединение 54 для продвижения внешнего компонента катетера 22 (который может также называться защитным компонентом) вперед по центральному компоненту катетера 20 и по паре пазов 12, 14 по направлению к направляющему наконечнику 40. По мере продвижения внешнего компонента катетера 22 вперед по паре пазов 12, 14, дорожка типа «застежки-молнии» 56, находящаяся на внутренней части внешнего компонента катетера 22, проходит по рельсам 36, 38 по паре пазов 12, 14, в результате чего эти пазы 12, 14 переходят из своей неограничительной изогнутой конфигурации обратно в ограничительную конфигурацию. Если внешний компонент катетера 22 полностью продвигается по паре пазов 12, 14 и снова входит в сцепление с направляющим наконечником 40, то дорожка типа «застежки-молнии» 56 во внешнем компоненте катетера 22 удерживает пазы 12, 14 в своей ограничительной конфигурации. Данное устройство может быть снова позиционировано для установки в другое положение в биологическом канале или в другом биологическом канале, либо оно может быть удалено из тела организма.
Форму и длину пазов 12, 14 выбирают так, чтобы различные варианты устройства можно было использовать в биологическом пространстве или в биологических каналах различных размеров или диаметров. В некоторых вариантах осуществления изобретения, пазы могут быть плоскими или закругленными. Плоские пазы, предпочтительно, имеют ширину примерно от 0,2 мм до 20 мм, высоту примерно от 0,2 мм до 5 мм, и длину примерно от 10 мм до 200 мм, в зависимости от конкретного применения. Закругленные пазы, предпочтительно, имеют диаметр примерно от 0,2 мм до 20 мм и длину примерно от 10 мм до 200 мм, в зависимости от конкретного применения. В конкретных вариантах осуществления изобретения, плоские пазы имеют ширину от 3,5 мм до 5 мм, от 5 мм до 10 мм, от 10 мм до 15 мм, от 15 мм до 20 мм, или любое значение в указанном интервале (например, 3,5 мм-10 мм); высоту от 3,5 мм до 5 мм, от 5 мм до 10 мм, от 10 мм до 15 мм, от 15 мм до 20 мм, или любое значение в указанном интервале (например, от 3,5 мм до 10 мм); и длину от 10 мм до 20 мм, от 20 мм до 40 мм, от 40 мм до 80 мм, от 80 мм до 120 мм, от 120 мм до 150 мм или от 150 до 200 мм, или любое значение в указанном интервале (например, от 10 мм до 40 мм), или любую комбинацию из вышеуказанных значений (например, ширину от 5 мм до 10 мм, высоту от 3,5 до 5 мм, и длину от 20 до 40 мм). В других вариантах осуществления изобретения, закругленные пазы имеют диаметр от 3,5 мм до 5 мм, от 5 мм до 10 мм, от 10 мм до 15 мм, от 15 мм до 20 мм, или любое значение в указанном интервале (например, от 3,5 мм до 10 мм), и длину от 10 мм до 20 мм, от 20 мм до 40 мм, от 40 мм до 80 мм, от 80 мм до 120 мм, от 120 мм до 150 мм или от 150 до 200 мм, или любое значение в указанном интервале (например, от 10 мм до 40 мм), или любую комбинацию из вышеуказанных значений (например, диаметр от 5 мм до 10 мм и длину от 20 до 40 мм).
Во втором конкретном варианте осуществления изобретения, проиллюстрированном на фигуре 27, устройство согласно изобретению представляет собой катетер для доставки жидкости 110, содержащий центральный компонент катетера 112 удлиненной формы с продольной осью 113, и один или несколько (а предпочтительно, два) гибких упругих привода, которые, в данном конкретном варианте осуществления изобретения, изготовлены в виде трубок 114, 116 для подвода в тканевые пенетраторы, которые простираются от дистальной части центрального компонента катетера 112. По меньшей мере часть трубок 114, 116 для подвода в тканевые пенетраторы перемещается между ограничительной конфигурацией, которая ориентирована, в основном, параллельно центральной продольной оси 113 катетерного устройства, и неограничительной конфигурации, которая ориентирована, в основном, не параллельно центральной продольной оси 113 катетера.
Катетер также содержит одну или несколько (а предпочтительно, две) гибких тканевых пенетраторов удлиненной формы 118, 120, которые проходят через две трубки 114, 116 для подвода в тканевые пенетраторы и внешнюю выпускную трубку 122, которая простирается по всей длине центрального компонента катетера 112, трубки для 114, 116 для подвода в тканевые пенетраторы и средний рельс 132.
Центральный компонент катетера 112 и внешняя выпускная трубка 122 могут быть изготовлены из любых материалов, которые обычно применяются для изготовления катетеров. Примерами таких материалов являются, но не ограничиваются ими, силикон, полиуретан, найлон, дакрон и PEBAXTM.
Тканевые пенетраторы 118, 120 соединены с соответствующими наконечниками 166, 168 (фигура 31). Один или несколько пар тканевых пенетраторов 118, 120, предпочтительно, имеют диаметр примерно от 0,2 мм (калибр 33) до 3,4 мм (калибр 10), а более предпочтительно от 0,8 мм до 1,3 мм (калибр примерно 18-21). Один или несколько пар тканевых пенетраторов могут иметь стандартный скос, короткий скос или истинно короткий скос. Пару тканевых пенетраторов 118, 120 предпочтительно, изготавливают из материалов, которая придает тканевым пенетраторам гибкость по всей их длине. Примерами таких материалов являются, но не ограничиваются ими, никель, алюминий, сталь и их сплавы. В конкретных вариантах осуществления изобретения, тканевые пенетраторы изготавливают из нитинола. Тканевые пенетраторы 118, 120 по всей своей длине могут быть изготовлены из одного материала, либо дистальные концы (например, дистальный конец 1 мм - 20 мм), включая наконечники 156, 158 тканевых пенетраторов 118, 120 могут быть изготовлены из одного материала и соединены с соответствующими наконечниками 166, 168 посредством системы трубок, изготовленных из другого материала, например, из пластика.
Одна или несколько пар трубок 114, 116, используемых для подвода к тканевым пенетраторам, предпочтительно, изготавливают из гибкого упругого материала. Такой гибкий упругий материал может деформироваться, например, если трубки 114, 116 для подвода в тканевые пенетраторы находятся в прямой ограничительной конфигурации, как показано на фигуре 27, но возвращаются в свою исходную форму при снятии деформирующей силы, например, если трубки 114, 116 для подвода в тканевые пенетраторы находятся в изогнутой неограничительной конфигурации, представленной на фигуре 28. При этом, может быть использован любой гибкий упругий материал, включая, но не ограничиваясь им, хирургическая сталь, алюминий, полипропилен, олефиновые материалы, полиуретан и другие синтетические каучуковые или пластиковые материалы. Пара трубок для подвода в тканевые пенетраторы 114, 116, наиболее предпочтительно, изготавливают из материала с конфигурационной памятью. Примерами таких материалов с конфигурационной памятью являются, но не ограничиваются ими, сплавы меди-цинка-алюминия-никеля, сплавы меди-алюминия-никеля и сплавы никеля-титана (NiTi). В предпочтительном варианте осуществления изобретения, таким материалом с конфигурационной памятью является нитинол.
Центральный компонент катетера 112 имеет гибкую удлиненную форму с противоположными проксимальным концом 124 и дистальным концом 126 (фигура 27). Дистальный конец 126 центрального компонента катетера изготовлен в виде направляющего наконечника, который имеет внешнюю конфигурацию, направляющую дистальный конец 126 через биологический канал. Канал направляющего кабеля 128 в среднем рельсе 132 простирается через центр центрального компонента катетера 112 от проксимального конца 124 до дистального конца 126. Канал направляющего кабеля 128 включает гибкий направляющий кабель удлиненной формы 130 для плавного передвижения кабеля по каналу 128 (Фигура 29). Направляющий кабель 130 используется для продвижения катетерного устройства через биологический канал. В некоторых вариантах осуществления изобретения, направляющий кабель 130 имеет твердую сердцевину, например, из нержавеющей стали или сверхэластичного нитинола. Направляющий кабель может быть изготовлен, но необязательно, из рентгеноконтрастного материала, либо полностью, либо в его дистальной части (например, в наиболее удаленной части, находящейся на расстоянии 1 мм - 25 мм или на расстоянии 1 мм – 3 мм). На направляющий кабель 130 может быть, но необязательно, нанесено инертное с медицинской точки зрения покрытие, такое как TEFLON®. В других вариантах осуществления изобретения, катетерное устройство представляет собой катетер для быстрой замены лекарственных средств, где указанный направляющий кабель расположен у дистального конца направляющего наконечника 126 и простирается дальше от этого наконечника.
Узкий средний рельс 132, окружающий канал направляющего кабеля 128, простирается от направляющего наконечника катетера у дистального конца 126 по направлению к проксимальному концу катетера 124. Средний рельс 132 соединяет направляющий наконечник 126 с опорной частью 138 центрального компонента катетера.
Опорная часть центрального компонента катетера 138 имеет цилиндрическую внешнюю поверхность, простирающуюся по всей длине опорной части. Опорная часть 138 простирается почти по всей длине центрального компонента катетера 112. Как показано на фигуре 29, канал направляющего кабеля 128 проходит через центр опорной части центрального компонента катетера 138. Кроме того, пара просветов тканевых пенетраторов 140, 142, вместе с каналом направляющего кабеля 128, также простирается по всей длине опорной части центрального компонента катетера 138. У проксимального конца 124 центрального компонента катетера, пара входных отверстий 144, 146 соединяет пару просветов 140, 142 с внешним центральным компонентом катетера 112 (фигура 27).
В альтернативном варианте осуществления изобретения, медицинское устройство, представленное на фигуре 27, может также включать один гибкий упругий привод, который был изготовлен в виде трубки для подвода в тканевые пенетраторы; один гибкий удлиненный тканевый пенетратор, который проходит через трубку-подвод в тканевый пенетратор и соединен с наконечником; и внешнюю выпускную трубку, которая простирается по всей длине центрального компонента катетера, трубку для подвода в тканевый пенетратор, и средний рельс.
Пара трубок 114, 116 для подвода в первый и второй тканевые пенетраторы отходят от опорной части центрального компонента катетера 138 по направлению к дистальному концу катетера 126. Каждая трубка для подвода в тканевые пенетраторы изготовлена в виде узкой удлиненной трубки, имеющей проксимальный конец, который соединен с опорной частью центрального компонента катетера 138, и противоположный дистальный конец 148, 150. Каждая первая и вторая трубка 114, 116 для подвода в тканевые пенетраторы имеет внутренний канал 152, 154, который сообщается с соответствующим первым просветом тканевого пенетратора 140 и вторым просветом тканевого пенетратора 142 в опорной части центрального компонента катетера 138.
Как показано на фигурах 29 и 30, внешние конфигурации трубок 114, 116 для подвода в тканевые пенетраторы соответствуют среднему рельсу 132, таким образом, что трубки 114, 116 для подвода в тканевые пенетраторы, по своей длине, могут быть расположены бок о бок с противоположных сторон среднего рельса 132. Дистальные концы трубки для подвода в тканевый пенетратор 148, 150 могут быть изготовлены в виде поверхностей направляющего наконечника, который также облегчает прохождение катетера через сосудистую систему. Дистальные концы трубки для подвода в тканевые пенетраторы 148, 150, предпочтительно, имеют диаметр, превышающий диаметр трубок 114, 116 для подвода в тканевые пенетраторы. В конкретном варианте осуществления изобретения, дистальные концы трубки для подвода в тканевый пенетратор 148, 150 являются закругленными и имеют луковичную форму. Такие концы являются нетравматичными, а трубки исключают возможного случайного прокола стенки биологического канала. Концы 148, 150 являются доступными для направляющего наконечника 126 и их диаметр не превышает диаметр такого наконечника.
Каждую из трубок 114, 116 для подвода в тканевые пенетраторы, предпочтительно, изготавливают из материала, обладающего запоминающими конфигурацию свойствами, такого как нитинол. Трубки 114, 116 имеют изогнутые, неограничительные конфигурации, представленные на фигуре 28. Трубки 114, 116 приобретают изогнутые неограничительные конфигурации, представленные на фигуре 28, без приложения поддерживающей силы. В целях придания трубкам 114, 116 для подвода в тканевые пенетраторы прямой ограничительной конфигурации вдоль средниего рельса 132, этим трубкам, для их сохранения в прямом ограничительном положении, должна быть сообщена поддерживающая сила, как показано на фигуре 27. По мере того, как трубки 114, 116, находясь в прямой ограничительной конфигурации, как показано на фигуре 28, будут приобретать изогнутую неограничительную конфигурацию, как показано на фигуре 28, каналы тканевого пенетратора 152, 154, проходящие через эти трубки, также будут менять свою прямую конфигурацию на изогнутую.
Пара тканевых пенетраторов 118, 120, от их дистального конца до наконечников 166, 168, имеют длину, которая слегка превышает общую длину просветов тканевого пенетратора 140, 142, проходящих через опорную часть центрального катетера 138 и каналы тканевого пенетратора 152, 154, проходящие через трубки 114, 116 для подвода в тканевые пенетраторы. Наконечники 156, 158 тканевых пенетраторов 118, 120 расположены возле дистальных концов 148, 150 трубок 114, 116 для подвода в тканевые пенетраторы и внутри каналов 152, 154 трубок в ограничительной конфигурации, представленной на фигуре 27. Противоположные проксимальные концы тканевых пенетраторов 118, 120 выступают из боковых входных отверстий 144, 146 центрального катетера 112. Пара тканевых пенетраторов 118, 120 имеет размеры, которые обеспечивают легкое прохождение через просветы тканевых пенетраторов 140, 142 центрального компонента катетера 112 и через каналы тканевых пенетраторов 152, 154 трубок 114, 116 для подвода в тканевые пенетраторы. Боковые входные отверстия 144, 146 центрального компонента катетера 112, предпочтительно, расположены под углом 20°-90° к проксимальному концу центрального катетера 124, а наиболее предпочтительно, под углом 30°-60° к проксимальному концу центрального катетера 124.
Пара устройств неавтоматизированного ручного перемещения и контроллеров линейных перемещений 162, 164 может быть подсоединена к проксимальным концам тканевых пенетраторов 118, 120 и соединена с отверстиями центрального катетера 144, 146 (фигура 31). Эти контроллеры 162, 164 могут быть сконструированы так, чтобы неавтоматизированное перемещение могло быть переведено в регулируемое линейное перемещение тканевых пенетраторов 118, 120 через просветы тканевых пенетраторов центрального катетера 140, 142 и через каналы трубок для подвода в тканевые пенетраторы 152, 154. В одном из вариантов осуществления изобретения имеются вращающиеся контроллеры 162, 164, которые могут быть перемещены вручную в одном направлении, так, чтобы наконечники тканевых пенетраторов для инъекций 156, 158, расположенные у дистальных концов тканевых пенетраторов, могли быть регулируемым образом позиционированы на нужном растоянии от каналов трубок для тканевых пенетраторов 152, 154, расположенных у дистальных концов трубки тканевого пенетратора 148, 150. При вращении контроллеров в обратном направлении, тканевые пенетраторы 118, 120 могут быть возвращены назад в каналы трубок для тканевых пенетраторов 152, 154. Каждое движение вручную к контроллеру линейных перемещений 162, 164 может обеспечиваться наконечником 166, 168, который сообщается с внутренним каналом, проходящим через тканевые пенетраторы 118, 120, и может быть использован для подсоединения к шприцу или к системе трубок, содержащих раствор диагностического или терапевтического средства.
Внешняя выпускная трубка 122 имеет вид трубки, которая окружает центральный катетер 112, трубки 114, 116 для подвода в тканевые пенетраторы и средний рельс 132. Выпускная трубка 122 может быть смонтирована на центральном компоненте катетера 112 и паре трубок 114, 116 для подвода в тканевые пенетраторы, сконструированных для обеспечения плавного движения выпускной трубки 122 вперед, где открытый дистальный конец 172 выпускной трубки расположен рядом с дистальными концами 148, 150 трубок 114, 116 для тканевых пенетраторов как показано на фигуре 27, и движения выпускной трубки 122 назад, где дистальный конец 172 выпускной трубки расположен рядом с участком соединения трубок для тканевых пенетраторов 114, 116 с центральным компонентом катетера 112 как показано на фигуре 28. Противоположный проксимальный конец 174 выпускной трубки 122 может быть снабжен механическим сцеплением 176 с центральным катетером 112. Механическое сцепление 176 позволяет выпускной трубке 122 двигаться в направлении вперед и назад по отношению к центральному катетеру 112 и к трубкам для тканевых пенетраторов 114, 116 (фигуры 27 и 28). Такое соединение может быть обеспечено дисковым переключателем, подвижным соединением, пусковым механизмом или нажатием кнопки, либо каким-либо другим сцеплением, которое может управляться вручную для осуществления движения выпускной трубки 122 относительно центрального катетера 112 и трубок 114, 116. Если выпускная трубка 122 движется вперед как показано на фигуре 27, то дистальный конец трубки 172 проходит по всей длине трубок 114, 116 для подвода в тканевые пенетраторы и переводит подводящие трубки в их ограничительные положения, выходящие за пределы боковых сторон среднего рельса 132 центрального катетера. Если выпускная трубка 122 двигается в положение назад, как показано на фигуре 28, то дистальный конец 172 выпускной трубки отходит назад от всей длины трубок тканевых пенетраторов для подачи жидкостей 114, 116 и позволяют трубкам для подвода постепенно высвобождать свою энергию ограничительного состояния и переходить в их изогнутую неограничительную конфигурацию как показано на фигуре 28.
При использовании катетера 110, выпускная трубка 122 продвигается вперед как показано на фигуре 27. Направляющий кабель 130 устанавливают в биологическом канале (таком как артерия или вена) в известном положении. Затем катетер продвигают вперед по биологическому каналу по направляющему кабелю. Направляющий кабель 130 выходит из биологического канала и входит в дистальный конец центрального компонента катетера 126 через просвет направляющего кабеля 128. Кабель 130 проходит через центральный катетер 112 и выходит у проксимального конца центрального компонента катетера, смежного с входными отверстиями катетера 144, 146, где направляющий кабель 130 может управляться вручную.
Катетер 110 может проходить через биологический канал и может управляться направляющим кабелем 130. Данное устройство может быть, но необязательно, снабжено рентгеноконтрастными маркерами для мониторинга положения данного устройства в биологическом канале. Любой материал, который предупреждает проникновение электромагнитного излучения, рассматривается как рентгеноконтрастный, и такой материал является подходящим для использования. Предпочтительными рентгеноконтрастными материалами являются, но не ограничиваются ими, платина, золото или серебро. Рентгеноконтрастный материал может быть нанесен на поверхность всего наконечника 126 или его части, на все трубки 114, 116 для подвода в тканевые пенетраторы или на их части, на все тканевые пенетраторы 118, 120 или их части, на направляющий кабель 130, или на любые комбинации вышеупомянутых структур. Альтернативно, наконечник 126 может быть снабжен кольцом из рентгеноконтрастного материала. Данное устройство может быть, но необязательно, снабжено автономным визуализирующим устройством, таким как устройство для внутрисосудистой ультразвуковой или оптической когерентной томографии. Наконечник данного устройства может быть снабжен, но необязательно, оптическим устройством, используемым для определения положения данного устройства или свойств окружающего его биологического канала. Если устройство находится в нужном положении, то внешняя выпускная трубка 122 может быть перемещена от своего переднего положения, как показано на фигуре 27, в положение назад как показано на фигуре 28 путем ручного управления механическим соединением 176.
По мере удаления выпускной трубки 122 от пары трубок 114, 116 для подвода в тканевые пенетраторы, энергия ограничительного состояния трубок 114, 116 для тканевых пенетраторов высвобождается и трубки переходят в свою неограничительную изогнутую конфигурацию, как показано на фигуре 28. Такое движение устанавливает положения каналов тканевых пенетраторов 152, 154, находящихся у дистальных концов трубки тканевых пенетраторов 148, 150 на внутренних поверхностях биологического канала, в который было встроено устройство 110.
Затем оператор может осуществлять ручное управление контроллерами линейных перемещений 162, 164 для отведения дистальных концов тканевых пенетраторов 156, 158 из каналов тканевых пенетраторов 152, 154, расположенных у дистальных концов трубок для тканевых пенетраторов 148, 150. Может быть установлен датчик для каждого ручного управления контроллерами линейных перемещений 162, 164, который обеспечивает визуальную индикацию степени продвижения наконечников тканевых пенетраторов 156, 158 из концов трубок тканевых пенетраторов 148, 150 при вращении контроллеров 162, 164. Эти контроллеры могут быть также снабжены звуковым или тактильным датчиком, таким как щелчок, для индикации пошагового увеличения расстояния при движении тканевых пенетраторов. Это обеспечивает продвижение наконечников тканевых пенетраторов 156, 158 в стенки биологических каналов на нужное расстояние.
В третьем конкретном варианте осуществления изобретения, медицинским устройством согласно изобретению является катетер для доставки жидкости, включающий один или несколько тканевых пенетраторов, изготовленных из гибкого упругого материала. В некоторых аспектах изобретения, медицинское устройство согласно изобретению имеет центральную продольную ось и включает один или несколько тканевых пенетраторов, где один или несколько тканевых пенетраторов может находиться в ограничительной конфигурации, и по своей длине ориентированы, в основном, параллельно продольной оси указанного медицинского устройства, и в не-ограничительной конфигурации, при которой по меньшей мере часть длины указанного одного или нескольких тканевых пенетраторов ориентированы, в основном, не параллельно центральной продольной оси данного устройства. После установки устройства в нужный участок, смежный со стенкой биологического канала, один или несколько тканевых пенетраторов (а если необходимо, то все тканевые пенетраторы), могут освобождаться от ограничительной конфигурации и принимать неограничительную конфигурацию, что позволяет осуществлять контакт со стенкой биологического канала. Один или несколько тканевых пенетраторов могут иметь любую форму, а в предпочтительных вариантах осуществления изобретения, переход одного или несколько приводов из ограничительной конфигурации в неограничительную конфигурацию осуществляется после снятия поддерживающей силы оператором данного устройства, но без применения данным оператором какой-либо деформирующей силы к указанному устройству или к ткани-мишени.
В предпочтительном варианте осуществления изобретения, тканевые пенетраторы, изготовленные из эластичного, упругого материала, обладают способностью сжиматься под действием поддерживающей силы, например, если тканевые пенетраторы находятся в ограничительной конфигурации, и принимают свою исходную неограничительную форму при снятии такой поддерживающей силы, например, если тканевые пенетраторы находятся в неограничительной конфигурации. При этом, может быть использован любой эластичный упругий материал, включая, но не ограничиваясь ими, хирургическую сталь, алюминий, полипропилен, олефиновые материалы, полиуретан и другие синтетические каучуковые или пластиковые материалы. Наиболее предпочтительно, один или несколько тканевых пенетраторов изготавливают из материалов с конфигурационной памятью. Примерами таких материалов с конфигурационной памятью являются, но не ограничиваются ими, сплавы меди-цинка-алюминия-никеля, сплавы меди-алюминия-никеля и сплавы никеля-титана (NiTi). В предпочтительном варианте осуществления изобретения, таким материалом с конфигурационной памятью является нитинол. В предпочтительном варианте осуществления изобретения, в случае, если тканевые пенетраторы принимают неограничительную конфигурацию, то такие запоминающие свойства материала, из которого изготовлен каждый тканевый пенетратор, позволяют получать нужные тканевые пенетраторы без приложения какой-либо внешней деформирующей силы, благодаря переходу из положения, в основном, параллельного продольной оси медицинского устройства в положение, в основном, перпендикулярное продольной оси медицинского устройства.
В предпочтительном варианте осуществления изобретения, тканевые пенетраторы поддерживаются в ограничительной конфигурации благодаря внешнему компоненту катетера, имеющему трубчатую конфигурацию, которая окружает тканевые пенетраторы. Между внешним компонентом катетера и центральным компонентом катетера, к которому присоединены тканевые пенетраторы, имеется механическое соединение. Это механическое соединение позволяет передвигать внешний компонент катетера назад по длине центрального компонента катетера, что приводит к снятию ограничительного состояния одного или нескольких тканевых пенетраторов и позволяет одному или нескольким тканевым пенетраторам приобретать неограничительную конфигурацию, при которой они могут контактировать с нужным участком для доставки лекарственного средства. Для среднего специалиста в данной области очевидно, что такой конкретный вариант может быть легко адаптирован для включения рентгеноконтрастных маркеров в целях облегчения позиционирования данного устройства или быстрой замены лекарственного средства при применении данного устройства.
В различных вариантах осуществления изобретения, медицинское устройство согласно изобретению позволяет осуществлять доставку жидкостей в отдельные слои стенки сосудов. Стенка сосудов содержит множество структур и слоев, включая эндотелиальный слой и базальный мембранный слой (в собирательном значении, внутренний слой), внутреннюю эластичную пластинку, медиальный слой и адвентициальный слой. Эти слои расположены так, что эндотелий обращен к просвету сосуда и к базальной мембране, внутренней оболочке сосуда, внутренней эластичной пластинке, медиальному слою эндотелия и адвентициальному слою эндотелия, каждый из которых последовательно расположен в эндотелии в виде слоев, как описано в публикации патентной заявки США No. 2006/0189941A1. Что касается медицинских устройств согласно изобретению, то глубина, на которую наконечники тканевых пенетраторов 156, 158 могут проникать в ткань-мишень, может регулироваться путем вращения контроллеров 162, 164. Так, например, если слоем-мишенью является адвентициальный слой, то энергия органичительного состояния трубок 114, 116 высвобождается, и эти трубки принимают свою неограничительную изогнутую конфигурацию, как показано на фигуре 28, а наконечники тканевых пенетраторов 156, 158 продвигаются контроллерами на длину, достаточную для их проникновения на соответствующую глубину адвентициального слоя. Аналогичным образом, если слоем-мишенью является медиальный слой, то энергия органичительного состояния трубок 114, 116 высвобождается и эти трубки принимают свою неограничительную изогнутую конфигурацию, как показано на фигуре 28, а наконечники тканевых пенетраторов 156, 158 продвигаются контроллерами на длину, достаточную для их проникновения на соответствующую глубину медиального слоя.
При введении тканевых пенетраторов в нужный слой стенки биологического канала, то через эти тканевые пенетраторы 118, 120 может быть затем доставлена жидкость. После завершения доставки жидкости, контроллеры 162, 164 могут задвинуть наконечники тканевых пенетраторов 156, 158 назад во внутренние каналы 152, 154 трубок 114, 116 для подвода в тканевые пенетраторы. Выпускная трубка 122 может быть затем перемещена в свое переднее положение, где дистальный конец выпускной трубки 172 перемещает трубки 114, 116 для подвода в тканевые пенетраторы назад в свое ограничительное положение, как показано на фигуре 27. Если выпускная трубка 122 полностью перемещается в свое переднее положение, показанное на фигуре 27, то данное устройство может быть возвращено в свое исходное положение или удалено из организма.
Медицинское устройство согласно изобретению также позволяет доставлять жидкости к бляшкообразным отложениям, находящимся на внутренней стороне стенок биологического канала или в самих стенках биологического канала.
Медицинское устройство согласно изобретению также позволяет доставлять жидкости во внеклеточное пространство или в ткани, расположенные за пределами внешней стенки биологического канала (например, во внешнюю поверхность кровеносных сосудов или в мышцу, расположенную на внешней поверхности сосуда, такую как миокард).
Одним из преимуществ устройств согласно изобретению является то, что приводы, благодаря свой конструкции, могут контактировать почти со всем окружением внутренней стенки биологического канала после их введения в этот канал. В предпочтительных вариантах осуществления изобретения, приводы могут контактировать менее чем со 100% окружения внутренней стенки биологического канала, в который они введены. Более предпочтительно, приводы могут контактировать с менее чем 75%, 50% или 25% окружения внутренней стенки биологического канала, в который они введены. Наиболее предпочтительно, приводы могут контактировать с менее чем 10%, 5%, 2,5%, 1%, 0,5% или 0,1% окружения внутренней стенки биологического канала, в который они введены.
Указанные устройства могут быть использованы для доставки жидкостей, содержащих различные терапевтические и/или диагностические средства, в стенку биологического канала. Терапевтическими средствами являются, но не ограничиваются ими, белки, химические вещества, небольшие молекулы, клетки и нуклеиновые кислоты. Терапевтическое средство, доставляемое с помощью такого устройства, может содержать микрочастицы или наночастицы, может представлять собой комплекс с микрочастицами или наночастицами, или может быть связано с микрочастицами или наночастицами. Белковыми веществами являются эластазы, антипролиферативные агенты и агенты, ингибирующие вазоспазм. В частности, рассматривается применение устройства для доставки эластазы. В некоторых опубликованных патентных заявках (WO 2001/21574; WO 2004/073504 и WO 2006/036804) указывается, что эластаза, взятая отдельно и в комбинации с другими средствами может давать благоприятный эффект при лечении заболеваний биологических каналов, включая обструкцию биологических каналов и вазоспазм. Диагностическими средствами являются, но не ограничиваются ими, констрастные агенты, микрочастицы, наночастицы или другие визуализирующие агенты.
С использованием такого устройства могут быть осуществлены различные способы доставки отдельных жидкостей. В некоторых случаях, отдельные жидкости могут быть доставлены через каждый тканевый пенетратор данного устройства, либо одновременно, либо последовательно. В других случаях, одна и та же жидкость может быть доставлена через оба тканевых пенетратора либо одновременно, либо последовательно. В настоящем изобретении также рассматриваются варианты и/или способы, при которых первая жидкость доставляется через оба тканевых пенетратора с последующей доставкой второй жидкости через оба тканевых пенетратора.
Также конкретно рассматриваются способы доставки жидкостей в стенку или через стенку биологического канала с применением указанных устройств. Указанные способы включают стадии введения устройства в биологический канал, перемещения данного устройства в нужный участок данного биологического канала, освобождения приводов от их ограничительных положений, перемещения, но необязательно, тканевых пенетраторов через просветы в приводах для проникновения жидкости на нужную глубину в стенку биологического канала, доставки по меньшей мере одной жидкости в стенку или через стенку, возвращения, но необязательно, тканевых пенетраторов обратно в просветы приводов, возвращения приводов в их ограничительное положение, повторного переведения данного устройства в тот же самый или в другой канал для доставки дополнительной жидкости, если это необходимо, и удаления данного устройства из биологического канала.
6. Примеры
В данном разделе описаны способы получения рекомбинантной эластазы типа I для клинического применения, например, в качестве агента для увеличения диаметра кровеносных сосудов и просветов кровеносных сосудов. Панкреатическая эластаза типа I человека обнаруживает 89% идентичность аминокислот по всей длине панкреатической эластазы типа I свиней при полном сохранении «каталитической триады» и остатков, определяющих специфичность к субстрату. Эластаза типа I свиней была впервые синтезирована как ферментативно неактивный профермент, который активируется трипсином с образованием зрелого фермента, содержащего четыре внутренних дисульфидных связей, и не содержащего гликозилированных групп (см. публикации Shotton, 1970, Methods Enzymol 19:113-140, Elastase; и Hartley and Shotton, 1971, Biochem. J. 124(2): 289-299, Pancreatic Elastase. The Enzymes 3:323-373 и работы, на которые имеются ссылки в данных публикациях).
В приведенных ниже примерах проиллюстрирована разработка эффективных и масштабируемых схем экспрессии рекомбинантной эластазы типа I свиней и человека и схем очистки для получения этих ферментов с использованием циклического гуанозин-монофосфата (cGMP), подходящих для не-клинических и клинических исследований, и для их промышленного применения в фармацевтике. Зрелая эластаза свиней получила название PRT-102. Зрелая эластаза типа I человека получила название PRT-201.
6.1. Терминология и обозначения
Используемые здесь термины PRT-101, PRT-102, PRT-201 и про-PRT-201 имеют следующие значения:
PRT-101: панкреатическая эластаза свиней. Если это не оговорено особо, то панкреатическая эластаза свиней, используемая в примерах, представляет собой панкреатическую эластазу свиней высокой степени очистки, закупаемую у Elastin Products Company, Inc, Owensville, MO, catalog # EC134.
PRT-102: зрелая рекомбинантная панкреатическая эластаза типа I свиней. Следует отметить, что векторы, обозначенные «pPROT101-XXX», кодируют PRT-102.
PRT-201: зрелая рекомбинантная панкреатическая эластаза типа I человека.
про-PRT-201: рекомбинантная панкреатическая эластаза типа I человека в форме профермента, содержащая пропептидную последовательность.
Ниже приводятся обозначения, используемые в разделе 6 данной заявки:
BKGY: забуференная комплексная среда, содержащая глицерин
BKME: забуференная комплексная среда, содержащая метанол
CHO: яичник китайского хомячка
E. coli: Escherichia coli
ELA-1: панкреатическая эластаза типа I
HEK: почки эмбриона человека
hELA-1: ELA-1 человека
ГХ: гидрофобная хроматография
MBP: белок, связывающийся с мальтозой
pELA-1: ELA-1 свиней
P. pastoris: Pichia pastoris
ПЦР: полимеразная цепная реакция
PMSF: фенилметилсульфонилфторид
ОФ: обратная фаза
S. cerevisiae: Saccharomyces cerevisiae
ДСН-ПААГ: электрофорез в полиакриламидном геле с додецилсульфатом натрия
ЭХ: эксклюзионная хроматография
USP: Фармакопея США
YPDS: Среда, содержащая пептонно-дрожжевой экстракт с декстрозой и сорбитом
6.2. Пример 1: Синтез ДНК эластазы
Последовательность, кодирующую эластазу-1 человека, получали как описано в патенте США No. 5162205 (Takiguichi et al., 1992). Для облегчения клонирования в экспрессионные векторы, в указанной последовательности было сделано несколько изменений (фигура 1A). Замены оснований, внесенные исходя из вырожденности генетического кода, были сделаны так, чтобы это не приводило к изменению аминокислотных остатков. Для минимизации потенциального «сквозного прочитывания» сайта связывания с рибосомой был введен второй стоп-кодон сразу после нативного стоп-кодона.
Модифицированная кодирующая последовательность была синтезирована фирмой Blue Heron Biotechnology (Bothell, WA) методом «длинных олигонуклеотидов», проводимым без применения ПЦР и по лицензии, выданной Amgen (Thousand Oaks, CA). Рекомбинантную ДНК, обозначенную ELA-1.2A (SEQ ID NO:81), клонировали в вектор Blue Heron pUC, то есть производное вектора pUC119, и полученную плазмиду обозначали pPROT1. Плазмиду pPROT1 секвенировали по обеим цепям для подтверждения правильности последовательности. Полученные с высокой точностью данные секвенирования с обширным перекрыванием по обеим цепям позволяют однозначно определить всю нуклеотидную последовательность, где такое перекрывание было получено путем проведения минимум четырех реакций секвенирования, по меньшей мере одной реакции для каждой цепи.
6.3. Пример 2: Экспрессия PRT-201 в E.coli
Для получения растворимой и ферментативно активной эластазы человека в E.coli был разработан ряд стратегий экспрессии.
Один набор экспрессионных векторов E. coli содержался в гибриде панкреатической эластазы типа I человека (ELA-1) с карбокси-концом связывающегося с мальтозой белка (MBP) с сохранением рамки считывания, который, в свою очередь, был присоединен к N-концевому секреторному пептиду. Обе последовательности, кодирующие зрелую ELA-1 человека и профермент, клонировали с сохранением рамки считывания в виде С-концевого гибрида с MBP-кодирующей последовательностью плазмиды pMAL-p2G (New England Biolabs, Inc., Beverly, MA) и получали либо pPROT3 (зрелую ELA-1), либо pPROT5 (профермент ELA-1). Конструирование pPROT3 осуществляли сначала путем проведения ПЦР-мутагенеза фрагмента, кодирующего зрелую ELA-1 человека, длиной 6,6 т.п.н. с использованием SnaBI-сайта у N-концевого кодона валина зрелой ELA-1 человека и HindIII-сайта, расположенного со стороны 3’-конца по отношению к кодонам терминации зрелой ELA-1. Такой ПЦР-мутагенез предусматривает использование матрицы pPROT1, содержащей ELA-1.2A-кодирующую последовательность (SEQ ID NO:81), и двух олигонуклеотидных праймеров (5’ ATC TAC GTA GTC GGA GGG ACT GAG GCC, SEQ ID NO:75; и 5’ gtc gac aag ctt atc agt tgg agg cga t, SEQ ID NO:76). Полученный 6,6 т.п.н.-ПЦР-фрагмент выделяли, гидролизовали ферментами SnaBI и HindIII, а затем клонировали в XmaI/HindIII-гидролизованный вектор pMAL-p2G с получением pPROT3. Конструирование pPROT5 осуществляли путем клонирования ScaI/HindIII-фрагмента из pPROT1 и лигирования в вектор pMAL p2G, который был гидролизован ферментами SnaBI и HindIII. Полученный гибрид функционально связывает N-конец области, кодирующей профермент ELA-1 человека, с С-концом MBP вектора pMAL-p2G в pPROT5. Домен расщепления пробелка ELA-1 человека трипсином сохранялся в pPROT5.
Штамм TB1 E. coli трансформировали векторами pPROT3 и pPROT5, а затем индуцировали IPTG для того, чтобы определить, может ли продуцироваться слитый белок или ферментативно активный ELA-1 человека. В случае pPROT3, весь полученный слитый белок MBP-ELA-1 оказался нерастворимым. В периплазматическом материале, полученном посредством осмотического шока индуцированного pPROT3, содержащегося в E. coli, какого-либо растворимого или ферментативно активного слитого белка МВР-ELA-1 обнаружено не было. В случае pPROT5, в периплазматическом материале, полученном посредством осмотического шока индуцированного pPROT3, содержащегося в E. coli, могли детектироваться низкие уровни растворимого рекомбинантного белка MBP-proELA-1, на что указывал электрофорез в ДСН-ПААГ с окрашиванием кумасси или вестерн-блот-анализ, проводимый с использованием анти-MBP антител (New England Biolabs, Inc., Beverly, MA). Растворимый рекомбинантный белок MBP-proELA-1 может быть гидролизован трипсином с получением MBP и зрелой ELA-1 человека. Зрелую ELA-1 человека, полученную путем индуцирования pPROT5, затем анализировали на эластазную активность с использованием пептидного субстрата SLAP. Эластазная активность наблюдалась в экстрактах периплазматического pPROT5. Такая ферментативная активность эластазы зависит от активации трипсином (то есть активность не наблюдалась в отсутствии трипсина, но ее количество повышалось по мере увеличения периода активации трипсином). Кроме того, эластазная активность зависит от pPROT5, поскольку активность не наблюдалась в экстрактах контрольного вектора pMAL-p2G, одновременно обработанного трипсином. И наконец, эластазная активность pPROT5 ингибировалась ингибитором PMSF (известным как ингибитор сериновой протеазы).
Рекомбинантный слитый белок MBP-proELA-1 затем очищали и расщепляли трипсином с получением ферментативно активной зрелой ELA-1 человека, происходящей от pPROT5. Слитый белок сначала очищали с помощью аффинной хроматографии на амилозе, а затем элюировали мальтозой. После этого очищенный MBP-proELA-1 обрабатывали иммобилизованным трипсином. После проведения стадии активации трипсином, расщепленный MBP-proELA-1 очищали с помощью катионообменной хроматографии на сефарозе SP Sepharose. Однако последующие эксперименты, проводимые с использованием аффинно очищенной зрелой ELA-1 человека, происходящей от pPROT5, показали, что из E.coli, содержащей pPROT5, может быть выделено лишь очень ограниченное количество растворимой и ферментативно активной эластазы. Кроме того, специфическая активность аффинно очищенной зрелой ELA-1 человека, происходящей от pPROT5, была очень низкой, а именно составляла в пределах от 0,27 до 0,38 ед./мг (ед. = микромоль субстрата SLAP, гидролизованного за одну минуту).
Была также проведена альтернативная стратегия получения растворимой и ферментативно активной ELA-1 в E. coli. Коротко, был сконструирован вектор pPROT8, кодирующий слитый белок, содержащий первые 8 аминокислотных остатков альфа-субъединицы lacZ E.coli плюс 5 аминокислот кодируемых полилинкером остатков, за которыми следовал N-концевой профермент ELA-1 человека. Этот вектор конструировали путем лигирования BamHI/NcoI-фрагмента, содержащего последовательность pPROT1, кодирующую ELA-1 человека (то есть вектора, содержащего последовательность ELA-1.2A; SEQ ID NO: 81), в pBlueHeron pUC (Blue Heron Biotechnology, Bothell, WA, USA), который был гидролизован ферментами BamHI/NcoI.
Штамм EC100 E. coli (EPICENTRE Biotechnologies, Madison, WI), трансформировали вектором pPROT8, а затем индуцировали IPTG для того, чтобы определить, может ли продуцироваться слитый белок или ферментативно активная ELA-1 человека. В случае трансформированных клеток EC100, весь слитый белок LacZ-proELA-1, происходящий от pPROT8, был нерастворимым (то есть присутствовали в тельцах включения). Затем штамм E.coli, содержащий мутации в генах trxB и gor (штамм Origami™, Takara Mirus Bio, Inc., Madison, WI) трансформировали вектором pPROT8 как штаммы E. coli с мутациями в этих кодирующих последовательностях, которые, как известно, стимулируют выделение растворимых и ферментативно активных рекомбинантных белков. Хотя до некоторой степени растворимый слитый белок LacZ-proELA-1, происходящий от pPROT8, в штамме trxB/gor E.coli, был выделен после IPTG-индуцирования, однако этот белок не превращался в ферментативно активную ELA-1 человека под действием трипсина.
6.4. Пример 3: Экспрессия PRT-201 в клеточных линиях млекопитающих
Для получения растворимой и ферментативно активной панкреатической эластазы типа I человека (ELA-1) в клеточных линиях млекопитающих было предпринято несколько стратегий экспрессии. Высококопийный экспрессионный вектор pcDNA3.1 (Invitrogen) млекопитающих, содержащий промотор CMV, использовали в качестве остова для двух экспрессионных векторов эластазы ELA-1 человека, pPROT30 и pPROT31. Для конструирования pPROT30, последовательность профермента ELA-1 человека амплифицировали с помощью ПЦР и присоединяли к сигнальной последовательности панкреатической эластазы свиней, включенной в прямой ПЦР-праймер. С использованием рестрикционных сайтов, включенных в ПЦР-праймер, ПЦР-продукт гидролизовали и лигировали с использованием соответствующих рестрикционных сайтов в вектор pcDNA3.1. pPROT31 конструировали аналогичным образом, за исключением того, что для прямой экспрессии зрелого фермента, вместо последовательности, кодирующей профермент, использовали последовательность, кодирующую зрелую ELA-1 человека. E. coli трансформировали реакционными смесями для лигирования и отбирали клоны для скрининга miniprep. Один клон для каждого экспрессионного вектора отбирали исходя из предполагаемых паттернов гидролиза рестриктирующими ферментами для получения нужной вставки. Для каждого клона получали плазмидную ДНК и последовательности, содержащие экспрессионный вектор, подтверждали путем секвенирования ДНК.
Клеточные линии млекопитающих CHO, COS, HEK293 и HEK293T подвергали временной трансфекции векторами pPROT30 и pPROT31 по отдельности. Через несколько дней, супернатанты клеточных культур собирали и анализировали на экспрессию пробелка ELA-1 человека (pPROT30) или зрелого белка (pPROT31) с помощью вестерн-блот-анализа. Поликлональное антитело против панкреатической эластазы свиней перекрестно реагировало с полосой пробелка ELA-1 человека с предполагаемой молекулярной массой в супернатантах pPROT30 и с полосой зрелого белка ELA-1 человека с предполагаемой молекулярной массой в супернатантах pPROT31.
Супернатанты pPROT30 и pPROT31 анализировали на эластазную активность с помощью SLAP-анализа. Для pPROT30, супернатанты сначала обрабатывали трипсином для превращения профермента в зрелый PRT-201. Ни в одном из супернатантов любого вектора, как показал SLAP-анализ, какой-либо эластазной активности не обнаруживалось.
6.5. Пример 4: Экспрессия активированного трипсином PRT-201 в P. pastoris
Вектор для экспрессии секретируемого белка P. pastoris, PV-1, был синтезирован фирмой Blue Heron и впервые использован для клонирования последовательности, кодирующей ELA-1 человека дикого типа. Вектор PV-1 был сконструирован для облегчения клонирования, отбора и экспрессии рекомбинантного белка на высоком уровне. Данный вектор содержит ген резистентности к Зеоцину™ для прямого отбора многокопийных интегрантов. Присоединение N-конца пропептида эластазы к последовательности фактора α-скрещивания дрожжей, содержащей сигнал секреции дрожжей, пропептид и спейсерные последовательности, представленные на фигуре 1В, позволяет осуществлять секрецию экспрессированного белка в культуральной среде. Секретированный белок проэластазы может быть легко выделен из клеточного осадка, по существу, за первую стадию очистки. Кроме того, для экспрессии была выбрана проферментная форма ELA-1 человека, содержащая сайт расщепления трипсином, во избежание прямой экспрессии зрелого активированного фермента, который может давать неправильную укладку белка или который может быть токсичным для клеток, экспрессирующих рекомбинантный фермент.
Клонирование экспрессионной конструкции pPROT24-V для прямой экспрессии профермента ELA-1 осуществляли следующим образом. Область, кодирующую ELA-1 человека (SEQ ID NO:81), амплифицировали из ELA-1 Blue Heron pUC с помощью ПЦР (ПЦР-системы с высокой достоверностью Expand High Fidelity PCR System, Roche, Indianapolis, В). Прямой праймер 20F включал XhoI-сайт (5'-ggctcgagaaaagagaggctgaagctactcaggaccttccggaaaccaatgcccgg-3; SEQ ID NO:35). Праймер 24R включал SacII-сайт (5'-gggccgcggcttatcagttggaggcgatgacat-3'; SEQ ID NO:36). Полученный ПЦР-продукт подвергали гель-очистке и клонировали в pCR2.1-TOPO (Invitrogen). Последовательность, кодирующую ELA-1, выделяли с использованием XhoI и SacII, подвергали гель-очистке и клонировали в вектор PV-1 в этих сайтах с получением pPROT24-V (фигура 3).
Лигированный продукт pPROT24-V амплифицировали в штамме ТОР10 E. coli. Клеточную смесь высевали на планшеты со средой LB с низкой концентрацией соли, в которую было добавлено 25 микрограммов/мл зеоцина. Затем получали плазмидную ДНК (Qiagen, Valencia, CA) и вставку ELA-1 человека идентифицировали путем гидролиза рестриктирующими ферментами. pPROT24-кодирующую последовательность подтверждали путем секвенирования обеих цепей очищенной ДНК maxiprep путем проведения множества реакций с перекрыванием. Данные секвенирования с высокой достоверностью позволяют проводить точный анализ нуклеотидов и подтверждать «правильную» кодирующую последовательность. Были получены маточные глицериновые растворы pPROT24-V/TOP10, и эти растворы хранили при -80°C.
Для трансформации использовали штамм NRRL Y-11430 P. pastoris дикого типа, полученный от Департамента сельского хозяйства США (USDA, Peoria, IL, USA). Плазмидную ДНК от pPROT24-V линеаризовали ферментом SacI, и полный гидролиз подтверждали с помощью электрофореза небольшой аликвоты реакционной смеси на агарозном геле. Трансформацию штамма P. pastoris плазмидной ДНК pPROT24-V осуществляли путем электропорации. Клеточные смеси высевали на YPDS-планшеты, содержащие 100 микрограммов/мл зеоцина. Через три дня начинали образовываться колонии, которые затем отбирали в течение еще нескольких дней для пересева штрихом на свежие планшеты.
Вообще говоря, резистентные к лекарственному средству трансформанты скринировали на экспрессию в 1-литровой колбе с перегородкой. Одну колонию использовали для инокуляции 200 мл среды BKGY. Раствор BKGY имел следующий состав: 10 г/л глицерина, 13,4 г/л азотистого основания дрожжей с сульфатом аммония и без аминокислот (Invitrogen), 20 г/л соевого пептона, 10 г/л дрожжевого экстракта, 0,4 мг/л биотина в 0,1 M фосфатно-калиевого буфера (pH 5,0). Культуру выращивали в течение двух дней при 28°C со встряхиванием при 275 об/мин. Культуры осаждали путем центрифугирования при 650×g в течение 10 минут при комнатной температуре. Клеточный осадок ресуспендировали в среде для индуцирования BKME, pH 5,0, в отношении 1 г сырых клеток : 5 мл среды для индуцирования. 50 мл клеточной суспензии помещали в 500 мл-колбу без перегородки, где отношение клеточной суспензии к объему колбы составляло 1:10. Клетки инкубировали при 22°C со встряхиванием при 275 об/мин в течение 1-3 дней. Затем среду для индуцирования, два раза в день за весь период индуцирования, пополняли метанолом до конечной концентрации 0,5%.
Для скрининга на экспрессию брали 1 мл аликвот, которые переносили в микроцентрифужные 1,5 мл-пробирки и центрифугировали в течение 5 минут при 20000×g в микроцентрифуге. Супернатанты переносили в свежие пробирки и хранили при –80°С. Для анализа, проводимого путем электрофореза в ДСН-ПААГ, аликвоты супернатантов оттаивали и смешивали с 4 X буфером Лэммли, в который был добавлен восстановитель бета-меркаптоэтанол до объема 5%. Образцы кипятили в течение 5 минут, осторожно центрифугировали и загружали на преформированный 8-16% гель в градиенте Tris-HCl в электрофоретической системе Criterion (Bio-Rad). После электрофореза, гель окрашивали кумасси и анализировали на экспрессию профермента ELA-1 человека. Для последующего анализа был выбран клон 201-24-266-VU, полученный с высоким выходом. Был создан экспериментальный банк клеток, состоящий из глицериновых маточных растворов 201-24-266-VU, и эти растворы хранили при -80°C.
Для крупномасштабного продуцирования профермента ELA-1 человека с использованием клона 201-24-266-VU было осуществлено множество циклов продуцирования, которые обычно проводили методами, описанными ниже. В указанных методах, где это было возможно, в эти циклы были внесены изменения.
Для культивирования клеток, серии клеточных культур в 2-литровых шейкерных колбах с перегородками (обычно от 20 до 40 колб), содержащих 500 мл культуральной среды BKGY, инокулировали 250 микролитрами оттаявшего глицеринового маточного раствора 201-24-266-VU. Культуры выращивали при 28°C в течение 2 дней в шейкерном инкубаторе при 250–300 об/мин. Через 2 дня, клетки осаждали центрифугированием и супернатант отбрасывали. Клеточный осадок ресуспендировали в среде для индуцирования BKME, pH 5,0, в отношении 1 г клеточной массы : 5 мл среды. Клеточную суспензию в объеме 200-400 мл помещали в 2-литровые колбы без перегородок, и культивировали в течение 3 дней в шейкерном инкубаторе (250-300 об/мин) при 22°C. Затем среду, два раза в день за весь период индуцирования, пополняли метанолом до объема 0,5%. По окончании индуцирования, культуры в шейкерных колбах центрифугировали с образованием клеточного осадка. Затем супернатант удаляли и сразу фильтровали при комнатной температуре через 0,22 мкм полиэфирсульфоновую мембрану с использованием 1-литровых вакуумных фильтров для удаления какого-либо остаточного клеточного дебриса. Фильтрат хранили при 2-8°С в течение 1,5 месяца. Как показал ГФ-ВЭЖХ-анализ, выход профермента ELA-1 человека из клона про-PRT-201-24-266-VU в осветленном супернатанте обычно составлял 200-250 мг/л.
Захват про-PRT-201-24-266-VU из супернатанта осуществляли следующим образом. Сначала, супернатант, полученный путем проведения множества раундов культивирования в шейкерных колбах (обычно от 4 до 10 раундов), объединяли (обычно всего 8-25 л), 8-кратно разводили водой и доводили до pH 5,0 добавлением 1 M HCl. Затем разведенный супернатант загружали на уравновешенную колонку для ионообменного захвата Macro-Prep High S с объемом слоя 2 л при 2-8°C и при скорости 100 мл/мин (линейная скорость потока 76 см/ч). Программа проведения хроматографии включала следующие стадии: 1. Промывка колонки 10 литрами (5 колоночными объемами [КО]) буфера A (20 мМ цитрат натрия, pH 5,0) при 100 мл/мин (76 см/ч); 2. Промывка колонки 4 литрами (2 КО) смеси 90% буфера A и 10% буфера B (500 мМ хлорид натрия; 20 мМ цитрат натрия, pH 5,0) для конечной буферной композиции 50 мМ хлорида натрия; 20 мМ цитрата натрия, pH 5,0, при 100 мл/мин (76 см/ч); 3. Промывка колонки 6 литрами (3 КО) смеси 80% буфера A и 20% буфера B для конечной буферной композиции 100 мМ хлорида натрия; 20 мМ цитрата натрия, pH 5,0, при 100 мл/мин (76 см/ч); 4. Промывка колонки 6 литрами (3 КО) линейного градиента 75% буфера A и 25% буфера B → 68% буфера A и 32% буфера B, при 100 мл/мин (153 см/ч); 5. Элюирование линейным градиентом 30 литров (15 КО) 68% буфера A и 32% буфера B → 0% буфера A и 100% буфера B, при 100 мл/мин (76 см/ч). Элюат собирали во фракции, каждая из которых составляла 500–1000 мл.
Обычно, с помощью электрофореза в ДСН-ПААГ с последующим окрашиванием кумасси были обнаружены белки преимущественно двух видов: гликозилированный профермент ELA-1 человека и не-гликозилированный профермент ELA-1 человека, которые были затем идентифицированы с помощью ЖХ/МС-анализа, обычно при элюировании примерно 320 мМ хлорида натрия, как показано на фигуре 4. В некоторых раундах продуцирования был обнаружен белок в виде небольшой молекулы, размер которого был меньше размера профермента ELA-1 человека. Последующий ЖХ/МС-анализ этих фракций показал, что большинство этих белков не является полноразмерными проферментами, поскольку в них отсутствует несколько аминокислот у N-конца. Эти N-концевые варианты очищали и подвергали анализу на эластазную активность, который показал, что их эластазная активность меньше эластазной активности полноразмерного PRT-201. N-концевые варианты образовывались из профермента ELA-1 человека, имеющего низкий уровнь эластазной активности во время культивирования клеток и проведения хроматографии методом захвата, и такие варианты либо сами расщеплялись под действием внутримолекулярной реакции, либо расщепляли другую молекулу профермента ELA-1 человека под действием межмолекулярной реакции. Субоптимальные условия расщепления во время этих процедур могут давать высокий уровень неточного расщепления профермента (иногда называемого спонтанным или неконтролируемым превращением) с образованием, главным образом, N-концевых вариантов, а не интактного полноразмерного PRT-201.
После оценки результатов электрофореза в ДСН-ПААГ была собрана субпопуляция фракций с получением очищенного негликозилированного про-PRT-201, который был использован для последующей обработки. Фракции, содержащие гликозилированный профермент или полноразмерный PRT-201 и/или N-концевые варианты (которые вместе мигрировали на ПААГ с ДСН), обычно исключали из сбора. Собранный про-PRT-201 обычно хранили в 5-литровом пластиковом химическом стакане при 2-8°C в течение нескольких часов или в течение ночи с последующим превращением профермента в зрелый фермент.
Превращение про-PRT-201 в зрелый PRT-201 с использованием иммобилизованного трипсина осуществляли следующим образом. Собранные фракции про-PRT-201 диализовали в 20 мМ фосфата натрия, pH 5,0, в течение ночи при 2-8°C. Эта стадия позволяла удалять цитрат, который ингибирует трипсин. После диализа, про-PRT-201 пропускали через колонку с рекомбинантным трипсином (TrypZean), иммобилизованным на агарозных сферах, предварительно уравновешенную 20 мМ фосфата натрия, pH 5,0. Обычно, время контактирования про-PRT-201 с иммобилизованным TrypZean составляло 3,5-5 минут. Материал, полученный после превращения анализировали с помощью электрофореза в ДСН-ПААГ для подтверждения превращения, а затем загружали на колонку Macro-Prep High S для полиш-хроматографии. Затем колонку последовательно промывали 5 колоночными объемами 20 мМ цитрата натрия, pH 5,0; 2 колоночными объемами 20 мМ цитрата натрия, 50 мМ хлорида натрия, pH 5,0; и 3 колоночными объемами 20 мМ цитрата натрия, 100 мМ хлорида натрия, pH 5,0. Затем колонку промывали линейным градиентом 125 мМ хлорида натрия → 160 мМ хлорида натрия в 20 мМ цитрата натрия, pH 5,0. PRT-201 элюировали в линейном градиенте 165 мМ → 500 мМ хлорида натрия в 20 мМ цитрата натрия, pH 5,0 и собирали во фракции. Фракции анализировали на белок с помощью электрофореза в ДСН-ПААГ с последующим окрашиванием кумасси и оценивали на эластазную активность с помощью SLAP-анализа. Обычно собирали фракции, специфическая активность которых составляла 90% или превышала специфическую активность фракций с наивысшей специфической активностью. Последующий ЖХ/МС-анализ показал, что долго элюирующиеся фракции с меньшей специфической активностью были обогащены N-концевыми вариантами PRT-201.
Собранные фракции с высокой специфической активностью подвергали диафильтрации в буфер для получения препаратов, состоящий из 0,1 х PBS (13,7 мМ хлорид натрия, 1 мМ фосфат натрия, 0,27 мМ фосфат калия) при pH 5,0. После концентрирования PRT-201 до 1 мг/мл, pH доводили до 7,4. Полученный раствор разделяли на аликвоты, которые помещали в стеклянные сосуды с сывороткой, снабженные эластомерной пробкой, и лиофилизовали. Лиофилизацию обычно осуществляли путем проведения первого цикла сушки при температуре от -30 до -50°C и второго цикла сушки при -15°C. После лиофилизации, сосуды закрывали под вакуумом гофрированной пробкой и запаивали алюминием. После этого сосуды обычно помещали на хранение при 2-8°C или -80°C.
Для оценки стабильности лиофилизованного PRT-201 в сосудах, две партии, которые были изготовлены в виде стерильного GMP-продукта лекарственного средства, анализировали в соответствии с программой теста на стабильность. Программа оценки стабильности включала хранения продукта лекарственного средства при -15°C и периодическое взятие подпартии сосудов для тестирования с применением нижеследующих аналитических методов оценки стабильности (в скобках приводятся технические характеристики): оценка по внешнему виду лиофилизованного материала (белый или не совсем белый порошок), оценка по внешнему виду после разведения (прозрачный бесцветный раствор, не содержащий частиц), оценка специфической активности, проводимая с помощью SLAP-анализа (25-45 ед./мг), оценка чистоты по ОФ-ВЭЖХ (общая чистота : не менее чем 93%; отдельные примеси: не более чем 2%), оценка чистоты, проводимая с помощью электрофореза в восстанавливающем ПААГ с ДСН (не менее чем 93%), оценка чистоты, проводимая с помощью электрофореза в не-восстанавливающем ПААГ с ДСН (не менее чем 93%), оценка по включению макрочастиц (в соответствии с нормами USP), оценка на присутствие агрегатов, проводимая с помощью ЭХ-ВЭЖХ (не более чем 3%), оценка по содержанию вещества в одном сосуде (4,5–5,5 мг), определение pH (6,5-8,5), определение влажности (не превышала 5%) и оценка стерильности (в соответствии с нормами USP). На определенный момент времени, обе партии удовлетворяли требуемым техническим характеристикам в течение всей процедуры тестирования (лот C0807117 через 12 месяцев и лот C1007132 через 9 месяцев). Полученные результаты показали, что PRT-201 является стабильным по меньшей мере в течение 12 месяцев при его хранении в лиофилизованном состоянии в сосудах при -15°C.
Цитрат натрия, pH 5,0, применяемый при проведении хроматографии методом захвата про-PRT-201 и полиш-хроматографии превращенного PRT-201, использовали исходя из данных, указывающих на то, что цитрат натрия ингибирует эластазную активность очищенного PRT-201, а поэтому он также может ингибировать эластазную активность про-PRT-201 и PRT-201 во время проведения обработки. Такое ингибирование может минимизировать спонтанное превращение про-PRT-201 в N-концевые варианты и минимизировать ауторасщепление PRT-201. В том эксперименте, в котором буфер для SLAP-анализа содержал 115 мМ цитрата натрия, pH 5,0, специфическая активность PRT-201 снижалась на 91%.
Иногда, материал, элюированный из колонки для захвата про-PRT-201, не подвергали превращению под действием трипсина как описано выше, а вместо этого его использовали для получения препаратов, обогащенных белками различных видов. Так, например, из элюата, взятого с колонки для захвата, получали пулы фракций, содержащих, главным образом, гликозилированный про-PRT-201, не-гликозилированый про-PRT-201 или белки, образующиеся в результате спонтанного превращения. Обычно, такие пулы фракций подвергали диафильтрации в 10 мМ фосфата натрия, pH 5,0, лиофилизовали и хранили при -80°C.
Было проведено исследование для определения влияния рН и температуры на стабильность очищенного про-PRT-201 в течение определенного периода времени. Лиофилизованный про-PRT-201 разводили в 10 мМ фосфата натрия при pH от 3,0 до 8,4, а затем инкубировали при 4°C или 25°C в течение 7 дней. Через 7 дней, образцы про-PRT-201 в условиях при pH 4,0–8,0 и 25°C были обогащены зрелым PRT-201, уровень которого увеличивался с увеличением pH, на что указывали электрофорез в ДСН-ПААГ и окрашивание кумасси. В условиях pH 8,4 и 25°C наблюдалось полное превращение про-PRT-201 в зрелый PRT-201. Образцы при 4°C, pH 4,0-8,4, обнаруживали незначительное превращение, либо вообще не обнаруживали превращения. При pH 3,0, какого-либо превращения при 4°C и 25°C не обнаруживалось. В литературе (Hartley and Shotton, 1971, Pancreatic Elastase. Enzymes 3:323-373) сообщалось, что панкреатическая эластаза свиней необратимо инактивировалась после длительного хранения при pH ниже 3,0. Таким образом, исходя из результатов, полученных в данном исследовании, подходящими условиями минимизации превращения очищенного про-PRT-201, выбираемыми во избежание необратимой инактивации PRT-201, являются хранение при 4°C и при pH 3,0–4,0.
6.6. Пример 5: Экспрессия аутоактивированного PRT-201 в Р. Pastoris
Для получения варианта профермента, обладающего способностью к аутоактивации, что позволяет избежать активации трипсином, был сконструирован ряд вариантов векторов, кодирующих домен расщепления эластазы, и эти векторы были проанализированы в экспериментах по лабораторному культивированию и превращению. Варианты векторов получали путем сайт-направленного ПЦР-мутагенеза вектора pPROT24-V, а затем производных этого вектора. Сайт-направленный мутагенез осуществляли с использованием ДНК-полимеразы Pfu Turbo (Stratagene). Штамм XL10-Gold E.coli трансформировали полученными плазмидами. Трансформированные клеточные смеси высевали на планшеты со средой LB с низкой концентрацией соли, в которую было добавлено 25 микрограммов/мл зеоцина. Резистентные к лекарственному средству клоны собирали и получали плазмидную ДНК (Qiagen, Valencia, CA). Клоны подтверждали на предполагаемые изменения кодонов путем секвенирования обеих цепей плазмидной ДНК в пропептидной области с проведением множества перекрывающихся реакций. P. pastoris трансформировали вариантами векторов, и клоны отбирали как описано в предыдущем примере.
Систематизированные данные полученных вариантов домена расщепления эластазы приводятся ниже в таблице 4.

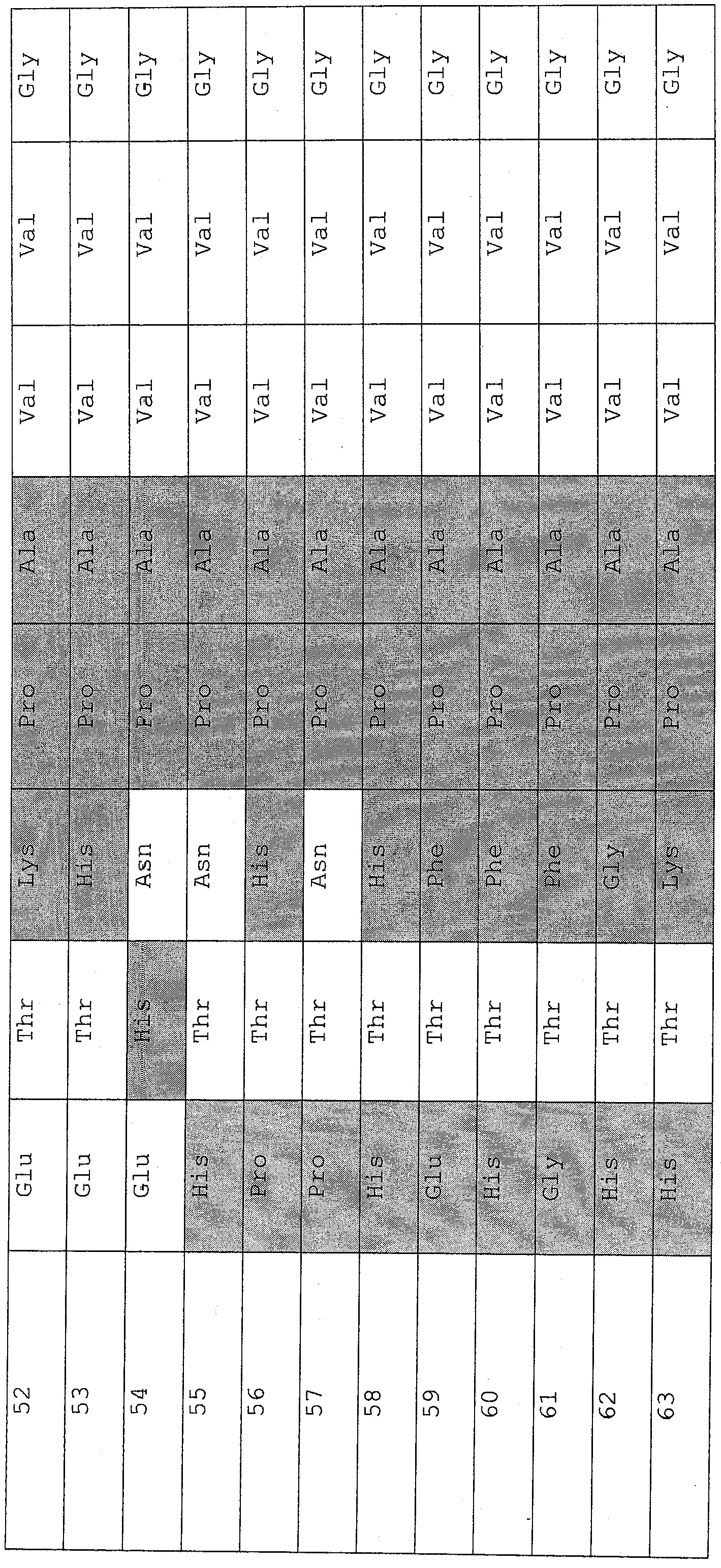
В вышеприведенной таблице 4, первый столбец под заголовком «обозначение пропептидной последовательности» соответствует SEQ ID NO для указанного домена расщепления эластазы. Так, например, число 24 соответствует последовательности SEQ ID NO:24, являющейся доменом расщепления трипсином дикого типа. Числа 40-49, 52-63 соответствуют, соответственно, последовательностям SEQ ID NO:40-49 и 52-63, являющимся вариантами доменов расщепления эластазы.
Условия культивирования вариантов клонов в шейкерных колбах, разработанные для активируемого трипсином клона 201-24-266-VU, были, в основном, аналогичны условиям, описанным в предыдущем примере. Было проанализировано несколько методов превращения вариантов пробелков, секретированных в супернатанте в шейкерной колбе, в зрелый PRT-201. Первая стратегия превращения состояла из хроматографической очистки варианта профермента с последующим его регулируемым расщеплением в конкретном буфере для превращения. Поскольку аминокислотные замены в вариантах пробелков давали лишь небольшие изменения теоретических значений изоэлектрических точек по сравнению с проферментом дикого типа, то катионообменную хроматографию осуществляли, в основном, как описано в предыдущем примере. Супернатанты вариантов культур клона получали для проведения хроматографии либо путем разведения водой, в основном, как описано в предыдущем примере, либо путем концентрирования с последующей диафильтрацией супернатанта с применением фильтрации в тангенциальном потоке в буфере для загрузки на колонку. После хроматографической очистки, элюированные фракции анализировали с помощью электрофореза в ДСН-ПААГ с последующим окрашиванием кумасси. Анализ на геле продемонстрировал большее количество зрелого белка, превращенного в пробелок во фракциях по сравнению с фракциями исходного супернатанта, что указывает на присутствие значительного количества спонтанно превращенного пробелка. После дополнительной очистки, спонтанно превращенный белок, как показал ЖХ/МС-анализ, состоял, главным образом, из N-концевых вариантов, которые, как было обнаружено, обладали незначительной эластазной активностью или вообще не обладали такой активностью в SLAP-анализе.
Вторая стратегия превращения состояла из превращения варианта пробелка с последующим его выделением из супернатанта культуры, и хроматографической очистки зрелого фермента. Такая стратегия превращения сначала была протестирована в лабораторном анализе, а затем в промышленном масштабе с большими объемами превращения. Для лабораторного превращения, осветленный супернатант из культур варианта клона обычно 5-кратно концентрировали путем центрифугирования при 2-8°C в ультрацентрифужном фильтре. После концентрирования, ретентат 5-кратно разводили буфером Tris до конечной концентрации 100 мМ Tris-HCl, обычно при pH 8,0–9,0. Образцы инкубировали при комнатной температуре на вращающейся платформе. Мониторинг эластазной активности с помощью SLAP-анализа обычно проводили до тех пор, пока скорость реакции активации не достигала плато. В некоторых случаях, скорость реакции повышалась так медленно, что SLAP-мониторинг был прекращен еще до достижения плато. Превращенные образцы анализировали на молекулы белка (например, на пробелок и PRT-201/N-концевые варианты) с помощью электрофореза в ДСН-ПААГ. Для проведения такой стратегии превращения в промышленном масштабе, супернатант, содержащий вариант пробелка, подвергали 10-кратному концентрированию путем фильтрации в тангенциальном потоке с последующей диафильтрацией 100 мМ Tris-HCl при рН 6,0-9,0. Мониторинг скорости реакции превращения проводили в течение определенного периода времени с помощью ГХ-ВЭЖХ-анализа, в котором проводили количественную оценку пробелка, PRT-201 и N-концевых вариантов. Если рН буфера для диафильтрации составлял 8,0-9,0, то скорость реакции превращения обычно увеличивалась.
Пробелки эластазы, перечисленные в таблице 5, экспрессировали в P. pastoris, как описано выше, и тестировали на их способность к аутопревращению в лабораторных анализах на превращение во второй стратегии превращения, описанной выше. Результаты этих исследований систематизированы ниже в таблице 5:
В вышеприведенной таблице 5, первый столбец под заголовком «обозначение пропептидной последовательности» соответствует SEQ ID NO для указанного домена расщепления эластазы. Так, например, число 24 соответствует последовательности SEQ ID NO:24, являющейся доменом расщепления эластазы дикого типа, активируемым трипсином. Числа 40-49 и 52-63 соответствуют, соответственно, последовательностям SEQ ID NO: 40-49 и 52-63, являющимся вариантами доменов расщепления эластазы. Столбец под заголовком «выход в шейкерных колбах» соответствует количеству соответствующего пробелка в супернатанте культуры, полученного в течение 3-дневного индуцирования, как было определено в анализе, проводимом путем электрофореза в ДСН-ПААГ. Столбец под заголовком «стабильность в шейкерных колбах» соответствует стабильности соответствующего пробелка в супернатанте среды для культивирования в шейкерных колбах, полученного в течение 3-дневного индуцирования, как было определено по количеству PRT-201/N-концевых вариантов с помощью электрофореза в ДСН-ПААГ. Столбец под заголовком «скорость превращения» соответствует относительной скорости превращения пробелка в PRT-201, на что указывает время до достижения максимальной скорости SLAP-реакции (высокая: менее 60 минут; средняя: 60-120 минут; и низкая: более чем 120 минут). Время превращения вариантов пробелков определяли с помощью лабораторного анализа на превращение, описанного выше, и сравнивали с временем превращения пробелка 24, определяемого путем активации с использованием иммобилизованного трипсина. Столбец под заголовком «% N-концевых вариантов» включает процент превращенного белка, содержащего N-концевые варианты белка эластазы (то есть варианты, содержащие сайт расщепления связи у С-конца по отношению к любому аминокислотному остатку, не являющемуся P1). Для иллюстрации относительных систем ранжирования, используемых в таблице 5, на фигуре 5 проиллюстрированы примеры электрофореза в ДСН-ПААГ, скорости превращения и анализы N-концевых вариантов для подгруппы аутоактивированных вариантов.
Анализ различных вариантов показал, что белки проэластазы, включающие последовательности SEQ ID NO:48 или SEQ ID NO:55, являющиеся вариантами домена расщепления эластазы, давали аутоактивированные эластазы с превосходными свойствами, включая средние и высокие выходы в шейкерных колбах и низкий процент вариантов после превращения. Дополнительный анализ пробелков эластазы, включающих последовательности SEQ ID NO:48 или SEQ ID NO:55, являющиеся вариантами домена расщепления эластазы, показал, что аутоактивация соответствующих пробелков (проферментов эластазы SEQ ID NO:64 и SEQ ID NO:69, соответственно) приводила к продуцированию N-концевого варианта лишь одного класса с расщеплением по пептидной связи у С-конца по отношению к остатку P’2. Дополнительный анализ пробелков эластазы показал, что пробелок, содержащий вариант SEQ ID NO:55 домена расщепления эластазы, был более стабильным, чем пробелок, содержащий вариант SEQ ID NO:48 домена расщепления эластазы.
Первоначальные эксперименты по оптимизации условий регулируемого расщепления очищенного про-PRT-201 осуществляли с использованием пробелка с последовательностью пропептида 42 (SEQ ID NO:6). Этот очищенный пробелок подвергали превращению в серии условий, включая pH (7,7–8,9), буферную композицию (0,4-10 мМ цитрат натрия), концентрацию белка (0,14–0,23 мг/мл) и время реакции (от 5 до 24 часов). По окончании периода превращения, реакции гасили добавлением муравьиной кислоты для снижения pH до 3,0. Относительное количество молекул белка в каждой реакционной смеси определяли с помощью масс-спектрометрии. На основании этих результатов был сделан вывод, что условия реакции превращения, которая давала наименьший процент N-концевых вариантов, включают pH 8,3, буфер, состоящий из 100 мМ Tris и менее чем 1 мМ цитрата натрия, концентрацию белка 0,2 мг/мл, и время реакции от 5 до 24 часов. В этом исследовании анализировали только конечные показатели реакции. Таким образом, данные по качеству превращения в реальном времени не были получены, а конечный результат может указывать на начальное продуцирование N-концевых вариантов и на значительный период времени разложения этих вариантов. Затем проводили ГХ-ВЭЖХ-анализ для мониторинга реакции превращения в реальном времени. Дополнительные исследования по оптимизации превращения, включая мониторинг, проводимый с помощью ГХ-ВЭЖХ в реальном времени, описаны в примере 6.
6.7. Пример 6: Экспрессия аутоактивированного PRT-201 в P. pastoris с использованием многокопийного варианта вектора
Для повышения уровней экспрессии нужного белка проводили интеграцию многокопийных рекомбинантных генов в P. pastoris (см., например, Sreekrishna et al., 1989, Biochemistry 28:4117-4125; Clare et al., 1991, Bio/Technology 9:455-460; RomaNN et al., 1991, Vaccine 9:901-906). Однако в некоторых случаях уровни экспрессии однокопийных интегрантов векторов были достаточно высокими и не увеличивались при использовании многокопийных интегрантов векторов (Cregg et al., 1987, Bio/Technology 5:479-485). События спонтанной интеграции многокопийных плазмид происходят in vivo в P. pastoris с низкой частотой. В целях достижения геномной интеграции множества копий гена и возможного увеличения уровня экспрессии белка, для получения тандемных вставок гена в экспрессионный вектор с последующей трансформацией P. pastoris был применен метод лигирования in vitro.
В целях получения многокопийного интегранта варианта pPROT55-V, для конструирования вектора, содержащего множество копий pPROT55-V, который был затем использован для трансформации P. pastoris, был применен метод лигирования in vitro. Для получения многокопийного вектора, вектор pPROT55-V гидролизовали ферментами BglII и BamHI, и получали экспрессионныую 2,3 т.п.н.-касету, кодирующую ген про-PRT-201, промотор AOX1 и последовательность терминации транскрипции AOX1. Затем экспрессионную кассету лигировали с препаратом вектора pPROT55-V, который линеаризовали ферментом BamHI и обрабатывали щелочной фосфатазой кишечника теленка (New England Biolabs, MA, USA) для предотвращения самолигирования. Смесь для лигирования инкубировали в течение ночи при 16°C. Штамм TOP10 E. coli (Invitrogen, CA, USA) трансформировали указанной реакционной смесью для лигирования. Смесь для трансформации высевали на среду LB с низкой концентрацией соли в присутствии 25 микрограммов/мл зеоцина. Затем собирали резистентные к лекарственному средству трансформанты и получали плазмидную ДНК.
Для определения числа экспрессионных кассет в полученных клонах, плазмидную ДНК гидролизовали ферментами BglII и BamHI и анализировали с помощью электрофореза в агарозном геле с использованием стандартного маркера размера ДНК. Клон, содержащий одну полосу с определенной вставкой, размер которой соответствовал размеру трех экспрессионных 2,3 т.п.н.-кассет, идентифицировали и обозначали pPROT55M3-V. Для подтверждения образования линейного мультимера для вектора pPROT55M3-V в ориентации «голова к хвосту» осуществляли рестрикционное картирование. На фигуре 6 проиллюстрирована схема клонирования pPROT55M3-V.
Штамм NRRL Y-11430 P. pastoris дикого типа использовали для трансформации, которую осуществляли как описано в примере 4, за исключением того, что перед трансформацией, вектор pPROT55M3-V линеаризовали ферментом BglII, а не SacI. Резистентные к лекарственному средству трансформанты культивировали и скринировали на экспрессию пробелка pPROT55M3 как описано в примере 4.
Оптимизацию условий культивирования в шейкерных колбах осуществляли в целях мимнимизации спонтанного расщепления в процессе индуцирования. Оптимизацию в шейкерных колбах осуществляли по двум параметрам, температуре индуцирования и составу среды для индуцирования. Во-первых, было обнаружено, что проведение индуцирования при 22°C, по сравнению с индуцированием при 25°C, давало более высокое отношение количества профермента к зрелому ферменту в супернатанте культуры для всех протестированных сред. Во-вторых, добавление цитрата натрия для повышения силы буфера в среде для индуцирования приводило к предотвращению спонтанного превращения зрелого фермента в супернатанте культуры во всех тестируемых концентрациях цитрата натрия (12,5-50 мМ). Влияние таких параметров на выход и стабильность экспрессии пробелка в супернатанте в шейкерных колбах в течение определенного периода времени проиллюстрировано на фигуре 7.
Высокоэкспрессируемый трехкопийный клон 201-55M3-003-VU был выбран для анализа методом крупномасштабной ферментации, проводимой в соответствии с процедурами ферментации, разработанными для клона 201-55-001-VU, описанного ниже. Ферментацию клона 201-55-001-VU осуществляли путем оттаивания одного сосуда с банком клеток, который использовали для инокуляции шейкерной колбы, содержащей 500 мл культуральной среды BKGY при pH 5,7. Посевную культуру выращивали в течение 24 часов со встряхиванием при 28°C до тех пор, пока сырая клеточная масса не достигала плотности приблизительно 40 г/л. Ферментер, содержащий культуральную среду BKGY при pH 5,7, стерилизовали в автоклаве. После охлаждения среды до 28°C добавляли добавки, включающие азотистое основание дрожжей и биотин. Ферментер инокулировали посевной культурой в отношении посевная культура:культуральная среда BKGY = 1:33.
Процедуру ферментации начинали с культивирования в клеточной среде с подпиткой глицерином, который подавали при pH 5,7 и при 28°C. pH корректировали путем добавления 10% фосфорной кислоты и 30% раствора сульфата аммония. Культуру перемешивали при 300-1000 об/мин с аэрацией для поддержания содержания растворенного кислорода на уровне 40%. После истощения начальной партии глицерина и быстрого образования уровня растворенного кислорода, что является показателем истощения глицерина в системе, вводили еще 50% глицерина при скорости подачи 131 г/ч до тех пор, пока сырая клеточная масса не достигала плотности, предпочтительно, 200 г/л – 300 г/л. После достижения плотности сырой клеточной массы 200 г/л – 300 г/л сразу начинали индуцирование путем введения ударной дозы метанола 0,025 мл на грамм сырой биомассы. После истощения ударной дозы метанола и повышения уровня растворенного кислорода, индуцирование продолжали путем добавления лимитирующих количеств метанола при постоянной скорости подачи 0,0034 г метанола/г сырой клеточной массы/ч. На начальном этапе постоянной подпитки метанолом, pH сбраживающей среды изменялся от 5,7 до 5,5, а температура снижалась с 28°C до 22°C. Ферментативный бульон собирали после 70-часового индуцирования.
Для определения относительных выходов однокопийных и 3-копийных клонов, клон 201-55-001-VU, содержащий один геномный интегрант однокопийного вектора pPROT55-V, подвергали параллельной ферментации с клоном 201-55M3-003-VU, содержащим один геномный интегрант 3-копийного вектора pPROT55M3-V. Процедуры ферментации осуществляли как описано выше, за исключением того, что рН культуры в процессе индуцирования поддерживали при 5,7. Супернатанты, собранные после ферментации клонов 201-55-001-VU и 201-55M3-003-VU, анализировали с помощью электрофореза в градиенте ПААГ с ДСН с последующим окрашиванием коллоидальным синим (фигура 8), что указывало на то, что многокопийный клон 201-55M3-003-VU экспрессировал пробелок на более высоком уровне, чем однокопийный клон 201-55-001-VU. Результаты электрофореза в ДСН-ПААГ, проводимого вместе с ГХ-ВЭЖХ-анализом концентрации пробелка в супернатантах ферментативного бульона, подтвердили, что клон 201-55M3-003-VU продуцировал приблизительно 600 мг/л секретированного пробелка, а клон 201-55-001-VU продуцировал приблизительно 400 мг/л указанного пробелка. Таким образом, многокопийный клон 201-55M3-003-VU, содержащий три экспрессионных кассеты, продуцировал пробелок приблизительно на 50% больше пробелка, чем однокопийный клон 201-55-001-VU, содержащий одну экспрессионную кассету.
Две стратегии превращения тестировали с использованием супернатанта 201-55M3-003-VU, продуцированного в результате ферментации. Эти стратегии, в основном, соответствовали стратегиям, описанным для других вариантов пробелка в примере 5, за исключением того, что они были проведены в большем масштабе. В первой стратегии, пробелок захватывали из супернатанта с помощью катионообменной хроматографии с последующим его превращением в зрелый белок и очисткой с помощью полиш-хроматографии. Во второй стратегии, пробелок, перед его очисткой, превращали в зрелый белок, с последующим захватом посредством катионообменной хроматографии, а затем проводли пролонгированную стадию превращения для удаления N-концевых вариантов и полиш-хроматографию. Обе эти стратегии также включают стадию пролонгированного инкубирования в буфере при pH 8,0, проводимую после превращения для достижения селективного расщепления N-концевых вариантов.
В первой стратегии осуществляли захват пробелка с последующим его превращением и проведением глубокой очистки PRT-201, как описано ниже. Супернатант клона 201-55M3-003-VU собирали из сбраживаемой культуры и замораживали при -80°C. Приблизительно 7 л замороженного осветленного супернатанта (3,5 л из сбраживаемой культуры 201-55M3-003-VU, описанной выше, и 3,5 л из культур 201-55M3-003-VU в шейкерных колбах, полученных, в основном, как описано в примерах 4 и 5) оттаивали и 8-кратно разводили деионизованной водой и 1 M цитратом натрия, pH 4,3, при 2-8°C до получения конечной концентрации 25 мМ цитрата натрия. pH раствора доводили до 4,7. Раствор загружали на катионообменную колонку Macroprep High S с объемом слоя 2,3 л при 76 см/ч при 2-8°C. Колонку промывали 5 колоночными объемами 25 мМ цитрата натрия, pH 4,7, а затем 5 колоночными объемами 160 мМ хлорида натрия, 25 мМ цитрата натрия, pH 4,7. Пробелок элюировали 15 колоночными объемами линейного градиента 160 мМ хлорида натрия → 500 мМ хлорида натрия в 25 мМ цитрата натрия, pH 4,7, при 87 мл/мин (67 см/ч). Элюат собирали во фракции. Фракции анализировали на содержание белка с помощью электрофореза в ДСН-ПААГ (фигура 9). Небольшое количество спонтанно превращенного белка было обнаружено с помощью электрофореза в ДСН-ПААГ. Фракции, содержащие пробелок, собирали в пулы для последующей обработки. Собранный материал анализировали с помощью ГХ-ВЭЖХ-анализа, который указывал на то, что данный материал на 92% состоял из пробелка и на 8% из зрелого PRT-201.
Для инициации превращения, собранный материал подвергали буферному обмену путем фильтрации в тангенциальном потоке в 100 мМ хлорида натрия, 20 мМ Tris, pH 4,0, с использованием диафильтрации в постоянном объеме при 10-12°C. Фильтрацию в тангенциальном потоке осуществляли с использованием регенерированных целлюлозных мембран при давлении внутри мембраны 15 фунт/кв.дюйм (103,4 кПа), со скоростью перекрестного потока 20 л/мин и скоростью потока 800 мл/мин. Три объема буфера для диафильтрации при 2-8°C добавляли при такой же скорости, как скорость потока. Затем, при такой же скорости, как скорость потока добавляли три дополнительных объема буфера при комнатной температуре в целях повышения температуры раствора для превращения до 26°C. Фильтрацию в тангенциальном потоке проводили в целях концентрирования раствора для превращения до уровня 1,5 мг/мл при давлении внутри мембраны 15 фунт/кв.дюйм (103,4 кПа), скорости перекрестного потока 1,2 л/мин и скорости потока 76 мл/мин. Однако приблизительно через 2 минуты после начала процедуры концентрирования неожиданно наблюдалось осаждение, и процесс концентрирования прекращали. Концентрация белка в растворе после превращения составляла 1,1 мг/мл, как было определено по УФ-поглощению на 280 нм в объеме 570 мл. Для минимизации последующего осаждения, раствор, используемый в процедуре превращения, разводили до 1 мг/мл 100 мМ хлоридом натрия, 20 мМ Tris, pH 4,0, и фильтровали через мембрану 0,22 микрон. В раствор, используемый в процедуре превращения, добавляли 16 мл 3 M Tris, pH 9,0. Раствор, используемый в процедуре превращения, помещали на водяную баню при 26°C. Мониторинг реакции превращения, проводили с помощью ГХ-ВЭЖХ-анализа. Через 30 минут, ГХ-ВЭЖХ-анализ показал, что большая часть пробелка превращалась в PRT-201, и лишь некоторая часть – в N-концевые варианты (фигура 10). Через 1 час, реакционная смесь, подвергаемая процедуре превращения, состояла из 0% пробелка, 86% полноразмерного PRT-201 и 14% N-концевых вариантов. Материал, образовавшийся после реакции превращения, инкубировали в течение еще 4 часов, а затем проводили ГХ-ВЭЖХ-анализ, который показал, что этот материал на 98% состоял из полноразмерного PRT-201 и на 2% из N-концевых вариантов.
Материал, используемый в реакции превращения, 4-кратно разводили деионизованной водой и 1 M цитрата натрия, pH 4,3, до конечной концентрации 25 мМ цитрата натрия. pH раствора в препарате для загрузки в полиш-колонку доводили до 5,0. Этот раствор загружали на катионообменную колонку Macroprep High S с объемом слоя 600 мл при скорости потока 27 мл/мин (83 см/ч). Эту колонку промывали 5 колоночными объемами 20 мМ цитрата натрия, pH 5,0, а затем 5 колоночными объемами 160 мМ хлорида натрия, 20 мМ цитрата натрия, pH 5,0. PRT-201 элюировали 15 колоночными объемами в линейном градиенте 160 мМ → 500 мМ хлорида натрия в 25 мМ цитрата натрия, pH 5,0, при скорости 87 мл/мин (67 см/ч). Элюат собирали во фракции. Эти фракции анализировали на содержание белка с помощью электрофореза в ДСН-ПААГ и на специфическую активность с помощью SLAP-анализа. Фракции, содержащие PRT-201 и имеющие специфическую активность ≥30 ед./мг, собирали. Собранные фракции PRT-201 подвергали диафильтрации в тангенциальном потоке в буфере для получения препаратов (0,1 х PBS, pH 5,0). pH подвергнутого диафильтрации PRT-201 доводили до pH 7,4, и концентрацию белка доводили до 1 мг/мл путем фильтрации в тангенциальном потоке. Сосуды заполняли и лиофилизовали, как описано для PRT-201, полученного из клона 201-24-266-VU в примере 4.
Во второй стратегии, превращение пробелка с последующей очисткой PRT-201 осуществляли следующим образом. Приблизительно 7 л замороженного осветленного супернатанта, полученного в результате ферментации 201-55M3-003-VU как описано выше, оттаивали, и начинали реакцию превращения путем фильтрации в тангенциальном потоке с использованием буфера для превращения, содержащего 100 мМ Tris, pH 8,0, с применением диафильтрации с регенерированными целлюлозными мембранами при постоянном объеме и при температуре окружающей среды. Двух объемов диафильтрации 100 мМ Tris-HCl, pH 8,0 оказалось достаточно для изменения pH ретентата от pH 5,0 до 8,0 и осуществления превращения. Также осуществляли эксперимент путем прямого доведения pH осветленного супернатанта до 8,0 путем добавления основания Tris до конечной концентрации 100 мМ и доведения pH до 8,0 добавлением 1 н гидроксида натрия. Это приводило к образованию осадка и мутного супернатанта, возможно, из-за нежелательного осаждения компонентов бульона. В предпочтительном способе, превращение с применением фильтрации в тангенциальном потоке не приводило к осаждению.
Мониторинг реакции превращения проводили с помощью ГХ-ВЭЖХ-анализа в реальном времени. После инициации превращения, про-PRT-201 медленно, в течение первых двух часов, превращался в зрелый PRT-201, а затем скорость превращения увеличивалась (фигура 11). Через 4,5 часов, реакционная смесь, образовавшаяся после реакции превращения, состояла приблизительно на 4% из про-PRT-201, на 75% из зрелого PRT-201 и на 21% из N-концевых вариантов. Через 6,5 часов, реакционная смесь, образовавшаяся в результате реакции превращения, состояла приблизительно на 1% из про-PRT-201, на 83% из зрелого PRT-201 и на 16% из N-концевых вариантов. Снижение уровня N-концевых вариантов с 21% до 16% за период времени от 4,5 часов до 6,5 часов может быть обусловлено разложением N-концевых вариантов по всей длине активного PRT-201, но оно не было таким явным и таким быстрым, как снижение уровня N-концевых вариантов, наблюдаемое в процессе превращения очищенного про-PRT 201. В этой второй стратегии, удлинение реакции превращения не может приводить к полному удалению N-концевых вариантов, что обусловлено присутствием конкурентных белков в супернатанте, которые конкурируют за связывание с активным центром эластазы. Для повышения качества реакции превращения, материал, образовавшийся после реакции превращения, захватывали, а затем подвергали диафильтрации в соответствующем буфере в целях инициации пролонгированного превращения при pH 8,0 для селективного разложения N-концевых вариантов, описанных ниже.
Захват PRT-201 из материала для превращения осуществляли следующим образом. Буфер для материала, используемого в реакции превращения, заменяли на 20 мМ цитрата натрия, pH 5,0, и загружали на катионообменную хроматографическую колонку Macro-Prep High S. Колонку промывали 5 колоночными объемами 20 мМ цитрата натрия, pH 5,0, а затем 5 колоночными объемами 20 мМ цитрата натрия, 160 мМ хлорида натрия, pH 5,0. PRT-201 элюировали линейным градиентом 160 мМ → 500 мМ хлорида натрия в 20 мМ цитрата натрия, pH 5,0. Фракции анализировали на содержание белка с помощью электрофореза в ДСН-ПААГ, на N-концевые варианты с помощью ГХ-ВЭЖХ, на концентрацию белка по УФ-поглощению на 280 нм и на эластазную активность с помощью SLAP-анализа. С помощью электрофореза в ДСН-ПААГ были детектированы две преобладающих полосы белка, соответствующих гликоформам PRT-201 и PRT-201, как показано на фигуре 12. Фракции, содержащие гликоформы PRT-201, как было определено с помощью электрофореза в ДСН-ПААГ, или N-концевые варианты, как было определено с помощью ГХ-ВЭЖХ, исключали из сбора. Фракции, имеющие относительно низкую специфическую активность (менее чем 30 ед./мг), как было определено в SLAP-анализе, также исключали из сбора. Остальные фракции, содержащие PRT-201, собирали для последующей обработки. ГХ-ВЭЖХ-анализ собранных фракций показал, что этот материал состоял приблизительно на 98% из полноразмерного PRT-201 и на 1-2% из N-концевых вариантов. Собранный материал хранили при 2-8°C в течение 12-16 часов.
Поскольку проводимые ранее наблюдения показали, что уровень N-концевых вариантов снижался за весь период пролонгированного превращения, описанного выше, то собранный материал PRT-201 подвергали стадии пролонгированного инкубирования при pH 8,0. Прологнированное инкубирование осуществляли путем диафильтрации и фильтрации в тангенциальном потоке с 100 мМ Tris, 300 мМ хлорида натрия, pH 8,0 в течение 2,5 часов при температуре окружающей среды. Через 2,5 часа, материал, образующийся в реакции превращения, состоял на 100% из зрелого PRT-201, на что указывал ГХ-ВЭЖХ-анализ. Материал, образующийся в реакции превращения, подвергали диафильтрации и фильтрации в тангенциальном потоке в 20 мМ цитрата натрия, pH 5,0, для подавления эластазной активности и приготовления препарата для колоночной хроматографии. Подвергнутый диафильтрации материал PRT-201 хранили приблизительно в течение 64 часов при 2-8°C.
Очистку PRT-201 с помощью полиш-хроматографии осуществляли следующим образом. Подвергнутый диафильтрации материал PRT-201 загружали на катионообменную колонку Macro-Prep High S и промывали 5 колоночными объемами буфера С (20 мМ цитрат натрия, pH 5,0), а затем 5 колоночными объемами 160 мМ хлорида натрия, 20 мМ цитрата натрия, pH 5,0. Элюирование PRT-201 осуществляли 15 колоночными объемами линейного градиента 68% буфера C и 32% буфера D (160 мМ хлорида натрия, 25 мМ цитрата натрия, pH 5,0) → 0% буфера C и 100% буфера D (500 мМ хлорида натрия, 25 мМ цитрата натрия, pH 5,0), при 50 мл/мин (153 см/ч). Элюат собирали во фракции. PRT-201 элюировался как симметричный пик при 37 мСи/см (330 мМ хлорида натрия). Фракции анализировали на содержание белка с помощью анализа методом электрофореза в ДСН-ПААГ, на концентрацию белка по УФ-поглощению на 280 нм и на специфическую активность с помощью SLAP-анализа. Фракции, содержащие PRT-201 с специфической активностью 30,1-38,8 ед./мг, собирали. Собранные фракции PRT-201 подвергали диафильтрации путем фильтрации в тангенциальном потоке в буфере для получения препарата (0,1 х PBS, pH 5,0). pH подвергнутого диафильтрации PRT-201 доводили до pH 7,4, а концентрацию белка доводили до 1 мг/мл путем фильтрации в тангенциальном потоке. Сосуды наполняли и лиофилизовали, как описано для PRT-201, продуцированного клоном 201-24-266-VU в примере 4.
Условия проведения процедур превращения, описанных выше, выбирали исходя из результатов исследований по оптимизации превращения, в которых оценивали концентрацию белка, температуру, состав буфера, объем диафильтрации и значение рН. В первом исследовании оценивали влияние концентрации пробелка на продуцирование N-концевых вариантов в процессе превращения. Очищенный про-PRT-201, продуцированный клоном 201-55M3-003-VU (про-PRT-201-55M3-003-VU) в исходной концентрации 0,2 мг/мл в 20 мМ фосфата натрия, pH 5,0, разделяли на аликвоты и концентрировали до 1,0, 1,6 и 1,8 мг/мл на центрифужных устройствах для концентрирования, как было определено по УФ-поглощению на 280 нм. Превращение пробелка осуществляли путем добавления Tris и хлорида натрия к 100 мМ каждого из образцов в четырех концентрациях, доведения pH от 5,0 до 8,0, и инкубирования этих образцов при температуре окружающей среды. Мониторинг реакции превращения осуществляли с помощью ГХ-ВЭЖХ в реальном времени до тех пор, пока содержание пробелка не составляло ≤ 1% от содержания всего белка (фигура 13). На этой стадии, образец в концентрации 0,2 мг/мл состоял приблизительно на 8% из N-концевых вариантов, тогда как образцы в концентрациях 1,0 мг/мл, 1,6 и 2,0 мг/мл состояли приблизительно на 14%, 19% и 29% из N-концевых вариантов, соответственно. Остальной белок в каждом образце состоял из полноразмерного PRT-201. Полученные результаты показали, что увеличение концентраций про-PRT-201-55-003-VU в процессе превращения приводит к образованию большего количества N-концевых вариантов и меньшего количества полноразмерного PRT-201. Другие исследования позволяют предположить, что превращение про-PRT-201-55M3-003-VU происходит в результате внутримолекулярных и межмолекулярных реакций. Таким образом, что касается данного варианта пробелка, то вероятно, что внутримолекулярные реакции, благоприятствующие образованию более разбавленных растворов пробелка, дают более точное превращение, тогда как межмолекулярные реакции, благоприятствующие образованию более концентрированных растворов пробелка, дают менее точное превращение, то есть приводят к образованию большего процента N-концевых вариантов по отношению к полноразмерному белку PRT-201.
Во втором исследовании проводили анализ влияния температуры на продуцирование N-концевых вариантов в процессе превращения. Очищенный про-PRT-201, продуцированный клоном 201-55M3-VU (обозначенный про-PRT-201-55M3-003-VU) и полученный в концентрации 1,6 мг/мл, подвергали превращению как описано выше при 15°C или 26°C. Мониторинг реакции превращения осуществляли с помощью ГХ-ВЭЖХ в реальном времени и проводили до тех пор, пока содержание пробелка не составляло <1% от всего белка. Время, необходимое для такого снижения уровня пробелка, составляло приблизительно 30 минут при 26°C и приблизительно 90 минут при 15°C. В это время наблюдалось аналогичное процентное содержание N-концевых вариантов (примерно 20% от всего белка) при обеих температурах. Так, например, при более высокой температуре, то есть, 26°C, наблюдалась более быстрая реакция превращения по сравнению с реакцией превращения при более низкой температуре, то есть 15°C, но при этом, профили продуцирования продуктов реакции были, по существу, идентичными.
В третьем исследовании оценивали влияние состава буфера на растворимость пробелка в процессе реакции превращения. Очищенный про-PRT-201 (про-PRT-201-55M3-003-VU) в концентрации 1,0 мг/мл подвергали реакции превращения в условиях, перечисленных в таблице 6. Реакции превращения осуществляли при температуре окружающей среды, за исключением одной реакции (с буфером, содержащим 20 мМ Tris-HCl, 100 мМ хлорида натрия, pH 4,0), которую проводили при 2-8°C. Реакции превращения визуально оценивали на осаждение. Как указывается в таблице 6, буферные композиции, использование которых не приводило к осаждению, включали 100 мМ Tris-HCl, pH 8,0; 100 мМ Tris-HCl, 100 мМ хлорида натрия, pH 5,0; и 100 мМ Tris-HCl, 300 мМ хлорида натрия, pH 8,0. При использовании буферных композиций с более низкими концентрациями Tris или без хлорида натрия при более низком pH (то есть pH 5,0), наблюдалось осаждение.
В четвертом исследовании анализировали влияние числа объемов диафильтрации при фильтрации в тангенциальном потоке на осаждение в процессе превращения супернатанта, содержащего пробелок (про-PRT-201-55M3-003-VU). Раствор, используемый для замены буфера, содержит 100 мМ Tris-HCl, 100 мМ хлорида натрия, pH 8,0. Кроме того, было протестировано прямое доведение pH супернатанта от pH 5,0 до 8,0 без фильтрации в тангенциальном потоке. Как указано в таблице 7, прямая коррекция pH супернатанта давала высокий уровень осаждения. При использовании 1 объема диафильтрации для замены буфера наблюдалась некоторая степень осаждения. Но при использовании 2-5 объемов диафильтрации, такого осаждения не наблюдалось.
В пятом исследовании анализировали влияние рН на эластазную активность зрелого PRT-201. Это исследование проводили в целях определения интервала значений рН, используемых для превращения, которые не давали бы необратимой потери эластазной активности зрелого PRT-201 как продукта превращения. Растворы 1 мг/мл PRT-201 в 20 мМ Tris-HCl, 20 мМ фосфата калия получали с рН от 1 до 14. Эти растворы хранили при комнатной температуре в течение 0,5, 2, 24 и 48 часов. Через указанные промежутки времени, растворы тестировали на эластазную активность с помощью SLAP-анализа. Эластазная активность оставалась, в большинстве случаев, стабильной при pH 3-8 во все периоды времени. При рН менее 3 и более 8, эластазная активность во все периоды времени снижалась, и при увеличении периода времени, наблюдаемая активность эластазы снижалась. Полученные результаты показали, что реакция превращения, осуществляемая при значениях рН, выходящих за пределы интервала 3-8, оказывала негативное влияние на эластазную активность продукта превращения, а именно PRT-201.
6.8. Пример 7: Продуцирование аутоактивированной рекомбинантной панкреатической эластазы типа I свиней
Вектор, кодирующий аутоактивированный профермент ELA-1 свиней, экспрессировали в P. pastoris. Полученный аутоактивированный ELA-1 свиней сравнивали с белком ELA-1 свиней, экспрессируемым в виде активированного трипсином пробелка дикого типа.
Для конструирования активированного трипсином вектора ELA-1 свиней получали область, кодирующую ELA-1 свиней, которая была синтезирована фирмой Blue Heron Biotechnology (Bothell, WA) методом «длинных олигонуклеотидов», проводимым без применения ПЦР и по лицензии, выданной Amgen (Thousand Oaks, CA). Рекомбинантный ген клонировали в вектор Blue Heron pUC, то есть производное вектора pUC119. Ген ELA-1 свиней секвенировали по обеим цепям для подтверждения правильности последовательности. Рестрикционные SacII- и Xbal-сайты вводили в качестве потенциальных сайтов клонирования, фланкирующих ген ELA-1 свиней, как показано на фигуре 14. Для минимизации потенциального «сквозного прочитывания» сайтов связывания с рибосомой был также добавлен второй стоп-кодон, следующий непосредственно за нативным стоп-кодоном. На фигуре 15 проиллюстрирована природная идентичная аминокислотная последовательность профермента ELA-1 свиней, которая содержит активированный трипсином сайт.
Область, кодирующую ELA-1 свиней, амплифицировали с помощью ПЦР с использованием пары олигонуклеотидов, содержащих рестрикционные XhoI- и SacII-сайты, для облегчения клонирования. ПЦР-продукт гидролизовали ферментами Xhol и SacII и очищали с помощью электрофореза в агарозном геле. Фрагмент ELA-1 свиней клонировали в вектор PV-1 в рестрикционные сайты XhoI и SacII. Штамм TOP10 E. coli трансформировали смесью для лигирования. Клеточную смесь высевали на планшеты со средой LB с низкой концентрацией соли, в которую было добавлено 25 мг/мл зеоцина. Затем резистентные к лекарственному средству клоны собирали и получали плазмидную ДНК (Qiagen, CA). Исходя из рестрикционного анализа, клон, содержащий вставку гена ELA-1 свиней, идентифицировали, и вектор обозначали pPROT101-24-V. Кодирующую последовательность этого вектора подтверждали путем секвенирования ДНК. Схема клонирования для pPROT101-24-V представлена на фигуре 16.
С использованием активированного трипсином вектора pPROT101-24-V были сконструированы три различных аутоактивированных клона путем замены сайта расщепления трипсином в пропептидной области ELA-1 свиней сайтами расщепления эластазы. Сайт-направленный мутагенез осуществляли, в основном, как описано в примере 4 с использованием синтетических олигонуклеотидных праймеров, содержащих нужные мутации, как описано в таблице 8. Все мутации пропептидной области подтверждали путем секвенирования двухцепочечной ДНК.

Штамм NRRL Y-11430 P. pastoris дикого типа трансформировали, и резистентные к лекарственному средству трансформанты культивировали и скринировали на экспрессию пробелков ELA-1 свиней, как описано в примере 3. Как показал анализ, проведенный с помощью электрофореза в ДСН-ПААГ и окрашивания кумасси (см. фигуру 17 и фигуру 18), активированные трипсином клоны pPROT101-24-V дикого типа имели наиболее высокие уровни экспрессии по сравнению с аутоактивированными клонами. Из всех аутоактивированных клонов, клоны pPROT101-49-V имели наибольший уровень экспрессии, а за ними следовали клон pPROT101-55L-V и клон pPROT101-49-V. Аутоактивированные пробелки pPROT101-42-V и pPROT101-55L-V обнаруживали значительный уровень спонтанного превращения в процессе индуцирования, а активированный трипсином пробелок pPROT101-24-V и аутоактивированный пробелок pPROT101-49-V обладали более высокой стабильностью в среде для индуцирования.
Исследования эластазной активности PRT-102, продуцированного путем активации трипсином белка проэластазы, экспрессированного из pPROT101-24-V, показали, что специфическая активность PRT-102 превышает специфическую активность PRT-201, как показано ниже в таблице 9.
Для того, чтобы определить, могут ли пробелки pPROT101-55L-V и pPROT101-49-V превращаться в зрелые ферменты, обладающие эластазной активностью, был проведен эксперимент по лабораторному превращению. Супернатанты pPROT101-55L-V и pPROT101-49-V в шейкерных колбах подвергали 10-кратному концентрированию на центрифужном фильтрующем устройстве и 5-кратно разводили 100 мМ Tris-HCl, pH 9,0. Реакцию превращения проводили при комнатной температуре, а затем осуществляли мониторинг эластазной активности в течение определенного периода времени с помощью SLAP-анализа. В каждый период времени вычисляли среднее изменение оптической плотности в минуту, и данные выражали как не-нормализованную скорость реакции (фигура 19). Превращение обоих супернатантов pPROT101-49-V и pPROT101-55L-V приводило к повышению уровня эластазной активности. Каждый образец клона, взятый в последний момент времени, анализировали с помощью электрофореза в ДСН-ПААГ с последующим окрашиванием кумасси и сравнивали с образцами до превращения (фигура 20). Результаты электрофореза в ДСН-ПААГ подтвердили, что почти весь пробелок pPROT101-49-V превращался в зрелый белок по окончании анализа на превращение. Результаты электрофореза в ДСН-ПААГ также показали, что почти весь белок pPROT101-55L-V спонтанно превращался в зрелый белок еще до проведения анализа на превращение.
Очищенные препараты пробелков pPROT101-24-V и pPROT101-49-V и зрелых ферментов были отданы в Дэнфортский Научно-исследовательский центр по изучению растений (Danforth Plant Science Center, MO) для анализа молекулярной массы интактных молекул. Пробелки были очищены с помощью катионообменной хроматографии (Macroprep High S, Bio-Rad). Для анализа зрелого фермента, пробелки от обоих клонов сначала обрабатывали в целях продуцирования зрелых ферментов, а затем очищали с помощью катионообменной хроматографии. Затем активированный трипсином пробелок обрабатывали трипсином, а аутоактивированный пробелок подвергали реакции превращения в присутствии 100 мМ Tris-HCl, pH 9,0, после чего проводили очистку катионообменной хроматографией. Главные пики, полученные с помощью масс-спектрометрического анализа, указаны в таблице 10.
Результаты, полученные с помощью электрофореза в ДСН-ПААГ, результаты анализа на эластазную активность и результаты масс-спектрометрического анализа показали, что аутоактивированные формы панкреатической эластазы типа I свиней могут быть получены путем конструирования пропептидной последовательности с заменой сайта расщепления трипсином сайтом расщепления эластазы. Уровни экспрессии этих аутоактивированных форм панкреатической эластазы типа I свиней были ниже, чем уровни экспрессии активированной трипсином формы дикого типа. Из всех протестированных аутоактивированных клонов, клоны с пропептидной последовательностью pPROT101-49-V обнаруживали самый высокий уровень экспрессии и наименьший уровень спонтанного превращения. Превращение клонов pPROT101-49-V и pPROT101-55L-V приводило к продуцированию зрелых белков со значительной эластазной активностью. Масс-спектрометрический анализ показал, что молекулярные массы пробелка pPROT101-49-V и зрелого белка типа I свиней соответствуют предполагаемым массам.
6.9. Пример 8: Тест на трипсиновую активность зрелой рекомбинантной эластазы-1 человека, проводимый с помощью колориметрического анализа с использованием пептидного субстрата BENZ
Колориметрический анализ на гидролиз, проводимый с использованием небольшого пептидного субстрата N-бензоил-Phe-Val-Arg-п-нитроанилида (BENZ), осуществляли для того, чтобы определить, обладает ли очищенный зрелый белок эластазы, продуцируемый аутоактивированным клоном 201-55M3-003-VU, трипсиновой активностью. Три сосуда с лиофилизованным PRT-201, выделенным из клона 201-55M3-003-VU, брали после хранения при -80°C и разводили водой с получением 1 мг/мл PRT-201 в 0,1 х PBS, pH 7,4. Концентрации белка подтверждали по УФ-поглощению на 280 нм. Маточный раствор TrypZean (10 мг/мл) использовали в целях построения стандартной кривой для трипсиновой активности. Предварительно протестированный образец активированного трипсином PRT-201 был включен в качестве позитивного контроля. Кроме того, в некоторые экспериментальные и контрольные образцы включали TrypZean для определения восстановления трипсиновой активности в присутствии PRT-201. Подгруппу образцов, содержащих и не содержащих TrypZean, обрабатывали соевым ингибитором трипсина (SBTI) для определения способности SBTI ингибировать какую-либо эндогенную или экзогенную трипсиновую активность. Для подтверждения эффективности ингибитора, стандарты TrypZean также обрабатывали SBTI. Систематизированные данные для образцов, включенных в это исследование, приводятся ниже в таблице 11.
Был получен раствор субстрата (0,4 мг/мл N-бензоил-Phe-Val-Arg-п-нитроанилида, лот 7733 в 0,1 M Tris, pH 8,3), который предварительно нагревали до 30°C на водяной бане. 100 микролитров каждого образца, с тремя повторностями, пипетировали в 96-луночный микропланшет, 200 микролитров раствора субстрата пипетировали в каждую лунку с использованием многоканальной пипетки, и этот микропланшет сразу помещали на микропланшет-ридер, предварительно нагретый до 30°C. На указанном микропланшет-ридере регистрировали данные оптической плотности на 405 нм для каждой лунки в минуту в течение 60 минут.
Образцы PRT-201 также тестировали на эластазную активность в SLAP-анализе. Был получен раствор субстрата SLAP (4,5 мг/мл SLAP в 0,1 M Tris, pH 8,3), который предварительно нагревали до 30°C на водяной бане. 1 мг/мл образцов PRT-201 разводили 20 х водой до 0,05 мг/мл. 10 микролитров разведения каждого образца, с тремя повторностями, пипетировали в 96-луночный микропланшет. 300 микролитров раствора субстрата SLAP пипетировали в каждую лунку с использованием многоканальной пипетки, и этот микропланшет сразу помещали на микропланшет-ридер, предварительно нагретый до 30°C. На указанном микропланшет-ридере регистрировали данные оптической плотности на 405 нм для каждой лунки в минуту в течение 5 минут.
Результаты BENZ- и SLAP-анализов на активность, соответственно, представлены ниже в таблицах 11 и 12.
Уровень трипсиновой активности PRT-201, выделенного из клона 201-55M3-003-VU, был ниже уровня значений в интервалах, представленных на стандартной кривой в анализе на трипсиновую активность (<1,56 нг/мл). Кроме того, коэффициенты регрессии для реакций гидролиза, проводимых с тремя повторностями, были достаточно низкими (<0,8), что также подтверждает отсутствие трипсиновой активности в указанном аутоактивированном зрелом белке эластазы. В противоположность этому, уровень трипсиновой активности контрольного образца, активированного трипсином, как было определено, составлял 8,7 нг/мл.
7. Список последовательностей
8. Конкретные варианты осуществления изобретения, список противопоставленных материалов
Настоящее изобретение проиллюстрировано на нижеследующих конкретных вариантах его осуществления.
1. Белок, содержащий (i) последовательность активации эластазы, содержащую последовательность распознавания эластазы, функционально связанную с (ii) аминокислотной последовательностью зрелой эластазы.
2. Белок согласно варианту осуществления 1, где последовательность распознавания эластазы содержит SEQ ID NO:11.
3. Белок согласно варианту осуществления 1, где последовательность распознавания эластазы содержит SEQ ID NO:12.
4. Белок согласно варианту осуществления 1, где последовательность распознавания эластазы содержит SEQ ID NO:13.
5. Белок согласно варианту осуществления 1, где последовательность распознавания эластазы содержит SEQ ID NO:93.
6. Белок согласно варианту осуществления 1, варианту осуществления 2 или варианту осуществления 4, где последовательность распознавания эластазы содержит любую из последовательностей SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:18, SEQ ID NO:20 или SEQ ID NO:21.
7. Белок согласно варианту осуществления 1, где последовательность активации содержит SEQ ID NO:80.
8. Белок согласно варианту осуществления 1 или варианту осуществления 7, где последовательность активации содержит SEQ ID NO:23, SEQ ID NO:72 или SEQ ID NO:73.
9. Белок согласно варианту осуществления 1, где белок содержит домен расщепления, содержащий SEQ ID NO:74.
10. Белок согласно варианту осуществления 1 или варианту осуществления 9, где домен расщепления содержит любую из последовательностей SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:54 и SEQ ID NO:55.
11. Белок согласно любому из вариантов осуществления 1-5 и 7, который содержит SEQ ID NO:64.
12. Белок согласно любому из вариантов осуществления 1-5 и 7, который содержит SEQ ID NO:69.
13. Белок проэластазы типа I, содержащий последовательность домена расщепления SEQ ID NO:74.
14. Белок проэластазы типа I согласно варианту осуществления 13, где домен расщепления содержит любую из последовательностей SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:54 или SEQ ID NO:55.
15. Белок проэластазы типа I согласно варианту осуществления 13 или варианту осуществления 14, где последовательность зрелой эластазы содержит последовательность, которая по меньшей мере на 85% идентична аминокислотной последовательности, начинающейся с положения 6 (например, у C-конца по отношению к остатку P5′ в соответствии с представленной здесь нумерацией аминокислот эластазы) и до конца SEQ ID NO:84 или SEQ ID NO:1.
16. Белок проэластазы типа I согласно варианту осуществления 13 или варианту осуществления 14, который содержит последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности, начинающейся с положения 6 (например, у C-конца по отношению к остатку P5′ в соответствии с представленной здесь нумерацией аминокислот эластазы) и до конца SEQ ID NO:84 или SEQ ID NO:1.
17. Белок проэластазы типа I согласно варианту 13 или варианту осуществления 14, который содержит последовательность, которая по меньшей мере на 98% идентична аминокислотной последовательности, начинающейся с положения 6 и до конца SEQ ID NO:84 или SEQ ID NO:1.
18. Белок проэластазы типа I согласно варианту осуществления 13 или варианту осуществления 14, где зрелая эластаза содержит последовательность, имеющую до 10 консервативных аминокислотных замен по сравнению с аминокислотной последовательностью, начинающейся с положения 6 и до конца SEQ ID NO:84 или SEQ ID NO:1.
19. Белок проэластазы типа I согласно варианту осуществления 13 или варианту осуществления 14, который содержит последовательность, имеющую до 7 консервативных аминокислотных замен по сравнению с аминокислотной последовательностью, начинающейся с положения 6 и до конца SEQ ID NO:84 или SEQ ID NO:1.
20. Белок проэластазы типа I согласно варианту осуществления 13 или варианту осуществления 14, который содержит последовательность, имеющую до 5 консервативных аминокислотных замен по сравнению с аминокислотной последовательностью, начинающейся с положения 6 и до конца SEQ ID NO:84 или SEQ ID NO:1.
21. Белок проэластазы типа I согласно любому из вариантов осуществления 13-20, где аминокислотным остатком, обозначенным «Xaa1» в SEQ ID NO:74, является глутамат или гистидин.
22. Белок проэластазы типа I согласно любому из вариантов осуществления 13-21, где аминокислотным остатком, обозначенным “Xaa4” в SEQ ID NO:74, является пролин.
23. Белок проэластазы типа I согласно любому из вариантов осуществления 13-22, где аминокислотным остатком, обозначенным “Xaa5” в SEQ ID NO:74, является аланин.
24. Белок проэластазы типа I согласно любому из вариантов осуществления 13-23, где аминокислотным остатком, обозначенным “Xaa1” в SEQ ID NO:74, является гистидин, остатком, обозначенным “Xaa4” в SEQ ID NO:74, является пролин, а остатком, обозначенным “Xaa5” в SEQ ID NO:74, является аланин.
25. Белок проэластазы типа I согласно любому из вариантов осуществления 13-24, который содержит аминокислотную последовательность SEQ ID NO:103.
26. Белок проэластазы типа I согласно варианту осуществления 25, который содержит аминокислотную последовательность SEQ ID NO:64.
27. Белок проэластазы типа I согласно варианту осуществления 25, который содержит аминокислотную последовательность SEQ ID NO:69.
28. Белок согласно любому из вариантов осуществления 1-27, который является выделенным.
29. Белок согласно любому из вариантов осуществления 1-27, который содержит сигнальную последовательность.
30. Белок, содержащий (i) сигнальную последовательность; (ii) последовательность активации эластазы, содержащую последовательность распознавания эластазы; и (iii) аминокислотную последовательность зрелой эластазы.
31. Белок согласно варианту осуществления 30, где сигнальная последовательность является функциональной в Pichia pastoris.
32. Белок согласно варианту осуществления 30, где сигнальной последовательностью является сигнальный пептид α-фактора дрожжей.
33. Белок согласно варианту осуществления 32, где сигнальный пептид α-фактора дрожжей содержит аминокислотную последовательность SEQ ID NO:34.
34. Белок согласно варианту осуществления 30, где сигнальной последовательностью является секреторная сигнальная последовательность млекопитающего.
35. Белок согласно варианту осуществления 34, где секреторной сигнальной последовательностью млекопитающего является сигнальная последовательность эластазы типа I свиней.
36. Белок согласно варианту осуществления 34, где указанной секреторной сигнальной последовательностью млекопитающего является сигнальная последовательность эластазы типа I человека.
37. Белок согласно варианту осуществления 1 или варианту осуществления 30, где последовательностью распознавания эластазы является последовательность распознавания эластазы типа I человека.
38. Белок согласно варианту осуществления 1 или варианту осуществления 30, где зрелой эластазой является эластаза типа I человека.
39. Белок согласно варианту осуществления 1 или варианту осуществления 30, где зрелой эластазой является эластаза типа I свиней.
40. Нуклеиновая кислота, кодирующая белок согласно любому из вариантов осуществления 1-39.
41. Молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, кодирующую белок, где указанный белок содержит (i) последовательность активации, содержащую последовательность распознавания эластазы, функционально связанную с (ii) аминокислотной последовательностью эластазы.
42. Молекула нуклеиновой кислоты согласно варианту осуществления 41, где белок также содержит сигнальную последовательность, функционально связанную с указанной последовательностью активации.
43. Молекула нуклеиновой кислоты согласно варианту осуществления 41 или варианту осуществления 42, где сигнальная последовательность функционирует в Pichia pastoris.
44. Нуклеиновая кислота согласно любому из вариантов осуществления 41-43, где последовательностью распознавания эластазы является последовательность распознавания эластазы типа I.
45. Нуклеиновая кислота согласно любому из вариантов осуществления 41-44, где последовательностью распознавания эластазы является последовательность распознавания эластазы типа I человека.
46. Молекула нуклеиновой кислоты согласно любому из вариантов осуществления 41-45, где последовательность распознавания эластазы содержит SEQ ID NO:11.
47. Молекула нуклеиновой кислоты согласно любому из вариантов осуществления 41-45, где последовательность распознавания эластазы содержит SEQ ID NO:12.
48. Молекула нуклеиновой кислоты согласно любому из вариантов осуществления 41-45, где последовательность распознавания эластазы содержит SEQ ID NO:13.
49. Молекула нуклеиновой кислоты согласно любому из вариантов осуществления 41-45, где последовательность распознавания эластазы содержит SEQ ID NO:93.
50. Нуклеиновая кислота согласно любому из вариантов осуществления 41-46 и 48, где последовательность распознавания эластазы содержит любую из последовательностей SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:18, SEQ ID NO:20 или SEQ ID NO:21.
51. Молекула нуклеиновой кислоты согласно любому из вариантов осуществления 41-50, где последовательность активации содержит SEQ ID NO:80.
52. Молекула нуклеиновой кислоты согласно любому из вариантов осуществления 41-45 и 51, где последовательность активации содержит SEQ ID NO:23, SEQ ID NO:72, или SEQ ID NO:73.
53. Молекула нуклеиновой кислоты согласно любому из вариантов осуществления 41-46, где белок содержит домен расщепления, содержащий SEQ ID NO:74.
54. Молекула нуклеиновой кислоты согласно любому из вариантов осуществления 41-46 и 53, где домен расщепления содержит любую из последовательностей SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:54 и SEQ ID NO:55.
55. Нуклеиновая кислота согласно любому из вариантов осуществления 41-54, где эластазой является зрелая эластаза типа I человека.
56. Нуклеиновая кислота согласно любому из вариантов осуществления 41-54, где эластазой является зрелая эластаза типа I свиней.
57. Нуклеиновая кислота согласно любому из вариантов осуществления 41-54, где эластаза содержит любую из аминокислотных последовательностей SEQ ID NO:5, SEQ ID NO:84, SEQ ID NO:87 и SEQ ID NO:39.
58. Нуклеиновая кислота согласно варианту осуществления 57, где эластаза содержит аминокислотную последовательность SEQ ID NO:1 или SEQ ID NO:4.
59. Молекула нуклеиновой кислоты согласно любому из вариантов осуществления 42-58, где сигнальной последовательностью является сигнальный пептид α-фактора дрожжей.
60. Молекула нуклеиновой кислоты согласно варианту осуществления 59, где белок содержит любую из аминокислотных последовательностей SEQ ID NO:34, SEQ ID NO:50, SEQ ID NO:51, SEQ ID NO:96 и SEQ ID NO:97.
61. Молекула нуклеиновой кислоты согласно любому из вариантов осуществления 42 и 44-58, где сигнальной последовательностью является секреторная сигнальная последовательность млекопитающего.
62. Молекула нуклеиновой кислоты согласно варианту осуществления 61, где секреторной сигнальной последовательностью млекопитающего является сигнальная последовательность эластазы типа I свиней.
63. Молекула нуклеиновой кислоты согласно варианту осуществления 61, где секреторной сигнальной последовательностью млекопитающего является сигнальная последовательность эластазы типа I человека.
64. Молекула нуклеиновой кислоты согласно любому из вариантов осуществления 41-63, где белок содержит любую из аминокислотных последовательностей SEQ ID NO: 88-91 и 98-103.
65. Молекула нуклеиновой кислоты согласно варианту осуществления 64, где белок содержит любую из аминокислотных последовательностей SEQ ID NO: 6-9 и 64-69.
66. Молекула нуклеиновой кислоты согласно варианту осуществления 64, где белок содержит любую из комбинаций полиморфизмов эластазы, представленных в таблице 2.
67. Молекула нуклеиновой кислоты согласно варианту осуществления 64, где белок содержит любую из комбинаций полиморфизмов эластазы, представленных в таблице 3.
68. Белок, кодируемый молекулой нуклеиновой кислоты согласно любому из вариантов осуществления 41-67.
69. Белок согласно варианту осуществления 68, который является выделенным.
70. Вектор, содержащий молекулу нуклеиновой кислоты согласно любому из вариантов осуществления 41-67.
71. Вектор согласно варианту осуществления 70, также включающий нуклеотидную последовательность, регулирующую экспрессию гена и функционально связанную с нуклеотидной последовательностью, кодирующей указанный белок.
72. Вектор согласно варианту осуществления 70 или варианту осуществления 71, в котором нуклеотидная последовательность, кодирующая указанный белок, является мультимеризованной.
73. Клетка-хозяин, содержащая вектор согласно любому из вариантов осуществления 70-72.
74. Клетка-хозяин согласно варианту осуществления 73, где по меньшей мере одна копия указанного вектора интегрирована в геном клетки-хозяина.
75. Клетка-хозяин согласно варианту осуществления 74, где одна копия указанного вектора интегрирована в геном клетки-хозяина.
76. Клетка-хозяин согласно варианту осуществления 74, где от двух до пяти копий указанного вектора интегрированы в геном клетки-хозяина.
77. Клетка-хозяин согласно варианту осуществления 74 или 76, где две копии указанного вектора интегрированы в геном клетки-хозяина.
78. Клетка-хозяин согласно варианту осуществления 74 или 76, где три копии указанного вектора интегрированы в геном клетки-хозяина.
79. Клетка-хозяин, содержащая по меньшей мере одну копию молекулы нуклеиновой кислоты согласно любому из вариантов осуществления 41-67, интегрированной в геном данной клетки.
80. Клетка-хозяин согласно варианту осуществления 79, где одна копия указанной молекулы нуклеиновой кислоты интегрирована в ее геном.
81. Клетка-хозяин согласно варианту осуществления 79, где от двух до пяти копий указанной молекулы нуклеиновой кислоты интегрированы в ее геном.
82. Клетка-хозяин согласно варианту осуществления 79, где две копии указанной молекулы нуклеиновой кислоты интегрированы в ее геном.
83. Клетка-хозяин согласно варианту осуществления 79, где три копии указанной молекулы нуклеиновой кислоты интегрированы в ее геном.
84. Клетка, генетически сконструированная в целях экспрессии молекулы нуклеиновой кислоты согласно любому из вариантов 41-67.
85. Клетка согласно варианту осуществления 84, где нуклеотидная последовательность функционально связана с промотором, индуцируемым метанолом.
86. Клетка Pichia pastoris, генетически сконструированная в целях экспрессии нуклеотидной последовательности согласно любому из вариантов осуществления 41-67.
87. Клетка Pichia pastoris согласно варианту осуществления 87, в которой нуклеотидная последовательность функционально связана с промотором, индуцируемым метанолом.
88. Супернатант клеточной культуры, содержащий белок согласно любому из вариантов осуществления 1-27 или 68.
89. Способ получения белка эластазы, включающий культивирование клетки-хозяина согласно варианту осуществления 84 в условиях, при которых продуцируется белок.
90. Способ получения белка эластазы, включающий культивирование клетки-хозяина согласно варианту осуществления 85 в условиях, при которых продуцируется белок.
91. Способ получения белка эластазы, включающий культивирование клетки-хозяина согласно варианту осуществления 86 в условиях, при которых продуцируется белок.
92. Способ получения белка эластазы, включающий культивирование клетки-хозяина согласно варианту осуществления 87 в условиях, при которых продуцируется белок.
93. Способ согласно варианту осуществления 91 или варианту осуществления 92, где указанные условия включают период роста или индуцирования при pH 2-6.
94. Способ согласно варианту осуществления 91 или варианту осуществления 92, где указанные условия включают период роста или индуцирования при температуре 22°C-28°C.
95. Способ согласно любому из вариантов осуществления 89-92, где клетку-хозяин культивируют в комплексной среде.
96. Способ согласно варианту осуществления 95, где указанной комплексной средой является забуференная метанолом комплексная среда или забуференная глицерином комплексная среда.
97. Способ согласно любому из вариантов осуществления 89-96, где клетку-хозяина культивируют в присутствии цитратного, сукцинатного или ацетатного соединения.
98. Способ согласно варианту осуществления 97, где указанным цитратным, сукцинатным или ацетатным соединением является цитрат натрия, сукцинат натрия или ацетат натрия, соответственно.
99. Способ согласно варианту осуществления 97 или варианту осуществления 98, где одно цитратное, сукцинатное или ацетатное соединение присутствует в указанной культуре в концентрации 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
100. Способ согласно варианту осуществления 97 или варианту осуществления 98, где более чем одно из цитратных, сукцинатных или ацетатных соединений присутствует в указанной культуре, и где общая концентрация цитратных, сукцинатных или ацетатных соединений в указанном растворе составляет 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
101. Способ согласно любому из вариантов осуществления 89-100, который также содержит выделение белка.
102. Способ согласно варианту осуществления 95, где белок выделяют путем выделения супернатанта.
103. Способ согласно варианту осуществления 95, где белок выделяют из супернатанта.
104. Способ согласно любому из вариантов осуществления 95-104, где выделенный белок не содержит сигнальной последовательности.
105. Способ согласно любому из вариантов осуществления 95-104, где выделенный белок не содержит сигнальной последовательности и последовательности активации.
106. Способ согласно любому из вариантов осуществления 89-92 и 93-105, который также включает увеличение pH раствора, содержащего указанный белок, до pH 6-12.
107. Способ согласно любому из вариантов осуществления 89-92 и 93-106, который также включает контактирование белка с каталитическим количеством эластазы.
108. Способ согласно любому из вариантов осуществления 89-92 и 93-106, который также включает выдерживание белка в условиях аутоактивации, контактирование белка с каталитическим количеством эластазы, или то и другое.
109. Способ согласно варианту осуществления 108, где белок выдерживают в условиях аутоактивации.
110. Способ согласно варианту осуществления 109, где белок присутствует в супернатанте, выдерживаемом в условиях аутоактивации.
111. Способ получения белка эластазы, включающий:
(a) культивирование клетки-хозяина, способной экспрессировать рекомбинантный белок проэластазы в присутствии первого цитратного, сукцинатного или ацетатного соединения;
(b) выделение рекомбинантного белка проэластазы из указанной клеточной культуры; и
(c) выдерживание, но необязательно, рекомбинантного белка проэластазы в условиях активации, способствующих продуцированию зрелого белка эластазы и, тем самым, получение белка эластазы.
112. Способ согласно варианту осуществления 111, где способ включает стадию выдерживания рекомбинантного белка проэластазы в условиях активации, способствующих продуцированию зрелого белка эластазы.
113. Способ согласно варианту осуществления 112, где рекомбинантный белок проэластазы очищают, а затем помещают в условия активации.
114. Способ согласно варианту осуществления 113, где указанный рекомбинантный белок проэластазы очищают в присутствии второго цитратного, сукцинатного или ацетатного соединения так, чтобы образовывался раствор, содержащий указанный очищенный белок проэластазы и второе цитратное, сукцинатное или ацетатное соединение.
115. Способ согласно любому из вариантов осуществления 111-114, где указанным первым цитратным, сукцинатным или ацетатным соединением являются цитрат натрия, сукцинат натрия или ацетат натрия, соответственно.
116. Способ согласно варианту осуществления 114 или варианту осуществления 115, где указанным вторым цитратным, сукцинатным или ацетатным соединением являются цитрат натрия, сукцинат натрия или ацетат натрия, соответственно.
117. Способ согласно любому из вариантов осуществления 114-116, где указанные первое и второе цитратное, сукцинатное или ацетатное соединение являются одинаковыми.
118. Способ согласно любому из вариантов осуществления 114-116, где указанные первое и второе цитратное, сукцинатное или ацетатное соединение являются различными.
119. Способ согласно любому из вариантов осуществления 114-118, где одно из цитратных, сукцинатных или ацетатных соединений присутствует в указанной культуре в концентрации 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
120. Способ согласно любому из вариантов осуществления 114-118, где более чем одно из цитратных, сукцинатных или ацетатных соединений присутствует в указанной культуре, и где общая концентрация цитратных, сукцинатных или ацетатных соединений в указанной культуре составляет 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
121. Способ согласно любому из вариантов осуществления 111-120, где одно из цитратных, сукцинатных или ацетатных соединений присутствует в указанном растворе в концентрации 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
122. Способ согласно любому из вариантов осуществления 111-120, где более чем одно из цитратных, сукцинатных или ацетатных соединений присутствует в указанном растворе, и где общая концентрация цитратных, сукцинатных или ацетатных соединений в указанном растворе составляет 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
123. Способ согласно любому из вариантов осуществления 111-122, где клетку-хозяина культивируют в комплексной среде.
124. Способ согласно варианту осуществления 123, где комплексной средой является забуференная метанолом комплексная среда или забуференная глицерином комплексная среда.
125. Способ согласно любому из вариантов осуществления 111-124, где белок проэластазы выделяют из супернатанта указанной клетки-хозяина.
126. Способ согласно любому из вариантов осуществления 111-125, где указанные условия активации включают обработку трипсином.
127. Способ согласно любому из вариантов осуществления 111-125, где указанными условиями активации являются условия аутоактивации.
128. Способ согласно любому из вариантов осуществления 111-127, который также включает стадию выделения указанного зрелого белка эластазы.
129. Способ согласно любому из вариантов осуществления 111-128, где зрелым белком эластазы является зрелый белок эластазы типа I.
130. Способ согласно варианту осуществления 129, где зрелым белком эластазы типа I является зрелый белок эластазы типа I человека.
131. Способ согласно варианту осуществления 129, где зрелым белком эластазы типа I является зрелый белок эластазы типа I свиней.
132. Способ получения зрелого белка эластазы, включающий:
(a) лиофилизацию белка проэластазы;
(b) хранение лиофилизованного белка проэластазы;
(c) разведение лиофилизованного белка проэластазы; и
(d) активацию разведенного белка проэластазы,
и тем самым, получение зрелого белка эластазы.
133. Способ согласно варианту осуществления 132, где белок проэластазы является рекомбинантным.
134. Способ согласно варианту осуществления 133, где белок проэластазы был получен или может быть получен способом, включающим: (i) культивирование клетки-хозяина, способной экспрессировать белок проэластазы в условиях, при которых экспрессируется белок проэластазы; и (ii) выделение белка проэластазы.
135. Способ согласно варианту осуществления 134, где клетку-хозяина культивируют в комплексной среде.
136. Способ согласно варианту осуществления 135, где комплексной средой является забуференная метанолом комплексная среда или забуференная глицерином комплексная среда.
137. Способ согласно любому из вариантов осуществления 132-136, где клетку-хозяин культивируют в присутствии цитратного, сукцинатного или ацетатного соединения.
138. Способ согласно варианту осуществления 137, где цитратным, сукцинатным или ацетатным соединением является цитрат натрия, сукцинат натрия или ацетат натрия, соответственно.
139. Способ согласно варианту осуществления 137 или варианту осуществления 138, где одно из цитратных, сукцинатных или ацетатных соединений присутствует в указанной культуре в концентрации 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
140. Способ согласно варианту осуществления 137 или варианту осуществления 138, где более чем одно из цитратных, сукцинатных или ацетатных соединений присутствует в указанной культуре, и где общая концентрация цитратных, сукцинатных или ацетатных соединений в указанном растворе составляет 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
141. Способ согласно любому из вариантов осуществления 132-140, где белок проэластазы выделяют из супернатанта указанной клетки-хозяина.
142. Способ согласно любому из вариантов осуществления 132-141, где белок проэластазы очищают перед его лиофилизацией.
143. Способ согласно любому из вариантов осуществления 132-142, где лиофилизованный белок проэластазы хранят в течение периода времени по меньшей мере один день, по меньшей мере одну неделю, по меньшей мере один месяц или по меньшей мере три месяца.
144. Способ согласно любому из вариантов осуществления 132-143, где белок проэластазы хранят при температуре от -80°C до +4°C.
145. Способ согласно любому из вариантов осуществления 132-144, где указанная стадия активации включает активацию трипсином.
146. Способ согласно любому из вариантов осуществления 132-144, где указанная стадия активации включает аутоактивацию.
147. Способ согласно любому из вариантов осуществления 132-146, который также включает стадию выделения указанного зрелого белка эластазы.
148. Способ согласно любому из вариантов осуществления 132-147, где зрелым белком эластазы является зрелый белок эластазы типа I.
149. Способ согласно варианту осуществления 148, где зрелым белком эластазы типа I является зрелый белок эластазы типа I человека.
150. Способ согласно варианту осуществления 148, где зрелым белком эластазы типа I является зрелый белок эластазы типа I свиней.
151. Способ получения зрелого белка эластазы типа I, включающий создание условий, благоприятствующих аутоактивации рекомбинантного аутоактивированного белка проэластазы типа I; контактирование указанного рекомбинантного аутоактивированного белка проэластазы типа I с каталитическим количеством эластазы; или осуществление той и другой стадии с продуцированием зрелого белка эластазы типа I.
152. Способ согласно варианту осуществления 151, где указанный рекомбинантный аутоактивированный белок проэластазы типа I был получен или может быть получен способом, включающим:
(a) культивирование клетки-хозяина согласно варианту осуществления 84 или 86 в условиях, при которых происходит экспрессия данного белка; и
(b) выделение экспрессированного белка с получением рекомбинантного аутоактивированного белка проэластазы типа I.
153. Способ согласно варианту осуществления 152, где клетку-хозяина культивируют в комплексной среде.
154. Способ согласно варианту осуществления 153, где комплексной средой является забуференная метанолом комплексная среда или забуференная глицерином комплексная среда.
155. Способ согласно любому из вариантов осуществления 152-154, где клетку-хозяин культивируют в присутствии цитратного, сукцинатного или ацетатного соединения.
156. Способ согласно варианту осуществления 155, где цитратным, сукцинатным или ацетатным соединением является цитрат натрия, сукцинат натрия или ацетат натрия соответственно.
157. Способ согласно варианту осуществления 155 или варианту осуществления 156, где одно из цитратных, сукцинатных или ацетатных соединений присутствует в указанной культуре в концентрации 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
158. Способ согласно варианту осуществления 155 или варианту осуществления 156, где более чем одно из цитратных, сукцинатных или ацетатных соединений присутствует в указанной культуре, и где общая концентрация цитратных, сукцинатных или ацетатных соединений в указанном растворе составляет 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
159. Способ согласно любому из вариантов осуществления 152-158, где выделение экспрессированного белка включает выделение супернатанта.
160. Способ согласно варианту осуществления 159, где указанную стадию аутоактивации осуществляют в супернатанте.
161. Способ согласно любому из вариантов осуществления 152-154, где экспрессированный белок выделяют из супернатанта.
162. Способ согласно варианту осуществления 161, где указанную стадию аутоактивации осуществляют в супернатанте.
163. Способ согласно варианту осуществления 161, который также включает стадию очистки экспрессированного белка.
164. Способ согласно любому из вариантов осуществления 151-163, где рекомбинантный аутоактивированный белок проэластазы типа I помещают в условия аутоактивации, и где способ включает увеличение pH раствора, содержащего выделенный белок.
165. Способ согласно варианту осуществления 164, где pH раствора повышают до щелочного значения.
166. Способ согласно варианту осуществления 165, где щелочное значение pH составляет в пределах от 7 до 9.
167. Способ согласно варианту осуществления 166, где щелочное значение pH составляет 8.
168. Способ согласно любому из вариантов осуществления 164-167, где выделенный белок присутствует в указанном растворе в концентрации 10 мг/мл или менее.
169. Способ согласно любому из вариантов осуществления 164-167, где выделенный белок присутствует в указанном растворе в концентрации 5 мг/мл или менее.
170. Способ согласно любому из вариантов осуществления 164-167, где выделенный белок присутствует в указанном растворе в концентрации 2 мг/мл или менее.
171. Способ согласно любому из вариантов осуществления 164-167, где выделенный белок присутствует в указанном растворе в концентрации 1 мг/мл или менее.
172. Способ согласно любому из вариантов осуществления 164-167, где выделенный белок присутствует в указанном растворе в концентрации 0,5 мг/мл или менее.
173. Способ согласно любому из вариантов осуществления 164-167, где выделенный белок присутствует в указанном растворе в концентрации 0,25 мг/мл или менее.
174. Способ согласно любому из вариантов осуществления 165-173, где выделенный белок присутствует в указанном растворе в концентрации по меньшей мере 0,1 мг/мл.
175. Способ согласно любому из вариантов осуществления 165-173, где выделенный белок присутствует в указанном растворе в концентрации по меньшей мере 0,2 мг/мл.
176. Способ согласно любому из вариантов осуществления 165-175, где выделенный белок выдерживают при щелочном pH в течение 0,5-8 часов.
177. Способ согласно варианту осуществления 174, где выделенный белок выдерживают при щелочном pH в течение 2-7 часов.
178. Способ согласно варианту осуществления 177, где выделенный белок выдерживают при щелочном pH в течение 6 часов.
179. Способ согласно любому из вариантов осуществления 165-178, где указанную обработку проводят при щелочном pH и при температуре 22°C-28°C.
180. Способ согласно варианту осуществления 179, где указанную обработку проводят при щелочном pH и при температуре 26°C.
181. Способ согласно вариантам осуществления 152-180, где выделенный белок, перед его аутоактивацией, помещают на хранение.
182. Способ согласно варианту осуществления 181, где выделенный белок, перед его хранением, подвергают лиофилизации.
183. Способ согласно варианту осуществления 182, где выделенный белок, перед его лиофилизацией, подвергают очистке.
184. Способ согласно любому из вариантов осуществления 181-183, где выделенный белок хранят в течение периода времени по меньшей мере один день, по меньшей мере одну неделю, по меньшей мере один месяц или по меньшей мере три месяца.
185. Способ согласно варианту осуществления 184, где выделенный белок хранят при температуре от -80°C до +4°C.
186. Способ согласно любому из вариантов осуществления 150-185, если такие варианты не зависят от вариантов осуществления 160 или 162, где рекомбинантную аутоактивированную проэластазу типа I, перед ее выдерживанием в условиях аутоактивации, подвергают очистке.
187. Способ согласно любому из вариантов осуществления 150-186, который также включает стадию выделения указанного зрелого белка эластазы типа I.
188. Способ согласно любому из вариантов осуществления 150-187, где зрелым белком эластазы типа I является зрелый белок эластазы типа I человека.
189. Способ согласно любому из вариантов осуществления 150-187, где зрелым белком эластазы типа I является зрелый белок эластазы типа I свиней.
190. Способ получения зрелого белка эластазы типа I, включающий:
(a) культивирование клетки-хозяина согласно варианту осуществления 84 или 86 в условиях, благоприятствующих экспрессии указанного белка;
(b) выделение экспрессированного белка;
(c) очистку экспрессированного белка;
(d) повышение pH раствора, содержащего белок, или контактирование выделенного белка с каталитическим количеством эластазы и продуцирование зрелого белка эластазы типа I, и тем самым получение зрелого белка эластазы типа I.
191. Способ согласно варианту осуществления 190, где клетку-хозяина культивируют в комплексной среде.
192. Способ согласно варианту осуществления 191, где комплексной средой является забуференная метанолом комплексная среда или забуференная глицерином комплексная среда.
193. Способ согласно любому из вариантов осуществления 190-192, где клетку-хозяина культивируют в присутствии цитратного, сукцинатного или ацетатного соединения.
194. Способ согласно варианту осуществления 193, где цитратным, сукцинатным или ацетатным соединением является цитрат натрия, сукцинат натрия или ацетат натрия, соответственно.
195. Способ согласно варианту осуществления 193 или варианту осуществления 194, где одно цитратное, сукцинатное или ацетатное соединение присутствует в указанной культуре в концентрации 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
196. Способ согласно варианту осуществления 193 или варианту осуществления 194, где более чем одно из цитратных, сукцинатных или ацетатных соединений присутствует в указанной культуре, и где общая концентрация цитратных, сукцинатных или ацетатных соединений в указанном растворе составляет 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
197. Способ согласно любому из вариантов осуществления 190-196, который также включает стадию (e) очистки указанной зрелой эластазы типа I.
198. Способ согласно любому из вариантов осуществления 190-197, где зрелым белком эластазы типа I является зрелый белок эластазы типа I человека.
199. Способ согласно любому из вариантов осуществления 190-197, где зрелым белком эластазы типа I является зрелый белок эластазы типа I свиней.
200. Способ получения зрелого белка эластазы типа I, включающий:
(a) культивирование клетки-хозяина согласно варианту осуществления 84 или 86 в условиях, благоприятствующих экспрессии указанного белка;
(b) выделение экспрессированного белка; и
(c) выдерживание выделенного белка при щелочном рН вплоть до продуцирования зрелого белка, с получением зрелого белка эластазы типа I.
201. Способ согласно варианту осуществления 200, где клетку-хозяина культивируют в комплексной среде.
202. Способ согласно варианту осуществления 201, где комплексной средой является забуференная метанолом комплексная среда или забуференная глицерином комплексная среда.
203. Способ согласно любому из вариантов осуществления 200-202, где клетку-хозяина культивируют в присутствии цитратного, сукцинатного или ацетатного соединения.
204. Способ согласно варианту осуществления 203, где цитратным, сукцинатным или ацетатным соединением является цитрат натрия, сукцинат натрия или ацетат натрия, соответственно.
205. Способ согласно варианту осуществления 203 или варианту осуществления 204, где одно цитратное, сукцинатное или ацетатное соединение присутствует в указанной культуре в концентрации 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
206. Способ согласно варианту осуществления 203 или варианту осуществления 204, где более чем одно из цитратных, сукцинатных или ацетатных соединений присутствует в указанной культуре, и где общая концентрация цитратных, сукцинатных или ацетатных соединений в указанном растворе составляет 5-50 мМ, 7,5-100 мМ, 10-150 мМ, 50-200 мМ, 100-150 мМ, 75-125 мМ или 90-110 мМ.
207. Способ согласно любому из вариантов осуществления 200-206, где щелочной рН имеет значение 7-9.
208. Способ согласно варианту осуществления 207, где щелочной рН имеет значение 8.
209. Способ согласно любому из вариантов осуществления 200-208, где выделенный белок, при его выдерживании в условиях щелочного рН, имеет концентрацию 10 мг/мл или менее.
210. Способ согласно любому из вариантов осуществления 200-208, где выделенный белок, при его выдерживании в условиях щелочного рН, имеет концентрацию 5 мг/мл или менее.
211. Способ согласно любому из вариантов осуществления 200-208, где выделенный белок, при его выдерживании в условиях щелочного рН, имеет концентрацию 2 мг/мл или менее.
212. Способ согласно любому из вариантов осуществления 200-208, где выделенный белок, при его выдерживании в условиях щелочного рН, имеет концентрацию 1 мг/мл или менее.
213. Способ согласно любому из вариантов осуществления 200-208, где выделенный белок, при его выдерживании в условиях щелочного рН, имеет концентрацию 0,5 мг/мл или менее.
214. Способ согласно любому из вариантов осуществления 200-208, где выделенный белок, при его выдерживании в условиях щелочного рН, имеет концентрацию 0,25 мг/мл или менее.
215. Способ согласно любому из вариантов осуществления 209-214, где выделенный белок, при его выдерживании в условиях щелочного рН, имеет концентрацию по меньшей мере 0,1 мг/мл.
216. Способ согласно любому из вариантов осуществления 209-214, где выделенный белок, при его выдерживании в условиях щелочного рН, имеет концентрацию по меньшей мере 0,2 мг/мл.
217. Способ согласно любому из вариантов осуществления 200-214, где указанный выделенный белок выдерживают при щелочном pH в течение 0,5-8 часов.
218. Способ согласно варианту осуществления 217, где указанный выделенный белок выдерживают при щелочном pH в течение 2-7 часов.
219. Способ согласно варианту осуществления 218, где указанный выделенный белок выдерживают при щелочном pH в течение 6 часов.
220. Способ согласно любому из вариантов осуществления 200-219, где указанную обработку проводят при щелочном pH и при температуре 22°C-28°C.
221. Способ согласно варианту осуществления 220, где указанную обработку проводят при щелочном pH и при температуре 26°C.
222. Способ согласно любому из вариантов осуществления 200-221, который также включает стадию (d) выделения указанного зрелого белка эластазы типа I.
223. Способ согласно любому из вариантов осуществления 150-222, где зрелой эластазой типа I является зрелая эластаза типа I свиней.
224. Способ согласно любому из вариантов осуществления 150-222, где зрелой эластазой типа I является зрелая эластаза типа I человека.
225. Способ получения препарата зрелого белка эластазы, включающий:
(a) выдерживание аутоактивированного белка проэластазы в условиях аутоактивации с продуцированием зрелого белка эластазы; и
(b) приготовление препарата зрелого белка эластазы с получением готового препарата зрелого белка эластазы.
226. Способ согласно варианту осуществления 225, где аутоактивированный белок проэластазы является рекомбинантным.
227. Способ согласно варианту осуществления 226, который, перед проведением стадии (а), также включает выделение белка проэластазы из культуры клетки-хозяина, способной экспрессировать указанный аутоактивированный белок проэластазы, культивированный в условиях, благоприятствующих экспрессии пробелка эластазы;
228. Способ согласно варианту осуществления 225 или варианту осуществления 226, который также включает, перед проведением стадии (b), очистку указанного зрелого белка эластазы.
229. Способ согласно любому из вариантов осуществления 225-228, где указанная стадия приготовления препарата включает лиофилизацию указанного зрелого белка эластазы.
230. Способ согласно варианту осуществления 229, где зрелый белок эластазы, перед его лиофилизацией, не смешивают с буфером или с ингредиентами буфера.
231. Способ согласно варианту осуществления 230, где зрелый белок эластазы, после его лиофилизации, смешивают с одним или несколькими ингредиентами буфера.
232. Способ согласно варианту осуществления 229, где зрелый белок эластазы, перед его лиофилизацией, смешивают с буфером или с одним или несколькими ингредиентами буфера.
233. Способ согласно варианту осуществления 231 или 232, где указанным буфером является буфер на основе забуференного фосфатом физиологического раствора («PBS»), либо ингредиентами буфера являются ингредиенты буфера PBS.
234. Способ согласно любому из вариантов осуществления 231-233, где буфер содержит декстран или где ингредиенты буфера содержат декстран.
235. Способ согласно варианту осуществления 234, где декстраном является декстран-18.
236. Способ согласно любому из вариантов осуществления 230-235, где буфер содержит полисорбат 80.
237. Способ согласно любому из вариантов осуществления 229-236, где указанная стадия приготовления препарата также включает разведение лиофилизованного зрелого белка эластазы жидкостью.
238. Способ согласно варианту осуществления 237, где жидкостью является вода.
239. Способ согласно варианту осуществления 237, где жидкостью является буфер.
240. Способ согласно варианту осуществления 239, где буфером является буфер с высокой ионной силой, более высокой ионной силой или менее высокой ионной силой.
241. Способ согласно любому из вариантов осуществления 237-240, где после разведения образуется раствор зрелого белка эластазы в буфере с высокой ионной силой, более высокой ионной силой или менее высокой ионной силой.
242. Способ согласно варианту осуществления 241, где ингредиенты буфера уже присутствуют в лиофилизате, либо их добавляют после разведения, либо то и другое.
243. Способ согласно любому из вариантов осуществления 240-242, где указанный буфер с высокой ионной силой включает 1 х PBS.
244. Способ согласно варианту осуществления 240 или 241, где буфер с менее высокой ионной силой включает 0,1 х PBS – 0,5 х PBS.
245. Способ согласно варианту осуществления 244, где буфер с менее высокой ионной силой включает 0,1 х PBS.
246. Способ согласно варианту осуществления 244, где буфер с менее высокой ионной силой включает 0,5 х PBS.
247. Способ согласно варианту осуществления 240 или 241, где буфер с более высокой ионной силой включает 1,1 х PBS – 3 х PBS.
248. Способ согласно варианту осуществления 247, где буфер с более высокой ионной силой включает 1,5 х PBS – 2 х PBS.
249. Способ согласно любому из вариантов осуществления 241-248, где буфер содержит декстран.
250. Способ согласно варианту осуществления 249, где декстраном является декстран 18.
251. Способ согласно любому из вариантов осуществления 241-250, где буфер содержит полисорбат 80.
252. Способ согласно любому из вариантов осуществления 241-251, где буфер имеет pH 7-8.
253. Способ согласно варианту осуществления 252, где буфер имеет pH 7,4.
254. Способ согласно любому из вариантов осуществления 237-253, где зрелый белок эластазы разводят до концентрации от 0,001 мг/мл до 50 мг/мл.
255. Способ согласно варианту осуществления 254, где зрелый белок эластазы разводят до концентрации от 0,1 мг/мл до 40 мг/мл.
256. Способ согласно варианту осуществления 255, где зрелый белок эластазы разводят до концентрации от 5 мг/мл до 30 мг/мл.
257. Способ согласно варианту осуществления 256, где зрелый белок эластазы разводят до концентрации от 10 мг/мл до 20 мг/мл.
258. Способ согласно любому из вариантов осуществления 225-257, где указанным препаратом является фармацевтическая композиция, содержащая указанный зрелый белок эластазы.
259. Способ согласно любому из вариантов осуществления 225-258, где зрелым белком эластазы типа I является зрелый белок эластазы типа I человека.
260. Способ согласно любому из вариантов осуществления 225-258, где зрелым белком эластазы типа I является зрелый белок эластазы типа I свиней.
261. Способ получения лиофилизованной зрелой эластазы типа I, включающий:
(a) продуцирование зрелой эластазы типа I способом согласно любому из вариантов осуществления 151-181;
(b) выделение зрелой эластазы типа I; и
(c) лиофилизацию указанной выделенной зрелой эластазы типа I, с получением лиофилизованной зрелой эластазы типа I.
262. Способ согласно варианту осуществления 261, где лиофилизованная зрелая эластаза типа I имеет чистоту 95%-100%.
263. Способ согласно варианту осуществления 261 или варианту осуществления 262, где лиофилизованная зрелая эластаза типа I имеет чистоту по меньшей мере 95%.
264. Способ согласно варианту осуществления 261 или варианту осуществления 262, где лиофилизованная зрелая эластаза типа I имеет чистоту по меньшей мере 98%.
265. Способ согласно любому из вариантов осуществления 261-264, где лиофилизованную зрелую эластазу типа I очищают до гомогенности.
266. Способ согласно любому из вариантов осуществления 261-265, где зрелым белком эластазы типа I является зрелый белок эластазы типа I человека.
267. Способ согласно любому из вариантов осуществления 261-265, где зрелым белком эластазы типа I является зрелый белок эластазы типа I свиней.
268. Способ согласно любому из вариантов осуществления 130, 149, 188, 198, 223, 259 и 267, где зрелый белок эластазы типа I человека состоит, по существу, из SEQ ID NO:5, SEQ ID NO:84 или SEQ ID NO:87.
269. Способ согласно варианту осуществления 268, где зрелый белок эластазы типа I человека состоит, по существу, из SEQ ID NO:1 или SEQ ID NO:4.
270. Способ согласно любому из вариантов осуществления 131, 150, 189, 199, 224, 260 и 268, где зрелый белок эластазы типа I свиней состоит, по существу, из SEQ ID NO:39.
271. Способ согласно любому из вариантов осуществления 111-128, 132-148, 151-197 и 225-257, где белком проэластазы является белок согласно любому из вариантов 13-27.
272. Способ согласно любому из вариантов осуществления 200-222, где экспрессированным белком является белок согласно любому из вариантов 13-27.
273. Зрелая эластаза типа I человека, которая была получена или может быть получена способом согласно любому из вариантов осуществления 149, 188, 198 и 223.
274. Зрелая эластаза типа I человека согласно варианту осуществления 273, которая имеет специфическую активность от 1 до 40 ед./мг белка.
275. Зрелая эластаза типа I свиней, которая была получена или может быть получена способом согласно любому из вариантов осуществления 150, 189, 199 и 224.
276. Зрелая эластаза типа I человека согласно варианту осуществления 275, которая имеет специфическую активность от 10 до 100 ед./мг белка.
277. Фармацевтическая композиция, содержащая терапевтически эффективное количество (a) зрелой эластазы типа I человека согласно варианту осуществления 273 или варианту осуществления 274 или (b) препарат зрелой эластазы типа I человека, которая была получена или может быть получена способом согласно варианту осуществления 259.
278. Фармацевтическая композиция согласно варианту осуществления 277, где зрелый белок эластазы типа I человека состоит, по существу, из SEQ ID NO:5, SEQ ID NO:84 или SEQ ID NO:87.
279. Фармацевтическая композиция согласно варианту осуществления 278, где зрелый белок эластазы типа I человека состоит, по существу, из SEQ ID NO:1 или SEQ ID NO:4.
280. Фармацевтическая композиция, содержащая терапевтически эффективное количество (a) зрелой эластазы типа I свиней согласно варианту осуществления 275 или варианту осуществления 276 или (b) препарат зрелой эластазы типа I свиней, которая была получена или может быть получена способом согласно варианту осуществления 260.
281. Фармацевтическая композиция согласно варианту осуществления 280, где зрелый белок эластазы типа I свиней состоит, по существу, из SEQ ID NO:39.
282. Фармацевтическая композиция, содержащая (i) терапевтически эффективное количество зрелой эластазы типа I человека и (ii) фармацевтически приемлемый носитель, где указанная фармацевтическая композиция отличается тем, что она обладает по меньшей мере одним из нижеследующих свойств:
(a) композиция не содержит трипсина;
(b) композиция, по существу, не содержит трипсина;
(c) композиция не содержит каких-либо белков, состоящих из SEQ ID NO: 2, 3, 37, 38, 70 и/или 71;
(d) композиция, по существу, не содержит каких-либо белков, состоящих из SEQ ID NO: 2, 3, 37, 38, 70 и/или 71;
(e) композиция не содержит бактериальных белков;
(f) композиция, по существу, не содержит бактериальных белков;
(g) композиция не содержит белков млекопитающих, не являющихся зрелой эластазой типа I человека;
(h) композиция, по существу, не содержит белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека.
283. Фармацевтическая композиция, содержащая (i) терапевтически эффективное количество зрелой эластазы типа I человека и (ii) фармацевтически приемлемый носитель, где фармацевтическая композиция отличается тем, что она обладает по меньшей мере одним из нижеследующих свойств:
(a) композиция не содержит трипсина;
(b) композиция, по существу, не содержит трипсина;
(c) композиция не содержит каких-либо белков, состоящих из SEQ ID NO:70 и 71;
(d) композиция, по существу, не содержит каких-либо белков, состоящих из SEQ ID NO:2 и 3;
(e) композиция не содержит бактериальных белков;
(f) композиция, по существу, не содержит бактериальных белков;
(g) композиция не содержит белков млекопитающих, не являющихся зрелой эластазой типа I человека;
(h) композиция, по существу, не содержит белков млекопитающих, не являющихся указанной зрелой эластазой типа I человека.
284. Фармацевтическая композиция согласно варианту осуществления 282 или варианту осуществления 283, которая отличается тем, что она обладает по меньшей мере двумя свойствами (a)-(h).
285. Фармацевтическая композиция согласно варианту осуществления 284, где указанными по меньшей мере двумя свойствами являются свойства (a) и (c).
286. Фармацевтическая композиция согласно варианту осуществления 284, где указанными по меньшей мере двумя свойствами являются свойства (b) и (d).
287. Фармацевтическая композиция согласно варианту осуществления 282 или варианту осуществления 283, где указанная композиция отличается тем, что она обладает по меньшей мере тремя свойствами (a)-(h).
288. Фармацевтическая композиция согласно варианту осуществления 284, где указанными по меньшей мере тремя свойствами являются свойства (a), (c) и (e).
289. Фармацевтическая композиция согласно варианту осуществления 284, где указанными по меньшей мере тремя свойствами являются свойства (b), (d) и (f).
290. Фармацевтическая композиция согласно варианту осуществления 282 или варианту осуществления 283, где указанная композиция отличается тем, что она обладает по меньшей мере четырьмя из свойств (a)-(h).
291. Фармацевтическая композиция согласно варианту осуществления 284, где указанными по меньшей мере четырьмя свойствами являются свойства (a), (c), (e) и (g).
292. Фармацевтическая композиция согласно варианту осуществления 284, где указанными по меньшей мере четырьмя свойствами являются свойства (b), (d), (f) и (h).
293. Фармацевтическая композиция согласно варианту осуществления 282 или варианту осуществления 283, отличающаяся тем, что она обладает по меньшей мере пятью из свойств (a)-(h).
294. Фармацевтическая композиция согласно варианту осуществления 282 или варианту осуществления 283, отличающаяся тем, что она обладает по меньшей мере шестью из свойств (a)-(h).
295. Фармацевтическая композиция согласно варианту осуществления 282 или варианту осуществления 283, отличающаяся тем, что она обладает по меньшей мере семью из свойств (a)-(h).
296. Фармацевтическая композиция согласно варианту осуществления 282 или варианту осуществления 283, отличающаяся тем, что она обладает по меньшей мере всеми свойствами (a)-(h).
297. Фармацевтическая композиция согласно любому из вариантов осуществления 282–296, которая не содержит или, по существу, не содержит одного, двух, трех или всех четырех белков, состоящих из SEQ ID NO:85, 86, 94 и 95.
298. Фармацевтическая композиция согласно любому из вариантов осуществления 282–297, которая не содержит или, по существу, не содержит каких-либо белков, состоящих из SEQ ID NO:85 и SEQ ID NO:86.
299. Фармацевтическая композиция согласно любому из вариантов осуществления 282–297, которая не содержит или, по существу, не содержит каких-либо белков, состоящих из SEQ ID NO:94 и SEQ ID NO:95.
300. Фармацевтическая композиция согласно любому из вариантов осуществления 282–297, которая не содержит или, по существу, не содержит одного, двух или всех трех белков, состоящих из SEQ ID NO:106, 107 и 108.
301. Фармацевтическая композиция согласно любому из вариантов осуществления 282–300, которая содержит фармацевтически приемлемые уровни эндотоксинов.
302. Фармацевтическая композиция согласно варианту осуществления 301, где указанной фармацевтической композицией является жидкая композиция, и где указанные фармацевтически приемлемые уровни эндотоксинов составляют 8 ЭЕ/мл или менее.
303. Фармацевтическая композиция согласно варианту осуществления 302, где указанные фармацевтически приемлемые уровни эндотоксинов составляют 5 ЭЕ/мл или менее.
304. Фармацевтическая композиция согласно варианту осуществления 301, где указанной фармацевтической композицией является твердая композиция, и где указанные фармацевтически приемлемые уровни эндотоксинов составляют 10 ЭЕ или менее на грамм зрелой эластазы типа I человека.
305. Фармацевтическая композиция согласно варианту осуществления 304, где указанные фармацевтически приемлемые уровни эндотоксинов составляют 5 ЭЕ или менее на грамм зрелой эластазы типа I человека.
306. Фармацевтическая композиция согласно любому из вариантов осуществления 282-305, где зрелая эластаза типа I человека обладает специфической активностью от 1 до 40 ед./мг белка.
307. Фармацевтическая композиция согласно варианту осуществления 306, где зрелая эластаза типа I человека обладает специфической активностью от 25 до 35 ед./мг белка.
308. Фармацевтическая композиция согласно варианту осуществления 306, где зрелая эластаза типа I человека обладает специфической активностью, превышающей 10 ед./мг белка.
309. Фармацевтическая композиция согласно варианту осуществления 306, где зрелая эластаза типа I человека обладает специфической активностью, превышающей 20 ед./мг белка.
310. Фармацевтическая композиция согласно любому из вариантов осуществления 282-309, где зрелая эластаза типа I человека состоит, по существу, из SEQ ID NO: 5, 84 или 87.
311. Фармацевтическая композиция согласно варианту осуществления 310, где зрелая эластаза типа I человека состоит, по существу, из SEQ ID NO:1 или SEQ ID NO:4.
312. Фармацевтическая композиция согласно любому из вариантов осуществления 282-311, трипсиновая активность которой соответствует менее чем 4 нг на 1 мг зрелого белка эластазы типа I человека.
313. Фармацевтическая композиция согласно варианту осуществления 312, трипсиновая активность которой соответствует менее чем 2 нг на 1 мг зрелого белка эластазы типа I человека.
314. Лиофилизованный препарат белка, состоящего, по существу, из SEQ ID NO:5, 84 или 87, который, после его разведения до концентрации указанного белка 1 мг/мл, обладает трипсиновой активностью, соответствующей менее чем 2 нг/мл трипсина.
315. Лиофилизованный препарат согласно варианту осуществления 314, в котором содержание влаги составляет менее чем 5%.
316. Лиофилизованный препарат согласно варианту осуществления 315, который содержит ионы натрия, ионы калия, ионы фосфата и ионы хлорида.
317. Лиофилизованный препарат согласно варианту осуществления 315, который включает полисорбат-80.
318. Лиофилизованный препарат согласно варианту осуществления 315, который включает декстран.
319. Лиофилизованный препарат согласно варианту осуществления 318, где декстраном является декстран-18.
320. Лиофилизованный препарат согласно варианту осуществления 311, который также включает ионы натрия, ионы калия, ионы фосфата, ионы хлорида и полисорбат-80.
321. Лиофилизованный препарат согласно варианту осуществления 314, который также включает ионы натрия, ионы калия, ионы фосфата, ионы хлорида и декстран.
322. Лиофилизованный препарат согласно варианту осуществления 321, где декстраном является декстран-18.
323. Лиофилизованный препарат согласно варианту осуществления 314, который включает ионы натрия, ионы калия, ионы фосфата, ионы хлорида, полисорбат-80 и декстран.
324. Лиофилизованный препарат согласно варианту осуществления 323, где декстраном является декстран-18.
325. Жидкий препарат, содержащий раствор по меньшей мере 0,1 мг/мл белка, состоящего, по существу, из SEQ ID NO:5, 84 или 87, и обладающего трипсиновой активностью, соответствующей менее, чем 2 нг/мл трипсина.
326. Жидкий препарат согласно варианту осуществления 325, где раствором является забуференный раствор.
327. Жидкий препарат согласно варианту осуществления 326, где раствор забуферен до pH 7-8.
328. Жидкий препарат согласно варианту осуществления 326, где раствором является PBS.
329. Жидкий препарат согласно варианту осуществления 328, где раствор содержит 137 мМ хлорида натрия, 2,7 мМ фосфата калия и 10 мМ фосфата натрия.
330. Жидкий препарат согласно любому из вариантов осуществления 325-329, который также содержит один или несколько наполнителей.
331. Жидкий препарат согласно варианту осуществления 330, в котором один или несколько наполнителей содержат декстран-18.
332. Жидкий препарат согласно варианту осуществления 331, в котором декстран-18 присутствует в количестве 8% масс./объем указанного раствора.
333. Жидкий препарат согласно варианту осуществления 330, в котором один или несколько наполнителей содержат полисорбат-80.
334. Жидкий препарат согласно варианту осуществления 333, в котором полисорбат-80 присутствует в количестве 0,01% масс./объем указанного раствора.
335. Жидкий препарат согласно любому из вариантов осуществления 325-334, где концентрация указанного белка в указанном растворе составляет от 0,001 мг/мл до 40 мг/мл.
336. Жидкий препарат согласно варианту осуществления 335, где концентрация указанного белка в указанном растворе составляет от 0,1 мг/мл до 20 мг/мл.
337. Жидкий препарат согласно любому из вариантов осуществления 325-336, который также включает один или несколько компонентов, таких как консервант, солюбилизирующий агент и краситель.
338. Жидкий препарат согласно любому из вариантов осуществления 325-337, который, по существу, не содержит белков млекопитающих, не являющихся указанным белком SEQ ID NO:5, 84 или 87.
339. Жидкий препарат согласно любому из вариантов осуществления 325-338, который, по существу, не содержит бактериальных белков.
340. Препарат, который был получен или может быть получен способом согласно любому из вариантов осуществления 225-258.
341. Препарат согласно варианту осуществления 340, который представляет собой жидкий препарат.
342. Препарат согласно варианту осуществления 340 или 341, где зрелым белком эластазы типа I является зрелый белок эластазы типа I человека.
343. Препарат согласно варианту осуществления 342, где зрелый белок эластазы типа I человека, по существу, состоит из SEQ ID NO:5, SEQ ID NO:84 или SEQ ID NO:87.
344. Препарат согласно варианту осуществления 342, где зрелый белок эластазы типа I человека, по существу, состоит из SEQ ID NO:1 или SEQ ID NO:4.
345. Препарат согласно варианту осуществления 340 или 341, где зрелым белком эластазы типа I является зрелый белок эластазы типа I свиней.
346. Препарат согласно варианту осуществления 345, где зрелый белок эластазы типа I свиней, по существу, состоит из SEQ ID NO:39.
347. Способ удаления одного или нескольких неправильно процессированных зрелых белков эластазы из смеси «правильно» и «неправильно» процессированных зрелых белков эластазы, где указанный способ включает:
(a) выдерживание композиции, содержащей смесь «правильно» и «неправильно» процессированных зрелых белков эластазы при pH, при котором правильно процессированный зрелый фермент является активным;
(b) поддерживание указанного pH до разложения одного или нескольких неправильно процессированных зрелых белков эластазы, и тем самым, удаление указанных одного или нескольких неправильно процессированных зрелых белков эластазы из смеси «правильно» и «неправильно» процессированных зрелых белков эластазы.
348. Способ согласно варианту осуществления 347, где указанные один или несколько «неправильно» процессированных зрелых белков эластазы, по сравнению с правильно процессированными зрелыми белками эластазы, содержат по меньшей мере одну или несколько дополнительных аминокислот у N-конца.
349. Способ согласно варианту осуществления 347 или 348, где указанный рН составляет 5-12.
350. Способ согласно любому из вариантов осуществления 347-349, где указанные один или несколько неправильно процессированных зрелых белков эластазы разлагаются на 50%-100%.
351. Способ согласно варианту осуществления 348, где указанные один или несколько неправильно процессированных зрелых белков эластазы разлагаются на 50%-99%.
352. Способ согласно варианту осуществления 348, где указанные один или несколько неправильно процессированных зрелых белков эластазы разлагаются на 50%-98%.
353. Способ согласно варианту осуществления 348, где указанные один или несколько неправильно процессированных зрелых белков эластазы разлагаются на 50%-95%.
354. Способ согласно варианту осуществления 348, где указанные один или несколько неправильно процессированных зрелых белков эластазы разлагаются на 50%-90%.
355. Способ согласно любому из вариантов осуществления 350-354, где более чем один неправильно процессированный зрелый белок эластазы разлагается по меньшей мере на 50%.
356. Способ согласно варианту осуществления 355, где все неправильно процессированные зрелые белки эластазы в смеси разлагаются по меньшей мере на 50%.
357. Способ согласно любому из вариантов осуществления 350-354, где по меньшей мере один неправильно процессированный зрелый белок эластазы разлагается по меньшей мере на 75%.
358. Способ согласно варианту осуществления 357, где более чем один неправильно процессированный зрелый белок эластазы разлагается по меньшей мере на 75%.
359. Способ согласно варианту осуществления 357, где все неправильно процессированные зрелые белки эластазы в смеси разлагаются по меньшей мере на 75%.
360. Способ согласно любому из вариантов осуществления 350-354, где по меньшей мере один неправильно процессированный зрелый белок эластазы разлагается по меньшей мере на 90%.
361. Способ согласно варианту осуществления 360, где более чем один неправильно процессированный зрелый белок эластазы разлагается по меньшей мере на 90%.
362. Способ согласно варианту осуществления 360, где все неправильно процессированные зрелые белки эластазы в смеси разлагаются по меньшей мере на 90%.
363. Способ согласно любому из вариантов осуществления 347-362, где композицией является жидкая композиция, в которой общий белок эластазы имеет концентрацию 10 мг/мл или менее.
364. Способ согласно любому из вариантов осуществления 347-362, где композицией является жидкая композиция, в которой общий белок эластазы имеет концентрацию 5 мг/мл или менее.
365. Способ согласно любому из вариантов осуществления 347-362, где композицией является жидкая композиция, в которой общий белок эластазы имеет концентрацию 2 мг/мл или менее.
366. Способ согласно любому из вариантов осуществления 347-362, где композицией является жидкая композиция, в которой общий белок эластазы имеет концентрацию 1 мг/мл или менее.
367. Способ согласно любому из вариантов осуществления 347-362, где композицией является жидкая композиция, в которой общий белок эластазы имеет концентрацию 0,5 мг/мл или менее.
368. Способ согласно любому из вариантов осуществления 347-362, где композицией является жидкая композиция, в которой общий белок эластазы имеет концентрацию 0,25 мг/мл или менее.
369. Способ согласно любому из вариантов осуществления 363-368, где композицией является жидкая композиция, в которой общий белок эластазы имеет концентрацию по меньшей мере 0,1 мг/мл.
370. Способ согласно любому из вариантов осуществления 363-368, где композицией является жидкая композиция, в которой общий белок эластазы имеет концентрацию по меньшей мере 0,2 мг/мл.
371. Способ согласно любому из вариантов осуществления 347-370, где трипсиновая активность указанной композиции составляет менее чем 4 нг/мл трипсина на мг всех белков эластазы.
372. Способ согласно любому из вариантов осуществления 347-370, где трипсиновая активность указанной композиции составляет менее чем 2 нг/мл трипсина на мг всех белков эластазы.
373. Способ согласно любому из вариантов осуществления 347-372, где композиция не содержит или, по существу, не содержит белка, состоящего из SEQ ID NO:104, и/или не содержит или, по существу, не содержит белка, состоящего из SEQ ID NO:105.
374. Способ получения фармацевтической композиции, содержащей зрелую эластазу типа I, где указанный способ включает (i) получение лиофилизованной зрелой эластазы типа I способом согласно любому из вариантов осуществления 261-265; и (ii) разведение лиофилизованной зрелой эластазы типа I в воде или в фармацевтически приемлемом носителе, с получением фармацевтической композиции, содержащей зрелую эластазу типа I человека.
375. Способ получения фармацевтической композиции, содержащей зрелую эластазу типа I, где указанный способ включает разведение лиофилизованного препарата согласно любому из вариантов осуществления 314-324 в воде или в фармацевтически приемлемом носителе, и тем самым, получение фармацевтической композиции, содержащей зрелую эластазу типа I.
376. Способ согласно варианту осуществления 374 или варианту осуществления 375, где фармацевтическая композиция содержит фосфат.
377. Способ согласно любому из вариантов осуществления 374-376, где указанная зрелая эластаза типа I представляет собой зрелую эластазу типа I человека.
378. Способ согласно варианту осуществления 377, отличающийся тем, что специфическая активность составляет 1-40 ед./мг белка.
379. Способ согласно варианту осуществления 377, где зрелая эластаза типа I обладает специфической активностью 25-35 ед./мг белка.
380. Способ согласно любому из вариантов осуществления 377-379, где зрелая эластаза типа I человека в указанной фармацевтической композиции сохраняет 60%-100% своей специфической активности после хранения по меньшей мере в течение одной недели при 4°C, после хранения по меньшей мере в течение одного месяца при 4°C, после хранения по меньшей мере в течение двух месяцев при 4°C, после хранения по меньшей мере в течение трех месяцев при 4°C, или после хранения по меньшей мере в течение шести месяцев при 4°C.
381. Способ согласно любому из вариантов осуществления 377-379, где зрелая эластаза типа I человека в указанной фармацевтической композиции сохраняет 60%-98% своей специфической активности после хранения по меньшей мере в течение одной недели при 4°C, после хранения по меньшей мере в течение одного месяца при 4°C, после хранения по меньшей мере в течение двух месяцев при 4°C, после хранения по меньшей мере в течение трех месяцев при 4°C, или после хранения по меньшей мере в течение шести месяцев при 4°C.
382. Способ согласно любому из вариантов осуществления 377-379, где зрелая эластаза типа I человека в указанной фармацевтической композиции сохраняет 60%-95% своей специфической активности после хранения по меньшей мере в течение одной недели при 4°C, после хранения по меньшей мере в течение одного месяца при 4°C, после хранения по меньшей мере в течение двух месяцев при 4°C, после хранения по меньшей мере в течение трех месяцев при 4°C, или после хранения по меньшей мере в течение шести месяцев при 4°C.
383. Способ согласно любому из вариантов осуществления 377-379, где зрелая эластаза типа I человека в указанной фармацевтической композиции сохраняет 60%-90% своей специфической активности после хранения по меньшей мере в течение одной недели при 4°C, после хранения по меньшей мере в течение одного месяца при 4°C, после хранения по меньшей мере в течение двух месяцев при 4°C, после хранения по меньшей мере в течение трех месяцев при 4°C, или после хранения по меньшей мере в течение шести месяцев при 4°C.
384. Способ согласно любому из вариантов осуществления 377-379, где зрелая эластаза типа I человека в указанной фармацевтической композиции сохраняет 60%-80% своей специфической активности после хранения по меньшей мере в течение одной недели при 4°C, после хранения по меньшей мере в течение одного месяца при 4°C, после хранения по меньшей мере в течение двух месяцев при 4°C, после хранения по меньшей мере в течение трех месяцев при 4°C, или после хранения по меньшей мере в течение шести месяцев при 4°C.
385. Способ согласно любому из вариантов осуществления 377-384, где зрелая эластаза типа I человека в указанной фармацевтической композиции сохраняет 70% своей специфической активности после хранения по меньшей мере в течение одной недели при 4°C.
386. Фармацевтическая композиция, которая была получена или может быть получена способом согласно любому из вариантов осуществления 374-385.
387. Способ терапевтического увеличения диаметра артерии или вены у человека, нуждающегося в этом, где способ включает: местное введение в стенки артерий или вены человека (a) фармацевтической композиции согласно любому из вариантов осуществления 277-313 и 386, (b) жидкого препарата согласно любому из вариантов осуществления 325-339, или (c) препарата согласно варианту осуществления 341 в дозе, достаточной для увеличения диаметра артерии или вены.
388. Способ согласно варианту осуществления 387, где диаметр сосуда, диаметр просвета сосуда или то и другое являются увеличенными.
389. Способ предупреждения или лечения вазоспазма артерии или вены у человека, нуждающегося в этом, где указанный способ включает: местное введение в стенки артерий или вены человека (a) фармацевтической композиции согласно любому из вариантов осуществления 277-313 и 386, (b) жидкого препарата согласно любому из вариантов осуществления 325-339, или (c) препарата согласно варианту осуществления 341 в дозе, достаточной для предупреждения или лечения вазоспазма артерии или вены.
390. Способ лечения обструкции артерии или вены у человека, нуждающегося в таком лечении, где указанный способ включает: местное введение в стенки артерий или вены человека (a) фармацевтической композиции согласно любому из вариантов осуществления 277-313 и 386, (b) жидкого препарата согласно любому из вариантов осуществления 325-339, или (c) препарата согласно варианту осуществления 341, где указанное введение приводит к протеолизу эластина в стенках артерии или вены и тем самым к увеличению диаметра артерии или вены.
391. Способ лечения заболевания артерии или вены у человека, нуждающегося в таком лечении, путем введения человеку трансплантата для артериовенозного диализа или проведения артериовенозного анастомоза, где способ включает: местное введение в стенки артерий или вены человека (a) фармацевтической композиции согласно любому из вариантов осуществления 277-313 и 386, (b) жидкого препарата согласно любому из вариантов осуществления 325-339, или (c) препарата согласно варианту осуществления 341, где указанное введение приводит к протеолизу эластина в стенках артерии или вены и тем самым к увеличению диаметра артерии или вены.
392. Способ лечения заболевания вен у человека путем проведения гемодиализа, где способ включает: местное введение в стенки вены человека (a) фармацевтической композиции согласно любому из вариантов осуществления 277-313 и 386, (b) жидкого препарата согласно любому из вариантов осуществления 325-339, или (c) препарата согласно варианту осуществления 341, где указанное введение приводит к протеолизу эластина в стенках вены и тем самым к увеличению диаметра вены.
393. Способ согласно любому из вариантов осуществления 387-392, который также включает введение части устройства доставки в стенку артерии или вены для доставки эластазы в стенку указанной артерии или вены.
394. Способ согласно любому из вариантов осуществления 387-393, где фармацевтическую композицию или жидкий препарат вводят посредством катетера.
395. Способ согласно любому из вариантов осуществления 387-394, где фармацевтическую композицию иди жидкий препарат вводят непосредственно в стенку артерии или вены.
396. Способ согласно любому из вариантов осуществления 387-395, где артерия или вена являются закупоренными.
397. Способ согласно варианту осуществления 396, где артерия или вена являются закупоренными в результате стеноза.
398. Способ согласно варианту осуществления 397, где обструкция, до ее устранения, препятствует прохождению крови в достаточном объеме.
399. Способ согласно варианту осуществления 398, где обструкцией является стеноз.
400. Способ согласно варианту осуществления 399, где обструкция артерии или вены происходит в результате гиперплазии интимы.
401. Способ согласно любому из вариантов осуществления 387-400, включающий введение фармацевтической композиции или жидкого препарата в закупоренную коронарную или периферическую артерию.
402. Способ согласно любому из вариантов осуществления 387-395, где артерия или вена являются восприимчивыми к обструкции в результате гиперплазии интимы.
403. Способ согласно любому из вариантов осуществления 387-400 и 402, где композицию вводят в стенки вены.
404. Способ согласно варианту осуществления 403, где вену подсоединяют к трансплантату для артериовенозного гемодиализа или создают артериовенозный анастомоз.
405. Способ согласно варианту осуществления 404, где вену подвергают гемодиализу.
406. Способ согласно варианту осуществления 405, который также включает прямое соединение вены с артерией или соединение вены с артерией посредством трансплантата.
407. Способ согласно любому из вариантов осуществления 387-394, где композицию вводят в адвентициальную поверхность хирургически доступной артерии или вены.
408. Способ согласно любому из вариантов осуществления 387-407, где зрелым белком эластазы типа I, присутствующим в указанной фармацевтической композиции, в жидкой композиции или в жидком препарате, соответственно, является зрелый белок эластазы типа I человека.
409. Способ согласно варианту осуществления 408, где зрелый белок эластазы типа I человека, по существу, состоит из SEQ ID NO:5, SEQ ID NO:84 или SEQ ID NO:87.
410. Способ согласно варианту осуществления 408, где зрелый белок эластазы типа I человека, по существу, состоит из SEQ ID NO:1 или SEQ ID NO:4.
411. Способ согласно любому из вариантов осуществления 387-407, где зрелым белком эластазы типа I, присутствующим в указанной фармацевтической композиции, в жидкой композиции или в жидком препарате, соответственно, является зрелый белок эластазы типа I свиней.
412. Способ согласно варианту осуществления 411, где зрелый белок эластазы типа I свиней, по существу, состоит из SEQ ID NO:39.
413. Лекарственная форма, содержащая от 0,0033 мг до 200 мг (a) зрелой эластазы типа I человека согласно варианту осуществления 273 или варианту осуществления 274 или (b) препарата зрелой эластазы типа I человека, которая была получена или может быть получена способом согласно варианту осуществления 259.
414. Лекарственная форма согласно варианту осуществления 413, где зрелый белок эластазы типа I человека, по существу, состоит из SEQ ID NO:5, SEQ ID NO:84 или SEQ ID NO:87.
415. Лекарственная форма, содержащая от 0,0033 мг до 200 мг (a) зрелой эластазы типа I свиней согласно варианту осуществления 276 или варианту осуществления 276 или (b) препарата зрелой эластазы типа I свиней, которая была получена или может быть получена способом согласно варианту осуществления 260.
416. Лекарственная форма согласно варианту осуществления 415, где зрелый белок эластазы типа I свиней, по существу, состоит из SEQ ID NO:39.
417. Лекарственная форма согласно любому из вариантов осуществления 413-416, которая содержит 0,5-50 мг указанной зрелой эластазы типа I.
418. Лекарственная форма согласно варианту осуществления 417, которая содержит 1 мг-20 мг указанной зрелой эластазы типа I.
419. Лекарственная форма согласно варианту осуществления 418, которая содержит 5 мг-10 мг указанной зрелой эластазы типа I.
420. Лекарственная форма согласно любому из вариантов осуществления 413-419, которая находится в контейнере, в упаковке, в раздаточном устройстве или в катетере.
421. Набор, содержащий белок эластазы согласно любому из вариантов осуществления 1-39 и 68-69, который был получен или может быть получен способом согласно любому из вариантов осуществления 89-224, 261-276 и 347-373; нуклеиновую кислоту согласно любому из вариантов осуществления 40-67; вектор согласно любому из вариантов осуществления 70-72; клетку согласно любому из вариантов осуществления 73-87; супернатант клеточной культуры согласно варианту осуществления 88, эластазный препарат согласно любому из вариантов осуществления 314-346, который был получен или может быть получен способом согласно любому из вариантов осуществления 261-276; фармацевтическую композицию согласно любому из вариантов осуществления 277-313 и 386, которая была получена или может быть получена способом согласно любому из вариантов осуществления 374-385, или лекарственную форму согласно любому из вариантов осуществления 415-420.
422. Набор согласно варианту осуществления 421, который представляет собой терапевтический набор.
423. Набор согласно варианту осуществления 422, который включает контейнер, упаковку, раздаточное устройство или катетер.
424. Набор согласно варианту осуществления 423, который представляет собой промышленный набор.
Настоящее изобретение также проиллюстрировано на нижеследующих конкретных вариантах его осуществления, которые относятся к белкам проэластазы SEQ ID NO:64 и SEQ ID NO:69:
1. Белок, содержащий аминокислотную последовательность SEQ ID NO:64 или SEQ ID NO:69.
2. Белок согласно конкретному варианту осуществления изобретения 1, который является выделенным.
3. Молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, кодирующую белок согласно конкретному варианту осуществления изобретения 1.
4. Молекула нуклеиновой кислоты согласно конкретному варианту осуществления изобретения 3, где белок содержит сигнальную последовательность, функционально связанную с указанной аминокислотной последовательностью SEQ ID NO:64 или SEQ ID NO:69.
5. Молекула нуклеиновой кислоты согласно конкретному варианту осуществления изобретения 4, где сигнальная последовательность является функциональной в Pichia pastoris.
6. Молекула нуклеиновой кислоты согласно конкретному варианту осуществления изобретения 5, где сигнальной последовательностью является сигнальный пептид α-фактора дрожжей.
7. Вектор, содержащий молекулу нуклеиновой кислоты согласно конкретному варианту осуществления изобретения 4.
8. Вектор согласно конкретному варианту осуществления изобретения 7, в котором нуклеотидная последовательность является мультимеризованной.
9. Клетка-хозяин, содержащая вектор согласно конкретному варианту осуществления изобретения 7.
10. Клетка-хозяин согласно конкретному варианту осуществления изобретения 9, в которой по меньшей мере одна копия указанного вектора интегрирована в геном клетки-хозяина.
11. Клетка-хозяин согласно конкретному варианту осуществления изобретения 10, в которой от двух до пяти копий указанного вектора интегрированы в геном клетки-хозяина.
12. Клетка-хозяин согласно конкретному варианту осуществления изобретения 9, в котором нуклеотидная последовательность является мультимеризованной.
13. Клетка-хозяин согласно конкретному варианту осуществления изобретения 12, в которой вектор содержит от двух до пяти копий указанной нуклеотидной последовательности.
14. Клетка, генетически сконструированная в целях экспрессии молекулы нуклеиновой кислоты согласно конкретному варианту осуществления изобретения 3.
15. Клетка согласно конкретному варианту осуществления изобретения 14, которая является клеткой Pichia pastoris.
16. Клетка согласно конкретному варианту осуществления изобретения 15, где указанная нуклеотидная последовательность функционально связана с промотором, индуцируемым метанолом.
17. Супернатант клеточной культуры, содержащий белок согласно конкретному варианту осуществления изобретения 1.
18. Способ получения белка эластазы, включающий культивирование клетки согласно конкретному варианту осуществления изобретения 15 в условиях, благоприятствующих экспрессии белка SEQ ID NO:64 или SEQ ID NO:69.
19. Способ согласно конкретному варианту осуществления изобретения 18, где указанными условиями являются одно, два, три или все четрые из нижеследующих условий: (i) период роста или индуцирования при pH 2-6; (ii) период роста или индуцирования при температуре 22°C-28°C; (iii) культивирование в комплексной среде; или (iv) культивирование в присутствии цитратного, сукцинатного или ацетатного соединения.
20. Способ согласно конкретному варианту осуществления изобретения 18, который также включает выделение белка.
21. Способ согласно конкретному варианту осуществления изобретения 18, который также включает выдерживание указанного белка SEQ ID NO:64 или SEQ ID NO:69 в условиях активации в целях продуцирования зрелого белка эластазы.
22. Способ согласно конкретному варианту осуществления изобретения 21, где указанный белок, перед его выдерживанием в условиях активации, очищают.
23. Способ согласно конкретному варианту осуществления изобретения 22, где указанный белок очищают в присутствии цитратного, сукцинатного или ацетатного соединения.
24. Способ согласно конкретному варианту осуществления изобретения 21, который также включает очистку зрелого белка эластазы.
25. Способ согласно конкретному варианту осуществления изобретения 24, который также включает лиофилизацию очищенного зрелого белка эластазы.
26. Способ получения зрелого белка эластазы, включающий выдерживание супернатанта клеточной культуры согласно конкретному варианту осуществления изобретения 17 в условиях аутоактивации с получением зрелого белка эластазы.
27. Способ согласно конкретному варианту осуществления изобретения 26, который также включает очистку зрелого белка эластазы.
28. Способ согласно конкретному варианту осуществления изобретения 27, который также включает лиофилизацию очищенного зрелого белка эластазы.
29. Способ получения фармацевтической композиции, содержащей зрелый белок эластазы, где указанный способ включает разведение лиофилизата, содержащего лиофилизованный белок проэластазы, полученный способом согласно конкретному варианту осуществления изобретения 25 или согласно конкретному варианту осуществления изобретения 28.
30. Способ согласно конкретному варианту осуществления изобретения 29, где лиофилизат (a) содержит один или несколько ингредиентов буфера или (b) не содержит ингредиентов буфера.
31. Способ согласно конкретному варианту осуществления изобретения 30, где указанный лиофилизат разводят водой или буфером.
32. Способ согласно конкретному варианту осуществления изобретения 31, где после разведения образуется раствор зрелого белка эластазы в буфере с высокой ионной силой, более высокой ионной силой или менее высокой ионной силой.
33. Способ согласно конкретному варианту осуществления изобретения 32, где буфером является забуференный фосфатом физиологический раствор.
34. Способ согласно конкретному варианту осуществления изобретения 29, где зрелый белок эластазы разводят до концентрации 0,001 мг/мл - 50 мг/мл.
35. Способ согласно конкретному варианту осуществления изобретения 29, где зрелый белок эластазы имеет специфическую активность от 1 до 40 ед./мг белка.
36. Фармацевтическая композиция, полученная способом согласно конкретному варианту осуществления изобретения 29.
37. Фармацевтическая композиция согласно конкретному варианту осуществления изобретения 36, которая отличается тем, что она обладает по меньшей мере одним, по меньшей мере двумя, по меньшей мере тремя, по меньшей мере четырьмя, по меньшей мере пятью, по меньшей мере шестью или по меньшей мере семью из нижеследующих свойств:
(a) композиция не содержит трипсина;
(b) композиция, по существу, не содержит трипсина;
(c) композиция не содержит каких-либо белков, состоящих из SEQ ID NO: 70 и 71;
(d) композиция, по существу, не содержит каких-либо белков, состоящих из SEQ ID NO: 2 и 3;
(e) композиция не содержит бактериальных белков;
(f) композиция, по существу, не содержит бактериальных белков;
(g) композиция не содержит белков млекопитающих, не являющихся указанным зрелым белком эластазы;
(h) композиция, по существу, не содержит белков млекопитающих, не являющихся указанным зрелым белком эластазы;
(i) композиция не содержит или, по существу, не содержит одного, двух, трех или всех четырех белков, состоящих из SEQ ID NO:85, 86, 94 и 95;
(j) композиция не содержит или, по существу, не содержит одного, двух или всех трех белков, состоящих из SEQ ID NO:106, 107 и 108;
(k) композиция содержит фармацевтически приемлемые уровни эндотоксинов;
(l) зрелый белок эластазы в указанной композиции обладает специфической активностью, составляющей 1-40 ед./мг белка;
(m) трипсиновая активность в композиции соответствует менее чем 4 нг на 1 мг зрелого белка эластазы;
(n) композиция содержит полисорбат-80;
(o) композиция содержит декстран;
(p) композиция содержит ионы натрия, ионы калия, ионы фосфата, ионы хлорида и полисорбат-80;
(q) композиция содержит ионы натрия, ионы калия, ионы фосфата, ионы хлорида и декстран;
(r) композиция содержит ионы натрия, ионы калия, ионы фосфата, ионы хлорида, полисорбат-80 и декстран;
(s) зрелый белок эластазы в указанной фармацевтической композиции сохраняет 60%-100% своей специфической активности после хранения по меньшей мере в течение одной недели при 4°C, после хранения по меньшей мере в течение одного месяца при 4°C, после хранения по меньшей мере в течение двух месяцев при 4°C, после хранения по меньшей мере в течение трех месяцев при 4°C, или после хранения по меньшей мере в течение шести месяцев при 4°C; и
(t) композиция содержит лекарственную форму, составляющую от 0,0033 мг до 200 мг указанного зрелого белка эластазы.
38. Фармацевтическая композиция согласно конкретному варианту осуществления изобретения 37, где фармацевтическая композиция отличается тем, что она обладает по меньшей мере тремя свойствами, по меньшей мере четырьмя свойствами или пятью свойствами, независимо выбранными из нижеследующих групп (i)-(v):
(i) (a), (b) или (m)
(ii) (e) или (f)
(iii) (g) или (h)
(iv) (k)
(v) (l)
39. Фармацевтическая композиция согласно конкретному варианту осуществления изобретения 38, где два из указанных по меньшей мере трех или из указанных по меньшей мере четырех свойств выбраны из групп (i) и (iv) или (v).
40. Фармацевтическая композиция согласно конкретному варианту осуществления изобретения 38, где три из указанных по меньшей мере четырех свойств выбраны из групп (i), (iv) и (v).
41. Способ удаления одного или нескольких неправильно процессированных зрелых белков эластазы из смеси «правильно» и «неправильно» процессированных зрелых белков эластазы, где указанный способ включает:
(a) выдерживание композиции, содержащей смесь «правильно» и «неправильно» процессированных зрелых белков эластазы при pH, при котором правильно процессированный зрелый фермент является активным;
(b) поддерживание указанного pH до разложения одного или нескольких неправильно процессированных зрелых белков эластазы, и тем самым, удаление указанных одного или нескольких неправильно процессированных зрелых белков эластазы из смеси «правильно» и «неправильно» процессированных зрелых белков эластазы.
42. Способ согласно конкретному варианту осуществления изобретения 41, где указанные один или несколько неправильно процессированных зрелых белков эластазы, по сравнению с правильно процессированными зрелыми белками эластазы, содержат по меньшей мере одну или несколько дополнительных аминокислот у N-конца.
43. Способ согласно конкретному варианту осуществления изобретения 41, где указанный рН составляет 5-12.
44. Способ согласно конкретному варианту осуществления изобретения 41, где указанные один или несколько неправильно процессированных зрелых белков эластазы разлагаются на 50%-100%.
45. Способ терапевтического увеличения диаметра артерии или вены у человека, нуждающегося в этом, где способ включает: местное введение в стенки артерий или вены человека фармацевтической композиции согласно конкретному варианту осуществления изобретения 36 в дозе, достаточной для увеличения диаметра артерии или вены.
46. Способ согласно конкретному варианту осуществления изобретения 45, где диаметр сосуда, диаметр просвета сосуда или то и другое являются увеличенными.
47. Способ предупреждения или лечения вазоспазма артерии или вены у человека, нуждающегося в этом, где способ включает: местное введение в стенки артерий или вены человека фармацевтической композиции согласно конкретному варианту осуществления изобретения 36 в дозе, достаточной для предупреждения или лечения вазоспазма артерии или вены.
48. Способ лечения обструкции артерии или вены у человека, нуждающегося в таком лечении, где способ включает: местное введение в стенки артерий или вены человека фармацевтической композиции согласно конкретному варианту осуществления изобретения 36, где указанное введение приводит к протеолизу эластина в стенках артерии или вены и тем самым к увеличению диаметра артерии или вены.
49. Способ лечения заболевания артерии или вены у человека, нуждающегося в таком лечении, путем введения человеку трансплантата для артериовенозного диализа или проведения артериовенозного анастомоза, где способ включает: местное введение в стенки артерий или вены человека фармацевтической композиции согласно конкретному варианту осуществления изобретения 36, где указанное введение приводит к протеолизу эластина в стенках артерии или вены и тем самым к увеличению диаметра артерии или вены.
50. Способ лечения заболевания вен у человека путем проведения гемодиализа, где способ включает: местное введение в стенки вены человека фармацевтической композиции согласно конкретному варианту осуществления изобретения 36, где указанное введение приводит к протеолизу эластина в стенках вены и тем самым к увеличению диаметра вены.
51. Набор, содержащий фармацевтическую композицию согласно конкретному варианту осуществления изобретения 36.
52. Набор согласно конкретному варианту осуществления изобретения 51, где фармацевтическая композиция содержится в контейнере, в упаковке, в раздаточном устройстве или в катетере.
Притязания предварительной заявки на патент США № 60/992319, поданной 4 декабря 2007, во всей своей полноте вводятся в настоящее описание посредством ссылки, и каждый вариант, представленный в пунктах формулы изобретения, вводится в настоящее описание посредством ссылки как конкретный вариант его осуществления.
Настоящее изобретение не ограничивается объемом представленного здесь описания конкретных вариантов его осуществления. Действительно, в настоящее изобретение, помимо уже имеющихся модификаций, могут быть внесены различные другие модификации, которые будут очевидны из вышеприведенного описания и описания графического материала. Такие модификации входят в объем прилагаемой формулы изобретения.
В настоящей заявке цитируются различные работы, включая патентные заявки, патенты и научные публикации, каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Реферат
Группа изобретений относится к области биотехнологии. Предложен аутоактивируемый белок панкреатической эластазы типа I. Предложена молекула нуклеиновой кислоты, кодирующая указанный белок. Предложен вектор для экспрессии указанного белка, содержащий указанную молекулу нуклеиновой кислоты. Предложена клетка-хозяин для продукции указанного белка. Предложен способ получения указанного белка, включающий культивирование указанной клетки-хозяина. Предложен способ получения фармацевтической композиции, содержащей указанный белок. Группа изобретений позволяет получать фармацевтические композиции с низким содержанием трипсина, содержащие зрелый белок панкреатической эластазы типа I, которые могут быть использованы в лечении и профилактике заболеваний биологических каналов (артерий и вен у человека). 10 н. и 18 з.п. ф-лы, 39 ил., 13 табл., 8 пр.

Комментарии