Лиофилизированная композиция для индукции иммунного ответа на флавивирус, композиция и способ для ее получения - RU2541784C2
Код документа: RU2541784C2
Чертежи











Описание
Область, к которой относится изобретение
Настоящее изобретение относится к фармацевтическим композициям, таким как вакцины, и к способам получения и применения таких композиций.
Предшествующий уровень техники
Вакцинация является одним из самых больших достижений медицины и она избавила миллионы людей от воздействий разрушительных заболеваний. Перед тем как вакцины стали широко применяться, от инфекционных заболеваний только в США ежегодно погибали тысячи детей и взрослых и гораздо больше во всем мире. Вакцинация широко применяется для защиты и лечения инфекции бактериями, вирусами и другими патогенами, а также представляет собой подход, который используется при профилактике и лечении рака. При вакцинации используются несколько различных подходов, включая введение убитого патогена, ослабленного живого патогена и неактивных субъединиц патогена. В случае вирусной инфекции было обнаружено, что живые вакцины обеспечивают самые мощные и длительные защитные иммунные реакции.
Живые, ослабленные вакцины были разработаны против флавивирусов, которые представляют собой мелкие, заключенные в оболочку положительно-нитевые РНК вирусы, которые в целом передаются инфицированными комарами и клещами. Род Flavivirus семейства Flaviviridae включает приблизительно 70 вирусов, многие из которых, такие как вирусы желтой лихорадки (YF), денге (DEN), японского энцефалита (JE) и клещевого энцефалита (TBE), являются основными человеческими патогенами (обзор см. в публикации Burke and Monath, Fields Virology, 4th Ed., 1043-1126, 2001).
Различные подходы использовались при разработке вакцин против флавивирусов. Например, в случае вируса желтой лихорадки две вакцины (вакцина против желтой лихорадки 17D и французская нейропатическая вакцина) были разработаны серийным пассажем (Monath, “Yellow Fever”, In Plotkin and Orenstein, Vaccines, 3rd ed., Saunders, Philadelphia, pp. 815-879, 1999). Другой подход к ослаблению флавивирусов для применения при вакцинации включает конструирование химерных флавивирусов, которые включают компоненты двух (или более) различных флавивирусов. Понимание того как конструируются такие химеры, требует объяснения структуры генома флавивируса.
Белки флавивируса продуцируются трансляцией одной длиной открытой рамки считывания для генерирования полипротеина, за которой следует сложная серия пост-трансляционных протеолитических расщеплений полипротеина комбинацией протеаз хозяина и вируса для генерирования вирусных белков (Amberg et al., J. Virol. 73:8083- 8094, 1999; Rice, "Flaviviridae," In Virology, Fields (ed.), Raven-Lippincott, New York, 1995, Volume I, p. 937). Вирусные структурные белки расположены в полипротеине в порядке C-prM-E, где “C” представляет собой капсид, “prM” представляет собой предшественника, связанного с вирусной оболочкой белка М, и “E” представляет собой белок оболочки. Эти белки присутствуют в N-концевой области полипротеина, тогда как неструктурные белки (NS1, NS2A, NS2B, NS3, NS4A, HS4B и NS5) локализуются в С-концевой области полипротеина.
Были получены химерные флавивирусы, которые включают структурные и неструктурные белки из различных флавивирусов. Например, в так называемой технологии ChimeriVaxTM используется капсид вируса желтой лихорадки 17D и неструктурные белки для доставки оболочечных белков (prM и E) других флавивирусов (см., например, Chambers et al., J. Virol. 73:3095-3101, 1999). Эта технология использовалась для разработки перспективных вакцин вирусов лихорадки денге, японского энцефалита (JE), Западного Нила (WN) и энцефалита Сент-Луиса (SLE) (см., например, Pugachev et al., in New Generation Vaccines, 3r ed., Levine et al., eds., Marcel Dekker, New York, Basel, pp. 559-571, 2004; Chambers et al., J. Virol. 73:3095- 3101, 1999; Guirakhoo et al., Virology 257:363-372, 1999; Monath et al., Vaccine 17: 1869-1882, 1999; Guirakhoo et al., J. Virol. 74:5477-5485, 2000; Arroyo et al., Trends MoI. Med. 7:350-354, 2001 ; Guirakhoo et al., J. Virol. 78:4761-4775, 2004; Guirakhoo et al., J. Virol. 78:9998-10008, 2004; Monath et al., J. Infect. Dis. 188:1213-1230, 2003; Arroyo et al., J. Virol. 78: 12497-12507, 2004; и Pugachev et al., Am. J. Trop. Med. Hyg. 71:639-645, 2004).
Основным условием для успешного применения и промышленного производства вакцин является способ, которым они обрабатываются и составляются для обеспечения устойчивости и поддержания эффективности в условиях, в которых вакцины транспортируются и хранятся перед применением. Лиофилизация представляет собой подход, используемый при переработке некоторых вакцинных продуктов, и является, по существу, способом сушки замораживанием под низким давлением с удалением воды посредством сублимации и оставляет продукт в виде высушенной лепешки с небольшим количеством влаги. Этот способ может иметь преимущества для вакцин, включая химерные флавивирусные вакцины, как описано выше, потому что такие вакцины имеют тенденцию быть более устойчивыми в среде с низкой влажностью. Лиофилизация может также увеличить температуру хранения продукта и облегчить его транспортировку. Решающим фактором, воздействующим на эффективность процесса лиофилизации, является составление вакцины. Например, желательно, чтобы состав после удаления воды усиливал устойчивость продукта. Обычно состав вакцины будет содержать любой или все из следующих компонентов: наполнитель (например, сахар), стабилизатор (например, сахар или белок) и буфер. Поэтому разработка эффективных и действенных способов и составов имеет большое значение для разработки клинически используемых и промышленно успешных вакцин, включая флавивирусные вакцины, как обсуждается выше.
Краткое описание сущности изобретения
Изобретение относится к композициям, включающим одну или несколько живых, ослабленных флавивирусных вакцин, один или несколько стабилизаторов, один или несколько наполнителей и один или несколько буферных компонентов. В одном примере стабилизатор представляет собой человеческий сывороточный альбумин (HSA) (например, нерекомбинантный человеческий сывороточный альбумин (HSA) или рекомбинантный человеческий сывороточный альбумин (rHSA)) (например, примерно 0,05-2,0% или 0,1%). Примерами наполнителей, которые могут быть включены в композиции по изобретению, являются лактоза (например, примерно 2-10% или 4%) и/или маннит (например, примерно 2-10% или 5%), тогда как примерами буферных компонентов, которые могут быть включены в композиции, являются гистидин (например, примерно 1-20 мМ или 10 мМ) и/или глутамат калия (например, примерно 20-80 мМ или 50 мМ). Композиция может быть представлена в лиофилизированной форме или в жидкой форме перед лиофилизацией. Кроме того, рН композиций может составлять, например, 6-10, 7-9, 7,5-8,5 или 7,9-8,1.
Живые, ослабленные флавивирусные вакцины, включенные в композиции по изобретению, могут представлять собой, например, химерные флавивирусы, такие как флавивирусы, которые включают структурные белки первого флавивируса и неструктурные белки второго, другого флавивируса. В одном примере такой химерный флавивирус включает пре-мембранные/мембранные и оболочечные белки первого флавивируса и капсид и неструктурные белки второго, другого флавивируса.
Первый и второй флавивирусы могут быть независимо выбраны из группы, состоящей из вирусов желтой лихорадки (например, YF17D), японского энцефалита, денге-1, денге-2, денге-3, денге-4, энцефалита долины Мюррей, энцефалита Сент-Луиса, энцефалитов Западного Нила, Кунжин, Роцио, Илхеуса, Центрально-Европейского энцефалита, сибирского энцефалита, российского весенне-летнего энцефалита, болезни Киасанурского леса, Алхурма, Омской геморрагической лихорадки, болезни Лупинга, Повассан, Негиши, Абсеттаров, Хансалова, Апои и Гипр. В определенных примерах первый флавивирус представляет собой вирус японского энцефалита или вирус Западного Нила, а второй вирус представляет собой вирус желтой лихорадки (например, YF17D).
В изобретение также включены композиции, включающие один или несколько белков и/или фармацевтические продукты на основе вируса, человеческий сывороточный альбумин (например, нерекомбинантный человеческий сывороточный альбумин (HSA) или рекомбинантный человеческий сывороточный альбумин (rHA)) (например, примерно 0,05-2,0% или 0,1%), соль (соли) глутаминовой кислоты щелочных металлов (например, глутамат калия) (например, примерно 20-80 мМ или 50 мМ), одну или несколько дополнительных аминокислот (например, гистидин) (например, примерно 1-20 мМ или 10 мМ), и один или несколько сахаров или сахарных спиртов (например, лактозу и/или маннит) (например, примерно 2-10%, 4% или 5%). Композиции могут быть в лиофилизированной форме или в жидкой форме перед лиофилизацией. Кроме того, рН композиций может составлять, например, 6-10, 7-9, 7,5-8,5 или 7,9-8,1.
В одном примере фармацевтический продукт на основе вируса включает вакцину против натуральной оспы (например, из вируса коровьей оспы или ослабленного вируса коровьей оспы, такого как, например, АСАМ1000, АСАМ2000, или модифицированной коровьей оспы Анкара (MVA)). В другом примере фармацевтический продукт на основе вируса включает слияние капсидного белка вируса гепатита В (например, слияние капсидного белка вируса гепатита В, кроме того, включающее один или несколько пептидов М2е гриппа). Кроме того, в другом примере фармацевтический продукт на основе вируса включает токсин или токсоид Clostridium difficile.
В изобретение также включены способы получения терапевтических композиций, которые включают процесс лиофилизации композиции, такой как описанные выше. Этот процесс может включать стадии замораживания, первичной сушки и вторичной сушки. В одном примере стадия сушки включает замораживание примерно при -50˚С в течение примерно 120 минут. Стадия первичной сушки может включать стадии плавного повышения температуры со скоростью примерно +0,1˚С/минуту до температуры полок примерно -40˚С, удерживания в течение примерно 500 минут; плавного повышения температуры со скоростью примерно +0,1˚С/минуту до температуры полок примерно -35˚С, удерживания в течение примерно 500 минут; плавного повышения температуры со скоростью примерно +0,1˚С/минуту до температуры полок примерно -30˚С, удерживания в течение примерно 500 минут; и плавного повышения температуры со скоростью примерно +0,1˚С/минуту до температуры полок примерно -25˚С, удерживания в течение примерно 800 минут. В этом примере стадия вторичной сушки может включать стадии плавного повышения температуры, включающие плавное повышение температуры со скоростью примерно +0,1˚С/минуту до температуры полок примерно +20˚С, удерживания в течение примерно 800 минут.
В другом примере стадия замораживания может включать замораживание примерно при -40˚С в течение примерно 60 минут. Стадия первичной сушки может включать стадии плавного повышения температуры со скоростью +0,5˚С/минуту до температуры полок примерно -5˚С, удерживания в течение примерно 300 минут; и плавного понижения температуры со скоростью примерно -0,5˚С/минуту до температуры полок примерно -0˚С, удерживания в течение примерно 300 минут. Стадия вторичной сушки может включать стадии плавного повышения температуры, включающие плавное повышение температуры со скоростью +0,2˚С/минуту до температуры полок примерно +30˚С, удерживания в течение примерно 600 минут; и плавное понижение температуры со скоростью примерно -1,0˚С/минуту до температуры полок примерно +5˚С, удерживания в течение примерно 9999 минут.
Изобретение также включает способы профилактики или лечения одного или нескольких заболеваний или состояний у субъекта, которые включают введение одной или нескольких композиций по изобретению, как описано выше и в других местах описания. В определенных примерах этих способов у субъекта имеется риск развития или инфекция флавивирусом (например, инфекция вирусом японского энцефалита, вирусом Западного Нила, вирусом денге или вирусом желтой лихорадки), натуральная оспа, грипп или инфекция Clostridium difficile. Кроме того, изобретение включает применение описанных в настоящей заявке композиций и препаратов при профилактике и лечении описанных в настоящей заявке заболеваний и состояний, а также для получения лекарственных средств при применении в этих целях. В целом, способы осуществляются для «профилактики» заболевания, состояния или инфекции субъекта, если у субъекта нет заболевания, состояния или инфекции перед введением материала композиции по изобретению. Способы осуществляются для «лечения» заболевания, состояния или инфекции субъекта, если у субъекта имеется такое заболевание, состояние или инфекция. Профилактику и/или лечение можно проводить для снижения воздействий, которые были бы иначе получены в отсутствие введения, или для устранения таких воздействий.
Изобретение обеспечивает несколько преимуществ. Например, как обсуждено выше, решающее значение для эффективного применения фармацевтических композиций, включающих белковые и/или вирусные компоненты, такие как вакцины, имеет то, чтобы композиции оставались устойчивыми в меняющихся условиях транспортировки и хранения. Как далее обсуждается ниже, настоящее изобретение относится к составам и стадиям переработки, которые приводят к получению композиций с повышенной устойчивостью. Другие признаки и преимущества изобретения станут очевидны из следующего детального описания и чертежей и формулы изобретения.
Краткое описание чертежей
Фиг.1 представляет собой график, показывающий потерю титра в результате хранения при 37˚С в эксперименте c JEPD-018.
Фиг.2 представляет собой график, показывающий устойчивость с гистидином и без него в эксперименте c WNPD-033.
Фиг.3 представляет собой график, показывающий устойчивость с глутаматом калия и без него в эксперименте с WNPD-045.
Фиг.4 представляет собой график, показывающий устойчивость при различных концентрациях лактозы при 37˚С в эксперименте c JEPD-145.
Фиг.5 представляет собой график, показывающий устойчивость составов с одиночными сахарами по сравнению с комбинацией маннита/лактозы при 37˚С.
Фиг.6 представляет собой график, показывающий потерю титра в результате хранения при 37˚С в подвергнутых отжигу образцах.
Фиг.7 представляет собой термограмму 4% раствора лактозы, который имеет температуру стеклования -32,6˚С.
Фиг.8 представляет собой термограмму, показывающую что когда 5% маннит добавляется к составу, то температура стеклования снижается приблизительно на 6˚С до -38˚С.
Фиг.9 представляет собой график, показывающий устойчивость в реальном масштабе времени окончательного состава при -80˚С.
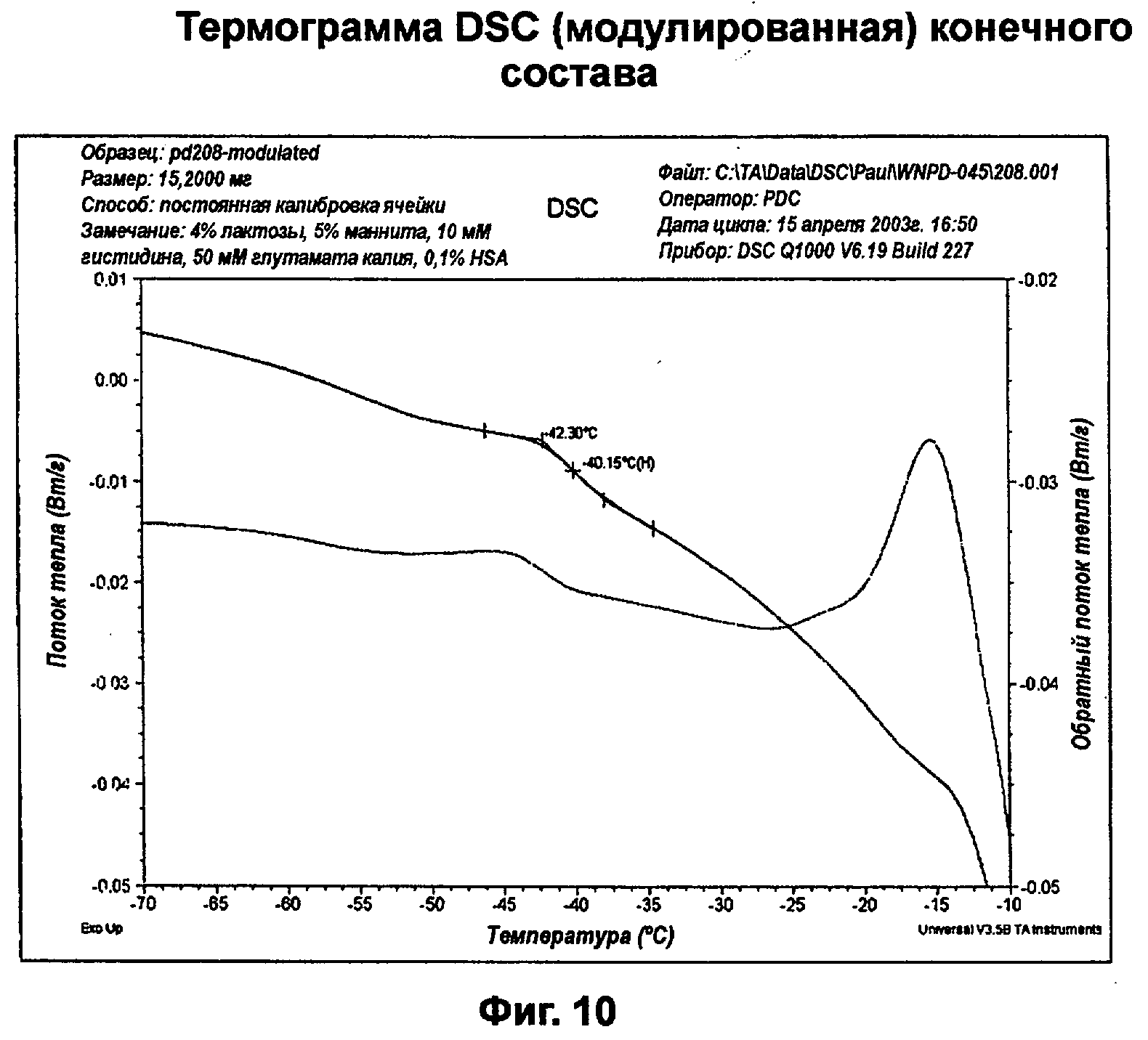
Фиг.10 представляет собой термограмму образца WNPD-045, анализированного с использованием модулированного DSC (дифференциального сканирующего калориметра) для улучшения разрешения.
Фиг.11 представляет собой термограмму образца JEPD-172, которая показала достаточное разрешение без использования модулированного сканирования.
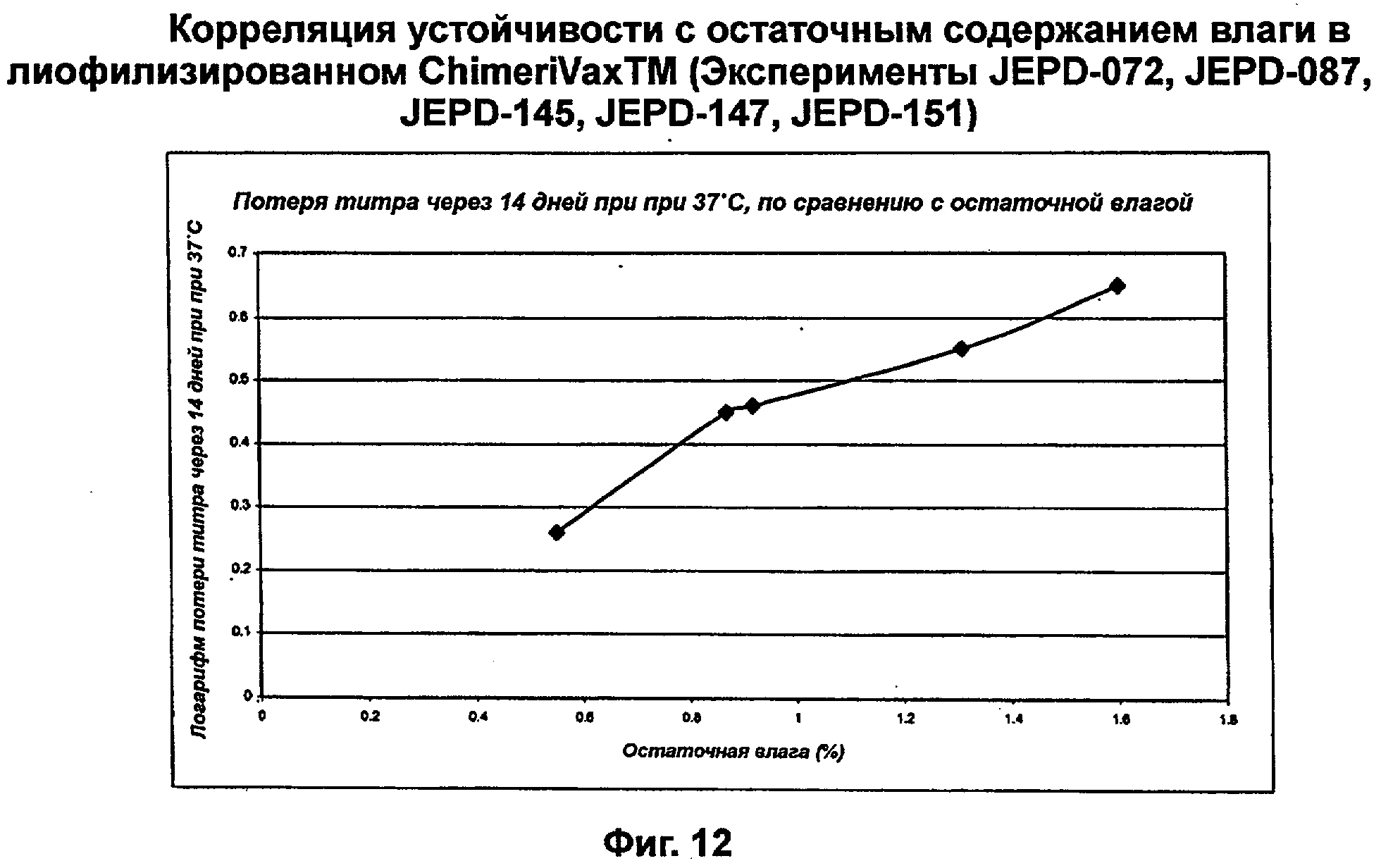
Фиг.12 представляет собой график, показывающий корреляцию устойчивости с остаточным содержанием влаги в лиофилизированном ChimeriVaxTM в указанных экспериментах.
Фиг.13 представляет собой график, показывающий полученные термопарой температуры эксперимента c JEPD-151.
Подробное описание
Изобретение относится к композициям и способам, которые можно применять для получения фармацевтических продуктов на вирусной и/или белковой основе, включающих живые вирусные вакцины, как далее описано ниже. Композиции по изобретению включают компоненты (например, определенные стабилизаторы, наполнители и буферы), которые, как описано ниже, по данным заявителей, имеют преимущества при получении вакцин, тогда как способы включают стадии с использованием лиофилизации, которая также обеспечивает преимущества. Изобретение также относится к способам профилактики и лечения, в которых применяются описанные в настоящей заявке композиции. Композиции и способы по изобретению описаны далее следующим образом.
Композиции по изобретению включают один или несколько терапевтических средств на белковой и/или вирусной основе, а также один или несколько стабилизаторов, наполнителей и/или буферов. Определенный пример композиции по изобретению детальнее описан ниже и включает химерную флавивирусную вакцину, человеческий сывороточный альбумин (0,1%) в качестве стабилизатора, маннит (5%) и лактозу (4%) в качестве наполнителей, и гистидин (10 мМ) и глутамат калия (50 мМ) в качестве буферных компонентов. В дополнение к этому определенному примеру изобретение также включает композиции, в которых компоненты этих типов варьируются по идентичности и/или количеству, как описано ниже.
Стабилизаторы, которые могут присутствовать в композициях по изобретению, включают сывороточные альбуминовые белки. Предпочтительный сывороточный альбуминовый белок представляет собой человеческий сывороточный альбумин (HSA) или в нерекомбинантной, или в рекомбинантной форме. Дополнительный пример сывороточного альбуминового белка, который может быть включен в композиции по изобретению, представляет собой бычий сывороточный альбумин. В дополнение к сывороточным альбуминам другие стабилизаторы, которые могут быть включены в композиции по изобретению, представляют собой желатины, такие как человеческий желатин (например, рекомбинантный человеческий желатин, который может быть дикого типа или созданный методами инженерии) и свиной желатин, казеин, PVP (поливинилпирролидон) и комбинации любых стабилизаторов, указанных в настоящем описании (или других, известных в данной области). В случае человеческого сывороточного альбумина количество этого компонента может составлять, например, примерно 0,05-2,0%, 0,075-1,0% или 0,1%.
Наполнители, которые могут присутствовать в композициях по изобретению, включают сахара, такие как лактоза, сахароза и фруктоза, и/или сахарные спирты, такие как маннит и сорбит. Как далее обсуждается ниже, в композициях по изобретению, включающих маннит, может быть предпочтительно, чтобы этот компонент был в аморфной, а не в кристаллической форме. Кроме того, в определенных примерах может быть предпочтительно, чтобы композиции по изобретению включали комбинации сахаров и/или сахарных спиртов. В одном примере, который далее описан ниже, композиции по изобретению могут включать комбинацию лактозы и маннита, причем последний предпочтительно представлен в аморфной форме. В одном примере лактоза присутствует в количестве примерно 1-10%, 2-8% или 4-6% (например, 4%), тогда как маннит присутствует в количестве примерно 1-10%, 2-8% или 4-6% (например, 5%).
Как отмечено выше, в дополнение к стабилизаторам и наполнителям композиции по изобретению могут включать буферные компоненты, такие как аминокислоты, которые могут служить для содействия поддержанию, например, определенного уровня или диапазона рН и/или устойчивости продукта. Один пример буферного компонента, который может быть включен в композиции по изобретению, представляет собой гистидин, который может присутствовать в композициях в концентрации примерно, например, 1-20, 5-15 или 10 мМ. Другим примером буферного компонента являются соли глутаминовой кислоты щелочных металлов, такие как глутамат натрия и калия, которые могут присутствовать в композициях в концентрации примерно 10-100, 25-75 или 50 мМ. Кроме того, композиции в целом имеют рН, например, 6-10, 7-9, 7,5-8,5 или 7,9-8,1.
Композиции по изобретению также включают один или несколько активных, терапевтических компонентов, которые могут представлять собой терапевтические средства на пептидной или белковой основе, а также вирусы, такие как живые, ослабленные вирусные вакцины. Одним примером терапевтических средств типа последней группы (живые, ослабленные вирусные вакцины) являются флавивирусные вакцины, такие как вакцины вируса желтой лихорадки. Определенным примером такой вакцины вируса желтой лихорадки является вакцина штамма YF17D (Smithburn et al., "Yellow Fever Vaccination," World Health Org., p. 238, 1956; Freestone, in Plotkin et al. (eds.), Vaccines, 2nd edition, W. B. Saunders, Philadelphia, 1995). В композициях по изобретению могут также присутствовать другие штаммы вируса желтой лихорадки, например YF 17DD (№ доступа в генном банке U 17066) и YF 17D-213 (№ доступа в генном банке U 17067) (dos Santos et al., Virus Res. 35:35-41, 1995), YF17D-204 France (X15067, X15062), YF17D-204, 234 US (Rice et al., Science 229:726-733, 1985; Rice et al., New Biologist 1:285-296, 1989; C 03700, K 02749), и штаммы вируса желтой лихорадки, описанные Galler et al., Vaccine 16 (9/10):1024-1028, 1998.
Дополнительные флавивирусы, которые могут присутствовать в композициях по изобретению, включают другие флавивирусы, переносимые комарами, такие как вирусы японского энцефалита (например, SA14-14-2), денге (серотипы 1-4), энцефалита долины Мюррей, энцефалитов Сент-Луиса, Западного Нила, Кунжин, энцефалита Роцио и вирусов Илхеуса; флавивирусы, переносимые клещами, такие как вирусы Центрально-Европейского энцефалита, сибирского энцефалита, российского весенне-летнего энцефалита, болезни Киасанурского леса, Алхурма, Омской геморрагической лихорадки, болезни Лупинга, Повассан, Негиши, Абсеттаров, Хансалова, Апои и Гипр, а также вирусы из рода Hepacivirus (например, вирус гепатита С).
В дополнение к вирусам, перечисленным выше, а также другим флавивирусам химерные флавивирусы также могут быть включены в композиции по изобретению. Эти химеры состоят из флавивируса (т.е. каркасный флавивирус), в которых структурный белок (или белки) были замещены соответствующим структурным белком (или белками) второго вируса (т.е. испытуемого или заданного вируса, такого как флавивирус; см., например, патент США № 6696281; патент США № 6184024; патент США № 6676936 и патент США № 6497884). Например, химеры могут состоять из каркасного флавивируса (например, вируса желтой лихорадки), в котором белки мембраны и оболочки флавивируса были замещены мембраной и оболочкой второго, испытуемого вируса (например, вируса Западного Нила, вируса денге (серотипа 1, 2, 3 или 4), вируса японского энцефалита или другого вируса, такого как любой из вирусов, которые указаны в данном описании). Химерные вирусы могут быть получены из любой комбинации вирусов, но обычно из вируса, против которого изыскивается иммунитет, является источником вставленного структурного белка (белков).
Определенным примером типа химерного вируса, который может быть включен в композиции по изобретению, является человеческая вакцина штамма вируса желтой лихорадки, YF17D, в котором мембранный белок и оболочечный белок были замещены мембранным белком и оболочечным белком другого флавивируса, такого как вирус Западного Нила (серотип 1, 2, 3 или 4), вирус японского энцефалита, вирус энцефалита Сент-Луиса, вирус энцефалита долины Мюррей или любой другой флавивирус, такой как один из вирусов, перечисленных выше. Химерные флавивирусы, полученные с использованием этого подхода, были обозначены как так называемые вирусы ChimeriVax. Следующие химерные флавивирусы, которые были получены с использованием технологии ChimeriVaxTM, и депонированные в Американской коллекции типовых культур (АТСС) в Manassas, Virginia, U.S.A., в соответствии с условиями Будапештского договора, с присвоенной датой депонирования 6 января 1998 г., можно использовать для получения вирусов по изобретению: химерный вирус желтой лихорадки 17D/денге типа 2 (YF/DEN-2; номер доступа в АТСС ATCC VR-2593) и химерный вирус желтой лихорадки 17D/японского энцефалита SA14-14-2 (YF/JE A1.3; номер доступа в АТСС ATCC VR-2594).
Детали получения химерных вирусов, которые можно использовать в изобретении, описаны, например, в следующих публикациях: WO 98/37911; WO 01/39802; Chambers et al., J. Virol. 73:3095-3101, 1999; WO 03/103571; WO 2004/045529; патент США № 6,696,281; патент США № 6,184,024; патент США № 6,676,936 и патент США № 6,497,884. Дополнительные определенные примеры химерных флавивирусов, которые могут присутствовать в композициях по изобретению и которые могут включать определенные ослабляющие мутации, описаны, например, в WO 02/072835, WO 02/102828, WO 03/103571, WO 2004/045529, WO 2005/082020, WO 2006/044857, WO 2006/1 16182 и в патенте США № 6,589,531. Дополнительные вирусные вакцины, которые могут присутствовать в композициях по изобретению, включают вакцины против натуральной оспы (например, вакцины на основе вирусов коровьей оспы, включающие АСАМ1000, АСАМ2000, модифицированной вакцина вируса коровьей оспы Анкара (MVA) и Lister, и вакцины на основе вируса обезьяньей оспы), и вирусы герпеса и вакцины, включающие их (например, HSV-1 и его рекомбинанты и HSV-1 и его рекомбинанты) (см., например, патент США № 7115270).
В дополнение к вирусам, композиции по изобретению могут также включать терапевтические или вакцинные пептиды или белки, такие как, например, конструкту гибридного белка ядра вируса гепатита В (например, белки ядра вируса гепатита В, слитые с одним или несколькими пептидами гриппа, такими как М2е; см., например, WO 2005/055957), и токсоидные вакцины C. difficile (включая, например, токсоиды А и/или В).
Композиции, описанные выше и в других местах в настоящей заявке, могут быть в лиофилизированной форме, или в форме жидкости, такой как до или после процесса лиофилизации. Как далее детально обсуждается в настоящем описании, композиции по изобретению особенно предпочтительны ввиду устойчивости активных компонентов, которая в значительной части определяется составом и способом получения продукта, включающим лиофилизацию. В целом, способ включает следующие стадии: замораживания, первичной сушки, вторичной сушки и укупоривания флаконов. Способ в дальнейших деталях описан ниже, в экспериментальных примерах, но пример способа следующий.
На стадии замораживания полки лиофилизатора предварительно охлаждаются до -50˚С. После загрузки всех лотков температура в области полок поддерживается на уровне -50˚С в течение 120 минут. На стадии первичной сушки вакуум устанавливается на 25 мТ, и проводятся следующие стадии плавного повышения температуры: плавное повышение температуры со скоростью +0,1˚С/минуту до температуры полки -40˚С, удерживание в течение 500 минут; плавное повышение температуры со скоростью +0,1˚С/минуту до температуры полки -35˚С, удерживание в течение 500 минут; плавное повышение температуры со скоростью +0,1˚С/минуту до температуры полки -30˚С, удерживание в течение 500 минут; и плавное повышение температуры со скоростью +0,1˚С/минуту до температуры полки -40˚С, удерживание в течение 800 минут. На стадии вторичной сушки вакуум остается на уровне 25 мТ, и проводится плавное повышение температуры, такое как плавное повышение температуры со скоростью +0,1˚С/минуту до температуры полки +20˚С, удерживание в течение 800 минут. При необходимости продукт может удерживаться при +20˚С, 25 мТ до 24 дополнительных часов перед укупориванием флаконов. На стадии укупоривания флаконов камеру дегазируют пропущенным через фильтр с размером пор 0,22 мкм сухим газообразным азотом, вакуум устанавливают на 800 мбар (небольшой вакуум), и флакончики закупоривают пробками. Альтернативный цикл лиофилизации, который может использоваться в изобретении, суммирован в следующей таблице 1.
Таким образом, способы по изобретению могут включать замораживание при температуре или примерно при температуре от -70˚С до -30˚С (например, от -60˚С до -40˚С или -50˚С). Замораживание может проводиться в течение примерно от 30 до 240 минут (например, от 60 до 120 минут) или дольше. Затем материал может быть подвергнут одному или нескольким стадиям сушки, как описано в настоящей заявке. На этих стадиях может создаваться вакуум (например, 25 мТ), и температура может постепенно изменяться (например, со скоростью от 0,1 до 1,0˚С/минуту или 0,0˚С/минуту), в течение периода времени (такого как 100-1000 минут, например 200-600 или 300-500 минут). При первичной сушке температура может подниматься, например, примерно от -30˚С до +10˚С, например, от -20˚С до +5˚С, или от -15˚С до 0˚С, тогда как при вторичной сушке температура может изменяться, например, от +5˚С до +35˚С, например, от 10˚С до 30˚С, или от 15˚С до 20˚С. Как известно специалистам в данной области, эти параметры (например, величины температуры, времени удерживания, скорости плавного изменения температуры и уровней вакуума) могут изменяться на основании, например, полученных результатов.
Перед составлением вирусы (включая химеры), которые могут быть включены в композиции по изобретению, могут быть получены с использованием стандартных способов в данной области. Например, молекула РНК, соответствующая геному вируса, может быть введена в первичные клетки, куриные эмбрионы или линии диплоидных клеток, из которых (или супернатантов которых) можно затем очистить потомство вирусов. В другом способе, который можно использовать для получения вирусов, используются гетероплоидные клетки, такие как клетки Vero (Yasumura et al., Nihon Rinsho 21:1201-1215, 1963). В этом способе молекула нуклеиновой кислоты (например, молекула РНК), соответствующая геному вируса, вводится в гетероплоидные клетки, вирус собирают из среды, в которой культивировались клетки, собранный вирус обрабатывается нуклеазой (например, эндонуклеазой, которая разрушает и ДНК, и РНК, такой как бензоназа (BenzonaseTM); патент США № 5173418), обработанный нуклеазой вирус концентрируется (например, путем использования ультрафильтрации с применением фильтра, имеющего массовую отсечку, например, 500 кДа), и концентрированный вирус включается в состав в целях вакцинации. Детали этого способа представлены в документе WO 03/060088 A2, который включен в настоящее описание путем ссылки.
Вакцинные композиции по изобретению можно вводить в качестве первичных профилактических средств лицам с риском инфекции или их можно применять в качестве вторичных средств для лечения инфицированных пациентов. Ввиду того, что вирусы в некоторых из этих композиций ослаблены, они особенно хорошо подходят для введения «индивидуумам с риском», таким как пожилые лица, дети или лица, инфицированные ВИЧ. Такие вакцины можно применять в ветеринарии, например при вакцинации лошадей против инфекции вирусом Западного Нила или при вакцинации птиц (например, ценных, находящихся под угрозой исчезновения или домашних птиц, таких как соответственно фламинго, белоголовые орланы и гуси). Кроме того, вакцины по изобретению могут включать вирус, такой как химерный вирус, включающий определенную мутацию, в смеси с вирусами, не имеющими таких мутаций.
Вакцины по изобретению можно вводить, используя способы, которые хорошо известны в данной области, и специалисты в данной области могут легко определить подлежащие введению целесообразные количества вакцин. То, что определяется как количество вируса, целесообразное для введения, можно определить путем учета таких факторов как, например, антропометрические параметры и общее состояние здоровья субъекта, которому предстоит ввести вирус. Например, вирусы по изобретению могут быть включены в составы в виде стерильных водных растворов, содержащих от 102 до 108, например от 103 до 107 инфекционных единиц (например, бляшкообразующих единиц или инфекционных доз культуры ткани) и объеме дозы от 0,1 до 1,0 мл, подлежащей введению, например, внутримышечным, подкожным или внутрикожным путями. Кроме того, ввиду того, что флавивирусы могут быть способны инфицировать хозяина-человека через слизистые оболочки, например пероральным путем (Gresikova et al., "Tick-borne Encephalitis," In The Arboviruses, Ecology and Epidemiology, Monath (ed.), CRC Press, Boca Raton, Florida, 1988, Volume IV, 177-203), вакцины на основе флавивируса по изобретению можно также вводить через слизистые оболочки. Кроме того, вакцины по изобретению можно вводить одной дозой, или, необязательно, введение может включать применение примирующей дозы, за которой следует введение бустер-дозы, которая вводится, например, через 2-6 месяцев, в соответствии с целесообразностью, определяемой специалистами в данной области.
Экспериментальные примеры
Описанные ниже эксперименты проводились в программе разработки составления и лиофилизации двух вакцин, ChimeriVaxTM-WN (химерный флавивирус, включающий капсид и неструктурные белки вируса желтой лихорадки и пре-мембранные/мембранные и оболочечные белки вируса Западного Нила) и ChimeriVaxTM-JE (химерный флавивирус, включающий капсид и неструктурные белки вируса желтой лихорадки и пре-мембранные/мембранные и оболочечные белки вируса японского энцефалита), но эти подходы включены в изобретение в отношении составления и переработки также других терапевтических продуктов, содержащих другой белок/пептид и/или вирус, как обсуждено выше.
Так, в одном примере состав по изобретению включает 10 мМ гистидина (аминокислоты), 50 мМ глутамата калия (аминокислоты), 0,1% HSA ((человеческого сывороточного альбумина, по Фармакопее США), 5% маннита и 4% лактозы, рН 7,9-8,1. В одном примере способов по изобретению лиофилизация проводится следующим образом. Полки лиофилизатора предварительно охлаждаются до -50˚С, и после загрузки всех лотков температура полок поддерживается на уровне -50˚С в течение 120 минут. На стадии первичной сушки вакуум устанавливается на 25 мТ, и стадии включают: плавное повышение температуры со скоростью +0,1˚С/минуту до температуры полок примерно -40˚С, удерживания в течение 500 минут; плавное повышение температуры со скоростью +0,1˚С/минуту до температуры полок -35˚?С, удерживания в течение 500 минут; плавное повышения температуры со скоростью +0,1˚С/минуту до температуры полок -30˚С, удерживания в течение 500 минут; и плавное повышение температуры со скоростью +0,1˚С/минуту до температуры полок примерно -25˚С, удерживания в течение 800 минут. На стадии вторичной сушки вакуум остается на уровне 25 мТ, температура плавно повышается со скоростью +0,1˚С/минуту до температуры полок примерно +20˚С с удерживанием в течение 800 минут. При необходимости, продукт может удерживаться при +20˚?С, 25 мТ в течение дополнительного периода до 24 часов перед укупориванием. На стадии укупоривания камера дегазируется пропущенным через фильтр с размером пор 0,22 мкм сухим газообразным азотом, вакуум устанавливается на 800 мбар (небольшой вакуум), и флакончики укупориваются пробками. Обоснование этого примера, а также другие составы и способы, включенные в изобретение, частично представлено ниже.
Пример I - Эксперимент по исследованию лиофилизации составов вируса Западного Нила с маннитом/лактозой (WNPD-045)
В эксперименте, описанном в данном примере, заявители исследовали составы вируса Западного Нила с основой из 5% маннита, 4% лактозы и 10 мМ гистидина. Полные составы показаны в таблице 2 со связанными величинами температуры стеклования.
Вирус включали в состав добавлением к буферам после выполнения разведения 1:100 осветленного объема WNPD-001. Состав получали в BSC. Лиофилизацию проводили в следующих условиях: плавное повышение температуры со скоростью 0,5˚С/минуту до температуры полок примерно -55˚С и удерживание в течение 120 минут; когда температура продукта достигает -50˚С, удерживание в течение 15 минут; сушка в камере при 150 мТ и форвакуумной линии при 100 мТ; плавное повышение температуры со скоростью 0,5˚С/минуту до температуры полок примерно -20˚С и удерживание в течение 1034 минут при 50 мТ; и плавное повышение температуры со скоростью 0,53˚С/минуту до температуры полок примерно 20˚С при 50 мТ и удерживание в течение примерно 862 минут. Этот цикл лиофилизации был завершен приблизительно через 38 часов.
Ускоренное исследование устойчивости выполняли на лиофилизированном материале. Ряд флаконов с лиофилизированным материалом инкубировали при 37˚С. На 7-й и 14-й дни флаконы извлекали, маркировали и помещали для хранения при -80˚С. Все составы с глутаматом калия претерпели значительную усадку лепешек через 7 дней при 37˚С. Составы без глутамата калия не претерпели этой усадки. Эксперименты c WNPD-049 и c WNPD-051 представляли собой анализ PFU (бляшкообразующих единиц) для определения устойчивости вируса в этих составах. Все образцы растворяли WFI (водой для инъекций).
Результаты
Все составы после лиофилизации представлялись очень похожими. Лепешки были полными и, как представлялось, не подвергались значительной потере объема. Некоторые лепешки отсоединились от стенок флаконов, но это представлялось случайным явлением среди составов. В таблице 3 показаны выходы после замораживания и выходы после лиофилизации по сравнению с основным количеством осветленного материала, использованного в составе. В таблице 4 показаны результаты ускоренного исследования при 37˚С.


Выводы
Составы с HSA работали очень хорошо и дали некоторые из лучших результатов, полученных заявителями к настоящему времени. Не было значимых потерь при хранении при -80˚С. Эти составы также проявили очень хорошие выходы при лиофилизации при среднем выходе 73%. Следует отметить, что вид лепешек этих образцов был гораздо более однородным, чем при любом другом составе, полученном до настоящего времени. Устойчивость составов HSA очень перспективна. Оба состава проявили логарифм потери <0,5 после 14 дней хранения при 37˚С. Представляется, что наличие глутамата калия благоприятно для состава.
Составы с рекомбинантным человеческим желатином, rHG-272, не дали таких же хороших результатов, как составы с HSA, но они могут улучшиться, если увеличить концентрацию 0,1%. Эти составы проявили низкие выходы после замораживания при -80˚С. Это подтверждают данные, наблюдавшиеся при WNPD-033 (см. ниже), при которых имелось низкое извлечение после замораживания в составе rHG-272. Составы с рекомбинантным желатином также проявили потери (>1 логарифма) в исследованиях устойчивости после 14 дней хранения при 37˚С.
Пример II - Разработка лиофилизированной вакцины для продуктов ChimeriVaxTM-WN и ChimeriVaxTM-JE
В этом примере описана разработка и характеристика состава, подходящего для вакцин ChimeriVaxTM-WN и ChimeriVaxTM-JE, а также разработка и оптимизация цикла лиофилизации для этих вакцин.
Экспериментальная процедура и результаты
Процедуры
Состав
Для составления объемов для экспериментов по лиофилизации концентрированный ChimeriVaxTM-WN или ChimeriVaxTM-JE в разведении 1:100 вливали в буфер состава. Композиция буфера состава варьировалась в соответствии с планом эксперимента. Образцы составленного основного количества продукта брали перед лиофилизацией и хранили при -80˚С в качестве “pre-lyo” образцов.
Лиофилизация
Для экспериментов по получению составов WNPD-070 и JEPD-144 лиофилизацию выполняли с использованием системы FTS DuraStop MP. Начиная с JEPD-145, использовали систему Kinetics LyoStar II. Параметры лиофилизации варьировали в соответствии с планом эксперимента. Для всех экспериментов использовали флакончики по 3 мл. Обычно использовали объем заполнения 0,5 мл, однако экспериментировали с объемом заполнения 0,3 мл, и это будет отмечено в случае применимости.
Анализ образования бляшек с ChimeriVaxTM-WN
Анализ образования бляшек использовали для оценки извлечения вируса при исследованиях процесса лиофилизации и устойчивости. Лиофилизированные образцы ChimeriVaxTM-WN растворяли или в воде для инъекций (WFI), или в 0,9%-ном хлориде натрия для инъекций. Растворенные образцы разбавляли в среде WN PFU. Разведения высевали в количестве 100 мкл на лунку на планшеты O-Vero, засеянные в концентрации 2х105 клеток на лунку. Планшеты инкубировали в течение 1 часа при 37˚С и 5% СО2 и затем наслаивали покрывающий слой метилцеллюлозы. Планшеты инкубировали в течение 96 ± 12 часов при 37˚С и 5% СО2 и затем окрашивали 1%-ным кристаллическим фиолетовым в 70%-ном метаноле. Окрашенные планшеты промывали, и затем производили подсчет. Приемлемые разведения имели от 10 до 120 бляшек на лунку и имели относительное стандартное отклонение <40% для всех лунок, рассчитанное для каждого разведения.
Анализ образования бляшек с ChimeriVaxTM-JE
Анализ образования бляшек использовали для оценки извлечения вируса при исследованиях процесса лиофилизации и устойчивости. Лиофилизированные образцы ChimeriVaxTM-JE растворяли или в воде для инъекций (WFI), или в 0,9%-ном хлориде натрия для инъекций. Растворенные образцы разбавляли в среде JE PFU. Разведения высевали в количестве 100 мкл на лунку на планшеты O-Vero, засеянные в концентрации 3х105 клеток на лунку. Планшеты инкубировали в течение 1 часа при 37˚С и 5% СО2 и затем наслаивали покрывающий слой метилцеллюлозы. Планшеты инкубировали в течение 96 ± 12 часов при 37˚С и 5% СО2 и затем окрашивали 1%-ном кристаллическим фиолетовым в 70%-ном метаноле. Окрашенные планшеты промывали и затем производили подсчет. Приемлемые разведения имели от 10 до 120 бляшек на лунку и имели относительное стандартное отклонение <40% для всех лунок, рассчитанное для каждого разведения.
Исследования устойчивости
Исследования устойчивости проводили при ряде температур. Ускоренные исследования устойчивости проводили в инкубаторе при 37˚С. Образцы также держали при окружающей температуре (15-30˚С), 25˚С, 2-8˚С и -20˚С. Образцы, взятые в нулевое время, хранили при -80˚?С. В некоторых случаях образцы, хранившиеся в условиях повышенных температур, извлекали в определенные дни и хранили при -80˚С для анализа в более позднее время.
Анализ остаточной влаги
Анализ остаточной влаги выполняли, используя прямую инъекцию образца в кулонометр Coulometric Karl Fischer. Испытание проводилось группой контроля качества Acambis' Quality Control group in Canton, MA, в соответствии с нормативами US02-FRM-158-02.
Дифференциальная сканирующая калориметрия
Дифференциальную сканирующую калориметрию выполняли с использованием прибора TA Instruments Q1000. Жидкие образцы охлаждали до -70˚С и затем плавно согревали до 20˚С. Когда требовалось более высокое разрешение, использовали модулированный способ. Эти способы давали величины температур стеклования для возможных буферов составов. Твердые образцы плавно согревали от 0˚С до 120˚С. Этот способ использовали для оценки температуры стеклования лиофилизированного материала и для определения условий хранения.
Результаты
Обзор разработки состава
Составы оценивали на основании следующих критериев:
- Tg' - температура стеклования замороженного материала
- Вид лиофилизированной лепешки
- Извлечение при лиофилизации
- Устойчивость лиофилизированного материала при 37˚С
- Остаточная влага в лиофилизированном материале
- Tg - температура стеклования лиофилизированного материала
Большое количество наполнителей оценивалось в ранних экспериментах по получению составов. Компоненты, скрининг которых первоначально проводился, включали: сорбит, маннит, сахарозу, декстран, лактозу, глицин, крахмалы Hetastarch, Pentastarch, PEG 3350, PVP 40K, хлорид натрия, хлорид калия, Tween-80, гистидин, аланин, HEPES, TRIS, глутамат калия, триполифосфат и фосфат калия. Некоторые составы не смогли образовать приемлемые лепешки и имели очень низкое извлечение вируса (менее чем 30%) после лиофилизации. Извлечение вируса начало улучшаться при добавлении HSA в составы в качестве стабилизатора.
Эксперименты с HSA
В эксперименте WNPD-021 HSA сначала использовали в качестве стабилизатора. Различные концентрации HAS добавляли к двум базовым составам. Эти два состава были следующие:
1% Hetastarch, 1% сахарозы, 0,1% сорбита и 50 мМ глутамата калия
4% лактозы, 2% сорбита, 10 мМ гистидина, 10 мМ аланина и 50 мМ глутамата калия
и добавляли HSA в концентрациях 0%, 0,2%, 1% и 2%.
Анализ образования бляшек показал следующие выходы при растворении WFI (см.таблицу 5).

В эксперименте JEPD-018, кроме того, исследовали эффект HSA в качестве стабилизатора в лиофилизированном составе. В этом эксперименте использовался состав 4% лактозы, 2% сорбита, 10 мМ гистидина, 10 мМ аланина и 50 мМ глутамамта калия, и исследовались концентрации HSA 0%, 0,05%, 0,1%, 1% и 2%. После лиофилизации образцы хранили при 37°С в ускоренном исследовании устойчивости. В таблице 6 показано, что присутствие HSA значительно улучшает выход вируса после лиофилизации. В образцах, титрованных после 5, 12 и 19 дней хранения при 37°С, проявилось заметно улучшенное извлечение (фиг.1). Не представляется, что какое-либо значимое улучшение имело место при концентрациях HSA выше, чем 0,1%, поэтому было решено сосредоточиться на составах с использованием 0,1% HSA.

Рекомбинантные стабилизаторы также оценивали для исследования возможности исключения HSA. В экспериментах с JEPD-018 исследовали применение рекомбинантного HSA Delta Biologics' Recombinant HSA и рекомбинантного человеческого желатина Fibrinogen's (2 штамма - дикого типа и полученный методами инженерии). Продукты рекомбинантного человеческого желатина (rHG) использовали в концентрациях 0,5% и 1%. Все стабилизаторы использовали в базовом составе из 5% маннита, 4% лактозы, 10 мМ гистидина и 50 мМ глутамата калия. Рекомбинантный HSA работал сравнимо с нерекомбинантным, однако продукты желатина в целом имели низкие уровни извлечения и проявляли плохую устойчивость в исследованиях при 37°С.

Выбор буферных компонентов
Гистидин был выбран в качестве буферного компонента, потому что он имеет величину рК около оптимального диапазона рН для продуктов ChimeriVaxTM. Целевым диапазоном рН для заявителей является 7,9-8,1, а гистидин имеет рК3' 8,97. В эксперименте c WNPD-033 испытывался состав 5% сахарозы, 0,1% HSA и 50 мМ глутамата калия с 10 мМ гистидина или без него. Эти составы лиофилизировали и использовали в ускоренном исследовании устойчивости при 37°С. Эти два лиофилизированных состава имели очень похожие выходы после растворения (74% без гистидина, 87% с гистидином) и проявили одинаковые профили устойчивости при 37°С (фиг.2). Несмотря на одинаковые профили с гистидином и без него, он был выбран в качестве компонента состава ввиду его буферной емкости в целевом диапазоне рН.
В эксперименте WNPD-033 исследовали составы 5% маннита, 4% лактозы, 0,1% HSA и 10 мМ гистидина с 50 мМ глутамата калия и без него. Эти два состава лиофилизировали и затем инкубировали при 37°С в течение 28 дней. Образцы брали через 7-дневные интервалы в течение инкубации при 37°С для построения профиля устойчивости, показанного на фиг.3. Оба состава имели сравнимые выходы после лиофилизации (выше 80%). Состав с 50 мМ глутамата калия проявил лучшую устойчивость при 37°С, чем без него. Через 28 дней логарифм потери составил 0,26 в титре для состава с глутаматом калия. Без глутамата калия имелся логарифм потери 0,56. На основании этих данных было решено включить 50 мМ глутамата калия в состав.
Выбор наполнителей
Лактоза была сначала исследована в качестве компонента состава WNPD-021. Этот эксперимент дал перспективные выходы при лиофилизации, показанные в таблице 5, и лактозу, кроме того, исследовали в WNPD-018, и были получены очень перспективные результаты в ускоренных исследованиях устойчивости (таблица 6 и фиг.1).
В эксперименте WNPD-029 тщательно изучены эти перспективные результаты. В этом эксперименте использовался базовый состав 4% лактозы, 2% сорбита, 10 мМ гистидина, 10 мМ аланина и 50 мМ глутамата калия. Представленные ниже данные укрепили выводы о преимуществах использования HSA в качестве стабилизирующего компонента (см. таблицу 8).

В эксперименте JEPD-145 варьировалась концентрация лактозы. Лактозу во всех концентрациях - 2%, 3% и 4% - лиофилизировали в комбинации с 5% маннита, 0,1% HSA, 10 мМ гистидина и 50 мМ глутамата калия. Этот эксперимент показал, что поведение 3% и 4% лактозы было одинаковым, но 2% лактоза работала хуже в ускоренном исследовании устойчивости (фиг.4). Поскольку не было ощутимого преимущества при использовании 3% лактозы, исследования продолжали, используя 4% в качестве концентрации лактозы.
В эксперименте WNPD-036 сравнивали следующие три состава (см.таблицу 9):
- 4% лактозы, 2% сорбита, 10 мМ гистидина, 10 мМ аланина, 50 мМ глутамата калия, 0,1% HSA
- 4% лактозы, 3% сахарозы, 10 мМ гистидина, 50 мМ глутамата калия, 0,1% HSA
- 4% лактозы, 3% маннита, 10 мМ гистидина, 0,1% HAS

Состав лактозы/маннита работал хорошо. Он имел превосходное извлечение после лиофилизации и проявил логарифм потери лишь 0,15 в титре через 2 недели при 37°С. Он был выбран в качестве кандидата на дальнейшее исследование. Была надежда на то, что кристаллизующие свойства маннита могут использоваться для ускорения цикла лиофилизации.
Составы с одним сахаром
В других экспериментах тщательно исследовали использование этих наполнителей отдельно. В WNPD-030 исследовали составы, содержащие только маннит или сахарозу. Лактозу исследовали в WNPD-047. Эти составы сравнивали с составом, содержащим комбинацию двух сахаров 5% маннита и 4% лактозы из WNPD-045. Устойчивость состава WNPD-045 (5% маннит, 4% лактоза, 0,1% HSA, 10 мМ гистидина, 50 мМ глутамата калия) намного превосходила устойчивость любого из составов с одним сахаром. Все составы с одном сахаром проявили потери вирусного титра через 14 дней при 37°С больше, чем 0,9 логарифма. Состав маннита/лактозы имел за тот же период времени логарифм потери только 0,46. Это иллюстрируется на фиг.5.
Отжиг
Попытку отжига осуществляли в двух экспериментах лиофилизации, JEPD-166 и JEPD-172. В этих экспериментах флаконы замораживали при -50°С и затем согревали со скоростью 0,8°С/минуту до -15°С и удерживали в течение 180 минут для отжига. Затем температуру снижали со скоростью 0,8°С/минуту до -50°С и удерживали в течение дополнительных 120 минут перед началом первичной сушки.
В обоих экспериментах были получены превосходные лепешки. Отжиг обеспечил возможность кристаллизации маннита, и лепешка имела вид типичной кристаллической лепешки маннита. Однако подвергнутый отжигу материал проявлял низкую устойчивость по сравнению со всеми экспериментами, в которых лепешки получали без отжига. Подвергнутые отжигу образцы проявили почти 1,0 логарифм потери после двух недель хранения при 37°С, тогда как не подвергнутые отжигу образцы имели потери в диапазоне от 0,3 до 0,5 логарифмов за тот же период времени (фиг.6).
Эти данные вместе с данными по системам с одним сахаром привели к заключению, что кристаллический маннит неблагоприятен для устойчивости продуктов ChimeriVaxTM.
Дифференциальная сканирующая калориметрия подтвердила, что отжиг, по существу, кристаллизовал весь маннит. На фиг.7 показана термограмма 4%-ного раствора лактозы, который имеет температуру стеклования -32,6°С. На фиг.8 показано, что когда 5% маннита добавляется к составу, то температура стеклования понижается примерно на 6°С до -38°С. Однако отжиг обеспечивает возможность кристаллизации маннита и восстанавливает температуру стеклования до диапазона, наблюдавшегося на термограмме одной лактозы. Исчезновение этого понижения температуры стеклования подтверждает, что маннит полностью кристаллизовался.
По этим данным можно сделать другой вывод. Лактоза всегда остается в аморфном состоянии при лиофилизации. Сам маннит в составе будет лиофилизирован как кристаллический материал, однако, при комбинации с другими сахарами маннит может быть или кристаллическим, или аморфным. Предыдущие эксперименты показали низкую устойчивость в следующих случаях:
- Лактоза отдельно (4%) - где лактоза является аморфной
- Маннит отдельно (5%) - где маннит является кристаллическим
- Лактоза (4%) и маннит (5%), подвергнутые отжигу, - где маннит является кристаллическим, а лактоза является аморфной
Хорошая устойчивость была определена только у одного из составов, включающего эти два компонента. Когда лактоза (4%) и маннит (5%) лиофилизируются без какой-либо стадии отжига, и лактоза и маннит остаются в аморфном состоянии. Поэтому именно или аморфный маннит, или комбинация аморфного маннита/лактозы придает более высокую устойчивость лиофилизированному ChimeriVaxTM. Одна аморфная лактоза оказалась неэффективной, как и маннит в кристаллическом состоянии любого типа.
Подтверждение данных для конечного состава
Как указано выше, 5% маннита, 4% лактозы, 0,1% HSA, 10 мМ гистидина, 50 мМ глутамата калия (рН 7,9-8,1) выбрали в качестве буфера состава для вакцин ChimeriVaxTM. Ряд экспериментов провели для характеристики состава и для создания и оптимизации цикла лиофилизиации.
Устойчивость жидкости
Данные экспериментов WNPD-052, JEPD-072 и JEPD-087 можно исследовать для демонстрации, что этот состав обеспечивает превосходную устойчивость при испытании хранения при -80°С в реальном масштабе времени. В этих экспериментах не наблюдались статистически значимые потери тиров вследствие хранения (фиг.9). Этот состав должен обеспечить адекватную устойчивость продуктам ChimeriVaxTM при хранении при -80°С перед лиофилизацией.
Дифференциальная сканирующая калориметрия
Дифференциальная сканирующая калориметрия (DSC) использовалась для определения температуры стеклования (Tg') этого состава. На фиг.10 показана термограмма образца WNPD-045. Его анализировали с использованием модулированной DSC для улучшения разрешения. На фиг.11 показан образец из эксперимента JEPD-172, который показал достаточное разрешение без использования моделированного сканирования. Оба образца проявляли низкую температуру стеклования (средней точкой) в диапазоне от -38 до -40°С.
Анализ влаги
При сравнении количества остаточной влаги с устойчивостью вакцины при 37°С через 2 недели видна тенденция. На фиг.12 представлены данные, собранные по экспериментам JEPD-072, JEPD-087, JEPD-145, JEPD-147 и JEPD-151, и показана потеря тетра по сравнению с процентной долей остаточной влаги.
Параметры лиофилизации
В экспериментах, показанных в таблице 10, детально представлены параметры, использованные при лиофилизации конечного состава. Они также охватывают выходы вирусов после лиофилизации, процентное содержание влаги в лиофилизированной лепешке, вид лиофилизированной лепешки и данные ускоренного исследования устойчивости при 37°С по 1 и 2 неделям, а также максимальную точку времени по инкубации при 37°С.

На основании этих данных было необходимо установить цикл лиофилизации, который можно было передать производителю по контракту. В эксперименте JEPD-151 был самый высокий выход после лиофилизации, наилучшая устойчивость после 2 недель при 37°С, самое низкое количество остаточной влаги и лучшие лепешки с эстетической точки зрения (фиг.13). Цикл лиофилизации из этого эксперимента служил в качестве модели для технических спецификаций, которые были переданы производителю по контракту.
Технические спецификации
Эти технические спецификации были основаны на данных эксперимента JEPD-151, но величины времени удерживания были продлены для компенсации потенциальных проблем масштаба при использовании другого лиофилизатора. Эти спецификации были переданы в исследовательский институт Walter Reed Army Institute of Research для окончательного заполнения материала ChimeriVaxTM-WN и ChimeriVaxTM-JE I/II фазы испытаний.
Цикл замораживания
- Предварительно охладить полки лиофлизатора до -50°С
- После загрузки всех лотков удерживать температуру полок при -50°С в течение 120 минут.
Первичная сушка
- Установить вакуум на 25 мТ
- Плавно согревать со скоростью +0,1°С/минуту до температуры полок -40°С, удерживать в течение 500 минут.
- Плавно согревать со скоростью +0,1°С/минуту до температуры полок -35°С, удерживать в течение 500 минут.
- Плавно согревать со скоростью +0,1°С/минуту до температуры полок -30°С, удерживать в течение 500 минут.
- Плавно согревать со скоростью +0,1°С/минуту до температуры полок -25°С, удерживать в течение 800 минут.
Вторичная сушка
Вакуум остается на уровне 25 мТ
- Плавно согревать со скоростью +0,1°С/минуту до температуры полок +20°С, удерживать в течение 800 минут.
- При необходимости продукт может удерживаться при +20°С, 25 мТ до 24 дополнительных часов перед укупориванием флаконов.
Укупоривание флаконов
- Дегазировать камеру пропущенным через фильтры с размером пор 22 мкм сухим газообразным азотом.
- Установить вакуум на 800 мбар (небольшой вакуум).
- Вставить пробки во флаконы.
Материалы и оборудование
Материалы
- Среда WN PFU - среда M199 (Gibco, Catalog # 12340-30), содержащая 10% FBS (Hyclone, Catalog # SH30070.30) и 1х пенициллин/стрептомицин (Sigma, P4333);
- Среда JE PFU - среда EMEM -, содержащая 10% FBS (Hyclone, Catalog # SH30070.03) и 1х пенициллин/стрептомицин (Sigma, P4333), 1х L-глутамин (2 мМ) (Gibco, Catalog # 25030-018), и 20 мМ HEPES;
- Наслаивание метилцеллюлозы - Метилцеллюлоза (полученная на SOP# 502-066), содержащая 5% или 10% FBS (Hyclone, Catalog # SH30070.03), 1х L-глутамин (Gibco, Catalog # 25030-018), 1х антибиотик/антимикотическое средство (Gibco, Catalog # 15240-062).
Оборудование
- Лиофилизатор FTS Durastop MP
- Лиофилизатор Kinetics Lyostar II
- Кулометрический титратор Orio Karl Fischer, модель AF7LC
- TA Instruments DSC QQ1000 (ID# 8769)
- Инкубатор Heraeus Heracell 240 (ID# 9055)
- Низкотемпературный инкубатор VWR, модель 205 (ID#s 8618 и 8617)
- Холодильник VWR (ID#s 8663)
- Fischer Scientific Isotemp (ID# 9059)
- Revco Ultima II (ID# 9061).
Выводы/обсуждение
Данные, представленные в данном примере, описывают выбор и разработку состава, предназначенного для лиофилизации продуктов ChimeriVaxTM. Состав был всесторонне охарактеризован и показал адекватную устойчивость в жидкой форме и превосходное извлечение и устойчивость после лиофилизации. Перед лиофилизцией составленную вакцину можно хранить в жидкой форме при -80°С без какого-либо значимого воздействия на титр. Этот пример также охватывает разработку и оптимизацию цикла лиофилизации для заполнения 0,5 мл во флакончик емкостью 3 мл. Этот цикл должен дать лепешки приемлемого вида, с высоким извлечением вируса (>70%) и низким содержанием остаточной влаги (<2%). Лиофилизированный продукт продемонстрировал превосходную устойчивость при повышенной температуре и, вероятно, не проявит значимой потери титра при хранении в условиях хранения ≤-10°С.
Содержание всех публикаций, отмеченных выше, включено в настоящее описание путем ссылки. Другие варианты находятся в пределах объема следующей формулы изобретения.
Реферат
Представленные изобретения относятся к лиофилизированной композиции для индукции иммунного ответа на флавивирус, композиции для получения указанной лиофилизированной композиции и способу получения лиофилизированной композиции. Охарактеризованная лиофилизированная композиция содержит эффективное количество живого ослабленного флавивируса, один или несколько стабилизаторов, один или несколько буферных компонентов, лактозу и аморфный маннит, которая получена лиофилизацией смеси, содержащей эффективное количество живого ослабленного флавивируса, один или несколько стабилизаторов, один или несколько буферных компонентов, лактозу и манит, причем флавивирус может быть химерным флавивирусом. При получении указанной лиофилизированной композиции проводят заморозку компонентов с последующей их сушкой. Изобретения позволяют получать устойчивые при транспортировке и хранении композиции, включающие флавивирус. 3 н. и 28 з.п. ф-лы, 13 ил., 10 табл., 2 пр.
Формула
(a) человеческий сывороточный альбумин в концентрации 0,1%;
(b) лактозу в концентрации 4%;
(c) маннит в концентрации 5%;
(d) глутамат калия в концентрации 50 мМ; и
(e) гистидин в концентрации 10 мМ.
(a) живой ослабленный химерный флавивирус, содержащий вирус желтой лихорадки, в котором белки мембраны и оболочки вируса желтой лихорадки были замещены белками мембраны и оболочки вируса японского энцефалита;
(b) человеческий сывороточный альбумин в концентрации 0,1%;
(c) лактозу в концентрации 4%;
(d) маннит в концентрации 5%, где указанный маннит остается в аморфном состоянии после лиофилизации указанной композиции;
(e) глутамат калия в концентрации 50 мМ; и
(f) гистидин в концентрации 10 мМ.
a) заморозка смеси, содержащей указанный живой ослабленный флавивирус, лактозу, маннит, буферный компонент и стабилизатор; и
b) сушка замороженной смеси, полученной на стадии a);
где стадии a) заморозки и b) сушки осуществляются таким образом, что маннит, содержащийся в лиофилизированной композиции, полученной в b), является аморфным.

Комментарии