Ингибиторы фукозидазы - RU2765202C2
Код документа: RU2765202C2
Чертежи
Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Эта заявка утверждает приоритет предварительной заявки США № 62/199194 от 30 июля 2015, которая включена здесь в виде ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Вообще, настоящее изобретение касается соединений, пригодных в качестве ингибиторов ферментов фукозидаз, и способов и композиций для терапии опухолей или раковых заболеваний, таких как болезни печени и опухоли печени (например, гепатоцеллюлярная карцинома), раскрытым здесь соединением.
УРОВЕНЬ ТЕХНИКИ
[0003] Отмечены различия в гликозилировании белков для нормальных и опухолевых клеток, которые являются основой для развития опухоль-селективных антител (Hakomori, S., Adv Exp. Med. Biol., 491:369-402, 2001). По наблюдениям клетки гепатоцеллюлярной карциномы (HCC) в значительной степени и ненадлежащим образом фукозилируют свои гликопротеины по сравнению с нормальными гепатоцитами (Block, T.M. et al., Proc. Natl. Acad. Sci. U S A, 102:779-84, 2005; Comunale, M.A. et al., J. Proteome Res. 8:595-602, 2009; Mehta, A. et al., Dis. Markers, 25:259-65, 2008; Noda, K. et al., Рак Res. 63:6282-9, 2003; Norton, P.A. et al., J. Cell. Biochem. 104:136-49, 2008). Большая часть этих гликопротеинов оканчивается в опухолевой лизосоме, где они деградируют. В одном сообщении предполагается, что повышенные уровни лизосомальной альфа-L-фукозидазы в сыворотке предсказывают развитие HCC, указывая на вероятную повышающую регуляцию этого фермента предраковыми гепатоцитами, обеспечивая повышенные уровни фукозилирования гликопротеинов на биосинтетическом пути (Giardina, M.G. et al., Рак 83:2468-74, 1998). Исследован каталитический механизм действия альфа-L-фукозидазы печени человека (White, W.J. et al., Biochim. Biophys. Acta. 912: 132-8 (1987)).
[0004] Инактивация лизосомальной альфа-L-фукозидазы (FUCA1), например, вследствие наследственных мутаций в гене дает в результате лизосомную болезнь накопления (LSD), так называемый фукозидоз (Willems, P.J. et al., Eur. J. Hum. Genet. 7:60-7, 1999; Intra, J. et al., Gene 392:34-46, 2007). Пациенты с обнаруженным фукозидозом демонстрируют лизосомальное накопление недеградированного материала, так как их организм не способен лизосомально разрушать терминальные и ядро-фукозилированные олигосахариды, и редко выживают дольше шести лет (Willems, P.J. et al., Am. J. Med. Genet. 38:111-31, 1991).
[0005] В патенте США 5240707 раскрыты ингибиторы альфа-маннозидазы и фукозидазы, которые, как предполагают, пригодны в качестве иммуномодуляторов и антиметастатических агентов. Другие известные ингибиторы фукозидазы включают L-дезоксифуконоджиримицин (DFJ) (Winchester, B. et al., Biochem. J. 265:277-82, 1990) на базе структуры классического ноджиримициниминосахара, имеющий константу ингибирования в отношении лизосомальной фукозидазы 10 нМ. Смотри также патент США 5100797, в котором раскрыты дополнительные ингибиторы на базе дезоксифуконоджиримицина (DFJ или DNJ), например, бета-L-гомофуконджиримицин и 1-бета-C-замещенные дезоксиманноджиримицины. Другим потенциальным ингибитором фукозидазы является член класса семичленных азепанов ((3R,4R,5S,6S)-1-бутил-4,5,6-тригидроксиазепан-3-карбоновая кислота, также известная под именем «Faz»). Несмотря на гидроксильную форму идуронатного сахара и наличие карбоксильной функциональности, эта новая молекула также ингибирует фукозидазу с эффективностью в низком наномолярном диапазоне (Li, H и др., Chembiochem 9:253-60, 2008). Исследованы также ингибиторы иминосахаров, имеющие алкил-модифицированный амин (McCormack, P.L. et al., Drugs 63:2427-34; discussion 2435-6, 2003; Bause, E. et al., FEBS Lett. 278:167-70, 1991). Ингибиторы фукозидазы описаны также в патентах США №№ 5382709, 5240707, 5153325, 5100797, 5096909 и 5017704, патентной публикации США № 2011/0189084 и работе Wu et al., Angew. Chem. Int. Ed. 49:337-40 (2010).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] Вообще, настоящее изобретение касается соединений, композиций и способов лечения опухолей или раковых заболеваний, в том числе такой болезни печени как гепатоцеллюлярная карцинома. Предполагается, что композиции содержат соединение, которое раскрыто здесь.
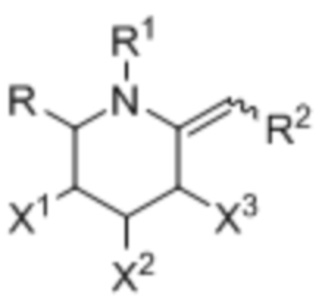
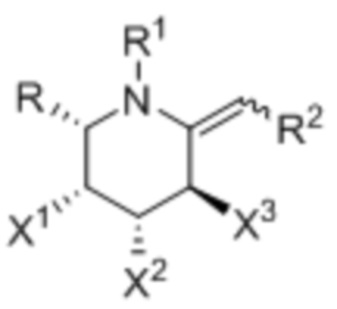
[0007] В одном аспекте изобретение касается соединения формулы I:
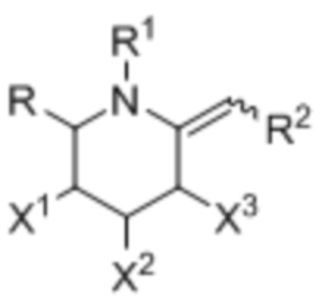
где:
X1, X2, и X3 независимо выбраны из группы, состоящей из OH, атома галогена и O(C)OCH3;
R выбран из группы, состоящей из C1-3алкила и C1-3галогеналкила;
R1 выбран из группы, состоящей из H, C1-3алкила, OH, ―CO2C1-3алкил;а
R2 выбран из группы, состоящей из ―NRbC(O)Ra, -NRbC(O)ORa, -NRbC(O)NRcRa, -NRbC(O)SRa, -C(O)Ra и -C(O)NRbRa;
Rа обозначает ―C0-3алкилен-G;
G выбран из группы, состоящей из арила, гетероарила, циклоалкила, и гетероциклоалкила; и
Rb и Rc независимо выбраны из группы, состоящей из H и C1-3алкила.
[0008] В некоторых вариантах осуществления X1, X2 и X3 обозначают OH.
[0009] В некоторых вариантах осуществления R обозначает метил.
[0010] В некоторых вариантах осуществления R1 обозначает H.
[0011] В некоторых вариантах осуществления R2 обозначает -NRbC(O)Ra.
[0012] В некоторых вариантах осуществления R2 обозначает -C(O)NRbRa.
[0013] В некоторых вариантах осуществления Rb обозначает H.
[0014] В некоторых вариантах осуществления G выбран из группы, состоящей из необязательно замещенного индолила, бензотиофенила, флуоренила, инденил,а дигидроинденила и фенила.
[0015] В некоторых вариантах осуществления G выбран из группы, состоящей из необязательно замещенного фенила и
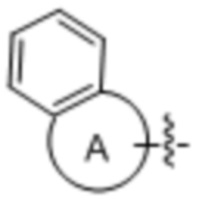
где A обозначает 5-, 6-, 7-, 8-, 9- или 10-членную карбоциклическую или гетероциклическую кольцевую систему.
[0016] В некоторых вариантах осуществления G выбран из группы, включающей
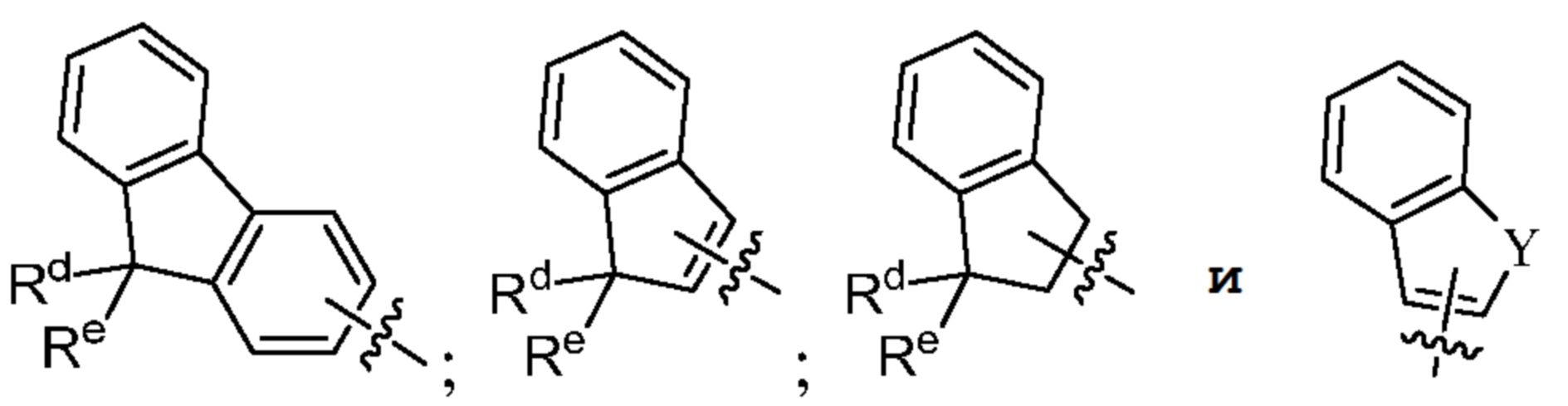
Rd и Re независимо выбраны из группы, включающей H, ORf, NRfRg, C1-3алкил и C1-5циклоалкил; или
Rd и Re, взятые вместе с атомом углерода, к которому они присоединены, образуют C=O;
Rf и Rg независимо выбраны из группы, включающей H и C1-3алкил; и
Y выбран из группы, включающей NH, N-C1-3алкил, S, SO, SO2 и O.
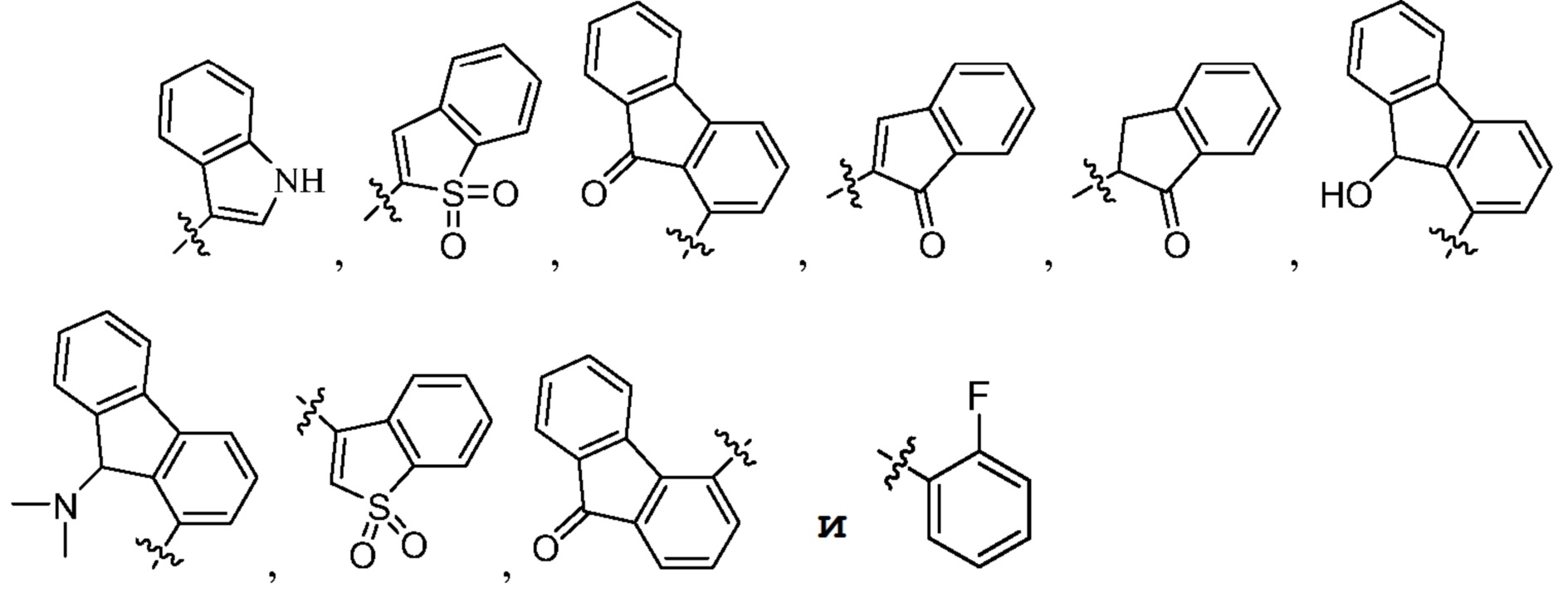
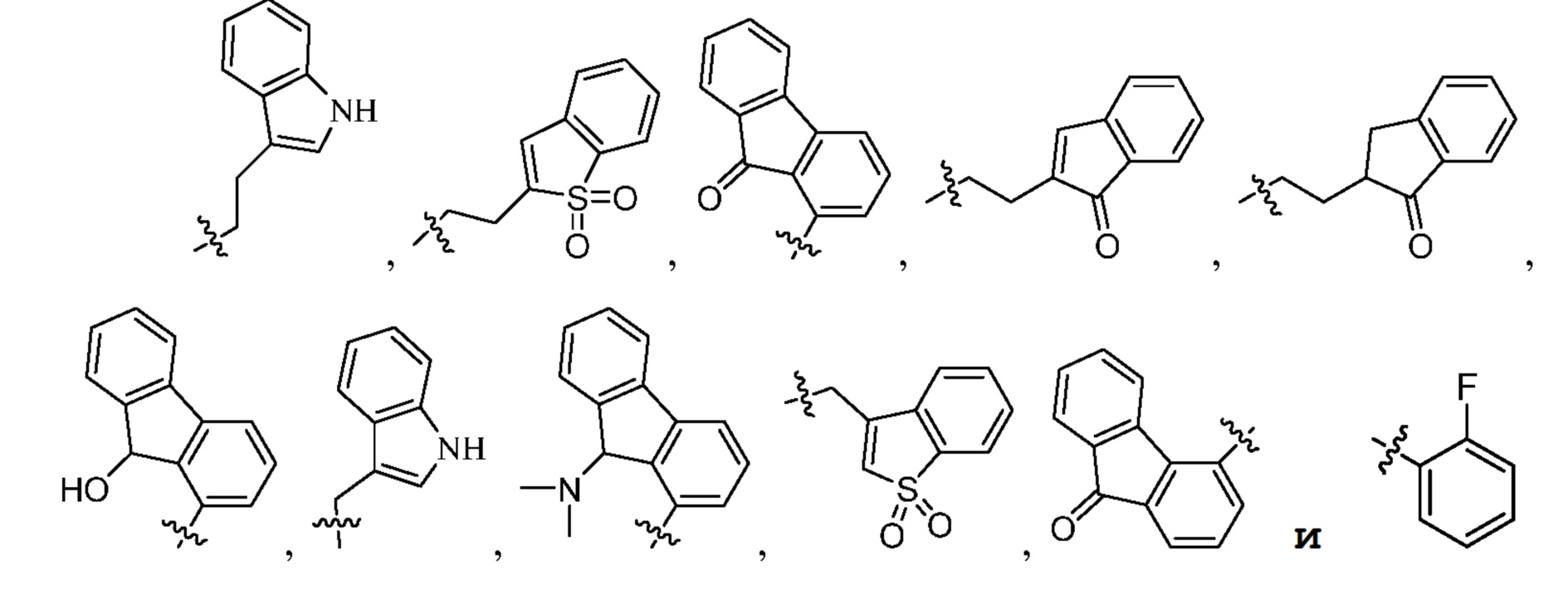
[0017] В некоторых вариантах осуществления G выбран из группы, включающей
[0018] В некоторых вариантах осуществления Ra выбран из группы, включающей
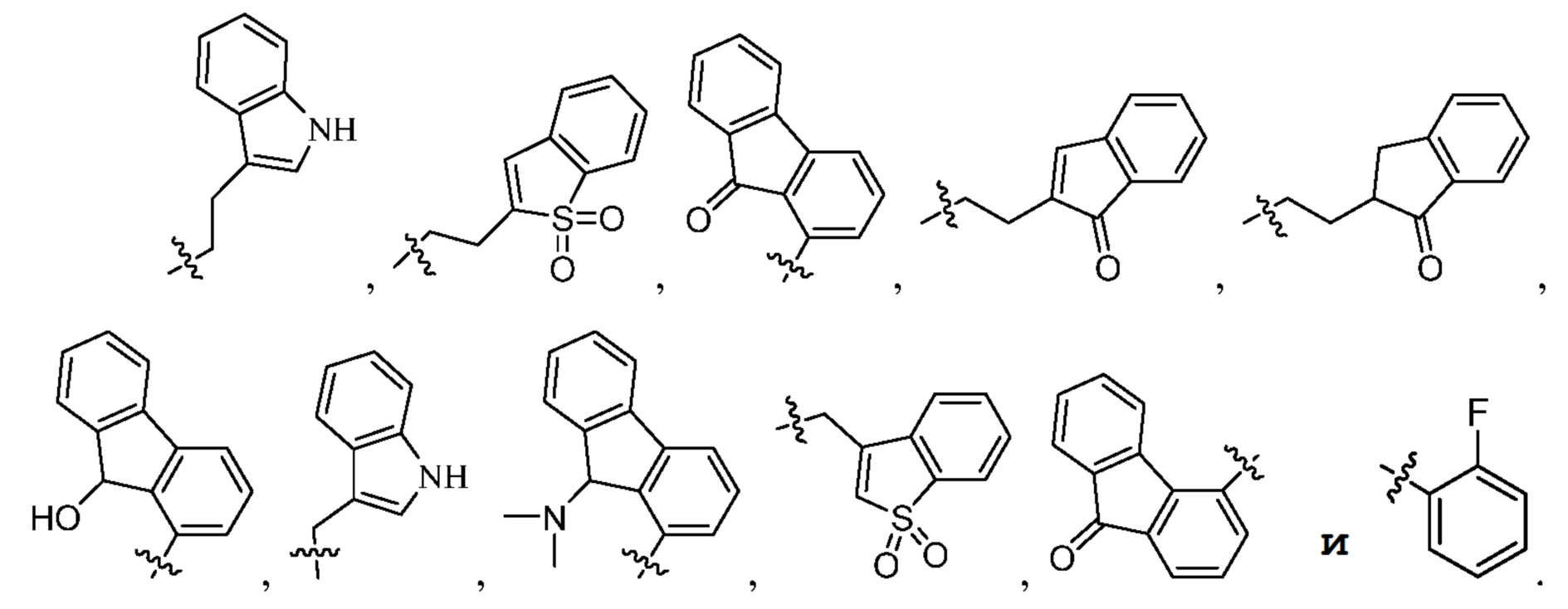
[0019] В некоторых вариантах осуществления Ra обозначает

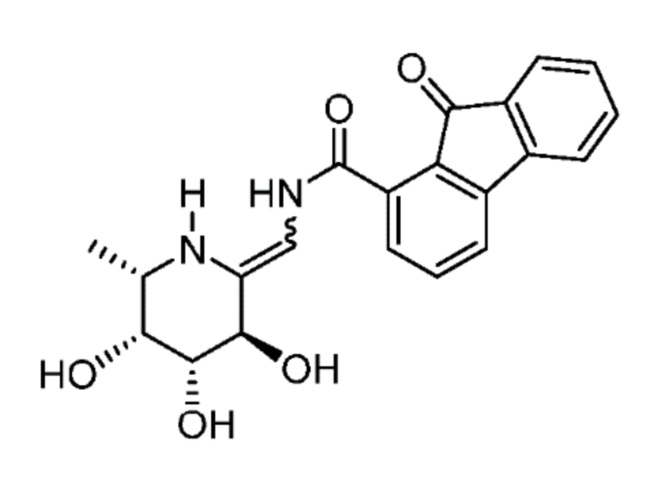
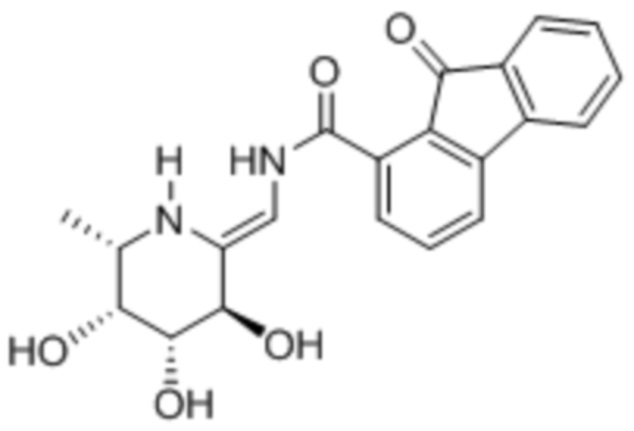
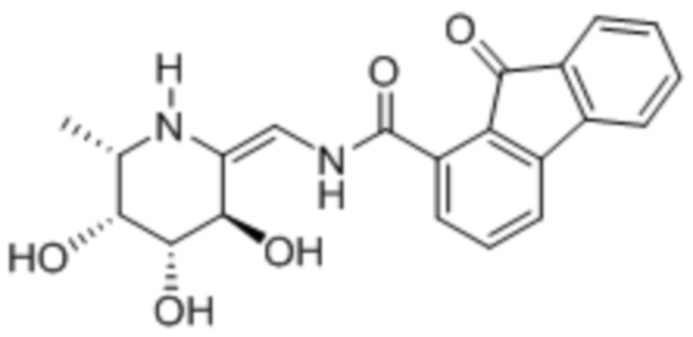
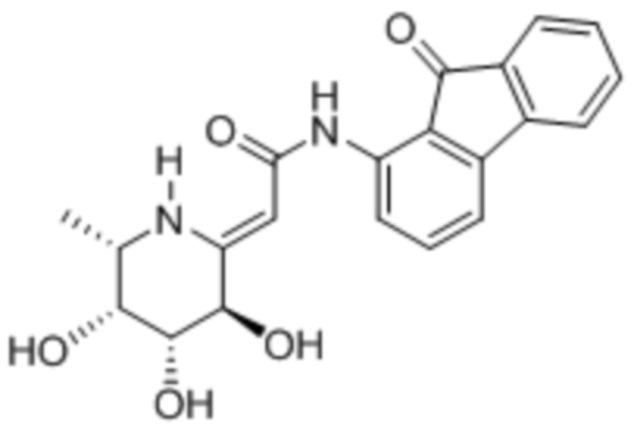
[0020] В некоторых вариантах осуществления соединение формулы I имеет следующую структуру:
[0021] В некоторых вариантах осуществления соединение формулы I имеет следующую структуру:
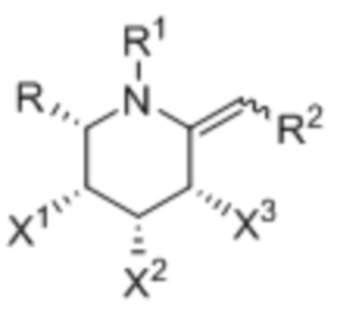
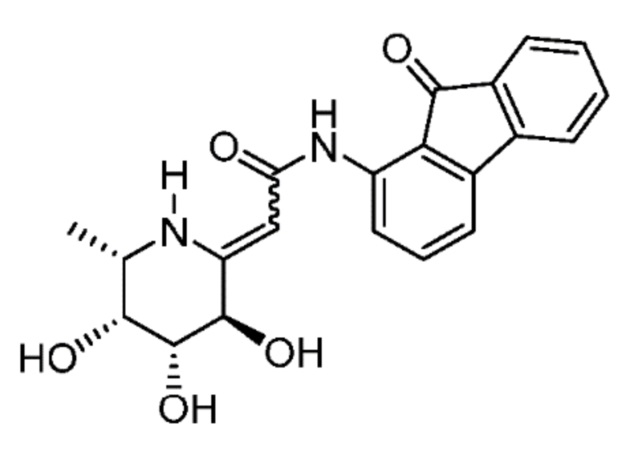
[0022] В некоторых вариантах осуществления соединение выбрано из группы, включающей:
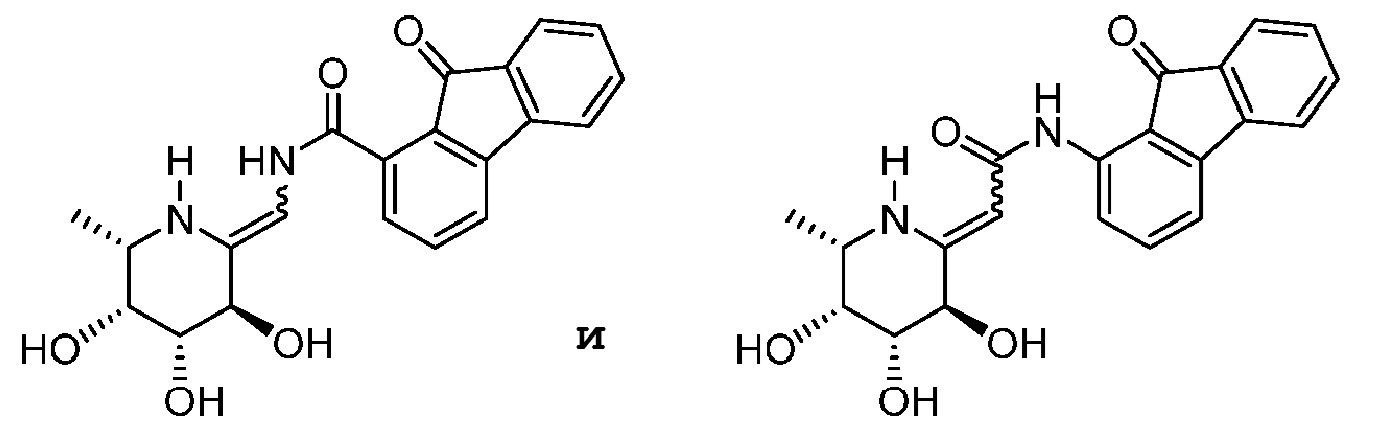
[0023] В некоторых вариантах осуществления соединение выбрано из группы, включающей:

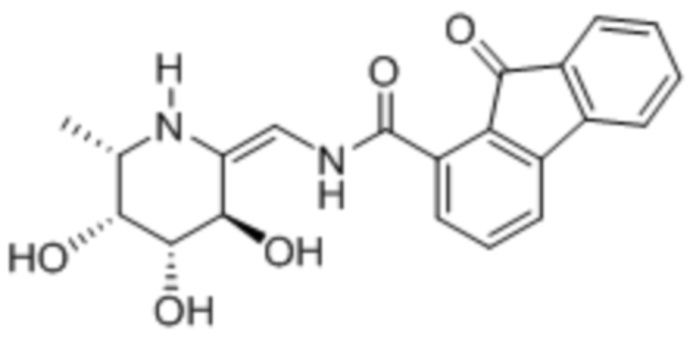
[0024] В некоторых вариантах осуществления соединение выбрано из группы, включающей:
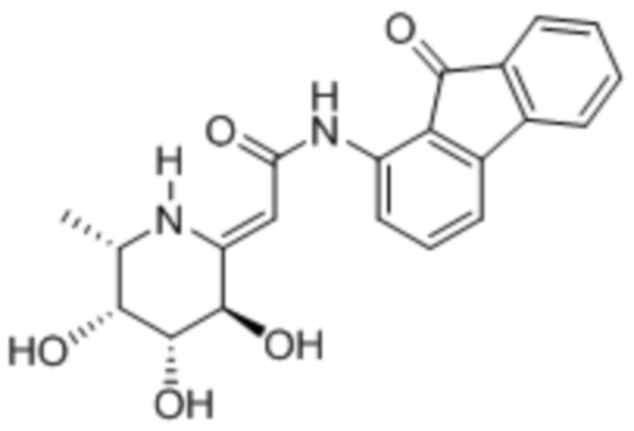
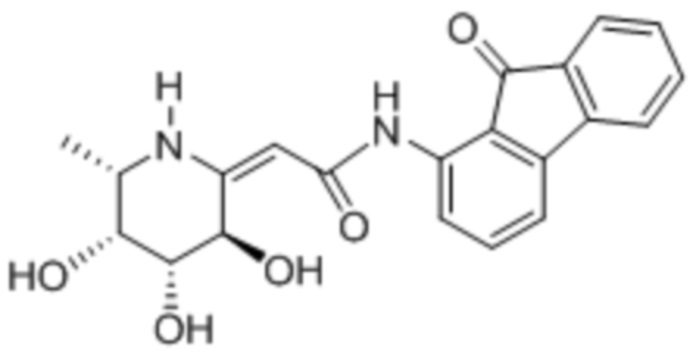
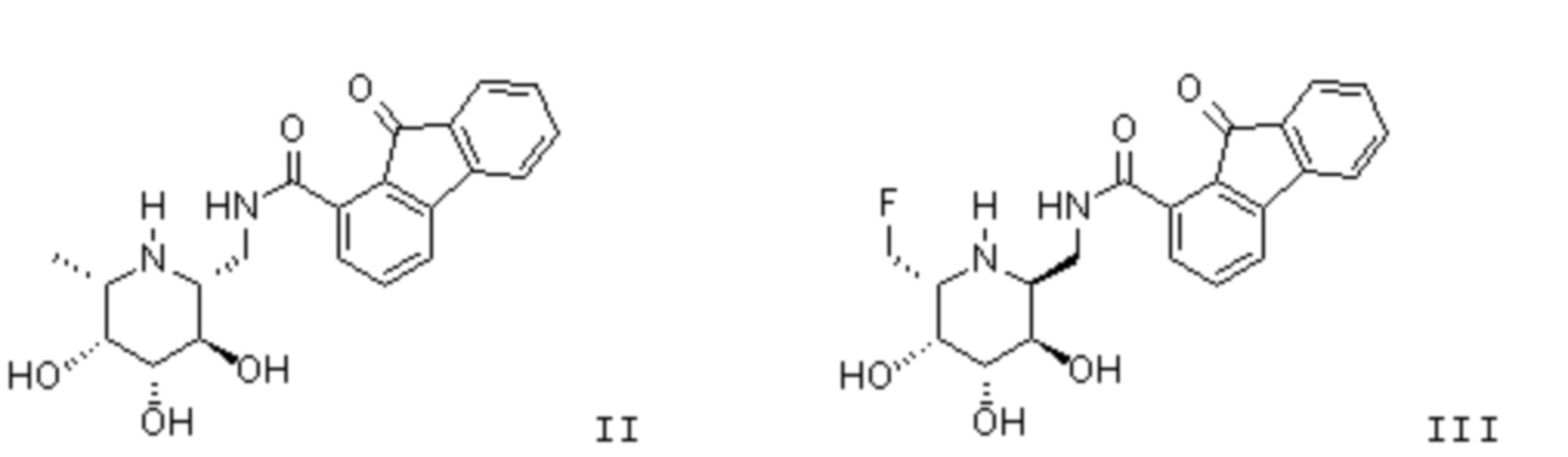
[0025] В другом аспекте изобретения предлагается способ лечения опухоли или ракового заболевания у нуждающегося в этом пациента, включающий введение описанного здесь соединения в терапевтически эффективном количестве. В различных вариантах осуществления соединение представляет собой соединение II или соединение III:
[0026] В различных вариантах осуществления опухоль или раковое заболевание представляет собой рак печени, рак молочной железы, меланому, рак легкого, лейкемию, рак поджелудочной железы, рак желудка, колоректальный рак и рак головы и шеи.
[0027] В различных вариантах осуществления соединение снижает метастаз опухолей у субъекта. Еще в одном варианте в результате лечения уменьшается размер опухоли у субъекта.
[0028] В некоторых вариантах осуществления опухоль представляет собой опухоль печени и является результатом гепатоцеллюлярной карциномы, инфицирования вирусом гепатита, цирроза, токсического поражения печени и наследственного гемохроматоза.
[0029] В родственном варианте осуществления опухоль печени является результатом гепатоцеллюлярной карциномы.
[0030] В другом варианте осуществления в результате лечения снижаются уровни альфа-фетопротеина в крови субъекта по сравнению с уровнями до лечения.
[0031] В некоторых вариантах осуществления соединение вводят внутривенно. В родственном варианте осуществления соединение вводят через печеночную артерию. В некоторых вариантах осуществления соединение вводят в дозах в диапазоне от 0,02 до 2000 мг/кг или от 0,1 до 100 мг/кг, например, от 1 до 1500 мг/кг, от 10 до 1000 мг/кг, от 25 до 500 мг/кг, от 50 до 250 мг/кг, от 75 до 200 мг/кг, от 50 до 150 мг/кг, от 60 до 130 мг/кг, от 70 до 110 мг/кг, от 75 до 100 мг/кг, от 80 до 95 мг/кг, от 85 до 90 мг/кг, от 100 до 250 мг/кг, от 120 до 230 мг/кг, от 130 до 220 мг/кг, от 140 до 210 мг/кг, от 150 до 200 мг/кг, от 160 до 190 мг/кг, от 170 до 180 мг/кг, примерно 87,5 мг/кг или примерно 175 мг/кг.
[0032] В некоторых вариантах осуществления соединение вводят в комбинации со вторым агентом. В некоторых вариантах осуществления второй агент выбран из группы, включающей химиотерапевтический агент, цитотоксический агент, радиоизотоп, противовирусный агент, противогрибковый агент, противовоспалительный агент и антитело. В родственном варианте осуществления химиотерапевтический агент выбран из группы, включающей доксорубицин и 5-фторурацил.
[0033] Еще в одном варианте второй агент является цитотоксическим агентом. В некоторых вариантах осуществления цитотоксический агент выбран из группы, включающей мехлорэтамин гидрохлорид, циклофосфамид, ифосфамид, хлорамбуцил, мелфалан, бусульфан, тиотепа, кармустин, ломустин, дакарбазин и стрептозоцин.
[0034] В другом варианте осуществления второй агент является радиоизотопом. В некоторых вариантах осуществления радиоизотоп выбран из группы, включающей131I,125I,111In,90Y,67Cu,127Lu,212Bi,213Bi,255Fm,149Tb,223Rd,213Pb,212Pb,211At,89Sr,153Sm,166Ho,225Ac,186Re,67Ga,68Ga и99mTc.
[0035] В одном варианте осуществления образование опухоли связано с инфицированием вирусом гепатита, и второй агент является противовирусным агентом.
[0036] Предполагается также применение любого из раскрытых здесь и описанных выше соединений с целью получения лекарства для лечения любого из описанных здесь опухолевых или раковых заболеваний. Также композиция, содержащая описанное здесь соединение, предполагается для применения с целью лечения опухоли или ракового заболевания. Рассматриваются также шприцы, например, шприцы для разового использования или предварительно заполненные, стерильные запечатанные контейнеры, например, пузырьки, флаконы, сосуды и/или наборы или упаковки, содержащие любое из описанных выше соединений, необязательно с соответствующими инструкциями по применению.
[0037] Любое из описанных здесь выше соединений можно вводить одновременно с любыми известными в данной области или описанными здесь агентами, подходящими для лечения опухоли или ракового заболевания, в качестве дополнительной терапии. Также рассматриваются композиции, содержащие любое из описанных выше соединений вместе с другими терапевтическими агентами (например, агентами для терапии печени).
[0038] Понятно, что каждый описанный здесь признак, или вариант осуществления, или комбинация является неограничительным иллюстративным примером какого-либо из аспектов изобретения, и считается, что как таковой, его можно комбинировать с любым другим описанным здесь признаком, или вариантом осуществления, или комбинацией. Например, если признаки описаны с формулировкой «один вариант осуществления», «некоторые варианты осуществления», «еще один вариант осуществления», «конкретные типичные варианты осуществления» и/или «другой вариант осуществления», то каждый из этих типов вариантов осуществления является неограничительным примером признака, который, как предполагается, будет комбинирован с любым другим признаком или описанной здесь комбинацией признаков без перечисления каждой вероятной комбинации. Такие признаки или комбинации признаков применяют к любому из аспектов изобретения. Если раскрыты примеры величин в пределах диапазонов, то предполагается, что любые из этих примеров являются вероятными конечными точками диапазона, рассматривается любое и все числовые значения между такими конечными точками и любая и все комбинации верхних и нижних конечных точек.
Краткое описание фигур
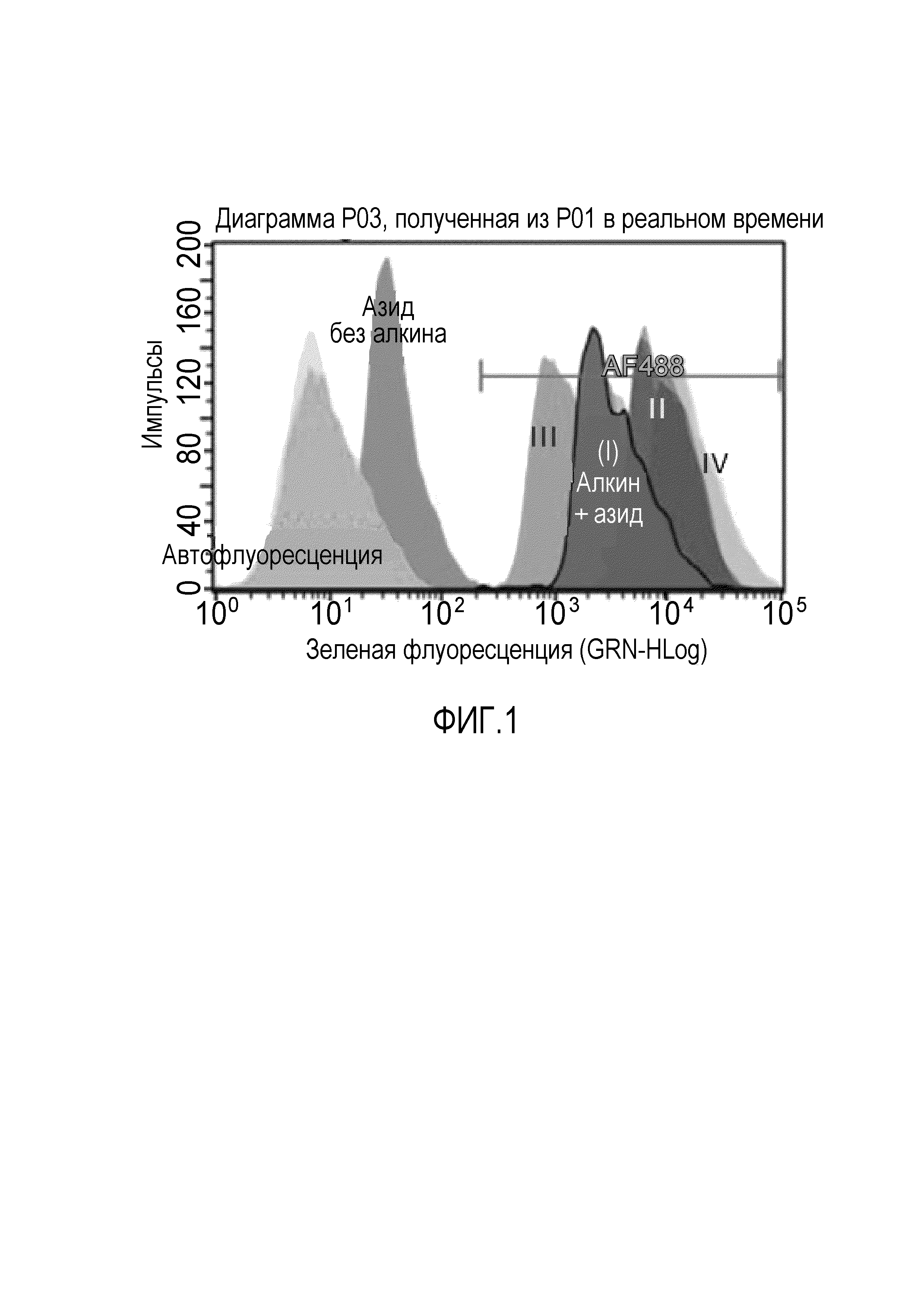
[0039] На ФИГ. 1 представлен график, показывающий нарушения метаболизма гликопротеинов в клетках HepG2, инкубированных с соединениями II, III и IV.
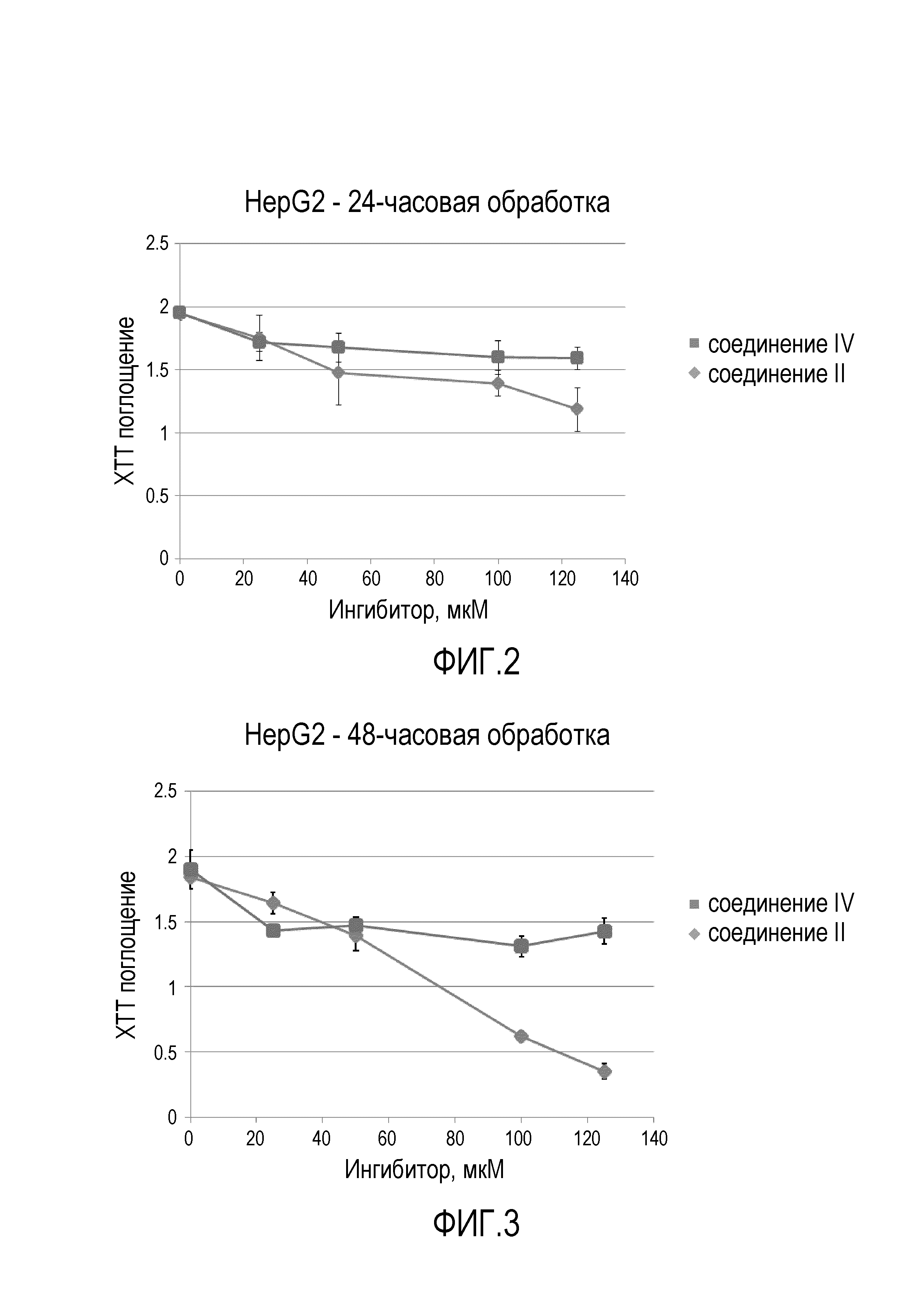
[0040] На ФИГ. 2 представлен график, показывающий цитотоксичность соединений II и IV в клетках HepG2 после 24-часовой обработки.
[0041] На ФИГ. 3 представлен график, показывающий цитотоксичность соединений II и IV в клетках HepG2 после 48-часовой обработки.
Подробное описание
[0042] Настоящее изобретение касается соединений и применений таких соединений в качестве ингибиторов фукозидазы (например, соединений, которые ингибируют активность альфа-L-фукозидазы по отщеплению от гликопротеинов фукозных остатков). Настоящее изобретение также касается применений таких соединений для лечения опухолей или раковых заболеваний, таких как опухоли печени, в частности гепатоцеллюлярной карциномы. Без связи с теорией изобретения, ингибиторы фукозидазы вызывают накопление в лизосоме олигосахарида, производного гликопртеина, аналогичное эффектам лизосомной болезни накопления в клетке печени, индуцируя тем самым цитотоксический процесс в клетках.
Определения
[0043] Используемые здесь и в приложенной формуле изобретения формы единственного числа включают множественное число, пока контекст ясно не диктует иное. Таким образом, например, ссылка на «производное» включает множество таких производных, и ссылка на «пациента» включает ссылку на одного или большее количество пациентов и т.д.
[0044] Также использование союза «или» означает «и/или», пока не указано по-другому. Аналогично, выражения «содержат», «содержит», «содержащий», «включают», «включает» и «включающий» являются взаимозаменяемыми и, как предполагается, неограничительными.
[0045] Ясно также, что при использовании в описаниях различных вариантов осуществления термина «содержащий» специалисты в данной области обычно понимают, что в некоторых конкретных случаях вариант осуществления можно описать по-другому, используя выражение «состоящий главным образом из» или «состоящий из».
[0046] Если не определено иначе, все используемые здесь технические и научные термины имеют такое значение, как обычно понимает рядовой специалист в области, к которой принадлежит это изобретение. Здесь описаны типичные способы, приборы и материалы, хотя в практике раскрытых способов и продуктов можно применять способы и материалы, аналогичные или эквивалентные описанным здесь.
[0047] Обсуждаемые выше и всюду по тексту документы приведены единственно с целью их раскрытия до даты регистрации настоящей заявки. Ничто здесь не должно быть истолковано как признание, что заявители не имеют права датировать задним числом такое изобретение на основании предшествующего изобретения. Каждый документ включен в виде ссылки во всей своей полноте при особом внимании к раскрытию, ради которого он цитирован.
[0048] Следующие ссылки обеспечивают специалиста общим определением многих терминов, используемых в этом раскрытии: Singleton, et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY (2d ed. 1994); THE CAMBRIDGE DICTIONARY OF SCIENCE AND TECHNOLOGY (Walker ed., 1988); THE GLOSSARY OF GENETICS, 5TH ED., R. Rieger, et al. (eds.), Springer Verlag (1991); и Hale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY (1991).
[0049] Используемое здесь выражение «терапевтически эффективное количество» или «эффективное количество» относится к количеству соединения, достаточному для облегчения симптомов, например, лечения, исцеления, предупреждения или облегчения соответствующего медицинского состояния, или повышения скорости лечения, исцеления, предупреждения или облегчения таких состояний, обычно обеспечивая статистически существенное улучшение в подвергаемой лечению популяции пациентов. При указании индивидуального активного ингредиента, который вводят сам по себе, терапевтически эффективная доза относится только к одному этому ингредиенту. При указании комбинации терапевтически эффективная доза относится к объединенным количествам активных ингредиентов, которые дают терапевтический эффект, вводятся ли они в комбинации, в том числе последовательно или одновременно. В некоторых вариантах осуществления, например, при жировой болезни печени, терапевтически эффективное количество соединения облегчает один или несколько симптомов, включая, но не ограничиваясь этим, фиброз печени, жирность печени, заболеваемость или прогрессирование цирроза, заболеваемость гепатоцеллюлярной карциномой, повышенные уровни аминотрансфераз печени, таких как ALT и AST, повышенный ферритин сыворотки, повышенные уровни гамма-глютамилтрансферазы (гамма-GT) и повышенные уровни инсулина, холестерина и триглицеридов плазмы.
[0050] Используемое здесь выражение «опухоль печени» включает первичные опухоли, и/или новообразования, и/или метастазы, которые развиваются в или на печени или физически связаны с печенью. Выражение также включает метастазы опухолей печени, которые мигрируют куда-то в другое место в организме, но остаются восприимчивыми к раскрытым здесь соединениям. Известны многие типы таких опухолей и новообразований. Первичные опухоли печени включают гепатоцеллюлярную карциному и другие опухоли, известные в данной области. Такие опухоли обычно являются солидными опухолями или диффузными опухолями с накоплениями, локализованными в печени. Опухоли или новообразования для лечения согласно изобретению могут быть злокачественными или доброкачественными и могут представлять собой опухоли, ранее подвергаемые лечению химиотерапией, облучением и/или другому лечению.
[0051] Используемые здесь термины «опухоли», или «новообразования», или «рак» включают первичные опухоли и/или метастазы. Опухоли включают, например, карциномы яичников, шейки матки, предстательной железы, молочной железы, легких, толстой кишки или желудка и их метастазы в печени.
[0052] Термин «лечение» касается профилактического лечения или терапевтического лечения. В некоторых вариантах осуществления «лечение» касается введения соединения или композиции субъекту в терапевтических или профилактических целях.
[0053] «Терапевтическое» лечение - это лечение, принимаемое субъектом, который демонстрирует признаки или симптомы патологии, с целью ослабления или устранения этих признаков или симптомов. Признаки или симптомы могут быть биохимическими, клеточными, гистологическими, функциональными или физическими, субъективными или объективными.
[0054] «Профилактическое» лечение - это лечение, принимаемое субъектом, который не демонстрирует признаков заболевания или демонстрирует только легкие признаки заболевания, с целью снижения риска развития патологии. Соединения или композиции по изобретению можно давать в качестве профилактического лечения для снижения вероятности развития патологии или минимизации тяжести патологии в случае развития.
[0055] Термин «диагностический» означает идентифицирующий наличие, степень и/или природу патологического состояния. Диагностические способы различаются специфичностью и селективностью. Несмотря на то, что конкретный диагностический метод может не дать окончательного диагноза состояния, он достаточен, если метод обеспечивает положительное указание, что способствует диагностике.
[0056] Выражение «фармацевтическая композиция» относится к композиции, пригодной для фармацевтического применения в отношении подвергаемого лечению животного, включая людей и млекопитающих. Фармацевтическая композиция содержит терапевтически эффективное количество соединения по изобретению, необязательно другой биологически активный агент и необязательно фармацевтически пригодный наполнитель, носитель или разбавитель. В варианте осуществления фармацевтическая композиция включает композицию, содержащую активный ингредиент(ы) и инертный ингредиент(ы), который составляет носитель, а также любой продукт, который прямо или косвенно получается в результате комбинирования, комплексообразования или агрегации любых двух или большего количества ингредиентов, или в результате диссоциации одного или большего количества ингредиентов, или в результате других типов реакций или взаимодействий одного или большего количества ингредиентов. Таким образом, фармацевтические композиции по настоящему изобретению включают любую композицию, полученную смешиванием соединения по изобретению и фармацевтически пригодного наполнителя, носителя или разбавителя.
[0057] Выражение «фармацевтически пригодный носитель» относится к любым стандартным фармацевтическим носителям, буферам и подобному, например, физиологический раствор с фосфатным буфером, 5% водный раствор декстрозы и эмульсии (например, эмульсия масло/вода или вода/масло). Неограничительные примеры наполнителей включают адъюванты, связующие, наполнители, разбавители, разрыхлители, эмульгирующие агенты, увлажняющие агенты, лубриканты, вещества, способствующие скольжению, подслащающие агенты, ароматизаторы и красители. Подходящие фармацевтические носители, наполнители и разбавители описаны в Remington's Pharmaceutical Sciences, 19th Ed. (Mack Publishing Co., Easton, 1995). Предпочтительные фармацевтические носители зависят от предполагаемого способа введения активного агента. Типичные способы введения включают энтеральное введение (например, пероральное) или парентеральное введение (например, подкожную, внутримышечную, внутривенную или внутрибрюшинную инъекцию; или локальное, трансдермальное или чресслизистое введение).
[0058] «Фармацевтически пригодная соль» представляет собой соль, которую можно представить в виде соединения для фармацевтического применения, включающего, но не ограниченного этим, соли металлов (например, натрия, калия, магния, кальция и т.д.) и соли аммония или органических аминов.
[0059] Используемое здесь выражение «фармацевтически пригодный» или «фармакологически пригодный» обозначает материал, который не является нежелательным, биологически или по другой причине, то есть материал, который можно вводить индивидууму, не вызывая никаких нежелательных биологических эффектов, или без взаимодействия вредным образом с каким-либо компонентом композиции, где он содержится, или с какими-либо компонентами, присутствующими на теле или в организме индивидуума.
[0060] Используемый здесь термин «стандартная дозированная форма» относится к физически дискретным единицам, пригодным в качестве единичных доз для пациентов людей и животных, причем каждая единица содержит предварительно определенное количество соединения по изобретению, рассчитанное как количество, достаточное для производства желательного эффекта, необязательно в сочетании с фармацевтически пригодным наполнителем, разбавителем, носителем или транспортным средством. Спецификации для новых стандартных дозированных форм по настоящему изобретению зависят от конкретного используемого соединения, эффекта, которого следует достичь, и фармакодинамики, связанной с каждым соединением в организме-носителе.
[0061] Используемый здесь термин «субъект» включает млекопитающих. Примеры млекопитающих включают, но не ограничены этим, любого члена класса млекопитающих: людей, приматов, отличных от людей, таких как шимпанзе и другие человекообразные и виды обезьян; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы, свиньи; домашних животных, таких как кролики, собаки и кошки; лабораторных животных, включая грызунов, таких как крысы, мыши и морские свинки, и подобных. Данный термин не указывает конкретный возраст или пол. В различных вариантах осуществления субъектом является человек. В различных вариантах осуществления субъектом является ребенок или подросток.
Альфа-L-Фукозидаза
[0062] Фермент альфа-L-фукозидаза (Genbank, инвентарный № NP_000138, включено здесь в виде ссылки) обычно участвует в расщеплении длинных цепей сахаров (олигосахаридов) в лизосоме. Если фермент отсутствует, цепи сахаров аккумулируются, и со временем это приводит к клиническим признакам фукозидоза. Фукозидоз является аутосомной рецессивной лизосомной болезнью накопления, вызванной недостатком альфа-L-фукозидазы с накоплением в тканях сахара фукозы. Смотри, например, работу Johnson et al., Biochem. Biophys. Res. Commun. 133:90-7, 1986. Разные фенотипы включают такие клинические признаки как неврологическое расстройство, задержка роста, висцеромегалия и эпилептические припадки в тяжелой ранней форме; грубые черты лица, диффузную ангиокератому туловища, спастическое состояние мышц и задержку психомоторного развития в более длительной форме.
[0063] Фукозидоз можно детектировать, применяя генетические тесты для идентификации мутации в гене фукозидазы. Фукозидоз также диагностируют по повышенным уровням фукозилированных белков в моче пациентов с фукозидозом (Michalski et al., Eur J Biochem. 201: 439-58, 1991).
[0064] Альфа-L-фукозидаза при повышенных уровнях детектируется в гепатоцеллюлярной карциноме и является, как предполагают, маркером для HCC (Giardina et al., Рак 70:1044-48, 1992).
Ингибиторы фукозидазы
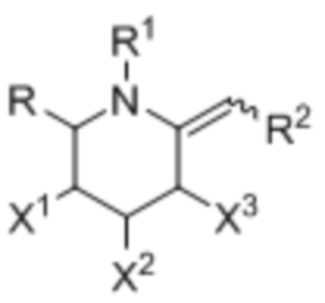
[0065] Изобретение касается соединений, которые препятствуют ферментативной активности фукозидазы по гидролизу углеводных связей. Соединения имеют структуру, представленную формулой I:

где:
X1, X2, и X3 независимо выбраны из группы, включающей OH, атом галогена и O(C)OCH3;
R выбран из группы, включающей C1-3алкил и C1-3галогеналкил; R1 выбран из группы, включающей H, C1-3алкил, OH, ―CO2C1-3алкил;
R2 выбран из группы, включающей -NRbC(O)Ra, -NRbC(O)ORa, -NRbC(O)NRcRa, -NRbC(O)SRa, -C(O)Ra и -C(O)NRbRa;
Rаобозначает ―C0-3алкилен-G;
G выбран из группы, включающей арил, гетероарил, циклоалкил и гетероциклоалкил; и
Rb и Rc независимо выбраны из группы, включающей H и C1-3алкил.
[0066] В некоторых случаях X1, X2 и X3 обозначают OH, R обозначает метил и/или R1 обозначает H. В некоторых случаях R2 обозначает ―NRbC(O)Ra или ―C(O)NRbRa. В некоторых случаях Rb обозначает H.
[0067] Подходящие группы G включают, но не ограничены этим, необязательно замещенный индолил, бензотиофенил, флуоренил, инденил, дигидроинденил и фенил. Например, группы G включают необязательно замещенный фенил и

где A обозначает 5-, 6-, 7-, 8-, 9- или 10-членную карбоциклическую или гетероциклическую кольцевую систему.
[0068] Группы G также включают, но не ограничены этим,
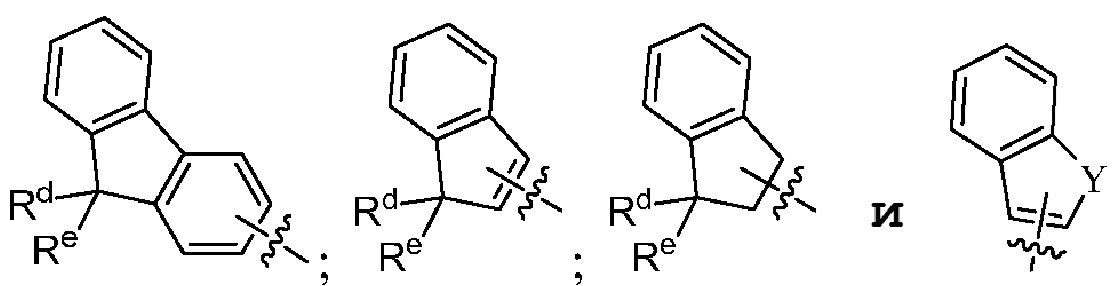
где Rd и Re независимо выбраны из группы, включающей H, ORf, NRfRg, C1-3алкил и C1-5циклоалкил; или
Rd и Re, взятые вместе с атомом углерода, к которому они присоединены, образуют C=O;
Rf и Rg независимо выбраны из группы, включающей H и C1-3алкил; и
Y выбран из группы, включающей NH, N-C1-3алкил, S, SO, SO2 и O.
[0069] Примеры групп G включают, но не ограничены этим, следующие группы:

[0070] Примеры групп Ra включают, но не ограничены этим, следующие группы:
[0071] В некоторых случаях соединение формулы I имеет следующую структуру:

[0072] В некоторых случаях соединение формулы I имеет следующую структуру:

[0073] Подходящие соединения включают, но не ограничены этим:

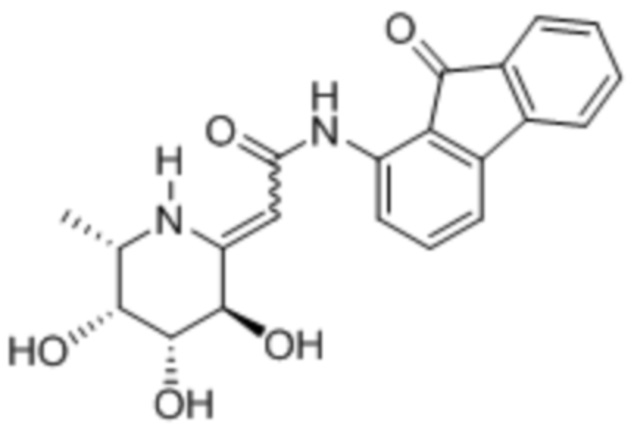
[0074] Примеры соединений также включают, но не ограничены этим:
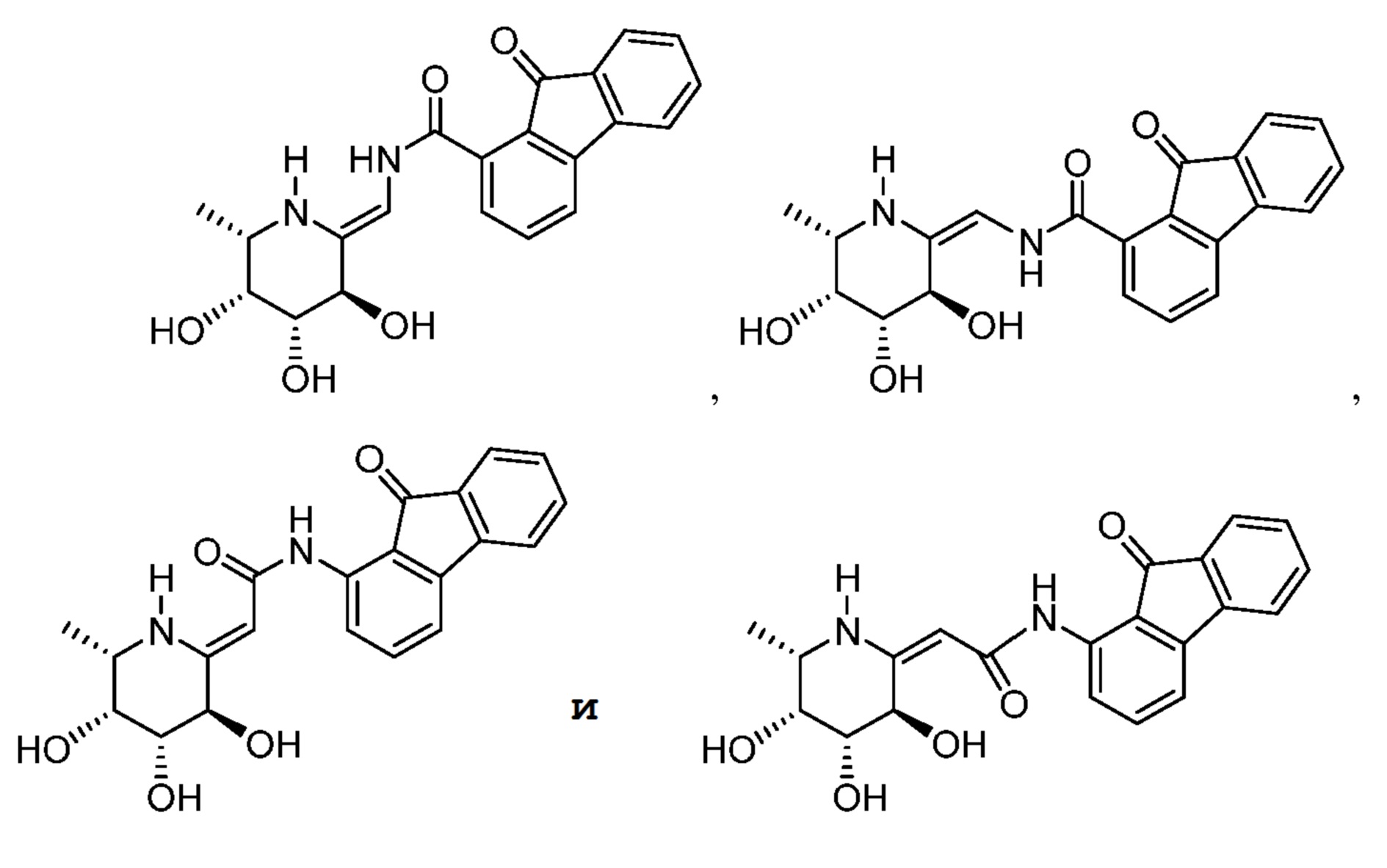
Способы применения, фармацевтические композиции и введение
[0075] Соединения можно приготовить в виде препаратов для инъекций, растворяя, суспендируя или эмульгируя их в водном или неводном растворителе, таком как растительные или другие аналогичные масла, синтетические глицериды алифатических кислот, сложные эфиры высших алифатических кислот или пропиленгликоль; и, если требуется, с общепринятыми добавками, такими как солюбилизаторы, изотонические агенты, суспендирующие агенты, эмульгирующие агенты, стабилизаторы и консерванты.
[0076] Соединения можно использовать в аэрозольном препарате для введения путем ингаляции. Соединения по настоящему изобретению можно приготовить в находящихся под давлением подходящих пропеллентах, таких как дихлордифторметан, пропан, азот и подобные.
[0077] Стандартные дозированные формы для инъекции или внутривенного введения могут содержать соединение в композиции в виде раствора в стерильной воде, стерильном стандартном физиологическом растворе или другом стерильном фармацевтически пригодном носителе.
[0078] Для конкретного применения описанные здесь соединения в качестве активного ингредиента можно комбинировать с фармацевтическим носителем в виде однородной смеси по общепринятым методикам приготовления фармацевтических препаратов. Носитель может иметь большое разнообразие форм в зависимости от формы препарата, желательной для введения, например, перорального или парентерального (в том числе внутривенного).
[0079] Что касается трансдермальных способов введения, способы трансдермального введения лекарств раскрыты в Remington's Pharmaceutical Sciences, 17th Edition, (Gennaro et al. Eds. Mack Publishing Co., 1985). Дермальные или кожные пластыри представляют собой средства для трансдермальной доставки соединений, пригодных в способах изобретения. Пластыри предпочтительно доставляют усилитель абсорбции, например, ДМСО, повышающий абсорбцию соединений. Другие способы трансдермальной доставки лекарств раскрыты в патентах США №№ 5962012, 6261595 и 6261595, каждый из которых включен в виде ссылки во всей своей полноте.
[0080] Фармацевтически пригодные наполнители, такие как транспортные средства, адъюванты, носители или разбавители, являются коммерчески доступными. Также коммерчески доступными являются фармацевтически пригодные вспомогательные вещества, такие как регуляторы pH и буферные агенты, агенты, регулирующие тоничность, стабилизаторы, увлажняющие агенты и подобные.
[0081] Специалисты легко оценят, что уровни доз можно варьировать как функцию конкретного соединения, тяжести симптомов и восприимчивости субъекта к побочным эффектам. Специалист в данной области легко определит предпочтительные дозы для данного соединения разнообразными способами, включая, но не ограничиваясь этим, реакцию на дозу и фармакокинетические оценки, проведенные на пациентах, подопытных животных и in vitro.
[0082] В каждом таком аспекте композиции включают, но не ограничены этим, композиции, подходящие для перорального, ректального, локального, парентерального (включая подкожное, внутримышечное и внутривенное), пульмонального (назальной или буккальной ингаляции) или назального введения, хотя наиболее подходящий способ в любом данном случае будет зависеть частично от природы и тяжести состояний, подлежащих лечению, и от природы активного ингредиента. Типичными способами введения являются пероральный и внутривенный способы. Композиции можно легко представить в виде стандартной дозированной формы и приготовить любыми способами, хорошо известными в данной области фармацевтики.
[0083] Композиции по настоящему изобретению можно вводить инкапсулированными или присоединенными к вирусным конвертам или пузырькам, или включенными в клетки. Пузырьки представляют собой мицеллярные частицы, которые обычно являются сферическими и часто липидными. Липосомы представляют собой пузырьки, образованные из двухслойной мембраны. Подходящие пузырьки включают, но не ограничены этим, однослойные пузырьки и многослойные липидные пузырьки или липосомы. Такие пузырьки и липосомы можно получить из широкого разнообразия липидных или фосфолипидных соединений, таких как фосфатидилхолин, фосфатидная кислота, фосфатидилсерин, фосфатидилэтаноламин, сфингомиелин, гликолипиды, ганглиозиды и т.д., применяя стандартные методики, такие как методики, описанные, например, в патенте США № 4394448. Такие пузырьки или липосомы можно использовать для введения соединений внутриклеточно и доставки соединений к целевым органам. Применяя инкапсуляцию, можно также обеспечить регулируемое высвобождение рассматриваемых композиций (смотри, например, патент США № 5186941).
[0084] Можно применять любой способ введения, который доставляет соединение в сыворотку крови. Предпочтительно вводят композицию парентерально, наиболее предпочтительно внутривенно. В некоторых вариантах осуществления композицию вводят через воротную вену. Также приемлемы инъекции в яремную вену и сонную артерию. Композиции можно вводить локально или регионально, например, внутрибрюшинно, или подкожно, или внутримышечно. В одном аспекте композиции вводят с подходящим фармацевтическим разбавителем или носителем.
[0085] Предполагаемые к введению дозы зависят от потребностей индивидуума, желательного эффекта, используемого активного агента и выбранного способа введения. Предпочтительны дозы соединения в диапазоне примерно от 0,2 пмоль/кг до примерно 25 нмоль/кг, и в частности предпочтительны дозы в диапазоне 2-250 пмоль/кг; в альтернативных вариантах предпочтительными могут быть дозы соединения в диапазоне от 0,02 до 2000 мг/кг или от 0,1 до 100 мг/кг, например, от 1 до 1500 мг/кг, от 10 до 1000 мг/кг, от 25 до 500 мг/кг, от 50 до 250 мг/кг, от 75 до 200 мг/кг, от 50 до 150 мг/кг, от 60 до 130 мг/кг, от 70 до 110 мг/кг, от 75 до 100 мг/кг, от 80 до 95 мг/кг, от 85 до 90 мг/кг, от 100 до 250 мг/кг, от 120 до 230 мг/кг, от 130 до 220 мг/кг, от 140 до 210 мг/кг, от 150 до 200 мг/кг, от 160 до 190 мг/кг, от 170 до 180 мг/кг, примерно 87,5 мг/кг или примерно 175 мг/кг.
[0086] Соединения по изобретению подходят для терапевтического, профилактического и диагностического вмешательства у животных, например, млекопитающих и в частности людей.
[0087] Рассматриваемые способы находят применение для лечения различных болезненных состояний. Специфические болезненные состояния, поддающиеся лечению рассматриваемыми соединениями, разнообразны. Таким образом, болезненные состояния, которые оказывают воздействие на печень и поддаются лечению способами по изобретению, включают клеточные пролиферативные заболевания, такие как опухолевые заболевания, аутоиммунные заболевания, заболевания с гормональными отклонениями, дегенеративные заболевания, старческие заболевания и подобные, результатом которых может быть рост опухоли печени.
[0088] Считают, что лечение включает любой благотворный для субъекта результат, связанный с введением соединения, в том числе пониженную вероятность приобретения болезни, предупреждение болезни, замедление, прекращение или реверсию прогрессирования болезни или облегчение симптомов, связанных с болезненным состоянием, поражающим организм-носитель, где выражение «облегчение» или «польза» используют в широком смысле для обозначения, по меньшей мере, снижения величины параметра, например, симптома, связанного с патологическим состоянием, подлежащим лечению, таким как воспаление и боль, с ним связанные. По существу лечение также включает ситуации, когда патологическое состояние или, по меньшей мере, связанные с ним симптомы полностью подавлены, например, предотвращены или приостановлены, например, прекращены, так что организм-носитель больше не страдает от патологического состояния, или, по меньшей мере, от симптомов, которые характеризуют патологическое состояние.
Рак
[0089] Здесь предполагается, что ингибиторы фукозидазы подходят для лечения раковых заболеваний, чувствительных, как определено, к лечению ингибитором фукозидазы. Предполагается, что описанные здесь способы подходят для идентификации раковых заболеваний, которые невосприимчивы к лечению ингибиторами фукозидазы. Типичные раковые заболевания включают, но не ограничены этим, адренокортикальную карциному, СПИД-связанные раковые заболевания, СПИД-связанную лимфому, анальный рак, аноректальный рак, рак анального канала, рак аппендикса, церебеллярную астроцитому у детей, церебральную астроцитому у детей, базальную клеточную карциному, рак кожи (не меланому), билиарный рак, внепеченочный рак желчных протоков, внутрипеченочный рак желчных протоков, рак мочевого пузыря, рак костей и суставов, остеосаркому и злокачественную фиброзную гистиоцитому, рак головного мозга, опухоль головного мозга, глиому ствола головного мозга, церебеллярную астроцитому, церебральную астроцитому/злокачественную глиому, эпендимому, медуллобластому, супратенториальные примитивные нейроэктодермальные опухоли, глиому зрительного пути и гипоталамическую глиому, рак молочной железы, включая тройной негативный рак молочной железы, бронхиальные аденомы/карциноиды, карциноидную опухоль, желудочно-кишечный рак, рак нервной системы, лимфому нервной системы, рак центральной нервной системы, лимфому центральной нервной системы, рак шейки матки, детские раковые заболевания, хроническую лимфоцитарную лейкемию, хроническую миелогенную лейкемию, хронические миелопролиферативные расстройства, рак толстой кишки, колоректальный рак, кожную Т-клеточную лимфому, лимфоидное новообразование, грибовидный микоз, синдром Сезари, эндометриальный рак, рак пищевода, экстракраниальную опухоль зародышевых клеток, экстрагональную опухоль зародышевых клеток, внепеченочный рак желчных протоков, рак глаз, внутриглазную меланому, ретинобластому, рак желчного пузыря, рак желудка, желудочно-кишечную карциноидную опухоль, желудочно-кишечную стромальную опухоль (GIST), опухоль из зародышевых клеток, опухоль из зародышевых клеток яичника, гестационную трофобластическую опухолевую глиому, рак головы и шеи, гепатоклеточный (печени) рак, лимфому Ходжкина, гипофарингеальный рак, внутриглазную меланому, глазной рак, опухоли островковых клеток (эндокринная поджелудочная железа), саркому Капоши, рак почки, ларингеальный рак, острый лимфобластный лейкоз, острый миелоидный лейкоз, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, лейкоз волосистой клетки, рак губы и полости рта, рак печени, рак легкого, немелкоклеточный рак легкого, мелкоклеточный рак легкого, СПИД-связанную лимфому, неходжкинскую лимфому, первичную лимфому центральной нервной системы, макроглобулинемию Вальденстрема, медуллобластому, меланому, внутриглазную (глазную) меланому, карциному меркелевых клеток, мезотелиому злокачественную, мезотелиому, метастатический плоскоклеточный рак шеи, рак ротовой полости, рак языка, синдром множественной эндокринной неоплазии, фунгоидный микоз, миелодиспластические синдромы, миелодиспластические/миелопролиферативные заболевания, хронический миелогенный лейкоз, острый миелоидный лейкоз, множественную миелому, хронические миелопролиферативные расстройства, носоглоточный рак, нейробластому, рак полости рта, рак ротоглотки, рак яичников, эпителиальный рак яичников, низко злокачественную скрытую опухоль яичников, рак поджелудочной железы, рак островковых клеток поджелудочной железы, рак околоносовой пазухи и полости носа, рак паращитовидной железы, рак полового члена, фарингеальный рак, феохромоцитому, пинеалобластому и супратенториальные примитивные нейроэктодермальные опухоли, опухоль гипофиза, плазмоклеточное новообразование/множественную миелому, плевролегочную бластому, рак предстательной железы, ректальный рак, переходно-клеточный рак почечной лоханки и мочеточника, ретинобластому, рабдомиосаркому, рак слюнной железы, семейство Юинга опухолей саркомы, саркому мягких тканей, рак матки, саркому матки, рак кожи (немеланому), рак кожи (меланому), карциному кожи из клеток меркеля, рак тонкой кишки, плоскоклеточную карциному, рак желудка (желудочный), тестикулярный рак, рак гортани, тимому и карциному вилочковой железы, рак щитовидной железы, переходно-клеточный рак почечной лоханки, мочеточника и других органов мочевыделения, гестационную трофобластическую опухоль, уретральный рак, эндометриальный рак матки, саркому матки, рак тела матки, вагинальный рак, рак вульвы и опухоль Вилмса. В некоторых вариантах осуществления рак выбран из группы, включающей меланому, рак ободочной и прямой кишки, рак поджелудочной железы, рак мочевого пузыря, рак молочной железы, тройной негативный рак молочной железы, рак яичников и рак легкого.
[0090] В различных вариантах осуществления опухоль или раковое заболевание представляет собой рак печени, рак молочной железы, меланому, рак легкого, лейкемию, рак поджелудочной железы, рак желудка, колоректальный рак или рак головы и шеи.
Болезни печени
[0091] Рассматриваемые в изобретении болезни печени или расстройства печени, включают, но не ограничены этим, расстройства, обсуждаемые ниже. Гепатоцеллюлярная карцинома или гепатома является пятым наиболее распространенным раковым заболеванием в мире, и степень заболеваемости постоянно повышается. Туморогенные гепатоциты поддерживают высокие уровни экспрессии LRP1. Гепатоцеллюлярная карцинома слабо реагирует на химиотерапию, так как опухолевые клетки демонстрируют высокие степени резистентности к лекарственному средству, и применяемые химиотерапии имеют существенную токсичность, особенно в сердце и почках, вследствие системного (внутривенного) введения.
[0092] Термин «гепатит» является общим для воспаления печени. Гепатит может быть острым или хроническим и включает острое или хроническое расстройство печени, например, вследствие вирусных (например, гепатита A, B, C, D или E или отличных от ABCDE, CMV, Эпштейна-Барра), грибковых, риккетсиозных или паразитарных инфекций, алкоголя, химических токсинов, лекарств (например, ацетаминофена, амиодарона, изониазида, галотана, хлорпромазина, эритромицина), метаболическое заболевание печени (например, болезнь Вильсона, дефицит альфа 1 антитрипсина), рак, идиопатическое аутоиммунное заболевание печени, цирроз (например, первичный билиарный цирроз), билиарную обструкцию. Результатом инфицирования печени вирусом гепатита A, B и/или C может быть медленно прогрессирующее заболевание печени, приводящее к расстройству печени. Острая гепатитная инфекция обычно вызвана гепатитом А. Инфекции гепатитом B и гепатитом С могут сохраняться в организме и становиться продолжительными (хроническими) инфекциями. Гепатит C может вызывать критические состояния, в том числе цирроз и рак.
[0093] Рассмотренные дополнительные болезни или состояния печени, которые, как предполагается, поддаются лечению с применением раскрытых здесь соединений, включают опухоли, связанные или являющиеся результатом печеночного стеатоза, цирроза печени, токсического поражения печени (например, вследствие токсичности лекарства или токсичности окружающей среды, например, рака, вызванного афлатоксином B1) и наследственного гемохроматоза.
[0094] Предполагается, что введение раскрытых здесь соединений субъектам, имеющим опухоль печени, производят в комбинации со вторым агентом, включающим, но не ограниченным этим, химиотерапевтические агенты, цитотоксические агенты, радиоизотопы, антивирусы, противогрибковые агенты, противовоспалительные агенты, антитела и другие терапевтические агенты, пригодные для лечения опухолей печени или других заболеваний печени, связанных с развитием опухолей печени.
[0095] Лекарства-кандидаты для введения HCC-пациентам в комбинации с раскрытыми здесь соединениями для терапии карциномы печени включают, но не ограничены этим: 5-фторурацил, доксорубицин (адриамицин), митомицин C, цисплатин, эпирубицин, даунорубицин, этопозид и другие химиотерапевтические агенты, указанные в таблице 1, адефовир, ламивудин, энтекавир, рибивирин, интерферон альфа, пегилированный интерферон альфа-2a, интерферон альфа-2b и другие антивирусные агенты, витамин E, урсодезоксихолевую кислоту и другие агенты, применяемые для лечения болезни печени. Дополнительные агенты показаны в таблице 1.
ТАБЛИЦА 1
[0096] Цитотоксические агенты, пригодные для лечения опухолей, включают, но не ограничены этим, мехлорэтамин гидрохлорид, циклофосфамид, ифосфамид, хлорамбуцил, мелфалан, бусульфан, тиотепа, кармустин, ломустин, дакарбазин и стрептозоцин.
[0097] Радиоизотопы, пригодные для лечения опухолей, включают, но не ограничены этим,131I,125I,111In,90Y,67Cu,127Lu,212Bi,213Bi,255Fm,149Tb,223Rd,213Pb,212Pb,211At,89Sr,153Sm,166Ho,225Ac,186Re,67Ga,68Ga и99mTc.
[0098] Антитела, предполагаемые для применения в способах, включают антитела, используемые для лечения рака и других расстройств, включая, но не ограничиваясь этим, антитела к рецептору эпидермального фактора роста (EGFR) (цетуксимаб, панитумумаб), антитела к рецептору тромбоцитарного фактора роста альфа (PDGFR альфа), антитела к глипикану 3 (GPC3) и другие антитела, пригодные для лечения рака или рака, который метастазирован в печень и другие области организма.
Наборы
[0099] В качестве дополнительного аспекта изобретение включает наборы, которые содержат одно или более описанных здесь соединений или композиций, упакованных таким образом, чтобы облегчить их использование для практического применения способов изобретения. В одном варианте осуществления такой набор включает описанное здесь соединение или композицию (например, композицию, содержащую соединение само по себе или в комбинации со вторым агентом), упакованную в контейнер, например, закупоренный флакон или сосуд с этикеткой, прикрепленной к контейнеру или включенной в упаковку, на которой описано использование соединения или композиции при практическом применении способа. Предпочтительно упаковывать соединение или композицию в виде стандартной дозированной формы. Набор может дополнительно включать приспособление, подходящее для введения композиции, соответствующей конкретному способу введения. Предпочтительно набор содержит этикетку, на которой описано применение композиции.
[0100] Притом что изобретение описано в сочетании с конкретными вариантами его осуществления, предшествующее описание, а также примеры, которые следуют далее, предназначены для иллюстрации, а не ограничения области изобретения. Специалистам в данной области будут ясны другие аспекты, преимущества и модификации, входящие в область изобретения.
Примеры
Пример 1
Синтез соединений
[0101] Раскрытые здесь соединения можно получить следующими способами, проводя подходящие модификации исходных реагентов. Специалист в данной области, принимая во внимание приведенные ниже методики и используя типичные методики органической химии, может синтезировать раскрытое здесь соединение.
[0102] Синтез промежуточного продукта A: промежуточный продукт A получали из D-глюкозы, как показано на схеме 1.
Схема 1
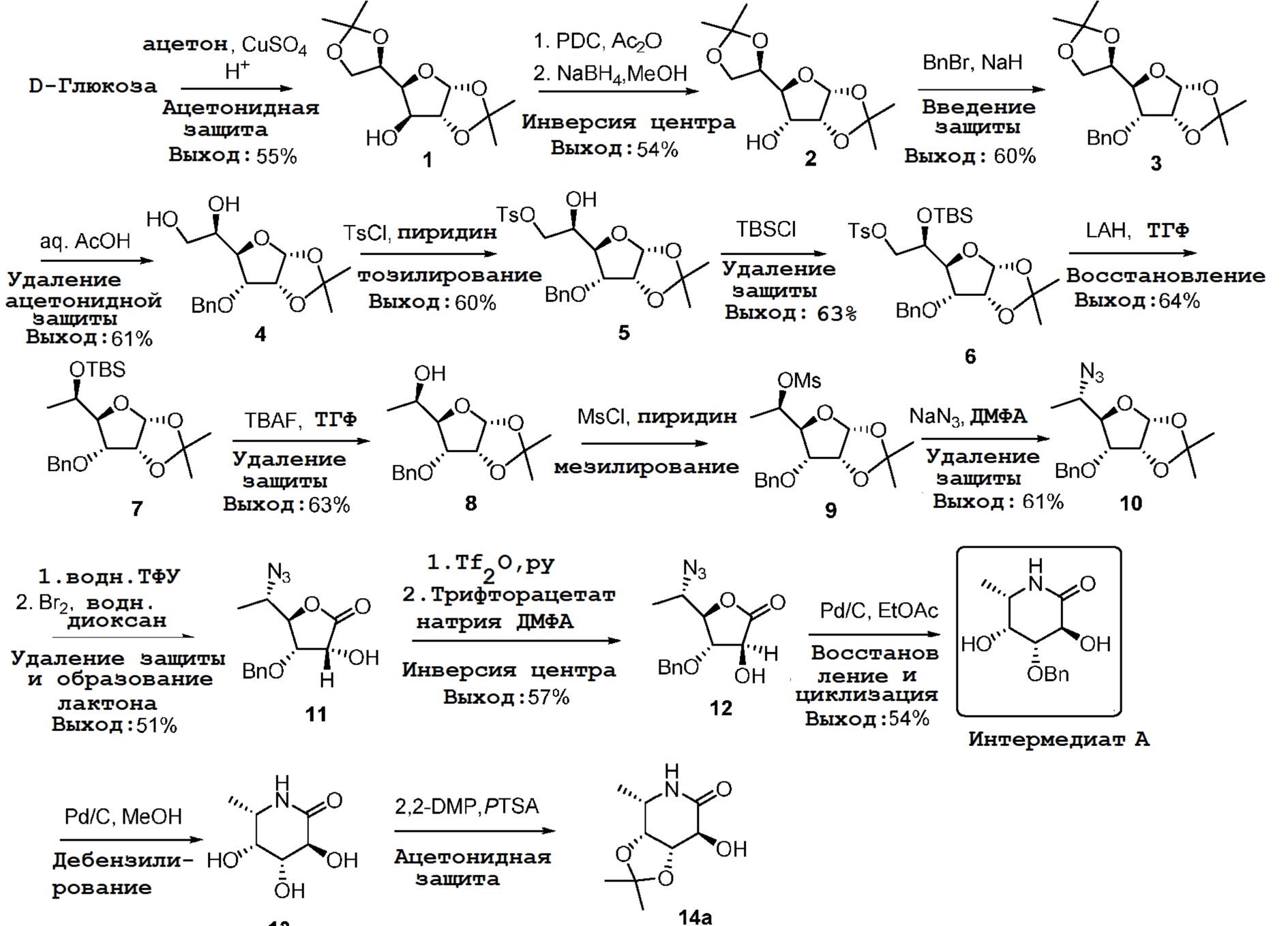
[0103] Дебезилирование промежуточного продукта A дает в результате соединение 13, которое можно преобразовать в соединение с защитой 14a.
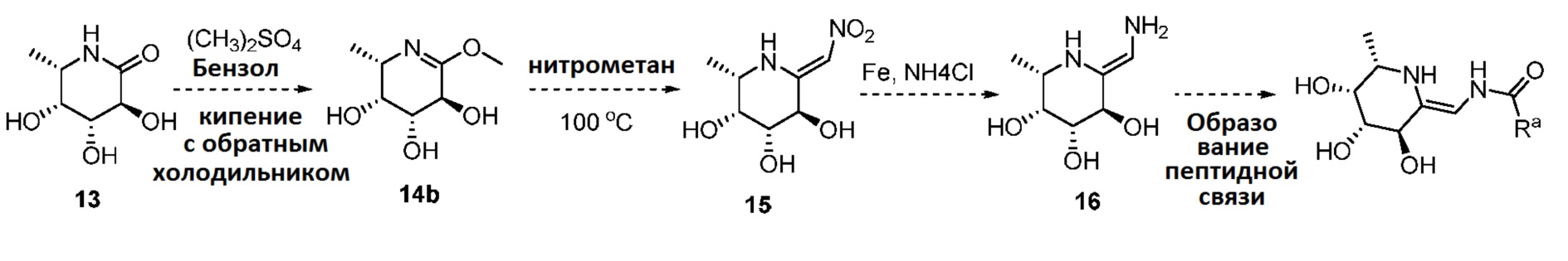
[0104] Синтез соединений формулы I: соединения формулы I получали из соединения 13 конверсией в енамин (соединение 16) с последующим соединением с подходящей активированной карбоновой кислотой, как показано на схеме 2.
Схема 2
[0105] Соединения формулы I также получали из соединения 13 конверсией в тиолактам (соединение 29) с последующим соединением с подходящим α-бромамидом (соединение 3') и преобразованием в соединение формулы I, как показано на схеме 3.
Схема 3
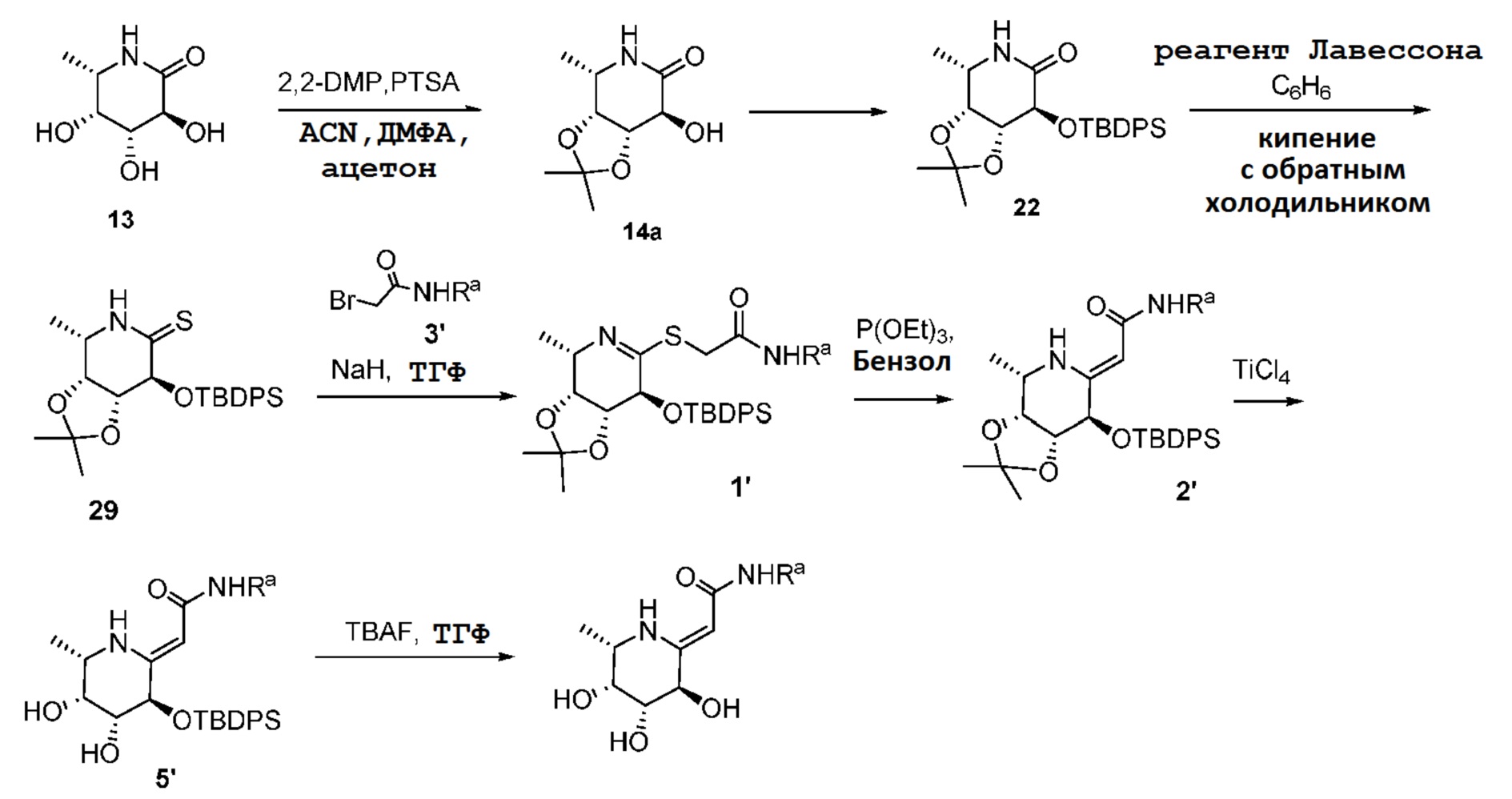
Пример 2
In vitro ингибирование фукозидазы
[0106] Ингибирование фукозидазы оценивали, готовя реакционную смесь из 50 мМ фосфатно-цитратного буфера, pH 4,5, 5 мМ MgCl2, 640 нМ 4-метилумбеллиферил-альфа-L-фукопиранозида (4MU-FUC), 1 нг/мл rhFUCA1 (R&D Systems) и соединения II, III или IV:
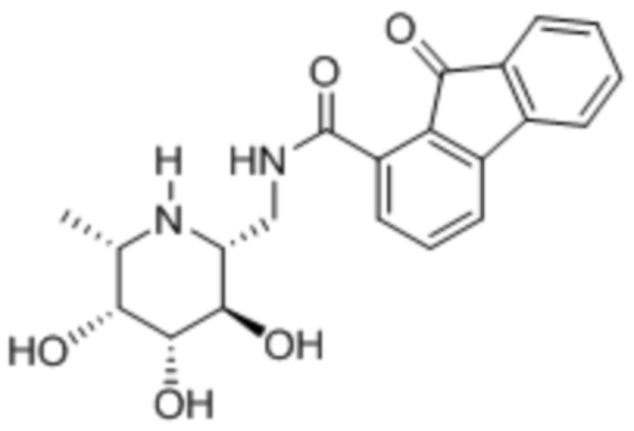
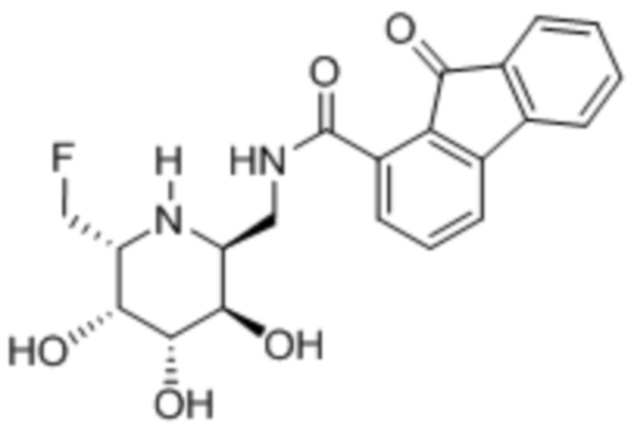
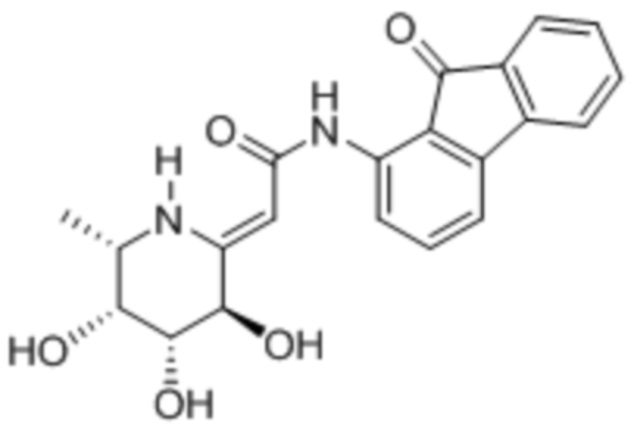
Реакционные смеси (100 мкл) инкубировали при 37°C в течение 30 мин. и затем гасили таким же объемом 600 мМ цитратно-карбонатного буфера, pH 9. Измеряли флуоресценцию при возбуждении при 360 нм и испускании при 450 нм. Результаты приведены в таблице 2.
Таблица 2
[0107] Результаты демонстрируют эффективное ингибирование активности фукозидазы соединениями II, III и IV.
Пример 3
Метаболическое мечение меченой фукозой
[0108] Нарушения метаболизма гликопртеинов оценивали, культивируя клетки HepG2 без ингибиторов фукозидазы или с соединением II, III или IV (смотри пример 2) в течение 24 ч и затем в течение еще 48 ч, добавляя (3S,4R,5R,6S)-6-этинилтетрагидро-2H-пиран-2,3,4,5-тетраилтетраацетат, перацетилированный аналог фукозы, содержащий алкиновый фрагмент вместо 5'-метильной группы (Click-iTTM Fucose Alkyne, Molecular Probes, Eugene, Oregon). Клетки фиксировали, пермеабилизировали, промывали и окрашивали азидом Alexa Fluor 488 для ортогональной маркировки гликопротеинов, включающих аналог фукозы. Затем анализировали клетки на флуоресценцию, используя проточный цитометр Guava 6HT-2L (ThermoFisher). Результаты представлены на ФИГ. 1 и в таблице 3 и демонстрируют повышенные уровни фукозилированного материала в клетках после обработки соединениями II и IV в соответствии с ингибированием фукозидазы. Результаты также демонстрируют пониженные уровни фукозилированного материала в клетках, обработанных соединением III, предполагая вероятное ингибирование фукозилирования. Кроме того, в аналогичном исследовании с использованием здоровых фибробластных клеток вместо клеток HepG2 обработка соединением II дает минимальное влияние на уровни фукозилированного материала.
Таблица 3
Пример 4
Цитотоксичность в клетках HepG2
[0109] Для исследования цитотоксичности соединений в клетках высевали клетки HepG2 в трех экземплярах на 96-луночные планшеты при плотности 1,5e4 клеток/лунка в минимальной существенной среде, 10% FBS и 2 мМ L-глутамин. Высеянные клетки оставляли восстанавливаться на 48 ч. Затем заменяли среду такой же средой, содержащей разведения соединения II или IV (смотри пример 2), инкубировали в течение 24 или 48 ч и подвергали XTT-исследованию для определения жизнеспособности (ATCC). Результаты представлены на ФИГ. 2 и ФИГ. 3 и показывают, что соединение IV демонстрирует пониженную цитотоксичность при более высоких концентрациях ингибитора по сравнению с соединением II.
Пример 5
Цитотоксичность соединения II
[0110] Мультиплексное исследование цитотоксичности: для оценки цитотоксичности соединения II (смотри пример 2) на раковых и нормальных клетках культивировали клетки в RPMI1640, 10% FBS, 2 мМ L-аланил-L-глутамин, 1 мМ Na пируват или в специальной среде в увлажненной атмосфере 5% CO2 при 37°C. Клетки высевали на 384-луночные планшеты и инкубировали в увлажненной атмосфере 5% CO2 при 37°C. Через 24 ч после высевания клеток добавляли соединение II. В то же время (нулевое время) готовили планшет с необработанными клетками.
[0111] После 72-часового инкубационного периода клетки фиксировали и окрашивали флуоресцентно мечеными антителами и красителем для ядер, делая возможной визуализацию ядер, апоптических клеток и митотических клеток. Апоптические клетки детектировали, используя антитело против активной каспазы-3. Митотические клетки детектировали, используя антитело против фосфогистона-3.
[0112] Соединение II последовательно разводили 3,16-кратно и оценивали более 9 концентраций. Исследование выполняли методом автоматической флуоресцентной микроскопии, используя анализатор GE Healthcare IN Cell Analyzer 1000, и получали изображения, используя 4X объектив.
[0113] Анализ данных: получали двенадцатибитные tiff-изображения, используя анализатор InCell Analyzer 1000 3.2, и анализировали при помощи программы Developer Toolbox 1.6. Рассчитывали значения EC50 и IC50, применяя нелинейную регрессию для подгонки данных к сигмовидной 4-точечной, 4-параметровой модели реакции на дозу с одним сайтом связывания, где: y (подгонка)=A+[(B-A)/(1+((C/x)^D))]. Построение кривой, расчеты EC50/IC50 и составление отчета выполняли, используя программу (AIM) на базе механизма восстановления данных MathIQ.
[0114] При мультиплексном исследовании цитотоксичности использовали методику анализа, основанную на изображении клеток, где клетки фиксируют и окрашивают флуоресцентно мечеными антителами и красителем для ядер с целью визуализации ядер и апоптических и митотических клеток. Апоптические клетки детектировали, используя антитело против активной каспазы-3. Митотические клетки детектировали, используя антитело против фосфогистона-3. Пролиферацию клеток измеряли по интенсивности сигнала включенного красителя для ядер. Результат исследования пролиферации клеток обозначен как относительное количество клеток. Для определения конечной точки пролиферации клеток выходные данные по пролиферации клеток преобразовывали в проценты от контроля (POC), применяя следующую формулу:
[0115] POC=относительное количество клеток (лунки с соединением)/относительное количество клеток (лунки с носителем)×100.
[0116] Относительное количество клеток IC50 равно концентрации тестируемого соединения при 50% максимальной вероятной реакции. Относительное количество клеток EC50 равно концентрации тестируемого соединения в точке перегиба кривой или половине эффективной реакции (параметр C в уравнении подгоняемой кривой). GI50 обозначает концентрацию, необходимую для снижения наблюдаемого роста наполовину. Это концентрация, которая ингибирует рост на полпути между необработанными клетками и количеством клеток, высеянных в лунку (нулевое время).
[0117] Необработанный планшет в нулевой момент времени использовали для определения количества удвоений за 72-часовой период исследования: количество удвоений за 72 ч=LN[число клеток (конечная точка 72 ч)*число клеток (нулевое время)]/LN(2)
[0118] Результатом каждого биомаркера является кратное увеличение относительно базового значения для носителя, нормированное по относительному количеству клеток в каждой лунке.
[0119] Маркер активированная каспаза-3 метит клетки от ранней до поздней стадии апоптоза. Результат показан как кратность увеличения апоптических клеток относительно базового значения для носителя, нормированная по относительному количеству клеток в каждой лунке. Концентрации тестируемого соединения, которые вызывают 5-кратную индукцию сигнала каспазы-3, указывают на существенную индукцию апоптоза. Лунки с концентрациями, превышающими относительное количество клеток IC95, исключают из анализа индукции с использованием каспазы-3.
[0120] Маркер фосфо-гистон-3 метит митотические клетки. Результат показан как кратность индукции митотических клеток относительно базового значения для носителя, нормированная по относительному количеству клеток в каждой лунке. Если кратность индукции сигнала митотической клетки относительно базового значения составляет ~1, «эффект отсутствует» на клеточный цикл. Двойная или большая кратность увеличения сигнала фосфо-гистона-3 относительно базового значения для носителя указывает на существенную индукцию тестируемого соединения митотического блока.
[0121] Двойная или большая кратность снижения сигнала фосфо-гистона-3 может указывать только на блок G1/S, если уровни цитотоксичности ниже измеренного относительного количества клеток IC95. Если наблюдают двойную или большую кратность снижения сигнала фосфо-гистона-3 при концентрациях, превышающих относительное количество клеток IC95, то наиболее вероятно, что снижение количества митотических клеток происходит скорее из-за более общего эффекта цитотоксичности, чем истинного фазового блока G1/S. Лунки с концентрациями, превышающими относительное количество клеток IC95, исключают из анализа с использованием фосфо-гистона-3.
[0122] Результаты этих исследований представлены в таблице 4 и показывают, что соединение II, которое ингибирует лизосомальную фукозидазу в клетках, является токсичным для ряда опухолевых клеточных линий, в том числе клеточных линий толстой кишки и предстательной железы. Результаты также демонстрируют, что соединение II индуцирует прекращение роста в некоторых нормальных (неопухолевых) первичных линиях, но не убивает их.
Таблица 4
Пример 6
Фармакокинетика и биораспределение соединения II
[0123] Для оценки фармакокинетики соединения II (смотри пример 2) в плазме мышей вводили соединение II внутривенно при дозе 1 мг/кг. Определяли концентрацию соединения II в различные моменты времени в течение 24 час. после введения, и результаты представлены в таблице 5.
Таблица 5
BQL=ниже предела количественного определения <1,0 нг/мл;
---=не применимо.
[0124] Для оценки биораспределения соединения II (смотри пример 2) в печени и толстой кишке мышей вводили соединение II внутривенно при дозе 1 мг/кг. Концентрацию соединения II определяли через 1 и 8 ч после введения, и результаты представлены в таблице 6 и 7.
Таблица 6
Концентрация соединения II в печени
Таблица 7
Концентрация соединения II в толстой кишке
[0125] Эти результаты демонстрируют быстрый клиренс ингибиторов фукозидазы из плазмы мышей, но отражают распределение соединения в ткани, в частности в толстой кишке.
Пример 7
In Vivo эффективность на ортотопической модели гепатоцеллюлярной карциномы человека
[0126] Для оценки соединения in vivo использовали ортотопическую модель гепатоцеллюлярной карциномы человека. Ортотопическую модель опухоли получали, имплантируя клеточную линию гепатокарциномы человека HepG2 голым мышам и позволяя опухолевым клеткам расти in vivo.
[0127] Изучение эффективности выполняли, используя 10 мышей на группу и две схемы введения дозы. Соединение II (смотри пример 2) вводили через оральный зонд (po) при дозе 175 мг/кг один раз в день в течение 3 недель (QDx21) или при дозе 87,5 мг/кг два раза в день в течение 3 недель (BIDx21). Контрольным животным вводили носитель (100 мкл).
[0128] Затем оценивали животных на изменения массы тела и объем опухоли, и результаты представлены в таблицах 8 и 9.
Таблица 8
Объем опухоли (мм3)
Таблица 9
Масса тела (г)
[0129] Соединение II демонстрирует эффективное снижение объема опухоли на животной модели для обеих схем введения доз, притом что большее снижение наблюдается для дозы 87,5 мг/кг дважды в день. Эти данные подтверждают пригодность ингибиторов фукозидазы для направленного воздействия на опухолевые клетки у людей, страдающих от гепатокарциномы или других состояний печени.
Пример 8
Характеристика соединений
[0130] В дополнение к приведенным выше примерам можно измерять активность описанных здесь соединений посредством других исследований, известных в этой области, в том числе исследований, описанных ниже, но не ограничиваясь этим.
[0131] Биохимическая эффективность в клетках HepG2: клетки HepG2, изначально полученные из HCC опухоли, продуцируют гиперфукозилированные гликопротеины. Для оценки биохимической эффективности соединений в гепатоцитах культивировали клетки HepG2 в стандартных условиях и инкубировали на многолуночных планшетах только с буфером, одним или большим количеством известных ингибиторов фукозидазы или тестируемых соединений. После инкубации в течение ночи клетки ополаскивали холодным PBS и лизировали замораживанием-оттаиванием в 50 мМ цитрате натрия, рН 4,8. Клеточные лизаты осветляли центрифугированием и оценивали активность фукозидазы, проводя исследование с применением 4-метилумбеллиферил-альфа-L-фукозы (доступной от Sigma-Aldrich, обозначенной PMID 2137330) в соответствии с протоколом производителя. Также оценивали уровни β-глюкуронидазы, применяя стандартные процедуры для нормировки по числу клеток, и лизосомальную функцию.
[0132] Исследования функциональной эффективности в клетках HepG2: клетки HepG2 высевают с плотностью 1×105 клеток на лунку на 12-луночные планшеты и позволяют восстанавливаться в течение 24 ч. Затем клетки инкубируют с тестируемыми соединениями в течение 72 ч. Затем оценивают состояние клеток посредством MTT исследования пролиферации.
[0133] Ожидается, что ингибирование активности фукозидазы в клетках HepG2 будет вызывать накопление фукозилированных белков в клетках, приводя к гибели клеток или, по меньшей мере, снижению или прекращению пролиферации клеток.
[0134] Функциональная эффективность на ортотопической модели ксенотрансплантата опухоли: эффективность соединия оценивают на ортотопической модели внутрипеченочного ксенотрансплантата, как описано выше (Ong, L.C. et al., Mol. Imaging Biol. 11:334-42 (2009); Aihara, A. et al., J. Hepatol. 52:63-71 (2010)). Кратко говоря, 6-8 недельных мышей с тяжелым комбинированным иммунодефицитом (SCID) анестезируют подходящим анестетиком, например, кетамином, диазепамом или их комбинацией и проводят верхнюю срединную лапаротомию для раскрытия воротной вены мыши посредством срединного разреза брюшной полости. Затем производят инъекцию суспензии 106 HepG2 клеток в воротную вену в течение одной минуты, используя иглу 30 размера. Затем разрез зашивают и согревают животных до полного пробуждения.
[0135] Для определения эффективности лечения соединением выполняют исследование методом позитронной эмиссионной томографии (PET) с использованием подходящего агента, меченного радиоактивным изотопом, такого как 2-дезокси-2-(F-18)-фтор-D-глюкоза (18F-FDG) (Ong, L.C. et al., Mol. Imaging Biol. 11:334-42 (2009)), для отслеживания прогрессирования HepG2-индуцированной опухоли у обработанных и контрольных мышей неинвазивным методом. Эффективность лечения соединением также определяют in vivo, проводя гистологический анализ опухолевой области у обработанных и контрольных животных.
[0136] Также определяют индикаторы лизосомных болезней накопления, в том числе уровни гликозаминогликана (GAG) в лизосоме, моче и крови, на ортотопической модели опухоли.
[0137] Ожидается, что введение соединения будет снижать размер опухоли или замедлять прогрессирование роста опухоли по сравнению с субъектами, не принимающими соединение. Ожидается также, что введение соединения будет повышать уровень фукозилированных белков в лизосомах клеток, принимающих соединение, что определяют в GAG исследованиях.
Пример 9
Характеристика соединений
[0138] В дополнение к приведенным выше примерам in vivo активность описанных здесь соединений можно измерять на других животных моделях, известных в данной области, включая, но не ограничиваясь этим, описанные ниже модели.
[0139] Функциональная эффективность на модели ксенотрансплантата подкожной опухоли: эффективность соединения оценивают на модели подкожного ксенотрансплантата. Подходящие модели подкожного ксенотрансплантата можно получить, используя 6-8 недельных мышей с тяжелым комбинированным иммунодефицитом (SCID), анестезируя их подходящим анестетиком, например, кетамином, диазепамом или их комбинацией и затем проводя инъекцию подходящей суспензии клеток, например, клеток Huh-7, SK-Hep1, HA22T/VGH или PLC/PRF/5 для гепатоцеллюлярной карциномы; клеток BT-474, MDA-MB-453, MCF-7 или MDA-MB-231 для рака молочной железы; клеток NCI-H460, A549, NCI-1703 или NCI-H226 для рака легкого; клеток SNU-1, NCI-N87, TMC-1, TSGH или TSGH-S3 для рака желудка; клеток MV4-11, RS4-11 или MOLM-13 для острого миелоидного лейкоза; клеток COLO 205 или HT-29 для рака толстой кишки; клеток RPMI2650 для носовой карциномы; клеток PANC1 или MIA-PaCa 2 for карциномы поджелудочной железы; клеток RPMI-2650, Detroit 562, FaDu или HSC-3 для рака головы и шеи; и TT клеток для карциномы щитовидной железы. Затем зашивают разрез и животных согревают до полного пробуждения.
[0140] Для определения эффективности лечения соединением проводят исследование методом позитронной эмиссионной томографии (PET) с использованием подходящего агента, меченного радиоактивным изотопом, например, 2-дезокси-2-(F-18)-фтор-d-глюкозы (18F-FDG) (Ong, L.C. et al., Mol. Imaging Biol. 11:334-42 (2009)), для отслеживания прогрессирования индуцированной опухоли у обработанных и контрольных мышей неинвазивным методом. Эффективность лечения соединением также определяют in vivo посредством гистологического анализа опухолевой области у обработанных и контрольных животных.
[0141] Также определяют индикаторы лизосомных болезней накопления, в том числе уровни гликозаминогликана (GAG) в лизосоме, моче и крови, на модели подкожной опухоли.
[0142] Ожидается, что введение соединения будет снижать размер опухоли или замедлять прогрессирование роста опухоли по сравнению с субъектами, не принимающими соединение. Ожидается также, что введение соединения будет повышать уровень фукозилированных белков в лизосомах клеток, принимающих соединение, что определяют в GAG исследованиях.
[0143] Функциональная эффективность на ортотопической модели ксенотрансплантата опухоли: эффективность соединения оценивают на ортотопической модели ксенотрансплантата. Подходящие ортотопические модели ксенотрансплантатов можно получить, используя 6-8 недельных мышей с тяжелым комбинированным иммунодефицитом (SCID), анестезируя их подходящим анестетиком, например, кетамином, диазепамом или их комбинацией и затем проводя инъекцию подходящей суспензии клеток, например, клеток Huh-7, PLC/PRF/5 или BNL 1ME A.7R.1-luc для гепатоцеллюлярной карциномы; клеток, полученных от пациентов, например, от пациентов с гепатоцеллюлярной карциномой для моделей ксенотрансплантатов (PDX), полученных от пациентов; клеток Detroit 562 или HSC-3 для рака головы и шеи и клеток B16-F10 для меланомы. Затем зашивают разрез и животных согревают до полного пробуждения.
[0144] Кроме того, модель спонтанных метастазов меланомы в лимфатические узлы можно получить, инокулируя клетки крысиной меланомы B16-F10-luc2 в заднюю подушечку стопы иммунокомпетентных сингенных мышей C57Bl/6.
[0145] Для определения эффективности лечения соединением проводят исследование методом позитронной эмиссионной томографии (PET), используя подходящий агент, меченный радиоактивным изотопом, например, 2-дезокси-2-(F-18)-фтор-d-глюкозу (18F-FDG) (Ong, L.C. et al., Mol. Imaging Biol. 11:334-42 (2009)), для отслеживания прогрессирования индуцированной опухоли у обработанных и контрольных мышей неинвазивным методом. Эффективность лечения соединением также определяют in vivo посредством гистологического анализа опухолевой области у обработанных и контрольных животных.
[0146] Также определяют индикаторы лизосомных болезней накопления, в том числе уровни гликозаминогликана (GAG) в лизосоме, моче и крови, на модели подкожной опухоли.
[0147] Ожидается, что введение соединения будет снижать размер опухоли или замедлять прогрессирование роста опухоли по сравнению с субъектами, не принимающими соединение. Ожидается также, что введение соединения будет повышать уровень фукозилированных белков в лизосомах клеток, принимающих соединение, что определяют в GAG исследованиях.
Пример 10
Введение соединений In Vivo
[0148] HCC является 5 наиболее распространенной диагностируемой злокачественной опухолью, и по всему миру насчитывается почти 500000 смертельных случаев ежегодно. Первый вариант лечения включает хирургическое удаление, трансплантацию и физическую деструкцию опухолевой ткани, но только 5-10% пациентов имеют опухоли, пригодные для таких подходов (Ribero, D. et al., Expert Rev. Anticancer Ther. 6:567-579 (2006); Lau, W. Y. et al., J. Am. Coll. Surg. 202:155-168 (2006); Lin, X. D. et al., Hepatobiliary Pancreat. Dis. Int. 5:16-21 (2006)). Кроме того, системная химиотерапия дает низкую степень отклика 15-20%, из-за токсичности химиотерапии и резистентности опухолевых клеток (Chan, J. Y., et al., Life Sci. 67:2117-2124 (2000); Plosker, G. L., et al., Drugs 45:788-856 (1993)).
[0149] Например, доксорубицин представляет собой раковый химиотерапевтический агент с высокой эффективностью относительно широкого разнообразия опухолей и особо токсичен в отношении клеток, подверженных быстрому росту, включая опухолевые клетки. Однако применение доксорубицина при лечении гепатоцеллюлярной карциномы ограничено существенной токсичностью для печени и сердца и подавлением производства кровяных клеток (Danesi, R., et al., Clin. Pharmacokinet. 41:431-444 (2002)). Кроме того, клетки гепатоцеллюлярной карциномы демонстрируют высокие степени преобразования в лекарственно-устойчивые типы (Hu, Y., et al., Int. J. Oncol. 25:1357-1364 (2004)).
[0150] Альтернативный подход к терапии использует облучение. Например, новый способ лечения рака печени, который в настоящее время тестируется, включает инъекцию микроскопических стеклянных гранул, которые мечены радиоактивным материалом (90Y), в магистральную печеночную артерию, откуда они проходят в мелкие кровеносные сосуды, которые питают опухолевую ткань. Далее облучение разрушает опухолевую ткань. Однако существенный сброс крови из печеночной артерии в легкие препятствует применению стеклянных гранул для многих пациентов. Существенный отток гранул в артерии, снабжающие желудочно-кишечный тракт, также может вызывать серьезные побочные эффекты. Таким образом, эффективная доставка лекарства к опухолевой ткани требует более направленного подхода, который не полагается на большие количества материала, которые будут захвачены кровеносными сосудами.
[0151] Для оценки соединения in vivo используют ортотопические модели гепатоцеллюлярной карциномы человека.
[0152] Для получения ортотопических опухолей у животных имплантируют клеточные линии гепатокарциномы человека голым мышам, крысам или другому подходящему животному и позволяют опухолевым клеткам расти in vivo. Клеточные линии HCC, подходящие для ортотопических моделей, включают, но не ограничены этим, описанные выше клеточные линии, такие как Hep3B, HepG2, SK-Hep1, HA22T/VGH, PLC/PRF/5 и Huh-7. Ортотопические модели опухолей HCC известны в данной области и описаны, например, в работах Okubo et al. (J Gastroenterol Hepatol. 2007 22:423-8); Armengol et al., (Clin Cancer Res. 2004 10:2150-7); и Yao et al., (Clin Cancer Res. 2003 9:2719-26).
[0153] Сначала устанавливают диапазон доз для введения соединений и контролей in vivo, исследование диапазона малых доз проводят, используя 5 мышей, принимающих соединение (например, до 200 мг/кг/день), на группу. Тестируемые агенты вводят внутривенно или внутрибрюшинно ежедневно в течение двух недель (QDx14) и подопытных животных тестируют на изменение массы тела, данные клинических наблюдений, клиническую патологию и гистопатологию ткани в конечной точке исследования.
[0154] Для проведения исследования эффективности используют от 8 до 10 мышей на группу и вводят животным, принимающим человеческие HCC клетки, и контрольным животным дозы указанных выше соединений из 3 диапазонов тест-доз. Тестируемые агенты вводят внутривенно или внутрибрюшинно и с подходящей частотой, например, ежедневно в течение 4 недель (QDx28), ежедневно в течение 3 недель (QDx21) или ежедневно в течение 2 недель (QDx14). Затем подопытных животных оценивают на изменения массы тела, данные клинических наблюдений и in vivo эффективность по таким измерениям как объем опухоли, гистопатология печени и общая клиническая патология, используя методики, известные в данной области.
[0155] Способность соединений снижать рост клеток гепатоцеллюлярной карциномы in vivo демонстрирует, что соединения эффективно доставляются в клетки печени, обеспечивая в результате биологически измеримый эффект. Демонстрация эффективного уничтожения опухоли на животных моделях предполагает, что соединения эффективны при направленном воздействии на опухолевые клетки у людей, страдающих от гепатокарциномы или других состояний печени.
[0156] Другой подходящей животной моделью гепатоцеллюлярной карциномы (HCC) для тестирования биораспределения и эффективности терапевтических средств является вирус гепатита сурка (WHV)-инфицированного Eastern woodchuck (Tennant, B.C., et al., Gastroenterology 127:S283-293 (2004)). Почти у всех сурков, неонатально инфицированных вирусом, развивается HCC в среднем за 24 месяца. Средняя продолжительность жизни составляет 30 месяцев, однако у WHV-инфицированных сурков не развивается цирроз, состояние, присутствующее у большинства HCC-пациентов. Вирус гепатита сурка и вирус гепатита B человека аналогичны по структуре, генетике, способам передачи, течению инфицирования и прогрессированию гепатоцеллюлярной карциномы. Имеются существенные аналогии, которые подчеркивают важность этой модели. Подобно людям, более половины всех сурков, подвергшихся воздействию вируса гепатита вскоре после рождения, развивают хроническую инфекцию, и почти у всех хронически инфицированных сурков развивается гепатоцеллюлярная карцинома приблизительно через 20-28 месяцев после воздействия. Остальные привитые новорожденные сурки часто развивают острый гепатит, но будут вырабатывать антитела к вирусу и восстанавливаться. От 17 до 25% этих «восстановившихся» животных развивают HCC через 29-56 месяцев после воздействия. Развитие HCC после видимого восстановления от инфекции гепатита также встречается у людей.
[0157] Для определения эффективности соединений на клетках опухоли печени, изучают потребление и токсичность контрольных и тестируемых соединений на модели HCC сурка. В одном варианте осуществления используют шесть хронически инфицированных сурков и четыре неинфицированных сурка возраста приблизительно 1,5-2 лет.
[0158] Пригодное соединение, как правило, будет демонстрировать следующие характеристики: 1) не оказывает отрицательного влияния на уже ослабленную функцию печени, 2) измеримое потребление печенью и злокачественной тканью печени и 3) после потребления является токсичным для опухолевых клеток и вызывает регрессию опухоли.
[0159] На опухолевых моделях выполняют также определение индикаторов лизосомных болезней накопления, включающих уровни олигосахаридов в лизосоме, моче и крови.
[0160] Как ожидается, специалистам в данной области приходят в голову многочисленные модификации и варианты изобретения, изложенные в приведенных выше иллюстративных примерах. Следовательно, в изобретение должны быть включены только такие ограничения, которые представлены в прилагаемой формуле изобретения.
Реферат
Изобретение относится к соединению формулы I, обладающему свойствами ингибиторов ферментов фукозидаз, и его применению для лечения опухоли или ракового заболевания, представляющего собой рак печени. В общей формуле I X1, X2 и X3 представляют собой OH; R представляет собой C1-3алкил; R1 представляет собой H; R2 выбран из группы, состоящей из -NRbC(O)Ra, и -C(O)NRbRa; Ra обозначает
Формула


Комментарии