Композиции и способы борьбы с накоплением жировой ткани - RU2711478C2
Код документа: RU2711478C2
Чертежи
















Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет по предварительной заявке на патент США с серийным номером 61/917136, поданной 17-го декабря 2013 года; по предварительной заявке на патент США с серийным номером 61/974660, поданной 3-го апреля 2014 года; по предварительной заявке на патент США с серийным номером 62/007255, поданной 3-го июня 2014 года; по предварительной заявке на патент США с серийным номером 62/045189, поданной 3-го сентября 2014 года; по предварительной заявке на патент США с серийным номером 62/074225, поданной 3-го ноября 2014 года; по предварительной заявке на патент США с серийным номером 62/074227, поданной 3-го ноября 2014 года; и по предварительной заявке на патент США с серийным номером 62/074234, поданной 3-го ноября 2014 года. Содержание этих заявок полностью включено в настоящее описание путем ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Список последовательностей подан в данном изобретении в виде текстового ASCII-файла с названием «MHMS200014US01_ST25.txt», созданного 17-го декабря 2014 года и имеющего размер 24995 байт. Материал, содержащийся в этом текстовом файле, тем самым полностью включен в настоящее описание путем ссылки.
[0003] Настоящее изобретение в различных примерных вариантах осуществления относится в общем к композициям и способам борьбы с накоплением жира в ткани с использованием молекулярных антагонистов, таких как моноклональные антитела (мАт), которые связываются с глюкозозависимым инсулинотропным полипептидом (GIP). Накопление жировой ткани происходит при нескольких различных заболеваниях или состояниях, которые можно лечить с помощью таких антагонистов/моноклональных антител. Настоящее изобретение также относится к лечению таких заболеваний или состояний путем улучшения толерантности к глюкозе без необходимости повышения уровня инсулина в сыворотке с помощью введения таких антагонистов/моноклональных антител.
[0004] Ожирение представляет собой патологию, при которой избыток жира накапливается в такой степени, что он оказывает отрицательное влияние на здоровье. В Соединенных Штатах считается, что ожирение возникает, когда индекс массы тела человека (ИМТ), рассчитываемый путем деления веса человека на квадрат роста человека, составляет 30 кг/м2 или больше. Ожирение может возникать в результате сочетания ряда факторов, включая чрезмерное потребление калорий, неправильное питание, отсутствие физической активности, генетику, возраст и недостаток сна. Ожирение повышает вероятность возникновения различных заболеваний, в том числе сердечно-сосудистых заболеваний, диабета 2 типа, обструктивного апноэ сна, некоторые виды рака и остеоартрит.
[0005] Метаболический синдром диагностируется, когда три из пяти следующих заболеваний диагностируется совместно: повышенное кровяное давление, избыточный жир вокруг талии, высокое содержание глюкозы в крови натощак, высокий уровень триглицеридов в сыворотке крови и низкий уровень холестерина высокой плотности (HDL). Метаболический синдром также повышает риск развития других заболеваний, включая сахарный диабет 2 типа, ишемическую болезнь сердца, липодистрофию и потенциально некоторые психические заболевания. Лечение включает в себя изменения в образе жизни и медикаментозное лечение.
[0006] Гиперлипидемия представляет собой состояние, при котором уровень липидов и/или липопротеинов в крови аномально повышен. Первичная гиперлипидемия, как правило, связана с генетическими причинами, тогда как вторичная гиперлипидемия возникает из-за других факторов, таких как сахарный диабет, применение некоторых лекарственных средств, а также потребление алкоголя. Гиперлипидемию можно разделить на гиперхолестеринемию и гипертриглицеридемию. В Соединенных Штатах гиперхолестеринемию обычно диагностируют, когда уровень общего холестерина превышает 240 мг/дл. Гипертриглицеридемию обычно диагностируют в Соединенных Штатах, когда уровень триглицеридов превышает 500 мг/дл.
[0007] Инсулиннезависимый (II типа), сахарный диабет возникает, когда клетки организма не отвечают должным образом на инсулин, состояние, известное как резистентность к инсулину. В результате, высокий уровень сахара в крови сохраняется в течение длительного периода времени. Основной причиной является избыточная масса тела и недостаточная двигательная активность. Долгосрочные осложнения могут включать в себя сердечно-сосудистые заболевания, инсульт, почечную недостаточность и повреждение глаз.
[0008] Синдром Кушинга связан с длительным воздействием аномально высокого уровня гормона кортизола. Кортизол вырабатывается в надпочечниках, и обычно индуцируется кортикотропином. Однако индуцированный питанием синдром Кушинга возникает, когда надпочечники аномально реагируют на желудочный ингибиторный полипептид (GIP).
[0009] Жировая болезнь печени (ЖБП) является общемировой хронической проблемой со здоровьем, которая встречается у взрослых и детей. Клинически ЖБП подразделяется на две большие группы: неалкогольную ЖБП (НАЖБП) и алкогольную ЖБП (АЖБП). НАЖБП и АЖБП характеризуются содержанием жира печени, превышающим 5-10%, единственный отличительный фактор, являющийся основной причиной заболевания. Однако обычно трудно провести различие между этими двумя классами ЖБП на основе только морфологических характеристик. Как правило, ЖБП возникает у тех, кто потребляет чрезмерное количество алкоголя, у тех, кто может иметь нарушения обмена веществ или генетическую предрасположенность, которые влияют на метаболизм жирных кислот, и/или у тех, кто страдает ожирением. Общие сопутствующие заболевания включают ожирение, сахарный диабет II типа (инсулиннезависимый) и гиперлипидемию.
[0010] Основные патологии ЖБП включают стеатоз печени и стеатогепатит с переходом в цирроз. Стеатоз возникает, когда содержание липидов в печени превышает 5-10% по весу, что указывает на аномальное удерживание липидных везикул и ингибирование окисления жирных кислот. Стеатоз считается обратимым, при условии выявления и устранения основной причины заболевания.
[0011] Если стеатоз сохраняется, он может трансформироваться в неалкогольный стеатогепатит (НАСГ) или алкогольный стеатогепатит (ASH) в зависимости от тяжести и исходной причины. В отличие от стеатоза, НАСГ и АСГ необратимы, а только поддаются лечению. Они характеризуются накоплением еще большего количества жира, смешанным лобулярным воспалением, баллонирующей дегенерацией гепатоцитов, гликогенированными ядрами гепатоцитов и перицеллюлярным фиброзом. Они могут переходит в цирроз и, в конечном итоге, рак печени.
[0012] Современные методы лечения ЖБП включают в себя (1) соблюдение плана разумной диеты и физических упражнений, (2) избегание усиления повреждения печени, которое может произойти вследствие внезапной потери веса или злоупотребления наркотиками, (3) снижение веса, (4) прием инсулин-сенсибилизирующих агентов для снижения резистентности к инсулину и контроль уровня глюкозы в крови, (5) использование препаратов, снижающих содержание липидов в крови, или препаратов для лечения заболевания печени, и (6) поиск печеночного трансплантата.
[0013] В клинических условиях подавители аппетита работают, частично вызывая тошноту. Таким образом, можно похудеть, если он/она хочет чувствовать себя плохо во время процесса. Такой побочный эффект является нежелательным, особенно в связи с просьбой пациента соблюдать режим для потери веса.
[0014] Желательными являются дополнительные методы лечения ЖБП и других заболеваний, связанных с накоплением жира.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0015] Настоящее изобретение направлено на моноклональные антитела (мАт), которые связываются с желудочным ингибиторным полипептидом (GIP), также известным как глюкозозависимый инсулинотропный полипептид, и к способам применения таких мАт для лечения заболеваний, связанных с накопление жира в тканях.
[0016] В данном описании раскрыты в различных вариантах осуществления способы лечения нескольких различных заболеваний или состояний. К ним относятся ожирение, диабет II типа, индуцированный питанием синдром Кушинга или метаболический синдром. Также раскрыты способы снижения накопления жира в ткани в печени, в сальнике или в подкожной клетчатке. Все эти способы включают введение человеку композиции, содержащей фармацевтически эффективное количество молекулярного антагониста желудочного ингибиторного полипептида (GIP).
[0017] Молекулярный антагонист содержит по меньшей мере одну определяющую комплементарность область (CDR), по меньшей мере на 80% идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 31, SEQ ID NO: 32 и SEQ ID NO: 33.
[0018] В определенных вариантах осуществления молекулярный антагонист содержит вариабельный домен легкой цепи, имеющий первую CDR и вторую CDR, причем каждая CDR имеет по меньшей мере 95% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24. Первая CDR и вторая CDR молекулярного антагониста соединены друг с другом соединительной группой. Соединительная группа может представлять собой цепочку аминокислот.
[0019] В других вариантах осуществления молекулярный антагонист содержит вариабельный домен легкой цепи, имеющий первую CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 20, вторую CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 21 и третью CDR с по меньшей мере 85% идентичности с аминокислотной последовательностью SEQ ID NO: 22. Первая CDR, вторая CDR и третья CDR молекулярного антагониста соединены друг с другом посредством соединительных групп. Соединительные группы могут представлять собой независимо друг от друга цепочку аминокислот.
[0020] В других вариантах осуществления молекулярный антагонист содержит вариабельный домен легкой цепи, имеющий по меньшей мере 80% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19.
[0021] В других вариантах осуществления молекулярный антагонист содержит вариабельный домен тяжелой цепи, имеющий первую CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 31, вторую CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 32 и третью CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 33.
[0022] В некоторых вариантах осуществления молекулярный антагонист содержит вариабельный домен тяжелой цепи, имеющий по меньшей мере 80% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30.
[0023] В конкретных вариантах осуществления молекулярный антагонист содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи; где вариабельный домен легкой цепи содержит первую CDR и вторую CDR, причем каждая CDR имеет по меньшей мере 95% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24; и где вариабельный домен тяжелой цепи содержит первую CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 31, вторую CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 32 и третью CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 33. Молекулярный антагонист может представлять собой одноцепочечный вариабельный фрагмент (scFv), F(abʹ)2-фрагмент, Fab- или Fabʹ-фрагмент, диантитело, триантитело, тетраантитело или моноклональное антитело.
[0024] В других вариантах осуществления молекулярный антагонист содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи; где вариабельный домен легкой цепи содержит по меньшей мере 80% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19; и где вариабельный домен тяжелой цепи содержит по меньшей мере 80% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30. Молекулярный антагонист может представлять собой одноцепочечный вариабельный фрагмент (scFv), F(abʹ)2-фрагмент, Fab- или Fabʹ-фрагмент, диантитело, триантитело, тетраантитело или моноклональное антитело.
[0025] В определенных вариантах осуществления молекулярный антагонист представляет собой моноклональное антитело с вариабельным доменом легкой цепи, имеющим по меньшей мере 80% идентичности с SEQ ID NO: 18, и вариабельным доменом тяжелой цепи, имеющим по меньшей мере 80% идентичности с аминокислотной последовательностью, выбранный из группы, состоящей из SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30.
[0026] В более конкретных вариантах осуществления молекулярный антагонист представляет собой полноразмерное моноклональное антитело с вариабельным доменом легкой цепи, имеющим по меньшей мере 90% идентичности с SEQ ID NO: 18, и вариабельным доменом тяжелой цепи, имеющим по меньшей мере 90% идентичности с SEQ ID NO: NO: 29.
[0027] Молекулярный антагонист может связываться с аминокислотной последовательностью GIP, причем аминокислотная последовательность выбрана из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4.
[0028] В конкретных вариантах осуществления молекулярный антагонист представляет собой полноразмерное моноклональное антитело, содержащее константные области антитела человека.
[0029] Молекулярный антагонист может иметь молекулярную массу (МW) от примерно 30 кДа до примерно 500 кДа. Молекулярный антагонист может иметь аффинность связывания с GIP, характеризуемую IC50 от примерно 0,1 нМ до примерно 7 нМ.
[0030] Композицию можно вводить внутривенно, внутрибрюшинно или подкожно. Композиция может дополнительно содержать инертное фармацевтическое вспомогательное вещество, выбранное из группы, состоящей из буферных агентов, поверхностно-активных веществ, консервантов, наполнителей, полимеров и стабилизаторов. Композиция может быть представлена в виде порошка, инъекций, раствора, суспензии или эмульсии.
[0031] Композиция может содержать моноклональное антитело-антагонист в количестве от примерно 0,1 до примерно 1000 миллиграмм на миллилитр композиции. Иногда, композиция является лиофилизированной.
[0032] Жировая болезнь печени может представлять собой алкогольную жировую болезнь печени или неалкогольную жировую болезнь печени.
[0033] Также в данном документе раскрыты молекулярные антагонисты желудочного ингибиторного полипептида (GIP), которые могут иметь различные формы, такие как полноразмерные моноклональные антитела и их варианты. Молекулярные антагонисты описаны выше.
[0034] Также в данном документе раскрыты комплементарные последовательности ДНК, содержащие по меньшей мере 85% идентичности с последовательностью ДНК, выбранной из группы, состоящей из SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41 и SEQ ID NO: 42.
[0035] Эти и другие не ограничивающие признаки настоящего раскрытия более подробно обсуждаются ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0036] Патент или файл заявки содержит по меньшей мере один рисунок, выполненный в цвете. Копии данного патента или публикации патентной заявки с цветным чертежом (цветными чертежами) будут предоставлены Организацией по запросу и после уплаты необходимой пошлины.
[0037] Ниже приведено краткое описание чертежей, которые представлены для целей иллюстрации примерных вариантов, раскрытых в данном документе, а не для целей ограничения их.
[0038] Фиг.1А представляет собой график, показывающий вес тела мышей в зависимости от времени для трех различных групп мышей на протяжении 17-недельного исследования. Мыши C57BL/6, которых кормили пищей с высоким содержанием жиров, являются признанной моделью индуцированного питанием ожирения и ассоциированного метаболического синдрома. «ВЖД-контрольных» мышей кормили пищей с высоким содержанием жиров (высокожировая диета, ВЖД) и вводили фосфатно-солевой буферный раствор (PBS) путем внутрибрюшинной инъекции. Мышей «ВЖД-мАт» кормили ВЖД-пищей и вводили путем внутрибрюшинной инъекции моноклональное антитело, антагонист желудочного ингибиторного полипептида (GIP мАт) в PBS в количестве 60 мг/кг веса тела (BW) в неделю. Мышей на «изо-диете» кормили изокалорийной пищей с низким содержанием жиров и не лечили. В ВЖД-диете около 60% от общего количества калорий получают из жира, а в изокалорийной диете, около 10% от общего количества калорий получают из жира. Мышам, которым вводили анти-GIP мАт, прибавляли в весе гораздо медленнее. ВЖД-контрольные мыши имели средний прирост веса 21,5±1,0 г в течение 17-недельного периода исследования. Мыши ВЖД-мАт имели средний прирост веса 11,5±0,5 г в течение 17-недельного периода исследования. Разница в прибавке в весе между этими двумя группами была достоверной с р-величиной 0,00000007.
[0039] Фиг. 1В представляет собой график, показывающий процентный прирост веса в зависимости от времени для трех различных групп мышей. Мыши, которым вводили GIP мАт, прибавляли в весе гораздо медленнее. ВЖД-контрольные мыши прибавляли в весе почти в два раза быстрее мышей ВЖД-мАт.
[0040] Фиг. 2 представляет собой график, показывающий результаты теста толерантности к глюкозе после внутрибрюшинного (i.p.) введения (IPGTT). После 17-недельного периода исследования у 6 мышей из каждой группы проводили IPGTT. После внутрибрюшинного введения раствора глюкозы (2 мг глюкозы/кг веса мыши), собирали кровь через 0, 10, 30, 60 и 120 минут и измеряли содержание глюкозы. Концентрацию глюкозы в крови откладывали на графике в зависимости от времени. ВЖД-контрольные мыши с меньшей эффективностью, чем мыши ВЖД-мАт или мыши на изо-диете, были способны справляться с нагрузкой глюкозой. Это согласуется с развитием интолерантности к глюкозе у ВЖД-контрольных мышей, но не у мышей ВЖД-мАт или мышей на изо-диете.
[0041] На фиг. 3 показаны репрезентативные магнитно-резонансные изображения мышей. Показаны репрезентативные изображения у ВЖД-контрольных мышей (слева) и у мышей ВЖД-мАт (справа). На изображениях представлен боковой вид мыши с головой вверху и задней частью внизу изображения. Белые или светлые участки представляют собой участки с высоким содержанием жира.
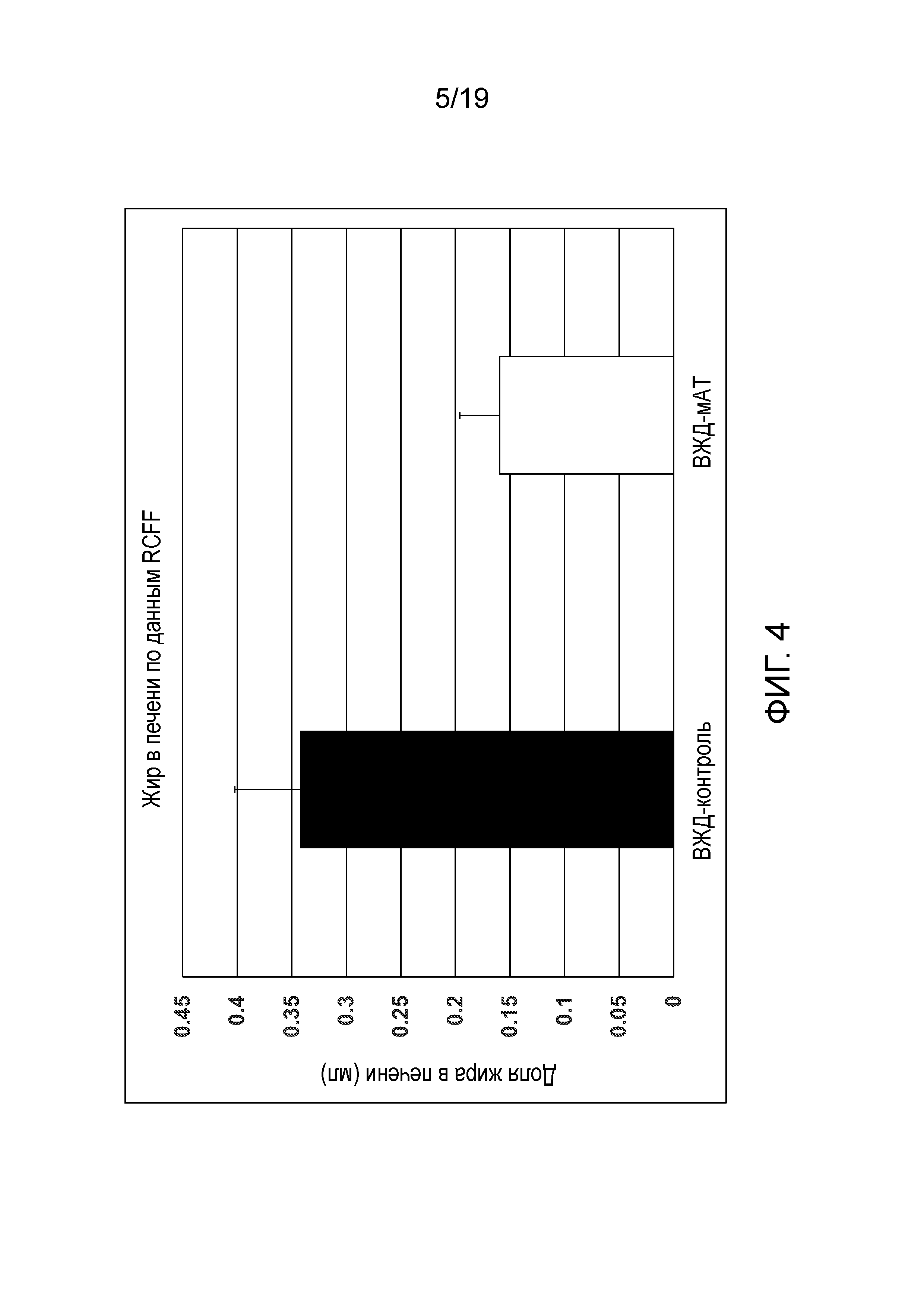
[0042] На фиг. 4 показана жировая фракция печени, определенная с помощью МРТ жировой фракции c компенсированной релаксацией (RCFF). В конце 17-недельного периода нахождения на заданном питании, 6 мышам из каждой группы давали наркоз и проводили МРТ. Методику RCFF использовали для количественной оценки жировой фракции печени у каждой мыши. На график наносили среднюю жировую фракцию печени для каждой группы. Контрольные животные накапливали в два раза больший объем жира в печени по сравнению с мышами, которые получали лечение GIP-специфичными мАт (р=0,03).
[0043] На фиг. 5 показана жировая фракция сальника, определенная с помощью МРТ жировой фракции c компенсированной релаксацией (RCFF) после 17-недельного периода нахождения на заданном питании. На график наносили среднюю жировую фракцию сальника для каждой группы. Контрольные животные накапливали почти в 3,5 раза больше объема жира в сальнике, чем мыши, которые получали лечение GIP-специфичными мАт (р=0,0005).
[0044] На фиг. 6 показана жировая фракция подкожной клетчатки, определенная с помощью МРТ жировой фракции c компенсированной релаксацией (RCFF). На график наносили среднюю жировую фракцию подкожной клетчатки для каждой группы. Контрольные животные накапливали примерно в 2 раза больше объема подкожного жира, чем мыши, которые получали лечение GIP-специфичными мАт (р=0,0002).
[0045] На фиг. 7 показаны репрезентативные фотографии окрашенных срезов тканей, полученных из печени умерщвленных мышей после 17-недельного периода исследования. Печень удаляли и фиксировали в формалине. Из фиксированный ткани делали срезы и окрашивали масляным красным O, а жирорастворимый диазокраситель использовали для окрашивания нейтральных триглицеридов и липидов. На панелях представлены репрезентативные образцы, показывающие заметное снижение темно-красных капелек жира в печени мышей ВЖД-мАт (справа) по сравнению с ВЖД-контрольными мышами (слева).
[0046] Фиг. 8 представляет собой набор из двух фотографий, в котором сравнивается сальниковый жир у ВЖД-контрольной мыши (слева) и у ВЖД-мАт мыши (справа) после 17-недельного периода исследования. Жир имеет белый цвет, и гораздо больше жира наблюдается у ВЖД-контрольной мыши.
[0047] На фиг. 9 показаны уровни триглицеридов (ТГ), измеренные в сыворотке мышей. В конце 17-недельного периода нахождения на заданном питании мышей забивали, собирали цельную кровь, получали сыворотку и измеряли содержание триглицеридов в сыворотке крови. На график наносили средний уровень ТГ в сыворотке крови для мышей из каждой группы. Уровень ТГ у ВЖД-контрольных мышей был в 1,44 раза выше уровня ТГ у мышей ВЖД-мАт (р=0,02). Более высокое содержание ТГ связано с ожирением и метаболическим синдромом.
[0048] На фиг. 10 показано содержание общего холестерина (ОХ), измеренное в сыворотке крови у мышей после 17-недельного периода нахождения на заданном питании. Содержание ОХ у ВЖД-контрольных мышей было в 1,55 раза выше содержания ОХ у мышей ВЖД-мАт (р=0,006). Более высокое содержание ОХ связано с ожирением и метаболическим синдромом.
[0049] На фиг. 11 показано соотношение количества липопротеинов высокой плотности (ЛПВП) и общего холестерина (ОХ), измеренного в сыворотке мышей после 17-недельного периода нахождения на заданном питании. На график наносили среднее значение для каждой группы. Соотношение уровней ЛПВП и общего холестерина у ВЖД-мАТ мышей было на 25% выше соотношения уровней ЛПВП и общего холестерина у ВЖД-контрольных мышей (величина р=0,03). Более высокое соотношение уровня ЛПВП и общего холестерина является желательным, поскольку более низкие значения соотношения связаны с ожирением и метаболическим синдромом.
[0050] На фиг. 12 показаны уровни липопротеинов низкой плотности (ЛПНП), измеренные в сыворотке мышей после 17-недельного периода нахождения на заданном питании. На график наносили средний уровень ЛПНП в сыворотке для мышей из каждой группы. Содержание ЛПНП у ВЖД-контрольных мышей было в 1,95 раза выше содержания ЛПНП у мышей ВЖД-мАт (р=0,007). Более высокое содержание LDL («плохой» холестерин) связано с ожирением и метаболическим синдромом.
[0051] На фиг. 13 показаны уровни инсулина, измеренные в сыворотке мышей после 17-недельного периода нахождения на заданном питании. На график нанесены средний уровень инсулина в сыворотке для 5 мышей из каждой группы. Содержание инсулина у ВЖД-контрольных мышей в 2,6 раза выше содержания инсулина у мышей ВЖД-мАт (р=0,03). Более высокое содержание инсулина связанно с ожирением, резистентностью к инсулину и метаболическим синдромом. Обратите внимание, что единицей измерения на оси у является пикограмм/миллилитр.
[0052] На фиг. 14 показаны уровни адипонектина, измеренные в сыворотке мышей после 17-недельного периода нахождения на заданном питании. На график наносили средний уровень адипонектина в сыворотке мышей из каждой группы. Содержание адипонектина у ВЖД-контрольных мышей было в 1,35 раза выше содержания адипонектина у мышей ВЖД-мАт. Более высокое содержание адипонектина связано с увеличением общего содержания жира в организме. Обратите внимание, что единицей измерения на оси у является микрограмм/миллилитр.
[0053] На фиг. 15 показаны уровни лептина, измеренные в сыворотке мышей после 17-недельного периода нахождения на заданном питании. На график наносили средний уровень лептина в сыворотке мышей из каждой группы. Содержание лептина у ВЖД-контрольных мышей было 5,73 раза выше содержания лептина у мышей ВЖД-мАт (р=0,006). Более высокое содержание лептина связано с увеличением общего содержания жира в организме. Обратите внимание, что единицей измерения на оси у является пикограмм/миллилитр.
[0054] На фиг. 16 показаны уровни глюкагона, измеренные в сыворотке мышей после 17-недельного периода нахождения на заданном питании. На график наносили средние уровни глюкагона в сыворотке мышей из каждой группы. Не наблюдалось никаких существенных различий в содержании глюкагона в сыворотке между группами. Обратите внимание, что единицей измерения на оси у является пикограмм/миллилитр.
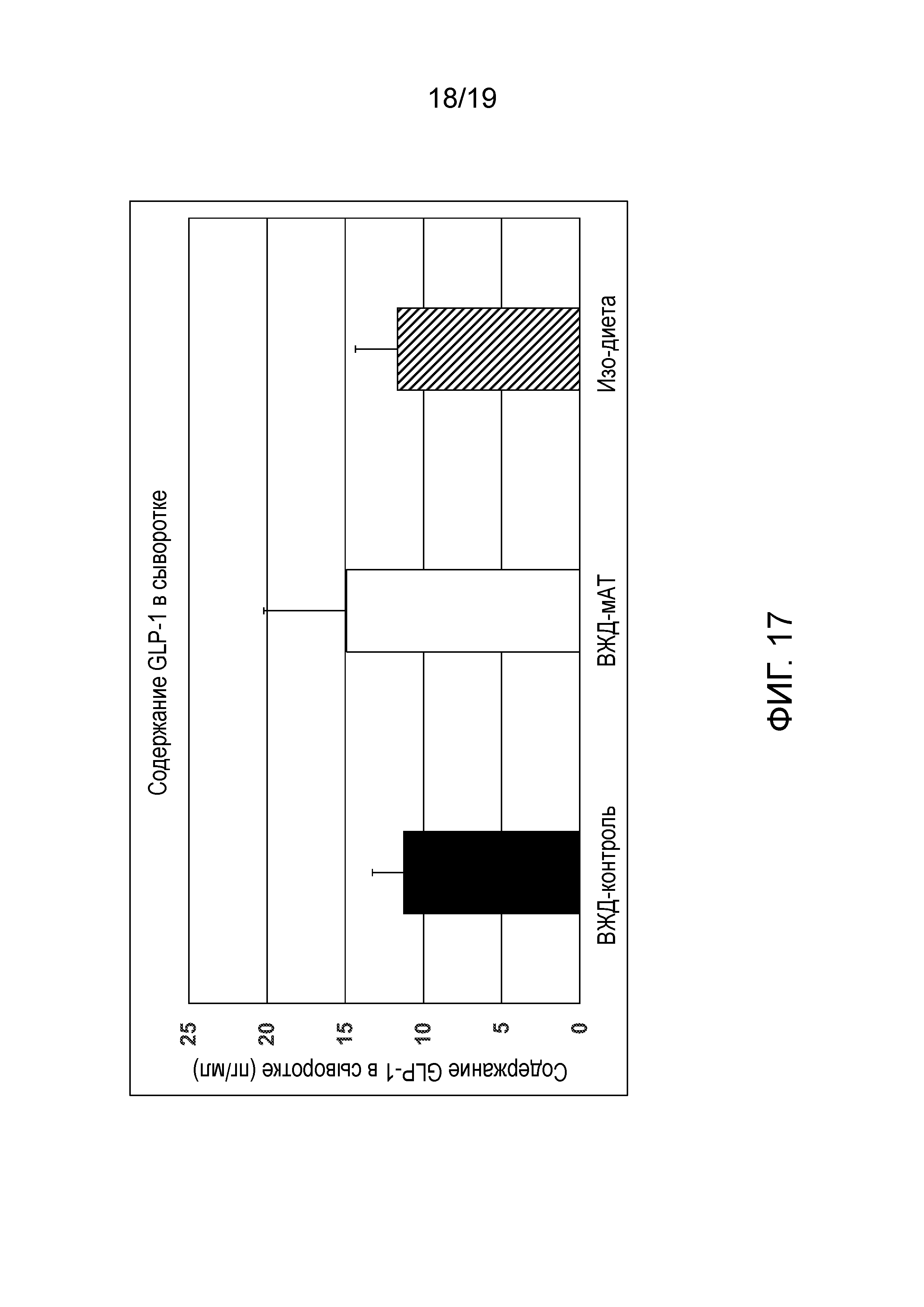
[0055] На фиг. 17 показаны уровни глюкагон-подобного пептида 1 (GLP-1), измеренные в сыворотке крови у мышей после 17-недельного периода нахождения на заданном питании. На график наносили средние уровни GLP-1 в сыворотке мышей из каждой группы. Не наблюдалось никаких существенных различий в содержании GLP-1 в сыворотке между группами. Обратите внимание, что единицей измерения на оси у является пикограмм/миллилитр.
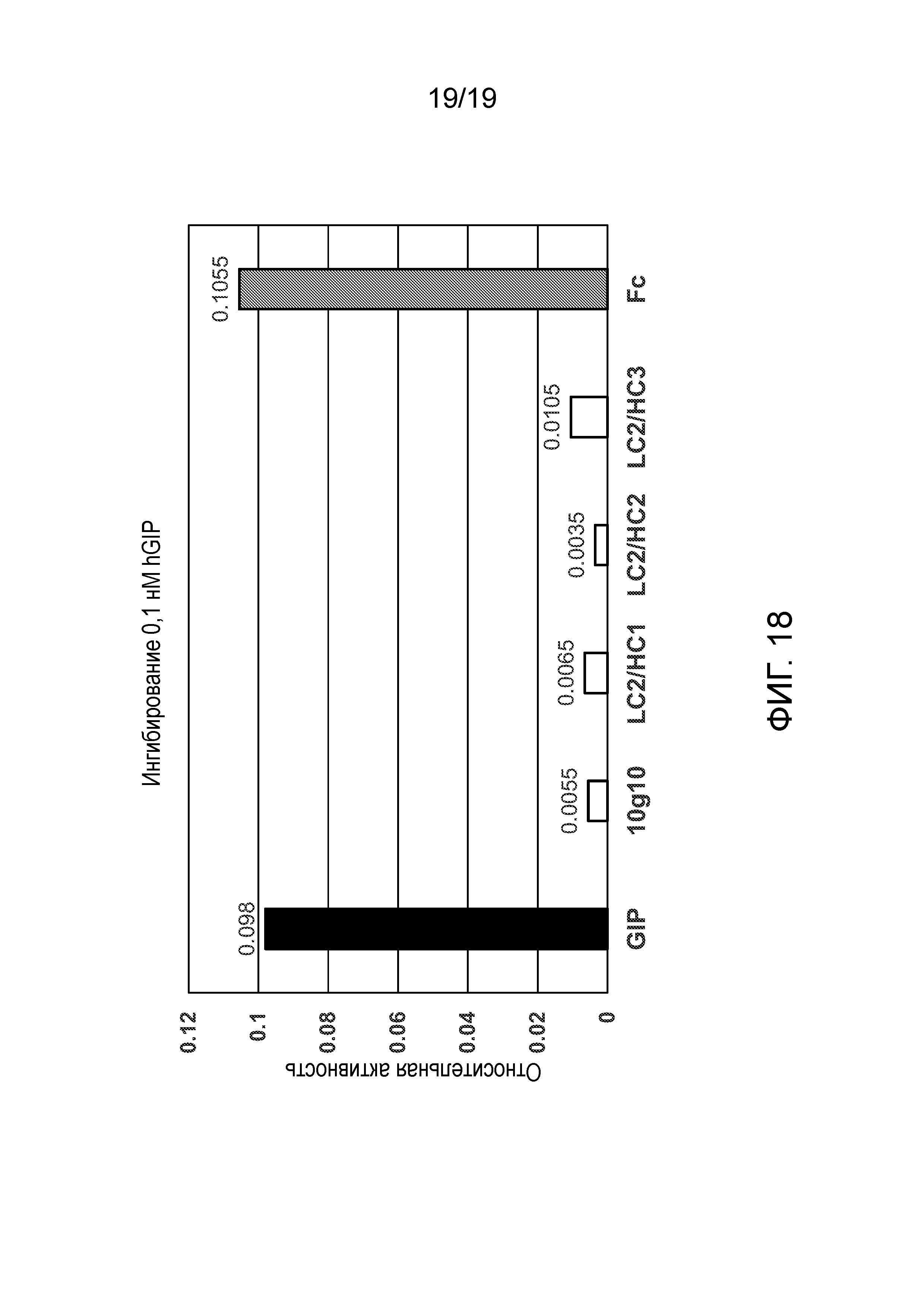
[0056] Фиг. 18 представляет собой график, показывающий относительную активность трех гуманизированных антител к GIP, наряду с исходным антителом, положительным контролем и отрицательным контролем в анализе нейтрализующей активности in vitro. На оси ординат отложена относительная активность, и она является безразмерной.
ПОДРОБНОЕ ОПИСАНИЕ
[0057] Формы единственного числа включают в себя множественное число, если контекст явно не диктует иное.
[0058] Используемые в данном описании и в формуле изобретения открытые переходные фразы «включает в себя», «содержит», «имеет», «включает» и их варианты требуют присутствия перечисленных ингредиентов/стадий и разрешают присутствие других ингредиентов/стадий. Эти фразы также должны быть истолкованы как раскрытие закрытых фраз «состоит из» или «по существу состоит из», которые разрешают только перечисленные ингредиенты/стадии и неизбежные примеси, и исключают другие ингредиенты/стадии.
[0059] Следует понимать, что численные величины в описании и формуле изобретения настоящей заявки включают в себя численные величины, которые являются одинаковыми при сведении к одному числу значащих цифр и численные величины, которые отличаются от указанного значения меньше, чем экспериментальная погрешность обычной методики измерений, типа описанной в настоящей заявке для определения величины.
[0060] Все диапазоны, раскрытые в данном документе, включают указанные конечные точки и комбинируются независимо друг от друга (например, диапазон «от 2 г до 10 г» включает конечные точки, 2 грамма и 10 граммов, и все промежуточные значения).
[0061] Термин «примерно» может быть использован, чтобы включать любую числовую величину, которая может быть изменена без изменения основной функции этой величины. При использовании совместно с диапазоном «примерно» также раскрывает диапазон, определенный абсолютными величинами двух конечных точек, например, «от примерно 2 до примерно 4» также раскрывает диапазон «от 2 до 4». Термин «примерно» может означать плюс или минус 10% от указанного количества.
[0062] Термин «идентичность» относится к сходству между парой последовательностей (нуклеотидных или аминокислотных). Идентичность измеряется путем деления числа идентичных остатков на общее количество остатков и умножения результата на 100 для получения процентной величины. Таким образом, две копии одинаковой последовательности имеют 100% идентичности, но последовательности, которые являются менее высококонсервативными и имеют делеции, дополнения или замены, могут иметь более низкую степень идентичности. Специалистам в данной области техники будет понятно, что некоторые компьютерные программы, такие как те, которые используют алгоритмы, подобно BLAST, доступны для определения идентичности последовательностей. Поиск BLAST по нуклеотидным последовательностям производится с помощью программы NBLAST, а поиск BLAST по белку выполняется с помощью программы BLASTP с использованием параметров по умолчанию соответствующих программ.
[0063] Две разных последовательности могут отличаться друг от друга, не влияя на общую функцию белка, кодируемого последовательностью. В связи с этим, в данной области техники хорошо известно, что химически подобные аминокислоты могут заменять друг друга, часто без изменения функции. Соответствующие свойства могут включать в себя кислотность/основность, полярность/неполярность, электрический заряд, гидрофобность и химическую структуру. Например, основные остатки Lys и Arg считаются химически подобными и часто заменяют друг друга, как это делают кислотные остатки Asp и Glu, гидроксильные остатки Ser и Thr, ароматические остатки Tyr, Phe и Trp, и неполярные остатки Ala, Val, Ile, Leu и Met. Эти замены считаются «консервативными». Аналогично, в данной области техники известны нуклеотидные кодоны и приемлемые вариации. Например, кодоны ACT, ACC, АСА и ACG, все кодируют аминокислоту треонин, то есть третий нуклеотид может быть изменен без изменения получающейся аминокислоты. Сходство измеряется путем деления числа подобных остатков на общее количества остатков и умножения результата на 100 для получения процентной величины. Следует отметить, что сходство и идентичность являются мерой различных свойств.
[0064] «Антитело» представляет собой белок, используемый иммунной системой для идентификации антигена-мишени. Основной функциональной единицей антитела является иммуноглобулиновый мономер. Мономер состоит из двух идентичных тяжелых цепей и двух идентичных легких цепей, которые образуют Y-образный белок. Каждая легкая цепь состоит из одного константного домена и одного вариабельного домена. Для легких цепей, константный домен может также указываться как «константная область», а вариабельный домен также может указываться как «вариабельная область». Каждая тяжелая цепь состоит из одного вариабельного домена и трех или четырех константных доменов. Для тяжелых цепей, константные домены вместе указываются как «константная область», а вариабельный домен также может указываться как «вариабельная область». Плечи Y называются областью антиген-связывающих фрагментов (Fab), причем каждое плечо называется Fab-фрагментом. Каждый Fab-фрагмент состоит из одного константного домена и одного вариабельного домена из тяжелой цепи и одного константного домена и одного вариабельного домена из легкой цепи. Основание Y называется Fc-областью и состоит из двух или трех константных доменов от каждой тяжелой цепи. Вариабельные домены тяжелых и легких цепей в Fab-области являются частью антитела, которая связывается с GIP. Более конкретно, определяющие комплементарность области (CDR) вариабельных доменов связываются со своим антигеном (т.е. GIP). В аминокислотной последовательности каждого вариабельного домена присутствуют три CDR, расположенные не последовательно. Термин «полноразмерное» используется в данном документе для обозначения антитела, которое содержит Fab-область и Fc-область.
[0065] «Антагонист GIP» согласно настоящему изобретению представляет собой молекулу, которая связывается с GIP и препятствует биологическому действию GIP.
[0066] Настоящее изобретение относится к способам лечения пациентов с использованием молекул, которые противодействуют GIP, т.е. связываются с GIP. В связи с этим, глюкозозависимый инсулинотропный полипептид, также указываемый как желудочный ингибиторный полипептид или GIP, представляет собой инсулинотропный пептид, высвобождаемый из кишечника K-клетками после приема пищи. В качестве инкретина, GIP стимулирует секрецию инсулина, стимулируя панкреатические бета-клетки в ответ на прием пищи. GIP, также указываемый в данном документе как GIP(1-42), в основном циркулирует в виде 42-аминокислотного полипептида, а также присутствует в форме, лишенной первых 2 N-концевых аминокислот (GIP(3-42)). GIP(1-30)-NH2 или GIP(1-30)-альфаамид представляет собой синтетическое производное GIР(1-42), лишенное последних 12 С-концевых аминокислот. GIP(1-30)-NH2 имеет те же биологические функции, что и GIP(1-42). Существование GIP(1-30)-NH2 в природе было предложено гипотетически, но он не был идентифицирован ни у одного биологического вида.
[0067] GIP функционирует посредством связывания с своим рецептором (GIPR), находящимся на поверхности клеток-мишеней. GIPR является членом глюкагон-секретинового семейства G-белок-связанных рецепторов (GPCR), имеющих семь трансмембранных доменов. Природный GIP(1-42) и синтетическое производное GIP(1-30)-NH2 связываются с GIPR с высокой аффинностью и обладают свойствами агониста. Рецепторы GIP также экспрессируются в адипоцитах, которые реагируют на повышение уровня GIP увеличением потребления глюкозы, синтезом жирных кислот и включением жирных кислот в липиды в адипоцитах. Природный GIP(1-42) и синтетическое производное GIP(1-30)-NH2 также ингибируют липолиз в адипоцитах, индуцируемый глюкагоном и агонистами β-адренергических рецепторов, включая изопротеренол.
[0068] GIP является высококонсервативным у человека (Homo sapiens) (SEQ ID NO: 1), мыши (Mus musculus) (SEQ ID NO: 2), крысы (Rattusnorvegicus) (SEQ ID NO: 3) и свиньи (Sus scrofa) (SEQ ID NO: 4). Четыре последовательности отличаются только четырьмя заменами, все из которых являются консервативными. 42-аминокислотные последовательности этих четырех видов перечислены ниже:
SEQ ID NO: 1: YAEGT FISDY SIAMD KIHQQ DFVNW LLAQK GKKND WKHNI TQ
SEQ ID NO: 2: YAEGT FISDY SIAMD KIRQQ DFVNW LLAQR GKKSD WKHNI TQ
SEQ ID NO: 3: YAEGT FISDY SIAMD KIRQQ DFVNW LLAQK GKKND WKHNL TQ
SEQ ID NO: 4: YAEGT FISDY SIAMD KIRQQ DFVNW LLAQK GKKSD WKHNI TQ
[0069] Настоящее изобретение относится к способам лечения жировой болезни печени (ЖБП), а также других заболеваний, которые включают накопление жировой ткани, с использованием композиций, содержащих молекулярные антагонисты, которые связываются с GIP. В конкретных вариантах осуществления молекулярными антагонистами являются полноразмерные моноклональные антитела (т.е. анти-GIP мАт). При жировой болезни печени стеатоз приводит к накоплению триглицеридных жиров в клетках печени. Известно, что после перорального введения глюкозы содержание GIP в сыворотке увеличивается от 5 до 6 раз, что стимулирует высвобождение инсулина, способствующего поглощению глюкозы. GIP также активирует Akt/PKB, которые способствуют мембранной транслокации переносчика глюкозы 4, что приводит к повышенному поглощению глюкозы адипоцитами, что приводит к синтезу и накоплению жира. В итоге, была высказана гипотеза, что противодействие GIP и снижение его биологической активности будут ингибировать абсорбцию глюкозы и, таким образом, приведут к снижению синтеза и накопления жира. Настоящее описание показывает, что удержание жира в печени, сальнике или подкожной клетчатке может быть снижено путем введения пациенту композиции, содержащей моноклональное антитело-антагонист к GIP. Другие молекулярные антагонисты, которые являются вариациями CDR из моноклонального антитела, также могут быть эффективными в отношении снижения накопления жировой ткани.
[0070] Молекулярные антагонисты GIP, описанные в данном документе, также могут быть полезными для облегчения других заболеваний или состояний, которые можно лечить путем снижения экспрессии GIP или путем снижения потребления калорий или потери веса, таких как ожирение, метаболический синдром, гиперлипидемия, диабет II типа и индуцированный питанием синдром Кушинга.
[0071] Моноклональные антитела-антагонисты к GIP по настоящему изобретению могут быть получены и скринированы следующим образом. Два пептида со следующими аминокислотными последовательностями были синтезированы химическим путем:
GIP(1-17)+C: YAEGT FISDY SIAMD KIC (SEQ ID NO: 5)
C+mGIP(26-42): CLLAQ RGKKS DWKHN ITQ (SEQ ID NO: 6)
[0072] Аминокислотная последовательность GIP(1-17)+C соответствует первым 17 аминокислотам, обычно общим у зрелого GIP человека, мыши, крысы и свиньи. Последовательность также содержит дополнительный остаток цистеина на N-конце, чтобы облегчить конъюгирование с гемоцианином морского блюдечка (KLH). Аминокислотная последовательность С+mGIP (26-42) соответствует последним 17 аминокислотам зрелого мышиного GIP, который имеет только две замены при сравнении отдельно с GIP человека или GIP свиньи, и только три замены по сравнению с крысиным GIP. Последовательность также содержит дополнительный остаток цистеина на C-конце для облегчения конъюгации с KLH. Два пептида конъюгировали с KLH. Каждый конъюгат затем использовали отдельно для введения группе из четырех мышей в четырех различных случаях. Инъекции мышам делали на 1-й, 4-й, 7-й, 10-й и 24-й неделе перед сбором селезенки.
[0073] Селезенки извлекали из иммунизированных мышей, и выделяли спленоциты перед слиянием В-клеток с иммортализованными клетками миеломы in vitro. Для повышения эффективности в процессе слияния добавляли полиэтиленгликоль (ПЭГ). Гибридные клетки или гибридомы инкубировали в гипоксантин-аминоптерин-тимидиновой (HAT) среде в течение 14 дней, чтобы убить клетки миеломы, которые не слились с В-клетками. Клетки гибридомы затем разбавляли инкубационной средой и переносили в несколько 96-луночных планшетов. Степень разбавления была такой, чтобы каждая лунка содержала приблизительно одну клетку. Клетки гибридомы размножали в течение несколько дней перед сбором кондиционной среды или супернатанта для скрининга.
[0074] 96-луночные планшеты покрывали синтезированным мышиным GIP(1-42) (Phoenix Pharmaceuticals), используя 50 мкл 4 мкг/мл раствора в PBS. Гибридомные супернатанты затем собирали и добавляли в лунки, содержащие мышиный GIP(1-42), на 4 часа при температуре 37°C. Супернатанты затем удаляли, и лунки промывали, чтобы удалить все антитела, не связавшиеся с мышиным GIP. Далее в лунки добавляли раствор козьих анти-мышиных IgG, конъюгированных с пероксидазой хрена (HRP). Козьи анти-мышиные IgG-HRP приобретали в Jackson Laboratories и использовали в разведении 1:5000. После инкубации в течение 1 часа при 37°С удаляли раствор антитела и лунки промывали 2 раза 0,4 мг/мл раствором BSA в PBS.
[0075] Затем в каждую лунку добавляли раствор, содержащий 4 мг/мл субстрата HRP, о-фенилендиамина дигидрохлорида (ОРО), в 0,4 мг/мл пероксиде мочевины и 0,05 М фосфатно-цитратном буфере, рН 5,0. Для количественной оценки пероксидазную активность измеряли для каждой лунки по поглощение света при длине волны 490 нм при помощи ELISA-планшетного спектрофотометра. Это позволило идентифицировать гибридомы, которые продуцируют моноклональные антитела, связывающиеся с мышиным GIP в лунках.
[0076] Далее, супернатант от этих идентифицированных гибридом смешивали с 4 мкг/мл раствором мышиного GIP в течение 30 минут при 37°С, после чего добавляли в лунки, покрытые мышиным GIP, как описано выше. После инкубации в течение 1 часа при температуре 37°С лунки промывали, и в них добавляли козьи анти-мышиные IgG-HRP. После инкубации в течение 1 ч образцы промывали, и в каждую лунку добавляли раствор, содержащий 4 мг/мл субстрата HRP (OPO) в 0,4 мг/мл пероксиде мочевины и 0,05 М фосфатно-цитратном буфере, рН 5,0. Активность HRP количественно оценивали в каждой лунке. В этом скрининге моноклональные антитела, которые связываются с GIP в суспензии, будут «нейтрализованы» и не будут иметь возможность связываться с GIP, фиксированным в лунках. Поэтому, лунки с низкой активностью HRP соответствуют моноклональным антителам, которые более эффективно связывали GIP в суспензии. С использованием этих критериев были идентифицированы пять гибридом, которые продуцировали лучшие моноклональные антитела (мАт), связывающиеся с мышиным GIP в суспензии. Из-за высокой степени идентичности между GIP мыши и человека, ожидалось, что данные моноклональные антитела, которые связываются с мышиным GIP, также связываются с GIP человека.
[0077] Затем проверяли способность супернатанта гибридом нейтрализовать GIP и предупреждать взаимодействие лиганда с рецептором, активацию рецептора и рецепторнозависимую передачу сигнала с использованием системы на основе клеточной культуры. В данной системе используются репортерные клетки (клетки LGIPR2), которые несут геном LacZ под контролем промотора, отвечающего на циклический аденозинмонофосфат (цАМФ), и экспрессируют крысиный GIPR на поверхности клетки. Добавление GIP к этим клеткам приводит к активации GIPR, индукции сигнального каскада, что приводит к накоплению цАМФ, индукции гена LacZ и синтезу β-галактозидазы. После добавления исследуемого образца и 4-часовой инкубации, использовали колориметрический анализ для измерения содержания β-галактозидазы в клеточных лизатах. Степень изменения цвета пропорциональна уровню β-галактозидазы. Уровень β-галактозидазы зависит от количества свободного биологически активного GIP в тестируемом образце.
[0078] Супернатанты от пяти выращенных в культуре гибридомных клонов, считающихся положительными по суспензионному анализу, разводили в соотношении 1:1 и 1:20 растворами мышиного или человеческого GIP. Смеси затем добавляли к клеткам и инкубировали LGIPR2 перед промывкой и тестированием на β-галактозидазу. Три из пяти супернатантов давали значительное ингибирование активности мышиного GIP при разведении 1:1, а два из этих трех супернатантов давали значительное ингибирование мышиного GIP при разведении 1:20.
[0079] Для того, чтобы продемонстрировать, что моноклональные антитела были специфичными к GIP, супернатанты от пяти гибридом, оцениваемых положительными в суспензионном анализе, разводили в соотношении 1:1 0,1 нМ раствором человеческого глюкагон-подобного пептида-1 (GLP-1). Смеси затем добавляли к клеткам LGLP-1R. Клетки LGLP-1R идентичны клеткам LGIPR2 за исключением того, что они экспрессируют рецептор GLP-1, а не GIPR. Клетки инкубировали в течение 4 часов при температуре 37°С до того, как смеси удаляли, клетки промывали и анализировали содержание β-галактозидазы. Ни один из супернатантов не ингибировал природный GLP-1, что указывает на их специфичность в отношении GIP.
[0080] Затем две гибридомы, которые продуцировали супернатанты, дающие значительное ингибирование мышиного GIP при разведении 1:20, размножали и собирали примерно 5×105 клеток и выделяли общую РНК с использованием набора, приобретенного у Ambion (RNaqueous-4PCR, Life Technologies). Два микрограмма общей РНК использовали для получения первой цепи кДНК с использованием системы для синтеза первой цепи кДНК Suprscript III, приобретенной у компании Life Technologies. Полученную кДНК использовали для амплификации кДНК, кодирующей последовательности вариабельных областей тяжелых и легких цепей в двух отдельных полимеразных цепных реакциях (ПЦР).
[0081] Для амплификации последовательностей вариабельных областей тяжелых цепей, использовали олигонуклеотид с последовательностью CAGTCGAAGC TTTGAGGAGA CGGTGACCGTG GTCCCTTGGC CCCAG (SEQ ID NO: 43) в качестве обратного праймера, и олигонуклеотид с последовательностью CAACTAGGAT CCAGGTSMAR CTGCAGSAGT CWGG (SEQ ID NO: 44) использовали в качестве прямого праймера. Обратный праймер содержит последовательность AAGCTT (SEQ ID NO: 45) на своем 5'-конце, которая является последовательностью, узнаваемой рестриктазой HindIII. Прямой праймер содержит последовательность GGATCC (SEQ ID NO: 46) на своем 5'-конце, которая является последовательностью, узнаваемой рестриктазой BamHI. Полученные продукты ПЦР расщепляли ферментами HindIII-BamHI и затем лигировали с плазмидой pUC18, которую также расщепляли ферментами рестрикции HindIII и BamHI. Реакцию лигирования проводили с использованием набора Fast-Link, приобретенного у Epicentre. Лигазную реакцию использовали для трансформации бактериальных клеток E.coli DH5a (Life Technologies). Бактерии, которые включали плазмиду, отбирали на чашках с агаром, содержащих 50 мкг/миллилитр (мкг/мл) карбенициллина. Колонии, выросшие на карбенициллиновом агаре, выкалывали и наращивали в 2-мл культурах в течение 16 часов. Бактерии собирали, и выделяли плазмидную ДНК с использованием мини-препаративного способа щелочного лизиса. Очищенную плазмидную ДНК расщепляли ферментами рестрикции BamHI и HindIII перед разделением ДНК с помощью электрофореза в 1,2%-м агарозном геле в Трис-боратном буфере. Фрагменты ДНК в геле окрашивали бромистым этидием и визуализировали с использованием ультрафиолетовой лампы. Плазмиды, дающие рестрикционные фрагменты с приблизительным размером 374 пар оснований, секвенировали с использованием услуги, предоставляемой Eurofins MWG Operon (Huntsville, AL).
[0082] Для амплификации последовательностей вариабельных областей легких цепей следовали в общем такой же процедуре, как описанная выше. Основные отличия состояли в том, что в качестве прямого праймера использовали олигонуклеотид с последовательностью CAGTCGAAGC TTGTTAGATC TCCAGCTTG GTCCC (SEQ ID NO: 47) и олигонуклеотид с последовательностью CAACTAGGAT CCGACATTCA GCTGACCCAG TCTCCA (SEQ ID NO: 48) использовали в качестве обратного праймера. Точно также, прямой праймер содержал последовательность узнавания для HindIII (SEQ ID NO: 45), а обратный праймер содержал последовательность узнавания для BamHI (SEQ ID NO: 46). Плазмиды, дающие рестрикционные фрагменты с приблизительным размером 355 пар оснований, секвенировали с использованием услуги, предоставляемой Eurofins MWG Operon (Huntsville, AL).
[0083] Полученные в результате моноклональные антитела, идентифицированные с использованием процедуры, описанной выше, представляют собой мышиные антитела. Эти мышиные антитела были частично гуманизированы путем создания химерных антител, несущих мышиные вариабельные домены тяжелых и легких цепей, слитые с константными областями тяжелых и легких цепей антител человека, соответственно. Это осуществляли путем амплификации вариабельных последовательностей тяжелой цепи и легкой цепи с использованием ПЦР. Матрицами, используемыми в ПЦР, были производные pUC18, содержащие соответствующие последовательности кДНК вариабельных областей тяжелых или легких цепей. Вариабельные области тяжелых цепей амплифицировали с использованием олигонуклеотида с последовательностью TCACGAATTC TCAGGTCCAG CTGCAGGAGT (SEQ ID NO: 49) в качестве прямого праймера, и олигонуклеотида с последовательностью TTGGTGCTAG CTGAGGAGAC GGTGACCGT (SEQ ID NO: 50) в качестве обратного праймера. Прямой праймер содержит последовательность GAATTC (SEQ ID NO: 51) на своем 5'-конце, которая является последовательностью, узнаваемой рестриктазой EcoRI. Обратный праймер содержит последовательность GCTAGC (SEQ ID NO: 52) на своем 5'-конце, который является последовательностью, узнаваемой рестриктазой NheI. После ПЦР-амплификации ДНК-фрагменты расщепляли с помощью EcoRI и NheI и лигировали с плазмидой pFUSEss-CHIg-hG1, которую также расщепляли ферментами рестрикции EcoRI и NheI. Плазмида pFUSEss-Chig-HG1 представляет собой вектор для экспрессии в клетках млекопитающих, приобретенный у InvivoGen (San Diego, CA). Клонирование последовательностей кДНК вариабельных областей тяжелых цепей в эту плазмиду дает ген, который кодирует химерную тяжелую цепь, состоящую из вариабельной области мыши и константной области человека. Реакцию лигирования проводили с использованием набора Fast-Link, приобретенного у Epicentre. Реакцию лигирования использовали для трансформации бактериальных клеток E.coli DH5a (Life Technologies). Бактерии, которые включали плазмиды, были отобраны на чашках, содержащих 50 мкг/мл зеомицина. Колонии, выросшие на чашках с зеомициновым агаром, выкалывали и наращивали в 2-мл культурах в течение 16 часов. Бактерии собирали, и плазмидную ДНК выделяли с использованием мини-препаративного способа щелочного лизиса. Очищенную плазмидную ДНК расщепляли ферментами рестрикции EcoRII и NheI перед разделением ДНК с помощью электрофореза в 1,2%-м агарозном геле в Трис-боратном буфере. Фрагменты ДНК в геле окрашивали бромистым этидием и визуализировали с использованием ультрафиолетовой лампы. Успешное клонирование подтверждали идентификацией фрагмента ДНК с размером 373 пар оснований.
[0084] Вариабельные области легких цепей были амплифицированы с использованием в качестве прямого праймера олигонуклеотида с последовательностью GTCACGAATTCAGACATTCAGCTGACCCAG (SEQ ID NO: 55), содержащего последовательность узнавания (SEQ ID NO: 51) рестриктазы EcoRI, и олигонуклеотида с последовательностью AGCCACCGTA CGTTTGATCT CCAGCTTGGT CCCA (SEQ ID NO: 53) в качестве обратного праймера. Обратный праймер содержит последовательность CGTACG (SEQ ID NO: 54) на своем 5'-конце, которая является последовательностью, узнаваемой рестриктазой BsiWI. После ПЦР-амплификации ДНК-фрагменты расщепляли с помощью EcoRI и BsiWI и лигировали с плазмидой pFUSE2ss-CLIg-hK, которую также расщепляли ферментами рестрикции EcoRI и BsiWI. Плазмида pFUSE2ss-CLIg-hK представляет собой вектор для экспрессии в клетках млекопитающих, приобретенный у InvivoGen (San Diego, CA). Клонирование последовательностей кДНК вариабельных областей легких цепей в эту плазмиду дает ген, который кодирует химерную легкую цепь, состоящую из вариабельной области мыши и константной области человека. Реакцию лигирования проводили с использованием набора Fast-Link, приобретенного у Epicentre. Реакцию лигирования использовали для трансформации бактериальных клеток E.coli DH5a (Life Technologies). Бактерии, которые включали плазмиду, отбирали на чашках с агаром, содержащих 50 мкг/мл бластоцидина. Колонии, выросшие на чашках с бластоцидиновым агаром, собирали и наращивали в 2-мл культуре в течение 16 часов. Бактерии собирали, и плазмидную ДНК выделяли с использованием мини-препаративного способа щелочного лизиса. Очищенную плазмидную ДНК расщепляли ферментами рестрикции EcoRII и BsiWI перед разделением ДНК с помощью электрофореза в 1,2%-м агарозном геле в Трис-боратном буфере. Фрагменты ДНК в геле окрашивали бромистым этидием и визуализировали с использованием ультрафиолетовой лампы. Успешное клонирование подтверждали идентификацией фрагмента ДНК с размером 353 пар оснований.
[0085] Для экспрессии химерных антител, содержащих клонированные из гибридом вариабельные области и константные области человека, производные pFUSEss-CHIg-hG1 и pFUSE2ss-CLIg-hK, содержащие вариабельные последовательности тяжелой цепи и легкой цепи, соответственно, были введены в клетки яичника китайского хомячка (СНО-1) в культуре. Плазмидная ДНК была введена путем трансфекции с использованием катионнолипидного реагента Turbofect (Thermo Scientific, Pittsburgh, PA), способствующего проникновению ДНК в культивируемые клетки. Через два дня после трансфекции клеточный супернатант собирали и анализировали на содержание GIP-нейтрализующей активности. Для того, чтобы продемонстрировать способность химерных моноклональных антител нейтрализовать GIP, клеточный супернатант смешивали с равным объемом 2×10-9 М hGIP перед добавлением к культивируемым клеткам LGIPR2. После 4-часовой инкубации при 37°С клетки лизировали, и анализировали β-галактозидазную активность. В этом анализе, комбинация плазмид, содержащих вариабельные последовательности легкой цепи и тяжелой цепи из гибридомы названной 10g10, была способна нейтрализовать активность GIP в клеточном репортерном анализе.
[0086] Вариабельные области моноклональных антител, выделенных и идентифицированных с использованием процедур, описанных выше, были сохранены, а константные области были заменены человеческими константными областями. В качестве альтернативы, антагонистические мАТ к GIP могут быть созданы с использованием трансгенных мышей, продуцирующих «полностью» человеческие мАт, или также могут быть использованы другие технологии. Например, аминокислоты в вариабельных доменах, которые являются консервативными в мышиных антителах, могут быть заменены аминокислотами, которые являются консервативными в человеческих антителах.
[0087] Полученное в результате моноклональное антитело-антагонист связывается с GIP. В конкретных вариантах осуществления молекулярный антагонист, используемый в композициях по настоящему изобретению может связываться с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4. Другими словами, антагонист (например, моноклональное антитело) связывается с эпитопами, содержащимися в этих четырех последовательностях.
[0088] В различных вариантах осуществления настоящего изобретения молекулярный антагонист имеет МW от примерно 30 кДа до примерно 500 кД, включая примерно от 120 кДа до примерно 500 кДа. В других вариантах осуществления настоящего изобретения молекулярный антагонист имеет аффинность связывания GIP, характеризуемую IC50 от примерно 0,1 нМ до примерно 7 нМ.
[0089] Как было описано выше, моноклональное антитело-антагонист, которое связывается с GIP, имеет вариабельные домены легких цепей и тяжелых цепей, которые связываются с GIP, или, более конкретно, CDR вариабельных доменов легких цепей и тяжелых цепей, связывающиеся с GIP. В общем случае предполагается, что молекулярные антагонисты по настоящему изобретению содержат по меньшей мере одну определяющую комплементарность область (CDR), которая связывается с GIP. Более конкретно, молекулярный антагонист содержит по меньшей мере одну CDR, имеющую по меньшей мере 80% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 31, SEQ ID NO: 32 и SEQ ID NO: 33. Эти CDR были идентифицированы с помощью различных модификаций вариабельных доменов в легкой цепи и тяжелой цепи, идентифицированных в гибридоме 10g10, указанной выше. Эти модификации обсуждаются более подробно в разделе примеров ниже. Более желательно, чтобы CDR имели по меньшей мере 85% или по меньшей мере 90% или по меньшей мере 95% идентичности, или имели 100% идентичности с этими аминокислотными последовательностями. В более конкретных вариантах осуществления молекулярный антагонист содержит две, три, четыре, пять или шесть CDR, имеющих необходимую идентичность с двумя, тремя, четырьмя, пятью или шестью различными аминокислотными последовательностями в указанной выше группе.
[0090] В некоторых более конкретных вариантах осуществления молекулярный антагонист содержит вариабельный домен легкой цепи, имеющий первую CDR и вторую CDR, причем каждая CDR имеет по меньшей мере 95% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24. Эти CDR были идентифицированы в вариабельной области легкой цепи. Более желательно, чтобы CDR имели 100% идентичности с этими аминокислотными последовательностями.
[0091] В других конкретных вариантах осуществления молекулярный антагонист содержит вариабельный домен легкой цепи, имеющий первую CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 20, вторую CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 21 и третью CDR с по меньшей мере 85% идентичности к аминокислотной последовательностью SEQ ID NO: 22. Вариабельный домен, содержащий комбинацию этих трех CDR, был идентифицирован, как имеющий очень высокую аффинность связывания с GIP. Более желательно, чтобы все три CDR имели по меньшей мере 85% или по меньшей мере 90%, или по меньшей мере 95% идентичности, или имели 100% идентичности с этими аминокислотными последовательностями.
[0092] В дополнительных вариантах осуществления молекулярный антагонист содержит вариабельный домен тяжелой цепи, имеющий первую CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 31, вторую CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 32 и третью CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 33. Вариабельный домен, содержащий комбинацию этих трех CDR, был идентифицирован, как имеющий очень высокую аффинность связывания с GIP. Более желательно, чтобы все три CDR имели по меньшей мере 85% или по меньшей мере 90%, или по меньшей мере 95% идентичности, или имели 100% идентичности с этими аминокислотными последовательностями.
[0093] Как правило, предполагается, что эти вариабельные домены содержат две или три CDR, как указано выше, причем CDR соединены друг с другом посредством соединительных групп. Соединительными группами обычно могут являться любые группы, которые позволят CDR связываться с GIP. Например, соединительные группы могут представлять собой цепочки аминокислот, присутствующие в природных вариабельных доменах антител. Аминокислотные цепочки могут иметь любую желаемую длину.
[0094] В конкретных вариантах осуществления молекулярный антагонист содержит вариабельный домен легкой цепи с по меньшей мере 80% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19. Более желательно, чтобы вариабельный домен легкой цепи имел по меньшей мере 85% или по меньшей мере 90%, или по меньшей мере 95%, или имел 100% идентичности с одной из этих аминокислотных последовательностей. Эти вариабельные домены содержат различные комбинации CDR легкой цепи из SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24, соединенных друг с другом с аминокислотами.
[0095] В других вариантах осуществления молекулярный антагонист содержит вариабельный домен тяжелой цепи с по меньшей мере 80% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30. Более желательно, чтобы вариабельный домен тяжелой цепи имел по меньшей мере 85% или по меньшей мере 90%, или по меньшей мере 95%, или имел 100% идентичности с одной из этих аминокислотных последовательностей. Эти вариабельные домены содержат различные комбинации CDR тяжелой цепи из SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33 и SEQ ID NO: 34, соединенных друг с другом с аминокислотами.
[0096] Также предусмотрены молекулярные антагонисты, имеющие любую комбинацию из вариабельных доменов легкой цепи и вариабельных доменов тяжелой цепи, описанных выше. Более конкретно, некоторые молекулярные антагонисты содержат только один вариабельный домен легкой цепи и только один вариабельный домен тяжелой цепи. Другие содержат несколько вариабельных доменов легкой цепи и вариабельных доменов тяжелой цепи; в этих вариантах осуществления обычно несколько вариабельных доменов легкой цепи являются одинаковыми, и несколько вариабельных доменов тяжелой цепи являются одинаковыми.
[0097] В некоторых конкретных вариантах осуществления молекулярный антагонист содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи. Вариабельный домен легкой цепи содержит первую CDR и вторую CDR, причем каждая CDR имеет по меньшей мере 95% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24; и вариабельный домен тяжелой цепи содержит первую CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 31, вторую CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 32 и третью CDR с по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 33. Вариабельный домен легкой цепи может иметь 100% идентичности с одной из перечисленных аминокислотных последовательностей. Более конкретно, вариабельный домен тяжелой цепи имеет по меньшей мере 85% или по меньшей мере 90%, или по меньшей мере 95%, или имеет 100% идентичности с одной из перечисленных аминокислотных последовательностей.
[0098] В других конкретных вариантах осуществления молекулярный антагонист содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи. Вариабельный домен легкой цепи имеет по меньшей мере 80% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19; и вариабельный домен тяжелой цепи имеет по меньшей мере 80% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30. Более конкретно, вариабельный домен легкой цепи и/или вариабельный домен тяжелой цепи имеют по меньшей мере 85% или по меньшей мере 90%, или по меньшей мере 95%, или имеют 100% идентичности с одной из их перечисленных аминокислотных последовательностей.
[0099] В еще более конкретных вариантах осуществления настоящего изобретения молекулярный антагонист имеет вариабельный домен легкой цепи, имеющий по меньшей мере 80% идентичности с SEQ ID NO: 18, и вариабельный домен тяжелой цепи, имеющий по меньшей мере 80% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30. Кроме того, эти домены могут иметь по меньшей мере 85% или по меньшей мере 90%, или по меньшей мере 95%, или 100% идентичности с одной из их перечисленных аминокислотных последовательностей.
[0100] В особенно желательных вариантах осуществления молекулярный антагонист имеет вариабельный домен легкой цепи, имеющий по меньшей мере 90% идентичности с SEQ ID NO: 18, и вариабельный домен тяжелой цепи, имеющий по меньшей мере 90% идентичности с SEQ ID NO: 29. В более конкретных вариантах осуществления эти домены могут иметь по меньшей мере 95% или могут иметь 100% идентичности с их приведенной аминокислотной последовательностью.
[0101] Молекулярные антагонисты по настоящему изобретению имеют в нескольких различных вариантах осуществления вариабельный домен легкой цепи и вариабельный домен тяжелой цепи, описанные выше. В частности предусмотрено, что молекулярный антагонист может представлять собой одноцепочечный вариабельный фрагмент (scFv), F(аb')2-фрагмент, Fab- или Fab'-фрагмент, диантитело, триантитело, тетраантитело или моноклональное антитело, в которых эти вариабельные домены будут являться частью.
[0102] Одноцепочечный вариабельный фрагмент (scFv) включает вариабельный домен легкой цепи и вариабельный домен тяжелой цепи, соединенные вместе соединительной группой, которая обычно имеет длину от примерно 10 до примерно 25 аминокислот (хотя и необязательно в пределах этого диапазона). N-конец одного вариабельного домена соединен с С-концом другого вариабельного домена. При желании, scFv может быть пегилированным (полиэтиленгликолем) для увеличения своего размера, например, как цертолизумаб пегол. Два scFvs могут быть соединены вместе с помощью другой соединительной группы с образованием тандемного scFv.
[0103] Если вариабельный домен легкой цепи и вариабельный домен тяжелой цепи соединены друг с другом более короткой соединительной группой для образования scFv, то два вариабельных домена не смогут связаться, а scFv будет димеризоваться, образуя диантитело. Еще более короткие соединительные группы могут привести к образованию тримеров (т.е. триантитела) и тетрамеров (т.е. тетраантитела).
[0104] Полноразмерное моноклональное антитело образуется двумя тяжелыми цепями и двумя легкими цепями. Кроме того, каждая легкая цепь и каждая тяжелая цепь содержит вариабельный домен. Каждая легкая цепь связана с тяжелой цепью. Две тяжелые цепи соединены друг с другом в шарнирной области. Если константная область тяжелых цепей удаляется ниже шарнирной области, то получается F(аb')2-фрагмент, который содержит в общей сложности четыре вариабельных домена. F(аb')2-фрагмент затем может быть разделен на два Fab'-фрагмента. Fab'-фрагмент содержит сульфгидрильные группы из шарнирной области. Fab-фрагмент образуется, когда константная область тяжелой цепи удаляется выше шарнирной области, и не содержит сульфгидрильные группы из шарнирной области. Однако все эти фрагменты содержат вариабельный домен легкой цепи и вариабельный домен тяжелой цепи.
[0105] В предпочтительных вариантах осуществления, исследуемых в экспериментах, описанных ниже, молекулярный антагонист представляет собой полноразмерное моноклональное антитело, образуемое легкими и тяжелыми цепями, имеющими вариабельные области/домены, описанные выше, в сочетании с человеческими константными областями. Константная область тяжелой цепи может принадлежать любому изотипу антитела человека, включая IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 или IgM. Константная область легкой цепи антитела человека может быть каппа или лямбда-изотипа. В конкретных вариантах осуществления константная область тяжелой цепи относится изотипу IgG1, а константная область легкой цепи относится к изотипу каппа.
[0106] В конкретных вариантах осуществления молекулярный антагонист представляет собой моноклональное антитело с вариабельным доменом легкой цепи, имеющим по меньшей мере 80% идентичности с последовательностью SEQ ID NO: 18, и с вариабельным доменом тяжелой цепи, имеющим по меньшей мере 80% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30. Эти домены могут иметь по меньшей мере 85% или по меньшей мере 90%, или по меньшей мере 95%, или 100% идентичности с одной из их перечисленных аминокислотных последовательностей.
[0107] В других конкретных вариантах осуществления настоящего изобретения молекулярный антагонист представляет собой полноразмерное моноклональное антитело с вариабельным доменом легкой цепи, имеющим по меньшей мере 90% идентичности с последовательностью SEQ ID NO: 18, и с вариабельным доменом тяжелой цепи, имеющим по меньшей мере 90% идентичности с SEQ ID NO: 29. Эти домены могут иметь по меньшей мере 95% или могут иметь 100% идентичности с их приведенной аминокислотной последовательностью.
[0108] Молекулярный антагонист GIP, который в некоторых формах представляет собой моноклональное антитело, может затем использоваться в композиции, которая может быть введена человеку. Композиция содержит фармацевтически эффективное количество молекулярного антагониста GIP. В конкретных вариантах осуществления композиция содержит молекулярный антагонист в количестве от примерно 0,1 до примерно 1000 мг на миллилитр композиции (вес/объем).
[0109] Фармацевтические композиции, содержащие молекулярный антагонист GIP, обычно вводят парентеральным (т.е. подкожно, внутримышечно, внутривенно, внутрибрюшинно, внутриплеврально, интравезикулярно или интратекально) путем, определяемым выбором препарата и заболеванием. Доза, используемая для конкретного состава или применения, будет определяться требованиями конкретного состояния болезни и ограничениями, накладываемыми характеристиками возможностей материалов-носителей. Предусмотрено, что в наиболее предпочтительно форме композицию вводят внутривенно, внутрибрюшинно или подкожно.
[0110] Фармацевтическая композиция может включать фармацевтически приемлемый носитель. Носитель выступает в качестве переносчика для доставки молекулярного антагониста. Примеры фармацевтически приемлемых носителей включают жидкие носители, такие как вода, масло и спирты, в которых молекулярные антагонисты могут быть растворены или суспендированы.
[0111] Фармацевтическая композиция может также включать в себя вспомогательные вещества. Конкретные вспомогательные вещества включают в себя буферные агенты, поверхностно-активные вещества, консерванты, наполнители, полимеры и стабилизаторы, которые применимы с этими молекулярными антагонистами. Буферные агенты используются для контроля рН композиции. Поверхностно-активные вещества используются для стабилизации белков, ингибирования агрегации белка, ингибирования адсорбции белка на поверхности, а также способствуют рефолдингу белков. Примеры поверхностно-активных веществ включают Tween 80, Tween 20, Brij 35, Triton Х-10, Pluronic F127 и додецилсульфат натрия. Консерванты используются для предупреждения роста микроорганизмов. Примеры консервантов включают бензиловый спирт, м-крезол и фенол. Наполнители используются в процессе лиофилизации для добавления объема. Гидрофильные полимеры, такие как декстран, гидроксилэтилкрахмал, полиэтиленгликоли и желатин, могут быть использованы для стабилизации белков. Полимеры с неполярными остатками, такие как полиэтиленгликоль, также могут быть использованы в качестве поверхностно-активных веществ. Белковые стабилизаторы могут включать в себя многоатомные спирты, сахара, аминокислоты, амины и соли. Подходящие сахара включают сахарозу и трегалозу. Аминокислоты включают гистидин, аргинин, глицин, метионин, пролин, лизин, глутаминовую кислоту, а также их смеси. Белки, такие как сывороточный альбумин человека, также могут конкурентно адсорбироваться на поверхности и снижают агрегацию белкового молекулярного антагониста. Следует отметить, что отдельные молекулы могут служить многим целям. Например, гистидин может выступать в качестве буферного агента и антиоксиданта. Глицин может быть использован в качестве буферного агента и в качестве агента для увеличения объема.
[0112] Фармацевтическая композиция может быть представлена в форме порошка, инъекции, раствора, суспензии или эмульсии. Предполагается, что состав будет поставляться в виде инъекций. Иногда, молекулярный антагонист GIP может быть лиофилизирован с использованием стандартных методов, известных в данной области техники. Лиофилизированный антагонист может быть затем восстановлен, например, в подходящем разбавителе, таком как физиологический солевой раствор, стерильная вода, ледяная уксусная кислота, ацетат натрия, их комбинации и т.п.
[0113] Доза будет зависеть от целого ряда факторов, включающих терапевтический индекс препаратов, тип заболевания, возраст пациента, вес тела больного, а также переносимости. Дозу обычно выбирают для достижения концентрации в сыворотке у пациента от примерно 0,1 г/мл до примерно 100 мкг/мл. Доза для конкретного пациента может быть определена квалифицированным врачом с использованием стандартных фармакологических подходов с учетом вышеуказанных факторов. Ответ на лечение можно контролировать путем анализа содержания в крови или жидкости организма глюкозы или инсулина, или путем мониторинга содержания жира в организме пациента. Опытный врач будет корректировать дозу, основываясь на ответе на лечение, определяемом с помощью этих анализов. Однократное введение обычно может быть достаточным для получения терапевтического эффекта, но предполагается, что будут использоваться многократное введение для обеспечения постоянного ответа в течение значительного периода времени. Из-за белковоподобной природы молекулярных антагонистов, раскрытых в данном документе, полагают, что антагонисты будут иметь длительный период полураспада в организме, так что композицию нужно будет вводить только один или два раза в месяц или, возможно, один раз в неделю. Концентрация молекулярного антагониста в кровотоке должна быть достаточной, чтобы нейтрализовать GIP, который генерируется во время и после еды.
[0114] Фармацевтические композиции, содержащие молекулярные антагонисты GIP по настоящему изобретению, могут быть использованы для лечения жировой болезни печени или других заболеваний, которые включают накопление жира в тканях. Термин «лечить» используется для обозначения замедления развития заболевания, регрессии заболевания и/или профилактического применения с целью снижения вероятности возникновения заболевания. Это может быть измерено несколькими различными способами, например, посредством измерения фракции жира в печени, фракции жира в сальнике или фракции жира в подкожной клетчатке.
[0115] В случае больных ожирением полагают, что молекулярные антагонисты GIP будут ингибировать связывание GIP с его рецептором на энтероцитах, снижая поглощение глюкозы после приема пищи путем ингибирования GIP-индуцированной транслокации натрий/глюкозного транспортера (SGLT1) из цитоплазмы на люминальную мембрану. GIP-индуцированная секреция инсулина из панкреатических бета-клеток также будет ослаблена, уменьшая запасание питательных веществ, связанное с повышенным инсулиновым ответом. Ингибирование связывания GIP с его рецептором на адипоцитах также должно снижать GIP-индуцированное поглощение глюкозы жировыми клетками и предупреждать ингибирование липолиза, вызываемое GIP. В целом это приводит к менее эффективному поглощению и хранению питательных веществ, способствуя снижению веса. Эти эффекты также приносят пользу пациентам с метаболическим синдромом или гиперлипидемией.
[0116] Для пациентов с диабетом II типа, ингибирование связывания GIP с его рецептором на энтероцитах будет снижать поглощение глюкозы после приема пищи и уровень сахара в крови. Пациенты, которые переедают, также получат пользу от эффектов снижения веса вследствие нейтрализации GIP.
[0117] Для больных, предрасположенных или страдающих от жировой болезни печени, ингибирование связывания GIP с его рецептором в бета-клетках будет снижать секрецию инсулина после приема пищи, тем самым снижая индуцированное инсулином накопление жира в печени.
[0118] Для пациентов, страдающих от индуцированного питанием синдрома Кушинга, ингибирование связывания GIP с его рецептором на клетках надпочечников будет снижать или предупреждать увеличение GIP-индуцированной секреции кортизола после приема пищи.
[0119] Настоящее изобретение будет дополнительно проиллюстрировано в следующих неограничивающих трех наборах рабочих примеров, при этом следует понимать, что эти примеры предназначены только для иллюстрации, и изобретение не должно быть ограничено материалами, условиями, параметрами процесса и т.п., приведенными в настоящем документе. Все пропорции даны по весу, если не указано иное.
ПРИМЕРЫ
ПРИМЕР 1
[0120] Моноклональные антитела были получены и скринированы, как описано выше с использованием гибридом, чтобы идентифицировать моноклональное антитело, обладающее высокой аффинностью связывания с желудочным ингибиторным пептидом (GIP) в суспензии. Таким образом было идентифицировано моноклональное антитело 10g10.
[0121] Вариабельный домен легкой цепи 10g10 имеет аминокислотную последовательность SEQ ID NO: 16. Первая CDR вариабельного домена легкой цепи имеет аминокислотную последовательность SEQ ID NO: 25. Вторая CDR вариабельного домена легкой цепи имеет аминокислотную последовательность SEQ ID NO: 26. Третья CDR вариабельного домена легкой цепи имеет аминокислотную последовательность SEQ ID NO: 22. кДНК, кодирующая вариабельный домен легкой цепи 10g10, имеет нуклеотидную последовательность SEQ ID NO: 35.
[0122] Вариабельный домен тяжелой цепи 10g10 имеет аминокислотную последовательность SEQ ID NO: 27. Первая CDR вариабельного домена тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 31. Вторая CDR вариабельного домена тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 34. Третья CDR вариабельного домена тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 33. кДНК, кодирующая вариабельный домен тяжелой цепи 10g10, имеет нуклеотидную последовательность SEQ ID NO: 39.
[0123] Для сравнения было идентифицировано антитело 14B9, как не имеющее сродства с GIP. Вариабельный домен легкой цепи 14B9 имеет аминокислотную последовательность SEQ ID NO: 7. Первая CDR вариабельного домена легкой цепи имеет аминокислотную последовательность SEQ ID NO: 9. Вторая CDR вариабельного домена легкой цепи имеет аминокислотную последовательность SEQ ID NO: 26. Третья CDR вариабельного домена легкой цепи имеет аминокислотную последовательность SEQ ID NO: 10. кДНК, кодирующая вариабельный домен легкой цепи 14B9, имеет нуклеотидную последовательность SEQ ID NO: 8.
[0124] Вариабельный домен тяжелой цепи 14B9 имеет аминокислотную последовательность SEQ ID NO: 11. Первая CDR вариабельного домена тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 13. Вторая CDR вариабельного домена тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 14. Третья CDR вариабельного домена тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 15. кДНК, кодирующая вариабельный домен тяжелой цепи 14B9, имеет нуклеотидную последовательность SEQ ID NO: 12.
ПРИМЕР 2
[0125] Материалы и способы
[0126] 30 девятинедельных самцов мышей C57BL/6 были приобретены у Jackson Laboratories (Bar Harbor, ME). В первый день исследования каждая мышь весила от 19 до 25 граммов. Затем мышей разделяли случайным образом на три группы по 10 мышей в каждой.
[0127] Все мыши имели свободный доступ к пище и воде на протяжении всего исследования. Все мыши содержались в виварии при температуре 22±2°С при 12-часовом световом/12-часовом темновом цикле. Мышей содержали в группах по пять животных на клетку, пока каждое из них не достигало веса 25 граммов. Затем мышей содержали по два-три животных на клетку.
[0128] Высокожировая диета (ВЖД) (кат.№ TD.06414) и низкожировая изокалорийная диета (кат.№ TD.08806) были приобретены у Harlan-Teklad (Indianapolis, IN). ВЖД состояла по весу приблизительно из 23,5% белка, 27,3% углеводов и 34,3% жира. ВЖД обеспечивала 18,4% от общего количества калорий из белка, 21,3% из углеводов и 60,3% из жира, и 5,1 ккал/грамм. Изокалорийная диета состояла по весу приблизительно из 18,6% белка, 62,6% углеводов и 4,2% жира. Изокалорийная диета обеспечивала 20,5% от общего количества калорий из белка, 69,1% из углеводов и 10,4% из жира, и 3,6 ккал/грамм.
[0129] Одну группу из 10 мышей (ВЖД-контрольная группа) кормили ВЖД в течение 17 недель и вводили 0,1 мл фосфатно-солевого буфера (PBS) с помощью внутрибрюшинных (i.p.) инъекций пять раз в неделю.
[0130] Вторую группу из 10 мышей (группа ВЖД-мАт) кормили ВЖД в течение 17 недель и вводили анти-GIP мАт 10g10 в PBS пять раз в неделю. С понедельника по четверг антитело вводили путем внутрибрюшинной инъекции 0,1 мл раствора, состоящего из 0,2 мг/мл мАт в PBS. Каждую пятницу антитело вводили путем внутрибрюшинной инъекции 0,1 мл раствора, состоящего из 0,4 мг/мл мАт в PBS. Каждую неделю исследования это обеспечивало введение 10 мг GIP мАт на кг веса тела четыре дня в неделю и 20 мг GIP мАт на кг веса тела в один день недели. Этот режим дозирования соблюдался в течение всего исследования.
[0131] Третью группу из 10 мышей (группа изо-питания) кормили изокалорийным питанием в течение 17 недель. Эта группа не получала никаких инъекций.
[0132] Вес каждой мыши измеряли и регистрировали каждый понедельник вечером на протяжении всего исследования. Кроме того, количество потребляемой пищи в каждой группе также измеряли и регистрировали в течение всего курса исследования.
[0133] Результаты
[0134] ВЖД-контрольная группа набирала вес почти в два раза быстрее группы ВЖД-мАт или группы изо-питания.
[0135] Общий вес тела в зависимости от времени показан на фиг.1A. Наборе веса в процентах за каждую неделю показан на фиг.1B. Через одну неделю на специальном питании, обе группы на питании с высоким содержанием жира (ВЖД) (с и без анти-GIP мАт) набрали около 10% от своего веса тела. Прирост веса у обеих групп на ВЖД оставался примерно одинаковым до 4-й недели, когда у группы ВЖД-мАт набор веса начал снижаться, тогда как вес у ВЖД-контрольной группы неуклонно возрастал. Разница в наборе веса стала очень значительной (р<0,001) к 7-й неделе. Группа на изо-диете набирала вес более медленными темпами на протяжении исследования. Группа ВЖД-мАт и группа изо-диеты имели примерно одинаковый набор веса тела через 17 недель. Введение антагониста GIP (анти-GIP мАт) оказывало явный эффект на увеличение веса тела мышей.
[0136] Исходя из фиг.1B видно, что действие анти-GIP мАТ проявлялось не сразу, а требовало проложлительного приема. В 1-4-ю недели эксперимента обе группы мышей на ВЖД практически одинаково набирали вес. Только начиная с 5 недели, темп набора веса в группе ВЖД-мАТ снижался по сравнению с ВЖД-контрольной группой.
МРТ
[0137] Материалы и способы
[0138] После 17 недель на специальном питании случайным образом выбирали шесть мышей из ВЖД-контрольной группы и шесть мышей из группы ВЖД-мАт для магнитно-резонансной томографии (МРТ). Все мыши получали анестезию перед получением изображений в Отделе томографических исследований университета Case Western Reserve.
[0139] Последовательность двумерного T1-взвешенного асимметричного эха, быстрого накопления с усилением релаксации (aRARE) выполнялась на МРТ-сканере для мелких животных Bruker Biospec 7T (Bruker BioSpin, Billerica, MA) (TR=1087 мс, TE=9,1 мс, FOV=100×50 мм, матрица 512×256, усреднение по 4 повторам, длина следа эхо=4, толщина среза=1 мм). Последовательность aRARE обеспечивает выбираемую пользователем задержку эха для достижения π/6, 5π/6 и 3π/2 радиан сдвига между жиром и водой (сдвиги эхо 79, 396 и 714 мкс при 7Т).
[0140] Томографические изображения, полученные в результате использования aRARE при сборе данных, были использованы для создания отдельных изображений жира и воды с помощью модифицированной методике реконструкции изображений IDEAL для 7Т и позволили определить биораспределение липидов у мышей. При этом, ожирение, метаболический синдром и НАЖБП являются не только последствием общего веса тела, но зависят от того, где хранится избыток жира.
[0141] Результаты
[0142] На фиг. 3 показаны репрезентативные магнитно-резонансные изображения ВЖД-контрольных мышей (слева) и мышей ВЖД-мАт (справа). На изображениях представлен боковой вид мыши с головой вверху и задней частью внизу изображения. Белые или светлые участки представляют собой участки с высоким содержанием жира. ВЖД-контрольные мыши имели гораздо больше жира по сравнению с ВЖД-мАт.
[0143] На фиг. 4 показана жировая фракция печени, определенная с помощью МРТ жировой фракции c компенсированной релаксацией (RCFF). ВЖД-контрольная группа накопила в два раза больший объем жира в своей печени по сравнению с мышами в группе ВЖД-мАт.
[0144] На фиг. 5 показана жировая фракция сальника, определенная с помощью МРТ жировой фракции c компенсированной релаксацией (RCFF). ВЖД-контрольная группа накопила почти в 3,5 раза больше объема сальникового жира, чем мыши в группе ВЖД-мАт.
[0145] На фиг. 6 показана жировая фракция подкожной клетчатки, определенная с помощью МРТ жировой фракции c компенсированной релаксацией (RCFF). ВЖД-контрольные животные накопили приблизительно в 2 раза больший объем подкожного жира, чем мыши в группе ВЖД-мАт.
[0146] На фиг. 7 показаны репрезентативные фотографии окрашенных срезов тканей, взятых из печени умерщвленных мышей. Печень удаляли и фиксировали в формалине. Из фиксированный ткани делали срезы и окрашивали масляным красным O, а жирорастворимый диазокраситель использовали для окрашивания нейтральных триглицеридов и липидов. Печень ВЖД-контрольных животных представлена слева, а печень ВЖД-мАт животных - справа. Наблюдается намного больше окрашенных красным (темным) капелек жира в печени ВЖД-контрольных мышей, чем в печени мышей ВЖД-мАт. Кроме того, размер капель жира был больше в печени ВЖД-контрольных мышей, чем в печени мышей ВЖД-мАт. Это иллюстрирует снижение количества жира, накапливаемого в печени при введении анти-GIP моноклональных антител. Эти результаты согласуются с объемом жировой фракции печени на фиг. 4.
[0147] На фиг. 8 представлен собой набор из двух фотографий, сравнивающий сальниковый жир у ВЖД-контрольной мыши (слева) с сальниковым жиром у мыши ВЖД-мАт (справа). Жир имеет белый цвет, и гораздо больше жира наблюдается в ВЖД-контрольной мыши.
[0148] В совокупности данные показали, что введение антагонистического моноклонального антитела, которое связывается с GIP, значительно сокращало количество жира, накапливаемого мышами на диете высоким содержанием жиров. Это включало жир, накапливаемый в печени, сальнике и под кожей.
ГЛЮКОЗОТОЛЕРАНТНЫЙ ТЕСТ
[0149] Материалы и способы
[0150] После 17 недель на специальном питании случайным образом выбирали по шесть мышей из каждой группы питания для внутрибрюшинных тестов на толерантность к глюкозе (IPGTT). Все животные первоначально проходили голодание в течение шести часов перед тем как отбирали приблизительно 2 мкл крови из хвостовой вены каждого животного. Эти первые образцы представляли базовые уровни глюкозы в крови или нулевое время на кривой IPGTT. Уровень глюкозы в крови измеряли с помощью глюкометра Truetest™ (Nipro Diagnostics, Fort Lauderdale, FL).
[0151] Каждой мыши затем вводили приблизительно 2 мг глюкозы на кг массы тела путем внутрибрюшинной инъекции. Глюкоза представляла собой 20%-й раствор в воде. После введения, собирали приблизительно 2 мкл крови из хвостовой вены каждой мыши через 10, 30, 60 и 120 минут. Концентрацию глюкозы в крови измеряли и записывали.
[0152] Результаты
[0153] Результаты показаны на фиг.2. Уровень глюкозы в сыворотке крови у ВЖД-контрольных мышей вырос до гораздо более высокой концентрации по сравнению с мышами ВЖД-мАт и мышами на изо-диете. Кроме того, уровень глюкозы в сыворотке крови у мышей ВЖД-мАт и на изо-диете начал снижаться гораздо раньше. Это согласуется с развитием толерантности к глюкозе у ВЖД-контрольных мышей, но не у мышей ВЖД-мАт или на изо-диете.
АНАЛИЗ СЫВОРОТКИ КРОВИ
[0154] Материалы и способы
[0155] После 17 недель на специальном питании мыши в трех группах были умерщвлены. Цельную кровь собирали, выделяли сыворотку и измеряли содержание ряда различных компонентов.
[0156] Результаты
[0157] На фиг. 9 показан уровень триглицеридов (ТГ), измеренный в сыворотке у каждой группы мышей. Уровень ТГ у ВЖД-контрольных мышей был в 1,44 раза выше уровня ТГ у мышей ВЖД-мАт (р=0,02). Более высокое содержание ТГ связано с ожирением и метаболическим синдромом.
[0158] На фиг. 10 показан средний уровень общего холестерина (ОХ), измеренный в сыворотке крови у каждой группы мышей. Уровень ОХ у ВЖД-контрольных мышей был в 1,55 раза выше уровня ОХ у мышей ВЖД-мАт. Более высокое содержание ОХ связано с ожирением и метаболическим синдромом.
[0159] На фиг. 11 показано среднее соотношение количества липопротеинов высокой плотности (ЛПВП) и общего холестерина (ОХ), измеренное в сыворотке каждой группы мышей. Соотношение ЛПВП и ОХ у ВЖД-контрольных мышей было на 20% ниже, чем соотношение ЛПВП и уровня ОХ у мышей ВЖД-мАт. Более низкое соотношение ЛПВП и уровня ОХ связано с ожирением и метаболическим синдромом.
[0160] На фиг. 12 показан средний уровень липопротеинов низкой плотности (ЛПНП), измеренный в сыворотке каждой группы мышей. Содержание ЛПНП у ВЖД-контрольных мышей было в 1,95 раза выше содержания ЛПНП у мышей ВЖД-мАт. Более высокий уровень ЛПНП («плохого» холестерина) связан с ожирением и метаболическим синдромом.
[0161] На фиг. 13 показан средний уровень инсулина, измеренный в сыворотке каждой группы мышей. Содержание инсулина у ВЖД-контрольных мышей было в 2,6 раза выше содержания инсулина у мышей ВЖД-мАт. Более высокое содержание инсулина связано с ожирением, резистентности к инсулину и метаболического синдрома.
[0162] На фиг. 14 показан средний уровень адипонектина, измеренный в сыворотке каждой группы мышей. Содержание адипонектина у ВЖД-контрольных мышей было в 1,35 раза выше содержания адипонектина у мышей ВЖД-мАт. Более высокое содержание адипонектина связано с увеличением общего содержания жира в организме.
[0163] На фиг. 15 показан средний уровень лептина, измеренный в сыворотке каждой группы мышей. Содержание лептина у ВЖД-контрольных мышей было 5,73 раза выше содержания лептина у мышей ВЖД-мАт. Более высокое содержание лептина связано с увеличением общего содержания жира в организме.
[0164] На фиг. 16 показан средний уровень глюкагона, измеренный в сыворотке каждой группы мышей. Не наблюдалось никаких существенных различий в уровне глюкагона в сыворотке между группами.
[0165] На фиг. 17 показан средний уровень глюкагон-подобного пептида 1 (GLP-1), измеренный в сыворотке крови у каждой группы мышей. Не наблюдалось никаких существенных различий в уровне GLP-1 в сыворотке между группами.
[0166] В совокупности эти данные показали, что введение моноклонального антитела-антагониста, которое связывается с GIP, значительно улучшало показатели по всем маркерам, связанным с ожирением и метаболическим синдромом. Эти данные позволяют предположить, что введение моноклонального антитела может снизить осложнения, связанные с ожирением и метаболическим синдромом. Тот факт, что не наблюдалось никаких изменений в уровне глюкагона или GLP-1 в сыворотке, показал, что моноклональное антитело было специфичным к GIP, и позволяет предположить, что должно возникать мало побочных эффектов (если они вообще будут возникать) от ингибирования глюкагона или GLP-1, которые имеют некоторые общие биологические пути с GIP, но которые также имеют другие биологические эффекты, которые не являются общими с GIP.
ОБСУЖДЕНИЕ
[0167] Результаты этих экспериментов показали, что внутрибрюшинное введенные моноклональные антитела, которые связываются с GIP, могут значительно снизить накопление жировой ткани и накопление жира в печени. Мыши на диете с высоким содержанием жиров (ВЖД) после введения GIP-мАт имели заметно меньшее содержание жира, чем ВЖД-контрольные мыши. Снижение содержания жира наблюдалось в печени, сальнике и в подкожной клетчатке. Это свидетельствует о том, что умеренное количество антагонистических GIP-мАт может уменьшить или предотвратить накопление жира в ткани путем ингибирования GIP. Подавление GIP снижает всасывание глюкозы в кишечнике, снижает всасывание пептидов в кишечнике, уменьшает секрецию инсулина после приема пищи, уменьшает поглощение глюкозы адипоцитами, повышает липолиз и ингибирует поглощение питательных веществ. Изменение содержания в сыворотке крови маркеров, связанных с ожирением и метаболическим синдромом, также указывает на то, что антагонистическое GIP-мАт может быть полезны в борьбе с последствиями для здоровья при этих заболеваниях.
ПРИМЕР 3: МОДИФИКАЦИЯ АНТИТЕЛ
[0168] Вариабельную область легкой цепи мАт 10g10 дополнительно модифицировали путем замены определенных аминокислот, консервативных в мышиных антителах, определенными аминокислотами, консервативными в антителах человека. Это было сделано для «гуманизации» вариабельной области легкой цепи, чтобы сделать ее более похожей на вариабельную область антитела человека, а также увеличить вероятность того, что иммунная система человека не будет распознавать «гуманизированное» мАт, как чужеродное вещество. Чтобы гуманизировать вариабельную область легкой цепи, олигонуклеотиды были синтезированы химическим путем. Последовательности олигонуклеотидов были аналогичны последовательности вариабельной области легкой цепи мАт 10g10, за исключением того, что определенные основания были изменены. Предполагается, что измененные пары оснований поменяют определенные аминокислоты вариабельной области легкой цепи при трансляции последовательности в белок. Для получения двухцепочечной (ds) ДНК использовали реакцию синтеза ДНК. Три различных ds-олигонуклеотида синтезировали и затем расщепляли рестрикционными эндонуклеазами HindIII и NotI, перед лигированием в вектор для экспрессии в клетках млекопитающих. Вектор для экспрессии в клетках млекопитающих содержит сигнальную последовательность и константную область легкой цепи антитела человека. ds-олигонуклеотиды лигировали с вектором таким образом, чтобы вариабельная область и константная область при экспрессии мРНК и последующей трансляции в белок, генерировали легкую цепь антитела.
[0169] Три полученные гуманизированные легкие цепи в настоящем документе называются LC1, LC2 и LC3. Аминокислотной последовательностью LC1 является SEQ ID NO: 17, а последовательностью кДНК для LC1 является SEQ ID NO: 36. Аминокислотной последовательностью LC2 является SEQ ID NO: 18, а последовательностью кДНК для LC1 является SEQ ID NO: 37. Аминокислотной последовательностью LC3 является SEQ ID NO: 19, а последовательностью кДНК для LC1 является SEQ ID NO: 38.
[0170] Вариабельная область тяжелой цепи мАТ 10g10 также была дополнительно модифицирована таким же образом. Вновь были выбраны основания для изменения определенных аминокислот вариабельной области тяжелой цепи при трансляции последовательности в белок. Три различных ds-олигонуклеотида для цепи были синтезированы и затем лигированы в вектор для экспрессии в клетках млекопитающих. Вектор для экспрессии в клетках млекопитающих содержит сигнальную последовательность и константную область тяжелой цепи антитела человека. ds-олигонуклеотиды лигировали с вектором таким образом, чтобы вариабельная область и константная область при экспрессии мРНК и последующей трансляции в белок, генерировали тяжелую цепь антитела.
[0171] Три полученные гуманизированные тяжелые цепи в настоящем документе называются HC1, HC2 и HC3. Аминокислотной последовательностью НC1 является SEQ ID NO: 28, а последовательностью кДНК для НC1 является SEQ ID NO: 40. Аминокислотной последовательностью НC2 является SEQ ID NO: 29, а последовательностью кДНК для НC1 является SEQ ID NO: 41. Аминокислотной последовательностью НC3 является SEQ ID NO: 30, а последовательностью кДНК для НC1 является SEQ ID NO: 42.
[0172] Моноклональные антитела (мАт), содержащие гуманизированные вариабельные области легкой цепи и вариабельные области тяжелой цепи получали в клетках СНО. Вектор для экспрессии в клетках млекопитающих, содержащий кодирующую последовательность для легкой цепь антитела, совместно трансфицировали с вектором для экспрессии в клетках млекопитающих, содержащим кодирующую последовательность для тяжелой цепи антитела. В общей сложности, в клетки СНО трансфицировали 9 уникальных комбинаций: LC1/НС1, LC1/НС2, LC1/HC3, LC2/НС1, LC2/НС2, LC2/HC3, LC3/НС1, LC3/Нс2 и LC3/HC3. Моноклональные антитела, полученные с этими комбинациями, сравнивали с мАт 10g10.
[0173] Клетки СНО, трансфицированые совместно векторами для экспрессии в клетках млекопитающих, выращивали в культуре и собирали супернатант. Супернатант оценивали на наличие GIP-связывающих мАт путем прямого твердофазного ИФА (прямого ELISA). Дно лунок в 96-луночных планшетах покрывали GIP человека. В разные лунки 96-луночного планшета добавляли серийные разведения супернатанта. После одночасовой инкубации лунки дважды промывали PBS перед внесением в каждую лунку вторичного антитела, которое специфически связывается с IgG человека. Антитело, которое специфически связывается с IgG человека, конъюгировано с ферментом пероксидазой хрена (HRP). После одночасовой инкубации лунки промывали PBS перед добавлением субстрата HRP. Если HRP присутствовала в лунке, то субстрат превращался в окрашенное соединение. Интенсивность цвета оценивали с использованием спектрофотометра. Производимая интенсивность окрашивания была пропорциональна количеству конъюгата HRP-антитело, остающегося в каждой лунке. Производимая интенсивность окрашивания также пропорциональна количеству мАТ, связанного с hGIP в каждой лунке.
[0174] Результаты этой оценки показали, что различные комбинации векторов, кодирующих тяжелую цепь и легкую цепь, связывали GIP человека в следующем порядке (от самой высокой аффинности связывания до самой низкой аффинности связывания): LC2/НС1, LC2/HC2, LC3/HC2, LC1/НС2, LC2/HC3, LC3/HC1, LC1/HC1, 10g10, LC1/HC3 и LC3/HC3.
[0175] Антитела, продуцируемые в 100 мл суспензионных культур клеток СНО, трансфицированных совместно комбинацией векторов для экспрессии LC2/HC1, LC2/HC2 и LC2/НС3, были очищены с использованием белок А-агарозы.
[0176] Далее, с использованием системы для культивирования клеток была протестирована способность этих трех очищенных моноклональных антител нейтрализовать hGIP и предупреждать взаимодействие лиганда с рецептором, активацию рецептора и рецепторно-зависимую передачу сигнала. В этой системе используются репортерные клетки (клетки LGIPR3a), которые несут ген LacZ под контролем отвечающего на циклический аденозинмонофосфат (цАМФ) промотора и экспрессируют GIPR крыс на клеточной поверхности. Добавление GIP к этим клеткам приводит к активации GIPR, индукции сигнального каскада, что приводит к накоплению цАМФ, индукции гена LacZ и синтезу бета-галактозидазы. После добавления исследуемого образца и 4-часовой инкубации использовали колориметрический анализ для измерения содержания β-галактозидазы в клеточных лизатах. Степень изменения цвета была пропорциональна уровню β-галактозидазы. Уровень β-галактозидазы зависит от количества свободного биологически активного GIP в тестируемом образце.
[0177] мАТ смешивали с раствором GIP человека (hGIP) в среде DMEM при конечной концентрации 25 мкг/мл для мАТ и 0,1 нМ для hGIP. Смеси затем добавляли к клеткам LGIPR3a и инкубировали перед промывкой и анализом на β-галактозидазу. Результаты показаны на фиг.18. 10g10 представляет собой исходное мышиное мАт. GIP действовал в качестве положительного контроля. Fc представляет собой очищенный Fc-фрагмент человека, который выступал в качестве отрицательного контроля.
[0178] Результаты показали, что гуманизированные антитела нейтрализовали hGIP in vitro аналогично мышиному мАт 10g10. Гуманизированное антитело LC2/НС2 является наиболее эффективным из трех гуманизированных моноклональных антител. Оно также было более эффективен, чем оригинальное мышиное мАт. В данном случае желательной является более низкая относительная активность, и LC2/НС2 имело относительную активность 0,0035 по сравнению с 0,0055 для мышиного мАТ 10g10.
[0179] Определяющие комплементарность области (CDR) вариабельных областей шести гуманизированных легких цепей (LC1, LC2, LC3) и тяжелых цепей (НС1, НС2, HC3) также были определены. LC1 имела CDR из SEQ ID NO: 20, SEQ ID NO: 23 и SEQ ID NO: 22. LC2 имела CDR из SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22. LC3 имела CDR из SEQ ID NO: 20, SEQ ID NO: 24 и SEQ ID NO: 22. НС1, НС2 и НС3, все имели одинаковые CDR, которые представляли собой SEQ ID NO: 31, SEQ ID NO: 32 и SEQ ID NO: 33.
[0180] Хотя были описаны конкретные варианты осуществления изобретения, альтернативы, модификации, вариации, улучшения и существенные эквиваленты, которые в настоящее время являются или могут являться непредусмотренными, могут появится у заявителей или у других специалистов в данной области техники. Соответственно, прилагаемая формула изобретения в поданном виде и с возможными внесенными поправками, охватывает все такие альтернативы, модификации, вариации, улучшения и существенные эквиваленты.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> WOLFE, M. MICHAEL
BOYLAN, MICHAEL O
<120> КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
<130> MHMS 200014US01
<150> 62/045,189
<151> 2014-09-03
<150> 62/007,255
<151> 2014-06-03
<150> 61/917,136
<151> 2013-12-17
<150> 61/974,660
<151> 2014-04-03
<150> 62/074,225
<151> 2014-11-03
<150> 62/074,227
<151> 2014-11-03
<150> 62/074,234
<151> 2014-11-03
<160> 55
<170> PatentIn version 3.5
<210> 1
<211> 42
<212> Белок
<213> Homo sapiens
<400> 1
Tyr Ala Glu Gly Thr Phe Ile Ser Asp Tyr Ser Ile Ala Met Asp Lys
1 5 10 15
Ile His Gln Gln Asp Phe Val Asn Trp Leu Leu Ala Gln Lys Gly Lys
20 25 30
Lys Asn Asp Trp Lys His Asn Ile Thr Gln
35 40
<210> 2
<211> 42
<212> Белок
<213> Mus musculus
<400> 2
Tyr Ala Glu Gly Thr Phe Ile Ser Asp Tyr Ser Ile Ala Met Asp Lys
1 5 10 15
Ile Arg Gln Gln Asp Phe Val Asn Trp Leu Leu Ala Gln Arg Gly Lys
20 25 30
Lys Ser Asp Trp Lys His Asn Ile Thr Gln
35 40
<210> 3
<211> 42
<212> Белок
<213> Rattus norvegicus
<400> 3
Tyr Ala Glu Gly Thr Phe Ile Ser Asp Tyr Ser Ile Ala Met Asp Lys
1 5 10 15
Ile Arg Gln Gln Asp Phe Val Asn Trp Leu Leu Ala Gln Lys Gly Lys
20 25 30
Lys Asn Asp Trp Lys His Asn Leu Thr Gln
35 40
<210> 4
<211> 42
<212> Белок
<213> Sus scrofa
<400> 4
Tyr Ala Glu Gly Thr Phe Ile Ser Asp Tyr Ser Ile Ala Met Asp Lys
1 5 10 15
Ile Arg Gln Gln Asp Phe Val Asn Trp Leu Leu Ala Gln Lys Gly Lys
20 25 30
Lys Ser Asp Trp Lys His Asn Ile Thr Gln
35 40
<210> 5
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический пептид для скрининга
<400> 5
Tyr Ala Glu Gly Thr Phe Ile Ser Asp Tyr Ser Ile Ala Met Asp Lys
1 5 10 15
Ile Cys
<210> 6
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический пептид для скрининга
<400> 6
Cys Leu Leu Ala Gln Arg Gly Lys Lys Ser Asp Trp Lys His Asn Ile
1 5 10 15
Thr Gln
<210> 7
<211> 109
<212> Белок
<213> Mus musculus
<400> 7
Asp Ile Gln Leu Thr Gln Ser Pro Ala Ile Met Ala Ala Ser Leu Gly
1 5 10 15
Gln Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Ser Gly Ala Ser Pro Lys Ser Leu
35 40 45
Ile His Arg Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Val Glu
65 70 75 80
Ala Glu Asp Asp Ala Thr Tyr Tyr Cys Leu Gln Trp Ser Gly Phe Pro
85 90 95
Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 8
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<223> искусственная
<400> 8
gacattcagc tgacccagtc tccagcaata atggctgcct ctctggggca gaaggtcacc 60
atgacctgca gtgccagctc aagtgtaagt tccagttact tgcactggta ccagcagaag 120
tcaggcgctt cccccaaatc cttgattcat aggacatcca acctggcttc tggagtccca 180
gctcgcttca gtggcagtgg gtctgggacc tcttactctc tcacaatcag cagcgtggag 240
gctgaagatg atgcaactta ttactgcctg cagtggagtg gtttcccatt cacgttcggc 300
tcggggacca agctggagat caaacgt 327
<210> 9
<211> 12
<212> Белок
<213> Mus musculus
<400> 9
Ser Ala Ser Ser Ser Val Ser Ser Ser Tyr Leu His
1 5 10
<210> 10
<211> 9
<212> Белок
<213> Mus musculus
<400> 10
Leu Gln Trp Ser Gly Phe Pro Phe Thr
1 5
<210> 11
<211> 117
<212> Белок
<213> Mus musculus
<400> 11
Gln Val Gln Leu Gln Glu Ser Gly Ala Ala Leu Val Arg Ser Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile Lys Asp Tyr
20 25 30
Tyr Phe His Trp Val Lys Gln Arg Pro Asp Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Asp Pro Glu Asn Gly Asp Thr Glu Tyr Ala Pro Asn Phe
50 55 60
Gln Val Lys Ala Thr Met Thr Ala Asp Thr Tyr Ser Asn Thr Ala Tyr
65 70 75 80
Leu His Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Asn Ser Tyr Gly Asn Asn Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 12
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> искусственная
<400> 12
caggtccagc tgcaggagtc tggggcagcg cttgtgaggt caggggcctc agtcaaattg 60
tcctgcacag cttctggctt caacattaaa gactactatt ttcactgggt gaagcagagg 120
cctgaccagg gcctggagtg gattggatgg attgatcctg agaatggtga tactgaatat 180
gccccgaact tccaggtcaa ggccactatg actgcagaca catattccaa cacagcctac 240
ctgcatctca gcagcctgac atctgaggac actgccgtct attactgtaa ttcctacggt 300
aataactact ttgactactg gggccaaggg accacggtca ccgtctcctc a 351
<210> 13
<211> 10
<212> Белок
<213> Mus musculus
<400> 13
Gly Phe Asn Ile Lys Asp Tyr Tyr Phe His
1 5 10
<210> 14
<211> 7
<212> Белок
<213> Mus musculus
<400> 14
Ala Pro Asn Phe Gln Val Lys
1 5
<210> 15
<211> 10
<212> Белок
<213> Mus musculus
<400> 15
Asn Ser Tyr Gly Asn Asn Tyr Phe Asp Tyr
1 5 10
<210> 16
<211> 111
<212> Белок
<213> Mus musculus
<400> 16
Asp Ile Gln Leu Thr Gln Ser Pro Ser Thr Met Ala Ala Ser Pro Gly
1 5 10 15
Glu Lys Ile Thr Ile Thr Cys Ser Ala Ser Ser Ser Ile Ser Ser Asn
20 25 30
Ser Leu His Trp Tyr Gln Gln Lys Pro Gly Phe Ser Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Thr Ser Asn Leu Ala Ser Gly Val Pro Gly Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Gly Thr Met Glu
65 70 75 80
Thr Glu Asp Val Ala Thr Tyr Tyr Cys Gln Gln Gly Ser Ser Phe Pro
85 90 95
Arg Met Leu Thr Phe Gly Thr Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 17
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный
<400> 17
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Ile Ser Ser Asn
20 25 30
Ser Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Thr Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ser Ser Phe Pro
85 90 95
Arg Met Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 18
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный
<400> 18
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Ile Ser Ser Asn
20 25 30
Ser Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Thr Ser Asn Leu Gln Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ser Ser Phe Pro
85 90 95
Arg Met Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 19
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный
<400> 19
Asp Ile Gln Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Ser Ser Ile Ser Ser Asn
20 25 30
Ser Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Arg Thr Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Gly Ser Ser Phe Pro
85 90 95
Arg Met Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
<210> 20
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный
<400> 20
Arg Ala Ser Ser Ser Ile Ser Ser Asn Ser Leu His
1 5 10
<210> 21
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный
<400> 21
Arg Thr Ser Asn Leu Gln Ser
1 5
<210> 22
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный
<400> 22
Gln Gln Gly Ser Ser Phe Pro Arg Met Leu Thr
1 5 10
<210> 23
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный
<400> 23
Arg Thr Ser Ser Leu Gln Ser
1 5
<210> 24
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный
<400> 24
Arg Thr Ser Asn Arg Ala Thr
1 5
<210> 25
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный
<400> 25
Ser Ala Ser Ser Ser Ile Ser Ser Asn Ser Leu His
1 5 10
<210> 26
<211> 7
<212> Белок
<213> Mus musculus
<400> 26
Arg Thr Ser Asn Leu Ala Ser
1 5
<210> 27
<211> 117
<212> Белок
<213> Mus musculus
<400> 27
Gln Val Gln Leu Gln Glu Ser Gly Ala Glu Leu Val Arg Ser Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile Arg Asp Tyr
20 25 30
Tyr Leu His Trp Ile Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Asp Pro Glu Asn Gly Asp Thr Glu Tyr Ala Pro Lys Phe
50 55 60
Gln Asp Lys Ala Thr Val Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Asn Val Tyr Gly Ile Tyr Phe Met Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 28
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный
<400> 28
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Val Ser Gly Phe Asn Ile Arg Asp Tyr
20 25 30
Tyr Leu His Trp Val Gln Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asp Pro Glu Asn Gly Asp Thr Glu Tyr Ala Pro Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Asn Val Tyr Gly Ile Tyr Phe Met Asp Tyr Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 29
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный
<400> 29
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Phe Asn Ile Arg Asp Tyr
20 25 30
Tyr Leu His Trp Val Gln Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asp Pro Glu Asn Gly Asp Thr Glu Tyr Ala Pro Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Asn Val Tyr Gly Ile Tyr Phe Met Asp Tyr Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 30
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный
<400> 30
Gln Val Gln Leu Gln Glu Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Asn Ile Arg Asp Tyr
20 25 30
Tyr Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asp Pro Glu Asn Gly Asp Thr Glu Tyr Ala Pro Lys Phe
50 55 60
Gln Gly Arg Val Thr Thr Thr Ala Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Asn Val Tyr Gly Ile Tyr Phe Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 31
<211> 10
<212> Белок
<213> Mus musculus
<400> 31
Gly Phe Asn Ile Arg Asp Tyr Tyr Leu His
1 5 10
<210> 32
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> гуманизированный
<400> 32
Ala Pro Lys Phe Gln Gly Arg
1 5
<210> 33
<211> 10
<212> Белок
<213> Mus musculus
<400> 33
Asn Val Tyr Gly Ile Tyr Phe Met Asp Tyr
1 5 10
<210> 34
<211> 7
<212> Белок
<213> Mus musculus
<400> 34
Ala Pro Lys Phe Gln Asp Lys
1 5
<210> 35
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> искусственная
<400> 35
gacattcagc tgacccagtc tccatccacc atggctgcat ctcccgggga gaagatcact 60
atcacctgca gtgccagctc aagtataagt tccaattcct tgcattggta tcagcagaag 120
ccaggattct cccctaaact cttgatttat aggacatcca atctggcttc tggagtccca 180
ggtcgcttca gtggcagtgg gtctgggacc tcttactctc tcacaattgg caccatggag 240
actgaagatg ttgccactta ctactgccag cagggtagta gttttccacg catgctcacg 300
ttcggtactg ggaccaagct ggagatcaaa cgt 333
<210> 36
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> искусственная
<400> 36
gacatccaga tgacccagtc cccctcctcc gtgtctgctt ctgtgggcga cagagtgaca 60
attacctgcc gggcctcctc ctccatctcc tccaattccc tgcactggta tcagcagaag 120
cccggcaagg cccccaagct gctgatctac cggacctcca gcctgcagtc cggcgtgccc 180
tctagattct ccggctctgg ctctggcacc gactataccc tgaccatctc cagcctgcag 240
cccgaggact tcgccaccta ctactgtcag cagggctcct ccttcccccg gatgctgaca 300
tttggccagg gcaccaagct ggaaatcaag cgg 333
<210> 37
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> искусственная
<400> 37
gacatccagc tgacccagtc cccctcctcc gtgtctgctt ctgtgggcga cagagtgaca 60
attacctgcc gggcctcctc ctccatctcc tccaattccc tgcactggta tcagcagaag 120
cccggcaagg cccccaagct gctgatctac cggacctcca acctgcagtc cggcgtgccc 180
tctagattct ccggctctgg ctctggcacc gactataccc tgaccatctc cagcctgcag 240
cccgaggact tcgccaccta ctactgtcag cagggctcct ccttcccccg gatgctgaca 300
tttggccagg gcaccaagct ggaaatcaag cgg 333
<210> 38
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> искусственная
<400> 38
gacatccaga tgacccagag ccctggcacc ctgtctctgt ctcccggcga gagagctacc 60
ctgtcctgca gagcctcctc ctccatctcc tccaattccc tgcactggta tcagcagaag 120
cccggccagg cccccagact gctgatctac cggacctcca atcgggccac cggcatccct 180
gccagattct ccggctctgg ctctggcacc gactataccc tgaccatctc cagcctggaa 240
cccgaggact tcgccgtgta ctactgtcag cagggctcct ccttcccccg gatgctgaca 300
tttggcggag gcaccaaggt ggaaatcaag cgg 333
<210> 39
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> искусственная
<400> 39
caggtccagc tgcaggagtc tggggcagag cttgtgaggt caggggcctc agtcaagttg 60
tcctgcacag cttctggctt caacattaga gactactatt tgcactggat aaaacagagg 120
cctgaacagg gcctggagtg gattggatgg attgatcctg agaatggtga tactgaatat 180
gccccgaagt tccaggacaa ggccactgtg actgcagaca catcctccaa cacagcctac 240
ctgcagctca acagcctgac atctgaggac actgccgtct attactgtaa tgtatatggc 300
atctatttta tggactattg gggccaaggg accacggtca ccgtctcctc a 351
<210> 40
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> искусственная
<400> 40
caggtgcagc tggtgcagtc tggcgccgaa gtgaagaaac ctggcgctac cgtgaagatc 60
tcctgcaagg tgtccggctt caacatccgg gactactacc tgcactgggt gcagcaggcc 120
cctggcaagg gactggaatg gatgggctgg atcgaccccg agaacggcga taccgagtac 180
gcccctaagt tccagggcag agtgaccatc accgccgaca cctctaccga caccgcctac 240
atggaactgt cctccctgcg gagcgaggac accgccgtgt actactgcaa cgtgtacggc 300
atctacttca tggactactg gggccagggc acaatggtca ccgtgtcctc t 351
<210> 41
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> искусственная
<400> 41
caggtgcagc tggtgcagtc tggcgccgaa gtgaagaaac ctggcgctac cgtgaagatc 60
tcctgcaagg cctccggctt caacatccgg gactactacc tgcactgggt gcagcaggcc 120
cctggcaagg gactggaatg gatgggctgg atcgaccccg agaacggcga taccgagtac 180
gcccctaagt tccagggcag agtgaccatc accgccgaca cctctaccaa caccgcctac 240
atggaactgt cctccctgcg gagcgaggac accgccgtgt actactgcaa cgtgtacggc 300
atctacttca tggactactg gggccagggc acaatggtca ccgtgtcctc t 351
<210> 42
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> искусственная
<400> 42
caggtgcagc tgcaggaatc tggcgccgaa gtgaagaaac ctggcgcctc cgtgaaggtg 60
tcctgcaagg cctccggctt caacatccgg gactactacc tgcactgggt gcgacaggct 120
ccaggccagg gactggaatg gatgggctgg atcgaccccg agaacggcga taccgagtac 180
gcccctaagt tccagggcag agtgaccacc accgccgaca cctctatctc caccgcctac 240
atggaactgt cccggctgag atccgacgac accgccgtgt actactgcaa cgtgtacggc 300
atctacttca tggactactg gggccagggc acactcgtca ccgtgtcctc t 351
<210> 43
<211> 46
<212> Белок
<213> Искусственная последовательность
<220>
<223> праймер
<400> 43
Cys Ala Gly Thr Cys Gly Ala Ala Gly Cys Thr Thr Thr Gly Ala Gly
1 5 10 15
Gly Ala Gly Ala Cys Gly Gly Thr Gly Ala Cys Cys Gly Thr Gly Gly
20 25 30
Thr Cys Cys Cys Thr Thr Gly Gly Cys Cys Cys Cys Ala Gly
35 40 45
<210> 44
<211> 34
<212> Белок
<213> Искусственная последовательность
<220>
<223> праймер
<400> 44
Cys Ala Ala Cys Thr Ala Gly Gly Ala Thr Cys Cys Ala Gly Gly Thr
1 5 10 15
Ser Met Ala Arg Cys Thr Gly Cys Ala Gly Ser Ala Gly Thr Cys Trp
20 25 30
Gly Gly
<210> 45
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> праймер
<400> 45
Ala Ala Gly Cys Thr Thr
1 5
<210> 46
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> праймер
<400> 46
Gly Gly Ala Thr Cys Cys
1 5
<210> 47
<211> 34
<212> Белок
<213> Искусственная последовательность
<220>
<223> праймер
<400> 47
Cys Ala Gly Thr Cys Gly Ala Ala Gly Cys Thr Thr Gly Thr Thr Ala
1 5 10 15
Gly Ala Thr Cys Thr Cys Cys Ala Gly Cys Thr Thr Gly Gly Thr Cys
20 25 30
Cys Cys
<210> 48
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 48
caactaggat ccgacattca gctgacccag tctcca 36
<210> 49
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 49
tcacgaattc tcaggtccag ctgcaggagt 30
<210> 50
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 50
ttggtgctag ctgaggagac ggtgaccgt 29
<210> 51
<211> 6
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 51
gaattc 6
<210> 52
<211> 6
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 52
gctagc 6
<210> 53
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 53
agccaccgta cgtttgatct ccagcttggt ccca 34
<210> 54
<211> 6
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 54
cgtacg 6
<210> 55
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> праймер
<400> 55
Gly Thr Cys Ala Cys Gly Ala Ala Thr Thr Cys Ala Gly Ala Cys Ala
1 5 10 15
Thr Thr Cys Ala Gly Cys Thr Gly Ala Cys Cys Cys Ala Gly
20 25 30
<---
Реферат
Предложены способ лечения ожирения, диабета II типа или метаболического синдрома с использованием композиции, содержащей фармацевтически эффективное количество молекулярного антагониста желудочного ингибиторного полипептида (GIP), а также способ снижения накопления жировой ткани в печени, снижения накопления жировой ткани в сальнике или снижения накопления подкожной жировой ткани с использованием композиции, содержащей фармацевтически эффективное количество молекулярного антагониста GIP. Предложен также молекулярный антагонист GIP. При этом молекулярный антагонист GIP содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи, где вариабельный домен легкой цепи имеет 100% идентичности с аминокислотной последовательностью SEQ ID NO: 17, SEQ ID NO: 18 или SEQ ID NO: 19, а вариабельный домен тяжелой цепи имеет 100% идентичности с аминокислотной последовательностью SEQ ID NO: 28, SEQ ID NO: 29 или SEQ ID NO: 30. Группа изобретений обеспечивает снижение скорости набора веса, снижение синтеза и накопления липидов. 3 н. и 16 з.п. ф-лы, 19 ил., 3 пр.

Комментарии