Твёрдые формы цефтолозана - RU2703457C2
Код документа: RU2703457C2
Чертежи



Описание
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет приоритет согласно предварительной заявке на патент США № 61/883530, поданной 27 сентября 2013 года, заявке на патент США № 14/289,224, поданной 28 мая 2014 года, и заявке на патент США № 14/289,251, поданной 28 мая 2014 года, каждая из которых включена в настоящую заявку посредством ссылки во всей их полноте.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Настоящее раскрытие относится к твердым формам цефтолозана.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Кристаллическое состояние соединения может быть важным при использовании соединения для фармацевтических целей. По сравнению с аморфным твердым веществом, физические свойства твердого кристаллического соединения могут изменяться из одной твердой формы в другую, что может влиять на его приемлемость для фармацевтического использования. Кроме того, различные твердые формы кристаллического соединения могут включать различные типы и/или различные количества примесей. Различные твердые формы соединения также могут иметь различную химическую стабильность после воздействия тепла и/или воды в течение определенного периода времени.
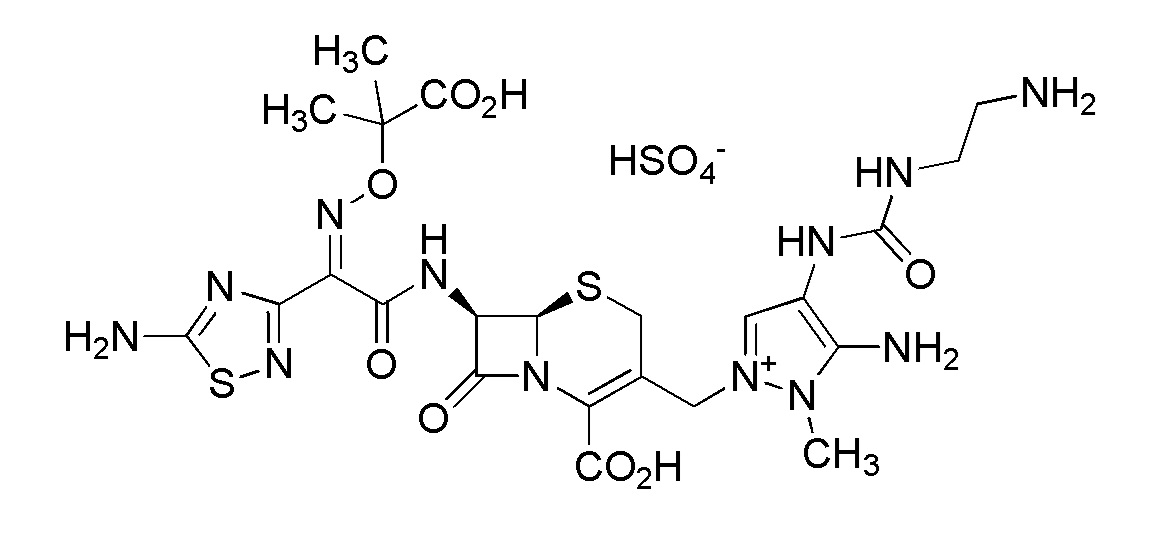
Цефтолозан представляет собой цефалоспориновое антибактериальное средство, также называемое CXA-101, FR264205, или имеет химические названия, такие как (6R,7R)-3-[(5-амино-4-{[(2-аминоэтил)карбамоил]амино}-1-метил-1H-пиразол-2-ий-2-ил)метил]-7-({(2Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-[(1-карбокси-1-метилэтокси)имино]ацетил}амино)-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоксилат и 7β-[(Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-(1-карбокси-1-метилэтоксиимино)ацетамидо]-3-{3-амино-4-[3-(2-аминоэтил)уреидо]-2-метил-1-пиразолио}метил-3-цефем-4-карбоксилат. Цефтолозан сульфат представляет собой фармацевтически приемлемую цефтолозановую соль формулы (I), которая может быть сформулирована для внутривенного введения или инфузии.
патент США № 7129232 раскрывает гидросульфатную соль цефтолозана среди других солей “с основно- или кислотно-аддитивной солью, такой как соль с неорганическим основанием, например, соль щелочного металла [например, соль натрия, соль калия и т.п.], соль щелочно-земельного металла [например, соль кальция, соль магния и т.п.], соль аммония; соль с органическим основанием, например, соль органического амина [например, триметиламиновая соль, триэтиламиновая соль, пиридиновая соль, пиколиновая соль, этаноламиновая соль, триэтаноламиновая соль, дициклогексиламиновая соль, N,N′-дибензилэтилендиаминовая соль и т.п.]; соль присоединения неорганической кислоты [например, гидрохлорид, гидробромид, сульфат, гидросульфат, фосфат и т.п.]; соль присоединения органической карбоновой или сульфоновой кислоты [например, формиат, ацетат, трифторацетат, малеат, тартрат, цитрат, фумарат, метансульфонат, бензолсульфонат, толуолсульфонат и т.п.]; и соль с основной или кислотной аминокислотой [например, аргинин, аспарагиновая кислота, глутаминовая кислота и т.п.]”. Кроме того, патент США № 7129232 раскрывает кристаллическую твердую форму цефтолозан сульфата, полученную путем растворения цефтолозан сульфата в растворе воды и этанола, и добавления затравочных кристаллов, с получением кристаллической формы, описанной в настоящей заявке как (Сравнительный) Пример 1. Синтез цефтолозана также описан в патенте США № 7129232.
Как описано в настоящей заявке, по-прежнему существует необходимость в твердых формах цефтолозана, обладающих улучшенной стабильностью цефтолозана. Например, чистота цефтолозана в водно-этанольном растворе во время осаждения, в соответствии с методикой, описанной в патенте США 7129232, снизилась от около 97% до около 68% в течение 6-дневного испытания стабильности (см. Пример 3), как измерено при помощи высокоэффективной жидкостной хроматографии (ВЭЖХ). Соответственно, сохраняется потребность в твердых формах цефтолозана, имеющих большую стабильность цефтолозана, для использования в разработке лекарственного вещества и лекарственного продукта.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Новые твердые формы цефтолозана (например, кристаллический цефтолозан сульфат), раскрываемые в настоящей заявке, включают цефтолозан сульфат в Форме 1 и Форме 2, а также композиции, включающие твердую форму цефтолозана, включающую по меньшей мере один или несколько из цефтолозан сульфата Формы 1 и цефтолозан сульфата Формы 2. Новые композиции также включают цефтолозан сульфат твердой формы 1, цефтолозан сульфат твердой формы 2 и/или кристаллические и аморфные твердые формы цефтолозана. Новая цефтолозановая твердая форма 1 и новая цефтолозановая твердая Форма 2 цефтолозан сульфата, обе могут быть идентифицированы при помощи порошкового рентгеноструктурного анализа (XRPD), оба имеют одну или несколько характеристических дифракций при углах (2 тета ±0,2) 24,2 и 37,8. Помимо этого, дифракции цефтолозана в обеих твердой Форме 1 и твердой Форме 2 могут показывать Рамановские спектры, включающие один или несколько из следующих пиков (±5 см-1) при около 597 см-1, 716 см-1 и 1329 см-1. Предпочтительная композиция цефтолозана может включать цефтолозан в одной или нескольких твердых формах (например, твердой Форме 1 и/или твердой Форме 2), характеризующихся порошковой рентгеновской дифрактограммой с дифракциями при углах (2 тета ±0,2) 24,2 и 37,8, в дополнение к Рамановским спектрам, включающим один или несколько из следующих пиков при около 597 см-1, 716 см-1 и 1329 см-1.
Новая цефтолозановая твердая Форма 1 цефтолозан сульфата может быть идентифицирована при помощи порошкового рентгеноструктурного анализа (XRPD), имеющего одну или несколько характеристических дифракций при углах (2 тета ±0,2) 12,4, 16,4, 22,6, 25,1 и 28,0. Кроме того, цефтолозан в твердой Форме 1 может показывать Рамановские спектры, включающие один или несколько из следующих пиков (±5 см-1) при 171 см-1, 743 см-1, 819 см-1, 1055 см-1, 2894 см-1 и 2976 см-1.
Новая цефтолозановая твердая Форма 2 цефтолозан сульфата может быть идентифицирована при помощи порошкового рентгеноструктурного анализа (XRPD), имеющего одну или несколько характеристических дифракций при углах (2 тета ±0,2) 4,4, 8,8, 11,0, 14,9 и 17,7. Кроме того, цефтолозан в твердой Форме 1 может показывать Рамановские спектры, включающие один или несколько из следующих пиков (±5 см-1) при 151 см-1, 684 см-1, 802 см-1, 1174 см-1 и 2953 см-1.
Заявители также обнаружили, что новые твердые формы цефтолозановой соли (например, Форма 1 и Форма 2 цефтолозан сульфата) также можно получить посредством поддержания твердой формы цефтолозановой соли в физических условиях, эффективных для преобразования цефтолозановой соли в первой твердой форме в цефтолозановую соль во второй твердой форме. Например, построение изотермы сорбции воды (например, Фиг. 5) цефтолозан сульфата в Форме 1 продемонстрировало обратимое преобразование между цефтолозан сульфатом в твердой Форме 1 и твердой Форме 2 как функцию относительной влажности. Твердая форма цефтолозана может быть изменена посредством поддержания цефтолозана в условиях определенной относительной влажности (например, как показано в изотерме сорбции воды для цефтолозан сульфата на Фиг. 5). Цефтолозан в твердой Форме 2 может быть преобразован в цефтолозан в Форме 1 посредством поддержания образца при относительной влажности (RH), эффективной для преобразования цефтолозана в Форме 2 в Форму 1 цефтолозана при определенной температуре (например, RH около 50% или выше при температуре около 20-25 градусов C, предпочтительно, по меньшей мере около 70% RH при температуре около 25 градусов C). Сразу после того, как он был таким образом образован, цефтолозан в твердой Форме 1 может быть преобразован в цефтолозан сульфат в Форме 2 путем уменьшения RH (например, RH около 20-40%). Цефтолозан сульфат в Форме 2 может быть преобразован в смесь аморфного цефтолозан сульфата и Формы 2 путем уменьшения RH до менее чем около 20%.
Твердые формы цефтолозана (Форма 1 и Форма 2) могут быть получены из раствора, включающего изопропанол, или посредством поддержания твердой формы цефтолозана в условиях, эффективных для преобразования первой твердой формы во вторую твердую форму (например, путем поддержания цефтолозан сульфата в Форме 1 в физических условиях, эффективных для образования цефтолозан сульфата в Форме 2, или преобразования Формы 2 в физических условиях, эффективных для образования цефтолозан сульфата Формы 1). Улучшенная технология изготовления может включать стадии (a) объединения цефтолозан сульфата с молярным избытком серной кислоты (например, около 2,5 молярных эквивалентов серной кислоты относительно цефтолозана) и изопропанолом (например, около 20-40 объемов изопропанола в расчете на количество активного цефтолозана) в условиях, эффективных для получения твердой формы цефтолозана (например, цефтолозан сульфата Формы 1) и (b) выделения твердой формы цефтолозана (например, путем фильтрации твердой формы цефтолозана из раствора, включающего изопропанол).
Заявители обнаружили новые способы получения твердых форм цефтолозан сульфата, которые обеспечивают улучшенную стабильность цефтолозана в процессе получения, по сравнению со способами получения твердых форм цефтолозана, раскрываемых в патенте США 7129232 (см. Сравнительный Пример 1 в настоящей заявке). Улучшенные технологии изготовления частично основаны на открытии, что твердые формы цефтолозан сульфата, полученные с использованием определенных способов, включающих использование изопропанола (например, как описано в Примере 2a) с цефтолозаном, обеспечивают улучшенную стабильность цефтолозана в жидкой фазе в процессе получения (по сравнению с технологиями изготовления, описанными в патенте США 7129232), как определено по чистоте цефтолозана около 82% после 6-дневного испытания стабильности цефтолозана Примера 3 (по сравнению с около 68% для твердых форм цефтолозана, раскрываемых в патенте США 7129232). Новые твердые формы цефтолозана, включая цефтолозан сульфат твердой Формы 1 и цефтолозан твердой Формы 2, могут быть получены из водного раствора с изопропиловым спиртом, даже в отсутствие этанола. В другой стороны, патент США 7129232 раскрывает твердую форму цефтолозана, полученную из водного раствора без изопропилового спирта.
Способы получения полезны для получения антибиотических композиций, включающих цефтолозан в одной или нескольких твердых формах, подходящих для лечения инфекций. Например, фармацевтическая композиция, включающая цефтолозан для парентерального введения, может быть получена из цефтолозан сульфата в твердой Форме 1 и/или твердой Форме 2 при помощи способа, включающего стадии: (a) образования раствора цефтолозана, включающего цефтолозан сульфат в твердой Форме 1 и/или твердой Форме 2, и (b) лиофилизации раствора цефтолозана с получением лиофилизированной комопозиции цефтолозана. Лиофилизированная композиция цефтолозана может быть объединена с тазобактамом (или его фармацевтически приемлемой солью) с получением фармацевтической композиции CXA-201, подходящей для внутривенного введения, после реструктурирования.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг. 1 показывает две порошковые рентгеновские дифрактограммы новых твердых форм цефтолозан сульфата. Верхний образец соответствует продукту Примера 2a. Нижний образец соответствует продукту Примера 2b.
Фиг. 2 показывает два Рамановских спектра новых твердых форм цефтолозан сульфата. Верхний образец соответствует продукту Примера 2a. Нижний образец соответствует продукту Примера 2b.
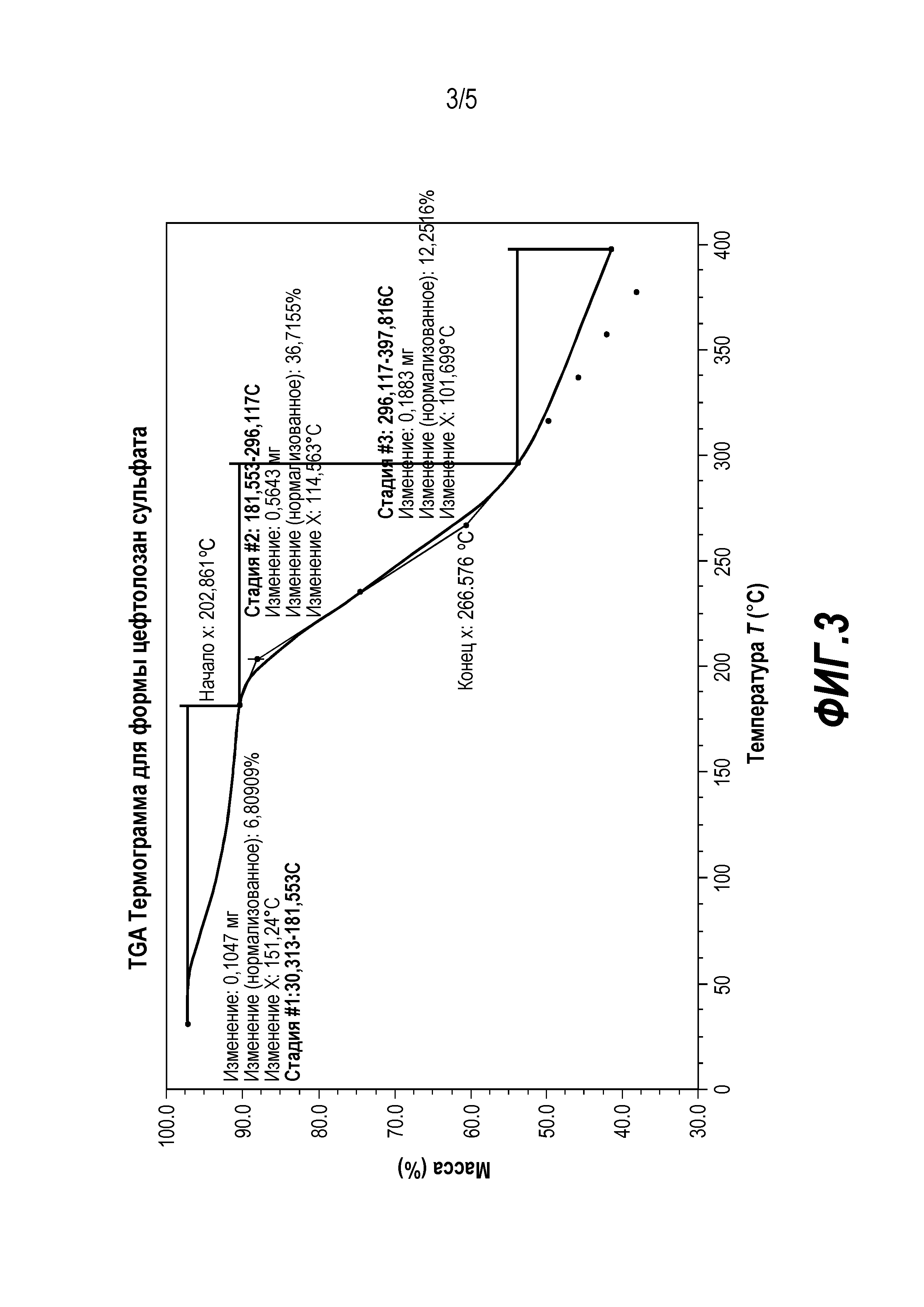
Фиг. 3 представляет собой кривую термогравиметрического анализа (ТГА) для цефтолозан сульфата в твердой форме, обозначенной в настоящей заявке как Форма 2.
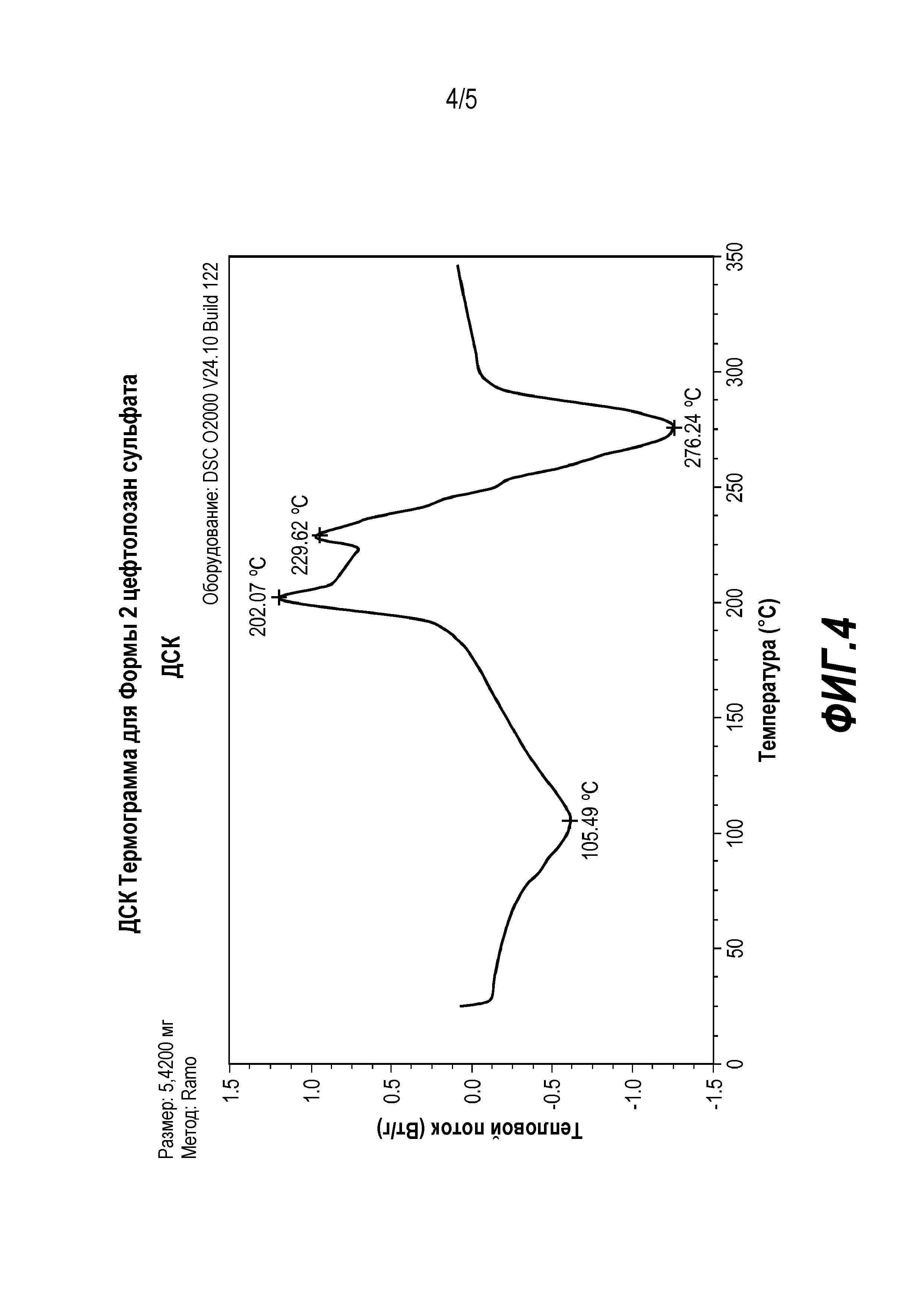
Фиг. 4 представляет собой термограмму дифференциальной сканирующей калориметрии (ДСК) для цефтолозан сульфата в твердой форме, обозначенной в настоящей заявке как Форма 2.
Фиг. 5 представляет изотерму сорбции/десорбции влаги для твердых форм цефтолозан сульфата.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Цефтолозан может быть получен в виде фармацевтически приемлемой соли в одной или нескольких твердых формах. Цефтолозан также известен как CXA-101; регистрационный номер CAS 689293-68-3; (6R,7R)-3-[(5-амино-4-{[(2-аминоэтил)карбамоил]амино}-1-метил-1H-пиразол-2-ий-2-ил)метил]-7-({(2Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-[(1-карбокси-1-метилэтокси)имино]ацетил}амино)-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоксилат и 7β-[(Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-(1-карбокси-1-метилэтоксиимино)ацетамидо]-3-{3-амино-4-[3-(2-аминоэтил)уреидо]-2-метил-1-пиразолио}метил-3-цефем-4-карбоксилат; 5-Тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновая кислота, 3-[[4-[[[(2-аминоэтил)амино]карбонил]амино]-2,3-дигидро-3-имино-2-метил-1H-пиразол-1-ил]метил]-7-[[(2Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-[(1-карбокси-1- метилэтокси)имино]ацетил]амино]-8-оксо-, (6R,7R)-; и (6R,7R)-3-[(5-амино-4-{[(2-аминоэтил)карбамоил]амино}-1-метил-1H-пиразол-2-ий-2-ил)метил]-7-({(2Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-[(1-карбокси-1-метилэтокси)имино]ацетил}амино)-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоксилат. Цефтолозан сульфат представляет собой пример фармацевтически приемлемой соли цефтолозана. Структура цефтолозан сульфата показана ниже.

Цефтолозан сульфат
Цефтолозан сульфат также имеет название: регистрационный номер CAS 936111-69-2; 1H-Пиразолий, 5-амино-4-[[[(2-аминоэтил)амино]карбонил]амино]-2-[[(6R,7R)-7-[[(2Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-[(1-карбокси-1-метилэтокси)имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]метил]-1-метил-, сульфат (1:1); и 5-амино-4-{[(2-аминоэтил)карбамоил]амино}-2-{[(6R,7R)-7-({(2Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-[(1-карбокси-1-метилэтокси)имино]ацетил}амино)-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]метил}-1-метил-1H-пиразолий моносульфат.
Цефтолозан сульфат может находиться в аморфной твердой форме или в кристаллической твердой форме или в виде смесей твердых форм. Кристаллические твердые формы цефтолозана могут существовать в одной или нескольких уникальных твердых формах, которые могут дополнительно включать один или несколько эквивалентов воды или растворителя (то есть, гидраты или сольваты, соответсвенно).
Как раскрыто в настоящей заявке, кристаллический цефтолозан сульфат, осажденный или кристаллизованный из смеси изопропанол/вода, имеет значительно лучшую стабильность в растворе, включающем изопропанол, по сравнению со стабильностью в растворе, включающем этанол, как использовали для получения кристаллического цефтолозан сульфата, осажденного из смеси этанол/вода, ранее описанного в патенте США № 7129232 (см. Пример 3). Более того, кристаллические формы, осажденные или кристаллизованные из смеси изопропанол/вода, имеют четкие характеристические пики XRPD (см. Примеры 1 и 2 и Таблицы 4 и 6), которые не были обнаружены в ранее раскрытых кристаллических формах цефтолозана, описанных в патенте США № 7129232. Соответственно, в настоящей заявке представлены новые твердые формы кристаллического цефтолозан сульфата, их фармацевтические композиции и способы получения таких твердых форм кристаллического цефтолозан сульфата и способы их использования.
Новые твердые формы цефтолозана могут быть получены из водных растворов, включающих цефтолозан и изопропиловый спирт (в настоящей заявке, также называемый IPA или изопропанол). Как описано в Примере 2a, цефтолозан сульфат в твердой Форме 1 может быть получен путем образования раствора цефтолозана, включающего цефтолозановую соль, сильную кислоту и IPA, и поддержания раствора в условиях, эффективных для образования цефтолозанового влажного осадка, содержащего Форму 1 цефтолозановой соли. Предпочтительно, раствор цефтолозана представляет собой водный раствор, включающий цефтолозан и сильную кислоту (например, серную кислоту) в количестве, обеспечивающем по меньшей мере 1 молярный эквивалент сильной кислоты относительно молярного количества цефтолозана в растворе. В некоторых примерах, Форму 1 цефтолозана получали из раствора цефтолозана, который подвергали полировочной фильтрации, и температуру регулировали и поддерживали в течение всего процесса образования соли и выделения. Водный раствор серной кислоты (H2SO4) добавляли к партии. Необязательно, после этого можно внести кристалл цефтолозан сульфата в качестве затравки. Партию оставляли выстаиваться, с последующим добавлением IPA в течение определенного периода времени. После добавления IPA партию интенсивно перемешивали в течение дополнительного периода времени и затем фильтровали. Мокрый осадок цефтолозан сульфата промывали раствором IPA и водой.
Раствор цефтолозана предпочтительно поддерживали при температуре, эффективной для обеспечения требуемой чистоты и выхода цефтолозана в твердой Форме 1, такой как 8-12 градусов C. Помимо температуры (например, 8-12 градусов C, предпочтительно около 10 градусов C) и количества сильной кислоты (например, серной кислоты в количестве, обеспечивающем 1-3 молярных эквивалента, и предпочтительно 2,45-2,55 молярных эквивалента, по отношению к молярному количеству цефтолозана), концентрация цефтолозана до образования соли (например, 75-85 г/л), количество затравки (например, 0,1-1 масс./масс.%) и время старения после внесения затравки (например, 2-4 часа) также представляют собой параметры, которые можно регулировать для получения твердой формы цефтолозана в Форме 1. Особенно предпочтительные способы для получения Формы 1 твердой формы цефтолозан сульфата включают поддержание водного раствора цефтолозан сульфата, изопропилового спирта и серной кислоты при температуре 8-12 градусов C. Таблица 1 показывает примерный диапазон значений для различных параметров способа для получения твердых форм цефтолозан сульфата, наряду с предпочтительными диапазонами и целевыми (наиболее предпочтительными) значениями для каждого параметра способа.
Твердые формы цефтолозана могут быть получены способами, включающими стадию объединения цефтолозан сульфата и растворителя, таким образом, чтобы образовался раствор, включающий цефтолозан сульфат, и таким образом, чтобы осадить кристаллический цефтолозан сульфат из раствора. Твердые формы кристаллического цефтолозан сульфата могут быть получены способами, которые включают стадии: (1) объединения цефтолозан сульфата и растворителя, таким образом, чтобы образовался раствор цефтолозан сульфата; и (2) объединения антирастворителя с раствором, где антирастворитель способен смешиваться с растворителем, и где цефтолозан сульфат частично или полностью нерастворим в антирастворителе, таким образом, чтобы кристаллический цефтолозан сульфат осаждался или кристаллизовывался из раствора.
Композицию цефтолозан сульфата можно получить способом, включающим стадии: (a) образования раствора, включающего воду, 72-100 г/л активного цефтолозана и 1,5-2,95 молярных эквивалентов серной кислоты по отношению к цефтолозану; (b) объединения раствора из стадии (a) с 20-40 объемами изопропилового спирта, добавляемого к раствору в течение 0,5-8 часов, с получением твердого цефтолозан сульфата; и (c) выделения твердого цефтолозан сульфата из раствора. Температура раствора может быть около 0-20 градусов C, предпочтительно 8-12 градусов C (например, 10 градусов C). Необязательно, способ может дополнительно включать добавление затравочного кристалла цефтолозан сульфата, предпочтительно в количестве 0,03-4,0% масс/масс, и старение затравочного кристалла в растворе в течение около 1-5 часов. Необязательно, способ может включать старение раствора в течение периода времени до около 8 часов после добавления изопропилового спирта.
В другом аспекте, способы получения кристаллического цефтолозан сульфата могут включать стадии: (1) объединения свободного основания цефтолозана (то есть, несолевой формы цефтолозана, имеющей суммарный формальный заряд равный нулю) и растворителя, таким образом, чтобы образовался раствор свободного основания цефтолозана; (2) объединения кислоты с раствором свободного основания цефтолозана (например, в количестве, обеспечивающем молярный эквивалент или избыток кислоты по отношению к свободному основанию цефтолозана, и/или количестве, эффективном для доведения pH раствора цефтолозана до около 1,5-2,0); и (3) обеспечения возможности осаждения кристаллического цефтолозан сульфата или кристаллизации из раствора. Кроме того, способ может включать добавление антирастворителя (предпочтительно, изопропилового спирта) в количестве, эффективном для обеспечения нужной скорости или степени осаждения и/или кристаллизации цефтолозанва в растворе. Соответственно, стадия (3) дополнительно может включать объединение антирастворителя с раствором, где антирастворитель способен смешиваться с растворителем, и где цефтолозан сульфат частично или полностью нерастворим в антирастворителе, таким образом, чтобы кристаллический цефтолозан сульфат осаждался или кристаллизовался из раствора. В некоторых вариантах осуществления настоящего изобретения, температуру раствора доводят до 0-20°C. В других вариантах осуществления настоящего изобретения, стадия (3) включает стадию затравки раствора одним или несколькими кристаллами цефтолозан сульфата. В некоторых вариантах осуществления настоящего изобретения, объем антирастворителя, который добавляют к раствору, составляет 20-40 объемов по отношению к цефтолозану. В некоторых вариантах осуществления настоящего изобретения, температуру раствора, образованного на стадии (1), доводят до 0-20°C прежде чем приступить к стадии (2). В одном варианте осуществления настоящего изобретения, способ получения кристаллического цефтолозан сульфата также может включать стадию: (4) сушки осажденного или кристаллизованного кристаллического цефтолозан сульфата. Сушка может включать процедуры, включающие, но не ограничивающиеся этим, сушку воздухом, вакуумную сушку, воздействия потока нейтрального газа (например, азота) и нагревание.
В альтернативном варианте осуществления настоящего изобретения, кислота (например, серная кислота) сначала может быть объединена с растворителем, и полученную смесь затем объединяют с цефтолозаном. Альтернативно, сначала можно объединить цефтолозан и кислоту (например, серную кислоту), и полученная смесь затем объединяют с растворителем. В одном варианте осуществления настоящего изобретения, антирастворитель добавляют к раствору цефтолозан сульфата или свободного основания. В другом варианте осуществления настоящего изобретения, раствор цефтолозан сульфата или свободного основания добавляют в антирастворитель. В некоторых вариантах осуществления настоящего изобретения, растворитель выбирают из группы, состоящей из воды и серной кислоты. В некоторых вариантах осуществления настоящего изобретения, антирастворитель выбирают из группы, состоящей из спиртов, простых эфиров, сложных эфиров, кетонов, нитрилов, амидов, нитроалканов, нитроаренов, замещенных или незамещенных ароматических растворителей, замещенных или незамещенных алифатических растворителей и их смесей. В некоторых вариантах осуществления настоящего изобретения, антирастворитель выбирают из группы, состоящей из ацетона, ацетонитрила, 1-бутанола, циклогексана, дихлорметана, диизопропилового эфира, диметилформамида, диметилсульфоксида, 1,4-диоксана, этанола, этилацетата, гептана, метанола, изопропилацетата, метилэтилкетона, метилизобутилкетона, N-метил-2-пирролидинона, нитрометана, изопропанола, трет-бутилметилового эфира, тетрагидрофурана, толуола и их смесей. В предпочтительном варианте осуществления настоящего изобретения, растворитель представляет собой воду. В другом предпочтительный варианте осуществления настоящего изобретения, антирастворитель представляет собой изопропанол.
Также, в настоящей заявке представлен способ получения кристаллического цефтолозан сульфата, включающий одну или несколько стадий, выбранных из группы, состоящей из следующих: (1) объединение свободного основания цефтолозана, серной кислоты и воды, таким образом, чтобы образовался водный раствор цефтолозан сульфата; и (2) объединение изопропанола с водным раствором, таким образом, чтобы кристаллический цефтолозан сульфат осаждался или кристаллизовался из раствора. В другом аспекте, в настоящей заявке представлен способ получения кристаллического цефтолозан сульфата, включающий стадии: (1) объединение свободного основания цефтолозана, серной кислоты и смеси растворитель/антирастворитель, таким образом, чтобы образовался раствор цефтолозан сульфата; и (2) объединение антирастворителя с раствором, где антирастворитель способен смешиваться с растворителем, и где цефтолозан сульфат частично или полностью нерастворим в антирастворителе, таким образом, чтобы кристаллический цефтолозан сульфат осаждался или кристаллизовался из раствора. В другом аспекте, в настоящей заявке представлен способ получения кристаллического цефтолозан сульфата, включающий стадии: a) растворение цефтолозан сульфата в воде с получением первого раствора цефтолозан сульфата; b) объединение первого раствора цефтолозан сульфата с изопропанолом с получением второго раствора цефтолозан сульфата; c) кристаллизация цефтолозан сульфата из второго раствора с получением кристаллического цефтолозан сульфата. В другом аспекте, в настоящей заявке представлен кристаллический цефтолозан сульфат, полученный в соответствии с любым одним из вышеуказанных способов. В другом аспекте, в настоящей заявке представлен кристаллический цефтолозан сульфат, полученный при помощи любого одного из вышеуказанных способов. Способы и процедуры, описанные в настоящей заявке, также могут дополнительно включать добавление одного или нескольких затравочных кристаллов кристаллического цефтолозан сульфата.
Как используется настоящей заявке, термин “осаждать” относится к образованию твердого вещества из раствора, содержащего это вещество. Вещество, которое осаждают из раствора, может быть аморфным или кристаллическим. Осаждение может происходить в различных условиях, известных специалистам в данной области, включая обработку раствора растворенного вещества (например, растворенное вещество A в растворителе B) антирастворителем (то есть, растворителем, который способен смешиваться с растворителем B, но не растворять растворенное вещество A). Неограничивающие примеры пар растворитель/антирастворитель включают пару вода/изопропанол.
Твердые формы цефтолозана можно идентифицировать при помощи различных аналитических методов, таких как порошковый рентгеноструктурный анализ (XRPD). Твердые формы цефтолозан сульфата в твердой Форме 1 и новую цефтолозановую твердую Форму 2 цефтолозан сульфата - обе можно идентифицировать при помощи XRPD, при этом обе формы имеют одну или несколько общих для них характеристических дифракций при углах (2 тета ±0,2) 24,2 и 37,8. Кроме того, цефтолозан в обеих формах - твердой Форме 1 и твердой Форме 2 может показывать Рамановские спектры, включающие один или несколько из следующих пиков (±5 см-1) при около 597 см-1, 716 см-1 и 1329 см-1. Предпочтительная композиция цефтолозана может включать цефтолозан в одной или нескольких твердых формах (например, твердой Форме 1 и/или твердой Форме 2), характеризующийся порошковой рентгеновской дифрактограммой с дифракциями при углах (2 тета ±0,2) 24,2 и 37,8, в дополнение к Рамановским спектрам, включающим один или несколько из следующих пиков (±5 см-1) при около 597 см-1, 716 см-1 и 1329 см-1. Кроме того, композиции, включающие цефтолозан сульфат в твердой Форме 1 и/или твердой Форме 2, могут быть идентифицированы при помощи порошковых рентгеновских дифрактограмм с дифракциями при значениях 2-тета (2 тета ±0,2), которые указаны в Таблице 4 (для Формы 1) и/или Таблице 6 (для Формы 2), соответсвенно.
Новая цефтолозановая твердая Форма 1 цефтолозан сульфата может быть идентифицирована при помощи порошкового рентгеноструктурного анализа (XRPD), имеющего одну или несколько характеристических дифракций при углах (2 тета ±0,2) 12,4, 16,4, 22,6, 25,1 и 28,0. Кроме того, цефтолозан в твердой Форме 1 может показывать Рамановские спектры, включающие один или несколько из следующих пиков (±5 см-1) при 171 см-1, 743 см-1, 819 см-1, 1055 см-1, 2894 см-1 и 2976 см-1. В одном варианте осуществления настоящего изобретения, в настоящей заявке представлен кристаллический цефтолозан сульфат Формы 1, характеризующийся порошковой рентгеновской дифрактограммой, имеющей пики по существу при тех же самых углах, как на верхнем спектре на Фиг.1. В другом варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат Формы 1 характеризуется порошковой рентгеновской дифрактограммой, имеющей один или несколько пиков по существу при тех же углах (2 тета ±0,2), как в Таблице 4.
Новая цефтолозановая твердая Форма 2 цефтолозан сульфата может быть идентифицирована при помощи порошкового рентгеноструктурного анализа (XRPD), имеющего одну или несколько характеристических дифракций при углах (2 тета ±0,2) 4,4, 8,8, 11,0, 14,9 и 17,7. Кроме того, цефтолозан в твердой Форме 1 может показывать Рамановские спектры, включающие один или несколько из следующих пиков (±5 см-1) при 151 см-1, 684 см-1, 802 см-1, 1174 см-1 и 2953 см-1. В одном варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат Формы 2 характеризуется порошковой рентгеновской дифрактограммой, имеющей характеристические пики по существу при тех же самых углах, как на нижнем спектре на Фиг.1. В другом варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат Формы 2 характеризуется порошковой рентгеновской дифрактограммой, имеющей один или несколько пиков по существу при тех же самых углах (2 тета ±0,2), как в Таблице 6.
Кристаллические формы цефтолозан сульфата также могут характеризоваться по содержанию в них воды. В одном варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат включает 11-27%, 12-26%, 13-25%, 14-24%, 15-23%, 16-22% или 17-21% воды по массе. В конкретном варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат включает 18-20% воды по массе. В другом варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат включает около 26,3% по массе воды. В конкретном варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат представляет собой цефтолозан сульфат декагидрат.
Кристаллические формы цефтолозан сульфата также можно определить по содержанию в них воды. В одном варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат включает 4-10%, 5-9% или 6-8% воды по массе. Форма 1 цефтолозан сульфата может включать около 18-20% воды. Форма 2 цефтолозан сульфата может включать менее чем около 11% воды и предпочтительно около 5-11% воды и наиболее предпочтительно около 7-8% воды.
В другом варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат включает около 7% воды по массе. В особом варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат представляет собой цефтолозан сульфат тригидрат.
В некоторых вариантах осуществления настоящего изобретения, кристаллический цефтолозан сульфат может быть охарактеризован методом рамановской спектроскопии. В конкретном варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат в Форме 1 имеет рамановский спектр по существу в соответствии с верхним спектром, показанным на Фиг.2. В другом конкретном варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат в Форме 1 имеет рамановский спектр с одним или несколькими пиками по существу в тех же положениях (±5 см-1), как показано в Таблице 5. Цефтолозан твердой Формы 1 может показывать пики комбинационного сдвига, включающее один или несколько из некоторых пиков, не наблюдаемых в Форме 1, при около (±5 см-1) 171 см-1, 743 см-1, 819 см-1, 1055 см-1, 2894 см-1 и 2976 см-1.
В других вариантах осуществления настоящего изобретения, кристаллический цефтолозан сульфат в Форме 2 имеет рамановский спектр по существу в соответствии с нижним спектром, показанным на Фиг.2. В другом конкретном варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат в Форме 2 имеет рамановский спектр с одним или несколькими пиками по существу в тех же положениях (±5 см-1), как показано в Таблице 7. Цефтолозан твердой Формы 2 может показывать пики комбинационного сдвига, включающие один или несколько из пиков при около (±5 см-1) 151 см-1, 684 см-1, 802 см-1, 1174 см-1 и 2953 см-1.
Цефтолозан в твердой Форме 1 и твердой Форме 2 оба характеризуются интенсивнымми пиками комбинационного сдвига(±5 см-1) при около 597 см-1, 716 см-1 и 1329 см-1. Кроме того, цефтолозан твердой Формы 1 и Формы 2 может показывать пики комбинационного сдвига, включающие один или несколько из следующих пиков при значениях, указанных в Таблицах 5 и 7 (±5 см-1).
В другом аспекте, в настоящей заявке представлена композиция, включающая аморфную и кристаллическую твердые формы цефтолозан сульфата. В одном варианте осуществления настоящего изобретения, композиция включает кристаллический цефтолозан сульфат и аморфный цефтолозан сульфат, где аморфный цефтолозан сульфат присутствует в количестве, выбранном из следующих дапазонов: 90-99%, 80-89%, 70-79%, 60-69%, 50-59%, 40-49%, 30-39%, 20-29%, 10-19%, 1-9% и 0-0,99%.
В некоторых вариантах осуществления настоящего изобретения, кристаллический цефтолозан сульфат представляет собой гидрат. В одном варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат представляет собой цефтолозан сульфат декагидрат. В конкретном варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат включает 5-амино-4-{[(2-аминоэтил)карбамоил]амино}-2-{[(6R,7R)-7-({(2Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-[(1-карбокси-1-метилэтокси)имино]ацетил}амино)-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]метил}-1-метил-1H-пиразолий моносульфат и воду в молярном соотношении 1:10.
В другом варианте осуществления настоящего изобретения, кристаллический цефтолозан сульфат представляет собой цефтолозан сульфат тригидрат. В конкретном варианте осуществления настоящего изобретения, цефтолозан сульфат включает 5-амино-4-{[(2-аминоэтил)карбамоил]амино}-2-{[(6R,7R)-7-({(2Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-[(1-карбокси-1-метилэтокси)имино]ацетил}амино)-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]метил}-1-метил-1H-пиразолий моносульфат и воду в молярном соотношении 1:3.
По сравнению с предыдущими кристаллическими формами цефтолозан сульфата, некоторые новые кристаллические формы цефтолозан сульфата имеют выгодные свойства. Например, было обнаружено, что эти кристаллические формы являются более химически стабильными, что может быть полезным для получения различных композиций лекарственных средств.
Фармацевтическая композиция может включать и/или быть получена из твердой формы цефтолозан сульфата, обозначенной как Форма 2 цефтолозан сульфата, которая демонстрирует порошковую рентгеновскую дифрактограмму (XRPD), имеющую дифракции при углах (2 тета ±0,2) 4,4, 8,8, 11,0, 14,9 и 17,7. Цефтолозан сульфат может показывать пики комбинационного сдвига (±5 см-1) при около 151 см-1, 684 см-1, 802 см-1, 1174 см-1 и 2953 см-1.
Фармацевтическая композиция может содержать или быть получена из твердой формы цефтолозана, характеризующейся одним или несколькими из следующих: (a) твердая форма цефтолозан сульфата демонстрирует порошковую рентгеновскую дифрактограмму, дополнительно включающую дифракции при углах (2 тета ±0,2): 4,4, 8,8, 11,0, 14,9 и 17,7; (b) твердая форма цефтолозан сульфата по пункту 1, которая демонстрирует порошковую рентгеновскую дифрактограмму, дополнительно включающую одну или несколько дополнительных дифракций при углах (2 тета ±0,2), перечисленных в Таблице 6; (c) твердая форма цефтолозан сульфата, которая показывает пики комбинационного сдвига при около (±5 см-1) 151 см-1, 684 см-1, 802 см-1, 1174 см-1 и 2953 см-1; (d) твердая форма цефтолозан сульфата по пункту 1, которая показывает один или несколько дополнительных пиков комбинационного сдвига при значениях, перечисленных в Таблице 7; и любая комбинация одной или нескольких из характеристик (a)-(d).
Фармацевтическая композиция может содержать или быть получена из лиофилизированной композиции цефтолозана, полученной способом, включающим стадии: (a) объединение цефтолозан сульфата в твердой форме, обозначенной в настоящей заявке как цефтолозан сульфат в твердой Форме 2, с водой, хлоридом натрия и L-аргинином для образования водного раствора; и (b) лиофилизация водного раствора для образования лиофилизированной композиции, включающей цефтолозан сульфат. Фармацевтическая композиция, полученная таким способом, может включать осуществление цикла лиофилизации, характеризующегося одной или несколькими из следующих характеристик: (a) концентрация не более чем 150 мг свободного основания цефтолозана/г нерасфасованного раствора, (b) глубина заполнения не более чем 3 см, (c) замораживание до по меньшей мере -40°C во время цикла лиофилизации, (d) сушка до не более чем 40°C и (e) одно- или многостадийная сушка и установлка давления в камере в начальной стадии первичной сушки при не более чем 400 мкбар.
Композиция цефтолозан сульфата может быть получена способом, включающим следующие стадии: (a) образование раствора, включающего воду, 72-100 г/л активного цефтолозана и 1,5-2,95 молярных эквивалентов серной кислоты по отношению к цефтолозану; (b) объединение раствора из стадии (a) с 20-40 объемами изопропилового спирта, добавляемого к раствору в течение 0,5-8 часов, с получением твердого цефтолозан сульфата; и (c) выделение твердой композиции цефтолозан сульфата из раствора.
Фармацевтические композиции, включающие цефтолозан и тазобактам, могут быть получены путем смешивания первой композиции, включающей терапевтически эффективное количество цефтолозана, со второй композицией, включающей терапевтически эффективное количество тазобактама, для образования смешанной фармацевтической композиции. Фармацевтическая композиция может включать цефтолозан или его терапевтически эффективную соль и тазобактам или его фармацевтический эффективную соль в количестве, обеспечивающем около 500 мг активного тазобактама на 1000 мг активного цефтолозана. Фармацевтическая антибиотическая композиция предпочтительно включает цефтолозан и тазобактам в массовом соотношении 2:1 активного цефтолозана к активному тазобактаму (“CXA-201”), которая демонстрирует антибактериальную активность, включая антибиотическую активность против инфекций, вызываемых многими грамотрицательными патогенными организмами, такими как Pseudomonas aeruginosa (P. aeruginosa). В частности, CXA-201 представляет собой фармацевтическую композицию, полезную для внутривенного введения для лечения осложненных интраабдоминальных инфекций и/или осложненных инфекций мочевыводящих путей, и находится в стадии оценки для лечения воспаления легких.
Также в настоящей заявке представлены способы лечения инфекции, выбранной из группы, включающей: осложненные интраабдоминальные инфекции (cIAI), осложненные инфекции мочевыводящих путей (cUTI) или госпитальная инфекция/бактериальная пневмония, спровоцированная искусственной вентилляцией легких (HABP/VABP). Эти способы могут включать введение пациенту фармацевтической композиции для инъекций, включающей цефтолозан в форме, подходящей для инъекций, полученной из лиофилизированной композиции, которую получают способом, включающим следующие стадии: (a) объединение цефтолозан сульфата в твердой форме, которая демонстрирует порошковую рентгеновскую дифрактограмму (XRPD), имеющую дифракции при углах (2 тета ±0,2) 4,4, 8,8, 11,0, 14,9 и 17,7, с водой для образования водного раствора; и (b) лиофилизация водного раствора для образования лиофилизированной композиции цефтолозана, включающей цефтолозан сульфат.
Фармацевтические композиции могут быть получены путем объединения тазобактама (или его фармацевтически приемлемой соли) в одной или нескольких твердых формах с композицией цефтолозана, включающей цефтолозан в одной или нескольких солевых и/или твердых формах. Цефтолозан в фармацевтической композиции может представлять собой цефтолозан сульфат в одной или нескольких твердых формах, раскрытых в настоящей заявке, включая аморфную форму, Форму 1, Форму 2 и/или их комбинации. Цефтолозан в фармацевтической композиции можно получить способом, включающим лиофилизацию раствора цефтолозан сульфата в твердой Форме 1, твердой форме 2 и/или их комбинации. Например, цефтолозан в фармацевтической композиции может быть получен в отсутствие тазобактама путем образования водного раствора, включающего цефтолозан сульфат в твердой Форме 1, твердой форме 2 и/или их комбинации и другие компоненты, включая эксципиенты, стабилизаторы, регулирующие pH добавки (например, буферы) и т.п. Неограничивающие примеры этих добавок включают хлорид натрия, лимонную кислоту и L-аргинин. Например, использование хлорида натрия приводит к лучшей стабильности; L-аргинин используют для доведения водного раствора до pH 5-7 (например, до pH 6-7) и для повышения растворимости цефтолозана; и лимонную кислоту используют для предотвращения обесцвечивания продукта, благодаря ее способности хелатировать ионы металлов. В одном варианте осуществления настоящего изобретения, pH первого водного раствора является подходящим для получения продукта для введения путем инъекции (например, pH в диапазоне 5-7, включая 6-7). Предпочтительно, первый водный раствор включает около 125 мг - 500 мг стабилизирующего цефтолозан агента (такого как хлорид натрия) на 1000 мг активного цефтолозана. Цефтолозан может быть включен в виде количества цефтолозан сульфата формулы (I), содержащего по меньшей мере около 1000 мг активного вещества цефтолозана. Водный раствор, включающий цефтолозан (например, цефтолозан сульфат в Форме 2 и/или других твердых формах, раскрытых в настоящей заявке) затем лиофилизируют с образованием первой лиофилизированной композиции цефтолозана, которую объединяют с тазобактамом, например, лиофилизированным тазобактамом (например, лиофилизированный натрий тазобактам) или кристаллическим тазобактамом.
Фармацевтическую композицию можно получить путем объединения композиции цефтолозана с (второй) композицией тазобактама (например, предпочтительно, но не обязательно, полученной в отсутствие цефтолозана) путем образования второго раствора, содержащего тазобактам. Тазобактам может быть включен в количестве, обеспечивающем около 500 мг активного тазобактама на 1000 мг активного цефтолозана (то есть, 1:2 массовое отношение активного тазобактама к активному цефтолозану). Тазобактам представляет собой ингибитор бета-лактамазы в его свободной кислотной форме. Если не указано иное, тазобактам может представлять собой свободную кислоту, натриевую соль, an соль с аргинином или их гидрат или сольват. В одном варианте осуществления настоящего изобретения, тазобактам в (второй) композиции тазобактама представляет собой тазобактам в виде кислоты, и вторая композиция дополнительно включает бикарбонат натрия или гидроксид натрия. Лиофилизация тазобактама в присутствии бикарбоната натрия или гидроксида натрия обеспечивает лиофилизированный натрий тазобактам, который затем дополнительно смешивают с (первой) лиофилизированной композицией цефтолозана.
Фармацевтические композиции можно получить путем лиофилизации (например, лиофилизации водного раствора цефтолозана, полученного путем растворения цефтолозана в Форме 2 и/или Форме 1 с другими компонентами, такими как стабилизирующий агент, хелатообразующий агент и/или подщелачивающий агент). Конкретные способы лиофилизации описаны в Remington’s Pharmaceutical Sciences, Chapter 84, page 1565, Eighteenth Edition, A. R. Gennaro, (Mack Publishing Co., Easton, Pa., 1990).
Фармацевтические композиции, включающие цефтолозан и тазобактам, могут быть сформулированы для лечения инфекций путем парентерального введения (включая подкожное, внутримышечное и внутривенное введение). Фармацевтические композиции дополнительно могут включать эксципиенты, стабилизаторы, регулирующие pH добавки (например, буферы) и т.п. Неограничивающие примеры этих добавок включают хлорид натрия, лимонную кислоту и L-аргинин. Например, использование хлорида натрия приводит к лучшей стабильности; L-аргинин используют для доведения pH и для повышения растворимости цефтолозана; и лимонную кислоту используют для предотвращения обесцвечивания продукта, благодаря ее способности хелатировать ионы металлов. В одном конкретном варианте осуществления настоящего изобретения, фармацевтические композиции, описанные в настоящей заявке, формулируют для введения путем внутривенной инъекции или инфузии.
Фармацевтические антибиотические композиции могут быть представлены в содержащем стандартную лекарственную форму контейнере (например, в ампуле или пакете или т.п.). Стандартную лекарственную форму можно растворить с использованием фармацевтически приемлемого носителя и затем вводить внутривенно. Стандартная лекарственная форма включает 1000 мг активного цефтолозана и 500 мг тазобактама, типично 1000 мг активного цефтолозана в виде цефтолозан сульфата и 500 мг активного тазобактама в виде тазобактама натрия, аргинината или свободной кислоты. Стандартные лекарственные формы обычно хранят в флаконах.
В одном аспекте, обеспечивается содержащий стандартную лекарственную форму контейнер (например, пакет, ампула или т.п.), содержащий стандартную лекарственную форму фармацевтической композиции, сформулированной для парентерального введения для лечения осложненных интраабдоминальных инфекций, при этом фармацевтическая композиция включает терапевтически эффективное количество цефтолозан сульфата и тазобактама в соотношении 1000 мг активного вещества цефтолозана на 500 мг активного вещества тазобактама, где фармацевтическую композицию получают способом, включающим следующие стадии:
a. лиофилизация первого водного раствора в отсутствие тазобактама, при этом первый водный раствор включает цефтолозан сульфат, от 125 мг до 500 мг хлорида натрия на 1000 мг активного вещества цефтолозана, L-аргинин и/или лимонную кислоту в количестве, эффективном для доведения pH первого водного раствора до 5-7 (например, 6-7) до лиофилизации, с получением первой лиофилизированной композиции цефтолозана,
b. лиофилизация второго раствора в отсутствие цефтолозана, при этом второй раствор содержит тазобактам, подвергаемый лиофилизации для образования второй лиофилизированной композиции тазобактам; и
c. смешивание первой лиофилизированной композиции цефтолозана и второй лиофилизированной композиции тазобактама с получением смешанной фармацевтической композиции в стандартной лекарственное форме.
В одном варианте осуществления содержащего стандартную лекарственную форму контейнера, тазобактам во втором растворе представляет собой тазобактам в форме кислоты, и где тазобактам в форме кислоты в второй раствор лиофилизируют в присутствии бикарбоната натрия или гидроксида натрия, с образованием, таким образом, лиофилизированного натрий тазобактама во второй лиофилизированной композиции тазобактама.
Фармацевтические композиции, представленные в настоящей заявке, включающие цефтолозан сульфат и тазобактам в соотношении 1000 мг активного вещества цефтолозана на 500 мг активного вещества тазобактама, можно получить способом, включающим следующие стадии:
a. лиофилизация первого водного раствора в отсутствие тазобактама, при этом первый водный раствор содержит цефтолозан сульфат при pH 5-7 (например, 6-7) до лиофилизации, с получением первой лиофилизированной композиции цефтолозана,
b. смешивание первой лиофилизированной композиции цефтолозана с тазобактамом с получением антибактериальной композиции.
Как описано в настоящей заявке, цефтолозан может быть стабилизирован в фармацевтической композиции, включающей цефтолозан и стабилизирующее эффективное количество стабилизирующего агента, выбранного из группы, состоящей из следующих: хлорид натрия, декстран 40, лактоза, мальтоза, трегалоза и сахароза. Фармацевтические композиции, обеспечиваемые настоящим изобретением, основаны частично на удивительном открытии, что фармацевтические композиции цефтолозана, включающие эти стабилизирующие агенты, демонстрируют улучшенный остаточный процент цефтолозана (например, % цефтолозана, оставшегося через 3 дня при 70 градусах C, определенный при помощи ВЭЖХ) и/или химическую стабильность (например, меньшее снижение чистоты цефтолозана, определенной при помощи ВЭЖХ через 7 дней при 60 градусах C в испытании стабильности) по сравнению с контрольными образцами, включающими цефтолозан без стабилизирующего агента.
Соответственно, предпочтительные фармацевтические антибиотические композиции могут включать цефтолозан сульфат и стабилизирующий агент (например, от 300 до 500 мг стабилизирующего агента на 1000 мг активного вещества цефтолозана) в лиофилизированной стандартной лекарственной форме (например, порошок в контейнере). Стандартную лекарственную форму можно растворить с использованием фармацевтически приемлемого носителя (например, 0,9% водный раствор хлорида натрия, изотонический солевой раствор и/или вода для инъекций) и затем вводить внутривенно. В некоторых композициях цефтолозана стабилизирующий агент может быть выбран из группы, состоящей из следующих: хлорид натрия, лактоза, мальтоза и декстран 40, и/или выбран из группы, состоящей из следующих: хлорид натрия, трегалоза и сахароза.
Фармацевтические композиции цефтолозана, включающие от 125 до 500 мг (например, от 480 до 500 мг) хлорида натрия на 1000 мг активного вещества цефтолозана, демонстрируют улучшенную чистоту цефтолозана и химическую стабильность по сравнению с фармацевтическими композициями, включающими цефтолозан со сравнительно меньшим количеством хлорида натрия. Раскрываемые фармацевтические композиции цефтолозана включают стабилизирующее количество хлорида натрия (например, от 125 до 500 мг хлорида натрия [более конкретно, от 480 до 500 мг] на 1000 мг активного вещества цефтолозана). Некоторые предпочтительные композиции демонстрируют улучшенную чистоту цефтолозана и химическую стабильность по сравнению с фармацевтическими композициями, включающими цефтолозан со сравнительно меньшим количеством хлорида натрия. Например, раскрываемые фармацевтические композиции типично включают общее количество примесей менее чем около 4% после хранения в течение семи дней при 60 градусах C, как определено при помощи ВЭЖХ. Альтернативно, раскрываемые фармацевтические композиции включают менее чем около 2% примесей, представленных Пиком 1 после хранения в течение семи дней при 60oC, как определено при помощи ВЭЖХ (см. ВЭЖХ метод, описанный в Таблице 10), где Пик 1 имеет время удерживания по отношению к цефтолозану приблизительно 0,15.
Другой варианте осуществления настоящего изобретения представляет собой контейнер, содержащий стандартную лекарственную форму фармацевтической композиции, сформулированной для парентерального введения для лечения осложненных интраабдоминальных инфекций или осложненных инфекций мочевыводящих путей. Контейнер можно получить способом, включающим следующие стадии: a) лиофилизация водного раствора, включающего 189 мг натрия из хлорида натрия на 1000 мг активного вещества цефтолозана в форме цефтолозан сульфата, и дополнительно включающего лимонную кислоту и L-аргинин, с получением лиофилизированной композиции цефтолозана; и b) заполнение контейнера достаточным количеством лиофилизированной композиции с получением стандартной лекарственной формы, включающей стабилизирующее цефтолозан эффективное количество натрия из хлорида натрия (например, 125-500 мг хлорида натрия на 1 г активного вещества цефтолозана) и 1000 мг активного вещества цефтолозана в форме цефтолозан сульфата. В одном аспекте, pH водного раствора находится в пределах от 6,0 до 7,0. В другом аспекте, фармацевтическая композиция сформулирована для парентерального введения путем восстановления фармацевтической композиции в контейнере (например, с использованием 10 мл разбавителя, такого как вода для инъекций или изотонический солевой раствор) с последующим добавлением восстановленной фармацевтической композиции к носителю для инъекций (например, около 100 мл изотонического солевого раствора или другого фармацевтически приемлемого носителя для внутривенного введения). Необязательно, контейнер также заполняют тазобактамом (например, лиофилизированным тазобактамом, таким как тазобактам натрий). Еще в одном аспекте, фармацевтическая композиция представляет собой жидкую композицию, включающую 487 мг хлорида натрия на 1000 мг активного вещества цефтолозана и тазобактам в количестве, обеспечивающем около 500 мг кислотного эквивалента тазобактама на 1000 мг активного вещества цефтолозана, сформулированную для парентерального введения, и pH водного раствора находится в пределах от 5,0 до 7,0 и предпочтительно около 6,0-7,0.
Фармацевтическая композиция в контейнере также может представлять собой Цефтолозан/Тазобактам для фармацевтического продукта для инъекций, 1000 мг/500 мг. Он представлен в виде комбинации двух стерильных активных порошков в одном контейнере, предназначенной для реструктурирования и внутривенной инфузии. В одном варианте осуществления, фармацевтический продукт получают путем преобразования цефтолозан сульфата в стерильную композицию в виде порошка с использованием эксципиентов, таких как лимонная кислота, хлорид натрия и L-аргинин. Это можно осуществить путем лиофилизации, как описано в настоящей заявке. Лекарственное вещество тазобактам натрия может быть представлено в виде стерильного порошка без каких-либо эксципиентов. Лекарственное вещество тазобактам натрия можно подвергнуть лиофилизации, распылительной сушке, или оно может быть представлено в виде кристаллического вещества. Фармацевтический продукт затем получают путем асептического введения двух порошков (например, двух отдельно лиофилизированных лекарственных порошков) последовательно в один контейнер.
В одном вариантее осуществления настоящего изобретения, контейнер с цефтолозаном/тазобактамом для инъекций содержит приблизительно 2255 мг стерильной порошковой композиции цефтолозана, которая содержит 1147 мг цефтолозан сульфата, что эквиваленто 1000 мг цефтолозана в форме свободного основания, а также приблизительно 537 мг стерильного лекарственного вещества тазобактам натрия, что эквиваленто 500 мг тазобактама в форме свободной кислоты. Во время введения содержимое контейнера реструктурируют с использованием 10 мл носителя, стерильного 5% раствор декстрозы для инъекций USP, воды для инъекций или 0,9% раствор хлорида натрия для инъекций USP, затем содержимое контейнера дополнительно разбавляют в инфузионном мешке 0,9% раствором хлорида натрия для инъекций USP или 5% раствором декстрозы для инъекций USP, для введения.
Цефтолозан-содержащие фармацевтические композиции также могут включать количество тазобактама в фармацевтически приемлемой форме, обеспечивающее 500 мг тазобактама как кислоты на 1000 мг активного вещества цефтолозана в виде композиции, сформулированной для инъекций или для реструктурирования перед парентеральным введением. В одной форме выпуска, продукт цефтолозана/тазобактама может быть представлен в одном контейнере, включающем цефтолозан сульфат и тазобактам натрий, для введения путем восстановления содержащейся в контейнере стандартной лекарственной формы твердого цефтолозана/тазобактама с образованием восстановленной композиции для инъекции. В одной форме выпуска (например, для лечения некоторых инфекций мочевых путей и/или некоторых интраабдоминальных инфекций), каждый контейнер, содержащий стандартную лекарственную форму CXA-201, может содержать 1000 мг активного цефтолозана (масса, эквивалентная свободному основанию, например, обепечивается в виде фармацевтически приемлемой соли, такой как цефтолозан сульфат) и стерильный тазобактам натрий в количестве, эквивалентом 500 мг свободной кислоты тазобактама, в твердой форме. В другой форме выпуска (например, для лечения госпитальной инфекции/бактериальной пневмонии, спровоцированной искусственной вентилляцией легких (HABP/VABP)), продукт цефтолозана/тазобактама может включать содержащий стандартную лекарственную форму контейнер, обеспечивающий 2000 мг активного вещества цефтолозана (например, в виде эквивалентного количества цефтолозан сульфата) и 1000 мг тазобактама как кислоты (например, в виде эквивалентного количества тазобактама натрия). Композиции цефтолозана/тазобактама демонстрируют сильную антибактериальную активность против различных грам-отрицательных инфекций, таких как, например, осложненные интраабдоминальные инфекции (cIAI), осложненные инфекции мочевыводящих путей (cUTI) или госпитальная инфекция/бактериальная пневмония, спровоцированная искусственной вентилляцией легких (HABP/VABP).
Цефтолозан/тазобактам можно использовать для лечения инфекции, выбранной из группы, состоящей из следующих: инфекции мочевых путей и интраабдоминальные инфекции. Способы лечения могут включать внутривенное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической композиции, включающей цефтолозан сульфат и количество тазобактама, обеспечивающее около 500 мг активного вещества тазобактама на 1000 мг активного вещества цефтолозана, при этом цефтолозан сульфат в фармацевтической композиции получен из твердой формы цефтолозан сульфата, полученной способом, включающим следующие стадии: (a) объединение цефтолозан сульфата в твердой форме, обозначенной как Форма 2 цефтолозан сульфата, с водой, хлоридом натрия и L-аргинином с образованием водного раствора; (b) лиофилизация водного раствора с образованием лиофилизированной цефтолозановой композиции, включающей цефтолозан сульфат; (c) объединение лиофилизированной композиции цефтолозана с тазобактамом с получением фармацевтической композиции; (d) восстановление фармацевтической композиции в фармацевтически приемлемом разбавителе; и (e) внутривенное введение восстановленной фармацевтической композиции пациенту.
В некоторых вариантах осуществления твердых форм цефтолозан сульфата, композиций и фармацевтических композиций, описанных в настоящей заявке, твердая форма, композиция или фармацевтическая композиция не включает цефтолозановое вещество, имеющее комбинацию пиков XRPD, описанную в Таблице 1a:
В одном аспекте, обеспечивается композиция, включающая твердую форму цефтолозан сульфата, которая демонстрирует порошковую рентгеновскую дифрактограмму (XRPD), имеющую дифракции при углах (2 тета ±0,2) 12,4, 16,4, 22,6, 25,1 и 28,0, где композиция не включает цефтолозановое вещество, имеющее комбинацию пиков XRPD, описанную в Таблице 1a.
В другом аспекте, обеспечивается композиция, включающая твердую форму цефтолозан сульфата, которая демонстрирует порошковую рентгеновскую дифрактограмму (XRPD), имеющую дифракции при углах (2 тета ±0,2) 4,4, 8,8. 11,0, 14,9 и 17,7, где композиция не включает цефтолозановое вещество, имеющее комбинацию пиков XRPD, описанную в Таблице 1a.
В другом аспекте, обеспечивается композиция, включающая твердую форму цефтолозан сульфата, которая демонстрирует пики комбинационного сдвига (±5 см-1) при около 171 см-1, 743 см-1, 819 см-1, 1055 см-1, 2894 см-1 и 2976 см-1, где композиция не включает цефтолозановое вещество, имеющее комбинацию пиков XRPD, описанную в Таблице 1a.
В другом аспекте, обеспечивается композиция, включающая твердую форму цефтолозан сульфата, которая демонстрирует пики комбинационного сдвига (±5 см-1) при около 151 см-1, 684 см-1 и 802 см-1, где композиция не включает цефтолозановое вещество, имеющее комбинацию пиков XRPD, описанную в Таблице 1a.
В другом аспекте, обеспечивается композиция, включающая твердую форму цефтолозан сульфата, которая демонстрирует:
a. порошковую рентгеновскую дифрактограмму (XRPD), имеющую дифракции при углах (2 тета ±0,2) 24,2 и 37,8, и
b. пики комбинационного сдвига (±5 см-1) при около 597 см-1, 716 см-1 и 1329 см-1;
где композиция не включает цефтолозановое вещество, имеющее комбинацию пиков XRPD, описанную в Таблице 1a.
В другом аспекте, настоящим изобретением обеспечивается фармацевтическая композиция, включающая лиофилизированную композицию цефтолозана, полученную способом, включающим следующие стадии:
a. объединение цефтолозан сульфата в твердой форме, обозначенной в настоящей заявке как Форма 1 цефтолозан сульфата, с водой с образованием водного раствора; и
b. лиофилизация водного раствора с образованием лиофилизированной композиции цефтолозана, включающей цефтолозан сульфат;
где фармацевтическая композиция не включает цефтолозановое вещество, имеющее комбинацию пиков XRPD, описанную в Таблице 1a.
В другом аспекте, настоящим изобретением обеспечивается фармацевтическая композиция, включающая лиофилизированную композицию цефтолозана, полученную способом, включающим следующие стадии:
a. объединение цефтолозан сульфата в твердой форме, которая демонстрирует порошковую рентгеновскую дифрактограмму (XRPD), имеющую дифракции при углах (2 тета ±0,2) 24,2 и 37,8 и пики комбинационного сдвига (±5 см-1) при около 597 см-1, 716 см-1 и 1329 см-1, с водой с образованием водного раствора; и
b. лиофилизация водного раствора с образованием лиофилизированной композиции цефтолозана, включающей цефтолозан сульфат;
где фармацевтическая композиция не включает цефтолозановое вещество, имеющее комбинацию пиков XRPD, описанную в Таблице 1a.
В другом аспекте, настоящим изобретением обеспечивается фармацевтическая композиция, включающая твердую форму цефтолозан сульфата, обозначенную как Форма 2 цефтолозан сульфата, которая демонстрирует порошковую рентгеновскую дифрактограмму (XRPD), имеющую дифракции при углах (2 тета ±0,2) 4,4, 8,8, 11,0, 14,9 и 17,7, где фармацевтическая композиция не включает цефтолозановое вещество, имеющее комбинацию пиков XRPD, описанную в Таблице 1a.
В другом аспекте, настоящим изобретением обеспечивается фармацевтическая композиция, включающая лиофилизированную композицию цефтолозана, полученную способом, включающим следующие стадии:
a. объединение цефтолозан сульфата в твердой форме обозначенной как Форма 2 цефтолозан сульфата, с водой с образованием водного раствора; и
b. лиофилизация водного раствора с образованием лиофилизированной композиции цефтолозана, включающей цефтолозан сульфат.
В другом аспекте, настоящим изобретением обеспечивается фармацевтическая композиция, включающая лиофилизированную композицию цефтолозана, полученную способом, включающим следующие стадии:
a. объединение цефтолозан сульфата в твердой форме обозначенной как Форма 2 цефтолозан сульфата, с водой с образованием водного раствора; и
b. лиофилизация водного раствора с образованием лиофилизированной композиции цефтолозана, включающей цефтолозан сульфат;
где фармацевтическая композиция не включает цефтолозановое вещество, имеющее комбинацию пиков XRPD, описанную в Таблице 1a.
В другом аспекте, обеспечивается композиция цефтолозан сульфата, полученная способом, включающим следующие стадии:
a. образование раствора, включающего воду, 72-100 г/л активного вещества цефтолозана и 1,5-2,95 молярных эквивалентов серной кислоты относительно цефтолозана;
b. объединение раствора из стадии (a) с 20-40 объемами изопропилового спирта, добавляемого к раствору в течение 0,5-8 часов, с получением твердого цефтолозан сульфата; и
c. выделение композиции твердого цефтолозан сульфата из раствора;
где композиция не включает цефтолозановое вещество, имеющее комбинацию пиков XRPD, описанную в Таблице 1a.
В другом аспекте, настоящим изобретением обеспечивается фармацевтическая композиция, включающая лиофилизированную композицию цефтолозана, полученную способом, включающим следующие стадии:
a. объединение цефтолозан сульфата в твердой форме, которая демонстрирует порошковую рентгеновскую дифрактограмму (XRPD), имеющую дифракции при углах (2 тета ±0,2) 4,4, 8,8. 11,0, 14,9 и 17,7, с водой с образованием водного раствора; и
b. лиофилизация водного раствора с образованием лиофилизированной композиции цефтолозана, включающей цефтолозан сульфат;
где композиция не включает цефтолозановое вещество, имеющее комбинацию пиков XRPD, описанную в Таблице 1a.
ПРИМЕРЫ
Оборудование и способы
За исключением Сравнительного Примера 1, и если не указано иное, следующее оборудование и способы использовали в рабочих Примерах, описанных в настоящей заявке. Сравнительный Пример 1 описан в патенте США 7232129.
Рентгеновская порошковая дифракция(XRPD)
Эксперименты с использованием метода рентгеновской порошковой дифракции с высоким разрешением (Bruker, AXS D8 Advance) осуществляли на Bruker D8 дифрактометре с использованием Cu Kα излучения (40 кВ, 40 мА), θ-2θ гониометра и первичной и вторичной щелей Соллера (2,5°), Ge монохроматора и Lynxeye детектора (угол раскрытия 2,948°). Сертифицированный корундовый стандарт (NIST 1976) использовали для контроля работы оборудования. Сбор данных осуществляли с использованием Diffrac.Suite Measurement Center v2.2.47.1, и данные анализировали и представляли с использованием Diffrac.EVA v2.0 или v3.0.
Образцы испытывали в условиях окружающей среды. Приблизительно 500 мг каждого образца измельчали в течение 3 минут при помощи ступки и пестика. Образец получали путем обратной загрузки растертого в порошок веществв в держатель для образцов и поддерживая его при помощи кремниевой пластины с нулевым фоном. После плотной упаковки образовывалась плоская поверхность. Когда образец осторожно переворачивали, внешний вид API в держателе образца оказался очень похожим на внешний вид корундового образца для NIST, используемого для проверки работы инструмента. Тип сканирования объединенным ДваТета/Тета методом использовали для сбора данных. Угловой диапазон был от 2 до 50°2θ, и размер шага 0,001°2θ. Время сбора составляло 1 сек для каждого шага. Устанавливали радиус гониометра 280 мм. Скорость вращения образца 15 об/мин и размер щели 0,1 мм.
Термический анализ
Эксперименты с использованием метода термогравиметрического анализа (TGA) осуществляли на TA Instruments Discovery Series TGA. Температурную калибровку осуществляли с использованием сертифицированного индия. Типично, 3-15 мг образца делали плоским в герметично закрытых алюминиевых чашах. Данные собирали для образцов с проколом и без прокола. Для образцов с проколом, после зажима и уплотнения, автоматический пробоотборник прокалывал крышку образца своим внутренним пробойником непосредственньо перед анализом образца. Образцы нагревали при 20°C/мин при температуре от 30°C до 400°C. Систему продували сухим азотом в процессе эксперимента при скорости 50 мл/мин. Использовали программу для контроля оборудования TRIOS Explorer Software v5.3.0.75. Программу TRIOS v2.40.1838 или v2.04.04563 использовали для анализа данных.
Эксперименты с использованием метода дифференциальной сканирующей калориметрии (DSC) осуществляли на TA Instruments Q2000, который использовали для сбора данных DSC. Калибровку по теплоемкости осуществляли с использованием сапфира, а калибровку по энергии и температуре осуществляли с использованием сертифицированного индия. Типично, 3-10 мг образца делали плоским в герметично закрытых алюминиевых чашах и точно регистрировали массу. Данные собирали для образцов с проколом в крышке. Образцы нагревали при 10°C/мин при температуре от 25°C до 350°C. Систему продували сухим азотом в процессе эксперимента при скорости 50 мл/мин. Использовали программу для контроля оборудовании Advantage for Q Series v2.9.0.396 и Thermal Advantage v5.4.0. Данные анализировали с использованием программа Universal Analysis v4.5A.
Гравиметрический анализ динамической сорбции паров
Данные гравиметрического анализа динамической сорбции паров (Фиг. 5) получали с использованием анализатора поглощения влаги SMS DVS Intrinsic, контролируемого с использованием программы DVS Intrinsic Control v1.0.0.30. Температуру образца поддерживали при 25°C путем контроля оборудования. Влажность контролировали путем смешивания потоков сухого и влажного азота. Относительную влажность(RH) измеряли с использованием калиброванного Rotronic зонда, расположенного рядом с образцом. Изменение массы change образца как функции %RH постоянно контролировали с использованием микровесов (точность ±0,005 мг). Приблизительно 40 мг образца помещали во взвешенную сеточную корзину из нержавеющей стали в условиях окружающей среды. Ссылочную массу устанавливали в начале эксперимента. Изотермические параметры поглощения влаги описаны ниже:
Анализ данных осуществляли в Microsoft Excel с использованием DVS Analysis Suite v6.0. Образец извлекали после завершения изотермического эксперимента для твердого характеризации твердого состояния.
Измерение методом спектроскопии
Рамановские спектры получали на Raman 960 спектрометре с фурье-преобразованием (Thermo Nicolet), снабженном германиевым (Ge) детектором. Проверку длины волны осуществляли с использованием серы и циклогексана. Каждый образец упаковывали в виде пеллеты и помещали в держатель для пеллет, специально используемый для анализа. Приблизительно 0,505 Вт мощности Nd:YVO4 лазера (длина волны возбуждения 1064 нм) использовали для облучения каждого образца. Перевень пиков получали с использованием OMNIC программы v7.2a.
(Сравнительный) Пример 1: Твердая форма, раскрытая в 7129232
Раствор 7β-[(Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-(1-карбокси-1-метилэтоксиимино)ацетамидо]-3-{3-амино-4-[3-(2-аминоэтил)уреидо]-2-метил-1-пиразолио}метил-3-цефем-4-карбоксилата (36 г) в воде очищали при помощи препаративной ВЭЖХ с использованием ODS колонки. Элюат, содержащий желаемый продукт, концентрировали до около 1,5 л в вакууме. Концентрат доводили до около pH 1 при помощи концентрированной хлористоводородной кислоты и хроматографировали на Diaion® HP-20 (6 л), элюируя 20% водным раствором 2-пропанола. Элюат концентрировали до около 800 мл в вакууме и добавляли 2M серной кислоты (17 мл). Полученный раствор лиофилизировали с получением соли серной кислоты в виде аморфного порошка (23,6 г).
Порошок растворяли в воде (71 мл) и этаноле (57 мл). После добавления затравочных кристаллов (310 мг), что приводило к осаждению белого твердого вещества, смесь перемешивали в течение 1 часа. Добавляли смесь этанола (47 мл) и воды (37 мл) в течение 30 минут и добавляли этанол (33 мл) в течение 20 минут. Затем суспензию перемешивали еще в течение 1,5 часов. Осадок собирали фильтрованием, промывали смесью этанол/вода (60 мл/20 мл) и этанолом (60 мл) и сушили с получением гидросульфата 7β-[(Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-(1-карбокси-1-метилэтоксиимино)ацетамидо]-3-{3-амино-4-[3-(2-аминоэтил)уреидо]-2-метил-1-пиразолио}метил-3-цефем-4-карбоновой кислоты в виде кристаллов (17,3 г).
ИК(KBr) 3353, 3183, 1778, 1652, 1558, 1403, 1321, 1143, 1118, 997, 619 см−1
1H-ЯМР(D2O) δ 1,61 (6H, с), 3,10-3,55 (6H, м), 3,71 (3H, с), 5,02 и 5,23 (2H, ABq, J=16,7 Гц), 5,25 (1H, д, J=4,9 Гц), 5,87 (1H, д, J=4,9 Гц), 7,91 (1H, с)
ESI-MS: m/z=667(M+H+)
Пример 2a: Новая твердая форма цефтолозан сульфата
Для получения цефтолозан сульфата в Форме 1: цефтолозан (1 молярный эквивалент) растворяли в воде с получением раствора при концентрации 80 г/л. Добавляли водный раствор серной кислоты (20-98%, 2,5 молярных эквивалентов) при 0-20°C. Полученный раствор затравливали цефтолозан сульфатом (от 0,01 до 0,05% по массе в расчете на активный цефтолозан) и оставляли для перемешивания в течение 1-3 часов при 0-20°C. Наблюдали осаждение. Добавляли изопропанол (20-40 объемов относительно активного цефтолозана) для получения суспензии при 0-20°C. После фильтрования получали кристаллический цефтолозан сульфат. Порошковая рентгеновская дифрактограмма Формы 1 кристаллического цефтолозан сульфата представлена на Фиг. 1 (верхняя дифрактограмма), и соответствующие данные представлены в Таблице 4. Рамановский спектр Формы 1 кристаллического цефтолозан сульфата представлен на Фиг. 2 (верхний спектр), и соответствующие данные представлены в Таблице 5.
Пример 2b: Новая твердая форма цефтолозан сульфата
Для получения цефтолозан сульфата в Форме 2: Цефтолозан сульфат, полученный также, как Форма 1 в Примере 2a, сушили в вакууме и продували азотом при 20-25°C в течение 24-48 часов с получением кристаллического цефтолозан сульфата (после вакуумной сушки). Порошковая рентгеновская дифрактограмма кристаллического цефтолозан сульфата Формы 2 представлена на Фиг. 1 (нижняя дифрактограмма), и соответствующие данные представлены в Таблице 6.
Рамановский спектр кристаллического цефтолозан сульфата Формы 2 представлен на Фиг. 2 (нижний спектр), и соответствующие данные представлены в Таблице 7. В Таблице 7 представлен перечень пиков комбинационного сдвига для цефтолозан сульфата в твердой Форме 2.
Свойство сорбции/десорциии кристаллического цефтолозан сульфата Формы 2 показано на Фиг. 5. Наблюдали обратимый гистерезис, связанный с примерно 23% масс/масс воды при относительной влажности (RH) между 0% и 90%. DVS изотерма на Фиг. 5 согласуется с присутствием двух кристаллических форм, которые могут быть взаимопревращаемыми как функция относительной влажности. Присутствие твердой Формы 1 цефтолозан сульфата и твердой Формы 2 цефтолозан сульфата в образце, испытанном с получением DVS изотермы на Фиг. 5, подтверждали путем измерения изменяющейся влажности XRPD (VH-XRPD) на основании XRPD диракционных углов, раскрытых для Формы 1 и Формы 2 цефтолозан сульфата (как раскрыто в настоящей заявке). Как показано на DVS графике, показывающем изотерму, на Фиг. 5, нижняя кривая соответствует цефтолозан сульфату в твердой Форме 2, а верхняя кривая соответствует цефтолозан сульфату в твердой Форме 1. Y-ось DVS графика представляет изменение массы. X-ось DVS графика относится к проценту относительной влажности (RH) образца. Контрольная точка 10 на Фиг. 5 представляет собой исходную точку Формы 2 в DVS эксперименте. Нижняя часть кривой на Фиг. 5 была получена путем измерения изменения массы образца цефтолозан сульфата в твердой Форме 2 при повышении относительной влажности (RH) в образце, начинаясь у контрольной точки 10 нижней кривой от контрольной точки 10 (Форма 2) и продвигаясь к контрольной точке 20 (Форм 1). На основании полученных данных, цефтолозан сульфат в образце преобразовывался из Формы 2 в Форму 1, когда образец подвергали условиям RH между 50% (контрольная точка 12) и 70% RH (контрольная точка 15). Снова обращаясь к нижней кривой на Фиг. 5, цефтолозан сульфат в Форме 1 присутствует в образце от 70% RH до контрольной точки 20, где образец представляет собой цефтолозан сульфат в кристаллический Форме 1. Как показано на верхней кривой на Фиг. 5, от контрольной точки 20 до контрольной точки 30, цефтолозан сульфат в образце остается в твердой Форме 1. От контрольной точки 30 до около 20% RH (контрольная точка 35 на верхней кривой) кристаллическая форма цефтолозан сульфата в веществе преобразуется из Формы 1 в Форму 2. По мере того, как относительная влажность образца резко снижалась ниже примерно 20% на верхней кривой между контрольной точкой 30 и контрольной точкой 40 (0% RH), цефтолозан сульфат становился более аморфным, с некоторым остаточным количеством Формы 2, остающимся в контрольной точке 40. Обобщая вышесказанное, цефтолозан сульфат в образце присутствовал в виде Формы 2 в контрольной точке 10 (40% RH), преобразовывался из Формы 2 в Форму 1 между контрольной точкой 12 и контрольной точкой 15 на нижней кривой, оставался в виде твердой Формы 1 между контрольной точкой 20 и контрольной точкой 30 на верхней кривой, преобразовывался из Формы 1 в Форму 2 между контрольной точкой 30 и контрольной точкой 35 на верхней криваой и оставался в виде твердой Формы 2 от контрольной точки 35 до контрольной точки 40 (с образованием аморфной твердой формй в образце). От контрольной точки 40 до контрольной точки 10 (нижний кривая) увеличение относительной влажности частично кристаллической Формы 2 вещества приводило к веществу, сохраняющему некоторое количество цефтолозан сульфата в Форме 2 (частично кристаллический).
Пример 2d: Репрезентативный пример способа получения новых твердых форм цефтолозан сульфата
С использованием способа, включающего стадии 1-9 (ниже), Форму 2 активного цефтолозан сульфата получали в виде белого твердого вещества, с определением массы 76,2% (определяли с использованием метода ВЭЖХ, описанного в связи с параметрами в Таблице 9 ниже) и чистоты 98,7% AUC с использованием ВЭЖХ (определяли с использованием ВЭЖХ метода, обсуждаемого в связи с Таблицей 10 ниже). Цефтолозан сульфат твердой Формы 1 получали путем осуществления стадий 1-8 в процедуре, описанной ниже, и затем сушили (стадия 9) с получением цефтолозан сульфата Формы 2. Вещества, используемые в способе ниже, указаны в Таблице 8a.
1. Фильтрование через фильтр тонкой очистки (1 микрометр) раствора цефтолозана (85 г/л, 650 л) в реактор с внутренними стеклянными стенками и доведение температуры до 8-12 градусов C, при целевой температуре около 10 градусов C. Эту температуру поддерживают вплоть до стадии 6.
2. Загрузка 50% (масс/масс) серной кислоты (41 кг, 29 л, 2,5 эквив.) в раствор в реакторе стадии 1 в течение 10-30 минут.
3. (необязательная, но предпочтительная стадия) Загрузка цефтолозансульфатной затравки (200 г, 0,3% по массе) в реактор и перемешивание раствора. (Внимание: наблюдали зародышеобразование при внесении затравки)
4. Старение партии в реакторе в течение 3 часов.
5. Загрузка изопропанола (IPA) (1650 л, 30 объемов) в реактор при равномерной скорости 4-5 об/час. (время добавления 6-7 часов, целевое 6,5 часов) (Внимание: если скорость IPA добавления неравномерная, это может негативно влиять на уровни чистоты продукта)
6. Перемешивание партии в реакторе в течение 1-6 часов, целевое время 2 часа.
7. Фильтрование полученной суспензии цефтолозан сульфата из реактора.
8. Промывка фильтровальной лепешки цефтолозана со стадии 7 раствором 4:1 IPA/вода. (221 л, 4 объемов)
9. Сушка твердого вещества со стадии 8 в вакууме с использованием продувки сухим азотом, при температуре азота 15-35 градусов C, целевая температура около 25 градусов C. Процесс сушки следует контролировать путем измерения остаточных уровней воды и IPA в лепешке. Процесс сушки может быть завершен, когда содержание остаточной воды меньше чем около 8,5% и уровни IPA меньше чем около 5000 ч/млн. Типично, сушка завершается максимум через 48 часов.
Пример 3: Испытание сравнительной стабильности цефтолозана в растворителях
Это испытание стабильности использовали для оценки стабильности и чистоты цефтолозан сульфата в различных системах растворителей.
Образец 1 представлял собой систему растворителей, используемую для получения кристаллического цефтолозан сульфата из смеси изопропанола и воды, как описано в Примере 2b (в отсутствие этанола). Образец 2 представлял собой систему растворителей, используемую для получения кристаллического цефтолозан сульфата, полученного в соответствии с процедурой патента США № 7129232, где кристаллы осаждали из смеси этанола и воды.
Образец 1 и образец 2 поддерживали в течение 6 дней (как описано в Примере 2a, при постоянном перемешивании). Чистоту цефтолозана в образцах в каждой системе растворителей измеряли при помощи ВЭЖХ в день 0, день 3 и день 6.
К удивлению, чистота цефтолозан сульфата в образце 1 была существенно выше, чем чистота цефтолозан сульфата в образце 2 (см. Таблица 8b).
Пример 4: Определение содержания воды для кристаллического цефтолозана
Содержания воды в кристаллическом цефтолозан сульфате (полученном в соответствии с Примером 2a в виде Формы 1) определяли с использованием волюметрического титратора по Карлу Фишеру V30 от компании Mettler Toledo, который был соединен с Stromboli печью от Mettler Toledo с устройством для смены образцов. AquaStar CombiTitrant 5 (EMD; Cat. No.1.88005.1045; Lot No. 51096) использовали в качестве титрующего раствора, и AquaStar Combi-Метанол (EMD; Cat. No 1.88009.1045; Lot No 53046) использовали в качестве растворителя. Для обработки данных использовали LabX программу, версия 3.1.1.0.
Hydranal водный стандарт для KF-печи (Fluka; Cat. No. 34693; Lot No. SZBB010AV), который, как ожидают, содержит 5% воды, точно взвешивали два раза при или очень близко к 200 мг. Кристаллический цефтолозан сульфат (15-18 мг) точно взвешивали три раза в отдельных 20 мл Stromboli сосудах для образцов. Сосуды герметично закрывали с использованием алюминиевых прокладок и резиновых крышек. Используемый в качестве холостой пробы сосуд получали, герметично закрывая пустой 20-мл Stromboli сосуд алюминиевой прокладкой и резиновой крышкой. Сосуд с холостой пробой использовали для определения фонового уровня влаги в воздухе внутри сосуда. Все сосуды загружали на устройство для смены образцов в печь Stromboli. Массы водного стандарта и образцов из мокрых лепешек цефтолозан сульфата вводили в граммах в управляющую программу титратора. Водный стандарт и сосуд с холостой пробой уравновешивали при 150°C. Образцы кристаллического цефтолозан сульфата уравновешивали при 130°C. Поток азота при 40-50 мл/мин использовали для транспорта влаги через трубопровод для перекачки в титровальный сосуд. Использовали время смешивания 180 сек, и получение данных было запрограммировано с максимальным отклонением 15 мкг/мин. По окончании экспериментов программа титратора представляла содержание воды в массовых процентах. KF титратор прошел проверку точности, так как среднее значения полученных в двух повторах показателей для водного стандарта было в приемлемом диапазоне 4,80-5,20%. Результаты содержания воды для кристаллического цефтолозан сульфата, полученные от трехкаратно повторяющихся взвешиваний, регистрировались, и было представлено среднее значение. Для определения содержания воды используют уравнение, описанное ниже. Программа, описанная выше, представляет результат сразу после учета фонового уровня влаги, без какой-либо необходимости подсчета вручную.
Было определено, что образец кристаллического цефтолозан сульфата, полученный в соответствии с Примером 1, содержал около 26,3% масс. воды.
Пример 5: Определение концентрации цефтолозана
Стандарты и образцы получали в 50 мМ перхлората натрия моногидрата, pH 4,00. Стандарт для количественного определения (Стандартный Раствор 1) и стандартный раствор для проверки пригодности хроматографической системы (Стандартный Раствор 2) оба получали при целевой рабочей концентрации 0,3 мг/мл, принимая во внимание концентрацию стандарта в том виде, как он есть. Образцы получали при целевой активной концентрации 0,3 мг/мл путем получения образца при 0,04% (масс/об).
Стандартный Раствор 1 инжектируют 6 раз в начале анализа для установления годности и точности системы.
Пригодность системы определяли с использованием первой инжекции Стандартного Раствора 1. Коэффициент симметрии для пика цефтолозана должен быть от 0,8 до 1,5, и время удерживания для пика цефтолозан должно быть 10,0 минут ±1,5 минут. Установку насоса для двухкомпонентных смесей на изократический режим (0,0 до 10,0 минут и 20,1 до 25,0 минут) можно регулировать для достижения времени удерживания пика цефтолозана.
Дополнительное соответствие эксперимента определяют следующим образом:
- %RSD 6 вводов Стандартного Раствора 1 должно быть менее чем 1,0%. Регенерация Стандартного Раствора 2 должна быть 100,0 ±1,0%.
- Время удерживания Стандартного Раствора 2 должно быть ±5% от RT первой инжекции Стандартного Раствора 1.
- Коэффициент симметрии цефтолозана в Стандартном Растворе 2 должен быть 0,8-1,5.
Каждый образец получали в двух повторах и инжектировали отдельно. Отношение факторов отклика для двух препаратов должно быть в пределах 100,0±1,0%.
Средняя концентрация в образце, в чистом виде, указана в мкг/мг и рассчитывается с использованием следующих уравнений:

где:
Ac = Площадь пика цефтолозана в хроматограмме образца;
Cstd = Концентрация Стандарта 1 цефтолозана, мг/мл;
Astd = Средняя площадь пика в 6 инжекциях Стандарта 1;
Wc = масса образца, мг;
Vc = объем образца, мл;
1000 = Преобразование из мг в мкг; и

Среднее найденное содержание цефтолозана, безводного и не содержащего серную кислоту, указано в % и рассчитывается с использованием следующего уравнения:
Среднее найденной содержание (%) = Концентрация ×10/(100-Содержание воды - Серная кислота);
где:
Концентрация = средняя концентрация в образце, в чистом виде, мкг/мг;
Содержание воды = Среднее содержание воды, %; и
Серная кислота = Среднее содержание серной кислоты, %.
Пример 6: Определение содержания воды в цефтолозане
Испытание для определения содержания воды осуществляли с использованием Stromboli печи и волюметрического титратора, в трех повторах, с использованием отдельного отвешивания 180 мг цефтолозан сульфата. Образец для испытания экстрагировали при 130°C, влагу переносили в титровальный сосуд и титровали до потенциометрической конечной точки. Процент влаги рассчитывали на основании массы образца и представляли среднее от трех значений.
Пример 7: Определение чистоты цефтолозан сульфата.
Образцы цефтолозан сульфата получали при концентрации 1 мг/мл в разбавителе (50 мМ перхлората натрия моногидрата, pH 4,00). Стандарт пригодности системы (SST) получали при концентрации 1 мг/мл цефтолозан сульфата, содержащего указываемые примеси, в разбавителе (50 мМ перхлората натрия моногидрата, pH 4,00). Образцы цефтолозана и SST хранили в охлажденном лотке пробоотборника при 4±2°C, и образцы были стабильны тоько в течение 5 часов в этих условиях. ВЭЖХ условия перечислены в Таблице 10.
В начале каждого эксперимента холостую пробу, содержащую разбавитель, и SST - каждый инжектировали по отдельности. Пригодности системы определяли с использованием SST. Коэффициент симметрии для пика цефтолозана должен быть между 0,8 и 1,5, и время удерживания для пика цефтолозана должно быть 24,0 мин ±1,0 мин. Установку насоса для двухкомпонентных смесей 3,0-33,0 мин можно регулировать для достижения времени удерживания пика цефтолозана.
Каждый образец получали отдельно и инжектировали два раза. Только примеси >LOD (0,008% площади) были интегрированы. Процент площади пика для каждой примеси >LOD получали непосредственно из хроматограммы. Рассчитывали средний % площади каждого пика, и абсолютная разница любого пика в не может быть >0,030%. Чистоту и сопутствующие примеси определяли на основании соответствующего % площади каждого пика относительно общей площади пиков образца. Общее количество примесей представляет собой сумму индивидуальных примесей >LOD. Расчеты осуществляли следующим образом:

где:
ПлощадьПримесь = Площадь пика отдельной примеси; и
Площадьобщая = Общая площадь всех пиков >LOD, включая Цефтолозан.

где:
ПлощадьЦефтолозана = Площадь пика цефтолозана; и
Площадьобщая = Общая площадь всех пиков >LOD, включая Цефтолозан.

Указываются индивидуально определенные примеси, равные или больше предела количественного определения (LOQ) (0,027% площади). Индивидуально неуточненные примеси, равные или больше 0,03%, также указываются.
Пример 8: Лиофилизация твердых форм цефтолозана
Стерильные композиции цефтолозана, подходящие для комбинации с тазобактамом для образования фармацевтической композиции, получали в виде лиофилизированного порошка из цефтолозан сульфата, включающего твердую форму 2, путем объединения лекарственного вещества с эксципиентами в водном растворе, асептической фильтрации раствора, лиофилизации раствора, затем измельчения, просеивания и упаковки стерильного лиофилизированного порошка. Определяли физическую стабильность основного объема раствора при различных концентрациях, и концентрации вплоть до 150 мг свободного основания цефтолозана/г раствора были определены как подходящие. Все регистрируемые партии получали с использованием 150 мг/г концентрации цефтолозана в смешиваемом растворе, и эта концентрация была предложена для коммерческого производства. Растворимость полученной композиции цефтолозана оценивали в диапазоне концентраций, предложенном для промышленного производства, в присутствии эксципиентов, предполагаемых для испоьзования в композиции цефтолозана для применения в фармацевтической композиции. Для каждого образца, отношение активных к неактивным ингредиентам сохранялось одинаковым. Образцы доводили до pH 6,9, поддерживали при температуре 2-8°C и визуально оценивали на образование какого-либо осадка. Результаты представлены в Таблице 11.
На основании эти наблюдений, нерасфасованный раствор цефтолозана с вплоть до 150 мг свободного основания цефтолозана/г раствора можно выдерживать при 2-8°C вплоть до 48 часов без какого-либо эффекта на его растворимость. Подходящее компаундирование до 150 мг свободного основания цефтолозана/г раствора при 10±2,5°C было подтверждено в процессе получения партий в лабораторном, пилотном и проектном масштабе. В Таблице 12 представлены данные стабильности раствора. Данные чистоты, представленные в Таблице 12, получали с использованием модифицированное версии ВЭЖХ метода, который описан в Таблице 10. Как часть модификации, исходная композиция подвижной фазы состояла из 75% подвижной фазы A и 25% подвижной фазы B. Эта композиция линейно изменялась до 70% подвижной фазы A и 30% подвижной фазы B в течение 30 минут, с последующим линейным изменением до 100% подвижной фазы B в течение еще 30 минут. 100% подвижной фазы B затем поддерживали постоянной в течение 25 минут, после чего композиция подвижной фазы возвращалась в течение 0,1 минуты к исходным условиям 75% подвижной фазы A и 25% подвижной фазы B. Уравновешивание колонки осуществляли при исходной композиции подвижной фазы в течение вплоть до 110 минут, что давало общее время осуществления ВЭЖХ 110 минут. Предел количественных определений, определенный для этого метода с условиями, описанными выше, был 0,015%, и поэтому представляли данные о всех индивидуально установленных примесях равных или больше 0,015%.
Температура компаундирования 10±2,5°C представляла собой целевую температуру для поддержания чистоты цефтолозана. Для подтверждения стабильности получаемого раствора, осуществляли испытание, в котором цефтолозан был получен в соответствии с предложенным коммерческим способом, и его поддерживали при 10±2,5°C до 2 дней. Брали пробы раствора и испытывали на концентрацию цефтолозана и чистоту/примеси. Результаты представлены в Таблице 12. Данные, показывающие профиль содержащего примеси цефтолозана, по существу не отличались от исходных, и ни одна из индивидуальных сопутствующих примесей не увеличивалась больше чем на 0,10%. Поэтому максимальное допустимое время хранения 24 часа было предложено для коммерческих целей.
Нерасфасованный раствор цефтолозана делают асептическим путем стерилизующего фильтрования. Для рутинного коммерческого производства, полученный раствор сначала подвергают предварительной фильтрации через фильтр 0,45 мкм, затем стерильно отфильтровывают через два 0,22 мкм фильтры последовательно, и целостность 0,22 мкм фильтров оценивают в процессе производства.
После серии испытаний, как в пилотном, так и в коммерческом масштабе, оборудования для лиофилизации был разработан способ лиофилизации, и было показано, что он является подходящим: в диапазоне концентраций раствора, при различной глубине заполнения лотка лиофилизатора, соблюдая последовательность параметров цикла лиофилизации, в ряде лиофилизаторов, как в лабораторном, так и в коммерческом масштабе, и в двух разных коммерческих комплектах для лиофилизации.
В частности, использовали шесть разных лиофилизаторов (один пилотный лиофилизатор и пять коммерческих лиофилизаторов из двух отдельных коммерческих комплектов) для получения приемлемого цефтолозанового вещества с использованием концентраций вплоть до 150 мг свободного основания цефтолозана/г раствора, глубины заполнени от 1 до 3 см и различных параметров цикла, включая температуры первичной и/или вторичной сушка вплоть до 40°C. На основании этих исследований, замораживание продукта до по меньшей мере от -40 до -45°C считали подходящей целью. Температуры первичной сушки также типично устанавливали на основании температуры стеклования замороженного нерасфасованного раствора для минимизации разрушения. Однако, в отдельных случаях, разрушение можно предотвратить с использованием температур первичной сушки, продиктованных температурой полного расплава vs. температура стеклования. Поэтому осуществляли испытания для исследования этих двух температур более тщательно, для определения, что будет иметь преимущество для предотвращения разрушения. Ряд условий лиофилизации и оборудования был определен как эффективный среди большого диапазона условий лиофилизация. Поэтому предпочтительные циклы лиофилизации для получения лиофилизированной композиции цефтолозана из раствора, содержащего цефтолозан сульфат твердой Формы 2, имеют одну или несколько из следующих характеристик: (1) концентрация не более чем 150 мг свободного основания цефтолозана/г нерасфасованного раствора, (2) глубина заполнения не более чем 3 см, (3) параметры цикло, включающие: замораживание до по меньшей мере в пределах от -40 до -45°C, (4) сушка до не более чем 40°C, (4) одно- или много-стадийная сушка и установка давления в камере во время начала первичной сушки при не более чем 400 мкбар.
Пример 9: Предпочтительная фармацевтическая композиция, включающая цефтолозан и тазобактам (“репрезентативный продукт цефтолозана/тазобактама”)
Фармацевтические композиции, включающие цефтолозан и тазобактам, можно получить способом, описанным в настоящей заявке. Репрезентативный продукт цефтолозана/тазобактама описан в Таблице 14 ниже (цефтолозан и тазобактам для инъекций) как антибактериальный комбинированный продукт для инъекций, состоящий из цефалоспоринового антибактериального цефтолозан сульфата и ингибитора бета-лактамазы натрий-тазобактама для внутривенного введения.
Первый водный раствор, включающий цефтолозан сульфат Формы 2 и ингредиенты в композиции цефтолозана, указанные в Таблице 13, лиофилизировали в отсутствие тазобактама, с получением лиофилизированной композиции цефтолозана. Первый водный раствор включает цефтолозан сульфат и эксципиенты, указанные в предпочтительных композициях, в количестве в расчете на стандартную лекарственную форму, обеспечиваемую количествами и функциями, описанными в Таблице 14. Все эксципиенты являются фармакопейными и типичными для стерильных фармацевтических лекарственных форм, не требующими никакой дополнительной обработки перед их использованием в композиции. Эксципиенты использовали в количествах, находящихся диапазоне, установленном для других одобренных FDA продуктов, как описано в Базе данных Неактивных Ингредиентов (IID). Второй раствор, содержащий тазобактам в форме кислоты и бикарбонат натрия, лиофилизировали в отсутствие цефтолозана с получением композиции натрий тазобактама, описанной в Таблице 14. Затем лиофилизированную композицию натрий тазобактама подвергали сухому смешиванию с лиофилизированной композицией цефтолозана при массовом соотношении натрий тазобактама и цефтолозан сульфата, обеспечивающем 500 мг кислотного эквивалента тазобактама на 1000 мг эквивалента цефтолозанового активного вещества.
Пример 10: Восстановление препарата цефтолозана/тазобактама перед введением субъекту
Композицию цефтолозана/тазобактама Примера 9 восстанавливали перед внутривенным (IV) введением. В соответствии с одним вариантом осуществления способа лечения, непосредственно перед введением инъекции пациенту содержимое одного флакона, содержащего 1500 мг цефтолозана и тазобактама, восстановленного при помощи 20 мл 0,9% NaCl (нормальный солевой раствор) и разбавляли в 80-мл пукете со стерильной водой для инъекций для получения общего объема 100 мл.
Композицию цефтолозана и тазобактама восстанавливали в соответствии со следующей процедурой:
Получают 1 флакон, включающий стандартную лекарственную форму цефтолозана/тазобактама, 1500 мг/флакон. Указывают место изготовления и номер партии и время и дату получения на этикетке, обеспечиваемой для флакона. Цефтолозан/тазобактам Примера 9 не содержит бактериостатического консерванта. Получение раствора для инфузии необходимо осуществлять в соответствии с асептическим методом.
Асептически восстанавливают лиофилизированный флакон, включающий стандартную лекарственную форму цефтолозана/тазобактама, 1500 мг с 10 мл воды для инъекций или 0,9% раствора хлорида натрия для инъекций, USP (нормальный солевой раствор) и осторожно встряхивают для растворения. Конечный объем составляет примерно 11,4 мл. Конечная концентрация примерно 132 мг/мл.
Используя асептический метод, извлекают все содержимое (приблизительно 11,4 мл) восстановленного флакона с использованием шприца и добавляют его в инфузионный мешок, содержащий 100 мл 0,9% раствора хлорида натрия для инъекций, USP (нормальный солевой раствор) или 5% раствора декстрозы для инъекций, USP. Следует убедиться, что весь объем восстановленного флакона добавлен в инфузионный мешок.
Осторожно переворачивают IV мешок для обеспечения полного смешивания его содержимого и растворения лекарственного средства. Конечный объем разбавленной стандартной лекарственной формы цефтолозана/тазобактама Примера 9 для инфузии будет ~111 мл. Все содержимое инфузионного мешка цефтолозана/тазобактама вводят каждому субъекту. Это значит, что через инфузионную линию был пропущен стерильный солевой раствор для полного введения нужной дозы).
Проверяют инфузионный мешок на доступ воздуха, видимое загрязнение и протекание. Разбавленный раствор должен быть прозрачным.
После восстановления стерильной водой для инъекций или 0,9% раствором хлорида натрия (нормальный солевой раствор) для инъекций, раствор цефтолозана/тазобактама в флаконе можно хранить в течение 1 часа перед его переносом и разбавлением в инфузионном мешке.
После разбавления раствора нормальным солевым раствором или 5% раствором декстрозы, раствор цефтолозана/тазобактама, полученный из композиции цефтолозана/тазобактама Примера 9, является стабильным в течение 24 часов при хранении при комнатной температуре или в течение 10 дней при хранении при охлаждении при 2-8°C (36-46°F).
Пример 11: Температура плавления цефтолозан сульфата Формы 2
Эксперимент для определения температуры плавления осуществляли для цефтолозан сульфата Форм 2 с использованием аппаратп для определения температуры плавления SRS Optimelt. SRS-сертифицированные ванилин и фенацетин использовали для проверки работы системы. Осуществляли сканирование температура от 100°C до 400°C для цефтолозан сульфата. Вещество разлагалось до его плавления. Разложение, как показывало явное изменение цвета, начиналось при около 170°C.
Пример 12: TGA и DSC цефтолозан сульфата Формы 2
Термогравиметрический анализ (TGA) и полученные методом дифференциальной сканирующей калориметрии (ДСК) термограммы показаны на Фиг. 3 и Фиг. 4, соответсвенно. Начальну потрею массы 6,8% наблюдали в TGA термограмме от исходной температуры до 181°C, что согласуется с содержанием воды и остаточного изопропанола, присутствующего в цефтолозан сульфате, партия 440637 0004 2. Анализ термограммы выше 181°C показал, что цефтолозан сульфат по-видимому претерпевает разложение при повышении температуры выше указанной. DSC термограмма показала широкую эндотерму с минимумом при около 105,49°C. Последующая экзотерма в термограмме является показателем разложения, что согласуется с наблюдением в эксперименте определения температуры плавления.
Пример 13: Гигроскопичность цефтолозан сульфата Формы 2
Гигроскопичность цефтолозан сульфата, Формы 2 оценивали с использованием анализатора поглощения влаги SMS DVS Intrinsic, снабженного калиброванным Rotronic зондом. Температуру was поддерживали при 25°C и вещество подвергали условиям относительной влажности от 0 до 90%. Цефтолозан сульфат показал непрерывную абсорбцию воды в течение всего цикла при общем поглощении 23% при 90% относительной влажности, и это указывает на то, что цефтолозан сульфат является гигроскопичным.
Реферат
Цефтолозан сульфат представляет собой цефалоспориновое антибактериальное средство. Новые стабильные, твердые формы фармацевтически приемлемой сульфатной соли цефтолозана были выделены путем лиофилизации. Описаны характеризация и идентификация этих твердых форм при помощи XRPD и рамановского ИК, а также способы их получения и использования в фармацевтических композициях. 9 з.п. ф-лы, 5 ил., 16 табл., 13 пр.

Комментарии