Вирусосодержащий препарат и его применение - RU2686108C2
Код документа: RU2686108C2
Чертежи


Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области композиций биологически активных материалов, таких как материалы на основе вирусов (например, вирусы, вирусные частицы, вирусная вакцина), или, и более конкретно, к композиции, подходящей для их хранения. Оно также относится к получению такой композиции. Более конкретно, настоящее изобретение касается композиции, содержащей (i) материал на основе вируса, (ii) по меньшей мере один полимер, выбранный из группы поливинилпирролидона и его производных, (iii) по меньшей мере один сахар, (iv) по меньшей мере две разные аминокислоты, (v) по меньшей мере две фармацевтически приемлемые соли, где по меньшей мере одна из указанных солей представляет собой фосфатную соль и, возможно, (vi) фармацевтически приемлемый буфер. Более конкретно, композиция по данному изобретению подходит для способов сушки, более конкретно - способов сублимационной сушки. Данное изобретение, кроме того, касается полученного высушенного продукта и, более конкретно, - полученного лиофилизированного продукта. Композиции и высушенные продукты согласно настоящему изобретению являются полезными в качестве вакцины для предупреждения и/или лечения расстройств, таких как рак, аутоиммунные заболевания и инфекционные заболевания.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Хранение и транспортировка биологически активных материалов, используемых, например, в фармацевтической промышленности, являются проблематичными, так как данные материалы склонны к деградации, особенно тепловой деградации. Это особенно верно в случае биологически активных материалов, таких как вакцины, которые могут распространяться по всему миру и могут, таким образом, подвергаться действию разных температур, в зависимости от стран распространения или изменения температуры во время транспортировки. Это дополнительно ограничивает распространение биологических материалов в развивающиеся страны с ограниченной инфраструктурой.
Для терапевтической активности материалов на основе вирусов, включая вирусы, вирусные частицы, вирусную вакцину, требуется, чтобы поддерживалась их структурная целостность во время хранения и/или транспортировки для того, чтобы они были инфекционными и/или биологически активными.
Эта структурная целостность материала на основе вируса часто нарушается во время процесса приготовления препарата, таким образом, препятствуя его терапевтическому применению. Для указанной терапевтической активности, кроме того, требуется то, чтобы потеря вирусного титра и, в частности, потеря инфекционного титра была ограниченной.
Разработка новых способов или композиций для того, чтобы стабилизировать биологически активные материалы для промышленных применений, таких как вакцины, для улучшения способности к хранению и транспортировке данных биологических материалов, таким образом, является постоянной целью фармацевтической промышленности.
Одним из предложенных решений было поддержание биологически активных материалов в пределах особых интервалов температуры, более конкретно при низких температурых, т.е. меньше 0°С, более конкретно до -30°С и даже более предпочтительно до -80°С. Это хранение при ультранизких температурах является не только очень дорогим, но и создает значительное неудобство для хранения, транспортировки и клинического применения. Таким образом, была необходимой разработка композиций, которые можно хранить в охлажденном состоянии.
Согласно одной альтернативе, таким образом, предложили готовить биологически активные материалы с добавками животного или человеческого происхождения, такими как альбумин, пептон, желатин или гемацель. Однако применение таких компонентов ограничивается вопросами безопасности, такими как риски аллергических реакций или риски загрязнения или передачи инфекционного агента (например, BSE (губчатая энцефалопатия крупного рогатого скота)). Кроме того, данный раствор обычно является дорогим и, таким образом, не совместимым с промышленной разработкой.
Кроме того, предполагается, что материал на основе вируса не будет сохранять его инфекционность при хранении в охлажденном состоянии в жидкой форме в течение длительного периода времени. В результате, отсутствуют описанные исследования по приготовлению и хранению вируса в охлажденном состоянии в жидкой форме. Таким образом, сохраняется потребность в композициях вирусных препаратов, стабильных при долговременном хранении.
Другой альтернативой была консервация биологически активных материалов, особенно материалов на основе вируса, в сухой форме. Среди доступных методик сушки биоматериала сублимационная сушка (также именуемая лиофилизацией) представляет собой ключевую стадию для изготовления биофармацевтических препаратов, таких как вакцины. Сублимационная сушка приводит к получению высушенных биологических продуктов, которые являются стабильными при примерно 4°С-8°С и, в некоторых случаях, до примерно 25°С.Лиофилизацию широко применяли для улучшения стабильности разных вирусных вакцин и рекомбинантных белковых продуктов.
Процесс сублимационной сушки включает последовательные стадии замораживания растворов или суспензий биоматериалов, с последующими первичными и вторичными стадиями сушки (относительно обзора, см., Adams, 2007, Methods Mol. Biol. 368, 15-38). По существу данная методика основана на сублимации воды при температуре ниже нуля под вакуумом без плавления раствора. Однако скорость диффузии водного пара из замороженного биоматериала является очень низкой и, следовательно, данный процесс является времязатратным. Кроме того, обе стадии - замораживание и сушка привносят стрессы (например, концентрация солей, осаждение/кристаллизация, напряжение сдвига, крайние значения рН, остаточная влага, сохраняющаяся во время процесса сублимационной сушки), которые могут заставлять биологический материал претерпевать значимые химические и физические изменения и быть очень повреждающими для некоторых биологических материалов, таких как материалы на основе вирусов. Таким образом, необходимо иметь адаптированные композиции, обеспечивающие консервацию биологически активного материала во время процесса сушки и, преимущественно, кроме того, во время стадий хранения/транспортировки.
В предшествующем уровне техники предложены примеры композиций, используемых для сублимационной сушки биологических материалов, более конкретно материалов на основе вирусов.
Для того чтобы ограничивать потерю инфекционного титра препарата полиовируса, в WO89/06542 была предложена сушка маточного раствора вируса при 37°С в присутствии стабилизирующего раствора, составленного из 10% трегалозы в качестве единственного защитного агента. Однако потеря инфекционного титра остается большой и большей, чем потеря, наблюдаемая для невысушенной вакцины.
В ЕР 0872249 описан препарат рекомбинантного вирусного вектора, содержащий комбинацию глутаминовой кислоты или ее натриевой соли и глюкозы.
В WO 95/10601 раскрыт водный раствор рекомбинантного вируса, содержащий сахарид, высокомолекулярную структурную добавку, аминокислоту, буфер и воду.
В WO 03/053463 раскрыты композиции вируса осповакцины, содержащие сахарозу, декстран, глутаминовую кислоту и буфер, который не содержит фосфат.
В WO 2005/066333 описана вирусная композиция, содержащая мочевину, сахар, соль, буфер, диспергирующий агент и смесь незаменимых и заменимых аминокислот.
В WO 2007/056847 раскрыта композиция, содержащая вирус, содержащая сахарозу, сорбит, поливинилпирролидон, мочевину, TRIS буфер, мононатрия глутамат и другую аминокислоту, такую как аргинин, аланин, серии или глицин.
В WO 2008/114021 и WO 2011/121306 описаны вирусные композиции, содержащие полиэтилениминные соединения, возможно в комбинации с одним или более чем одним сахаром.
Тем не менее, сохраняется потребность в новых композициях, обеспечивающих стабилизацию биологических материалов и, в частности, материалов на основе вирусов, обеспечивающих промышленные применения, хранение без воздействия на биологическую активность продукта и, более конкретно, для того, чтобы избегать потери титра вируса.
Согласно настоящему изобретению предложена композиция, содержащая материалы на основе вируса, более конкретно, водная композиция, подходящая для сублимационной сушки. Согласно предпочтительному воплощению композиция по данному изобретению является стабильной на протяжении тестов долговременной стабильности, как определено ниже, и, более конкретно, на протяжении хранения при температурах выше 0°С, конкретно от примерно 4°С до примерно 30°С, предпочтительно от примерно 4°С до примерно 25°С, более предпочтительно от примерно 2°С до примерно 8°С и даже более предпочтительно от примерно 4°С до примерно 5°С (например, при температуре охлаждения).
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
КОМПОЗИЦИЯ
Согласно первому воплощению настоящее изобретение касается композиции, содержащей (i) по меньшей мере один материал на основе вируса, (ii) по меньшей мере один полимер, выбранный группы поливинилпирролидона и его производных, (iii) по меньшей мере один сахар, (iv) по меньшей мере две разные аминокислоты, (v) по меньшей мере две фармацевтически приемлемые соли, где по меньшей мере одна из указанных солей представляет собой фосфатную соль, и, возможно, (vi) фармацевтически приемлемый буфер.
Если не утверждается иное, следующие термины в том виде, в котором они используются во всей данной заявке, имеют следующее значение.
«И/или» в данной заявке включает значение «и», «или» и «все или любая другая комбинация элементов, связанных указанным термином».
Подразумевается, что термины «содержащий» и «содержат(жит)» означают то, что материалы, продукты, препараты, композиции и способы включают упоминаемые компоненты или стадии, но не исключают других. Фразы «по существу состоящий из» или «по существу состоят(ит) из», при использовании для определения продуктов, композиций и способов, будут означать исключение других компонентов или стадий, имеющих любое существенное значение. Таким образом, например, композиция по существу состоящая из перечисленных компонентов не исключала бы следовых примесей и фармацевтически приемлемых носителей. Фразы «состоящий из» или «состоят(ит) из» будут означать исключение всего, кроме следовых элементов других компонентов или стадий.
Термины «примерно» или «приблизительно» в том виде, в котором они используются в данной заявке, означают в пределах 10% и, более предпочтительно, в пределах 5% от данного значения или интервала. Согласно конкретному воплощению данного определения фраза «примерно х» также включает х.
Согласно предпочтительному воплощению композиция по настоящему изобретению представляет собой водную композицию. Такая композиция подходит для хранения при температуре охлаждения или для хранения при температуре, не являющейся температурой охлаждения (например, при температуре окружающей среды), особенно при сублимационной сушке.
Согласно настоящему изобретению фраза «материал или продукт на основе вируса» означает вирусы, вирусные частицы, вирусные векторы и вирусную вакцину. Данные термины являются синонимами и являются взаимозаменяемыми. Данный термин включает вирусы дикого типа, умерщвленные, живые ослабленные, инактивированные и рекомбинантные вирусы. Он, кроме того, включает продукты на основе вирусов, такие как вирусные векторы, вирусные частицы, такие как вирусоподобные частицы (VLP) или нуклеокапсиды.
Согласно настоящему изобретению термин «вирусы» предпочтительно относится к вирусам, используемым в вакцинах, и более предпочтительно к ДНК-вирусам, таким как Adenoviridae, Herpesviridae и Poxviridae.
Согласно более предпочтительному воплощению подразумевается, что термин «вирусы» обозначает вектор на основе вируса оспы. Вирусы оспы согласно настоящему изобретению более предпочтительно относятся к хордопоксвирусам (вирусам оспы позвоночных). Хордопоксвирусы включают ортопоксвирусы, парапоксвирусы, авипоксвирусы, каприпоксвирусы, леприпоксвирусы, суипоксвирусы, моллюсципоксвирусы или ятапоксвирусы, но не ограничиваются ими. Предпочтительные хордопоксвирусы согласно данному изобретению представляют собой ортопоксвирусы. Согласно другому предпочтительному воплощению он выбран из группы, состоящей из вируса осповакцины, подходящие вирусы осповакцины включают, без ограничения, штамм Copenhagen (Goebel et al., 1990, Virol. 179, 247-266 и 517-563; Johnson et al., 1993, Virol. 196, 381-401), штамм Wyeth, Elstree, Western Reserve (WR), IHDJ, и сильно ослабленный вирус, происходящий от них, включающий MVA (модифицированный вирус осповакцины Анкара), NYVAC (см. WO 92/15672 - Tartaglia et al., 1992, Virology, 188, 217-232). Данный вектор также может быть получен из любого другого члена Poxviridae, в частности вируса оспы кур (например, TROVAC, см. Paoletti et al, 1995, Dev Biol Stand., 84, 159-163); вируса оспы канареек (например, ALVAC, WO 95/27780, Paoletti et al, 1995, Dev Biol Stand., 84, 159-163); вируса оспы голубей; вируса оспы свиней и тому подобных.
Согласно одному воплощению вирусный вектор представляет собой компетентный к репликации вектор, способный инфицировать клетки млекопитающих, особенно делящиеся клетки (т.е. онколитический вектор), и более конкретно компетентный к репликации вектор на основе вируса оспы, выбранный в группе, состоящей из вируса осповакцины штаммов Copenhagen или WR (см., например, WO 2009/065547, WO 2009/065546 или WO 9531105).
Согласно другому воплощению вирусный вектор представляет собой ослабленный вирус оспы, характеризующийся потерей его способности репродуктивно реплицироваться в линиях человеческих клеток.
Согласно предпочтительному воплощению материал на основе вируса по настоящему изобретению представляет собой вирус или вирусную частицу, выбранную из группы, состоящей из вируса осповакцины (VV) и модифицированного вируса осповакцины Анкара (MVA).
Предпочтительный VV может представлять собой W, описанный в патентных заявках WO 2009/065546, WO 2009/065547 или WO 95/31105, описывающих именно VV, усиленный иммуностимулирующим цитокином, который представляет собой GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор), или суицидным геном.
Данное изобретение предпочтительно осуществляется с использованием модифицированного вируса осповакцины Анкара (MVA) (Sutter et al., 1994, Vaccine, 12, 1032-40). Типичным штаммом MVA является MVA 575, который был депонирован в Европейскую коллекцию культур клеток животных (ЕСАСС) под номером депонирования ЕСАСС V00120707. Другими примерами штаммов MVA, пригодных согласно данному изобретению, являются штамм MVA, депонированный в CNCM (Национальная коллекция культур микроорганизмов) под №1-721, MVA-BN, депонированный в ЕСАСС под номером V00083008, MVA II/85, MVA-572, депонированный в ЕСАСС под номером депонирования V94012707, или производное любого такого вируса.
Как определено ранее, вирус согласно настоящему изобретению может быть вирусом дикого типа, ослабленным или рекомбинантным вирусом, более предпочтительно рекомбинантным вирусом оспы.
Термин «рекомбинантный» вирус относится к вирусу, более конкретно к вирусу оспы, содержащему экзогенную последовательность, вставленную в его геном. Термин «экзогенная последовательность» в том виде, как он используется в данной заявке, относится к нуклеиновой кислоте, которая не присутствует в природе в родительском вирусе.
Примером такого рекомбинантного вируса является JX-594/TG6006, который представляет собой вирус осповакцины с инактивированной тимидинкиназой (штамм Wyeth), экспрессирующий иммуностимулирующий цитокин, который представляет собой гранулоцитарно-макрофагальный колониестимулирующий фактор, т.е. GM-CSF (см. WO 95/31105, WO 2007/030668 и WO 2008/113078). Другим примером является дважды инактивированный - по тимидинкиназе (ТК) и рибонуклеотидредуктазе (I4L) вирус осповакцины TG6002 (штамм Copenhagen), экспрессирующий суицидный ген, такой как суицидный ген FCU1 (см. WO 2009/065546).
Экзогенная последовательность также может заменять функцию дефектного гена в клетке-мишени. У млекопитающих, включая человека, имеется несколько тысяч наследственных генетических заболеваний, которые вызваны дефектными генами, таких как, например, заболевания, включающий муковисцидоз, мышечную дистрофию Дюшенна или серповидно-клеточную анемию. Многие типы рака также вызваны дефектными генами, особенно протоонкогенами и генами-суппрессорами опухолей, которые подверглись мутации, такими как, например, протоонкгены ras, src, bcl и так далее. Примерами генов-суппрессоров опухолей являются р53 и Rb.
Согласно другой возможности экзогенная последовательность может кодировать ассоциированный с опухолью антиген (ТАА). Термин «ТАА» относится к молекуле, которая детектируется в опухолевых клетках с более высокой частотой или плотностью, чем в неопухолевых клетках того же самого типа ткани. Примеры ТАА включают СЕА, MART1, MAGE1, MAGE3, GP-100, MUC1, но не ограничиваются ими, как, например, описано в WO 92/07000, WO 95/09241, включенных в данную заявку посредством ссылки, более предпочтительно MUC1.
Экзогенный ген, кроме того, может кодировать антиген. Предпочтительно антиген происходит из вируса, такого как, например ВИЧ-1 (вирус иммунодефицита человека-1) (как, например, др 120 или др 160), любой из вирусов иммунодефицита кошек, вирусы герпеса человека или животных, такие как gD или их производные, или немедленного раннего белка, такого как ICP27 из HSV1 (вирус простого герпеса 1) или HSV2, цитомегаловируса (такой как дВ или его производные), вируса ветряной оспы (такой как gpI, II или III) или вируса гепатита, такого как вирус гепатита В (HBV), например, из антигена поверхности гепатита В или его производного (см. WO 2011/015656 и WO 2013/007772), вируса гепатита A (HAV), вируса гепатита С (HCV, см. WO 04/111082; предпочтительно неструктурный белок HCV из генотипа штамма 1b) и вируса гепатита Е (HEV), или из других вирусных патогенов, таких как респираторно-синцитиальный вирус, вирус папилломы человека (HPV; см. WO 90/10459, WO 95/09241, WO 98/04705, WO 99/03885 и WO 07/121894; предпочтительными являются белки Е6 и Е7 из штамма HPV16; см. также Liu et al. Proc Natl Acad Sci USA. 2004 Oct 5;101 Suppl 2:14567-71) или вирус гриппа, или происходят из бактериальных патогенов, таких как Salmonella, Neisseria, Borrelia (например, OspA или OspB, или их производные) или Chlamydia, или Bordetella, например, Р. 69, РТ и FHA, или происходят из паразитов, таких как плазмодий или Toxoplasma. Согласно настоящему изобретению указанный антиген более предпочтительно выбран из HCV или HPV. В данном отношении такой предпочтительный рекомбинантный вирус, используемый в композиции согласно настоящему изобретению, представляет собой MVA-HCV (см. WO 04/111082), также именуемый TG4040, который представляет собой MVA, экспрессирующий антигены NS3, NS4 и NS5B HCV (причем NS3 и NS4 экспрессируются в виде слитого белка, и NS5B - независимо).
Рекомбинантный вирус может содержать более чем одну экзогенную последовательность, и каждая экзогенная последовательность может кодировать более чем одну молекулу. Например, он может быть полезным для ассоциации в том же самом рекомбинантном вирусе экзогенной последовательности, кодирующей, например, ТАА (как описано ранее) или антиген (как описано ранее) с экзогенной последовательностью, кодирующей цитокин (например, интерлейкин (IL, как, например, IL2); фактор некроза опухоли (TNF); интерферон (IFN); колониестимулирующий фактор (CSF)).
В данном отношении предпочтительными рекомбинантными вирусами, используемыми согласно настоящему изобретению, являются следующие:
- MVA-[MUC1-IL2], который представляет собой MVA, экспрессирующий антиген MUC-1 и IL-2 (см. WO 92/07000 и WO 95/09241), также именуемый TG4010; и
- MVA-[HPV-IL2], который представляет собой MVA, экспрессирующий неонкогенные антигены Е6 и Е7 HPV-16 и IL-2 (см. WO 90/10459, WO 95/09241, WO 98/04705, WO 99/03885 и WO 07/121894), также именуемый TG4001.
Согласно предпочтительному воплощению материал на основе вируса по настоящему изобретению представляет собой продукт на основе вируса оспы, более конкретно продукт на основе VV, такой как так называемые JX-594/TG6006 и TG6002, или продукт на основе MVA, такой как так называемые TG4040, TG4010 и TG4001.
Вирус оспы, содержащийся в композиции согласно настоящему изобретению, может представлять собой встречающийся в природе вирус оспы, ослабленный вирус оспы или рекомбинантный вирус оспы.
Способы получения и очистки материала на основе вируса, особенно вирусных векторов и/или вирусов, используемых согласно настоящему изобретению, известны специалисту в данной области. Более конкретно, касаясь вирусов оспы, доступные способы получения включают репликацию вируса в линии клеток (например, в HelaS3 или в линии клеток утки), в оплодотворенных яйцах или фибробластах эмбриона курицы (CEF). Клетки CEF особенно приспособлены к продукции продукта на основе MVA. Их можно культивировать при условиях, известных специалисту в данной области. Согласно WO 07/147528 вирус, продуцированный из CEF или супернатанта линий клеток, можно очищать посредством глубинной фильтрации, микрофильтрации и диафильтрации.
В WO 2010/130753 описан способ получения вируса оспы с использованием нуклеаз и дополнительной очистки вируса с использованием анионообменного адсорбента.
Тем не менее, результаты, наблюдаемые с композицией по изобретению, получают независимо от того, является ли вирус в композиции неочищенным, очищенным или частично очищенным вирусом. Очищенные или частично очищенные вирусы являются предпочтительными. Термин «очищенный» в том виде, в котором он используется в данной заявке, относится к уменьшению содержания белка по меньшей мере на 90% по сравнению с содержанием белка неочищенного вирусного препарата, тогда как термин «частично очищенный» означает значимое уменьшение (например, по меньшей мере на 20%) по сравнению с содержанием белка неочищенного вирусного препарата.
Согласно одному воплощению настоящего изобретения указанная композиция содержит по меньшей мере один материал на основе вируса, который представляет собой вирус, и титр вируса в указанной композиции составляет от 1⋅106 Pfu(бляшкообразующая единица)/мл до 1⋅1010 Pfu/мл, более предпочтительно от 1⋅107 Pfu/мл до 1⋅109 Pfu/мл, более предпочтительно от 1⋅107 Pfu/мл до 5⋅108 Pfu/мл и более предпочтительно от 1⋅108 Pfu/мл до 5⋅108 Pfu/мл.
Композиция по изобретению, кроме того, содержит (ii) по меньшей мере один полимер, выбранный в группе поливинилпирролидона и его производных, и их смесь.
Термин «поливинилпирролидон» в том виде, как он используется в данной заявке, относится к водорастворимому полимеру, составленному из мономера N-винилпирролидона. Термины и сокращения PVP, повидон, пласдон, повидон, кросповидон, коллидон используются синонимично.
Подразумевается, что термин «производные PVP» и его вариации в том виде, как он используется в данной заявке, означает вещества, содержащие поливинилпирролидон (PVP) и его замещенные версии, включая соповидон (например, пласдон S-630 и коллидон VA-64; и поперечносвязанный PVP (например, кросповидон, также именуемый поливинилполипирролидон или PVPP), но не ограничиваясь ими.
Согласно настоящему изобретению PVP и его производные имеют молекулярную массу в интервале от 5 кДа до 400 кДа, более предпочтительно - в интервале от 5 кДа до 70 кДа. Согласно преимущественному воплощению PVP и его производные имеют низкую молекулярную массу, т.е. молекулярную массу не больше, чем 55 кДа, предпочтительно составляющую от 10 кДа до 40 кДа, предпочтительно от 15 «Да до 30 кДа, и которая более предпочтительно составляет 25 кДа. PVP полимер с низкой молекулярной массой был бы менее иммуногенным, чем с высокой молекулярной массой, и лучше бы переносился во время инъекции.
Согласно предпочтительному воплощению композиция по изобретению содержит от 5 г/л до 80 г/л PVP или производных, или их смесь, предпочтительно от 10 г/л до 50 г/л, более предпочтительно от 15 г/л до 40 г/л и более предпочтительно от 20 г/л до 35 г/л PVP или его производных, как определено выше. Согласно одному конкретному воплощению композиция по изобретению содержит 33,25 г/л PVP, и более конкретно PVP, имеющего одну молекулярную массу - 25 кДа.
Композиция по изобретению, кроме того, содержит (iii) по меньшей мере один сахар.
Указанный сахар более предпочтительно выбран среди моносахарида, дисахарида, трисахарида и тетрасахарида, и его производных.
Согласно настоящему изобретению предпочтительно выбраны такие моносахариды, как глюкоза, галактоза и манноза.
Дисахариды согласно настоящему изобретению предпочтительно выбраны среди сахарозы, лактулозы, лактозы, мальтозы, трегалозы, целлобиозы, изомальтозы и мальтулозы.
Согласно настоящему изобретению предпочтительно выбран такой трисахарид, как раффиноза.
Согласно настоящему изобретению также рассматривается такой тетрасахарид, как стахиоза.
Согласно предпочтительному воплощению композиция по настоящему изобретению содержит по меньшей мере один дисахарид. Согласно даже более предпочтительному воплощению указанный дисахарид выбран из группы, состоящей из сахарозы, лактулозы, лактозы, мальтозы, трегалозы, целлобиозы, изомальтозы и мальтулозы, и предпочтительно представляет собой сахарозу.
Согласно предпочтительному воплощению композиция по данному изобретению содержит от 10 г/л до 100 г/л сахара, предпочтительно от 20 г/л до 80 г/л, более предпочтительно от 30 г/л до 70 г/л, и даже более предпочтительно от 40 г/л до 60 г/л. Согласно более предпочтительному воплощению настоящего изобретения указанная композиция содержит 50 г/л сахара, преимущественно 50 г/л сахарозы.
Согласно предпочтительному воплощению композиция по настоящему изобретению имеет отношение массы сахара к PVP (caxap/PVP (масс/масс), составляющее по меньшей мере 1, более предпочтительно от 1 до 5, более предпочтительно от 1 до 2 и предпочтительно - 1,5.
Композиция по данному изобретению, кроме того, содержит (iv) по меньшей мере две разные аминокислоты.
Более предпочтительно указанные аминокислоты выбраны среди аланина, аргинина, аспарагина, аспартата, цистеина, глутамина, глутамата, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, пирролизина, селеноцистеина, серина, треонина, триптофана, тирозина, валина и их производных, включая оба стереоизомера.
Термин «глутамат» относится к фармацевтически приемлемой солевой форме глутаминовой кислоты, предпочтительно он представляет собой одновалентную соль и более предпочтительно мононатриевую соль глутаминовой кислоты, т.е. мононатрия глутамат (MSG).
Согласно одному предпочтительному воплощению композиция по настоящему изобретению содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из L-стереоизомеров, например, L-аргинина.
Согласно одному предпочтительному воплощению композиция по настоящему изобретению содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из аргинина, гистидина и лизина.
Согласно другому предпочтительному воплощению композиция по настоящему изобретению содержит по меньшей мере одну аминокислоту, выбранную в группе, состоящей из аспартата и глутамата.
Согласно предпочтительному воплощению композиция по настоящему изобретению содержит аргинин и глутамат.
Согласно предпочтительному воплощению композиция по данному изобретению содержит общее количество аминокислоты, составляющее от 10 г/л до 200 г/л, более предпочтительно от 10 г/л до 150 г/л и более предпочтительно от 10 г/л до 100 г/л.
Согласно другому предпочтительному воплощению композиция по настоящему изобретению содержит от 5 г/л до 100 г/л и более предпочтительно от 5 г/л до 80 г/л аргинина. Концентрация аргинина от 5 г/л до 20 г/л больше подходит для композиции вируса с высоким вирусным титром (например, примерно 1⋅108 PFU/мл или более), и более высокая концентрация аргинина - для композиции вируса с меньшим вирусным титром (например, меньше чем 1⋅108 PFU/мл).
Согласно более предпочтительному воплощению композиция по настоящему изобретению содержит от 1 г/л до 50 г/л, более предпочтительно от 1 г/л до 20 г/л, более предпочтительно от 1 г/л до 10 г/л и более предпочтительно от 1 г/л до 5 г/л глутамата. Согласно более предпочтительному воплощению настоящего изобретения указанная композиция содержит 2,49 г/л глутамата.
Согласно одному конкретному воплощению настоящего изобретения указанная композиция содержит 2,49 г/л глутамата и 8,43 г/л аргинина.
Согласно более предпочтительному воплощению настоящего изобретения указанная композиция содержит 2,49 г/л глутамата и 42,13 г/л аргинина.
Согласно более предпочтительному воплощению настоящего изобретения указанная композиция содержит 2,49 г/л глутамата и 56,04 г/л аргинина.
Композиция по данному изобретению, кроме того, содержит (v) по меньшей мере две фармацевтически приемлемые соли, где по меньшей мере одна из указанных солей представляет собой фосфатную соль.
Известно, что фосфаты вызывают сдвиги рН, и их применение в композиции считалось проблематичным (см., например, Freeze Drying of Pharmaceuticals & Biologicals Conference, August 6 - 9, 2008, Great Divide Lodge Breckenridge, Colorado). Аналогично в EP1418942 показано, что присутствие фосфата в композиции, содержащей материал на основе вируса, особенно вируса оспы, индуцирует агрегацию и осаждение вируса, особенно на протяжении процесса сушки. Неожиданно авторы настоящего изобретения показали, что в контексте настоящего изобретения фосфатный буфер участвует в стабилизации свойств заявленной композиции.
Согласно одному воплощению по меньшей мере одна из фармацевтически приемлемых солей по изобретению выбрана в группе, состоящей из натриевых и калиевых солей и их комбинаций.
Согласно предпочтительному воплощению по меньшей мере одна из фармацевтически приемлемых солей данной композиции представляет собой фосфатную соль и выбрана в группе, состоящей из одноосновных фосфатных солей, двухосновных фосфатных солей и трехосновных фосфатных солей.
Согласно одному воплощению по меньшей мере одна из фармацевтически приемлемых солей данной композиции представляет собой фосфатную соль и выбрана в группе, состоящей из мононатрия фосфата (NaH2PO4) и монокалия фосфата (KH2PO4).
Согласно другому воплощению по меньшей мере одна из фармацевтически приемлемых солей данной композиции представляет собой фосфатную соль и выбрана в группе, состоящей из динатрия фосфата (Na2HPO4) и дикалия фосфата (K2HPO4).
Согласно другому воплощению по меньшей мере одна из фармацевтически приемлемых солей данной композиции представляет собой фосфатную соль и выбрана в группе, состоящей из трикалия фосфата (K3PO4) и тринатрия фосфата (Na3PO4).
Согласно одному предпочтительному воплощению настоящего изобретения по меньшей мере одна из фармацевтически приемлемых солей данной композиции представляет собой динатрия фосфат Na2HPO4.
Согласно другому воплощению композиция согласно настоящему изобретению содержит (v) по меньшей мере две фосфатные соли, которые образуют фосфатный буфер. Указанный фосфатный буфер более предпочтительно предствляет собой смесь, содержащую по меньшей мере одну моноосновную фосфатную соль и по меньшей мере одну двухосновную фосфатную соль. Указанный фосфатный буфер более предпочтительно представляет собой смесь, содержащую монокалия фосфат (KH2PO4) и динатрия фосфат (Na2HPO4). Таким образом, согласно одному предпочтительному воплощению композиция по настоящему изобретению содержит (v) монокалия фосфат (KH2PO4) и динатрия фосфат (Na2HPO4).
Согласно одному конкретному воплощению композиция по настоящему изобретению содержит (v) монокалия фосфат (KH2PO4) и динатрия фосфат (Na2HPO4) в соотношении примерно 1:5 соответственно.
Согласно другому предпочтительному воплощению композиция по данному изобретению содержит по меньшей мере 0,1 г/л, более предпочтительно от 0,1 г/л до 10 г/л и даже более предпочтительно от 0,1 г/л до 5 г/л фосфатной соли.
Согласно одному конкретному воплощению настоящего изобретения указанная композиция содержит по меньшей мере 0,1 г/л, предпочтительно 0,19 г/л фосфатной соли.
Согласно другому предпочтительному воплощению композиция по данному изобретению содержит по меньшей мере 0,1 г/л Na2HPO4 и предпочтительно от 0,1 г/л до 5 г/л Na2HPO4.
Согласно одному конкретному воплощению настоящего изобретения указанная композиция содержит 0,19 г/л фосфатной соли и даже более конкретно 0,19 г/л Na2HPO4.
Согласно другому предпочтительному воплощению композиция по данному изобретению содержит по меньшей мере 0,1 г/л KH2PO4, предпочтительно от 0,1 г/л до 5 г/л KH2PO4, даже предпочтительно от 0,1 г/л до 1 г/л KH2PO4 и более предпочтительно от 0,1 г/л до 0,6 г/л KH2PO4.
Согласно другому конкретному воплощению настоящего изобретения указанная композиция содержит 0,94 г/л фосфатной соли и даже более конкретно 0,79 г/л Na2HPO4 и 0,15 г/л KH2PO4.
Согласно другому конкретному воплощению настоящего изобретения указанная композиция содержит 1,88 г/л фосфатной соли и даже более конкретно 1,59 г/л Na2HPO4 и 0,29 г/л KH2PO4:
Согласно другому конкретному воплощению настоящего изобретения указанная композиция содержит 3,75 г/л фосфатной соли и даже более конкретно 3,17 г/л Na2HPO4 и 0,58 г/л KH2PO4.
В контексте данного изобретения предпочтительно, что указанная композиция содержит по меньшей мере 1 г/л фосфатного буфера (например, по меньшей мере 1,2; 1,5; 1,6; 1,7 или 1,8 г/л). Предпочтительная композиция содержит и фосфатный буфер, как определено выше (например, 1,59 г/л Na2HPO4 и 0,29 г/л KH2PO4 или 3,17 г/л Na2HPO4 и 0,58 г/л KH2PO4) и аргинин, как определено выше (например, примерно 8,43 г/л или более).
Согласно другому конкретному воплощению композиция по изобретению содержит (v) по меньшей мере одну дополнительную фармацевтически приемлемую соль, которая не является фосфатной солью.
Согласно одному воплощению указанная дополнительная фармацевтически приемлемая соль представляет собой одновалентную соль. Согласно одному предпочтительному воплощению указанная дополнительная фармацевтически приемлемая соль выбрана из группы, состоящей из NaCl и KCl, и предпочтительно представляет собой NaCl.
Согласно одному воплощению композиция по изобретению содержит от 1 г/л до 10 г/л, предпочтительно не больше, чем 5 г/л и более предпочтительно от 1 г/л до 5 г/л указанной дополнительной фармацевтически приемлемой соли.
Согласно одному конкретному воплощению настоящего изобретения указанная композиция содержит 3,89 г/л NaCl.
Согласно одному конкретному воплощению настоящего изобретения указанная композиция содержит 1,94 г/л NaCl.
Композиция по изобретению, кроме того, может содержать (vi) фармацевтически приемлемый буфер.
Согласно одному воплощению композиция по изобретению, кроме того, содержит фармацевтически приемлемый буфер.
Согласно одному воплощению рН композиции согласно настоящему изобретению составляет от примерно 7 до примерно 8,5, предпочтительно составляет 7,5 плюс/минус 0,5 и более предпочтительно составляет 7,5. рН можно корректировать соответствующими количествами фосфатных солей, более предпочтительно KH2PO4 и Na2HPO4, согласно способам, хорошо известным специалисту в данной области, таким как способы, описанные в Sorensen in Hayat, 1986.
Указанный фармацевтически приемлемый буфер может быть выбран в группе, состоящей из TRIS (трис(гидроксиметил)аминометан), BES (N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновая кислота), TES (N-[трис(гидроксиметил)метил]-2-аминоэтансульфоновая кислота), DIPSO (3-(N,N-бис[2-гидроксиэтил]амино)-2-гидроксипропансульфоновая кислота), MOBS (4-(N-морфолино)бутансульфоновая кислота), TAPSO (2-гидрокси-3-[трис(гидроксиметил)метиламино]-1-пропансульфоновая кислота), HEPPSO (2-гидрокси-3-[4-(2-гидроксиэтил)-1-пиперазинил]пропансульфоновая кислота), POPSO (пиперазин-N,N'-бис(2-гидроксипропансульфоновая кислота)), MOPS (3-(N-морфолино)пропансульфоновая кислота), HEPES (4-(2-гидроксиэтил)пиперазин-1-этансульфоновая кислота) и бикарбонатов. Согласно предпочтительному воплощению указанный буфер представляет собой TRIS или HEPES, и даже более предпочтительно - TRIS.
Согласно одному предпочтительному воплощению композиция по изобретению содержит от примерно 1 мМ до примерно 100 мМ и более предпочтительно от примерно 1 мМ до примерно 50 мМ указанного фармацевтически приемлемого буфера.
Согласно одному конкретному воплощению настоящего изобретения указанная композиция содержит примерно 10 мМ TRIS, более конкретно 1,61 г/л TRIS.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) по меньшей мере один материал на основе вируса, (ii) по меньшей мере один полимер, выбранный в группе поливинилпирролидона и его производных, (iv) по меньшей мере две разные аминокислоты, (v) по меньшей мере две фармацевтически приемлемые соли, где по меньшей мере одна из указанных солей представляет собой фосфатную соль, и где указанная фосфатная соль представляет собой соль динатрия фосфатную соль, и возможно (vi) фармацевтически приемлемый буфер, который более предпочтительно выбран среди TRIS или HEPES.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) по меньшей мере один материал на основе вируса, (ii) по меньшей мере один полимер, выбранный в группе поливинилпирролидона и его производных, (iv) по меньшей мере две разные аминокислоты, (v) смесь соли динатрия фосфата и соли монокалия фосфата и возможно (vi) фармацевтически приемлемый буфер, который более предпочтительно выбран среди TRIS или HEPES.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) по меньшей мере один материал на основе вируса, (ii) по меньшей мере один полимер, выбранный в группе поливинилпирролидона и его производных, (iv) по меньшей мере две разные аминокислоты, (v) смесь соли динатрия фосфата, соли монокалия фосфата и NaCl, и возможно (vi) фармацевтически приемлемый буфер, который более предпочтительно выбран среди TRIS или HEPES.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) по меньшей мере две фармацевтически приемлемые соли, где по меньшей мере одна из указанных солей представляет собой фосфатную соль, и возможно (vi) фармацевтически приемлемый буфер.
Согласно другому преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) смесь по меньшей мере одной одновалентной фосфатной соли и/или по меньшей мере одной двухвалентной фосфатной соли, и возможно (vi) фармацевтически приемлемый буфер.
Согласно другому преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) смесь соли динатрия фосфата и соли монокалия фосфата и возможно (vi) фармацевтически приемлемый буфер.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) по меньшей мере одну фосфатную соль и по меньшей мере одну одновалентную соль, предпочтительно NaCl, и возможно (vi) фармацевтически приемлемый буфер.
Согласно другому преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) по меньшей мере одну одновалентную фосфатную соль и/или по меньшей мере одну двухвалентную фосфатную соль, и по меньшей мере одну одновалентную соль, предпочтительно NaCl, и возможно (vi) фармацевтически приемлемый буфер.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) соль динатрия фосфат и по меньшей мере одну одновалентную соль, предпочтительно NaCl, и возможно (vi) фармацевтически приемлемый буфер.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) соль динатрия фосфат и монокалия фосфат и по меньшей мере одну одновалентную соль, предпочтительно NaCl, и возможно (vi) фармацевтически приемлемый буфер.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) по меньшей мере две фармацевтически приемлемые соли, где по меньшей мере одна из указанных солей представляет собой фосфатную соль, и возможно (vi) фармацевтически приемлемый буфер.
Согласно другому преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) смесь по меньшей мере одной одновалентной фосфатной соли и/или по меньшей мере одной двухвалентной фосфатной соли, и возможно (vi) фармацевтически приемлемый буфер.
Согласно другому преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) смесь соли динатрия фосфата и соли монокалия фосфата и возможно (vi) фармацевтически приемлемый буфер.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) по меньшей мере одну фосфатную соль и одну одновалентную соль, предпочтительно NaCl, и возможно (vi) фармацевтически приемлемый буфер.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) соль динатрия фосфат и по меньшей мере одну одновалентную соль, предпочтительно NaCl, и возможно (vi) фармацевтически приемлемый буфер.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) смесь соли динатрия фосфата и монокалия фосфата, и по меньшей мере одной одновалентной соли, предпочтительно NaCl, и возможно (vi) фармацевтически приемлемый буфер.
Согласно другому преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) смесь соли динатрия фосфата и соли монокалия фосфата и (vi) фармацевтически приемлемый буфер, выбранный в группе TRIS, BES, TES, DIPSO, MOBS, TAPSO, HEPPSO, POPSO, MOPS, HEPES и бикарбонатов, предпочтительно буфер TRIS.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) по меньшей мере одну фосфатную соль и одну одновалентную соль и (vi) фармацевтически приемлемый буфер, выбранный в группе TRIS, BES, TES, DIPSO, MOBS, TAPSO, HEPPSO, POPSO, MOPS, HEPES и бикарбонатов, предпочтительно буфер TRIS.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) соль динатрия фосфат и по меньшей мере одну одновалентную соль, предпочтительно NaCl, и (vi) фармацевтически приемлемый буфер, выбранный в группе TRIS, BES, TES, DIPSO, MOBS, TAPSO, HEPPSO, POPSO, MOPS, HEPES и бикарбонатов, предпочтительно буфер TRIS.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) смесь соли динатрия фосфата и монокалия фосфата и по меньшей мере одной одновалентной соли, предпочтительно NaCl, и (vi) фармацевтически приемлемый буфер, выбранный в группе TRIS, BES, TES, DIPSO, MOBS, TAPSO, HEPPSO, POPSO, MOPS, HEPES и бикарбонатов, предпочтительно буфер TRIS.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) смесь соли динатрия фосфата, монокалия фосфата и NaCl, и (vi) фармацевтически приемлемый буфер, выбранный в группе TRIS, BES, TES, DIPSO, MOBS, TAPSO, HEPPSO, POPSO, MOPS, HEPES и бикарбонатов, предпочтительно буфер TRIS.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) по меньшей мере две фармацевтически приемлемые соли, где по меньшей мере одна из указанных солей представляет собой фосфатную соль, и (vi) фармацевтически приемлемый буфер, выбранный в группе TRIS, BES, TES, DIPSO, MOBS, TAPSO, HEPPSO, POPSO, MOPS, HEPES и бикарбонатов, предпочтительно буфер TRIS.
Согласно другому преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) смесь по меньшей мере одной одновалентной фосфатной соли и/или по меньшей мере одной двухвалентной фосфатной соли и (vi) фармацевтически приемлемый буфер, выбранный в группе TRIS, BES, TES, DIPSO, MOBS, TAPSO, HEPPSO, POPSO, MOPS, HEPES и бикарбонатов, предпочтительно буфер TRIS.
Согласно другому преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) смесь соли динатрия фосфата и соли монокалия фосфата, и (vi) фармацевтически приемлемый буфер, выбранный в группе TRIS, BES, TES, DIPSO, MOBS, TAPSO, HEPPSO, POPSO, MOPS, HEPES и бикарбонатов, предпочтительно буфер TRIS.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) по меньшей мере одну фосфатную соль и одну одновалентную соль, предпочтительно NaCl, и (vi) фармацевтически приемлемый буфер, выбранный в группе TRIS, BES, TES, DIPSO, MOBS, TAPSO, HEPPSO, POPSO, MOPS, HEPES и бикарбонатов, предпочтительно буфер TRIS.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) соль динатрия фосфат и по меньшей мере одну одновалентную соль, предпочтительно NaCl, и (vi) фармацевтически приемлемый буфер, выбранный в группе TRIS, BES, TES, DIPSO, MOBS, TAPSO, HEPPSO, POPSO, MOPS, HEPES и бикарбонатов, предпочтительно буфер TRIS.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) смесь соли динатрия фосфата и монокалия фосфата и по меньшей мере одной одновалентной соли, предпочтительно NaCl, и (vi) фармацевтически приемлемый буфер, выбранный в группе TRIS, BES, TES, DIPSO, MOBS, TAPSO, HEPPSO, POPSO, MOPS, HEPES и бикарбонатов, предпочтительно буфер TRIS.
Согласно преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) смесь соли динатрия фосфата, монокалия фосфата и NaCl, и (vi) фармацевтически приемлемый буфер, выбранный в группе TRIS, BES, TES, DIPSO, MOBS, TAPSO, HEPPSO, POPSO, MOPS, HEPES и бикарбонатов, предпочтительно буфер TRIS.
Согласно другому преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) от примерно 0,1 г/л до примерно 1 г/л соли динатрия фосфата и от примерно 1 г/л до примерно 10 г/л, предпочтительно от примерно 1 г/л до примерно 5 г/л одновалентной соли, предпочтительно NaCl.
Согласно другому преимущественному воплощению настоящее изобретение относится к композиции, содержащей (i) вирус оспы, выбранный в группе, состоящей из MVA и VV, (ii) PVP, (iii) сахарозу, (iv) аргинин и глутамат, (v) от примерно 0,1 г/л до примерно 1 г/л соли динатрия фосфата и от примерно 1 г/л до примерно 10 г/л, предпочтительно от примерно 1 г/л до примерно 5 г/л одновалентной соли, предпочтительно NaCl, и (vi) от примерно 1 г/л до примерно 10 г/л и более предпочтительно от примерно 1 г/л до примерно 5 г/л буфера TRIS.
Типичная композиция, содержащая вирус, подходящая для сублимационной сушки, содержит (ii) 33,25 г/л 25 кДа PVP, (iii) 50 г/л сахарозы, (iv) 2,49 г/л глутамата и 8,43 г/л аргинина, (v) 0,79 г/л Na2HPO4 и 0,15 г/л KH2PO4.
Согласно другому конкретному воплощению настоящего изобретения указанная композиция содержит 1,88 г/л фосфатной соли и даже более конкретно 1,59 г/л Na2HPO4 и 0,29 г/л KH2PO4.
Согласно другому конкретному воплощению настоящего изобретения указанная композиция содержит 3,75 г/л фосфатной соли и даже более конкретно 3,17 г/л Na2HPO4 и 0,58 г/л KH2PO4.
Согласно другому конкретному воплощению настоящего изобретения указанная композиция содержит 3,89 г/л NaCl.
Согласно одному конкретному воплощению настоящего изобретения указанная композиция содержит 1,94 г/л NaCl.
Согласно другому конкретному воплощению настоящего изобретения указанная композиция содержит 3,89 г/л NaCl и 1,61 мМ TRIS.
Согласно одному конкретному воплощению настоящего изобретения указанная композиция содержит 1,94 г/л NaCl и 1,61 г/л TRIS.
СУХОЙ ПРОДУКТ
Настоящее изобретение, кроме того, касается стабильной вакцины, содержащей материал на основе вируса, которая содержит композицию, как раскрыто выше, в высушенной, предпочтительно в лиофилизированной форме.
Термин «сухой» обозначает препарат, композицию, продукт, вакцину и тому подобное, который демонстрирует остаточное содержание влаги меньше, чем 3% по массе продукта, предпочтительно меньше, чем 2% и более предпочтительно 1% или менее. Согласно конкретному воплощению высушенный материал (включающий сухой препарат, сухую композицию, сухой продукт, сухую вакцину, сухую вакцину, содержащую материал на основе вируса) является твердым, находящимся либо в кристаллической, либо в аморфной форме, и при примерно 5°С, и при комнатной температуре, и до примерно до 45°С.
Согласно одному конкретному воплощению указанное остаточное содержание влаги определяется способом Карла Фишера.
Согласно настоящему изобретению «сухой материал» (включая сухой препарат, сухую композицию, сухой продукт, сухую вакцину, сухую вакцину, содержащую материал на основе вируса) имеет такое остаточное содержание влаги, которое определено выше.
Согласно одному воплощению указанное сухое вещество можно получать сублимационной сушкой композиции, предпочтительно водной композиции, как раскрыто выше. Таким образом, согласно предпочтительному воплощению сухой материал (в частности сухая композиция или сухая вакцина, содержащая материал на основе вируса) относится к «высушенному сублимацией» или «лиофилизированному» материалу (в частности к «высушенной сублимацией» или «лиофилизированной» композиции, или к «высушенной сублимацией» или «лиофилизированной» вакцине, содержащей материал на основе вируса по настоящему изобретению).
Термины «высушенный сублимацией» и «лиофилизированный» являются эквивалентными, а также термины «лиофилизация» и «сублимационная сушка».
Согласно предпочтительному воплощению потеря титра вируса после лиофилизации, т.е. потеря, обусловленная процессом сублимационной сушки, составляет не более чем 0,3 log, предпочтительно не более чем 0,2 log и более предпочтительно не более чем 0,1 log.
Кроме того, указанный «сухой материал» преимущественно является стабильным (см. ниже), т.е. его совокупная потеря титра вируса является ограниченной.
Кроме того, следует отметить, что, в то время как в литературе известно, что фосфатные соли, такие как динатрия гидрофосфат додекагидрат (Na2HPO4, [12H2O]), выпадают в осадок при низких температурах, посредством этого, возможно, существенно снижая рН продукта (Croyle et al., « Factors that influence stability of recombinant adenoviral preparations for human gene therapy, Pharmaceutical development and technology», 3(3), 373-383, 1998), рН композиции согласно настоящему изобретению неожиданно поддерживался во время замораживания при всех температурах.
Кроме того, желательно, чтобы «сухой материал» согласно настоящему изобретению имел низкое остаточное содержание влаги (RM), так как оно, как известно специалисту в данной области, является индикатором стабильности, поскольку воздействие влаги во время хранения может дестабилизировать продукт, обеспечивая, таким образом, меньший срок хранения. RM представляет собой количество связанной воды, которое остается в лиофилизированном продукте. Для того чтобы определять содержание воды посредством объемного титрования можно использовать хорошо известную колориметрическую методику Карла Фишера для тестрования остаточной влаги (Jennings, Т.А., "Lyophilization, Introduction and Basic Principles", Interpharm Press, Denver, CO, US, 1999, ISBN 1-57491-081-7, страницы 415-418). Его измеряют как процентную долю по массе остающейся воды по сравнению с общей массой высушенного продукта. Европейская фармакопея (V издание) рекомендует RM меньше 3% от массы продукта.
Более конкретно, в «сухом материале» согласно настоящему изобретению RM составляет меньше, чем 3% от массы продукта, более предпочтительно меньше, чем 2% и более предпочтительно 1% от массы продукта или меньше.
Также ожидается, что «сухой материал» согласно настоящему изобретению имеет подходящий внешний вид. Действительно, подходящие сухие композиции дают гладкий белый слой или «кек», который не отваливается с боковых стенок сосуда после лиофилизации. Менее подходящий «сухой материал» выглядит «расплавленным», «вскипевшим» или неправильно сформированным иным образом, и отваливается с боковых стенок сосуда после хранения.
«Сухой материал» можно получать в форме сухого порошка. Кек, образующийся в результате, например, сублимационной сушки, можно размалывать в порошковую форму. Твердый «сухой материал» согласно данному изобретению может, таким образом, принимать форму свободно сыпучих частиц. Твердая композиция типично предложена в виде порошка в запечатанном сосуде, ампуле или шприце. В качестве альтернативы, может быть предложена твердая матрица в виде пластыря. Порошок можно прессовать в форму таблетки.
Способ сублимационной сушки
Как упоминалось выше, композиция, предпочтительно водная композиция по изобретению, подходит для сушки, предпочтительно сублимационной сушки. Предпочтительно материал на основе вируса, содержащийся в композиции, подвергающейся лиофилизации, очищают или по меньшей мере частично очищают, как определено выше.
Согласно одному конкретному воплощению настоящее изобретение относится к способу получения «сухого материала», где указанный способ включает стадию сублимационной сушки водной композиции, содержащей (i) по меньшей мере один материал на основе вируса, (ii) по меньшей мере один полимер, выбранный в группе поливинилпирролидона и его производных, (iii) по меньшей мере один сахар, (iv) по меньшей мере две разные аминокислоты, (v) по меньшей мере две фармацевтически приемлемые соли, где по меньшей мере одна из указанных солей представляет собой фосфатную соль и, возможно, (vi) фармацевтически приемлемый буфер.
Способы сублимационной сушки обычно известны специалисту в данной области (Day, J. and McLellan, M., Methods in Molecular Biology, Humana Press, (1995) vol. 38).
Обычно имеется три главные стадии способа сублимационной сушки, а именно: замораживание, первичная сушка и вторичная сушка. Замораживание типично проводят с использованием установки для сублимационной сушки. Во время данной стадии важно охладить биологический материал до температуры ниже эвтектической точки (Teu) в случае простых кристаллических продуктов или температуры стеклования (Tg') в случае аморфных продуктов, т.е. ниже наименьшей температуры, при которой могут сосуществовать твердая и жидкая фазы вещества. Это обеспечивает то, что на следующей стадии первичной сушки будет происходить сублимация, а не плавление.
Во время первичной сушки контролируется давление путем приложения подходящих уровней вакуума при подаче достаточного количества тепла для обеспечения сублимации воды. На этой стадии сублимируется по меньшей мере 50%, типично 60-70% воды в материале. Первичная сушка может быть медленной, поскольку слишком большое количество тепла могло бы деградировать или изменять структуру биологического материала. Холодная камера конденсатора и/или обкладки конденсатора обеспечивают поверхности, на которых захватывается водный пар посредством повторного отверждения.
В процессе вторичной сушки удаляется гидратационная вода посредством дополнительного приложения тепла. Типично также снижают давление для того, чтобы способствовать дальнейшей сушке. После завершения процесса сублимационной сушки вакуум может быть либо устранен инертным газом, таким как азот, перед запечатыванием, либо вещество может быть запечатано под вакуумом.
В контексте настоящего изобретения неожиданно обнаружили, что для стадии вторичной сушки могли бы применяться высокие температуры, т.е. вплоть до 50°С, для того, чтобы ускорять процесс сублимационной сушки без повреждения вируса.
Таким образом, настоящее изобретение более предпочтительно относится к способу сублимационной сушки, заключающемуся в сушке жидкой композиции согласно настоящему изобретению, и в котором стадию вторичной сушки проводят при температуре, изменяющейся вплоть до 50°С плюс/минус 5°С, более предпочтительно от 30°С до 45°С, и она предпочтительно проводится при 40°С плюс/минус 5°С.
Кроме того, следует отметить, что мог бы быть получен сухой продукт с теми же самыми параметрами титра в уменьшенном объеме, например, до одной трети от номинального объема, таким образом, обеспечивая увеличение концентрации одной трети и дополнительно уменьшая продолжительность цикла лиофилизации по сравнению с тем, что обычно известно в данной области для вирусов, таких как вирусы оспы.
РАСТВОРЕННЫЙ МАТЕРИАЛ
Настоящее изобретение, кроме того, касается растворенного материала. «Растворенный материал» (включающий растворенный препарат, растворенную композицию, растворенный продукт, растворенную вакцину, растворенную вакцину, содержащую материал на основе вируса) соответствует «сухому материалу» (включающему сухой препарат, сухую композицию, сухой продукт, сухую вакцину, сухую вакцину, содержащую материал на основе вируса), который был растворен путем добавления подходящего количества фармацевтически приемлемого растворителя. Согласно конкретному воплощению фармацевтически приемлемый растворитель выбран в группе, состоящей из воды для инъекции (WFI), физиологической сыворотки или физиологических растворов, таких как раствор NaCl.
При содержании в композиции согласно настоящему изобретению дополнительной соли, более предпочтительно одновалентной соли, такой как NaCl, она, более конкретно, предназначена для корректировки, если это необходимо, осмолярности растворенного материала. Более конкретно, осмолярность растворенного материала согласно настоящему изобретению должна быть совместимой с инъекционным применением, т.е. должна составлять от 280 мОсм/кг до 900 мОсм/кг, более конкретно от 280 мОсм/кг до 600 мОсм/кг и более предпочтительно от 280 мОсм/кг до 350 мОсм/кг.
ТИТР ВИРУСА
Одним их главных недостатков способа сушки и, более конкретно, способа сублимационной сушки, является то, что они могут быть нестабильными, приводящими к общей потере титра вируса у вируса, который может возрастать во время хранения.
Одной целью настоящего изобретения было предложение композиции, предпочтительно водной композиции, которая является стабильной. Оно, кроме того, относится к сухой, предпочтительно лиофилизированной композиции, как раскрыто выше, которая является стабильной. Более конкретно, указанная стабильность означает то, что материал или продукт на основе вируса, содержащийся в композиции (включая водную или сухую форму) по изобретению, является биологически активным и сохраняет его биологическую активность (т.е. материал на основе вируса, например, вируса оспы, остается инфекционным) при приготовлении согласно изобретению. Согласно изобретению материал на основе вируса сохраняет его биологическую активность при приготовлении согласно изобретению, если биологическая активность материала на основе вируса в данное время находится в пределах примерно 10% (в пределах ошибок анализа) от биологической активности, демонстрируемой во время получения композиции. В случае вирусов биологическую активность можно считать сохраняющейся, когда вирусный титр композиции находится в пределах одного log от исходного титра. Согласно конкретному воплощению композиция, содержащая материал на основе вируса, по настоящему изобретению, является стабильной, когда общая потеря титра вируса при температуре инкубации+5°С плюс/минус 3°С на протяжении по меньшей мере 60 суток (например, 90 суток или даже более, как, например, на протяжении нескольких месяцев или лет) составляет меньше, чем 0,7 log, предпочтительно меньше, чем 0,5 log, более предпочтительно меньше, чем 0,4 log и даже более предпочтительно меньше, чем 0,3 log.
Фраза «общая потеря титра вируса» согласно настоящему изобретению определяется как совокупная потеря титра вируса, измеренного после стадии сушки и измеренного на протяжении хранения сухой композиции (измерение проводят после растворения материала в воде).
Фраза «потеря титра вируса после стадии сушки» соответствует потере титра вируса между временем получения композиции и моментом после стадии сушки, т.е. она представляет собой потерю титра вируса из-за процесса сушки как такового. В следующих экспериментах она соответствует потере титра вируса, измеренного в сутки 0 относительно суток -1 (см. раздел примеров).
«Потеря титра вируса после стадии сушки» не зависит от температуры и предпочтительно составляет меньше, чем 0,3 log, более предпочтительно меньше, чем 0,2 log.
«Потеря титра вируса во время хранения» указанной сухой композиции соответствует потере титра вируса после стадии сушки и на протяжении определенного периода хранения «n» суток при определенной температуре хранения.
«Потеря титра вируса во время хранения» предпочтительно меньше, чем 0,4 log при +5°С плюс/минус 3°С в течение по меньшей мере 60 суток, более предпочтительно меньше, чем 0,3 log при +5°С плюс/минус 3°С в течение по меньшей мере 60 суток (например, 90 суток или даже более).
В качестве альтернативы, можно сокращать оценку стабильности композиций согласно настоящему изобретению путем проведения ускоренных исследований стабильности при повышенных температурах. В самом деле, такие ускоренные исследования стабильности обеспечивают прогнозирование результатов при меньшей температуре без необходимости ждать данных по стабильности в реальном времени, т.е. обычно 1-3 года при +5°С плюс/минус 3°С (по сравнению с, например, примерно 1 неделей при 37 плюс/минус 5°С и примерно 3-5 сутками при 45 плюс/минус 5°С). Для этой цели в современном уровне техники описаны разные математические модели, и их можно использовать для экстраполяции результатов при меньших температурах. Одной из данных моделей является хорошо известный порядок - многомерная модель, основанная на принципе Аррениуса, которая излагается следующим образом:
где С0 представляет собой исходный титр в PFU/мл, Т представляет собой температуру в градусах Кельвина, t представляет собой время в сутках, С представляет собой титр в соответствующее время t в PFU/мл, и β0, β1 и β2 представляют собой параметры модели (которые могут изменяться, в зависимости от конкретных данных модели).
Обычно ускоренные тесты стабильности проводят на протяжении примерно 1 недели при 37 плюс/минус 5°С (рекомендация Всемирной организации здравоохранения). В настоящем случае такие ускоренные исследования проводили при 45 плюс/минус 5°С в разные периоды времени (см. раздел примеров).
Термин «комнатная температура» (RT) в том виде, как он используется в настоящем описании, соответствует температуре, составляющей от примерно 20°С до примерно 25°С.
Анализом, который используется для определения титра вируса оспы, например, является методика бляшечного анализа (см., например, Kaufmann and Kabelitz, 2002, Methods in Microbiology Vol. 32: Immunology of Infection. Academic Press. ISBN 0125215320). Титр из данного анализа приводится в виде бляшкообразующей единицы на миллилитр (PFU/мл). Подробный протокол для определения титра вируса и, таким образом, общей потери титра вируса приведен в разделе примеров. Однако для определения титра вируса также можно использовать любой альтернативный протокол.
Композицию, содержащую материал на основе вируса или растворенный материал согласно изобретению, можно вводить пациенту или животному, нуждающемуся в этом, более конкретно в виде вакцины для терапевтического или профилактического применения.
Согласно другому воплощению изобретение касается композиции, содержащей материал на основе вируса или растворенный материал, как определено ранее, для применения в качестве вакцины. Ее можно вводить разными путями, которые могут представлять собой, например, внутривенный, внутриопухолевый, внутримышечный, внутрикожный, подкожный или внутрибрюшинный путь. То, как можно правильно вводить такую композицию, в частности водную композицию, содержащую вирусы оспы, находится в пределах квалификации практикующего врача. Введение можно осуществлять в виде одной дозы или повторять один или несколько раз после определенного интервала времени. Подходящий путь введения и дозировка варьируют как функция разных параметров, таких как, например, индивид, заболевание, подлежащее лечению, или интересующий(щие) ген(ны), подлежащий(щие) переносу.
Настоящее изобретение также относится к способу введения композиции, содержащей материал на основе вируса или растворенный материал, как определено ранее, хозяину, нуждающемуся в этом, характеризуемому тем, что сухой продукт растворяют в физиологически приемлемом растворителе, предпочтительно выбранном среди воды PPI, WFI, физиологической сыворотки или физиологического раствора, такого как раствор NaCl, и затем вводят указанному хозяину, нуждающемуся в этом.
Настоящее изобретение также относится к композиции, содержащей материал на основе вируса или растворенный материал, как определено ранее, для лечения и/или предупреждения заболеваний и, более предпочтительно, болезненных состояний, выбранных среди раковых заболеваний, инфекционных заболеваний и/или аутоиммунных расстройств.
Термин «рак» в том виде, как он используется в данной заявке, относится к следующим: рак легкого (например, мелкоклеточные карциномы легкого и немелкоклеточный рак легкого), рак бронха, рак пищевода, рак глотки, рак головы и шеи (например, рак гортани, рак губы, рак полости носа и околоносовой пазухи и рак горла), рак полости рта (например, рак языка), желудочный рак (например, рак желудка), рак кишки, желудочно-кишечный рак, рак толстой кишки, рак прямой кишки, колоректальный рак, рак ануса, рак печени, рак поджелудочной железы, рак мочевых путей, рак мочевого пузыря, рак щитовидной железы, рак почки, карцинома, аденокарцинома, гепатокарцинома, печеночно-клеточная карцинома (НСС) или метастатический колоректальный рак (mCRC), рак кожи (например, меланома), рак глаза (например, ретинобластома), рак мозга (например, глиома, медуллобластома и астроцитома мозга), рак центральной нервной системы, лимфома (например, В-клеточная лимфома кожи, лимфома Беркитта, синдром Ходжкина и неходжкинская лимфома), рак кости, лейкоз, рак молочной железы, рак половых путей, рак шейки матки (например, внутриэпителиальная неоплазия шейки матки), рак матки (например, рак эндометрия), рак яичника, рак вагины, рак вульвы, рак простаты, рак яичка, но не ограничивается ими. Термин «раковые заболевания» также относится к опухолям, индуцированным вирусом, включающим следующие: карцинома, индуцированная вирусом папилломы, опухоли, индуцированные вирусом герпеса, В-клеточная лимфома, индуцированная EBV (вирус Эпштейна-Барр), опухоли, индуцированные вирусом гепатита В, лимфома, индуцированная HTLV-1 (человеческий лимфотропный Т-клеточный вирус-1) и лимфома, индуцированная HTLV-2, но не ограничивающимся ими.
В случае раковых заболеваний такое введение композиции согласно настоящему изобретению может быть, кроме того, ассоциировано с химиотерапией первой линии.
Термин «инфекционное заболевание» в том виде, как он используется в данной заявке, относится к любому заболеванию, которое вызвано инфекционным организмом. Инфекционные организмы включают вирусы (например, одноцепочечные РНК-вирусы, одноцепочечные ДНК-вирусы, вирус иммунодефицита человека (ВИЧ), вирус гепатита А, В и С, вирус простого герпеса (HSV), цитомегаловирус (CMV), респираторно-синцитиальный вирус (RSV), вирус Эпштейна-Барр (EBV) или вирус папилломы человека (HPV)), паразитов (например, патогены являющиеся протистами и многоклеточными, такие как виды Plasmodia, виды Leishmania, виды Schistosoma или виды Trypanosoma), бактерии (например, микобактерии, в частности, М. tuberculosis, Salmonella, стрептококки, Е. coli или стафилококки), грибки (например, виды Candida или виды Aspergillus), Pneumocystis carinii и прионы, но не ограничиваются ими.
Термин «аутоиммунное расстройство» в том виде, как он используется в данной заявке, относится к двум общим типам: «системные аутоиммунные заболевания» (т.е. расстройства, которые повреждают многие органы или ткани) и «локализованные аутоиммунные заболевания» (т.е. расстройства, которые повреждают только один орган или ткань). Однако эффект «локализованных аутоиммунных заболеваний» может быть системным путем оказания непрямого воздействия на другие органы и системы организма. «Системные аутоиммунные заболевания» включают следующие: ревматоидный артрит, который может поражать суставы и возможно легкое и кожу, волчанка, включая системную красную волчанку (SLE), которая может поражать кожу, суставы, почки, сердце, мозг, эритроциты, а также другие ткани и органы; склеродермия, которая может поражать кожу, кишечник и легкие; синдром Шегрена, который может поражать слюнные железы, слезные железы и суставы; синдром Гудпасчера, который может поражать легкие и почки, гранулематоз Вегенера, который может поражать пазухи, легкие и почки; ревматическая полимиалгия, которая может поражать большие группы мышц и височный артериит/гигантоклеточный артериит, который может поражать артерии головы и шеи, но не ограничиваются ими. «Локализованные аутоиммунные заболевания» включают следующие: сахарный диабет типа 1, который поражает островки поджелудочной железы; тиреоидит Хашимото и базедова болезнь, которые поражают щитовидную железу; целиакия, болезнь Крона и язвенный колит, которые поражают желудочно-кишечный тракт; рассеянный склероз (MS) и синдром Гийена-Барре, которые поражают центральную нервную систему; болезнь Аддисона, которая поражает надпочечники; первичный биллиарный цирроз печени, склерозирующий холангит и аутоиммунный гепатит, которые поражают печень; феномен Рейно, который может поражать пальцы рук, пальцы ног, нос, уши, но не ограничиваются ими.
Таким образом, настоящее изобретение, кроме того, относится к способу лечения или предупреждения болезненных состояний, как упомянуто выше, с использованием композиции, содержащей материал на основе вируса или растворенный материал, как определено ранее. Такой способ более предпочтительно включает растворение лиофилизированного продукта, как определено выше, и введение соответствующего растворенного материала хозяину, нуждающемуся в этом.
Затем другое воплощение настоящего изобретения касается способа вакцинации животного, включая человека, нуждающегося в этом, композицией, содержащей материал на основе вируса или растворенный материал, как определено ранее.
При необходимости композицию по изобретению можно, кроме того, готовить с традиционными носителями вакцины, которые хорошо известны специалисту в данной области.
Данное изобретение было описано иллюстративным способом, и следует понимать, что терминология, которую использовали, предназначена для того, чтобы соответствовать характеру слов описания, а не ограничению. Очевидно, в свете приведенных выше идей возможны многие модификации и вариации настоящего изобретения. Следовательно, необходимо понимать, что, в пределах объема приложенной формулы изобретения, данное изобретение можно воплощать на практике отличным способом от того, который конкретно описан в данной заявке.
Все процитированные выше раскрытия патентов, публикаций и записей в базах данных конкретно включены в данное изобретение посредством ссылки во всей их полноте в той же самой степени, как если бы каждый такой индивидуальный патент, публикация или запись были конкретно и индивидуально указаны как включенные посредством ссылки.
Если не определено иначе, все материалы, использованные для того, чтобы добиться воплощения следующих примеров, имеются в продаже.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 проиллюстрирована совокупная потеря инфекционного титра вектора на основе MVA (TG4001), приготовленного в отсутствие фосфата (черные столбики) или в присутствии возрастающих концентраций фосфата (от светлосерых до темно-серых столбиков), и который хранили при 5°С (Фиг. 1А) или 45°С (Фиг. 1Б) в течение указанного периода времени. Светло-серые столбики представляют композицию I, столбики серого цвета промежуточной интенсивности представляют композицию II, темно-серые столбики представляют композицию III, и черные столбики представляют контрольный образец RS1, описанный ниже.
ПРИМЕРЫ
Материал
- L-аргинина гидрохлорид, порошок (J.T BACKER - SIGMA);
- SVF (РАА)
- TRIS - трис(гидроксиметил)аминометан, порошок (J.T BACKER);
- Соляная кислота (HCl), 1 М (MERCK);
- Гидроксид натрия (NaOH), 1 н. (VWR);
- Сахароза, порошок (MERCK);
- Хлорид натрия (NaCl), порошок (MERCK);
- PVP25, порошок (MERCK);
- L-глутаминовая кислота, мононатриевая соль (MERCK);
- Динатрия гидрофосфат, безводный порошок (MERCK);
- Калия дигидрофосфат, безводный порошок (MERCK);
- Вода для инъекции (COOPER);
- Сосуды - сосуды TopLyo® (SCHOTT); пробки (STELMI);
- DAB - 3,3'-диаминобензидин (SIGMA);
- Клетки-хозяева ВНК-21 (АТСС (Американская коллекция типовых культур), CCL10);
- Антитело против вакцины (Meridian Life science);
- Антитело против антитела кролика, объединенное с пероксидазой (DAKO);
- Вода MilliQ (Millipore);
- PBS (фосфатно-солевой буферный раствор) (DULBECCO SIGMA);
- Triton Х-100 (SIGMA);
- DMEM (среда Игла, модифицированная по Дульбекко) (GIBCO)
- Катионы 100Х (10 г/л магния ацетат тетрагидрат, MERCK и 10 г/л кальция хлорид дигидрат JT BAKER);
Следует отметить, что в следующих таблицах при указании «-» он обозначает то, что соответствующий ингредиент отсутствует в соответствующих композициях.
Способ
Способ титрования вируса для того, чтобы оценивать стабильность композиции согласно настоящему изобретению во время лиофилизации и во время хранения с течением времени, подробно описан ниже.
Некоторые сухие образцы растворяли и титровали немедленно после лиофилизации для того, чтобы оценивать эффект процесса лиофилизации на стабильность вируса (т.е. потерю титра вируса в сутки 0 в следующих примерах).
Другие сухие образцы хранили после лиофилизации при разных температурах (например, при 5°С и 45°С) до растворения для титрования для оценки потери титра вируса во время хранения, включающей потерю титра вируса из-за процесса лиофилизации (т.е. потеря титра вируса в сутки 4, 7, 28, 60 и/или 90 в следующих примерах).
Как указано ранее, целью настоящего изобретения является получение сухого продукта, общая потеря титра вируса которого ограничена с течением времени при температуре выше 0°С, более предпочтительно от 4°С до 25°С и более предпочтительно при примерно 4°С или 5°С. Поскольку ожидание данных по стабильности в реальном времени является времязатратным (1-2 года при 2-8°С), тесты на стабильность типично можно проводить при повышенных температурах, таких как 45°С, в течение примерно 3-5 суток, и их результаты коррелировали с тем, что можно ожидать при меньшей температуре, используя уравнение Аррениуса.
Протокол, использованный для титрования вируса композиции перед сублимационной сушкой и для растворенных композиций, осуществляли на клетках ВНК-21 (клетки почки новорожденного хомяка-1), используя методику бляшечного анализа. В таком способе в образце определяется число бляшкообразующих единиц (pfu/мл). Вирусная бляшка образуется при инфицировании клетки вирусом в пределах фиксированного монослоя клеток (Kaufmann and Kabelitz, 2002, Methods in Microbiology Vol.32: Immunology of Infection. Academic Press. ISBN 0125215320). Конкретные стадии, осуществляемые для каждой из следующих приведенных в качестве примера композиции согласно изобретению, подробно описаны ниже в разделе «ПРИМЕРЫ».
Пример 1: получение жидкой композиции, содержащей вирус оспы, подлежащей сублимационной сушке
Перечисленные ниже жидкие композиции I-V получали согласно следующим этапам. Данные композиции содержат продукты на основе MVA. Более конкретно, композиции I-III содержат TG4001, и композиции IV и V содержат TG4040.
a) TG4001 и TG4040 исходно поддерживали в замороженном состоянии в растворе А1 и растворе А2 соответственно. Состав каждого из растворов А1 (содержащего TG4001) и А2 (содержащего TG4040) подробно описан в следующей Таблице 1.

Растворы А1 и А2 оттаивали.
При необходимости растворы А1 и А2 можно дополнительно разводить согласно способам, хорошо известным специалисту в данной области. Например, раствор А1 не был дополнительно разведен и был использован в указанном качестве для получения композиций I-III. В том, что касается раствора А2, его разбавляли раствором А'2, соответствующим вышеописанному раствору А2 (не включающему TG4040), для того чтобы получить конечный конечный титр вируса 6.70Е+07 pfu/мл.
Полученные суспензии вируса затем гомогенизировали путем кратковременного перемешивания.
б) Затем 170 мкл следующих растворов Б добавляли в 340 мкл растворов вируса А1 и А2 соответственно, в том виде, в котором они были получены на стадии а).
Более конкретно:
- 170 мкл растворов Б1-Б3 добавляли в 340 мкл вирусного раствора А1 со стадии а), содержащего TG4001, для того чтобы получить композиции I-III, и
- 170 мкл растворов Б4 и Б5 добавляли в 340 мкл вирусных растворов А'2 со стадии а), содержащих TG4040, для того чтобы получить композиции IV и V.
Данные смеси затем гомогенизировали путем кратковременного перемешивания.
Подробные составы растворов Б1-Б5 приведены в следующей Таблице 2.
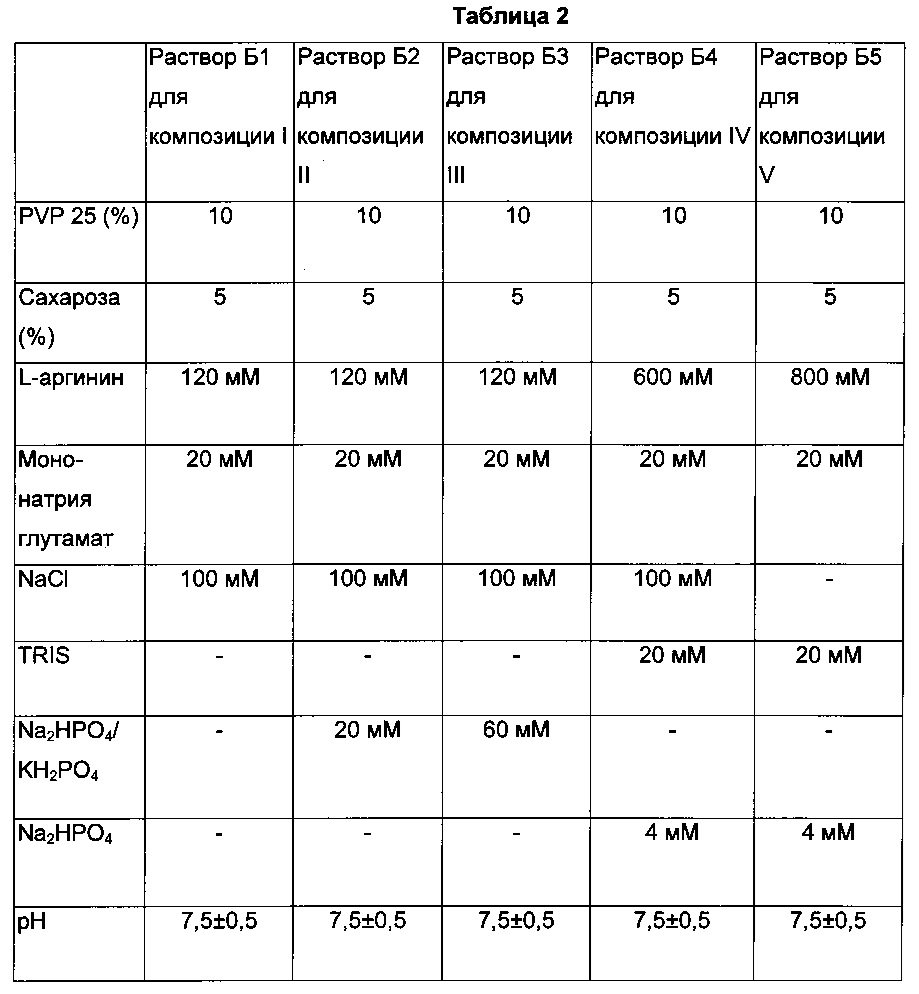
в) Полученные перед лиофилизацией жидкие композиции I-V (510 мкл) подробно описаны в следующей Таблице 3.

Вышеописанные жидкие композиции I-V также представляют собой часть настоящего изобретения.
Пример 2: получение соответствующих лиофилизированных композиций I-V
В следующих примерах все лиофилизации осуществляли в лиофилизаторе TELSTAR LYOBETA 25.
Протокол лиофилизации был следующим.
а) Получение сухих продуктов I-III
Сосуды TopLyo® (SCHOTT) заполняли жидкими композициями I-III, полученными ранее в примере 1, и процесс лиофилизации проводили следующим образом:



б) Получение сухих продуктов IV и V
Сосуды TopLyo® (SCHOTT) заполняли жидкими композициями IV и V, полученными ранее в примере 1, и процесс лиофилизации проводили следующим образом. Протокол является аналогичным протоколу, который осуществляли для композиций МП, но в данном случае проводится дополнительная стадия воздействия вакуумом.



Полученные сухие продукты I-V образовали кек подходящего вида, т.е. гладкий белый «кек», который не отпадал от боковых стенок сосуда после лиофилизации.
Соответствующий титр вируса указанных продуктов I-V после сублимационной сушки подробно описан в следующей Таблице 4.

Сухие продукты I-V также представляют собой часть настоящего изобретения.
Указанные кеки размалывали, и полученный порошок затем растворяли для того, чтобы определять титр вируса согласно ранее описанному способу титрования вируса.
Пример 3: исследования стабильности: оценка общих потерь титра вируса, т.е. на протяжении хранения с течением времени, включая потерю из-за процесса лиофилизации
3. а) Растворение сухих продуктов I-V
Растворенные материалы (раств. комп.) I-V, полученные с WFI в конечном объеме 680 мкл, подробно описаны сразу после лиофилизации в следующей Таблице 5 (т.е. без периода хранения для t0).

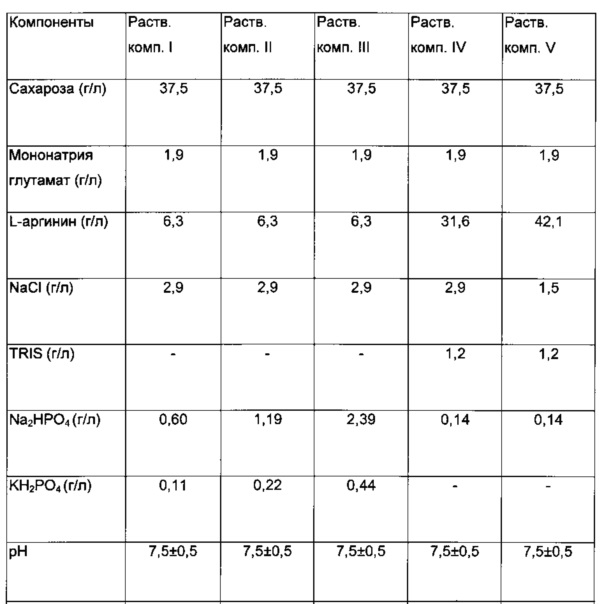
Для того чтобы оценить титр вируса сухих продуктов I-V после хранения либо при 5°С, либо при 45°С в течение указанного периода времени, сухие продукты I-V сперва необходимо было растворить. В следующих примерах их растворяли WFI в конечном объеме 680 мкл, и соответствующие вирусные титры оценивали согласно методике бляшечного анализа, подробно описанной ранее.
Растворенные материалы I-V также представляют собой часть настоящего изобретения.
3.б) Оценка потери титра вируса сухих композиций I-V при 5°С
Как указано ранее, оценивали совокупную потерю титра вируса каждого сухого продукта (т.е. потерю во время хранения с течением времени, включая потерю из-за процесса лиофилизации) с использованием методики бляшечных анализов на клетках ВНК-21.
Стадии, осуществляемые в связи с этим для каждой из композиций I-V, подробно описаны ниже.
1. Распределение клеток
Клетки-хозяеа ВНК-21 выращивали в монослоях в DMEM. При конфлюентности клетки промывали 10 мл PBS и затем трипсинировали. После удаления трипсина клетки ресуспендировали в 10 мл DMEM с 10% SFV (вирус пенистости обезьян) при 37°С.
Затем клеточную суспензию гомогенизировали и распределяли в многолуночные планшеты (2 мл в каждую из 6 лунок планшета). Затем указанные планшеты инкубировали при 37°С, 5% CO2.
2. Инфекция клеток
Примерно через 1 сутки после распределения клеток в каждую лунку, содержащую клетки ВНК-21 со стадии 1, добавляли аликвоты суспензий вируса. При необходимости указанные суспензии сперва серийно разводили в PBS, катионах 100Х и 1% SVF согласно способу, хорошо известному специалисту в данной области. В зависимости от случая, суспензии вируса, которые добавляли к клеткам ВНК-21 со стадии 1, представляли собой либо жидкие композиции, содержащие вирус, перед лиофилизацией, либо растворенную композицию, содержащую вирус (т.е. после лиофилизации, в разные периоды времени и при разных температурах). Культуральную среду затем удаляли, и после перемешивания на протяжении 60 минут при комнатной температуре, в каждую лунку распределяли 2 мл инфекционной среды (DMEM плюс 5% SVF). Затем инкубировали планшеты при 37°С, 5% CO2.
3. Фиксация клеток
После удаления среды клетки промывали PBS (примерно 1 мл на лунку). Затем добавляли 1 мл раствора метанола/ацетона (50/50), и образующуюся смесь аккуратно перемешивали при комнатной температуре.
Затем давали планшетам высохнуть при комнатной температуре.
4. Детекция и определение титра
Определение титра вируса проводили согласно хорошо известной пероксидазной реакции с использованием антител против вакцины и антител против антител кролика, объединенных с пероксидазой. Более конкретно, перед реакцией антитела против вакцины разводили в 100 раз в PBS плюс 2% SVF. Затем 500 мкл указанных антител добавляли в каждую лунку и инкубировали при 37°С на протяжении примерно 30 минут и затем 3 раза промывали 1 мл PBS плюс 1% Triton Х-100.
Реакцию с антителами против антител кролика, объединенными с пероксидазой, проводили таким же способом, за исключением того, что перед реакцией указанные антитела разводили в 200 раз в PBS плюс 2% SVF.
Раствор DAB получали путем растворения одной имеющейся в продаже таблетки DAB в 15 мл 0,05 М TRIS. Затем полученный раствор фильтровали на фильтровальной установке NALGENE с размером пор 2 мкм, и образующийся отфильтрованный раствор добавляли к 15 мкл водного раствора 30% H2O2. Сразу после получения в каждую лунку добавляли 1 мл раствора DAB и оставляли до того момента, пока не появлялось коричневое окрашивание. Окрашенный раствор затем удаляли, и результаты интерпретировали визуально.
Затем рассчитывали инфекционный титр в PFU/мл, используя следующую формулу:
[среднее число вирусных бляшек х4]х кратность разведения = число PFU/мл
Результаты
Результаты исследования стабильности при 5°С представлены в следующей Таблице 6, в которой:
- SD - стандартное отклонение.
- Титр вируса в сутки -1 соответствует титру вируса жидких композиций I-V перед лиофилизацией.
- Титр вируса в сутки 0 соответствует титру вируса сухих композиций I-V сразу после лиофилизации. Его сравнение с титром вируса жидких композиций I-V перед лиофилизацией обеспечивает определение потери титра вируса на протяжении лиофилизации.
- Титр вируса в сутки 28, 60 и 90 соответствует титру вируса сухих композиций I-V после периодов хранения 28, 60 и 90 суток соответственно. Его сравнение с титром вируса растворенных композиций I-V сразу после лиофилизации (т.е. в сутки 0) обеспечивает определение потери титра вируса на протяжении хранения при 5°С.
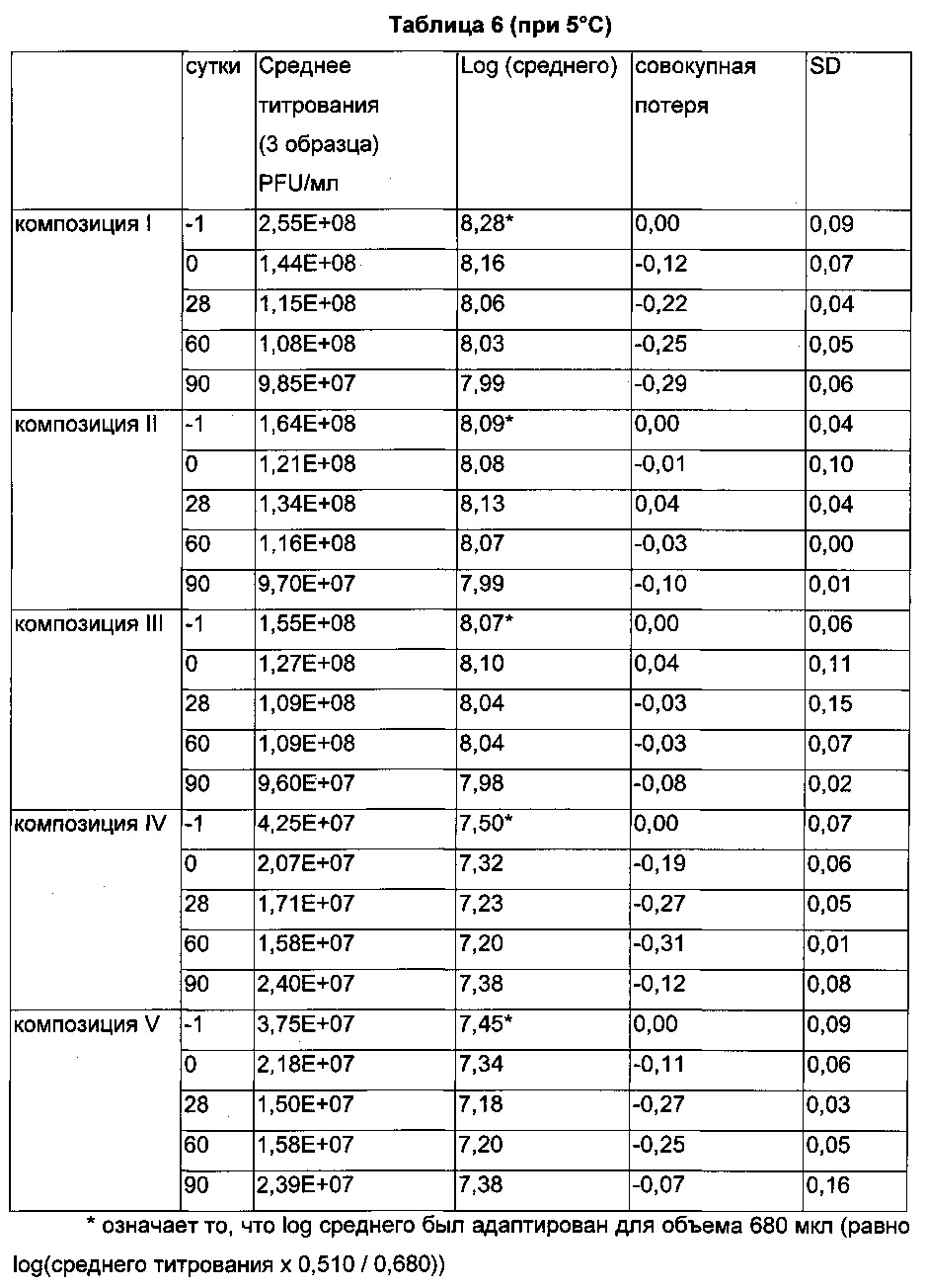
Как и ожидалось, сухие продукты I-V являются стабильными при 5°С. Действительно, их совокупные потери титра вируса составляют не больше чем 0,6 log после по меньшей мере 90 суток хранения при 5°С.
3. в) Оценка потери титра вируса сухих продуктов I-V при 45°С
Для того чтобы дополнительно оценить стабильность сухих продуктов I-V, провели исследования стабильности при 45°С. Как было объяснено ранее, такая повышенная температура обеспечивает прогнозирование деградации вируса ускоренным способом.
Каждый сухой продукт I-V хранили в течение 4, 28, 60 и 90 суток при 45°С.
Совокупную потерю титра вируса каждого сухого продукта (т.е. потерю на протяжении хранения с течением времени, включающую потерю, из-за процесса лиофилизации) оценивали с использованием способа титрования (методика бляшечных анализов на клетках ВНК-21), как описано ранее.
Результаты
Результаты ускоренного исследования стабильности при 45°С представлены в следующей Таблице 7, в которой:
- SD, титр вируса в сутки -1 и титр вируса в сутки 0 имеют такое же значение, что и в предыдущей Таблице 6.
- Титр вируса в сутки 4, 7, 28 и 60 соответствует титру вируса сухих композиций I-V после периодов хранения 4, 7, 28 и 60 суток соответственно. Его сравнение с титром вируса растворенных композиций I-V сразу после лиофилизации (т.е. в сутки 0) обеспечивает определение потери титра вируса на протяжении хранения при 45°С.



Следует отметить, что в приведенной выше Таблице 7 результаты, показанные для композиций IV и V в сутки 3; 3,5 и 4 при 45°С, оценивали согласно описанному ниже статистическому анализу, т.е. с использованием программы SAS 9.2 и многомерной модели на основе закона Аррениуса 1-го порядка, которая определена в следующем уравнении:
где:
- С0 представляет собой исходный титр в pfu/мл (после лиофилизации),
- Т представляет собой температуру в градусах Кельвина,
- t представляет собой время в сутках,
- С представляет собой титр в соответствующее время t в pfu/мл.
Поскольку в настоящем примере используется только одна температура, т.е. 45°С, данное уравнение можно упростить:
При оценке параметров модели титр в данный момент времени можно оценивать посредством следующей формулы:
Где:
- С0 представляет собой исходный титр в pfu/мл (после лиофилизации),
- t представляет собой время в сутках,
- представляет собой оценочный титр в соответствующее время t в pfu/мл,
- , представляют собой оценочные параметры модели.
И оценка потери затем оценивается посредством:
где:
- представляет собой оценочный титр в pfu/мл,
- С-1 представляет собой титр за одни сутки до лиофилизации в pfu/мл,
- представляет собой оценочную потерю.
Что касается композиции IV, скорректированное R2, равное 0,995, означает то, что данная модель правильно согласуется с данными.
Что касается композиции IV, скорректированное R2, равное 0,999, означает то, что данная модель правильно согласуется с данными.
Таким образом, вышеописанные результаты показывают то, что жидкие композиции I-V позволяют сохранять стабильность вируса после воздействия нагревания, которое происходит во время процесса лиофилизации, и что, кроме того, стабильность вируса сохранялась в дальнейшем во время долговременных тестов стабильности.
В заключение, в композициях согласно настоящему изобретению вирусы были защищены против повреждения, вызванного тепловыми стрессами как во время процесса лиофилизации (т.е. из-за стадий замораживания, сублимационной сушки и оттаивания), так и на протяжении хранения при температурах выше 0°С, более конкретно при примерно 5°С.
Пример 4: композиция вирусного препарата без Фосфата
Из очищенной партии TG4040 получали три эталонных образца (RS2-RS4), и один (RS1) - из очищенной партии вируса TG4001. Данные эталонные образцы обрабатывали вместе с композициями I-V, описанными в примерах 1-3, за исключением того, что образцы RS готовили без фосфата. Концентрации Arg и NaCl также варьировали, в зависимости от образца.
Как описано выше, 340 мкл вирусного раствора смешивали со 170 мкл стабилизирующего раствора. Подробные составы стабилизирующего раствора для каждого эталонного продукта S1-S4 приведены в следующей Таблице 8.

Полученные перед лиофилизацией жидкие эталонные продукты RS1-RS4 подробно описаны в следующей Таблице 9.

Эталонные продукты RS1-RS4 затем лиофилизируют, как описано выше, и растворяют WFI в конечном объеме 680 мкл.
Подробные составы растворенных эталонных продуктов RS1-RS4 (680 мкл), полученных сразу после процесса лиофилизации (т.е. без периода хранения), подробно описаны в следующей Таблице 10.


Исследования стабильности проводили при 5°С и 45°С, как описано в Примере 3. С этой целью каждый сухой эталонный продукт RS1-RS4 хранили при 5°С или 45°С в течение определенного периода времени, и оценивали совокупную потерю титра вируса (т.е. потерю на протяжении хранения с течением времени, включая потерю из-за процесса лиофилизации) в разные моменты времени с использованием ранее описанного способа титрования.
Результаты по стабильности композиций TG4001 и TG4040 при 5°С приведены в следующей Таблице 11.


Результаты по стабильности композиций TG4001 и TG4040 при 45°С приведены в следующей Таблице 12.


Как проиллюстрировано на Фиг. 1 и в Таблицах 6 и 11, присутствие фосфата является полезным для стабильности вирусных препаратов. В самом деле, совокупная потеря инфекционного титра TG4001 после 28, 60 или 90 суток при 5°С уменьшается в присутствии фосфатного буфера по сравнению с его отсутствием (см. Фиг. 1А). Например, после 60 суток при 5°С совокупная потеря составляет -0,25 log для композиции I, содержащей 0,94 г/л фосфатного буфера, -0,03 log для для композиций II и III, содержащих 1,88 г/л и 3,75 г/л фосфатного буфера, по сравнению с -0,25 log для эталонного образца RS1, приготовленного в отсутствие фосфата. Повышенную стабильность, предоставляемую композициями, содержащими фосфатный буфер, также наблюдали в ускоренных исследованиях стабильности; что приводило к совокупным потерям титра примерно -2 log после 60 суток при 45°С в присутствии фосфата (-2,40 log, -2,31 log и -1,98 log для композиций I, II и III соответственно) по сравнению с более чем -3 log в отсутствие фосфата (-3,24 log для RS1).
Такую же тенденцию наблюдали с композициями TG4040. Например, совокупная потеря, измеренная после 90 суток при +5°С для образца RS4, является более значительной, чем потеря, детектированная с композицией V (-0,17 log и -0,07 log соответственно). Данный эффект также наблюдали после 60 суток при 45°С (-2,08 log по сравнению с -1,81 log соответственно).
Пример 5: долговременная стабильность
Вирусные препараты TG4040 готовили, как описано выше. Более конкретно, тестировали две разные концентрации: соответственно высокую дозу (примерно 1,70×108 pfu/мл) и низкую дозу (примерно 7,00×107 pfu), и вирусные препараты готовили в композициях, содержащих 1 мМ Na2HPO4 и 10 мМ Tris; 10 мМ глутамат Na, 3,75% сахарозы, 50 мМ NaCl, 2,5% PVP 25 кДа и 30 мМ Arg). Компзицию со 150 мМ Arg также тестировали с препаратом с низкой дозой TG4040.
Три композиции TG4040 обрабатывали, как описано выше, и лиофилизировали согласно полупромышленному способу (IDT). Лиофилизированный продукт растворяли, и стабильность вируса оценивали при 5°С в течение периода времени один год (потерю вируса оценивали перед лиофилизацией, сразу после растворения (t0) и в сутки 28, 90, 180, 270 и 365 при 5°С.
Для каждой композиции TG4040 наблюдали общую потерю вируса хуже -0,60 log после одного года при 5°С (соответственно -0,33 log для композиции с высокой дозой в 30 мМ Arg; -0,42 log для композиции с низкой дозой в 30 мМ Arg и -0,24 log для композиции с низкой дозой в 150 мМ Arg).
В совокупности, данные результаты подчеркивают то, что присутствие фосфата является полезным для стабильности вирусного препарата. Arg также играет роль в стабильности вируса, особенно когда концентрация вируса перед лиофилизацией меньше, чем 108 PFU/мл. Матрицу продукта, содержащую остаточные белки, разводят при низкой концентрации вируса таким же способом; данные белки могли бы содействовать стабилизации вируса в высокой концентрации. Arg будет заменять стабилизирующую роль остаточного белка в матрице на протяжении операции сублимационной сушки.
Все документы (например, патенты, патентные заявки, публиации), процитированные в приведенном выше описании изобретения, являются включенными в данную заявку посредством ссылки. Для специалистов в данной области будут очевидными разные модификации и вариации настоящего изобретения, не отступающие от объема и сущности изобретения. Несмотря на то, что данное изобретение было описано в связи с конкретными предпочтительными воплощениями, следует понимать, что изобретение, в том виде, в котором оно изложено в формуле изобретения, не должно чрезмерно ограничиваться такими конкретными воплощениями. В самом деле, подразумевается, что разные модификации описанных способов осуществления изобретения, которые являются очевидными для специалистов в данной области, находятся в пределах объема следующей формулы изобретения.
Реферат
Настоящая группа изобретений относится к иммуногенной лиофилизованной композиции, иммуногенной растворенной композиции и к их применению для получения вакцины. Иммуногенная лиофилизованная композиция содержит материал на основе вируса, поливинилпирролидон, коповидон и/или их смесь, сахара, аминокислоты, фармацевтически приемлемые соли, где по меньшей мере одна из указанных солей представляет собой фосфатную соль, фармацевтически приемлемый буфер. Такие композиции могут быть использованы в качестве вакцин, предпочтительно для лечения и/или предупреждения раковых заболеваний, инфекционных заболеваний и/или аутоиммунных расстройств. 4 н. и 21 з.п. ф-лы,, 2 ил., 12 табл., 5 пр.

Комментарии