Фармацевтическая композиция, содержащая кальциевую соль розувастатина - RU2602911C2
Код документа: RU2602911C2
Чертежи

Описание
Настоящее изобретение относится к фармацевтическим композициям и более конкретно к фармацевтической композиции, содержащей кальциевую соль бис[(Е)-7-[4-(4-фторфенил)-6-изопропил-2-[метил(метилсульфонил)амино]-пиримидин-5-ил]-(3R,5S)-3,5-дигидроксигепт-6-еновой кислоты] (формулы I, которая также известна как кальциевая соль розувастатина и здесь далее называется "Агентом"), и к способам их изготовления.
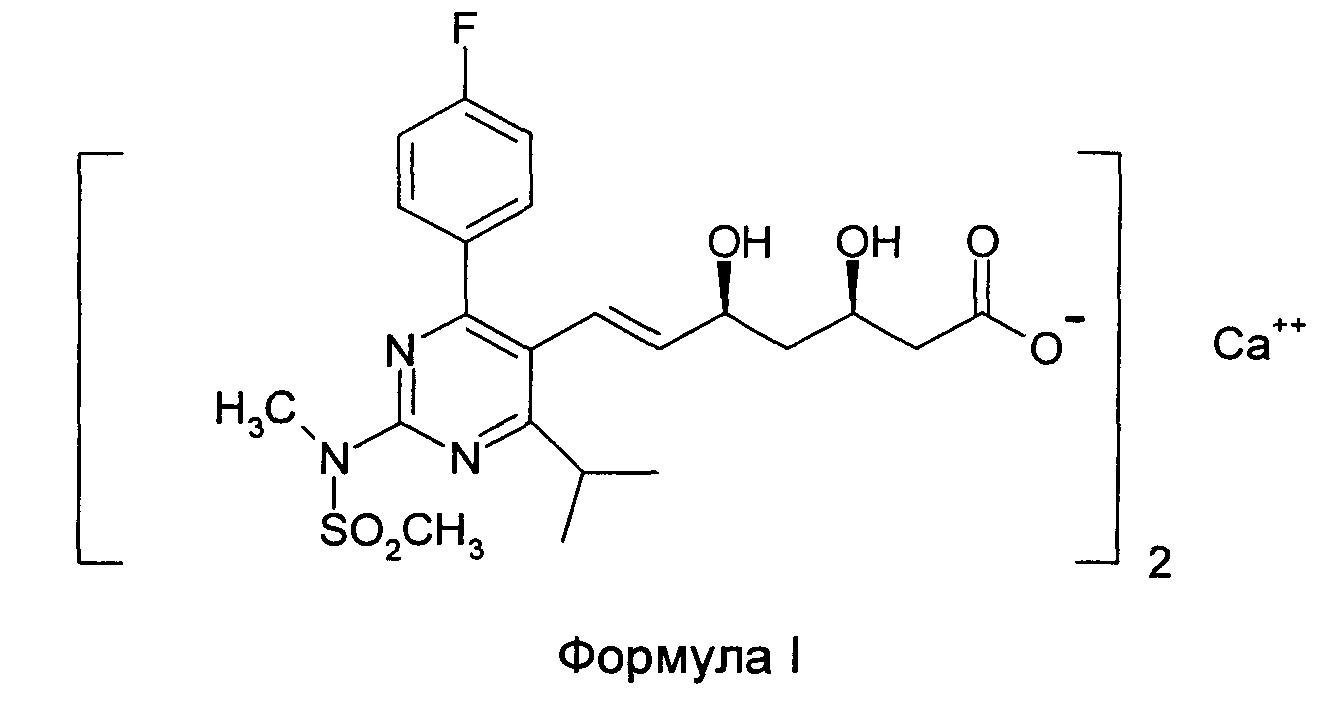
Указанный Агент раскрыт в публикации Европейской патентной заявки №0521471 и в Bioorganic and Medicinal Chemistry, (1997), 5(2), 437-444, как ингибитор 3-гидрокси-3-метилглутарил-СоА-редуктазы (HMG-CoA-редуктазы), который полезен в лечении гиперхолестеринемии, гиперлипидпротеинемии и атеросклероза.
Проблема, связанная с Агентом, заключается в том, что в определенных условиях он подвергается разложению. Это затрудняет изготовление продукта и предоставление фармацевтической композиции с адекватным сроком хранения. Основными продуктами разложения, которые образуются, являются соответствующий (3R,5S) лактон (здесь далее "лактон") и продукт окисления (здесь далее "В2"), в котором гидроксигруппа, расположенная рядом с двойной углерод-углеродной связью, окисляется до кетонной функциональной группы.
Поэтому важно найти фармацевтическую композицию, содержащую Агент, которая остается стабильной на протяжении длительного периода времени. Предпочтительно также, чтобы такая композиция имела хорошую текучесть для облегчения переработки в стандартные лекарственные формы для перорального введения, например в таблетки, и имела хорошие характеристики разрыхления и растворения, будучи переработанной в таблетки для перорального введения, которые могут иметь разные дозировки. В публикации Международной заявки WO 01/54668, поданной авторами настоящего изобретения, описана такая стабильная композиция в форме таблетки.
Пациенты, которым требуется терапия статинами, могут нуждаться также в одновременном лечении по поводу других сердечно-сосудистых состояний. Удобной альтернативой приему множества таблеток является комбинированная терапия статином вместе с другим обычно используемым сердечно-сосудистым лекарственным средством в одной таблетке. Изготовление такой комбинированной таблетки может быть проблематичным, поскольку, например, существует необходимость хранить два активных ингредиента по отдельности во избежание взаимодействия друг с другом, или для того чтобы каждый из них оставался стабильным на протяжении срока хранения таблетки, могут быть необходимы разные условия (такие как pH или влагосодержание). Для обеспечения наибольшей гибкости при изготовлении целого ряда возможных комбинированных терапевтических средств предпочтительной будет разработка способа, при котором статин может быть нанесен на внутреннее ядро, содержащее другой активный ингредиент, например посредством распыления раствора, содержащего Агент, на внутреннее ядро, так чтобы после выпаривания растворителя на ядре сформировалось покрытие, содержащее Агент (нанесение покрытия распылением). Однако чтобы осуществлять надежное и воспроизводимое производство, статин, такой как Агент, должен быть стабильным в растворе, используемом в процессе нанесения покрытия (нанесение формирующего покрытие раствора) в течение длительного периода времени. Нестабильность Агента, описанного выше, свидетельствует о том, что достичь этого будет очень трудно.
В WO 2007/103557 описан способ нанесения посредством распыления на капсулы покрытия, содержащего активный ингредиент, и представляется, что этот способ направлен в первую очередь на разрешение трудностей, связанных с нанесением покрытия на капсулы посредством распыления (размер, гладкость и растворимость оболочки капсулы).
Авторы настоящего изобретения неожиданно обнаружили условия, в которых Агент может быть нанесен посредством распыления на ядро таблетки, которое может содержать другой активный ингредиент, и обнаружили, основываясь на результатах испытаний на стабильность, что содержание продуктов разложения, включая продукты разложения лактон и В2, упомянутые выше, в полученной таблеточной лекарственной форме остается в приемлемых пределах в течение коммерчески жизнеспособного срока хранения.
Аналогично, Агент может быть нанесен посредством распыления на ядра пилюль или гранул таким же способом, и затем из этих пилюль или гранул могут быть дополнительно сформованы, например, таблетки.
Таким образом, необходимо понимать, что ссылка на "внутреннее ядро" может означать ядро таблетки, пилюли или гранулы.
Таким образом, в первом аспекте данного изобретения предложена фармацевтическая лекарственная форма, содержащая слой, содержащий кальциевую соль розувастатина, нанесенный посредством распыления на ядро таблетки, пилюли или гранулы, причем указанный слой, содержащий кальциевую соль розувастатина, содержит кальциевую соль розувастатина и первый формирующий покрытие полимер в соотношении приблизительно от 1:8 до 2:1. В данном контексте "приблизительно" означает +/-0,1.
В одном аспекте Агент распыляют на ядро таблетки. В другом аспекте Агент распыляют на ядро пилюли. В еще одном аспекте Агент распыляют на ядро гранулы.
Когда Агент распыляют на ядро пилюли или гранулы, покрытое ядро может быть дополнительно обработано способами, известными в данной области и/или описанными здесь, с образованием фармацевтического продукта (такого как капсула или таблетка).
В одном воплощении первый формирующий покрытие полимер содержит гипромеллозу (гидроксипропилметилцеллюлозу или НРМС) и полиэтиленгликоль (PEG). В другом воплощении первый формирующий покрытие полимер содержит поливиниловый спирт (PVA) и полиэтиленгликоль (PEG).
Подходящий первый формирующий покрытие полимер предоставляет собой Opadry YS-1 10925A, или Opadry 85F19250, или эквиваленты. Opadry YS-1 10925А содержит 90,90% (масс./масс.) гипромеллозы (гидроксипропилметилцеллюлозы) (тип 2910, 6 сП) и 9,10% (масс./масс.) полиэтиленгликоля 400 (и поэтому представляет собой смесь HPMC/PEG). Opadry 85F19250 содержит 52,260% (масс./масс.) поливинилового спирта, частично гидролизованного, 30,00% (масс./масс.) талька, 14,74% (масс./масс.) полиэтиленгликоля 3350 и 3,00% (масс./масс.) Polysorbate 80 (и поэтому представляет собой смесь PVA/PEG). Должно быть понятно также, что эквивалентные полимеры имеют компоненты HPMC/PEG или PVA/PEG в соотношениях, сходных с соотношениями в двух полимерах, описанных выше. Дополнительно, часть НРМС может быть заменена на НРС (гидроксипропилцеллюлоза). Кроме того, могут быть использованы альтернативные пластификаторы, такие как триацетин, дибутилсебекат, трибутилцитрат, триэтилцитрат, ацетилтриэтилцитрат, ацетилтрибутилцитрат, дибутилфталат, диэтилфталат, диметилфталат, глицерин, пропиленгликоль, бензилбензоат, 2-пирролидон, N-метилпирролидон, хлорбутанол, сорбит и/или диацетин.
В одном аспекте слой, содержащий кальциевую соль розувастатина, дополнительно содержит стабилизирующий агент, такой как соединение для корректировки pH слоя. В одном из воплощений pH слоя, содержащего кальциевую соль розувастатина, составляет от 5,6 до 11. В еще одном аспекте pH составляет от 6 до 8. Примеры таких стабилизирующих агентов включают гидроксид натрия и ацетат кальция. Понятно, что целью такой корректировки pH является сдерживание образования продуктов разложения.
В еще одном воплощении может быть добавлен стабилизирующий агент, который не напрямую изменяет pH. Примером такого агента является антиоксидант, такой как ВНА (бутилгидроксианизол).
Дополнительные возможные стабилизирующие агенты включают фармацевтически приемлемые гидроксиды (такие как гидроксиды натрия, калия, кальция или алюминия); фармацевтически приемлемые кальциевые соли органических кислот, где кальций замещает все протоны (такие как ацетат кальция, лактат кальция, сукцинат кальция и фумарат кальция) и их магниевые или алюминиевые эквиваленты; фармацевтически приемлемые неорганические силикаты магния, силикаты магния-алюминия и силикаты алюминия; фармацевтически приемлемые неорганические катионные соли, включая кальциевые, калиевые, натриевые, алюминиевые, магниевые или литиевые, в частности растворимые соли.
Стабилизирующие агенты, которые представляют собой любую из вышеуказанных солей магния или кальция, являются конкретными воплощениями изобретения.
Влагосодержание таблетки следует контролировать, и чтобы достичь этого, слой, содержащий кальциевую соль розувастатина, должен быть достаточно сухим. В одном аспекте содержание воды в таблетке составляет менее 1,40% (масс./масс.) В еще одном аспекте содержание воды составляет менее 1,2% (масс./масс.), например менее 1,0% (масс./масс.), например менее 0,8% (масс./масс.). Понятно, что более высокое содержание воды способно стимулировать более быстрое разложение кальциевой соли розувастатина. Более высокое содержание воды допускается в лекарственных формах, содержащих стабилизирующие агенты, такие как ацетат кальция. В одном аспекте лекарственные формы, не содержащие стабилизирующий агент, как описано здесь выше, имеют влагосодержание менее 0,8% (масс./масс.).
Содержание воды измеряли путем взвешивания 10 таблеток и нагревания таблеток при 50°С при относительной влажности от 30 до 50% в течение 24 часов в термостате. Таблетки нагревали в течение приблизительно 24 ч (не менее 23,5 ч). После охлаждения до комнатной температуры таблетки снова взвешивали и рассчитывали влагосодержание.
Должно быть понятно, что для измерения влагосодержания в слое покрытия вышеуказанную процедуру нужно проводить после нанесения каждого слоя покрытия.
Слой, содержащий кальциевую соль розувастатина, наносят на ядро таблетки, пилюли или гранулы. В одном аспекте ядро таблетки, пилюли или гранулы не содержит активный ингредиент.В другом аспекте ядро таблетки, пилюли или гранулы содержит активный ингредиент, который не является кальциевой солью розувастатина. В еще одном аспекте ядро таблетки, пилюли или гранулы содержит также кальциевую соль розувастатина. Под "активным ингредиентом" подразумевается ингредиент, который имеет желаемую биологическую активность.
В одном аспекте перед нанесением посредством распыления слоя, содержащего кальциевую соль розувастатина, ядро таблетки, пилюли или гранулы покрывают подслоем второго формирующего покрытие полимера. Второй формирующий покрытие полимер может представлять собой любой подходящий полимер, который совместим с первым формирующим покрытие полимером, используемым в слое, содержащем розувастатин. Предпочтительно, первый и второй формирующие покрытие полимеры являются одинаковыми. Присутствие подслоя является важным, если ядро таблетки, пилюли или гранулы содержит активный ингредиент, который не совместим с розувастатином (например, из-за его pH), так как подслой препятствует контактированию этих двух активных ингредиентов. Присутствие подслоя часто является желательным для создания гладкой поверхности для нанесения слоя, содержащего розувастатин, и получения за счет этого однородного слоя, содержащего розувастатин.
Второй формирующий покрытие полимер в подслое может быть таким же, как и первый формирующий покрытие полимер в слое, содержащем кальциевую соль розувастатина, или может быть другим, но совместимым с ним. В одном аспекте первый и второй формирующие покрытие полимеры являются одинаковыми. Подходящий второй формирующий покрытие полимер представляет собой Opadry YS-1 10925A или Opadry 85F19250 или эквиваленты, как описано здесь выше.
Ядро таблетки, пилюли или гранулы может иметь любой размер, подходящий для нанесения покрытия с использованием стандартного оборудования для нанесения покрытий. Ядро таблетки, пилюли или гранулы может быть изготовлено с возможностью немедленного высвобождения, контролируемого высвобождения или модифицированного высвобождения способами, известными в данной области. Следует иметь в виду, что здесь термин "контролируемое высвобождение", который можно также охарактеризовать как "пролонгированное высвобождение", относится к лекарственным формам, из которых активный ингредиент высвобождается в организм в течение длительного периода времени. Следует иметь в виду, что здесь термин "модифицированное высвобождение" относится к лекарственным формам, из которых высвобождение активного ингредиента в организм происходит предусмотренным образом; например, это может быть высвобождение с некоторой задержкой во времени или высвобождение в условиях с определенным pH (например, при использовании энтеросолюбильного покрытия для предотвращения высвобождения активного ингредиента до того, как таблетка достигнет определенного места в пищеварительном тракте).
Таблетка может быть также изготовлена с возможностью разрыхления при разжевывании.
Возможно, слой, содержащий кальциевую соль розувастатина, покрывают верхним слоем (внешним покрытием), содержащим третий формирующий покрытие полимер, например для защиты таблетки от повреждения при ударе или в результате воздействия воздуха, воды или света. В одном аспекте слой, содержащий кальциевую соль розувастатина, покрывают верхним слоем (внешним покрытием). Подходящий верхний слой содержит полимер HPMC-PEG или PVA-PEG (в частности, HPMC-PEG).
В одном аспекте третий формирующий покрытие полимер дополнительно содержит окрашивающие агенты и/или агенты, обеспечивающие светонепроницаемость. Подходящие окрашивающие агенты известны в данной области. Подходящие агенты, обеспечивающие светонепроницаемость, в частности диоксид титана и/или оксид трехвалентного железа, известны в данной области.
В одном аспекте третий формирующий покрытие полимер дополнительно содержит оксид трехвалентного железа (и, возможно, также диоксид титана) в количествах, достаточных для предотвращения светопропускания верхнего слоя. Понятно, что имеется большая вероятность разложения вследствие воздействия света, если кальциевая соль розувастатина распределена тонким слоем по всей поверхности ядра таблетки, по сравнению с традиционной таблеткой, где розувастатин присутствует в виде частиц внутри матрицы из эксципиентов. Следовательно, для предотвращения разложения в лекарственных формах по настоящему изобретению может потребоваться большее количество вещества, обеспечивающего светонепроницаемость.
Ранее было обнаружено, что оксид трехвалентного железа особенно эффективен в предотвращении разложения розувастатина под действием света (смотри WO 01/54669). Таким образом, в еще одном аспекте изобретения внешний (верхний) слой содержит светозащитное покрытие, содержащее оксид трехвалентного железа.
Соответственно, третий формирующий покрытие полимер верхнего слоя представляет собой Opadry 03В94523 или Opadry II 85F94317. Opadry 03В94523 состоит из 65,90% (масс./масс.) гипромеллозы (типа 2910, 6 сП), 9,10% (масс./масс.) полиэтиленгликоля 400, 24,45% (масс./масс.) диоксида титана и 0,55% (масс/масс.) красного оксида трехвалентного железа. Opadry II 85F94317 состоит из 40,0% (масс./масс.) поливинилового спирта, частично гидролизованного, 14,8% (масс./масс.) талька, 20,2% (масс./масс.) полиэтиленгликоля 3350, 24,27% (масс./масс.) диоксида титана и 0,73% (масс./масс.) оксида трехвалентного железа.
В одном аспекте третий формирующий покрытие полимер является таким же, как первый формирующий покрытие полимер. В одном воплощении первый, второй и третий формирующие покрытия полимеры все содержат, например, полимеры HPMC-PEG. Следует иметь в виду, что хотя первый, второй и третий формирующие покрытия полимеры все могут содержать полимер HPMC-PEG, каждый слой может иметь отличающиеся дополнительные компоненты, которые описаны здесь выше.
Дополнительно, в косметических или коммерческих целях в композицию лекарственной формы могут быть добавлены другие компоненты. Например, для маскировки вкуса одного или более компонентов возможно добавление корригента. Для удобства корригент может быть добавлен в верхний слой.
В воплощении (IA) изобретения предложена фармацевтическая лекарственная форма, содержащая слой, содержащий кальциевую соль розувастатина, нанесенный на ядро таблетки, пилюли или гранулы, причем указанный слой, содержащий кальциевую соль розувастатина, содержит кальциевую соль розувастатина и полимер HPMC/PEG в соотношении приблизительно от 1:8 до 2:1, и слой, содержащий кальциевую соль розувастатина, нанесен на ядро таблетки, пилюли или гранулы посредством распыления раствора розувастатина кальция и полимера HPMC/PEG в воде.
В другом воплощении (IB) изобретения предложена фармацевтическая лекарственная форма, содержащая слой, содержащий кальциевую соль розувастатина, нанесенный на ядро таблетки, пилюли или гранулы, причем указанный слой, содержащий кальциевую соль розувастатина, содержит кальциевую соль розувастатина и полимер HPMC/PEG, причем указанная лекарственная форма дополнительно покрыта внешним слоем, содержащим полимер НРМС и оксид трехвалентного железа.
В другом воплощении (IC) изобретения предложена фармацевтическая лекарственная форма, содержащая ядро таблетки, пилюли или гранулы, покрытое посредством распыления слоем, содержащим кальциевую соль розувастатина в полимере HPMC/PEG, причем указанная лекарственная форма дополнительно покрыта внешним слоем, содержащим полимер НРМС и оксид трехвалентного железа, и слой, содержащий кальциевую соль розувастатина, нанесен на ядро таблетки, пилюли или гранулы посредством распыления раствора розувастатина кальция и полимера HPMC/PEG в воде.
В одном аспекте этих воплощений (IA), (IB) и (IC) ядро таблетки, пилюли или гранулы содержит активный ингредиент, который не является кальциевой солью розувастатина. В еще одном аспекте этот активный ингредиент также не выбран из любого одного или более из следующих: ниацин или аналог ниацина, фибрат, метформин, ингибитор СЕТР (белка-переносчика холестерилового эфира) и/или аспирин. В еще одном аспекте этот активный ингредиент полезен для лечения сердечно-сосудистых, тромботических или диабетических заболеваний, хотя предпочтительно он не является ни одним из агентов, перечисленных в этом абзаце выше. В еще одном аспекте этот активный ингредиент выбран из ингредиентов, перечисленных ниже.
В еще одном аспекте этих воплощений (IA), (IB) и (IC) раствор, содержащий кальциевую соль розувастатина и полимер HPMC/PEG, дополнительно содержит стабилизирующий агент, в частности ацетат кальция или ВНА, более конкретно ацетат кальция.
В еще одном аспекте этих воплощений (IA), (IB) и (IC) перед нанесением покрытия распылением раствора кальциевой соли розувастатина и полимера HPMC/PEG в воде ядро таблетки, гранулы или пилюли покрывают подслоем полимера (в частности, полимера HPMC/PEG).
Понятно, что ядро таблетки будет содержать различные эксципиенты, а также возможно активный ингредиент (как описано здесь). Могут быть использованы любые традиционные эксципиенты, известные в данной области (такие как наполнители, разрыхлители или смазывающие вещества), при условии, что они совместимы с любым присутствующим активным ингредиентом и совместимы с любым формирующим покрытие полимером или слоем, содержащим розувастатин, если они находятся в прямом контакте.
Как упомянуто выше, этот способ приготовления розувастатина применим к пилюлям или гранулам. Понятно, что такие покрытые пилюли или гранулы сами могут быть приготовлены в форме таблеток, и третий формирующий покрытие слой (внешнее покрытие или верхний слой) затем может быть нанесен на всю таблетку. Для последующего приготовления покрытые пилюли или гранулы могут быть смешаны с другими эксципиентами и затем спрессованы в таблетки. Понятно, что этот способ будет обеспечивать изготовление, например, жевательных таблеток методами, известными в данной области.
Жевательные таблетки предназначены для разжевывания и не предназначены для проглатывания целиком. Обычно лекарственная форма жевательной таблетки будет содержать сахар (например, сахарозу) или сахарный спирт или полиол (такой как маннит или ксилит). Сахарные спирты могут быть предпочтительными, так как они придают холодящее ощущение. Обычно жевательные таблетки содержат смазывающее вещество, такое как стеарат магния, стеариновая кислота, стеарат кальция или их комбинация. Другие смазывающие вещества включают гидрогенизированное растительное масло и стеарилфумарат натрия. Могут быть добавлены краситель, корригент и подсластители. Типичными подсластителями являются сахарин (или его соли), аспартам, калиевая соль ацесульфама, комбинация калиевая соль аспартама-калиевая соль ацесульфама, сукралоза и стевия. Дополнительным возможным подсластителем является цикламат (или его соль). Другие ингредиенты, такие как крахмалы (например, для увеличения гладкости вкусового ощущения) или скользящие вещества могут быть добавлены при необходимости или желании.
После смешивания прессуют таблетки. Жевательные таблетки обычно больше, чем обычные таблетки, чтобы был объем, достаточный для жевания и/или для увеличения допустимого содержания ингредиентов таблетки.
Для того чтобы инкорпорировать лекарственные формы по изобретению, жевательные таблетки необходимо изготавливать в отсутствие воды, например путем добавления гранул, содержащих розувастатин, после окончания гранулирования или в виде смеси для прямого прессования.
Перорально распадающиеся таблетки (ODT), помещенные на язык, распадаются за короткий период времени (например, через 30 секунд). Несмотря на то, что механизм разрушения и распада таблеток отличается от жевательных таблеток, между ними существует много общего, например, в том, что касается использования сахаров, красителей, подсластителей и корригентов. Предпочтительным является использование корригента, который увеличивает выработку слюны, например мяты. Смазывающие вещества используют, но количество смазывающего вещества должно быть ограничено, поскольку оно будет замедлять проникание или впитывание воды.
Обычно ODT содержит сахарный спирт или комбинацию с другими сахарными спиртами и/или крахмалом, которые измельчены до частиц небольшого размера для облегчения впитывания и растворения. Ингредиенты смешивают вместе в виде порошковой смеси. Количество смазывающего вещества ограничивают и/или используют таблеточный пресс, который распыляет смазывающее вещество на стенки матрицы.
Как упомянуто выше, кальциевая соль розувастатина является ингибитором HMG-CoA-редуктазы, и ее эффект снижения липопротеинов низкой плотности (LDL)-холестерина известен. Фармацевтические лекарственные формы по данному изобретению, следовательно, полезны для лечения состояний, ассоциированных с повышением уровня LDL-холестерина. Так как ядро таблетки, пилюли или гранулы также может содержать активный ингредиент, который сам может быть полезен против состояний, иных чем состояния, которые лечат ингибиторами HMG-CoA-редуктазы, лекарственные формы по изобретению имеют множество разных применений.
Подходящий активный ингредиент, который может присутствовать в ядре таблетки, пилюли или гранулы, выбран из ниацина и аналогов ниацина, бигуанидов (примеры включают метформин, фенформин, буформин), сульфонилмочевин (примеры включают хлорпропамид, глибурид, глимеперид), тиазолидиндионов (примеры включают росиглитазон, пиоглитазон), ингибиторов DPP-4 (дипептидилпептидазы-4), ингибиторов SGLT-2 (натрий-зависимого переносчика глюкозы-2), ингибиторов альдозоредуктазы, ингибиторов фосфодиэстеразы-5, амфипатических карбоновых кислот (примеры включают фенофибрат, гемфибризил), ингибиторов фосфодиэстеразы-3 (примером является циклостазол), ингибиторов белка-переносчика холестериловых эфиров (СЕТР), ингибиторов агрегации тромбоцитов (примеры включают тиенопиридины (примером является клопидогрел) прасугрел, аспирин), ингибиторов Фактора Ха, дипиридамола, блокаторов периферических кальциевых каналов, диуретиков, ингибиторов ангиотензин-превращающего фермента, антагонистов рецепторов ангиотензина II, прямых ингибиторов тромбина (примеры включают дабигатран), кофермента Q-10, витамина D2 (эргокальциферол) и витамина D3 (холекальциферол).
В еще одном аспекте подходящий активный ингредиент, который может присутствовать в ядре таблетки, пилюли или гранулы, выбран из бигуанидов (примеры включают метформин, фенформин, буформин), сульфонилмочевин (примеры включают хлорпропамид, глибурид, глимеперид), тиазолидиндионов (примеры включают росиглитазон, пиоглитазон), ингибиторов DPP-4, ингибиторов SGLT-2, ингибиторов альдозоредуктазы, ингибиторов фосфодиэстеразы-5, ингибиторов фосфодиэстеразы-3 (примером является циклостазол), ингибиторов агрегации тромбоцитов (примеры включают тиенопиридины (примером является клопидогрел) прасугрел, аспирин), ингибиторов Фактора Ха, дипиридамола, блокаторов периферических кальциевых каналов, диуретиков, ингибиторов ангиотензин-превращающего фермента, антагонистов рецепторов ангиотензина II, прямых ингибиторов тромбина (примеры включают дабигатран), кофермента Q-10, витамина D2 (эргокальциферол) и витамина D3 (холекальциферол).
В еще одном аспекте подходящий активный ингредиент, который может присутствовать в ядре таблетки, пилюли или гранулы, выбран из сульфонилмочевин (примеры включают хлорпропамид, глибурид, глимеперид), тиазолидиндионов (примеры включают росиглитазон, пиоглитазон), ингибиторов DPP-4, ингибиторов SGLT-2, ингибиторов альдозоредуктазы, ингибиторов фосфодиэстеразы-5, ингибиторов фосфодиэстеразы-3 (примером является циклостазол), ингибиторов агрегации тромбоцитов (примеры включают тиенопиридины (примером является клопидогрел) прасугрел, аспирин), ингибиторов Фактора Ха, дипиридамола, блокаторов периферических кальциевых каналов, диуретиков, ингибиторов ангиотензин-превращающего фермента, антагонистов рецепторов ангиотензина II, прямых ингибиторов тромбина (примеры включают дабигатран), кофермента Q-10, витамина D2 (эргокальциферол) и витамина D3 (холекальциферол).
В еще одном аспекте подходящий активный ингредиент, который может присутствовать в ядре таблетки, пилюли или гранулы, выбран из сульфонилмочевин (примеры включают хлорпропамид, глибурид, глимеперид), тиазолидиндионов (примеры включают росиглитазон, пиоглитазон), ингибиторов DPP-4, ингибиторов SGLT-2, ингибиторов альдозоредуктазы, ингибиторов фосфодиэстеразы-5, ингибиторов фосфодиэстеразы-3 (примером является циклостазол), ингибиторов агрегации тромбоцитов (примеры включают тиенопиридины (примером является клопидогрел) прасугрел, аспирин), ингибиторов Фактора Ха, дипиридамола, блокаторов периферических кальциевых каналов, диуретиков, ингибиторов ангиотензин-превращающего фермента, антагонистов рецепторов ангиотензина II, прямых ингибиторов тромбина (примеры включают дабигатран), кофермента Q-10, витамина D2 (эргокальциферол) и витамина D3 (холекальциферол).
В еще одном аспекте подходящий активный ингредиент, который может присутствовать в ядре таблетки, пилюли или гранулы, выбран из агонистов GPR40 (сопряженного с G-белком рецептора 40) (примеры включают TAK 875 и AMG 837), лекарственных средств против ожирения (примеры включают Qnexa (комбинация фиксированных доз фентермина и топирамата), Contrave (комбинация фиксированных доз буприопиона и налтрексона) и Lorqess (лоркасерин).
В еще одном аспекте изобретения предложен способ лечения сердечно-сосудистых заболеваний, включающий введение подходящей лекарственной формы по изобретению теплокровному животному, например человеку, нуждающемуся в таком лечении.
Понятно, что используемые активные ингредиенты будут зависеть от заболевания или состояния, которое лечат, и специалисту будут понятны применения активных ингредиентов, описанных выше.
В еще одном аспекте изобретения предложено применение фармацевтической лекарственной формы для лечения сердечно-сосудистых заболеваний, тромботических и/или диабетических заболеваний.
В еще одном аспекте изобретения предложено применение фармацевтической лекарственной формы в изготовлении лекарственного средства для лечения сердечно-сосудистых заболеваний, тромботических и/или диабетических заболеваний.
В одном воплощении этих аспектов применение является применением для лечения сердечно-сосудистых заболеваний. В другом воплощении применение является применением для лечения сердечно-сосудистых и тромботических заболеваний. В еще одном воплощении применение является применением для лечения сердечно-сосудистых и диабетических заболеваний.
В еще одном аспекте изобретения предложен способ изготовления лекарственной формы, включающий нанесение покрытия распылением раствора, содержащего кальциевую соль розувастатина и первый формирующий покрытие полимер в воде, на ядро таблетки, пилюли или гранулы.
В еще одном аспекте изобретения предложен способ изготовления лекарственной формы, включающий нанесение покрытия распылением раствора, содержащего кальциевую соль розувастатина и первый формирующий покрытие полимер в воде, на ядро таблетки, пилюли или гранулы с получением слоя, содержащего кальциевую соль розувастатина.
В еще одном аспекте изобретения предложен также способ изготовления лекарственной формы, включающий:
а) покрытие ядра таблетки, пилюли или гранулы подслоем второго формирующего покрытие полимера; и
б) нанесение покрытия распылением раствора, содержащего кальциевую соль розувастатина и первый формирующий покрытие полимер в воде, на покрытое ядро таблетки, пилюли или гранулы с получением слоя, содержащего кальциевую соль розувастатина.
В еще одном аспекте изобретения предложен также способ изготовления лекарственной формы, включающий:
а) возможно покрытие ядра таблетки, пилюли или гранулы подслоем второго формирующего покрытие полимера;
б) нанесение покрытия распылением раствора, содержащего кальциевую соль розувастатина и первый формирующий покрытие полимер в воде, на (возможно покрытое) ядро таблетки, пилюли или гранулы с получением слоя, содержащего кальциевую соль розувастатина; и
в) покрытие слоя, содержащего кальциевую соль розувастатина, внешним покрытием, содержащим третий формирующий покрытие полимер.
В одном воплощении вышеуказанных аспектов изобретения ядро таблетки, пилюли или гранулы содержит активный ингредиент, который не является кальциевой солью розувастатина, и который, в частности, выбран из списка активных ингредиентов, описанных здесь выше.
Предпочтительно, в вышеуказанных аспектах и воплощениях изобретения первый формирующий покрытие полимер содержит НРМС и PEG или PVA и PEG (более предпочтительно НРМС и PEG) в качестве основных компонентов. Кроме того, первый формирующий покрытие полимер для удобства содержит также стабилизирующий агент, такой как ацетат кальция или ВНА, в частности ацетат кальция.
Предпочтительно, первый формирующий покрытие полимер, второй формирующий покрытие полимер (если он используется) и третий формирующий покрытие полимер (если он используется) все являются одинаковыми и, в частности, все содержат НРМС и PEG или PVA и PEG, более предпочтительно все содержат НРМС и PEG. Понятно, что даже если первый формирующий покрытие полимер, второй формирующий покрытие полимер (если он используется) и третий формирующий покрытие полимер (если он используется) описаны здесь как все одинаковые, то каждый слой может содержать отличающиеся дополнительные компоненты. Например, слой, содержащий кальциевую соль розувастатина, может также содержать стабилизирующие агенты, которые описаны здесь выше, и внешнее покрытие может также содержать добавки (в частности, оксид трехвалентного железа), которые обеспечивают защиту кальциевой соли розувастатина от разложения под действием света.
В одном аспекте подслой (если он используется), слой, содержащий кальциевую соль розувастатина, и слой внешнего покрытия (если оно используется) все нанесены методами нанесения покрытий распылением.
В еще одном аспекте изобретения предложен способ изготовления лекарственной формы, включающий:
а) возможно покрытие ядра таблетки, пилюли или гранулы подслоем полимера HPMC/PEG (возможно содержащим дополнительные компоненты, которые описаны здесь выше, в частности ацетат кальция или ВНА, более предпочтительно ацетат кальция);
б) нанесение покрытия распылением раствора, содержащего кальциевую соль розувастатина и полимер HPMC/PEG в воде, на (возможно покрытое) ядро таблетки, пилюли или гранулы с получением слоя, содержащего кальциевую соль розувастатина.
В еще одном аспекте изобретения предложен также способ изготовления лекарственной формы, включающий:
а) возможно покрытие ядра таблетки, пилюли или гранулы подслоем полимера HPMC/PEG (возможно содержащим дополнительные компоненты, которые описаны здесь выше, в частности ацетат кальция или ВНА, более предпочтительно ацетат кальция);
б) нанесение покрытия распылением раствора, содержащего кальциевую соль розувастатина и полимер HPMC/PEG в воде, на (возможно покрытое) ядро таблетки, пилюли или гранулы с получением слоя, содержащего кальциевую соль розувастатина; и
в) покрытие слоя, содержащего кальциевую соль розувастатина, внешним покрытием, содержащим полимер HPMC/PEG (возможно содержащим дополнительные компоненты, такие как оксид трехвалентного железа).
В одном аспекте этих способов ядро таблетки, пилюли или гранулы содержит активный ингредиент, который не является кальциевой солью розувастатина. В еще одном аспекте этот активный ингредиент также не выбран из любого одного или более из следующих: ниацин или аналог ниацина, фибрат, метформин, ингибитор СЕТР и/или аспирин. В еще одном аспекте этот активный ингредиент полезен для лечения сердечно-сосудистых, тромботических или диабетических заболеваний, хотя предпочтительно он не является ни одним из агентов, перечисленных в этом абзаце выше. В еще одном аспекте этот активный ингредиент выбран из ингредиентов, перечисленных ниже:
сульфонилмочевины (примеры включают хлорпропамид, глибурид, глимеперид), тиазолидиндионы (примеры включают росиглитазон, пиоглитазон), ингибиторы DPP-4, ингибиторы SGLT-2, ингибиторы альдозоредуктазы, ингибиторы фосфодиэстеразы-5, ингибиторы фосфодиэстеразы-3 (примером является циклостазол), ингибиторы агрегации тромбоцитов (примеры включают тиенопиридины (примером является клопидогрел) прасугрел, аспирин), ингибиторы Фактора Ха, дипиридамол, блокаторы периферических кальциевых каналов, диуретики, ингибиторы ангиотензин-превращающего фермента, антагонисты рецепторов ангиотензина II, прямые ингибиторы тромбина (примеры включают дабигатран), кофермент Q-10, витамин D2 (эргокальциферол) и витамин D3 (холекальциферол), агонисты GPR40 (примеры включают TAK 875 и AMG 837), лекарственные средства против ожирения (примеры включают Qnexa™ (комбинация фиксированных доз фентермина и топирамата), Contrave™ (комбинация фиксированных доз буприопиона и налтрексона) и Lorqess™ (лоркасерин).
В одном воплощении всех аспектов способов, указанных выше, слой, содержащий розувастатин, содержит кальциевую соль розувастатина и первый формирующий покрытие полимер в соотношении приблизительно от 1:8 до 2:1.
В еще одном аспекте изобретения предложен продукт, получаемый способом, который описан выше. В еще одном дополнительном аспекте изобретения предложен продукт, полученный способом, который описан выше.
Следующий аспект изобретения включает стабильный раствор розувастатина кальция и полимера HPMC/PEG в воде.
Пригодность композиций по изобретению может быть оценена путем мониторинга образования продуктов разложения в соответствии с Руководствами ЮН (Международная конференция по гармонизации). Анализ разложения продукта в конкретных условиях за конкретные периоды времени определяет возможный срок хранения и условия хранения продукта.
Другие аспекты изобретения следующие:
1. Фармацевтическая лекарственная форма, содержащая слой, содержащий кальциевую соль розувастатина, нанесенный распылением на ядро таблетки, пилюли или гранулы, причем указанный слой, содержащий кальциевую соль розувастатина, содержит кальциевую соль розувастатина и первый формирующий покрытие полимер в соотношении приблизительно от 1:8 до 2:1.
2. Фармацевтическая лекарственная форма, которая определена в пункте 1, где слой, содержащий кальциевую соль розувастатина, дополнительно содержит стабилизирующий агент.
3. Фармацевтическая лекарственная форма, которая определена в пункте 1 или 2, где перед нанесением покрытия посредством распыления слоем, содержащим кальциевую соль розувастатина, ядро таблетки, пилюли или гранулы покрывают подслоем второго формирующего покрытие полимера.
4. Фармацевтическая лекарственная форма, которая определена в пункте 3, где первый и второй покрывающие полимеры являются одинаковыми.
5. Фармацевтическая лекарственная форма, которая определена выше, где слой, содержащий кальциевую соль розувастатина, дополнительно покрыт внешним покрытием из третьего формирующего покрытие полимера.
6. Фармацевтическая лекарственная форма по п.5, где внешнее покрытие дополнительно содержит краситель и/или вещество, обеспечивающее светонепроницаемость.
7. Фармацевтическая лекарственная форма, которая определена в пункте 5 или 6, где третий формирующий покрытие полимер является таким же, как второй формирующий покрытие полимер.
8. Способ изготовления лекарственной формы, которая определена в любом из пунктов 1-7, включающий нанесение покрытия распылением раствора, содержащего кальциевую соль розувастатина и первый формирующий покрытие полимер в воде, на ядро таблетки, пилюли или гранулы.
Краткое описание графических материалов
На Фиг.1 графически представлены данные по образованию лактона при 25°С/60% ОВ (относительная влажность) при хранении лекарственных форм по изобретению в сосудах из ПЭВП (полиэтилен высокой плотности) с осушителем.
Примеры
В примерах, описанных ниже, покрытие на таблетки наносили с использованием перфорированного барабана для нанесения покрытий, но другое фармацевтически приемлемое оборудование для нанесения покрытий также может быть использовано.
Ядра таблеток имели форму капсулы и имели следующие приблизительные размеры: 9,8 мм×19,3 мм с толщиной приблизительно 8 мм.
Здесь ниже термин "подслой" относится к слою под покрытием, термин "слой Агента" относится к слою, содержащему кальциевую соль розувастатина, и термин "верхний слой" относится к слою внешнего покрытия.
Пример 1
Ядра таблеток покрывали смесью, содержащей Opadry YS-1-10925A и воду. Распыление проводили при скорости 70 г/мин в течение 184 минут при температуре на входе 70-72°С.
Пример 2
Ядра таблеток покрывали смесью, содержащей Opadry II 85F19250 и воду. Распыление проводили при скорости 70 г/мин в течение 160 минут при температуре на входе 70-73°С
Пример 3
Покрытые ядра таблеток покрывали смесью Агента, Opadry YS-1-10925A и воды. Распыление проводили при скорости 15 г/мин в течение 330 минут при температуре на входе 56,0-61,9°С.
После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry 03B94523 и воды. Распыление проводили при скорости 15 г/мин в течение 70 минут при температуре на входе 60,8-62,5°С.
Пример 4
Покрытые ядра таблеток покрывали смесью Агента, Opadry YS-1-10925A и воды. Распыление проводили при скорости 15 г/мин в течение 342 минут при температуре на входе 69,1-72,7°С.
После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry 03B94523 и вода. Распыление проводили при скорости 15 г/мин в течение 50 минут при температуре на входе 52,2-58,5°С
Пример 5
Покрытые ядра таблеток покрывали смесью Агента, Opadry YS-1-10925A, ВНА-этанольного раствора и воды. Распыление проводили при скорости 15 г/мин в течение 340 минут при температуре на входе 58,4-61,0°С.
После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry 03B94523 и воды. Распыление проводили при скорости 15 г/мин в течение 65 минут при температуре на входе 62,0-65,1°С.
Пример 6
Покрытые ядра таблеток покрывали с использованием смеси Агента, Opadry YS-1-10925A, ВНА-этанольного раствора и воды. Распыление проводили при скорости 15 г/мин в течение 360 минут при температуре на входе 66,0-73,6°С.
После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry 03B94523 и воды. Распыление проводили при скорости 15 г/мин в течение 68 минут при температуре на входе 57,0-59,1°С.
Пример 7
Покрытые ядра таблеток покрывали с использованием смеси Агента, Opadry II 85F19250 и воды. Распыление проводили при скорости 15 г/мин в течение 307 минут при температуре на входе 56,5-66,1°С.
После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry II 85F94317 и воды. Распыление проводили при скорости 15 г/мин в течение 54 минут при температуре на входе 59,2-69,9°С.
Пример 8
Покрытые ядра таблеток покрывали смесью Агента, Opadry II 85F19250 и воды. Распыление проводили при скорости 15 г/мин в течение 330 минут при температуре на входе 68,0-76,8°С.
После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry II 85F94317 и воды. Распыление проводили при скорости 15 г/мин в течение 48 минут при температуре на входе 65,0-72,6°С.
Пример 9
Покрытые ядра таблеток покрывали смесью Агента, Opadry II 85F19250, ВНА-этанольного раствора и воды. Распыление проводили при скорости 15 г/мин в течение 290 минут при температуре на входе 54,9-65,4°С.
После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry II 85F94317 и воды. Распыление проводили при скорости 15 г/мин в течение 50 минут при температуре на входе 64,5-70,5°С.
Пример 10
Покрытые ядра таблеток покрывали смесью Агента, Opadry II 85F19250, ВНА-этанольного раствора и воды. Распыление проводили при скорости 15 г/мин в течение 330 минут при температуре на входе 67,8-75,7°С.
После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry II 85F94317 и воды. Распыление проводили при скорости 15 г/мин в течение 62 минут при температуре на входе 66,0-70,3°С.
Пример 11
Ядра таблеток покрывали смесью, содержащей Opadry YS-1-10925A и воду. Распыление проводили при скорости 15 г/мин в течение 119 минут при температуре на входе 65,9-68,9°С. Затем покрытые ядра таблеток покрывали смесью Агента, Opadry YS-1-10925A и воды. Распыление проводили при скорости 15 г/мин в течение 180 минут при температуре на входе 61,5-68,0°С.
Пример 12
Ядра таблеток покрывали смесью, содержащей Opadry YS-1-10925A и воду. Распыление проводили при скорости 15 г/мин в течение 140 минут при температуре на входе 59,4-65,0°С. Затем покрытые ядра таблеток покрывали смесью Агента, Opadry YS-1-10925A и воды. Распыление проводили при скорости 15 г/мин в течение 175 минут при температуре на входе 62,0-68,1°С.
Пример 13
Покрытые ядра таблеток покрывали смесью Агента, Opadry YS-1-10925A и воды. Распыление проводили при скорости 15 г/мин в течение 311 минут при температуре на входе 62,4-70,5°С. После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry 03B94523 и воды. Распыление проводили при скорости 15 г/мин в течение 60 минут при температуре на входе 67,0-72,3°С.
Пример 14
Покрытые ядра таблеток покрывали смесью Агента, Opadry YS-1-10925A и воды. Распыление проводили при скорости 15 г/мин в течение 306 минут при температуре на входе 63,3-73,1°С. После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry 03B94523 и воды. Распыление проводили при скорости 15 г/мин в течение 60 минут при температуре на входе 54,5-70,8°С.
Пример 15
Покрытые ядра таблеток покрывали смесью Агента, Opadry YS-1-10925A и воды. Распыление проводили при скорости 15 г/мин в течение 435 минут при температуре на входе 66,0-71,7°С. После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry 03B94523 и воды. Распыление проводили при скорости 15 г/мин в течение 90 минут при температуре на входе 64,5-68,8°С.
Пример 16
Покрытые ядра таблеток покрывали смесью Агента, Opadry YS-1-10925A и воды. Распыление проводили при скорости 15 г/мин в течение 435 минут при температуре на входе 66,0-74,4°С. После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry 03B94523 и воды. Распыление проводили при скорости 15 г/мин в течение 85 минут при температуре на входе 66,5-69,7°С.
Пример 17
Покрытые ядра таблеток покрывали смесью Агента, Opadry YS-1-10925A и воды. Распыление проводили при скорости 15 г/мин в течение 438 минут при температуре на входе 66,7-71,1°С. После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Qpadry 03B94523 и воды. Распыление проводили при скорости 15 г/мин в течение 95 минут при температуре на входе б6,0-70,0°С.
Пример 18
Покрытые ядра таблеток покрывали смесью Агента, ацетат кальция, Opadry YS-1-10925A и воды. Распыление проводили при скорости 15 г/мин в течение 390 минут при температуре на входе 66,4-68,0°С. После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry 03B94523 и воды. Распыление проводили при скорости 15 г/мин в течение 70 минут при температуре на входе 67,5-73,7°С.
Пример 19
Покрытые ядра таблеток покрывали смесью Агента, раствора гидроксида натрия, Opadry YS-1-10925A и воды. Распыление проводили при скорости 15 г/мин в течение 390 минут при температуре на входе 67,0-68,5°С. После окончания нанесения слоя Агента таблетки покрывали системой верхнего слоя, состоящей из Opadry 03B94523 и воды. Распыление проводили при скорости 15 г/мин в течение 70 минут при температуре на входе 69,0-75,0°С.
Образование лактона в % (масс./масс.)
Стабильность композиций по изобретению иллюстрируется следующими данными по стабильности:
Реферат
Изобретение относится к способу изготовления фармацевтической лекарственной формы, содержащей кальциевую соль розувастатина. Фармацевтическая лекарственная форма содержит ядро таблетки, покрытое посредством распыления подслоем формирующего покрытие полимера. Подслой покрывается слоем активного агента посредством распыления раствора, содержащего кальциевую соль розувастатина, ацетат кальция и полимер гидроксипропилметилцеллюлоза/полиэтиленгликоль в воде. Слой активного агента дополнительно покрыт внешним слоем, содержащим полимер гидроксипропилметилцеллюлозу и оксид железа. Фармацевтическая лекарственная форма по изобретению является стабильной на протяжении длительного периода времени. 3 н. и 13 з.п. ф-лы, 1 ил., 18 табл., 18 пр.
Формула
а) покрытие ядра таблетки, пилюли или гранулы подслоем второго формирующего покрытие полимера; и
б) нанесение покрытия распылением раствора, содержащего кальциевую соль розувастатина, стабилизирующий агент и первый формирующий покрытие полимер в воде, на покрытое ядро таблетки, пилюли или гранулы с получением слоя, содержащего кальциевую соль розувастатина, где стабилизирующий агент выбран из фармацевтически приемлемой соли органической кислоты, в которой все протоны замещены кальцием или магнием.
а) покрытие ядра таблетки, пилюли или гранулы подслоем второго формирующего покрытие полимера;
б) нанесение покрытия распылением раствора, содержащего кальциевую соль розувастатина, стабилизирующий агент и первый формирующий покрытие полимер в воде, на покрытое ядро таблетки, пилюли или гранулы с получением слоя, содержащего кальциевую соль розувастатина, и
в) покрытие слоя, содержащего кальциевую соль розувастатина, внешним покрытием, содержащим третий формирующий покрытие полимер.

Комментарии