Мультиплексное обнаружение нуклеиновых кислот - RU2783946C2
Код документа: RU2783946C2
Чертежи


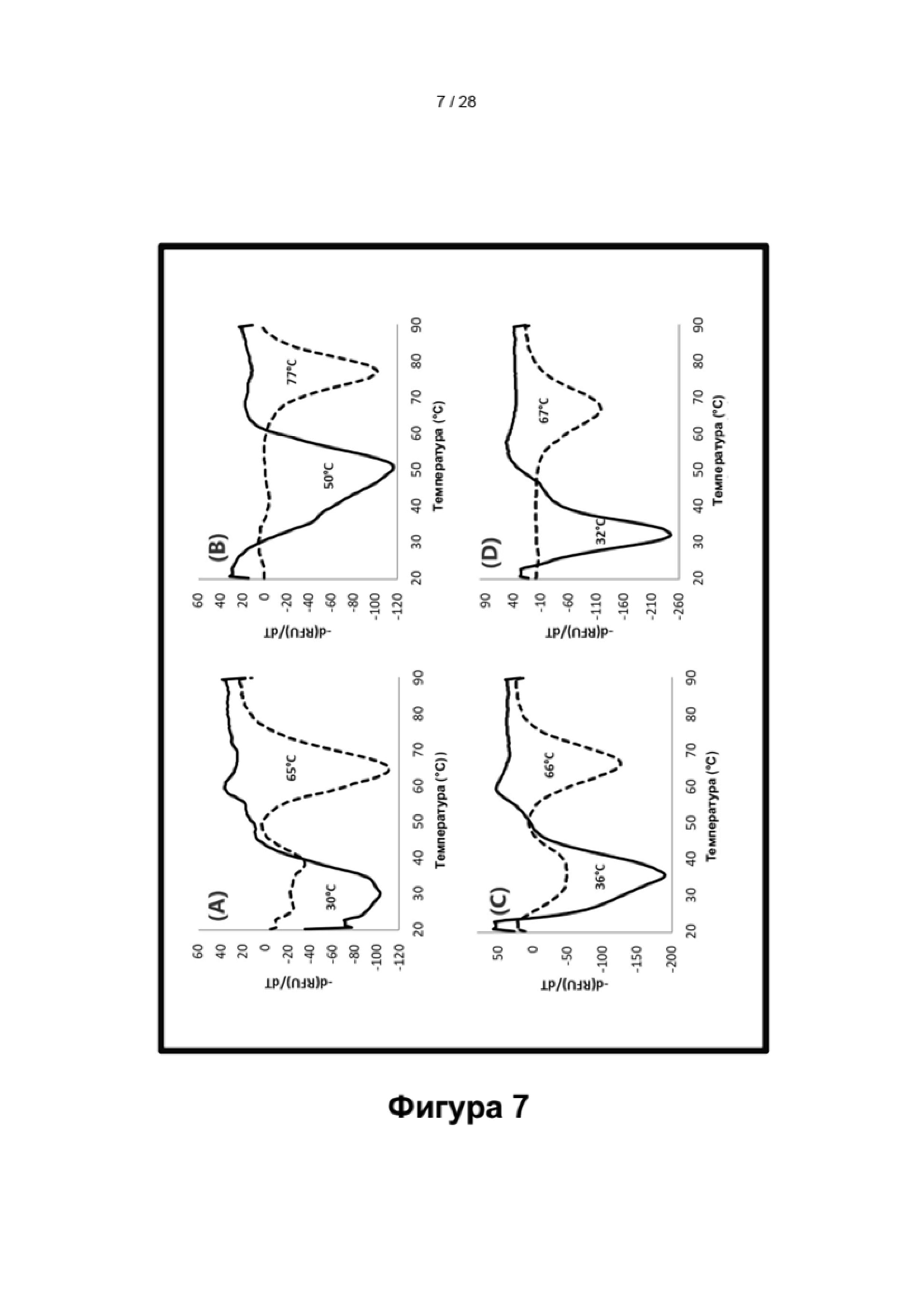
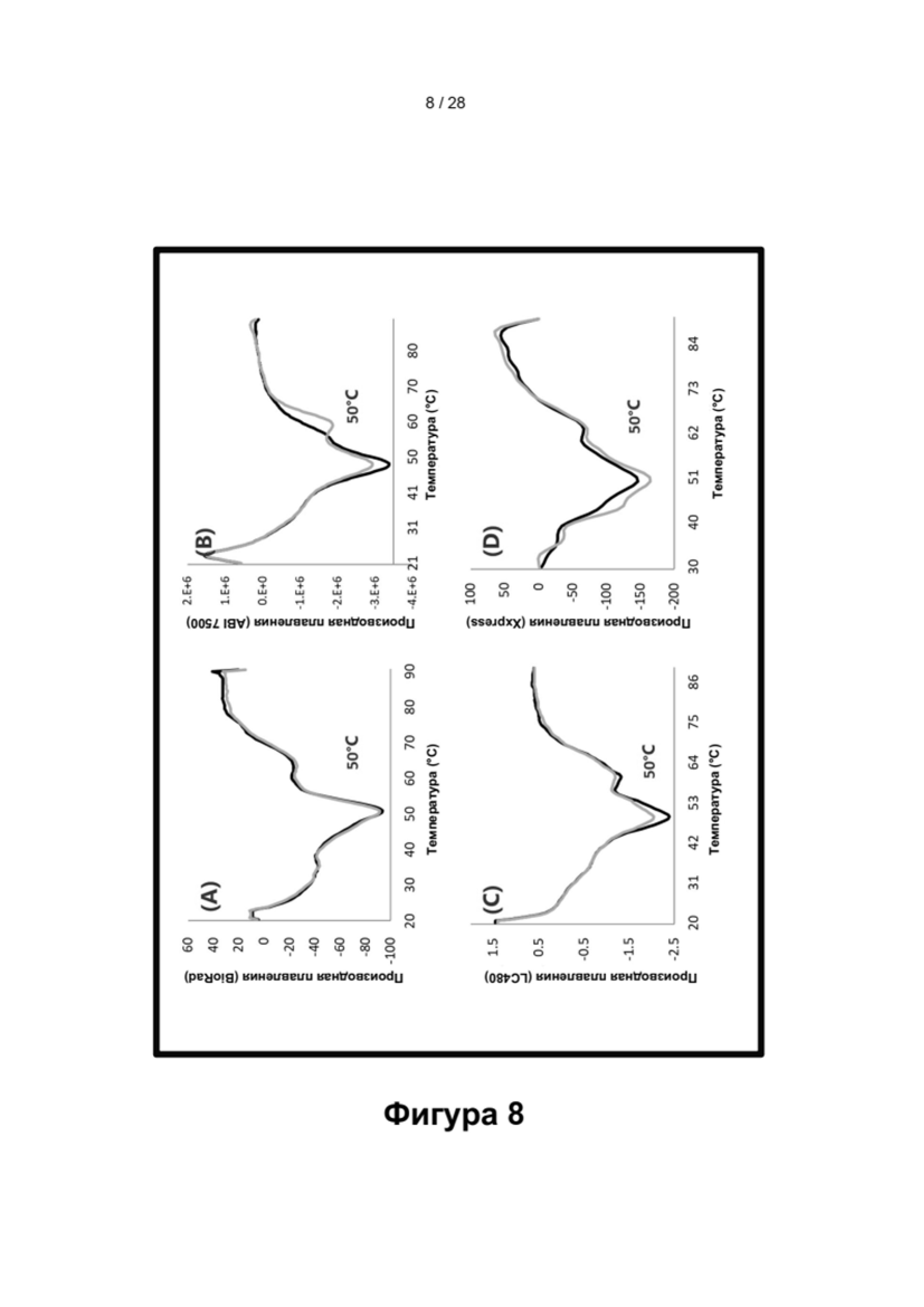
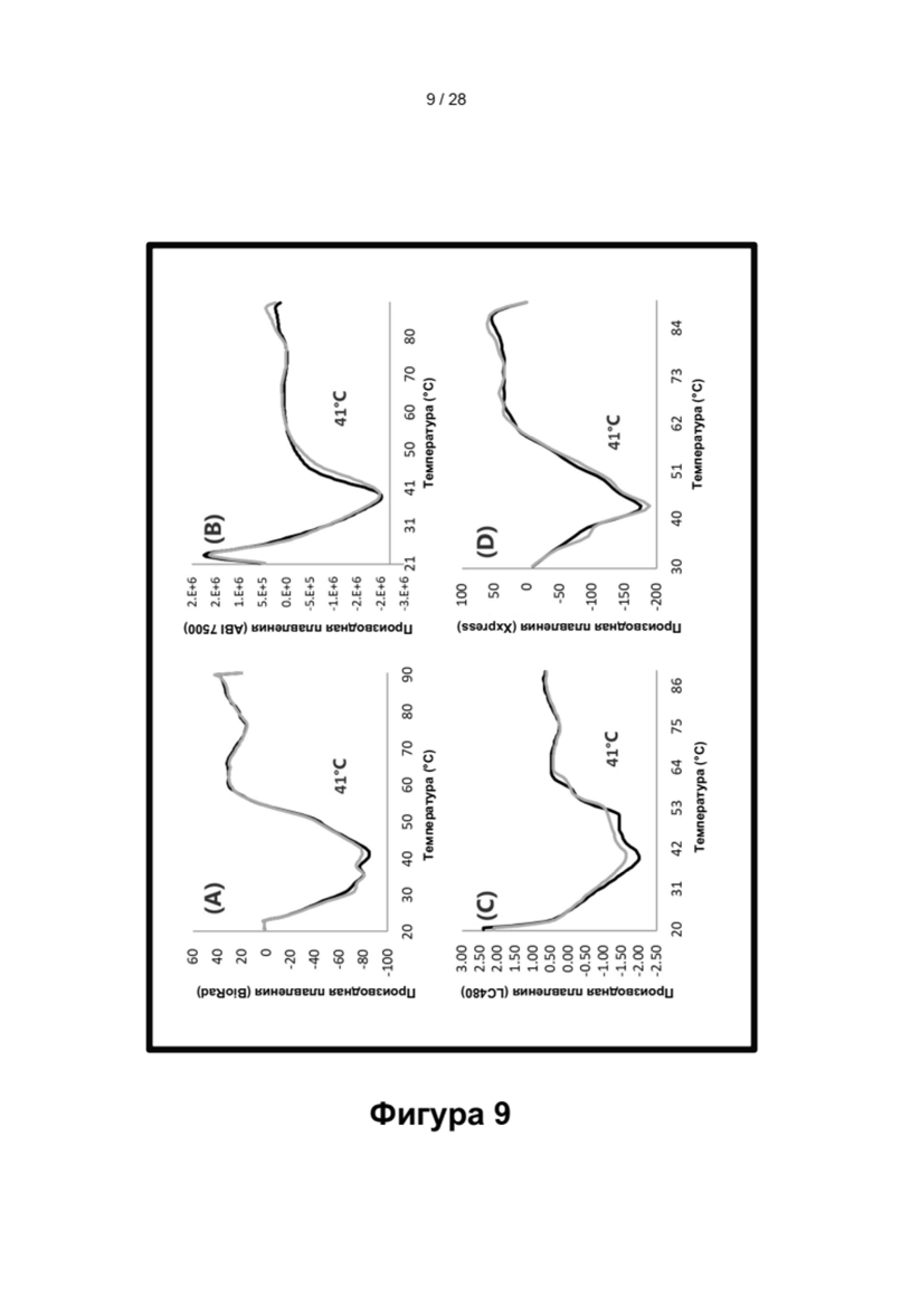


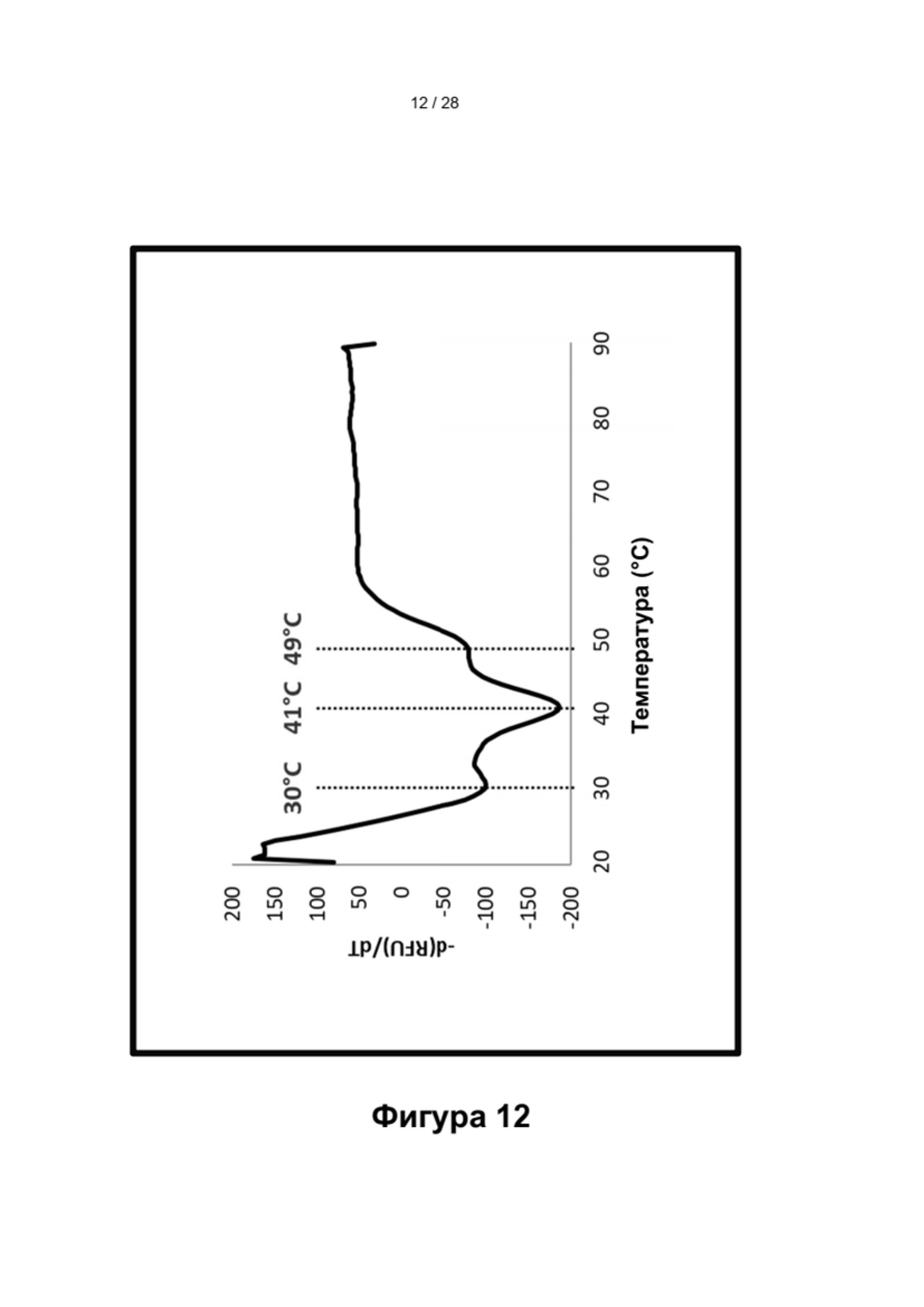








Описание
Область техники
Настоящее изобретение в целом относится к области молекулярной биологии. Конкретнее, в настоящем изобретении предложены олигонуклеотиды и способы их применения для обнаружения и/или дифференциации нуклеиновых кислот-мишеней. Указанные олигонуклеотиды и способы находят особое применение при амплификации, обнаружении и/или различении нескольких мишеней одновременно.
Включение посредством перекрестной ссылки
Настоящая заявка испрашивает приоритет австралийской предварительной заявки №2018902915; поданной 9 августа 2018 г., содержание которой полностью включено в настоящий документ посредством перекрестной ссылки.
Уровень техники
Генетический анализ становится повседневной процедурой в клинических условиях для оценки риска заболевания, диагностики заболевания, установления прогноза для пациента или реакции пациента на терапию, а также для наблюдения за ходом заболевания у пациента. Внедрение таких генетических анализов зависит от разработки простых, недорогих и быстрых способов анализа для распознавания генетических изменений.
Способы амплификации нуклеиновых кислот in vitro находят широкое применение в генетике и диагностике заболеваний. Такие способы включают полимеразную цепную реакцию (ПЦР), амплификацию с замещением цепи (SDA), амплификацию, зависимую от хеликазы (HDA), рекомбиназно-полимеразную амплификацию (RPA), петлевую изотермическую амплификацию (LAMP), амплификацию по типу катящегося кольца (RCA), транскрипционно-опосредованную амплификацию (ТМА), самоподдерживающуюся репликацию последовательности (3SR), амплификацию на основе последовательности нуклеиновой кислоты (NASBA) или полимеразную цепную реакцию с обратной транскрипцией (ОТ-ПЦР). Каждая из этих стратегий амплификации мишени требует использования олигонуклеотидных праймеров. Процесс амплификации приводит к экспоненциальной амплификации ампликонов, содержащих олигонуклеотидные праймеры на 5'-концах и вновь синтезированные копии последовательностей между праймерами.
Обычно используемые методы мониторинга накопления ампликонов в реальном времени или по завершении амплификации включают обнаружение с использованием МНКзимов с универсальными субстратными зондами; использование мишень-специфичных молекулярных маяков, зондов TaqMan или гидролизных зондов; праймеров/зондов типа "скорпион"; и/или использование интеркалирующих красителей, например, SybGreen. Анализ кривой плавления с высоким разрешением можно выполнять во время или по завершении нескольких из этих протоколов с целью получения дополнительной информации, поскольку ампликоны с различными последовательностями денатурируют при разных температурах, известных как температура плавления или Tm. Такие протоколы обеспечивают измерение кривых плавления, которые возникают в результате а) разделения двух цепей двуцепочечных ампликонов в присутствии интеркалирующего красителя, или b) отделения одной цепи ампликона и комплементарного мишень-специфичного зонда, меченого флуорофором и гасителем. Анализ кривой плавления позволяет получить информацию о кинетике диссоциации двух цепей ДНК во время нагревания. Температура плавления (Tm) - это температура, при которой диссоциирует 50% ДНК. Tm зависит от длины, состава последовательности и содержания G-C в спаренных нуклеотидах. Выяснение информации о ДНК-мишени на основе анализа кривой плавления обычно включает серию измерений флуоресценции с небольшими интервалами, обычно в широком диапазоне температур. Температура плавления зависит не только от последовательности оснований. На температуру плавления могут влиять концентрации олигонуклеотидов, катионов в буфере (как одновалентных (Na+), так и двухвалентных (Mg2+) солей), а также наличие или отсутствие дестабилизирующих агентов, например, мочевины или формамида.
В общем случае, количество доступных флуоресцентных каналов, способных контролировать отдельные длины волн, ограничивает количество мишеней, которые можно обнаруживать и специфично выявлять в ходе одной реакции на приборе в реальном времени. Недавно разработанный протокол, известный как «Отщепление и удлинение меченого олигонуклеотида, Tagging Oligonucleotide Cleavage and Extension» (TOCE), расширяет эту возможность, позволяя анализировать несколько мишеней на одной длине волны. В технологии TOCE используются "подающий" и "принимающий" олигонуклеотиды (Pitcher и Catcher). "Подающие" олигонуклеотиды содержат две области: фрагмент, обеспечивающий адресное воздействие, комплементарный мишени, и меченый фрагмент, не являющийся комплементарным и расположенный на 5'-конце.
Захватывающий олигонуклеотид содержит двойную метку и область на 3'-конце, комплементарную меченому фрагменту "подающего" олигонуклеотида. Во время амплификации "подающий" олигонуклеотид связывается с ампликонами, и при удлинении праймера экзонуклеазная активность полимеразы может отщеплять меченый фрагмент от "подающего" олигонуклеотида. Затем высвободившийся меченый фрагмент связывается с "принимающим" олигонуклеотидом и действует как праймер для синтеза комплементарной цепи. Поэтому температуру плавления двуцепочечной молекулы "принимающего" олигонуклеотида (Catcher-Tm) используют в качестве суррогатного маркера для исходной матрицы. Поскольку можно использовать несколько "принимающих" олигонуклеотидов, обладающих различной последовательностью и длиной и плавящихся при различных температурах, можно получить серию значений Catcher-Tm, указывающих на серию мишеней, несмотря на измерения при одной длине волны. Ограничения этого подхода включают присущую ему сложность, поскольку требуется, чтобы высвобожденный фрагмент инициировал и завершил второе удлинение цепи на искусственной мишени.
Зонды-шпильки или зонды типа "стебель-петля" также оказались полезными инструментами для обнаружения нуклеиновых кислот и/или мониторинга амплификации мишени. Зонды-шпильки, дважды меченые парой красителей "флуорофор/гаситель", широко известны в данной области техники как молекулярные маяки. В целом эти молекулы имеют три особенности; 1) стеблевую структуру, образованную при гибридизации комплементарных 5'- и 3'-концов олигонуклеотида; 2) петлевую область, комплементарную мишени или ампликону-мишени, подлежащим обнаружению; и 3) пару красителей "флуорофор/гаситель", присоединенных к концам молекулярного маяка. Во время ПЦР петлевая область связывается с ампликонами за счет комплементарности, и это приводит к плавлению стебля и разделению пары красителей "флуорофор/гаситель". Разделение пары красителей, присоединенных к концам интактного раскрытого молекулярного маяка, вызывает изменение флуоресценции, которое указывает на присутствие мишени. Этот способ обычно используют для мультиплексного анализа нескольких мишеней в одном ПЦР-анализе. В мультиплексных реакциях каждый молекулярный маяк содержит свою мишень-специфичную петлевую область и уникальный флуорофор, так что гибридизацию каждого молекулярного маяка с каждым видом ампликона можно отслеживать на отдельном канале, т.е. при отдельной длине волны.
Концепция молекулярных маяков расширена в стратегии, известной как "низкоспецифичные маяки" (Sloppy Beacons). В этом протоколе петлевая область одного маяка является достаточно длинной, чтобы допускать несовпадение оснований и, следовательно, связывается с рядом близкородственных мишеней, различающихся по одному или более нуклеотидам. После амплификации выполняют анализ кривой плавления, что позволяет дифференцировать различные виды мишеней в зависимости от температуры, при которой разделяются (плавятся) мишень и петлевая область маяка. Таким образом, можно одновременно обнаруживать и различать несколько близкородственных разновидностей при одной длине волны путем определения профиля плавления конкретных мишеней с помощью одного низкоспецифичного маяка. Стандартные молекулярные маяки и низкоспецифичные маяки отличаются от зондов TaqMan и гидролизных зондов тем, что они не предусматривают своего разрушения или расщепления во время амплификации. Недостатком технологий, основанных на гибридизации ДНК, например, низкоспецифичных маяков и ТОСЕ, является возможность получения ложноположительных результатов из-за неспецифической гибридизации между зондами и неспецифичными нуклеотидными последовательностями.
Во многих анализах обнаружения нуклеиновых кислот используют анализ кривой плавления для выявления присутствия конкретных последовательностей-мишеней в данном образце. Протоколы анализа кривой плавления включают измерение флуоресценции при различных температурах в постепенно увеличивающемся диапазоне температур. Затем строят график изменения коэффициента угла наклона этой кривой в зависимости от температуры, получая кривую плавления. Этот процесс часто является медленным и обычно занимает от 30 до 60 минут. Кроме того, анализ кривой плавления может требовать интерпретации квалифицированным специалистом и/или использования специального программного обеспечения для интерпретации результатов. Следовательно, существует высокий спрос на более быстрые и/или более простые альтернативы анализу кривой плавления.
Существует потребность в улучшенных композициях и способах для одновременного обнаружения, дифференциации и/или количественного определения множественных неродственных ампликонов, полученных с помощью ПЦР или альтернативных протоколов амплификации мишеней.
Сущность изобретения
Настоящее изобретение направлено на устранение одного или более недостатков современных анализов, предусматривающих мультиплексное обнаружение.
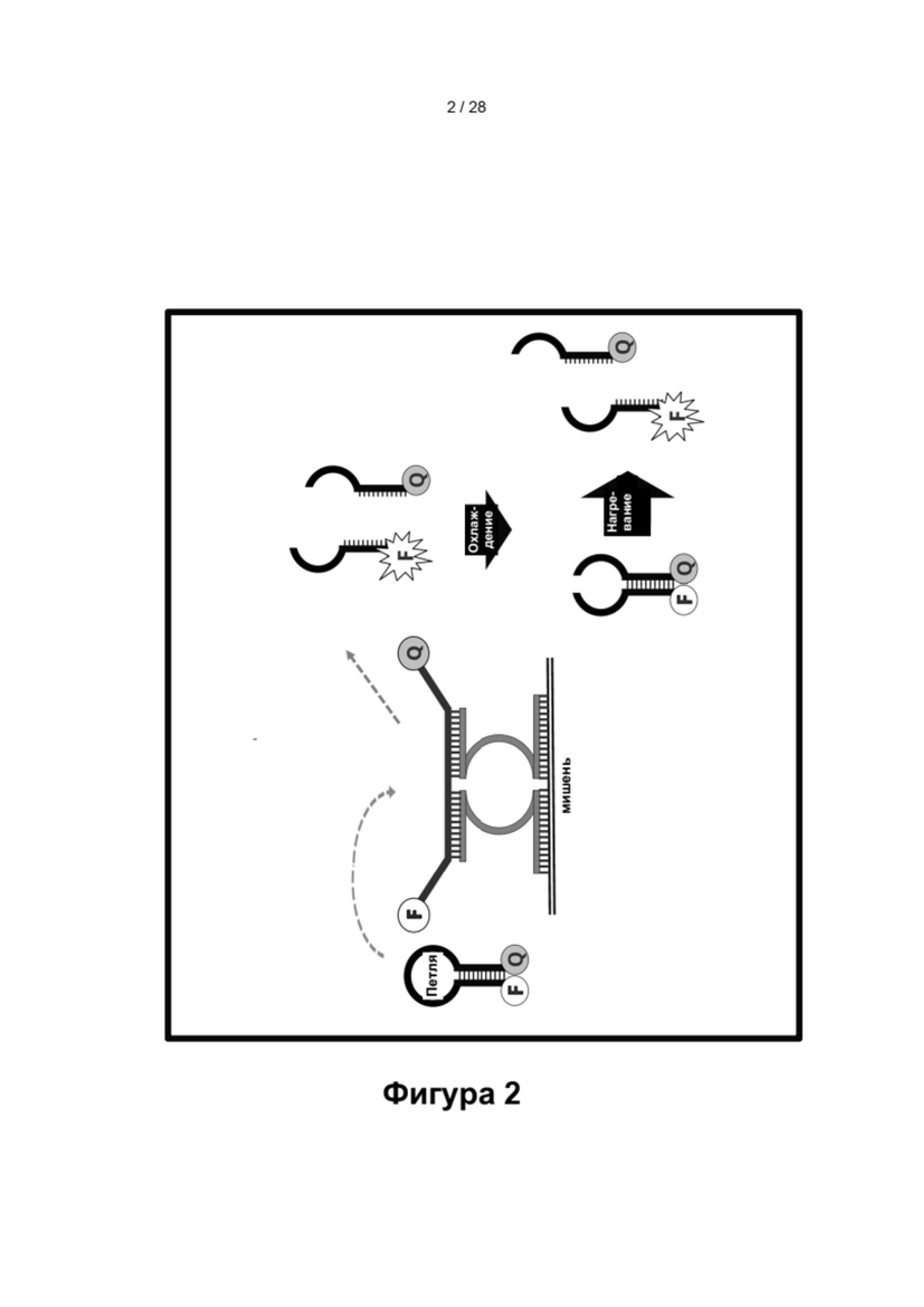
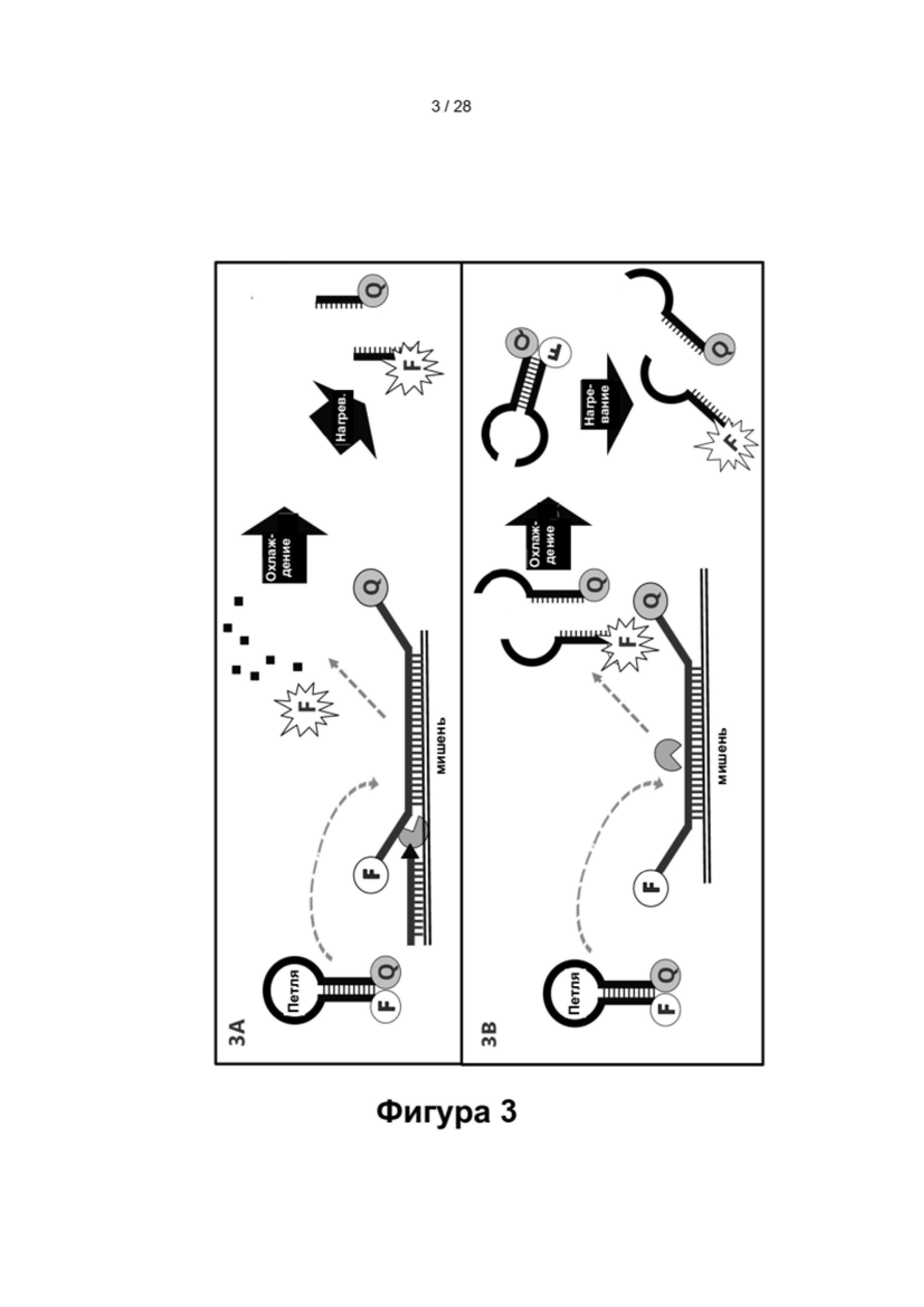
В настоящем изобретении предложены способы и композиции, расширяющие возможность мультиплексирования во время протоколов амплификации с использованием олигонуклеотидных структур, в настоящем документе упомянутых под названием LOCS (Loops Connected to Stems - петли, соединенные со стеблями). Серии LOCS, меченых одной парой "флуорофор/гаситель", можно индивидуально различать в рамках одной реакции на основании температуры, при которой стеблевой фрагмент плавится после раскрытия LOCS посредством расщепления или разрушения в ответ на присутствие мишени. Таким образом, температура плавления области стебля используется в качестве суррогатного маркера конкретной мишени, вызвавшей раскрытие LOCS. В то время как другие способы, включающие использование структуры "стебель-петля", используют изменение флуоресценции после а) гибридизации области петли с ампликонами-мишенями (молекулярные маяки и низкоспецифичные маяки), увеличивающей расстояние между парами красителей, или b) расщепления, обеспечивающего физическое разделение красителей (расщепляемые молекулярные маяки), в настоящем изобретении предложены усовершенствования по сравнению с существующими анализами для мультиплексного обнаружения. Эти усовершенствования обусловлены, по меньшей мере частично, за счет управления температурой плавления стеблевого фрагмента олигонуклеотидов «стебель-петля» путем изменения длины и/или состава последовательности стебля, так что плавление каждого стебля происходит при своей температуре.
Как описано в настоящем документе, несколько LOCS, меченых одним и тем же флуорофором, могут содержать а) различные последовательности петель, что позволяет выполнять прямое или косвенное обнаружение нескольких мишеней одновременно, и b) различные последовательности стеблей, плавящиеся при различных температурах, которые можно использовать для выявления конкретной(ых) мишени(ей), присутствующей(их) в нескольких исследуемых объектах. Способы согласно настоящему изобретению обеспечивают одно или более преимуществ по сравнению со способами, известными в данной области техники, например, протоколом ТОСЕ, заключающихся в отсутствии необходимости применения отдельных "принимающих" молекул, что уменьшает количество компонентов в реакционной смеси и снижает затраты. Более того, способ ТОСЕ по своей природе более сложен, чем способы согласно настоящему изобретению, поскольку он требует, чтобы высвобожденный фрагмент инициировал и завершал второе удлинение на синтетической мишени. Кроме того, в некоторых вариантах реализации LOCS-зонды могут быть универсальными (независимо от последовательности-мишени), и/или их можно комбинировать с рядом технологий обнаружения, что обеспечивает широкую применимость в области молекулярной диагностики. Кроме того, температура плавления, используемая в традиционных способах амплификации и обнаружения, основана на гибридизации и плавлении зонда с нуклеиновой кислотой-мишенью. Недостатком этих способов является увеличение количества ложно положительных результатов из-за неспецифичной гибридизации между зондами и неспецифичными нуклеотидными последовательностями. Способы согласно настоящему изобретению позволяют преодолеть это ограничение, поскольку репортерные зонды LOCS, содержащие универсальные субстраты, не связываются с последовательностью-мишенью. Наконец, в данной области техники хорошо известно, что внутримолекулярные связи прочнее межмолекулярных связей, и, следовательно, вероятность гибридизации этих нерасщепленных (замкнутых) LOCS с неспецифической мишенью и получения ложноположительного сигнала значительно ниже.
В результате того, что внутримолекулярные связи прочнее межмолекулярных связей, LOCS с двойной меткой плавится при одной температуре в неповрежденном (замкнутом) состоянии и при более низкой температуре после раскрытия области петли в результате мишень-зависимого расщепления или разрушения. Это свойство нуклеиновых кислот используется в настоящем изобретении для расширения возможностей инструментов по различению нескольких мишеней с использованием одного типа детектора, например, одного канала флуоресценции.
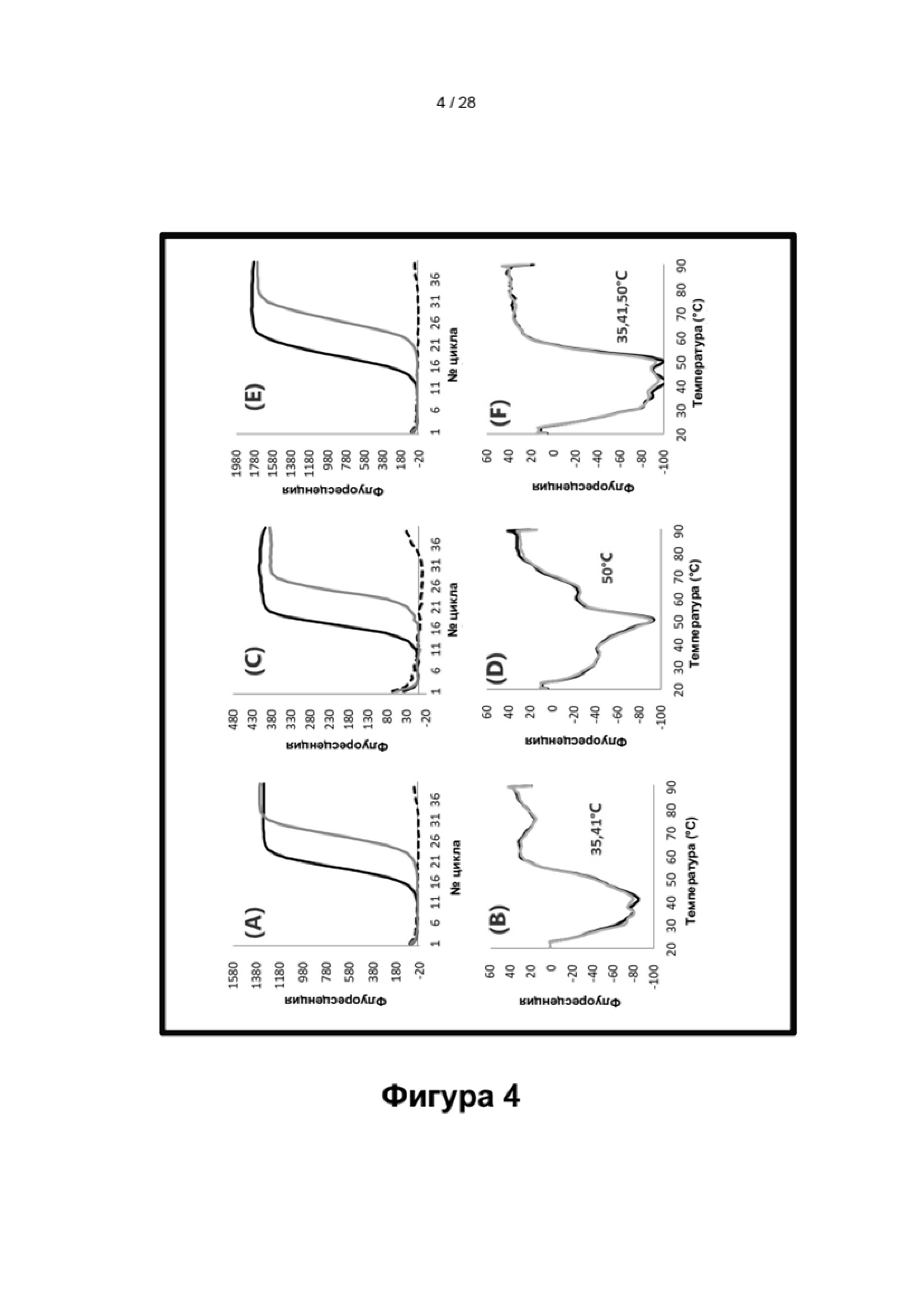
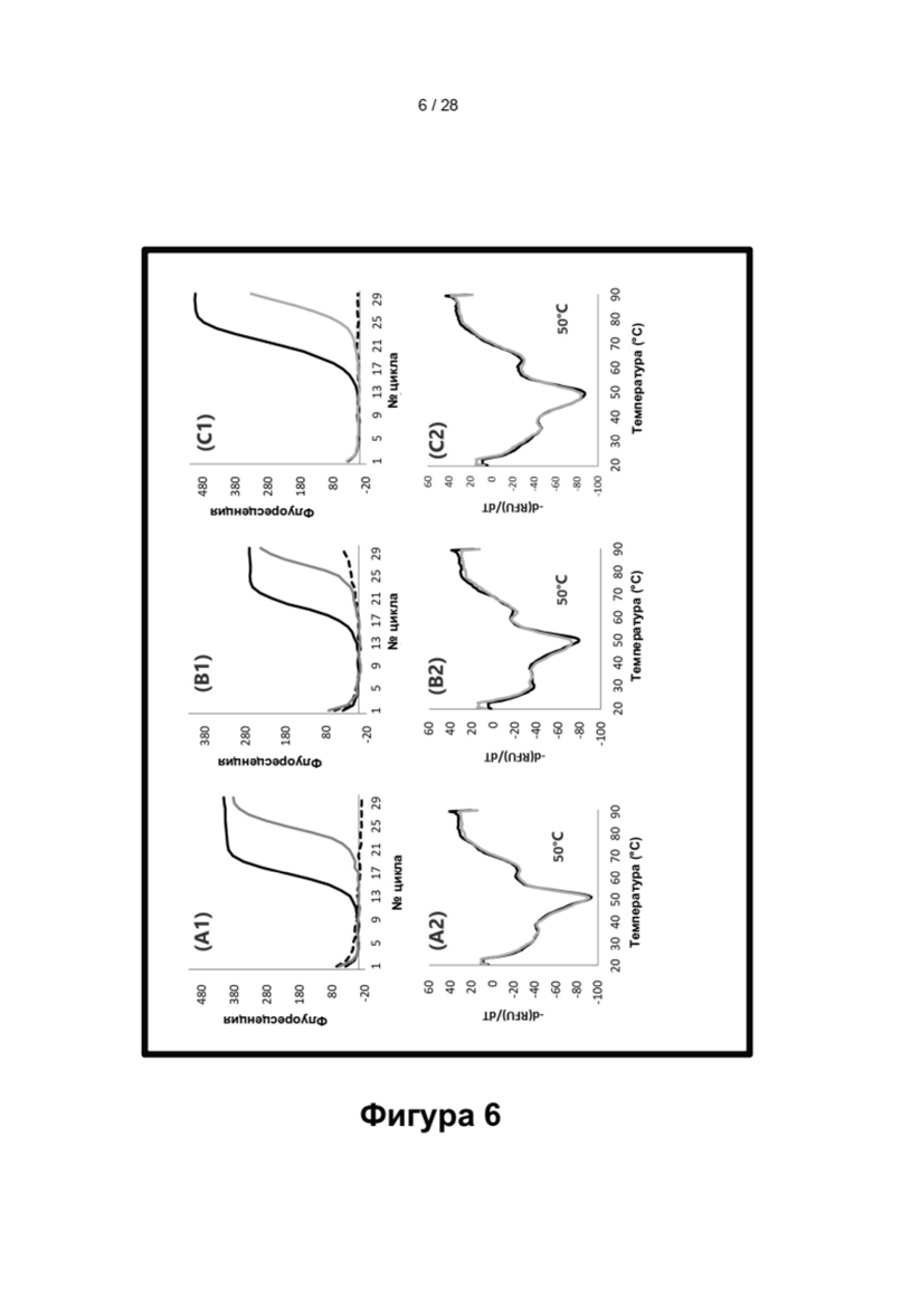
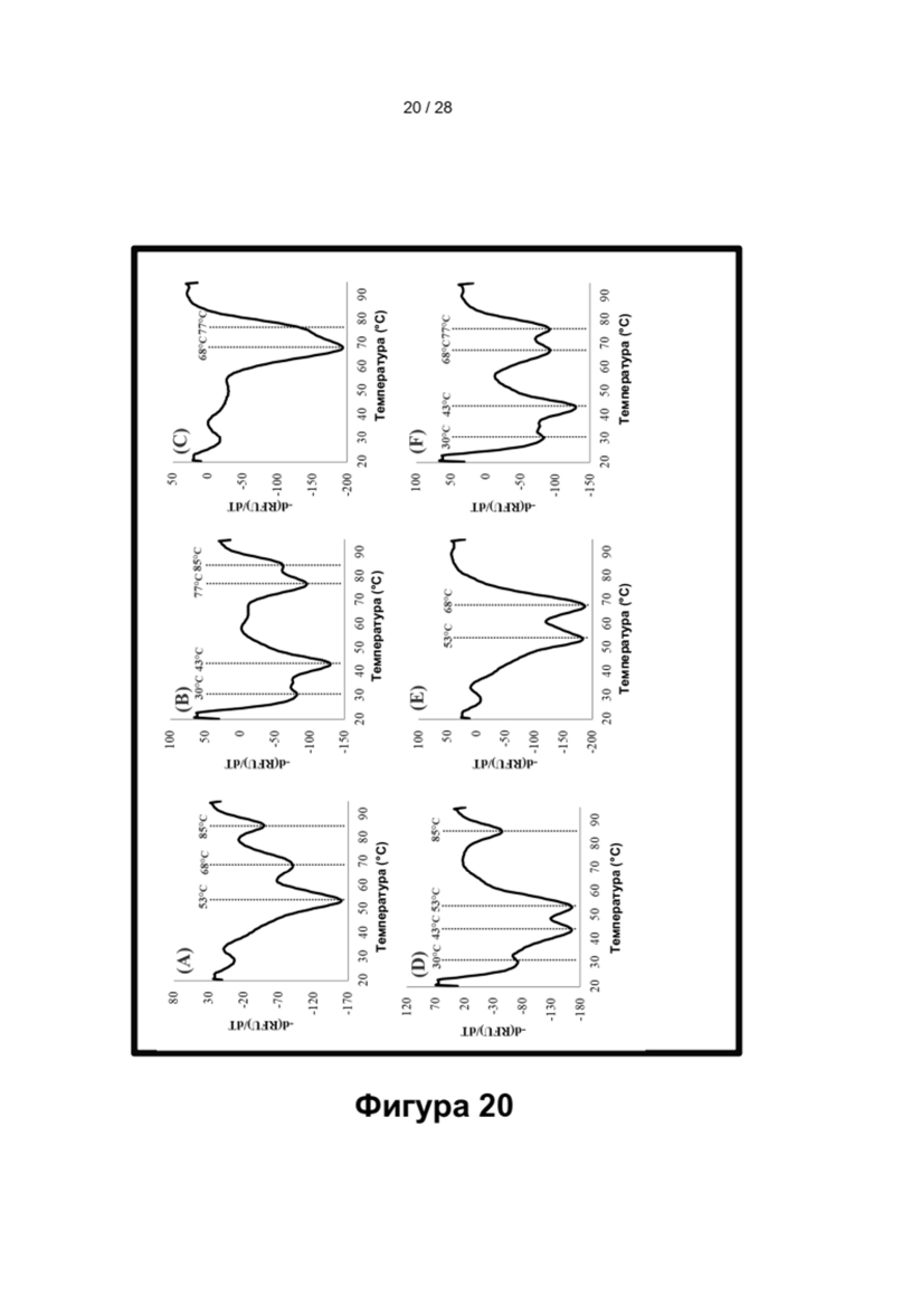
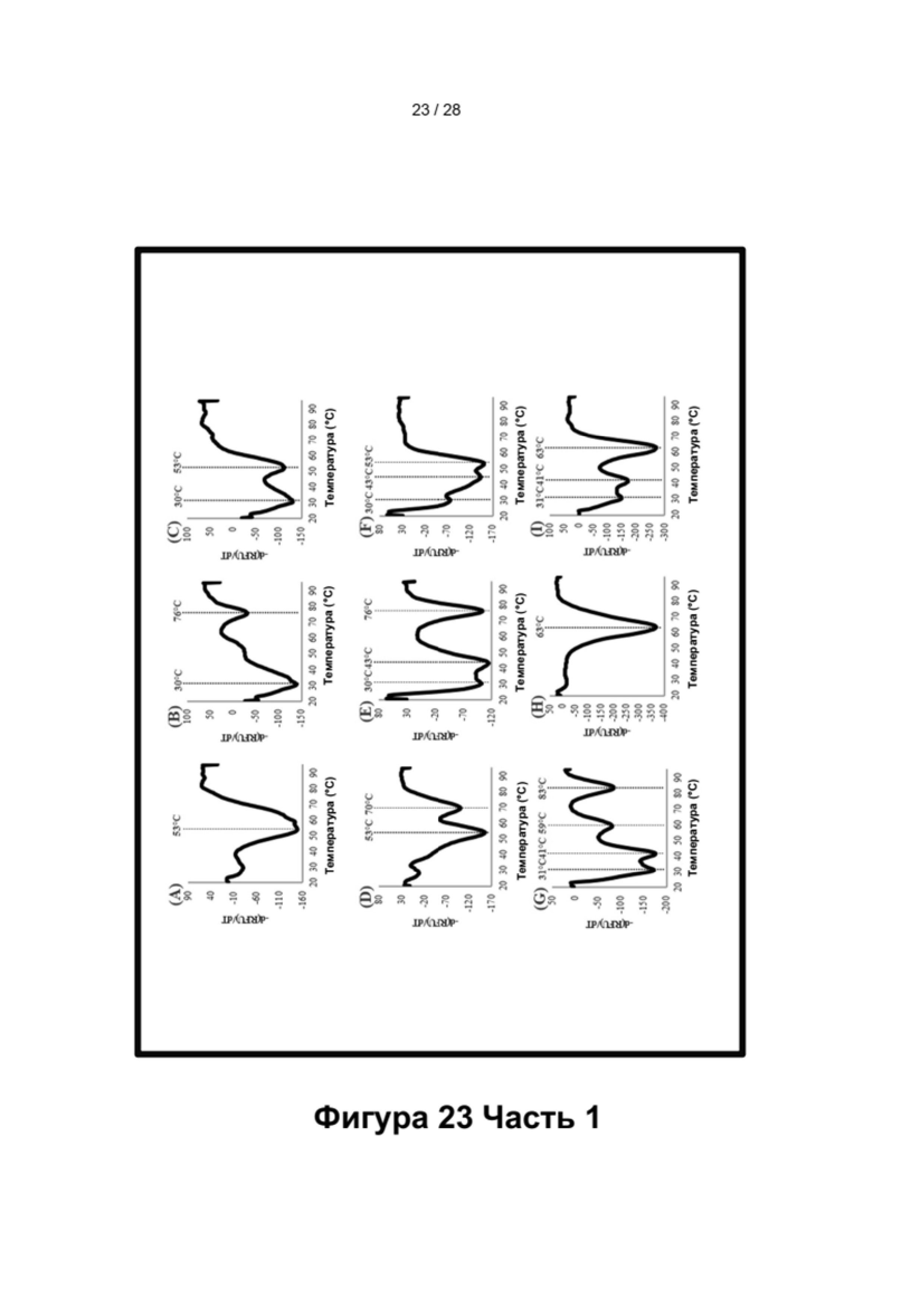
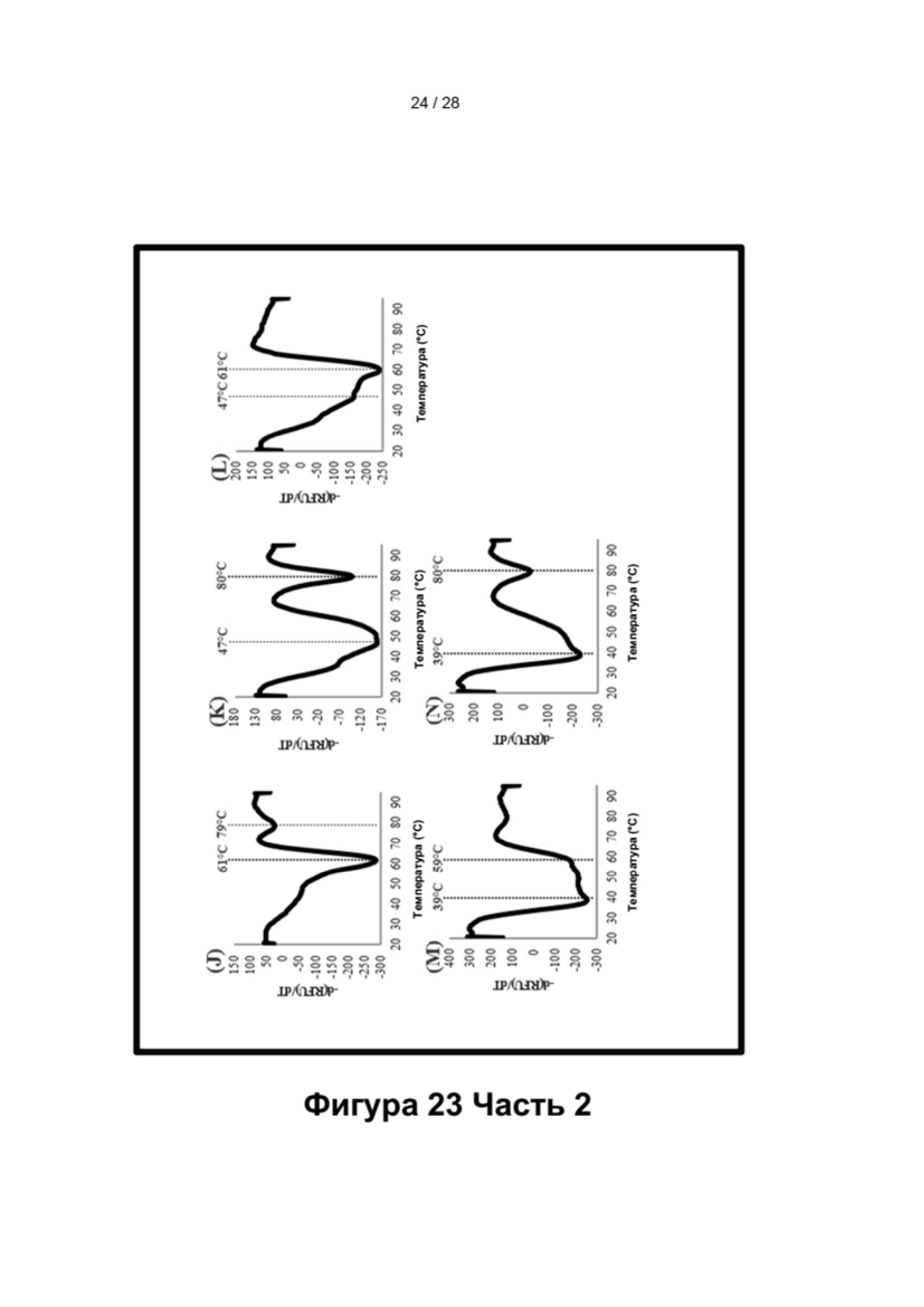
Зависимые от температуры сигналы флуоресценции, продуцируемые репортерами LOCS согласно настоящему изобретению, четко заданы и не зависят от ДНК-мишени. Таким образом, можно получать информацию о ДНК-мишени на основе измерений сигнала флуоресценции, генерируемого при выбранных температурах, а не в диапазоне всего температурного градиента, что дает преимущество в виде снижения времени работы термоциклеров (например, устройств ПЦР). В качестве неограничивающего примера, в системе ПЦР Bio-Rad CFX96 для выполнения традиционного анализа плавления с настройками температуры от 20°С до 90°С с шагом 0,5°С и временем выдержки 5 секунд требуется 141 цикл измерения флуоресценции, что занимает приблизительно 50 минут. При использовании LOCS-зондов информацию о ДНК-мишени можно получить на том же устройстве за 2-6 измерений флуоресценции, что занимает приблизительно 2-5 минут. Без конкретных ограничений, снижение времени работы может быть выгодным при многих вариантах применения, включая, например, диагностику.
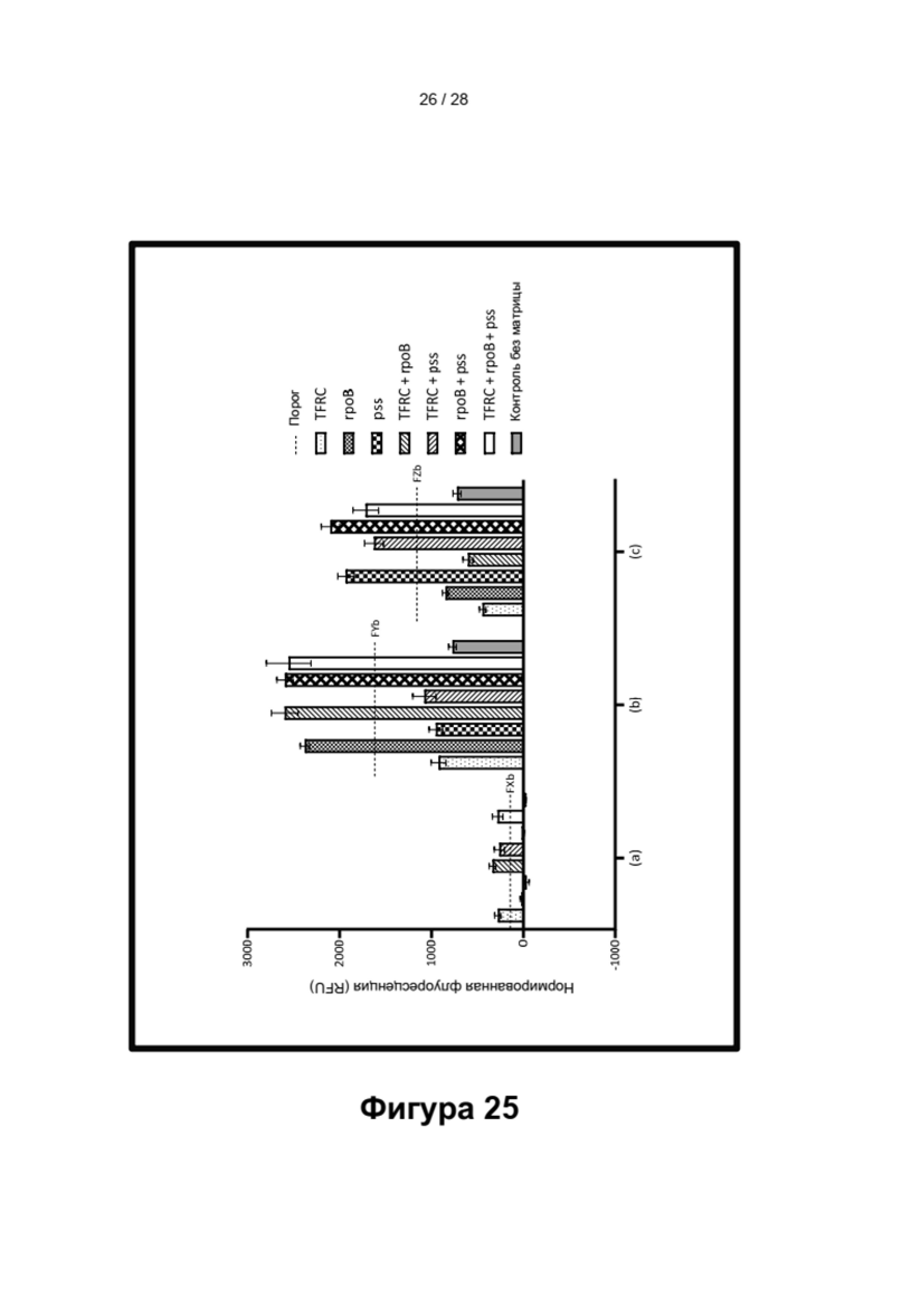
LOCS-зонды согласно настоящему изобретению также можно применять для одновременного обнаружения, дифференциации и/или количественного определения нескольких мишеней на одном канале флуоресценции. При обычной кПЦР количественное определение целевой ДНК выполняют с использованием значения цикла количественного определения (Cq) на основе кривой амплификации, полученной путем измерения флуоресценции при одной температуре в каждом цикле амплификации. Значение Cq пропорционально отрицательному логарифмическому значению концентрации ДНК-мишени, и поэтому по экспериментально определенному значению Cq можно определить эту концентрацию. Однако если в одном канале имеется более одного мишень-специфичного зонда, правильное и специфичное количественное определение каждой мишени сопряжено со сложностями, поскольку трудно определить, исходит ли сигнал от конкретного зонда. Решая эту проблему, LOCS позволяет правильно и точно определять количество более чем одной мишени на одном канале при условии, что кривую амплификации получают путем измерения флуоресценции во время амплификации при более чем одной температуре. Это возможно, поскольку различные LOCS могут давать существенно различающуюся флуоресценцию при различных температурах.
В некоторых вариантах реализации, где для анализа требуется получение флуоресценции лишь в ограниченное количество моментов времени в ходе ПЦР, например, после ПЦР, использование LOCS-структур устраняет необходимость получения данных в каждом цикле. Таким образом, эти варианты реализации хорошо подходят для протоколов с очень быстрой сменой циклов, которые могут сократить время получения результата.
Как отмечалось выше, протоколы анализа кривой плавления подразумевают измерение флуоресценции при различных температурах в постепенно увеличивающемся диапазоне температур (например, между 30°С и 90°С). Затем строят график изменения коэффициента угла наклона этой кривой в зависимости от температуры, получая кривую плавления. Этот процесс часто является медленным и может занимать, например, от 30 до 60 минут. Повышение скорости анализа кривой плавления требует доступа к узкоспециализированным приборам и не достигается с помощью стандартных устройств ПЦР. Таким образом, существует большая потребность в более быстрых альтернативах анализу кривой плавления, которые могут обеспечить одновременное обнаружение нескольких мишеней на одном канале флуоресценции с использованием стандартных инструментов. Температура плавления (Tm) LOCS-структур согласно настоящему изобретению является заранее определенной и постоянной (т.е. не зависит от последовательности-мишени или ее концентрации) и, следовательно, не требует постепенного изменения во всем диапазоне градиента температур. Каждая LOCS-структура требует лишь одного измерения флуоресценции при своей специфичной Tm, что исключает необходимость использования полного градиента температур, ускоряет получение результата и, следовательно, позволяет преодолеть вышеуказанные ограничения.
Кроме того, анализ кривой плавления обычно требует интерпретации квалифицированным персоналом или использования специализированного программного обеспечения для интерпретации результатов.
В некоторых вариантах реализации настоящего изобретения измерение флуоресценции при одной температуре после завершения ПЦР устраняет необходимость в субъективной интерпретации кривых плавления и облегчает объективное определение наличия или отсутствия мишеней.
В других вариантах реализации настоящего изобретения для анализа может потребоваться регистрация флуоресценции только при ограниченном количестве моментов времени в пределах ПЦР, например, после ПЦР, что устраняет необходимость регистрации данных в каждом цикле. Таким образом, эти варианты реализации хорошо подходят для протоколов с очень быстрой сменой циклов, которые могут сократить время получения результата.
Описано несколько способов, включающих регистрацию флуоресценции при нескольких температурах во время ПЦР, включая регистрацию при двух температурах, облегчающую различение полностью совпадающих и несовпадающих зондов. Кроме того, в некоторых протоколах используют несколько температур регистрации после каждого цикла ПЦР для количественного определения концентрации каждой мишени, когда две мишени присутствуют и обнаруживаются на одном канале. Другие способы одновременной количественной оценки двух мишеней достигаются путем построения полной кривой плавления в конце каждого цикла ПЦР.
LOCS-структуры согласно настоящему изобретению могут быть совместимы с большинством (а потенциально - со всеми) из этих существующих способов анализа.
Настоящее изобретение по меньшей мере частично относится к следующим вариантам реализации 1-59:
Вариант реализации 1. Способ определения наличия или отсутствия первой и второй мишеней в образце, причем указанный способ включает:
- получение реакционной смеси путем приведения образца или его производного, предположительно содержащего первую и/или вторую мишени или их ампликоны, в контакт с:
первым и вторым замкнутыми олигонуклеотидами типа "стебель-петля", причем каждый из замкнутых олигонуклеотидов типа "стебель-петля" содержит двуцепочечный стеблевой фрагмент, образованный гибридизированными нуклеотидами и соединенный с замкнутым одноцепочечным петлевым фрагментом, образованным негибридизованными нуклеотидами, причем:
количество гибридизованных нуклеотидов и/или последовательность гибридизованных нуклеотидов в стеблевом фрагменте первого и второго замкнутых олигонуклеотидов типа "стебель-петля" различаются, и
каждый из двуцепочечных стеблевых фрагментов содержит молекулу флуорофора, соединенную с одной цепью, и молекулу гасителя, соединенную с противоположной цепью; и
ферменты, способные расщеплять или разрушать одноцепочечные петлевые фрагменты первого и второго замкнутых олигонуклеотидов типа "стебель-петля" только при их контакте с мишенью или ее ампликоном;
- обработку реакционной смеси:
в условиях, подходящих для того, чтобы ферменты индуцировали расщепление или разрушение петлевого фрагмента первого и второго замкнутых олигонуклеотидов типа "стебель-петля", тем самым образуя первый и второй раскрытые олигонуклеотиды типа "стебель-петля";
- обнаружение наличия или отсутствия указанных первого и второго раскрытых олигонуклеотидов путем обработки реакционной смеси или ее производного при: первой температуре, при которой цепи двуцепочечного стеблевого фрагмента первого раскрытого олигонуклеотида типа "стебель-петля" диссоциируют, тем самым облегчая пространственное разделение молекул флуорофора и гасителя стеблевого фрагмента первого раскрытого олигонуклеотида типа "стебель-петля" и обеспечивая получение первого обнаружимого сигнала, и
второй температуре, при которой цепи двуцепочечного стеблевого фрагмента второго раскрытого олигонуклеотида типа "стебель-петля" диссоциируют, тем самым облегчая пространственное разделение молекул флуорофора и гасителя стеблевого фрагмента второго раскрытого олигонуклеотида типа "стебель-петля" и обеспечивая получение второго обнаружимого сигнала,
причем:
первая температура отличается от второй температуры,
флуорофор первого раскрытого олигонуклеотида типа "стебель-петля" и флуорофор второго раскрытого олигонуклеотида типа "стебель-петля" излучают в одной и той же цветовой области видимого спектра, и
обнаружение сигнала при первой температуре указывает на присутствие первой мишени в образце, а невозможность обнаружения сигнала при первой температуре указывает на отсутствие первой мишени в образце; и
обнаружение сигнала при второй температуре указывает на присутствие второй мишени в образце, а невозможность обнаружения сигнала при второй температуре указывает на отсутствие второй мишени в образце.
Вариант реализации 2. Способ по варианту реализации 1, в котором ферменты содержат многокомпонентные нуклеозимы (МНКзимы), и указанная обработка реакционной смеси включает обработку реакционной смеси в условиях, подходящих для:
связывания первого многокомпонентного нуклеозима (МНКзима) с первой мишенью или его ампликоном и гибридизации субстратных цепей указанного первого МНКзима с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля", что облегчает указанное расщепление петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля" первым МНКзимом с образованием первого раскрытого олигонуклеотида типа "стебель-петля".
Вариант реализации 3. Способ по варианту реализации 2, в котором мишень представляет собой нуклеотидную последовательность или ее ампликон, способный гибридизоваться с сенсорными цепями первого МНКзима, тем самым облегчая сборку первого МНКзима.
Вариант реализации 4. Способ по варианту реализации 1, в котором:
- мишень представляет собой анализируемое вещество, белок, соединение или молекулу;
- ферменты включают ферменты с аптамером, способным связываться с первой мишенью; и
- связывание первой мишени с аптамером способно сделать ферменты с аптамером каталитически активными.
Вариант реализации 5. Способ по варианту реализации 4, в котором ферменты с аптамером включают любой один или более из следующих классов соединений: апта-ДНКзимы, апта-рибозимы, апта-МНКзимы.
Вариант реализации 6. Способ по любому из вариантов реализации 2, 4 или 5, в котором:
- мишень представляет собой анализируемое вещество, белок, соединение или молекулу;
- реакционная смесь дополнительно содержит олигонуклеотидную последовательность, способную гибридизоваться с сенсорными цепями первого МНКзима, тем самым облегчая сборку первого МНКзима;
- первый МНКзим содержит последовательность аптамера, способную связываться с первой мишенью; и
- связывание мишени с аптамером способно сделать первый МНКзим каталитически активным.
Вариант реализации 7. Способ по любому из вариантов реализации 1-6, в котором ферменты включают эндонуклеазы рестрикции, а указанная обработка реакционной смеси включает:
обработку реакционной смеси в условиях, подходящих для гибридизации первой мишени или ее ампликона с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля" с образованием двуцепочечной последовательности для связывания первой эндонуклеазы рестрикции, что облегчает указанное расщепление петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля" с образованием первого раскрытого олигонуклеотида типа "стебель-петля".
Вариант реализации 8. Способ по варианту реализации 7, в котором эндонуклеаза рестрикции представляет собой никующую эндонуклеазу, способную связываться с цепью петли указанной двуцепочечной последовательности для первой эндонуклеазы рестрикции и расщеплять ее.
Вариант реализации 9. Способ по любому из вариантов реализации 1 - 8, в котором ферменты обладают экзонуклеазной активностью (например, ферменты-полимеразы, экзонуклеазы), и указанная обработка реакционной смеси включает:
обработку реакционной смеси в условиях, подходящих для:
- гибридизации первой мишени или ее ампликона с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля" с образованием первой двуцепочечной последовательности, содержащей первую мишень или ее ампликон,
- гибридизации первого праймера-олигонуклеотида с первой мишенью или ее ампликоном с образованием второй двуцепочечной последовательности, расположенной выше (в направлении к 5') относительно первой двуцепочечной последовательности, содержащей первую мишень или ее ампликон,
- ассоциации первого фермента, обладающего экзонуклеазной активностью, с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля" на конце первого праймера-олигонуклеотида или рядом с ним, и
- каталитической активности первого фермента, обладающего экзонуклеазной активностью, что облегчает разрушение петлевого фрагмента первой двуцепочечной последовательности, содержащей первую мишень или ампликон, и образование первого раскрытого олигонуклеотида типа "стебель-петля".
Вариант реализации 10. Способ по любому из вариантов реализации 1 - 9, в котором ферменты обладают экзонуклеазной активностью, а указанная обработка реакционной смеси включает:
обработку реакционной смеси в условиях, подходящих для:
- гибридизации первой мишени или ее ампликона с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля" с образованием первой двуцепочечной последовательности, содержащей первую мишень или ее ампликон,
- ассоциации первого фермента, обладающего экзонуклеазной активностью, с первой двуцепочечной последовательностью, содержащей первую мишень или ее ампликон; и
- каталитической активности первого фермента, обладающего экзонуклеазной активностью, что облегчает разрушение петлевого фрагмента первой двуцепочечной последовательности, содержащей первую мишень или ампликон, и образование первого раскрытого олигонуклеотида типа "стебель-петля".
Вариант реализации 11. Способ по любому из вариантов реализации 1 - 10, в котором ферменты включают ДНКзимы и/или рибозимы, требующие первого кофактора для проявления каталитической активности, и указанная обработка реакционной смеси включает обработку реакционной смеси в условиях, подходящих для:
- связывания указанного первого кофактора с ДНКзимом и/или связывания указанного первого кофактора с рибозимом, придающего каталитическую активность ДНКзиму и/или рибозиму,
- гибридизации ДНКзима и/или рибозима с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля",
- каталитической активности ДНКзима и/или рибозима для облегчения расщепления петлевого фрагмента первого замкнутого олигонуклеотида типа «стебель-петля» и образования первого раскрытого олигонуклеотида типа "стебель-петля".
причем:
первая мишень представляет собой первый кофактор.
Вариант реализации 12. Способ по варианту реализации 11, в котором первый кофактор представляет собой ион металла (например, Mg2+, Mn2+, Са2+, Pb2+).
Вариант реализации 13. Способ по любому из вариантов реализации 1 - 12, в котором указанная обработка дополнительно включает обработку реакционной смеси в условиях, подходящих для любого одного или более из следующих процессов:
- связывания второго МНКзима со второй мишенью или его ампликоном и гибридизации субстратных цепей указанного второго МНКзима с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля", что облегчает указанное расщепление петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля" вторым МНКзимом с образованием второго раскрытого олигонуклеотида типа "стебель-петля";
- гибридизации второй мишени или ее ампликона с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля" с образованием двуцепочечной последовательности для связывания второй эндонуклеазы рестрикции с целью ассоциации со второй двуцепочечной последовательностью, что облегчает указанное расщепление петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля" с образованием второго раскрытого олигонуклеотида типа "стебель-петля".
- гибридизации второй мишени или ее ампликона с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля" с образованием второй двуцепочечной последовательности, содержащей вторую мишень или ее ампликон,
гибридизации второго праймера-олигонуклеотида со второй мишенью или ее ампликоном с образованием второй двуцепочечной последовательности, расположенной выше (в направлении к 5') относительно второй двуцепочечной последовательности, содержащей вторую мишень или ее ампликон,
ассоциации второго фермента, обладающего экзонуклеазной активностью, с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля" на конце второго праймера-олигонуклеотида или рядом с ним, и
каталитической активности второго фермента, обладающего экзонуклеазной активностью, что облегчает разрушение петлевого фрагмента второй двуцепочечной последовательности, содержащей вторую мишень или ампликон, и образование второго раскрытого олигонуклеотида типа "стебель-петля";
- гибридизации второй мишени или ее ампликона с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля" с образованием второй двуцепочечной последовательности, содержащей вторую мишень или ее ампликон,
ассоциации второго фермента, обладающего экзонуклеазной активностью, со второй двуцепочечной последовательностью, содержащей вторую мишень или ее ампликон, и каталитической активности второго фермента, обладающего экзонуклеазной активностью, что облегчает разрушение петлевого фрагмента второй двуцепочечной последовательности, содержащей вторую мишень или ампликон, и образование второго раскрытого олигонуклеотида типа "стебель-петля";
- связывания второго кофактора с ДНКзимом и/или связывания второго кофактора с рибозимом, придающего каталитическую активность ДНКзиму и/или рибозиму,
гибридизации ДНКзима и/или рибозима с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля",
каталитической активности ДНКзима и/или рибозима для облегчения расщепления петлевого фрагмента второго замкнутого олигонуклеотида типа «стебель-петля» и образования второго раскрытого олигонуклеотида типа "стебель-петля".
причем:
вторая мишень представляет собой второй кофактор.
Вариант реализации 14. Способ по варианту реализации 13, в котором второй кофактор представляет собой ион металла (например, Mg2+, Mn2+, Са2+, Pb2+).
Вариант реализации 15. Способ по варианту реализации 13, в котором вторая эндонуклеаза рестрикции представляет собой никующую эндонуклеазу, способную ассоциировать с цепью петли указанной двуцепочечной последовательности, содержащей вторую мишень или ее ампликон, и расщеплять ее.
Вариант реализации 16. Способ по варианту реализации 15, в котором первая и вторая эндонуклеазы рестрикции представляют собой эндонуклеазы рестрикции разного типа.
Вариант реализации 17. Способ по варианту реализации 15, в котором первая и вторая эндонуклеазы рестрикции представляют собой эндонуклеазы рестрикции одного и того же типа.
Вариант реализации 18. Способ по варианту реализации 13, в котором вторая мишень представляет собой нуклеотидную последовательность или ее ампликон, способную гибридизоваться с сенсорными цепями второго МНКзима, тем самым облегчая сборку второго МНКзима.
Вариант реализации 19. Способ по варианту реализации 13, в котором:
- вторая мишень представляет собой анализируемое вещество, белок, соединение или молекулу;
- ферменты включают ферменты с аптамером, способным связываться со второй мишенью; и
- связывание второй мишени с аптамером способно сделать ферменты с аптамером каталитически активными.
Вариант реализации 20. Способ по варианту реализации 19, в котором ферменты с аптамером включают любой один или более из следующих классов соединений: апта-ДНКзимы, апта-рибозимы, апта-МНКзимы.
Вариант реализации 21. Способ по варианту реализации 13, 19 или 20, в котором:
- вторая мишень представляет собой анализируемое вещество, белок, соединение или молекулу;
- реакционная смесь дополнительно содержит олигонуклеотидную последовательность, способную гибридизоваться с сенсорными цепями второго МНКзима, тем самым облегчая сборку второго МНКзима;
- второй МНКзим содержит последовательность аптамера, способную связываться со второй мишенью; и
- связывание второй мишени с аптамерной последовательностью второго МНКзима способно сделать второй МНКзим каталитически активным, облегчая удаление ингибирующей молекулы, связанной с аптамером второго МНКзима.
Вариант реализации 22. Способ по любому из вариантов реализации 1 - 21, в котором флуорофор первого замкнутого и раскрытого олигонуклеотидов типа "стебель-петля" является таким же, как флуорофор второго замкнутого и раскрытого олигонуклеотидов типа "стебель-петля".
Вариант реализации 23. Способ по любому из вариантов реализации 13 - 22, в котором:
- реакционная смесь содержит указанные первый и второй МНКзимы; и
- последовательность петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля", способного гибридизоваться с субстратными цепями первого МНКзима, отличается от последовательности петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля", способного гибридизоваться с субстратными цепями второго МНКзима.
Вариант реализации 24. Способ по любому из вариантов реализации 1 - 23, в котором флуорофор первого замкнутого и раскрытого олигонуклеотидов типа «стебель-петля» и флуорофор второго замкнутого и раскрытого олигонуклеотидов типа «стебель-петля» обнаруживают на одном канале флуоресцентного излучения устройства.
Вариант реализации 25. Способ по любому из вариантов реализации 1 - 24, дополнительно включающий определение наличия или отсутствия третьей мишени или ее ампликона в образце путем:
- приведения реакционной смеси, содержащей образец или его производное, в контакт с:
третьим замкнутым олигонуклеотидом типа "стебель-петля", причем указанный третий замкнутый олигонуклеотид типа "стебель-петля" содержит двуцепочечный стеблевой фрагмент гибридизированных нуклеотидов, соединенный с петлевым фрагментом замкнутого одноцепочечного олигонуклеотид а, состоящего из негибридизованных нуклеотидов, причем:
количество гибрид изо ванных нуклеотидов и/или последовательность гибридизованных нуклеотидов в стеблевом фрагменте третьего замкнутого олигонуклеотида типа "стебель-петля" отличается от количества и последовательности гибридизованных нуклеотидов в стеблевых фрагментах первого и второго замкнутых олигонуклеотидов типа "стебель-петля";
двуцепочечный стеблевой фрагмент содержит молекулу флуорофора, соединенную с одной цепью, и молекулу гасителя, соединенную с противоположной цепью; и
ферменты, способные расщеплять или разрушать одноцепочечный петлевой фрагмент третьего замкнутого олигонуклеотида типа "стебель-петля", только когда он находится в контакте с мишенью или ее ампликоном;
- обработки реакционной смеси в условиях, подходящих для индукции расщепления или разрушения петлевого фрагмента третьего замкнутого олигонуклеотида типа «стебель-петля» ферментами, что позволяет получить третий раскрытый олигонуклеотид типа "стебель-петля";
- обнаружения присутствия или отсутствия третьего олигонуклеотида путем обработки реакционной смеси или ее производного при:
третьей температуре, при которой цепи двуцепочечного стеблевого фрагмента третьего раскрытого олигонуклеотида типа "стебель-петля" диссоциируют, тем самым облегчая пространственное разделение молекул флуорофора и гасителя стеблевого фрагмента третьего раскрытого олигонуклеотида типа "стебель-петля" и обеспечивая получение третьего обнаружимого сигнала,
причем:
третья температура отличается от первой и второй температур, и
обнаружение сигнала при третьей температуре указывает на присутствие третьей мишени в образце, а невозможность обнаружения сигнала при третьей температуре указывает на отсутствие третьей мишени в образце.
Вариант реализации 26. Способ по любому из вариантов реализации 1 - 24, дополнительно включающий определение наличия или отсутствия третьей мишени или ее ампликона в образце путем:
- приведения реакционной смеси, содержащей образец или его производное, в контакт с:
третьим замкнутым олигонуклеотидом типа "стебель-петля", причем указанный третий замкнутый олигонуклеотид типа "стебель-петля" содержит двуцепочечный стеблевой фрагмент гибридизированных нуклеотидов, соединенный с петлевым фрагментом замкнутого одноцепочечного олигонуклеотид а, состоящего из негибридизованных нуклеотидов, причем:
количество гибрид изо ванных нуклеотидов и/или последовательность гибридизованных нуклеотидов в стеблевом фрагменте третьего замкнутого олигонуклеотида типа "стебель-петля" совпадает с количеством и последовательностью гибридизованных нуклеотидов в стеблевых фрагментах первого или второго замкнутых олигонуклеотидов типа "стебель-петля";
двуцепочечный стеблевой фрагмент содержит молекулу флуорофора, соединенную с одной цепью, и молекулу гасителя, соединенную с противоположной цепью, причем молекула флуорофора, соединенная с третьим раскрытым олигонуклеотидом типа "стебель-петля", излучает в другой области видимого спектра по сравнению с флуорофором первого и/или второго замкнутых олигонуклеотидов типа "стебель-петля"; и
ферменты, способные расщеплять или разрушать одноцепочечный петлевой фрагмент третьего замкнутого олигонуклеотида типа "стебель-петля", только когда он находится в контакте с мишенью или ее ампликоном;
- обработки реакционной смеси в условиях, подходящих для индукции расщепления или разрушения петлевого фрагмента третьего замкнутого олигонуклеотида типа «стебель-петля» ферментами, что позволяет получить третий раскрытый олигонуклеотид типа "стебель-петля";
- обнаружения присутствия или отсутствия третьего олигонуклеотида путем обработки реакционной смеси или ее производного при:
третьей температуре, при которой цепи двуцепочечного стеблевого фрагмента третьего раскрытого олигонуклеотида типа "стебель-петля" диссоциируют, тем самым облегчая пространственное разделение молекул флуорофора и гасителя стеблевого фрагмента третьего раскрытого олигонуклеотида типа "стебель-петля" и обеспечивая получение третьего обнаружимого сигнала,
причем:
обнаружение сигнала при третьей температуре указывает на присутствие третьей мишени в образце, а невозможность обнаружения сигнала при третьей температуре указывает на отсутствие третьей мишени в образце.
Вариант реализации 27. Способ по варианту реализации 26, в котором третья температура отличается от первой и/или второй температур.
Вариант реализации 28. Способ по любому из вариантов реализации 25 - 27, в котором указанный способ включает обработку реакционной смеси в условиях, подходящих для любого одного или более из следующих процессов:
- связывания третьего МНКзима со третьей мишенью или его ампликоном и гибридизации субстратных цепей указанного третьего МНКзима с петлевым фрагментом третьего замкнутого олигонуклеотида типа "стебель-петля", что облегчает указанное расщепление петлевого фрагмента третьего замкнутого олигонуклеотида типа "стебель-петля" третьим МНКзимом с образованием третьего раскрытого олигонуклеотида типа "стебель-петля";
- гибридизации третьей мишени или ее ампликона с петлевым фрагментом третьего замкнутого олигонуклеотида типа "стебель-петля" с образованием двуцепочечной последовательности для связывания третьей эндонуклеазы рестрикции с целью ассоциации со второй двуцепочечной последовательностью, что облегчает указанное расщепление петлевого фрагмента третьего замкнутого олигонуклеотида типа "стебель-петля" с образованием третьего раскрытого олигонуклеотида типа "стебель-петля";
- гибридизации третьей мишени или ее ампликона с петлевым фрагментом третьего замкнутого олигонуклеотида типа "стебель-петля" с образованием третьей двуцепочечной последовательности, содержащей третью мишень или ее ампликон,
гибридизации третьего праймера-олигонуклеотида с третьей мишенью или ее ампликоном с образованием третьей двуцепочечной последовательности, расположенной выше (в направлении 5') относительно третьей двуцепочечной последовательности, содержащей третью мишень или ее ампликон, ассоциации третьего фермента, обладающего экзонуклеазной активностью, с петлевым фрагментом третьего замкнутого олигонуклеотида типа "стебель-петля" на конце третьего праймера-олигонуклеотида или рядом с ним, и
каталитической активности третьего фермента, обладающего экзонуклеазной активностью, что облегчает разрушение петлевого фрагмента третьей двуцепочечной последовательности, содержащей третью мишень или ампликон, и образование третьего раскрытого олигонуклеотида типа "стебель-петля";
- гибридизации третьей мишени или ее ампликона с петлевым фрагментом третьего замкнутого олигонуклеотида типа "стебель-петля" с образованием третьей двуцепочечной последовательности, содержащей третью мишень или ее ампликон,
ассоциации третьего фермента, обладающего экзонуклеазной активностью, с третьей двуцепочечной последовательностью, содержащей третью мишень или ее ампликон, и каталитической активности третьего фермента, обладающего экзонуклеазной активностью, что облегчает разрушение петлевого фрагмента третьей двуцепочечной последовательности, содержащей третью мишень или ампликон, и образование третьего раскрытого олигонуклеотида типа "стебель-петля";
- связывания третьего кофактора с ДНКзимом и/или связывания третьего кофактора с рибозимом, что придает каталитическую активность ДНКзиму и/или рибозиму,
гибридизации ДНКзима и/или рибозима с петлевым фрагментом третьего замкнутого олигонуклеотида типа "стебель-петля",
каталитической активности ДНКзима и/или рибозима для облегчения расщепления петлевого фрагмента третьего замкнутого олигонуклеотида типа «стебель-петля» и образования третьего раскрытого олигонуклеотида типа "стебель-петля".
причем:
третья мишень представляет собой третий кофактор.
Вариант реализации 29. Способ по варианту реализации 28, в котором кофактор представляет собой ион металла (например, Mg2+, Mn2+, Са2+, Pb2+).
Вариант реализации 30. Способ по варианту реализации 28, в котором третья эндонуклеаза рестрикции представляет собой никующую эндонуклеазу, способную ассоциировать с цепью петли указанной двуцепочечной последовательности, содержащей третью мишень или ее ампликон, и расщеплять ее.
Вариант реализации 31. Способ по варианту реализации 28, в котором третья мишень представляет собой нуклеотидную последовательность или ее ампликон, способную гибридизоваться с сенсорными цепями третьего МНКзима, тем самым облегчая сборку третьего МНКзима.
Вариант реализации 32. Способ по варианту реализации 28, в котором:
- мишень представляет собой анализируемое вещество, белок, соединение или молекулу;
- ферменты включают ферменты с аптамером, способным связываться с третьей мишенью; и
- связывание третьей мишени с аптамером способно сделать ферменты с аптамером каталитически активными.
Вариант реализации 33. Способ по варианту реализации 32, в котором ферменты с аптамером включают любой один или более из следующих классов соединений: апта-ДНКзимы, апта-рибозимы, апта-МНКзимы.
Вариант реализации 34. Способ по варианту реализации 28, в котором:
- третья мишень представляет собой анализируемое вещество, белок, соединение или молекулу;
- реакционная смесь дополнительно содержит олигонуклеотидную последовательность, способную гибридизоваться с сенсорными цепями третьего МНКзима, тем самым облегчая сборку третьего МНКзима;
- третий МНКзим содержит последовательность аптамера, способную связываться с третьей мишенью; и
- связывание третьей мишени с последовательностью аптамера третьего МНКзима способно сделать третий МНКзим каталитически активным, облегчая удаление ингибирующей молекулы, связанной с аптамером третьего МНКзима.
Вариант реализации 35. Способ по любому из вариантов реализации 28 или 30 - 34. в котором:
- реакционная смесь содержит указанный третий МНКзим и один или оба из указанных первого и второго МНКзимов; и
- последовательность петлевого фрагмента третьего замкнутого олигонуклеотида типа "стебель-петля", способного гибридизоваться с субстратными цепями третьего МНКзима, отличается от:
последовательности петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля", способного гибридизоваться с субстратными цепями первого МНКзима, и/или
последовательности петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля", способного гибридизоваться с субстратными цепями первого МНКзима.
Вариант реализации 36. Способ по любому из вариантов реализации 25 или 28 - 35, в котором:
- количество гибридизованных нуклеотидов и/или последовательность гибридизованных нуклеотидов в стеблевом фрагменте третьего замкнутого олигонуклеотида типа "стебель-петля" отличается от количества и последовательности гибридизованных нуклеотидов в стеблевых фрагментах первого и второго замкнутых олигонуклеотидов типа "стебель-петля";
- третья температура отличается от первой и второй температур; и
- флуорофор третьего замкнутого и раскрытого олигонуклеотида типа «стебель-петля» излучает в той же цветовой области видимого спектра, что и флуорофоры первого и второго замкнутых и раскрытых олигонуклеотидов типа «стебель-петля».
Вариант реализации 37. Способ по любому из вариантов реализации 25 или 28 - 36, в котором флуорофор третьего замкнутого и раскрытого олигонуклеотидов типа "стебель-петля" является таким же, как флуорофор первого и/или второго замкнутого и раскрытого олигонуклеотидов типа "стебель-петля".
Вариант реализации 38. Способ по варианту реализации 37, в котором флуорофор третьего замкнутого и раскрытого олигонуклеотидов типа «стебель-петля» и флуорофор первого замкнутого и раскрытого олигонуклеотидов и/или флуорофор второго замкнутого и раскрытого олигонуклеотидов обнаруживают на одном и том же канале флуоресцентного излучения устройства.
Вариант реализации 39. Способ по любому из вариантов реализации 25 - 35 или 36, в котором:
- флуорофор первого замкнутого и раскрытого олигонуклеотида типа «стебель-петля» излучает в той же цветовой области видимого спектра, что и флуорофор второго замкнутого и раскрытого олигонуклеотида типа «стебель-петля»; и
- флуорофор третьего замкнутого и раскрытого олигонуклеотида типа «стебель-петля» излучает в цветовой области видимого спектра, отличающейся от области излучения флуорофора первого и второго замкнутых и раскрытых олигонуклеотидов типа «стебель-петля».
Вариант реализации 40. Способ по любому из вариантов реализации 25 - 39, в котором третья температура отличается от первой температуры и/или второй температуры более чем на: 1°С, 2°С, 3°С, 4°С, 5°С, 6°С, 7°С, 8°С, 9°С, 10°С, 11°С, 12°С, 13°С, 14°С, 15°С, 16°С, 17°С, 18°С, 19°С, 20°С, 25°С, 30°С, 35°С, 40°С, 45°С, 50°С, 55°С, 60°С, 65°С, 70°С, 75°С, 80°С.
Вариант реализации 41. Способ по любому из вариантов реализации 1 - 40, в котором анализ кривой плавления используют для любого указанного обнаружения сигнала или любой указанной невозможности обнаружения сигнала.
Вариант реализации 42. Способ по любому из вариантов реализации 1 - 41, в котором первая температура отличается от второй температуры более чем на: 1°С, 2°С, 3°С, 4°С, 5°С, 6°С, 7°С, 8°С, 9°С, 10°С, 11°С, 12°С, 13°С, 14°С, 15°С, 16°С, 17°С, 18°С, 19°С, 20°С, 25°С, 30°С, 35°С, 40°С, 45°С, 50°С, 55°С, 60°С, 65°С, 70°С, 75°С, 80°С.
Вариант реализации 43. Способ по любому из вариантов реализации 1 - 42, в котором любой указанный ампликон получен посредством любой из полимеразной цепной реакции (ПЦР), амплификации с замещением цепи (SDA), амплификации, зависимой от хеликазы (HDA), рекомбиназно-полимеразной амплификации (RPA), петлевой изотермической амплификации (LAMP), амплификации по типу катящегося кольца (RCA), транскрипционно-опосредованной амплификации (ТМА), самоподдерживающейся репликации последовательности (3SR), амплификации на основе последовательности нуклеиновой кислоты (NASBA) или полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР).
Вариант реализации 44. Способ по любому из вариантов реализации 1 - 43, в котором образец представляет собой биологический образец, полученный от субъекта.
Вариант реализации 45. Способ по любому из вариантов реализации 1 - 43, в котором способ выполняют in vitro.
Вариант реализации 46. Способ по любому из вариантов реализации 1 - 43, в котором способ выполняют ex vivo.
Вариант реализации 47. Композиция, содержащая:
первый и второй замкнутые олигонуклеотиды типа "стебель-петля", причем каждый из замкнутых олигонуклеотидов типа "стебель-петля" содержит двуцепочечный стеблевой фрагмент, образованный гибридизированными нуклеотидами и соединенный с одноцепочечным петлевым фрагментом, образованным негибридизованными нуклеотидами, причем:
количество гибридизованных нуклеотидов и/или последовательность гибридизованных нуклеотидов в стеблевом фрагменте первого и второго замкнутых олигонуклеотидов типа "стебель-петля" различаются, и
каждый из двуцепочечных стеблевых фрагментов содержит молекулу флуорофора, соединенную с одной цепью, и молекулу гасителя, соединенную с противоположной цепью,
причем молекулы флуорофора излучают в одной и той же цветовой области видимого спектра, а температура плавления (Tm) двуцепочечного стеблевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля" отличается от Tm двуцепочечного стеблевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля".
Вариант реализации 48. Композиция по варианту реализации 47, в которой одноцепочечный петлевой фрагмент первого замкнутого олигонуклеотида типа "стебель-петля" отличается от последовательности одноцепочечного петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля".
Вариант реализации 49. Композиция по варианту реализации 47 или 48, дополнительно содержащая:
первый МНКзим, содержащий субстратные цепи, способные гибридизоваться с замкнутым одноцепочечным петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля"; и
второй МНКзим, содержащий субстратные цепи, способные гибридизоваться с одноцепочечным петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля".
Вариант реализации 50. Композиция по варианту реализации 49, в которой:
субстратные цепи первого МНКзима гибридизируются с одноцепочечным петлевым фрагментом первого замкнутого олигонуклеотида типа «стебель-петля»; и
субстратные цепи второго МНКзима гибридизируются с одноцепочечным петлевым фрагментом второго замкнутого олигонуклеотида типа «стебель-петля».
Вариант реализации 51. Композиция по варианту реализации 50, в которой:
первый и/или второй МНКзимы содержат последовательность аптамера, связанную с анализируемым соединением-мишенью, белком, соединением или молекулой, и сенсорные цепи, гибридизированные с олигонуклеотидной последовательностью; и
первый МНКзим предназначен для обнаружения мишени, отличающейся от мишени второго МНКзима.
Вариант реализации 52. Композиция по варианту реализации 50, в которой:
первый и/или второй МНКзимы содержат сенсорные цепи, гибридизующиеся с последовательностью-мишенью, и первый МНКзим предназначен для обнаружения мишени, отличающейся от мишени второго МНКзима.
Вариант реализации 53. Композиция по любому из вариантов реализации 47 - 52, дополнительно содержащая:
первую олигонуклеотидную последовательность, гибридизующуюся с указанным одноцепочечным петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля", тем самым образуя двуцепочечную последовательность, содержащую указанный первый олигонуклеотид;
вторую олигонуклеотидную последовательность, гибридизующуюся с указанным одноцепочечным петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля", тем самым образуя двуцепочечную последовательность, содержащую указанный второй олигонуклеотид;
эндонуклеазу рестрикции, ассоциированную с двуцепочечной последовательностью, включающую указанный первый олигонуклеотид, и способную расщеплять ее; и/или
эндонуклеазу рестрикции, ассоциированную с двуцепочечной последовательностью, включающую указанный второй олигонуклеотид, и способную расщеплять ее.
Вариант реализации 54. Композиция по любому из вариантов реализации 47 - 53, дополнительно содержащая:
первую двуцепочечную последовательность, содержащую первую олигонуклеотидную последовательность-мишень, гибридизующуюся с указанным одноцепочечным петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля", тем самым образуя первую двуцепочечную последовательность, содержащую указанный первый олигонуклеотид-мишень;
вторую двуцепочечную последовательность, содержащую вторую олигонуклеотидную последовательность-мишень, гибридизующуюся с указанным одноцепочечным петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля", тем самым образуя двуцепочечную последовательность, содержащую указанный второй олигонуклеотид-мишень;
первый праймер-олигонуклеотид, гибрид изующийся с первым олигонуклеотидом-мишенью выше (в направлении 5') относительно указанной первой двуцепочечной последовательности, и первый фермент, обладающий экзонуклеазной активностью (например, полимераза, экзонуклеаза), ассоциированный с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля" на конце первого праймера-олигонуклеотида или рядом с ним; и/или
второй праймер-олигонуклеотид, гибрид изующийся со вторым олигонуклеотидом-мишенью выше (в направлении 5') относительно указанной второй двуцепочечной последовательности, и второй фермент, обладающий экзонуклеазной активностью (например, полимераза, экзонуклеаза), ассоциированный с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля" на конце второго праймера-олигонуклеотида
Вариант реализации 55. Композиция по любому из вариантов реализации 47 - 54, дополнительно содержащая:
первую двуцепочечную последовательность, содержащую первую олигонуклеотидную последовательность-мишень, гибридизующуюся с указанным одноцепочечным петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля", тем самым образуя первую двуцепочечную последовательность, содержащую указанный первый олигонуклеотид-мишень;
вторую двуцепочечную последовательность, содержащую вторую олигонуклеотидную последовательность-мишень, гибридизующуюся с указанным одноцепочечным петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля", тем самым образуя двуцепочечную последовательность, содержащую указанный второй олигонуклеотид-мишень;
причем первый фермент, обладающий экзонуклеазной активностью, ассоциирован с первой двуцепочечной последовательностью, а второй фермент, обладающий экзонуклеазной активностью, ассоциирован со второй двуцепочечной последовательностью.
Вариант реализации 56. Композиция по любому из вариантов реализации 47 - 55, дополнительно содержащая:
первый ДНКзим и/или первый рибозим, гибридизующийся с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля",
второй ДНКзим и/или второй рибозим, гибридизующийся с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля",
кофакторы для каждого указанного ДНКзима, способные придать каждому указанному ДНКзиму каталитическую активность и, таким образом, индуцировать расщепляющую активность любого указанного ДНКзима, гибридизованного с петлевым фрагментом.
кофакторы для каждого указанного рибозима, способные придать каждому указанному рибозиму каталитическую активность и, таким образом, индуцировать расщепляющую активность любого указанного рибозима, гибридизованного с петлевым фрагментом.
Вариант реализации 57. Композиция по любому из вариантов реализации 47 - 56, дополнительно содержащая:
третьи замкнутые олигонуклеотиды типа "стебель-петля", причем указанные третьи замкнутые олигонуклеотиды типа "стебель-петля" содержат двуцепочечный стеблевой фрагмент из гибридизированных нуклеотидов, соединенный с одноцепочечным петлевым фрагментом, состоящим из негибридизованных нуклеотидов, причем:
количество гибрид изо ванных нуклеотидов и/или последовательность гибридизованных нуклеотидов в стеблевом фрагменте третьих замкнутых олигонуклеотидов типа "стебель-петля" отличается от количества и последовательности гибридизованных нуклеотидов в стеблевых фрагментах первого и второго замкнутых олигонуклеотидов типа "стебель-петля", и
двуцепочечный стеблевой фрагмент третьих замкнутых олигонуклеотидов типа "стебель-петля" содержит молекулу флуорофора, соединенную с одной цепью, и молекулу гасителя, соединенную с противоположной цепью, причем молекула флуорофора третьего замкнутого олигонуклеотида типа "стебель-петля" излучает в другой области видимого спектра по сравнению с молекулами флуорофора первого и второго замкнутых олигонуклеотидов типа "стебель-петля".
Вариант реализации 58. Композиция по любому из вариантов реализации 47 - 56, дополнительно содержащая:
третьи замкнутые олигонуклеотиды типа "стебель-петля", причем указанные третьи замкнутые олигонуклеотиды типа "стебель-петля" содержат двуцепочечный стеблевой фрагмент из гибридизированных нуклеотидов, соединенный с одноцепочечным петлевым фрагментом, состоящим из негибридизованных нуклеотидов, причем:
количество гибридизованных нуклеотидов и/или последовательность гибридизованных нуклеотидов в стеблевом фрагменте третьих замкнутых олигонуклеотидов типа "стебель-петля" отличается от количества и последовательности гибридизованных нуклеотидов в стеблевых фрагментах первого и второго замкнутых олигонуклеотидов типа "стебель-петля", и
двуцепочечный стеблевой фрагмент третьих замкнутых олигонуклеотидов типа "стебель-петля" содержит молекулу флуорофора, соединенную с одной цепью, и молекулу гасителя, соединенную с противоположной цепью, причем молекула флуорофора третьего замкнутого олигонуклеотида типа "стебель-петля" излучает в той же области видимого спектра по сравнению с молекулами флуорофора первого и второго замкнутых олигонуклеотидов типа "стебель-петля".
Вариант реализации 59. Композиция по любому из вариантов реализации 47-56, дополнительно содержащая:
третьи замкнутые олигонуклеотиды типа "стебель-петля", причем указанные третьи замкнутые олигонуклеотиды типа "стебель-петля" содержат двуцепочечный стеблевой фрагмент из гибридизированных нуклеотидов, соединенный с одноцепочечным петлевым фрагментом, состоящим из негибридизованных нуклеотидов, причем:
количество гибрид изо ванных нуклеотидов и/или последовательность гибридизованных нуклеотидов в стеблевом фрагменте третьих замкнутых олигонуклеотидов типа "стебель-петля" совпадает с количеством и последовательностью гибридизованных нуклеотидов в стеблевых фрагментах первого или второго замкнутых олигонуклеотидов типа "стебель-петля", и
двуцепочечный стеблевой фрагмент третьих замкнутых олигонуклеотидов типа "стебель-петля" содержит молекулу флуорофора, соединенную с одной цепью, и молекулу гасителя, соединенную с противоположной цепью, причем молекула флуорофора третьего замкнутого олигонуклеотида типа "стебель-петля" излучает в другой области видимого спектра по сравнению с молекулами флуорофора первого и второго замкнутых олигонуклеотидов типа "стебель-петля".
Настоящее изобретение также относится к вариантам реализации 1-81, перечисленным ниже:
Вариант реализации 1. Способ определения наличия или отсутствия первой и второй мишеней в образце, причем указанный способ включает:
(а) получение реакционной смеси путем приведения образца или его производного, предположительно содержащего первую и/или вторую мишени или их ампликоны, в контакт с:
первым и вторым замкнутыми олигонуклеотидами типа "стебель-петля", причем каждый из замкнутых олигонуклеотидов типа "стебель-петля" содержит двуцепочечный стеблевой фрагмент, образованный гибридизированными нуклеотидами и соединенный с замкнутым одноцепочечным петлевым фрагментом, образованным негибридизованными нуклеотидами, причем:
количество гибридизованных нуклеотидов и/или последовательность гибридизованных нуклеотидов в стеблевом фрагменте первого и второго замкнутых олигонуклеотидов типа "стебель-петля" различаются, и
ферменты, способные расщеплять или разрушать одноцепочечные петлевые фрагменты первого и второго замкнутых олигонуклеотидов типа "стебель-петля" только при их контакте с мишенью или ее ампликоном;
(b) обработку реакционной смеси:
- в условиях, подходящих для того, чтобы ферменты индуцировали расщепление или разрушение петлевого фрагмента первого и второго замкнутых олигонуклеотидов типа "стебель-петля", тем самым образуя первый и второй раскрытые олигонуклеотиды типа "стебель-петля";
- при первой температуре, при которой или выше которой цепи двуцепочечного стеблевого фрагмента первого раскрытого олигонуклеотида типа "стебель-петля" диссоциируют, тем самым облегчая пространственное разделение молекул флуорофора и гасителя стеблевого фрагмента первого раскрытого олигонуклеотида типа "стебель-петля" и обеспечивая получение первого обнаружимого сигнала, и
- при второй температуре, при которой или выше которой цепи двуцепочечного стеблевого фрагмента второго раскрытого олигонуклеотида типа "стебель-петля" диссоциируют, тем самым облегчая пространственное разделение молекул флуорофора и гасителя стеблевого фрагмента второго раскрытого олигонуклеотида типа "стебель-петля" и обеспечивая получение второго обнаружимого флуоресцентного сигнала;
причем:
первая температура ниже, чем вторая температура, и
флуорофор первого раскрытого олигонуклеотида типа "стебель-петля" и флуорофор второго раскрытого олигонуклеотида типа "стебель-петля" излучают в одной и той же цветовой области видимого спектра; и
(c) обнаружение уровней указанных первого и второго флуоресцентных сигналов при одной или более температурах, включая температуру, равную второй температуре или превышающую ее, что позволяет определять наличие или отсутствие указанных мишеней в образце.
Вариант реализации 2. Способ по варианту реализации 1, в котором ферменты содержат многокомпонентные нуклеозимы (МНКзимы), и указанная обработка реакционной смеси включает обработку реакционной смеси в условиях, подходящих для:
связывания первого многокомпонентного нуклеозима (МНКзима) с первой мишенью или его ампликоном и гибридизации субстратных цепей указанного первого МНКзима с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля", что облегчает указанное расщепление петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля" первым МНКзимом с образованием первого раскрытого олигонуклеотида типа "стебель-петля".
Вариант реализации 3. Способ по варианту реализации 2, в котором первая мишень представляет собой нуклеотидную последовательность или ее ампликон, способный гибридизоваться с сенсорными цепями первого МНКзима, тем самым облегчая сборку первого МНКзима.
Вариант реализации 4. Способ по варианту реализации 1, в котором:
- первая мишень представляет собой анализируемое вещество, белок, соединение или молекулу;
- ферменты включают ферменты с аптамером, способным связываться с первой мишенью; и
- связывание первой мишени с аптамером способно сделать ферменты с аптамером каталитически активными.
Вариант реализации 5. Способ по варианту реализации 4, в котором ферменты с аптамером включают любой один или более из следующих классов соединений: апта-ДНКзимы, апта-рибозимы, апта-МНКзимы.
Вариант реализации 6. Способ по любому из вариантов реализации 2, 4 или 5, в котором:
- первая мишень представляет собой анализируемое вещество, белок, соединение или молекулу;
- реакционная смесь дополнительно содержит олигонуклеотидную последовательность, способную гибридизоваться с сенсорными цепями первого МНКзима, тем самым облегчая сборку первого МНКзима;
- первый МНКзим содержит последовательность аптамера, способную связываться с первой мишенью; и
- связывание мишени с аптамером способно сделать первый МНКзим каталитически активным.
Вариант реализации 7. Способ по любому из вариантов реализации 1 - 6, в котором указанные замкнутые олигонуклеотиды типа "стебель-петля" не гибридизуются с указанной мишенью или ее ампликоном во время указанного расщепления или разрушения ферментами.
Вариант реализации 8. Способ по любому из вариантов реализации 1 - 6, в котором ферменты включают эндонуклеазы рестрикции, а указанная обработка реакционной смеси включает:
обработку реакционной смеси в условиях, подходящих для гибридизации первой мишени или ее ампликона с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля" с образованием двуцепочечной последовательности для связывания первой эндонуклеазы рестрикции, что облегчает указанное расщепление петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля" с образованием первого раскрытого олигонуклеотида типа "стебель-петля".
Вариант реализации 9. Способ по варианту реализации 8, в котором эндонуклеаза рестрикции представляет собой никующую эндонуклеазу, способную связываться с цепью петли указанной двуцепочечной последовательности для первой эндонуклеазы рестрикции и расщеплять ее.
Вариант реализации 10. Способ по любому из вариантов реализации 1 - 6, в котором ферменты обладают экзонуклеазной активностью (например, ферменты-полимеразы, экзонуклеазы), и указанная обработка реакционной смеси включает:
обработку реакционной смеси в условиях, подходящих для:
- гибридизации первой мишени или ее ампликона с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля" с образованием первой двуцепочечной последовательности, содержащей первую мишень или ее ампликон,
- гибридизации первого праймера-олигонуклеотида с первой мишенью или ее ампликоном с образованием второй двуцепочечной последовательности, расположенной выше (в направлении к 5') относительно первой двуцепочечной последовательности, содержащей первую мишень или ее ампликон
- ассоциации первого фермента, обладающего экзонуклеазной активностью, с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля" на конце первого праймера-олигонуклеотида или рядом с ним, и
- каталитической активности первого фермента, обладающего экзонуклеазной активностью, что облегчает разрушение петлевого фрагмента первой двуцепочечной последовательности, содержащей первую мишень или ампликон, и образование первого раскрытого олигонуклеотида типа "стебель-петля".
Вариант реализации 11. Способ по любому из вариантов реализации 1 - 6, в котором ферменты обладают экзонуклеазной активностью, а указанная обработка реакционной смеси включает:
обработку реакционной смеси в условиях, подходящих для:
- гибридизации первой мишени или ее ампликона с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля" с образованием первой двуцепочечной последовательности, содержащей первую мишень или ее ампликон,
- ассоциации первого фермента, обладающего экзонуклеазной активностью, с первой двуцепочечной последовательностью, содержащей первую мишень или ее ампликон, и
- каталитической активности первого фермента, обладающего экзонуклеазной активностью, что облегчает разрушение петлевого фрагмента первой двуцепочечной последовательности, содержащей первую мишень или ампликон, и образование первого раскрытого олигонуклеотида типа "стебель-петля".
Вариант реализации 12. Способ по любому из вариантов реализации 1 - 11, в котором ферменты включают ДНКзимы и/или рибозимы, требующие первого кофактора для проявления каталитической активности, и указанная обработка реакционной смеси включает обработку реакционной смеси в условиях, подходящих для:
- связывания указанного первого кофактора с ДНКзимом и/или связывания указанного первого кофактора с рибозимом, придающего каталитическую активность ДНКзиму и/или рибозиму,
- гибридизации ДНКзима и/или рибозима с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля",
- каталитической активности ДНКзима и/или рибозима для облегчения расщепления петлевого фрагмента первого замкнутого олигонуклеотида типа «стебель-петля» и образования первого раскрытого олигонуклеотида типа "стебель-петля".
причем:
первая мишень представляет собой первый кофактор.
Вариант реализации 13. Способ по варианту реализации 12, в котором первый кофактор представляет собой ион металла (например, Mg2+, Mn2+, Са2+, Pb2+).
Вариант реализации 14. Способ по любому из вариантов реализации 1 - 13, в котором указанная обработка дополнительно включает обработку реакционной смеси в условиях, подходящих для любого одного или более из следующих процессов:
- связывания второго МНКзима со второй мишенью или его ампликоном и гибридизации субстратных цепей указанного второго МНКзима с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля", что облегчает указанное расщепление петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля" вторым МНКзимом с образованием второго раскрытого олигонуклеотида типа "стебель-петля";
- гибридизации второй мишени или ее ампликона с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля" с образованием двуцепочечной последовательности для связывания второй эндонуклеазы рестрикции с целью ассоциации со второй двуцепочечной последовательностью, что облегчает указанное расщепление петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля" с образованием второго раскрытого олигонуклеотида типа "стебель-петля",
- гибридизации второй мишени или ее ампликона с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля" с образованием второй двуцепочечной последовательности, содержащей вторую мишень или ее ампликон,
гибридизации второго праймера-олигонуклеотида со второй мишенью или ее ампликоном с образованием второй двуцепочечной последовательности, расположенной выше (в направлении к 5') относительно второй двуцепочечной последовательности, содержащей вторую мишень или ее ампликон,
ассоциации второго фермента, обладающего экзонуклеазной активностью, с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля" на конце второго праймера-олигонуклеотида или рядом с ним, и
каталитической активности второго фермента, обладающего экзонуклеазной активностью, что облегчает разрушение петлевого фрагмента второй двуцепочечной последовательности, содержащей вторую мишень или ампликон, и образование второго раскрытого олигонуклеотида типа "стебель-петля";
- гибридизации второй мишени или ее ампликона с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля" с образованием второй двуцепочечной последовательности, содержащей вторую мишень или ее ампликон,
ассоциации второго фермента, обладающего экзонуклеазной активностью, со второй двуцепочечной последовательностью, содержащей вторую мишень или ее ампликон, и
каталитической активности второго фермента, обладающего экзонуклеазной активностью, что облегчает разрушение петлевого фрагмента второй двуцепочечной последовательности, содержащей вторую мишень или ампликон, и образование второго раскрытого олигонуклеотида типа "стебель-петля";
- связывания второго кофактора с ДНКзимом и/или связывания второго кофактора с рибозимом, придающего каталитическую активность ДНКзиму и/или рибозиму,
гибридизации ДНКзима и/или рибозима с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля",
каталитической активности ДНКзима и/или рибозима для облегчения расщепления петлевого фрагмента второго замкнутого олигонуклеотида типа «стебель-петля» и образования второго раскрытого олигонуклеотида типа "стебель-петля".
причем:
вторая мишень представляет собой второй кофактор.
Вариант реализации 15. Способ по варианту реализации 14, в котором второй кофактор представляет собой ион металла (например, Mg2+, Mn2+, Са2+, Pb2+).
Вариант реализации 16. Способ по варианту реализации 14, в котором вторая эндонуклеаза рестрикции представляет собой никующую эндонуклеазу, способную ассоциировать с цепью петли указанной двуцепочечной последовательности, содержащей вторую мишень или ее ампликон, и расщеплять ее.
Вариант реализации 17. Способ по варианту реализации 16, в котором первая и вторая эндонуклеазы рестрикции представляют собой эндонуклеазы рестрикции разного типа.
Вариант реализации 18. Способ по варианту реализации 16, в котором первая и вторая эндонуклеазы рестрикции представляют собой эндонуклеазы рестрикции одного и того же типа.
Вариант реализации 19. Способ по варианту реализации 14, в котором вторая мишень представляет собой нуклеотидную последовательность или ее ампликон, способную гибридизоваться с сенсорными цепями второго МНКзима, тем самым облегчая сборку второго МНКзима.
Вариант реализации 20. Способ по варианту реализации 14, в котором:
- вторая мишень представляет собой анализируемое вещество, белок, соединение или молекулу;
- ферменты включают ферменты с аптамером, способным связываться со второй мишенью; и
- связывание второй мишени с аптамером способно сделать ферменты с аптамером каталитически активными.
Вариант реализации 21. Способ по варианту реализации 20, в котором ферменты с аптамером включают любой один или более из следующих классов соединений: апта-ДНКзимы, апта-рибозимы, апта-МНКзимы.
Вариант реализации 22. Способ по варианту реализации 14, 20 или 21, в котором:
- вторая мишень представляет собой анализируемое вещество, белок, соединение или молекулу;
- реакционная смесь дополнительно содержит олигонуклеотидную последовательность, способную гибридизоваться с сенсорными цепями второго МНКзима, тем самым облегчая сборку второго МНКзима;
- второй МНКзим содержит последовательность аптамера, способную связываться со второй мишенью; и
- связывание второй мишени с аптамерной последовательностью второго МНКзима способно сделать второй МНКзим каталитически активным, облегчая удаление ингибирующей молекулы, связанной с аптамером второго МНКзима.
Вариант реализации 23. Способ по любому из вариантов реализации 1-22, в котором флуорофор первого замкнутого и раскрытого олигонуклеотидов типа "стебель-петля" является таким же, как флуорофор второго замкнутого и раскрытого олигонуклеотидов типа "стебель-петля".
Вариант реализации 24. Способ по любому из вариантов реализации 14-23, в котором:
- реакционная смесь содержит указанные первый и второй МНКзимы; и
- последовательность петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля", способного гибридизоваться с субстратными цепями первого МНКзима, отличается от последовательности петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля", способного гибридизоваться с субстратными цепями второго МНКзима.
Вариант реализации 25. Способ по любому из вариантов реализации 1-24, в котором флуорофор первого замкнутого и раскрытого олигонуклеотидов типа «стебель-петля» и флуорофор второго замкнутого и раскрытого олигонуклеотидов типа «стебель-петля» обнаруживают на одном канале флуоресцентного излучения устройства.
Вариант реализации 26. Способ по любому из вариантов реализации 1-25, в котором указанные ферменты не индуцируют расщепление или разрушение любой указанной мишени или ее ампликона.
Вариант реализации 27. Способ по любому из вариантов реализации 1-26, в котором каждый из первого и второго замкнутых олигонуклеотидов типа "стебель-петля" состоит из указанного двуцепочечного стеблевого фрагмента и указанного одноцепочечного петлевого фрагмента.
Вариант реализации 28. Способ по любому из вариантов реализации 1-27, дополнительно включающий определение наличия или отсутствия третьей мишени или ее ампликона в образце путем:
(d) приведения реакционной смеси, содержащей образец или его производное, в контакт с:
третьим замкнутым олигонуклеотидом типа "стебель-петля", причем указанный третий замкнутый олигонуклеотид типа "стебель-петля" содержит двуцепочечный стеблевой фрагмент гибридизированных нуклеотидов, соединенный с петлевым фрагментом замкнутого одноцепочечного олигонуклеотида, состоящего из негибридизованных нуклеотидов, причем:
количество гибридизованных нуклеотидов и/или последовательность гибридизованных нуклеотидов в стеблевом фрагменте третьего замкнутого олигонуклеотида типа "стебель-петля" отличается от количества и последовательности гибридизованных нуклеотидов в стеблевых фрагментах первого и второго замкнутых олигонуклеотидов типа "стебель-петля";
двуцепочечный стеблевой фрагмент содержит молекулу флуорофора, соединенную с одной цепью, и молекулу гасителя, соединенную с противоположной цепью; и
ферменты, способные расщеплять или разрушать одноцепочечный петлевой фрагмент третьего замкнутого олигонуклеотида типа "стебель-петля", только когда он находится в контакте с мишенью или ее ампликоном;
(e) обработку реакционной смеси:
в условиях, подходящих для индукции расщепления или разрушения петлевого фрагмента третьего замкнутого олигонуклеотида типа «стебель-петля» ферментами, что позволяет получить третий раскрытый олигонуклеотид типа "стебель-петля";
при третьей температуре, при которой или выше которой цепи двуцепочечного стеблевого фрагмента третьего раскрытого олигонуклеотида типа "стебель-петля" диссоциируют, тем самым облегчая пространственное разделение молекул флуорофора и гасителя стеблевого фрагмента третьего раскрытого олигонуклеотида типа "стебель-петля" и обеспечивая получение третьего обнаружимого флуоресцентного сигнала; причем:
третья температура выше, чем первая и вторая температуры, и
(f) обнаружение уровней указанных первого, второго и третьего флуоресцентных сигналов при одной или более температурах, включая температуру, равную третьей температуре или превышающую ее, что позволяет определять наличие или отсутствие указанных мишеней в образце.
Вариант реализации 29. Способ по любому из вариантов реализации 1-27, дополнительно включающий определение наличия или отсутствия третьей мишени или ее ампликона в образце путем:
(d) приведения реакционной смеси, содержащей образец или его производное, в контакт с:
третьим замкнутым олигонуклеотидом типа "стебель-петля", причем указанный третий замкнутый олигонуклеотид типа "стебель-петля" содержит двуцепочечный стеблевой фрагмент гибридизированных нуклеотидов, соединенный с петлевым фрагментом замкнутого одноцепочечного олигонуклеотида, состоящего из негибридизованных нуклеотидов, причем:
количество гибридизованных нуклеотидов и/или последовательность гибридизованных нуклеотидов в стеблевом фрагменте третьего замкнутого олигонуклеотида типа "стебель-петля" совпадает с количеством и последовательностью гибридизованных нуклеотидов в стеблевых фрагментах первого или второго замкнутых олигонуклеотидов типа "стебель-петля";
двуцепочечный стеблевой фрагмент содержит молекулу флуорофора, соединенную с одной цепью, и молекулу гасителя, соединенную с противоположной цепью, причем молекула флуорофора, соединенная с третьим раскрытым олигонуклеотидом типа "стебель-петля", излучает в другой области видимого спектра по сравнению с флуорофором первого и/или второго замкнутых олигонуклеотидов типа "стебель-петля"; и
ферменты, способные расщеплять или разрушать одноцепочечный петлевой фрагмент третьего замкнутого олигонуклеотида типа "стебель-петля", только когда он находится в контакте с мишенью или ее ампликоном;
(e) обработку реакционной смеси:
- в условиях, подходящих для индукции расщепления или разрушения петлевого фрагмента третьего замкнутого олигонуклеотида типа «стебель-петля» ферментами, что позволяет получить третий раскрытый олигонуклеотид типа "стебель-петля";
- при третьей температуре, при которой цепи двуцепочечного стеблевого фрагмента третьего раскрытого олигонуклеотида типа "стебель-петля" диссоциируют, тем самым облегчая пространственное разделение молекул флуорофора и гасителя стеблевого фрагмента третьего раскрытого олигонуклеотида типа "стебель-петля" и обеспечивая получение третьего обнаружимого флуоресцентного сигнала;
(f) обнаружение уровней указанных первого, второго и третьего флуоресцентных сигналов при одной или более температурах, включая температуру, равную третьей температуре или превышающую ее, что позволяет определять наличие или отсутствие указанных мишеней в образце.
Вариант реализации 30. Способ по варианту реализации 29, в котором третья температура отличается от первой и/или второй температур.
Вариант реализации 31. Способ по любому из вариантов реализации 28-30, в котором указанный способ включает обработку реакционной смеси в условиях, подходящих для любого одного или более из следующих процессов:
- связывания третьего МНКзима с третьей мишенью или его ампликоном и гибридизации субстратных цепей указанного третьего МНКзима с петлевым фрагментом третьего замкнутого олигонуклеотида типа "стебель-петля", что облегчает указанное расщепление петлевого фрагмента третьего замкнутого олигонуклеотида типа "стебель-петля" третьим МНКзимом с образованием третьего раскрытого олигонуклеотида типа "стебель-петля";
- гибридизации третьей мишени или ее ампликона с петлевым фрагментом третьего замкнутого олигонуклеотида типа "стебель-петля" с образованием двуцепочечной последовательности для связывания третьей эндонуклеазы рестрикции с целью ассоциации со второй двуцепочечной последовательностью, что облегчает указанное расщепление петлевого фрагмента третьего замкнутого олигонуклеотида типа "стебель-петля" с образованием третьего раскрытого олигонуклеотида типа "стебель-петля";
- гибридизации третьей мишени или ее ампликона с петлевым фрагментом третьего замкнутого олигонуклеотида типа "стебель-петля" с образованием третьей двуцепочечной последовательности, содержащей третью мишень или ее ампликон,
гибридизации третьего праймера-олигонуклеотида с третьей мишенью или ее ампликоном с образованием третьей двуцепочечной последовательности, расположенной выше (в направлении 5') относительно третьей двуцепочечной последовательности, содержащей третью мишень или ее ампликон, ассоциации третьего фермента, обладающего экзонуклеазной активностью, с петлевым фрагментом третьего замкнутого олигонуклеотида типа "стебель-петля" на конце третьего праймера-олигонуклеотида или рядом с ним, и
каталитической активности третьего фермента, обладающего экзонуклеазной активностью, что облегчает разрушение петлевого фрагмента третьей двуцепочечной последовательности, содержащей третью мишень или ампликон, и образование третьего раскрытого олигонуклеотида типа "стебель-петля";
- гибридизации третьей мишени или ее ампликона с петлевым фрагментом третьего замкнутого олигонуклеотида типа "стебель-петля" с образованием третьей двуцепочечной последовательности, содержащей третью мишень или ее ампликон,
ассоциации третьего фермента, обладающего экзонуклеазной активностью, с третьей двуцепочечной последовательностью, содержащей третью мишень или ее ампликон, и
каталитической активности третьего фермента, обладающего экзонуклеазной активностью, что облегчает разрушение петлевого фрагмента третьей двуцепочечной последовательности, содержащей третью мишень или ампликон, и образование третьего раскрытого олигонуклеотида типа "стебель-петля";
- связывания третьего кофактора с ДНКзимом и/или связывания третьего кофактора с рибозимом, что придает каталитическую активность ДНКзиму и/или рибозиму,
гибридизации ДНКзима и/или рибозима с петлевым фрагментом третьего замкнутого олигонуклеотида типа "стебель-петля",
каталитической активности ДНКзима и/или рибозима для облегчения расщепления петлевого фрагмента третьего замкнутого олигонуклеотида типа «стебель-петля» и образования третьего раскрытого олигонуклеотида типа "стебель-петля".
причем:
третья мишень представляет собой третий кофактор.
Вариант реализации 32. Способ по варианту реализации 31, в котором кофактор представляет собой ион металла (например, Mg2+, Mn2+, Са2+, Pb2+).
Вариант реализации 33. Способ по варианту реализации 31, в котором третья эндонуклеаза рестрикции представляет собой никующую эндонуклеазу, способную ассоциировать с цепью петли указанной двуцепочечной последовательности, содержащей третью мишень или ее ампликон, и расщеплять ее.
Вариант реализации 34. Способ по варианту реализации 31, в котором третья мишень представляет собой нуклеотидную последовательность или ее ампликон, способную гибридизоваться с сенсорными цепями третьего МНКзима, тем самым облегчая сборку третьего МНКзима.
Вариант реализации 35. Способ по варианту реализации 31, в котором:
- мишень представляет собой анализируемое вещество, белок, соединение или молекулу;
- ферменты включают ферменты с аптамером, способным связываться с третьей мишенью; и
- связывание третьей мишени с аптамером способно сделать ферменты с аптамером каталитически активными.
Вариант реализации 36. Способ по варианту реализации 35, в котором ферменты с аптамером включают любой один или более из следующих классов соединений: апта-ДНКзимы, апта-рибозимы, апта-МНКзимы.
Вариант реализации 37. Способ по варианту реализации 31, в котором:
- третья мишень представляет собой анализируемое вещество, белок, соединение или молекулу;
- реакционная смесь дополнительно содержит олигонуклеотидную последовательность, способную гибридизоваться с сенсорными цепями третьего МНКзима, тем самым облегчая сборку третьего МНКзима;
- третий МНКзим содержит последовательность аптамера, способную связываться с третьей мишенью; и
- связывание третьей мишени с последовательностью аптамера третьего МНКзима способно сделать третий МНКзим каталитически активным, облегчая удаление ингибирующей молекулы, связанной с аптамером третьего МНКзима.
Вариант реализации 38. Способ по любому из вариантов реализации 31 или 33-37, в котором:
- реакционная смесь содержит указанный третий МНКзим и один или оба из указанных первого и второго МНКзимов; и
- последовательность петлевого фрагмента третьего замкнутого олигонуклеотида типа "стебель-петля", способного гибридизоваться с субстратными цепями третьего МНКзима, отличается от:
последовательности петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля", способного гибридизоваться с субстратными цепями первого МНКзима, и/или
последовательности петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля", способного гибридизоваться с субстратными цепями первого МНКзима.
Вариант реализации 39. Способ по любому из вариантов реализации 28 или 31-38, в котором:
- количество гибридизованных нуклеотидов и/или последовательность гибридизованных нуклеотидов в стеблевом фрагменте третьего замкнутого олигонуклеотида типа "стебель-петля" отличается от количества и последовательности гибридизованных нуклеотидов в стеблевых фрагментах первого и второго замкнутых олигонуклеотидов типа "стебель-петля";
- третья температура отличается от первой и второй температур; и
- флуорофор третьего замкнутого и раскрытого олигонуклеотида типа «стебель-петля» излучает в той же цветовой области видимого спектра, что и флуорофоры первого и второго замкнутых и раскрытых олигонуклеотидов типа «стебель-петля».
Вариант реализации 40. Способ по любому из вариантов реализации 28 или 31-39, в котором флуорофор третьего замкнутого и раскрытого олигонуклеотидов типа "стебель-петля" является таким же, как флуорофор первого и/или второго замкнутого и раскрытого олигонуклеотидов типа "стебель-петля".
Вариант реализации 41. Способ по варианту реализации 40, в котором флуорофор третьего замкнутого и раскрытого олигонуклеотидов типа «стебель-петля» и флуорофор первого замкнутого и раскрытого олигонуклеотидов и/или флуорофор второго замкнутого и раскрытого олигонуклеотидов типа «стебель-петля» обнаруживают на одном и том же канале излучения флуоресценции устройства.
Вариант реализации 42. Способ по любому из вариантов реализации 28-38 или 39, в котором:
- флуорофор первого замкнутого и раскрытого олигонуклеотида типа «стебель-петля» излучает в той же цветовой области видимого спектра, что и флуорофор второго замкнутого и раскрытого олигонуклеотида типа «стебель-петля»; и
- флуорофор третьего замкнутого и раскрытого олигонуклеотида типа «стебель-петля» излучает в цветовой области видимого спектра, отличающейся от области излучения флуорофора первого и второго замкнутых и раскрытых олигонуклеотидов типа «стебель-петля».
Вариант реализации 43. Способ по любому из вариантов реализации 28-42, в котором первая температура отличается от первой температуры и/или второй температуры более чем на: 1°С, 2°С, 3°С, 4°С, 5°С, 6°С, 7°С, 8°С, 9°С, 10°С, 11°С, 12°С, 13°С, 14°С, 15°С, 16°С, 17°С, 18°С, 19°С, 20°С, 25°С, 30°С, 35°С, 40°С, 45°С, 50°С, 55°С, 60°С, 65°С, 70°С, 75°С, 80°С.
Вариант реализации 44. Способ по любому из вариантов реализации 28-43, в котором обнаружение третьего флуоресцентного сигнала при третьей температуре указывает на присутствие третьей мишени в образце, а невозможность обнаружения третьего флуоресцентного сигнала при третьей температуре указывает на отсутствие третьей мишени в образце.
Вариант реализации 45. Способ по любому из вариантов реализации 1-44, в котором:
(i) определение наличия первого флуоресцентного сигнала при первой температуре указывает на присутствие первой мишени в образце, а определение отсутствия первого флуоресцентного сигнала указывает на отсутствие первой мишени в образце; и
(ii) определение наличия второго флуоресцентного сигнала при второй температуре указывает на присутствие второй мишени в образце, а определение отсутствия второго флуоресцентного сигнала указывает на отсутствие второй мишени в образце.
Вариант реализации 46. Способ по любому из вариантов реализации 1-44, в котором указанное определение наличия или отсутствия первой и второй мишеней включает анализ кривой плавления с использованием указанных первого и второго флуоресцентных сигналов.
Вариант реализации 47. Способ по любому из вариантов реализации 1-44, в котором часть (с) включает обнаружение уровней указанного первого и второго флуоресцентных сигналов при:
- температуре, равной или превышающей вторую температуру; и
- температуре, равной или превышающей первую температуру, и не достигающей второй температуры.
Вариант реализации 48. Способ по варианту реализации 47, в котором часть (с) дополнительно включает обнаружение уровней указанного первого и второго флуоресцентных сигналов при температуре, не достигающей второй температуры.
Вариант реализации 49. Способ по варианту реализации 47 или варианту реализации 48, в котором часть (с) включает обнаружение уровней указанного первого и второго флуоресцентных сигналов во время и/или по завершении реакции амплификации нуклеиновой кислоты.
Вариант реализации 50. Способ по любому из вариантов реализации 47-49, дополнительно включающий получение флуоресцентного сигнала положительного контроля первой мишени с использованием известной концентрации первой мишени и/или известной концентрации первого замкнутого олигонуклеотида типа "стебель-петля".
Вариант реализации 51. Способ по любому из вариантов реализации 47-50, дополнительно включающий получение флуоресцентного сигнала положительного контроля первой мишени путем повторного выполнения указанного способа на отдельном контрольном образце, содержащем указанную первую мишень.
Вариант реализации 52. Способ по варианту реализации 51, в котором контрольный образец, содержащий первую мишень, содержит первую мишень в известной концентрации.
Вариант реализации 53. Способ по варианту реализации 51 или варианту реализации 52, в котором контрольный образец, содержащий первую мишень, дополнительно содержит указанную вторую мишень.
Вариант реализации 54. Способ по любому из вариантов реализации 46-53, дополнительно включающий получение флуоресцентного сигнала положительного контроля второй мишени путем повторного выполнения указанного способа на отдельном контрольном образце, содержащем указанную вторую мишень.
Вариант реализации 55. Способ по варианту реализации 54, в котором контрольный образец, содержащий вторую мишень, содержит вторую мишень в известной концентрации.
Вариант реализации 56. Способ по варианту реализации 54 или варианту реализации 55, в котором указанный контрольный образец дополнительно содержит указанную первую мишень.
Вариант реализации 57. Способ по любому из вариантов реализации 46-53, дополнительно включающий получение флуоресцентного сигнала объединенного положительного контроля путем повторного выполнения указанного способа на отдельном контрольном образце, содержащем указанную первую и указанную вторую мишени.
Вариант реализации 58. Способ по варианту реализации 57, в котором объединенный контрольный образец содержит первую мишень в известной концентрации и/или вторую мишень в известной концентрации.
Вариант реализации 59. Способ по любому из вариантов реализации 50-58, дополнительно включающий нормировку указанного первого флуоресцентного сигнала и/или указанного второго флуоресцентного сигнала с использованием любого указанного флуоресцентного сигнала положительного контроля.
Вариант реализации 60. Способ по любому из вариантов реализации 46-59, дополнительно включающий получение флуоресцентного сигнала отрицательного контроля путем повторного выполнения способа по любому из вариантов реализации 1-3 на отдельном отрицательном контрольном образце, не содержащем:
(i) указанной первой мишени; или
(ii) указанной второй мишени; или
(iii) указанной первой мишени или указанной второй мишени.
Вариант реализации 61. Способ по варианту реализации 60, дополнительно включающий нормировку указанного первого флуоресцентного сигнала и/или указанного второго флуоресцентного сигнала с использованием указанного флуоресцентного сигнала отрицательного контроля.
Вариант реализации 62. Способ по любому из вариантов реализации 46 - 61, дополнительно включающий сравнение указанного первого и/или второго флуоресцентных сигналов с пороговым значением, причем:
- пороговое значение получают с использованием флуоресцентных сигналов, полученных при анализе серии образцов, протестированных в соответствии со способом по любому из вариантов реализации 1-3, и включающих любой один или более из:
(i) контроля, не содержащего матрицы, и первой мишени,
(ii) контроля, не содержащего матрицы, и второй мишени,
(iii) контроля, не содержащего матрицы, первой мишени и второй мишени,
что позволяет определить указанное наличие или отсутствие первой и второй мишеней в образце.
Вариант реализации 63. Способ по варианту реализации 62, в котором серию образцов тестируют с использованием указанного первого замкнутого олигонуклеотида "стебель-петля" в известной концентрации и/или указанного второго замкнутого олигонуклеотида "стебель-петля" в известной концентрации.
Вариант реализации 64. Способ по любому из вариантов реализации 1-63, в котором первая температура отличается от второй температуры более чем на: 1°С, 2°С, 3°С, 4°С, 5°С, 6°С, 7°С, 8°С, 9°С, 10°С, 11°С, 12°С, 13°С, 14°С, 15°С, 16°С, 17°С, 18°С, 19°С, 20°С, 25°С, 30°С, 35°С, 40°С, 45°С, 50°С, 55°С, 60°С, 65°С, 70°С, 75°С, 80°С.
Вариант реализации 65. Способ по любому из вариантов реализации 1-64, в котором любой указанный ампликон получен посредством любой из полимеразной цепной реакции (ПЦР), амплификации с замещением цепи (SDA), амплификации, зависимой от хеликазы (HDA), рекомбиназно-полимеразной амплификации (RPA), петлевой изотермической амплификации (LAMP), амплификации по типу катящегося кольца (RCA), транскрипционно-опосредованной амплификации (ТМА), самоподдерживающейся репликации последовательности (3SR), амплификации на основе последовательности нуклеиновой кислоты (NASBA) или полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР).
Вариант реализации 66. Способ по любому из вариантов реализации 1 - 65, в котором образец представляет собой биологический образец, полученный от субъекта.
Вариант реализации 67. Способ по любому из вариантов реализации 1 - 65, в котором способ выполняют in vitro.
Вариант реализации 68. Способ по любому из вариантов реализации 1 - 65, в котором способ выполняют ex vivo.
Вариант реализации 69. Композиция, содержащая:
первый и второй замкнутые олигонуклеотиды типа "стебель-петля", причем каждый из замкнутых олигонуклеотидов типа "стебель-петля" содержит двуцепочечный стеблевой фрагмент, образованный гибридизированными нуклеотидами и соединенный с одноцепочечным петлевым фрагментом, образованным негибридизованными нуклеотидами, причем:
количество гибридизованных нуклеотидов и/или
последовательность гибридизованных нуклеотидов в стеблевом фрагменте первого и второго замкнутых олигонуклеотидов типа "стебель-петля" различаются, и
каждый из двуцепочечных стеблевых фрагментов содержит молекулу флуорофора, соединенную с одной цепью, и молекулу гасителя, соединенную с противоположной цепью,
причем молекулы флуорофора излучают в одной и той же цветовой области видимого спектра, а температура плавления (Tm) двуцепочечного стеблевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля" отличается от Tm двуцепочечного стеблевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля".
Вариант реализации 70. Композиция по варианту реализации 69, в которой одноцепочечный петлевой фрагмент первого замкнутого олигонуклеотида типа "стебель-петля" отличается от последовательности одноцепочечного петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля".
Вариант реализации 71. Композиция по варианту 69 или 70, дополнительно содержащая:
первый МНКзим, содержащий субстратные цепи, способные гибридизоваться с замкнутым одноцепочечным петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля"; и
второй МНКзим, содержащий субстратные цепи, способные гибридизоваться с одноцепочечным петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля".
Вариант реализации 72. Композиция по варианту реализации 71, в которой:
субстратные цепи первого МНКзима гибридизируются с одноцепочечным петлевым фрагментом первого замкнутого олигонуклеотида типа «стебель-петля»; и
субстратные цепи второго МНКзима гибридизируются с одноцепочечным петлевым фрагментом второго замкнутого олигонуклеотида типа «стебель-петля».
Вариант реализации 73. Композиция по варианту реализации 72, в которой:
первый и/или второй МНКзимы содержат последовательность аптамера, связанную с анализируемым соединением-мишенью, белком, соединением или молекулой, и сенсорные цепи, гибридизированные с олигонуклеотидной последовательностью; и
первый МНКзим предназначен для обнаружения мишени, отличающейся от мишени второго МНКзима.
Вариант реализации 74. Композиция по варианту реализации 72, в которой:
первый и/или второй МНКзимы содержат сенсорные цепи, гибридизующиеся с последовательностью-мишенью, и первый МНКзим предназначен для обнаружения мишени, отличающейся от мишени второго МНКзима.
Вариант реализации 75. Композиция по любому из вариантов реализации 69 - 74, дополнительно содержащая:
первую олигонуклеотидную последовательность, гибридизующуюся с указанным одноцепочечным петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля", тем самым образуя двуцепочечную последовательность, содержащую указанный первый олигонуклеотид;
вторую олигонуклеотидную последовательность, гибридизующуюся с указанным одноцепочечным петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля", тем самым образуя двуцепочечную последовательность, содержащую указанный второй олигонуклеотид;
эндонуклеазу рестрикции, ассоциированную с двуцепочечной последовательностью, включающую указанный первый олигонуклеотид, и способную расщеплять ее; и/или
эндонуклеазу рестрикции, ассоциированную с двуцепочечной последовательностью, включающую указанный второй олигонуклеотид, и способную расщеплять ее.
Вариант реализации 76. Композиция по любому из вариантов реализации 69 - 75, дополнительно содержащая:
первую двуцепочечную последовательность, содержащую первую олигонуклеотидную последовательность-мишень, гибридизующуюся с указанным одноцепочечным петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля", тем самым образуя первую двуцепочечную последовательность, содержащую указанный первый олигонуклеотид-мишень;
вторую двуцепочечную последовательность, содержащую вторую олигонуклеотидную последовательность-мишень, гибридизующуюся с указанным одноцепочечным петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля", тем самым образуя двуцепочечную последовательность, содержащую указанный второй олигонуклеотид-мишень;
первый праймер-олигонуклеотид, гибридизующийся с первым олигонуклеотидом-мишенью выше (в направлении 5') относительно указанной первой двуцепочечной последовательности, и первый фермент, обладающий экзонуклеазной активностью (например, полимераза, экзонуклеаза), ассоциированный с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля" на конце первого праймера-олигонуклеотида или рядом с ним; и/или
второй праймер-олигонуклеотид, гибридизующийся со вторым олигонуклеотидом-мишенью выше (в направлении 5') относительно указанной второй двуцепочечной последовательности, и второй фермент, обладающий экзонуклеазной активностью (например, полимераза, экзонуклеаза), ассоциированный с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля" на конце второго праймера-олигонуклеотида
Вариант реализации 77. Композиция по любому из вариантов реализации 69 - 76, дополнительно содержащая:
первую двуцепочечную последовательность, содержащую первую олигонуклеотидную последовательность-мишень, гибридизующуюся с указанным одноцепочечным петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля", тем самым образуя первую двуцепочечную последовательность, содержащую указанный первый олигонуклеотид-мишень;
вторую двуцепочечную последовательность, содержащую вторую олигонуклеотидную последовательность-мишень, гибридизующуюся с указанным одноцепочечным петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля", тем самым образуя двуцепочечную последовательность, содержащую указанный второй олигонуклеотид-мишень;
причем первый фермент, обладающий экзонуклеазной активностью, ассоциирован с первой двуцепочечной последовательностью, а второй фермент, обладающий экзонуклеазной активностью, ассоциирован со второй двуцепочечной последовательностью.
Вариант реализации 78. Композиция по любому из вариантов реализации 69 - 77, дополнительно содержащая:
первый ДНКзим и/или первый рибозим, гибридизующийся с петлевым фрагментом первого замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента второго замкнутого олигонуклеотида типа "стебель-петля",
второй ДНКзим и/или второй рибозим, гибридизующийся с петлевым фрагментом второго замкнутого олигонуклеотида типа "стебель-петля", отличающимся от последовательности одноцепочечного петлевого фрагмента первого замкнутого олигонуклеотида типа "стебель-петля",
кофакторы для каждого указанного ДНКзима, способные придать каждому указанному ДНКзиму каталитическую активность и, таким образом, индуцировать расщепляющую активность любого указанного ДНКзима, гибридизованного с петлевым фрагментом.
кофакторы для каждого указанного рибозима, способные придать каждому указанному рибозиму каталитическую активность и, таким образом, индуцировать расщепляющую активность любого указанного рибозима, гибридизованного с петлевым фрагментом.
Вариант реализации 79. Композиция по любому из вариантов реализации 69 - 78, дополнительно содержащая:
третьи замкнутые олигонуклеотиды типа "стебель-петля", причем указанные третьи замкнутые олигонуклеотиды типа "стебель-петля" содержат двуцепочечный стеблевой фрагмент из гибридизированных нуклеотидов, соединенный с одноцепочечным петлевым фрагментом, состоящим из негибридизованных нуклеотидов, причем:
количество гибридизованных нуклеотидов и/или
последовательность гибридизованных нуклеотидов в стеблевом фрагменте третьих замкнутых олигонуклеотидов типа "стебель-петля" отличается от количества и последовательности гибридизованных нуклеотидов в стеблевых фрагментах первого и второго замкнутых олигонуклеотидов типа "стебель-петля", и
двуцепочечный стеблевой фрагмент третьих замкнутых олигонуклеотидов типа "стебель-петля" содержит молекулу флуорофора, соединенную с одной цепью, и молекулу гасителя, соединенную с противоположной цепью, причем молекула флуорофора третьего замкнутого олигонуклеотида типа "стебель-петля" излучает в другой области видимого спектра по сравнению с молекулами флуорофора первого и второго замкнутых олигонуклеотидов типа "стебель-петля".
Вариант реализации 80. Композиция по любому из вариантов реализации 69 - 78, дополнительно содержащая:
третьи замкнутые олигонуклеотиды типа "стебель-петля", причем указанные третьи замкнутые олигонуклеотиды типа "стебель-петля" содержат двуцепочечный стеблевой фрагмент из гибридизированных нуклеотидов, соединенный с одноцепочечным петлевым фрагментом, состоящим из негибридизованных нуклеотидов, причем:
количество гибридизованных нуклеотидов и/или
последовательность гибридизованных нуклеотидов в стеблевом фрагменте третьих замкнутых олигонуклеотидов типа "стебель-петля" отличается от количества и последовательности гибридизованных нуклеотидов в стеблевых фрагментах первого и второго замкнутых олигонуклеотидов типа "стебель-петля", и
двуцепочечный стеблевой фрагмент третьих замкнутых олигонуклеотидов типа "стебель-петля" содержит молекулу флуорофора, соединенную с одной цепью, и молекулу гасителя, соединенную с противоположной цепью, причем молекула флуорофора третьего замкнутого олигонуклеотида типа "стебель-петля" излучает в той же области видимого спектра по сравнению с молекулами флуорофора первого и второго замкнутых олигонуклеотидов типа "стебель-петля".
Вариант реализации 81. Композиция по любому из вариантов реализации 69 - 78, дополнительно содержащая:
третьи замкнутые олигонуклеотиды типа "стебель-петля", причем указанные третьи замкнутые олигонуклеотиды типа "стебель-петля" содержат двуцепочечный стеблевой фрагмент из гибридизированных нуклеотидов, соединенный с одноцепочечным петлевым фрагментом, состоящим из негибридизованных нуклеотидов, причем:
количество гибридизованных нуклеотидов и/или последовательность гибридизованных нуклеотидов в стеблевом фрагменте третьих замкнутых олигонуклеотидов типа "стебель-петля" совпадает с количеством и последовательностью гибридизованных нуклеотидов в стеблевых фрагментах первого или второго замкнутых олигонуклеотидов типа "стебель-петля", и
двуцепочечный стеблевой фрагмент третьих замкнутых олигонуклеотидов типа "стебель-петля" содержит молекулу флуорофора, соединенную с одной цепью, и молекулу гасителя, соединенную с противоположной цепью, причем молекула флуорофора третьего замкнутого олигонуклеотида типа "стебель-петля" излучает в другой области видимого спектра по сравнению с молекулами флуорофора первого и второго замкнутых олигонуклеотидов типа "стебель-петля".
Краткое описание чертежей
Предпочтительные варианты реализации настоящего изобретения будут описаны исключительно в качестве примеров со ссылкой на приложенные фигуры 1-8, представленные ниже.
Фигура 1: Типичные LOCS-репортеры и температуры плавления (Tm) их интактных замкнутых, заблокированных форм и расщепленных или разрушенных раскрытых форм. Типичные интактные (замкнутые) LOCS (фигура 1А, LHS) имеют петлевую область, стеблевую область и пару красителей "флуорофор (F) - гаситель (Q)". Расщепление или разрушение петлевой области может привести к образованию раскрытых репортерных LOCS-структур (фигура 1А RHS). Температуры плавления (Tm) стеблевых областей интактных LOCS превышают Tm стеблевых областей в раскрытых LOCS-структурах. По существу, стебель A LOCS А разделяется или плавится при Tm 1. Она превышает Tm 2, которая представляет собой температуру, при которой плавится стебель А раскрытого LOCS (фигура 1 В). Аналогичным образом, стебель В интактного LOCS В плавится при Tm 3. Она превышает Tm 4, которая представляет собой температуру, при которой плавится стебель В' раскрытого LOCS (фигура 1 В). Наличие отрицательного пика при температуре, соответствующей Tm раскрытой LOCS-структуры, указывает на присутствие мишени, которая вызывает раскрытие специфического LOCS. Поскольку каждый стебель в каждом конкретном раскрытом LOCS плавится при определенной температуре, несколько LOCS, меченых одним и тем же флуорофором, можно одновременно анализировать в одной реакции.
На фигуре 2 показана типичная стратегия обнаружения мишени с использованием LOCS-олигонуклеотидов, которые являются универсальными и могут использоваться для обнаружения любой мишени. В этой схеме LOCS-олигонуклеотид содержит стеблевую область, пару красителей "флуорофор - гаситель" и петлевую область. Петлевая область содержит универсальный субстрат для каталитической нуклеиновой кислоты, например, МНКзима, также известного в данной области техники как PlexZyme. МНКзимы образуются при выравнивании сенсорных цепей компонентов - партзимов, выполняющих роль датчиков мишени, рядом друг с другом на мишени. Петлевая область LOCS-олигонуклеотида связывается с субстрат-связывающими цепями МНКзима, и МНКзим расщепляет субстрат в составе петли, генерируя флуоресцентный сигнал. Реакционную смесь можно охладить, обеспечивая повторный отжиг стеблевой области раскрытого LOCS, а затем реакцию можно подвергнуть анализу кривой плавления, тем самым отслеживая флуоресценцию по мере нагревания реакционной смеси. Присутствие пика плавления, соответствующего Tm раскрытого LOCS, указывает на присутствие мишени, вызвавшей сборку МНКзима. Можно обнаруживать непосредственно мишень либо ампликоны мишени, полученные с помощью протоколов амплификации мишени.
На фигуре 3 показана типичная стратегия обнаружения мишени с использованием LOCS-олигонуклеотидов, специфичных по отношению к мишени. LOCS-олигонуклеотиды содержат стеблевую область, пару красителей "флуорофор - гаситель" и петлевую область, содержащую область, комплементарную ампликону мишени. На схеме, проиллюстрированной на фигуре 3А, петлевая область LOCS-олигонуклеотидов связывается с ампликонами мишени во время амплификации. Во время удлинения праймеров экзонуклеазная активность полимеразы разрушает петлевую область, генерируя флуоресцентный сигнал в реальном времени, но оставляя стеблевые области интактными. Стеблевые области комплементарны друг другу, но не своей мишени. После амплификации реакционную смесь можно охладить для повторного отжига стебля разрушенной раскрытой LOCS-структуры. Затем можно выполнить анализ кривой плавления для измерения температуры, при которой стеблевая область, полученная из раскрытого LOCS, плавится и генерирует флуоресценцию. На схеме, проиллюстрированной на фигуре 3В, петлевая область LOCS-олигонуклеотида содержит область, комплементарную ампликону мишени, и дополнительно содержит сайт распознавания для фермента рестрикции, например, никующего фермента. Петлевая область LOCS-олигонуклеотида связывается с мишенью, и никующий фермент расщепляет петлевую область, оставляя молекулу мишени интактной. Это раскрывает LOCS и генерирует флуоресцентный сигнал. Затем реакционную смесь можно охладить, обеспечивая возможность повторного отжига стебля расщепленной раскрытой LOCS-структуры; а затем можно выполнить анализ кривой плавления для измерения температуры, при которой плавится стеблевая область, полученная из раскрытого LOCS. Эту стратегию можно использовать для непосредственного обнаружения последовательностей-мишеней или обнаружения ампликонов мишени в сочетании со способом амплификации мишени.
На фигуре 4 показаны графики ПЦР-амплификации, полученные в результате реакций, содержащих 10000 копий (черная линия), 40 копий (серая линия) или 0 копий (пунктирная линия) мишеней MgPa (фигура 4А), TV-Btub (фигура 4С) или как MgPa, так и TV-Btub (фигура 4Е). Сигнатуры кривой плавления, полученные после амплификации реакционных смесей, содержащих 10000 копий (черная линия) и 40 копий (серая линия), показаны для мишеней MgPa (фигура 4В), TV-Btub (фигура 4D) или как MgPa, так и TV-Btub (фигура 4F). Сигнатуры плавления, полученные путем раскрытия LOCS-1 в присутствии гена-мишени MgPa, включали пики при температурах плавления 35°С и 41°С; сигнатуры плавления, полученные при раскрытии LOCS-2 в присутствии гена-мишени TV-Btub, включали пик, соответствующий температуре плавления 50°С; в то время как сигнатуры плавления, полученные при раскрытии LOCS-1 и LOCS-2 в присутствии генов-мишеней MgPa и TV-Btub, включали три пика при температурах плавления 35°С, 41°С и 50°С. Сигнатура плавления LOCS в присутствии MgPa (Tm=35°С и 41°С) отличается от сигнатуры плавления LOCS, полученной в присутствии гена-мишени TV-Btub (Tm=50°С). Кроме того, сигнатура плавления LOCS в присутствии генов-мишеней MgPa и TV-Btub (Tm=35°С, 41°С и 50°С) отличается от вышеупомянутых сигнатур плавления в присутствии лишь одного гена-мишени, что указывает обнаружение обеих мишеней.
На фигуре 5 (верхняя панель) показаны графики ПЦР-амплификации, полученные для реакционных смесей, содержащих 10000 копий (черная линия), 40 копий (серая линия) или 0 копий (пунктирная линия) генов-мишеней MgPa (фигура 5А1), HMPV (фигура 5 В1) и СТ-ompA (фигура 5С1). Результаты, показанные на нижней панели, представляют собой сигнатуры кривой плавления, полученной для реакционной смеси, содержащей 10000 копий (черная линия) и 40 копий (серая линия) генов-мишеней MgPa (фигура 5А2), HMPV (фигура 5 В2) и СТ-ompA (фигура 5С2). Эти три мишени были специфично обнаружены с использованием 3 различных МНКзимов, каждый из которых содержал идентичные субстрат-связывающие цепи и отличался только мишень-связывающими цепями. Каждый МНКзим раскрывал один и тот же универсальный LOCS- олигонуклеотид-1, содержащий универсальный субстрат и универсальный стебель. Каждая мишень позволяла получить кривую плавления с пиком при 40°С, что соответствует Tm универсального стебля.
На фигуре 6 (верхняя панель) показаны графики ПЦР-амплификации, полученные для реакционных смесей, содержащих 10000 копий (черная линия), 40 копий (серая линия) или 0 копий (пунктирная линия) генов-мишеней TV-Btub (фигура 6А1), VZV (фигура 6 В1) и rpoB (фигура 6С1). Результаты, показанные на нижней панели, представляют собой сигнатуры кривой плавления, полученной для реакционной смеси, содержащей 10000 копий (черная линия) и 40 копий (серая линия) мишеней TV-Btub (фигура 6А2), VZV (фигура 6В2) и rpoB (фигура 6С2). Эти три мишени были специфично обнаружены с использованием трех различных МНКзимов, каждый из которых содержал идентичные субстрат-связывающие цепи и отличался только мишень-связывающими цепями. Каждый МНКзим раскрывал один и тот же универсальный LOCS-2, содержащий универсальный субстрат и универсальный стебель. Каждая мишень позволяла получить кривую плавления с пиком при 50°С, что соответствует Tm универсального стебля в составе LOCS-2.
На фигуре 7 показаны сигнатуры кривой плавления, полученные при использовании LOCS-1 (фигура 7А), LOCS-2 (фигура ТВ), LOCS-3 (фигура 7С) и LOCS-4 (фигура 7D) и использованные для мониторинга амплификации мишеней CT-Cds (фигура 7А и 7С) или TFRC (фигура 7В и 7D). Сигнатуры кривых плавления, полученные в отсутствие мишени (пунктирная линия), содержали пики при Tm 65°С, 77°С, 66°С и 67°С, соответствующие температурам плавления замкнутых интактных LOCS-1, LOCS-2, LOCS-3 и LOCS-4, соответственно. В присутствии мишени CT-Cds (черная линия; фигура 7А и 7С) раскрытые структуры LOCS-1 и LOC-3 позволили получить температуры плавления 30°С и 36°С, соответственно. В присутствии мишени TFRC (черная линия; фигура 7В и 7D) раскрытые структуры LOCS-2 и LOC-4 позволили получить температуры плавления 50°С и 32°С, соответственно.
На фигуре 8 показаны кривые плавления, полученные для амплификации мишени MgPa на термоциклере BioRad® CFX96 (фигура 8А), ABI 7500 (фигура 8 В), Light Cycler 480 (панель С) или XXpress PCR (фигура 8D). Обе мишени отслеживали на канале FAM на всех аппаратах.
На фигуре 9 показаны кривые плавления, полученные для амплификации мишени TV-Btub на термоциклере BioRad® CFX96 (фигура 9А), ABI 7500 (фигура 9 В), Lightcycler 480 (фигура 9С) или XXpress PCR (фигура 9D). Обе мишени отслеживали на канале FAM на всех аппаратах.
На фигуре 10 показаны сигнатуры кривых плавления, полученные в результате дуплексной ПЦР, при которой мишени MgPa (черные кривые) и TV-Btub (серые кривые) совместно амплифицировали и считывали на одном канале. Сплошные и пунктирные линии обозначают концентрации мишени 10000 копий и 40 копий, соответственно. На фигуре 10А показаны кривые плавления, полученные с использованием считывания LOCS-1 и LOCS-2 на канале FAM; на фигуре 10 В показаны результаты, полученные с использованием считывания LOC-5 и LOCS-6 на канале HEX; на фигуре 10С показаны результаты, полученные с использованием считывания LOCS-7 и LOCS-8 на канале Texas Red, а на фигуре 10D показаны результаты с использованием считывания LOCS-9 и LOCS-10 на канале Су5.
На фигуре 11 показаны сигнатуры кривой плавления, полученные после ПЦР-амплификации реакционных смесей, содержащих 10000 копий генов-мишеней MgPa (фигура 11А), TV-Btub (фигура 11 В), CTcry (фигура 11С), как MgPa, так и TV-Btub (фигура 11D), как MgPa, так и CTcry (фигура 11Е) или как TV-Btub, так и CTcry (фигура 11F). Сигнатуры плавления, полученные при раскрытии LOCS-1 и/или LOCS-2 и/или LOCS-11, продуцировали пики, указывающие на плавление этих структур при Tm в диапазоне от 30°С до 50°С, в то время как интактный замкнутый LOCS плавился в диапазоне Tm от 64°С до 74°С. В каждом сценарии сигнатуры плавления LOCS уникальны и отличаются от сигнатур плавления других LOCS.
На фигуре 12 показаны сигнатуры кривой плавления, полученные после ПЦР-амплификации реакционных смесей, содержащих по 10000 копий каждого из генов-мишеней MgPa, TV-Btub и CTcry. Сигнатуры плавления, полученные при раскрытии LOCS-1, LOCS-2 и LOCS-11 в присутствии генов-мишеней MgPa, TV-Btub и CTcry, включали три пика при температурах плавления 30°С, 41°С и 49°С. Реакционную смесь, содержащую все три гена-мишени, можно отличить от смесей, содержащих лишь один ген-мишень (фигуры 11А-11С), и смесей, содержащих два из трех генов-мишеней (фигуры 11D-11E). Например, реакционную смесь, содержащую все три гена-мишени, можно отличить от реакционной смеси, содержащей только TV-Btub и CTcry (фигура 11F), по исчезновению пика Tm раскрытого LOCS 1 (~ 64°С).
На фигуре 13 показаны сигнатуры кривой плавления, полученные после ПЦР-амплификации 4-плексных реакционных смесей, содержащих по 10000 копий каждого из генов-мишеней MgPa, TV-Btub, NGopa или gpd. Эти четыре мишени были специфично обнаружены с использованием 4 различных МНКзимов, в свою очередь, эти МНКзимы расщепляли и раскрывали 4 различных LOCS-репортера, отслеживаемые на 2 флуоресцентных каналах. Каждый LOCS-репортер содержит свой универсальный субстрат, но одни и те же универсальные стебли (стебель-1 и стебель-2), использовавшиеся как на канале FAM, так и на канале Texas Red. Наличие генов MgPa или TV-Btub обнаруживали по увеличению сигнала на канале Texas Red; а наличие генов NGopa или gpd обнаруживали по увеличению сигнала на канале FAM. Специфичное обнаружение MgPa или TV-Btub на канале Texas Red и NGopa или gpd на канале FAM выполняли на основе наличия уникальной сигнатуры кривой плавления. Сигнатуры плавления, полученные на канале Texas Red при раскрытии LOCS-7 в присутствии MgPa и LOCS-8 в присутствии TV-Btub, содержали пики при температурах плавления 43°С и 53°С, соответственно. Сигнатуры плавления, полученные на канале FAM при раскрытии LOCS-12 в присутствии NGopa и LOCS-13 в присутствии gpd, содержали пики при температурах плавления 26°С, 42°С и 53°С, соответственно.
На фигуре 14 показаны сигнатуры кривых плавления, полученные в результате одноплексной ПЦР, при которой каждая из петлевых областей трех LOCS-репортеров содержит свой субстрат для своего МНКзима, однако все три LOCS содержат одну и ту же стеблевую последовательность. Сигнатуры плавления, полученные в отсутствие мишени (серые линии), демонстрируют пики плавления при 74°С (фигура 14А), 75°С (фигура 14 В) и 75°С (фигура 14С), соответствующие температурам плавления замкнутых интактных LOCS-2, LOCS-14 и LOCS-15, соответственно. В присутствии мишени TFRC (черная линия; фигура 14А, 14В и 14С) раскрытые структуры LOCS-2, LOCS-14 и LOC-15 позволяли получить температуры плавления 49°С, 48°С и 49°С, соответственно.
На фигуре 15 показаны сигнатуры кривой плавления, полученные при использовании LOCS-16 (фигура 15А) и LOCS-17 (фигура 15 В) с целью обнаружения и идентификации двух различных мишеней (AF-NE-TV1 и AF-NE-R5b) с использованием никующей эндонуклеазы (Nt. AlwI) в качестве способа, альтернативного расщеплению МНКзимом. Сигнатуры кривых плавления, полученные в отсутствие мишени (серые линии), содержали пики при Tm 65°С и 76°С, соответствующие температурам плавления замкнутых интактных LOCS-16 и LOCS-17, соответственно. Сигнатуры кривых плавления, полученные в присутствии мишени (черная линия; AF-NE-TV1 и AF-NE-R5b, соответственно), содержали пики при Tm 29°С и 48°С, соответствующие температурам плавления расщепленных раскрытых LOCS-16 и LOCS-17, соответственно. Данные из этого примера демонстрируют, что LOCS-репортеры можно применять с альтернативными способами обнаружения мишеней, например, способами, использующими никующие эндонуклеазные ферменты.
На фигуре 16 показаны кривые амплификации (фигура 16А) и сигнатуры кривой плавления (фигура 16В), полученные при использовании стратегии, аналогичной той, которая опосредует генерацию сигнала TaqMan/гидролизных зондов, для раскрытия зондов LOCS, а именно, разрушения специфических областей зондов (петель) во время ПЦР за счет экзонуклеазной активности полимеразы. Графики ПЦР получены при использовании реакционных смесей, содержащих 10000 копий (черная линия) или 0 копий (серая линия) гена-мишени TV-btub (фигура 16А). Сигнатура кривой плавления, полученная в отсутствие мишени (серая линия), характеризовалась пиком плавления при Tm 61°С, что соответствует температуре плавления замкнутого интактного LOCS-18 (фигура 16В). Сигнатура кривой плавления, полученная в присутствии мишени (черная линия), характеризовалась пиком плавления при Tm 40°С, что соответствует температурам плавления расщепленного раскрытого LOCS-18 (фигура 16В). Данные из этого примера демонстрируют, что LOCS-репортеры можно использовать с альтернативными способами обнаружения мишеней, например, технологией TaqMan, использующей ферменты с экзонуклеазной активностью для расщепления зондов, гибридизующихся с ампликонами.
На фигуре 17 показаны графики ПЦР-амплификации, полученные при использовании реакционных смесей, содержащих 20000 копий мишени Х/CTcry (сплошная черная линия), 20000 копий мишени Y/NGopa (пунктирная черная линия) или 20000 копий обеих мишеней (серая линия) при 39°С (фигура 17А) и 72°С (фигура 17В). Пороговые значения ТХ и TY указаны для графика амплификации, полученного при 39°С и 72°С, соответственно. Указаны конечные значения флуоресценции, обозначенные как ЕХ1, ЕХ2, EY1 и EY2.
На фигуре 18 показаны графики ПЦР-амплификации, полученные при использовании реакционных смесей, содержащих 0 копий мишени Х/CTcry (сплошная черная линия), 32 копии мишени Х/CTcry (серая линия) или 20000 копий обеих мишеней XCTcry (пунктирная черная линия) при 39°С с 20000 копий мишени Y/NGopa (фигура 18А), при 72°С с 20000 копий мишени Y/NGopa (фигура 18В), при 72°С с 20000 копий мишени Y/NGopa после нормировки по FAF (фигура 18С), при 39°С с 32 копиями мишени Y/NGopa (фигура 18D), при 72°С с 32 копиями мишени Y/NGopa (фигура 18Е), при 72°С с 32 копиями мишени Y/NGopa после нормировки по FAF (фигура 18F), при 39°С с 0 копий мишени Y/NGopa (фигура 18G), при 72°С с 0 копий мишени Y/NGopa (фигура 18Н), при 72°С с 0 копий мишени Y/NGopa после нормировки по FAF (фигура 18I).
На фигуре 19 показана нелинейная логистическая регрессия для относительного сдвига значения Cq в зависимости от In количества копий мишени Y (NGopa) - ln количества копий мишени X (CTcry).
На фигуре 20 показаны характеристики кривой плавления, полученные на канале HEX в результате 6-плексных реакций в одной лунке при использовании 10000 копий гена-мишени gpd, gpd3 или porA. Шесть мишеней специфически обнаружили и дифференцировали с использованием двух флуоресцентных каналов (три мишени на канал) в одной лунке. Эти мишени обнаружили с использованием шести различных МНКзимов, которые, в свою очередь, расщепляли и раскрывали шесть различных LOCS-репортеров. Фигура 20А: LOCS-21 в присутствии gpd (53°С, 68°С и 85°С), фигура 20В: LOCS-22 в присутствии gpd3 (30°С, 43°С, 77°С и 85°С), фигура 20С: LOCS-23 в присутствии porA (68°С и 77°С), фигура 20D: LOCS-21 и LOCS-22 в присутствии gpd и gpd3 (30°С, 43°С, 53°С и 85°С), фигура 20Е: LOCS-21 и LOCS-23 в присутствии gpd и porA (53°С и 68°С), фигура 20F: LOCS-22 и LOCS-23 в присутствии gpd3 и porA (30°С, 43°С, 68°С и 77°С).
На фигуре 21 показаны сигнатуры кривой плавления, полученные на канале Texas Red в результате тех же 6-плексных реакций в одной лунке, показанных на фигуре 20, содержащих 10000 копий генов-мишеней TV-Btub, MgPa или LGV. В этих реакциях специфически обнаружены и дифференцированы шесть мишеней с использованием двух флуоресцентных каналов (по три мишени на канал). Эти мишени обнаружили с использованием шести различных МНКзимов, которые, в свою очередь, расщепляли и раскрывали шесть различных LOCS-репортеров, при мониторинге на каналах HEX и Texas Red. Фигура 21А: сигнатура кривой плавления, полученная с помощью LOCS-24 в присутствии TV-Btub (30°С, 42°С, 66°С и 82°С), фигура 21В: LOCS-25 в присутствии MgPa (53°С, 66°С и 82°С), фигура 21С: LOCS-26 в присутствии LGV (68°С), фигура 21D: LOCS-24 и LOCS-25 в присутствии TV-Btub и MgPa (30°С, 42°С, 53°С и 82°С), фигура 21Е: LOCS-24 и LOCS-26 в присутствии TV-Btub и LGV (30°С, 42°С и 68°С), фигура 21F: LOCS-25 и LOCS-26 в присутствии MgPa и LGV (30°С, 43°С, 53°С и 68°С).
На фигуре 22 показаны сигнатуры кривой плавления, полученные после ПЦР-амплификации в результате тех же 6-плексных реакций, которые приведены на фигурах 20 и 21, при использовании по 10000 копий каждого из gpd, gpd3 и porA (фигура 22А) или по 10000 копий каждого из генов-мишеней TV-Btub, MgPa и LGV (фигура 22В). Эти мишени обнаружили с использованием шести МНКзимов, которые, в свою очередь, расщепляли и раскрывали шесть LOCS-репортеров, при мониторинге на двух флуоресцентных каналах. Фигура 22А: Сигнатура плавления, полученная на канале HEX при использовании LOCS-21, LOCS-22 и LOCS-23 в присутствии генов-мишеней gpd, gpd3 и porA (30°С, 43°С, 53°С и 68°С). Фигура 22В: Сигнатура плавления, полученная на канале TEXAS RED при использовании LOCS-24, LOCS-25 и LOCS-26 в присутствии TV-Btub, MgPa и LGV (30°С, 42°С, 53°С и 68°С).
На фигуре 23 показаны сигнатуры кривой плавления, полученные после ПЦР-амплификации в результате 10-плексных реакций при использовании 10000 копий генов-мишеней NGopa, porA, gpd, gpd3, TV-Btub, MgPa, CTcry, LGV, polA или TFRC. Десять генов-мишеней специфически обнаружили с использованием десяти различных МНКзимов, которые, в свою очередь, расщепляли и раскрывали десять различных LOCS-репортеров, при мониторинге на пяти флуоресцентных каналах (FAM, HEX, Texas Red, Су5 и Су5.5). Дифференциация мишеней на канале FAM показана на фигуре 23А: LOCS-15 в присутствии NGopa (53°С), на фигуре 2 В: LOCS-27 в присутствии porA (30°С и 76°С) и на фигуре 23С: LOCS-15 и LOCS-27 в присутствии как NGopa, так и porA (30°С и 53°С). Дифференциация мишеней на канале HEX показана на фигуре 23D: LOCS-21 в присутствии gpd (53°С и 70°С), на фигуре 23Е: LOCS-22 в присутствии gpd3 (30°С, 43°С и 76°С) и на фигуре 23F: LOCS-21 и LOCS-22 в присутствии генов-мишеней gpd и gpd3 (30°С, 43°С и 53°С). Дифференциация мишеней на канале Texas Red показана на фигуре 23G: LOCS-24 в присутствии TV-Btub (31°С, 41°С, 59°С и 83°С), на фигуре 23Н: LOCS-28 в присутствие MgPa (63°С) и на фигуре 231: LOCS-24 и LOCS-28 в присутствии как TV-Btub, так и MgPa (31°С, 41°С и 63°С). Дифференциация мишеней на канале Су5 показана на фигуре 23J: LOCS-29 в присутствии CTcry (61°С и 79°С), на фигуре 23K: LOCS-10 в присутствии LGV (47°С и 80°С) и на фигуре 23L: LOCS-29 и LOCS-10 в присутствии как CTcry, так и LVG (47°С и 61°С). Дифференциация мишеней на канале Су5.5 показана на фигуре 23М: LOCS-30 и LOCS-31 в присутствии мишеней генов как polA, так и TFRC (39°С и 59°С) и на фигуре 23N: LOCS-31 при наличии гена TFRC (39°С и 80°С).
На фигуре 24 показан сравнительный анализ уровня дифференциальной флуоресценции до и после амплификации на канале JOE при использовании реакционных смесей, содержащих 10000 копий TFRC, rpoB, pss или всех комбинаций двух или более генов-мишеней, измеренных при 40,5°С, 56,5°С и 78,5°С и выраженных как средние значения уровня флуоресценции из трех повторных реакций за вычетом среднего из трех повторных реакций контроля без матрицы. Показатель погрешности представляет собой стандартное отклонение по каждым трем повторностям.
На фигуре 25 показан сравнительный дифференциальный уровень флуоресценции после амплификации на канале JOE при использовании реакционных смесей, содержащих 10000 копий TFRC, rpoB, pss или всех комбинаций двух или более генов-мишеней, измеренных при 32°С, 40,5°С, 56,5°С и 65,5°С. Значения выражали в виде разности уровней флуоресценции между (а) 32°С и 40,5°С; (б) 40,5°С и 56,5°С; и (с) 56,5°С и 65°С, усредненной по трем повторным реакциям. Показатель погрешности представляет собой стандартное отклонение по каждым трем повторностям.
На фигуре 26 показан сравнительный анализ дифференциального уровня флуоресценции до и после амплификации на канале JOE при использовании реакционных смесей, содержащих 10000 копий TFRC, rpoB, pss или всех комбинаций двух или более генов-мишеней, измеренных при 39,5°С, 56,5°С и 65,5°С. Значения выражали в виде (i) разности между уровнем флуоресценции до и после амплификации при 39,5°С; (ii) разности между разницей уровня флуоресценции до и после амплификации при 39,5°С и разности между уровнем флуоресценции до и после амплификации при 39,5°С и уровнем флуоресценции после амплификации при 56,5°С и (iii) разности между разностью уровня флуоресценции до и после амплификации при 56,5°С и разностью уровня флуоресценции до и после амплификации при 65,5°С, усредненной по трем повторным реакциям. Показатель погрешности представляет собой стандартное отклонение по каждым трем повторностям.
На фигуре 27 показана сравнительная высота пика плавления при 40°С, 51°С и 65°С, полученная на канале JOE при использовании реакционных смесей, содержащих 10000 копий TFRC, rpoB, pss или всех комбинаций двух или более генов-мишеней, усредненная по трем повторным реакциям. Показатель погрешности представляет собой стандартное отклонение по каждым трем повторностям.
Определения
В настоящей заявке формы единственного числа включают упоминание форм множественного числа, если иное явным образом не следует из контекста. Например, фраза «полинуклеотид» также включает множество полинуклеотидов.
В настоящем документе термин «содержащий» означает «включающий». Вариации слова «содержащий», например, «содержать» и «содержит», имеют соответственно различающиеся значения. Таким образом, например, полинуклеотид, «содержащий» последовательность нуклеотидов, может состоять исключительно из этой последовательности нуклеотидов или может содержать один или более из дополнительных нуклеотидов.
В настоящем документе термин «множество» означает более одного. В некоторых конкретных аспектах или вариантах реализации множество может означать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51 или более, и любое целое число, производное от них, и любой диапазон, производный от них.
В настоящем документе термин «субъект» включает любое животное, имеющее важное экономическое, социальное или исследовательское значение, включая крупный рогатый скот, лошадей, овец, приматов, птиц и грызунов. Следовательно, «субъект» может являться млекопитающим, например, человеком, или млекопитающим, не являющимся человеком. Этот термин также охватывает субъектов-микроорганизмов, включая бактерии, вирусы, грибы/дрожжи, простейших и нематод, но не ограничиваясь ими. «Субъект» в соответствии с настоящим изобретением также включает инфекционные агенты, например, прионы.
В настоящем документе термины «полинуклеотид» и «нуклеиновая кислота» могут использоваться взаимозаменяемо и относятся к одно- или двуцепочечному полимеру дезоксирибонуклеотидных или рибонуклеотидных оснований или их аналогов, производных, вариантов, фрагментов или комбинаций, включая ДНК, метилированную ДНК, алкилированную ДНК, РНК, метилированную РНК, микроРНК, миРНК, кшРНК, мРНК, тРНК, мякРНК, мвРНК, ммРНК, предшественники микроРНК и первичные микроРНК, другие некодирующие РНК, рибосомную РНК, их производные, их ампликоны или любую их комбинацию, но не ограничиваясь ими. В качестве неограничивающего примера, источник нуклеиновой кислоты можно выбрать из группы, состоящей из синтетических соединений, млекопитающих, человека, животных, растений, грибов, бактерий, вирусов, архей или любой их комбинации. Термины «полинуклеотид» и «нуклеиновая кислота», «олигонуклеотид» включают ссылку на любую конкретную последовательность, а также на последовательность, комплементарную ей, если не указано иное.
В настоящем документе термин «мишень» относится к любой молекуле или анализируемому соединению, присутствующим в образце, для обнаружения которых можно использовать способы согласно настоящему изобретению. Следует понимать, что термин «мишень» включает мишени, являющиеся нуклеиновыми кислотами, и мишени, не являющиеся нуклеиновыми кислотами, например, белки, пептиды, анализируемые соединения, лиганды и ионы (например, ионы металлов).
В настоящем документе термин «олигонуклеотид» относится к сегменту ДНК или ДНК-содержащей молекуле нуклеиновой кислоты, или РНК, или РНК-содержащей молекуле, или их комбинации. Примеры олигонуклеотидов включают нуклеиновые кислоты-мишени; субстраты, например, субстраты, которые может модифицировать МНКзим; праймеры, например, праймеры, используемые для амплификации мишеней in vitro такими способами, как ПЦР; и компоненты МНКзимов. Термин «олигонуклеотид» включает упоминание любой конкретной последовательности, а также последовательности, комплементарной ей, если не указано иное. Олигонуклеотиды могут содержать по меньшей мере одно добавление или замещение, включая группу, содержащую 4-ацетилцитидин, 5-(карбоксигидроксилметил)уридин, 2'-O-метилцитидин, 5-карбоксиметиламинометилтиоуридин, дигидроуридин, 2'-O-метилпсевдоуридин, бета-D-галактозилкеозин, 2'-O-метилгуанозин, инозин, N6-изопентениладенозин, 1-метиладенозин, 1-метилпсевдоуридин, 1-метил гуанозин, 1-метилинозин, 2,2-диметилгуанозин, 2-метиладенозин, 2-метилгуанозин, 2-метилгуанозин, 3-метилцитидин, 5-метилцитидин, N6-метиладенозин, 7-метил гуанозин, 5-метиламинометилуридин, 5-метоксиаминометил-2-тиоуридин, бета-D-маннозилметилуридин, 5-метоксикарбонилметилуридин, 5-метоксиуридин, 2-метилтио-N6-изопентениладенозин, N-((9-бета-рибофуранозил-2-метилтиопурин-6-ил)карбамоил)треонин, N-((9-бета-рибофуранозилпурин-6-ил)N-метилкарбамоил)треонин, метиловый эфир уридин-5-оксиуксусной кислоты, уридин-5-оксиуксусную кислоту (v), вибутоксозин, псевдоуридин, кеозин, 2-тиоцитидин, 5-метил-2-тиоуридин, 2-тиоуридин, 4-тиоуридин, 5-метилуридин, N-((9-бета-D-рибофуранозилпурин-6-ил)карбамоил)треонин, 2'-O-метил-5 -метилуридин, 2'-O-метилуридин, вибутозин, 3-(3-амино-3-карбоксипропил)уридин, бета-D-арабинозилуридин, бета-D-арабинозилтимидин, но не ограничиваясь ими.
В настоящем документе термины «комплементнарный», «комплементарность», «совпадение» и «совпадающий» относятся к способности нуклеотидов (например, дезоксирибонуклеотидов, рибонуклеотидов или их комбинаций) гибридизоваться друг с другом посредством спаривания оснований по Уотсону-Крику, либо неоднозначного спаривания оснований. Связи могут образовываться посредством спаривания оснований по Уотсону-Крику между основаниями аденина (А) и основаниями урацила (U), между основаниями аденина (А) и основаниями тимина (Т), между основаниями цитозина (С) и основаниями гуанина (G). Неоднозначная пара оснований представляет собой пару оснований, не соответствующую правилу Уотсона-Крика и образованную между двумя нуклеотидами в полинуклеотидной двуцепочечной структуре (например, гуанин-урацил, инозин-урацил, инозин-аденин и инозин-цитозин). Нуклеотиды, обозначаемые как «комплементарные» или являющиеся «комплементарными» друг другу, представляют собой нуклеотиды, которые обладают способностью гибридизоваться друг с другом либо за счет спаривания соответствующих оснований по Уотсону-Крику, либо за счет неоднозначного спаривания оснований.
В настоящем документе термины «некомплементарный», «не комплементарный», «несоответствие» и «несоответствующий» относятся к нуклеотидам (например, дезоксирибонуклеотидам, рибонуклеотидам и их комбинациям), не обладающим способностью гибридизоваться друг с другом за счет спаривания соответствующих оснований по Уотсону-Крику либо за счет неоднозначного спаривания оснований.
В настоящем документе термин «фермент» относится к любой молекуле, способной катализировать химическую реакцию (например, амплификацию полинуклеотида, расщепление полинуклеотида и т.д.). Неограничивающие примеры ферментов, подходящих для использования в настоящем изобретении, включают нуклеозимы и ферменты-белки. Неограничивающие примеры подходящих нуклеозимов включают РНКзимы, МНКзимы и ДНКзимы. Неограничивающие примеры подходящих ферментов-белков включают экзонуклеазы и эндонуклеазы. Ферменты обычно обеспечивают каталитическую активность, способствующую осуществлению одного или более способов, описанных в настоящем документе. В качестве неограничивающего примера, экзонуклеазная активность может представлять собой каталитическую активность, присущую, например, полимеразе. В качестве неограничивающего примера, эндонуклеазная активность может представлять собой каталитическую активность, присущую, например, ферменту рестрикции, включая никующую эндонуклеазу, рибоэндонуклеазу или нуклеазу, специфичную к двуцепочечной структуре (DSN).
В настоящем документе термин «ампликон» относится к нуклеиновой кислоте (например, ДНК или РНК или их комбинации), являющейся продуктом естественной или искусственной амплификации или репликации нуклеиновых кислот, включая, помимо прочего, ПЦР, ОТ-ПЦР, SDA, HDA, RPA, LAMP, RCA, ТМА, 3SR или NASBA.
В настоящем документе следует понимать, что термин «олигонуклеотид типа "стебель-петля"» означает ДНК или молекулу, содержащую ДНК, или РНК, или молекулу, содержащую РНК, или их комбинацию (т.е. гибридную молекулу или комплекс ДНК-РНК), содержащую или состоящую из двуцепочечного стеблевого компонента, соединенного с одноцепочечным петлевым компонентом. Двуцепочечный стеблевой компонент содержит прямую цепь, гибридизованную за счет спаривания комплементарных оснований с комплементарной обратной цепью, причем 3'-нуклеотид прямой цепи соединен с 5'-нуклеотидом компонента одноцепочечной петли, а 5'- нуклеотид обратной цепи соединен с 3'-нуклеотидом компонента одноцепочечной петли. Двуцепочечный стеблевой компонент может дополнительно содержать один или более флуорофоров на одной цепи (например, прямой цепи) и один или более гасителей на противоположной цепи (например, обратной цепи).
В настоящем документе термины «олигонуклеотид типа "стебель-петля"» и «LOCS», также называемый в настоящем документе «LOCS-олигонуклеотид», «LOCS-структура», «LOCS-репортер», «интактный LOCS», «замкнутый LOCS» и «LOCS-зонды», используются взаимозаменяемо и означают ДНК или ДНК-содержащую молекулу, или РНК, или РНК-содержащую молекулу, или их комбинацию (т.е. гибридную молекулу или комплекс ДНК-РНК), содержащую или состоящую из двуцепочечного стеблевого компонента (также называемого в настоящем документе «стебель», «стеблевая область» и «стеблевой фрагмент»), присоединенного к одноцепочечному петлевому компоненту (также называемому в настоящем документе «петля», «петлевая область» и «петлевой фрагмент»). Двуцепочечный стеблевой компонент содержит прямую цепь, гибридизованную за счет спаривания комплементарных оснований с комплементарной обратной цепью, причем 3'-нуклеотид прямой цепи соединен с 5'-нуклеотидом компонента одноцепочечной петли, а 5'-нуклеотид обратной цепи соединен с 3'-нуклеотидом компонента одноцепочечной петли.
Двуцепочечный стеблевой компонент может дополнительно содержать один или более флуорофоров на одной цепи (например, прямой цепи) и один или более гасителей на противоположной цепи (например, обратной цепи). Например, флуорофор(ы) могут быть присоединены к 5'-концу прямой цепи или рядом с ним, а гаситель(и) могут быть присоединены к 3'-концу обратной цепи или рядом с ним, или наоборот. Одноцепочечный петлевой компонент может содержать область, способную служить субстратом для каталитической нуклеиновой кислоты, например, МНКзима, ДНКзима, рибозима, апта-МНКзима или аптазима. В качестве дополнения или альтернативы, одноцепочечный петлевой компонент может содержать область, комплементарную нуклеиновой кислоте-мишени (например, мишени для обнаружения, количественной оценки и т.п.) и/или полученным из нее ампликонам, которая может дополнительно служить в качестве субстрата для фермента-экзонуклеазы. В качестве неограничивающего примера, экзонуклеазная активность может быть присуща ферменту-полимеразе. В качестве дополнения или альтернативы, область одноцепочечного петлевого компонента может содержать область, которая может: (i) быть комплементарной мишени, подлежащей обнаружению, (ii) содержать одну цепь двуцепочечного сайта, распознаваемого ферментом рестрикции; и (iii) служить субстратом для фермента рестрикции.
В настоящем документе термины «раскрытый олигонуклеотид типа "стебель-петля"», «раскрытый LOCS», «раскрытый LOCS-олигонуклеотид», «раскрытая LOCS-структура», «раскрытые LOCS-репортеры», «раскрытые LOCS-зонды», «раскрытый LOCS», «расщепленный LOCS» и «разрушенный LOCS» используются взаимозаменяемо и относятся к «олигонуклеотиду типа "стебель-петля"» или «LOCS», в котором одноцепочечный петлевой компонент расщеплен и/или разрушен (например, ферментом, описанным в настоящем документе), так что по меньшей мере одна связь между соседними нуклеотидами в составе петли удалена, что приводит к образованию раскрытой структуры в области петли. В раскрытом LOCS прямая и обратная цепи двуцепочечного стеблевого фрагмента могут сохранять способность гибридизироваться друг с другом с образованием стебля.
В настоящем документе термин «универсальный стебель» относится к двуцепочечной последовательности, которую можно включить в любую LOCS-структуру. Один и тот же «универсальный стебель» можно использовать в LOCS, содержащих петли, содержащие субстраты каталитических нуклеиновых кислот либо последовательность, комплементарную рассматриваемой мишени. Один универсальный стебель можно использовать в качестве суррогатного маркера для любой мишени, способной облегчить раскрытие конкретного LOCS. Ряд универсальных стеблей можно внедрить в ряд LOCS, предназначенных для анализа любого набора мишеней.
В настоящем документе термин «универсальный LOCS» относится к LOCS-структуре, содержащей «универсальный стебель» и «универсальную петлю», содержащую универсальный субстрат каталитической нуклеиновой кислоты, который может расщепить любой МНКзим с дополнительными субстрат-связывающими цепями независимо от последовательностей цепей-датчиков мишеней в составе МНКзима. Один универсальный LOCS можно использовать в качестве суррогатного маркера для любой мишени, способной облегчить раскрытие конкретного LOCS. Ряд универсальных LOCS можно внедрить в любой мультиплексный анализ, предназначенный для анализа любого набора мишеней.
В настоящем документе термины «нуклеозим», «каталитическая нуклеиновая кислота», «нуклеиновая кислота с каталитической активностью» и «каталитический нуклеозим» используются взаимозаменяемо и означают ДНК или ДНК-содержащие молекулу или комплекс, или РНК, или РНК-содержащую молекулу или комплекс, или их комбинацию (т.е. ДНК-РНК-гибридную молекулу или комплекс), способную распознавать по меньшей мере один субстрат и катализировать модификацию (например, расщепление) по меньшей мере одного субстрата. Нуклеотидные остатки в каталитических нуклеиновых кислотах могут содержать основания А, С, G, Т и U, а также их производные и аналоги. Вышеприведенные термины включают одномолекулярные нуклеозимы, которые могут содержать одну ДНК или ДНК-содержащую молекулу (также известную в данной области техники как «ДНК-фермент», «дезоксирибозим» или «ДНКзим») или РНК, или молекулу, содержащую РНК (также известную в данной области техники как «рибозим») или их комбинацию, представляющую собой ДНК-РНК-гибридную молекулу, способную распознавать по меньшей мере один субстрат и катализировать модификацию (например, расщепление) по меньшей мере одного субстрата. Вышеприведенные термины включают нуклеозимы, содержащие ДНК или ДНК-содержащий комплекс, или РНК, или РНК-содержащий комплекс, или их комбинацию, являющуюся ДНК-РНК-гибридным комплексом, способным распознавать по меньшей мере один субстрат и катализировать модификацию (например, расщепление) по меньшей мере одного субстрата. Термины «нуклеозим», «каталитическая нуклеиновая кислота», «нуклеиновая кислота с каталитической активностью» и «каталитический нуклеозим» включают МНКзимы.
В настоящем документе термины «МНКзим» и «многокомпонентный нуклеозим» имеют одинаковое значение и относятся к двум или более олигонуклеотидным последовательностям (например, партзимам), которые лишь в присутствии соединения, облегчающего сборку МНКзима (например, мишени), образуют активный нуклеозим, способный каталитически модифицировать субстрат. «МНКзим» также известен в данной области техники как «PlexZyme». МНКзимы могут катализировать ряд реакций, включая расщепление субстрата и другие ферментативные модификации субстрата или субстратов. МНКзимы с эндонуклеазной или расщепляющей активностью также известны как «расщепляющие МНКзимы». Каждый из компонентов-партзимов (партзимы А и В) связывается с соединением, облегчающим сборку (например, с последовательностью-мишенью ДНК или РНК) посредством спаривания оснований по Уотсону-Крику. МНКзим образуется только при гибридизации сенсорных цепей партзимов А и В рядом друг с другом на соединении, облегчающем сборку. Субстратные цепи МНКзима взаимодействуют с субстратом, модификацию (например, расщепление) которого катализирует каталитическое ядро МНКзима, образованное за счет взаимодействия каталитических доменов партзимов А и В. МНКзимы могут расщеплять субстраты ДНК/РНК-химерного репортера. Расщепление МНКзимом субстрата между парой красителей "флуорофор и гаситель" может приводить к появлению флуоресцентного сигнала. Термины «многокомпонентный нуклеозим» и «МНКзим» включают двухкомпонентные структуры, состоящие из двух молекул, или трехкомпонентные структуры, состоящие из трех молекул нуклеиновой кислоты, или другие многокомпонентные структуры, например, образованные четырьмя или более молекулами нуклеиновой кислоты.
Следует понимать, что термины «МНКзим» и «многокомпонентный нуклеозим», используемые в настоящем документе, охватывают все известные МНКзимы и модифицированные МНКзимы, включая соединения, описанные в одной или более публикациях патентов РСТ №WO/2007/041774, WO/2008/040095, WO2008/122084 и родственных публикациях патентов США №2007-0231810, 2010-0136536 и 2011-0143338 (содержание каждого из этих документов полностью включено в настоящий документ посредством ссылки). Неограничивающие примеры МНКзимов и модифицированных МНКзимов, охватываемых терминами «МНКзим» и «многокомпонентный нуклеозим», включают МНКзимы с расщепляющей каталитической активностью (представленные в настоящем документе), разобранные или частично собранные МНКзимы, содержащие один или более ингибиторов сборки, МНКзимы, содержащие один или более аптамеров («апта-МНКзимы»), МНКзимы, содержащие одну или более укороченную сенсорную цепь и, необязательно, один или более из стабилизирующих олигонуклеотидов, МНКзимы, содержащие один или более из ингибиторов активности, многокомпонентные неактивные пронуклеозимы (MHKi), каждый из которых подробно описан в одном или более из патентов WO/2007/041774, WO/2008/040095, US 2007-0231810, г. US 2010-0136536 и/или US 2011-0143338.
В настоящем документе термины «партзим», «компонент-партзим» и «партзим-компонент» относятся к ДНК-содержащим или РНК-содержащим, или ДНК-РНК-содержащим олигонуклеотидам, два или более из которых только в присутствии соединения, облегчающего сборку МНКзима, описанного в настоящем документе, могут совместно образовывать «МНКзим». В некоторых предпочтительных вариантах реализации один или более, предпочтительно по меньшей мере два компонента-партзима, могут содержать три области или домена: «каталитический» домен, образующий часть каталитического ядра, катализирующего модификацию; домен «сенсорной цепи», способный ассоциировать с соединением, облегчающим сборку и/или связываться с ним; и домен «субстратной цепи», способный ассоциировать с субстратом и/или связываться с ним. Термины «сенсорная цепь», «цепь-датчик мишени» или «цепь, чувствительная к мишени» или «цепь-мишень» могут взаимозаменяемо использоваться для описания домена партзимов, который связывается с соединением, облегчающим сборку, например, с мишенью. Партзимы могут содержать по меньшей мере один дополнительный компонент, включая аптамер, называемый в настоящем документе «апта-партзимом», но не ограничиваясь им. Партзим может содержать несколько компонентов, включая партзим-компонент с укороченной сенсорной цепью и компонент стабилизирующей цепи, стабилизирующий структуру МНКзима посредством взаимодействия либо с соединением, облегчающим сборку, либо с субстратом, но не ограничиваясь ими.
Термины «молекула, облегчающая сборку», «соединение, облегчающее сборку», «молекула, облегчающая сборку МНКзима» и «соединение, облегчающее сборку МНКзима», используемые в настоящем документе, относятся к объектам, которые могут облегчать самосборку компонентов-партзимов с образованием каталитически активного МНКзима посредством взаимодействия с сенсорными цепями МНКзима. В настоящем документе соединения, облегчающие сборку, могут облегчать сборку МНКзимов, обладающих расщепляющей или другой ферментативной активностью. В предпочтительных вариантах реализации для самосборки МНКзима требуется соединение, облегчающее сборку. Соединение, облегчающее сборку, может состоять из одной молекулы или может состоять из двух или более «компонентов, облегчающих сборку», которые могут спариваться или связываться с сенсорными цепями одного или более олигонуклеотидных «партзимов». Соединение, облегчающее сборку, может содержать один или более из нуклеотидных компонентов, не обладающий комплементарностью последовательности с сенсорной цепью/ями МНКзима. Соединение, облегчающее сборку, может являться мишенью. Мишень может представлять собой нуклеиновую кислоту, выбранную из группы, состоящей из ДНК, метилированной ДНК, алкилированной ДНК, РНК, метилированной РНК, микроРНК, миРНК, кшРНК, тРНК, мРНК, мякРНК, мвРНК, ммРНК, предшественников микроРНК и первичных микроРНК, других некодирующих РНК, рибосомной РНК, их производных, ампликонов или любых их комбинаций. Нуклеиновую кислоту можно амплифицировать. Амплификация может включать один или более из следующих способов: ПЦР, ОТ-ПЦР, SDA, HDA, RPA, LAMP, RCA, ТМА, 3SR или NASBA.
В настоящем документе термин «обнаружимый эффект» представляет собой эффект, который можно обнаружить или количественно определить в качестве показателя происшедшего расщепления LOCS-зонда/ов. Величина эффекта может указывать на количество исходного соединения, например, соединения, облегчающего сборку (например, мишени). Обнаружимый эффект можно обнаруживать различными способами, включая флуоресцентную спектроскопию, поверхностный плазмонный резонанс, масс- спектроскопию, ЯМР, электронный спиновый резонанс, поляризационную флуоресцентную спектроскопию, круговой дихроизм, иммуноанализ, хроматографию, радиометрию, фотометрию, сцинтиграфию, электронные способы, электрохимические способы, УФ-спектроскопию, спектроскопию в видимой части спектра или инфракрасную спектроскопию, ферментативные способы или любую их комбинацию.
В настоящем документе термины «полинуклеотидный субстрат» и «субстрат» включают любой одноцепочечный или двуцепочечный полимер из дезоксирибонуклеотидных или рибонуклеотидных оснований или их аналогов, производных, вариантов, фрагментов или комбинаций, которые может распознавать, модифицировать или на которые может воздействовать фермент, в том числе каталитический нуклеозим. «Полинуклеотидный субстрат» или «субстрат» можно модифицировать за счет различных ферментативных активностей, включая расщепление, но не ограничиваясь им. Расщепление или разрушение «полинуклеотидного субстрата» или «субстрата» может обеспечить «обнаружимый эффект» для мониторинга каталитической активности фермента. «Полинуклеотидный субстрат» или «субстрат» может расщепляться или разрушаться одним или более ферментами, в том числе каталитическими нуклеозимами, например, МНКзимами, апта-МНКзимами, ДНКзимами, аптазимами, рибозимами и/или белковыми ферментами, например, экзонуклеазами или эндонуклеазами, но не ограничиваясь ими.
В настоящем документе «репортерный субстрат» представляет собой субстрат, в особенности адаптированный для облегчения измерения расщепления субстрата или появления расщепленного продукта катализируемой реакции. Репортерные субстраты могут находиться в растворе в свободном или связанном (или «прикрепленном») состоянии, например, к поверхности или к другой молекуле. Репортерный субстрат можно метить любым из множества способов, в том числе, например, флуорофорами (с одним или более дополнительными компонентами, например, гасителями, или без них), радиоактивными метками, биотином (например, путем биотинилирования) или хемилюминесцентными метками.
В настоящем документе «универсальный субстрат» представляет собой субстрат, например, репортерный субстрат, распознаваемый и подверженный каталитическому действию множества МНКзимов, каждый из которых может распознавать свое соединение, облегчающее сборку. Использование таких субстратов облегчает разработку отдельных способов анализа для обнаружения, идентификации или количественной оценки широкого спектра соединений, облегчающих сборку, с использованием структурно родственных МНКзимов, каждый из которых распознает универсальный субстрат. Каждый из этих универсальных субстратов можно независимо метить одной или более метками. В предпочтительных вариантах реализации независимо обнаруживаемые метки применяют для мечения одного или более универсальных субстратов, что позволяет создать удобную систему для независимого или одновременного обнаружения множества соединений, облегчающих сборку, с использованием МНКзимов. В некоторых вариантах реализации субстраты могут быть подвержены каталитической модификации ДНКзимами, каталитически активными в присутствии кофактора, например, кофактора-иона металла, например, свинца или ртути.
В настоящем документе термин «зонд» относится к олигонуклеотиду, используемому для обнаружения нуклеиновой кислоты-мишени. Неограничивающие примеры зондов включают зонды TaqMan; зонды типа "молекулярный маяк"; и LOCS-зонды, содержащие субстраты нуклеозима в петлевых областях, подверженных каталитическому расщеплению нуклеозимом.
Термин «продукт» относится к новой молекуле или молекулам, которые образуются в результате ферментативной модификации субстрата. В настоящем документе термин «продукт расщепления» относится к новой молекуле, полученной в результате расщепления или эндонуклеазной активности фермента. В некоторых вариантах реализации продукты ферментативного расщепления или разрушения интактной замкнутой LOCS-структуры содержат два олигонуклеотидных фрагмента, способных к гибридизации с образованием раскрытой LOCS-структуры.
В настоящем документе термины «температура плавления» и «Tm» в контексте полинуклеотида следует понимать как упоминание температуры плавления (Tm), рассчитанной с использованием правила Уоллеса, согласно которому Tm=2°С (А+Т)+4°С (G+С) (см. Wallace et al., (1979) Nucleic Acids Res. 6, 3543), если иное не указано явным образом. Влияние состава последовательности на температуру плавления можно понять, используя способ ближайшего соседа, который определяется следующей формулой: Tm (°С)=ΔН° / (ΔS°+R ln[oligo]) - 273,15. Известно, что на температуру плавления, помимо длины стебля и состава последовательности, влияют и другие факторы, включая ионную силу и концентрацию олигонуклеотидов. Более высокая концентрация олигонуклеотида и/или иона увеличивает вероятность образования двуцепочечной структуры, что приводит к повышению температуры плавления. И наоборот, более низкая концентрация олигонуклеотида и/или иона способствует диссоциации стебля, что приводит к снижению температуры плавления.
В настоящем документе термин «гаситель» включает любую молекулу, которая, находясь в непосредственной близости от флуорофора, принимает энергию излучения, генерируемую флуорофором, и либо рассеивает энергию в виде тепла, либо излучает свет с большей длиной волны, чем длина волны излучения флуорофора. Неограничивающие примеры гасителей включают Dabcyl, TAMRA, графен, FRET-флуорофоры, гасители ZEN, гасители АТТО, гасители - "черные дыры" (BHQ) и гасители типа Black Berry (BBQ).
Следует понимать, что в настоящем документе термин «основание» в контексте нуклеиновой кислоты имеет то же значение, что и термин «нуклеотид».
В настоящем документе термин «набор» относится к любой системе доставки материалов. Такие системы доставки включают системы, которые позволяют хранить, транспортировать или доставлять реагенты (например, метки, эталонные образцы, материал подложки и т.д. в соответствующих контейнерах) и/или вспомогательные материалы (например, буферы, письменные инструкции по выполнению анализа и т.д.) из одного места в другое. Например, наборы могут содержать один или более контейнеров, например, коробок, содержащих соответствующие реагенты и/или вспомогательные материалы. Термин «набор» включает как фрагментированные, так и комбинированные наборы.
В настоящем документе термин «фрагментированный набор» относится к системе доставки, включающей два или более отдельных контейнера, каждый из которых содержит часть всех компонентов набора. Контейнеры можно доставлять предполагаемому получателю вместе или по отдельности. Любая система доставки, включающая два или более отдельных контейнера, каждый из которых содержит часть всех компонентов набора, включена в значение термина «фрагментированный набор».
В настоящем документе термин «комбинированный набор» относится к системе доставки, содержащей все компоненты для анализа реакции в одном контейнере (например, в одной коробке, содержащей каждый из нужных компонентов).
Следует понимать, что использование в настоящем документе термина «приблизительно» по отношению к указанному численному значению включает указанное численное значение и численные значения в пределах плюс-минус десять процентов от указанного значения.
Следует понимать, что использование в настоящем документе термина «между» при упоминании диапазона численных значений охватывает численные значения в каждой конечной точке диапазона. Например, полипептид длиной от 10 до 20 остатков включает полипептид длиной 10 остатков и полипептид длиной 20 остатков.
В настоящем документе любое описание документов, описывающих существующий уровень техники, или утверждений, полученных из этих документов или основанных на них, не является признанием того, что документы или полученных из них утверждения являются частью общеизвестных знаний в соответствующей области.
В целях описания все документы, упомянутые в настоящем документе, полностью включены в настоящий документ посредством ссылки, если не указано иное.
Сокращения
В настоящем документе и во всем описании заявки используются следующие сокращения:
LOCS: петля, соединенная со стеблями
МНКзим: многокомпонентный нуклеозим или нуклеозим, состоящий из нескольких частей;
Партзим: частичный фермент, содержащий олигонуклеотид;
ПЦР: полимеразная цепная реакция;
гДНК: геномная ДНК
NTC: контроль, не содержащий матрицы
кПЦР: количественная ПЦР в реальном времени
Ct; пороговый цикл
R2; коэффициент корреляции
нМ; наномолярный
мМ; миллимолярный
мкл; микролитр
dNTP; дезоксирибонуклеотидтрифосфат
NF-H2O: вода, не содержащая нуклеаз;
LNA: закрытая нуклеиновая кислота;
F: флуорофор;
Q: гаситель;
N=А, С, Т, G или любой их аналог;
N' = любой нуклеотид, комплементарный N или способный образовывать пару оснований cN;
(N): любое количество N;
(N'): любое количество N';
W: А или Т;
R: A, G или АА;
rN: любое рибонуклеотидное основание;
(rN): любое количество rN;
rR: А или G;
rY: С или U;
M: А или С;
H: А, С или Т;
D: G, А или Т;
JOE или 6-JOE: 6-карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеин;
FAM или 6-FAM: 6-карбоксифлуоресцеин.
BHQ1: гаситель - "черная дыра" 1
BHQ2: гаситель - "черная дыра" 2
ОТ-ПЦР: полимеразная цепная реакция с обратной транскрипцией
SDA: амплификация с замещением цепи
HDA: амплификация, зависимая от хеликазы
RPA: рекомбиназно-полимеразная амплификация
LAMP: петлевая изотермическая амплификация
RCA: амплификация по типу катящегося кольца
ТАРА: транскрипционно-опосредованная амплификация
3SR: самоподдерживающаяся репликация последовательности
NASBA: амплификация на основе нуклеотидной последовательности
IB: Iowa Black® FQ
IBR: Iowa Black® RQ
кшРНК: короткая шпилечная РНК
миРНК: малая интерферирующая РНК
мРНК: матричная РНК
тРНК: транспортная РНК
мякРНК: малая ядрышковая РНК
мвРНК: малая временная РНК
ммРНК: малая модулирующая РНК
пре-микроРНК: предшественник микроРНК
перв. микроРНК: первичная микроРНК
LHS: левая сторона
RHS: правая сторона
ДЦО: двуцепочечный олигонуклеотид
Tm: температура плавления
RFU: относительные единицы флуоресценции.
Подробное описание изобретения
В следующем подробном описании приведена информация о типичных вариантах реализации настоящего изобретения в достаточных подробностях, чтобы дать возможность специалистам в данной области техники реализовать настоящее изобретение на практике. Особенности или ограничения различных описанных вариантов реализации не обязательно ограничивают другие варианты реализации настоящего изобретения или настоящее изобретение в целом. Следовательно, последующее подробное описание не ограничивает сущность настоящего изобретения, которая определяется исключительно формулой изобретения.
Настоящее изобретение относится к способам и композициям для улучшенного мультиплексного обнаружения мишеней (например, нуклеиновых кислот, белков, анализируемых веществ, соединений, молекул и т.п.). В каждом из способов и композиций используются LOCS-олигонуклеотиды, которые можно применять в комбинации с различными другими средствами.
- LOCS-олигонуклеотиды
Типичные LOCS-олигонуклеотиды согласно настоящему изобретению показаны на фигуре 1. Типичные интактные (замкнутые) LOCS-олигонуклеотиды (фигура 1А, LHS) содержат петлевую область, стеблевую область и пару красителей "флуорофор (Р)/гаситель (Q)". На фигуре 1 показаны два типичных LOCS-олигонуклеотида, обозначенных как интактный LOCS А и интактный LOCS В. Эти LOCS-олигонуклеотиды содержат различающиеся последовательности петель и различающиеся последовательности стеблей. При использовании в комбинации два заданных LOCS-олигонуклеотида согласно настоящему изобретению, как правило, будут отличаться последовательностью и/или длиной стебля. Исключительно в качестве неограничивающего примера, стебель А интактного LOCS А можно сконструировать так, чтобы он плавился при первой температуре, обозначенной как Tm 1; в то время как стебель В интактного LOCS В можно сконструировать так, чтобы он плавился при другой температуре, обозначенной как Tm 3. Расщепление или разрушение петлевых областей интактных LOCS-олигонуклеотидов приводит к образованию раскрытых LOCS-структур (фигура 1А, RHS).
поскольку внутримолекулярные связи прочнее межмолекулярных связей, стеблевые области интактных LOCS-структур обычно плавятся при более высоких температурах, чем стебли раскрытых, расщепленных или разрушенных структур LOCS-олигонуклеотидов. Например, стебель А интактного LOCS А плавится при Tm 1, превышающей Tm 2, которая является температурой, при которой плавится стебель А' раскрытого LOCS (фигура 1В). Аналогичным образом, температура плавления стебля В интактного LOCS В, который плавится при Tm 3, превышает Tm 4, которая является температурой, при которой плавится стебель В' раскрытого LOCS (фигура 1В). Присутствие пика (обнаруживаемого, например, с помощью ассоциированного флуоресцентного маркера) при температуре, соответствующей конкретной раскрытой LOCS-структуре, указывает на присутствие мишени или ампликонов мишени, стимулирующих раскрытие этой конкретной LOCS-структуры. Поскольку стебель раскрытого LOCS А плавится при температуре, отличной от температуры раскрытого LOCS В (фигура 1В), несколько раскрытых LOCS-структур, меченых одним и тем же флуорофором, можно одновременно обнаружить и проанализировать в одной реакционной смеси. Кроме того, несколько раскрытых LOCS-структур, меченых разными флуорофорами, также можно одновременно обнаружить и проанализировать в одной реакционной смеси.
В отношении типичного варианта реализации, изображенного на фигуре 2, последовательность петлевой области LOCS-олигонуклеотида может, например, являться субстратом МНКзима или другой каталитической нуклеиновой кислоты/кислот. В дополнительных вариантах реализации, показанных на фигуре 3А и фигуре 3В, петлевая область LOCS-олигонуклеотида может являться последовательностью, специфичной по отношению к мишени, полностью или частично комплементарной мишени, подлежащей обнаружению, которая в двуцепочечном состоянии может являться субстратом для разрушения экзонуклеазой, например, экзонуклеазной активностью, присущей полимеразе. В еще одном типичном варианте реализации, показанном на фигуре 3В, мишень-специфичная последовательность внутри петли может дополнительно содержать одну цепь двуцепочечного сайта, распознаваемого ферментом рестрикции. Гибридизация последовательности петли с последовательностью-мишенью может привести к получению функционального, расщепляемого сайта рестрикции. В предпочтительных вариантах реализации фермент рестрикции представляет собой никующий фермент, способный расщеплять петлевую цепь LOCS-олигонуклеотида, оставляя мишень интактной.
В некоторых вариантах реализации LOCS-олигонуклеотиды согласно настоящему изобретению можно применять для непосредственного обнаружения мишени. В других типичных вариантах реализации LOCS можно применять для обнаружения ампликонов мишени, генерируемых технологиями амплификации мишеней, включая ПЦР, ОТ-ПЦР, SDA, HDA, RPA, LAMP, RCA, ТМА, 3SR или NASBA, но не ограничиваясь ими. Расщепление или разрушение, приводящие к раскрытию LOCS, могут происходить в реальном времени во время амплификации мишени или после амплификации, в конечной точке реакции. Петлевую область можно раскрыть в результате мишень-зависимого расщепления или разрушения, опосредованного ферментативной активностью каталитической нуклеиновой кислоты, включая МНКзим, ДНКзим, рибозим; или ферментативной активностью белкового фермента, включая экзонуклеазу или эндонуклеазу, но не ограничиваясь ими. В качестве неограничивающего примера, экзонуклеазная активность может представлять собой каталитическую активность, присущую, например, полимеразе. В качестве неограничивающего примера, эндонуклеазная активность может представлять собой каталитическую активность, присущую, например, ферменту рестрикции, включая никующую эндонуклеазу, рибоэндонуклеазу или дуплекс-специфичную нуклеазу (DSN).
Типичная стратегия, согласно которой петлевая область содержит субстрат каталитической нуклеиновой кислоты, показана на фигуре 2. В этой стратегии LOCS-олигонуклеотиды содержат универсальные субстраты, которые можно применять для обнаружения любой мишени. LOCS-олигонуклеотид содержит стеблевую область, пару красителей "флуорофор/гаситель" и промежуточную петлевую область, содержащую универсальный субстрат каталитической нуклеиновой кислоты, например, МНКзима. МНКзим может обнаруживать мишень непосредственно, или его можно применять для обнаружения ампликонов, образующихся во время амплификации мишени. МНКзимы образуются при выравнивании сенсорных цепей партзимов, выполняющих роль датчиков мишени, рядом друг с другом на мишени или на ампликонах мишени с образованием активного каталитического ядра. Петлевая область LOCS-олигонуклеотида связывается с субстрат-связывающими цепями МНКзима, и МНКзим расщепляет субстрат в составе петли, раскрывая LOCS и генерируя флуоресцентный сигнал. Затем реакционную смесь можно охладить, обеспечивая повторный отжиг стебля раскрытой LOCS-структуры. Затем реакционную смесь можно нагреть и выполнить анализ кривой плавления для измерения температуры, при которой плавится стеблевая область раскрытого LOCS. Специалист в данной области техники должен понимать, что мишени можно обнаруживать в реальном времени или по окончании реакции.
Реакционные смеси, предназначенные для одновременного обнаружения нескольких мишеней, могут содержать несколько LOCS-олигонуклеотидов, каждый из которых содержит свой универсальный субстрат внутри петель и свою стеблевую область, способную плавиться при своей температуре после расщепления субстрата/петли различными МНКзимами. LOCS-олигонуклеотиды могут дополнительно содержать одни и те же пары красителей "флуорофор/гаситель". Например, МНКзим 1 может образовываться в присутствии мишени 1 и расщеплять субстрат 1 внутри LOCS-олигонуклеотида 1. В результате получается расщепленная двуцепочечная раскрытая LOCS-структура 1, содержащая стебель 1, плавящийся при температуре 1. Одновременно МНКзим 2 может образовываться в присутствии мишени 2 и расщеплять субстрат 2 внутри LOCS-олигонуклеотида 2, в результате чего получается расщепленная двуцепочечная раскрытая LOCS-структура 2, содержащая стебель 2, плавящийся при температуре 2. При анализе профиля плавления реакционной смеси наличие пика при температуре 1 указывает на присутствие мишени 1; наличие пика при температуре 2 указывает на присутствие мишени 2; а наличие двух пиков при температурах 1 и 2 указывает на присутствие как мишени 1, так и мишени 2. Таким образом, одна длина волны, считываемая на одном канале прибора, позволяет обнаруживать и различать две мишени.
Реакционная смесь может дополнительно содержать дополнительные LOCS, меченные другими парами "флуорофор и гаситель". Например, LOCS-олигонуклеотиды 1 и 2 могут быть мечены флуорофором А, а LOCS-олигонуклеотиды 3 и 4 могут быть мечены флуорофором В. МНКзим 1 может образовываться в присутствии мишени 1 и расщеплять субстрат 1 внутри LOCS-олигонуклеотида 1, в результате чего получается расщепленная двуцепочечная раскрытая LOCS-структура 1, содержащая стебель 1, плавящийся при температуре 1. МНКзим 2 может образовываться в присутствии мишени 2 и расщеплять субстрат 2 внутри LOCS-олигонуклеотида 2, в результате чего получается расщепленная двуцепочечная раскрытая LOCS-структура 2, содержащая стебель 2, плавящийся при температуре 2. МНКзим 3 может образовываться в присутствии мишени 3 и расщеплять субстрат 3 внутри LOCS-олигонуклеотида 3, в результате чего получается расщепленная двуцепочечная раскрытая LOCS-структура 3, содержащая стебель 3, плавящийся при температуре 3. МНКзим 4 может образовываться в присутствии мишени 4 и расщеплять субстрат 4 внутри LOCS-олигонуклеотида 4, в результате чего получается расщепленная двуцепочечная раскрытая LOCS-структура 4, содержащая стебель 4, плавящийся при температуре 4. При анализе профиля плавления реакционной смеси при длине волны возбуждения флуорофора А наличие пика при температуре 1 указывает на присутствие мишени 1; наличие пика при температуре 2 указывает на присутствие мишени 2; а наличие двух пиков при температурах 1 и 2 указывает на присутствие как мишени 1, так и мишени 2. При анализе профиля плавления реакционной смеси при длине волны возбуждения флуорофора В наличие пика при температуре 3 указывает на присутствие мишени 3; наличие пика при температуре 4 указывает на присутствие мишени 4; а наличие двух пиков при температурах 3 и 4 указывает на присутствие как мишени 3, так и мишени 4. Таким образом, такой анализ с использованием двух длин волн, считываемых на двух каналах прибора, позволяет обнаруживать и различать четыре мишени. Квалифицированный специалист должен понимать, что данную стратегию можно расширить для мониторинга расщепления более чем двух мишеней при одной конкретной длине волны, и, кроме того, можно увеличить количество анализируемых флуорофоров до количества, определяемого максимальной способностью имеющегося прибора различать отдельные длины волн.
В отношении типичного варианта реализации, изображенного на фигуре 3, проиллюстрированы две типичные стратегии обнаружения мишени с использованием LOCS-олигонуклеотидов, содержащих петлевые области, специфичные по отношению к мишени и/или ампликону и комплементарные им. В отношении варианта реализации, показанного на фигуре 3А, LOCS-олигонуклеотид содержит стеблевую область, пару красителей "флуорофор-гаситель" и петлевую область, содержащую область, комплементарную ампликону мишени. Во время амплификации петлевая область LOCS-олигонуклеотидов связывается с ампликонами мишени. Во время удлинения праймеров экзонуклеазная активность полимеразы разрушает петлевую область, оставляя стеблевые области интактными и генерируя флуоресцентный сигнал в реальном времени. После амплификации реакционную смесь можно охладить, обеспечивая возможность повторного отжига стебля расщепленной раскрытой LOCS-структуры; а затем можно выполнить анализ кривой плавления для измерения температуры, при которой плавится стеблевая область, полученная из разрушенного раскрытого LOCS. Специалист в данной области техники должен понимать, что мишени можно обнаруживать в реальном времени или по окончании реакции.
В дополнительном типичном варианте реализации, изображенном на фигуре 3В, LOCS-олигонуклеотид содержит стеблевую область, пару красителей "флуорофор/гаситель" и петлевую область, содержащую область, комплементарную мишени, и дополнительно содержащую сайт распознавания для фермента рестрикции, например, никующего фермента. При связывании петлевой области LOCS-олигонуклеотида с мишенью никующий фермент расщепляет петлевую цепь LOCS, оставляя мишень интактной и генерируя флуоресцентный сигнал. Реакционную смесь можно охладить, обеспечивая возможность повторного отжига интактного стебля расщепленной раскрытой LOCS-структуры; а затем можно выполнить анализ кривой плавления для измерения температуры, при которой плавится стеблевая область, полученная из расщепленного раскрытого LOCS. Специалист в данной области техники должен понимать, что мишень можно непосредственно обнаруживать в реакционной смеси без предварительной амплификации. Кроме того, специалист в данной области техники должен понимать, что ампликоны мишени, образующиеся при амплификации мишени, можно обнаруживать в реальном времени или по окончании реакции. В предпочтительных вариантах реализации фермент рестрикции, используемый в комбинации с амплификацией мишени, может быть активным и термостабильным при температуре или температурах реакции.
В дополнительном типичном варианте реализации LOCS-олигонуклеотид может содержать стеблевую область, пару красителей "флуорофор/гаситель" и петлевую область, которая может содержать субстрат ДНКзима или рибозима, например, ДНКзима или рибозима, который может быть каталитически активным только в присутствии иона металла. В данной области техники известно, что специфические ДНКзимы и рибозимы требуют наличия ко фактора-катиона металла для обеспечения каталитической активности. Например, некоторые ДНКзимы и рибозимы могут быть каталитически активными только в присутствии, например, свинца или ртути. Такие металлы могут присутствовать, например, в образце из окружающей среды. Если LOCS-олигонуклеотид содержит петлю, содержащую субстрат для ДНКзима или рибозима, например, зависимого от свинца, то присутствие свинца в образце может привести к расщеплению LOCS и генерации флуоресцентного сигнала. Реакционную смесь можно охладить, обеспечивая возможность повторного отжига интактного стебля расщепленной раскрытой LOCS-структуры; а затем можно выполнить анализ кривой плавления для измерения температуры, при которой плавится стеблевая область, полученная из расщепленного раскрытого LOCS. Специалист в данной области техники должен понимать, что несколько ДНКзимов и/или рибозимов, каждый из которых зависит от конкретного металла-кофактора, можно объединить в одной реакционной смеси, предназначенной для обнаружения нескольких мишеней, например, свинца и ртути. Кроме того, специалист в данной области техники должен понимать, что мишени можно обнаруживать в реальном времени или по окончании реакции.
В настоящем документе упоминание последовательности нуклеотидов, "по существу комплементарной" другой последовательности нуклеотидов, может означать, что первая последовательность по меньшей мере на 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентична комплементарной цепи второй последовательности на протяжении области из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более нуклеотидов.
В настоящем документе последовательность нуклеотидов, "комплементарная" другой последовательности нуклеотидов, может означать, что первая последовательность на 100% идентична комплементарной цепи второй последовательности на протяжении области из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более нуклеотидов.
В настоящем документе упоминание последовательности нуклеотидов, "по существу не комплементарной" другой последовательности нуклеотидов, может означать, что первая последовательность менее чем на 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20%, 25%, 30%, 35% или 40% идентична комплементарной цепи второй последовательности на протяжении области из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более нуклеотидов. В настоящем документе последовательность нуклеотидов, "не комплементарная" другой последовательности нуклеотидов, может означать, что первая последовательность на 0% идентична комплементарной цепи второй последовательности на протяжении области из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более нуклеотидов.
Неограничивающие примеры нуклеиновых кислот-мишеней (т.е. полинуклеотидов), которые можно обнаруживать с использованием LOCS-олигонуклеотидов, могут включать ДНК, метилированную ДНК, алкилированную ДНК, комплементарную ДНК (кДНК), РНК, метилированную РНК, микроРНК, миРНК, кшРНК, мРНК, тРНК, мякРНК, мвРНК, ммРНК, предшественники микроРНК и первичные микроРНК, другие некодирующие РНК, рибосомную РНК, их производные, их ампликоны или любую их комбинацию (включая смешанные полимеры из дезоксирибонуклеотидных и рибонуклеотидных оснований).
В некоторых вариантах реализации температура плавления («Tm») интактного LOCS-олигонуклеотида превышает Tm раскрытой LOCS-структуры.
Анализ флуоресцентных сигналов
Флуоресцентные сигналы, генерируемые за счет диссоциации раскрытых LOCS-структур, можно анализировать любым подходящим способом обнаружения, дифференциации и/или количественного определения молекул-мишеней в соответствии со способами согласно настоящему изобретению.
Несмотря на то, что можно использовать стандартные анализы кривой плавления, в настоящем документе описаны и проиллюстрированы различные другие подходы (см. "Примеры"), которые можно применять для анализа в различных форматах.
В качестве неограничивающего примера, в различные моменты времени в ходе реакции, подходящей для обнаружения расщепления или разрушения петлевых областей LOCS-олигонуклеотидов, можно выполнить измерения сигнала флуоресценции при одной температуре или при нескольких температурах. В качестве неограничивающих примеров, эти моменты времени могут включать (i) момент времени в начале реакции и/или (i) один момент времени или несколько моментов времени в ходе реакции; и/или (iii) момент завершения или конечной точки реакции.
В некоторых вариантах реализации измерение флуоресцентного сигнала можно выполнять при двух или более температурах в каждом цикле во время ПЦР-амплификации. Анализ можно выполнять путем сравнения уровней флуоресценции, полученных при первой и/или второй температуре и/или при другой температуре.
В других вариантах реализации измерение флуоресцентного сигнала можно выполнять при двух или более температурах в каждом цикле во время ПЦР, и можно построить кривые амплификации для каждой серии измерений, полученных при каждой температуре. Каждому графику амплификации можно присвоить пороговые значения флуоресценции для каждой конкретной температуры, а значения Cq можно измерять как номер цикла, во время которого графики амплификации пересекают пороговые значения. В вариантах реализации, где флуоресцентный сигнал измеряют при двух температурах в каждом цикле во время ПЦР, Cq, измеренный с использованием флуоресцентного сигнала при более низкой температуре, может обеспечивать прямое количественное определение начальной концентрации первой мишени; a Cq, измеренный с использованием флуоресцентного сигнала при более высокой температуре, можно проанализировать, как показано в примере 12, что позволяет количественно определить исходную концентрацию второй мишени.
В качестве неограничивающего примера, измерения флуоресценции после амплификации по сравнению с контролем без матрицы при двух температурах, включая первую температуру, равную или превышающую температуру плавления первого раскрытого LOCS и уступающую температуре плавления второго раскрытого LOCS; и вторую температуру, равную или превышающую температуру плавления второго раскрытого LOCS, позволяют специфично обнаруживать первый и второй расщепленный раскрытый LOCS. Как показано в примере 15 (способ анализа А), при первой температуре расщепление первого LOCS генерирует значительный сигнал флуоресценции по сравнению с контрольной реакционной смесью без матрицы, пересекающий заранее определенный порог. При этой первой температуре интактные замкнутые первый и второй LOCS и/или расщепленный раскрытый второй LOCS не вносят значительного вклада в продукцию сигнала флуоресценции из-за более высоких температур плавления замкнутых первого и второго LOCS и раскрытого второго LOCS, и их сигнал не пересекает заранее определенный порог. При второй температуре, превышающей первую температуру, расщепление второго LOCS генерирует значительный сигнал флуоресценции по сравнению с контролем без матрицы, который пересекает заранее определенный порог, тогда как интактные замкнутые первый и второй LOCS и/или раскрытый первый LOCS не вносят значительного вклада в продукцию сигнала флуоресценции по сравнению с контролем без матрицы, и их сигнал не пересекает заранее определенный порог. Обнаружение каждого расщепленного LOCS-репортера указывает на наличие соответствующей мишени в образце.
В качестве неограничивающего примера, измерения флуоресценции после амплификации по сравнению с исходной контрольной флуоресценцией при конкретных значениях температуры, включая первую температуру, равную или превышающую температуру плавления первого замкнутого LOCS и уступающую температуре плавления второго замкнутого LOCS; и вторую температуру, равную или превышающую температуру плавления второго замкнутого LOCS, позволяют специфично обнаруживать первый и второй расщепленный раскрытый LOCS.
Как показано в примере 15 (способ анализа В), исходную контрольную флуоресценцию можно получить путем измерения флуоресценции при температуре, при которой ни один из раскрытых и/или замкнутых LOCS не генерирует значительного сигнала флуоресценции (температура-0), или ниже этой температуры. Анализ можно выполнять путем сравнения уровней флуоресценции, полученных при первой и/или второй температуре и температуре-0, и сравнения этих относительных уровней флуоресценции с заранее определенным порогом. Как показано в примере 15, при первой температуре расщепление первого LOCS генерирует значительный сигнал флуоресценции по сравнению с сигналом при температуре-0, который пересекает заранее определенный порог. При этой первой температуре интактные замкнутые первый и второй LOCS и/или расщепленный раскрытый второй LOCS не вносят значительного вклада в продукцию сигнала флуоресценции, и сигналы не пересекают заранее определенный порог. Это связано с более высокими температурами плавления замкнутых первого и второго LOCS и раскрытого второго LOCS. При второй температуре, превышающей первую температуру, расщепление второго LOCS генерирует значительный сигнал флуоресценции по сравнению с сигналом, полученным при температуре-0, и/или при первой температуре, и сигнал пересекает заранее определенный порог. При этой второй температуре интактный замкнутый первый и/или второй LOCS и раскрытый первый LOCS не вносят значительного вклада в продукцию сигнала флуоресценции по сравнению с сигналом при температуре-0 и/или первой температуре, и сигнал не пересекает предварительно определенный порог. Обнаружение каждого расщепленного LOCS-репортера указывает на наличие соответствующей мишени в образце.
В качестве неограничивающего примера, контрольную исходную флуоресценцию также можно получить путем измерения флуоресценции при первой и второй температурах в дополнительные моменты времени при инициировании реакции, например, перед ПЦР. В этот дополнительный момент времени все LOCS являются интактными (замкнутыми), не генерируют значительного сигнала флуоресценции, который не пересекает заранее определенный порог. Анализ можно выполнить путем сравнения уровней флуоресценции, полученных при первой и второй температуре в момент времени при инициировании реакции, и уровней флуоресценции, полученных при первой и второй температуре в момент времени во время и/или после реакции (например, во время ПЦР или после ПЦР). Как показано в примере 15 (способ анализа С), при первой температуре и в момент времени после ПЦР расщепление первого LOCS генерирует значительный сигнал флуоресценции по сравнению с сигналом интактного замкнутого первого LOCS, измеренным при первой температуре и в момент времени до ПЦР. Этот относительный сигнал пересекает заранее определенный порог. При этой первой температуре интактные замкнутые первый и второй LOCS и/или расщепленный раскрытый второй LOCS не вносят значительного вклада в продукцию сигнала флуоресценции по сравнению с сигналом, полученным перед ПЦР, из-за более высоких температур плавления замкнутых первого и второго LOCS и раскрытого второго LOCS. При второй температуре, превышающей первую температуру, и в момент времени после ПЦР расщепление второго LOCS генерирует значительный сигнал флуоресценции по сравнению с сигналом, полученным при второй температуре в момент времени перед ПЦР. При этой второй температуре и в момент времени после ПЦР интактный замкнутый первый или второй LOCS и/или раскрытый первый LOCS не вносят значительного вклада в продукцию сигнала флуоресценции по сравнению с моментом времени перед ПЦР при такой же второй температуре, и сигнал не пересекает заранее определенный порог. В качестве альтернативы, разность между относительным сигналом, полученным до и после ПЦР при второй температуре, и относительным сигналом, полученным до и после ПЦР при первой температуре, можно сравнить с заранее определенным порогом для определения наличия расщепленного второго LOCS; причем в присутствии раскрытого второго LOCS значение разности превышает заранее определенный порог, а в его отсутствие значение разности не достигает заранее определенного порога, как показано в примере 15 (способ анализа С). Обнаружение каждого расщепленного LOCS-репортера указывает на наличие соответствующей мишени в образце.
В качестве неограничивающего примера, другим альтернативным способом является измерение высоты пика плавления в сигнатуре плавления, которая эквивалентна значению dФлуоресценция/dТемпература (dF/dT) при Tm каждого расщепленного LOCS. Однако применимость этого способа не ограничивается определением значения dF/dT при Tm расщепленного LOCS, но также включает диапазон температур, в который входит Тm. Значение dF/dT при первой или второй температуре (А °С) эквивалентно градиенту уровня флуоресценции между (А - N)°С и (А+N)°С. Как показано в примере 15 (способ анализа D), значение dF/dT при первой температуре, рассчитанное по сигналам флуоресценции при (первая температура + N)°С и (первая температура - N)°С, превышает предварительно определенный порог только при наличии раскрытого первого LOCS. Значение dF/dT при второй температуре, превышающей первую температуру, рассчитанное по сигналам флуоресценции при (вторая температура + N)°С и (вторая температура - N)°С, превышает заранее определенный порог только при наличии раскрытого второго LOCS. Обнаружение каждого расщепленного LOCS-репортера указывает на присутствие соответствующего гена-мишени в образце. dF/dT при первой и второй температурах можно выразить как отношение, уникальное для каждой из возможных комбинаций раскрытого и LOCS. Эту информацию можно использовать для обнаружения конкретного раскрытого LOCS и, следовательно, соответствующей мишени, путем определения того, попадает ли это отношение в заранее заданный диапазон значений.
В некоторых вариантах реализации сигналы флуоресценции или их производные при первой, второй и/или дальнейших температурах сравнивают с заранее определенным порогом, причем сигнал расщепленного раскрытого первого LOCS пересекает заранее определенный порог при первой температуре, сигнал расщепленного раскрытого LOCS пересекает заранее определенный порог при второй температуре, а сигналы интактных замкнутых первого и второго LOCS не пересекают заранее определенные пороговые значения при первой и второй температурах. Следовательно, практическую ценность заранее определенных пороговых значений при первой и второй температурах можно использовать для обнаружения расщепленных раскрытых первого и второго LOCS. Обнаружение расщепленных раскрытых первого и второго LOCS указывает на присутствие первого и второго гена-мишени в образце. В других вариантах реализации сигналы флуоресценции или их производные при первой, второй и/или дальнейших температурах можно выразить в виде отношения, причем существует уникальное значение этого отношения для каждой из возможных комбинаций раскрытого и/или замкнутого LOCS. Эти уникальные значения отношения можно использовать для обнаружения расщепленных раскрытых первого и второго LOCS, и они указывают на присутствие первого и второго гена-мишени в образце.
В некоторых вариантах реализации описано обнаружение, дифференциация и/или количественная оценка первой и второй мишеней с использованием первого и второго LOCS на одном канале флуоресценции. Однако специалист в данной области техники должен понимать, что эти способы применимы для обнаружения, дифференциации и/или количественной оценки более чем двух мишеней, как показано в примере 15.
Типичные варианты применения LOCS-олигонуклеотидов
- Обнаружение мишеней во время или после амплификации мишени
LOCS-олигонуклеотиды согласно настоящему изобретению можно применять для определения присутствия амплифицированных нуклеотидных последовательностей-мишеней. Не существует особых ограничений в отношении способов амплификации, при которых можно применять LOCS-репортеры. Ампликоны, получаемые в ходе различных реакций, можно обнаруживать с помощью LOCS-репортеров при условии, что присутствие ампликонов-мишеней может способствовать расщеплению или разрушению LOCS-репортер а с образованием раскрытых LOCS-структур. Неограничивающие примеры способов, применимых для расщепления или разрушения петлевых областей, содержащихся в LOCS-структурах, включают расщепление МНКзимами, ДНКзимами, рибозимами, ферментами рестрикции, эндонуклеазами или разрушение экзонуклеазами, включая экзонуклеазную активность полимеразы, но не ограничиваясь ей.
Как правило, в способах амплификации нуклеиновых кислот используют ферменты (например, полимеразы) для получения копий нуклеиновой кислоты-мишени, специфически связываемой одним или более олигонуклеотидными праймерами. Неограничивающие примеры способов амплификации, при которых можно применять LOCS-олигонуклеотиды, включают один или более из полимеразной цепной реакции (ПЦР), полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР), амплификации с замещением цепи (SDA), амплификации, зависимой от хеликазы (HDA), рекомбиназно-полимеразной амплификации (RPA), петлевой изотермической амплификации (LAMP), амплификации по типу катящегося кольца (RCA), транскрипционно-опосредованной амплификации (ТМА), самоподдерживающейся репликации последовательности (3SR), амплификации на основе последовательности нуклеиновой кислоты (NASBA).
Квалифицированный читатель должен понимать, что варианты применения LOCS-олигонуклеотидов, описанные выше, представлены исключительно в качестве неограничивающих примеров. Раскрытые LOCS-олигонуклеотиды можно применять при любом способе амплификации нуклеиновых кислот на основе праймеров, и настоящее изобретение не ограничивается конкретными описанными вариантами реализации.
Обнаружение ампликонов, полученных с помощью LOCS-репортеров
Как обсуждалось выше, LOCS-репортеры согласно настоящему изобретению можно применять в любом способе амплификации полинуклеотидов, неограничивающие примеры которых включают ПЦР, ОТ-ПЦР, SDA, HDA, RPA, LAMP, RCA, ТМА, 3SR или NASBA.
Ампликоны получают с помощью способов, в которых применяют LOCS-репортеры, которые можно расщеплять или разрушать, используя любой подходящий способ, известный в данной области техники. Неограничивающие примеры включают применение каталитических нуклеиновых кислот, экзонуклеаз (см. пример 11), эндонуклеаз (см. пример 10) и т.п.
МНКзим можно применять для раскрытия LOCS-репортеров посредством обнаружения ампликонов, полученных такими способами, как ПЦР, ОТ-ПЦР, SDA, HDA, RPA, ТМА, LAMP, RCA, 3SR и NASBA. МНКзим может содержать один или более партзимов. МНКзимы представляют собой многокомпонентные нуклеозимы, собирающиеся и являющиеся каталитически активными только в присутствии соединения, облегчающего сборку, которое может представлять собой, например, обнаружимую мишень, например, ампликон, полученный из полинуклеотидной последовательности с использованием праймеров. МНКзимы состоят из множества "частичных ферментов" или партзимов, которые подвергаются самосборке в присутствии одного или более соединений, облегчающих сборку, и образуют активные МНКзимы, каталитически модифицирующие субстраты. Субстрат и соединения, облегчающие сборку (мишень), представляют собой отдельные молекулы нуклеиновой кислоты. Партзимы содержат несколько доменов, включая (i) сенсорные цепи, связывающиеся с соединением, облегчающим сборку (например, нуклеиновой кислотой-мишенью); (ii) субстратные цепи, связывающие субстрат, и (iii) последовательности-фрагменты каталитического ядра, которые после сборки объединяются, образуя полноценное каталитическое ядро. МНКзимы можно сконструировать таким образом, чтобы они распознавали широкий спектр соединений, облегчающих сборку, включая, например, различные нуклеотидные последовательности-мишени. В ответ на присутствие соединения, облегчающего сборку, МНКзимы модифицируют свои субстраты. Эта модификация субстрата может быть связана с генерацией сигнала, и, таким образом, МНКзимы могут генерировать выходной сигнал, усиленный за счет фермента. Соединение, облегчающее сборку, может являться нуклеиновой кислотой-мишенью, присутствующей в биологическом образце или образце из окружающей среды (например, ампликоном, полученным из полинуклеотидной мишени с использованием праймеров). В таких случаях обнаружение модификации субстрата за счет активности МНКзима указывает на присутствие мишени. В данной области техники известно несколько МНКзимов, способных расщеплять субстраты-нуклеиновые кислоты. МНКзимы и их модифицированные формы известны в данной области техники и описаны в публикациях патентов РСТ №WO/2007/041774, WO/2008/040095, WO2008/122084 и соответствующих публикациях патентов США №2007-0231810, 2010-0136536 и 2011-0143338 (содержание каждого из этих документов полностью включено в настоящий документ посредством ссылки).
Диагностические варианты применения
LOCS-олигонуклеотиды можно применять для диагностических и/или прогностических целей в соответствии со способами, описанными в настоящем документе. Диагностические и/или прогностические методы можно выполнять ex vivo или in vitro. В то же время способы согласно настоящему изобретению не обязательно использовать для диагностических и/или прогностических целей, и, следовательно, варианты применения, которые не являются диагностическими или прогностическими, также рассматриваются в настоящем изобретении.
В некоторых вариантах реализации способы, описанные в настоящем документе, можно использовать для диагностики инфекции у субъекта. Например, указанные способы можно использовать для диагностики инфекции, вызванной бактериями, вирусами, грибами/дрожжами, простейшими и/или нематодами у субъекта. В одном варианте реализации вирус может являться энтеровирусом. Субъектом могут являться виды крупного рогатого скота, лошадей, овец, приматов, птиц или грызунов. Например, субъектом может являться млекопитающее, например, человек, собака, кошка, лошадь, овца, коза или корова. Субъект может страдать заболеванием, вызванным инфекцией. Например, у субъекта может быть менингит, вызванный энтеровирусной инфекцией. Соответственно, в некоторых вариантах реализации способы согласно настоящему изобретению можно применять для диагностики менингита.
Способы согласно настоящему изобретению можно выполнять в отношении образца. Образец может происходить из любого источника. Например, образец может быть получен из окружающей среды, из промышленного источника или путем химического синтеза.
Следует понимать, что рассматриваемый в настоящем документе термин «образец» включает образец, модифицированный по сравнению со своим исходным состоянием, например, путем очистки, разбавления или добавления любого другого компонента или компонентов.
Способы согласно настоящему изобретению, включая диагностические и/или прогностические способы, но не ограничиваясь ими, можно выполнять в отношении биологического образца. Биологический образец может быть взят у субъекта. Кроме того, можно использовать хранящиеся биологические образцы. Неограничивающие примеры подходящих биологических образцов включают цельную кровь или ее компонент (например, клетки крови, плазму, сыворотку), мочу, кал, слюну, лимфу, желчь, мокроту, слезы, спинномозговую жидкость, жидкость бронхоальвеолярного лаважа, синовиальную жидкость, сперму, асцитную опухолевую жидкость, грудное молоко и гной.
Наборы
В настоящем изобретении предложены наборы, содержащие один или более из агентов для выполнения способов согласно настоящему изобретению. Обычно наборы для осуществления способов согласно настоящему изобретению содержат все необходимые реагенты для осуществления способа.
В некоторых вариантах реализации наборы могут содержать олигонуклеотидные компоненты, способные образовывать МНКзим в присутствии подходящего соединения, облегчающего сборку (например, ампликона, описанного в настоящем документе). Например, набор может содержать по меньшей мере первый и второй олигонуклеотидный компонент, содержащие первый и второй партзим, и второй контейнер, содержащий субстрат, причем самосборка первого и второго партзимов и субстрата в МНКзим требует ассоциации соединения, облегчающего сборку (например, ампликона), присутствующего в тестируемом образце. Соответственно, в таком варианте реализации первый и второй партзимы и LOCS-олигонуклеотид, содержащий субстрат в петлевой области, можно вносить в тестовый образец для определения присутствия одного или более ампликонов-мишеней. Как правило, наборы содержат по меньшей мере один LOCS-олигонуклеотид, предложенный в настоящем документе.
Обычно наборы согласно настоящему изобретению также содержат другие реагенты, реагенты для промывки, ферменты и/или другие реагенты, необходимые для выполнения способов согласно настоящему изобретению, например, ПЦР или других способов амплификации нуклеиновых кислот.
Наборы могут являться фрагментированными наборами или комбинированными наборами, согласно определениям в настоящем документе.
Фрагментированные наборы содержат реагенты, помещенные в отдельные контейнеры, и могут содержать небольшие стеклянные контейнеры, пластиковые контейнеры или полоски пластмассы или бумаги. Такие контейнеры могут обеспечивать эффективный перенос реагентов из одного отделения в другое, избегая при этом перекрестного загрязнения образцов и реагентов, а также количественное добавление агентов или растворов, содержащихся в каждом контейнере, из одного отделения в другое.
Такие наборы могут также содержать контейнер, в который вносят тестируемый образец, контейнер, содержащий реагенты, используемые при анализе, контейнеры, содержащие реагенты для промывки, и контейнеры, содержащие реагент, обеспечивающий обнаружение.
Комбинированные наборы содержат все компоненты для анализа реакции в едином контейнере (например, в единой коробке, в которой находится каждый из нужных компонентов).
Набор согласно настоящему изобретению может также содержать инструкции по эксплуатации компонентов набора для выполнения соответствующих способов. Наборы и способы согласно настоящему изобретению можно применять в сочетании с оборудованием и системами автоматизированного анализа, например, включая аппараты для ПЦР в реальном времени, но не ограничиваясь ими.
При амплификации, обнаружении, идентификации или количественном определении различных мишеней можно применять один набор согласно настоящему изобретению, или, в качестве альтернативы, могут потребоваться различные наборы, например, содержащие реагенты, специфичные по отношению к каждой мишени. Способы и наборы согласно настоящему изобретению находят применение в любых обстоятельствах, при которых желательно обнаруживать, идентифицировать или количественно определять любой объект.
Специалисты в данной области техники должны понимать, что в настоящее изобретение, описанное в виде конкретных вариантов реализации, можно вносить многочисленные изменения и/или модификации, не выходящие за рамки сущности настоящего изобретения, описанной в широком смысле слова. Таким образом, настоящие варианты реализации во всех отношениях следует рассматривать как иллюстративные, а не как ограничительные.
Примеры
Настоящее изобретение будет описано в дополнительных подробностях с упоминанием следующих конкретных примеров, в отношении которых не следует считать, что они каким-либо образом ограничивают сущность изобретения.
Пример 1: Использование LOCS-репортеров для увеличения количества анализируемых мишеней
В следующем примере LOCS-репортеры применяли для увеличения количества мишеней, которые можно обнаружить на одном канале флуоресценции. В этом примере два LOCS-репортера были мечены по 5'-концу флуорофором (FAM), а по 3'-концу - гасителем. Петлевые области LOCS-репортеров содержали нуклеиновую кислоту-субстрат, а стеблевые области содержали серию комплементарных пар оснований, удерживающих LOCS-репортер в конфигурации "стебель-петля". В этой конфигурации флуорофор и гаситель находились в непосредственной близости, и в отсутствие мишени флуоресценция гасилась.
Олигонуклеотиды
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: LOCS-1 (SEQ ID NO: 1), LOCS-2 (SEQ ID NO: 2), партзим A1 (SEQ ID NO: 3), партзим B1 (SEQ ID NO: 4), партзим A2 (SEQ ID NO: 5), партзим B2 (SEQ ID NO: 6), прямой праймер 1 (SEQ ID NO: 7), обратный праймер 1 (SEQ ID NO: 8), прямой праймер 2 (SEQ ID NO: 9) и обратный праймер 2 (SEQ ID NO: 10). Последовательности перечислены в перечне последовательностей. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению MgPa, представляли собой LOCS-1, партзим А1, партзим В1, прямой праймер 1 и обратный праймер 1. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению TV-Btub, представляли собой LOCS-2, партзим А2, партзим В2, прямой праймер 2 и обратный праймер 2.
Условия реакции
Амплификацию в реальном времени и обнаружение последовательности-мишени выполняли в общем реакционном объеме 20 мкл с использованием термоциклера BioRad® CFX96. Параметры цикла представляли собой: 95°С в течение 2 минут, 10 циклов снижения, включавших 95°С в течение 5 секунд и 61°С в течение 30 секунд (уменьшение на 0,5°С за цикл) и 40 циклов, включавших 95°С в течение 5 секунд и 52°С в течение 40 секунд (данные получали на этапе 52°С). Параметры кривой плавления представляли собой диапазон от 20°С до 90°С с шагом 0,5°С и выдержкой 5 секунд (регистрацию данных выполняли на этапе выдержки). Все реакции выполняли в двух повторностях, реакционные смеси содержали 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима А, 200 нМ каждого партзима В, 200 нМ каждого LOCS-репортера, 2 мМ MgCl2 (Bioline) и 1х смесь SensiFAST Probe No-ROX (Bioline). Реакционные смеси содержали матрицу G-Block (10000 или 40 копий), гомологичную генам MgPa и/или TV-Btub, либо не содержали мишени (H2O без нуклеаз (NF H2O)).
Результаты
Используя способ амплификации мишени in vitro, известный как ПЦР, два МНКзима (МНКзим 1 и МНКзим 2) использовали для мониторинга амплификации нуклеиновых кислот-мишеней в режиме реального времени посредством расщепления соответствующих LOCS-репортеров (LOCS-1 и LOCS-2, соответственно). МНКзим 1 был предназначен для обнаружения последовательностей, гомологичных гену MgPa (Mycoplasma genitalium), и для расщепления и раскрытия LOCS-1; а МНКзим 2 был предназначен для обнаружения последовательностей, гомологичных TV-Btub (Trichomonas vaginalis), и расщепления и раскрытия LOCS-2. В этом эксперименте амплификацию и обнаружение выполняли в одной пробирке, содержащей все МНКзимы, праймеры и LOCS-олигонуклеотиды. Присутствие MgPa или TV-Btub или как MgPa, так и TV-Btub (представляющих образец с совместной инфекцией) обнаруживали по увеличению сигнала на канале FAM.
В результатах, показанных на фигуре 4, приведены соответствующие графики ПЦР-амплификации, полученные при использовании реакционных смесей, содержащих 10000 копий (черная линия), 40 копий (серая линия) или 0 копий (пунктирная линия) мишеней MgPa (фигура 4А), TV-Btub (фигура 4С) или как MgPa, иак и TV-Btub (фигура 4Е). Сигнатуры кривой плавления, полученные после амплификации реакционных смесей, содержащих 10000 копий (черная линия) и 40 копий (серая линия), показаны для мишеней MgPa (фигура 4 В), TV-Btub (фигура 4D) или как MgPa, так и TV-Btub (фигура 4F). Результаты представляли собой средние значения реакций в двух повторностях, построенные с помощью Microsoft Excel (версия 14). Данные, полученные в этом примере, демонстрируют, что сигнатуры плавления LOCS, полученные в присутствии гена-мишени MgPa (Tm=35°C и 41°C), отличались от сигнатур плавления LOCS, полученных в присутствии гена-мишени TV-Btub (Tm=50°С). Кроме того, сигнатуры плавления LOCS в присутствии генов-мишеней MgPa и TV-Btub также отличались от вышеупомянутых сигнатур плавления, полученных в присутствии только одного гена-мишени. В присутствии обеих мишеней сигнатура кривой плавления (Tm=35°С, 41°С и 50°С) указывала на обнаружение обеих мишеней.
Данные этого эксперимента также демонстрируют, что сигнатуры плавления каждого раскрытого LOCS воспроизводились для реакционных смесей, содержавших высокие (10000 копий гена) и низкие концентрации мишени (40 копий гена). Этот пример демонстрирует, что две мишени, совместно амплифицированные в одной лунке при использовании одного флуоресцентного канала, можно различать на основе их уникальных сигнатур плавления LOCS. В примере представлен простой способ, который можно применять для обнаружения нескольких мишеней в одной лунке с использованием одного канала флуоресценции.
Температуры плавления (Tm) интактных замкнутых LOCS-репортеров были спроектированы так, чтобы они превышали температуры отжига реакционной смеси (52°С), и эти LOCS в достаточной степени подвергались действию гасителя во время реакции в отсутствие амплификации мишени. Tm стеблевых областей были спроектированы так, чтобы они были уникальными для каждого LOCS-репортера, и это достигалось путем изменения длины и нуклеотидного состава комплементарных областей, образующих стебель. В этом примере данные согласуются со сценарием, согласно которому расщепление петлевых областей с использованием МНКзимов приводит к раскрытию LOCS, что позволяет разделить его на два фрагмента. Из-за большой разности Tm между замкнутыми интактными LOCS-репортерами и раскрытыми LOCS-репортерами раскрытые фрагменты LOCS недостаточно стабильны, чтобы поддерживать образование двуцепочечной структуры при температуре отжига и сбора данных, и поэтому генерируется сигнал флуоресценции.
Мониторинг двух генов-мишеней в реальном времени генерировал кривые флуоресценции, которые пересекали произвольный порог, позволяя получить значение, которое может быть известно как Ct (пороговый цикл). Наблюдаемая кривая флуоресценции во время этапа амплификации указывала на присутствие одного или обоих генов-мишеней в данном образце. Однако идентифицировать конкретную мишень с помощью одних только кривых амплификации нельзя. В этой ситуации выполнили анализ кривой плавления с целью определить, какой LOCS-репортер был расщеплен, и тем самым идентифицировать конкретный(е) ген(ы)-мишень(и), присутствующий(е) в образце. После стадии амплификации образцы подвергали воздействию температурного градиента, причем различные характеристики кривой плавления соответствовали различным универсальным стеблям. Из-за различий Tm раскрытых и интактных LOCS-репортеров стебли расщепленных LOCS-репортеров диссоциируют при более низких температурах по сравнению с нерасщепленными замкнутыми LOCS-репортерами. Кроме того, из-за разной длины стебля и состава пар оснований разные стебли (стебель-1 и стебель-2) в составе LOCS-1 и LOCS-2 позволяли получить уникальные сигнатуры флуоресцентной кривой плавления.
Пример 2: Применение одних и тех же LOCS-репортеров для обнаружения различных генов-мишеней
В этом примере два LOCS-репортера (LOCS-1 и LOCS-2) использовали для различения множества различных генетических мишеней с целью демонстрации их универсальности и применимости для анализа любой рассматриваемой мишени. При использовании ПЦР-амплификации для обнаружения специфических генов-мишеней и расщепления соответствующих LOCS-репортеров (LOCS-1 и LOCS-2) использовали несколько МНКзимов (МНКзимы 1-6). Каждый из МНКзимов 1, 3 и 4 обладал способностью расщеплять LOCS-1 в присутствии соответствующих генов-мишеней. Каждый из МНКзимов 2, 5 и 6 обладал способностью расщеплять LOCS-2 в присутствии соответствующих генов-мишеней. В этом примере показаны комбинации двуцепочечных структур, представленные в таблице 1, для которых амплификацию и обнаружение выполняют одновременно в одной пробирке.
Олигонуклеотиды
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: LOCS-1 (SEQ ID NO: 1), LOCS-2 (SEQ ID NO: 2), партзим A1 (SEQ ID NO: 3), партзим B1 (SEQ ID NO: 4), партзим A2 (SEQ ID NO: 5), партзим B2 (SEQ ID NO: 6), прямой праймер 1 (SEQ ID NO: 7), обратный праймер 1 (SEQ ID NO: 8), прямой праймер 2 (SEQ ID NO: 9), обратный праймер 2 (SEQ ID NO: 10), партзим A3 (SEQ ID NO: 11), партзим B3 (SEQ ID NO: 12), партзим A4 (SEQ ID NO: 13), партзим B4 (SEQ ID NO: 14), прямой праймер 3 (SEQ ID NO: 15), обратный праймер 3 (SEQ ID NO: 16), прямой праймер 4 (SEQ ID NO: 17), обратный праймер 4 (SEQ ID NO: 18), партзим A5 (SEQ ID NO: 19), партзим B5 (SEQ ID NO: 20), партзим A6 (SEQ ID NO: 21), партзим B6 (SEQ ID NO: 22), прямой праймер 5 (SEQ ID NO: 23), обратный праймер 5 (SEQ ID NO: 24), прямой праймер 6 (SEQ ID NO: 25) и обратный праймер 6 (SEQ ID NO: 26). Последовательности перечислены в перечне последовательностей.
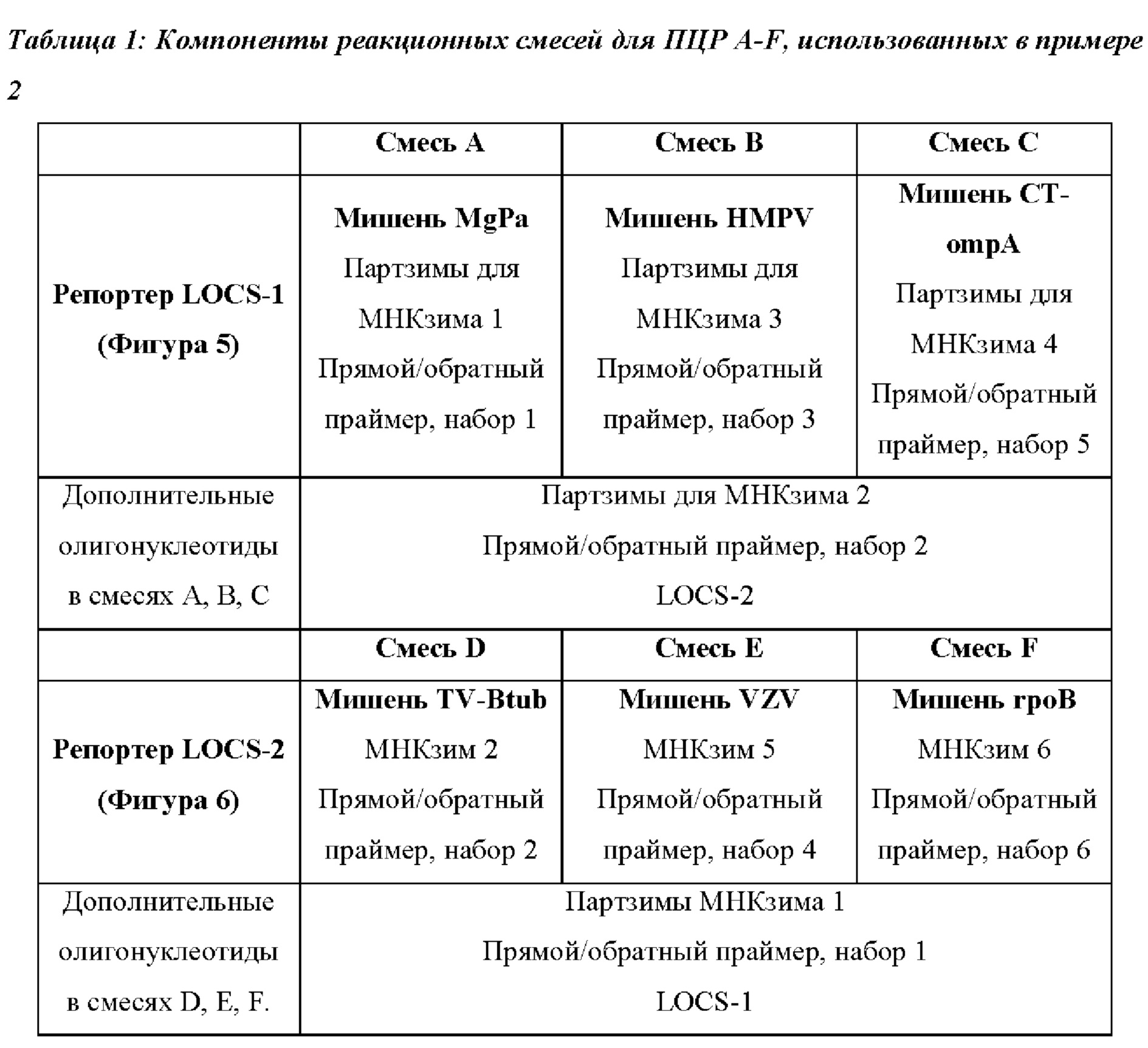
Компоненты и условия реакции.
Амплификацию в реальном времени и обнаружение последовательности-мишени выполняли в общем реакционном объеме 20 мкл с использованием термоциклера BioRad® CFX96. Параметры цикла представляли собой: 95°С в течение 2 минут, 10 циклов снижения, включавших 95°С в течение 5 секунд и 61°С в течение 30 секунд (уменьшение на 0,5°С за цикл) и 40 циклов, включавших 95°С в течение 5 секунд и 52°С в течение 40 секунд (данные получали на этапе 52°С). Параметры кривой плавления представляли собой диапазон от 20°С до 90°С с шагом 0,5°С и выдержкой 5 секунд (регистрацию данных выполняли на этапе выдержки). Все реакции выполняли как дуплексные реакции, содержащие олигонуклеотиды, указанные в таблице 1. Каждая реакционная смесь содержала 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима А, 200 нМ каждого партзима В, 200 нМ каждого LOCS-ре портера, 2 мМ MgCl2 (Bioline) и 1х смесь SensiFAST Probe No-ROX (Bioline). Реакционные смеси содержали матрицу G-Block (10000 или 40 копий) либо не содержали мишени (NF H2O). Результаты, представленные на фигурах 5 и 6, представляли собой средние значения для двух повторностей, построенные с помощью Microsoft Excel (версия 14).
Результаты
Результаты, показанные на фигуре 5 (верхняя панель), демонстрируют графики ПЦР-амплификации, полученные для реакционных смесей, содержащих 10000 копий (черная линия), 40 копий (серая линия) или 0 копий (пунктирная линия) MgPa (фигура 5А1), HMPV (фигура 5 В1) и СТ-ompA (фигура 5С1). Результаты, показанные на нижней панели, представляют собой сигнатуры кривой плавления, полученной для реакционных смесей, содержащих 10000 копий (черная линия) и 40 копий (серая линия) генов-мишеней MgPa (фигура 5А2), HMPV (фигура 5 В2) и СТ-ompA (фигура 5С2). Эти три мишени были специфично обнаружены с использованием МНКзимов 1, 3 и 5, каждый из которых содержал мишень-специфичные сенсорные цепи, однако субстрат-связывающие цепи для всех из них были идентичны. Каждый МНКзим, однажды сформированный в присутствии своей соединения-мишени, облегчающего сборку, был способен связывать, расщеплять и раскрывать один и тот же универсальный LOCS-1, содержащий первый универсальный субстрат и первый универсальный стебель. Таким образом, присутствие каждой мишени позволяло получить кривую плавления с пиком при 40°С, соответствовавшим Tm первого универсального стебля.
Результаты, показанные на фигуре 6 (верхняя панель), демонстрируют графики ПЦР-амплификации, полученные для реакционных смесей, содержащих 10.000 копий (черная линия), 40 копий (серая линия) или 0 копий (пунктирная линия) мишеней TV-Btub (фигура 6А1), VZV (фигура 6В1) и rpoB (фигура 6С1). Результаты, показанные на нижней панели, представляют собой сигнатуры кривой плавления, полученной для реакционных смесей, содержащих 10000 копий (черная линия) и 40 копий (серая линия) мишеней TV-Btub (фигура 6А2), VZV (фигура 6 В2) и rpoB (фигура 6С2). Эти три мишени были специфично обнаружены с использованием МНКзимов 2, 4 и 6, каждый из которых содержал мишень-специфичные сенсорные цепи, однако субстрат-связывающие цепи для всех из них были идентичны. Каждый МНКзим, однажды сформированный в присутствии своего соединения-мишени, облегчающего сборку, был способен связывать, расщеплять и раскрывать один и тот же универсальный LOCS-2, содержащий второй универсальный субстрат и второй универсальный стебель. Таким образом, присутствие каждой мишени позволяло получить кривую плавления с пиком при 50°С, соответствовавшим Tm второго универсального стебля.
Данные, полученные в этом примере, демонстрируют, что использование одних и тех же универсальных LOCS-репортеров для обнаружения различных генов-мишеней позволяло получить сопоставимые сигнатуры плавления. Показано, что сигнатуры плавления LOCS не зависели от последовательности-мишени, и поэтому их легко внедрить в любой анализ. В данном примере продемонстрировано, что указанные LOCS-репортеры универсальны, и их можно применять для обнаружения любого желательного гена или транскрипта-мишени.
Пример 3: Применение различных стеблей для создания LOCS-репортеров с различными температурами плавления в целях увеличения количества анализируемых мишеней
В этом примере LOCS-репортеры, содержащие стебли различного состава, использовали для демонстрации влияния длины стебля и состава пар оснований на окончательную сигнатуру плавления. В текущем примере четыре LOCS-репортера были мечены по 5'-концу флуорофором (FAM), а по 3'-концу - гасителем. LOCS-1 и LOCS-3 содержали идентичные петлевые области, содержащие субстрат 1; однако стеблевая область LOCS-3 (стебель 3) была длиннее, чем стеблевая область LOCS-1 (стебель 1) на одну пару оснований, что приводило к получению структуры с несколько более высокой прогнозируемой Tm как в интактном (замкнутом), так и в раскрытом состоянии. МНКзим с мишень-специфичными сенсорными цепями, способными управлять сборкой в присутствии соединения-мишени, облегчающего сборку (AF-CT-Cds), и субстратными цепями, способными связывать и расщеплять субстрат 1 в составе петли LOCS-1 или LOCS-3, использовали для мониторинга обнаружения изотермического сигнала
Аналогичным образом, LOCS-2 и LOCS-4 содержали идентичные петлевые области, содержащие субстрат 2; однако стеблевая область LOCS-2 (стебель 2) была длиннее, чем стеблевая область LOCS-4 (стебель 4) на две пары оснований, что приводило к получению структуры с более высокой прогнозируемой Tm как в интактном (замкнутом), так и в раскрытом состоянии. МНКзим с мишень-специфичными сенсорными цепями, способными управлять сборкой в присутствии соединения-мишени, облегчающего сборку (AF-TFRC), и субстратными цепями, способными связывать и расщеплять субстрат 2 в составе петли LOCS-2 или LOCS-4, использовали для мониторинга ПЦР-амплификации.
Компоненты и условия реакции
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: LOCS-1 (SEQ ID NO: 1), LOCS-2 (SEQ ID NO: 2), LOCS-3 (SEQ ID NO: 27), LOCS-4 (SEQ ID NO: 28), партзим A7 (SEQ ID NO: 29), партзим B7 (SEQ ID NO: 30), партзим A8 (SEQ ID NO: 31), партзим B8 (SEQ ID NO: 32), AF-CT-Cds (SEQ ID NO: 33) и AF-TFRC (SEQ ID NO: 38). Последовательности перечислены в перечне последовательностей.
Обнаружение последовательности-мишени в реальном времени выполняли в общем реакционном объеме 20 мкл. Каждая реакционная смесь содержала 1х буфер NH4 (Bioline), 8 мМ MgCl2 (Bioline), 200 нМ каждого партзима и 200 нМ LOCS-репортера. Реакционные смеси содержали соединение-мишень, облегчающее сборку, в конечных концентрациях 10 нМ, либо не содержали мишени (контрольной ДНК). Реакции инкубировали на термоциклере BioRad® CFX96 при 52°С, регистрация данных происходила каждые 10 секунд, общее количество циклов составило 150. Затем образцы подвергали градиентному росту температуры в диапазоне 20°С-90°C с шагом 0,5°С и временем выдержки 5 секунд (регистрация при каждом этапе выдержки). Результаты, представленные на фигуре 7, представляли собой средние значения для двух повторностей, построенные с помощью Microsoft Excel (версия 14).
Результаты
Результаты, представленные в таблице 2 и на фигуре 7, демонстрируют различия в сигнатурах кривой плавления, полученных для замкнутых интактных LOCS-репортеров (пунктирная линия), присутствующих в реакционных смесях без мишени, и сигнатурах, согласующихся с раскрытыми LOCS-репортерами (черная линия) в реакционных смесях, содержащих мишени, управляющие сборкой МНКзимов, способных расщеплять и раскрывать специфичные LOCS-репортеры.



Кроме того, данные, полученные в этом примере, демонстрируют различие в сигнатурах плавления, полученных при изменении последовательности и/или длины стеблевых областей. Данные демонстрируют, что раскрытый LOCS-1 позволял получить сигнатуры плавления с более низкой температурой плавления (30°С) по сравнению с температурой для раскрытого LOCS-3 (36°С). Аналогичным образом, раскрытый LOCS-4 позволял получить сигнатуры плавления с более низкой температурой плавления (32°С) по сравнению с температурой для раскрытого LOCS-2 (50°С). Эти результаты согласуются с тем фактом, что LOCS-1 и LOCS-4 содержали более короткие стебли по сравнению с LOCS-3 и LOCS-2, соответственно. Более того, каждый LOCS позволял получить уникальную сигнатуру плавления, отличную от сигнатур других LOCS- репортеров. Этот эксперимент демонстрирует, что за счет изменения длины и состава стеблевых областей можно было получать различные сигнатуры плавления. Таким образом, набор LOCS-репортеров можно использовать для одновременного обнаружения нескольких мишеней на одном канале. Кроме того, данные, полученные в этом эксперименте, были получены с использованием изотермического обнаружения мишеней, что свидетельствует о том, что LOCS-репортеры можно использовать с рядом различных способов биосенсорного анализа.
Пример 4: Совместимость LOCS-репортеров на нескольких платформах
В этом примере проверяли совместимость двух LOCS-репортеров с несколькими часто используемыми платформами ПЦР. Два МНКзима (МНКзим 1 и МНКзим 2) использовали для мониторинга амплификации нуклеиновых кислот-мишеней в режиме реального времени посредством расщепления соответствующих LOCS-репортеров (LOCS-1 и LOCS-2, соответственно). В этом примере амплификацию и обнаружение двух различных генов, а именно гена MgPa (Mycoplasma genitalium) и TV-Btub (Trichomonas vaginalis), одновременно выполняли в одной пробирке, причем оба гена были способны генерировать сигнал на канале FAM.
Компоненты и условия реакции
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: LOCS-1 (SEQ ID NO: 1), LOCS-2 (SEQ ID NO: 2), партзим A1 (SEQ ID NO: 3), партзим B1 (SEQ ID NO: 4), партзим A2 (SEQ ID NO: 5), партзим B2 (SEQ ID NO: 6), прямой праймер 1 (SEQ ID NO: 7), прямой праймер 2 (SEQ ID NO: 8), обратный праймер 1 (SEQ ID NO: 9) и обратный праймер 2 (SEQ ID NO: 10). Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению MgPa, представляли собой LOCS-1, партзим А1, партзим В1, прямой праймер 1 и обратный праймер 1.
Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению TV-Btub, представляли собой LOCS-2, партзим А2, партзим В2, прямой праймер 2, обратный праймер 1 и обратный праймер 2. Последовательности перечислены в перечне последовательностей.
Параметры цикла представляли собой: 95°С в течение 2 минут, 10 циклов снижения, включавших 95°С в течение 5 секунд и 61°С в течение 30 секунд (уменьшение на 0,5°С за цикл) и 40 циклов, включавших 95°С в течение 5 секунд и 52°С в течение 40 секунд (данные получали на этапе 52°С). Параметры кривой плавления на термоциклере BioRad® CFX96 представляли собой диапазон от 20°С до 90°C с шагом 0,5°С и выдержкой 5 секунд (регистрацию данных выполняли на этапе выдержки). Параметры кривой плавления на термоциклере Lightcycler 480 были заданы как режим непрерывной регистрации данных со скоростью роста 0,02°С в диапазоне от 20°С до 90°C с выдержкой в течение 1 секунды при каждой температуре. Параметры кривой плавления на термоциклере ABI 7500 были заданы как 1% скорость роста в диапазоне от 20°С до 90°C с выдержкой 5 с (регистрацию данных выполняли на этапе выдержки). Параметры кривой плавления на термоциклере Xxpress PCR представляли собой диапазон от 30°С до 90°C с шагом 0,5°С и выдержкой 0.5 с (регистрацию данных выполняли на этапе выдержки). Все реакции выполняли в двух повторностях, реакционные смеси содержали 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима А, 200 нМ каждого партзима В, 200 нМ каждого LOCS-репортера, 2 мМ MgCl2(Bioline) и lx смесь SensiFAST Probe No-ROX (Bioline). Амплификацию в реальном времени и обнаружение последовательности-мишени выполняли в общем реакционном объеме 20 мкл, за исключением реакций, запускаемых на термоциклере XXpress PCR, которые выполняли в объеме 15 мкл. Реакционные смеси содержали матрицу G-Block (10000 или 40 копий) либо не содержали мишени (NF H2O). Амплификацию в реальном времени и обнаружение последовательности-мишени выполняли с использованием термоциклера BioRad® CFX96, термоциклера Lightcycler 480, термоциклера ABI 7500 и термоциклера XXpress PCR.
Результаты
Результаты, приведенные на фигуре 8 и фигуре 9, демонстрируют кривые плавления, полученные после амплификации мишеней MgPa и TV-Btub, соответственно, при амплификации на термоциклере BioRad® CFX96 (панель А) или термоциклере Lightcycler 480 (панель В), или термоциклере ABI 7500 (панель С) или термоциклере XXpress PCR (панель D). Обе мишени отслеживали на канале FAM на всех аппаратах. Результаты, проиллюстрированные на фигуре 8D и фигуре 9D, получены с использованием 3-минутного протокола кривой плавления; тем самым продемонстрировано, что при помощи LOCS-репортеров можно быстро различать кривые плавления. Эти данные демонстрируют возможность получения сопоставимых сигнатур кривой плавления на различных платформах с использованием двух различных LOCS-репортеров. Кроме того, данные демонстрируют возможность получения сопоставимых сигнатур кривой плавления с использованием различных параметров кривой плавления.
Пример 5: Совместимость LOCS-репортера на нескольких флуоресцентных каналах
В этом примере проверяли совместимость десяти LOCS-репортеров на нескольких часто используемых флуоресцентных каналах. Два МНКзима (МНКзим 1 и МНКзим 2) использовали для мониторинга амплификации нуклеиновых кислот-мишеней в режиме реального времени посредством расщепления соответствующего LOCS-репортера. В этом примере использовали одни и те же последовательности LOCS-репортеров, однако LOCS метили различными парами "флуорофор и гаситель". В этом примере амплификацию и обнаружение двух различных генов, а именно гена MgPa {Mycoplasma genitalium) и TV-Btub (Trichomonas vaginalis), одновременно выполняли в одной пробирке, причем оба гена были способны генерировать сигнал на одном и том же канале. Протестировали несколько флуоресцентных каналов, включая FAM, HEX, Texas Red и Су5.
Компоненты и условия реакции
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: LOCS-1 (SEQ ID NO: 1), LOCS-2 (SEQ ID NO: 2), партзим A1 (SEQ ID NO: 3), партзим B1 (SEQ ID NO: 4), партзим A2 (SEQ ID NO: 5), партзим B2 (SEQ ID NO: 6), прямой праймер 1 (SEQ ID NO: 7), прямой праймер 2 (SEQ ID NO: 8), обратный праймер 1 (SEQ ID NO: 9), обратный праймер 2 (SEQ ID NO: 10), LOCS-5 (SEQ ID NO: 35) LOCS-6 (SEQ ID NO: 36), LOCS-7 (SEQ ID NO: 37) LOCS-8 (SEQ ID NO: 38), LOCS-9 (SEQ ID NO: 39) и LOCS-10 (SEQ ID NO: 40). Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению MgPa, представляли собой партзим А1, партзим В1, прямой праймер 1, обратный праймер 1 и LOCS-1, LOCS-5, LOCS-7 или LOCS-9. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению TV-Btub, представляли собой партзим А2, партзим В2, прямой праймер 2, обратный праймер 2 и LOCS-2, LOCS-6, LOCS-8 или LOCS-10. Последовательности перечислены в перечне последовательностей.
Параметры цикла представляли собой: 95°С в течение 2 минут, 10 циклов снижения, включавших 95°С в течение 5 секунд и 61°С в течение 30 секунд (уменьшение на 0,5°С за цикл) и 40 циклов, включавших 95°С в течение 5 секунд и 52°С в течение 40 секунд (данные получали на этапе 52°С). Параметры кривой плавления на термоциклере BioRad® CFX96 представляли собой диапазон от 20°С до 90°C с шагом 0,5°С и выдержкой 5 секунд (регистрацию данных выполняли на этапе выдержки). Все реакции выполняли в двух повторностях, реакционные смеси содержали 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима А, 200 нМ каждого партзима В, 200 нМ каждого LOCS-репортера, 2 мМ MgCl2 (Bioline) и 1х смесь SensiFAST Probe No-ROX (Bioline). Амплификацию в реальном времени и обнаружение последовательности-мишени выполняли в общем реакционном объеме 20 мкл с использованием термоциклера BioRad® CFX96. Реакционные смеси содержали матрицу G-Block (10000 или 40 копий) либо не содержали мишени (NF H2O).
Результаты
Результаты, приведенные на фигуре 10, демонстрируют кривые плавления, полученные после амплификации мишеней MgPa и TV-Btub, соответственно, при амплификации на термоциклере BioRad® CFX96. Обе мишени одновременно отслеживали на одном флуоресцентном канале. Результаты, показанные черным цветом, иллюстрируют кривые плавления, полученные в присутствии гена MgPa, а результаты, показанные серым цветом, иллюстрируют сигнатуры кривой плавления, полученные в присутствии мишени TV-Btub. Сплошные линии представляют собой концентрации мишени, равные 10000 копий, а пунктирные линии - концентрации мишени, равные 40 копий. Результаты, показанные на фигуре 10А, иллюстрируют кривые плавления, полученные с использованием LOCS-1 и LOCS-2 на канале FAM. Кривые плавления, показанные на фигуре 10 В, получены с использованием LOCS-5 и LOCS-6 на канале HEX. Кривые плавления, показанные на фигуре 10С, получены с использованием LOCS-7 и LOCS-8 на канале Texas Red, а кривые плавления, показанные на фигуре 10D, получены с использованием LOCS-9 и LOCS-10 на канале Су5. Данные продемонстрировали возможность получения сопоставимых сигнатур кривой плавления на различных флуоресцентных каналах с использованием одних и тех же двух стеблей и субстратов LOCS, посредством простой замены пары "флуорофор-гаситель".
Пример 6: Одновременное обнаружение трех мишеней на одном флуоресцентном канале с использованием трех LOCS-репортеров
В следующем примере LOCS-репортеры применяли для увеличения количества мишеней, которые можно обнаружить на одном канале флуоресценции. В этом примере три LOCS-репортера были мечены по 5'-концу флуорофором (FAM), а по 3'-концу - гасителем. Петлевые области LOCS-репортеров содержали нуклеиновую кислоту-субстрат, а стеблевые области содержали серию комплементарных пар оснований, удерживающих LOCS-репортер в конфигурации "петля-стебель". В этой конфигурации флуорофор и гаситель находились в непосредственной близости, и в отсутствие мишени флуоресценция гасилась.
Олигонуклеотиды
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: LOCS-1 (SEQ ID NO: 1), LOCS-2 (SEQ ID NO: 2), партзим A1 (SEQ ID NO: 3), партзим B1 (SEQ ID NO: 4), партзим A2 (SEQ ID NO: 5), партзим B2 (SEQ ID NO: 6), прямой праймер 1 (SEQ ID NO: 7), обратный праймер 1 (SEQ ID NO: 8), прямой праймер 2 (SEQ ID NO: 9), обратный праймер 2 (SEQ ID NO: 10), LOCS-11 (SEQ ID NO: 45), партзим A9 (SEQ ID NO: 43), партзим B9 (SEQ ID NO: 44), прямой праймер 7 (SEQ ID NO: 41) и обратный праймер 7 (SEQ ID NO: 42). Последовательности перечислены в перечне последовательностей. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению MgPa, представляли собой LOCS-1, партзим А1, партзим В1, прямой праймер 1 и обратный праймер 1. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению TV-Btub, представляли собой LOCS-2, партзим А2, партзим В2, прямой праймер 2 и обратный праймер 2. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению CTcry, представляли собой LOCS-11, партзим А9, партзим В9, прямой праймер 7 и обратный праймер 7.
Условия реакции
Амплификацию в реальном времени и обнаружение последовательности-мишени выполняли в общем реакционном объеме 20 мкл с использованием термоциклера BioRad® CFX96. Параметры цикла представляли собой: 95°С в течение 2 минут, 10 циклов снижения, включавших 95°С в течение 5 секунд и 61°С в течение 30 секунд (уменьшение на 0,5°С за цикл) и 35 циклов, включавших 95°С в течение 5 секунд и 52°С в течение 40 секунд (данные получали на этапе 52°С). Параметры кривой плавления представляли собой диапазон от 20°С до 90°C с шагом 0,5°С и выдержкой 5 секунд (регистрацию данных выполняли на этапе выдержки). Все реакции выполняли в двух повторностях, реакционные смеси содержали 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима А, 200 нМ каждого партзима В, 200 нМ каждого LOCS-репортера, 2 мМ MgCl2 (Bioline) и 1х смесь SensiFAST Probe No-ROX (Bioline). Реакционные смеси содержали матрицу G-Block (10000 копий), гомологичную генам MgPa и/или TV-Btub и/или CTcry, либо не содержали мишени (NF H2O).
Результаты
Используя способ амплификации мишени in vitro, известный как ПЦР, три МНКзима (МНКзим 1, МНКзим 2 и МНКзим 9) использовали для мониторинга амплификации нуклеиновых кислот-мишеней в режиме реального времени посредством расщепления соответствующих LOCS-репортеров (LOCS-1, LOCS-2 и LOCS-11, соответственно). МНКзим 1 был предназначен для обнаружения последовательностей, гомологичных гену MgPa (Mycoplasma genitalium), и для расщепления и раскрытия LOCS-1; МНКзим 2 был предназначен для обнаружения последовательностей, гомологичных TV-Btub (Trichomonas vaginalis), и расщепления и раскрытия LOCS-2; а МНКзим 9 был предназначен для обнаружения последовательностей, гомологичных CTcry (Chlamydia trachomatis), и расщепления и раскрытия LOCS-11. В этом эксперименте амплификацию и обнаружение выполняли в одной пробирке, содержащей все МНКзимы, праймеры и LOCS-олигонуклеотиды. Наличие MgPa, TV-Btub, CTcry или различных комбинаций этих трех мишеней (представляющих образец с множественной инфекцией) обнаруживали по увеличению сигнала на канале FAM.
Результаты, показанные на фигурах 11 и 12, демонстрируют соответствующие сигнатуры кривой плавления, полученные после амплификации в реакционных смесях, содержащих 10000 копий мишеней MgPa (фигура 11А), TV-Btub (фигура 11В), CTcry (фигура 11С), как MgPa, так и TV-Btub (фигура 11D), как MgPa, так и CTcry (фигура 11Е), как TV-Btub, так и CTcry (фигура 11F) или все три мишени MgPa, TV-Btub и CTcry (фигура 12). Результаты представляли собой средние значения реакций в двух повторностях, построенные с помощью Microsoft Excel (версия 14).
Данные, полученные в этом примере и обобщенные в таблице 3, демонстрируют, что сигнатуры плавления LOCS, полученные в присутствии гена-мишени MgPa (Tm=39°С и 66°С), отличались от сигнатур плавления LOCS, полученных в присутствии генов-мишеней TV-Btub (Tm=49°С и 64°С) и CTcry (Tm=30°С, 41°С и 64°С). Кроме того, сигнатуры плавления LOCS в присутствии двух или более генов-мишеней также отличались от вышеупомянутых сигнатур плавления, полученных в присутствии только одного гена-мишени. В присутствии мишеней MgPa и TV-Btub в одной реакционной смеси уникальная сигнатура кривой плавления (Tm=39°С, 49°С и 66°С) указывала на обнаружение обеих мишеней. Аналогичным образом, в присутствии MgPa и CTcry или TV-Btub и CTcry в одной реакционной смеси уникальные сигнатуры кривой плавления ((Tm=31°С, 41°С и 74°С) и (Tm=30°С, 41°С, 49°С и 66°С), соответственно) указывали на обнаружение двух мишеней и позволяли идентифицировать их. В присутствии мишеней MgPa, TV-Btub и CTcry в одной реакционной смеси уникальная сигнатура кривой плавления (Tm=30°С, 41°С и 49°С) указывала на обнаружение всех трех мишеней.


Этот пример демонстрирует, что три мишени, совместно амплифицированные в одной лунке при использовании одного флуоресцентного канала, можно различать на основе их уникальных сигнатур плавления LOCS. В примере представлен простой способ, который можно применять для обнаружения нескольких мишеней в одной лунке с использованием одного канала флуоресценции. Из-за разной длины стебля и состава пар оснований разные стебли (стебель-1, стебель-2 и стебель-3) в составе LOCS-1, LOCS-2 и LOCS-11 позволяли получить уникальные сигнатуры флуоресцентной кривой плавления.
В этом конкретном примере Tm раскрытого LOCS 1 (один пик при ~39°С указывает на MgPa) и раскрытого LOCS 3 (два пика при ~30/31°С и ~ 41°С указывают на CTcry) приводит к получению объединенного пика в присутствии как мишени MgPa, так и мишени CTcry. Тем не менее, реакционную смесь, содержащую MgPa, TV-Btub и CTcry (фигура 12), можно отличить от реакционной смеси, содержащей только TV-Btub и CTcry (фигура 11F), по исчезновению пика Tm раскрытого LOCS 1 (~64°С). Хотя объединенный пик не идеален для этого метода, альтернативные последовательности стеблей, позволяющие получить более четко различимые пики, легко выявить с помощью анализа скрининга стеблей, описанного в примере 7.
Пример 7: способ скрининга последовательностей, подходящих для использования в качестве универсальных стеблей, которые можно встроить в репортерные LOCS- олигонуклеотиды
В следующем примере проверяли пригодность серии двуцепочечных олигонуклеотидов (ДЦО) для использования в качестве универсальных стеблей. Эти ДЦО, не соединенные петлями, подвергали воздействию постепенно повышающихся температур в присутствии интеркалирующего красителя SYBR green I. Этот скрининговый анализ кривой плавления можно использовать для исследования различных длин и составов последовательностей с целью выявления серии ДЦО, плавящихся при определенных температурах, которые впоследствии можно включать в репортерные LOCS-олигонуклеотиды в качестве универсальных стеблей. SYBR green I представляет собой интеркалирующий краситель, генерирующий сигнал флуоресценции при связывании с двуцепочечными структурами ДНК. Под воздействием градиентно возрастающей температуры две олигонуклеотидные цепи ДЦО диссоциируют, и флуоресценция уменьшается. В следующем примере продемонстрировано, что температуру, при которой диссоциируют два олигонуклеотида (Tm), можно регулировать путем изменения длины и состава стебля. Кроме того, ДЦО тестировали при различных концентрациях с целью продемонстрировать, как можно дополнительно манипулировать Tm, изменяя концентрацию олигонуклеотидов.
Олигонуклеотиды
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: ДЦО-1А (SEQ ID NO: 56), ДЦО-1B (SEQ ID NO: 57), ДЦО-2А (SEQ ID NO: 58), ДЦО-2В (SEQ ID NO: 59), ДЦО-3А (SEQ ID NO: 60), ДЦО-3В (SEQ ID NO: 61), ДЦО-4А (SEQ ID NO: 62), ДЦО-4В (SEQ ID NO: 63), ДЦО-5A (SEQ ID NO: 64), ДЦО 5B (SEQ ID NO: 65), ДЦО-6А (SEQ ID NO: 66), ДЦО-6В (SEQ ID NO: 67), ДЦО-7А (SEQ ID NO: 68), ДЦО-7В (SEQ ID NO: 69), ДЦО-8А (SEQ ID NO: 70) и ДЦО-8В (SEQ ID NO: 71). Последовательности перечислены в перечне последовательностей.
Условия реакции
Анализ кривой плавления выполняли в общем реакционном объеме 20 мкл с использованием термоциклера BioRad® CFX96. Параметры кривой плавления представляли собой диапазон от 15°С до 70°C с шагом 0,5°С и выдержкой 5 секунд (регистрацию данных выполняли на этапе выдержки). Все реакции выполняли в двух экземплярах, причем реакционные смеси содержали 100 нМ, 200 нМ или 300 нМ олигонуклеотидов ДЦО-А и ДЦО-В, 1 мкМ SYBR green I, 8 мМ MgCl2 (Bioline) и 1х буфер NH4 (Bioline).
Результаты
Результаты, показанные в таблице 4, демонстрируют температуры плавления (Tm), полученные при воздействии градиентно возрастающих температур на ДЦО. Результаты представляли собой средние значения реакций в двух повторностях, построенные с помощью Microsoft Excel (версия 14).
В данном примере продемонстрировано, что увеличение длины стебля и содержания GC повышало Tm. Более того, увеличение концентрации олигонуклеотида также несколько повышало Tm, причем максимальное различие наблюдали при увеличении концентрации с 100 нМ до 200 нМ. Способ, описанный в этом примере, можно использовать в качестве способа скрининга для улучшения выявления альтернативных последовательностей стеблей, позволяющих получать более четко различимые пики.
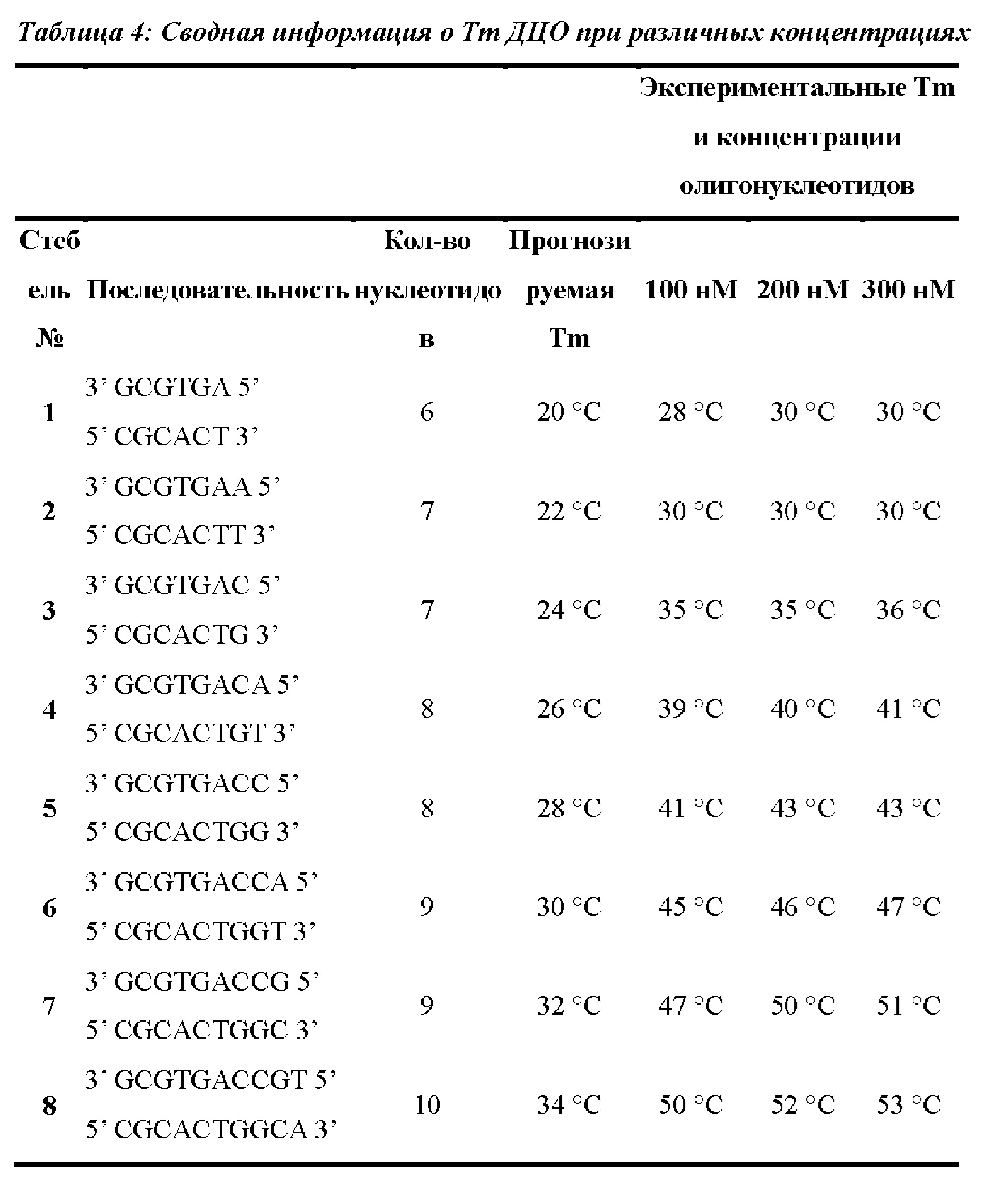
Этот способ также можно использовать для изучения влияния других компонентов реакционной смеси, включая концентрацию солей, концентрацию Mg, буфер, концентрацию dNTP и другие добавки, но не ограничиваясь ими. С помощью этого способа скрининга можно выявить ряд ДЦО, которые при включении в LOCS позволяют получить "лестницу" четко разделенных Tm. В альтернативном формате ДЦО можно метить различными парами "флуорофор и гаситель" для исследования способности различных комбинаций красителей влиять на Tm конкретного ДЦО.
Пример 8: Одновременное обнаружение четырех мишеней в одной лунке с использованием двух флуоресцентных каналов и четырех LOCS-репортеров, использующих только два стебля
В следующем примере несколько LOCS-репортеров, содержащих стебли одного и того же состава, присоединенные к различным субстратам (петлям), объединяли в одном реакционном сосуде с целью демонстрации возможности многократного использования одной и той же стеблевой области для одновременного обнаружения и различения нескольких мишеней в одной реакционной смеси. В текущем примере два стебля (стебель-1 и стебель-2) использовали для различения четырех различных мишеней на двух флуоресцентных каналах. В этом примере два LOCS-репортера были мечены по 5'-концу флуорофором FAM (LOCS-12 и LOCS-13), а другие два были мечены по 5'-концу флуорофором Texas Red (LOCS-7 и LOCS-8). Все четыре LOCS-репортера были мечены по 3'-концу гасителем. Каждая из петлевых областей четырех LOCS-репортеров содержала свою нуклеиновую кислоту-субстрат (Sub1, Sub2, Sub3 и Sub4). Два LOCS- репортера, по одному на каждый флуорофор, содержали стебель-1 (LOCS-7 и LOCS-12), а другие два LOCS-репортера содержали стебель-2 (LOCS-8 и LOCS-13). Стеблевые области содержали серию комплементарных пар оснований, удерживающих LOCS- репортер в конфигурации "петля-стебель". В этой конфигурации флуорофор и гаситель находились в непосредственной близости, и в отсутствие мишени флуоресценция гасилась. Стебель-1 характеризовался более низкой температурой плавления, чем стебель- 2, и был присоединен к петлям 1 и 3 для обнаружения мишеней MgPa и NGopa при первой температуре обнаружения (40°С), тогда как стебель-2 характеризовался более высокой температурой плавления и был присоединен к петлям 2 и 4 для различения мишеней TV-Btub и gpd при второй температуре обнаружения (50°С).
Олигонуклеотиды
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: LOCS-7 (SEQ ID NO: 37), LOCS-8 (SEQ ID NO: 38), партзим A1 (SEQ ID NO: 3), партзим B1 (SEQ ID NO: 4), партзим A2 (SEQ ID NO: 5), партзим B2 (SEQ ID NO: 6), прямой праймер 1 (SEQ ID NO: 7), обратный праймер 1 (SEQ ID NO: 8), прямой праймер 2 (SEQ ID NO: 9), обратный праймер 2 (SEQ ID NO: 10), LOCS-12 (SEQ ID NO: 46), LOCS-13 (SEQ ID NO: 47), партзим A10 (SEQ ID NO: 48), партзим BIO (SEQ ID NO: 49), партзим A11 (SEQ ID NO: 50), партзим B11 (SEQ ID NO: 51), прямой праймер 8 (SEQ ID NO: 52), обратный праймер 8 (SEQ ID NO: 53), прямой праймер 9 (SEQ ID NO: 54) и обратный праймер 9 (SEQ ID NO: 55). Последовательности перечислены в перечне последовательностей. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению MgPa, представляли собой LOCS-7, партзим А1, партзим В1, прямой праймер 1 и обратный праймер 1. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению TV-Btub, представляли собой LOCS-8, партзим А2, партзим В2, прямой праймер 2 и обратный праймер 2. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению NGopa, представляли собой LOCS-12, партзим А10, партзим В10, прямой праймер 8 и обратный праймер 8. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению gpd, представляли собой LOCS-13, партзим А11, партзим В11, прямой праймер 9 и обратный праймер 9.
Условия реакции
Амплификацию в реальном времени и обнаружение последовательности-мишени выполняли в общем реакционном объеме 20 мкл с использованием термоциклера BioRad® CFX96. Параметры цикла представляли собой: 95°С в течение 2 минут, 10 циклов снижения, включавших 95°С в течение 5 секунд и 61°С в течение 30 секунд (уменьшение на 0,5°С за цикл) и 35 циклов, включавших 95°С в течение 5 секунд и 52°С в течение 40 секунд (данные получали на этапе 52°С). Параметры кривой плавления представляли собой диапазон от 20°С до 90°С с шагом 0,5°С и выдержкой 5 секунд (регистрацию данных выполняли на этапе выдержки). Все реакции выполняли в двух повторностях, реакционные смеси содержали 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима А, 200 нМ каждого партзима В, 200 нМ каждого LOCS-репортера, 2 мМ MgCl2 (Bioline) и 1× смесь SensiFAST Probe No-ROX (Bioline). Реакционные смеси содержали матрицу G-Block (10000 копий), гомологичную генам MgPa, TV-Btub, NGopa или gpd, либо не содержали мишени (NF H2O).
Результаты
Используя способ амплификации мишени in vitro, известный как ПЦР, четыре МНКзима (МНКзим 1, МНКзим 2, МНКзим 10 и МНКзим 11) использовали для мониторинга амплификации нуклеиновых кислот-мишеней в режиме реального времени посредством расщепления соответствующих LOCS-репортеров (LOCS-7, LOCS-8, LOCS- 12 и LOCS-13, соответственно). МНКзим 1 был предназначен для обнаружения последовательностей, гомологичных гену MgPa (Mycoplasma genitalium), и для расщепления и раскрытия LOCS-7; МНКзим 2 был предназначен для обнаружения последовательностей, гомологичных TV-Btub (Trichomonas vaginalis), и расщепления и раскрытия LOCS-8; МНКзим 10 был предназначен для обнаружения последовательностей, гомологичных NGopa (Neisseria gonorrhoeae), и расщепления и раскрытия LOCS-12; а МНКзим 11 был предназначен для обнаружения последовательностей, гомологичных gpd (вирус простого герпеса 2 типа), и расщепления и раскрытия LOCS-13. В этом эксперименте амплификацию и обнаружение выполняли в одной пробирке, содержащей все МНКзимы, праймеры и LOCS-олигонуклеотиды.
Наличие генов MgPa или TV-Btub обнаруживали по увеличению сигнала на канале Texas Red; а наличие генов NGopa или gpd обнаруживали по увеличению сигнала на канале FAM. Различение MgPa или TV-Btub на канале Texas Red и NGopa или gpd на канале FAM выполняли на основе наличия уникальной сигнатуры кривой плавления. Результаты, показанные на фигуре 13А, демонстрируют соответствующие сигнатуры кривых плавления, полученные на канале Texas Red после амплификации в реакционных смесях, содержащих 10000 копий гена-мишени MgPa (черная линия) или TV-Btub (серая линия).
Результаты, показанные на фигуре 13В, демонстрируют соответствующие сигнатуры кривых плавления, полученные на канале FAM после амплификации в реакционных смесях, содержащих 10.000 копий гена-мишени NGopa (черная линия) или gpd (серая линия). Результаты представляли собой средние значения реакций в двух повторностях, построенные с помощью Microsoft Excel (версия 14). Наличие MgPa определяли как по увеличению сигнала Texas Red, так и по уникальной сигнатуре плавления на канале Texas Red (Tm=43°С). Наличие TV-Btub определяли как по увеличению сигнала Texas Red, так и по уникальной сигнатуре плавления на канале Texas Red (Tm=54°С). Наличие NGopa определяли как по увеличению сигнала FAM, так и по уникальной сигнатуре плавления на канале FAM (Tm=26°С и 42°С). Наличие gpd определяли как по увеличению сигнала FAM, так и по уникальной сигнатуре плавления на канале FAM (Tm=49°С).
Эти данные, полученные в данном примере и обобщенные в таблице 5, демонстрируют возможность многократного использования одних и тех же универсальных стеблевых областей в одной реакции за счет их присоединения к различным субстратам (петлям) и обнаружения на различных флуоресцентных каналах. Кроме того, данные демонстрирует, что четыре мишени, совместно амплифицированные в одной лунке при мониторинге на двух флуоресцентных каналах, можно различать на основе их уникальных температур плавления LOCS. В примере представлен простой способ, который можно применять для обнаружения нескольких мишеней в одной лунке. Использование одной и той же стеблевой последовательности для различения нескольких мишеней в одной реакционной смеси облегчает простую разработку анализов с высокой степенью мультиплексности и позволяет быстро и легко адаптировать LOCS-зонды для обнаружения любого выбранного гена-мишени.
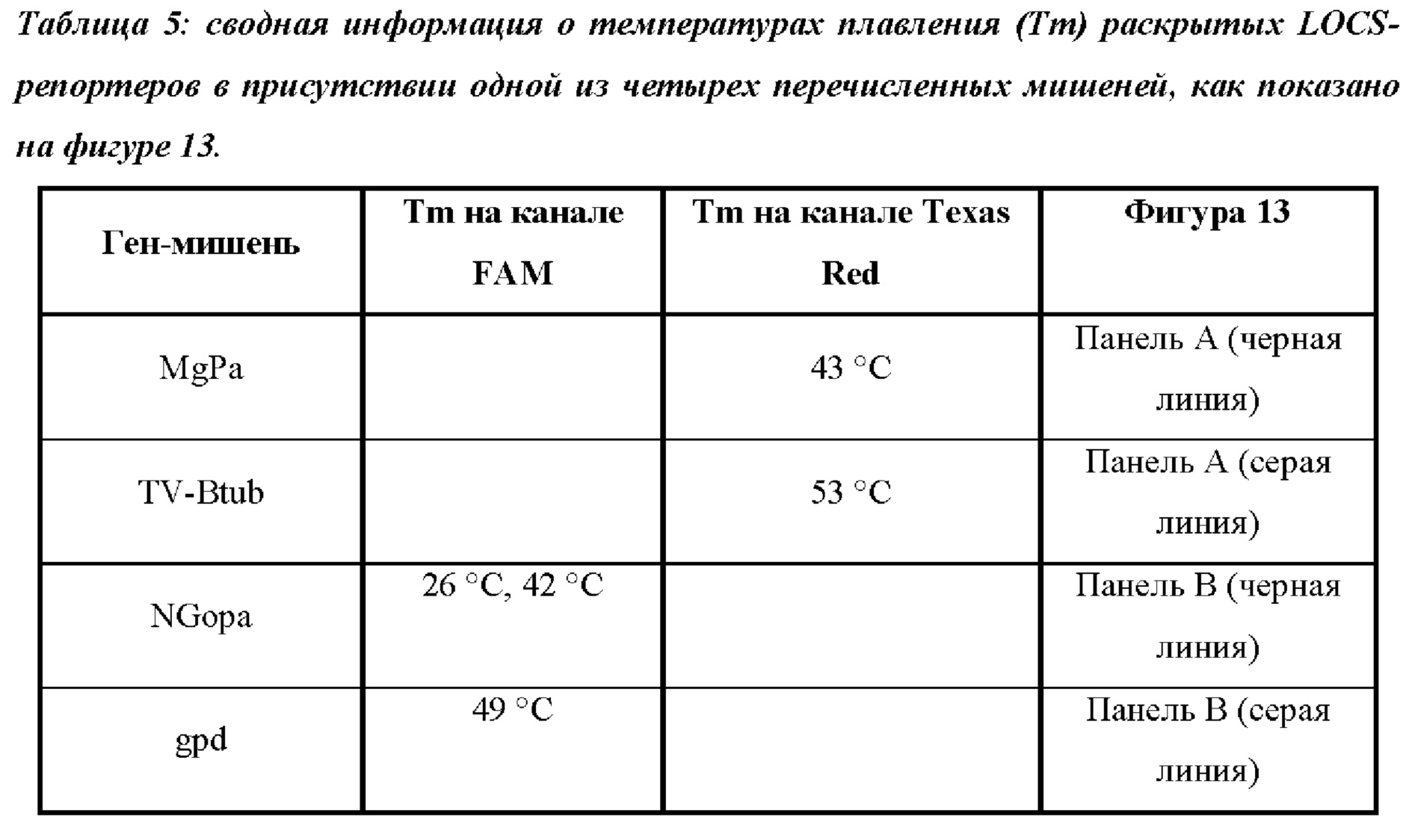
Пример 9 - Одну и ту же стеблевую последовательность можно объединять с различными субстратами в LOCS-репортерах, получая воспроизводимые температуры плавления.
В следующем примере три LOCS-репортера использовали для демонстрации возможности спаривания одного и того же стебля с различными петлевыми последовательностями (субстратами), получая сопоставимые сигнатуры плавления. В этом примере все три LOCS-репортера были мечены по 5'-концу флуорофором FAM, а по 3'-концу - гасителем. Каждая из петлевых областей трех LOCS-репортеров содержала свой субстрат нуклеозима (МНКзима), однако все три LOCS содержали одну и ту же стеблевую последовательность (стебель-2).
Олигонуклеотиды
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: прямой праймер 10 (SEQ ID NO: 72), обратный праймер 10 (SEQ ID NO: 73), LOCS-2 (SEQ ID NO: 2), LOCS-14 (SEQ ID NO: 78), LOCS-15 (SEQ ID NO: 79), партзим A8 (SEQ ID NO: 31), партзим B8 (SEQ ID NO: 32), партзим A12 (SEQ ID NO: 74), партзим В12 (SEQ ID NO: 75), партзим A13 (SEQ ID NO: 76) и партзим B13 (SEQ ID NO: 77).
Последовательности перечислены в перечне последовательностей. Олигонуклеотиды, специфичные по отношению к амплификации гена TFRC, представляли собой прямой праймер 10 (SEQ ID NO: 72) и обратный праймер 10 (SEQ ID NO: 73). Олигонуклеотиды, специфичные по отношению к обнаружению ампликона TFRC и расщеплению LOCS-2, представляли собой партзим А8 (SEQ ID NO: 31) и партзим В8 (SEQ ID NO: 32). Олигонуклеотиды, специфичные по отношению к обнаружению ампликона TFRC и расщеплению LOCS-14, представляли собой партзим А12 (SEQ ID NO: 74) и партзим В12 (SEQ ID NO: 75). Олигонуклеотиды, специфичные по отношению к обнаружению ампликона TFRC и расщеплению LOCS-15, представляли собой партзим А13 (SEQ ID NO: 76) и партзим В13 (SEQ ID NO: 77).
Условия реакции
Амплификацию в реальном времени и обнаружение последовательности-мишени выполняли в общем реакционном объеме 20 мкл с использованием термоциклера BioRad® CFX96. Параметры цикла представляли собой: 95°С в течение 2 минут, 10 циклов снижения, включавших 95°С в течение 5 секунд и 61°С в течение 30 секунд (уменьшение на 0,5°С за цикл) и 35 циклов, включавших 95°С в течение 5 секунд и 52°С в течение 40 секунд (данные получали на этапе 52°С). Параметры кривой плавления представляли собой диапазон от 20°С до 90°С с шагом 0,5°С и выдержкой 5 секунд (регистрацию данных выполняли на этапе выдержки). Все реакции выполняли в двух повторностях, реакционные смеси содержали 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима А, 200 нМ каждого партзима В, 200 нМ каждого LOCS-репортера, 2 мМ MgCl2 (Bioline) и 1х смесь SensiFAST Probe No-ROX (Bioline). Реакционные смеси содержали матрицу G-Block (10000 копий), гомологичную гену рецептора трансферрина человека (TFRC), либо не содержали мишени (NF H2O).
Результаты
В этом эксперименте ПЦР-амплификацию, обнаружение сигнала и дифференциацию кривой плавления выполняли в одной пробирке в виде одноплексной реакции. Во время ПЦР три МНКзима (МНКзим 8, МНКзим 12 и МНКзим 13) использовали для мониторинга амплификации нуклеиновых кислот-мишеней в режиме реального времени путем расщепления соответствующих LOCS-репортеров (LOCS-2, LOCS-14 и LOCS-15, соответственно). Все три МНКзима были предназначены для обнаружения одной и той же последовательности-мишени (гена TFRC), однако каждый МНКзим мог гибридизоваться с другой субстратной последовательностью (петлей) и расщеплять ее, тем самым раскрывая другой LOCS-репортер.
Результаты, показанные на фигуре 14, демонстрируют соответствующие сигнатуры кривых плавления, полученные на канале FAM после ПЦР-амплификации в реакционных смесях, содержащих 10000 копий гена-мишени TFRC (черная линия), или не содержащих мишени (серая линия). Наличие гена TFRC демонстрировали по наличию кривой ПЦР- амплификации, пересекающей пороговое значение (данные не показаны), и пиков плавления при Tm 49°С, 48°С и 49°С (фигуры 14А, 14В и 14С, соответственно) коррелирующих с расщепленными LOCS-2, LOCS-14 и LOCS-15, соответственно. Отсутствие гена TFRC определяли по отсутствию кривой ПЦР-амплификации, пересекающей пороговое значение (данные не показаны), и наличию пика плавления при Tm 74°С, 75°С и 75°С, коррелирующих с нерасщепленными LOCS-2, LOCS-14 и LOCS- 15, соответственно (фигуры 14А, 14В и 14С, соответственно). Результаты представляли собой средние значения реакций в двух повторностях, построенные с помощью Microsoft Excel (версия 14). Данные, полученные в этом примере, демонстрируют возможность использования одних и тех же универсальных стеблевых областей с различными субстратами (петлями) с получением сопоставимых сигнатур кривых плавления. Использование одной и той же стеблевой последовательности для конструирования LOCS-репортеров с различными субстратами облегчает простую разработку анализов с высокой степенью мультиплексности и позволяет быстро и легко адаптировать LOCS- зонды для обнаружения любого выбранного гена-мишени.
Пример 10 - Использование никующей эндонуклеазы в качестве альтернативного способа раскрытия LOCS-репортеров
В следующем примере использовали никующую эндонуклеазу (Nt. Alwl) для демонстрации образования сопоставимых сигнатур плавления при раскрытии петлевого фрагмента LOCS-репортеров после расщепления никующей эндонуклеазой в качестве способа, альтернативного расщеплению МНКзимом. Общая стратегия проиллюстрирована на фигуре 3В. В этом примере LOCS-репортер с двойной меткой содержал петлевую область, комплементарную последовательности-мишени, и стеблевую область, не комплементарную мишени. Гибридизация петлевой области LOCS-репортера с мишенью завершала формирование сайта распознавания никующей эндонуклеазы, облегчая расщепление LOCS-репортера никующей эндонуклеазой и оставляя мишень интактной. Поскольку внутримолекулярные связи прочнее межмолекулярных связей, стеблевые области интактных LOCS-структур плавятся при более высоких температурах, чем стебли раскрытых расщепленных LOCS-структур.
Олигонуклеотиды
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: AF-NE-TV1 (SEQ ID NO: 82), LOCS-16 (SEQ ID NO: 80), AF-NE-R5b (SEQ ID NO: 83) и LOCS-17 (SEQ ID NO: 81). Последовательности перечислены в перечне последовательностей.
Условия реакции
Обнаружение последовательности-мишени в реальном времени выполняли в общем реакционном объеме 20 мкл с использованием термоциклера BioRad® CFX96. Реакционные смеси инкубировали при постоянной температуре 52°С, данные собирали каждые 20 секунд, в общей сложности 200 раз. Параметры кривой плавления представляли собой диапазон от 20°С до 90°C с шагом 0,5°С и выдержкой 5 секунд (регистрацию данных выполняли на этапе выдержки). Все реакции выполняли в двух повторностях, реакционные смеси содержали 5 мМ MgCl2 (Ambion), 1х буфер II для ПЦР (ABI), 4 единицы Nt. Alwl (NEB) и 200 нМ LOCS (LOCS-16 или LOCS-17). Реакционные смеси содержали AF-NE-TV1 или AF-NE-R5b (200 нМ), либо не содержали мишени (NF Н20).
Результаты
Обнаружение сигнала и дифференциацию кривой плавления выполняли в одной пробирке. Результаты, показанные на фигурах 15А и 15В, демонстрируют соответствующие сигнатуры кривых плавления LOCS-16 и LOCS-17, полученные на канале FAM в реакционных смесях, содержащих 200 копий мишени (черная линия, AF-NE-TV1 или AF-NE-R5b, соответственно), или не содержащих мишени (серая линия, NF Н2О). Результаты представляли собой средние значения реакций в двух повторностях, построенные с помощью Microsoft Excel (версия 14). Наличие мишени AF-NE-TV1 обнаруживали как по быстрому увеличению флуоресценции с течением времени, так и по наличию пика плавления при 29°С, соответствующего расщепленному LOCS-16. Отсутствие мишени AF-NE-TV1 определяли по (i) отсутствию увеличения флуоресценции с течением времени, (ii) отсутствию пика плавления при 29°С и (iii) наличию пика плавления при 65°С, соответствующего нерасщепленному LOCS-16 (фигура 15А).
Наличие мишени AF-NE-R5b обнаруживали как по быстрому увеличению флуоресценции с течением времени, так и по наличию пика плавления при 48°С, соответствующего расщепленному LOCS-17. Отсутствие мишени AF-NE-R5b определяли по (i) отсутствию увеличения флуоресценции с течением времени, (ii) отсутствию пика плавления при 48°С и (iii) наличию пика плавления при 76°С, соответствующего нерасщепленному LOCS-17 (фигура 15В).
Данные из этого примера демонстрируют, что LOCS-репортеры можно применять с альтернативными способами обнаружения мишеней, например, способами, использующими никующие эндонуклеазные ферменты. Кроме того, данные также демонстрируют, что LOCS-репортеры, содержавшие один и тот же стебель (стебель-2), позволяют получать пики при одной и той же температуре плавления (~50°С) независимо от механизма разрушения петли, например, расщепления никующим ферментом или МНКзимом. В данном примере интактный и раскрытый LOCS-репортеры, содержащие стебель-2, позволяли получать пики плавления при 48°С и 76°С, соответственно. Эти пики плавления сопоставимы с пиками плавления, полученными с использованием стебля-2 с МНКзимами, как показано на фигуре 4D. Хотя для LOCS, содержащего один и тот же стебель, могут наблюдаться небольшие сдвиги на 1-2°С при использовании в различных протоколах, например, расщепления петли никующими ферментами по сравнению с расщеплением петли МНКзимом, эти сдвиги, вероятно, отражают различия в среде реакционной смеси, где на Tm стебля может влиять концентрация соли, глицерина или другого компонента.
Пример 11 - Использование экзонуклеазы TaqMan в качестве альтернативного способа раскрытия LOCS-репортеров
В следующем примере способ, аналогичный зонду TaqMan/гидролизному зонду, использовали для демонстрации образования сопоставимых сигнатур плавления при раскрытии стеблевого фрагмента LOCS-репортеров после расщепления экзонуклеазой, в качестве способа, альтернативного расщеплению петли МНКзимом. Общая стратегия для этого примера проиллюстрирована на фигуре 3А. В этом примере LOCS-репортер с двойной меткой содержал петлевую область, комплементарную последовательности-мишени, и стеблевую область, не комплементарную мишени. Во время ПЦР- амплификации петлевая область LOCS-репортера могла гибридизоваться с последовательностью-мишенью и/или ампликоном. Во время стадии удлинения праймера при ПЦР происходит удлинение 5'-праймера в область гибридизации LOCS-репортера с мишенью, полимераза постепенно расщепляет 5'-конец петлевой области LOCS-репортера, но оставляет интактной стеблевую область. Разрушение петлевой области снижает температуру плавления стебля LOCS, поскольку межмолекулярные силы между двумя фрагментами стебля LOCS значительно слабее внутримолекулярных сил, которые возникают между ними внутри молекулы замкнутого LOCS.
Олигонуклеотиды
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: прямой праймер 2 (SEQ ID NO: 9), обратный праймер 2 (SEQ ID NO: 10) и LOCS-18 (SEQ ID NO: 84). Последовательности перечислены в перечне последовательностей.
Условия реакции
Амплификацию в реальном времени и обнаружение последовательности-мишени выполняли в общем реакционном объеме 20 мкл с использованием термоциклера BioRad® CFX96. Параметры цикла представляли собой: 95°С в течение 2 минут, 50 циклов при 95°С в течение 5 секунд и 52°С в течение 40 секунд (данные регистрировали на этапе 52°С). Параметры кривой плавления представляли собой диапазон от 20°С до 90°C с шагом 0,5°С и выдержкой 5 секунд (регистрацию данных выполняли на этапе выдержки). Все реакции выполняли в двух повторностях, реакционные смеси содержали 400 нМ каждого прямого праймера, 200 нМ LOCS-16, 2 мМ MgCl2 (Bioline) и 1х смесь SensiFAST Probe No-ROX (Bioline). Реакционные смеси содержали синтетическую матрицу G-Block (10000 копий) либо не содержали мишени (NF H2O).
Результаты
В этом эксперименте ПЦР-амплификацию, обнаружение сигнала и дифференциацию кривой плавления выполняли в одной пробирке. Наличие гена-мишени (TV-btub) определяли по наличию кривой ПЦР-амплификации и пика плавления при Tm 40°, соответствующего разрушенному раскрытому LOCS-18. Отсутствие гена-мишени определяли по отсутствию кривой ПЦР-амплификации, отсутствию пика плавления при Tm 40°С и наличию пика плавления при Tm 61°С, соответствующего нерасщепленному замкнутому LOCS-18. Результаты, показанные на фигурах 16А и 16В, демонстрируют соответствующие кривые амплификации и сигнатуры кривых плавления, полученные на канале FAM в реакционных смесях, содержащих 10000 копий гена-мишени (черная линия), или не содержащих мишени (серая линия). Результаты представляли собой средние значения реакций в двух повторностях, построенные с помощью Microsoft Excel (версия 14).
Данные из этого примера демонстрируют, что LOCS-репортеры можно использовать с альтернативными способами обнаружения мишеней, использующими механизмы, аналогичные зонду TaqMan/гидролизному зонду, а именно механизмы в которых ферменты с экзонуклеазной активностью разрушают последовательности, гибридизующиеся с ампликонами. По существу, в этом примере LOCS-зонд состоял из петлевого фрагмента, выполняющего ту же функцию, что и стандартная последовательность зонда TaqMan, однако «TaqMan-подобная последовательность зонда» содержала комплементарные стеблевые последовательности, присоединенные к 5'- и 3'-области гибридизации, которые сами по себе не комплементарны мишени, но комплементарны друг другу. Кроме того, данные также демонстрируют, что LOCS- репортеры, содержавшие один и тот же стебель (стебель-1), позволяют получать пики при одной и той же температуре плавления независимо от механизма разрушения петли, например, разрушения экзонуклеазой или расщепления МНКзимом. В данном примере интактный и раскрытый LOCS-репортеры, содержащие стебель-1, позволяли получать пики плавления при 61°С и 40°С, соответственно. Эти пики плавления сопоставимы с пиками плавления, полученными с использованием стебля-1 с МНКзимами, как показано на фигурах 5А2, 5В2 и 5С2. Текущий способ имеет преимущество по сравнению с другими способами на основе экзонуклеаз, использующими кривую плавления, например, ТОСЕ, заключающееся в том, что высвобожденный меченый фрагмент зонда не должен впоследствии гибридизоваться с зондом захвата для обнаружения наличия последовательности-мишени, а LOCS-репортер может лучше гаситься на начальном этапе, поскольку флуорофор и гаситель зафиксированы в непосредственной близости друг от друга.
Пример 12: способ одновременного обнаружения и количественного определения нескольких мишеней на одном флуоресцентном канале с использованием двух температур сбора данных во время амплификации
В следующем примере продемонстрирован подход, в котором LOCS-репортеры позволяют одновременно обнаруживать и количественно определять несколько мишеней на одном флуоресцентном канале путем регистрации показаний флуоресценции при двух дискретных температурах в реальном времени во время ПЦР. Эта стратегия устраняет необходимость в анализе кривой плавления после ПЦР, которая была продемонстрирована в различных примерах выше. Кроме того, в данном примере описаны два альтернативных способа анализа данных, которые облегчают количественную оценку любой мишени, если она присутствует в образце.
В этом примере два LOCS-репортера, содержащие стебли разной длины, состава и температуры плавления, использовали для одновременного обнаружения, различения и количественной оценки двух мишеней X и Y на одном канале флуоресценции путем измерения флуоресценции в реальном времени при двух различных температурах (TL и TH) во время каждого цикла ПЦР. Анализ разработали таким образом, что мишень X отслеживали с помощью LOCS-X (расщепляемого только МНКзимом X в присутствии мишени X), а мишень Y отслеживали с помощью LOCS-Y (расщепляемого только МНКзимом Y в присутствии мишени Y). Кроме того, анализ разработали таким образом, что раскрытый LOCS-X характеризовался более низкой Tm по сравнению с раскрытым LOCS-Y.
Более низкую температуру обнаружения (TL) выбирали таким образом, чтобы стебель раскрытого LOCS-X плавился (диссоциировал), что приводило к повышенной флуоресценции, в то время как стебель замкнутого LOCS-X и стебли как раскрытого, так и замкнутого LOCS-Y оставались в ассоциированном и погашенном состоянии. Более высокую температуру (TH) выбирали таким образом, чтобы стебель раскрытого LOCS-Y плавился (диссоциировал), что приводило к повышенной флуоресценции, в то время как стебель замкнутого LOCS-Y оставался в ассоциированном и погашенном состоянии. Поскольку стебель LOCS-X характеризовался более низкой Tm, он плавился (диссоциировал) при этой более высокой температуре, что приводило к повышенной флуоресценции независимо от того, находился ли он в своей раскрытой или замкнутой конформации; однако флуоресценция замкнутого LOCS-X лишь способствовала увеличению фона/исходного сигнала.
С использованием измерений флуоресценции, выполненных при температурах TL и TH, можно построить две кривые ПЦР-амплификации. Пороговые значения для определения присутствия мишеней X и/или Y устанавливали как для графика TL (порог X; ТХ), так и для графика TH (порог Y; TY). Пороговые значения (ТХ и TY) и различные конечные точки, в которых реакции, как известно, выходят на плато, можно заранее определять на основе предыдущих экспериментов, где реакционные смеси, содержавшие только мишень X, выходили на плато в конечной точке ЕХ1 при TL или в конечной точке ЕХ2 при TH; реакционные смеси, содержавшие мишень Y, выходили на плато в конечной точке EY1 при TH, а реакционные смеси, содержавшие как мишени X, так и мишени Y, выходили на плато в конечной точке EY2 при TH. Конечные точки ЕХ1, ЕХ2, EY1 и EY2 можно необязательно получать на основе положительных контролей, запускаемых параллельно с экспериментальными образцами.
По отношению к графику амплификации TL, если ПЦР позволяла получить кривую амплификации, пересекавшую ТХ и выходившую на плато в конечной точке ЕХ1, превышавшей ТХ, этот результат указывал на наличие расщепленного LOCS-X, ассоциированного с мишенью X. При наличии также мишени Y кривая амплификации не должна была изменяться, поскольку расщепленный LOCS-Y не давал флуоресценции при TL. Следовательно, значения Cq, полученные на основе кривой амплификации, пересекающей ТХ, позволяли количественно определить мишень X в образце.
По отношению к графику амплификации TH, если ПЦР позволяла получить кривую амплификации, пересекавшую TY и выходившую на плато в точке EY1 или EY2, это указывало на наличие мишени Y. Пороговое значение TY задавали выше значения ЕХ2, так что кривая амплификации в реакционной смеси, содержавшей только мишень X, не пересекала этот порог. При наличии обеих мишеней X и Y расщепление LOCS-X и LOCS-Y приводит к получению кривой амплификации, пересекающей TY и выходящей на плато в точке EY2, превышающей EY1, которая ассоциирована с расщепленным LOCS-Y в присутствии только мишени Y. Поскольку ЕХ2
Мишень Y - способ количественной оценки 1
Две кривые амплификации, полученные за счет расщепленных LOCS-X самих по себе при TL 39°С и TH 72°С, характеризуются одинаковой эффективностью и Cq, но выходят на плато в разных конечных точках ЕХ1 и ЕХ2, соответственно. Следовательно, сигнал флуоресценции расщепленных LOCS-X в кривой амплификации при 72°С (F-LOCS-XFAF) можно экстраполировать из кривой амплификации при 39°С путем применения поправочного коэффициента флуоресценции (FAF). FAF представляет собой отношение конечных точек ЕХ1 и ЕХ2. Общий сигнал флуоресценции в кривой амплификации при 72°С (F-общая) происходит от сигнала флуоресценции, возникающего за счет как расщепленного LOCS-X (F-LOCS-XFAF), так и расщепленного LOCS-Y (F- LOCS-Y). Исходя из этого, кривую амплификации при 72°С, полученную за счет LOCS-Y, можно экстраполировать следующим образом:
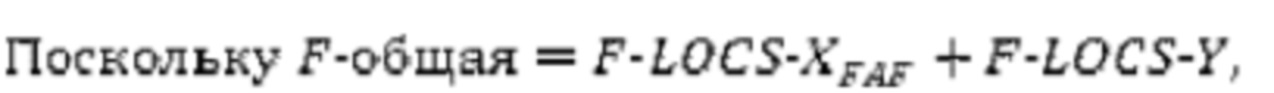

Значения Cq на основе кривой амплификации при TH 72°С, полученной за счет LOCS-Y с использованием TY, являются полностью количественными для мишени Y. Эту формулу можно применять для правильной количественной оценки независимо от того, содержит ли образец мишень X, Y или обе эти мишени.
Мишень Y - способ количественной оценки 2
В присутствии обеих мишеней X и Y экспериментально определенные значения Cq при 72°С (Cqнаблюдаемый) смещены по сравнению со значениями Cq для образца, содержащего такую же концентрацию мишени Y без мишени X. Связь между значениями Cqнаблюдаемый и ожидаемым Cq, определенная по стандартной кривой для мишени Y в отсутствие мишени X при 72°С (Cqстандартная кривая для мишени Y), описана ниже:
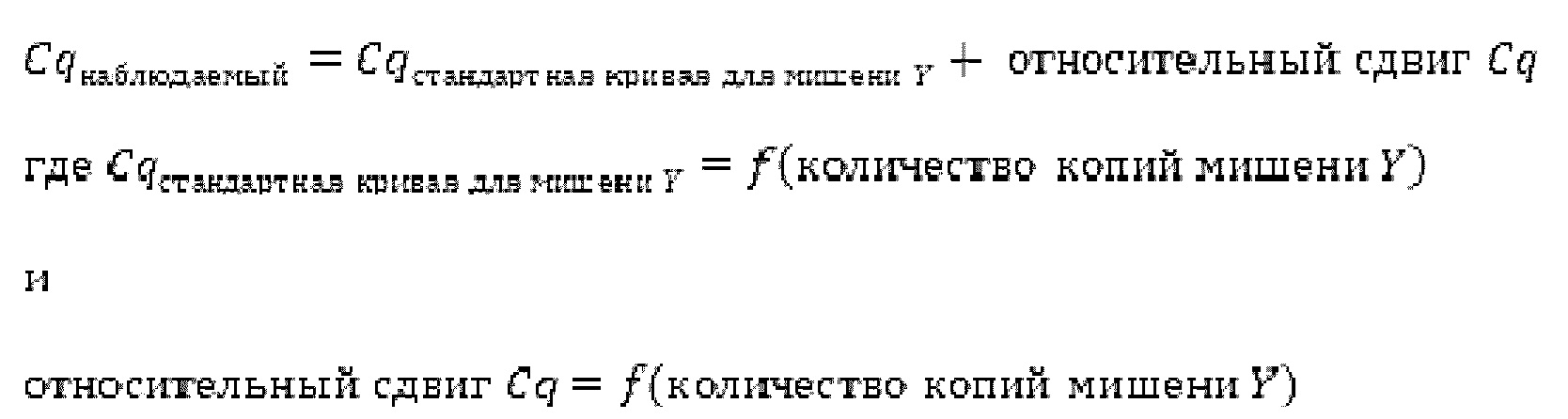
Так как Cqстандартная кривая для мишени Y и относитвльный сдвиг Cq являются функциями количества копий мишени Y, количество копий мишени Y можно рассчитать на основе экспериментально определенного значения Cq (Cqнaблюдaeмый). Этот относительный сдвиг значения Cq характеризуется математической (логистической) зависимостью от натурального логарифма величины (количество копий мишени Y/количество копий мишени X). При определении значений Cq с порогом, равным половине максимального уровня флуоресценции на кривой амплификации, измеренной при 72°С, логистическую зависимость можно выразить следующей формулой:
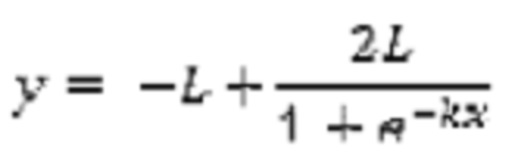
где у = относительный сдвиг Cq, L = максимально возможный сдвиг Cq, k = коэффициент крутизны, х=ln (количество копий мишени Y/количество копий мишени X); обратите внимание, что количество копий мишени X определяют на основе кривых амплификации при 39°С.
Включение коэффициента сдвига значения Cq в уравнение стандартной кривой для мишени Y, определенной в отсутствие мишени X, позволяет корректировать значение Cq в присутствии мишени X и впоследствии приводит к правильной количественной оценке мишени Y.
Вышеописанную стратегию можно адаптировать для обнаружения любых мишеней, однако в данном конкретном примере мишенью X является ген CTcry, а мишенью Y является ген NGopa; накопление ампликонов каждой мишени контролировали при низкой температуре (TL 39°С) и более высокой температуре (TH 72°С) во время ПЦР по изменениям флуоресценции, ассоциированным с LOCS-X (LOCS-19) и LOCS-Y (LOCS- 20); причем оба LOCS были мечены одним и тем же флуорофором (JOE).
Олигонуклеотиды
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: LOCS-19, LOCS-20, партзим А9, партзим В9, партзим А10, партзим В10, прямой праймер 7, обратный праймер 7, прямой праймер 8 и обратный праймер 11. Последовательности перечислены в перечне последовательностей. Олигонуклеотиды, специфичные по отношению к амплификации и количественной оценке CTcry, представляли собой LOCS-19, партзим А9, партзим В9, прямой праймер 7 и обратный праймер 7. Олигонуклеотиды, специфичные по отношению к амплификации и количественной оценке NGopa, представляли собой LOCS-20, партзим А10, партзим В10, прямой праймер 8 и обратный праймер 11.
Условия реакции
Обнаружение последовательности-мишени в реальном времени выполняли в общем реакционном объеме 20 мкл с использованием термоциклера BioRad® CFX96. Параметры цикла представляли собой: 95°С в течение 2 минут, затем 10 циклов снижения, включавших 95°С в течение 5 секунд и 61°С в течение 30 секунд (уменьшение на 0,5°С за цикл) и 40 циклов, включавших 95°С в течение 5 секунд, 52°С в течение 40 секунд, 39°С в течение 1 с и 72°С в течение 1 с (данные получали на этапах как 39°С, так и 72°С). Каждая реакционная смесь содержала 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима, 100 нМ репортера LOCS-19, 200 нМ репортера LOCS-20 и 1х мастер-микс PlexMastermix (Bioline). Реакционные смеси не содержали мишени (NF ШО), либо содержали синтетическую последовательность G-Block X (20000, 4000, 800, 160 или 32 копии), синтетическую последовательность G-Block гена NGopa (20000, 4000, 800, 160 или 32 копии), различные концентрации синтетической последовательности G-Block гена CTcry (20000, 4000, 800, 160 или 32 копии) на фоне синтетической последовательности G-Block гена CTcry (20000, 4000, 800, 160 или 32 копии) или различные концентрации синтетической последовательности G-Block гена NGopa (20000, 4000, 800, 160 или 32 копии) на фоне синтетической последовательности G-Block гена CTcry (20000, 4000, 800, 160 или 32 копии).
Результаты
Два МНКзима (МНКзим 9 и МНКзим 10) использовали для мониторинга амплификации нуклеиновых кислот-мишеней во время ПЦР в режиме реального времени посредством расщепления соответствующих LOCS-репортеров (LOCS-19 и LOCS-20, соответственно). МНКзим 9 был предназначен для обнаружения последовательностей, гомологичных CTcry, с целью обнаружения Chlamydia trachomatis, и для расщепления и раскрытия LOCS-19. МНКзим 10 был предназначен для обнаружения последовательностей, гомологичных NGopa, с целью обнаружения Neisseria gonorrhoeae, и для расщепления и раскрытия LOCS-20.
Результаты, показанные на фигуре 17А и 17В, демонстрируют сравнительные кривые амплификации, полученные на канале JOE при использовании реакционных смесей, содержащих 20000 копий CTcry или NGopa, либо 20000 копий обоих генов-мишеней, измеренные при 39°С и 72°С, соответственно. Результаты представлены в виде средних значений по реакциям в двух повторностях. При 39°С образцы, содержавшие 20000 копий матрицы CTcry (сплошная черная линия), демонстрировали кривые амплификации с уровнями флуоресценции, превышавшими ТХ (черная горизонтальная линия, обозначенная как ТХ) и достигавшими ЕХ1 (черная горизонтальная линия, обозначенная как ЕХ1). При 39°С образцы, содержащие по 20000 копий матриц CTcry и NGopa (сплошная серая линия), демонстрировали кривые амплификации с уровнями флуоресценции, превышавшими ТХ и достигавшими ЕХ1, тогда как образцы, не содержавшие матрицы CTcry (пунктирная черная линия), не превышали ТХ и не достигали ЕХ1. Таким образом, кривая амплификации при 39°С, выходившая на плато в точке ЕХ1, подтвердила наличие CTcry в образце. На графике показаны образцы, содержавшие 20000 копий только CTcry (сплошная черная линия) и 20000 копий CTcry и NGopa (сплошная серая линия), с аналогичными значениями Cq.
Поскольку наличие NGopa не влияло на значения Cq при 39°С, его можно использовать для количественной оценки CTcry в образце. Сводные результаты количественной оценки CTcry в образцах всех комбинаций 0, 32, 160, 800, 4000 и 20000 копий гена-мишени CTcry и 0, 32, 160, 800, 4000 и 20000 копий гена-мишени NGopa приведены в таблице 6. НЕТ означает отсутствие значения Cq, определенного при 39°С, и, таким образом, отсутствие CTcry в образце.
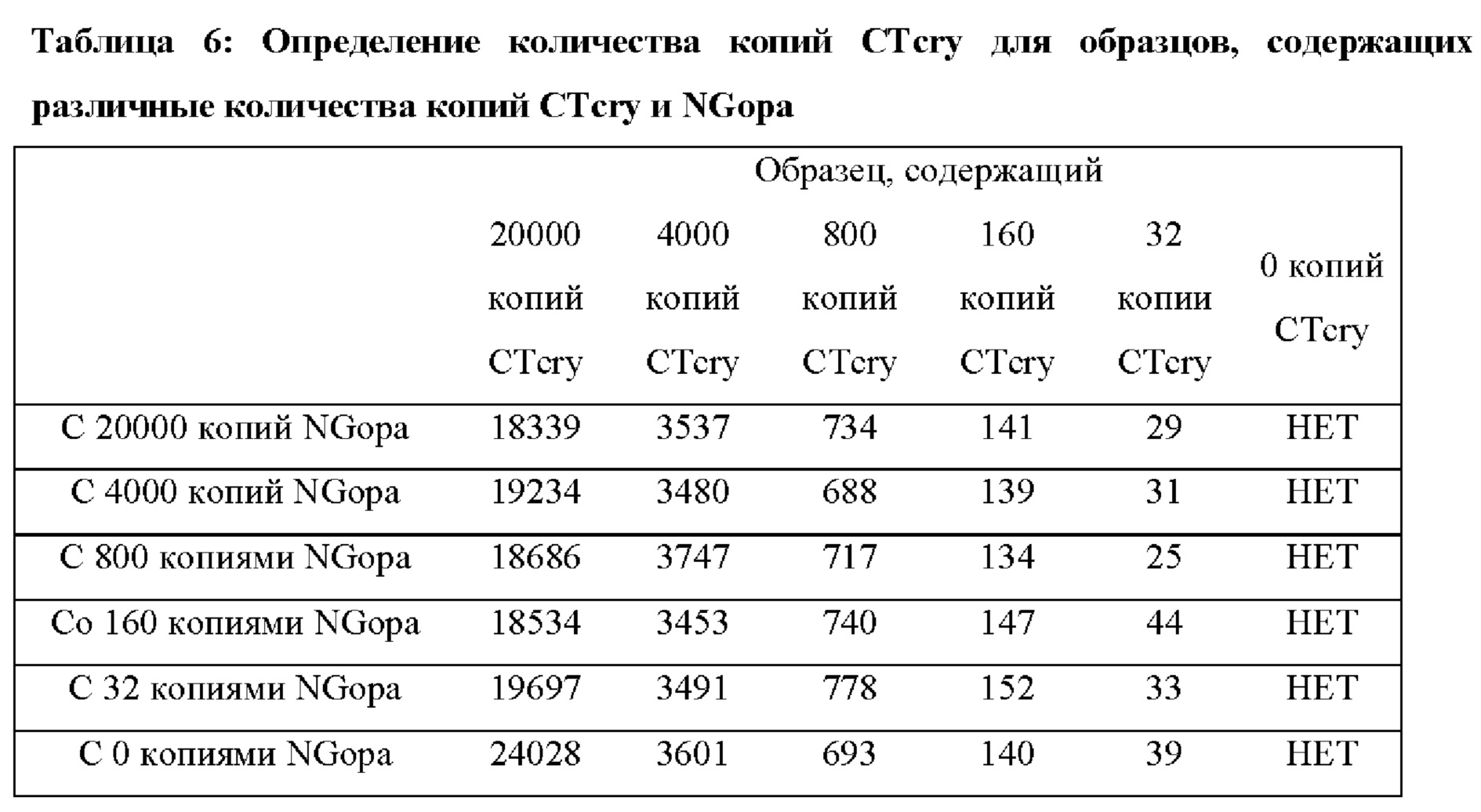
На фигуре 17В показаны кривые амплификации при 72°С для образцов, содержавших 20000 копий матрицы NGopa (пунктирная черная линия) с уровнями флуоресценции, превышавшими TY (черная горизонтальная линия, обозначенная как TY), и выходящие на плато в точке EY1 (черная горизонтальная линия, обозначенная как EY1). При 72°С образцы, содержавшие 20000 копий CTcry и NGopa (сплошная серая линия), демонстрировали кривые амплификации с уровнями флуоресценции, превышавшими TY, и выходившие на плато в точке EY2 (черная горизонтальная линия, обозначенная как EY2), тогда как образцы, не содержавшие матрицы мишени NGopa (сплошная черная линия), не превышали TY и не достигали EY1 и EY2, и выходили на плато только в конечной точке ЕХ2 (черная горизонтальная линия, обозначенная как конечная точка ЕХ2). Следовательно, кривая амплификации при 72°С, выходившая на плато в точке ЕХ2, подтверждала наличие мишени CTcry, но не NGopa в образце; выход на плато в точке EY1 подтверждал наличие NGopa, но не CTcry в образце; выход на плато в точке EY2 подтверждал наличие как CTcry, так и NGopa в образце.
При 72°С значение Cq образцов, содержавших 20000 копий CTcry и NGopa (сплошная серая линия), отличалось от значения Cq образцов, содержавших 20000 копий только матрицы NGopa (пунктирная черная линия). Наличие CTcry в образце в этом примере могло сместить значение Cq NGopa при 72°С приблизительно на -4,77. Следовательно, использование значений Cq при 72°С без нормировки позволяло определить концентрацию NGopa, заниженную в 24,77 раза по сравнению с ожидаемым значением, считая эффективность ПЦР-амплификации равной 100%. Сводный анализ амплификации при 72°С образцов всех комбинаций 0, 32, 160, 800, 4000 и 20000 копий гена-мишени CTcry и 0, 32, 160, 800, 4000 и 20000 копий гена-мишени NGopa без нормировки приведен в таблице 7 для значений Cq и в таблице 8 для количественной оценки NGopa. НЕТ означает отсутствие значения Cq, определенного при 72°С, и, таким образом, отсутствие NGopa в образце. Результаты показывают, что данный способ без нормировки является полностью количественным для CTcry и полуколичественным для NGopa.
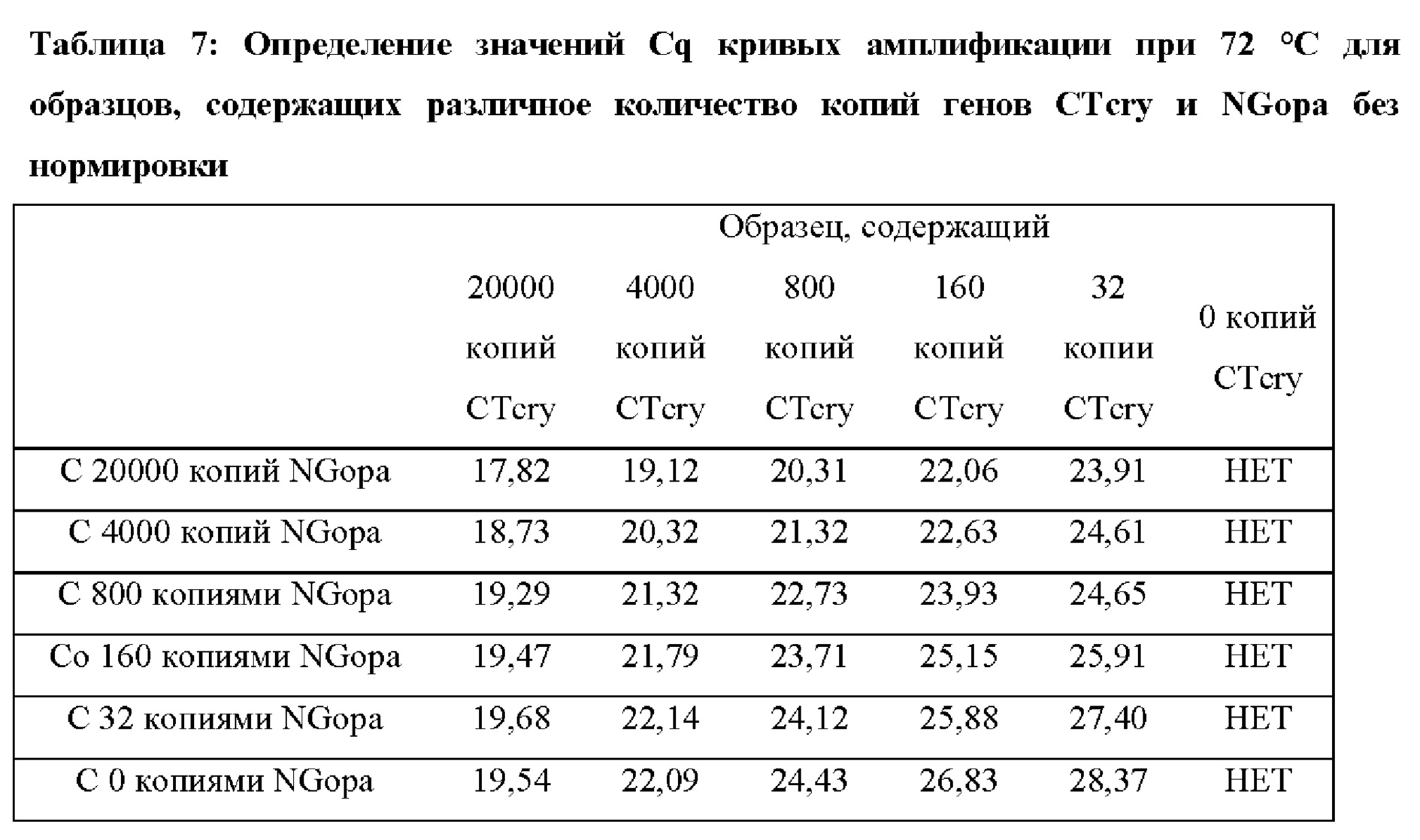


Результаты, показанные на фигуре 18, демонстрируют сравнительные кривые амплификации, полученные на канале JOE при использовании реакционных смесей, содержащих все возможные комбинации из 0, 32 и 20000 копий гена-мишени CTcry и 0, 32 и 20000 копий гена-мишени NGopa, измеренные при 39°С и 72°С, соответственно. Результаты представлены в виде средних значений по реакциям в двух повторностях. Образцы, представленные на графиках, содержали количество NGopa, указанное в левой части графиков. Образцы, содержавшие 20000 копий CTcry, представлены пунктирной черной линией, образцы, содержавшие 32 копии CTcry, представлены сплошной серой линией, а образцы, содержавшие 0 копий CTcry, представлены сплошной черной линией. Из ненормированных кривых амплификации, полученных при 72°С на фигуре 18В и 18Е, видно, что наличие CTcry в образце сдвигало значения Cq. Результаты дополнительно проанализировали с использованием способа количественной оценки 1. Вычитание кривой амплификации при 39°С, умноженной на FAF, из кривой амплификации при 72°С (поскольку F-LOCS-Y = F-total - F-LOCS-XFAF), позволило получить экстраполированные кривые амплификации, соответствующие сигналу флуоресценции расщепленного LOCS-20 без вклада расщепленного LOCS-19 (фигуры 18С и 18F). Все экстраполированные кривые амплификации при 72°С демонстрировали аналогичные значения Cq в присутствии одинакового количества матрицы NGopa, независимо от количества CTcry в образце. На фигуре 181 показано, что экстраполированные кривые амплификации при 72°С не демонстрировали значимой амплификации при отсутствии матрицы NGopa в образцах. Влияние нормировки с вычитанием сигналов F-LOCS-XFAF дополнительно продемонстрировано в таблице 9 (нормированные по F-LOCS-XFAF значения Cq) и в таблице 10 (количественная оценка NGopa после нормировки по F-LOCS-XFAF), представляющих собой анализ амплификации образцов всех комбинаций 0, 32, 160, 800, 4000 и 20000 копий гена-мишени CTcry и 0, 32, 160, 800, 4000 и 20000 копий гена-мишени NGopa после нормировки путем вычитания сигналов F-LOCS-XFAF. НЕТ означает отсутствие значения Cq, определенного при 72°С, и, таким образом, отсутствие мишени Y в образце.
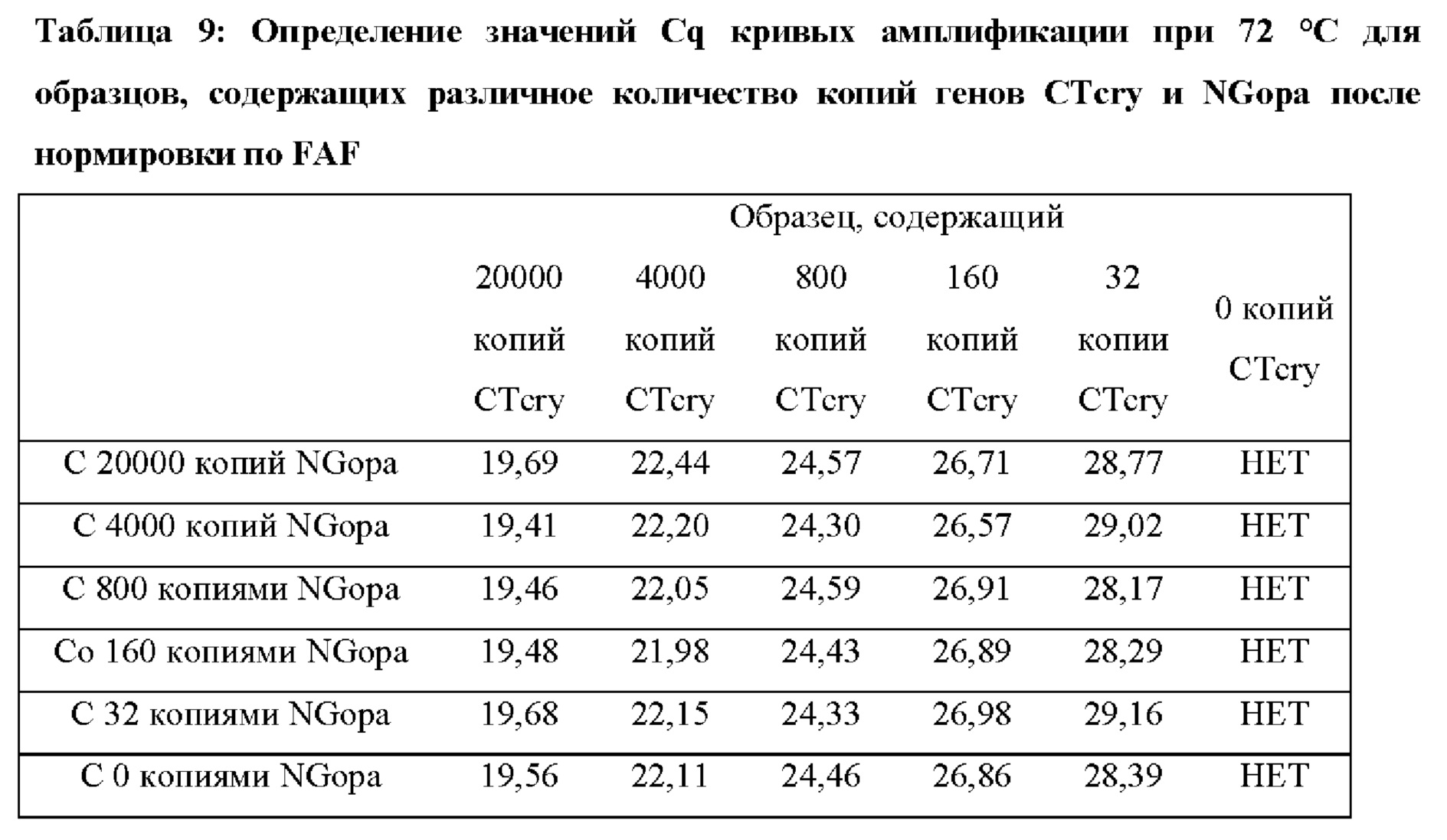

Для кривых амплификации на основе данных, полученных при 72°С, значения Cq для образцов, содержавших как CTcry, так и NGopa, были смещены относительно образца, содержавшего только NGopa. Результаты дополнительно проанализировали с использованием способа количественной оценки 2. На фигуре 19 показана логистическая регрессия натурального логарифма величины (количество копий NGopa/количество копий CTcry) в зависимости от относительного сдвига Cq, где порог Cq установили на уровне половины максимального уровня флуоресценции на кривой амплификации, подчиняющаяся следующей формуле:

Вышеуказанную формулу можно включить в уравнение стандартной кривой для NGopa, определенной в отсутствие CTcry при 72°С, следующим образом:

Поскольку количество копий CTcry определяли на основе данных, полученных при 39°С, вышеприведенную формулу можно использовать для определения количества копий NGopa в образце на основе экспериментального Cq (Cqнаблюдаемый) при 72°C с помощью программы математического решения. В таблице 11 показаны наблюдаемые значения Cq при 72°C с относительными коэффициентами сдвига Cq, рассчитанными для образцов всех комбинаций 0, 32, 160, 800, 4000 и 20000 копий гена-мишени CTcry и 0, 32, 160, 800, 4000 и 20000 копий гена-мишени NGopa, представленные как среднее значение по двум повторностям. В таблице 12 показано определение количества копий с использованием значений Cq, нормированных по коэффициенту относительного сдвига, для тех же образцов.
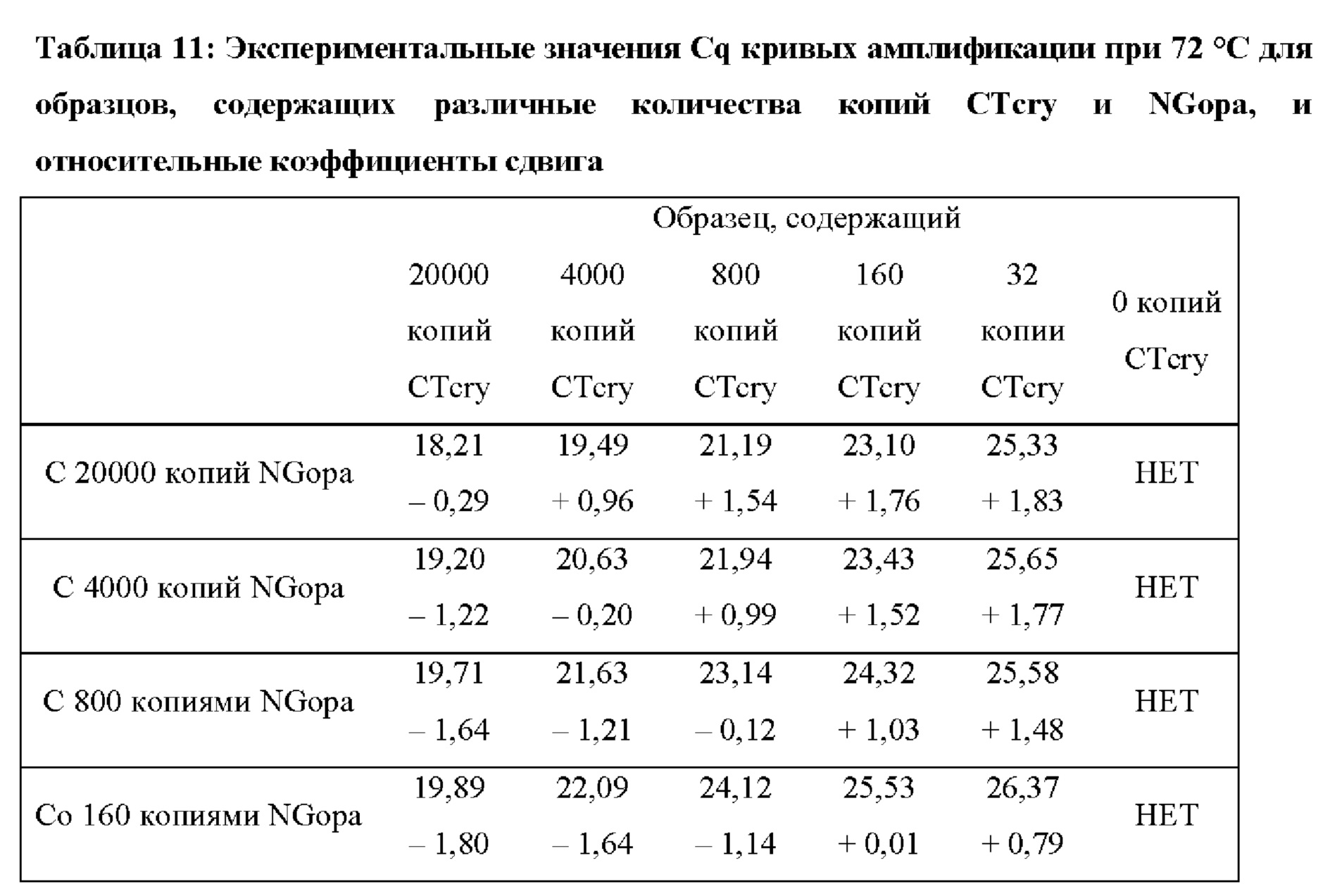

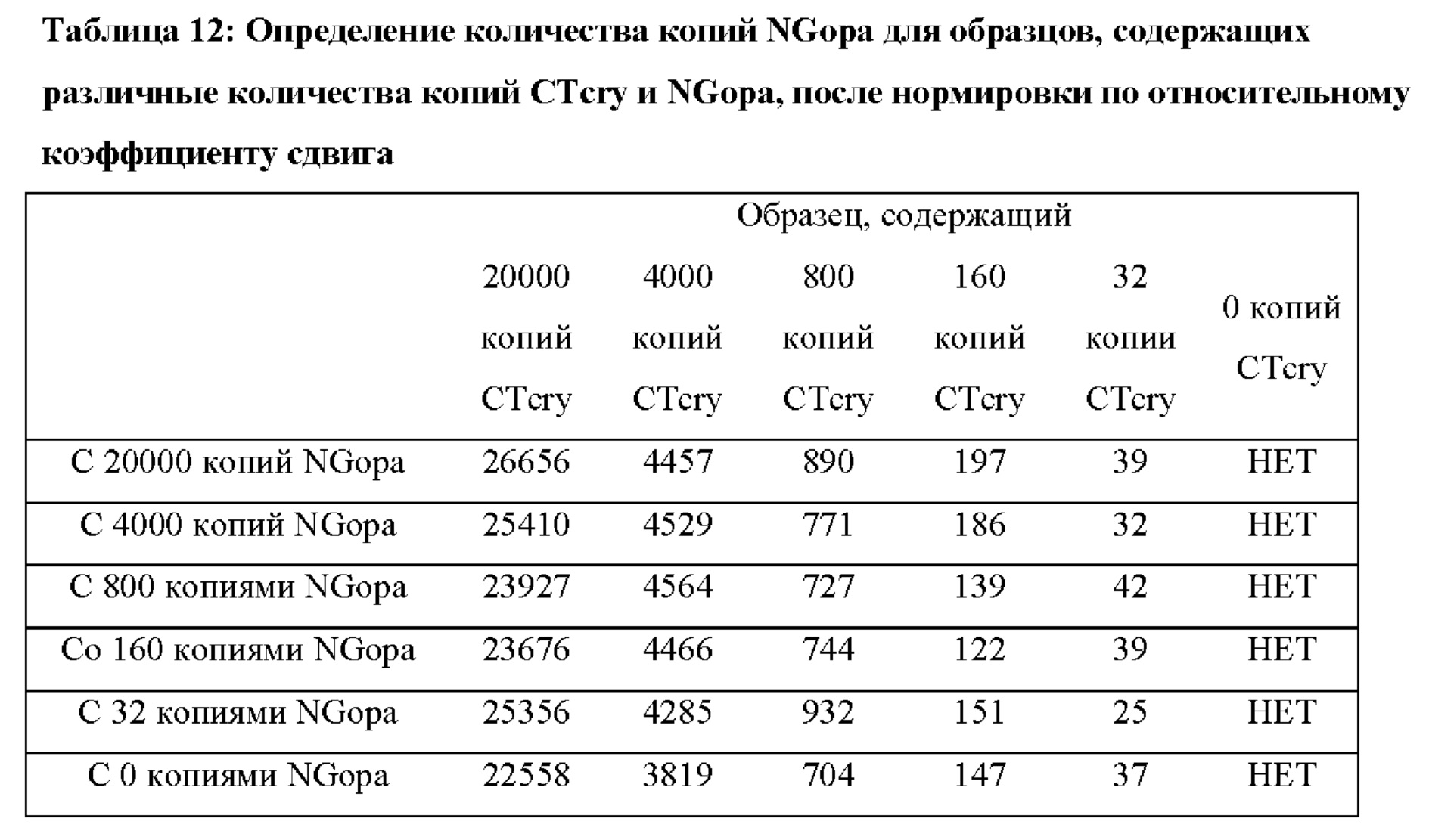
Пример 13: Одновременное обнаружение шести мишеней на двух флуоресцентных каналах с использованием шести LOCS-репортеров
В следующем примере LOCS-репортеры применяли для увеличения количества мишеней, которые можно обнаружить на двух каналах флуоресценции. В этом примере на каждом из двух флуоресцентных каналов обнаруживали три мишени. В этом примере все шесть LOCS-репортеров были мечены по 5'-концу флуорофором (JOE или Atto101), а по 3'-концу - гасителем (3IABkFQ или 3IAbRQSp, соответственно). Петлевые области каждого из LOCS-репортеров содержали свою нуклеиновую кислоту-субстрат, а стеблевые области содержали серию комплементарных пар оснований, удерживающих LOCS-репортер в конфигурации "петля-стебель". В этой конфигурации флуорофор и гаситель находились в непосредственной близости, и в отсутствие мишени флуоресценция гасилась.
Олигонуклеотиды
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: LOCS-21 (SEQ ID NO: 88), LOCS-22 (SEQ ID NO: 89), LOCS-23 (SEQ ID NO: 90), LOCS-24 (SEQ ID NO: 91), LOCS-25 (SEQ ID NO: 92), LOCS-26 (SEQ ID NO: 93), партзим A14 (SEQ ID NO: 94), партзим B14 (SEQ ID NO: 95), партзим A15 (SEQ ID NO: 96), партзим B15 (SEQ ID NO: 97), партзим A16 (SEQ ID NO: 98), партзим B16 (SEQ ID NO: 99), партзим A17 (SEQ ID NO: 100), партзим В17 (SEQ ID NO: 101), партзим A18 (SEQ ID NO: 102), партзим B18 (SEQ ID NO: 103), партзим A19 (SEQ ID NO: 104), партзим B19 (SEQ ID NO: 105), прямой праймер 12 (SEQ ID NO: 106), обратный праймер 12 (SEQ ID NO: 107), прямой праймер 9 (SEQ ID NO: 54), обратный праймер 9 (SEQ ID NO: 55), прямой праймер 13 (SEQ ID NO: 108), обратный праймер 13 (SEQ ID NO: 109), прямой праймер 14 (SEQ ID NO: 110), обратный праймер 2 (SEQ ID NO: 10), прямой праймер 1 (SEQ ID NO: 7), обратный праймер 1 (SEQ ID NO: 8), прямой праймер 15 (SEQ ID NO: 111), обратный праймер 15 (SEQ ID NO: 112). Последовательности перечислены в перечне последовательностей. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению gpd, представляли собой LOCS-21, партзим А14, партзим В14, прямой праймер 12 и обратный праймер 12. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению gpd3, представляли собой LOCS-22, партзим А15, партзим В15, прямой праймер 9 и обратный праймер 12. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению porA, представляли собой LOCS-23, партзим А16, партзим В16, прямой праймер 13 и обратный праймер 13. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению TV-Btub, представляли собой LOCS-24, партзим А17, партзим В17, прямой праймер 14 и обратный праймер 2. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению MgPa, представляли собой LOCS-25, партзим А18, партзим В18, прямой праймер 1 и обратный праймер 1. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению LGV, представляли собой LOCS-26, партзим А19, партзим В19, прямой праймер 15 и обратный праймер 15.
Условия реакции
Амплификацию в реальном времени и обнаружение последовательности-мишени выполняли в общем реакционном объеме 20 мкл с использованием термоциклера BioRad® CFX96. Параметры цикла представляли собой: 40°С в течение одной секунды, 70°С в течение одной секунды, 85°С в течение одной секунды, 95°С в течение 2 минут, 10 циклов снижения, включавших 95°С в течение 5 секунд и 61°С в течение 30 секунд (уменьшение на 0,5°С за цикл) и 40 циклов, включавших 95°С в течение 5 секунд, 52°С в течение 40 секунд и 65°С в течение 1 с (данные получали на этапе 65°С), а затем 40°С в течение одной секунды, 70°С в течение одной секунды и 85°С в течение одной секунды. Параметры кривой плавления представляли собой диапазон от 20°С до 95°C с шагом 0,5°С и выдержкой 5 секунд (регистрацию данных выполняли на этапе выдержки). Все реакции выполняли в двух повторностях, реакционные смеси содержали 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима А, 200 нМ каждого партзима В, по 200 нМ каждого из LOCS-21, LOCS-22, LOCS-24 и LOCS-25 и по 150 мм каждого из LOCS-23 и LOCS-26, 8 мМ MgCl2 (Bioline), 0,2 мМ dNTP (Bioline), 2 единицы полимеразы MyTaq (Bioline) и 1х буфер NH4 (Bioline). Реакционные смеси содержали матрицу G-Block (10000 копий), гомологичную генам gpd и/или gpd3 и/или porA и/или TV-Btub и/или MgPa и/или LGV, либо не содержали мишени (NF H2O).
Результаты
Используя способ амплификации мишени in vitro, известный как ПЦР, шесть МНКзимов (МНКзим 14, МНКзим 15, МНКзим 16, МНКзим 17, МНКзим 18 и МНКзим 19) использовали для мониторинга амплификации нуклеиновых кислот-мишеней в режиме реального времени посредством расщепления соответствующих LOCS-репортеров (LOCS-21, LOCS-22, LOCS-23, LOCS-24, LOCS-25 и LOCS-26, соответственно). Наличие любой или всех мишеней для каждого канала (JOE и Texas Red) определяли по увеличению флуоресценции в фазе амплификации ПЦР (данные не показаны); затем выполняли распознавание отдельных мишеней на основе уникальных сигнатур плавления LOCS. МНКзим 14 был предназначен для обнаружения последовательностей, гомологичных гену gpd, и для расщепления и раскрытия LOCS-21; МНКзим 15 был предназначен для обнаружения последовательностей, гомологичных гену gpd3, и для расщепления и раскрытия LOCS-22; МНКзим 14 был предназначен для обнаружения последовательностей, гомологичных гену porA, и для расщепления и раскрытия LOCS-23; МНКзим 17 был предназначен для обнаружения последовательностей, гомологичных TV-Btub, и расщепления и раскрытия LOCS-24; МНКзим 18 был предназначен для обнаружения последовательностей, гомологичных гену MgPa, и для расщепления и раскрытия LOCS-25; а МНКзим 19 был предназначен для обнаружения последовательностей, гомологичных гену LGV, и расщепления и раскрытия LOCS-26. В этом эксперименте амплификацию и обнаружение выполняли в одной пробирке, содержащей все МНКзимы, праймеры и LOCS-олигонуклеотиды. Наличие генов gpd, gpd3, porA, TV-Btub, MgPa, LGV или различных комбинаций шести генов (представляющих образец с множественной инфекцией) обнаруживали по увеличению сигнала на одном или обоих каналах JOE и Texas Red (данные не показаны).
Результаты, показанные на фигурах 20-22, демонстрируют соответствующие сигнатуры кривых плавления, полученные после амплификации в реакционных смесях, содержащих 10000 копий мишеней gpd (фигура 20А), gpd3 (фигура 20В), porA (фигура 20С), как gpd, так и gpd3 (фигура 20D).), как gpd, так и porA (фигура 20Е), как gpd3, так и porA (фигура 20F), или всех трех мишеней gpd, gpd3 и porA (фигура 22А), TV-Btub (фигура 21А), MgPa (фигура 21В), LGV (фигура 21С), как TV-Btub, так и MgPa (фигура 21D), как TV-Btub, так и LGV (фигура 21Е), как MgPa, так и LGV (фигура 21F) или всех трех мишеней TV-Btub, MgPa и LGV (фигура 22В). Результаты представляли собой средние значения реакций в двух повторностях, построенные с помощью Microsoft Excel (версия 14).
Сводные данные, полученные в этом примере и приведенные в таблице 13, демонстрируют, что сигнатуры плавления LOCS, полученные в присутствии гена-мишени gpd (Tm=53°С, 68°С и 85°С), отличались от сигнатур плавления LOCS, полученных в присутствии генов-мишеней gpd3 (Tm=30°С, 43°С, 77°С и 85°С) и porA (Tm=68°С и 77°С). Этот пример демонстрирует, что можно достичь одновременного обнаружения генов-мишеней TV-Btub, MgPa и/или LGV на втором канале в дополнение к обнаружению gpd, gpd3 и/или porA. Сигнатура плавления LOCS, полученная в присутствии гена-мишени TV-Btub (Tm=30°С, 42°С, 66°С и 82°С), отличается от сигнатур плавления LOCS, полученных в присутствии генов-мишеней MgPa (53°С, 66°С и 82°С) и LGV (Tm=68°С). Кроме того, сигнатуры плавления LOCS в присутствии двух или более генов-мишеней, считываемых на одном канале, также отличаются от вышеупомянутых сигнатур плавления, полученных в присутствии только одного гена-мишени. В присутствии генов-мишеней gpd и gpd3 в одной реакционной смеси уникальная сигнатура кривой плавления LOCS (Tm=30°С, 43°С, 53°С и 85°С) на канале JOE указывала на обнаружение обеих мишеней. Аналогичным образом, в присутствии gpd и porA или gpd3 и porA в одной реакционной смеси уникальные сигнатуры кривой плавления (Tm=53°С и 68°С и Tm=30°С, 43°С, 68°С и 77°С, соответственно) указывали на обнаружение двух мишеней и позволяли специфично идентифицировать их. Таким же образом, сигнатуры плавления LOCS на канале Texas Red являлись уникальными для каждой комбинации мишеней: TV-Btub и MgPa (Tm=30°С, 42°С, 53°С и 82°С), TV-Btub и LGV (Tm=30°С, 42°С и 68°С) или MgPa и LGV (Tm=53°С и 68°С). В присутствии всех генов-мишеней gpd, gpd3 и porA в одной реакционной смеси уникальная сигнатура кривой плавления LOCS (Tm=30°С, 43°С, 53°С и 68°С) на канале JOE указывала на обнаружение всех трех мишеней. Аналогичным образом, присутствие мишеней TV-Btub, MgPa и LGV в одном образце приводило к получению уникальной сигнатуры плавления LOCS (Tm=30°С, 42°С, 53°С и 68°С) на канале Texas Red.

Этот пример демонстрирует, что шесть мишеней, совместно амплифицированные в одной лунке при использовании двух флуоресцентных каналов (с обнаружением трех мишеней на каждом канале), можно различать на основе их уникальных сигнатур плавления LOCS. В примере представлен простой способ обнаружения нескольких мишеней в одной лунке с использованием всего двух флуоресцентных каналов. Из-за разной длины стебля и состава пар оснований разные стебли (стебель-5, стебель-6, стебель-7, стебель-8, стебель-9 и стебель-10) в составе LOCS-21, LOCS-22, LOCS-23, LOCS-24, LOCS-25 и LOCS-26 позволяли получить уникальные сигнатуры флуоресцентной кривой плавления.
Пример 14: Одновременное обнаружение и различение десяти мишеней в одной лунке с использованием пяти флуоресцентных каналов и десяти LOCS-репортеров
В следующем примере LOCS-репортеры применяли для увеличения количества мишеней, которые можно одновременно обнаружить в одной лунке с использованием пяти флуоресцентных каналов, за счет увеличения количества мишеней, которые можно обнаружить на каждом канале. В этом примере на каждом из пяти флуоресцентных каналов обнаруживали две мишени. В этом примере все десять LOCS-репортеров были мечены по 5'-концу флуорофором (FAM, JOE, AttoRho101, Су5 или Су5.5), а по 3'-концу - гасителем (3IABkFQ или 3IAbRQSp). Петлевые области LOCS-репортеров содержали нуклеиновую кислоту-субстрат, а стеблевые области содержали серию комплементарных пар оснований, удерживающих LOCS-репортер в конфигурации "петля-стебель". В этой конфигурации флуорофор и гаситель находились в непосредственной близости, и в отсутствие мишени флуоресценция гасилась.
Олигонуклеотиды
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: LOCS-10 (SEQ ID NO: 40), LOCS-15 (SEQ ID NO: 79), LOCS-21 (SEQ ID NO: 88), LOCS-22 (SEQ ID NO: 89), LOCS-24 (SEQ ID NO: 91), LOCS-27 (SEQ ID NO: 113), LOCS-28 (SEQ ID NO: 114), LOCS-29 (SEQ ID NO: 115), LOCS-30 (SEQ ID NO: 116), LOCS-31 (SEQ ID NO: 117), партзим A9 (SEQ ID NO: 43), партзим B9 (SEQ ID NO: 44), партзим A10 (SEQ ID NO: 48), партзим BIO (SEQ ID NO: 49), партзим A14 (SEQ ID NO: 94), партзим B14 (SEQ ID NO: 95), партзим A15 (SEQ ID NO: 97), партзим B15 (SEQ ID NO: 98), партзим A16 (SEQ ID NO: 98), партзим B16 (SEQ ID NO: 99), партзим A17 (SEQ ID NO: 100), партзим B17 (SEQ ID NO: 101), партзим A18 (SEQ ID NO: 102), партзим B18 (SEQ ID NO: 103), партзим A19 (SEQ ID NO: 104), партзим B19 (SEQ ID NO: 105), партзим A20 (SEQ ID NO: 118), партзим B20 (SEQ ID NO: 119), партзим A21 (SEQ ID NO: 120), партзим B21 (SEQ ID NO: 121), прямой праймер 1 (SEQ ID NO: 7), обратный праймер 1 (SEQ ID NO: 8), обратный праймер 2 (SEQ ID NO: 10), прямой праймер 7 (SEQ ID NO: 41), обратный праймер 7 (SEQ ID NO: 42), прямой праймер 8 (SEQ ID NO: 52), прямой праймер 9 (SEQ ID NO: 54), обратный праймер 9 (SEQ ID NO: 55), прямой праймер 10 (SEQ ID NO: 72), обратный праймер 10 (SEQ ID NO: 73), обратный праймер 11 (SEQ ID NO: 85), прямой праймер 12 (SEQ ID NO: 106), обратный праймер 12 (SEQ ID NO: 107), прямой праймер 13 (SEQ ID NO: 108), обратный праймер 13 (SEQ ID NO: 109), прямой праймер 14 (SEQ ID NO: 110), прямой праймер 15 (SEQ ID NO: 111), обратный праймер 15 (SEQ ID NO: 112), прямой праймер 16 (SEQ ID NO: 122) и обратный праймер 16 (SEQ ID NO: 123). Последовательности перечислены в перечне последовательностей.
Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению CTcry, представляли собой LOCS-29, партзим А9, партзим В9, прямой праймер 7 и обратный праймер 7. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению NGopa, представляли собой LOCS-15, партзим А10, партзим В10, прямой праймер 8 и обратный праймер 11. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению gpd, представляли собой LOCS-21, партзим А14, партзим В14, прямой праймер 12 и обратный праймер 12. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению gpd3, представляли собой LOCS-22, партзим А15, партзим В15, прямой праймер 9 и обратный праймер 9. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению porA, представляли собой LOCS-27, партзим А16, партзим В16, прямой праймер 13 и обратный праймер 13. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению TV-Btub, представляли собой LOCS-24, партзим А17, партзим В17, прямой праймер 14 и обратный праймер 2. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению MgPa, представляли собой LOCS-28, партзим А18, партзим В18, прямой праймер 1 и обратный праймер 1. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению LGV, представляли собой LOCS-10, партзим А19, партзим В19, прямой праймер 15 и обратный праймер 15. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению polA, представляли собой LOCS-30, партзим А20, партзим В20, прямой праймер 16 и обратный праймер 16. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению TFRC, представляли собой LOCS-31, партзим А21, партзим В21, прямой праймер 10 и обратный праймер 10.
Условия реакции
Амплификацию в реальном времени и обнаружение последовательности-мишени выполняли в общем реакционном объеме 20 мкл с использованием термоциклера BioRad® CFX96. Параметры цикла представляли собой: 31°С в течение одной секунды, 42°С в течение одной секунды, 53°С в течение одной секунды, 60°С в течение одной секунды, 95°С в течение 2 минут, 10 циклов снижения, включавших 95°С в течение 5 секунд и 61°С в течение 30 секунд (уменьшение на 0,5°С за цикл) и 40 циклов, включавших 95°С в течение 5 секунд, 52°С в течение 40 секунд и 65°С в течение 5 секунд (данные получали на этапе 65°С), а затем 31°С в течение одной секунды, 42°С в течение одной секунды, 53°С в течение одной секунды и 60°С в течение одной секунды. Параметры кривой плавления представляли собой диапазон от 20°С до 95°C с шагом 0,5°С и выдержкой 5 секунд (регистрацию данных выполняли на этапе выдержки). Все реакции выполняли в двух повторностях, реакционные смеси содержали 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима А, 200 нМ каждого партзима В, по 200 нМ каждого из репортеров LOCS-10, LOCS-15, LOCS-21, LOCS-22, LOCS-24, LOCS-27, LOCS-29 и LOCS-31 и по 150 мм каждого из LOCS-28 и LOCS-30, 8 мМ MgCh (Bioline), 0,2 мМ dNTP (Bioline), 2 единицы полимеразы MyTaq (Bioline) и 1x буфер NH4 (Bioline). Реакционные смеси содержали матрицу G-Block (10000 копий), гомологичную генам NGopa и/или porA, gpd и/или gpd3, TV-Btub и/или MgPa, CTcry и/или LGV или polA, либо не содержали мишени (NF H2O). Все реакционные смеси содержали фон из 10000 копий геномной ДНК человека, содержащей ген-мишень TFRC, который служит эндогенным контролем. Обнаружение гена TFRC контролировали в каждой реакции в качестве внутреннего контроля по увеличению флуоресценции на канале Су5.5 (данные не показаны).
Результаты
Используя способ амплификации мишени in vitro, известный как ПЦР, десять МНКзимов (МНКзим 9, МНКзим 10 и МНКзимы 14-21) использовали для мониторинга амплификации нуклеиновых кислот-мишеней в режиме реального времени посредством расщепления соответствующих LOCS-репортеров (LOCS-29, LOCS-15, LOCS-21, LOCS-22, LOCS-27, LOCS-24, LOCS-28, LOCS-10, LOCS-30 и LOCS-31, соответственно). Наличие одной или обеих мишеней на каждом канале (FAM, HEX, Texas Red, Су5 и Су5.5) определяли по увеличению флуоресценции в фазе амплификации ПЦР, а затем выполняли распознавание отдельных мишеней по сигнатурам плавления LOCS.
МНКзим 10 был предназначен для обнаружения последовательностей, гомологичных гену NGopa, и для расщепления и раскрытия LOCS-15; МНКзим 16 был предназначен для обнаружения последовательностей, гомологичных гену porA, и для расщепления и раскрытия LOCS-27; МНКзим 14 был предназначен для обнаружения последовательностей, гомологичных гену gpd, и для расщепления и раскрытия LOCS-21; МНКзим 15 был предназначен для обнаружения последовательностей, гомологичных гену gpd3, и для расщепления и раскрытия LOCS-22; МНКзим 17 был предназначен для обнаружения последовательностей, гомологичных TV-Btub, и расщепления и раскрытия LOCS-24; МНКзим 18 был предназначен для обнаружения последовательностей, гомологичных гену MgPa, и для расщепления и раскрытия LOCS-28; МНКзим 9 был предназначен для обнаружения последовательностей, гомологичных CTcry, и расщепления и раскрытия LOCS-29; МНКзим 19 был предназначен для обнаружения последовательностей, гомологичных гену LGV pmpH, и расщепления и раскрытия LOCS-10; МНКзим 20 был предназначен для обнаружения последовательностей, гомологичных polA, и расщепления и раскрытия LOCS-30, а МНКзим 21 был предназначен для обнаружения гена TFRC человека и расщепления и раскрытия LOCS-31.
В этом эксперименте амплификацию и обнаружение выполняли в одной пробирке, содержащей все партзимы для всех МНКзимов, все праймеры и все LOCS-олигонуклеотиды. Наличие любого из генов-мишеней NGopa, porA, gpd, gpd3, TV-Btub, MgPa, CTcry, LGV, polA, TFRC или различных комбинаций этих десяти генов-мишеней (представляющих образец с множественной инфекцией) обнаруживали по увеличению сигнала на любом из каналов FAM, HEX, Texas Red, Су5 или Су5.5 (данные не показаны).
Результаты, показанные на фигуре 23, демонстрируют соответствующие сигнатуры кривых плавления, полученные после амплификации в реакционных смесях, содержащих 10000 копий мишеней NGopa (фигура 23А), porA (фигура 23В), как NGopa, так и porA (фигура 23С), gpd (фигура 23D), gpd3 (фигура 23Е), как gpd, так и gpd3 (фигура 23F), TV-Btub (фигура 23G), MgPa (фигура 23Н), как TV-Btub, так и MgPa (фигура 231), CTcry (фигура 23J), LGV (фигура 23K), как CTcry, так и LGV (фигура 23L), polA (фигура 23М) или TFRC (фигура 23N). Результаты представляли собой средние значения реакций в двух повторностях, построенные с помощью Microsoft Excel (версия 14).
Сводные данные, полученные в этом примере и приведенные в таблице 14, демонстрируют, что сигнатуры плавления LOCS, полученные в присутствии одиночной мишени, отличались от сигнатур плавления LOCS, полученных в присутствии второй мишени, флуоресцирующей на том же канале. Кроме того, сигнатура плавления LOCS, полученная в присутствии обеих мишеней на одном канале, отличалась от сигнатуры плавления LOCS, полученной в присутствии любой из двух одиночных мишеней, обнаруживаемых при конкретной длине волны. Этот результат одинаков для всех пяти каналов в этом примере. Все сигнатуры плавления LOCS, полученные на канале FAM в присутствии генов-мишеней NGopa (Tm=53°С), porA (Tm=30°С и 76°С), а также как NGopa, так и porA (Tm=30°С и 53°С), отличались друг от друга. Все сигнатуры плавления LOCS, полученные на канале HEX в присутствии генов-мишеней gpd (53°С и 70°С), gpd3 (30°С, 43°С и 76°С), а также как gpd, так и gpd3 (30°С, 43°С и 53°С), отличались друг от друга. Все сигнатуры плавления LOCS, полученные на канале Texas Red в присутствии генов-мишеней TV-Btub (31°С, 41°С, 59°С и 83°С), MgPa (63°С), а также как TV-Btub, так и MgPa (31°С, 41°С и 63°С), отличались друг от друга. Все сигнатуры плавления LOCS, полученные на канале Су5 в присутствии генов-мишеней CTcry (61°С и 79°С), LGV (47°С и 80°С), а также как CTcry, так и LGV (47°С и 61°С), отличались друг от друга. В этом примере геномную ДНК человека (TFRC) обнаруживали на канале Су5.5 во всех реакциях; таким образом, она служила эндогенным контролем. Следовательно, реакция, обнаруживавшая polA, одновременно обнаруживала TFRC, что демонстрировалось в сигнатуре плавления LOCS двумя пиками (39°С и 59°С), соответствовавшими генам-мишеням TFRC и polA, соответственно. Сигнатуры плавления LOCS, полученные на канале Су5.5 в присутствии polA и TFRC (39°С и 59°С), отличались от сигнатуры плавления LOCS, полученной в присутствии TFRC (39°С и 80°С) самого по себе, обеспечивая различие между реакционными смесями, содержащими polA (сигнатуры плавления polA и TFRC), и реакционными смесями, не содержавшими polA (только сигнатура плавления LOCS TFRC).

Этот пример демонстрирует, что десять генов-мишеней, совместно амплифицированные в одной лунке при использовании пяти флуоресцентных каналов (с обнаружением двух мишеней в каждой лунке), можно различать на основе их уникальных сигнатур плавления LOCS. В примере представлен простой способ обнаружения нескольких мишеней в одной лунке с использованием пяти флуоресцентных каналов, что позволило удвоить количество обнаруживаемых мишеней на одном аппарате для ПЦР.
Пример 15: способы одноканального мультиплексного анализа в одной лунке путем измерения флуоресценции при заданных значениях температуры
В следующем примере представлены альтернативные протоколы обнаружения и различения нескольких мишеней при одной длине волны без необходимости выполнения полного анализа кривой плавления в широком диапазоне температур, как ранее проиллюстрировано в примерах с 1 по 6. В данном примере продемонстрированы несколько способов обнаружения и идентификации трех мишеней при одной длине волны с использованием модифицированных протоколов LOCS в сочетании с выбором стратегий анализа. Мишени X, Y и Z можно обнаружить с помощью трех LOCS-репортеров X, Y и Z, каждый из которых можно метить одним и тем же флуорофором. Каждый из трех LOCS-репортеров содержал свои стеблевые области с различными температурами плавления, причем Tm LOCS-X < Tm LOCS-Y < Tm LOCS-Z. Кроме того, каждый из LOCS-репортеров содержал свои петлевые области, содержавшие субстрат, специфичный по отношению к МНКзимам X, Y или Z, соответственно. МНКзимы X, Y или Z были предназначены для распознавания и обнаружения мишеней X, Y и Z, соответственно и расщепления LOCS-репортеров X, Y и Z, соответственно. Ограниченное количество измерений флуоресценции (в общей сложности шесть или менее) можно было выполнить до и/или после ПЦР-амплификации мишеней. Измерения при определенных температурах и в определенные моменты времени можно использовать в различных способах анализа. Сводная информация о них приведена в таблице 15.
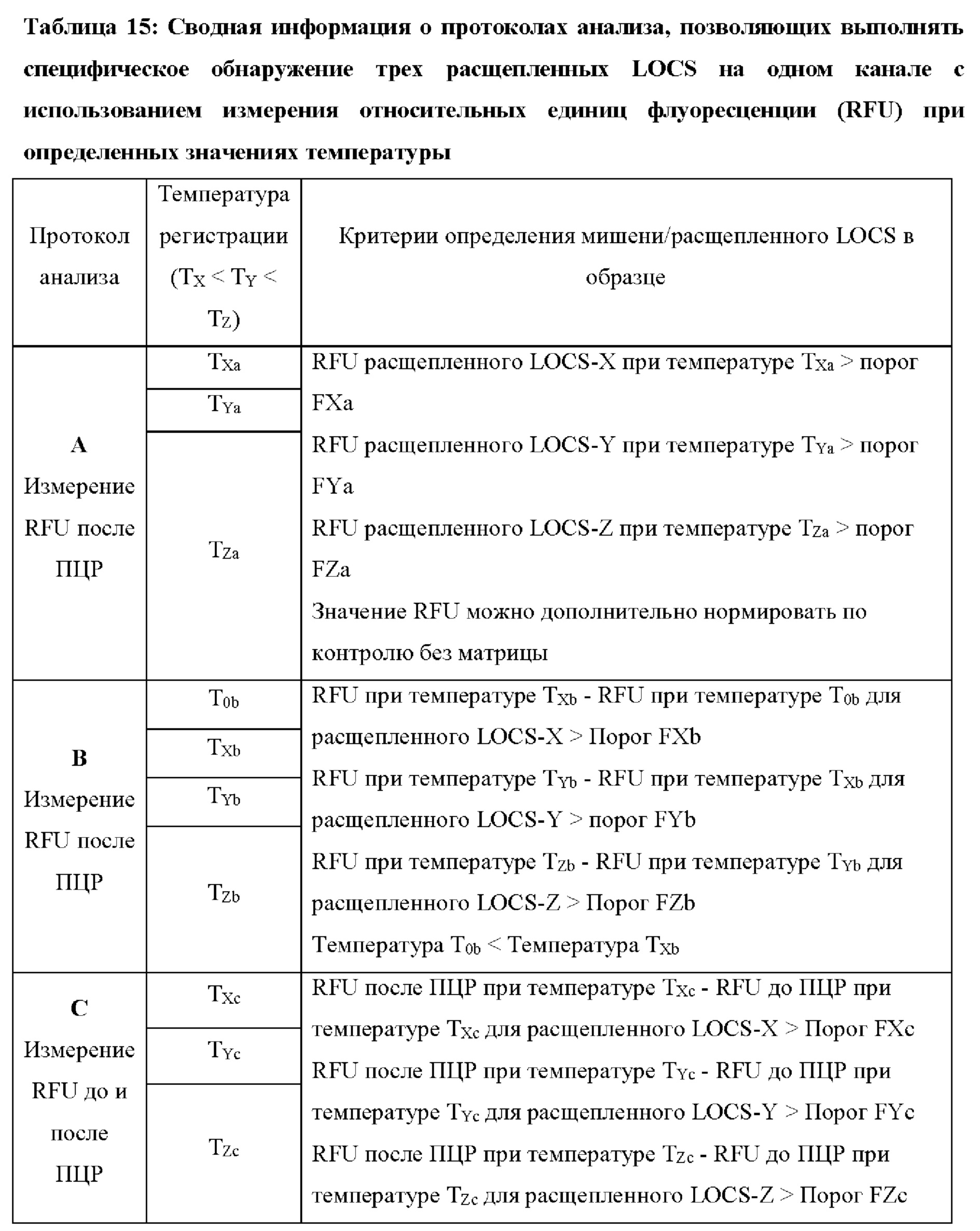

Стратегии, описанные в этом примере, можно адаптировать для обнаружения любых мишеней, однако в данном конкретном примере мишень X представляла собой ген TFRC, мишень Y - ген rpoB, а мишень Z - ген pss, обнаруживаемые зондами LOCS-X (LOCS-22), LOCS-Y (LOCS-21) и LOCS-Z (LOCS-23) соответственно, мечеными одним и тем же флуорофором (JOE). Используемые температуры обнаружения составляли: ТХа=40,5°С; TXb=56,5°С; TXc=78,5°С; T0b=32°С; TXb=40,5°С; TYb=56,5°С; TZb=65,5°С; ТХс=39,5°С; TYc=56,5°С; TZc=65,5°С; TXd=40°С; TYd=51°С; и TZd=65°С. Затем в следующем анализе было присвоено значение N=0,5°С.
Протокол анализа А1
При первой определенной температуре TXa расщепление LOCS-X генерировало значительный сигнал флуоресценции по сравнению с контролем без матрицы, превышавший пороговое значение FXa. При той же температуре присутствие расщепленных LOCS-Y и/или LOCS-Z не вносило значимого вклада в продукцию сигнала флуоресценции из-за более высокой Tm стеблей этих LOCS и, следовательно, уровень флуоресценции по сравнению с контролем без матрицы оставался ниже порога FXa. Измерение флуоресценции после амплификации при температуре TXa позволяло специфически обнаруживать расщепленный LOCS-X.
При второй определенной температуре TYa, превышавшей температуру TXa, расщепленный LOCS-Y генерировал относительный сигнал флуоресценции, значительно превышавший пороговое значение FYa. При температуре TYa относительный сигнал флуоресценции, генерируемый расщепленными LOCS-X и/или LOCS-Z, был значительно меньше порогового значения FYa. Таким образом, измерение флуоресценции после амплификации при температуре TYa позволяло специфически обнаруживать расщепленный LOCS-Y.
При третьей определенной температуре TZa, превышавшей температуры TXa и TYa, расщепленный LOCS-Z генерировал относительный сигнал флуоресценции, значительно превышавший пороговое значение FZa. При температуре TZa относительный сигнал флуоресценции, генерируемый расщепленными LOCS-X и/или LOCS-Y, был значительно меньше порогового значения FZa. Таким образом, измерение флуоресценции после амплификации при температуре Tza позволяло специфически обнаруживать расщепленный LOCS-Z. Обнаружение каждого расщепленного LOCS-репортера указывает на наличие соответствующей мишени в образце.
Протокол анализа А2
Вместо использования пороговых значений можно использовать алгоритм для определения расщепленных LOCS при расщеплении одного или более LOCS в образце. В этом алгоритме использовали отношение уровней флуоресценции по сравнению с контролем без матрицы, измеренное при каждой из трех температур обнаружения (температурах TXa, TYa и TZa). Отношение относительных уровней флуоресценции, измеренных при вышеупомянутых трех температурах, являлось уникальным для каждой из возможных комбинаций расщепленных LOCS и функционировало как отпечаток пальца, указывающий на наличие соответствующего гена-мишени в образце. Алгоритм состоял из семи логических тестов; один логический тест присваивали каждой возможной комбинации расщепленных и нерасщепленных LOCS для определения наличия одного или более из расщепленных LOCS. Возможные комбинации представляли собой (только X), (только Y), (только Z), (только X и Y), (только X и Z), (только Y и Z) или (X, Y и Z). Для определения образца как положительного по определенной комбинации мишеней для него было необходимо установить значение "ИСТИНА" в конкретном логическом тесте. Логический тест определял, действительно ли (1) отношение сигнала флуоресценции, измеренного при трех различных температурах, находилось в пределах заранее заданного диапазона значений, и (2) сигнал флуоресценции значительно превышал сигнал контроля без матрицы. Для образца можно было установить значение "ИСТИНА" максимум в одном наборе логических тестов, который указывал на конкретную комбинацию расщепленных LOCS-X, LOCS-Y и LOCS-Z и, следовательно, выявлял наличие соответствующей/их мишени/мишеней. Если для образца устанавливали значение "ЛОЖЬ" во всех логических тестах, то образец определяли как отрицательный, не содержавший расщепленных LOCS, что указывало на отсутствие всех трех мишеней в образце.
Протокол анализа В1
При первой определенной температуре T0b ни один из расщепленных LOCS-X, LOCS-Y или LOCS-Z не генерировал сигнала флуоресценции, значительно превышающего сигнал контроля без матрицы. При второй определенной температуре TXb, превышающей T0b, расщепленный LOCS-X генерировал значительный сигнал флуоресценции, тогда как расщепленные LOCS-Y и/или LOCS-Z не вносили значительного вклада в продукцию сигнала флуоресценции из-за более высокой Tm стеблей этих LOCS. Разность сигналов флуоресценции после амплификации при температурах T0b и TXb превышала пороговое значение FXb в присутствии расщепленного LOCS-X и была ниже него в отсутствие расщепленного LOCS-X, и, следовательно, это позволяло специфично обнаруживать расщепленный LOCS-X. При третьей определенной температуре TYb, превышавшей TXb, расщепленный LOCS-Y генерировал значительный сигнал флуоресценции. С другой стороны, расщепленный LOCS-Z не вносил значительного вклада в продукцию сигнала флуоресценции при температуре TYb из-за более высокой Tm его стебля. Расщепленный LOCS-X не вносил дополнительного значительного вклада в увеличение продукции флуоресценции при температуре TYb по сравнению с температурой TXb. Разность сигналов флуоресценции после амплификации при температурах TXb и TYb превышала пороговое значение FYb в присутствии расщепленного LOCS-Y и была ниже него в отсутствие расщепленного LOCS-Y, и, следовательно, это позволяло специфично обнаруживать расщепленный LOCS-Y. При четвертой определенной температуре TZb, превышавшей TYb, расщепленный LOCS-Z генерировал значительный сигнал флуоресценции. Расщепленные LOCS-X и/или LOCS-Y не вносили дополнительного значительного вклада в увеличение продукции флуоресценции при температуре TZb. Разность сигналов флуоресценции после амплификации при температурах TYb и TZb превышала пороговое значение FZb в присутствии расщепленного LOCS-Z и была ниже него в отсутствие расщепленного LOCS-Z, и, следовательно, это позволяло специфично обнаруживать расщепленный LOCS-Z.
Вышеупомянутые расчеты описываются следующими формулами:
Для определения наличия расщепленного LOCS-X,
если уровень флуоресценции после амплификации при температуре TXb - уровень флуоресценции после амплификации при температуре T0b > порога FXb, то в образце присутствует LOCS-X.
Для определения наличия расщепленного LOCS-Y,
если уровень флуоресценции после амплификации при температуре TYb - уровень флуоресценции после амплификации при температуре TXb > порога FYb, то в образце присутствует LOCS-Y.
Для определения наличия расщепленного LOCS-Z,
если уровень флуоресценции после амплификации при температуре TZb - уровень флуоресценции после амплификации при температуре TYb > порога FZb, то в образце присутствует LOCS-Z.
Обнаружение каждого расщепленного LOCS-репортера указывает на присутствие соответствующего гена-мишени в образце.
Протокол анализа В2
Вместо использования пороговых значений можно использовать алгоритм для определения расщепленных LOCS при расщеплении одного или более LOCS в образце с использованием отношения значений, рассчитанных на основе разностей уровней флуоресценции после амплификации, измеренных при T0b, TXb, TYb и TZb. Отношение значений (а) (уровень флуоресценции после амплификации при температуре TXb - уровень флуоресценции после амплификации при температуре T0b), (b) (уровень флуоресценции после амплификации при температуре TYb - уровень флуоресценции после амплификации при температуре TXb) и (с) (уровень флуоресценции после амплификации при температуре TZb - уровень флуоресценции после амплификации при температуре TYc) являлось уникальным для каждой из возможных комбинаций расщепленных LOCS и функционировало как отпечаток пальца, указывающий на наличие соответствующей мишени/мишеней в образце. Алгоритм состоял из восьми логических тестов; один логический тест присваивали каждой возможной комбинации расщепленных и нерасщепленных LOCS для определения наличия одного или более из расщепленных LOCS. Возможные комбинации представляли собой (отсутствие мишени), (только X), (только Y), (только Z), (только X и Y), (только X и Z), (только Y и Z) или (X, Y и Z). Для определения образца как положительного по определенной комбинации мишеней для него было необходимо установить значение "ИСТИНА" в логическом тесте. Логический тест определял, находится ли соотношение разностей трех вышеупомянутых значений в пределах заранее заданного диапазона значений. Для образца можно было установить значение "ИСТИНА" максимум в одном логическом тесте, который указывал на конкретную комбинацию расщепленных LOCS-X, LOCS-Y и LOCS-Z и являлся показателем наличия соответствующей мишени/мишеней или, при установлении значения "ИСТИНА" для логического теста (отсутствие мишени), указывал на отсутствие мишеней.
Протокол анализа C1
Обнаружение расщепленных LOCS после амплификации при определенной температуре также можно выполнить с использованием информации, полученной на основе разности между измерениями флуоресценции до и после амплификации при определенных температурах. Этот способ является альтернативой определению относительного уровня флуоресценции после амплификации по сравнению с контролем без матрицы или с эталонной температурой (T0b), как описано выше в протоколах А и В, соответственно. При первой определенной температуре TXc расщепленный LOCS-X генерировал значительный сигнал флуоресценции, и разность между измерениями флуоресценции до и после амплификации при температуре TXc превышала пороговое значение FXc. С другой стороны, наличие расщепленных LOCS-Y и/или LOCS-Z не приводило к продукции значительного сигнала флуоресценции при температуре TXc из-за более высокой Tm стебля, и разность при измерении флуоресценции при температуре ТХс до и после амплификации не достигала порога FXc. Таким образом, измерения флуоресценции до и после амплификации при температуре TXc позволяли специфично обнаруживать расщепленный LOCS-X. Возрастающий сигнал флуоресценции, генерируемый расщепленным LOCS-Y при второй температуре TYc, превышающей температуру TXc (где TYc>TXc), значительно превышал пороговое значение FYc. С другой стороны, возрастающий сигнал флуоресценции, генерируемый расщепленными LOCS-X и/или LOCS-Z при температуре TYc по сравнению с температурой TXc, был значительно меньше порогового значения FYc. Возрастающий сигнал флуоресценции при температуре TYc по сравнению с температурой TXc определяли путем вычисления разности между уровнем флуоресценции до и после амплификации при температуре TYc и разности между уровнем флуоресценции до и после амплификации при температуре TXc. Таким образом, информация, полученная при измерениях уровня флуоресценции до и после амплификации при температуре TXc и TYc, позволяла специфично обнаруживать расщепленный LOCS-Y. Возрастающий сигнал флуоресценции, генерируемый расщепленным LOCS-Z при третьей температуре TZc по сравнению с температурой TYc (где TZc>TYc), значительно превышает пороговое значение FZc. С другой стороны, возрастающий сигнал флуоресценции, генерируемый расщепленными LOCS-X и/или LOCS-Y при температуре TZc по сравнению с температурой TYc, был значительно меньше порогового значения FZc. Возрастающий сигнал флуоресценции при температуре TZc по сравнению с температурой TYc определяли путем вычисления разности между уровнем флуоресценции до и после амплификации при температуре TYc и разности между уровнем флуоресценции до и после амплификации при температуре TXc. Таким образом, информация, полученная при измерениях уровня флуоресценции до и после амплификации при температуре TYc и TZc, позволяла специфично обнаруживать расщепленный LOCS-Z.
Вышеупомянутые расчеты описаны ниже:
Для определения наличия LOCS-X,
если уровень флуоресценции после амплификации при температуре TXc - уровень флуоресценции до амплификации при температуре TXc > порогового значения FXc, то в образце присутствует LOCS-X.
Для определения наличия LOCS-Y,
если (уровень флуоресценции после амплификации при температуре TYc - уровень флуоресценции до амплификации при температуре TYc) - (уровень флуоресценции после амплификации при температуре TXc - уровень флуоресценции до амплификации при температуре TXc) > порогового значения FYc, то в образце присутствует LOCS-Y.
Для определения наличия LOCS-Z,
если (уровень флуоресценции после амплификации при температуре TZc - уровень флуоресценции до амплификации при температуре TZc) - (уровень флуоресценции после амплификации при температуре TYc - уровень флуоресценции до амплификации при температуре TYc) > порогового значения FZc, то в образце присутствует LOCS-Z. Обнаружение каждого расщепленного LOCS-репортера указывает на наличие соответствующей мишени в образце. Этот способ требует шести измерений флуоресценции.
Протокол анализа С2
Вместо использования пороговых значений можно использовать алгоритм для определения расщепленных LOCS при расщеплении одного или более LOCS в образце с использованием отношения значений, рассчитанных на основе разностей уровней флуоресценции до и после амплификации, измеренных при трех температурах обнаружения TXc, TYc и TZc. Отношение значений (i) уровень флуоресценции после амплификации при температуре TXC - уровень флуоресценции до амплификации при температуре TXc, (ii) (уровень флуоресценции после амплификации при температуре TYc - уровень флуоресценции до амплификации при температуре TYc) - (уровень флуоресценции после амплификации при температуре TXc - уровень флуоресценции до амплификации при температуре TXc) и (iii) (уровень флуоресценции после амплификации при температуре TZc - уровень флуоресценции до амплификации при температуре TZc) - (уровень флуоресценции после амплификации при температуре TYc - уровень флуоресценции до амплификации при температуре TYc) являлось уникальным для каждой из возможных комбинаций расщепленных и нерасщепленных LOCS и могло функционировать как отпечаток пальца, указывающий на наличие соответствующего гена-мишени в образце. Алгоритм состоял из восьми логических тестов; один логический тест присваивали каждой возможной комбинации расщепленных и нерасщепленных LOCS для определения наличия одного или более из расщепленных LOCS. Возможные комбинации представляли собой (отсутствие мишени), (только X), (только Y), (только Z), (только X и Y), (только X и Z), (только Y и Z) или (X, Y и Z). Для определения образца как положительного по определенной комбинации мишеней для него было необходимо установить значение "ИСТИНА" в логическом тесте. Логический тест определял, находится ли отношение разностей между значениями (i), (ii) и (iii) в пределах заранее заданного диапазона значений. Для образца можно было установить значение "ИСТИНА" максимум в одном логическом тесте, который указывал на конкретную комбинацию расщепленных LOCS-X, LOCS-Y и LOCS-Z и, таким образом, образец содержал соответствующую мишень/мишени или, при установлении значения "ИСТИНА" для логического теста (отсутствие мишени), не содержал мишеней.
Протокол анализа D1
Еще одним альтернативным способом является измерение высоты пика плавления в сигнатуре плавления, которая эквивалентна значению dФлуоресценция/dТемпература при Tm каждого расщепленного LOCS. Однако применимость этого способа не ограничивается определением значения dФлуоресценция/dТемпература при Tm расщепленного LOCS, но также включает диапазон температур, в который входит Tm. Значение dФлуоресценция/dТемпература при указанной температуре А°С было эквивалентно градиенту уровня флуоресценции между (А-N)°С и (А+N)°С. Математически это можно выразить следующей формулой:

Как видно из вышеприведенной формулы, для расчета значения dФлуоресценция/dТемпература при А°С требуются два измерения флуоресценции при температурах (А-N)°С и (А+N)°С. Для тройного анализа требуются три значения dФлуоресценция/dТемпература и, следовательно, шесть измерений флуоресценции после амплификации. В присутствии расщепленного LOCS-X значение dФлуоресценция/dТемпература при температуре TXd превышало пороговое значение FXd, однако в отсутствие расщепленного LOCS-X значение dФлуоресценция/dТемпература при температуре TXd не достигало порогового значения FXd. В присутствии расщепленного LOCS-Y значение dФлуоресценция/dТемпература при температуре TYd превышало пороговое значение FYd, однако в отсутствие расщепленного LOCS-Y значение dФлyopecцeнция/dTeмпepaтypa при температуре TYd не достигало порогового значения FYd. В присутствии расщепленного LOCS-Z значение dФлуоресценция/dТемпература при температуре TZd превышало пороговое значение FZd, однако в отсутствие расщепленного LOCS-Z значение dФлуоресценция/dТемпература при температуре TZd не достигало порогового значения FZd. Обнаружение каждого расщепленного LOCS-репортера указывает на присутствие соответствующего гена-мишени в образце.
Протокол анализа D2
Вместо использования пороговых значений можно использовать алгоритм для определения расщепленных LOCS при расщеплении одного или более LOCS в образце с использованием отношения значений dФлуоресценция/dТемпература при трех температурах обнаружения TXd, TYd и TZd. Отношение значений dФлуоресценция/dТемпература при вышеупомянутых трех температурах являлось уникальным для каждой из возможных комбинаций расщепленных LOCS и функционировало как отпечаток пальца, указывающий на наличие соответствующей мишени/мишеней в образце. Алгоритм состоял из восьми логических тестов; один логический тест присваивали каждой возможной комбинации расщепленных и нерасщепленных LOCS для определения наличия одного или более из расщепленных LOCS. Возможные комбинации представляли собой (отсутствие мишени), (только X), (только Y), (только Z), (только X и Y), (только X и Z), (только Y и Z) или (X, Y и Z). Для определения образца как положительного по определенной комбинации мишеней для него было необходимо установить значение "ИСТИНА" в логическом тесте. Логический тест определял, находится ли соотношение значений dФлyopecцeнция/dTeмпepaтypa при вышеупомянутых трех температурах в пределах заранее заданного диапазона значений. Для образца можно было установить значение "ИСТИНА" максимум в одном логическом тесте, который указывал на конкретную комбинацию расщепленных LOCS-X, LOCS-Y и LOCS-Z и, таким образом, на соответствующую мишень/мишени или, при установлении значения "ИСТИНА" для логического теста (отсутствие мишени), на отсутствие мишеней.
Олигонуклеотиды
Олигонуклеотиды, специфичные по отношению к этому эксперименту, включали: LOCS-22 (SEQ ID 89), LOCS-21 (SEQ ID 88), LOCS-23 (SEQ ID 90), партзим A22 (SEQ ID 124), партзим B22 (SEQ ID 125), партзим A23 (SEQ ID 126), партзим B23 (SEQ ID 127), партзим A24 (SEQ ID 130), партзим B24 (SEQ ID 131), прямой праймер 10 (SEQ ID 72), обратный праймер 10 (SEQ ID 73), прямой праймер 6 (SEQ ID 25), обратный праймер 6 (SEQ ID 26), прямой праймер 17 (SEQ ID 128) и обратный праймер 17 (SEQ ID 129). Последовательности перечислены в перечне последовательностей. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению гена TFRC, представляли собой LOCS-22, партзим А22, партзим В22, прямой праймер 10 и обратный праймер 10. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению гена rpoB, представляли собой LOCS-21, партзим А23, партзим В23, прямой праймер 6 и обратный праймер 6. Олигонуклеотиды, специфичные по отношению к амплификации и обнаружению гена pss, представляли собой LOCS-23, партзим А24, партзим В24, прямой праймер 17 и обратный праймер 17.
Условия реакции
Обнаружение последовательности-мишени в реальном времени выполняли в общем реакционном объеме 20 мкл с использованием термоциклера BioRad® CFX96. Параметры цикла представляли собой: 39,5°С в течение 30 секунд с регистрацией данных, 56,5°С в течение 30 секунд с регистрацией данных, 65,5°С в течение 30 секунд с регистрацией данных, 95°С в течение 2 минут, 10 циклов снижения, включавших 95°С в течение 5 секунд и 61°С в течение 30 секунд (уменьшение на 0,5°С за цикл) и 40 циклов, включавших 95°С в течение 5 секунд и 52°С в течение 40 секунд (данные получали на этапе 52°С), а затем 39,5°С в течение 30 секунд с регистрацией данных, 40,5°С в течение 30 секунд с регистрацией данных, 50,5°С в течение 30 секунд с регистрацией данных, 51,5°С в течение 30 секунд с регистрацией данных, 56,5°С в течение 30 секунд с регистрацией данных, 64,5°С в течение 30 секунд с регистрацией данных, 65,5°С в течение 30 секунд с регистрацией данных и 78,5°С в течение 30 секунд с регистрацией данных. Каждая реакционная смесь содержала 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима, 80 нМ репортера LOCS-22, 210 нМ репортера LOCS-21, 300 нМ репортера LOCS-23, 2 мМ MgCl2 (Bioline) и 1х смесь SensiFAST Probe No-ROX (Bioline). Реакционные смеси содержали геномную ДНК или синтетическую матрицу генов-мишеней G-Block (10000 копий на ген-мишень в NF H2O), или не содержали мишени (NF H2O).
Результаты
Во время ПЦР использовали три МНКзима (МНКзим 22, МНКзим 23 и МНКзим 24) для мониторинга амплификации нуклеиновых кислот-мишеней в режиме реального времени посредством расщепления соответствующих LOCS-репортеров (LOCS-22, LOCS-21, м LOCS-23, соответственно). МНКзим 22 был предназначен для обнаружения последовательностей гена TFRC {Homo sapiens) и расщепления LOCS-22. МНКзим 23 был предназначен для обнаружения последовательностей гена rpoB (Klebsiella pneumoniae) и расщепления LOCS-21. МНКзим 24 был предназначен для обнаружения последовательностей гена pss (Streptococcus pneumoniae) и расщепления LOCS-23. Наличие гена-мишени TFRC, rpoB или pss определяли по сигналу флуоресценции на канале JOE, измеренному при нескольких температурах, на стадии циклов ПЦР до или после амплификации.
Результаты, показанные на фигуре 24, демонстрируют сравнительный анализ уровней флуоресценции после амплификации на канале JOE при использовании реакционных смесей, содержащих 10000 копий TFRC, rpoB, pss или всех комбинаций двух или более генов-мишеней, измеренных при 40,5°С, 56,5°С и 78,5°С. Результаты представляют собой средние значения уровня флуоресценции для реакций, выполненных в трех повторностях, за вычетом среднего из реакций для контроля без матрицы, выполненных в трех повторностях. При 40,5°С образцы, содержащие TFRC, характеризовались более высоким уровнем флуоресценции (по сравнению с контролем без матрицы), чем пороговое значение FXa, однако это не относилось к образцам, не содержавшим TFRC. При 56,5°С образцы, содержащие rpoB, характеризовались более высоким уровнем флуоресценции (по сравнению с контролем без матрицы), чем пороговое значение FYa, однако это не относилось к образцам, не содержавшим rpoB. При 78,5°С образцы, содержащие pss, характеризовались более высоким уровнем флуоресценции (по сравнению с контролем без матрицы), чем пороговое значение FZa, однако это не относилось к образцам, не содержавшим pss.
В таблице 16 показаны результаты, полученные после обработки уровня флуоресценции после амплификации (измеренного при 40,5°С, 56,5°С и 78,5°С для каждого из образцов, содержавших 10000 копий TFRC, rpoB, pss или все комбинации двух или более генов-мишеней), с использованием семи логических тестов. Каждый из семи логических тестов включал три критерия (вторая строка таблицы 16), которые определяли, содержал ли образец (только TFRC), (только rpoB), (только pss), (только TFRC и rpoB), (только TFRC и pss), (только rpoB и pss) или (TFRC, rpoB и pss). Первые два критерия определяли, являлось ли отношение двух уровней флуоресценции, измеренных при различных температурах (40,5°С, 56,5°С или 78,5°С), за вычетом среднего уровня флуоресценции для контроля без матрицы при тех же температурах, большим или меньшим по сравнению с заранее заданным значением, или попадало ли оно в заранее заданный диапазон. Последний критерий определял, являлся ли наблюдаемый сигнал флуоресценции значительно более высоким по сравнению с сигналом контроля без матрицы. Считалось, что каждый образец характеризовался значением "ИСТИНА" для логического теста, только если он характеризовался значением "ИСТИНА" для всех трех критериев логического теста. Эксперимент выполняли с использованием восьми типов образцов в двух повторностях, представлявших собой все комбинации 0 или 10000 копий трех матриц-мишеней (контроль без матрицы содержал 0 копий всех трех матриц). Для всех протестированных образцов устанавливали значение "ИСТИНА" для максимум одного логического теста, и значение "ЛОЖЬ" для всех других логических тестов, что позволяло точно определить наличие гена-мишени. Контрольные образцы, не содержавшие матрицы, характеризовались значением "ЛОЖЬ" для всех логических тестов.


На фигуре 25 показано сравнение дифференциальных уровней флуоресценции после амплификации на канале JOE при использовании реакционных смесей, содержащих 10000 копий TFRC, rpoB, pss или всех комбинаций двух или более генов-мишеней, измеренных при 32°С, 40,5°С, 56,5°С.и 65,5°С в трех повторностях. Разность между уровнями флуоресценции, измеренными при 32°С и 40,5°С, обозначенная как (а), превышала пороговое значение FXb только в образцах, содержащих TFRC. Разность между уровнями флуоресценции, измеренными при 40.5°С и 56,5°С, обозначенная как (b), превышала пороговое значение FYb только в образцах, содержащих rpoB. Разность между уровнями флуоресценции, измеренными при 56.5°С и 65,5°С, обозначенная как (с), превышала пороговое значение FZb только в образцах, содержащих pss.
В таблице 17 показаны результаты, полученные после обработки дифференциальных значений уровня флуоресценции после амплификации, измеренного при 40,5°С, 56,5°С и 65,5°С для каждого из образцов, содержавших 10000 копий TFRC, rpoB, pss или все комбинации двух или более генов-мишеней, с использованием восьми логических тестов. Эти дифференциальные значения рассчитывали как разность уровней флуоресценции, измеренных при 32°С и 39,5°С; 40,5°С и 56,5°С; и 56,5°С и 65,5°С. Каждый из восьми логических тестов включал два критерия (вторая строка таблицы 17), которые определяли, содержал ли образец (отсутствие мишени), (только TFRC), (только rpoB), (только pss), (только TFRC и rpoB), (только TFRC и pss), (только rpoB и pss) или (TFRC, rpoB и pss). Эти два критерия определяли, являлось ли отношение двух дифференциальных значений флуоресценции большим или меньшим по сравнению с заранее заданным значением, или попадало ли оно в заранее заданный диапазон. Для всех протестированных образцов устанавливали значение "ИСТИНА" только для одного логического теста, и значение "ЛОЖЬ" для всех других логических тестов, что позволяло точно определить наличие гена-мишени.
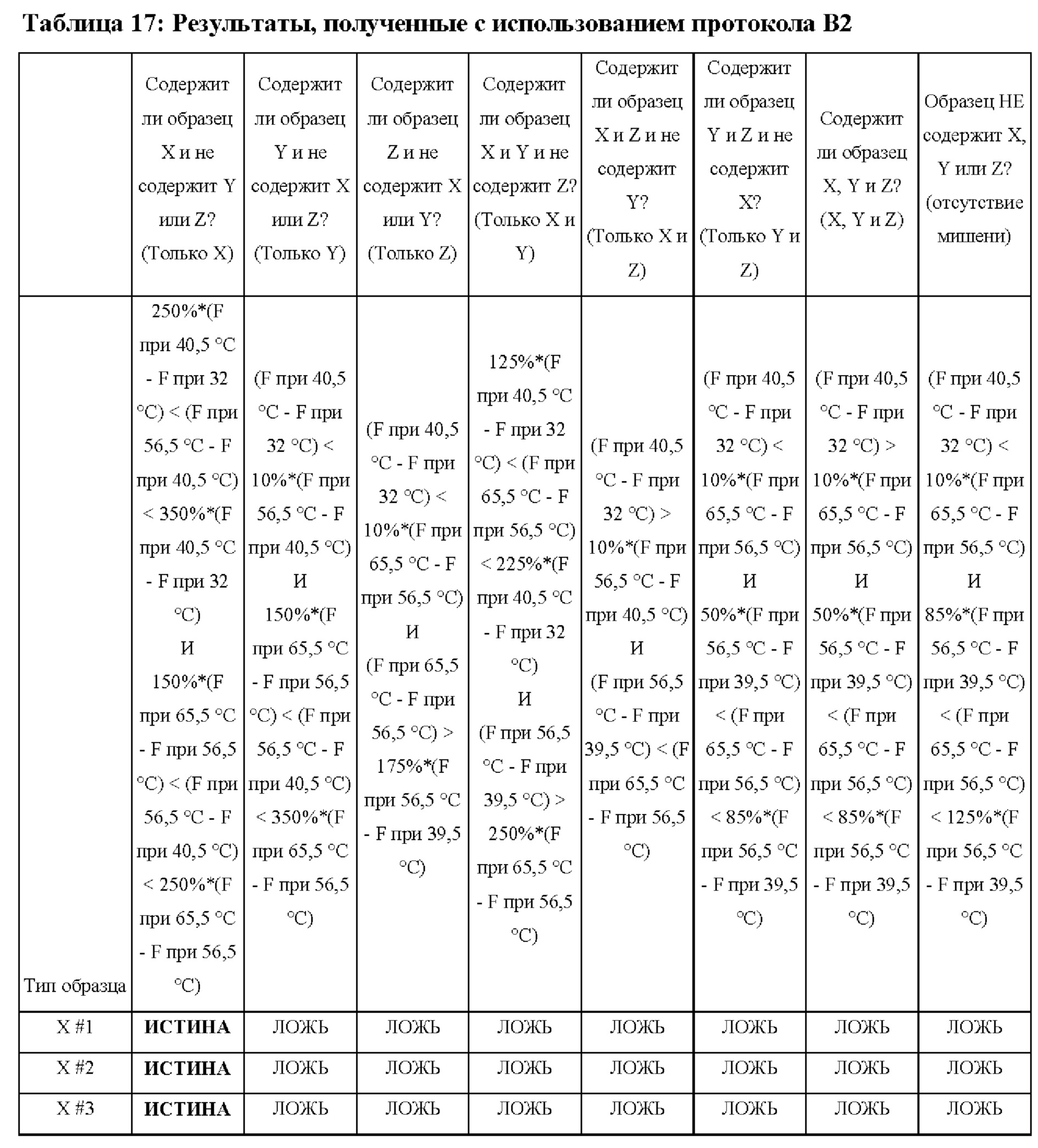
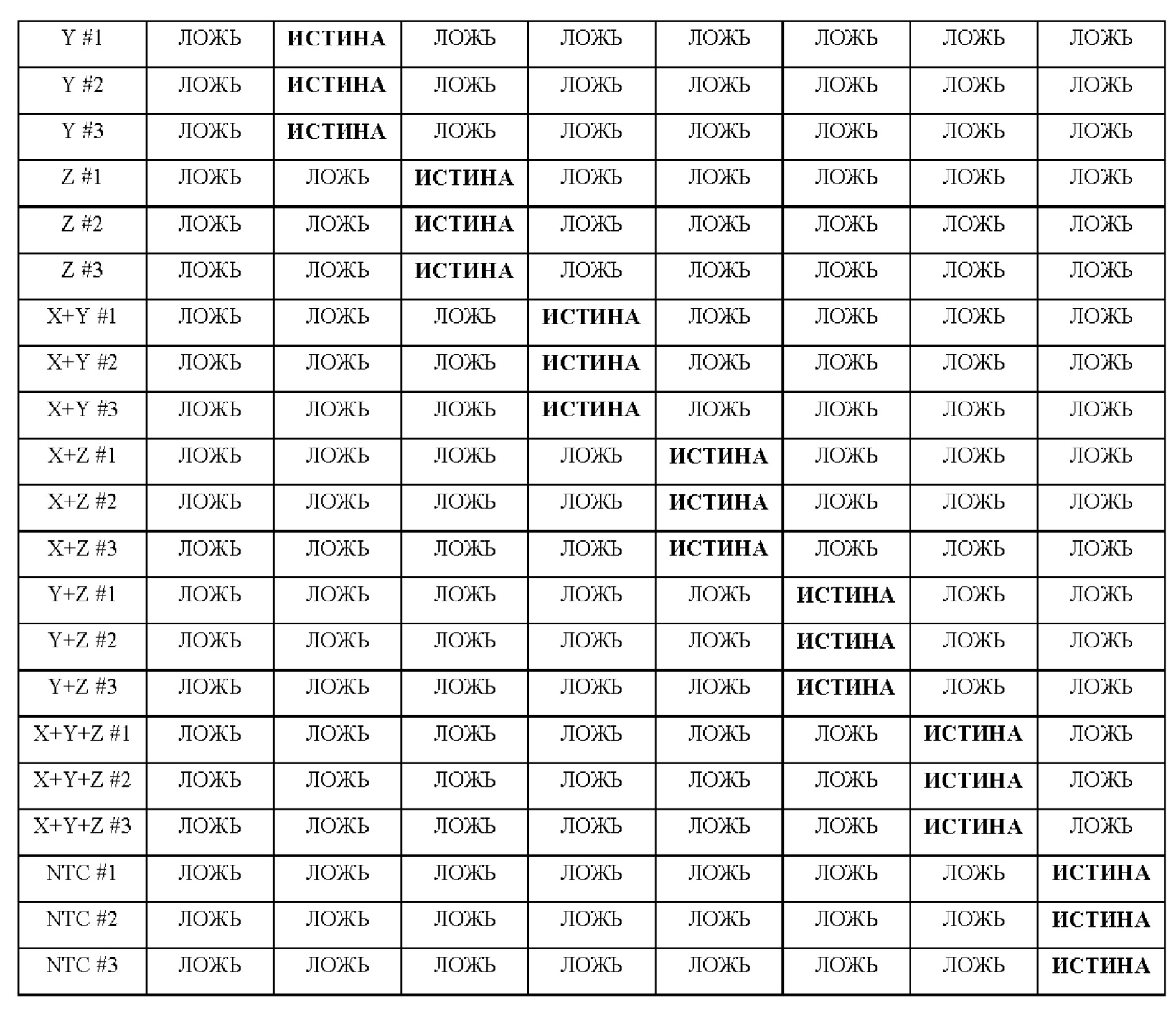
Результаты, показанные на фигуре 26, демонстрируют сравнение значений уровней флуоресценции до и после амплификации на канале JOE при использовании реакционных смесей, содержащих 10000 копий TFRC, rpoB, pss или всех комбинаций двух или более генов-мишеней, измеренных при 39,5°С, 56,5°С и 65,5°С. Результаты представляют собой средние показатели, полученные в трех повторных реакциях для значений (i) уровня флуоресценции после амплификации при 39,5°С - уровня флуоресценции до амплификации при 39,5°С, (ii) (уровень флуоресценции после амплификации при 56,5°С - уровень флуоресценции до амплификации при 56,5°С) - (уровень флуоресценции после амплификации при 39,5°С - уровень флуоресценции до амплификации при температуре 39,5°С) и (iii) (уровень флуоресценции после амплификации при температуре 65,5°С - уровень флуоресценции до амплификации при температуре 65,5°С) - (уровень флуоресценции после амплификации при температуре 56,5°С - уровень флуоресценции до амплификации при температуре 56,5°С). Для образцов, содержащих TFRC, нормированные значения флуоресценции (i) превышали пороговое значение FXc, однако это не относилось к образцам, не содержащим TFRC. Для образцов, содержащих rpoB, нормированные значения флуоресценции (ii) превышали пороговое значение FYc, однако это не относилось к образцам, не содержащим rpoB. Для образцов, содержащих pss, нормированные значения флуоресценции (iii) превышали пороговое значение FZc, однако это не относилось к образцам, не содержащим pss.
В таблице 18 показаны результаты, полученные после выполнения восьми логических тестов для вышеупомянутых значений (i), (ii) и (iii). Каждый из восьми логических тестов включал два критерия (вторая строка таблицы 18), которые определяли, содержал ли образец (отсутствие мишени), (только TFRC), (только rpoB), (только pss), (только TFRC и rpoB), (только TFRC и pss), (только rpoB и pss) или (TFRC, rpoB и pss). Каждый из этих двух критериев определял, являлось ли отношение двух из значений (i), (ii) и (iii) большим или меньшим по сравнению с заранее заданным значением, или попадало ли оно в заранее заданный диапазон. Для всех протестированных образцов устанавливали значение "ИСТИНА" только для одного логического теста, и значение "ЛОЖЬ" для всех других логических тестов, что позволяло точно определить наличие гена-мишени.

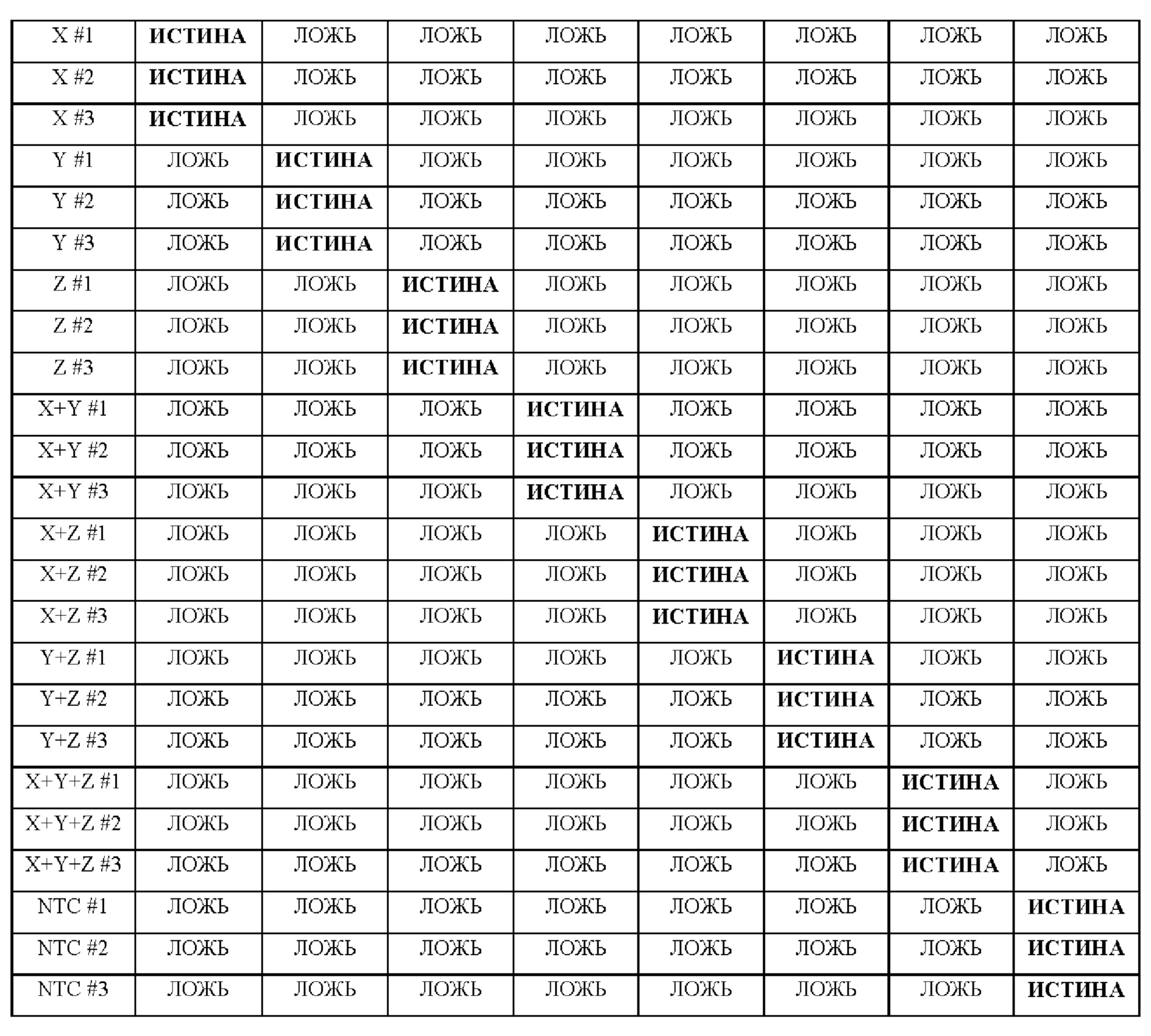
На фигуре 27 показано сравнение средних значений dФлуоресценция/dТемпература после амплификации, полученных на канале JOE при использовании реакционных смесей, содержащих 10000 копий TFRC, rpoB, pss или всех комбинаций двух или более генов-мишеней, при 37°С, 50°С и 65°С. Эти значения рассчитывали на основе измерений флуоресценции после амплификации, выполненных при 36,5°С, 37,5°С, 49,5°С, 50,5°С, 64,5°С и 65,5°С. Значение dФлуоресценция/dТемпература при 37°С превышало пороговое значение FXd только для образцов, содержавших TFRC. Значение dФлyopecцeнция/dTeмпepaтypa при 50°С превышало пороговое значение FYd только для образцов, содержавших rpoB. Значение dФлyopecцeнция/dTeмпepaтypa при 65°С превышало пороговое значение FZd только для образцов, содержавших pss.
В таблице 19 показаны результаты, полученные после обработки значений dФлyopecцeнция/dTeмпepaтypa, измеренных при 37°С, 50°С и 65,5°С для каждого из образцов, содержавших 10000 копий TFRC, rpoB, pss или все комбинации двух или более генов-мишеней, с использованием восьми логических тестов. Эти значения рассчитывали на основе измерений флуоресценции после амплификации, выполненных при 36,5°С, 37,5°С, 49,5°С, 50,5°С, 64,5°С и 65,5°С. Каждый из восьми логических тестов включал два критерия (вторая строка таблицы 19), которые определяли, содержал ли образец (отсутствие мишени), (только TFRC), (только rpoB), (только pss), (только TFRC и rpoB), (только TFRC и pss), (только rpoB и pss) или (TFRC, rpoB и pss). Эти два критерия определяли, являлось ли отношение двух значений с1Флуоресценция/с1Температура большим или меньшим по сравнению с заранее заданным значением, или попадало ли оно в заранее заданный диапазон. Для всех протестированных образцов устанавливали значение "ИСТИНА" только для одного логического теста, и значение "ЛОЖЬ" для всех других логических тестов, что позволяло точно определить наличие гена-мишени.

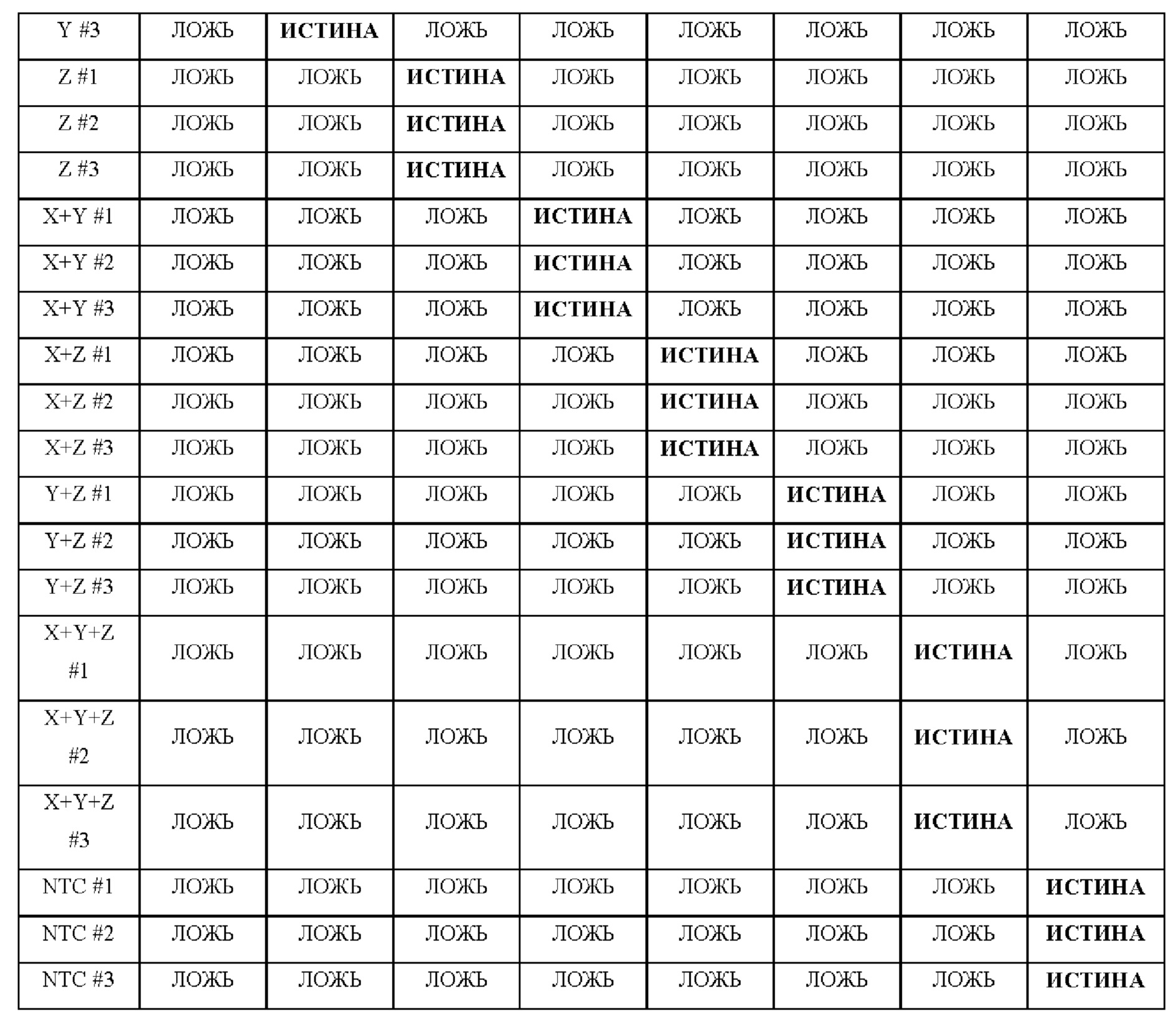


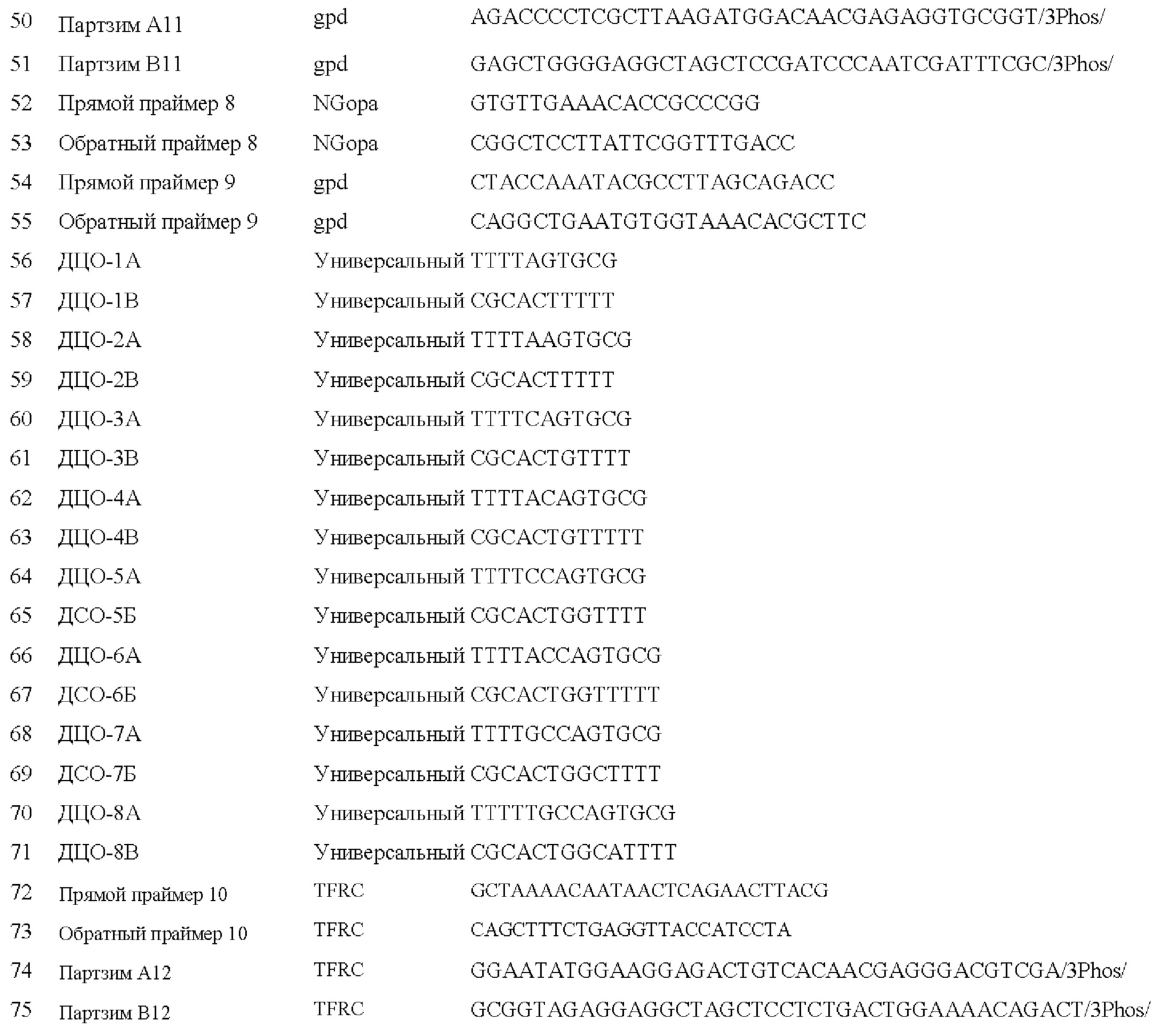



Реферат
Группа изобретений относится к области молекулярной биологии. Конкретнее, к олигонуклеотидам и способу их применения для обнаружения и/или дифференциации нуклеиновых кислот-мишеней. Способ определения наличия или отсутствия первой и второй мишеней в образце включает получение реакционной смеси путем приведения образца или его производного, предположительно содержащего первую и/или вторую мишени или их ампликоны, в контакт с первым и вторым замкнутыми олигонуклеотидами типа "стебель-петля"; обработку реакционной смеси, обнаружение уровней первого и второго флуоресцентных сигналов при одной или более температурах, что позволяет определять наличие или отсутствие указанных мишеней в образце. Композиция для определения наличия или отсутствия первой и второй мишеней в образце содержит первый и второй замкнутые олигонуклеотиды типа "стебель-петля". Группа изобретений обеспечивает расширение возможностей инструментов по различию нескольких мишеней с использованием одного типа детектора, например, одного канала флуоресценции. 2 н. и 79 з.п. ф-лы, 28 ил., 19 табл., 14 пр.
Формула
Документы, цитированные в отчёте о поиске
Бесконтактные способы обнаружения молекулярных колоний, наборы реагентов и устройство для их осуществления

Комментарии