Фармацевтическая композиция, покрытая энтеросолюбильной оболочкой, и способ ее получения - RU2197227C2
Код документа: RU2197227C2
Чертежи


Описание
Данное изобретение относится к фармацевтической композиции, покрытой энтеросолюбильной оболочкой, содержащей неустойчивый в кислоте препарат с высокой лекарственной нагрузкой, чувствительный при значениях рН окружающей среды ниже 3, такой как ddI, причем эта композиция также находится в виде гранул или таблеток с энтеросолюбильной оболочкой, такой как Eudragit L-30-D 55, и пластификатором, но не требует подслоя; гранулы также имеют антиадгезивное покрытие. Так называемые гранулы имеют высокое сопротивление разрыву при рН менее 3, но прекрасно высвобождают препарат при рН выше 4,5. Раскрыт также новый способ приготовления указанной фармацевтической композиции.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Энтеросолюбильные оболочки применяются многие годы
для предотвращения выделения лекарственного вещества из перорально вводимых лекарственных форм. В зависимости от состава и/или плотности энтеросолюбильные покрытия устойчивы к кислоте в желудке в
течение требуемого периода времени перед тем, как они начнут распадаться и обеспечивать пролонгированное выделение лекарственного вещества в нижней части желудка или верхней части тонкой кишки.
Примеры таких энтеросолюбильных покрытий описаны в патенте США 5225202. Как описывается в этом патенте, некоторыми примерами таких оболочек, которые применялись ранее, являются пчелиный воск и
глицерилмоностеарат; пчелиный воск, шеллак и целлюлоза; это могут быть также цетиловый спирт, смола мастикового дерева и шеллак, или шеллак и стеариновая кислота (патент США 2809918); поливинилацетат
и этилцеллюлоза (патент США 3835221); и нейтральный сополимер эфиров полиметакриловой кислоты (Eudragit L30D) (F.W. Goodhart et al., Pharm. Tech., pp. 64-71, April 1984); сополимеры метакриловой
кислоты и метилметакрилата (Eudragits), или нейтральный сополимер полиметакрилатов, содержащий стеараты металлов (Mehta et al., патенты США 4728512 и 4794001).
Большинство энтеросолюбильных полимеров начинают растворяться при рН 5,5 и выше, достигая максимальной скорости растворения при рН выше 6,5.
Многочисленные энтеросолюбильные фармацевтические композиции и/или фармацевтические композиции пролонгированного действия и способы приготовления таких композиций были уже описаны. Хотя некоторые из таких ранее описанных композиций получают в виде малых гранул или пилюль, они часто содержат многие другие ингредиенты помимо лекарственных веществ, такие как наполнители, буферирующие агенты, связующие и смачиватели, которые добавляют для увеличения объема композиции и уменьшения количества активного лекарственного вещества, которое должно содержаться в композиции. Способы получения таких вышеуказанных фармацевтических композиций требует многих длительных стадий, включая стадии получения подслоя (подложки) и внешнего слоя. Кроме того, многие из этих фармацевтических композиций предназначены для доставки в нижнюю часть ЖКТ, т.е. в толстую кишку, в противоположность верхней части ЖКТ, т.е. двенадцатиперстной кишки тонкого кишечника.
В патенте США 5225202 описаны энтеросолюбильные композиции, использующие полимерные покрытия из нейтрализованного фталата гидроксипропилметилцеллюлозы (НРМСР). Описываемые фармацевтические композиции содержат сердцевину из лабильного в кислоте лекарственного препарата, измельчителя, одного или более буферирующих веществ для обеспечения дополнительной защиты в желудке, помимо энтеросолюбильной оболочки, а также энтеросолюбильную оболочку и пластификатор. Фармацевтическая композиция также может включать один или более наполнителей - лактозу, сахар или крахмал. Согласно изобретению, описываемому в этой ссылке, когда ядро (сердцевина) содержит лекарственное вещество, несовместимое со слоем энтеросолюбильного покрытия, для предотвращения взаимодействия лабильного лекарственного вещества и кислой энтсросолюбильной оболочки применяют дополнительную подложку (подслой), которая ведет себя как физический барьер между ядром и внешним слоем энтеросолюбильной оболочки. Энтеросолюбильное покрытие из HPMCP начинает растворяться при рН 5, 0. Процесс приготовления этой фармацевтической композиции требует для покрытия многих стадий для получения подслоя, а затем энтеросолюбильной оболочки.
В патенте США 5026560 описана фармацевтическая композиция и способ получения указанной фармацевтическая композиции, причем фармацевтическая композиция содержит сердцевину из семян "чудесницы" (Nonpareil), получаемую покрытием сахарозы пшеничным крахмалом, напылением сердцевины с водным связующим в растворе воды или этанола и с напылением порошка, содержащего лекарственное вещество и низкозамещенную гидроксипропилцеллюлозу с последующим применением энтеросолюбильной оболочки.
Патент США 4524060 описывает фармацевтическую композицию пролонгированного действия для лечения гипертонии и содержит смесь микрочастиц индорамина или его фармацевтически приемлемой соли, агент для каналирования воды, смачивателя (увлажнителя), измельчителя, причем смесь находится в виде некомпримированной пилюли и имеет энтеросолюбильную оболочку для пролонгированного выделения, проницаемую для желудочного сока.
Патент США 5536507 относится к фармацевтической композиции с покрытием для пролонгированного выделения или энтеросолюбильной оболочкой, при этом предполагается, что преобладающее количество активного вещества композиции высвобождается в месте вблизи входа в толстую кишку или внутри нее при рН примерно 6,4-7,0.
Фармацевтические композиции, которые содержат лекарственный препарат, неустойчивый в кислой среде, например в желудке, и не забуференный соответствующим образом, требуют энтеросолюбильной защитной оболочки для предотвращения выделения такого лекарственного вещества прежде, чем оно достигнет кишечника.
ddI (также
известный как диданозин, или 2',3'-дидезоксиинозин, и выпускаемый Bristol-Myers Squibb Co. под торговой маркой VidexT) является неустойчивым в кислоте лекарственным веществом, имеющим формулу
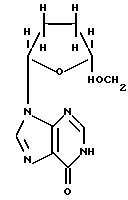
и, как было показано, является эффективным при лечении больных вирусом ВИЧ, который вызывает СПИД. Описан состав и способ ингибирования ВИЧ-репликации 2', 3'-дидезоксиинозином (см. патенты США 4861759, 5254539 и 5616566). Позднее VidexT стал применяться более широко в качестве компонента новых лечебных коктейлей, применяемых в терапии СПИД'а. Он также является неустойчивым в кислоте лекарственным веществом, чувствительным к среде с низким рН и распадающимся в желудке.
VidexT обычно выпускается в различных дозировках для перорального применения, включая жевательные/сосательные забуференные таблетки, содержащие 25, 50, 100 или 150 мг диданозина. Каждая таблетка забуферена карбонатом кальция и гидроксидом магния. Таблетки VidexT также содержат аспартам, сорбит, микрокристаллическую целлюлозу, PolyplasdoneT (полиплаздон), ароматизатор с мандариново-апельсиновым запахом и стеарат магния. Забуференный порошок VidexT для перорального раствора выпускают для перорального применения в одноразовых (на одну дозу) пакетиках, содержащих 100, 167 или 250 мг диданозина. Пакетики с любой из этих дозировок содержат также цитрат-фосфатный буфер (состоящий из двухосновного фосфата натрия, цитрата натрия и лимонной кислоты) и сахарозы. Также выпускается детский порошок VidexT для перорального раствора для введения через рот в стеклянных бутылочках на 4 или 8 унций (примерно, 120-240 мл), содержащих 2 или 4 грамма диданозина соответственно, и перед приемом через рот его нужно смешивать с пероральным антацидом.
Хотя делается акцент на таблетки, вводимые отдельно или как часть смеси ("коктейль") при терапии, данные жевательные/сосательные забуференные таблетки не очень хороши с точки зрения удобства для больного. В то время как другие продукты, являющиеся частью терапевтического коктейля при СПИД'е, представляют собой капсулы или таблетки и легко глотаются, жевательные/сосательные забуференные таблетки VidexT (называемые в данном описании "ddI") нужно тщательно прожевать, вручную раскрошить или сделать однородную суспензию перед употреблением. Так как ddI быстро разлагаются в среде с кислым рН, ddI в своей жевательной/сосательной форме и в виде забуференного порошка для перорального раствора, содержит буферирующие агенты и вводится с анатацидами в виде детского порошка. Однако наличие больших количеств анатацидных компонентов в рецептуре может привести к значительному дисбалансу в ЖКТ, выражающемуся в сильной диарее. Многие больные также недовольны тем, что приходится жевать большие таблетки ddI (доза=2 таблетки по 2,1 г каждая), вкусом ddI или временем, которое требуется, чтобы рассосать таблетки, и объемом жидкости (4 унции) на дозу. Все эти факторы вкупе с тем, что другие лекарственные нуклеозидные аналоги выпускаются в более удобной лекарственной форме (т.е. капсула или таблетки меньшего размера), вызывают необходимость в создании новой лекарственной формы ddI, которую легко жевать и которая не вызывает неприятных побочных эффектов (вызывающих дискомфорт).
В настоящее время доза для взрослых, 200 мг дважды в день или, возможно, 400 мг ежедневно, требует гранул или частиц с очень высокой нагрузкой по лекарственному веществу так, чтобы дозу 400 мг можно было поместить в одну капсулу. При низкой лекарственной нагрузке рецептура требует нескольких капсул/доза, что менее удобно с точки зрения больного.
Поэтому здесь предлагается покрытие (оболочка), которая предотвращает выделение лекарственного вещества в желудке и обеспечивает выделение лекарственного вещества в тонком кишечнике, что позволяет избежать необходимости в антациде, который может вызвать дисбаланс в ЖКТ при постоянном употреблении. Т.е., фармацевтические композиции, которые содержат лекарственное вещество, неустойчивое в кислой среде, например в желудке, требуют такой защитной оболочки для предотвращения выделения такого препарата до попадания в кишечник.
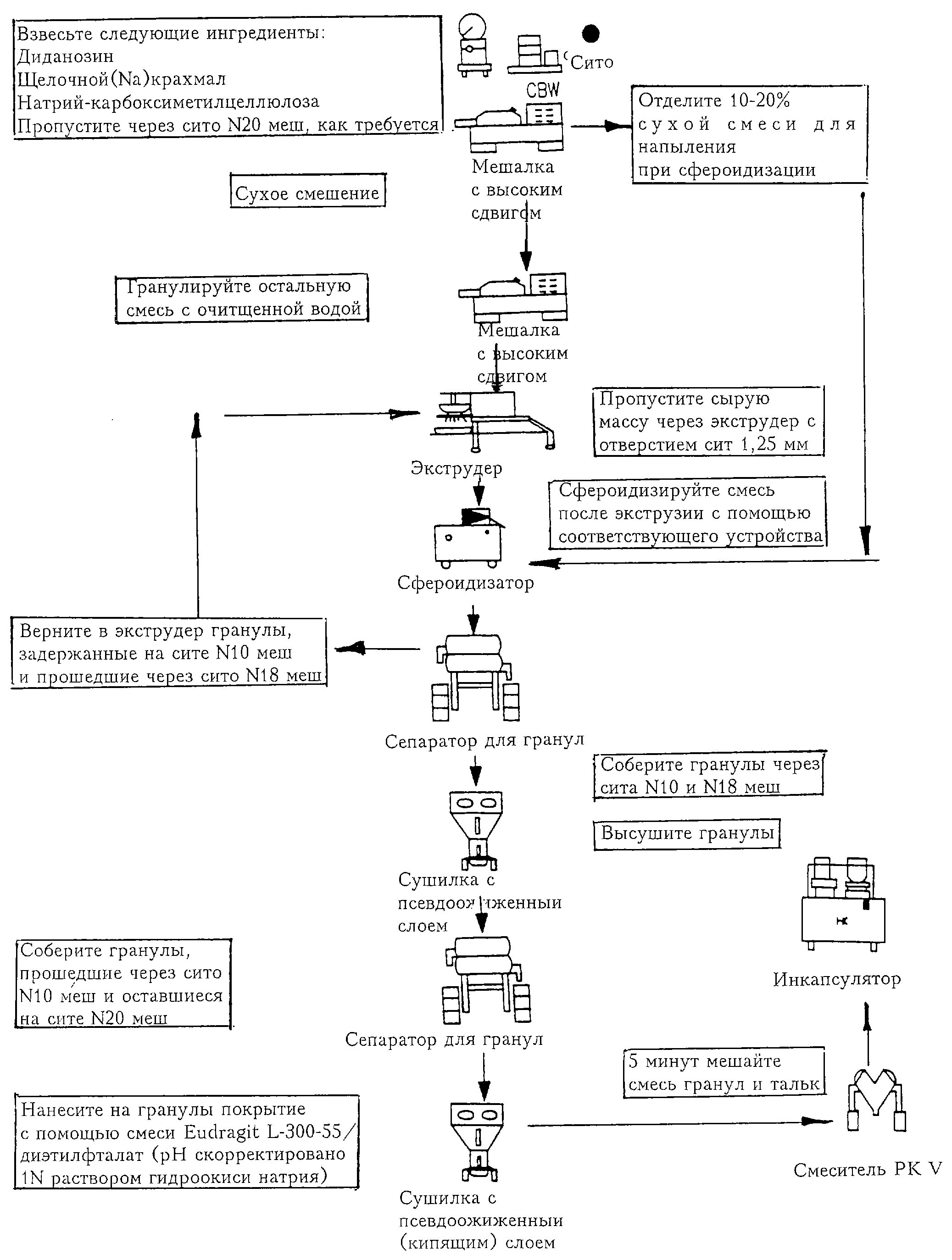
ОПИСАНИЕ ЧЕРТЕЖА
Чертеж представляет собой общую схему, иллюстрирующую процесс получения
энтеросолюбильной фармацевтической композиции по данному изобретению.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с данным изобретением предлагается покрытая энтеросолюбильной
оболочкой фармацевтическая композиция с высокой нагрузкой по лекарственному веществу и способ получения указанной фармацевтической композиции, которая включает лекарственное вещество, которое может
распадаться при низком рН среды, но защищено от такого разложения энтеросолюбильной оболочкой. Фармацевтическая композиция по изобретению, преимущественно в виде гранул, пилюль или таблеток, включает
ядро (сердцевину), содержащее лекарственное вещество, чувствительное к среде с низким рН, например, такое как ddI, и, при необходимости, связующее, дезинтегрант или вещество, вызывающее набухание, и
наполнитель. Ядро, кроме того, содержит энтеросолюбильную оболочку, окружающую ядро, которая включает сополимер метакриловой кислоты и пластификатор. Фармацевтическая композиция может дополнительно
содержать антиадгезионное покрытие.
Новый фармацевтический препарат по изобретению, покрытый энтеросолюбильной оболочкой, обеспечивает защиту лекарственного вещества или терапевтически активного агента, такого как ddI, при значениях рН ниже 3 (таких, как в желудке), но позволяет лекарственному веществу выделяться при рH 4,5 или выше (как в верхних отделах кишечника).
Соответственно, фармацевтическая композиция по изобретению обычно включает лекарственные вещества, химически неустойчивые в кислых средах. Фармацевтическая композиция по изобретению обеспечивает прекрасную защиту в очень кислых средах (рН<3), в то же время не мешая быстро выделяться при рН выше 4, вне зависимости от того, происходит ли это в верхней части кишечника или в двенадцатиперсной кишке.
Большинство известных из уровня техники энтеросолюбильных оболочек по своей природе являются кислыми и, следовательно, могут быть причиной химической нестабильности, когда находятся в контакте с неустойчивыми в кислой среде ингредиентами. Это справедливо особенно при высокой температуре и во влажной среде, что подтверждается на опыте в процессе нанесения покрытия в водной среде. Чтобы свести к минимуму эту вызванную кислотой неустойчивость, между частицами, гранулами, шариками и т.п. и энтеросолюбильной оболочкой используют обычно защитную оболочку или подслой. Эта защитная оболочка физически отделяет лабильное в кислоте лекарственное вещество от кислой энтеросолюбильной оболочки и, следовательно, повышает устойчивость рецептуры.
Таким образом, описывается способ, по которому таблетки, гранулы, пилюли и/или частицы, содержащие неустойчивые в кислоте лекарственные вещества, можно успешно покрывать водоэнтеросолюбильными оболочками без применения защитной оболочки или подслоя. Этот процесс включает повышение рН суспензии для получения энтеросолюбильной оболочки с помощью щелочных агентов. рН суспензии с покрывающим составом повышают до точки ниже той, при которой может быть нарушена целостность полимера в кишечнике. Способ может включать применение связующих, таких как натрийкарбоксиметилцеллюлозу, наполнителей, таких как микрокристаллическая целлюлоза, измельчителей, таких как щелочной крахмал, и других эксципиентов, таких как оксид магния, который по своей природе является относительно щелочным, в рецептурах, предназначенных для энтеросолюбильного покрытия. Эти стадии обеспечивают более устойчивую композицию неустойчивого в кислоте лекарственного вещества в ядре. В результате отсутствует несовместимость и нет необходимости в защитном подслое между нестабильным в кислоте лекарственным веществом и кислой энтеросолюбильной оболочкой. Этот способ не только ликвидирует увеличивающую стоимость стадию нанесения подслоя, но обеспечивает более быстрое выделение лекарственного вещества, так как дополнительный подслой замедляет выделение лекарственного вещества.
Обычно гранулы лекарственного вещества получают, готовя сырую массу, которую экструдируют в виде нитей или ленты. Нити и ленты вытягиваются, попадая на вращающееся с высокой скоростью режущее устройство, которое разрезает их на мелкие отрезки и скругляет концы, при этом образуются сферические частицы с помощью процесса, называемого сфероидизацией. При этой сфероидизации возникает центробежная сила. Под действием этой силы, если частицы не содержат достаточно поглотителя влаги, влага будет извлекаться из частиц (через поверхность), что вызовет агломерацию. Микрокристаллическая целлюлоза является хорошим поглотителем влаги и, следовательно, прекрасной добавкой при сфероидизации. Часто требуется более 15% и обычно более 30% для получения хороших характеристик сфероидизации.
Наблюдения показали, что когда влага выходит на поверхность в процессе сфероидизации, сухой порошок может осаждаться на частицах, связывая влагу и предотвращая агломерацию. Авторы данного изобретения полагают, что этот процесс можно использовать, чтобы полностью исключить применение адсорбента влаги (влагопоглотителя) при приготовлении гранул с большим содержанием (нагрузкой) лекарственного препарата. Кроме того, заявители полагают, что лекарственное вещество можно смешивать с сухим связующим (если требуется) и, при необходимости, дезинтегрантом. Основную часть этой сухой смеси можно сделать влажной массой, экструдировать, а оставшуюся сухую смесь можно применять для связывания влаги, которая выйдет на поверхность в процессе сферондизации. Этот метод позволяет очень высокие нагрузки лекарственного вещества и не изменяет состава гранул вне зависимости от количества сухой смеси, применяемой для напыления.
Способ по данному изобретению допускает образование гранул с очень высокой нагрузкой лекарственного вещества (100%) и обычно включает приготовление сухой смеси порошкообразного лекарственного вещества с очень малым количеством подходящего связующего или без него и, при необходимости, с измельчителем. Само лекарственное вещество, смесь лекарственное вещество/сухое связующее или смесь лекарственное вещество/сухое связующее/измельчитель могут становиться липкими при увлажнении. Из основной части (70-95%) этой смеси делают сырую массу, ее экструдируют и сфероидизируют, как это делают обычно в технике для получения гранул. Меньшую часть (5-30%) смеси оставляют для напыления. В процессе сфероидизании нити экструдата разрезаются и частицы округляются. В ходе этого процесса из этих частиц извлекается влага. Часть сухой смеси, отставленная ранее, распыляется на влажных частицах для связывания поверхностной влаги. Это делает частицы относительно сухими и позволяет свободно двигаться, не распыляясь. Соответственно, сфероидизация гранул происходит без агломерации.
Часто гранулы или частицы с энтеросолюбильной оболочкой или с модифицированным выделением для перорального приема лекарства готовят в виде капсул. При глотании оболочка капсулы растворяется, вызывая экспозицию содержимого капсулы с содержимым желудка. Вследствие наличия жидкостей в желудке экспонированные частицы увлажняются. Если влажные частицы не слипаются вместе, они диспергируют в содержимом желудка и могут начать поступать в двенадцатиперсную кишку на основании гранулометрического состава и других факторов, которые регулируют время прохождения через желудок. Однако если частицы становятся при увлажнении липкими, они могут слипаться вместе в виде одного или более комков. В этом случае такие комки могут вести себя как большие частицы и время их выхода из желудка будет меняться в зависимости от размера и содержания образовавшихся комков. В этом случае такая лекарственная форма не будет вести себя как истинная система, состоящая из многих частиц. Чтобы решить эту задачу, согласно способу по данному изобретению, покрытые энтеросолюбильной оболочкой гранулы, пилюли, частицы или таблетки перед инкапсулированием покрывают гидрофобным материалом. Берут такое количество гидрофобного покрытия, которого как раз хватает для того, чтобы предотвратить слипание после растворения оболочки капсулы, по слишком много, чтобы замедлить растворение. В результате этого простого процесса частицы ведут себя как индивидуальные частицы и время прохождения через желудок близко времени, ожидаемому при том размере частиц, на который рассчитана лекарственная форма, что дает возможность получать более предсказуемую и мало меняющуюся лекарственную форму.
Способ по данному изобретению иллюстрирует приготовление непокрытых гранул с высокой (до 100%) активностью из нестабильных в кислоте лекарственных веществ, таких как ddI, с применением водного процесса. Не требуется специализированного оборудования, так как найдено, что традиционное оборудование для экструзии и сфероидизации применимо для образования гранул. Применение щелочного связующего, такого как натрийкарбоксиметилцеллюлоза, и напыления сухой смесью, содержащей лекарственное вещество, при сфероидизации и, при необходимости, связующего и дезинтегранта, гарантировало химическую стабильность препарата и максимизировало нагрузку лекарственного вещества. Способ по данному изобретению дал высокий (>90%) выход гранул с узким гранулометрическим составом (в узком интервале).
Изобретение в особенности адаптировано к фармацевтическим композициям, таким как гранулы, пилюли или таблетки, предпочтительно гранулы, содержащие ddI в качестве лекарственного вещества, ddI присутствует в гранулах, покрытых оболочкой, в количествах, составляющих примерно до 100% композиции.
Покрытые оболочкой гранулы сначала проходят через желудок. Время прохождения через желудок составляет около двух часов и рН в этой области, равно примерно 1-3. Энтеросолюбильный компонент оболочки позволяет медикаментозному ядру оставаться практически интактным, таким образом препятствуя выделению фармакологически активного вещества в этой области или препятствуя кислоте проникать в ядро гранулы. Затем гранулы проходят через тонкий кишечник, где большая часть энтеросолюбильного компонента оболочки растворяется и высвобождает фармакологически активное вещество, находящееся внутри. При нормальном направлении потока идет в тонкий кишечник, который состоит из двенадцатиперсной, тощей и подвздошной кишки. Время прохождения через тонкий кишечник составляет около 2-4 часов и рН на этих участках равно примерно 5-7,2.
Применяемый в данном описании термин "энтеросолюбильная оболочка (покрытие)" обозначает полимерный(-ые) материал или материалы, который(-е) покрывает(-ют) сердцевину (ядро) с лекарственным препаратом. Материал полимерной энтеросолюбильной оболочки по данному изобретению не содержит никакого активного соединения, т.е. никакого терапевтически активного агента по данному изобретению. Предпочтительно, когда основное (значительное) количество или все количество полимерного материала энтеросолюбильного покрытия растворяется прежде, чем препарат или терапевтически активный агент выделяется из лекарственной формы, так чтобы достичь замедленного растворения медикаментозного ядра. Подходящим рН-чувствительным полимером является такой, который растворяется в кишечном соке при более высоких значениях рН (рН выше 4, 5), таких как в тонком кишечнике, и, следовательно, позволяет фармакологически активному веществу выделяться в области тонкого кишечника, а не в верхней части ЖКТ, например в желудке.
Полимерный материал оболочки выбирают так, чтобы терапевтически активный агент выделялся тогда, когда лекарственная форма достигает тонкого кишечника или участка, где рН выше 4,5. Предпочтительные рН-чувствительные материалы оболочки это те, которые остаются интактными при низких значениях рН в желудке, но разрушаются или растворяются при значениях рН, обычно обнаруживаемых в тонком кишечнике больного. Полимерный материал энтеросолюбилыюй оболочки начинает растворяться в водном растворе при рН около 4,5-5,5. Растворимость в зависимости от рН энтеросолюбильных полимеров по данному изобретению такова, что заметного растворения энтеросолюбильной полимерный оболочки не происходит до тех пор, пока лекарственная форма не выйдет из желудка. рН тонкого кишечника постепенно увеличивается примерно от 4,5 до 6,5 в луковице двенадцатиперсной кишки до примерно 7,2 в дистальных областях тонкого кишечника (подвздошная кишка). Чтобы обеспечить предсказуемое растворение, соответствующее времени прохождения через тонкий кишечник - 3 часа, и создать в нем возможность воспроизводимого выделения, оболочка должна начать растворяться в интервале рН, соответствующем двенадцатиперсной кишке, и продолжать растворяться в интервале рН в тонком кишечнике. Следовательно, количество полимерного энтеросолюбильного покрытия должно быть таким, чтобы оно практически растворилось в течение примерно трех часов, времени прохождения через тонкий кишечник.
Фармацевтический препарат, находящийся в ядре, является неустойчивым в кислоте лекарственным веществом, таким как ddI, правастатин, эритромицин, дигоксин, панкреатин, ddA, ddC и т.п. Данное изобретение не ограничивается этими лекарственными веществами, также могут применяться и другие лекарственные вещества.
В ядре (сердцевине) могут находиться одно или более связующих в количествах примерно от 0 до 10% и предпочтительно около 1% от веса композиции. Натрийкарбоксиметилцеллюлоза является предпочтительным связующим, наиболее пригодным для использования по данному изобретению. Примеры других связующих, которые можно использовать, включают AvicelФ РН101, AvicelФ RC 591, AvicelФ CL-611, (FMC Corp.), MethocelФ E-5 (Dow Corp.), Starch 1500 (Colorcon, Ltd. ), гидроксипропилметилцеллюлоза (HPMC) (Shin-Etsu Chemical Co., Ltd.), поливинилпирролидон, альгинат калия и альгинат натрия.
Ядро композиции по изобретению может также включать один или более измельчителей или веществ, способствующих набуханию, в количествах примерно от 1% до 4% от веса композиции, таких, например, веществ, как щелочной крахмал, выпускаемый под торговой маркой EXPLOTAB (Edward Mendell Co.), Ac-Di-Sol (сшитая натрийкарбоксиметилцеллюлоза) (FMC Corp.), натрийкроскармеллоза, кукурузный крахмал или сшитый поливинилпирролидон.
Ядро (сердцевина), используемое в фармацевтической композиции по изобретению, может быть в виде гранулы или шарика с диаметром примерно 0,5-5 мм и предпочтительно около 1-2 мм. Сердцевина преимущественно делается в форме гранулы или шарика.
При получении фармацевтической композиции по изобретению, покрытой энтеросолюбильной оболочкой, используется раствор энтеросолюбильного покрытия Eudragit L-30-D 55. Eudragit L-30-D 55 представляет собой водную дисперсию акрилового полимера, анионного сополимера метакриловой кислоты и этилакрилата с соотношением свободных карбоксильных групп и сложноэфирных групп, примерно 1:1, и средним молекулярным весом, примерно 250 000, поставляется в виде водной дисперсии, содержащей 30 вес.% сухого лака и выпускается фирмой Rohm-Pharma Co. , Германия. Так как оболочка имеет водную основу, следовательно, не используются никакие экологически вредные органические растворители.
Хотя Eudragit является предпочтительным полимером для покрытия, изобретение не ограничивается им и в технике известны и могут применяться другие энтеросолюбильные полимерные покрытия, такие как фталат гидроксипропилметилцеллюлозы НР50 (НРМСР-НР50) (USP/NF 220824), НР55 (НРМСР-Н55) (USP/NF тип 200731) и HP55S, поставляемый Shin Etsu Chemical, CoatericФ (поливинилацетатфталат) (Colorcon, Ltd.) или AquatericФ (ацетатфталат целлюлозы) (FMC Corp.) и т.п.
Энтеросолюбильная оболочка по изобретению предпочтительно содержит пластификатор, предпочтительно диэтилфталат, хотя изобретение не ограничивается этим и могут применяться другие пластификаторы, такие как триэтилцитрат (Citroflex-2), триацетин, трибутилсебацат или полиэтиленгликоль. При необходимости после покрытия может применяться антиадгезив (антиагломерант), который преимущественно является гидрофобным материалом, таким как тальк, стеарат магния или коллоидальная двуокись кремния, причем более предпочтительным является тальк.
Применяемые энтеросолюбильные покрытия значительно проще в обращении, чем ранее описанные системы для покрытия. И особенно предпочтительны для покрытия частиц малого диаметра, с малой массой (гранулы), с минимальными трудностями при образовании (агломерация) и не требующими применения органических растворителей.
Вышеописанная энтеросолюбильная оболочка включает сополимер метакриловой кислоты в количестве примерно 5-30% и предпочтительно 10-20% от веса сухих веществ, содержащихся в растворе веществ, входящих в состав энтеросолюбильной оболочки, и пластификатор в количестве примерно 1-6% вес.% и предпочтительно 2-3 вес.%.
Все вышеуказанные весовые величины даны по отношению к общей концентрации твердых веществ, входящих в состав энтеросолюбильной оболочки, в растворе/суспензии.
Состав для получения энтеросолюбильной оболочки, следовательно, содержит около 5-35 вес.% твердых веществ и около 65-95 вес.% воды.
В целом, если ядро содержит лекарственное вещество, несовместимое с энтеросолюбильным покрывающим слоем, применяют подслой, который может состоять из одного или более пленкообразователей или пластификаторов и который ведет себя как физический барьер между ядром и внешним слоем энтеросолюбильной оболочки. Однако в отличие от ранее описанных покрытий, таких как оболочка, описанная в патенте США 5225202, новая фармацевтическая композиция по изобретению, в результате нового процесса, используемого для изготовления композиции по данному изобретению, и корректировки рН покрытия не требует подслоя, так как необходимость в таком изолирующем слое отпадает в связи со стабилизацией гранул подщелачивающим агентом и водным покрытием с рН 5. Так как покрытие создается так, чтобы распадаться при рН 5,5, то энтеросолюбильное покрытие, наносимое при рН 5, относительно быстро распадается в кишечнике, так как требуется очень ненамного увеличить щелочность до достижения рН 5,5.
Для того, чтобы высвобождать лекарственное вещество в тонком кишечнике, энтеросолюбильная оболочка должна составлять по весу примерно 5-30% от веса ядра, но это соотношение может быть увеличено примерно до 60% для выделения в толстом кишечнике.
Фармацевтическую композицию в форме гранул или сфер, покрытых энтеросолюбильной оболочкой, см. табл.1, можно приготовить по способу, содержащему стадии приготовления сначала непокрытых гранул из сухой смеси, состоящей из лекарственного препарата, связующего, такого как NaCMC, дезинтегранта, такого как щелочного (Na) крахмала, которую готовят с помощью барабанного смесителя, планетарной мешалки или мешалки с высоким сдвигом. Часть высушенной смеси, в количестве около 5-30% и предпочтительно 10-20%, отделяют для позднейшего использования в процессе сфероидизации. Затем к оставшемуся количеству - 70-95% - сухой смеси добавляют воду и гранулируют в соответствующую сырую грануляционную массу, применяя планетарную мешалку или мешалку с высоким сдвигом. Сырую массу экструдируют, например, применяя экструдер Nica или экструдер другого типа, получая экструдат, который затем помещают в сфероидизатор, такой как Caleva, Nica или другого типа, получают при этом сырые гранулы, на которые в процессе сфероидизации напыляют 5-30% предварительно оставленной сухой смеси. Затем гранулы сортируют по размеру, просеивая через сита и получая гранулы заданного размера. Затем гранулы можно высушить в тарельчатой сушилке или в псевдоожиженном слое. Общий процесс по данному изобретению с применением ddI в качестве нестабильного в кислоте лекарственного препарата показан схематически на чертеже.
Высушенные гранулы или шарики затем могут быть покрыты энтеросолюбильной пленкой с помощью суспензии, содержащей Eudragit L-30-D и пластификатор (диэтилфталат), с помощью устройства для нанесения покрытия в псевдоожиженном слое, такого как система Wurster для нанесения покрытия распылением, или с помощью другой соответствующей системы для нанесения покрытия, а затем высушены. При получении суспензии пленочного покрытия раствор NaOH добавляют в суспензию до получения рН 5,0±0,1. Стабилизация гранул с помощью связующего и корректировки рН суспензии энтеросолюбильного пленочного покрытия до достижения значения 5 делает ненужным подслой или изолирующий слой. Преимуществом в данном случае является то, что процесс нанесения энтеросолюбильного покрытия при рН 5 позволяет относительно быстро разрушать его в кишечнике, так как требуется очень небольшое подщелачивание для доведения рН до 5,5.
Чтобы предотвратить комкование покрытых пленкой гранул, затем к ним добавляют гидрофобный антиадгезив (тальк) и перемешивают.
Полученные таким способом гранулы или шарики можно затем поместить в капсулы с твердой оболочкой, такие как желатиновые капсулы различного размера, в зависимости от требуемой дозировки препарата.
Примеры представляют предпочтительные варианты воплощения способа по данному изобретению. Следующие примеры дополнительно описывают материалы и методы, используемые при осуществлении способа по изобретению, и даны только в качестве иллюстрации, но не претендуют никоим образом на то, чтобы ограничить объем или сущность изобретения или формулы изобретения. Все температурные величины даны в градусах Цельсия, если не указано иначе, и все размеры ячейки сита даны в соответствии со стандартом ASTM (см.табл.2).
ПРИМЕР 1
Рецептуру ddI в виде гранул, покрытых энтеросолюбильной оболочкой, имеющую следующий состав, получают описанным ниже способом.
Приготовление гранул начинают с просеивания и перемешивания смеси ddI, щелочного (Na) крахмала и натрийкарбоксиметилцеллюлозы. Полученную смесь снова просеивают и повторно перемешивают. Затем отбирают около 10%-20% второй смеси и оставляют ее для распыления в процессе сфероидизации. Затем остальную смесь гранулируют до достижения соответствующего состояния сырой массы с помощью планетарной мешалки или мешалки с высоким сдвигом. При перемешивании добавляют около 200-360 г воды на 1 кг сухой смеси до достижения состояния сырой массы для экструзии. Сырую массу экструдируют через сито с помощью экструдера (Nica Model Е140, Feeder Speed 1, Agitator Speed 1), в результате чего после сфероидизации получают гранулы размером 10/18 меш. Экструдат переносят в подходящий сфероидизатор (Caleva Model 15 при 500 об/мин, или Q-400 MarumerizerФ при 700 об/мин) и сфероидизируют со средней скоростью, используя среднее сетчатое или звездообразное устройство для разрезания, в течение примерно 1-5 минут. Смесь - 10%-20% от веса ранее приготовленной смеси, - которая была оставлена, затем используют для напыления на гранулы с целью предотвращения агломерации. После сфероидизации в течение определенного времени продукт загружают в подходящий контейнер.
Сфероидизованные сырые гранулы затем осторожно пропускают через сита 10 и 18 (меш), собирая фракцию 10/18 меш. Фракции размером выше 10 и ниже 18 меш возвращают в экструдер на повторную экструзию и повторную сфероидизацию. Этот процесс повторяют до тех пор, пока не получат фракцию, составляющую по меньшей мере 90% продукта. Фракцию 10/18 меш затем сушат горячим воздухом в тарельчатой сушилке или в псевдоожиженном слое до достижения заранее определенного заданного содержания влаги. Высушенные гранулы просеивают через сита 10 и 20 меш для удаления комков и гранул меньшего размера. Фракцию продукта в виде гранул размером 10/20 меш переносят в соответствующий контейнер, соединенный с двумя полиэтиленовыми мешками. Определяют чистый вес, подсчитывают выход в % и эффективность процесса получения гранул.
Чтобы получить достаточные количества суспензии с пленочным покрытием для партии гранул, Eudragit L-30-D 55 фильтруют через сито 60 меш для удаления всех имеющихся комков. Отфильтрованный Eudragit взвешивают и добавляют при перемешивании в затаренную емкость, содержащую половину требуемой воды. Смесь непрерывно перемешивают в течение 5 минут или до получения четко видимой однородной смеси. При постоянном перемешивании добавляют в емкость диэтилфталат и продолжают перемешивание 20 минут до получения явной однородной смеси. Стандартизацию рН-метра осуществляют, применяя рН 4 и рН 7-буферные растворы. Продолжая перемешивать, в емкость добавляют раствор NaOH до достижения рН 5,0±0,1. Все рецептуры суспензии для покрытия корректируют водой и продолжают перемешивание еще 10 минут.
Для процесса покрытия гранул устанавливают процессор с псевдоожиженным слоем для системы Wurster для напыления покрытия или другой подходящей системы для нанесения покрытия. Идеальные параметры системы для напыления покрытия включают Aeromatic STREA-1, загрузка 300 г, наконечник (сопла) 0,8 мм, скорость распыления 8 г/мин, давление при распылении 1,0 бар (100 кПа), температура на входе 64oС, температура на выходе 42oС; Glatt GPCG-5 с колонной Wurster (Вурстера) 1500 г, наконечник (сопла) 1,2 мм, скорость распыления 20 г/мин, давление при распылении 1,0 бар (100 кПа), температура на входе 65oС, температура на выходе 42oС.
Перед началом нанесения пленочного покрытия с помощью суспензии гранулы при необходимости можно предварительно нагреть в течение примерно 5 минут до температуры около 50oС. Пленочное покрытие - 16-20 вес.% - наносят, используя ранее описанные параметры процесса покрытия. По завершении нанесения покрытия температуру на входе снижают, поддерживая температуру на входе около 50oС, и затем сушат гранулы в течение 25±10 мин. Определяют чистый вес покрытых пленкой гранул. Рассчитывают процентное содержание пленочного покрытия относительно веса гранул. Весовое количество талька, которое нужно добавить, определяют исходя из чистого веса гранул. Истинный прирост % вследствие покрытия пленкой зависит от эффективности операции покрытия. Количество нанесенного покрытия можно корректировать, чтобы достичь намеченного прироста веса за счет покрытия. Затем взвешивают определенное количество талька. Покрытые пленкой гранулы помещают в барабанный смеситель с тальком и перемешивают 15±5 минут. Затем гранулы переносят в подходящий(-е) контейнер(ы), соединенный(-е) с двумя полиэтиленовыми мешками, и определяют чистый вес.
Полученные таким способом гранулы можно помещать в капсулы или оболочки (скорлупу), такие как желатиновые капсулы, чтобы было легче глотать.
Найдено, что полученный таким образом продукт ddI в энтеросолюбильной оболочке прекрасно защищен от желудочной кислоты (рН 3), но очень хорошо выделяет ddI при рН выше 5.
ПРИМЕР 2
Предпочтительную рецептуру ddI в форме гранул,
покрытых энтеросолюбильной оболочкой, получают нижеописанным способом, ddI (0,7774 кг), щелочной (Na) крахмал (0,0327 кг) и NaCMC (0,0082 кг) помещают в соответствующий смеситель/миксер. Если
применяют смеситель барабанного типа, смесь перемешивают 10±2 мин. Если применяют планетарную мешалку, смесь перемешивают 10±2 мин. В случае мешалки с высоким сдвигом смесь перемешивают
5±2 мин. При применении барабанного смесителя или планетарной мешалки смесь размалывают на мельнице Eitzmill, снабженной молотками с поступательным движением, устройством для резки 1 и на
средней скорости. Размолотый материал затем помещают в барабанный смеситель или в планетарную мешалку и перемешивают 10±2 мин. Перед перемешиванием, если в случае каких-либо ингредиентов
требуется разбить комки, их пропускают через сито 20 меш из нержавеющей стали.
Затем около 10%-20% второй смеси отделяют и оставляют для напыления в процессе сфероидизации. Остальную смесь затем гранулируют до состояния соответствующей сырой массы с помощью планетарной мешалки или мешалки с высоким срезом. При перемешивании добавляют 200-360 г воды на 1 кг сухой смеси до достижения состояния сырой массы, пригодной для экструзии. Сырую массу экструдируют через соответствующее сито, используя экструдер Nica Model Е140, скорость подачи 1, скорость перемешивания 1, который позволяет получать при сфероидизации фракцию гранул 10/18 меш. Затем экструдат переносят в сфероидизатор, либо Caleva Model 15 при 500 об/мин, либо Q-400 MarumerizerФ при 700 об/мин и проводят сфероидизацию при средней скорости и с решетчатым режущим устройством среднего размера (0,3-0,4 мм) или с режущим устройством звездообразного типа примерно 1-3 минуты 10-20% ранее приготовленной сухой смеси, отставленной ранее, затем используют для напыления на гранулы с целью предотвращения агломерации. После сфероидизации в течение определенного времени продукт выгружают в подходящий контейнер.
Сырые сферические гранулы затем осторожно пропускают через сита 10 меш и 18 меш, собирая фракцию 10/18 меш. Фракцию выше 10 и ниже 18 меш возвращают в экструдер на повторные экструзию и сфероидизацию. Этот процесс продолжают до тех пор, пока эта фракция не составит по меньшей мере 90% продукта. Затем продукт - фракции 10/18 меш - сушат горячим воздухом в тарельчатой сушилке или в сушилке с псевдоожиженным слоем при 55o-60oС (например, Glatt GPC-5, температура на входе 60oС, температура продукта 50oС, температура на выходе 42oС), пока не достигнут заранее определенного заданного содержания влаги. Сухие гранулы пропускают через сита 10 и 20 меш для удаления комков и гранул меньшего размера. Продукт в виде высушенных гранул размером 10/20 меш переносят в соответствующий контейнер, соединенный с двумя полиэтиленовыми мешками. Определяют чистый вес и рассчитывают выход в % и эффективность процесса получения гранул.
Для приготовления достаточного количества пленочного покрытия для партии гранул весом 1 кг количество сухих веществ в Eudragit, осажденных на 1 кг гранул, составляло 0,1562 кг. Количество диэтилфталата, осажденного на 1 кг гранул, составило 0,0234 кг. Eudragit L-30-D 55 фильтруют через сетчатый фильтр 60 меш для удаления имеющихся в нем комков. Отфильтрованный Eudragit (0,1562 кг, масса сухого вещества) затем добавляют при перемешивании в затаренный сосуд, содержащий половину требующегося количества воды. Смесь непрерывно перемешивают в течение 5 минут или до достижения четко видимой однородной смеси. При непрерывном перемешивании добавляют в емкость (сосуд) диэтилфталат (0,0234 кг) и продолжают перемешивание в течение 20 минут или до четко видного состояния однородной смеси. Затем рН-метр стандартизуют, используя буферные растворы с рН 4 и рН 7. При продолжающемся перемешивании в емкость добавляют раствор NaOH до достижения рН 5,0±0,1. Массу рецептуры суспензии для покрытия корректируют с помощью воды и продолжают перемешивание еще 10 минут.
Затем гранулы покрывают, используя систему Wurster для нанесения покрытия распылением. Идеальные характеристики системы для напыления покрытия включают Aeromatic STREA-1, загрузка 300 г, отверстие форсунки 0,8 мм, скорость распыления 8 г/мин, давление при распылении 1,4 бар (140 кПа), температура на входе 64oС, температура на выходе 42oС; Glatt GPCG-5 с Wurster-колонной, 1500 г, отверстие форсунки 1,2 мм, скорость распыления 20 г/мин, давление при распылении 1,0 бар (100 кПа), температура на входе 65oС, температура продукта 48oС, температура на выходе 42oС.
Перед началом нанесения пленочного покрытия с помощью суспензии гранулы, при необходимости, можно предварительно нагреть до 50oС в течение примерно 5 минут, и сушить в течение 25±10 минут. Наносят 16-20 вес.%-ное пленочное покрытие, используя заранее определенные характеристики для покрытия. По окончании нанесения пленки температуру на входе снижают, чтобы сохранять температуру продукта примерно 50o С, и затем сушат гранулы в течение 25±10 мин. Определяют чистый вес покрытых пленкой гранул. Вычисляют процентное содержание пленочного покрытия относительно веса гранул.
Определяют массу талька (величина 0,2%), которую надо добавить, исходя из чистого веса гранул. Затем взвешивают расчетную массу талька. Покрытые пленкой гранулы помещают в подходящий барабанный смеситель с тальком и перемешивают 15±5 минут. Затем гранулы переносят в подходящий(-е) контейнер(ы), соединенный(-е) с двумя полиэтиленовыми мешками, и определяют чистый вес.
Полученные таким способом гранулы затем можно поместить в капсулы или оболочки, такие как желатиновые капсулы, чтобы их было легче глотать.
Найдено, что полученный таким образом продукт ddI в энтеросолюбильной оболочке прекрасно защищен от желудочной кислоты (рН 3), но отлично высвобождает ddI при значениях рН выше 4,5.
Реферат
Изобретение относится к фармацевтике и касается фармкомпозиции в виде гранул, содержащих ядро и энтеросолюбильную оболочку, при этом ядро включает 80-100% диданозина, 0-10% связующего при соотношении энтеросолюбильной оболочки и ядра от 0,05:1 до 0,6:1. Гранулы обладают повышенной химической стабильностью. 2 с. и 24 з.п. ф-лы, 1 ил.

Комментарии