Полиморфные формы соединения st-246 и способы получения - RU2578606C2
Код документа: RU2578606C2
Чертежи



















Описание
Перекрестная ссылка на родственные заявки
[00001] По настоящей заявке испрашивается приоритет и преимущество предварительной заявки США № 61/316747, поданной 23 марта 2010 года, и предварительной заявки США № 61/373031, поданной 12 августа 2010 года, содержание которых включено в данное описание посредством ссылки в полном объеме.
Область техники, к которой относится изобретение
[00002] Настоящее изобретение относится к отдельным кристаллическим формам фармацевтического соединения, 4-трифторметил-N-(3,3a,4,4a,5,5a,6,6a-октагидро-1,3-диоксо-4,6-этеноциклопроп[f]изоиндол-2(1H)-ил)бензамида, названного ST-246, к способам их получения, фармацевтической композиции, содержащей различные кристаллические формы, и их применению в терапии.
Заявление относительно федерально спонсируемого исследования или разработки
[00003] Это изобретение было создано при поддержке правительства США в рамках контракта № HHSN266200600014C, заключенного с Национальным институтом здоровья (NIH). Правительство США имеет определенные права на это изобретение.
Уровень техники
[00004] На всем протяжении данного описания в тексте приводятся различные публикации. Раскрытие этих публикаций во всей их полноте включено в данное описание посредством ссылки для того, чтобы более полно описать состояние данной области техники, как известно специалистам в данной области, по состоянию на дату описанного и заявленного в данном описании изобретения.
[00005] После ликвидации оспы (Fenner et al., The epidemiology of smallpox. In: Smallpox and its eradication. Switzerland: World Health Organization; 1988) и последующего прекращения обычной вакцинации от оспы в детстве, число людей, восприимчивых к инфекции вирусом натуральной оспы (VARV), этиологическим агентом, который вызывает оспу, во всем мире резко возросло. Кроме того, вторжение в места обитания диких животных, торговля экзотическими животными и торговля мясом диких животных повышают риск зоонозных инфекций другими ортопоксвирусами, такими как вирус оспы обезьян (MPXV), при которых вакцинация против натуральной оспы обеспечивает некоторую перекрестную защиту (Jezek et al., Human monkey pox. In: Melnick JL ed. Monographs in virology. Vol. 17. Basel, Switzerland: S Karger AG. 1988:81-102).
[00006] Учитывая, что большая часть населения во всем мире восприимчива к натуральной оспе, появление MPXV в Соединенных Штатах в 2003 году, и учитывая сохраняющуюся обеспокоенность преднамеренным распространением VARV, существует возобновление интереса к разработке более безопасных вакцин против натуральной оспы и других ортопоксвирусов и противовирусных лекарственных средств.
[00007] Одним недавно обнаруженным противовирусным соединением является ST-246, специфический и мощный ингибитор ортопоксвирусного белка, крайне важного для созревания вируса. Несколько исследований, оценивающих активность ST-246 в отношении ортопоксвирусов, продемонстрировали отличную эффективность in vitro и in vivo (Quenelle et al. 2007. Efficacy of delayed treatment with ST-246 given orally against systemic orthopoxvirus infections in mice. Antimicrobial Agents and Chemotherapy Feb; 51(2):689-95, Smee et al, 2008. Progress in the discovery of compounds inhibiting orthopoxviruses in animal models. Antiviral Chemistry and Chemotherapy 19(3):115-24). При оценивании in vitro против вируса осповакцины (VV), вируса коровьей оспы (CV), вируса эктромелии (ECTV), вирусов оспы обезьян, оспы верблюдов и натуральной оспы, соединение ST-246 ингибирует репликацию вируса на 50% (50% эффективная концентрация [EC50]) в концентрации ≤0,07 мкМ. На животных моделях при использовании летальной инфекции ECTV, VV или CV зарегистрировано, что соединение ST-246 является нетоксичным и в высшей степени эффективным в предотвращении или снижении смертности, даже когда лечение было задержано на 72 ч после вирусной инокуляции. (Quenelle et al., 2007. Efficacy of delayed treatment with ST-246 given orally against systemic orthopoxvirus infections in mice. Antimicrobial Agents and Chemotherapy Feb; 51(2):689-95, Smee et al. 2008. Progress in the discovery of compounds inhibiting orthopoxviruses in animal models. Antiviral Chemistry and Chemotherapy 19(3):115-24). Соединение ST-246 также было оценено с помощью нелетальной модели поражения хвоста мыши с использованием внутривенного VV. Когда ST-246 вводили перорально два раза в день в дозе 15 или 50 мг/кг массы тела в течение 5 дней, поражения хвоста были значительно уменьшены (Smee et al., 2008. Progress in the discovery of compounds inhibiting orthopoxviruses in animal models. Antiviral Chemistry and Chemotherapy 19(3):115-24). Совсем недавно ребенку было дано соединение ST-246 в качестве разрешенного Управлением по контролю качества пищевых продуктов и лекарственных препаратов (FDA) экстренного лечения вакцинальной экземы, которая развилась после контакта с развернутой для проведения родителям военной иммунизации против натуральной оспы (Vora et al., 2008, Severe eczema vaccinatum in a household contact of a smallpox vaccine. Clinical Infectious Disease 15; 46(10):1555-61).
[00008] Соединение ST-246 раскрыто в патентах WO 2008/130348, WO 2004/112718 и WO 2008/079159 в качестве одного из тетрациклических ацилгидразидных соединений для лечения или профилактики вирусных инфекций и связанных с ними заболеваний, в частности, вирусных инфекций, вызванных ортопоксвирусом, и связанных с ними заболеваний. Эти публикации раскрывают способ получения ST-246, но не раскрывают, какая полиморфная форма изготовлена. Тем не менее, раскрытый способ дает полугидрат ST-246, полиморфную форму V, как описано в данном описании ниже.
[00009] Способ получения моногидрата ST-246 раскрыт в CN 101445478A. Данные, приведенные в этой публикации, соответствуют полиморфной форме III в соответствии с настоящей классификацией полиморфов ST-246.
[000010] В настоящее время было неожиданно обнаружено, что ST-246 может существовать в виде многих различных полиморфных форм. Отдельная кристаллическая форма соединения может обладать физическими свойствами, которые отличаются от физических свойств других полиморфных форм, и такие свойства могут оказывать заметное влияние на физико-химические и фармацевтические процессы переработки соединения, особенно когда соединение получают или используют в коммерческих масштабах. Такие различия могут влиять на механические свойства переработки соединения (такие как реологические свойства твердого материала) и характеристики компрессии соединения. Кроме того, открытие новых полиморфных форм таких фармацевтически важных соединений, как ST-246, обеспечивает новые возможности для улучшения эксплуатационных характеристик фармацевтического конечного продукта и расширяет ассортимент материалов, которые доступны ученому в области формулирования лекарственного средства для разработки, например, фармацевтические лекарственные формы лекарственного средства с целевым профилем высвобождения или другими желаемыми физико-химическими свойствами.
[000011] Кроме того, учитывая, что новые полиморфные формы лекарственного вещества могут демонстрировать различные точки плавления, гигроскопичность, стабильность, растворимость и/или скорость растворения, кристалличность, свойства кристаллов, биодоступность, токсичность и технологические характеристики при формулировании, которые находятся среди многочисленных свойств, которые должны быть учтены при получении лекарственного средства, которое можно эффективно вводить. Кроме того, регулирующие органы требуют точного знания, характеризации и контроля полиморфной формы активного компонента в твердых лекарственных формах. Таким образом, в данной области техники существует необходимость в кристаллизации и характеризации новых полиморфных форм соединения ST-246.
Сущность изобретения
[000012] Настоящее изобретение относится к полиморфной форме I соединения ST-246, которая демонстрирует картину рентгеновской порошковой дифракции, имеющую характеристические пики приблизительно 7,63, 10,04, 11,47, 14,73, 15,21, 15,47, 16,06, 16,67, 16,98, 18,93, 19,96, 20,52, 20,79, 22,80, 25,16, 26,53, 27,20, 27,60, 29,60, 30,23, 30,49, 30,68, 31,14, 33,65, 34,33, 35,29, 35,56, 36,30, 37,36, 38,42, 38,66 градусов.
[000013] Настоящее изобретение также относится к полиморфной форме II соединения ST-246, которая демонстрирует картину рентгеновской порошковой дифракции, имеющую характеристики, соответствующие фиг.2.
[000014] Настоящее изобретение дополнительно относится к полиморфной форме III соединения ST-246, которая демонстрирует картину рентгеновской порошковой дифракции, имеющую характеристические пики приблизительно 6,71, 9,05, 12,49, 13,03, 13,79, 14,87, 15,72, 16,26, 16,74, 18,10, 18,43, 19,94, 21,04, 21,51, 23,15, 23,51, 25,32, 26,24, 26,87, 27,32, 27,72, 28,55, 29,08, 29,50, 29,84, 31,27, 33,48, 35,36, 39,56 градусов.
[000015] Настоящее изобретение также относится к полиморфной форме IV ST-246, которая демонстрирует картину рентгеновской порошковой дифракции, имеющую характеристики, показанные на фиг.4.
[000016] Настоящее изобретение дополнительно относится к полиморфной форме VI соединения ST-246, которая демонстрирует картину рентгеновской порошковой дифракции, имеющую характеристические пики, как показано на фиг.6.
[000017] Настоящее изобретение также относится к фармацевтическим композициям, содержащим каждую из полиморфных форм I-VI соединения ST-246 и дополнительно содержащие один или более фармацевтически приемлемых носителей, эксципиентов, разбавителей, добавок, наполнителей, смазывающих веществ или связующих веществ.
[000018] Настоящее изобретение дополнительно относится к способам лечения ортопоксвирусных инфекций или вакцинальной экземы, включающим введение субъекту, животному или человеку, нуждающемуся в этом, терапевтически эффективного количества каждой из полиморфных форм I-VI соединения ST-246.
[000019] Настоящее изобретение также предоставляет способы синтеза каждой из полиморфных форм I-VI соединения ST-246.
[000020] Настоящее изобретение также относится к стандартной лекарственной форме для перорального введения, где ST-246 имеет D90% диаметр размера частиц, составляющий приблизительно до 300 микрон. В некоторых вариантах осуществления ST-246, полиморфная модификация I, II, III, IV и VI, имеет D90% диаметр размера частиц, равный приблизительно 5 микрон; в другом варианте осуществления D90% диаметр размера частиц составляет приблизительно 16,6 микрон; в еще одном варианте осуществления D90% диаметр частиц составляет приблизительно 26,6 микрон; и еще в одном варианте осуществления D90% диаметр частиц составляет приблизительно 75 микрон.
[000021] В другом аспекте изобретения стандартная лекарственная форма для перорального введения содержит 200 мг соединения ST-246, где ST-246 выбрано из группы, состоящей из полиморфной модификации формы II соединения ST-246, полиморфной модификации формы III соединения ST-246, полиморфной модификации формы IV соединения ST-246 и полиморфной модификации формы VI соединения ST-246, и дополнительно содержащей 33,15 мг лактозы моногидрата; 42,90 мг натрийкроскармеллозы; 1,95 мг коллоидного диоксида кремния; 13,65 мг гипромеллозы, 7,8 мг лаурилсульфата натрия; 1,95 мг стеарата магния; и количество микрокристаллической целлюлозы до 88,60 мг, так что общая масса лекарственной формы, включая любые примеси, воду и остаточные растворители, составляет 390 мг.
Краткое описание чертежей
[000022] На фиг.1 показана картина рентгеновской порошковой дифракции (XRPD) формы I.
[000023] На фиг.2 показаны три картины рентгеновской порошковой дифракции (XRPD) формы II (из трех различных образцов).
[000024] На фиг.3 показана картина рентгеновской порошковой дифракции (XRPD) формы III.
[000025] На фиг.4 показаны две картины рентгеновской порошковой дифракции (XRPD) формы IV (из двух различных образцов).
[000026] На фиг.5 показана картина рентгеновской порошковой дифракции (XRPD) формы V.
[000027] На фиг.6 показаны две картины рентгеновской порошковой дифракции (XRPD) формы VI (из двух различных образцов).
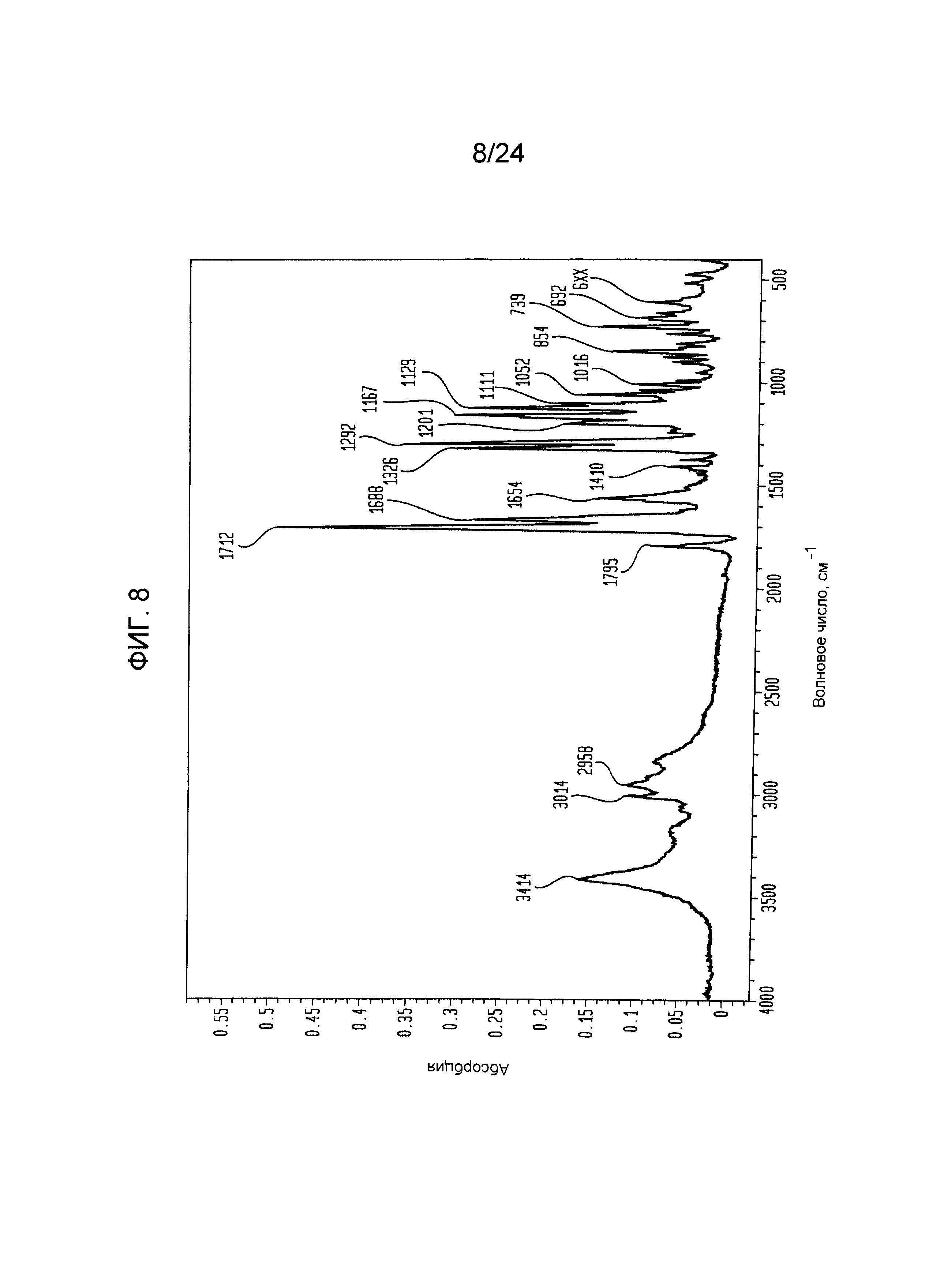
[000028] На фиг.7 изображено преобразование Фурье инфракрасной области спектра (FTIR) формы I.
[000029] На фиг.8 изображено преобразование Фурье инфракрасной области спектра (FTIR) формы III.
[000030] На фиг.9 изображено преобразование Фурье инфракрасной области спектра (FTIR) формы V.
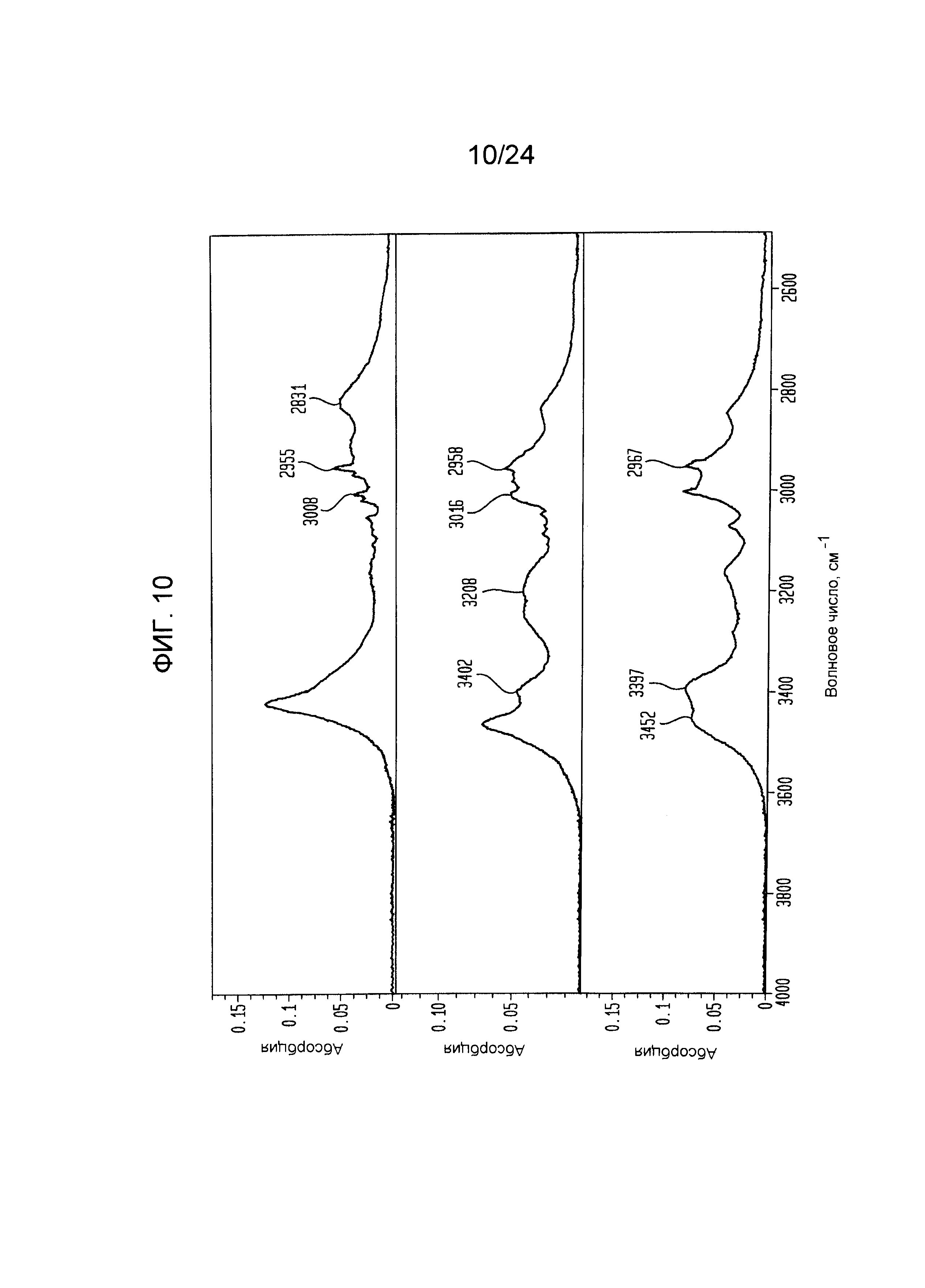
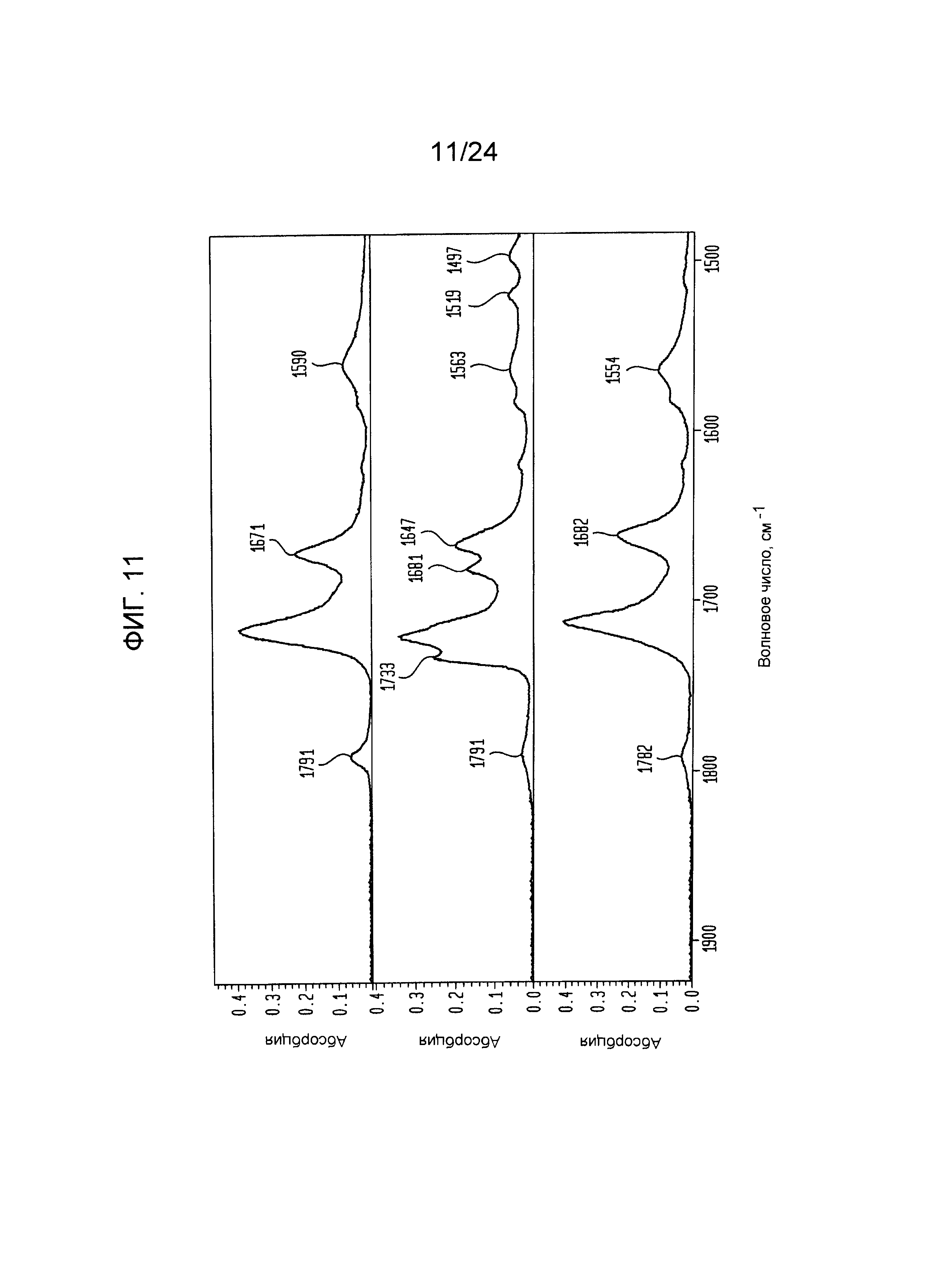
[000031] На фиг.10, 11, 12 и 13 изображен увеличенный вид FTIR спектра формы I (верхняя панель), формы V (средняя панель) и формы III (нижняя панель).
[000032] На фиг.14 изображена картина XRPD микронизированной (верхняя картина) и немикронизированной (нижняя картина) формы I.
[000033] На фиг.15 изображена картина XRPD микронизированной (верхняя картина) и немикронизированной (средняя и нижняя картины из 2 различных образцов) формы III.
[000034] На фиг.16 изображено влияние размера частиц на растворение 200 мг капсул ST-246 формы I с 3% HDTMA (гексадецилтриметиламмоний), где условия растворения являются следующими: 900 мл, 0,05М фосфатный буфер, рН 7,5, аппарат USP 2 при скорости 75 об/мин, при температуре 37°C, и капсула сделана из активных фармацевтических ингредиентов (API) формы I, с размером частиц D90, равным приблизительно 5,5 микрон.
[000035] На фиг.17 изображено влияние размера частиц на растворение 200 мг капсул ST-246 формы I с 3% HDTMA, где условия растворения являются следующими: 900 мл, 0,05М фосфатный буфер, рН 7,5, аппарат USP 2 при скорости 75 об/мин, при температуре 37°C, и капсула сделана из активных фармацевтических ингредиентов (API) формы I, с размером частиц D90, равным приблизительно 16,73 микрон.
[000036] На фиг.18 изображено влияние размера частиц на растворение 200 мг капсул ST-246 формы I с 3% HDTMA, где условия растворения являются следующими: 900 мл, 0,05М фосфатный буфер, рН 7,5, аппарат USP 2 при скорости 75 об/мин, при температуре 37°C, и капсула сделана из активных фармацевтических ингредиентов (API) формы I, с размером частиц D90, равным приблизительно 26,55 микрон.
[000037] На фиг.19 изображено влияние размера частиц на растворение 200 мг капсул ST-246 формы I с 3% HDTMA, где условия растворения являются следующими: 900 мл, 0,05М фосфатный буфер, рН 7,5, аппарат USP 2 при скорости 75 об/мин, при температуре 37°C, и капсула сделана из активных фармацевтических ингредиентов (API) формы I, с размером частиц D90, равным приблизительно 75 микрон.
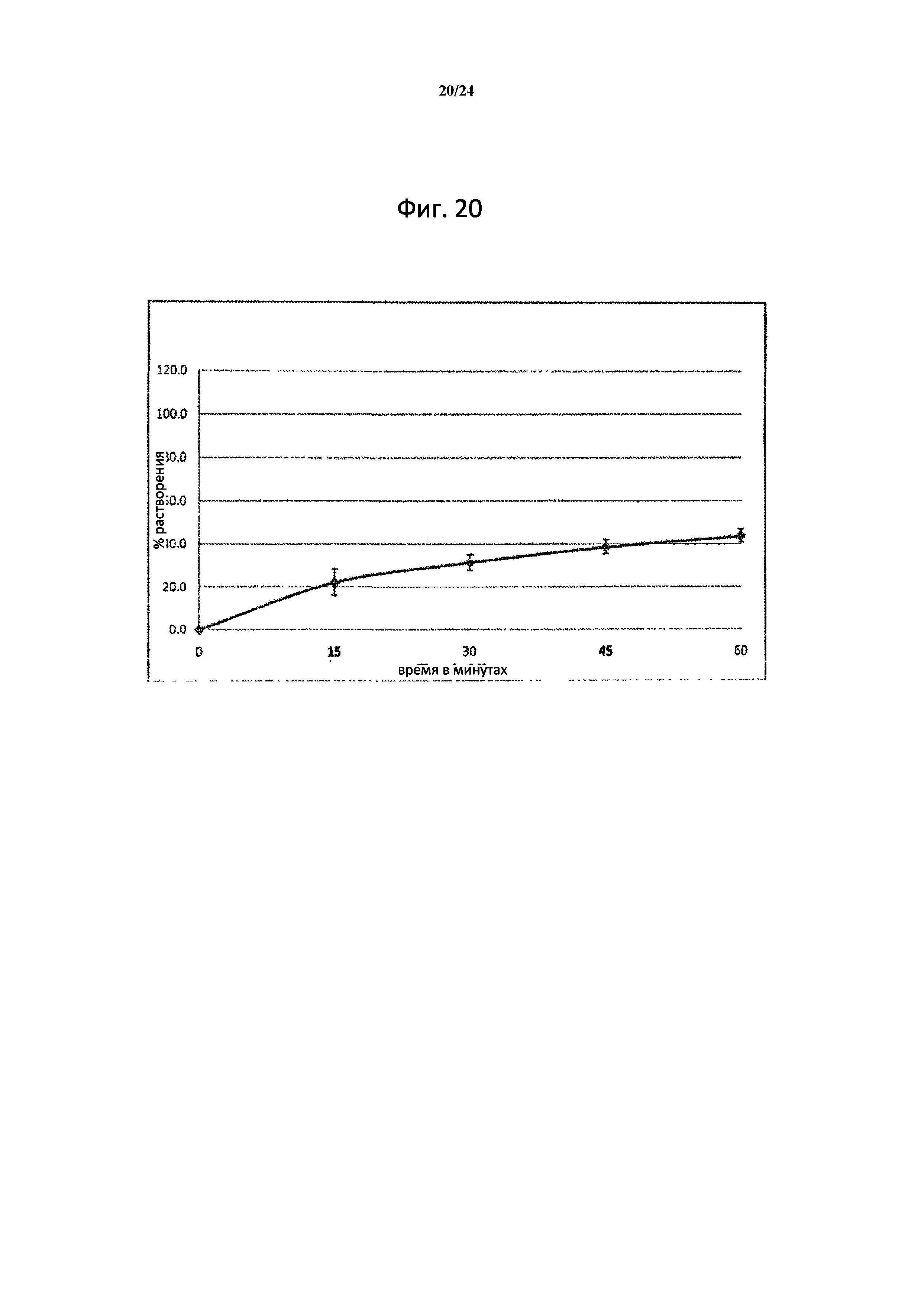
[000038] На фиг.20 изображено влияние размера частиц на растворение 200 мг капсул ST-246 формы I с 3% HDTMA, где условия растворения являются следующими: 900 мл, 0,05М фосфатный буфер, рН 7,5, аппарат USP 2 при скорости 75 об/мин, при температуре 37°C, и капсула сделана из API формы I, с размером частиц D90, равным приблизительно 254 микрон.
[000039] На фиг.21 изображен профиль растворения формы I.
[000040] На фиг.22 изображен профиль растворения формы III.
[000041] На фиг.23 изображен профиль растворения формы V.
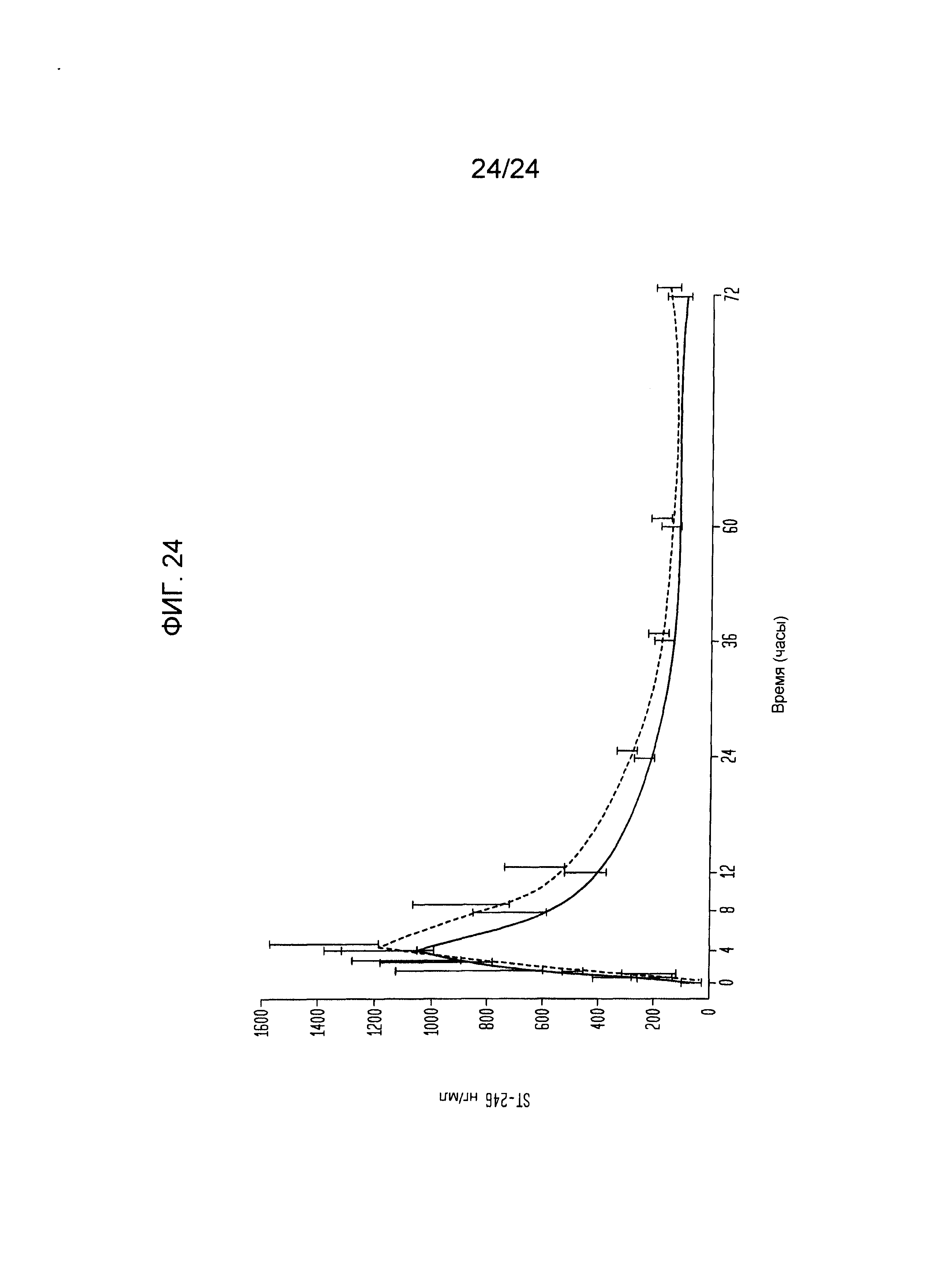
[000042] На фиг.24 изображена средняя (СО) концентрация в плазме ST-246 с течением времени (популяционный анализ фармакокинетики ФК) после единственного перорального введения.
Подробное описание изобретения
Определения
[000043] В соответствии с подробным описанием, применяются следующие сокращения и определения. Следует отметить, что как используется в данном описании, формы единственного числа включают множественное число обозначенного объекта, если контекст явно не диктует иное.
[000044] Термин “полиморфная форма, полиморф, полиморф формы, кристаллическая форма, физическая форма или кристаллический полиморф” соединения ST-246 в настоящем изобретении относится к кристаллической модификации ST-246, которая может быть охарактеризована с помощью аналитических способов, таких как рентгеновская порошковая дифракция (XRPD), дифференциальная сканирующая калориметрия (ДСК), при помощи анализа его точки плавления или инфракрасной спектроскопии (FTIR).
[000045] Термин "гидрат", используемый в данном описании, означает соединение по изобретению или его соль, которое дополнительно включает стехиометрическое или нестехиометрическое количество воды, нековалентно связанной межмолекулярными силами. Гидраты образуются путем комбинации одной или нескольких молекул воды с одной молекулой вещества, в которой вода сохраняет свое молекулярное состояние как H2O, и такая комбинация обладает способностью образовывать один или более гидратов. Термин "полугидрат", используемый в данном описании, относится к твердому веществу с 0,5 молекулы H2O на молекулу вещества.
[000046] Термин "фармацевтическая композиция" или "фармацевтический состав" предназначен для охвата лекарственного средства, включая активный ингредиент(ы), фармацевтически приемлемые эксципиенты, которые составляют носитель, а также любой продукт, который образуется, прямо или косвенно, из комбинации, комплексообразования или агрегации любых двух или более ингредиентов. Соответственно, фармацевтические композиции по настоящему изобретению охватывают любые композиции, полученные путем смешивания активного ингредиента, дисперсии или композита активного ингредиента, дополнительного активного ингредиента(ов) и фармацевтически приемлемых эксципиентов.
[000047] Распределение частиц по размерам (PSD) порошка или гранулированного материала, или частиц, диспергированных в жидкости, представляет собой список значений или математическую функцию, которая определяет относительные количества присутствующих частиц, отсортированных по размеру. PSD также известен как гранулометрический состав. Так как размер частиц для сложных сред представляет собой распределение по диаметрам, для того, чтобы передать результаты, могут быть использованы статистические данные. Общепринятый способ заключается в использовании значений d10, d50 и d90 в зависимости от объема распределения. То есть это означает, что 10%, 50% и 90%, соответственно, гранулометрического состава меньше, чем указанный диаметр.
[000048] Термин "единичная доза" относится к одной единице лекарственной формы, которую будут вводить пациенту. Единичная доза обычно будет сформулирована таким образом, чтобы включать количество лекарственного средства, достаточное для достижения терапевтического эффекта при однократном введении единичной дозы, хотя, когда идет речь о размере лекарственной формы, для достижения желаемого терапевтического эффекта могут быть необходимы более одной единичной дозы. Например, одна единичная доза лекарственного средства, как правило, представляет собой одну таблетку, одну капсулу или одну столовую ложку жидкости. Более одной единичной дозы может быть необходимо, чтобы ввести достаточное количество лекарственного средства для достижения терапевтического эффекта, где количество лекарственного средства вызывает физические ограничения на размер формы лекарственного средства.
[000049] Термин «период полувыведения» является фармакокинетическим термином, используемым для обозначения продолжительности времени, необходимого для выведения 50% от оставшегося количества препарата, присутствующего в организме.
[000050] Термин "AUC" (т.е. "площадь под кривой", "площадь под кривой концентрации" или "площадь под кривой концентрация-время") является фармакокинетическим термином, который используется для обозначения способа измерения биодоступности или степени всасывания лекарственного средства на основе графика проб концентрации в плазме крови индивидуума или группы индивидуумов, отобранных через определенные промежутки времени; показатель AUC является прямо пропорциональным общему количеству неизменного лекарственного средства в плазме крови пациента. Например, линейная кривая на графике AUC в сравнении с дозой (например, прямая восходящая линия) показывает, что лекарственное средство высвобождается медленно в кровоток и обеспечивает пациенту стабильное количество лекарственного средства; если AUC в сравнении с дозой представляет собой линейную зависимость, это в целом представляет собой оптимальную доставку лекарственного средства в кровоток пациента. В противоположность, нелинейная кривая AUC в сравнении с кривой дозы указывает на быстрое высвобождение лекарственного средства, так что некоторое количество лекарственного средства не поглощается, или лекарственное средство метаболизируется до поступления в кровоток.
[000051] Термин "Cmax" (т.е. "максимальная концентрация") представляет собой фармакокинетический термин, используемый для обозначения пика концентрации конкретного лекарственного средства в плазме крови пациента.
[000052] Термин "Tmax" (т.е. "время максимальной концентрации" или "время Cmax") представляет собой фармакокинетический термин, используемый для обозначения времени, в которое наблюдается Cmax в период действия после введения лекарственного средства. Как и следовало ожидать, лекарственная форма, которая будет включать компонент немедленного высвобождения, а также способный к сохранению в желудке компонент будет иметь Tmaxвыше, чем Cmax для формы немедленного высвобождения дозы, но ниже, чем Tmax для исключительно способной к сохранению в желудке лекарственной формы.
[000053] В настоящее время неожиданно обнаружили, что ST-246 существует в различных кристаллических формах, названных форма I, форма II, форма III, форма IV, форма V и форма VI.
[000054] Все формы были полностью охарактеризованы, и были собраны данные сопоставимости. Все формы характеризуются, как описано ниже в числе прочего при помощи следующей методологии:
ФИЗИЧЕСКАЯ ЭКСПЕРИМЕНТАЛЬНАЯ МЕТОДОЛОГИЯ
РЕНТГЕНОВСКАЯ ПОРОШКОВАЯ ДИФРАКЦИЯ (XRPD)
[000055] Картины дифракции регистрируют, используя дифрактометр Bruker D8 Discovery, скомпанованный со столиком XYZ, лазерным видеомикроскопом для позиционирования и двухмерным детектором HiStar. Периоды времени регистрации номинально составляли 60 секунд. Для облучения образцов использовали Cu Ka излучающую 1,5406 трубку, работающую при напряжении 40 кВ и силе тока 40 мА. Рентгеновская оптика состоит из зеркала Гебеля в сочетании с отверстием коллиматора 0,5 мм. Применяли тета-тета непрерывное сканирование с расстоянием образец-детектор, равным 15 см, что дает эффективный диапазон 2θ в пределах 4-40°. Образцы устанавливали в низкофоновые кварцевые пластины. Использовали нагревательный столик с изменяемой температурой для манипулирования температурой образца для некоторых экспериментов.
[000056] Полиморфные модификации соединения ST-246 характеризуются картинами рентгеновской порошковой дифракции (XRPD) и/или их пиками Раман-спектроскопии. Что касается рентгеновской порошковой дифракции, относительная интенсивность пиков рентгеновской порошковой дифракции данной полиморфной модификации может варьироваться в зависимости от размера кристалла полиморфной модификации, используемой для определения образца. Это представляет собой феномен предпочтительной ориентации. Предпочтительная ориентация обусловлена морфологией кристаллов. В этом случае, анализ XRPD может быть осуществлен с образцом, вращающимся в держателе образца во время XRPD анализа, чтобы уменьшить эффекты предпочтительной ориентации. Для XRPD анализа, образец дается в условиях измерения углов пиков в "градусах 2θ (два тета)".
[000057] В отношении процентного значения относительной интенсивности (I/Io), значение Io представляет значение максимального пика, определенного при помощи XRPD для образца для всех углов "2θ градусов", и значение I представляет значение интенсивности пика, измеренного при данном "угле 2θ градусов"
[000058] Угол "2θ градусов" представляет собой дифракционный угол, который является углом между падающими рентгеновскими лучами и дифрагированными рентгеновскими лучами. Значения относительной интенсивности для данного пика, выраженные в процентах, и углы "2θ градусов" рассчитываются. Тем не менее, в картинах рентгеновской порошковой дифракции есть ключевые основные пики при заданных углах, которые являются уникальными для каждой данной полиморфной модификации формы. Эти пики присутствуют в картинах XRPD каждой из форм полиморфа, имеющего размер кристалла приблизительно 10-40 микрон. Любые из этих основных пиков, либо самостоятельно, либо в любой характерной комбинации, являются достаточными, чтобы отличить одну из форм полиморфа от других существующих полиморфных форм.
ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ (FTIR)
[000059] Инфракрасные спектры получали на инфракрасном спектрометре с преобразованием Фурье Nicolet 510 M-O, оснащенном устройством нарушенного полного внутреннего отражения Harrick Splitpea™. Спектры были получены от 4000-400 см-1 с разрешением 4 см-1, и для каждого анализа было собрано 128 сканов.
ПОЛУЧЕНИЕ КРИСТАЛЛИЧЕСКИХ ФОРМ
[000060] Настоящее изобретение предоставляет способ получения полиморфной формы I соединения ST-246, включающий следующие стадии:
a) растворение ST-246 по меньшей мере в одном органическом растворителе и некотором количестве воды для приготовления раствора;
b) охлаждение указанного раствора до температуры, которая вызывает преимущественную кристаллизацию указанной полиморфной формы I соединения ST-246; и
c) необязательно сушку образованных кристаллов ST-246,
где указанный органический растворитель выбран из группы, состоящей из изопропилового спирта (ИПС), этилацетата, этанола, метанола, ацетона, изопропилацетата и тетрагидрофурана (ТГФ).
[000061] Предпочтительно, способ дополнительно включает добавление затравочных кристаллов полиморфной формы I соединения ST-246 во время стадии (b). Также предпочтительно, стадия охлаждения происходит в течение по меньшей мере 15 минут, более предпочтительно в течение по меньшей мере 2 часов и наиболее предпочтительно в течение по меньшей мере 5 часов.
[000062] Также предпочтительно, органический растворитель представляет собой этилацетат, и содержание воды составляет приблизительно 40% по объему от общего объема растворителя, более предпочтительно приблизительно 5% по объему от общего объема растворителя, более предпочтительно приблизительно 3% по объему от общего объема растворителя и наиболее предпочтительно приблизительно 2% по объему от общего объема растворителя. Также предпочтительно, органический растворитель представляет собой изопропиловый спирт, и содержание воды составляет приблизительно 5% по объему от общего объема растворителя.
[000063] Настоящее изобретение также предоставляет способ получения кристаллов полиморфной формы II соединения ST-246, включающий следующие стадии:
a) растворение ST-246 по меньшей мере в одном растворителе для приготовления раствора;
b) охлаждение указанного раствора до температуры, которая вызывает преимущественную кристаллизацию указанной полиморфной формы II соединения ST-246; и
c) необязательно сушку образованных кристаллов ST-246,
где указанный растворитель выбран из группы, состоящей из этилацетата, хлороформа, 1-пропанола, изопропилового спирта (ИПС), этанола, ацетона, ацетонитрила, толуола, изопропилацетата и диметилформамида (ДМФ).
[000064] Предпочтительно, способ дополнительно включает добавление затравочных кристаллов полиморфной формы II соединения ST-246 во время стадии (b). Также предпочтительно, растворитель не содержит воду и выбран из группы, состоящей из этилацетата и хлороформа.
[000065] Настоящее изобретение дополнительно предоставляет способ получения кристаллов полиморфной формы II соединения ST-246, включающий следующие стадии:
a) растворение ST-246 в этаноле и воде для приготовления раствора;
b) охлаждение указанного раствора до температуры, которая вызывает преимущественную кристаллизацию указанной полиморфной формы II соединения ST-246; и
c) необязательно сушку образованных кристаллов ST-246.
[000066] Предпочтительно, способ дополнительно включает добавление затравочных кристаллов полиморфной формы II соединения ST-246 во время стадии (b). Также предпочтительно, объемное соотношение этанол:вода составляет приблизительно 1:1.
[000067] Настоящее изобретение также предоставляет способ получения кристаллов полиморфной формы III соединения ST-246, включающий следующие стадии:
a) растворение ST-246 по меньшей мере в одном органическом растворителе и воде для приготовления раствора;
b) охлаждение указанного раствора до температуры, которая вызывает преимущественную кристаллизацию указанной полиморфной формы III соединения ST-246; и
c) необязательно сушку образованных кристаллов ST-246,
где органический растворитель выбран из группы, состоящей из изопропилового спирта (ИПС), этилацетата и этанола.
[000068] Предпочтительно, способ дополнительно включает добавление затравочных кристаллов полиморфной формы III соединения ST-246 во время стадии (b). Также предпочтительно, стадия охлаждения происходит в течение менее чем 15 минут.
[000069] Настоящее изобретение дополнительно предоставляет способ получения кристаллов полиморфной формы III соединения ST-246, включающий следующие стадии:
a) растворение ST-246 по меньшей мере в одном органическом растворителе для приготовления раствора;
b) охлаждение указанного раствора до температуры, которая вызывает преимущественную кристаллизацию указанной полиморфной формы III соединения ST-246; и
c) необязательно сушку образованных кристаллов ST-246,
где органический растворитель выбран из группы, состоящей из ацетона, изопропилового спирта (ИПС), диметиламина (ДМА), пиридина, трифторэтанола (ТФЭ), метанола, этанола, хлороформа, ацетонитрила (АЦН) и тетрагидрофурана (ТГФ).
[000070] Предпочтительно, способ дополнительно включает добавление затравочных кристаллов полиморфной формы III соединения ST-246 во время стадии (b).
[000071] Настоящее изобретение также предоставляет способ получения кристаллов полиморфной формы IV соединения ST-246, включающий следующие стадии:
a) растворение ST-246 по меньшей мере в одном органическом растворителе, необязательно содержащем воду, для приготовления раствора;
b) охлаждение указанного раствора до температуры, которая вызывает преимущественную кристаллизацию указанной полиморфной формы IV соединения ST-246, осажденную в кристаллической форме ST-246; и
c) необязательно сушку образованных кристаллов ST-246,
где указанный растворитель выбран из группы, состоящей из: смеси ацетонитрила и этилацетата, смеси этанола и толуола, смеси воды и этилацетата, и смеси трифторэтанола и ТГФ.
[000072] Предпочтительно, способ дополнительно включает добавление затравочных кристаллов полиморфной формы IV соединения ST-246 во время стадии (b). Также предпочтительно, растворитель представляет собой смесь АЦН и этилацетата в объемном соотношении, равном приблизительно 1:4, смесь этанола и толуола в объемном соотношении, равном приблизительно 1:4, смесь воды и этилацетата в объемном соотношении, равном приблизительно 1:4, и смесь ТФЭ и ТГФ в объемном соотношении, равном приблизительно 1:1.
[000073] Настоящее изобретение дополнительно предоставляет способ получения кристаллов полиморфной формы IV соединения ST-246, включающий следующие стадии:
a) растворение ST-246 по меньшей мере в одном растворителе для приготовления раствора;
b) охлаждение указанного раствора до температуры, которая вызывает преимущественную кристаллизацию указанной полиморфной формы IV соединения ST-246; и
c) необязательно сушку образованных кристаллов ST-246,
где указанный растворитель выбран из группы, состоящей из 1-бутанола, трифторэтанола (ТФЭ), хлороформа, дихлорметана и толуола.
[000074] Предпочтительно, способ дополнительно включает добавление затравочных кристаллов полиморфной формы IV соединения ST-246 во время стадии (b). Также предпочтительно растворитель не содержит воду. Также предпочтительно растворитель представляет собой 1-бутанол.
[000075] Настоящее изобретение также предоставляет способ получения кристаллов полиморфной формы VI соединения ST-246, включающий следующие стадии:
a) растворение ST-246 по меньшей мере в одном растворителе для приготовления раствора;
b) охлаждение указанного раствора до температуры, которая вызывает преимущественную кристаллизацию указанной полиморфной формы VI соединения ST-246; и
c) необязательно сушку образованных кристаллов ST-246,
где указанный растворитель выбран из группы, состоящей из нитрометана, метанола и хлороформа.
[000076] Предпочтительно, способ дополнительно включает добавление затравочных кристаллов полиморфной формы VI соединения ST-246 во время стадии (b). Также предпочтительно, растворитель не содержит воду и является нитрометаном.
[000077] Соединение ST-246 получают, как указано в приведенных ниже примерах. Процессы кристаллизации полиморфных модификаций ST-246 могут охватывать несколько комбинаций способов и их вариаций. Кристаллизация полиморфов ST-246 может быть выполнена путем растворения, диспергирования или суспендирования ST-246 при подходящей температуре в растворителе таким образом, что часть указанного выше растворителя выпаривается, увеличивая концентрацию ST-246 в указанном растворе, дисперсии или суспензии, охлаждения указанной смеси и необязательно промывания и/или фильтрации и сушки полученных кристаллов ST-246.
[000078] Образование кристаллов может также включать более одного процесса кристаллизации. В некоторых случаях, один, два или несколько дополнительных шагов кристаллизации могут быть выполнены преимущественно по разным причинам, например, для того, чтобы улучшить качество получаемой кристаллической формы. Например, полиморфы настоящего изобретения могут быть также получены путем добавления растворителя к начальному исходному основному материалу ST-246, перемешивания раствора при постоянной температуре до полного растворения веществ, концентрирования раствора путем вакуумной перегонки и охлаждения. Проводят первую кристаллизацию, и образовавшиеся кристаллы должны быть промыты растворителем, с последующей солюбилизацией ST-246 с тем же или другим растворителем, чтобы образовать желаемую полиморфную модификацию. Реакционная смесь может быть нагрета до температуры кипения с обратным холодильником и затем подвергнута перекристаллизации, с последующей стадией охлаждения после кипячения с обратным холодильником. Образованный полиморф может быть необязательно профильтрован и ему дают возможность высохнуть.
[000079] При помощи растворения, диспергирования или суспендирования ST-246 в растворителе можно получить различные степени дисперсии, такие как суспензии, жидкие кашицы или смеси, или предпочтительно получить гомогенные однофазные растворы. Термин "суспензия" относится к двухфазной системе, состоящей из тонко измельченного твердого вещества, т.е. ST-246 в аморфной, кристаллической форме или их смесей, диспергированных (взвешенных) в жидкой или дисперсионной среде, как правило, в растворителе. Термин "жидкая кашица" относится к суспензии, образованной, когда количество порошка смешивается с жидкостью, в которой твердое вещество является только слегка растворимым (или не растворимым). "Суспендирование" относится к изготовлению суспензии (жидкой кашицы).
[000080] Необязательно, среда растворителя может содержать добавки, например, диспергирующие вещества, поверхностно-активные вещества или другие добавки, или их смеси такого типа, который обычно используют в приготовлении кристаллических суспензий. Добавки могут быть с успехом использованы в модификации формы кристалла за счет увеличения мягкости и уменьшения площади поверхности.
[000081] Среду растворителя, содержащую твердое вещество, можно необязательно перемешивать в течение определенного периода времени или энергично взбалтывать, используя, например, смеситель с высоким сдвигом или гомогенизатор, или их комбинацию, для получения желаемого размера частиц органического соединения. Контроль температуры осаждения и затравливания может быть дополнительно использован для улучшения воспроизводимости процесса кристаллизации, гранулометрического состава и лекарственной формы продукта. Таким образом, кристаллизация может быть осуществлена без затравливания кристаллами ST-246 или предпочтительно в присутствии кристаллов ST-246, которые вводят в раствор при помощи затравливания. Затравливание может быть также осуществлено несколько раз при различных температурах. Количество затравочного материала зависит от масштаба эксперимента и может быть легко определено специалистом в данной области техники. Как правило, количество затравочного материала составляет приблизительно от 0,1 до 1% по массе от количества кристаллического материала, ожидаемого от реакции.
[000082] Время кристаллизации на каждой стадии кристаллизации будет зависеть от применяемых условий, используемых способов и/или растворителей. Дробление крупных частиц или агрегатов частиц после кристаллического преобразования может быть дополнительно выполнено для того, чтобы получить желаемый и однородный размер частиц. Соответственно, кристаллы, скопления порошка и крупный порошок полиморфных форм соединения ST-246 могут быть необязательно измельчены и отсортированы по размеру после проведения конверсии. Дробление или перемалывание относится к физическому разрушению крупных частиц или агрегатов частиц с использованием способов и аппаратов, хорошо известных в данной области техники, для уменьшения размера частиц порошков. Полученные в результате размеры частиц могут варьироваться от миллиметров до нанометров, предоставляя, например, нанокристаллы, микрокристаллы. Предпочтительным устройством для измельчения или помола является струйная мельница, или микронайзер, из-за его способности производить частицы малого размера в пределах узкого диапазона гранулометрического состава.
[000083] Изобретение обеспечивает также процесс, в котором полученную кристаллическую форму выделяют путем фильтрования или центрифугирования, необязательно в сочетании с промыванием и сушкой. В качестве исходного материала, используемого для процессов настоящего изобретения, может служить любая кристаллическая или аморфная форма ST-246, включая его гидрат.
[000084] В одном аспекте изобретения растворители, используемые в получении кристаллических форм настоящего изобретения, являются фармацевтически приемлемыми или фармацевтически неприемлемыми растворителями. Фармацевтически неприемлемые растворители должны быть удалены перед использованием полиморфа в фармацевтическом средстве.
[000085] Способы получения полиморфных форм настоящего изобретения обычно включают получение кристаллического твердого материала из раствора или дисперсии ST-246 в среде растворителя, или из суспензии ST-246, который может находиться изначально в аморфной или кристаллической форме. Условия, касающиеся кристаллизации, могут быть модифицированы в целях улучшения процесса кристаллизации или для того, чтобы индуцировать осаждение, но, не влияя на форму полученного полиморфа. Эти условия включают приведение раствора, дисперсии или суспензии ST-246 и растворителя(ей) к требуемой концентрации, его охлаждение, следуя определенной кривой охлаждение/температура, добавление затравочных кристаллов, приведение указанного раствора, дисперсии или суспензии к требуемой температуре с применением любого подходящего давления, удаление и/или отделение любого нежелательного материала или примесей, сушку образовавшихся кристаллов для получения полиморфов в твердом состоянии, если такое состояние является желаемым.
[000086] Одним из способов, вызывающих осаждение, является снижение растворимости ST-246. Растворимость соединения может быть уменьшена, например, путем охлаждения раствора. Растворимость ST-246 может быть уменьшена путем добавления анти-растворителя. Приведение раствора, дисперсии или суспензии ST-246 и растворителей к требуемой концентрации необязательно означает увеличение концентрации ST-246. В некоторых случаях, снижение или отсутствие изменений в концентрации ST-246 может быть предпочтительным. Способы, используемые для получения желаемой концентрации, включают, например, выпаривание посредством атмосферной перегонки, вакуумную перегонку, фракционированную перегонку, азеотропную перегонку, напыление пленок, нагревание, охлаждение, другие способы, хорошо известные в данной области техники, и их комбинации. Необязательный способ получения желаемой концентрации может также включать насыщение раствора ST-246 и растворителя, например, путем добавления достаточного объема осадителя к раствору для достижения точки насыщения.
[000087] Другие подходящие способы насыщения раствора включают в качестве примера введение дополнительного ST-246 в раствор и/или выпаривание части растворителя из раствора. Как указано в настоящем описании, насыщенный раствор включает растворы в их точках насыщения или превышающие их точки насыщения, то есть перенасыщенные. Почти насыщенный раствор относится к растворам, которые находятся вблизи насыщения, но еще не достигли своего предела насыщения растворимости.
[000088] В предпочтительном аспекте изобретения растворитель для кристаллизации является важным фактором в определении того, какой ST-246 полиморф образуется. Содержание воды также имеет важное значение, так как различные полиморфные формы имеют различные уровни гидратации. В смесях воды и смешивающихся с водой растворителей, количество воды может варьироваться приблизительно от 0,1% по объему до приблизительно 95% по объему, предпочтительно приблизительно от 10% до приблизительно 20% по объему, более предпочтительно приблизительно от 5% до приблизительно 10 % по объему и наиболее предпочтительно приблизительно от 5% до приблизительно 1% воды.
[000089] Полиморфные формы I и III соединения ST-246 являются моногидратами, и, следовательно, существует минимальный порог воды, которая должна присутствовать для того, чтобы кристаллизовать ST-246 в виде моногидрата. Кроме того, скорость охлаждения и температура выделения и количество воды может играть роль в определении того, какая полиморфная форма и/или гидрат ST-246 образуется. Как показано в таблице 1 ниже, существует корреляция между скоростью охлаждения температуры выделения, содержанием воды и генерацией формы I соединения ST-246 или формы III соединения ST-246. Кроме того, данные, приведенные в таблице 1, показывают, что композиция растворителя, температура кристаллизации или скорость охлаждения могут оказать влияние на образование полиморфной формы соединения ST-246. Например, как показано в таблице 1, когда и изопропиловый спирт (ИПС), и этилацетат используются в качестве основного растворителя, форма III соединения ST-246 образуется, когда теплый, приблизительно от 35°С до приблизительно 40°C, раствор, включающий более высокое содержание воды, охлаждают непосредственно на ледяной бане. В противоположность этому, в присутствии более низкого содержания воды или когда растворы были охлаждены до комнатной температуры для выделения, получают форму I соединения ST-246. Полиморфная форма материала до окончательной кристаллизации не влияет на окончательную форму полиморфа до тех пор, пока материал полностью растворяется в растворителе для кристаллизации.
[000090] Удаление и/или отделение любого нежелательного материала или примесей может быть выполнено при помощи очищения, фильтрации, промывания, осаждения или аналогичными способами. Отделение, например, может быть проведено посредством известных способов разделения твердого вещества и жидкости. Фильтрация может быть выполнена, среди прочих способов, путем пропускания раствора, дисперсии или суспензии через фильтровальную бумагу, фильтр из пористого стекла или из другого материала мембраны, путем центрифугирования или с использованием фильтра Бюхнера, фильтра или пластин Розенмунда или фильтр-пресса. Предпочтительно, проходная фильтрация или фильтрация безопасности может быть преимущественно добавлена к процессам, описанным выше, в целях повышения полиморфной чистоты полученной кристаллической формы.
[000091] Полученные кристаллы также могут быть высушены, и такой процесс сушки необязательно может быть использован в различных прохождениях кристаллизации, если применяют более чем одно прохождение кристаллизации. Процедуры сушки включают все способы, известные специалистам в данной области техники, такие как нагревание, применение вакуума, циркулирующего воздуха или газа, добавление десиканта, сублимационную сушку, распылительную сушку, выпаривание и т.п., или любую их комбинацию.
ФОРМА I
[000092] В одном аспекте изобретения кристаллическая форма соединения ST-246 раскрыта и названа как форма I соединения ST-246, или сокращенно “форма I”.
[000093] Одним из предпочтительных параметров надежной кристаллизации формы I является использование смесей этилацетат/вода. Некоторые параметры в процессе исследования кристаллизации со смесью этилацетат/вода изменялись (количество добавленной воды, температура растворения, температура выделения, скорость охлаждения) и суммированы в таблицах 1 и 2. форма I может быть получена с использованием смеси этилацетат/вода, при условии присутствия достаточного количества воды, чтобы позволить формирование моногидрата. Кроме того, было показано, что форма I образуется с использованием смесей ТГФ/вода, смесей ИПС/вода; и как ацетон, так и метанол продемонстрировали способность кристаллизовать форму I с более высокими уровнями воды. Кроме того, форма I также может быть получена путем выдерживания водной суспензии форм III и V в течение нескольких дней или дольше.
[000094] Форма I представляет собой моногидрат кристаллической формы соединения ST-246. Примеры рентгеновской дифракции (XRPD), данные для формы I суммированы на фиг.1 и показаны ниже:
[000095] Характеристический инфракрасный спектр формы I описан ниже и обобщен на фиг.7.
Область от 4000 до 400 см-1
[000096] Форма I имеет один большой пик при 3421 см-1, а также имеет широкую абсорбцию, лежащую в основе этих пиков, примерно от 3300 до 2600 см-1. Существуют также два пика при 3008 и 2956 см-1, что, вероятно, связано с C-H растяжением. Форма I имеет пики при 1791, 1717 и 1671 см-1. Все три формы имеют пик примерно при 1560 см-1.
[000097] Форма I соединения ST-246 является желательным полиморфом ST-246. Похоже, что она является термодинамически наиболее стабильной формой, так как все остальные преобразуются в форму I.
[000098] Форма I соединения ST-246 является стабильной и, следовательно, может храниться в условиях окружающей среды. Форма I не продемонстрировала преобразование в другую полиморфную форму в некоторых технологических условиях и условиях окружающей среды, которые лекарственное средство может испытывать на различных стадиях производства и хранения. Некоторые из протестированных условий включают хранение при высокой температуре и высокой влажности, комнатной температуре и высокой влажности, низкой влажности, температуре до 60°C, производстве капсул с использованием влажной грануляции и сушки, во время процесса измельчения или микронизации, в суспензии, при длительном хранении при комнатной температуре. Кроме того, форма I не является гигроскопичной и, следовательно, не абсорбирует влагу даже в условиях 90% относительной влажности. Форма I надежно производится при помощи коммерческого способа кристаллизации с более чем 99,0% чистоты и не более 0,15% примесей.
ФОРМА II
[000099] В другом аспекте изобретения кристаллическая форма соединения ST-246 раскрыта и названа как форма II соединения ST-246, или сокращенно “форма II”.
[0000100] Форма II соединения ST-246 была получена в присутствии некоторых спиртов, а также смесей ацетона/ИПС. В предпочтительном аспекте изобретения форма II надежно кристаллизуется в присутствии этилацетата или хлороформа. Безводная форма II является относительно нестабильной и склонной к преобразованию в форму III за счет абсорбции влаги.
[0000101] Форма II представляет собой безводную кристаллическую форму ST-246. Примеры рентгеновской дифракции (XRPD) суммированы на фиг.2.
ФОРМА III
[0000102] В другом аспекте изобретение относится к кристаллической форме соединения ST-246, которая названа как форма III соединения ST-246, или сокращенно “форма III”.
[0000103] Как указано в таблицах 1 и 2, смеси ИПС/вода при различных уровнях воды имеют тенденцию давать форму III. Кроме того, форма III может быть получена из водной суспензии формы V. На основании данных, приведенных в таблице 1, более быстрая скорость охлаждения и более низкая температура выделения могут иметь тенденцию давать форму III.
[0000104] Форма III представляет собой моногидрат кристаллической формы ST-246. Примеры монокристаллической рентгеновской дифракции (XRPD), данные для формы III показаны на фиг.3 и суммированы ниже:
[0000105] Характеристический инфракрасный спектр формы III описан ниже и обобщен на фиг.8.
Область от 4000 до 2500 см-1
[0000106] Форма III имеет расщепленный пик при 3452 и 3397 см-1. Существует также пик при ~3008 и 2956 см-1, что, вероятно, связано с C-H растяжением. Существуют также пики приблизительно от 3300 до 2600 см-1.
Область от 2000 до 1500 см-1
[0000107] Форма III имеет множество пиков при 1792, 1713 и 1662 см-1. Все из них, вероятно, связаны с C=O растяжениями. Существует также пик при 1560 см-1, предположительно объясняемый N-H деформацией.
Область от 1500 до 400 см-1
[0000108] Приблизительно от 1500 до 400 см-1 существует множество менее значимых пиков.
[0000109] Форма III (моногидрат) может быть преобразована в форму I в конкурентных экспериментах с применением суспензии. Преобразование из формы I в форму III никогда не наблюдалось, что свидетельствует о том, что форма I является термодинамически более стабильной формой, чем форма III. Тем не менее, форма III имеет преимущество перед другими, менее гидратированными формами, такими как, например, форма V, в которой форма III является полностью гидратированной и не впитывает какого-либо дальнейшего количества влаги во влажных условиях хранения.
ФОРМА IV
[0000110] Примеры XRPD, данные монокристаллической рентгеновской дифракции для формы IV показаны на фиг.4.
[0000111] В предпочтительном аспекте изобретения форма IV образуется в присутствии хлорированных растворителей и некоторых спиртов, таких как, например, ТФЭ, 1-бутанол, толуол, метиленхлорид, хлороформ и другие. Безводная форма IV является относительно нестабильной и склонной к преобразованию в форму V за счет абсорбции влаги.
ФОРМА V
[0000112] В еще одном аспекте изобретение относится к кристаллической форме соединения ST-246, которая названа как форма V соединения ST-246, или сокращенно "форма V".
[0000113] Форма V представляет собой полугидрат кристаллической формы ST-246. Примеры данных XRPD для формы V приведены ниже и суммированы на фиг.5.
[0000114] Инфракрасный спектр формы V также был обобщен на фиг.9 и описан ниже. Подчеркнутые пики считаются наиболее характерными для полиморфной модификации.
Область от 4000 до 2500 см-1
[0000115] Форма V имеет расщепленный пик при 3464 и 3402 см-1 вместе со вторым широким расщепленным пиком при 3238 и 3206 см-1. Эти пики, вероятно, связаны с OH и NH растяжениями и, кажется, позволяют дифференцировать три формы. Форма V также имеет пики при ~3008 и 2956 см-1, что, вероятно, связано с C-H растяжением. Существуют и другие пики приблизительно при 3300-2600 см-1.
Область от 2000 до 1500 см-1
[0000116] Форма V имеет существенно отличающиеся спектральные характеристики в этой области по сравнению с другими полиморфными формами соединения ST-246, демонстрируя 5 пиков, а не 3, и это при 1791, 1733, 1721, 1681 и 1667 см-1. Все из них, вероятно, связаны с C=O растяжениями. Все три формы имеют пик приблизительно при 1560 см-1, предположительно объясняемый N-H деформацией. Форма V имеет пики при 1519 и 1497 см-1.
Область от 1500 до 400 см-1
[0000117] Приблизительно от 1500 до 400 см-1 инфракрасный спектр трех форм демонстрирует только незначительные различия, и эта область, вероятно, не пригодна для дифференциации трех форм соединения ST-246, обсуждаемых в данном описании.
[0000118] Форма V (полугидрат) была сделана в начале ГМФ синтеза ST-246 и раскрыта в патентах WO 2008/130348, WO 2004/112718 и WO 2008/079159. Недостатком этой полиморфной модификации является то, что она гидратирована не полностью. Эта форма легко поглощает влагу при помещении во влажную окружающую среду и, как было показано в конкурентных экспериментах с суспензиями, преобразуется в форму I.
[0000119] Форма V имеет тенденцию образовываться, когда присутствует недостаточное количество воды, чтобы образовать форму моногидрата. Форма V образуется из смесей этилацетат/гексан, когда исходное соединение ST-246, используемое для кристаллизации, не содержит воду. Если исходное соединение ST-246 содержит достаточно воды, может быть образована форма III. Форма V также была генерирована смесями метанол/вода и ИПС/вода, с низкими уровнями содержания воды.
ФОРМА VI
[0000120] В одном аспекте изобретение относится к кристаллической форме соединения ST-246, которая названа как форма VI соединения ST-246, или сокращенно “форма VI”.
[0000121] Форма VI представляет собой моногидрат кристаллической формы ST-246. Примеры XRPD приведены на фиг.6. В предпочтительном аспекте изобретения форма VI может быть образована, например, в присутствии нитрометана или смеси хлороформ/метанол в качестве кристаллизационных растворителей.
[0000122] При получении полиморфных модификаций Форм I, II, III, IV и V, по существу свободных от других полиморфных форм, обычно используют кристаллизацию из смеси различных форм. Тем не менее, техника кристаллизации в связи с производством каждой из этих полиморфных форм, по существу свободных от других полиморфных форм, является другой и описана ниже.
[0000123] Более конкретно, настоящее изобретение обеспечивает изолированную форму I, которая является по меньшей мере приблизительно на 70% чистой (т.e. свободной от других форм), предпочтительно, по меньшей мере приблизительно на 80% чистой, предпочтительно, по меньшей мере приблизительно на 90% чистой, предпочтительно, по меньшей мере приблизительно на 95% чистой, более предпочтительно, по меньшей мере приблизительно на 99% чистой, и наиболее предпочтительно, по меньшей мере приблизительно на 99,9% чистой.
[0000124] Настоящее изобретение обеспечивает изолированную форму II, которая является по меньшей мере приблизительно на 70% чистой (т.e. свободной от других форм), предпочтительно, по меньшей мере приблизительно на 80% чистой, предпочтительно, по меньшей мере приблизительно на 90% чистой, более предпочтительно, по меньшей мере приблизительно на 99% чистой, и наиболее предпочтительно, по меньшей мере приблизительно на 99,9% чистой. Дополнительно, настоящее изобретение обеспечивает изолированную форму III, которая является по меньшей мере приблизительно на 70% чистой, предпочтительно, по меньшей мере приблизительно на 80% чистой, предпочтительно, по меньшей мере приблизительно на 90% чистой, предпочтительно, по меньшей мере приблизительно на 95% чистой, более предпочтительно, по меньшей мере приблизительно на 99% чистой, и наиболее предпочтительно, по меньшей мере приблизительно на 99,9% чистой.
[0000125] Также, настоящее изобретение обеспечивает изолированную форму IV, которая является по меньшей мере приблизительно на 70% чистой (т.е. свободной от других форм), предпочтительно, по меньшей мере приблизительно на 80% чистой, предпочтительно, по меньшей мере приблизительно на 90% чистой, предпочтительно, по меньшей мере приблизительно на 95% чистой, более предпочтительно, по меньшей мере приблизительно на 99% чистой, и наиболее предпочтительно, по меньшей мере приблизительно на 99,9% чистой.
[0000126] Дополнительно, настоящее изобретение обеспечивает изолированную форму VI, которая является по меньшей мере приблизительно на 70% чистой (т.е. свободной от других форм), предпочтительно, по меньшей мере приблизительно на 80% чистой, предпочтительно, по меньшей мере приблизительно на 90% чистой, предпочтительно, по меньшей мере приблизительно на 95% чистой, более предпочтительно, по меньшей мере приблизительно на 99% чистой, и наиболее предпочтительно, по меньшей мере приблизительно на 99,9% чистой.
[0000127] Кристаллы, скопления порошка и крупный порошок полиморфных форм соединения ST-246 могут быть необязательно измельчены и отсортированы по размеру после проведения конверсии. Дробление или перемалывание относится к физическому разрушению крупных частиц или агрегатов частиц с использованием способов и аппаратов, хорошо известных в данной области техники для уменьшения размера частиц порошков. Полученные в результате размеры частиц могут варьироваться от миллиметров до нанометров, предоставляя, например, нанокристаллы, микрокристаллы.
[0000128] Полиморфная модификация по изобретению может быть измельчена с использованием известных методик, таких как влажный помол, для получения размера частиц, подходящего для формирования таблеток и для других типов лекарственных форм. Тонкоизмельченные (в форме наночастиц) препараты полиморфной модификации изобретения могут быть получены способами, известными в данной области техники, см., например, международную патентную заявку WO 02/00196 (SmithKline Beecham).
[0000129] В одном аспекте, размер частиц каждой из полиморфных форм I-IV и VI соединения ST-246 в настоящем изобретении имеет D90 объема среднего диаметра частиц в диапазоне, равном приблизительно 0,01-200 мкм, предпочтительно приблизительно 15-50 мкм, и наиболее предпочтительно приблизительно 0,01-15 мкм. Такие частицы являются лучшими в смысле химической и физической стабильности, обладают хорошими характеристиками потока материала, улучшенным единообразием лекарственных форм и, таким образом, являются подходящими для массового изготовления и преимуществ технологии получения лекарственного средства.
КОМПОЗИЦИИ И ПРИМЕНЕНИЕ
[0000130] Композиции полиморфных форм ST-246 могут быть получены способами, известными в фармацевтической области техники. Следующие примеры (ниже) приведены с тем, чтобы специалисты в данной области техники более четко смогли понять и осуществить на практике настоящее изобретение. Они не должны рассматриваться как ограничивающие объем изобретения, а только как являющиеся иллюстративными и репрезентативными.
[0000131] Полиморфные соли настоящего изобретения могут быть введены в различных пероральных и парентеральных лекарственных формах. Пероральные лекарственные формы могут быть в виде таблеток, таблеток, покрытых оболочкой, твердых и мягких желатиновых капсул, растворов, эмульсий, сиропов или суспензий. Парентеральное введение включает внутривенное, внутримышечное, внутрикожное, подкожное, интрадуоденальное или внутрибрюшинное введение. Кроме того, соли по настоящему изобретению можно вводить трансдермальным путем (что может включать вещество, улучшающее проникновение), буккальным, назальным путями и с помощью суппозиториев.
[0000132] Для получения фармацевтических композиций из соединений настоящего изобретения, фармацевтически приемлемые носители могут быть твердыми или жидкими. Твердые формы лекарственных средств включают порошки, таблетки, пилюли, твердые и мягкие желатиновые капсулы, облатки, суппозитории и дисперсные гранулы. Твердый носитель может представлять собой одно или несколько веществ, которые также могут действовать в качестве разбавителей, ароматизаторов, смазывающих веществ, суспендирующих веществ, связующих веществ, консервантов, веществ, вызывающих распад таблеток, или инкапсулирующего материала.
[0000133] В порошках носитель представляет собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченным активным компонентом. В таблетках активный компонент смешан с носителем, обладающим требуемыми связующими свойствами в подходящих соотношениях, и спрессован до требуемой формы и размера.
[0000134] Подходящими эксципиентами для таблеток, покрытых оболочкой таблеток, и твердых желатиновых капсул являются, например, микрокристаллическая целлюлоза, лактоза, кукурузный крахмал и его производные, карбонат магния, стеарат магния, сахар, лактоза, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, тальк и жирные кислоты или их соли, например, стеариновая кислота. При желании, таблетки или капсулы могут быть с кишечнорастворимым покрытием или являться композициями с замедленным высвобождением. Подходящими эксципиентами для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы. Жидкие лекарственные формы включают растворы, суспензии, удерживаемые клизмы и эмульсии. Для парентеральных инъекций жидкие лекарственные формы могут быть сформулированы в виде раствора в воде или раствора в смеси вода/полиэтиленгликоль.
[0000135] Водные растворы, пригодные для перорального введения, могут быть получены путем растворения активного компонента в воде и добавления при желании подходящих красителей, ароматизаторов, стабилизаторов и загустителей. Водные суспензии, подходящие для перорального применения, могут быть получены путем диспергирования тонкоизмельченного активного компонента в воде совместно с вязким веществом, таким как природные или синтетические смолы, камеди, метилцеллюлоза, натрийкарбоксиметилцеллюлоза и другие хорошо известные суспендирующие средства.
[0000136] Композиции в дополнение к активному компоненту также могут содержать красители, ароматизаторы, стабилизаторы, буферы, искусственные и натуральные подсластители, диспергаторы, загустители, консерванты, увлажняющие вещества, эмульгаторы, соли для регулирования осмотического давления, маскирующие агенты, антиоксиданты и подобные.
[0000137] Соединения по настоящему изобретению можно вводить внутривенно в физиологическом растворе (например, забуференном до рН приблизительно 7,2-7,5). Обычные буферы, такие как фосфаты, бикарбонаты или цитраты, могут быть использованы в настоящей композиции.
[0000138] Также включены твердые лекарственные формы, которые предназначены для превращения непосредственно перед применением в жидкие лекарственные формы для перорального введения. Такие жидкие формы включают жидкие растворы, суспензии и эмульсии. Для получения суппозиториев подходящие эксципиенты включают природные и отвержденные масла, воски, глицериды жирных кислот, полужидкие или жидкие полиолы. Расплавленную гомогенную смесь затем выливают в формы подходящего размера, дают остыть и в результате этого затвердеть. Подходящие фармацевтические носители, эксципиенты и их композиции описаны в Remington: The Science and Practice of Pharmacy 1995, edited by E. W. Martin, Mack Publishing Company, 19th edition, Easton, Pa.
[0000139] Дозировка может варьироваться в широких пределах и, конечно, может быть скорректирована в каждом конкретном случае в соответствии с индивидуальными потребностями пациента и тяжестью состояния, подлежащего лечению. Обычно, лекарственное средство будет содержать приблизительно от 5% до приблизительно 95% активного соединения (масс/масс). Для перорального введения, суточная доза, составляющая приблизительно от 0,01 до приблизительно 100 мг/кг массы тела в сутки, должна быть подходящей для монотерапии и/или для комбинированной терапии. Предпочтительная суточная доза находится в диапазоне приблизительно от 0,1 до приблизительно 300 мг/кг массы тела, более предпочтительно, от 1 мг/кг приблизительно до 100 мг/кг массы тела и наиболее предпочтительно, от 1,0 приблизительно до 50 мг/кг массы тела в сутки.
[0000140] Как правило, лечение начинают с меньших доз, которые являются меньшими, чем оптимальная доза соединения. После этого доза увеличивается с помощью малых приращений до достижения оптимального эффекта при данных обстоятельствах. Суточная доза может быть введена в виде однократной дозы или в виде разделенных доз, как правило, от 1 до 5 доз в день.
[0000141] Фармацевтические препараты предпочтительно находятся в виде стандартных лекарственных форм. В такой форме препарат подразделяется на единичные дозы, содержащие соответствующее количество активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, упаковку, содержащую дискретные количества препарата, такие как упакованные таблетки, капсулы и порошок во флаконах или ампулах. Кроме того, стандартная лекарственная форма может представлять собой капсулу, таблетку, облатку или пастилку, или она может быть соответствующим количеством любого из вышеназванного в упакованной форме.
[0000142] Подходящие дозы могут быть легко оценены специалистом в данной области техники. Следует иметь в виду, что количество полиморфной модификации по изобретению, необходимое для применения при лечении, будет изменяться в зависимости от характера состояния, подлежащего лечению, а также возраста и состояния пациента и будет, в конечном счете, выбрана по усмотрению лечащего врача или ветеринара. Полиморфная модификация изобретения может быть использована в комбинации с другими антибактериальными лекарственными средствами, такими как пенициллин, цефалоспорин, сульфонамид или эритромицин.
[0000143] Дополнительный аспект изобретения включает комбинации, приведенные выше, которые могут быть легко представлены для применения в форме фармацевтической композиции и, соответственно, фармацевтической композиции, содержащей комбинацию, как определено выше, вместе с фармацевтически приемлемым носителем или эксципиентом. Отдельные компоненты таких комбинаций можно вводить последовательно или одновременно в отдельных или комбинированных фармацевтических композициях любым удобным путем введения.
[0000144] Когда введение является последовательным, полиморфная модификация по изобретению или второе терапевтическое средство может быть введено в первую очередь. Когда введение является одновременным, комбинация может быть введена или в той же самой, или в другой фармацевтической композиции.
[0000145] Используя пути и способы введения и количества доз, описанные выше, и лекарственные формы, описанные ниже, отдельные формы полиморфов, такие как форма I, форма II, форма III, форма IV, форма V и форма VI и смеси форм полиморфов настоящего изобретения могут быть использованы для профилактики и лечения различных заболеваний и состояний у людей. В качестве примера, но без ограничения, в случае ортопоксвирусных инфекций и сопутствующих заболеваний, это осуществляется путем введения пациенту, нуждающемуся в таком лечении, который страдает ортопоксвирусными инфекциями, композиции, содержащей одну из вышеуказанных полиморфных форм, таких как форма I, форма II, форма III, форма IV, форма V и форма VI, по существу свободных от других полиморфных форм, или смеси полиморфов, и инертного носителя или разбавителя; причем указанную выше композицию вводят в количестве, эффективном для профилактики или лечения указанной вирусной инфекции.
[0000146] Согласно настоящему изобретению, соединение ST-246, в качестве полиморфной формы, по существу свободной от других полиморфных форм, или в виде смеси полиморфных форм, вводят в количестве, эффективном для профилактики или лечения ортопоксвирусной инфекции. Любое эффективное количество такой полиморфной формы, по существу свободной от других полиморфных форм, или смесей полиморфных форм, необходимое для предотвращения или лечения таких вирусных инфекций, может быть использовано в данной композиции. Как правило, в случае пероральных лекарственных форм, применяют дозы приблизительно от 0,5 мг/кг до приблизительно 5,0 мг/кг массы тела в сутки. Однако количество полиморфной формы, такой как форма I, форма II, форма III, форма IV, форма V и форма VI, по существу свободной от других полиморфных форм, или смеси полиморфных форм, в пероральной стандартной дозе для введения будет зависеть в значительной степени от состояния вирусной инфекции, а также массы пациента и, конечно, является предметом врачебного решения. В одном аспекте изобретения форма I является предпочтительной для введения полиморфной модификацией формы соединения ST-246.
[0000147] Согласно настоящему изобретению, пероральная стандартная лекарственная форма, содержащая данную полиморфную форму, по существу свободную от других полиморфных форм, или смеси полиморфных форм, может быть предпочтительно введена в дозе приблизительно от 30 мг до 800 мг в сутки, более предпочтительно приблизительно от 50 мг до приблизительно 600 мг в сутки, введена от одного до трех раз в течение суток или по мере необходимости.
[0000148] В одном из аспектов изобретения полиморфная модификация настоящего изобретения, предпочтительно гидратная форма соединения ST-246, также может быть использована в сочетании с: (1) вакциной; (2) цидофовиром, инъекционным противовирусным лекарственным средством, которое является фосфонатом ациклических нуклеозидов, и поэтому не зависит от фосфорилирования вирусными ферментами, для лечения вакцинальной экземы (ЭВ), опасного для жизни осложнения инфекции вируса осповакцины и других связанных нарушений, и/или (3) CMX001 (гексадецилоксипропил-цидофовир), имитатором природного липида, лизолецитина, образованным путем объединения липида, 3-гексадецилокси-1-пропанола с фосфонатной группой цидофовира.
[0000149] Изобретение также предоставляет фармацевтические упаковки или наборы, включающие один или более контейнеров с одной или несколькими кристаллическими полиморфными модификациями соединения ST-246, включая форму I, форму II, форму III, форму IV, форму V и форму VI. Необязательно, объединенным с таким(и) контейнером(ами) может быть уведомление в форме, установленной государственным органом, регулирующим производство, применение или продажу фармацевтических препаратов или биологических продуктов, где уведомление отражает одобрение государственным органом производства, использования или продажи для введения человеку. В определенном аспекте изобретения набор содержит более одной кристаллической полиморфной модификации соединения ST-246.
Пример 1 - Получение полиморфной формы I
[0000150] В частности, для получения моногидрата ST-246, формы I, циклогептатриен подвергают взаимодействию с малеиновым ангидридом в присутствии толуола, с получением основного продукта, эндоизомера. Экзоизомер далее получают приблизительно от 7% до 0,6% путем кристаллизации из смеси толуол/гептан. Далее, гидразин в безводной форме или в форме гидрата подвергают взаимодействию с метил 4-(трифторметил)бензоатом в присутствии изопропанола с получением (4-(трифторметил)бензгидразида. Затем продукт кристаллизуют из изопропанола.
[0000151] Следующая стадия синтеза включает конденсацию эндо-трицикло[3.2.2.0]нон-8-эндо-6,7-дикарбонового ангидрида и (4-(трифторметил)бензгидразида) в изопропаноле. Продукт выделяют кристаллизацией из изопропанола, и суспензию затем нагревают до кипения с обратным холодильником и выдерживают. Полученный в результате раствор охлаждают и берут образцы для завершения реакции. После того, как анализ показывает завершение реакции, загружают углерод и целит, и партию нагревают до кипения с обратным холодильником и выдерживают. После охлаждения партию фильтруют для удаления твердых веществ, и последующим фильтрованием через фильтр с использованием ИПС. Партию охлаждают и выдерживают до тех пор, пока не образуется суспензия. Партию дополнительно охлаждают и выдерживают. Содержимое центрифугируют, и влажный осадок, содержащий продукт синтеза, промывают гептаном. Влажный осадок сушат, и его называют частично гидратированной формой соединения ST-246 (SG3).
[0000152] Загружают SG3, а затем этилацетат. Смесь нагревают и выдерживают для обеспечения растворения SG3. Партию подвергают полировочному фильтрованию, и проверка на посторонние материалы подтверждает, что фильтрация была успешной. Этилацетат используют для загрузки фильтра. После нагревания партии до кипения с обратным холодильником, загружают воду с пониженным эндотоксином (ПЭ). Партию затравливают и загружают конечную ПЭ воду. Партию выдерживают при температуре кипения с обратным холодильником, и производят проверку суспензии.
[0000153] Далее партию охлаждают, во время чего получают образец суспензии для проверки правильного полиморфа. Партию охлаждают дальше и выдерживают до окончательного выделения на центрифуге. Окончательный API сушат, измельчают, используя мельницу Fitz Mill, как описано в WO 02/00196. Форма I может быть получена путем кристаллизации ST-246 из разных растворителей и комбинаций растворителей, как далее обобщено в таблицах 2 и 3:
[0000154] Идентификацию формы I соединения ST-246, полученной способом, описанным выше, подтверждали XRPD и ИК, как показано на фиг.1 и 7.
Пример 2 - Получение полиморфной формы II
[0000155] Стандарты формы II получают перекристаллизацией исходного материала Форм I и V из растворителей этилацетата и хлороформа. Количество формы I или формы V соединения ST-246 растворяют либо в этилацетате, либо в хлороформе, и фильтруют через мембранные фильтры с размером пор 0,45 мкм. Отфильтрованные растворы вновь нагревают при более высокой температуре, чтобы убедиться, что все твердые вещества растворились, и затем температуру уменьшают до более низкой и выпаривают досуха в атмосфере азота (~2 фунта на квадратный дюйм).
[0000156] Предпочтительные условия кристаллизации для формы II суммированы в таблице 4 ниже:
[0000157] Дополнительные примеры условий кристаллизации для формы II также суммированы в таблицах 1-2 выше.
[0000158] Идентификацию формы II соединения ST-246, полученной способом, описанным выше, подтверждали XRPD, как показано на фиг.2.
Пример 3 - Получение полиморфной формы III
[0000159] Форму III получают ресуспендированием безводного соединения ST-246 в воде. Дополнительные примеры растворителей, используемых для получения формы III, суммированы в таблицах 1-9 выше.
[0000160] Идентификацию формы III соединения ST-246, полученной способом, описанным выше, подтверждали XRPD и ИК, как показано на фиг.3 и 8.
Пример 4 - Получение полиморфной формы IV
[0000161] Стандарт формы IV получают перекристаллизацией исходного материала формы I из растворителя 1-бутанола. Исходный твердый материал растворяют в 1-бутаноле и фильтруют через мембранный фильтр с размером пор 0,45 мкм. Отфильтрованный раствор вновь нагревают при более высокой температуре, чтобы убедиться, что все твердые вещества растворились, а затем температуру уменьшают и выпаривают досуха в атмосфере азота (~2 фунта на квадратный дюйм). Предпочтительные условия кристаллизации для формы IV суммированы в таблице 5. Дополнительные примеры кристаллизации формы IV суммированы в таблицах 1-3.
[0000162] Идентификацию формы IV соединения ST-246, полученной способом, описанным выше, подтверждали XRPD, как показано на фиг.4.
Пример 5 - Получение полиморфной формы V
[0000163] Форму V (полугидрат) получали в ходе раннего ГМФ синтеза ST-246, и она раскрыта в патентах WO 2008/079159 и WO 2008/130348. Недостатком этой полиморфной модификации является то, что она не является полностью гидратированной. Эта форма легко поглощает влагу при помещении во влажную окружающую среду и, как было показано в конкурентных экспериментах с суспензиями, преобразуется в форму I.
[0000164] Идентификацию формы V соединения ST-246 подтверждали XRPD и ИК, как показано на фиг.5 и 9.
Пример 6 - Получение полиморфной формы VI
[0000165] Стандарт формы VI получают перекристаллизацией исходного материала формы V из растворителя нитрометана. Исходный твердый материал растворяют в нитрометане и фильтруют через мембранный фильтр с размером пор 0,45 мкм. Отфильтрованный раствор вновь нагревают при более высокой температуре, чтобы убедиться, что все твердые вещества растворились, а затем температуру уменьшают и выпаривают досуха в атмосфере азота (~2 фунта на квадратный дюйм). Форма VI может быть получена путем кристаллизации соединения ST-246 из различных растворителей и комбинаций растворителей. Предпочтительные условия кристаллизации суммированы в таблице 6 ниже. Дополнительные примеры кристаллизации формы VI суммированы в таблицах 1-3.
[0000166] Идентификацию формы VI соединения ST-246, полученной способом, описанным выше, подтверждали XRPD, как показано на фиг.6.
Пример 7 - Отличительная и сравнительная физическая характеристика полиморфных форм соединения ST-246, формы I, формы III и формы V
[0000167] Было установлено, что соединение ST-246 может существовать в трех преобладающих физических формах (формах I, III и V). Эти данные были получены по соответствующим физическим/химическим свойствам и стабильности полиморфов, чтобы определить, оказывают ли различные твердые формы воздействие на качество продукта. Эти данные включают кристаллографические свойства полиморфов и физические/химические свойства полиморфов (например, растворимость, распад, диапазон плавления), ускоренные данные стабильности.
[0000168] Образцы рентгеновской дифракции Форм I, III и V показаны на фиг.1, 3 и 5, соответственно. Картины порошковой рентгеновской дифракции Форм I, III и V легко различимы на основе уникальных особенностей в их порошковых картинах.
Взаимопреобразование форм I, III и V
[0000169] Конкурентные и неконкурентные эксперименты с суспензией проводили с целью определения наиболее стабильной формы соединения ST-246. Эксперименты суспендирования проводили путем экспонирования избыточного материала одной или нескольких форм соединения ST-246 в небольшом объеме воды и перемешивания полученных в результате суспензий в течение нескольких дней при комнатной температуре и/или при температуре 45°C. Аналогичные эксперименты были также проведены при различных значениях рН в течение 60 минут при температуре 37°C. Суспензию фильтруют, и твердое вещество анализируют при помощи порошковой XRPD. Чтобы избежать возможной десольватации или физических изменений после выделения, образцы не подвергают сушке до проведения порошкового рентгеноструктурного анализа. Конкурентные и неконкурентные эксперименты суспензии в воде показывают, что форма V и форма III преобразуются в форму I в воде, а форма I остается неизменной. Данные относительно суспензии суммированы в таблице 7 ниже:
Микронизация формы I и III:
[0000170] Соединение ST-246 принадлежит к классу II биофармацевтической системы классификации BCS из-за его плохой растворимости в физиологически релевантных буферах. Фазу 1 клинического испытания материала выполняли с применением микронизированной формы V с размером частиц d50% 4,8 мкм и d90% 12 мкм. Таким образом, обе формы I и III в масштабе 400 грамм были микронизированны с использованием мельницы Airjet, как описано в WO 02/00196. При измельчении, обе формы дали желаемый размер частиц без испытания какого-либо преобразования в физической форме (на основе XRPD).
[0000171] Репрезентативные картины XRPD как микронизированных, так и немикронизированных форм I и III суммированы на фиг.14 и 15.
Стабильность лекарственного вещества
[0000172] Лекарственное вещество форм I и III, как микронизированное, так и немикронизированное, прошло краткосрочные оценки стабильности в условиях стресса. Краткосрочное исследование было завершено, и данные, полученные при температуре 40°C/75% ОВ, представлены в таблицах 8 и 9.
[0000173] Данные, полученные в отношении как микронизированного, так и немикронизированного лекарственного вещества, указывают на отсутствие изменений в физической форме обеих форм I и III в отношении чистоты, родственных веществ, влаги, XRPD и ДСК.
[0000174] Долгосрочные исследования также были завершены, и полученные данные представлены в таблице 10.
Статическая сорбция Форм I, III и V
[0000175] Тестирование гигроскопичности проводили на формах I, III и V в различных условиях влажности, чтобы понять свойства сорбции/десорбции. Приблизительно 1 г каждой формы измельчают с помощью ступки и пестика. Содержание воды определяют при помощи ТГА. Приблизительно 100 мг каждого порошка помещают в камеры статической влажности при 11 и 97% ОВ при температуре приблизительно 25°C на период времени ~10 дней. Единственным примером, который продемонстрировал изменения в потере массы с дня 0, являлся образец формы V, который хранили при 97% ОВ. Данные представлены в таблице 11 ниже:
Пример 8. - Анализ влияния размера частиц API соединения ST-246 на профили растворения твердых желатиновых капсул ST-246
[0000176] Влияние размера частиц лекарственных средств на их профиль растворения было всесторонне проанализировано (см. Fincher et al., 1968), и была выдвинута гипотеза, что уменьшение размера частиц малорастворимых лекарственных средств приводит к увеличению скорости растворения вследствие увеличения площади поверхности лекарственных средств, подвергшихся действию растворителя.
[0000177] В таблице 12 обобщен размер частиц API микронизированного и немикронизированного соединения ST-246 в микронах, где микронизацию выполняют для дальнейшего тестирования влияния размера частиц на профили растворения соединения ST-246.
[0000178] Для того, чтобы оценить влияние частиц API на растворение капсул ST-246, оценивали следующую композицию, содержащую полиморфную модификацию формы I соединения ST-246. Для этих экспериментов, ST-246 (форма-I), капсулы 200 мг получали с использованием лекарственного вещества с различными гранулометрическими составами, такими как d90% менее чем 10 мкм, d90% 16 мкм, d90% 25 мкм, d90% менее чем 254 мкм и d90% менее чем 75 мкм. Композиция желатиновых капсул ST-246 приведена в таблице 13 ниже.
Для этих экспериментов, профили растворения ST-246 (формы I) определяют в аппарате 2 (лопастный) согласно USP, который вращается со скоростью 75 об/мин. Профили растворения определяют при температуре 37°C, в 900 мл среды растворения, содержащей 0,05M фосфатный буфер с pH 7,5, содержащий 3% HDTMA. Совокупное высвобождение лекарственного средства с течением времени представлено в процентах от % растворенного соединения ST-246 и графически нанесено в виде функции выборки образца среды растворения от времени.
[0000179] Как суммировано в таблице 14 и на фиг.16-20, ST-246 (форма I) с D90 размером частиц (d90%), равным 5,3 микрон и 16,6 микрон, достигает почти 100% растворения приблизительно через 22 минуты, тогда как ST-246 (форма I) с D90 размером частиц (d90%), равным 26,6, достигает почти 100% растворения через 30 минут. Также, ST-246 (форма I) с D90 размером частиц, равным 40,85 и 58,2 микрон, достигает почти от 85% до 86% растворения через 30 минут. Дальше, ST-246 (форма I) с D90 размером частиц, равным 75 микрон, достигает почти 86% растворения через 30 минут, и ST-246 (форма I) с D90 размером частиц, равным 254 микрон, достигает только 44% растворения через 60 минут. В таблице 14 показаны профили растворения с использованием альтернативного способа растворения (1% HDTMA в 900 мл 0,05M фосфатного буфера, pH 7,5 при температуре 37°C в аппарате 2 (лопастный) согласно USP, который вращается со скоростью 50 об/мин) для капсул, изготовленных с соединением ST-246 (форма I) с D90 размером частиц (d90%), равным 5,3 микрон, 16,6 микрон и 26,6 микрон.

[0000180] Кроме того, форма I соединения ST-246 может быть сформулирована для перорального введения в капсулах, содержащих 200 мг ST-246. Для этих экспериментов может быть использовано соединение ST-246 (форма I) с D90 размером частиц, равным приблизительно от 5,3 до 75 микрон. Все неактивные ингредиенты могут быть GRAS (как правило, признаются в качестве безопасных) и USPLNF эксципиентами. Производственный процесс может включать мокрую грануляцию с использованием смесителя с высоким сдвигом/гранулятора и заполнение твердых желатиновых капсул.
[0000181] Подходящие лекарственные формы могут включать капсулы, содержащие различные количества активного ингредиента. Количественный состав образцовой лекарственной формы, содержащей 200 мг моногидрата ST-246, микронизированного с D90 размером частиц менее чем приблизительно 10 микрон, приведен в таблице 15 ниже:
[0000182] Другие примеры композиций суммированы в таблице 17.
Пример 9 - Ингибирование репликации ортопоксвируса
[0000183] Способность формы I соединения ST-246 ингибировать вирус осповакцины устанавливают при помощи следующей экспериментальной процедуры:
Получение вирусного исходного продукта
[0000184] Вирусные исходные продукты вируса осповакцины (NYCBH) получают в клетках Vero, инфицированных при низкой кратности (0,01 бляшкообразующих единиц (БОЕ)/клетка), и собирают, когда цитопатический эффект становится полным (4+CPE). Образцы подвергают замораживанию и оттаиванию, а затем обрабатывают ультразвуком, чтобы освободить клеточно-ассоциированный вирус. Остатки клеток удаляют низкоскоростным центрифугированием, и полученную в результате вирусную суспензию хранят в аликвотах по 1 мл при температуре -80 градусов Цельсия. БОЕ/мл вирусной суспензии количественно определяют при помощи стандартного анализа бляшек на клетках Vero и BSC-40.
CPE анализ вируса осповакцины
[0000185] Для определения количества исходного продукта вируса осповакцины, необходимого для получения полного CPE в течение 3 дней, монослои клеток Vero высевают на 96-луночные планшеты и инфицируют 2-кратным серийным разведением исходного продукта вируса осповакцины. На 3-й день после заражения, культуры фиксируют с помощью 5% глутаральдегида и окрашивают 0,1% кристаллвиолетом. Индуцированный вирусом CPE количественно определяют спектрофотометрически при ОП.суб.570. Из этого анализа, 1:800 разведение исходного продукта вируса осповакцины выбрано для использования в анализе HTS. Это количество вируса осповакцины представляет собой кратность инфекции, равную приблизительно 0,1 БОЕ/клетка.
[0000186] Чтобы установить отношение сигнал-шум (С/Ш) в 96-луночном анализе и оценить изменчивость между лунками и между анализами, выполняют шесть независимых экспериментов. Монослои клеток Vero инфицируют 1:800 разведением исходного продукта вируса осповакцины.
[0000187] Каждый планшет содержит следующие контроли: четыре экземпляра лунок с клетками, инфицированными вирусом, четыре экземпляра лунок с неинфицированными вирусом клетками и кривую доза-ответ в двух экземплярах для цидофовира (CDV), добавленного в 300, 100, 30 и 10 ДАМ, или фосфоноуксусной кислоты (ФУК), добавленной в 2100, 714, 210 и 71 М в качестве эталонных стандартов. На 3-й день после инфицирования планшеты обрабатывают, как описано выше. Результаты этих экспериментов показывают, что 96-луночный формат анализа является надежным и воспроизводимым.
Тестирование формы I
[0000188] Соединение ST-246, форму I тестируют при помощи CPE анализа вируса осповакцины. форму I растворяют в ДМСО и разбавляют в среде, таким образом, чтобы конечная концентрация в каждой лунке составляла 5 пM соединения и 0,5% ДМСО. Форму I добавляют с помощью робота в культуральную среду с использованием автоматической программно управляемой системы Biomek.RTM. FX.
[0000189] После добавления соединения, культуры инфицируют вирусом осповакцины. Через 3 дня планшеты обрабатывают и количественно определяют CPE, как описано. Форма I соединения ST-246 по изобретению ингибирует индуцированный вирусом осповакцины CPE более чем на 50% в тестовой концентрации (5 мкМ). форму I дополнительно оценивают на эффективность (ЕС50) в анализе CPE и на цитотоксичность (CC.sub.50) в анализе МТТ. Анализ МТТ измеряет активность митохондриальной дегидрогеназы в делящихся клетках. Абсорбция формазина при 490 нм может быть измерена непосредственно в 96-луночных планшетах для анализа после солюбизации формазина в 50% этаноле. Количество формазинового продукта прямо пропорционально количеству живых клеток в культуре. Значения EC50 определяют путем сравнения обработанных соединением клеток и необработанных соединением клеток с помощью компьютерной программы. Таким образом, значение EC50 формы I соединения ST-246 в CPE анализе составляет 50 нМ.
[0000190] Специфичность формы I соединения ST-246 для ингибирования ортопоксвируса находит свое отражение в том факте, что она не подавляет репликацию неродственных вирусов, в том числе вируса Pichinde, вируса лихорадки Рифт-Валли (штамм MP12), респираторно-синцитиального вируса и цитомегаловируса.
Пример 10 - Исследование формы I соединения ST-246 in vivo
Дизайн исследования
[0000191] Исследование выполнено как рандомизированное, плацебо-контролируемое, в параллельных группах, с изучением в разные моменты времени пероральной формы I соединения ST-246 у яванских обезьян (Macaca fascicularis). Для этих экспериментов, 15 нечеловеческих приматов (НЧП) инфицировали штаммом Zaire79 вируса обезьяньей оспы (MPX) в количестве 5×107 БОЕ при помощи внутривенной инъекции и рандомизировали в пять групп лечения, каждая из которых состояла из трех НЧП. Транспортное средство или форму I соединения ST-246 вводили перорально в дозе 3 мг/кг, 10 мг/кг, 30 мг/кг и 100 мг/кг один раз в сутки, с последующим введением 30% суспензии гидратированного гомогенизированного печенья для обезьян в количестве 5 мл/кг.
[0000192] Лечение начинают на 3-й день после инфицирования и продолжают один раз в сутки в течение 14 дней. За инфицированными животными наблюдают по меньшей мере два раза в день в течение периода времени до 33 дней, чтобы обследовать их на наличие признаков болезни. Образцы крови отбирают у инфицированных животных для вирусологических, гематологических, иммунологических и химических анализов. Полное вскрытие проводят у животных, которые умерли в ходе исследования, для сбора тканей для патологического исследования. Для определения степени заражения, трех животных умертвляют на 3 день и их ткани обрабатывают для определения уровней вируса в тканях. Органы подвергают замораживанию-оттаиванию, и 10% гомогенат ткани получают и анализируют при помощи количественной ПЦР. Количество геномов MPX на миллилитр крови определяют посредством экстракции ДНК при помощи мини-набора Qiagen QIAmp DNA и количественно анализируют с помощью TaqMan-MGBPCR, как описано выше. Поражения обезьяньей оспы подсчитывают ежедневно.
Фармакокинетический анализ формы I соединения ST-246 у яванских обезьян (НЧП)
[0000193] НЧП вводят соединение ST-246 в дозе 10, 20 и 30 мг/кг через желудочный зонд после приема пищи. В день введения дозы, всем животным вводят суспензию печенья для приматов непосредственно перед введением дозы лекарственного средства. Суспензию печенья, содержало одну банку (8 унций) энтерального питания Ensure или другого жидкого питания, приблизительно 36 г жидкости и формулу замены электролитов (Prang), приблизительно 94 г детского питания, 1 банку (2,5 унции) перетертых фруктов (пюре), пять жевательных печений для обезьян, и приблизительно 2 унции воды смешивают вместе, чтобы достичь однородной консистенции. Суспензию печенья вводят через желудочный зонд в дозе объемом 10 мл/кг. После введения каждой дозы предмета тестирования и до удаления зондовой трубки, трубку промывают 10 мл водопроводной воды. Дозированную композицию перемешивают магнитной мешалкой до и во время введения. Индивидуальные дозы основаны на самых последних измерениях массы тела. За исключением группы, получающей дозу 20 мг/кг, каждая группа дозирования включает три самки и три самца НЧП; группа, получающая дозу 20 мг/кг, включает четыре самца и четыре самки НЧП. НЧП в группах, получающих дозу 10 и 30 мг/кг, получают форму I соединения ST-246 в течение 14 дней подряд, а те, что находятся в группе, получающей 20 мг/кг, получают однократную дозу ST-246. Образцы крови отбирают из бедренной артерии/вены перед тестированием (0 ч) (до введения дозы) и через 0,5, 1, 2, 3, 4, 6, 8, 12 и 24 часа после введения дозы на 1, 7 и 14 день для определения концентрации в плазме ST-246, формы I.
Оценивание эффективности формы I соединения ST-246 на модели обезьяньей оспы у яванских обезьян
[0000194] Исследование, описанное в данном описании, является рандомизированным, плацебо-контролируемым, в параллельных группах, с изучением в разные моменты времени пероральной формы I соединения ST-246, у НЧП, внутривенно (ВВ) инфицированных MPX. Животные демонстрируют обширную инфекцию MPX основных тканей, о чем свидетельствует уровень вируса в тканях. Во время лечения формой I соединения ST-246 одна треть НЧП имеет вирусные поражения. Все животные, получавшие только транспортное средство, либо умирают, либо требуют эвтаназии, потому что они являются умирающими в течение периода исследования 33 дней, в то время как все животные, получавшие форму I соединения ST-246, выживают. Каждое из животных, получавших форму I соединения ST-246, выживает в течение всего периода исследования.
[0000195] Для этих экспериментов, вирусную нагрузку и развитие поражений определяли количественно ежедневно. Все дозы формы I соединения ST-246 значительно уменьшают количество присутствующей вирусной ДНК, начиная с 5-го дня после инфицирования, по сравнению с животными, пролеченными транспортным средством. В конце 14-дневного лечения, вирусная нагрузка в группах, получавших форму I соединения ST-246, демонстрирует линейное соотношение доза-ответ, а все группы, получавшие лечение, демонстрируют значительное, более чем 1000-кратное снижение уровня репликации вируса по сравнению с уровнем репликации вируса в группах, пролеченных транспортным средством.
Пример 11 - Фармакокинетическое сравнение однократного перорального приема капсул с антиортопоксвирусным соединением ST-246 формы I в сравнении с формой V, проведенное на здоровых добровольцах
Дизайн исследования
[0000196] Это было предварительное исследование фазы I, рандомизированное, двойное слепое, кроссоверное, проведенное для того, чтобы сравнить фармакокинетику (ФК; переменные AUC и Cmax) однократной пероральной дозы 400 мг (2×200 мг) формы I (тест) соединения ST-246 с Формой V (эталон) соединения ST-246, а также для того, чтобы оценить безопасность и переносимость обеих форм у нормальных здоровых добровольцев после еды. Двенадцать из шестидесяти трех обследованных лиц (мужчин и небеременных женщин, от 18 до 50 лет включительно) были приняты в исследование, и были рандомизированы в группу лечения одной из следующих последовательностей: форма I, затем форма V; или форма V, затем форма I.
[0000197] Для определения ФК соединения ST-246, образцы мочи и базовой (0 часов) венозной крови получали на день 1, с последующим серийным отбором крови после введения лекарственного средства. Все испытуемые субъекты получали однократную дозу 400 мг (2×200 мг) формы I или формы V соединения ST-246, перорально в течение 30 минут после стандартной легкой еды. Образцы крови после введения дозы (лечение 1) для анализа ФК были отобраны через 0,5, 1, 2, 3, 4, 8, 12, 24, 36, 48 и 72 часов. Образцы мочи после введения дозы получали на день 2. Период вымывания имел место во время исследования в дни 2-10, поэтому лечение 2 имело место на день 11. В это время те субъекты, которые первоначально получали форму I соединения ST-246, теперь получали однократную дозу 400 мг (2×200 мг) формы V, и наоборот. Забор крови для анализов ФК после лечения 2, совершали так же, как и после лечения 1, и отбор проб мочи имел место на день 14. Образцы плазмы отбирали и хранили при температуре -70°С до проведения анализа на максимальную концентрацию лекарственного средства [Cmax], время до достижения максимальной концентрации лекарственного средства [Tmax], конечный период полувыведения [t1/2], площадь под кривой концентрация-время [AUC], и почечный клиренс [Clr]. Образцы мочи немедленно центрифугировали при температуре 4°С в течение 10 мин при 2000×g, и оценивали на экскрецию с мочой. Количественно определяли соединение ST-246 в образцах человеческой плазмы утвержденными способами жидкостной хроматографии и тандемной масс-спектрометрии с использованием аналога соединения ST-246 в качестве внутреннего стандарта.
[0000198] В исследовании проводили сравнение фармакокинетических (ФК) профилей капсул формы 1 и формы V соединения ST-246 после однократного перорального введения дозы. Эта цель была достигнута путем сбора и анализа образцов плазмы для ФК оценки формы I у 12 из 12 субъектов и формы V у 11 из 12 субъектов. Фармакокинетические параметры, пик концентрации в плазме (Cmax,), время после введения дозы, за которое достигается Cmax (Tmax), плазменные экспозиции (AUC0-τ, AUC0-∞) и период полувыведения (t½) были оценены для соединения ST-246 при помощи не-компартментного анализа с использованием профессионального издания программного обеспечения WinNonlin (Pharsight Corporation, версия 5.2).
[0000199] Фармакокинетические параметры формы I и формы V соединения ST-246 суммированы в таблице 18 ниже:
[0000200] Средняя (СО) концентрация в плазме ST-246 с течением времени (Популяционный анализ фармакокинетики ФК) показана на фиг.24 после единственного перорального введения.
Реферат
Изобретение относится к полиморфной форме 4-трифторметил-N-(3,3a,4,4a,5,5a,6,6a-октагидро-1,3-диоксо-4,6-этеноциклопроп[f]изоиндол-2(1H)-ил)бензамида (соединение ST-246), к способу получения полиморфной формы и фармацевтической композиции, содержащей указанную полиморфную форму. 7 н. и 6 з.п. ф-лы, 24 ил., 18 табл., 11 пр.
Формула
a) растворение 4-трифторметил-N-(3,3а,4,4а,5,5а,6,ба-октагидро-1,3-диоксо-4,6-этеноциклопроп[f]изоиндол-2(1Н)-ил)бензамида (ST-246) в растворителе для приготовления раствора;
b) охлаждение указанного раствора до температуры, которая вызывает преимущественную кристаллизацию указанной полиморфной формы I 4-трифторметил-N-(3,3а,4,4а,5,5а,6,6а-октагидро-1,3-диоксо-4,6-этеноциклопроп[f]изоиндол-2(1Н)-ил)бензамида (ST-246), и
c) необязательно сушку образованных кристаллов 4-трифторметил-N-(3,3а,4,4а,5,5а,6,6а-октагидро-1,3-диоксо-4,6-этеноциклопроп[f]изоиндол-2(1Н)-ил)бензамида (ST-246),
где указанный растворитель содержит изопропиловый спирт или этилацетат и 5% воды, а раствор охлаждают до комнатной температуры, или где растворитель содержит изопропиловый спирт или этилацетат и 2% воды, а раствор охлаждают до температуры 2-5°C.
(a) приблизительно 200 мг соединения 4-трифторметил-N-(3,3а,4,4а,5,5а,6,6а-октагидро-1,3-диоксо-4,6-этеноциклопроп[f]изоиндол-2(1Н)-ил)бензамида (соединение ST-246), где указанный 4-трифторметил-1H-(3,3а,4,4а,5,5а,6,6а-октагидро-1,3-диоксо-4,6-этеноциклопроп[f]изоиндол-2(1Н)-ил)бензамид (ST-246) присутствует в виде полиморфа формы I;
(b) приблизительно 33,15 мг моногидрата лактозы;
(c) приблизительно 42,90 мг натрийкроскармеллозы;
(d) приблизительно 1,95 мг коллоидного диоксида кремния;
(e) приблизительно 13,65 мг гидроксипропилметилцеллюлозы;
(f) приблизительно 7,8 мг лаурилсульфата натрия;
(g) приблизительно 1,95 мг стеарата магния и
(h) количество микрокристаллической целлюлозы до 88,60 мг, так что общая масса лекарственной формы составляет приблизительно 390 мг.

Комментарии