Способ диагностики метастазов рака толстой кишки - RU2647470C2
Код документа: RU2647470C2
Чертежи
Описание
Изобретение относится к медицине, а именно к молекулярной биологии, онкологии, и может найти применение в диагностике риска возникновения метастазов при раке толстой кишки.
Фермент-зависимое метилирование ДНК в организме человека, как правило, наблюдается по основаниям цитозина в CpG-островках. Это событие в регуляторных районах (промоторах) обычно связано с транскрипционной инактивацией ассоциированного с промотором гена. Аберрантное метилирование онко-ассоциированных генов - частое событие в опухолях человека. Частота случаев изменения статуса метилирования генов в спорадических колоректальных опухолях, по разным оценкам, колеблется от 15 до 80% (см. Kim M.S., Lee J., Sidransky D. DNA methylation markers in colorectal cancer. Cancer Metastasis Rev. 2010; Vol. 29: 181-206), что позволяет использовать этот показатель для разработки новых молекулярных маркеров диагностики, скрининга и клинического прогноза опухолей. Аберрантное метилирование ДНК присутствует не только на ранних этапах канцерогенеза, но и является признаком дальнейшей прогрессии и метастазирования.
CDH13 - один из генов-онкосупрессоров, активность которых часто подавляется в опухолях человека посредством транскрипционной инактивации в результате гиперметилирования собственных промоторных участков. Ранее, было показано, что статус гиперметилирования гена CDH13 коррелирует с более продвинутой стадией заболевания, большим размером опухоли и риском развития рецидива и метастазирования у пациентов с раком мочевого пузыря (см. Lin Y.L., Xie P.G., Ma J.G. Aberrant methylation of CDH13 is a potential biomarker for predicting the recurrence and progression of non muscle invasive bladder cancer. Med Sci Monit. 2014. 20: 1572-7).
В работе Konishi K et al. (2011) (DNA Methylation Profiles of Primary Colorectal Carcinoma and Matched Liver Metastasis. PLoS ONE 6(11): e27889) представлены результаты исследования метилирования 79 случаев КРР с использованием бисульфит-пиросеквенирования 13-ти генов (MINT1, MINT2, MINT3J, MLH1, р16, р14, TIMP3, CDH1, CDH13, THBS1, MGMT, НРР1 и ERα) и микрочипов (МСАМ) с целью идентификации различий между первичными опухолями и метастазами, локализованными в печени. Сравнивая аберрантное метилирование 13-ти генов как непрерывную переменную в двух группах (без и с наличием метастазов в печени) статистически значимый эффект был получен только для MGMT (27,4% в метастазах печени [95% ДИ, 42,6% до 12,2%] против 13,4% в первичных опухолях [95% ДИ, 22,8% - 4,2%], Р=0,013). Тем не менее, авторами был сделан вывод об отсутствии значимых различий в уровне и паттерне метилирования между первичной опухолью и парным метастазом. Описываемый отрицательный результат не согласуется с данными, полученными ранее для 13 генов, которые свидетельствовали о прогностической значимости выбранных биомаркеров и их корреляции со стадией заболевания (Ogino S. et al. CpG island methylation, response to combination chemotherapy, and patient survival in advanced microsatellite stable colorectal carcinoma. Virchows Arch 450:529-537; Shen L. et al. Association between DNA methylation and shortened survival in patients with advanced colorectal cancer treated with 5-fluorouracil based chemotherapy. Clin Cancer Res. 2007 13: 6093-6098; Lin Y.L. et al. Aberrant methylation of CDH13 is a potential biomarker for predicting the recurrence and progression of non muscle invasive bladder cancer. Med Sci Monit. 2014 Sep 4;20:1572-7. doi: 10.12659/MSM.892130).
Анализ патентных источников показал наличие следующих изобретений близких по тематике к заявленному:
1) «Способ интраоперационной лапароскопической ультразвуковой диагностики распространения рака толстой кишки» (см. заявка на изобретение 2001132943/14, А61В 8/12, опубл. 10.08.2003). Авторами предложено в ходе оперативного вмешательства по поводу колоректального рака проводить лапароскопическое ультразвуковое исследование, в результате которого оценивают состояние регионарных и некоторых отдаленных лимфатических узлов и органов на предмет наличия метастазов. Способ является инвазивным и выполняется во время операции.
2) «Изоформы BARD1 при раке легкого и колоректальном раке и их применение» (см. заявка на изобретение 2013104137/15, 17.08.2010 US 61/374,370, опубл. 27.09.2014) включает последовательное определение изоформ указанного белка, наличие которых позволяет прогнозировать развитие рецидива колоректального рака. Отметим, что предлагаемый способ осуществляется с помощью многоступенчатых, сложных и дорогостоящих методов (электрофорез с антителами, секвенирование), требующих специализированного оборудования, и не является специфичным для рака толстой кишки.
Изобретение «Способ диагностики метастазов рака толстой кишки» является новым, так как сам методический подход и указанный маркер CpG-метилирования не использовали для заявленной в способе цели и для выбранной нозологии. Способ может быть осуществлен на оборудовании и реактивах компании Qiagen, имеющих регистрационное удостоверение Минздрава РФ.
Техническим результатом заявляемого изобретения является создание нового, дооперационного, эффективного способа выявления метастазов у больных раком толстой кишки, не требующего дополнительных инвазивных процедур.
Сущность заявляемого способа заключается в том, что используют высокоспецифичные праймеры для регуляторных последовательностей гена CDH13, анализируют полученные данные и вычисляют медиану метилирования Met (%) CpG-сайтов, сравнивают Met с контрольными значениями и в случае превышения Met установленной нормы по генетическому локусу CDH13 подтверждают наличие метастазов.
Способ основан на патогенетическом факторе канцерогенеза - метилировании регуляторных районов генов, ассоциированных с инициацией и развитием злокачественного процесса, что приводит к их инактивации без нарушения структуры ДНК.
Заявленный способ включает следующие этапы: отбор биопсийного материала, выделение тотальной ДНК из тканевых проб с помощью метода фенол-хлороформной экстракции; бисульфитное конвертирование ДНК с последующим использованием ее в качестве матрицы для амплификации участков регуляторных районов в присутствии ген-специфичных праймеров; пиросеквенирование полученных ампликонов в присутствии специфичного праймера; статистическая обработка данных на соответствие контрольным значениям уровня метилирования, рассчитанным на основании экспериментальных данных для условно нормальных и опухолевых тканей толстой кишки.
Заявляемый способ осуществляется следующим образом.
У пациента производят забор биопсийного образца опухолевой ткани. Образцы замораживают в жидком азоте для транспортировки в лабораторию и для хранения.
Выделение геномной ДНК из ткани проводят следующим образом: фрагменты ткани измельчают скальпелем и/или ножницами, помещают в лизирующий раствор. Дальнейшее выделение ДНК проводят по методу фенол-хлороформной экстракции (см. Корниенко И.В., Водолажский Д.И., Вейко В.П. и др. Подготовка биологического материала для молекулярно-генетических идентификационных исследований при массовом поступлении неопознанных тел. Ростов н/Д: ООО «Ростиздат». 2001. 256 с.).
Выделенную ДНК обрабатывают в ходе бисульфитной конверсии с помощью набора EpiJET Bisulfite Conversion Kit (Thermo Scientific) согласно протоколу производителя или по методу Patterson et al. (2011) (см. Patterson K., Molloy L., Qu W., Clark S. DNA Methylation: Bisulphite Modification and Analysis // J. Vis. Exp. 2011. Vol. 56. e3170.).
Анализируемые последовательности генетических локусов амплифицируют в 35 мкл ПЦР-смеси, содержащей 1 х ПЦР-буфер, 0,2 mM dNTPs, MgCl2 (см. табл. 1), 1 ед. акт. Taq-DNA-полимеразы, по 0,4 mkM прямого и обратного праймеров. Последовательности праймеров и оптимизированные условия амплификации приведены в таблице 1.

Амплификацию проводят на термоциклере в соответствии с инструкциями производителя по следующей программе:
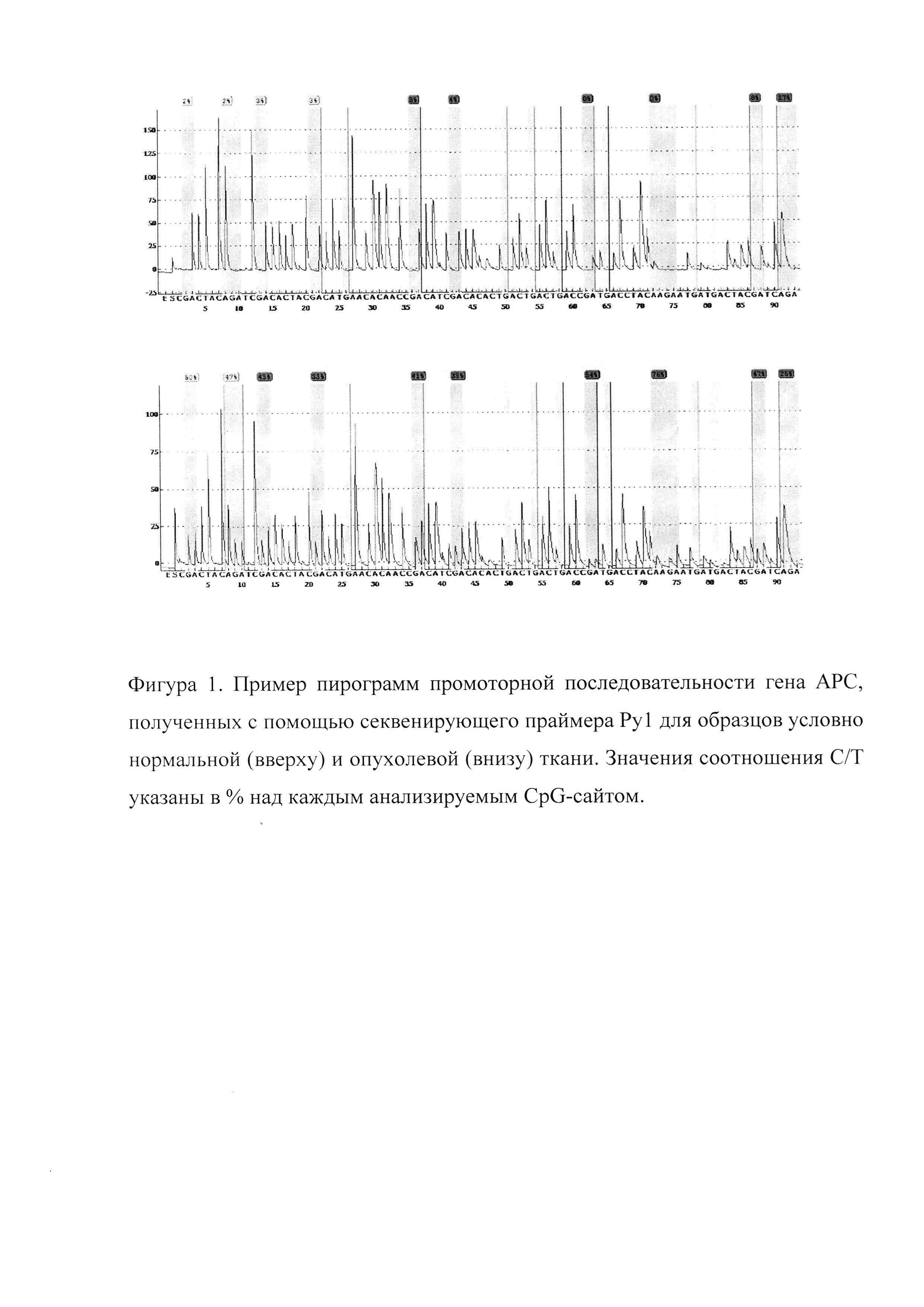
- первичная денатурация: 95°С 5 мин.
- 45 циклов:
- 95°С 20 с;
- 60°С 20 с;
- 72°С 20 с.
- терминальное удлинение цепи 72°С 10 мин.
Ампликоны, полученные после постановки ПЦР на матрице бисульфит-конвертированной ДНК, подвергают очистке, денатурации и отмывке с последующим отжигом с секвенирующим праймером при 80°С и постановкой реакции пиросеквенирования с использованием системы генетического анализа PyroMark Q24 (Qiagen, Germany) согласно инструкции производителя. Постановку пиросеквенирования каждого образца проводят, как минимум, в двух повторах. Полученные данные анализируют с помощью программного обеспечения PyroMark Q24 Software (Qiagen, Germany). Значение метилирования отдельного CpG-сайта, рассчитанного как отношение содержания нуклеотидов С/Т (рисунок), используют для вычисления усредненного метилирования промоторного участка каждого гена (Met, %).
Вывод об изменении статуса метилирования делают, сравнивая значения Met, полученные для опухоли, с контрольным значением. Под контрольным значением понимают нижнюю границу 95%-ого доверительного интервала, вычисленного для опухолей толстой кишки, гиперметилированных по исследованному локусу. Генетический локус признают гиперметилированным, если вычисленное Met равно или превышает контрольное значение. В нашем случае были получены следующие значения (см. таблица 2).

В целях оценки потенциальной значимости выбранного маркера была рассчитана чувствительность и специфичность. Показано, что для дифференциации случаев колоректального рака с метастазами и без метастазов маркер CDH13 имеет чувствительность 86% и специфичность 50%. Поскольку предложенная система открытая, есть возможность увеличить ее специфичность и чувствительность при расширении паттерна метилирования за счет других генетических локусов.
Для доказательства прогностической ценности предложенного метода приводится 2 выписки из историй болезни.
Пример №1
Больной Ш. обратился в ФГБУ «РНИОИ» МЗ РФ с жалобами на частые позывы на дефекацию до 6 раз в сутки, примесь крови в кале, слабость.
Считает себя больным с марта 2015 г, когда появились вышеуказанные симптомы. Обратился за медицинской помощью по месту жительства, направлен в РНИОИ. При обследовании в РНИОИ: СРКТ ОГК, ОБП и МТ от 14.05.2015 г.: легочная ткань: в нижней доле справа кальцинат 0,3 см; простата: 4,9×6,3 см с кальцинатами; остеохондроз L3-L5; в правой доле щитовидной железы киста 2,0 см, опухоль сигмовидной кишки и ректосигмоидного отдела 9,0×4,5 см.
Колоноскопия от 17.04.2015 г.: опухоль ректо-сигмоидного отдела толстой кишки и сигмовидной кишки (на 18 см от ануса нижний край опухоли). Гистологическое исследование биоптата при ФКС №28467-72/15 от 15.05.2015 г.: аденокарцинома.
С диагнозом (С 19) Рак ректо-сигмоидного отдела ободочной кишки T3-4NxM0 стадия 2-3, клиническая группа 2 госпитализирован для оперативного лечения.
28.05.2015 г. больному выполнена операция: резекция ректо-сигмоидного отдела толстой кишки. При интраоперационной ревизии отдаленных метастазов не выявлено.
Послеоперационный гисто-анализ от 28.05.15 - муцинозная аденокарцинома с инвазией в клетчатку, в лимфоузлах и линиях резекции опухоли нет.
Послеоперационный диагноз: (С19) Рак ректосигмоидного отдела ободочной кишки pT4N0M0 стадия 2, клиническая группа 3.
Участок удаленной опухоли был направлен на исследование метилирования гена CDH13 Результат исследования выявил аномальное метилирование гена CDH13.
Больной консультирован химиотерапевтом, учитывая стадию заболевания, химиотерапия не показана.
Однако, учитывая данные генетического исследования, больному рекомендовано дополнительное обследование. При обследовании: СРКТ ОГК, ОБП и МТ от 23.06.15, легочная ткань без очагов. Просвет трахеи и бронхов свободен. Плевра не изменена. Печень - в обеих долях множественные метастазы от 0,5 до 1,5 см в диаметре. Селезенка не изменена. Поджелудочная железа не увеличена, структура однородна. Надпочечники не изменены. Почки не изменены. Брюшина не изменена. Асцита нет. Сальник не изменен. Желчный пузырь без патологии. Мочевой пузырь не изменен. Забрюшинные лимфоузлы не увеличены. Внутригрудные лимфоузлы: не увеличены. Простата 6×6 см. Заключение: метастатическое поражение печени.
В связи с развитием отдаленных метастазов опухоли больной был повторно консультирован химиотерапевтом, рекомендовано проведение многокурсовой химиотерапии.
Учитывая выявление метастатического поражения печени через короткий промежуток времени после оперативного вмешательства (3 месяца), при котором визуально очаговое поражение печени было не обнаружено, можно предложить наличие субклинического метастатического поражения печени уже во время оперативного вмешательства, не определяемого визуально, пальпаторно и при СРКТ. Информация о возможном метастатическом поражении печени после операции могла изменить тактику лечения больного, которому была бы назначена полихимиотерапия, которая должна была увеличить бессобытийный период у данного пациента.
Анализ представленного клинического случая свидетельствует о важности установления метастатического поражения при раке толстой кишки для определения правильной тактики лечения.
Пример №2
Больной К. 06.08.1961 г. р., обратился в ФГБУ «РНИОИ» МЗ РФ с жалобами на периодические тупые боли в надлобковой области, вздутие живота, урчание в животе, позывы на дефекацию до 4 раз в сутки, примесь крови в кале.
Считает себя больным с марта 2015 г. Обратился к участковому терапевту по месту жительства, направлен в РНИОИ. При обследовании: СРКТ ОГК, ОБП, ОМТ 15.05.2015: опухоль сигмовидной кишки до 11 см, инфильтрация окружающей клетчатки, забрюшинные лимфоузлы до 2 см.
8.05.15 ФКС: опухоль на 40 см от ануса. Гистоанализ - аденокарцинома со слизеобразованием.
Биопсийный материал был направлен на исследование метилирования гена CDH13. Результат исследования не выявил аномального метилирования указанного гена.
С диагнозом: (С18) рак сигмовидной кишки T4N1M0 ст 3, гр 2, госпитализирован для оперативного лечения.
04.06.2015 г. выполнена операция - лапаротомия, при ревизии органов брюшной полости выявлена: опухоль сигмовидной кишки 8×6 см, прорастающая серозную оболочку, стенозирующая просвет кишки, забрюшинные лимфоузлы в плотном инфильтрате. Выполнена резекция сигмовидной кишки, попытка удаления забрюшинных лимфоузлов сопровождалась диффузным обильным кровотечением из инфильтрата, в связи с чем попытка удаления лимфоузлов прекращена.
Послеоперационный гистоанализ от 04.06.15 - слизеобразующая аденокарцинома толстой кишки, инвазия всех слоев; по линиям резекции опухоли нет; в лимфоузлах брыжейки метастазов нет.
Консультация химиотерапевта от 11.06.2015: учитывая отсутствие метастазов опухоли, химиотерапия не показана.
Послеоперационный диагноз: (С 18) рак сигмовидной кишки T4N0M0 ст 2, гр 3. В связи с неуточненным состоянием забрюшинных лимфоузлов больной находился под динамическим наблюдением, каждые 2-3 месяца выполнялось СРКТ и УЗИ органов брюшной полости и забрюшинного пространства. При наблюдении за больным в течение 9 месяцев патологии в брюшной полости и забрюшинном пространстве не выявлено.
Анализ представленного клинического случая также свидетельствует о возможности установления наличия или отсутствия метастатического поражения лимфоузлов с использованием исследования метилирования гена CDH13.
Под нашим наблюдением находилось 25 больных раком толстой кишки, которым дополнительно к гистологическому исследованию интраоперационного биопсийного материала, было выполнено исследование метилирования регуляторных участков гена CDH13. В итоге было установлено, что статистически достоверно чаще гиперметилирование данного маркера встречается при КРР с метастазами (χ2=7,5 при р<0,05), кроме того, гиперметилирование CDH13 в опухоли повышает риск метастазирования в 6 раз (OR=6,00; CI95% 1,56-23,11).
«Способ диагностики метастазов рака толстой кишки» позволяет идентифицировать рак толстой кишки с метастазами (в регионарные лимфоузлы и/или отдаленные лимфоузлы и органы), что способствует установлению правильного диагноза и определению правильной тактики лечения, а также будет способствовать улучшению результатов лечения больных раком толстой кишки. Заявляемый способ является экономически оправданным для уточнения диагноза до операционного вмешательства и дает возможность скорректировать тактику лечения в после операционном периоде; обладает высокой чувствительностью (86%), его осуществление возможно на материале, полученном во время диагностической биопсии, способ занимает менее 20 часов.
Реферат
Изобретение относится к области медицины, в частности к онкологии, и предназначено для диагностики метастазов рака толстой кишки. Из тканевых проб толстой кишки выделяют тотальную ДНК. Осуществляют бисульфитную конверсию препаратов ДНК и последующую амплификацию и пиросеквенирование. Используют высокоспецифичные праймеры для регуляторных последовательностей гена CDH13. Вычисляют медиану метилирования Met (%) CpG-сайтов. В случае превышения Met установленной нормы по генетическому локусу CDH13 подтверждают наличие метастазов. Изобретение обеспечивает создание эффективного способа выявления метастазов у больных раком толстой кишки, не требующего дополнительных инвазивных процедур. 2 табл., 2 пр.

Комментарии