Системы с регулируемым высвобождением и низкими дозами андрогенов, способ их получения и способ лечения с помощью этих систем - RU2142276C1
Код документа: RU2142276C1
Чертежи










Описание
В настоящей заявке раскрываются новые композиции с пролонгированным высвобождением активного ингредиента, обладающего андрогенной активностью, а также способы их получения и использования для лечения или предупреждения рака молочной железы, рака тела матки, остеопороза, а также для лечения эндометриоза у восприимчивых теплокровных животных, включая человека. Некоторые предпочтительные варианты осуществления настоящего изобретения относятся к новым композициям инъецируемых форм медроксипрогестерона ацетата и мегестерола ацетата, которые позволяют достичь нужных уровней активных ингредиентов в крови в течение продолжительного периода времени. Для этого, в целях предупреждения и лечения вышеуказанных заболеваний, а также в целях регулирования рождаемости теплокровных животных, включая человека, инъецируют биологически разлагаемые микрочастицы, которые медленно и с постоянной скоростью высвобождают, например медроксипрогестерона ацетата и мегестрола ацетата. Кроме того, в настоящей заявке раскрываются новые способы удаления нежелательного остаточного растворителя из частиц с пролонгированным высвобождением.
Предшествующий уровень техники
Имеется много работ, посвященных исследованию гормональной
терапии рака молочной железы и рака тела матки, а также лечению и предупреждению остеопороза и лечению эндометриоза. Главные, уже разработанные способы лечения рака молочной железы относятся к
ингибированию действия и/или продуцирования эстрогена. Роль эстрогенов в стимулировании развития эстрогензависимого рака молочной железы хорошо известна исследователям (Lippman, Semin. Oncol. 10
(suppl. ): 11-19, 1983; Slege and McGuire, Cancer Res. 38: 61-75, 1984; Wittliff, Cancer 53: 630-643, 1984; Poulin and Lobrie, Cancer Res. 46:4933-4937, 1986).
Известно также, что эстрагены способствуют пролиферации нормального эндометрия. Длительное введение эстрогенов без сопровождения прогестерона может привести к развитию гиперплазии эндометрия, что является предрасполагающим фактором для возникновения эндометриальной карциномы (Lucas, Obstet. Gynecol. Surv. 29: 507-528, 1974). После менопаузы риск заболевания раком тела матки возрастает, особенно у женщин, подвергавшихся эстрагеновой терапии без одновременного введения прогестина (Smith et al., N. Engl.J. Med. 293: 1164-1167, 1975; Mack et. al., N. Endl. J. Med 294: 1262-1276).
Многие исследователи посвятили свои работы изучению гормонального зависимого рака молочной железы и тела матки. Известным способом эндокринной терапии рака у женщин в предклимактерическом периоде является кастрация, осуществляемая путем хирургической операции или путем лучевой терапии, причем указанные две процедуры дают эффект необратимой кастрации. Недавно обратимая форма кастрации была достигнута с использованием агонистов фактора, высвобождающего лютенизирующий гормон (LHPH-агонистов), которые после ингибирования секреции биологически активного лютенизирующего гормона (LH) гипофизом способствуют снижению сывороточных уровней эстрогенов до уровней эстрогенов при кастрации (Nicholson et al., Brit. J. Cancer. 39: 268-273, 1979).
В некоторых работах показано, что лечение пациенток с раком молочной железы предклимактерического периода методом, предусматривающим использование LHPH-агонистов, способствует продуцированию у этих пациенток реакции, сравнимой с реакцией, вызываемой другими формами кастрации (Klijn et al., J. Steroid Biochem. 20:1381, 1984; Manni et al., Endocr. Rev. 7, 89-94, 1986). Хорошие результаты лечения с использованием LHPH-агонистов, проводимого у женщин в постклимактерическом периоде, были получены Nicholson et. al., J. Steroid Biochem. 23: 843-848, 1985).
В патенте США N 4071622 раскрывается использование LHPH-агонистов против ДМБА-индуцированной карциномы молочной железы у крыс.
В патенте США N 4775660 раскрывается лечение рака молочной железы с использованием комбинированной терапии, предусматривающей введение женщине антиандрогена и антиэстрогена после того, как гормональный выброс ее яичников был блокирован химическими и хирургическими средствами.
В патенте США N 4775661 описывается лечение рака молочной железы с использованием терапии, предусматривающей введение женщине (после того, как гормональный выброс ее яичников был блокирован химическим или хирургическим путем) антиандрогена и необязательно некоторых ингибиторов биосинтеза половых стероидных гормонов.
В патенте США N 4760053 описывается лечение рака, индуцируемого некоторыми половыми стероидными гормонами, которое предусматривает введение различных конкретных комбинаций соединений, выбранных из LHPH-агонистов, антиандрогенов, антиэстрогенов и некоторых ингибиторов биосинтеза половых стероидных гормонов.
Патент США N 4472382 относится к лечению аденокарциномы предстательной железы, доброкачественной гипертрофии предстательной железы и гормонзависимых опухолей молочной железы с использованием специфических фармацевтических средств или их комбинацией, обсуждаются также LHPH-агонисты и антиандрогены.
В публикации Международной заявки (ВОИС) 0921 05763 обсуждаются некоторые 16,16-дизамещенные андростеновые стероидные соединения, используемые для стимулирования роста волос и для лечения кожных заболеваний. В Международной патентной заявке PCT/W 086/01105 раскрывается способ лечения стероидзависимого рака у теплокровных животных, предусматривающий введение специфических лекарственных препаратов или их комбинаций. В этой работе обсуждаются антиандрогены, антиэстрогены, некоторые ингибиторы биосинтез половых стероидных гормонов и блокирование гормональных выбросов.
Другая рассматриваемая в настоящее время заявка (авторов настоящей заявки) на патент США N 07/321926, поданная 10 марта 1989 г., относится к способу лечения рака молочной железы и рака тела матки у восприимчивых теплокровных животных, включающему в себя в качестве одной из частей комбинированной терапии ингибирование секреции гормонов яичниками хирургическими средствами (овариэктомии) или химическими средствами (использование LHPH-агониста, например [D-Trp6, des-Gly-NH210] LHPH-этиламида, или его антогониста). В этой заявке обсуждаются антиэстрогены, андрогены, прогестины, ингибиторы продуцирования половых гормонов, в частности продуцирования стероидных гормонов, катализуемого 17 β- гидроксистероид-дегидрогеназой или ароматазой, ингибиторы секреции пролактина, и секреции гормона роста и секреции адренокортикотропного гормона (ACTH).
Было показано, что рецепторы андрогена присутствуют в нормальных клетках (Witliff, In: Buch, H, (Ed.) Methods in Cancer Res., Vol. 11, Acad. Press, New York, 1975, pp. 298-304, Allegra et. al., Cancer Res. 39: 1447-1454, 1979) и в опухолевых клетках (Allegra et al., Cancer Res. 39; 1447-1454; Englesmann et al., Brit. J. Cancer 30: 177-181, 1975; Moss et al., J. Step Biochem. 6: 743-749, 1975; Miller et al., Eur. J. Cancer Clin Oncol. 2: 539-542, 1975; Lippman et al., Cancer 38: 868-874, 1976; Allegra et al., Cancer Res. 39: 1447-1454, 1979; Miller et al., Eur J. Clin Oncol, 21: 539-542, 1985; Lea et al., Cancer Res. 49:7162-7167, 1989), а также в клеточных линиях установленной карциномы молочной железы (Lippman et al., Cancer Res. 36: 4610 - 4618, 1976; Horwitz et al., Cancer Res. 38: 2434 - 2439, 1978; Poulin et al. , Breast Cancer Res. Treatm. 12: 213 - 225, 1988). Рецепторы андрогена также присутствуют в диметилбенз(а)антрацен (ДМБА)-индуцированных опухолях молочной железы у крыс (Asselin et al., Cancer Res. 40: 1612 - 1622, 1980).
Описаны также рецепторы андрогена, присутствующие в эндометрии человека (MocLaughlin and Richardson, J. Steroin Biochem. 10: 371 - 377, 1979; Muechler and Cohler, Gynecol. Invest. 8: 104, 1988). Кроме того, было описано ингибирующее действие андрогена метилтриенолона (R1881) на рост карциномы эндометрия in vitro (Centola, Cancer Res. 45: 6264 - 6267, 1985).
В недавно опубликованных работах указывается, что рецепторы андрогена могут быть добавлены к экстрогеновым рецепторам с выбранной реакционной способностью или даже заменять эти эстрогеновые рецепторы, что, как предполагается, будет способствовать усилению реакционного ответа на эндокринную терапию (Teulings et al., Cancer Res. 40: 2557 - 2561, 1980; Bryan et al., Cancer 54: 2436 - 2440, 1984).
Первым андрогеном, который был успешно использован для лечения прогрессирующего рака молочной железы, является тестостерона пропионат (Nathason, Res. Prog. Horm. Res. 1: 261 - 291, 1947). После этого многие исследования подтвердили положительное воздействие андрогенов при лечении рака молочной железы (Alan and Herrman, Ann. Surg. 123: 1023 - 1035; Adair, Surg. Gynecol. Obstet. 84: 719 - 722, 1947; Adair et al., JAMA 140: 1193 - 2000, 1949). Эти первые результаты, полученные при исследовании совместного действия тестостерона пропионата и DES, показали, что эта комбинированная терапия дает очевидную ремиссию (Subcommittee on Steroid and Cancer of the Committee on Research of the Counsil on Pharmasy and Chemistry of the Am. Med. Association followed by the Cooperative Breast Cancer Group under the Cancer Chemotherapy National Service Center of the NCI), где было установлено, что введение тестостерона пропионата способствует повышению скорости и продолжительности ремиссии, повышению качества жизни и степени выживания (Cooperative Breast Cancer Group, JAMA 188, 1069 - 1072, 1964).
У 48% женщин в постклимактерическом периоде, которым вводили андроген с пролонгированным действием (метанола энантат) (Kennedy et al., Cancer 21: 197 - 207, 1967), наблюдалась ответная реакция (13 из 27 пациентов). У восприимчивой к лечению группы средняя продолжительность жизни была в четыре раза выше, чем у невосприимчивой группы (27 месяцев по сравнению с 7,5 месяцами). Большое число исследований показало, что андрогенная терапия дает ремиссию у 20 - 40% женщин с метастатическим раком молочной железы (Kennedy, Hormon Therapy in Cancer. Geriatrics 25: 106 - 12, 1970; Goldenberg et al., JAMA 223a 1267 - 1268, 1973).
Недавно 39%-ная реакция со средним удлинением продолжительности жизни 11 месяцев наблюдалась у группы из 33 женщин в посклимактерическом периоде, предварительное лечение которых Тамоксифеном (Manni et al., 48: 2507 - 2509, 1981), проводившееся после лечения Флуоксиместероном (Галостанин) (10 мг, два раза в день), не дало положительных результатов. 17 из этих женщин были также подвергнуты гипофизэктомии. При этом не наблюдалось какого-либо различия в показателях восприимчивости к Флуоксиместерону у пациентов, которые ранее реагировали на Тамоксифен и у пациентов, которые не давали положительной реакции на Тамоксифен. Из 17 пациентов, которые не были восприимчивыми ни к Тамоксифену, ни к гипофизэктомии, 7 оказались восприимчивыми к Флуоксиместерону со средним удлинением жизни 10 месяцев. Из них две пациентки оказались либо невосприимчивыми к Тамоксифену, либо к гипофизэктомии.
Было показано, что использование комбинации Флуоксиместерона и Тамоксифена дает лучшие результаты, чем использование лишь одного Тамоксифена. Практически полная восприимчивость (CR) (complete response) наблюдалась только при комбинированном лечении; причем у 32% пациенток при комбинированном лечении обнаруживали частичную восприимчивость (PR) (partial response) по сравнению лишь с 15% при монотерапии. Кроме того, при комбинированной терапии число невосприимчивых пациенток составляло лишь 25%, тогда как число восприимчивых пациенток, получавших лишь один TAM, составляло 50% (Tormey et al. Ann. Int. Med. 98: 139 - 144, 1983). Кроме того, средний период времени от начала терапии и до момента ее неблагоприятного исхода был более продолжительным (180 дней) при использовании Флуоксиместерона + Тамоксифена, чем при использовании лишь одного Тамоксифена (64 дня). Таким образом, при комбинированном лечении наблюдается тенденция к увеличению продолжительности жизни (380 дней по сравнению с 330 днями).
Было высказано предположение о независимости положительного эффекта комбинированной терапии, проводимой с использованием андрогена и антиэстрогена, которое опиралось на тот вывод, что пациенты, невосприимчивые к Тамоксифену, должны быть восприимчивыми к Флуоксиместерону, и наоборот. Более того, у пациентов, подвергавшихся лечению Тамоксифеном и перекрестно Флуоксиместероном, продолжительность жизни была больше, чем у пациентов, придерживавшихся обратной схеме лечения (Tormey et al., Ann. Int. Med. 98: 139 - 144, 1983).
Тот факт, что тестостерона пропионат дает положительный эффект у женщин как в пред-, так и в постклимактерическом периоде (Adair et al., J. Am. Med. Ass. 155, 1193 - 1200, 1949) указывает на то, что помимо ингибирования секреции гонадотропина, андроген также оказывает ингибирующее действие на развитие самой раковой опухоли.
В недавно проведенных in vitro - исследованиях описывается относительное антипролиферативное действие андрогена на рост клеток эстрогенвосприимчивой карциномы молочной железы человека клеточной линии ZR-75-1 (Poulin et al., "Androgens inhibit basal and estrogen-induced cell proliferation in the ZR-75-1 human breast cancer cell line", Breast cancer Res. Treatm. 12: 213 - 225, 1989). Как указывалось выше (Poulin et al., Breast Cancer Res. Treatm. 12: 213 - 225, 1989), было установлено, что рост клеток ZR-75-1-карциномы молочной железы человека ингибируется андрогенами, причем ингибирующее действие андрогенов является аддитивным и эффективным в сочетании с антиэстрогенами. Ингибирующее воздействие андрогенов на рост клеток ZR-75-1 карциномы молочной железы человека также наблюдалось in vivo у "голых" мышей. (Dauvois and Labrie, Cancer Res. 51: 3131 - 3151, 1991).
При исследовании возможного механизма действия андрогена было показано, что андрогены оказывают сильное ингибирующее действие на рецепторы эстрогена (EP) и прогестерона (PgR), содержащиеся в клетках карциномы ZR-75-1 молочной железы человека, как было измерено посредством связывания с радиоактивным лигандом и анти-ER моноклональными антителами. Аналогичный ингибирующий эффект наблюдался на уровнях ER - мРНК, измеренных с помощью анализа методом защиты рибонуклеазы. Андрогенное действие измеряли при субнаномолярных концентрациях неароматизируемого андрогена 5 α - дигидротестостерона (независимо от присутствия эстрогенов) и конкурентно реверсировали с использованием гидроксифлутамида (антиандрогена) (Poulin et al., Endocrynology 125: 392 - 399, 1989). Полученные данные относительно экспрессии рецептора эстрогена дают возможность предположить, что по крайней мере частично антиэстрогенное действие андрогенов направлено против роста самих клеток карциномы молочной железы и, более того, они дают основание предположить, что ингибирующее действие андрогенной терапии является аддитивным по отношению к стандартной терапии, ограничивающейся блокадой эстрогенов антиэстрогенами.
Daunois и др. (Breast Cancer Res. Treatment, 14: 299 - 306, 1989) показали, что постоянное высвобождение андрогена 5 α- дигидротестостерона (DHT) у овариэктомизированных крыс, имеющих ДМБА-индуцированную карциному молочной железы, вызывает заметное ингибирование опухолевого роста, индуцированного 17 β- эстрадиолом (E2). Действие DHT посредством взаимодействия с андрогеновым рецептором подтверждается тем фактом, что, как было установлено, одновременная терапия антиандрогеном флутамидом полностью нейтрализует действие DHT. Сильное ингибирующее действие андрогена DHT на рост опухоли особенно хорошо иллюстрирует тот факт, что под действием DHT число прогрессирующих опухолей снижалось от 69,2% до 29,2% у E2 - обработанных животных, а также тот факт, что под действием андрогена увеличивалось число случаев полной восприимчивости (исчезновение пальпируемых опухолей) от 11,5% до 33,3% у той же группы животных. Во время лечения с использованием андрогена DHT, действие которого также нейтрализуется антиандрогеном флутамидом, число опухолей, вновь появившихся за период 28-дневного наблюдения у E2 - обработанных животных, снизилось от 1,5 ± 0,3 до 0,7 ± 0,2 на крысу. Эти результаты в первую очередь указывают на то, что андрогены являются сильными ингибиторами роста ДМБА-индуцированной карциномы молочной железы, действие которых не зависит от ингибирования секреции гонадотропина, и как предполагается, направлено непосредственно на саму опухоль, причем указанные результаты подтверждают in vitro данные, полученные для клеток ZR-75-1-карциномы молочной железы человека (Poulin et al., Breast Canser Res. Treatm. 12: 213 - 225, 1988).
Натуральные андрогены тестостерон (TESTO) и дигидротестостерон (DHT) образуются в результате превращения андростендиона в TESTO с помощью 17 β- гидроксистероид-дегидрогеназы, с последующим превращением TESTO в DHT посредством воздействия фермента 5 β, редуктазы. Предшественник адреналина 5-андрост-5-ен-3 β- 17 α- диол может быть также конвертирован в TESTO с помощью фермента 3 β- гидроксистероид-дегидрогеназы/ Δ 5 Δ 4-изомеразы (3 β- -HSD).
Поскольку натуральные андрогены TESTO и DHT обладают сильным маскулинизирующим действием, то для получения соединений, обладающих меньшим нежелательным побочным маскулинизирующим действием (рост волос на теле, облысение, угри, себорея и громкий голос), могут быть синтезированы различные производные TESTO, а также прогестерона.
Медроксипрогестерона ацетат (MPA) является одним из соединений, наиболее широко используемых в эндокринной терапии прогрессирующего рака молочной железы у женщин (Mattson, Breast Canser Res. Treatm. 231 - 235, 1983; Blumenschein, Semin. Oncol. 10: 7 - 10, 1983; Hortobagyi et al., Breast Canser Res. Treatm. 5: 321 - 326, 1985; Haller and Glick, Semin. Oncol. 13: 2 - 8, 1986; Horwitz, J. Steroid. Biochem. 27: 447 - 457, 1987). Процент полной клинической восприимчивости при высоких дозах указанного синтетического прогестина в среднем составляет 40% для группы неотобранных пациентов с раком молочной железы (Horwitz, J. Steroid Biochem. 27: 447 - 457, 1987), то есть его эффективность сравнима с эффективностью нестероидного антиэстрогена Тамоксифена (Lippman, Semin. Oncol., 10 (Suppl): 11 - 19, 1983). Однако, в основном, для лечения рака молочной железы MPA используют после другого эндокринного терапевтического воздействия. Максимальное ингибирующее воздействие медроксипрогестерона ацетата (MPA) на рост клеток карциномы молочной железы человека in vitro может быть достигнуто при концентрации уже до 1 нМ, тогда как для глюкокортикоидного действия часто требуется примерно в 1000 раз более высокая доза (Poulin et al., Breast Canser Res. Treatm. 13: 161 - 172, 1989).
До настоящего времени механизм, лежащий в основе противоопухолевой активности MPA, был мало изучен и приписывался взаимодействию с рецептором прогестерона. Однако, как было установлено, этот стероид обладает высоким средством к рецепторам прогестерона (PgR), а также к рецепторам андрогена (AR) и глюкокортикоидным рецепторам (GR) в различных тканях животных (Perez Palacios et al. , J. Steroid Biochem. 19: 1729 - 1735, 1983); Janne and Bardin, Pharmacol. Rev. 36: 35S-42S, 1984; Pridjian et al., J. Steroid Biochem, 26: 313 - 319, 1987; Ojasso et al., J. Steroid Biochem, 27: 255 - 269, 1987), а также в опухолях молочной железы человека (Young et al., Am. J. Ostet. Gynecol. 137: 284 - 292, 1980); причем это свойство присуще и другим синтетическим производным прогестерона (Bullock et al., Endocrinology 103: 1768 - 1782, 1978; Janne and Bardin, Pharmacol. Rev. 36: 35S-42S, 1984; Ojasso et al., J. Sreroid Biochem. 27: 255 - 269, 1987). Известно, что при добавлении к рецепторам прогестерона (PgR), большинство синтетических гестагенных агентов обнаруживают значительную аффинность связывания с рецепторами андрогена (AR), а также с глюкокортикоидными (GR) рецепторами; и индуцируют биологическое действие, специфически определенное этими конкретными рецепторными системами (Labrie et al. , Fertil. Steril. 28: 1104 - 1112, 1977; Engel et al., Canser Res. 38: 3352 - 3364, 1978; Raynaud et al., In: Mechanisms of Steroid Action (G.P. Lewis, M. Grisburg, eds), Mac Miland Press, London, pp 145 - 158, 1981; Rochefort and Chalbos, Mol. Cell. Endocrinol. 36: 3 - 10, 1984; Janne and Bardin, Pharmacol. Rev. 36: 355-425, 1984; Poyet and Labrise, Mol. Cell. Endocrinol. 42: 283 - 288, 1985; Poulin et al. , Breast Canser Res. Treatm. 13: 161 - 172, 1989). В соответствии с этим, у пациентов, прошедших терапию с использованием MPA, отмечались некоторые побочные явления, не связанные с гестагенным действием.
Ингибирующее действие MPA на секрецию гонадотропина явно обнаруживается посредством его непосредственного взаимодействия с AR гипофиза крыс (Labrie et al. , Fertil. Steril. 28: 1104 - 1112, 1977; Perez-Palacios et al., J. Steroid Biochem. 19: 1729 - 1735, 1983) и человека (Perez-Palacios et al., J. Steroid Biochem. 15: 125 - 130, 1981). Кроме того, MPA оказывает андрогенное действие в мышиной почке (Janne and Bardin, Pharmacol. Rev. 36: 35S-42S, 1980) и в вентральной простате крыс (Labrie C. et al., J. Steroid Biochem. 28: 379 - 384, 1987, Lobrie C. et. al., Mol. Cell. Endocrinol. 68: 169-179, 1990/. Несмотря на свое высокое сродство с AR, MPA редко вызывает симптомы значительной вирилизации (угри, гирсутизм и т.п.) (Haller and Glick, Semin. Oncol. 13; 2-8, 1986).
Наиболее легко объясняемые побочные явления, ассоциированные с введением MPA, связаны с его глюкокортикоидным действием и проявляются в виде синдрома Кушинга, эйфории и субъективного ослабления боли (Mattsson, Breast Cancer Res. Treatm. 3: 231-235 1983; Blossey et al., Cancer 54: 1208-1215, 1984: Hortobagyi et al., Breast Cancer Res. Treatm. 5: 321-326, 1985; Von Veelen et al., Cancer Chemother. Phormacal. 15. 167-170, 1985). Подавление функции надпочечников MP-ацетатом, очевидно, обусловлено его ингибирующим действием на АСТН-секрецию на уровне гипофиза, и непосредственным ингибированием стероидогенеза на уровне надпочечников (Blossey et al., Cancer 54; 1208-1215, 1984; Van Veelen et al., Cancer Chemother. Pharmacol. 15: 167-170, 1985; Van Veelen et al., Cancer Treat. Rep. 69: 977-983, 1985).
Несмотря на свое высокое средство к AR, MPA редко вызывает симптом значительной вирилизации (угри, гирсутизм, и т.п.) (Haller and Glick, Semin Oncol. 135 2-8, 1986). Более того, что ингибирующее действие MPA на секрецию гонадотропина явно обнаруживается посредством его непосредственного взаимодействия с AP гипофиза у крыс (Labrie et al., Fertil. Steril. 28: 1104-1112, 1977; Perez-Palacios et al., J. Steroid Biochem. 19: 1729-1735, 1983) T и у человека (Perez-Palacios et al., J. Steroid Biochem. 15: 125-130, 1981). Кроме того, MPA обладает андрогенной активностью в почке мыши (Janne and Bardin, Pharmacol, Rev. 36: 35S-42S, 1980) и в вентральной простате крыс (Labrie. C. et al., J. Steroid "Biochem. 28: 379-384, 1987: Labrie. C. et al., Mol. Cell. Endocrynol. 68: 169-179, 1990).
Poulin и др. в своей работе: "Androgen and glucocorticoid receptor-mediated inhibition of cell proliferation by medroxy-progesteron acetat in ZR-75-1 human breast cancer cells" (Breast Cancer Res. Treatm. 13: 161-172, 1989) недавно обнаружили, что ингибирующее действие медроксипрогестерона ацетата (MPA) на рост клеток карциономы молочной железы 75-1 человека обусловлено андрогенными свойствами этого соединения. Андрогенные свойства MPA были проиллюстрированы и в других системах (Labrie C. et al., J. Steriod Biochem. 28: 379-384, 1987; Luthy et al., J. Steroid Biochem. 31:845-852, 1988; Plante et al., J. Steroid Biochem. 31: 61-64, 1988; Lobrie C. et. al., Moll. Cell. Endocrynol. 58: 169-179, 1990). Было также показано, что другие синтетические прогестины, помимо своей гестогенной активности, обладают андрегенной активностью в различной степени (Labrie et al., Fertit. Steril. 31: 29-34; 1979; Poyet and Labrie, The Prostat. 9: 237-246, 1986; Labrie C. et. al. , J. Steroid Biochem. 28: 379-384, 1987; Luthy et al., J. Steroid Biochem. 31: 845-852, 1988; Plante et al., J. Steroid Biochem 31: 61-64, 1989).
Высокие дозы прогестинов, а в частности медроксипрогестерона ацетата и мегестрола ацетата, были также с успехом использованы для лечения рака тела матки (Tatman et al. , Eur. J. Cancer Clin. Oncol. 25: 1619-1621, 1989; Podratz et al. , Obstet Gynecol. 66: 106-110, 1985; Enrlich et al., Am. J. Obstet. Gynetol. 158: 797-807, 1988).
Было показано, что андроген метилтестостерон способствует устранению симптомов эндометриоза (Hamblen, . South Ned. J. 50: 743, 1987; Preston, Obstet. Gynecol. 2: 152, 1965). Однако при использовании сильных андрогенных соединений, таких как тестостерон и его производные, андрогенное и мускулинизирующие побочные действия (иногда необратимые) являются весьма значительными.
Высокая доза MPA в качестве начального лечения рака молочной железы показала аналогичный эффект, что и Тамоксифен (Van Veeten et al., Cancer, 58; 7-13, 1986). Высокая доза прогестина, в частности медроксипрогестерона ацетата и мегестрола ацетата, была также успешно использована при лечении эндометриального рака (Tatman et al., Eur. J. Cancer Clin Oncol. 25: 1619-1621, 1989; Podratz et al., Obstet Gynecol. 66: 106-110 1985; Ehrlich et al. , Am. J. Obstet. Gynecol. 158: 797-807, 1988). Высокая доза MPA давала эффект, аналогичный эффекту, получаемому при использовании Тамоксифена, в лечении карциномы эндометрия (Rendina et al. , Europ. J. Obstet. Gynecol. Reprod Biol. 17. 285-291, 1984).
В рандомизированных клинических испытаниях высокая доза МРА, вводимая в течение 6 месяцев, способствовала рассасыванию опухоли у 50% пациентов и частичному рассасыванию у 13% пациентов по сравнению с 12% и 6% соответственно пациентами, которые получали плацебо (Tetimaa et al., Genycol. Endocrinol. 1:13, 1987).
Было показано, что андроген метилтестостерон устраняет симптомы эндометриоза (Hamblen, South Med. J. 50: 743, 1987; Preston, Obstet. Gynecol. 2: 152, 1965). Однако использование андрогенных соединений, таких как тестостерон, связана со значительными андрогенными и маскулинизирующими побочными явлениями (иногда необратимыми).
Аналогично андрогениндуцированному ослаблению рецепторов эстрогена в клетках карциномы ZR-75-1 молочной железы человека (Poulin et al., Endocrinology, 125: 392-399, 1989), пероральное введение МРА женщинам во время фолликулярной фазы вызывает снижение уровня связывающегося эстрогена в эндометрии (Tseng and Garpide, J. Clin. Endocrinol. Metab. 41; 402-404, 1975).
Исследования, проведенные на животных, показали, что дефицит андрогена приводит к нарушению остеогенеза, а введение тестостерона, в целом, повышает костеобразование (Silberberg and Silberberg, 1971, см. Finkelstein et al., Am. Int. Med. 106: 354-361, 1987). Орхиэктомия у крыс может привести к остеопорозу, обнаруживаемому через 2 месяца (Winks and Felks, Calcif Tissue Res. 32: 77-82, 1980; Verhas et al, Calif. Tissue Res. 39: 74-77, 1986).
Хотя ожидалось, что женщины с гирсутизмом, олигоменореей и аменореей и с низкими уровнями E2 в крови имеют пониженную массу костей, однако, как оказалось, пониженный риск развития остеопороза имеют женщины с высокими уровнями андрогена (но низкими уровнями эстрогена) (Dixon et al., Clinical Endocrinology, 30: 271-277, 1989).
Было обнаружено, что при остеопорозе уровни надпочечного андрогена понижены (Nordin et al., J. Clin Endocr. Metab. 60: 651, 1985). Кроме того, было показано, что женщины в постклимактерическом периоде, имеющие повышенные уровни андрогенов, практически защищены от прогрессирующего остеопороза (Deutsch et al., Int. J. Gynecol. Obstet. 25: 217-222, 1987; Aloia et al., Arch. Int. Med. 143. 1700-1704, 1973). В соответствии с указанной ролью андрогенов было установлено, что уровни метаболитов андрогена в моче значительно ниже у женщин с постклимактерической симптоматической менопаузой, чем у пациенток соответствующего контроля, и уровня конъюгированного дегидроэпиандростерона (DHEA) значительно снижены в плазме пациентов с остеопорозом (Hollo and Feher, Acta Med. Hung. 20: 133, 1964; Urist and Vincent, J. Clin Orthop. 18: 199, 1961; Hollo et al., Acta Med. Hung 27; 155, 1970). Высказывалось даже предположение, что остеопороз в постклимактерическом периоде возникает как в результате низкого уровня эстрогенов, так и в результате низкого уровня андрогенов (Hollo et al., Lancet: 1357, 1976).
Что касается механизма предполагаемой выше роли как эстрогенов, так и андрогенов при остеопорозе, то в этой связи указывается, что присутствие рецепторов эстрогена (Komm et al., 241: 81-84, 1988; Friksen et al., Scince, 241: 84-86, 1988), а также андрогена (Colvard et al, Proc. Natl. Acad Scince, 86: 854-857, 1989) в остеобластях может объяснять повышенную ресорбцию кости, наблюдаемую после истощения эстрогенов и андрогенов.
У юношей, в период нормального полового созревания, повышение уровней тестостерона в сыворотке способствует усилению активности щелочной фосфатазы (показатель остеогенной активности), которое, в свою очередь, способствует увеличению плотности кости (Krabbe et al., Arch. Dis. Child. 54: 950-953, 1979; Krabbe et al., Arch. Pediat Scand., 73: 750-755, 1984; Riis et al., Calif. Tissue Res., 37: 213-217, 1985).
У женщин быстрое разрежение кости наблюдается, начиная с момента наступления менопаузы, тогда как у мужчин такое разрежение кости может наблюдаться в возрасте около 65 лет (Riggs et al., J. Clin. Invest. 67: 328-335, 1987). Значительное разрежение кости у мужчин наблюдается примерно в возрасте 80 лет, которое сопровождается учащением случаев переломов тазобедренных суставов, позвоночника и запястья. Некоторые проведенные исследования показали, что остеопороз является клиническим проявлением дефицита андрогена у мужчин (Baran et al., Calcif. Tissue Res., 26: 103-106, 1978; Ooell and Swerdloff. West. J. Med., 124: 446-475, 1976; Smith and Walker, Calif. Tissue Res. 22 (Suppl.): 225-228, 1976).
У мужчин, хотя и менее часто, чем у женщин, остеопороз может вызывать значительную болезненность (Seeman et al. , Am. J. Med, 75 75: 977-983, 1983). Фактически, дефицит андрогена представляет собой значительный риск для компрессии спинного мозга у мужчин (Seeman et al., Am. J. Med. T. 75: 977-983, 1983). Пониженная плотность лучевых и спинномозговых костей сопровождается гипогонадизмом, связанным с гиперпролактинемией (Greespan et al., Ann Int. Med., 104: 777-782, 1986) или нервной анорексией (Riggottie et al., JAMA, 256: 385-388, 1986). Однако в этих случаях роль гиперпролактинемии и снижения веса тела остается невыясненной.
Хорошо известно, что гипогонадизм у мужчин является причиной перелома костей при остеопорозе (Albrigh and Rienfenstein, 1984; Saville, Clin. End. Metab. , T. 2: 177-185, 1973). Фактически, плотность кости снижается как при первичном гипогонадизме, так и при вторичном гипогонадизме (Velentras and Karras. Nouv. Presse Medicale 10: 2520, 1981).
Серьезное нарушение остеогенеза, проявлявшееся в снижении кортикального слоя кости и губчатой кости, наблюдалось у 23 мужчин с гипогонадотропным синдромом (Filkelstein et al., Ann. Ind., Med 106: 354-361, 1987; Foresta et al., Horm, Metab Res. 15:56-57; 1983).
Нарушение остеогенеза также наблюдалось у мужчин с синдромом Клайнфельтера (Foresta et al., Horm Metab. Res. 15:206-207, 1983; Foresta et al., Horm. Metab. Res. 15:56-57, 1983; Smith and Walker. Calif Tissue Res. 22: 225-228, 1977).
Была описана андрогенообратимая пониженная чувствительность к кальцитонину у крыс после кастрации (Ogata et al., Endocrinology 87: 421, 1970; Hollo et al., Lancet 1: 1205, 1971; Hollo et al., Lancet 1: 1357, 1976).
Кроме того, было обнаружено, что у мужчин с гипогонадизмом уровень кальцитонина в сыворотке понижен (Foresta et al., Horm. Metab. Res. 15: 206-207, 1983), а тестостероновая терапия кастрированных крыс способствует увеличению гипокольцинемического действия кальцитонина (McDermatt and Kidd. End. Rev.8: 377-390, 1987).
Albight and Ruferstein (1984) высказали оригинальное предположение, что андрогены способствуют повышению синтеза костного матрикса. Было показано также, что андрогены способствуют увеличению синтеза остеоидной ткани и минерализации костной ткани у кур (Puche and Rosmano, Calif. Tissue Res. 4: 39-47, 1969). Андрогенная терапия у мужчин с гипогонадизмом стимулирует развитие и укрепление скелета (Webster and Hogkina, Proc. Soc. Exp. Biol. Med. 45: 72-75, 1940). Кроме того, было показано, что тестостероновая терапия способствует положительному балансу азота, кальция и фосфата (Albright, E. , Reinfenstein E.C., In: The Parathyroid glands and metabolic bone disease. Williams and Williams Co.: Baltimore. pp. 145-204, 1948).
Как было показано путем исследования кости с помощью гистоморфометрии, тестостероновая терапия вызывает у мужчин с гипогонадизмом увеличение относительного объема остеоидной ткани, полной площади поверхности остеоидной ткани, линейное возрастание костеобразования и минерализацию кости (Barau et al., Calcif. Tissue Res. 26: 103-106, 1978).
Было проиллюстрировано, что лечение тестостеронами способствует увеличению поверхности остеоида и ширины луча с постоянной или обратно пропорциональной скоростью, повышая тем самым скорость минерализации кости (Peacock et al., Bone 7: 261-268, 1986). Наблюдаемое также снижение уровня фосфата в плазме обусловлено, по-видимому, воздействием на почвенную турбулярную реабсорбцию фосфатов (Selby et al., Clin Scu 69: 265-271, 1985).
При нормализации тестикулярной функции у мужчин с гиперпролактинемическим гипогонадизмом плотность кортикального слоя кости увеличивается (Greenspan et. al. , Ann. Int. Med., 104: 777-782, 1986; Greenspan et al., Ann Int. Med. 110: 526-531, 1989). Терапия с использованием тестостерона стимулирует костеобразование у мужчин с первичным гипогонадизмом (Baron et. al. , Calcif. Tissue Res. 26: 103-106, 1978; Francis et. al., Bone 7: 261-268, 1986).
У 21 мужчин с гипогонадизмом и с дефицитом C PH, нормализация уровня тестостерона в сыворотке, имевшая место в течение более, чем 12 месяцев, способствовала увеличению плотности кости (Kinkelstein et. al., J. Clin. Endocr. Metab. 69: 776-783, 1989). При этом, у мужчин с уже сращенным эпифизеолизом наблюдалось значительное увеличение плотности кортикального слоя кости, однако значительного изменения плотности трабекулярной кости на наблюдалось, что поддерживает высказанное ранее предположение с неустойчивой чувствительностью кортикальной и трабекулярной кости к стероидной терапии.
Проведенные ранее исследования с использованием анаболических стероидов при лечении небольшой группы пациентов позволили предположить о их благоприятном воздействии на костную ткань (Lafferty et al., Ann. J. Med. 36:514-528, 1964; Riggs et. al., J.Clin. Invest. 51; 2659-2663, 1972; Harrison et al. , Metabolism 20: 1107-1118, 1971). Позднее, измерения полного содержания кальция в организме, проведенные путем нейтронной активации, используемой в качестве параметра, показали положительное и относительно продолжительное (24-26 месяцев) воздействие анаболического стероида метандростенолона при исследовании (двойным слепым методом) постклимактерического остеопороза (Chessnut et al., Metabolism 26: 267-277, 1977; Aloia et al., Metabolism 30: 1076-1079, 1981).
Анаболические стероиды типа нандролона деканоата способствуют снижению ресорбции кости у женщин с остеопорозом (Dequeker and Geusens, Acta Endocrinol. 271 (Suppl.): 45-52, 1985), что соответствует результатам, полученным при проведении эстрогенной терапии (Dequeker and Ferin, 1976, см. Dequeker and Geusens). Эти данные подтверждают экспериментальные данные, полученные для кроликов и собак, у которых наблюдалось снижение ресорбции кости при введении нандролона деканоата (Ohem et al., Curr. Med. Res. Opin. 6: 606-613, 1980). Более того, при введении анаболических стероидов женщинам с остеопорозом (Dequeker and Geusens, Acta Endocrinol. (Suppl). 271: 45-52, 1985) наблюдалось не только снижение разрежения кости, но также и увеличение массы кости. С другой стороны, лечение витамином D способствует лишь снижению ресорбции кости.
У женщин постклимактерического периода лечение, проводимое с использованием нандролона, способствовало увеличению содержания минеральных веществ в кортикальном слое кости (Clin. Orthop. 225:273-277). Однако наличие андрогенных побочных явлений было зарегистрировано у 50% пациентов. Эти данные представляют особый интерес, поскольку имеющиеся до сих пор средства лечения ограничивались лишь приостановкой прогрессирующего разрежения кости, тогда как использование анаболического стероида нандролона стимулировало костеобразование. Было высказано предположение, что аналогичное стимулирование костеобразования может быть проведено путем андрогенной терапии у мужчин с гипогонадизмом (Baran et al. , Calcif. Tissue Res 26: 103, 1978). Недостаток схем лечения, в которых для ингибирования ресорбции кости используются кальций, кальцитриол или гормоны, заключается в том, что они почти всегда приводят к подавлению костеобразования (Need et. al., Mineral Electrolyte Metabolism 11: 35, 1985). Хотя Albright and Reiferestein (1948) (см. Need, Clin Orthop. 225; 273, 1987). Высказали предположение, что остеопороз как следствие пониженного костеобразования будет восприимчивым к тестостеронной терапии, однако маскулизирующее действие андрогенов не позволяет использовать их для лечения женщин в постклимактерическом периоде жизни. В соответствии с этим, были разработаны анаболические стероиды, т.е. соединения, обладающие меньшим маскулинизирующим действием. Хотя некоторые исследователи (Wilson and Griffin, Metabolism. 28: 1278, 1980) отмечали минимальный эффект такого лечения, однако, были сообщения и о более положительных результатах (Chessnut et al., Metabolism 32: 571-580; 1983; Chessnut ea tl., Metabolism, 26: 267, 1988; Dequeker and Geusens Acta Endocrinol. (Suppl. 110) 271: 452, 1985). Рандомизированные исследования женщин в постклимактерическом периоде показали, в целом, увеличение массы костной ткани при проведении лечения анаболическим стероидом станазололом, однако побочные явления отмечались у большинства пациенток (Chessnut et al., Metabolism 32: 571-580; 1983).
Как указывалось выше, дозы "прогестинов", например медроксипрогестерона ацетата, используемые при традиционном лечении рака молочной железы, сопровождаются значительными и нежелательными побочными явлениями (в частности, явлениями, связанными со взаимодействием стероидного гормона с глюкокортикоидным рецептором, например, такими как синдром Кушинга, эйфория) (Mottsson, Breast Canser Res. Treatm. 3: 231-235, 1983; Blossey et al., Cancer 54: 1208-1215, 1984; Hortobagyi et al., Breast Cancer Res. Treatm. 5: 321-326, 1985, Von Veelen et al., Cancer Chemother. Pharmacol, 15: 167-170, 1985).
Термин "прогестин" относится к производным прогестерона тестостерона. В некоторых случаях указанные прогестины были синтезированы в целях получения соединений, действующих как аналоги прогестерона на рецепторы прогестерона, в частности в целях регулирования рождаемости. Однако новые и более точные испытания показали, что указанные соединения, которые первоначально были предназначены для взаимодействия исключительно с рецепторами прогестерона, также взаимодействуют, и часто с высокой эффективностью, с рецепторами андрогена (Labrie et al., Fertil, Steril. 28: 1104-1112, 1977; Labrie et al. , Fertil, Steril. 31: 29-34; 1979; Labrie C. et al., J. Steroid Biochem. 28: 379-384, 1987; Labrie C. et al., Mol. Cell. Endocrinol. 68: 169-1793, 1990). Иногда, андрогенная активность этих соединений, особенно при низких концентрациях, превышает их истинную прогестиновую активность. К такому типу соединений относится, например, медроксипрогестерона ацетат (Poulin et al., Breast Cancer Res. Treatm. 13: 161-172, 1989).
Побочные явления, имеющие место при указанном способе терапии, являются основным недостатком практиковавшегося до сих пор лечения рака молочной железы и рака матки с использованием синтетических прогестинов. Традиционное лечение рака молочной железы путем блокады эстрогенов может оказывать неблагоприятное влияние на массу костной ткани у женщин. Аналогичное неблагоприятное влияние на массу костной ткани у женщин может оказывать традиционное лечение рака матки путем блокады эстрогенов.
Контрацептивные препараты, которые позволяют предохраняться от беременности в течение длительного периода времени, были разработаны уже 25 лет назад и используются до настоящего времени. Они включают в себя стероиды с пролонгированным высвобождением после инъекции (например Depoprovera, или позже были разработаны внешние системы доставки, например имплантаты, микросферы, вагинальные кольца, 1.U.DS, и т.п.). В настоящее время, в рамках программ по планированию семьи используют MPA и норэтистерон (NET)-энантат. По оценкам за 1985 год, 4 миллиона женщин принимали MPA и почти 1 миллион женщин принимали NET-энантат (Hall P.E., Lang-acting injectoble preparations. Fertility Regulation. Today and Tomorrow (Diczfalusy E., Bydeman M., eds) Raven Press: New York, pp. 119-141, 1987). Кроме того, по оценкам специалистов, 0,5 миллиона женщин в Латинской Америке и 1,0 миллион женщин в Китае принимают ежемесячные инъецируемые препараты, содержащие прогестерон и эстроген (Hall, 1987, см. выше.).
Обзор стероидных контрацептивных средств с пролонгированным высвобождением представлен в "Contraception", май, 1977, т. 15, N 5, стр. 513-533.
Для предохранения от беременности препарат (25 мг) в сочетании с 5 мг эстрадиола принимают один раз в месяц в виде инъекции (WHO, Said et al., Contraception 37: 1-20, 1988). Небольшое различие в эффективности и наличие побочных эффектов по сравнению с вышеуказанным препаратом наблюдалось при ежемесячной инъекции 50 мг норэтистерона энантана и 5 мг эстрадиола валерата. Было исследовано более чем 10000 женщин в каждой группе, принимавших вышеуказанные ежемесячные препараты. Комбинация "MPA-E2-ципионат" показала высокую эффективность как контрацептива, поскольку из 10969 женщин не было зарегистрировано случаев беременности. Частота прекращения введения ежемесячных инъекций женщинами была относительно высока и составляла 35% в год (WHO, Said et al., Contraception 37: 11-20, 1988), тогда как частота возникновения нерегулярных кровотечений составляла лишь у около 6,1%, а аменорея наблюдалась у 2,1% женщин. Опоздание к сроку введения инъекций, личные причины и потеря контроля сроков исполнения составляли до 18, 6% от всех причин прерывания эксперимента. Указанные данные свидетельствуют о необходимости разработки более приемлемых и легко доступных схем введения.
Использование DepoMPa (называемого также Depoprovera) отдельно (150 мг, 1М, каждые 3 месяца) 20498 менструирующими женщинами показало частоту случаев беременности 0,1±0,1%, нерегулярных кровотечений - 15, 0±1, 0% и случаев возникновения аменореи 11,9±1,0% (WHO, Said et al., Contraception 37: 1-20, 1988). В более мелкомасштабном исследовании (5434 менструирующих женщин), с использованием тех же самых доз DEPOMPa, получали следующие данные: частота прекращения приема составляла 40,7±2,0%, а частота возникновения нерегулярных кровотечений и аменореи имело место у 14,7±1,5% пациенток.
Ранее MPA использовали путем перорального введения или путем внутримышечной инъекции (Depoprovera). Недостаток перорального введения заключается в неравномерности и флуктуациях уровней MPA в крови, тогда как при инъекциях Depoprovera высвобождение MPA сначала происходит быстро, а затем, в последующие интервалы времени, снижается, причем достаточно неравномерно. Отсюда очевидно, что необходимо получить препараты с регулируемым высвобождением MPA, которые позволяли бы обеспечить постоянный уровень стериода в крови в течение продолжительного периода времени при соблюдении пациентом режима и схемы лечения, что в свою очередь позволило бы повысить эффективность указанного лекарственного средства. Аналогичные выводы могут быть сделаны и в отношении MGA.
В целях получения терапевтических препаратов с регулируемым высвобождением активного ингредиента, в последние 30 лет широко разрабатывались системы доставки лекарственного средства в нужные ткани в виде микрокапсул, которые изготавливались, в частности, путем введения активных ингредиентов в биологически разлагаемые полиэфиры, такие как поли (ε- капролактон), поли (ε - капролактон-CO-DL-молочная кислота), поли(DL-молочная кислота), поли(DL-молочная кислота-CO-гликоленовая кислота) и поли (ε- капролактон-CO-гликоленовая кислота). См. , например, работы (R.W. Baker, Controlled realease of biologically active agents, John Wiley and Sons Ed., N.Y., 1987), F. Lim, Biomedical Application of Microencapsulation, Franklim Lim, Ed. CRC. Press, Bocaraton, 1984).
В патенте США 3773919 (G.A. Boswell and R.M. Scribner) раскрывается использование полилактидных лекарственных смесей, содержащих, в частности, стероиды, такие как медроксипрогестерона ацетат, и обладающих пролонгированным действием.
В патенте DE/503679 (Carli) раскрываются получение композиций медроксипрогестерона ацетата путем объединения водонабухаемого нерастворимого полимера с водой.
В патенте WO 8807816 (R.J. Leaonard) раскрываются лекарственные препараты в виде шариков с расплавленным перекристаллизованным стероидом, которые используются как имплантат с пролонгированным высвобождением стериода.
В патенте US 4818542 e ca и др. раскрывается использование и получение пористых микросфер для системы доставки лекарственного средства.
В патенте DE 2010115 (Farbenfabriken Bayer AG) раскрывается получение твердых распыляемых микрогранул с замедленным высвобождением лекарственного средства.
В патенте США N 4166800 (F.W. Fong) раскрывается получение микросфер путем добавления агента разделения фаз при низкой температуре.
В патенте США N 4897268 (Tice и др.) раскрывается система доставки лекарственного средства, где инкапсулирование используется поли[DL-лактид-со-гликолид].
В патенте США N 4107071 (R.G. Bayless) раскрывается получение микрокапсул из частично гидролизованного сополимера этилена и винилацетата.
В патенте DE 2051580 (Du Pont и Co) раскрывается получение парентеральных гранул с регулируемым высвобождением.
В патенте США N 4622244 (Lapka и др.) раскрывается инкапсулирование макрочастиц или материала с разделением фаз и выделение микрокапсул при низкой температуре.
В патенте США N 4987268 (E.S. Nuwayser и W.A. Nucefora) раскрывается получение микрочастиц с составной серединой.
В патенте DE 4036425 раскрываются некоторые антиэстрогены и антипрогестомиметические стероиды.
Wise и др. (D.L. Wise Lactic/Glicolic Acid Polimers, Biology and Medicine, G. Gregotiadis ed., New York Academic. Press, pp 237-270, 1979) раскрывают применение сополимеров молочной/гликолевой кислоты в медицине. См. также Lewis, "Controlled Realease of bioactive Agents from Lactide/Glicolide Polimers", Drug and Pharmaceutical Sciences, vol. 45, pp. 1-41, 1990.
Был получен инъецируемый препарат с прологированным высвобождением, содержащий в качестве контрацептивного стероида норэтистерон, и продемонстрировавший на крысах равномерное высвобождение активного ингредиента в течение 2 месяцев (Anderson et al. , Contraception, 13: 375-384, 1976). Криогенно измельченные частицы размером 90-180 мкм и, содержащие 20% порэтистерона, вводили в биологически разлагаемый полимерный матрикс, синтезированный из L(+) молочной кислоты до молекулярной массы 200 000. Препарат (порошок из частиц размером 90-180 мкм), содержащий 20% норэтистерона в полимере, синтезированном из 90 частей L-лактида и 10 частей (по массе) гликолида до мол. массы 200 000, высвобождал активное соединение примерно в течение двух месяцев у бабуинов (Gresser et al., Contraception 17: 253-266, 1978). Однако эксперимент на крысах показал нулевую скорость высвобождения и не подтвердил результатов, полученных в эксперименте на приматах (Beck and Tice. In Long acting steroid contraception (D.R. Michell, ed) Raven Press: New York pp. 175-199, 1983). Система микрокапсул DL-PLANET является единственной лекарственной формой, которая была детально изучена в in vivo - условиях (Review by Back and Tice, In Long acting steroid contraception (D.R. Mishell, ed) Raven Press, New York, pp. 175-199, 1973).
Большинство способов получения микрочастиц требует использования органических растворителей, следовое количество которых все же остается в этих частицах и может вызывать местное или системное нежелательное токсическое действие. В других известных способах получения микрочастиц необходимо использовать высокие температуры, которые могут приводить к нежелательному термическому разложению стероида и/или полимера.
Проблемы, связанные с применением традиционных средств лечения рака молочной железы и рака матки, использующих MPA и мегестрола ацетат, заключается в том, что при таких способах лечения, как правило, наблюдаются побочные явления. Проблемы, связанные с использованием производных 19-нортестостерона, таких как норгестрель, норэтистерон и норэтиндрон, состоят в том, что указанные соединения обладают эстрогенной активностью (Vilchis et al., J. Ster. Biochem. 24: 525-531, 1986; Larrea et al, J. Ster. Biochem. 27: 657-663, 1987, Poulin et al., Breast Cancer Res, Treatm. 17: 197-207, 1990). Указанная эстрогенная активность этих соединений при их длительном использовании может оказывать негативное влияние в отношении риска заболеваемости раком молочной железы.
В соответствии с вышеуказанным очевидно, что для лечения и предупреждения эстрогензависимых заболеваний (а также остеопороза) и для предупреждения беременности необходимо разработать такие инъецируемые системы доставки с пролонгированным высвобождением медроксипрогестерона ацетата и мегестрола ацетата, которые позволяли бы поддерживать низкие концентрации этих стероидов в крови в течение длительных периодов времени (например, 1 месяц и более) и которые содержали бы минимальные количества остаточного токсичного органического растворителя и/или терморазлагаемых примесей, образуемых при чрезмерном нагревании терапевтической композиции.
В частности, применение указанных систем доставки с замедленным высвобождением MPA, MGA или других андрогенных соединений с минимальным маскулинизирующим действием в целях профилактики или контрацепции дало бы положительный эффект в отношении затрат на здравоохранение.
Краткое описание изобретения.
Целью настоящего изобретения является разработка способа предупреждения остеопороза у женщин, который предусматривает блокирование образования и/или действия эстрогена при лечении различных эстрогензависимых заболеваний. Эстрогензависимыми заболеваниями являются любые заболевания, начало, течение и прогрессирование которых по крайней мере частично зависит от биологической активности, индуцированной эстрогенами. Такими заболеваниями, например, являются (но не ограничиваются ими) рак молочной железы, эндометриальный рак, остеопороз, эндометриоз и разрежение кости.
Следующей целью настоящего изобретения является разработка способа предупреждения разрежения кости у женщин в постклимактерическом периоде, имеющих низкие уровни эстрогенов.
Очередной целью настоящего изобретения является получение набора и фармацевтических композиций для использования в вышеуказанных способах.
Другой целью настоящего изобретения является изготовление микросфер или микрочастиц, которые при их введении теплокровным животным, включая человека, способствовали бы поддержанию концентраций циркулирующих андрогенов на низком уровне в течение продолжительных периодов времени. Указанные микрочастицы могут быть использованы в целях концентрации, а также в целях, указанных выше.
Следующей целью настоящего изобретения является разработка способа использования терапевтически эффективных количеств медроксипрогестерона ацетата или мегестрола ацетата с регулируемым высвобождением для лечения или предупреждения эстрогензависимых заболеваний таким образом, чтобы, в основном, избежать возникновения нежелательных побочных явлений у человека и других животных.
Еще одной целью настоящего изобретения является получение микрочастиц или микросфер с пролонгированным высвобождением, которые содержат низке уровни остаточного органического растворителя.
Эти и другие цели настоящего изобретения могут быть достигнуты путем осуществления способов, раскрываемых в настоящей заявке, и/или путем использования фармацевтических соединений, композиций и выборов, раскрываемых в настоящей заявке.
В одном из вариантов своего осуществления настоящее изобретение относится к способу активации рецепторов андрогена у теплокровных животных, нуждающихся в такой активации, который предусматривает поддержание у указанного животного в течение по крайней мере 28 дня сывороточной концентрации андрогенного соединения в пределах от 1 до 50 нМ, не обладающего заметной маскулинизирующей активностью; при этом Ki - величина для андрогенного рецептора составляет менее чем 2 • 10-8 М, а ED50 величина, вызывающая 50% фармакологический эффект в отношении клеток карциномы ZR-75-1 молочной железы, составляет 3,0 нМ.
Способы, описанные в настоящей заявке, являются особенно ценными для лечения рака молочной железы или эндометриального рака, остеопороза или эндометриоза. Очевидно также, что указанные способы могут быть использованы и для других целей, направленных на активацию андрогенных рецепторов путем введения андрогенов или другими средствами. Способы лечения или предупреждения заболеваний или нарушений, осуждаемые в настоящей заявке, рассматриваются в рамках объема изобретения. Совершенно очевидно, что способы настоящего изобретения могут быть использованы как в профилактических, так и в терапевтических целях.
В другом варианте своего осуществления настоящее изобретение относится к частицам с пролонгированным высвобождением, включающим в себя андрогенный стероид настоящего изобретения, диспергированный в связующем веществе, которое является биологически совместимым с тканью человеческого организма, и которое подвергается биологическому разложению в организме с образованием биологически совестимых продуктов метаболизма; причем указанные частицы обладают способностью в стандартных условиях к высвобождению указанного андрогенного стероида в результате биологического разложения указанного связующего вещества со скоростью и продолжительностью, которые позволяют поддерживать сывороточные уровни указанного андрогенного стероида в пределах от 1,0 до 50, 0 нМ/л в течение периода времени, начиная от 48 часов, и, по крайней мере, до 28 дней после введения; при этом указанный андрогенный рецептор не обладает заметной маскулинизирующей активностью и имеет Ki-величину менее чем 2 • 10-8 для рецептора андрогена, а величина ED50 для клеток карциномы ZR-75-1 молочной железы составляет менее чем 3,0 нМ.
"Стандартные условия" для измерения соотношения скорости и количества высвобождаемого лекарственного средства описаны ниже в главе "Подробное описание изобретения". Скорость высвобождения является определяющим параметром частиц с пролонгированным высвобождением при данных конкретных условиях независимо от способа использования указанных частиц. Например, скорость высвобождения, присущую данным частицам, измеряют при определенной дозе. Однако определенные таким образом частицы могут быть использованы в широком диапазоне доз (подробно описанных ниже) и в соответствии с назначением лечащего врача. Другие параметры, например, такие как способы введения частиц, продолжительность высвобождения и т.п. также могут варьироваться в широких пределах, как описано ниже. При этом может быть добавлен разбавитель или носитель.
В другом варианте своего осуществления
настоящее изобретение относится к способу удаления остаточного органического растворителя из частиц с
пролонгированным высвобождением, включающему в себя следующие стадии:
(A) изготовление
частиц с пролонгированным высвобождением, имеющих средний размер от 5 мкм до 40 мкм и содержащих
активное соединение, диспергированное в связующем веществе с пролонгированным высвобождением, и,
нежелательно, остаточный органический растворитель; и затем
(B) выдерживание указанных частиц
в высоком вакууме, где давление составляет менее 133 Па (1,0 торр), а температура составляет на 7
- 20oC меньше, чем температура стеклования указанного связующего вещества, в течение
периода времени, достаточного для снижения концентрации остаточного органического растворителя в
указанных микросферах до уровня менее 0,1% (по отношению к полной массе указанных частиц).
В другом варианте своего осуществления настоящее изобретение относится к получению фармацевтической композиции, содержащей фармацевтически приемлемый разбавитель или носитель и множество микросфер с пролонгированным высвобождением, имеющих размер от 5 мкм до 40 мкм и включающих в себя активный ингредиент, диспергированный в связующем веществе с пролонгированным высвобождением, которое является биологически совместимым с тканями организма человека и которое подвержено биологическому разложению в организме с образованием биологически совместимых продуктов метаболизма; причем указанные микросферы обладают способностью, в стандартных условиях, к высвобождению указанного активного ингредиента в процессе и в результате биологического разложения указанного связующего вещества в течение периода времени, составляющего по крайней мере 28 дней; и содержат не более чем 0,1% (по полной массе микросфер) органического растворителя.
В следующем варианте своего осуществления настоящее изобретение относится к способам лечения или предупреждения эстрогензависимых заболеваний и расстройств, примерами которых служат (но не ограничиваются ими) рак молочной железы, эндометриальный рак, остеопороз и эндометриоз. Эти способы заключаются в том, что пациенту, нуждающемуся в таком лечении или профилактике, вводят эффективное количество микрочастиц с пролонгированным высвобождением отдельно либо в сочетании с дополнительными фармацевтическими носителями или разбавителями; причем указанные частицы содержат андрогенный стероид настоящего изобретения (например, медроксипрогестерона ацетата или мегестрола ацетат), диспергированный в связующем веществе с пролонгированным высвобождением, которое является биологически совестимым с тканями организма человека и которое подвержено биологическому разложению в организме с образованием биологически совместимых продуктов метаболизма; и, кроме того, указанные частицы обладают способностью, в стандартных условиях, к высвобождению указанного андрогенного стероида в процессе и в результате биологического разложения указанного связующего вещества со скоростью и продолжительностью, которые позволяют поддерживать уровни указанного андрогенного стероида в сыворотке крови в пределах от 1% до 50,0 нМ/литр в течение периода времени, начиная от 48 часов после введения и по крайней мере до 28 дней после введения; причем указанный андрогенный стероид не обладает значительной маскулинизирующей активностью и имеет Ki-величину для рецептора андрогена менее чем 2•10-8, а ED5--величину для клеток карциномы ZR-75-1 молочной железы менее чем 3,0 нМ.
В другом варианте своего осуществления настоящее изобретение относится в способу контрацепции, заключающемуся в том, что женщине, не желающей беременности, вводят эффективное количество частиц пролонгированного высвобождения отдельно или в сочетании с дополнительными разбавителями или носителями; причем указанные частицы содержат медроксипрогестерона ацетат, диспергированный в связующем веществе с пролонгированным высвобождением, которое является биологически совместимым с тканями организма человека и которое подвергается биологическому разложению в организме с образованием биологически совместимых продуктов метаболизма; и, кроме того, указанные частицы обладают способностью, в стандартных условиях, к высвобождению указанного медроксипрогестерона ацетата в процессе и в результате биологического разложения указанного связующего вещества со скоростью и продолжительностью, которые позволяют поддерживать уровни указанного медроксипрогестерона ацетата в сыворотке крови в пределах от 1,0 до 50,0 нм/литр в течение периода времени, начиная от 48 часов после введения и по крайней мере до 28 дней после введения; причем, указанные микросферы содержат не более чем 0,1% (по полной массе частиц) органического растворителя.
Используемые андрогены обладают специфическими свойствами, позволяющими им сохранять сильную андрогенную активность при низких концентрациях в крови (например, менее чем 50 нМ), тогда как активность рецептора глюкокортикоидов при этих концентрациях очень мала. Указанные андрогены также отличаются отсутствием физически маскулинизирующей активностью у женщин, использующих эти андрогены в указанных концентрациях. При этом следует отметить, что указанные соединения отличаются от натуральных андрогенов, продуцируемых в гонадных или периферических тканях, например, таких как тестостерон и дигидростерон, и обладающих значительной маскулинизирующей активностью, даже при низких концентрациях в крови. Синтетические прогестины, например производные прогестерона, также могут быть использованы в целях настоящего изобретения, поскольку они являются анаболическими стероидами.
Андрогены настоящего изобретения, в основном, не вызывают физически заметных прогрессирующих признаков маскулинизации, таких как повышенный рост волос на теле у женщин, угри, себорея или выпадение волос на голове. Эти признаки маскулинизации хорошо описаны в литературе. См., например, Ferriman and Gallwey, J. P. Clin. Endocrinol. Metab. 21: 1440-1447, 1961 (см. рост волос) Cremoncini et al., Acta Eur. Fertil. 7: 248-314, 1976 (угри, себорея, выпадение волос). См., также Cusan et al., J. Am. Acad. Dermatol. 23: 462-469, 1990.
В таблицах 1 и 2 представлена шкала оценки признаков маскулинизации.
Подробное описание изобретения
Предпочтительными соединениями,
предназначенными для использования в целях настоящего изобретения, являются синтетические
прогестины, анаболические стероиды и другие стероидные соединения, имеющие величину Ki для
андрогенного рецептора менее чем 2•10-8 М, обладающие действием, опосредованным
рецептором андрогена, и ингибирующим рост клеток карциномы ZR-75-1 молочной железы человека, с
достижением 50%-ного фармакологического эффекта при концентрации ниже 3,0 нМ/литр, и не оказывающих
маскулинизирующего действия, описанного выше. Предпочтительные андрогены настоящего изобретения не
вызывают значительного увеличения обычных явлений маскулинизации (например, значительного увеличения
любой из цифровых оценок, представленных в Таблицах 1 или 2), наблюдаемых у женщин после
прохождения 3-месячного курса лечения, при котором концентрация андрогена в крови поддерживалась на вернем
уровне заявленного диапазона концентраций (например, 50 нМ на литр). У большинства женщин
пациенток, у которых до лечения не наблюдалось видимых признаков маскулинизации либо эти признаки по шкале
оценок, указанной по шкале в Таблице 1, составляли в целом 10 баллов или менее для всех 11
участков, в течение лечения, проводившегося в соответствии с настоящим изобретением, указанные признаки
маскулинизации, если он имели место, сохраняются на прежнем уровне. То есть видимых признаков
маскулинизации после 3-месячного лечения не наблюдается. А у женщин, обнаруживавших некоторые признаки
маскулинизации до лечения, эти признаки не усиливаются после лечения.
Для того, чтобы установить, являются ли величины Ki ниже 2•10-8 М, Ki могут быть определены методом измерения аффинности различных соединений по отношению к андрогенному рецептору.
Получение тканей предстательной железы. Вентральные простаты получали от крыс Sprague-Dawley (Crl: CD (SD) Br) (поставляемых от Charles River, St-Constant, Quebec), весящих 200-250 г и кастрированных за 24 часа до умерщвления. Сразу после удаления простату помещали на лед, а затем использовали в анализе на связывание андрогена.
Получение цитозоля. Ткань простаты тонко измельчали ножницами (свежую кань) или распыляли с помощью системы Thermovac (замороженную ткань), а затем гомогенизировали в буфере A (Трис, 0,025М; монотиоглицерин, 20 мМ; глицерин 10% (по объему); ЭДТА, 1,5 мМ и молибдат натрия, 10 мМ, pH 7,4) в отношении 1: 5 (мас./об.), с использованием гомогенизатора Polytron PT-10. Эти и все последующие процедуры проводили при 0-4oC. Полученный гомогенат центрифугировали при 105000х г в течение 1 часа, в результате чего получали цитозольную фракцию в супернатанте.
Анализ на рецептор цитозольного андрогена. Аликвоты 100 мкл инкубировали при 0-4oC в течение 18 час. С 100 мкл 3нМ[3 H]T или [3H]RI881 в отсутствие или в присутствии возрастающих концентраций испытуемого намеченного андрогенного соединения. При завершении инкубации, свободные и связанные T или R1881 разделяли путем добавления 200 мкл покрытого декстраном угля (1% угля; 0,1% декстрана T-70; 0,1% желатина; 1,5 мМ ЭДТК и 50 мМ Трис (pH 7,4)) в течение 15 минут, а затем центрифугировали при 2300 х г и при 0-4oC еще 15 минут. Аликвоты (350 мкл) супернатанта переносили в сцинтилляционные сосуды с 10 мл водного раствора для подсчета импульсов (Formula 963, New England Nuclear), после чего проводили подсчет с помощью счетчика Beckman LS 330 (30% - эффективность для трития).
Вычисление Ki. Величины кажущейся константы ингибирования "Ki" вычисляли из уравнения Ki = IC50/(I + S/K) (Cheng and Prusoff., Biochem. Pharmacol. 22: 3099-3108, 1973). В этом уравнении S представляет собой концентрацию [3H] T или [3H]RI881, K представляет собой константу диссоциации (KD) T или RI881, а IC50 представляет собой концентрацию намеченных соединений, дающих 50% ингибирования связывания T или RI881. Для многих соединений величины Ki указаны в литературе. См., например, Ojasso et al., J. Ster. Biochem. 27: 255-269, 1987; Asselin et al., Cancer Res. 40: 1612-1622, 1980; Toth and Zaker, J. Steroid Biochem. 17: 653-660, 1982. Способ, дающий аналогичные результаты, описан в "Poulin et al., Breast Cancer Res. treatm. 12: 213-255, 1980".
Для определения концентрации, при которой данное соединение достигает половину от максимального, опосредованного рецептором андрогена, ингибирующего действия на рост клеток карциномы ZR-75-1 молочной железы человека, использовали способ, подробно описанный Poulin et al. (Breast Canner Res. Treatm 12: 213-255, 1988).
Сохранение маточных культур. Клеточная линия карциномы ZR-75-1 молочной железы человека может быть получена из Американской коллекции типовых культур (Rockville, MD). Эти клетки традиционно культивировали в не содержащей фенолового красного среде RPMI 1640, дополненной 10 нМ E2, 15 мМ Hepes, 2 мМ L-глутамина, 1 мМ пирувата натрия, 100 ME/мл пенициллина, 100 мкг/мл стрептоцимина сульфата и 10% (по объему) околоплодной сыворотки теленка (FBS) в водонасыщенной атмосфере, содержащей 95% воздуха и 5% CO2 при температуре 37oC.
Маточные культуры в их лог-фазе роста собирали с использованием 0,05% трипсина)/0,02% ЭДТК (мас./об.) в сбалансированном солевом растворе Хэнкса и ресуспендировали в среде RPMI 1640, не содержащей E2 и фенолового красного, и содержащей 5% (по объему) DCC (покрытый декстраном уголь) - обработанной FBS и 500 нг/мл бычьего инсулина, и дополненной так же, как описано выше, для сохранения маточных кульутр. Клетки высевали в 24-луночные культуральные планшеты Linbro (Flow Laboratories) с конечной плотностью 0,5 г 4,0•104 клеток на лунку.
Через 48 часов после посева добавляли свежую SD-среду, содержащую соответствующие концентрации стероидов. Конечная концентрация этанола, используемого для добавления испытуемых соединений, не превышала 0,12% (по объему) и не оказывала значимого влияния на рост клеток и морфологию. Инкубационную среду заменяли на каждый второй день, а клетки собирали через 12 дней после обработки (кроме тех случаев, о которых указано особо) путем трипсинизации. Число клеток определяли с помощью счетчика Coulter.
Вычисления и статический анализ. Кажущиеся величины IC50 вычисляли с помощью итерационного метода средне-квадратической регрессии (Rodbard, Endocrinology 94: 1427-1437, 1974), а кажущиеся величины констант ингибировали (Ki-величины) вычисляли в соответствии с методом Cheng and Prusoff (Biochem. Pharmacol. 22: 3099-3108, 1973).
Краткое описание чертежей.
Фиг. 1 - сравнительный график зависимости числа опухолей, наблюдаемый в группе крыс, обработанных в соответствии со способом настоящего изобретения (т. е. путем введения 30 г DepoProvera за одну неделю до того, как были индуцированы опухоли посредством введения диметилбенз(а)антрацена (DMBA)) по отношению к необработанной контрольной группе крыс.
Фиг. 2 - сравнительный график зависимости от времени эстрадиолстимулированного роста опухолей у овариэтомизированных крыс(о-о) по отношению к необработанной контрольной группе (о-о). Опухоли были индуцированы с использованием диметилбенз(а)-антрацена. Эстрадиол использовали для стимуляции роста опухолей у крыс как испытуемой, так и контрольной группы. Каждому животному испытуемой группы вводили одноразовую подкожную инъекцию 30 мг DepoProvera. Результаты выражали в процентах изменения всей площади поверхности опухоли для каждой группы.
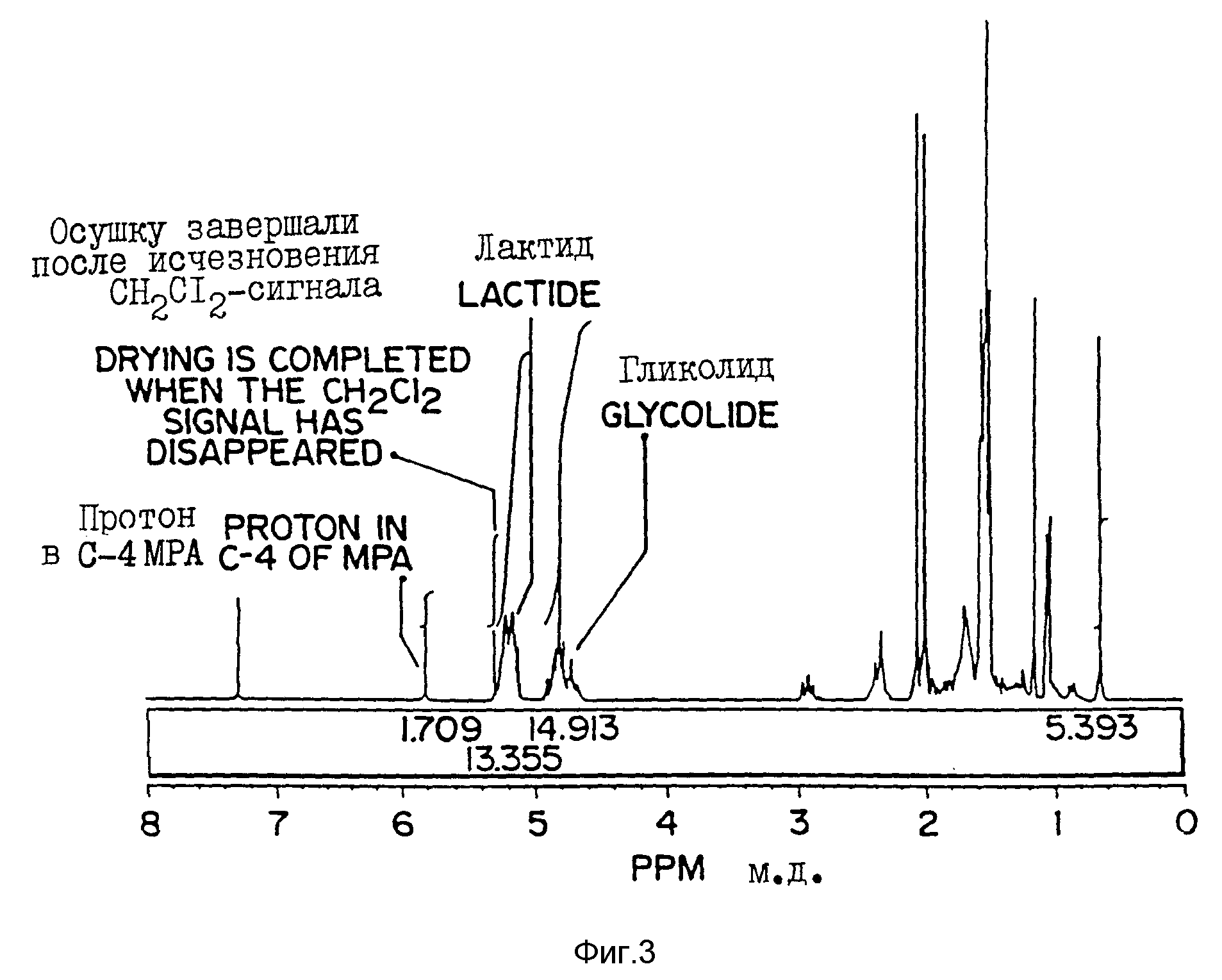
Фиг. 3 -1 H-ЯМР-спектр CIDCl3 - растворенных микрочастиц настоящего изобретения, полученный на ЯМР-спектрометре AC-F-300 FT Brucker. В рамке показана площадь под пиками при δ = 0,65 м.д. для MPA и при δ = 5,20 м.д. для лактида, которая была использована для определения загрузки сердцевины по формуле: % MPA (загрузка сердцевины) = 0,28391 + 0,98720 • [% площади (δ = 0, 65 м. д. )], где % площади (δ = 0,65 м.д.) определяли по формуле: Площадь (δ = 0,65 м.д.) / [Площадь (δ = 5,20 м.д.) + площадь (δ = 0,65 м.д.)].
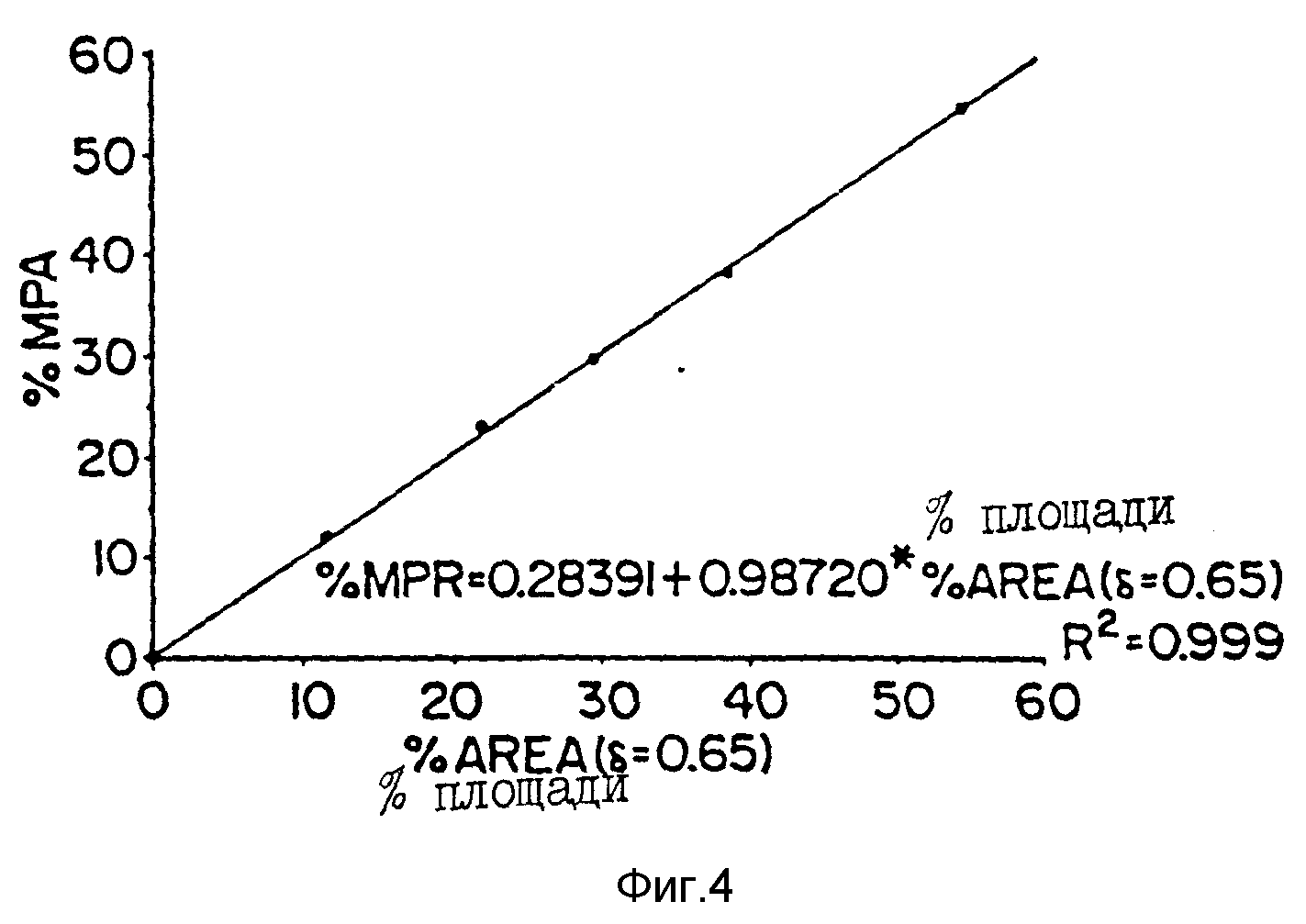
Фиг. 4 - стандартная кривая для определения загрузки сердцевины, построенная для известных смесей полимера и MPA, исходя из ЯМР-данных, аналогичных указанным для фиг. 3.
Фиг. 5 - хроматограмма микросфер с пролонгированным высвобождением MPA, выделенных с помощью стерической эксклюзионной хроматографии (СЭХ) для определения загрузки сердцевины. Пик при времени удерживания 12 минут соответствует полимерному связующему с пролонгированным высвобождением, а пик при времени удерживания 15,6 минут соответствует MPA. Вставка на фиг. 5 представляет калибровочную кривую, полученную исходя из смесей PLG/MPA со стандартными концентрациями. Площадь пика MPA дана по отношению к логарифму процентного содержания MPA в известной смеси с поли [DL-лактид-со-гликолидом] (50:50).
Фиг. 6 - фотографии MPA-микросфер, полученных с помощью растрового электронного микроскопа (РЭМ):(A) - с увеличением х 350 и (B) - с увеличением х 2000.
Фиг. 7 - фотографии MPA-микросфер настоящего изобретения в поперечном сечении, полученные с помощью растрового электронного микроскопа (РЭМ):(A) - с увеличением х 1500 и (B) - с увеличением х 5000.
Фиг. 8 - распределение MPA-микросфер по размерам, определенное с помощью растрового электронного микроскопа. Процентное содержание микросфер для каждого диапазона размеров дано по отношению к диапазону размеров (мкм).
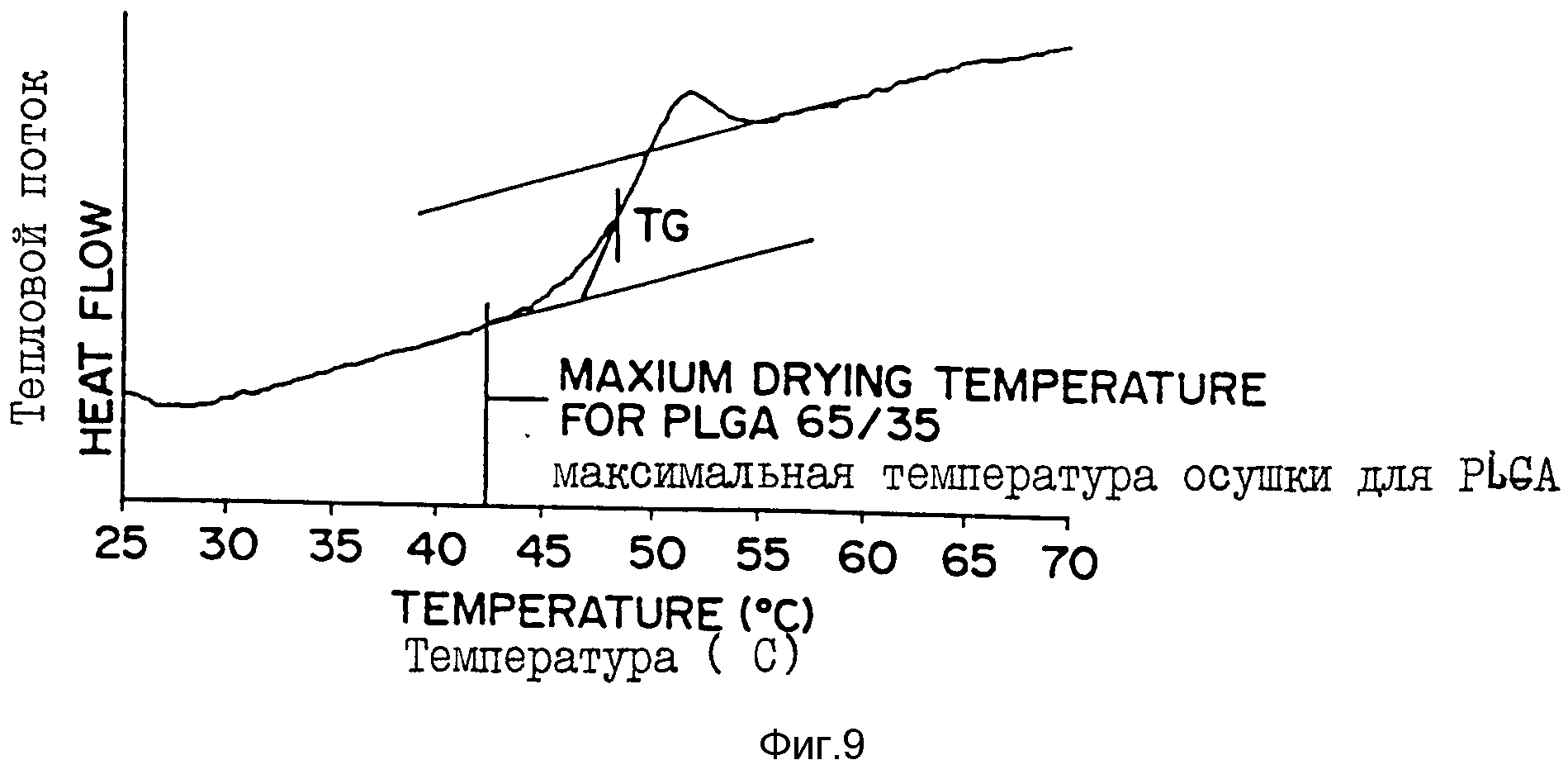
Фиг. 9 - кривая, полученная с помощью дифференциальной сканирующей калориметрии (ДСК), где тепловой поток (разница энергий между образцом и эталоном при данной температуре) прямо пропорционален теплотворности образца. На этой кривой показана температура стеклования (Tg) серии MPA, инкапсулированного в поли[DL-лактид-со-гликолид] (65:35)-микросферу настоящего изобретения с 33%-ной загрузкой MPA.
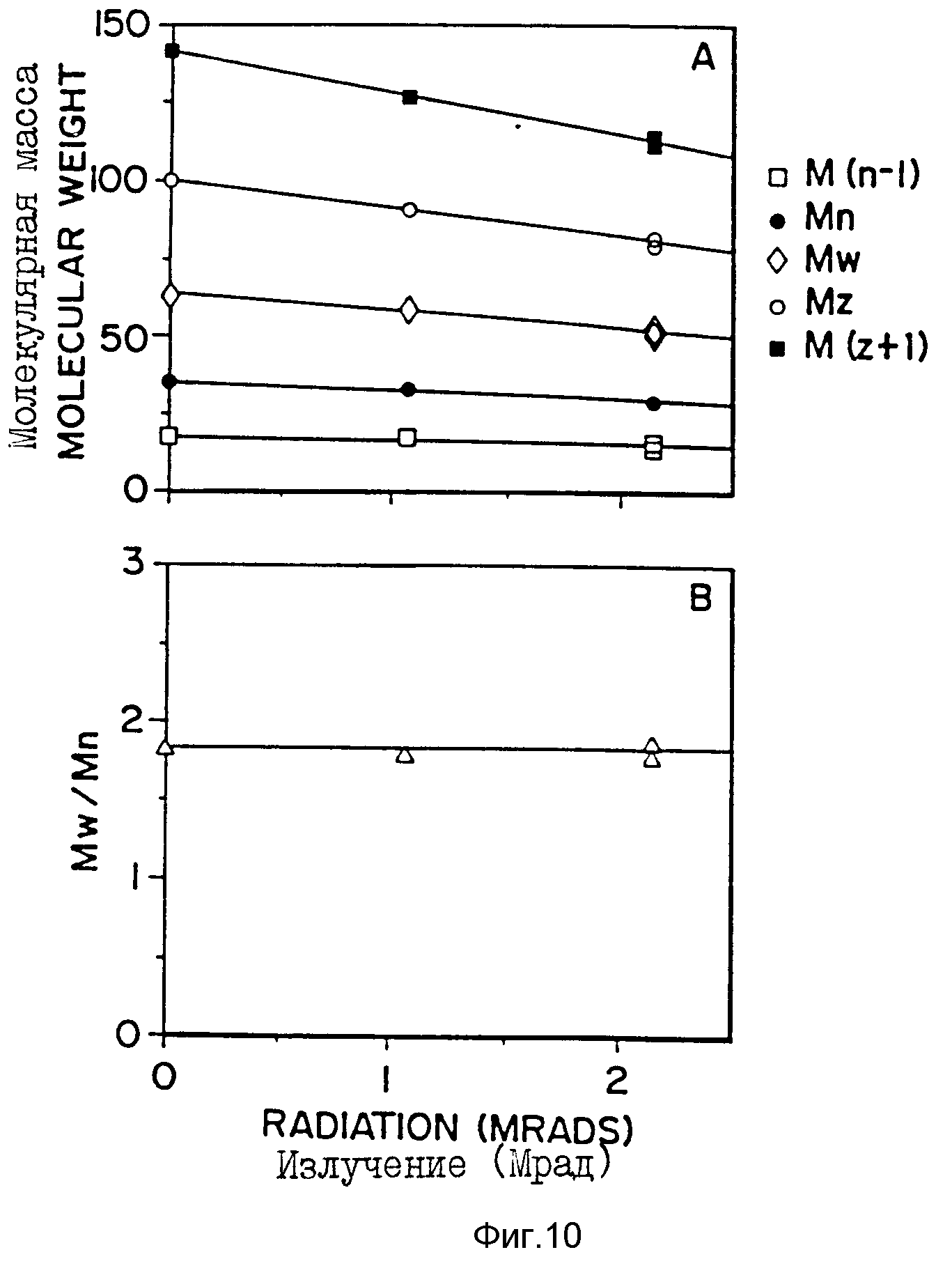
Фиг. 10 - (A): изменение различных параметров [M(n-1), Mn, Mw, Mz, M(z+1)] , характеристик молекулярной массы 50:50-поли-DL-лактид-со-гликолида после облучения указанными уровнями гамма-излучения (Mрад); (B): изменение массового распределения (Mw/Mn) в зависимости от уровня гамма-излучения (Mрад).
Фиг. 11 - кривая зависимости сывороточных уровней MPA в зависимости от времени, полученная для новозеландского белого кролика после введения ему одноразовой подкожной инъекции 50 мг MPA, инкапсулированного в 50:50-поли[DL-лактид-со-гликолид]миркосферы.
Фиг. 12 - кривая зависимости сывороточных уровней MPA от времени, полученная для овариэктомизированных самок крыс Sprague-Dawley после введения им разовой подкожной инъекции указанного количества MPA, инкапсулированного в 50:50-поли[DL-лактид-со-гликолид]'ные микросферы (1 нМ = 0,386 нг/мл).
Фиг. 13 - кривая зависимости процента крыс, имеющих диметилбенз(а)антрацен ДМБА-индуцированные опухоли, от времени, прошедшего после разовой инъекции MPA-микросфер (30 и 100 мг MPA или наполнителя (контроль)) перед введением ДМБА крысам (1 нМ = 0,386 нг/мл).
Более ясное понимание сложного механизма эндокринной активности синтетических прогестинов необходимо не только для предупреждения и терапии рака молочной железы, рака матки, остеопороза и эндометриоза, но также и для того, чтобы по возможности избежать появления побочных эффектов, вызываемых взаимодействием этих соединений со стероидными рецепторами, которое вовсе не является обязательным для получения положительного результата.
В идеальном варианте, для точного анализа биологического действия "прогестинов", обладающих сродством к многим стероидным рецепторам, необходимо отобрать in vitro-модели, обладающие функциональными рецепторами для всех основных классов стероидов. Для этих целей мы выбрали клеточную линию ZR-75-1 рака молочной железы человека, которая обладает функциональными рецепторами для эстрогенов, андрогенов, прогестерона и глюкокортикоидов (Vignon et al. , J. Clin. Endocrinol metab. 56: 1124-1130, 1983) для того, чтобы сравнить относительный вклад различных систем стероидных рецепторов в регулирование пролиферации клеток синтетическими прогестинами. В то время, как эстрогены являются в значительной степени митогенными в клетках ZR-75-1 (Poulin and Lobrie, Cancer Res. 46: 4933-4937, 1986) и специфически регулируют экспрессию и/или секрецию нескольких протеинов (Dickson and Lipman, Endocr. Rev. 8: 29-43, 1987); андрогены (Poulin et al., Breast Cancer Res. Treatm. 12: 213-225, 1988), T глюкокортикоиды (Hatton, A.C., Labrie, F. (неопубликованные результаты), а также прогестины Poulin et al., Breast Cancer Res. Treatm. 13: 161-172, 1989) ингибируют их пролиферацию посредством специфического взаимодействия с их соответствующими рецепторами.
При лечении рака молочной железы использовались многие прогестины, включая MPA (Blossey et al. , Cancer 54: 1208-1215, 1984; Hortobayyi et al., Breast Cancer Res. Treatm. 5: 321-326, 1985), MGA (Johnson et al., Semin. Oncol. 13: (Suppl. ): 15-19, 1986; Tchekmedyan et al., Semin. Oncol. 13 (Suppl. ): 20-25, 1986) и норэтиндром (Clavel et al., Eur. J. Cancer. Clin. Oncol. 18: 821-826, 1082; Earl et al., Clin. Oncol. 10: 103-109, 1984). С использованием in vitro-системы клеток ZR-75-1 рака молочной железы человека было установлено, что синтетические прогестины или анаболические стероиды, нор-тестостерон, RI881, дромостанолон, флуоксиместерон, этистерон, метаанадростанолон, оксандролон, даназол, станозолол, калустерон, оксиметолон, ципростерона ацетат, хлормадинона ацетат и норгестрол обладают андрогенной активностью при низких концентрациях. Помимо ингиирования клеточного роста андрогены способствуют заметному стимулированию секреции двух гликопротеинов, а именно: белка-15 (содержимого фиброзно-кистозных образований) (GCDFP-15) и GCDFP-24 (Simmard et al., Mol. Endocrinol. 3: 694-702, 1989; Simard et al., Endocrinology 126: 3223-3231, 1990). Таким образом, измерения секреции GCDFP-15 или GCDFP-24 могут быть использованы в качестве чувствительных параметров или маркеров активности андрогенов в этих клетках. Действительно, в условиях проводимых экспериментов изменения в секреции GCDFP-15 и GCDFP-24 противоположны изменениям в росте клеток. Все синтетические прогестины или анаболические стероиды, исследованные в связи с настоящим изобретением, обнаруживали андрогенное действие на рост клеток ZR-75-1 рака молочной железы и секрецию GCDFP-15 и GCDFP--24.
Для того, чтобы оценить потенциальную активность (включая побочные эффекты) указанных соединений, необходимо провести идентификацию рецепторов (эстрогенов, андрогенов, прогестерона и глюкокортикостероидов), ответственных за эту активность соединений. Поэтому, особенно важно оценить специфическое взаимодействие с андрогеновым рецептором при низких концентрациях соединения, поскольку такие низкие концентрации не взаимодействуют с глюкокортикоидным рецептором, исключая или минимизируя, тем самым, появление вторичных побочных эффектов.
Один из методов ингибирования роста клеток молочной железы или эндометрия заключается в активации рецептора андрогена эффективным соединением, обладающим сродством к этому рецептору, так, чтобы оно связывалось с рецептором андрогена при низких концентрациях, при которых не происходит значительного активирования других классов стероидных рецепторов, связанных с появлением возможных побочных эффектов. При этом, очень важно выбрать такие соединения, которые обладали бы максимальной аффинностью связывания с андрогенным рецептором, и в то же время оказывали бы минимальное вирилизирующее действие либо вовсе его не оказывали. Для минимизации взаимодействия таких соединений с рецепторами глюкокортикоида и эстрогена необходимо использовать низкие дозы этих соединений. Важно также выбрать такие стероиды, которые, обладая андрогенной активностью при низких концентрациях, не подвергались бы метаболическому разложению с образованием эстрогенов в in vivo-условиях, которые, при их использовании в низких концентрациях, не приводят к значительной активации рецепторов, не являющихся рецепторами андрогена.
Соединения настоящего изобретения, в частности анаболические стероиды и синтетические прогестины, используемые в различных концентрациях, сильно варьируются в своей способности к активации различных классов стероидных рецепторов. При тщательном контролировании концентрации в соответствии с настоящим изобретением можно селективно активировать нужные рецепторы и избежать значительной активации рецепторов, которая является нежелательной. Например, низкие концентрации MPA, определенные в настоящем описании, могут быть использованы для желательной активации рецепторов андрогена, что позволяет избежать возникновения побочных явлений, связанных с активацией глюкокортикоидов и являющихся серьезным недостатком предшествующих методов лечения.
Таким образом, настоящее изобретение относится к новому способу предупреждения и лечения рака молочной железы и рака тела матки, а также заболеваний, связанных с активацией рецепторов андрогена, например, таких, как остеопороз и эндометриоз. В соответствии с настоящим изобретением количество андрогенных соединений, вводимых пациенту, является значительно меньшим, чем количество соединений, используемых в предшествующих способах лечения рака молочной железы и эндометриального рака.
Контролирование концентрации андрогенов
настоящего изобретения в
крови
Для оценки эффективности лечения могут быть измерены концентрации активных соединений в крови. Например, измерения уровней медроксипрогестерона ацетата (MPA) в
плазме могут быть
проведены с помощью радиоиммуноанализа, осуществляемого после экстракции, описанной ниже.
Получение антител
У кроликов продуцировали антитела 144A против
17-гидроксипротестерон-3-0-карбоксиметилоксим-BSA. Меченым стероидом, используемым в радиоиммуноанализе (PИА) был метил-17L-гидроксистерона ацетат, 6L-[1,2-3H(N)], полученный из NEN(CAT
NO:
NET 480), а эталонным препаратом был медроксипрогестерона ацетат (MPA), полученный от Steraloids. Используемый для анализа буфер содержал 0,1% желатина в 0,1М фосфата натрия, 0,15М хлорида натрия,
0,
1% азида натрия, pH 7,2. Экстракционная смесь растворителей представляла собой смесь этилового эфира и ацетона (EEA, 9:1, по объему), а смесь растворителей для хроматографии LH-20 представляла
собой
смесь изо-октана : толуола : метанола (90:5:5, по объему) [10TH].
Процедура экстракции
Один миллилитр плазмы экстрагировали два раза 5 миллилитрами EEA. Экстракты
выпаривали
досуха в присутствии азота, а остаток растворяли в 1 мл 10TH. Затем экстракты подвергали LH-20-хроматографии на 10 х 30 см - колонках (Corning CAT N: 05 722A), заполненных 2 граммами LH-20
(Pharmacia). Гель промывали 30 миллилитрами 10TH, а затем добавляли 1 мл образца и элюировали смесью 10TH. Первые 6 мл отбрасывали. Следующие 10; 16,5 и 27,5 мл элюента представляли собой фракцию I
(прогестерон), II (MPA) и III (17-LH-прогестерон) соответственно. Фракцию II выпаривали досуха и восстанавливали в 1,5 мл буфера для анализа.
Радиоиммуноанализ
В каждую
боросиликатную лабораторную пробирку (12 х 75 мм) добавляли: 0,2 мл содержащие меченный литием стероид (25000 DPM); 0,5 мл эталонного препарата в пределах от 5 до 5000 пг на пробирку или 0,5 мл
фракции II экстрагированного образца, 0,2 мл антисыворотки 144A, разведенной в отношении 1/5000 или 0,2 мл аналитического буфера для подсчета неспецифического связывания. Затем пробирки инкубировали
при 4oC в течение ночи. После этого добавляли 0,2 мл 2% угля Norit-A, 0,2% Декстрана T-70, разведенные в воде. Затем пробирки слегка встряхивали и через 10 минут центрифугировали при 2000
х
г в течение 10 минут. Супернатант смешивали с 8 мл Препарата-989 (Formula-989) (NEN : NEE-989) и подсчитывали радиоактивность с помощью β- счетчика.
Верхний и нижний пределы обнаружения MPA составляли 10 и 10000 пг/мл соответственно, угловой коэффициент (LOGIT-LOG) составлял -2,2, а величина ED50 равна 315 пг/мл. Неспецифическое и чистое связывание составляло 1, 5 и 45% соответственно. Антитело 144A является высокоспецифичным для MPA, так как перекрестная реактивность с прогестероном, 20 α- OH-PrOOj, прегненолоном, 17-OH-прегненолоном, DHT, андростенедионом, тестостероном, 3 α- диолом, эстероном, эстрадиолом и кортизолом составляет менее 0,1%.
Вычисление и статистика
РИА - данные анализировали с
использованием программы, основанной на модели II Roadbard и Lewald (B: 2nd Karolinska Simposium. Geneva, 1970, стр. 79-103). Уровни MPA в плазме обычно выражали как средние величины дублированных
измерений отдельных образцов ± ср. кв. ош. Статистическую значимость определяли в соответствии с многоранговым критерием значимости Дункана - Крамера (Kramer C.Y. Biometrics 12: 307-310,
1956).
Относительное действие испытуемых соединений на различные рецепторы
Для оценки воздействия испытуемых соединений на различные стероидные рецепторы могут быть измерены
активности синтетических прогестинов и анаболических стероидов, опосредованные рецепторами андрогена, глюкокортикоида, прогестерона и экстрогена для клеток ZR-75-1 карциномы молочной железы человека
с
использованием в качестве параметров реакционного ответа клеточный рост и высвобождение GCDFP-15 и GCDFP-24 (Poulin and Laborie, Cancer Res. 46: 4933-4937, 1986; Poulin et al., Breast Cancer Res.
Treatm. 12: 213-225, 1988; Poulin et al., Breast Cancer Res. Treatm. 12: 161-172, 1989; Poulin et al. , Breast Cancer Res. Treatm. 13: 265-276, 1989; Simard et al., Mol. Endocrinol. 3: 694-702, 1989;
Simard et al., Endocrinology 126: 3223-3231, 1990).
Измерить активность рецептора прогестерона (PgR) позволяют следующие факторы: 1) добавление инсулина способствует полной реверсии ингибирования, обусловленного взаимодействием прогестина R5020 с PgR в клетках ZR-75-1; 2) антипролиферативное действие R5020 наблюдается только в условиях E1-стимулирования. Эти две характерные особенности роста клеток ZR-75-1 позволяют определить, в какой мере активность испытуемых соединений в отношении клеток ZR-75-1 может быть приписана взаимодействию этих соединений с PgR, и такое определение может быть осуществлено путем оценки влияния добавления инсулина и/или эстрогена на ответный рост клеток, измеряемый в конце 15-го дня инкубирования клеток ZR-75-1 с испытуемыми соединениями.
С другой стороны, степень участия рецептора эстрогена (ER) может быть непосредственно определена путем инкубации клеток ZR-75-1 в присутствии или в отсутствии эстрогена в среде.
Для анализа взаимодействия синтетических прогестинов или анаболических стероидов с рецептором андрогена (AR) и рецептором глюкокортикоида (GR) при их ингибирующем действии на рост клеток необходимо учитывать аддитивность антипролиферативных активностей андрогенов и глюкокортикоидов в этой клеточной линии (Poulin et al., Breast Cancer Res. Treatm. 12: 213-225, 1988; Hatton and Labrie F., неопубликованные данные). Так, например, может быть осуществлено насыщение AR 5 α- дигидротестостероном (DHT) с последующим измерением воздействия, полученного в результате добавления предполагаемого глюкокортикоида, на пролиферацию клеток. С другой стороны, действие предполагаемого андрогена может быть аналогичным образом измерено после насыщения GR дексаметазоном (DEX). Специфичность ростингибирующей активности испытуемых соединений может быть также дополнительно оценена посредством их реверсивной способности с использованием соответствующего антагониста (т.е. антиглюкокортикоида или антиандрогена). Так, например, в присутствии избыточного количества андрогена (1 МКМ DHT), в присутствии E2 и инсулина активность глюкокортикоида может быть оценена точно и без влияния других рецепторов. Аналогичным образом может быть оценена роль AR, если клетки инкубировать в присутствии избыточного количества глюкокортикоида (3 мкМ DEX), и в присутствии E2 и инсулина. Как показали тщательные кинематические исследования, 1 мкМ DHT и 3 мкМ DEX обнаруживали максимальное ингибирующее действие на AR и GR соответственно.
Кроме того, возможная антагонистическая активность "прогестинов", опосредованная AR и GR, может быть определена путем насыщения обеих рецепторных систем 5 α- дигидротестостероном (DHT) и дексаметазоном (DEX) так, чтобы количество одного лиганда значительно превышало количество другого лиганда, поскольку такое соотношение способствует полной реверсии (так как позволяет одновременно выбрать только один рецептор). Все эксперименты осуществляли с помощью культивирования клеток ZR-75-1 в E2-дополненной среде, содержащей инсулин для предупреждения PgR-опосредованного действия "прогестинов" на рост клеток.
С использованием описанной выше техники авторами настоящей заявки было установлено, что большинство андрогенных соединений, которые также активируют и другие рецепторы (например, рецепторы глюкокортикоида или прогестерона), очень отличаются по своему относительному воздействию на другие рецепторы в зависимости от концентрации. При определенных концентрациях, диапазон которых указывается в настоящей заявке, соединения настоящего изобретения могут оказывать положительное воздействие на рецепторы андрогена, не оказывая при этом нежелательного воздействия на другие рецепторы.
Отбор пациентов, которые могут быть особенно восприимчивыми к лечению способом, описанным в настоящей заявке.
Диагностика рака молочной железы обычно проводится с помощью осмотра самой молочной железы и/или с помощью маммографии. Эндометриальный рак обычно диагностируют с помощью эндометриальной биопсии. Оба из указанных раковых заболеваний могут быть установлены и диагностированы стандартными физическими методами, хорошо известными специалистам, например, такими, как сканирование кости, рентгенография грудной клетки, обследование костной системы, ультразвуковое исследование печени и изотопное сканирование печени (если это необходимо), CAT - сканирование (компьютерная аксиальная томография, MPI (ЯМР - томография) и физическое обследование. Эндометриоз может быть диагностирован на основании болей или симптомов, связанных с нарушением менструаций у женщин; однако более точный диагноз может быть установлен путем лапараскопии, а иногда путем биопсии.
Остеопороз может быть диагностирован стандартными способами, хорошо известными специалистам, например, такими, как QDR (количественно-цифровая радиография), двухфотонная абсорбциометрия и компьютерная томография. Определяют также уровни кальция и фосфата в крови и моче, уровни щелочной фосфатазы, кальцитомина и паратгормона в плазме, а также содержание гидроксипролина и соотношение кальций/среатина в моче.
Рак молочной железы или эндометриальный рак, остеопороз или другие заболевания, связанные с недостаточным костеобразованием, а также заболевания, восприимчивые к активации рецептора андрогена, могут быть подвергнуты лечению или профилактическому предупреждению в соответствии с настоящим изобретением.
Методика, которая может быть использована для оценки эффективности концентрации и наличия побочных явлений, описана Soid et al., Controception 375: 11-20, 1988.
Подходящими андрогенными соединениями являются 6- альфа - прогестерон или медроксипрогестерона ацетат, поставляемый, например, Upjohn и Farmitazia Corlo Erba, S.p.A под торговой маркой Provera, DepoProvera или FafIutaI, и акроним МРА.
Другими подходящими андрогенными соединениями являются соединения, описанные (Lobrie et al. (FerliI. SteriI 31: 29 - 34, 1979), а также анаболические стероиды или прогестины Raynaud and Ohasso, In: Innovotive Approaches in Drug Rescarch, Elsevier Sci. Publicher, Amsterdam, pp. 47-72, 1986; Sandberg and Kirdony Pharmac. Ther. 36: 263-307, 1988, and Vincens, Simard and De Lignieres, Les Androgenes, In: Pharmacologie, Clinique, Base de Therapeutique, 2-ieme Edition, Expantion, Scientifique (Paris), pp 2139-2158, 1988), а также Calusteron (7,17 α- диметилтестостерон), анаболические стероиды (Lam, Am. J. Sports Medicine 12: 31-38, 1984; Hilf. R., Anabolic - androgenic steroids and experimetal tumors. In: (Kochochian C.D., eds), Haudbook of Expeximental Pharmacology, vol. 43., Anabolic - Androgenic Steroids, Springer - Verlag, Berlin, 725 pp, 1978), флуоксиместерон (9 α- фторо-11 β- гидрокси-17 α- метилтестостерон, тестостерон-17 α- ципионат, 17 α- метилтестестерон, пантестон (тестостерона ундеканоат), D1 - тестолактонат и Андрактим.
Другими характерными и подходящими андрогенными соединениями являются ципротерона ацетат (Androcur, поставляемый от Shering Ag), 6-альфа-метил, 17-альфа-ацетоксипрогестерон или медроксипрогестерона ацетат (МРА), поставляемый помимо других, Upjohn and Farmitalia, Calbo Ebra, Gectodene, поставляемый Shering, мегестрола ацетат (17 α- ацетокси -6-метил-прегна-4,6-диен-3, 20-дион), поставляемый от Mead Johnson & Co., Ewanswille Ind., под торговой маркой Megace. Другими синтетическими прогестинами являются Левоноргестрол, Норгестамин, дезогестрол, 3-кетодезогестрол, порэтиндрон, норэтилстерон, 13 α- этил-17-гидрокси-18,19, динор-17 α- прегна-4,9,11-триен-20-ин-3-он (R2323 гестринон), демегестон, норгестриенон, гастринон и другие соединения, описанные в "Raynaud Ojasso, J.Steroid Biochem. 25: 811-833, 1986; Raynaud et al., J.Steroid Biochem. 12: 143-157, 1980; Raynaud, Ojasso and Labrie, Steroid Hormones, Agonists and Antagonists, In: Mechanisms of Steroid Action (G. P. Lewis and M.Ginsburg, eds), Mc Millan Press, London, pp. 145-158, 1981".
В целях настоящего изобретения могут быть также использованы другие производные прогестина, имеющие вышеописанные свойства.
Андрогенное соединение вводят предпочтительно в виде фармацевтической композиции местно, парентерально или перорально. Указанные соединения могут быть введены парентерально, т.е. внутримышечно или подкожно, путем инъекции или вливания с использованием для пускания в нос, либо внутривагинально с использованием суппозиториев, либо чрескожно с использованием гелей, пластырей и т.п. Андрогенные соединения могут быть также заключены в микрокапсулы, изготовленные из биологически совместимого и биологически разлагаемого полимера, например, такого, как поли [d1-лактид-со-гликолид], и вводимые путем подкожной или внутримышечной инъекций с помощью специальной техники, называемой инъекцией замедленного всасывания и обеспечивающей постоянное медленное (в течение 30 дней или более) высвобождение соединения. Кроме перорального введения предпочтительным способом введения соединений настоящего изобретения является подкожная инъекция замедленного всасывания. Например, после внутримышечного введения водной дисперсии DepoProvera может высвобождаться с относительно постоянной скоростью в течение 3 месяцев.
Количество каждого из вводимых соединений определяет лечащий врач, принимая во внимание состояние и возраст пациента, степень активности данного компонента и другие факторы. Для предупреждения рака молочной железы и рака матки, а также остеопороза в соответствии с настоящим изобретением могут быть использованы дозы, указанные ниже.
Андрогенную композицию предпочтительно вводят в количестве, при котором ежедневно высвобождается менее 25 мг активного андрогенного стероида на 50 кг веса тела.
Предпочтительная доза составляет 1 - 10 мг на 50 кг веса, а более предпочтительно 3 - 7 мг (например, 5 мг). Выбранная доза предпочтительно обеспечивает сывороточную концентрацию активного соединения ниже 50 нМ/литр, а более предпочтительно от 1,0 нМ/л и до 10, 15 или 25 нМ/литр в зависимости от восприимчивости пациента.
Дозы, необходимые для обеспечения этих уровней, варьируются от пациента к пациенту. Желательно, чтобы лечащий врач контролировал сывороточные уровни активного соединения с помощью техники, описанной в настоящей заявке, в целях оптимизации выбираемой дозы. В профилактических целях введение андрогена предпочтительно начинать в период перименопаузы для предупреждения развития рака молочной железы, рака матки и остеопороза у женщин. Андроген может быть введен в сочетании с соответствующей дозой эстрогена, используемого для предотвращения других признаков и симптомов, ассоциирующихся с менопаузой у женщин. В том случае, если у женщин образование или/и действие эстрогена было блокировано в целях лечения эндометриоза, лейкомиомы, рака молочной железы, рака матки, рака яичников или других эстроген-зависимых заболеваний, то введение андрогена можно начинать в любое время, а предпочтительно одновременно с блокадой эстрогенов.
Андроген, предназначенный для внутримышечной или подкожной инъекции замедленного всасывания, может быть инкапсулирован в биологически совместимый и биологически разлагаемый полимер, например поли[d1-лактид-со-гликолид] , например, путем разделения фаз, или формирования в микросферы или кубики, или каким-либо другим способом. Полученные микросферы могут быть затем суспендированы в носителе с получением инъецируемого препарата или препарата с замедленным всасыванием в виде шарика или палочки. См. также заявку на Европатент ЕРА N 58481, опубликованную 25 августа 1982 г., где описываются твердые композиции для подкожной инъекции или имплантации, или жидкие композиции для внутримышечных или подкожных инъекций, содержащих биологически совместимые и биологически разлагаемые полимеры, такие как сополимеры лактида и гликолида и активные соединения. Эти композиции способствуют пролонгированному высвобождению соединения.
Андрогены настоящего изобретения могут быть использованы в сочетании со стандартными фармацевтическими наполнителями, такими как осушенная распылением лактоза и стеарат магния, в виде таблеток или капсул для перорального введения.
Активные соединения могут быть включены в сердцевины таблеток или драже путем смешивания с твердыми порошкообразными носителями, такими как цитрат натрия, карбонат кальция или дикальцийфосфат, и связующими веществами, такими как поливинилпирролидон, желатин, и производные целлюлозы и возможно также путем добавления замасливателей, таких как стеарат магния, лаурилсульфат натрия, "Carbowax" или полиэтиленгликоль. Само собой разумеется, что в случае перорального введения в композицию могут быть добавлены отдушки.
Кроме того, в качестве фармацевтических форм могут быть использованы капсулы, например жесткие желатиновые капсулы, а также мягкие желатиновые капсулы, содержащие мягчитель или пластификатор, например глицерин. Твердые капсулы содержат активное соединение предпочтительно в виде гранул, например, в смеси с наполнителями, такими как лактоза, сахароза, маннит, крахмалы, такие как картофельный крахмал или амилопектин, производные целлюлозы или высокодиспергированные кремниевые кислоты. В мягких желатиновых капсулах активное соединение предпочтительно растворяют или суспендируют в подходящих жидкостях, таких как растительное масло или жидкий полиэтиленгликоль.
Альтернативно активное соединение может быть введено парентерально. В этих случаях используют растворы активных соединений, например, в кунжутном масле или оливковом масле. Активное соединение может быть включено в микрокапсулы или связано с биологически совместимым и биологически разлагаемым полимером, например, таким как поли [d,1-лактид-со-гликолид], и введено путем подкожной или внутримышечной инъекции с помощью специальной техники, называемой препаратом замедленного всасывания и обеспечивающей постоянное медленное (в течение 2 недель или более) высвобождение соединения (или соединений).
Настоящее изобретение также относится к наборам или одноразовым упаковкам, содержащим фармацевтическую композицию, активные ингредиенты или средства для введения указанной композиции или ингредиентов в целях лечения или предупреждения рака молочной железы, рака матки и остеопороза, а также лечения эндометриоза в соответствии с вышеприведенными обсуждениями. Указанные наборы или упаковки могут также содержать инструкции относительно использования фармацевтических композиций настоящего изобретения.
После проведения вышеописанной терапии в соответствии со схемой, обсуждаемой в настоящей заявке, можно добиться снижения роста опухолей и потери костной ткани, а также ремиссии эндометриоза при одновременной минимизации нежелательных побочных явлений.
Если необходимо получить композиции с регулируемым высвобождением, то подходящими для целей настоящего изобретения связывающими веществами с регулируемым высвобождением являются любые биологически совместимые материалы с регулируемым высвобождением, которые являются инертными по отношению к активному ингредиенту и которые способны включать в себя указанный активный ингредиент. Многие из таких материалов являются известными специалистам. Предпочтительными связующими с регулируемым высвобождением являются такие материалы, которые подвергаются медленному метаболизму в физиологических условиях после их подкожной или внутримышечной инъекции млекопитающему (т.е. в присутствии физиологических жидкостей, присутствующих в организме). Связующим веществом может быть такой материал, скорость биологического разложения которого является достаточно медленной для того, чтобы микросферы из этого связующего (т. е. без стероида или другого активного ингредиента), имеющие средний диаметр около 20 микрон, не могли бы полностью разложиться в течение по крайней мере одного месяца после их подкожной или внутримышечной инъекции. Примерами подходящих связывающих веществ служат (но не ограничиваются ими) биологически совместимые полимеры и сополимеры, которые обычно используются специалистами при изготовлении композиций с пролонгированным высвобождением. Указанные биологически совместимые соединения являются нетоксичными и инертными по отношению к окружающим тканям после их подкожной или внутримышечной инъекции, а также не вызывает значительных побочных явлений, таких как иммунный ответ, воспалительные реакции и т.п. Причем указанные соединения разлагаются с образованием метаболических продуктов, которые также являются биологически совместимыми и легко удаляются из организма.
Например, может быть использован полимерный матрикс, происходящий от сополимерных и гомополимерных полиэфиров, имеющих гидролизуемые сложноэфирные связи. Как известно, многие из указанных полимеров способны к биологическому разложению с образованием продуктов, не обладающих токсичностью или обладающих очень низкой токсичностью. В основном, такими предпочтительными полимерами являются полигликолевые кислоты (PGA) и полимолочные кислоты (PLA), поли (DL-молочная кислота-со-гликолевая кислота) (DLPLGA), поли(D-молочная кислота-со-гликолевая кислота) (DPLGA) и поли(L-молочная кислота-со-гликолевая кислота) (L PLGA). Предпочтительное соотношение для полимеров молочной кислоты и гликолевой кислоты и поли(молочная кислота-со-гликолевая кислота) составляет в пределах от 100:0 (т.е. чистый полилактид) до 50:50. Другими примерами подходящих биологически разлагаемых или биологически приемлемых полимеров служат (но не ограниваются ими) поли (ε- капролактон), поли (ε-капролактон-со-молочная кислота), поли (ε-капролактон-со-гликолевая кислота), поли (β-гидрокси-масляная кислота), поли(алкил-2-цианоакрилат), гидрогели, такие как поли(гидроксиметакрилат), полиамиды, поли (аминокислоты) (т.е. L-лейцин, глутаминовая кислота, L-аспарагиновая кислота и т. п.), поли(сложный эфир-мочевина), (поли(2-гидроксиэтил DL-аспартамид), полиацеталевые полиэфиры, сложные полиортоэфиры, поликарбонат, полимелеамиды, полисахариды и их сополимеры. Многие из указанных подходящих материалов являются коммерчески доступными, например полимолочная кислота-со-гликолид (поставляемый от Birmingham Polymer Inc, Birmingham Al. или от Dupont Company, Washington DC).
Частицы с пролонгированным высвобождением настоящего изобретения имеют скорость высвобождения активного ингредиента, рассчитанную таким образом, чтобы она обеспечивала постоянную определенную концентрацию этого ингредиента в сыворотке. При низкой дозе андрогена, обеспечиваемой настоящим изобретением, андроген высвобождается связующим веществом со скоростью, способствующей поддержанию сывороточных уровней указанного андрогена в пределах от 1 до 50 наномолей на литр, обычно от 1 до 25, а предпочтительно от 1 до 15, а более предпочтительно от 1 до 10 нМ/л, при стандартных условиях, обсуждаемых ниже. Стандартные условия определяют (лишь в целях ограничения измерения присущих указанным частицам свойства пролонгированного высвобождения) как подкожную инъекцию в 10 мг частиц (в виде 20 мг фармацевтической композиции, имеющей массовое соотношение 1:1 частиц к 2% водной карбоксиметилцеллюлозе (используемой в качестве носителя)) в спинку молодой самки крысы Sprague-Dawley. Затем, через 48 часов после введения инъекции и на протяжении 18 дней после инъекции измеряют концентрации андрогена в сыворотке путем периодического взятия проб для того, чтобы убедиться в том, что сывороточные урони активного ингредиента поддерживаются в нужных пределах в течение всего периода времени.
Скорость высвобождения указанных частиц может варьироваться путем изменения любого из ряда параметров (или их комбинации), известных специалистам. Примерами таких параметров могут служить (но не ограничиваются ими) состав связующего вещества с пролонгированным высвобождением, размер частиц и загрузка сердцевины. Например, известно, что полилактидное связующее гидролизуется более медленно, а поэтому (при прочих равных условиях) будет высвобождаться активный ингредиент более медленно, чем сополимеры молочной и гликолевой кислоты. Для таких сополимеров скорость высвобождения будет возрастать с возрастанием содержания (М%) гликолида. При равных массах частиц скорость высвобождения будет возрастать с уменьшением размера частиц, поскольку частицы с меньшим размером, в целом, имеют большую поверхностную площадь (в сумме всех частиц). Кроме того, повышение загрузки частиц (процент активного соединения в частицах) будет способствовать увеличению скорости высвобождения. Для регулирования продолжительности высвобождения эти параметры могут также варьироваться известными способами. Подробное обсуждение получения фармацевтических препаратов с пролонгированным высвобождением активного ингредиента приводится в работе F. Lim (F. Lim, Biomedical Application of Microenkapsulation, Franklin Lim, ed. CRC Precc, Boca Ration, 1984).
Стандартные условия и измерения, указанные выше, относятся лишь к свойствам частиц, связанных со скоростью их высвобождения, и имеют чисто определительный характер. Частицы, имеющие соответствующую скорость высвобождения, описанную подробно выше, могут быть изготовлены и введены различными способами. Эти частицы могут быть использованы для различных целей, а поэтому могут быть введены в широком диапазоне доз (см. ниже). Указанные частицы могут обеспечивать высвобождение активного ингредиента по меньшей мере 28 дней, или в течение значительно более длительного периода, например в течение двух, трех, шести месяцев и более. Другими словами, хотя частицы настоящего изобретения должны поддерживать соответствующие уровни в крови в течение 28 дней, однако, по желанию, они могут быть изготовлены таким образом, что указанные уровни в крови будут поддерживаться значительно более длительный период времени.
Для поддержания концентраций активного соединения с сыворотке крови на желаемом уровне (например, для андрогена - 1 - 50 нМ на литр) дозы могут варьироваться лечащим врачом. Для человека дозы, необходимые для достижения сывороточных уровней, аналогичных уровням, достигаемым у крыс в стандартных условиях, могут быть получены путем 30-кратного увеличения крысиной дозы, хотя эти дозы могут варьироваться в зависимости от метаболизма у каждого отдельного пациента. Так, например, частицы с пролонгированным высвобождением MPA, которые обеспечивают 30-наномолярные сывороточные концентрации после введения 10 мг-инъекций крысам в стандартных условиях, будут, как ожидается, обеспечивать приблизительно 30-наномолярные концентрации у человека после введения 300-мг инъекции; 20-наномолярные концентрации после введения 200-мг инъекции; 15-наномолярные концентрации после введения 150-мг инъекции, и т. п. Вышеприведенные дозы даны по массе частиц с пролонгированным высвобождением и не содержат носителя. Дозы конечной фармацевтической композиции должны быть рассчитаны с учетом носителя. Например, если необходимо получить 100 мг-дозу частиц, то композиция, имеющая соотношение частиц и носителя 1: 1, должна быть введена в количестве 200 мг. Аналогичным образом должна быть учтена скорость высвобождения частиц с пролонгированным высвобождением при стандартных условиях. Например, чтобы достичь той же самой концентрации, частицы со скоростью высвобождения (5 нМ) (в стандартных условиях) должны быть введены в дозе, в два раза превышающей дозу частиц со скоростью высвобождения 10 нМ (в стандартных условиях).
В основном, лечащий врач может начать с дозы, рассчитанной на поддержание сывороточных концентраций активного ингредиента от 1 до 10 нм, например 3 - 7 нМ. Затем, в зависимости от восприимчивости пациента доза может быть увеличена или уменьшена. Предпочтительно, чтобы пока не будет установлена оптимальная доза, использовались частицы с небольшим периодом высвобождения (например, 28 дней). Затем, могут быть введены частицы с более пролонгированным высвобождением активного ингредиента при сохранении оптимальных уровней этого ингредиента в крови. Само собой разумеется, что эти дозы должны быть скорректированы в отношении разницы скоростей высвобождения частиц с более коротким и с более длинным периодом высвобождения способом, описанным выше.
Предпочтительными активными соединениями являются все андрогенные соединения, описанные выше, например, медроксипрогестерона ацетат (6-альфа-метил, 17-альфа-ацетоксипрогестерон) или "MPA", который, среди прочих источников, может быть получен от Upjohn и Farmitalia Carlo Erba, S.P.A., под торговой маркой Provera, Depoprovera или Farlutal; и мегестрола ацетат (17 альфа-ацетокси-6-метил-прегна-4,6-диен-3,20-дион) или "MGA", который, среди прочих источников, может быть получен от Mead Jonson & Co., под торговой маркой Megace.
Предпочтительно, чтобы частицы с пролонгированным высвобождением были, в основном, сферическими. Это может быть достигнуто, например, путем растворения активного ингредиента и связующего вещества с пролонгированным высвобождением в органическом растворителе с последующим введением при размешивании этой смеси в воду. В результате этого, образуются небольшие микросферы из связующего вещества, содержащего диспергированный в нем активный ингредиент. Эти микросферы образуются благодаря тому, что при добавлении избыточного количества воды эти микросферы не растворяются в ней. Микросферы освобождаются от значительного количества органического растворителя в зависимости от того, насколько этот растворитель способен смешиваться с водой. Для стимулирования отделения микросфер от растворителя в процессе формирования микросфер в воде может быть добавлено поверхностно-активное вещество (ПАВ). При этом, средний размер частиц может быть увеличен путем уменьшения интенсивности размешивания, и соответственно, этот размер может быть уменьшен путем более интенсивного размешивания. Для облегчения введения инъекций пациентам, а также для облегчения последующего выведения нежелательных остатков органического растворителя, предпочтительно, чтобы образовывались более мелкие микросферы. В основном, средний размер микросфер составляет от 5 до 40 мкм, а предпочтительно от 9 до 28 мкм.
В одном из предпочтительных вариантов осуществления настоящего изобретения инкапсулирование MPA осуществляют путем получения водной суспензии микрокапелек, содержащих смесь MPA и полимера в метиленхлориде. В качестве полимера может быть использован, например, сополимер молочной и гликолевой кислоты (50:50). Образование микросфер контролируют с помощью ПАВ, такого как поли(виниловый спирт). Затем эти капельки отверждают путем удаления метиленхлорида, экстрагируемого большим количеством воды. Описанная техника позволяет получить лучшую форму капелек, чем при традиционном выпаривании в вакууме, которое обычно применяется при получении микросфер. Размер микросфер регулируют количеством ПАВ и скоростью размешивания суспензионной смеси.
Полное распределение частиц по размерам может варьироваться, однако, предпочтительно, чтобы это распределение было более узким и однородным. Например, предпочтительно, чтобы по крайней мере 90% частиц имели размер от 1 до 40 мкм, а более предпочтительно от 9 до 28 мкм. При этом следует отметить, что указанный размер относится к диаметру отдельных микросфер, даже если эти микросферы образуют нежелательные агломераты с другими микросферами. Для частиц с неправильной формой этот размер относится к более длинной оси частицы. Размер частиц может быть определен путем оценки характерного образца частиц под электронным микроскопом.
Примерами подходящих органических растворителей, используемых для получения микросфер, служат (но не ограничиваются ими) метиленхлорид, этилацетат, ацетон, диэтиловый эфир, тетрагидрофуран, гексафторацетон, гексафторизопропанол, ацетонитрил и их смеси. Подходящими ПАВ, используемыми в первой стадии изготовления микросфер путем микроинкапсулирования посредством экстракции растворителя (как описано в примере 3), являются (но не ограничиваются ими) поли(винил)спирт, поливинилпирролидон, карбоксиметилцеллюлоза, желатин, крахмал, тальк, сульфат магния, карбонат кальция и ионные агенты. ПАВ добавляют в количестве, предпочтительно от около 1 до 10% от объема воды.
Соотношение воды и растворителя (включая растворенное связующее вещество) может варьироваться, однако, предпочтительно использовать большое избыточное количество воды (например, вода: растворитель = 5:20 (объем/объем) или выше).
Концентрация добавляемого к органическому растворителю связующего вещества составляет, предпочтительно, от около 1% и до около 20% (по объему) в зависимости от его растворимости. Предпочтительно, если количество используемого растворителя будет близко к минимально необходимому количеству для полного растворения связующего вещества и активного ингредиента. Если полного растворения не происходит, то может быть добавлено еще некоторое количество растворителя. Соотношение активного ингредиента и связующего определяется желаемой загрузкой сердцевины, которая варьируется, предпочтительно от 1:4 до 7: 3 (по массе) соответственно, а более предпочтительно от 3:7 до 3:2. Степень загрузки сердцевины может устанавливаться в целях регулирования скорости высвобождения или продолжительности высвобождения нужного продукта, или в целях регулирования других параметров.
В изготовлении микросфер путем микроинкапсулирования с использованием метода экстракции растворителя, описанного в примере 3, предпочтительным растворителем для растворения медроксипрогестерона ацетата и полимера или сополимера является метиленхлорид, но могут быть использованы и другие растворители, которые частично смешиваются с водой и обладают низкой степенью токсичности для организма человека (например, такие, как этилацетат, ацетон, диэтиловый эфир, тетрагидрофуран, гексафтороацетон, гексафтороизопропанол, ацетонитрил и смеси этих растворителей). Более того, токсичность растворителя не является решающим фактором в том случае, если этот растворитель, в основном, удаляется с помощью техники удаления растворителей, описанной ниже. Предпочтительным поверхностно-активным веществом (ПАВ) является поли(виниловый спирт), но могут быть использованы также и другие ПАВ, например полимердиспергирующие агенты (такие как поли(винилпирролидон)-карбоксиметилцеллюлоза, желатин, крахмал), тальк, сульфат магния, карбонат кальция и ионогенные вещества.
Микрочастицы могут быть также получены путем литья из раствора, где проводят отливку из раствора MPA и полимера или сополимера в соответствующем растворителе (например, в одном из вышеуказанных растворителей). Затем растворитель выпаривают при атмосферном давлении. Полученную таким образом пленку нагревают и экструдируют через полую проволоку определенного размера. Полученные стержни или их фрагменты измельчают на микрочастицы. Микрочастицы могут быть, в свою очередь, раздроблены до получения размеров частиц в соответствующем диапазоне с помощью молекулярного сита. Обычно, средний размер частиц составляет от 1 до 250 микрон, предпочтительно 5-100 микрон, а более предпочтительно 9-28 микрон. Удаление растворителя и введение инъекций может быть облегчено путем использования более мелких частиц, предпочтительно частиц со средним размером (90% всех частиц) менее 40 мкм.
В соответствии с настоящим изобретением предпочтительная фармацевтическая композиция имеет загрузку сердцевины в пределах от 20 до 70% MPA или MCA, а более предпочтительно от 30 до 60% MPA или MCA. Отношение активного ингредиента к связующему веществу составляет, предпочтительно, 1:4 -7:3, например 3:7 - 3:2.
Информация о методах получения композиций с пролонгированным высвобождением других соединений может быть найдена в следующих работах: Kitchell and Wise, In Methods in Enzymology, Academic Press, vol. 112, pp. 436-448; Beck and Tice, In Long Acting Steroid Contraception (D.R.Mishell Jr., ed), Raven Press; New York, pp. 175-199, 1983; and Wise et al., In Biology and Medicine (G. Gregotiodis. ed), Academic Press, New York. pp, 237-270, 1979.
Стероид предпочтительно вводят в суточной дозе, которая обеспечивает высвобождение менее чем 25 мг активного MPA или MCA на 50 кг веса тела, предпочтительно 1-10 мг, а более предпочтительно 3-7 мг (например, 5 мг). Предпочтительно, если выбранная доза обеспечивает поддержание сывороточных концентраций активного соединения ниже 50 нМ/л, а более предпочтительно от 1,0 нМ/л и до 10, 15 или 25 нМ/л в зависимости от восприимчивости пациента.
В соответствии с настоящим изобретением одна парентеральная инъекция содержит предпочтительно менее 2,0 г активного ингредиента (например, медроксипрогестерона ацетата или мегестрола ацетата), а более предпочтительно от 0,15 до 1,0 г активного ингредиента.
Особенно предпочтительно, чтобы остаточный органический растворитель был по возможности полностью удален из частиц с пролонгированным высвобождением. Действительно, некоторые органические растворители являются настолько токсичными, что они не могут быть использованы для получения частиц с пролонгированным высвобождением, если только они не будут затем полностью удалены из полученных частиц. "Некорпоративный" органический растворитель, который не вовлекается вовнутрь физической структуры частиц, то есть растворитель, который просто контактирует с поверхностью частиц, может быть легко удален стандартными средствами (например, многократная промывка водой, обработка потоками воздуха и т.п.). Удаление органического растворителя, уже внедренного в физическую структуру частиц, является более трудной задачей, и ниже обсуждается новый способ удаления такого типа растворителей.
Удаление растворителя можно облегчить путем получения частиц с небольшими размерами. Предпочтительно, если полученные частицы имеют средний размер менее 40 микрон, например от 5 до 40 микрон, а более предпочтительно от 9 до 28 микрон. Наиболее предпочтительно, чтобы размер 90% всех частиц находился в пределах вышеуказанного диапазона.
В предпочтительном варианте осуществления настоящего изобретения, после формирования частиц, "некорпоративный" органический растворитель удаляют путем многократной промывки водой и/или осушки воздухом.
Удаление растворителя проводят предпочтительно способом, при котором частицы помещают в неглубокий вакуум, где давление составляет менее 6650 Па (50 торр), а температура не превышает меньшее из значений (A) 30oC и B) 7oC ниже температуры стеклования частиц.
Остаточный растворитель, включая физически "некорпоративный" растворитель, почти полностью удаляется из частиц, если эти частицы поместить в высокий вакуум (менее, чем 133 Па (1,0 торр), а предпочтительно менее чем 66 Па (0,5 торр)), при температуре на 7-20oC ниже температуры стеклования (Tg) частиц, а предпочтительно при температуре на 7-15oC ниже Tg, и более предпочтительно на 7-12oC ниже Tg. Указанная стадия высокого вакуума продолжается в течение периода времени, достаточного для снижения содержания остаточного органического растворителя в частицах до концентрации менее чем 0,1% (от всей массы частиц). Предпочтительно, если концентрация остаточного растворителя снижается до менее чем 0,05%, а более предпочтительно - менее чем 0,02%.
Температура стеклования может быть измерена или вычислена рядом известных способов, включая (но не ограничиваясь) измерение и построение кривой зависимости теплового потока от времени с помощью стандартной техники, проиллюстрированной на фиг. 9. Предпочтительно, максимальная температура нагревания не должна быть выше конечной точки линейной части кривой, находящейся ниже температуры стеклования (как показано на фиг. 9). Более высокие температуры могут привести к нежелательной агломерации частиц или к термодеградации продуктов. Если температура поддерживается в пределах диапазона настоящего изобретения, то частицы являются, в основном, свободно текучими и не содержат продуктов термического разложения. Однако использование умеренных температур в соответствии с настоящим изобретением, в основном, способствует удалению органического растворителя.
В предпочтительном варианте осуществления настоящего изобретения стадия неглубокого вакуума или другого метода снижения остаточного растворителя до менее чем 5%, а предпочтительно до менее чем 2% (по полной массе всех частиц), предшествует стадии высокого вакуума. Более высокие уровни растворителя могут привести к нежелательному разрушению частиц во время последующей стадии высокого вакуума. Такое разрушение может оказать неблагоприятное влияние на свойства частиц, относящихся к скорости высвобождения активного ингредиента.
При использовании начальной стадии неглубокого вакуума характерные периоды продолжительности этой стадии составляют от 1 до 10 дней, предпочтительно от 1 до 5 дней, а более предпочтительно от 2 до 4 дней. Периоды продолжительности стадии высокого вакуума, в основном, составляют от 1 до 20 дней, предпочтительно от 2 до 15 дней, а более предпочтительно от 3 до 10 дней. Однако при этом следует отметить, что стадия высокого вакуума должна продолжаться до тех пор, пока содержание остаточного органического растворителя не снизится ниже желаемого уровня. Содержание остаточного растворителя может быть определено известными методами, например, как показано ниже, в примере 6. Способ настоящего изобретения был с успехом использован для снижения растворителя до менее чем 0,02% мас., (т.е. до наименьшего количества, которое может быть обнаружено посредством анализа с использованием ГХ (газовой хроматографии) (см. пример 6)).
Частицы с пролонгированным высвобождением настоящего изобретения могут быть получены для использования в различных целях. Предпочтительно, эти частицы стерилизуют с помощью известной техники (например, как описано в примере 10). Затем они могут быть смешаны с фармацевтически приемлемыми разбавителями или носителями. Могут быть также добавлены известные консерванты. Концентрация частиц с пролонгированным высвобождением (по полной массе композиции) предпочтительно составляет от около 10 до около 70%. Носителем предпочтительно является такой материал, в котором связующее вещество для указанных частиц является, в основном, нерастворимым, например карбоксиметилцеллюлоза в воде, дистиллированной воде или солевом растворе.
В соответствии с настоящим изобретением предпочтительные микросферы отличаются тем, что в них отсутствуют примеси, образующиеся в результате термического разложения. Это достигается путем использования низких температур и высокого вакуума при осушке микросфер.
Предпочтительный носитель для парентеральной инъекции микрочастиц настоящего изобретения выбирают из группы, включающей в себя солевой раствор, водный разведенный раствор, карбоксиметилцеллюлозы, водный разведенный раствор глицерина, водный разведенный раствор гликоля, вода или разведенный водой этанол. Особенно предпочтительным носителем является 2-5%-ный водный раствор карбоксиметилцеллюлозы.
Предпочтительными способами введения композиций с пролонгированным высвобождением являются (но не ограничиваются ими) подкожные или внутримышечные инъекции и пероральное введение.
В соответствии с настоящим изобретением использование низких доз дает возможность в достаточной степени снизить побочные явления, что позволяет применять способы настоящего изобретения в профилактических целях и делает их более эффективными и более практичными, чем методы с использованием более высоких доз. Поскольку используемые для лечения дозы являются достаточно низкими, то для того, чтобы эффективная "превентивная терапия" была безопасной, необязательно выбирать меньшую дозу.
Пример 1
Предупреждение развития карциномы молочной железы у крыс, индуцированной диметилбенз(а)-антраценом ДМБА, с использованием медроксипрогестерона ацетата "МРА" в низких дозах
Для иллюстрации
эффективности настоящего изобретения при его использовании в целях предупреждения развития карциномы молочной железы на фиг. 1 показан эффект от введения подкожной инъекции DepoProvera
медроксипрогестерона ацетата (МРА) (30 мг) за одну неделю до индуцирования карциномы диметилбенз(а)антраценом. На фиг. 1 показан период от 30 до 85 дней после введения ДМБА. На этом чертеже одна
кривая соответствует среднему числу опухолей на одно животное DepoProvera - обработанной группы, а другая кривая соответствует среднему числу опухолей на одно животное необработанной группы. Было
установлено, что 30 мг-инъекция DepoProvera способствует высвобождению приблизительно 0,17 мг-день активного медроксипрогестерона ацетата в течение шести месяцев. Как видно из сравнения двух кривых,
представленных на фиг. 1, DepoProvera - обработанная группа обнаруживала большую резистентность к образованию опухолей, чем необработанная группа. Через 85 дней в необработанной группе наблюдалось, в
среднем, 1,89 опухолей на крысу, тогда как в DepoProvera - обработанной группе наблюдалось лишь 0,30 опухолей на крысу. Число опухолей и их размер определяли еженедельно с помощью штангенциркуля.
Пример 2
Лечение карциномы молочной железы, индуцированной диметилбенз(а)-антраценом, у крыс с использованием медроксипрогестерона ацетата в низких дозах.
На фиг. 2 проиллюстрировано ингибирование роста карциномы молочной железы, которое может быть достигнуто способами настоящего изобретения. Опухоли были индуцированы у овариэтомизированных крыс с использованием диметилбенз(а)антрацена. Каждому животному в обрабатываемой группе вводили одноразовую подкожную инъекцию 30 мг DepoProvera (которая, как было установлено, высвобождает 0,17 мг в день активного медроксипрогестерона ацетата в течение примерно шести месяцев). На этом чертеже проиллюстрировано среднее эстрадиолстимулированное изменение полной площади опухоли для каждой группы после обработки. Как видно из фиг. 2, группа, обработанная DepoProvera, обнаруживала значительно меньший рост опухолей, чем необработанная группа.
Пример 3
Получение микросфер,
содержащих медроксипрогестерона ацетат, путем экстракции растворителя
Полное растворение полимерного материала [50/50 поли(DL-лактид-со-гликолида)] (поставляемого Birmingham Polimer Inc.,
Birmingham, Al.) ("PLG") достигали путем его встряхивания с растворителем в течение ночи с использованием шейкера KS-10 (от BEA Enpotech Corp.), установленном на скорости 150-200 об/мин. Используемым
растворителем был метиленхлорид (CH2Cl2), полученный от BDH, который непосредственно перед использованием подвергали однократной дистилляции. Полимер (1,5 г) помещали в
стеклянный сосуд, в котором уже содержался метиленхлорид (15,0 г), продолжая при этом встряхивание. После этого при встряхивании добавляли медроксипрогестерона ацетат (0,75 г), в результате чего
получали раствор PLG-MPA-CH2Cl2.
Отдельно в 250-миллиметровом смоловарочном котле (от Kontes) смешивали 94 мл воды и 6 мл поверхностно-активного вещества (ПАВ, [поли(виниловый спирт)] (PVA) (Airvol 205, поставляемый Air Products and Chemicals) и поддерживали при постоянном перемешивании с помощью турбинного ротора, установленного на лабораторном смесителе, работающем с тяжелой нагрузкой. Затем к полученному ПАВ-раствору добавляли 1,16 мл метиленхлорида для насыщения водного раствора и во избежание экстракции метиленхлорида на этом этапе, используя 2, 0-миллиметровую стеклянную пипетку, которую вводили в одно из четырех отверстий в верхней части смоловарочного котла. Размешивание продолжали еще 5 минут при 850 об/мин. Затем получали микросферы путем добавления в размещаемый CH2CH2-насыщенный PVA-раствор предварительно полученного раствора PLG-MPA-CH2Cl2, используя шприц (целиком из полипропилена), снабженный 6-дюймовой иглой 16 калибра. После добавления раствора MPA размешивание продолжали еще 5 минут.
Отверждение микросфер
Стадию отверждения проводили следующим
образом:
1) содержимое смоловарочного котла быстро выливали в отверждающую баню, котел промывали дистиллированной водой, и содержимое еще раз выливали в отверждающую баню. Отверждающая баня
представляла собой большой сосуд (7 л) из нержавеющей стали, содержащий 5 л дистиллированной воды. Размешивание осуществляли на высокой скорости (850 об/мин) в течение 20 минут в лабораторном
смесителе, снабженном 2,5-дюймовой SS-лопастью.
2) Затем микросферы отделяли от промывочной среды с использованием 144 мм-системы фильтрации Millipore. После отверждения содержимое бани переносили в 20-литровый распределительный автоклав Millipore. На этой стадии следует позаботиться о тщательности промывания SS-сосуда для отверждения для того, чтобы добиться полного выделения микросфер, которые осаждаются на дно судна после прекращения размешивания. Затем микросферы собирали на 142-мм мембране (с размером пор 8 мкм) путем пропускания содержимого распределительного автоклава через мембранное устройство с использованием сжатого воздуха (69000 Па = 10 фунт/кв. дюйм).
3) Затем мембрану промывали дистиллированной водой, одновременно смывая с этой мембраны микросферы во вторую отверждающую баню, которая идентична первой отверждающей бане. После этого микросферы собирали на 142-мм мембране во второй раз способом, аналогичным описанному выше.
4) Затем осуществляли конечную промывку и осушку с использованием 144-мм системы фильтрации (Millipore). Первую стадию осушки проводили с использованием потока воздуха, поддерживаемого под давлением 69000 Па (10 фунт/кв.дюйм) в течение 1 часа. Затем микросферы переносили из мембраны в эксикатор, содержащий ~1 дюйм Drierite, и помещали в умеренный вакуум (9300 ПА = 70 торр) в течение 2 - 3 дней. После этого проводили окончательную сушку в вакуумной печи при 35-40oC и давлении 54 Па (0,4 торр) до тех пор, пока растворитель будет необнаружимым средствами газовой хроматографии (предел детекции CH2Cl2 для ГХ составляет 0,02% (по полной массе микрочастиц)). Поэтому этот способ позволяет удалять, в основном, весь остаточный органический растворитель, оставляя, возможно, лишь менее 0,02%.
Пример 4.
Получение микрочастиц, содержащих 60% медроксипрогестерона ацетата (MPA) и 40% поли
(молочной-со-гликолевой) кислоты (PLGA)
85:15 MedisorbTM с помощью литья
Использовали медроксипрогестерона ацетат (МРА), полученный от Steraloids. Непосредственно перед
использованием компонент характеризовали с помощью УФ-спектроскопии и определения его точки плавления. Поли (молочную-со-гликолевую) кислоту 85:15 DL MedisorbTM использовали в том виде, в
котором она была получена от DuPont. Метиленхлорид (наивысшего сорта) был получен от Fisher Scientific. Полимер (6,0022 г) растворяли в 24 мл метиленхлорида в виде 25%-ного раствора (0,25 г PLGA/ мл
метиленхлорида). Медроксипрогестерона ацетат (9,0022 г) добавляли к полимерному раствору и размешивали до полного перемешивания. Затем раствор наливали на чистую ровную стеклянную пластинку,
используя
регулируемую лопатку Boston-Bradley для получения одинаковой толщины слоя. Отлитую из раствора пленку оставляли на несколько часов для осушки в вытяжном шкафу с дымовой завесой. После
выпаривания
большей части растворителя полученную пленку отделяли от стеклянной пластины и осушали в вакууме при комнатной температуре в течение 4 дней.
Пленка, полученная в стадии отливки, имела очень низкую плотность, поскольку в результате удаления растворителя образовывались поры очень большого размера. Для уменьшения проникновения жидкостей в микрочастицы объем пор снижали путем прессования при нагревании с использованием гидравлического пресса. Полученную пленку экструдировали в стержни при около 125oC с помощью гидравлического пресса (Pasadena Hydraulic Inc. Press).
Экструдированные стержни измельчали в мелкие частицы с использованием стандартной дробилки, снабженной камерой для охлаждения. После измельчения порошок пропускали через серию стандартных сит США для получения частиц с размером в диапазонах 38-125 микрон, 125-180 микрон и 180-250 микрон. Полученные в результате частицы собирали.
Пример 5
Выпаривание остаточного растворителя
а) Для осушки использовали аппарат Adberhalden (поставляемый фирмой Aldrich Chemical Co). Наиболее важная отличительная особенность этого стеклянного
сосуда заключается в том, что он позволяет использовать высокий вакуум и нагревание одновременно и при этом дает возможность хранить образец для осушки в присутствии осушающего агента (молекулярного
сита 3A). В этой стадии высокий вакуум (1,3 Па) получали с помощью вакуумного насоса (E2M5 Edwards). Нагревание образца для осушки в случае партии MPA-MB-V осуществляли путем нагревания с обратным
холодильником смеси растворителей: CH2Cl2 + ацетон до получения температуры 45oC.
b) Партии (MPA-MB-VII) - (MPA-MB-XI), (MPA-MFI-73), (MPA-MLV-31), (MPA-MLV-32), (MPA-MLV-34), (MPA-MLV-35), (MPA-MLV-39) и (MPA-MLV-40) осушали следующим образом: во всех указанных партиях для дополнительной осушки микросфер использовали вакуумную печь. Вакуум 54 Па (0,4 торр) обеспечивали с помощью вакуумного насоса E2M5 Edwards. Температуру строго контролировали (44-46oC), и все партии одновременно осушали в указанной системе.
Пример
6
Определение остаточного метиленхлорида
Концентрацию остаточного метиленхлорида в микросферах определяли с помощью газовой хроматографии, используя газовый хроматограф
Varian 3700,
снабженный капиллярной колонкой DB-1 и FID-детектором. Температурный режим: 7 мин при 40oC, затем нагревание со скоростью 10oC/мин пока не будет достигнута
температура 200oC (1 мин). Объемы инъекций составляли 1,0 мкл. Для осуществления ГХ-анализа микросферы (25 мг) растворяли в CHCl3 (сорт HPLC, 1 мл), а затем разводили 5
миллилитрами изо-октана.
Течную концентрацию метиленхлорида определяли с помощью калибровочной кривой, полученной по 5 стандартам. Эти стандарты получали из чистого метиленхлорида (CH2
Cl2) и хлороформа
(CHCl3) в диапазоне концентраций от 0,1 до 1,0% мас. Результаты, полученные на основании анализа концентрации остаточного метиленхлорида, представлены в табл.
3.
Пример
7
Определение MPA-загрузки сердцевины
а) Ядерный магнитный резонанс: определение загрузки MPA осуществляли с помощью ЯМР-спектроскопии путем анализа
площади под пиком 19-метильной
группы MPA при δ = 0,65 м.д, и пиком атомов водорода полимера (мультиплет при δ = 5,20 и при δ = 4,8). Использовали ЯМР-спектрометр AC-F300FT
Bruker. См., например, ЯМР-спектр на
фиг. 3 и стандартную кривую на фиг. 4 для определения загрузки сердцевины, которая была построена для известных смесей полимера и MPA, исходя из данных
ЯМР-спектра.
b) Стерическая эксклюзионная хроматография: измерения загрузки сердцевины MPA посредством стерической эксклюзионной хроматографии (СЭХ) проводили с использованием СЭХ-системы с колонкой (PL-гель 50 А, 5 мкм) и с колонкой со смешанным PL-гелем и элюированием хлороформом (ВЭЖХ-сорт). Например, (см. фиг. 5) измерения 50:50-PLG-микросфер проводили при 40oC, и в этих условиях MPA и DL-PLG тщательно отделяли. Загрузку образца определяли путем измерения площади под пиком MPA с использованием калибровочной кривой, полученной исходя из стандартных концентраций смесей PLG/MPZ.
Пример
8
Физические характеристики микросфер, определенные с помощью растрового электронного микроскопа (РЭМ)
Для проведения анализа
морфологии поверхности микросфер эти микросферы
исследовали с помощью растрового электронного микроскопа (РЭМ), используя прибор JEOL JSM T330A. Образцы для исследования получали путем нанесения
микросфер на двухстороннюю магнитную ленту, а затем
покрывали золотым слоем, имеющим толщину 500 - 600
Например, точное определение распределения по размерам MPA-микросфер партии MPA-MB-V было осуществлено путем непосредственного измерения диаметра микросфер по фотографиям, полученным с помощью РЭМ. Как видно из фиг. 8, 95% из проанализированных таким образом 680 микросфер имели размер менее 40 мкм со средним диаметром 18,6 ± 9,7 (ср. кв. ош) микрон. Такой малый размер микросфер способствует облегчению введения инъекций и уменьшению продолжительности высвобождения.
Из фиг. 7, где показаны поперечные сечения микросфер, видно, что MPA концентрируется в участках, диспергированных в полимерах.
Пример
9
Характеризация микросфер с помощью дифференциальной сканирующей калориметрии (ДСК)
Термоанализ образцов
осуществляли с использованием прибора Perkin-Elmer DSC-7. Это прибор был
калиброван индием, а его скорость сканирования составляла 10oC/мин.
Из фиг. 9, где представлена ДСК-кривая MPA-микросфер, видно, что максимальная температура осушки может быть легко определена.
Пример 10
Стерилизация микросфер
Перед инъекцией микросферы
стерилизовали гамма-облучением (2,2 Мегарад.) с использованием кобальтового
источника (Cobalt-60 (Gammacell 200). Стабильность MPA контролировали с помощью стерической эксклюзионной хроматографии
(СЭХ), а стабильность полимера анализировали путем СЭХ, используя полистироловые
стандарты для калибровки и путем модификации относительной вязкости, используя капиллярный вискозиметр.
Гамма-облучение (2,2 Мегарад.) не разрушало MPA, но приведенная удельная вязкость микросфер в CH2Cl2-растворе снижалась от 0,301 ± 0,008 до 0,262 ± 0, 003 дл/г, что указывало на разрушение некоторых полимерных цепей.
Образцы партии MPA-MB-V экспонировали различными количествами гамма-излучения (0; 1,1; 2,2 Мегарад.) и измеряли параметры молекулярно-массового распределения (M(n - 1), Mn, Mz, M(z + 1) (см., например, фиг. 10A), а также их полидисперсность (Mw/Mn), см. фиг. 10B.
Полученные данные показали, что доминирующим фактором является бессистемный разрыв полимерных цепей. Таким образом, облученные микросферы будут биологически разлагаться более быстро, чем необлученные микросферы, а поэтому при получении микросфер это воздействие радиации следует учесть, например, путем предварительной ориентации при расчете на более низкую скорость высвобождения, чем желаемая скорость конечного продукта.
Пример 11
Сывороточные уровни MPA у кроликов, которым
были подкожно инъецированы MPA-содержащие микросферы
Новозеландских белых кроликов (весом около 2,7
кг) помещали по одному в клетку в режиме: 10 час.-день и 14 час.-ночь (освещение включали в
07:00 час), и этим кроликам давали 16% "Таблеток для кроликов", получаемых от Moulees Kiloplus (Квебек,
Канада), и водопроводную воду adlibitum.
Группе кроликов (10 кроликов) подкожно инъецировали 50 мг MPA-содержащих микросфер (партия MPA-MB-V) в суспензии в растворе 2% карбоксиметилцеллюлозы и 1% Твина 80. Пробы крови брали в различные интервалы времени, а концентрации MPA измеряли с помощью РИА. Сывороточные уровни MPA представлены на фиг. 11.
Пример 12
Сывороточные уровни MPA у крыс, которым были подкожно инъецированы MPA-содержащие
микросферы
Молодых самок крыс Spague-Dawley [Crl: CD(SD)] получали от Charles River
Canada Inc. (St-Constant, Quebec) и помещали в клетки (по 2 крысы на клетку) в режиме: 14 часов-день, 10
часов-ночь (освещение включали в 05:00 час.). Крысам давали еду и водопроводную воду
adlibitum.
Группе из 10 крыс (Sprague-Dawley) подкожно инъецировали возрастающие дозы (5, 10 и 20 мг) MPA-содержащих микросфер в суспензии в растворе 2% карбоксиметилцеллюлозы и 1% Твин 80. Пробы крови брали в различные интервалы времени, а концентрации MPA измеряли с помощью РИА. Результаты показаны на фиг. 12.
Пример 13
Предупреждение карциномы
молочной железы у крыс, индуцированной диметилбенз(а)-антраценом (ДМБА), с использованием низкой дозы MPA
(микросфер).
Материалы и методы:
Животные и индуцирование карциномы
молочной железы
В самок крыс Sprague-Danley (Crl: CD(SD)Br), (полученных от Charles River Canada
Inc., St. Constant, Quebec) возрастом 50 - 52 дня, индуцировали карциному молочной железы
путем одноразового внутрижелудочного введения 20 мг диметилбенз(а)антрацена (ДМБА) (Sigma Chemicals Co., St.
Louis, Mo) в 1 мл кукурузного масла.
Обработка
За одну неделю до
введения ДМБА животных разделяли на три группы (необраб. , необраб. + 30 мг MPA и необраб. + 100 мг MPA),
после чего животным подкожно вводили одноразовую инъекцию 30 мг или 100 мг MPA-содержащих
микросфер соответственно.
Результаты
Как показано на фиг. 13, через 85 дней после
введения ДМБА у необработанных крыс у 65% животных обнаруживали опухоли молочной железы,
тогда как у крыс, заранее обработанных 30 мг и 100 мг MPA (микросферы), лишь у 7,4% и 6,3% животных
обнаруживали опухоли молочной железы соответственно. Полученные данные явно свидетельствуют о том,
что предварительная обработка крыс MPA-микросферами способствовала ингибированию развития у них
карциномы молочной железы, индуцированной ДМБА, и, кроме того, эти данные дают основание предположить,
что MPA-микрокапсулы могут быть использованы для предупреждения рака молочной железы у женщин.
Термины и описания, используемые в настоящей заявке, относятся к предпочтительным вариантам настоящего изобретения, которые даны лишь в иллюстративных целях и не должны рассматриваться как некое ограничение изобретения; при этом каждому специалисту ясно, что в него могут быть внесены различные изменения, не выходящие за рамки нижеследующей формулы изобретения.
Реферат
Изобретение относится к медицине. Раскрываются частицы пролонгированного высвобождения, включающие андрогенный стероид, диспергированный в биологически разлагаемом полимерном связующем вещества при их массовом соотношении от 1:4 до 7:3 соответственно. Андрогенным стероидом является медроксипрогестерона ацетат или мегестрола ацетат. Биологическое разложение полимерного связующего вещества способствует высвобождению указанного андрогенного стероида со скоростью и продолжительностью, которые обеспечивают его концентрацию в сыворотке крови от 1,0 до 50,0 нМ/л за период от 48 часов до 28 дней после введения. Также рассмотрены способ активации рецепторов андрогена, способ ингибирования роста клеток рака молочной железы и способы контрацепции, предусматривающие введение терапевтически эффективных количеств части пролонгированного высвобождения. Новые инъецируемые системы доставки с пролонгированным высвобождением медроксипрогестерона ацетата и мегестрола ацетата позволяют поддерживать низкие концентрации этих стероидов в крови в течение длительных периодов времени, например одного месяца и более, а также содержат минимальные количества остаточного токсичного органического растворителя и обладают минимальным маскулинизирующим действием. Применение указанных систем доставки дает положительный эффект в отношении затрат на здравоохранение. 6 с. и 3 з.п. ф-лы, 15 ил. 3 табл.
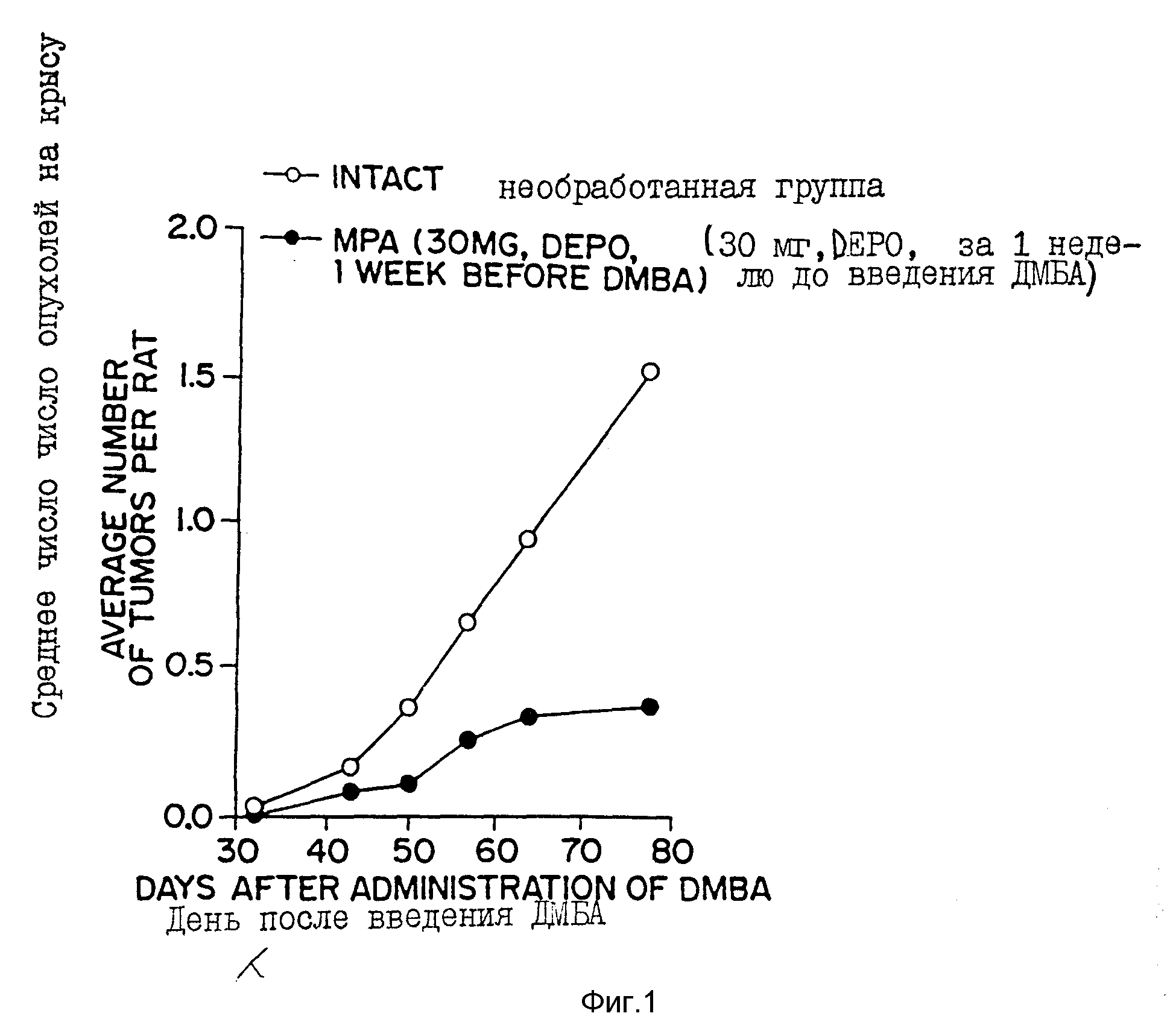

Комментарии