Удлиненная многослойная индикаторная тест-полоска для измерения концентрации аналита и способ измерения концентрации аналита - RU2198406C2
Код документа: RU2198406C2
Чертежи

Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Эта заявка является частичным продолжением одновременно рассматриваемой патентной заявки США 08/743432, поданной 1 ноября 1996 г., которая является продолжением аннулированной заявки 528511,
поданной 3 августа 1995 г., являющейся частичным продолжением заявки 411238, поданной 27 марта 1995 г., и заявки 442035, поданной 15 мая 1995 г.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
1. Область изобретения.
Это изобретение относится к сухой тест-полоске для измерения концентрации аналита в биологической жидкости, в частности тест-полоске, которая измеряет концентрацию непосредственно без необходимости использования измерительного прибора.
2. Описание известного уровня техники.
Было разработано много визуальных тест-устройств для измерения концентрации определенных аналитов в биологических жидкостях. Эти устройства измеряют, например, уровень глюкозы, холестерина, протеинов, кетонов, фенилаланина или ферментов в крови, моче или слюне.
Сухие фазовые индикаторные полоски, включающие основанные на ферментах составы экстенсивно используются в клинических лабораториях, врачебных кабинетах, госпиталях и домах для тестирования образцов биологических жидкостей на концентрацию глюкозы. В действительности индикаторные полоски стали повседневной необходимостью для многих из нескольких миллионов национальных диабетиков. Так как диабет может вызывать опасные аномалии в химии крови, он может приводить к потере зрения, повреждению почки и другим серьезным медицинским последствиям. Для минимизации риска этих последствий большинство диабетиков должно периодически контролировать себя, после чего соответственно регулировать концентрацию глюкозы в своей крови, например, через диетический контроль и/или с помощью инъекций инсулина. Некоторые пациенты должны проверять концентрацию глюкозы в своей крови по четыре раза в день или чаще.
Это особенно важно для диабетиков, которые должны соблюдать диету для регулирования потребления сахара и/или делать инъекции инсулина и которые должны руководствоваться в этом отношении частыми проверками концентрации глюкозы в крови для того, чтобы иметь быстродействующие недорогие и точные индикаторные полоски для определения глюкозы.
Известны индикаторные полоски, которые содержат индикатор, который изменяет оттенок цвета в зависимости от концентрации глюкозы в биологической жидкости, которая была нанесена на полоску. Хотя некоторые из этих полосок используют восстановительную химию, более обычно они включают окисляющееся красящее вещество или пару красящих веществ. Некоторые из полосок включают фермент, такой как глюкосидаза, который способен окислять глюкозу с образованием глюконовой кислоты и перекиси водорода. Они также содержат окисляемые красящее вещество и вещество, имеющее перекисную активность, которая способна осуществлять селективное катализационное окисление окисляемого красящего вещества в присутствии перекиси водорода (см., например, патент США 5306623, выданной 26 апреля 1994 г.).
В патенте США 3964871, выданном 22 июня 1976 г. Hochstrasser, описана доступная индикаторная полоска для непосредственного измерения содержания веществ, таких как глюкоза, в биологических жидкостях. Индикатор регистрирует концентрацию вещества путем включения как индикаторного реагента, который окисляется и изменяет цвет при вступлении в реакцию с веществом, так и "антагониста", который некоторым образом предотвращает накопление окисленного индикатора до его полного потребления.
В опубликованной 24 мая 1989 г. Европейской патентной заявке 0317070 (см. также патент США 5036000, опубликованный 30 июля 1991 г. на Palmer и др. ) описывается "цифровая" система количественного анализа для глюкозы и других аналитов. Эта система осуществляет измерение концентрации органического соединения в биологической жидкости путем первичного окисления соединения посредством оксидазного фермента для получения перекиси водорода. Система включает хромоген, который является восстановителем перекиси водорода, и воздушностабильный восстановитель перекиси водорода, который имеет больший восстановительный потенциал. Больший восстановительный потенциал задерживает любое обнаруживаемое изменение цвета посредством хромогена до тех пор, пока не будет потреблен воздушностабильный первый восстановитель перекиси водорода. Таким образом, не происходит результирующее изменение цвета, если количество перекиси водорода, которое должно измеряться, меньше заданного уровня, соответствующего концентрации воздушностабильного восстановителя перекиси. В результате, система измеряет концентрацию количественно, независимо от интенсивности изменения цвета.
В патенте США 4738823, выданном 19 апреля 1988 г. на имя Englemann, описана тест-полоска для определения аналита, имеющая опорный элемент, который имеет поглощающий материал, расположенный для удаления избыточного количества образца, наносимого на полоску. Полоска также может включать покрытие, в котором имеется отверстие, через которое может вводиться образец.
В патенте США 4810470, выданном 7 марта 1989 г. на имя Burkhardt и др., описано устройство для измерения концентрации аналита в жидких образцах. Устройство включает одну или более впитывающих матриц, имеющих непроницаемое для жидкости покрытие или пленку.
Образец наносится на часть впитывающей матрицы и измеряется в матрице хроматографически. За счет фитильного действия образец проходит к аналитической области, содержащей испытательный реагент для аналита.
В патенте США 4994238, выданном 19 февраля 1991 г. на имя Daffern и др., описано тест-устройство химического анализа, которое содержит поглощающий слой, водонепроницаемый барьерный слой и реагентный слой, который имеет заданный объем. Образец наносится на реагентный слой через выравненные отверстия в лежащих сверху поглощающем и барьерном слоях.
Независимо от того, проводится испытание дома, в кабинете врача, клинике или госпитале, чрезвычайно важными являются точность и воспроизводимость определения содержания глюкозы. В случае указывающей цвет индикаторной полоски желательно, чтобы изменение цвета было заметным и нечувствительным к изменениям в компонентах биологической жидкости, отличных от глюкозы. В случае визуально считываемой индикаторной полоски особенно важно, что диабетики, которые могут иметь ухудшенное зрение, имеют полоску, которая выставляет показательное изменение цвета, зависящее от концентрации глюкозы, хотя изменение цвета, выставляемое как изменение в поглощении при данной длине волны, является также важным для точности считываемых измерительным прибором полосок.
Так как изменение цвета включает ряд химических реакций, оно не происходит мгновенно. Таким образом, пользователь должен ожидать некоторый период времени, обычно минуту или меньше, для того, чтобы произошли реакции. При считывании полоски измерительным прибором схемы таймера могут выдавать сигнал, указывающий на завершение реакций. Однако при визуальном считывании полоски без использования измерительного прибора пользователь может недооценить необходимое время, считывать полоску преждевременно и получать ошибочный результат. Альтернативно, пользовать может чувствовать необходимость ожидания чрезмерное время перед считыванием полоски, чтобы быть уверенным в том, что реакция завершилась, вызывая ненужную задержку и неудовлетворенность пользователя. Таким образом, возникает необходимость использования "химического" таймера, то есть элемента на полоске, который будет изменять цвет независимо от концентрации глюкозы (или другого интересуемого аналита) в образце, но будет это делать только по истечении достаточного промежутка времени для завершения цветоформирующих реакций с образцом.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением удлиненная многослойная индикаторная тест-полоска для измерения концентрации аналита в образце биологической жидкости,
прикладываемом к полоске, содержит:
а) нижний слой со сквозным отверстием для приема образца,
б) мембранный слой, имеющий образцовую сторону, обращенную к нижнему слою, и
испытательную сторону, противоположную ей и имеющую расположенные вдоль ее длины множество дискретных впитывающих аналитических областей, разделенных невпитывающей областью, причем мембрана содержит
реагент, который может вступать в реакцию с аналитом для получения изменения цвета, при этом реагент содержит
i) первую компоненту, взаимодействующую с аналитом для получения перекиси
водорода;
ii) вторую компоненту, взаимодействующую с перекисью водорода для претерпевания изменения цвета, и
iii) третью компоненту, которая предотвращает изменение в цвете второй
компоненты;
в) промежуточный слой между нижним и мембранным слоями,
г) измерительное средство для распределения образца вдоль полоски, содержащее канал транспортировки жидкости,
сформированный в промежуточном слое, для направления образца поверх мембранной поверхности к впитывающим аналитическим областям,
причем концентрация ингибитора увеличивается заданным образом
в зависимости от расстояния от первого конца полоски так, что в образце должна быть соответствующим образом увеличивающаяся концентрация аналита для осуществления изменения цвета, тем самым одна или
более аналитических областей могут изменять цвет при прикладывании образца к полоске, и изменяющая цвет область, наиболее удаленная от первого конца, указывает концентрацию аналита в образце.
В процессе работы способ измерения концентрации аналита в образце биологической жидкости содержит операции:
а) прикладывают образец к индикаторной тест-полоске, которая содержит:
i) нижний слой со сквозным отверстием для приема образца,
ii) мембранный слой, имеющий образцовую сторону, обращенную к нижнему слою, и содержащий множество впитывающих аналитических
областей, каждая из которых изменяет цвет при контактировании с жидкостью, содержащей по крайней мере заданное количество аналита, превышающее количество аналита, вызывающее изменение цвета
аналитических областей, расположенных ближе к первому концу полоски, и
iii) измерительное средство для распределения образца от сквозного отверстия вдоль заданного невпитывающего пути к
каждой из аналитических областей и
б) определяют концентрацию аналита путем наблюдения аналитической области, которая изменяет цвет и которая является наиболее удаленной от первого конца
полоски.
Полоска является полоской типа, которая обеспечивает видимую индикацию концентрации аналита, содержащегося в биологической жидкости, приложенной к "образцовой стороне" полоски. Видимая индикация появляется на противоположной (или "испытательной") стороне полоски. Конечно, химический состав тест-полоски зависит от комбинации аналита/биологической жидкости, которая должна измеряться. Тест-полоски могут конструироваться для обнаружения аналитов, таких как глюкоза или другие сахары, алкоголь, холестерин, протеины, кетоны, мочевая кислота, пренилаланин или ферменты в биологических жидкостях, таких как кровь, моча и слюна, а также вода. Для удобства и краткости индикаторные тест-полоски, описанные наиболее подробно в этом описании, обнаруживают содержание глюкозы в крови. Обычный специалист в данной области техники мог бы легко приспособить представленную в этом описании информацию для обнаружения других комбинаций аналита/биологической жидкости.
Предлагаемая тест-полоска обеспечивает сравнительно простое и быстрое определение концентрации глюкозы в неизмеренном образце крови. Полоска содержит нижний слой с отверстием, через которое может вводиться образец к образцовой стороне пористой матрицы, противоположная сторона которой является испытательной стороной. Матрица обычно является мембраной и в настоящем описании и прилагаемой формуле изобретения попеременно используются два термина. Испытательный реагент прикладывается к матрице и в большей или меньшей степени проникает внутрь пор матрицы. Для простоты изобретатель иногда называет реагент на матрице "покрытием" в этом описании и в прилагаемой формуле изобретения, признавая, что покрытие реагента проникает в матрицу.
Между нижним слоем и матрицей находится промежуточный слой. В одном воплощении вырезы в промежуточном слое выравнены с невпитывающими областями мембраны для направления образца к ряду впитывающих аналитических областей, которые расположены вдоль полоски. (Используемый в этом описании и прилагаемой формуле изобретения термин "впитывающий" означает поглощающий.) Ряд канавок в промежуточном слое окружает пространство вокруг и выше аналитических областей для ограничения течения образца к этим областям. В другом воплощении удлиненная, практически прямоугольная прорезь в промежуточном слое направляет образец к последовательности впитывающих областей, которые разделены невпитывающей областью.
Таким образом, установленный объем образца, обычно цельная кровь, которая включает как эритроциты, так и глюкозу, направляется к образцовой стороне мембраны в каждой из ряда аналитических областей. Пористость матрицы дает возможность жидкости проходить от образцовой стороны к испытательной стороне, например, за счет капиллярного действия. Таким образом, испытательный реагент может вступать в реакцию с глюкозой в крови, вызывая изменение цвета на или около испытательной стороны. Так как сильно окрашенные эритроциты могут делать это труднее для обнаружения изменения цвета, предпочтительно, матрица является анизотропной с неодинаковыми размерами пор от больших пор на образцовой стороне к меньшим порам на испытательной стороне для улавливания эритроцитов от испытательной стороны. Может использоваться целый ряд материалов для различных компонент тест-полоски и таймера предлагаемого устройства. Некоторые из этих материалов описаны в патентах США 5306623 и 5418142, выданных 26 апреля 1994 г. и 23 мая 1995 г. соответственно на имя Kiser и введенных в описание для ссылки.
Испытательный реагент содержит компоненту для преобразования глюкозы в перекись водорода, одну или несколько компонентов для обнаружения перекиси водорода, полученной из глюкозы, присутствующей в образце, ингибитор. В качестве компонентов для обнаружения перекиси водорода может быть пероксидаза, предпочтительно хреновая пероксидаза, вместе с "индикатором", который изменяет цвет во время реакции. Индикатором может быть окисляемый краситель или красящая пара. Пероксидаза катализирует окисление индикатора в присутствии перекиси водорода. Конечным элементом реагента является ингибитор, который замедляет изменяющее цвет окисление индикатора.
Полоска разделена на части вдоль своей длины таким образом, что соседние мембранные сегменты имеют различные концентрации ингибитора. Каждый сегмент имеет впитывающую аналитическую область, которая изменяет цвет только если и когда достаточное количество глюкозы присутствует, чтобы сначала вызывать потребление всего ингибитора и затем окислять индикатор и тем самым вызывать характерное изменение цвета. Таким образом, изменение цвета в данной области служит доказательством пороговой концентрации глюкозы в первоначальном образце крови. Вдоль полоски, в данном направлении, каждый последующий сегмент имеет постепенно увеличивающуюся концентрацию ингибитора, которая соответствует постепенному увеличению пороговой концентрации глюкозы. Концентрация индикатора является одинаковой для всех сегментов. В принципе, также возможны другие изменяющиеся балансы ингибитор/индикатор.
Если сегменты имеют концентрации ингибитора в соответствующем диапазоне для данного тест-образца, соседние аналитические области вступают в реакцию с аналитом так, что одна область окрашивается, а соседняя область остается неокрашенной. Это указывает на то, что концентрация глюкозы в образце по крайней мере равна пороговой концентрации, необходимой для изменения цвета одной области, но не больше концентрации, требуемой для изменения цвета соседней области.
Для контроля глюкозы крови покрытие сегмента произвольного таймера содержит элементы индикаторной полоски - пористую матрицу, имеющую испытательный реагент, нанесенный на нее, и, кроме того, глюкозу. В сухом состоянии химия реагента не активируется глюкозой, но при прикладывании образца к полоске покрытие таймера гидратируется и глюкоза в покрытии по истечении заданного промежутка времени вызывает изменение цвета индикатора. Предпочтительно, глюкоза присутствует в таймере в количестве, превышающем количество, требуемое для преодоления ингибитора. В этом случае необходимый промежуток времени длиннее или короче, в зависимости от того, больше или меньше присутствует ингибитора. Изменение цвета в полоске и в таймере может наблюдаться или непосредственно глазом, или с помощью оптического прибора, который обнаруживает изменения в отражательной способности.
КРАТКОЕ ОПИСАНИЕ
ЧЕРТЕЖЕЙ
Фиг. 1 изображает перспективный вид матрицы предлагаемой индикаторной тест-полоски с непосредственным считыванием,
фиг. 2 изображает вид снизу с вырезом образцовой стороны
предлагаемой индикаторной тест-полоски с непосредственным считыванием,
фиг. 3 изображает в увеличенном масштабе фрагментарный перспективный вид внутренности тест-полоски, показанной на фиг.2,
с частичным вырезом,
фиг. 4 изображает поперечное сечение полоски, показанной на фиг.2, по линии 4-4,
фиг.5 изображает вид снизу тест-полоски, показанной на фиг.2,
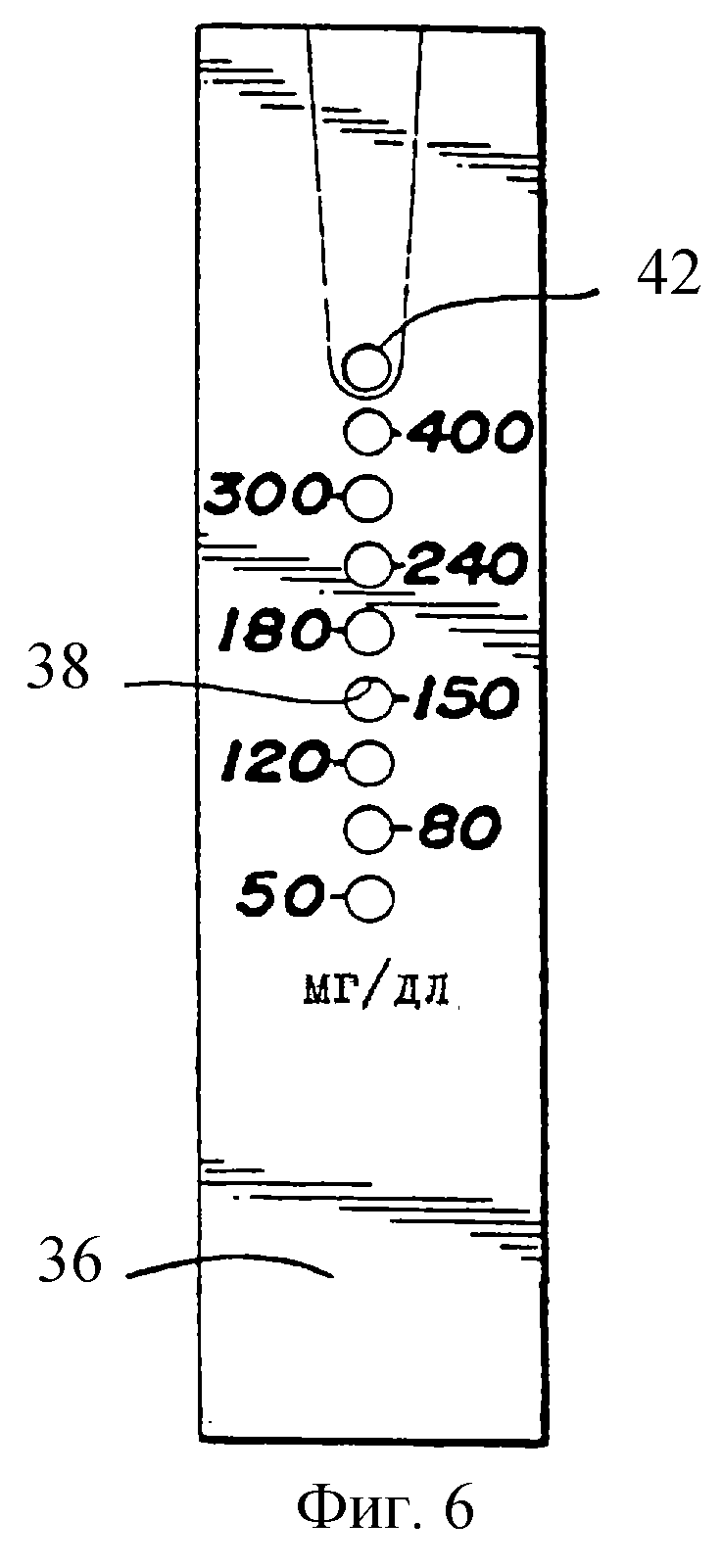
фиг.6
изображает вид сверху, показывающий испытательную сторону тест-полоски, показанной на фиг.5,
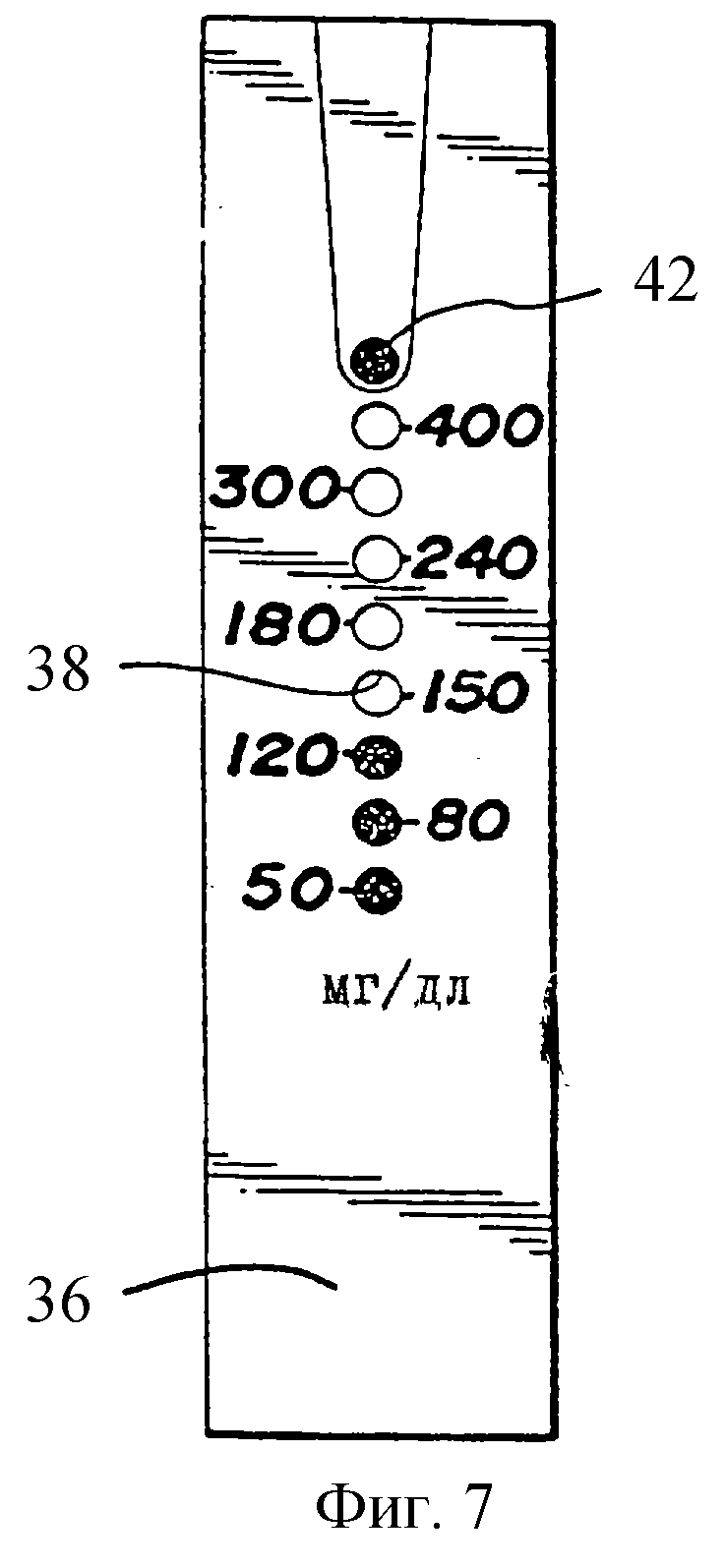
фиг.7 изображает полоску, показанную на фиг.6, после прикладывания к ней образца,
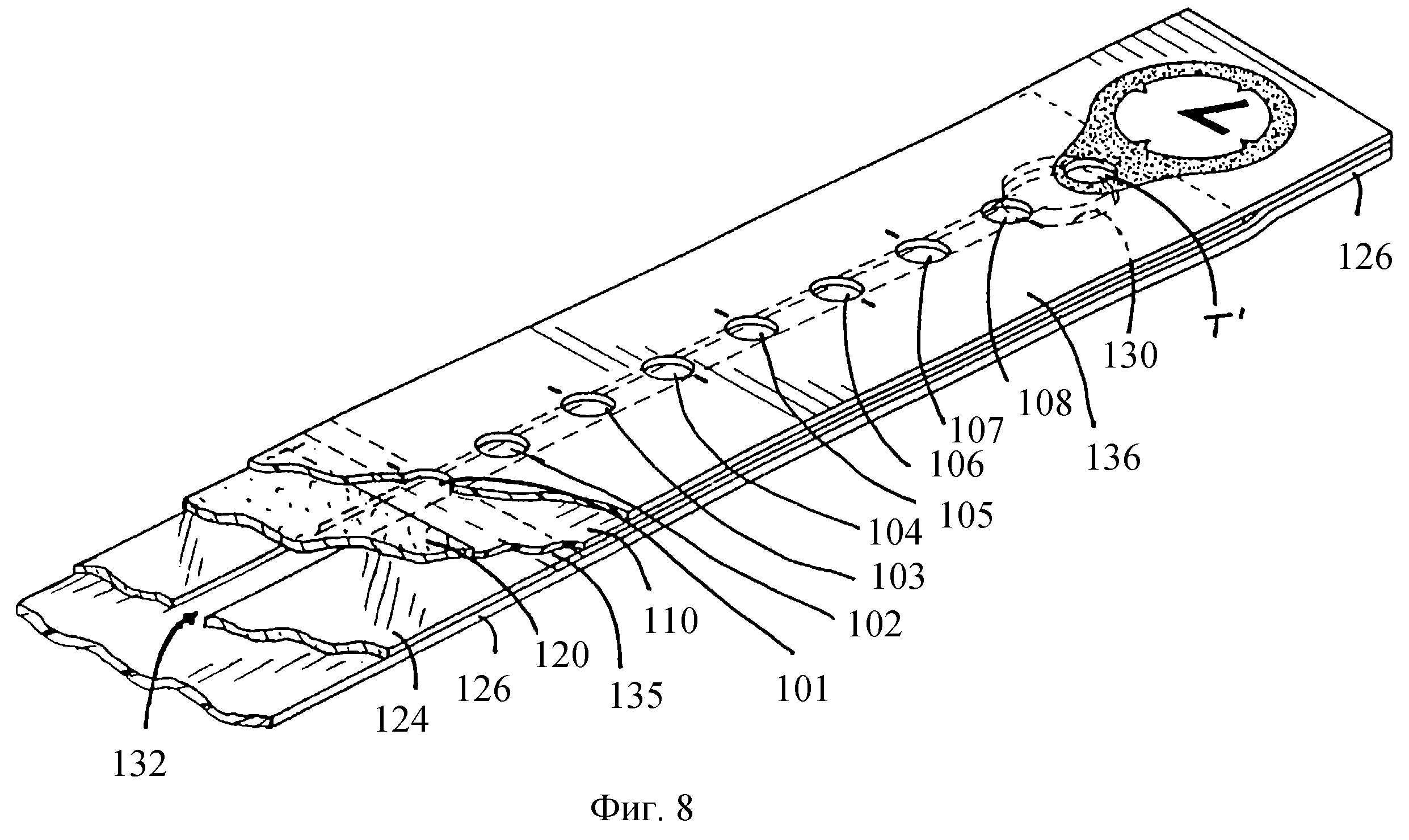
фиг.8
изображает перспективный вид с вырезом другого воплощения тест-полоски, показанной на фиг.2,
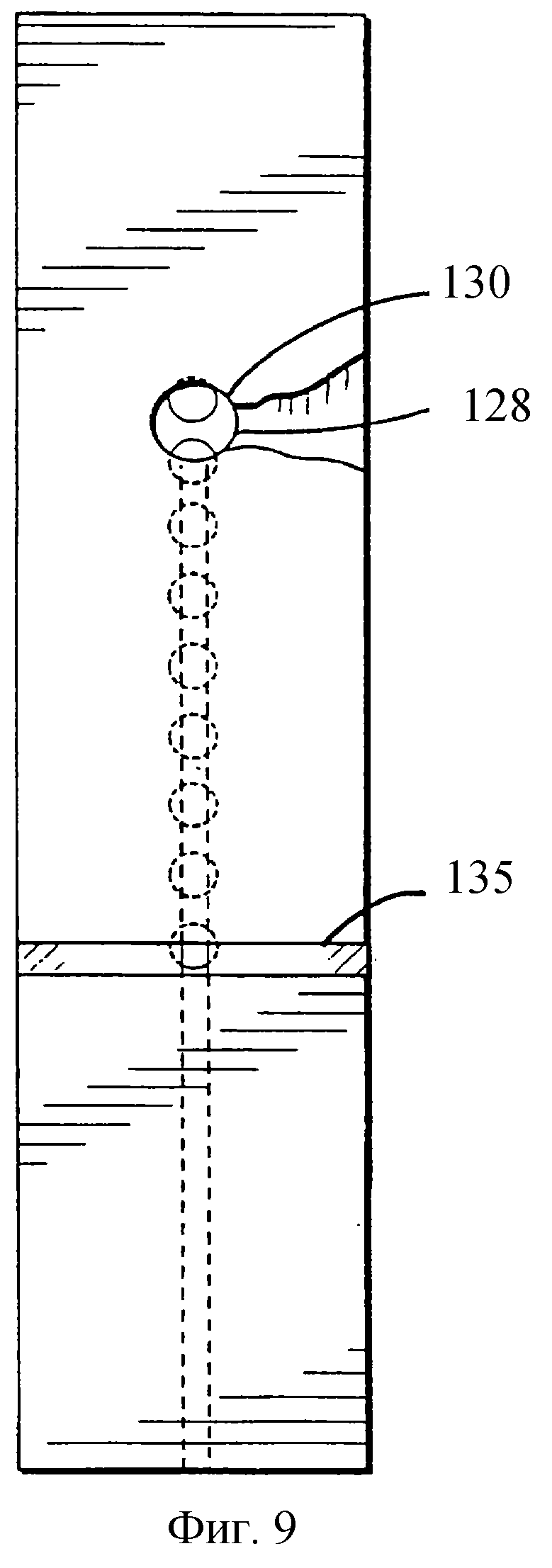
фиг.9 изображает вид снизу тест-полоски, показанной на фиг.8,
фиг.10 изображает вид
сверху тест-полоски, показанной на фиг.8,
фиг.11 изображает сечение полоски, показанной на фиг.10, по линии 11-11.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Предлагается
индикаторная тест-полоска с непосредственным считыванием для измерения концентрации аналита в биологической жидкости. Ключевым элементом такой тест-полоски является пористая матрица, которая включает
испытательный реагент, который претерпевает изменение цвета в ответ на содержание аналита в образце биологической жидкости, который прикладывается к полоске.
Матрица может иметь однородный состав или может быть покрыта подложкой и может быть или изотропной, или анизотропной. Она имеет образцовую сторону, к которой прикладывается образец, и испытательную сторону, где наблюдается изменение цвета. Предпочтительно, матрица представляет собой анизотропную мембрану, более предпочтительно, анизотропную мембрану, имеющую широкий диапазон размеров пор. Например, мембрана может иметь размер пор от около 0,1 до около 150 мкм. На стороне больших пор размер пор, предпочтительно, находится в диапазоне около 30-40 мкм. На стороне мембраны, где поры имеют наименьший размер, объем пор является сравнительно малым и материал мембраны является обычно совершенно плотным внутри слоя, который может обычно составлять вплоть до 20% толщины мембраны. Внутри этого слоя размер пор, предпочтительно, находится в диапазоне около 0,1-0,8 мкм с номинальным размером пор, предпочтительно, около 0,3 мкм. При прикладывании к образцовой стороне биологической жидкости образец сталкивается с все более мелкими порами при ее проникновении в мембрану. В конце концов плотные частицы, такие как эритроциты, достигают положения в мембране, где они дальше не могут проникать. Остаточная часть, еще содержащая растворенную глюкозу, проходит сквозь к испытательной стороне. Анизотропная природа мембраны и/или использование отделяющей компоненты (обсужденной ниже) позволяют сравнительно высокие скорости потока через мембрану, даже в то время как имеет место фильтрация плотных частиц.
При прохождении образца через матрицу реакция с реагентом вызывает формирование или разложение в объеме пор около испытательной стороны светопоглощающего красителя, тем самым значительно влияя на отражающую способность матрицы.
Примерами подходящих матричных материалов являются полисульфоны и полиамиды (найлоны). Могут также использоваться другие полимеры, имеющие сравнимые свойства. Полимеры могут быть модифицированы для введения других функциональных групп, которые предусматривают заряженные структуры, так что поверхности матрицы могут быть нейтральными, положительно заряженными или отрицательно заряженными.
Предпочтительным способом приготовления пористого материала, образующего матрицу, является литье полимера без поддерживающего сердечника. Такой матрицей, например, является анизотропная полисульфонная мембрана, доступная от фирмы Memtec, Inc, Timonium, MD. Обычно используется матрица, имеющая толщину менее 200 мкм, предпочтительно, в пределах около 115-155 мкм. Наиболее предпочтительной является толщина в пределах около 130-140 мкм, в частности, когда матрица выполнена из найлона или анизотропного полисульфона.
Мембрана может обрабатываться с помощью испытательного реагента путем погружения ее в смесь компонентов, тем самым пропитывая мембрану. Предпочтительно, по крайней мере некоторые из компонент прикладываются к мембране последовательно. Избыточный реагент может удаляться механическим средством, таким как, например, воздушный шабер, ракель или стеклянная палочка. Затем мембрана сушится. Реагент имеет тенденцию концентрироваться около испытательной стороны мембраны с малыми порами.
Испытательный реагент содержит (i) компоненту для преобразования глюкозы в перекись водорода, (ii) компоненту для обнаружения перекиси водорода и (iii) компоненту для торможения компоненты, которая обнаруживает перекись водорода. Реагент может произвольно дополнительно содержать отделяющую компоненту, которая вызывает улавливание в матрице частиц, таких как эритроциты, эффективно удаляя плотные частицы из биологической жидкости. Могут также включаться дополнительные компоненты, описанные ниже и приведенные в примерах.
Предпочтительными компонентами для преобразования глюкозы в перекись водорода являются глюкозоксидаза, фермент, который обычно получают из аспергилла или пеницилла. Глюкозоксидаза реагирует с глюкозой и кислородом для получения глюконолактона и перекиси водорода. Оптимальная концентрация глюкозоксидазы зависит от состава индикаторной системы. Например, если индикаторной системой является система МВТН SB-ANS (которая описана ниже), тогда концентрация глюкозоксидазы в пределах около 500-10000 ед/мл является подходящей, более предпочтительной является концентрация в пределах около 700-2000 ед/мл и наиболее предпочтительной является концентрация около 1000 ед/мл. Обычно более высокие концентрации глюкозоксидазы вызывают более быстрое прохождение реакции и пониженные концентрации вызывают более медленное прохождение реакции.
Таким образом, полученная перекись водорода вступает в реакцию с компонентой для обнаружения перекиси водорода, содержащей пероксидазу, которая выборочно катализирует реакцию между перекисью водорода и индикатором. Пероксидаза использует перекись водорода в качестве окислителя, способного удалять атомы водорода из различных веществ. Подходящая пероксидаза может содержать феррипротопорфирин, красный гемин, получаемый из растений. Пероксидазы, получаемые из животных, например из щитовидных желез животных, также являются подходящими. Особенно предпочтительной является хреновая пероксидаза (HR РО) в качестве составляющей части компоненты для обнаружения перекиси водорода.
Перекись водорода, предпочтительно катализируемая пероксидазой, реагирует или непосредственно, или косвенно для формирования или разложения индикаторного красителя, который поглощает свет в заданном диапазоне длин волн. Предпочтительно индикаторный краситель сильно поглощает на длине волны, отличной от той, на которой сильно поглощает испытательный реагент. Окисленная форма индикатора может представлять собой окрашенный или бесцветный конечный продукт, который служит доказательством изменения в цвете испытательной стороны матрицы. То есть испытательный реагент может указывать присутствие аналита в образце посредством обесцвечивания окрашенной области или, альтернативно, посредством окрашивания бесцветной области.
Индикаторы, являющиеся полезными в предлагаемом устройстве, включают а) 3-метил-2-бензотиазолинонгидразонгидрохлорид (МВТН), комбинированный с 3-диметиламинобензойной кислотой (ДМАВ); б) МВТН, комбинированный с 3,5-дихлоро-2-гидроксибензол-сульфокислотой (ДСНВS); в) 4-аминоантипирин (4-ААР) и 5-оксо-1-(р-сульфофенил)-2-пиразолин-3-карбоновую кислоту (OPS P); г) 4-ААР и N-(m-толил)-диетаноламин (NДА); д) 2,2'-азино-ди(3-этилбензтиазолин)сульфокислоту (ABTS); е) 4-ААР и 4-метоксинафтол; ж) пирогаллол красный (PGR); и) бромпирогаллол красный (BPR); к) кислотный зеленый 25 (AG); или л) [3-метил-2-бензотиазолинонгидразон] N-сульфонилбензолсульфонат мононатрия (МВТН SB), комбинированный с 8-анилино-1-аммонием нафталинсульфокислоты (ANS). Предпочтительной является система MBTH SB-ANS. Дополнительная информация, касающаяся системы MBTH SB-ANS, имеется в патенте США 5563031, выданном 8 октября 1996 г. и включенном в настоящее описание для ссылки.
Задерживающая компонента замедляет реакцию между перекисью водорода и индикатором, например, путем восстановления перекиси водорода или путем восстановления окисленного индикатора. В принципе, имеется несколько различных режимов работы для ингибитора. Во-первых, ингибитор мог бы конкурировать с индикатором и тем самым снижать скорость, при которой имеет место изменение цвета в индикаторе. Во-вторых, ингибитор мог бы быть неконкурирующим, так что практически весь ингибитор потребляется перед тем, как имеет место какое-либо значительное изменение цвета в индикаторе. Возможные также другие режимы работы ингибитора. Предпочтительно, ингибиторы предлагаемого устройства являются неконкурирующими.
Подходящими ингибиторами являются 2,3,4-оксигентизиновая кислота; пропилгаллат; 3,4-диоксикоричная кислота; 3,4-диоксибензальдегид; галлиевая кислота; 5, 6-диаменоурасил, аскорбиновая кислота и изоаскорбиновая кислота. Предпочитается аскорбиновая кислота, однако она окисляется в растворе и должна стабилизироваться для обеспечения возможности покрытия реагента. Предпочтительными стабилизаторами являются первичные спирты, такие как этиловый, метиловый или пропиловый спирт. Предпочтительным является этиловый спирт, в частности концентрированные растворы, то есть растворы, содержащие 50% или более этанола.
Хотя анизотропная мембрана, являющаяся предпочтительной матрицей, отфильтровывает эритроциты и удерживает их вдали от испытательной стороны, произвольно испытательный реагент может также содержать отделяющую компоненту. Отделяющая компонента должна быть способна получать сравнительно прозрачную бесцветную жидкость из жидкости, содержащей эритроциты, например цельной крови, путем изолирования эритроцитов в матрице. Отделяющие компоненты для использования в предлагаемом устройстве включают, но не ограничиваются полиэтиленгликолем, поли (метилвиниловый эфир/малеин) ангидридом, полипропиленгликолем, полистиролсульфокислотой, полиакриловой кислотой, поливиниловым спиртом и поливинилсульфокислотой при величине рН в пределах около 4,0-8,0. Такие отделяющие компоненты присутствуют в матрице в количествах, которые будут изменяться в зависимости от их заряда и молекулярного веса, других компонентов, заделанных в матрицу, величины рН матрицы и размера пор и остаточной влаги после сушки. Такие параметры легко определяются специалистом в данной области техники. Например, при использовании полипропиленгликоля в качестве отделяющей компоненты (например, PPG-410 от фирмы BASF) он, предпочтительно, присутствует с концентрацией около 2-30% веса к объему и, более предпочтительно, с концентрацией 8-10%. Другие отделяющие компоненты могут также использоваться при концентрации 2-30% веса к объему. Полимерные отделяющие компоненты могут пропитываться или заделываться в матрице или отливаться в мембране в процессе производства.
Отделение компонентов крови могут также осуществлять некоторые водорастворимые соли. Солями, подходящими для разделения компонентов крови, являются цитраты, соли муравьиной кислоты и сульфаты, а также определенные кислоты, такие как аминокислоты, лимонная кислота, фитиновая кислота и яблочная кислота (см., например, патент США 3552928, выданный 5 января 1971 г. на имя Fetter. Преимущество включения отделяющей компоненты заключается в том, что при практическом удалении из биологической жидкости плотных частиц, таких как эритроциты, становится меньше фонового цвета на испытательной стороне, затемняющего изменение в окрашивании, получаемое посредством испытательного реагента.
В матрицу могут быть заделаны другие компоненты для усиления окрашивания и улучшения считываемости индикаторных полосок и сохранения однородности и целостности матрицы. Например, испытательный реагент может включать соли и/или буферы для облегчения отделения красителя в матрице. Такие буферы могут содержать, например, цитрат, присутствующий в растворе в количестве от около 0,01 моля до около 1,0 моля и, предпочтительно, в количестве около 0,1 моля. Могут использоваться также другие буферы.
Могут также использоваться соединения, делающие матрицу гидрофильной, или соединения, которые могут действовать в качестве стабилизаторов, такие, как гидролизованные протеины. Такие соединения включают, но не ограничиваются, например, бычьим сывороточным альбумином, полипентидами и доступным протеином малого молекулярного веса, известным как Crotein SPA (от фирмы Croda, Inc.New York, N.Y.). Такие соединения используются при концентрациях, например, от около 1 мг/мл до около 100 мг/мл. В случае Crotein предпочтительна концентрация около 30 мг/мл.
В покрытие для матрицы могут также включаться другие стабилизаторы и консервирующие средства. Например, могут использоваться этилендиаминтетрауксусная кислота (ЕДТА), диэтилентриаминпентауксусная кислота (ДТРА) и родственные соединения, например, при концентрациях от около 0,01 мг/мл до около 10 мг/мл. Консервирующие средства служат для способствования стабилизации ингибитора.
Некоторые из индикаторов (например, BPR) имеют нежелательную тенденцию миграции в матрице. При использовании такого индикатора для предотвращения такой миграции включается агент спаривания ионов. Например, производные полиэтиленгликоля, коммерчески доступные под маркой Polycguart (H) (от фирмы Henkel, Inc. Ambler,PA), в частности, являются полезными за их способность облегчить спаривание ионов между индикатором и другими заместителями матрицы.
При индикации присутствия аналита путем формирования цвета (например, в индикаторной системе MBTH SB-ANS) могут добавляться поверхностно-активные вещества для повышения яркости цвета и контрастности относительно неокрашенного окружения.
При практической реализации настоящего изобретения могут также использоваться органические растворители и могут подпадать под формулировку испытательного реагента для матрицы, конечно, при условии, что они являются совместимыми с составами матрицы и испытательного реагента. Потенциально подходящие органические растворители включают хлороформ, ацетон, спирты, хлористый метилен, диэтиловый и петролейный эфиры, ацетонитрилы и их смеси. При практической реализации настоящего изобретения предпочтительной является, в частности, концентрация в 70% этанола в воде.
Испытательный реагент, который наносится на или пропитывается в матрицу, не является однородным по поверхности тест-полоски. Вместо этого, предпочтительно, реагент наносится на матрицу в виде ряда параллельных полосок или "сегментов", которые простираются поперек длины полоски. Состав в соседних сегментах имеет постепенно увеличивающуюся концентрацию ингибитора. Каждый сегмент имеет впитывающую аналитическую область. В аналитических областях испытательный реагент вступает в реакцию с любой глюкозой, содержащейся в крови, вызывая изменение цвета при условии, что концентрация глюкозы является достаточно большой для преодоления уровня ингибитора в этой аналитической области. Таким образом, каждая последующая аналитическая область требует постепенно увеличивающейся концентрации глюкозы в образце для того, чтобы вызывать изменение цвета области.
Произвольно, одна из аналитических областей приспосабливается для служения в качестве таймера для индикации того, что прошло достаточно времени для реакции реагента с глюкозой в каждой из аналитических областей. Сегмент таймера матрицы покрывается или пропитывается составом, который состоит из испытательного реагента и, кроме этого, глюкозы. Так как испытательный реагент служит для изменения цвета в ответ на глюкозу, комбинирование двух веществ, не вызывая изменения цвета, требует некоторого внимания. Количество ингибитора, превышающее количество, требуемое для выполнения функции выдержки времени, должно присутствовать для компенсации этого эффекта. Скорость сушки сегмента таймера после прикладывания раствора, содержащего глюкозу, управляется. На практике мембрана сначала покрывается раствором, содержащим буферы, стабилизаторы и ферменты, и это покрытие сушится для формирования первого слоя. Затем делается второе покрытие путем нанесения раствора, содержащего индикатор, ингибитор и глюкозу. Параметры, такие как скорость движения полотна (подложки), температура печи, воздушный поток и количество наносимых растворов покрытия, должны устанавливаться заранее, и соответствующие регулировки осуществляются для концентрации ингибитора и/или глюкозы. Вместо непосредственного нанесения второго покрытия менее предпочтительной альтернативой является изготовление второго покрытия на отдельном полотне и последующее его размещение на первом слое.
При прикладывании образца к полоске гидратация состава сегмента таймера дает возможность протекания формирующей окраску реакции. Затем определяется время, необходимое для изменения цвета сегмента таймера посредством температуры и посредством характеристик испытательного реагента, в частности концентрации ингибитора, количества глюкозы и скоростей гидратации и диффузии кислорода.
Время изменения цвета таймера может быть сделано зависящим от концентрации глюкозы в образце или, альтернативно, независимым от этой концентрации. Путем включения большого избытка глюкозы в таймер время становится практически независимым от концентрации глюкозы в образце. Путем включения меньшего количества глюкозы в таймер время может быть сделано зависимым от концентрации глюкозы в образце, то есть таймер будет изменять цвет быстрее, если будет концентрация глюкозы в образце больше. Предпочтительно, концентрация глюкозы в таймере больше, чем около 1500 мг/дл, что делает таймер практически независимым от концентрации глюкозы в образце, находящейся в пределах около 40-400 мг/дл. Состав сегмента таймера включает избыточное количество компоненты (такой как глюкозоксидаза), которая преобразует глюкозу в перекись водорода, и глюкозы. Состав таймера должен тогда включать, по крайней мере, такое же или большее количество ингибитора, чем у результирующего сегмента, который имеет наибольшую концентрацию ингибитора (который соответствует показанию наибольшей концентрации глюкозы).
Таймер также служит для выполнения важной функции управления качеством, указывая на то, что тест-полоска подвергается воздействию влаги. Тест-полоска должна оставаться сухой до момента времени ее использования, так как компоненты, преобразующие глюкозу в перекись водорода (обычно ферменты), имеют тенденцию деградировать, когда они подвергаются действию влаги. Таким образом, если полоска была преждевременно подвергнута действию влаги, она будет искажать результаты. Но повреждение тест-полоски не является очевидным для пользователя, который поэтому может использовать такую полоску и получать ошибочный результат. Однако, если полоска включает сегмент таймера, подвержение действию влаги вызывает изменение цвета таймера, что дает знать пользователю, что полоска была повреждена и не должна использоваться.
Дополнительная информация, касающаяся таймера, дана в одновременно рассматриваемой патентной заявке США 08/706753, поданной 3 сентября 1996 г. и введенной в это описание для ссылки.
Кроме матрицы, содержащей реагент, предлагаемая полоска содержит нижний слой, который поддерживает матрицу. Предпочтительно, нижний слой представляет собой лист термопластика, более предпочтительно, лист полиэфира, обычно толщиной в пределах около 0,05-0,2 мм, и имеет отверстие, через которое образец может прикладываться к образцовой стороне матрицы. От отверстия для образца образец крови распределяется вдоль длины матрицы. Если нижний слой вообще является непрозрачным, тогда на соответствующем расстоянии от образцового отверстия могут располагаться одно или несколько прозрачных окошек, при этом появление образца в окошках подтверждает, что к полоске был приложен соответствующий образец.
Распределение крови от образцового отверстия к аналитическим областям осуществляется через промежуточный слой, который лежит между нижним слоем и мембраной и, произвольно, приклеивается к обоим. Предпочтительно, промежуточный слой представляет собой лист термопластика, более предпочтительно, лист из полиэфира, имеющий обычно толщину в пределах около 0,05-0,2 мм. В одном воплощении профили в промежуточном слое направляют образец вниз длины полоски вдоль невпитывающих путей на мембране и к каждой из аналитических областей. Вырезы в промежуточном слое выравнены с аналитическими областями так, что каждая аналитическая область практически окружена стенками промежуточного слоя. В другом воплощении промежуточный слой имеет удлиненную, практически прямоугольную прорезь, которая направляет образец поперек поверхности мембраны к аналитическим областям. Ширина прорези обычно находится в пределах около 0,5-3 мм.
Предпочтительная структура для невпитывающих путей на мембране формируется путем разрушения пористой структуры мембраны. Это может быть выполнено путем нагревания или непосредственно, или путем использования лазера или ультразвука, и, предпочтительно, включая давление. Однако предпочтительным способом является дробление. Таким образом, мембрана подвергается дроблению, чтобы сделать ее невпитывающей (но еще гидрофильной) всюду, за исключением аналитических областей. В одном воплощении изобретения мембрана дробится между плоскими пластинами с пресс-формой, предотвращающей аналитические области от дробления. Предпочтительными являются давления, по крайней мере, около 80000 кПа. Необязательно, пластины могут быть нагреты до температуры, по крайней мере, около 110oС. Конечно, предпочтительные давления и температуры зависят от механизма дробления и времени задержки, а также и параметров мембраны. Оптимальные величины могут быть определены обычным экспериментальным путем. Воплощение, в котором мембрана подвергается дроблению таким образом, дает аналитические области, простирающиеся к нижнему слою, и используется с вырезанным промежуточным слоем, как обсуждено ниже.
Для точных измерений объем крови, подаваемый к каждой аналитической области, является предпочтительно воспроизводимым. Если бы вырезы целиком окружали аналитические области, тогда, предполагая наличие непроницаемого для жидкости уплотнения как между промежуточным слоем и нижним слоем, так и между промежуточными слоями раздробленной мембраной, то каждая аналитическая область была бы связана с замкнутым (цилиндрическим) объемом, стенки которого образованы промежуточным слоем и концы которого образованы мембраной и нижним слоем. Однако распределительный канал проходит вдоль полоски и подает образец к каждой из аналитических областей. Предпочтительно, нижний слой имеет входные отверстия, выравненные с аналитическими областями для облегчения равномерного заполнения канала и аналитических областей. Высокая точность требует, чтобы распределительный канал обеспечивал фиксированный объем образца к каждой аналитической области, но не в течение по крайней мере времени отсчета измерения - около 1 или 2 мин, начиная их отсчет спустя приблизительно 90 с после прикладывания образца крови. Так как первоначальный объем образца является переменным, предпочтительно имеется поглощающий слой в каждом конце мембраны для удаления избыточного количества образца с концов распределительного канала. Поглощающие слои на концах канала также усиливают фитильное действие (растекание) образца вдоль длины полоски. Предпочтительные поглощающие слои выполняются из неплетенных тканей, хорошо известных в данной области техники.
В другом воплощении изобретения мембрана и покрывающий лист прессуются между валками. Покрывающий лист имеет отверстия, расположенные для приспособления к аналитическим областям, и эти области тогда простираются в эти отверстия, оставаясь нераздробленными. Для этого воплощения в пресс-форме нет необходимости и, предпочтительно, дробление выполняется валками с прикладываемой силой, по крайней мере, около 4450 Н. Следует заметить, что в этом воплощении аналитические области простираются в противоположном направлении от направлений в описанном выше воплощении. Так как образец тянется к верхнему слою, открытому наружу, в нижнем слое не используются входные отверстия. Это воплощение используется с промежуточным слоем, который имеет практически прямоугольную прорезь для направления образца к аналитическим областям. Так как в этом воплощении имеется образцовое отверстие, расположенное около конца полоски, который имеет "высокоглюкозные" аналитические области, используется только один поглощающий слой около противоположного конца полоски.
Изменение цвета, вызванное глюкозой в тест-образце, появляется на испытательной стороне мембраны. В воплощении, в котором аналитические области простираются к нижнему слою, удобно покрывать испытательную сторону мембраны верхним слоем, имеющим отверстия, выравненные с аналитическими областями. Отверстия делают видимыми изменения цвета и также обеспечивают возможность доступа кислорода к местам реакции. Когда аналитические области простираются в противоположном направлении, отверстия в верхнем слое определяют аналитические области в процессе дробления, как было описано выше. В обоих случаях верхний слой, предпочтительно, представляет собой лист термопластика, более предпочтительно, лист из полиэфира, обычно имеющий толщину в пределах около 0,05-0,2 мм. Верхний слой может быть прикреплен к мембране, например, с помощью клея. Предпочтительно, использование любого клея ограничивалось бы невпитывающими областями мембраны, если бы он создавал помехи измеряющим содержание глюкозы реакциям. Однако, если клей не влияет на реакции, его размещение является менее критичным.
Так как аналитические области, когда они содержат предпочтительный реагент, медленно изменяют цвет при подвержении действию света или кислорода и так как произвольный таймер является чувствительным к влаге, предпочтительно, полоски упаковывают в непрозрачную кислороде - и влагонепроницаемую оболочку, такую как уплотненную обертку из фольги. Если полоски имеют индивидуальную упаковку, полоска может оставаться в открытой обертке в процессе использования.
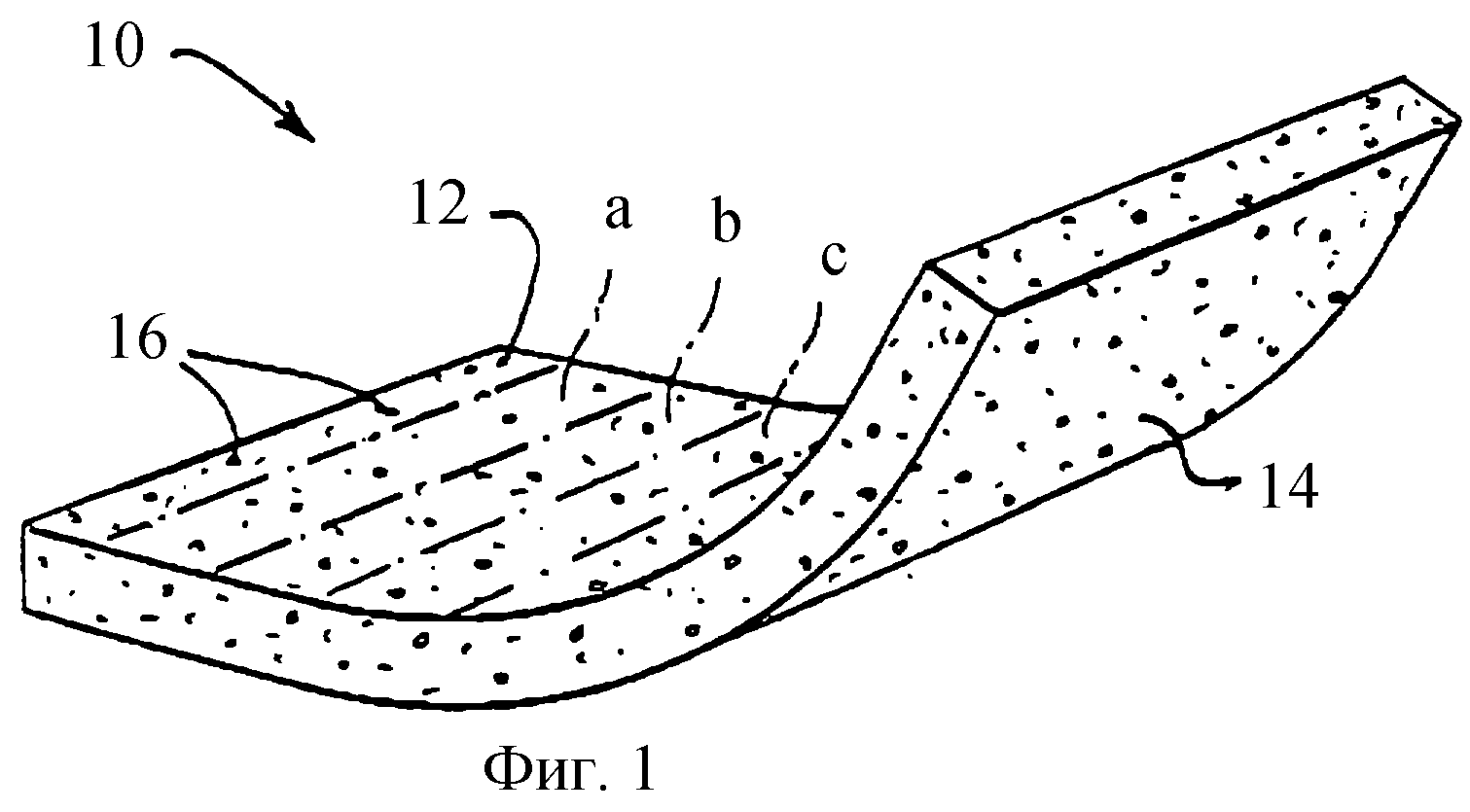
Изобретение будет теперь описано дальше со ссылкой на чертежи. На фиг.1 показана матрица 10 настоящего изобретения для измерения количества аналита в биологической жидкости. Хотя матрица 10 показана в изогнутом положении, она является гибкой и обычно занимает плоское положение в процессе использования. Матрица имеет образцовую сторону 12, к которой прикладывается образец биологической жидкости, и испытательную сторону 14, на или около которой изменение в цвете указывает на присутствие аналита. Изменение цвета происходит в результате взаимодействия аналита с реагентом, пропитываемым в поры 16. Предпочтительно, для измерения концентрации глюкозы в крови размеры пор являются сравнительно большими около образцовой стороны 12, и размер пор уменьшается при приближении к испытательной стороне 14. Градиент размера пор служит для улавливания эритроцитов около образцовой стороны 12, так что их цвет не препятствует способности видеть изменение цвета, свидетельствующее о присутствии аналита.
Схематично показаны три параллельных сегмента а, в и с. Каждый последующий сегмент имеет постепенно возрастающее количество ингибитора, чем предыдущий. В предпочтительном воплощении после прикладывания реагента к мембране в параллельных сегментах, как показано, мембрана дробится везде, кроме аналитических областей, где имеют место реакции аналита с реагентом. Одно воплощение формы впитывающих аналитических областей, расположенных по одной области в каждом из параллельных сегментов, и невпитывающие раздробленные области изображены в виде снизу на фиг.2 и во фрагментарном перспективном виде увеличенного масштаба на фиг.3.
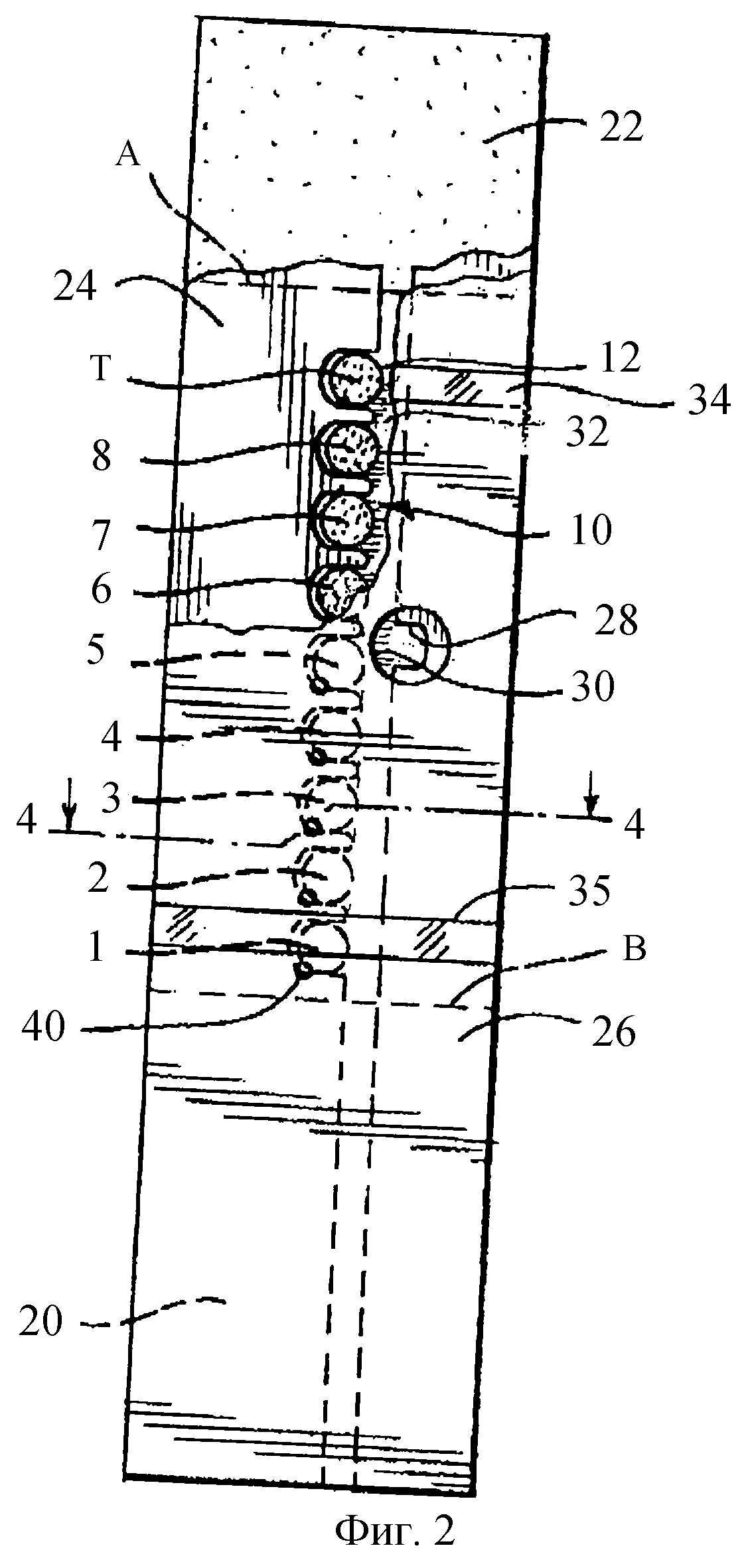
На фиг.2 представлен вид снизу с частичным вырезом образцовой стороны 12 и мембраны 10 и поглощающих слоев 20 и 22, покрытых промежуточным слоем 24 и нижним слоем 26. Предпочтительно, мембрана 10 и поглощающие слои 20 и 22 поддерживаются верхним слоем, который не показан. Предпочтительно, поглощающие слои расположены на концах мембраны (за пунктирными линиями А и В) для поглощения образца крови, который превышает объем, необходимый для измерения. Этот объем должен быть достаточным для подачи образца к каждой из аналитических областей и, если она имеется, также к области таймера. Вообще, для полоски, имеющей немного аналитических областей, не требуется образец большого объема, но она обеспечивает меньший диапазон измеряемых величин глюкозы и/или меньшую точность. На фиг.2 показано 9 впитывающих областей, представляющих 8 аналитических областей (занумерованных 1-8) и таймер (Т), которые обеспечивают адекватные диапазон и точность, в то же время не требуя неприемлемо большого объема образца. В промежуточном слое 24 имеется прорезь 28, выравненная с образцовым отверстием 30 в нижнем слое 26. Образец вводится через образцовое отверстие 30 и направляется за счет капиллярного действия вдоль центрального канала 32, промежуточного слоя 24 к каждой из аналитических областей и области таймера, причем любой избыток образца поглощается в поглощающих слоях 20 и 22. Появление в поле зрения образца через произвольные прозрачные окошки 34 и 35 подтверждает, что был обеспечен образец достаточного объема для измерения. Предпочтительно, промежуточный слой 24 формирует уплотнение с образцовой стороной 12 мембраны, так что образец не может, например, течь непосредственно между соседними аналитическими областями.
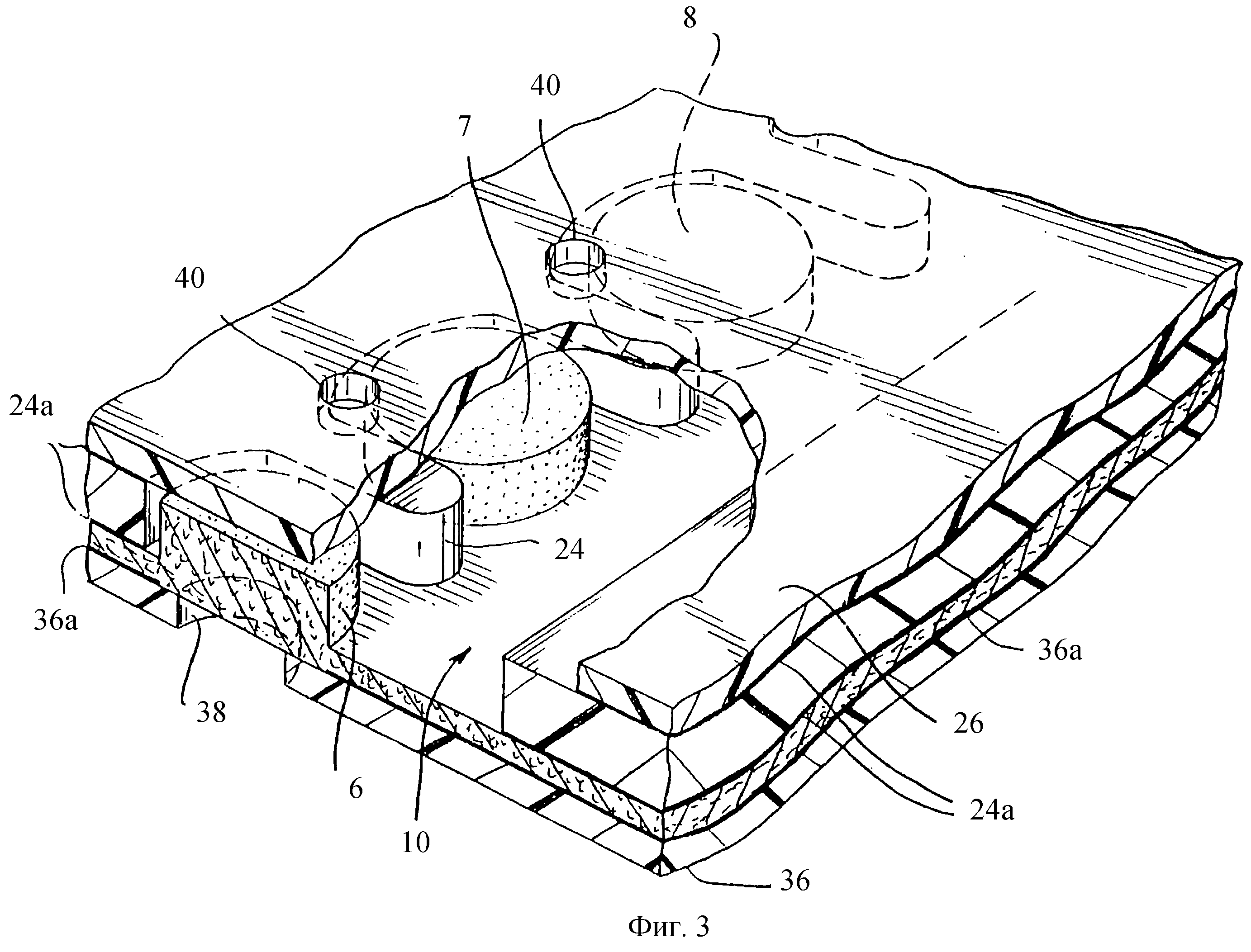
На фиг.3 показан фрагментарный перспективный вид в увеличенном масштабе, изображающий части трех аналитических областей 6, 7 и 8, видимых через нижний слой 26 и разделенных пальцами промежуточного слоя 24. Произвольные клеящие слои 24а соединяют промежуточный слой 24 с нижним слоем 26 и мембраной 10. Входные отверстия 40 в слое 26 облегчают протекание образца в полоску. Отверстия, такие как 38, в верхнем слое 36 выравнены с впитывающими областями, делая видимым любое изменение цвета во впитывающей области и также обеспечивая доступ кислорода, необходимого для прохождения реакции, изменяющей цвет. Произвольный клеящий слой 36а соединяет верхний слой 36 с испытательной стороной мембраны 10.
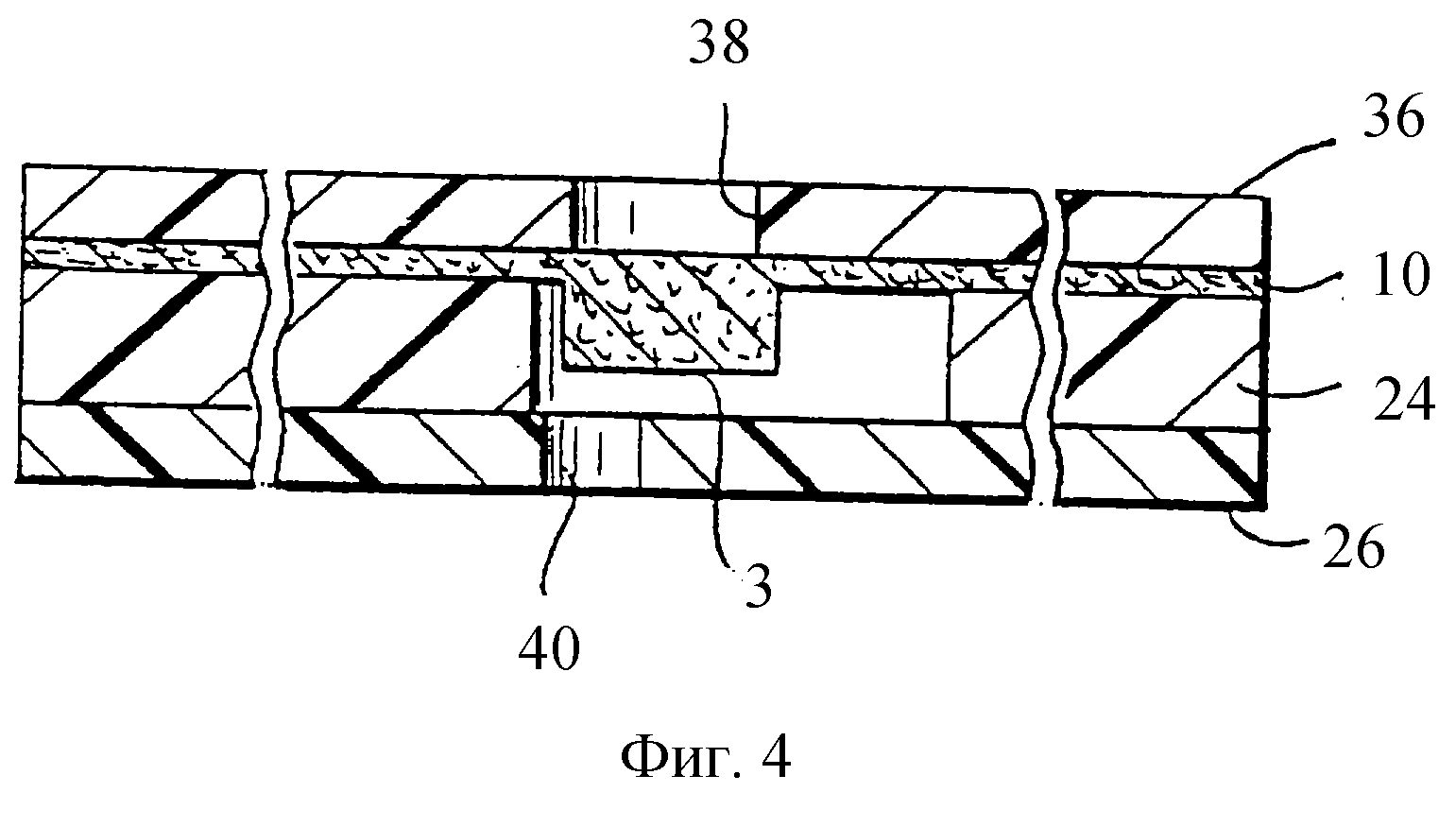
На фиг. 4 показано сечение по линии 4-4 фиг.2, которое иллюстрирует верхний слой 36 в дополнение к слоям, показанным на фиг.2. Входные отверстия в нижнем слое 26, такие как 40, выравнены с аналитическими областями и областью таймера и облегчают заполнение образцом объема, окружающего каждую из этих областей. Объемы, которые должны заполняться, ограничены мембраной 10, промежуточным слоем 24 и нижним слоем 26. Следует заметить, что колонкообразная аналитическая область 3 простирается к нижнему слою 26, и минимальный зазор между аналитической областью и нижним слоем составляет обычно только около 12 мкм. Для ясности зазор показан в увеличенном масштабе.
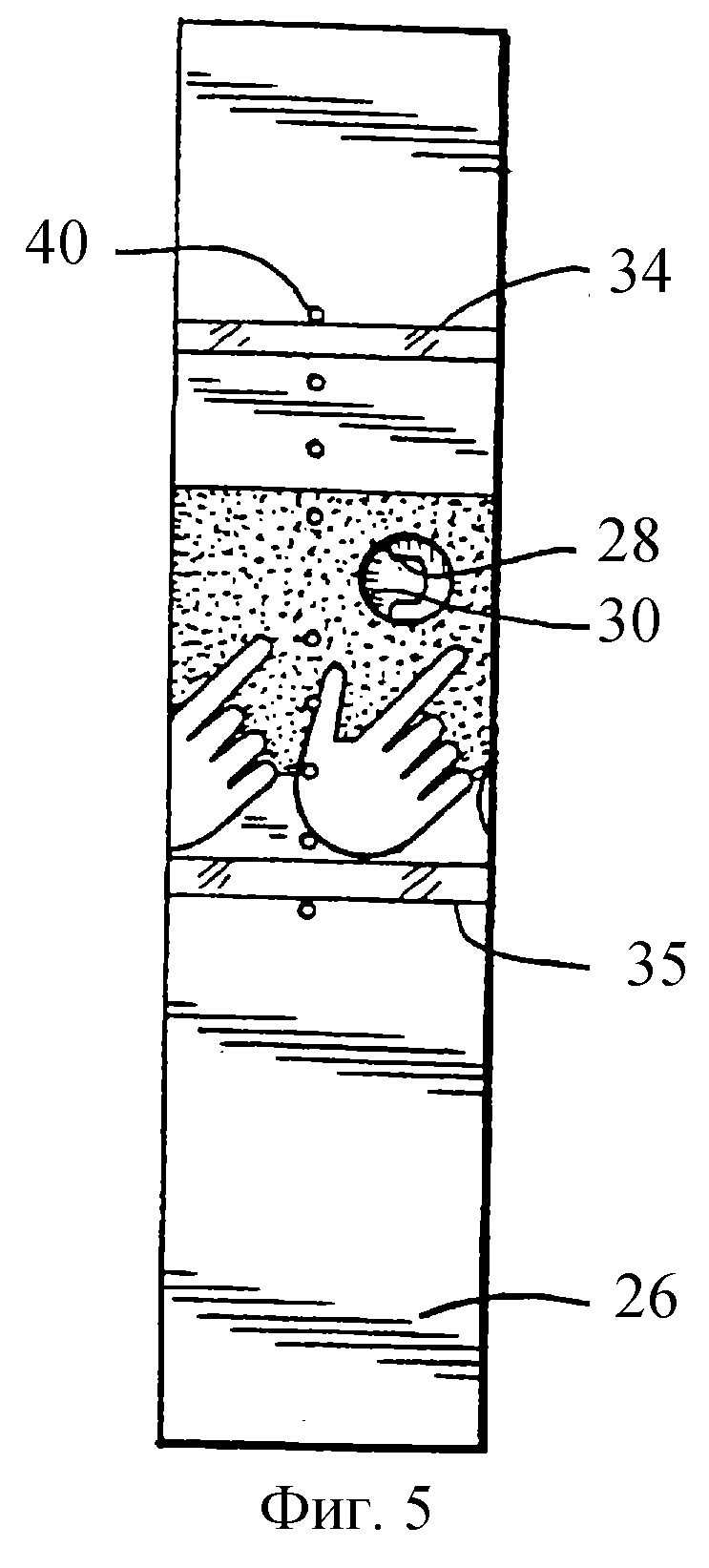
На фиг.5 представлен вид снизу полоски в соответствии с настоящим изобретением, показывающий образцовое отверстие 30 и графические изображения, которые направляют пользователя для введения образца через это отверстие. Когда образец виден через прозрачные окошки 34 и 35, это подтверждает, что соответствующий образец был приложен к полоске.
На фиг. 6 показан вид сверху верхнего слоя 36 полоски, которая была откалибрована для связывания аналитических областей с концентрацией глюкозы.
На фиг. 7 показана полоска, представленная на фиг.6 после прикладывания образца крови к отверстию 30 (фиг.2), при этом образец растекся вдоль центрального канал 32 и глюкоза в образце прореагировала с реагентом в аналитических областях. Так как нижняя аналитическая область имеет наименьшее количество ингибитора, эта область будет иметь измененный цвет первой. После этого изменили цвет вторая и затем третья области. Верхние кружки не изменили цвет, так как в образце было слишком мало глюкозы. Так как прошло достаточно времени для того, чтобы область таймера 42 изменила цвет, полоска может быть считана. Таким образом, результат, изображенный на фиг.7, указывает, что концентрация глюкозы в образце составляет, по крайней мере, 120 мг/дл, но меньше 150 мг/дл. Считывание может произведено в любое время после изменения цвета области таймера 42. Следует заметить, что на фиг.7 изменение цвета, вызванное реакцией с глюкозой, происходит от белого до окрашенного. Однако, альтернативно, система могла бы работать с индикаторным красителем, который разрушается путем вводимого глюкозой окисления с соответствующим изменением цвета с окрашенного до белого.
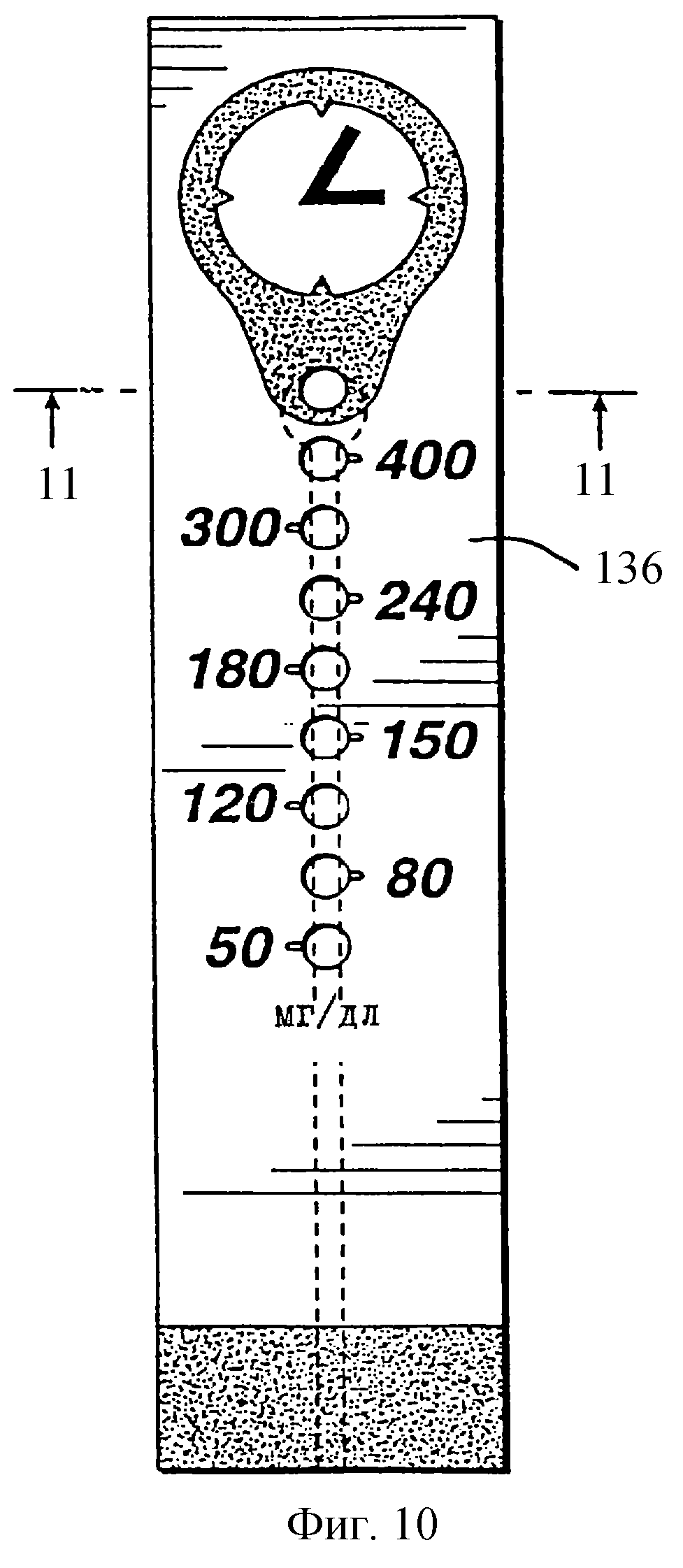
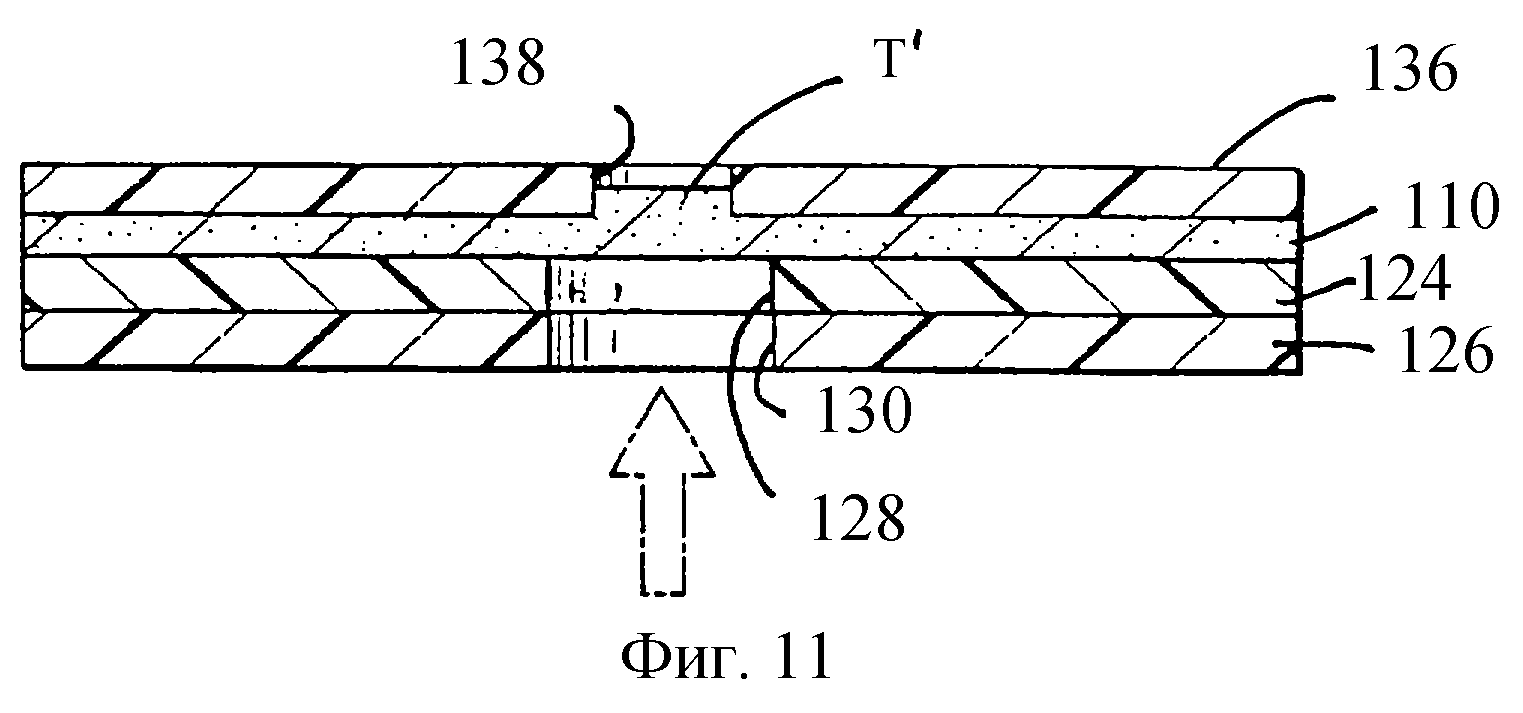
На фиг.8 показан перспективный вид с вырезом другого воплощения предлагаемой полоски. Нижний слой 126 имеет образцовое отверстие 130 для введения образца крови. В отличие от воплощения, показанного на фиг.2, где образцовое отверстие 30 расположено около середины (по отношению ко всей длине) полоски, предпочтительно, образцовое отверстие 130 расположено около конца полоски, который имеет аналитические области для указания высокой концентрации глюкозы, а также произвольный таймер. Расположение образцового отверстия в этом конце дает два преимущества. Во-первых, время, необходимое для измерения содержания глюкозы, уменьшается за счет уменьшенного времени, необходимого для того, чтобы кровь достигла "высокоглюкозных" аналитических областей (которые для ответа требуют наибольшее время). Во-вторых, изменчивость таймера уменьшается, так как образец, по существу, прикладывается к таймеру, устраняя изменчивость во времени для достижения кровью таймера. Промежуточный слой 124 имеет удлиненную прорезь 132, простирающуюся вдоль длины полоски от выреза, который обычно соответствует и находится в выравненной положении с образцовым отверстием 130. Прорезь пускает по каналу образец крови вдоль длины полоски поверх мембраны 110, к поглощающему слою 120. При прохождении образца поверх мембраны 110 часть его осаждается в таймере Т' и в каждой из восьми аналитических областей (обозначенных позициями 101-108). Область таймера и аналитические области наблюдаются через соответствующие отверстия в верхнем слое 136, которые выравнены с ними. Появление крови через прозрачное окошко 135 служит доказательством подачи для измерения достаточного объема образца.
На фиг. 9 показан вид снизу полоски, представленной на фиг.8, в котором были устранены графические изображения (такие, как изображены на фиг.5), которые направляют пользователя для введения образца через отверстие 130 в нижний слой (и выравненное отверстие 128 в промежуточном слое).
На фиг. 10 представлен вид сверху верхнего слоя 136, который показывает графические изображения таймера, а также и калибровку аналитических областей.
На фиг. 11 представлено поперечное сечение по линии 11 фиг.10, которое показывает верхний слой 136, мембрану 110, промежуточный слой 124 и нижний слой 126. Стрелкой показано направление введения образца в отверстие 130 в нижнем слое 126, и выравненное отверстие 128 в промежуточном слое 124. Следует заметить, что колонкообразная область таймера Т' простирается вверх к и, предпочтительно, в соответствующее отверстие 138, выравненное с таймером Т' и являющееся одним из 9 отверстий в верхнем слое 136, которые выравнены с соответствующей областью таймера и аналитическими областями.
Для лучшего понимания настоящего изобретения следующие примеры дополнительно иллюстрируют воплощения изобретения. Примеры не предназначены для внесения какого-либо ограничения.
ПРИМЕР 1 - BPR ИНДИКАТОР
Был приготовлен следующий раствор:
Дистиллированной воды - 83,5 г
1 вес.% ЕДТА a2 - 23,8 г
Аконитовая кислота - 6,0 г
NaOH (в твердом виде) - 2,2 г
Crotein SPA - 4,2 г
Имидазол - 0,6 г
Маннит - 3,0 г
5 вес.% Surfactol Q1 - 3,0 г
Регулировка рН - До 4,80
Этиловый спирт - 40,0 г
PPG-410 - 5,6 г
Раствор фермента - 28,0 г
Раствор фермента:
0,2 моля аконитовой кислоты - 97,0 г
Глюкооксидаза - 165000 ед
HRPO - 34000 ед
На мембрану Memtec BTSH 55 было нанесено покрытие погружением в этот раствор, и избыток его удалялся стеклянными палочками. Покрытая
мембрана была высушена в флотационной сушилке при температуре 77,8oС в условиях умеренного воздушного потока, так что полотно было высушено практически за 20 с. Полотно было намотано при
подготовке ко второму покрытию, описанному ниже.
Были приготовлены растворы, приведенные в таблице.
Были сделаны следующие разбавления основного раствора: 0,0405:1; 0, 108: 1; 0,236: 1; 0,369:1; 0,569:1; 1,260:1. Это постепенное увеличение концентрации ингибитора соответствует постепенному повышению концентрации глюкозы, на которое указывают аналитические области. Эти растворы, вместе с раствором таймера, были бок о бок нанесены на сторону с большими порами нагруженной ферментом мембраны с тем, чтобы осаждалось приблизительно 1,2•10-4 мл на 1 мм2 мембраны. Мембрана была влажной примерно 15 с перед помещением ее в условия сушки, как описано выше для этапа нанесения фермента. Результаты показали время реагирования таймера в течение 70 с, причем около 95% результатов показали время реагирования в пределах 64-79 с.
ПРИМЕР 2 - MBTH SB-ANS ИНДИКАТОР
Был приготовлен следующий раствор:
HPLC
вода - 1500 мл
Лимонная кислота - 16,92 г
Лимоннокислый натрий - 20,88 г
Маннит - 15 г
Двунатриевый ЕДТА - 1,26 г
Gantrez S95 - 6,75 г
Crotein SPA
- 36 г
Глюкозоксидаза - 1,69 мольн. ед.
HRPO - 1,5 мольн. ед.
Carbopol 910х - 75 мл
Двунатриевый цитратxx - 225 мл
х 11% раствор в ацетонитриле
хх 0,1 моля, рН 5,0
На мембрану Memtec BTS 35 наносилось покрытие в желобе, так что поверхность с большими порами входила в контакт с
покрывающим раствором; как и раньше, избыточный раствор был удален с помощью стеклянных палочек. Мембрана была высушена и намотана, как в примере 1.
Были приготовлены следующие
растворы:
Раствор А (индикатор)
70% (по объему) этанол - 2819 мл
MBTH SB - 2,98 г
(NH4) ANS - 25,83 г
Раствор В - 205 мл
2% ДТРА - 51,
25 мл
Раствор В (смачиватель)
MaphosR 60A - 41 г
70% (по объему) этанол - 205 мл
Раствор С (основной раствор аскорбата)
Вода - 115 мл
Аскорбиновая кислота - 4,58 г
Этанол - 2,67 мл
Раствор Д (таймер)
Вода - 53 мл
Аскорбиновая кислота - 8,75 г
Этанол - 123 мл
Приведенный объем
- До 175 мл с 70% EtОH
Раствор глюкозы - 40,5 мл
Для каждого раствора ингибитора объем раствора А был одинаковым, равным 263 мм. Для различных аналитических областей соотношение 70%
EtOH:раствор С изменялось от 58,9 до 0,200, так что объем из 70% EtOH + раствора С, добавленного к раствору А, составлял 87,5 мл для всех растворов ингибитора. Это эффективно изменяло только
концентрацию ингибитора в каждом растворе. Растворы, содержащие постепенно увеличивающуюся концентрацию ингибитора и раствор таймера (раствор Д), были нанесены бок о бок на сторону мембраны с большими
порами. Скорость осаждения была отрегулирована для достижения расхода ~ 8•10-5 мл ингибитора на мм2 поверхности мембраны. Мембрана была высушена, как описано выше за
исключением того, что задержка между нанесением покрытия и сушкой составляла около 1,6 мин. Результаты показали время реагирования таймера около 60 с с незначительным эффектом от гематокрита крови в
пределах 30-55% или концентрации глюкозы в пределах 78-420 мг/дл.
Специалистам в данной области техники должно быть понятно, что вышеприведенное описание и примеры являются иллюстрацией практического использования настоящего изобретения, но никоим образом не являются ограничением. Могут быть сделаны изменения в пределах объема и сущности настоящего изобретения.
Реферат
Изобретение относится к области медицины, в частности к лабораторным методам исследования. Заявленные многослойная испытательная тест-полоска и способ измерения позволяют более точно определять концентрации аналита. Удлиненная многослойная индикаторная тест-полоска для измерения концентрации аналита в образце биологической жидкости, прикладываемом к полоске, содержит нижний слой со сквозным отверстием для приема образца, мембранный слой, имеющий образцовую сторону, обращенную к нижнему слою, и испытательную сторону, противоположную ей и имеющую расположенные вдоль ее длины множество дискретных впитывающих аналитических областей, разделенных невпитывающей областью, причем мембрана содержит реагент, который может вступать в реакцию с аналитом для получения изменения цвета, при этом реагент содержит первую компоненту, взаимодействующую с аналитом для получения перекиси водорода, вторую компоненту для обнаружения перекиси водорода и третью компоненту для торможения второй компоненты, промежуточный слой между нижним и мембранным слоями, и измерительное средство для распределения образца вдоль полоски от образцового отверстия к аналитическим областям, содержащее канал транспортировки жидкости, сформированный в промежуточном слое, для направления образца поверх мембранной поверхности к впитывающим аналитическим областям, причем полоска разделена на части вдоль своей длины таким образом, что соседние сегменты мембраны имеют различные концентрации ингибитора, а именно каждый последующий сегмент имеет постепенно возрастающее количество ингибитора по сравнению с предыдущим в зависимости от расстояния от первого конца полоски, тем самым одна или более аналитических областей способны изменять цвет при прикладывании образца к полоске, и изменяющая цвет область, наиболее удаленная от первого конца, указывает концентрацию аналита в образце. В способе же измерения концентрации аналита в образце биологической жидкости прикладывают образец к заявленной удлиненной многослойной индикаторной тест-полоске. 2 с. и 29 з.п. ф-лы, 11 ил., 1 табл.

Комментарии