Оптический биосенсор необратимых ингибиторов холинэстеразы в воздухе - RU2654294C2
Код документа: RU2654294C2
Чертежи
Описание
Настоящее изобретение относится к области техники, предназначенной для контроля загрязнений окружающей воздушной среды фосфорорганическими ингибиторами (ФОИ) холинэстеразы, в частности, фосфорорганическими инсектицидами.
За последние годы во многих продуктах питания обнаружено превышение допустимых норм содержания инсектицидов в ряде европейских стран. Согласно статистическим данным, отравления токсичными фосфорорганическими соединениями - одна из серьезных проблем здравоохранения, являющаяся причиной ежегодной смерти в мире более 200000 человек (Masson P., Rochu D. Acta Nature. 2009. №1. P. 68). Приведенные данные послужили основанием для принятия Евросоюзом решения ограничить производство инсектицидов. Кроме того, существует вероятность реальной угрозы применения фосфорорганических отравляющих веществ (ФОВ) в террористических целях.
Высокая токсичность и кумулятивное действие многих ФОИ холинэстеразы (ХЭ) обусловливают высокие требования по чувствительности, а также к скорости формирования аналитического сигнала к техническим средствам (ТС), предназначенным для мониторинга окружающей воздушной среды на их наличие ФОИ). Так, санитарные требования к содержанию фосфорорганических отравляющих веществ (ФОВ) в атмосферном воздухе населенных пунктов составляют 10-8-10-7 мг/м3.
Технические характеристики известных к настоящему времени газосигнализаторов, предназначенных для мониторинга атмосферного воздуха на содержание фосфорорганических ингибиторов (ФОИ), не в полной мере соответствуют современным требованиям по оптимальному соотношению параметров «чувствительность - время формирования аналитического сигнала», поскольку работают в циклическом режиме. Так, например, время выдачи сигнала при настройке на определение низких концентраций ФОВ с использованием ГСА-14 предусмотрено за 2 минуты 40 с.
Следовательно, создание технического средства (ТС), соответствующего современным требованиям по мониторингу содержания ФОИ в атмосферном воздухе и своевременному оповещению населения, остается актуальной задачей.
В полевых условиях целесообразно использование для определения ФОИ наиболее простых по устройству и удобных в эксплуатации аналитических ТС типа биосенсор - устройства, состоящего из активного компонента и преобразователя аналитического сигнала в регистрируемый сигнал (световой, звуковой и т.п.).
Преимущественное использование в чрезвычайных ситуациях ТС для определения ФОИ на основе биохимического метода (БХМ) связано с его более высокой чувствительностью по сравнению с ТС, основанными на физико-химических методах. Следует отметить, что все ингибиторы холинэстеразы токсичны для человека. Важно также, что БХМ учитывает возможное проявление ФОИ потенцирующего синергизма при наличии в анализируемой пробе или воздухе ксенобиотиков.
Оптические биосенсоры (ОБС), разработанные на основе флуоресцентного метода регистрации аналитического сигнала, можно отнести к числу наиболее чувствительных и быстродействующих. Современные достижения в области оптоэлектроники позволяют с высокой чувствительностью регистрировать интенсивность флуоресценции и упростить само устройство биосенсора. Наибольшей чувствительностью к ФОИ отличаются ОБС на основе ХЭ с флуоресцентной меткой. Преимущество в простоте конструкции и эксплуатации имеют ОБС с бессубстратной аналитической системой.
Заявляемое изобретение направлено на создание оптического бессубстратного биосенсора для мониторинга окружающей воздушной среды на наличие необратимых ингибиторов ХЭ, характеризующегося высокой чувствительностью и специфичностью, на основе модификации данного фермента флуоресцентной меткой.
Известен ряд биосенсоров аналогичного назначения.
Биосенсором - аналогом заявляемого изобретения является бессубстратный ОБС для мониторинга содержания ФОВ в воздухе, основанный на образовании не флуоресцирующего комплекса ацетилхолинэстеразы (АХЭ) с обратимым ингибитором - флуорофором N-метилакридином (Гайнуллина Э.Т., Еремин С.А., Рыбальченко И.В., Рыжиков С.Б., Таранченко В.Ф. Патент №2165458 РФ. Б.и., 2001, №4). При воздействии ФОИ на такой не флуоресцирующий комплекс АХЭ с флуорофором, например, диизопропилфторфосфата, интенсивность флуоресценции активного компонента увеличивается. Наблюдаемый эффект обусловлен ингибированием АХЭ, что ведет к смещению равновесия в реакционной системе в сторону диссоциации комплекса АХЭ-флуорофор, увеличению концентрации свободного обратимого ингибитора - флуорофора, и, как следствие, к увеличению интенсивности флуоресценции активного компонента. Однако обсуждаемый ОБС не отвечает современным требованиям по соотношению параметров «чувствительность - время формирования аналитического сигнала».
К биосенсорам - аналогам заявляемого изобретения следует отнести и универсальный бессубстратный ОБС, предназначенный для определения ФОИ в атмосферном воздухе (Bauer D. Patent №7449299 USA. Б.и., 2008, №7). В модификации ОБС на основе того же активного компонента предусмотрено устройство для контакта с образцом, который может содержать ФОИ.
Активный компонент данного ОБС содержит модифицированную АХЭ и включает: 1) флуорофор-донор, содержащий наночастичку со скрытой квантовой точкой, 2) АХЭ, 3) акцепторный флуорофор. Донорный и акцепторный флуорофоры связаны с АХЭ, среднее расстояние между донором и акцептором составляет ~600 нм.. Флуорофор-донор со скрытой квантовой точкой включает CdS и CdSe, а акцепторный флуорофор является производным флуоресцеина. При этом акцепторный флуорофор способен к поглощению излучения флуорофора-донора. Модифицированная по такой технологии АХЭ включена в гидрогель желатина. Технический результат данным ОБС обеспечивается мониторингом изменения структуры активного центра фермента при воздействии ФОИ путем регистрации безызлучательного резонансного переноса энергии флуоресценции донора к акцептору. Однако изменения в структуре активного центра фермента при воздействии ФОИ незначительные, что не позволяет достигнуть высокой чувствительности. Расстояние между донором и акцептором в модифицированной АХЭ активного компонента данного ОБС составляет ~200-1000 нм, что значительно больше радиуса Ферстера (200-500 нм). Предложенная модификация АХЭ не способствует достижению высокой чувствительности. Кроме того, технология изготовления активного ОБС весьма сложна.
Наиболее близким аналогом (прототипом) является ОБС на основе комплекса АХЭ с обратимым ингибитором - флуорогеном тиофлавином T (ТФ). (Антохин A.M., Андреев О.И., Гайнуллина Э.Т. Патент №2386120 РФ. Б.и., 2010, №4). ТФ одновременно является активатором фосфорилирования активного центра холинэстеразы (активатором) (Radio Z, Taylor P. Chemico-biological interac. 1999. №119-120. P. 111).
Выбор ТФ для разработки данного ОБС определялся высокой интенсивностью флуоресценции его комплекса с АХЭ эритроцитов человека, в сотни раз превосходящей интенсивность флуоресценции исходного ТФ на длине волны λ~490 нм при возбуждении излучением с λ=448 нм (Антохин A.M., Гайнуллина Э.Т., Рыжиков С.Б., Таранченко В.Ф., Яваева Д.К. Бюл. эксперим. биол. и мед. 2009. Т. 147. С. 119).
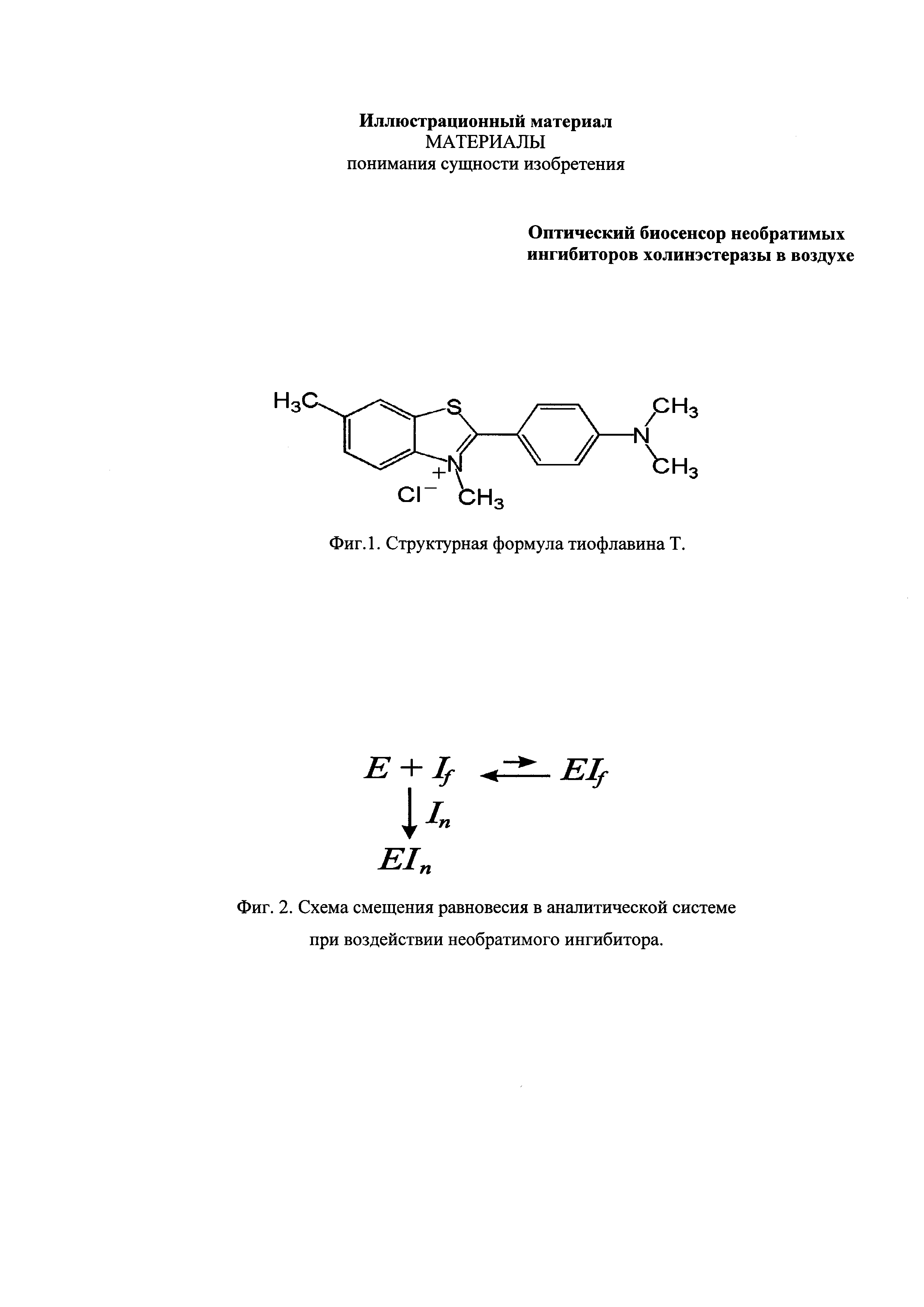
Структурная формула ТФ представлена на фиг. 1.
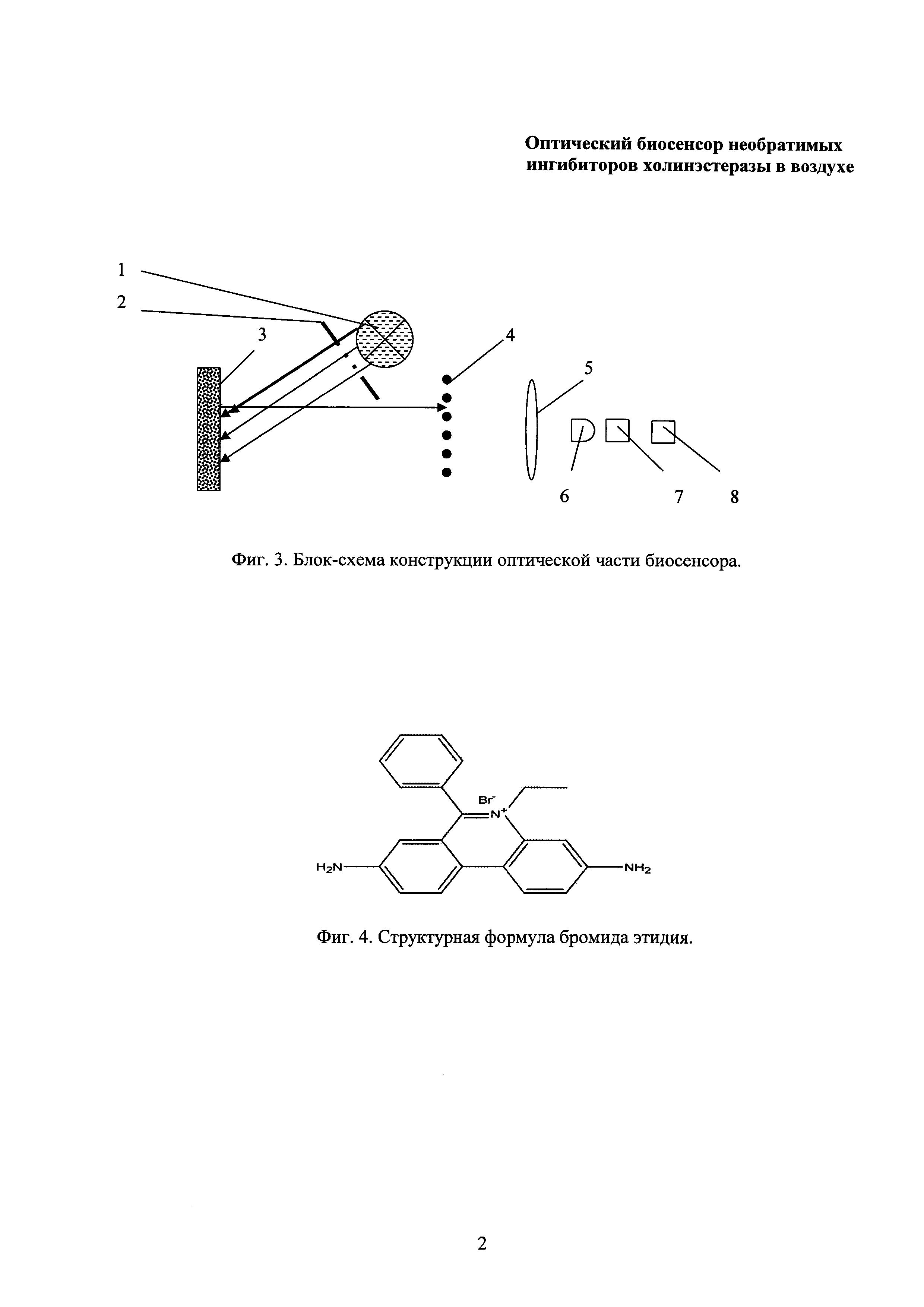
Технический результат данным ОБС основан на смещении равновесия в аналитической системе при воздействии необратимого ингибитора In на ацетилхолинэстеразу E в сторону образования фермент-ингибиторного комплекса EIn, что, в свою очередь, приводит к диссоциации флуоресцирующего комплекса EIf и снижению интенсивности флуоресценции активного компонента ОБС, как это представлено на фиг. 2, где: Е - АХЭ, If - флуороген-активатор, In - необратимый ингибитор.
Интенсивность флуоресценции ОБС - прототипа при воздействии инсектицидов (~50 нМ) диэтил(3,5,6-трихлорпиридин-2-ил)фосфата или дихлофоса снижается на 50% относительно исходной интенсивности флуоресценции ОБС. ОБС характеризуется высокой скоростью формирования аналитического сигнала за 10-15 с.
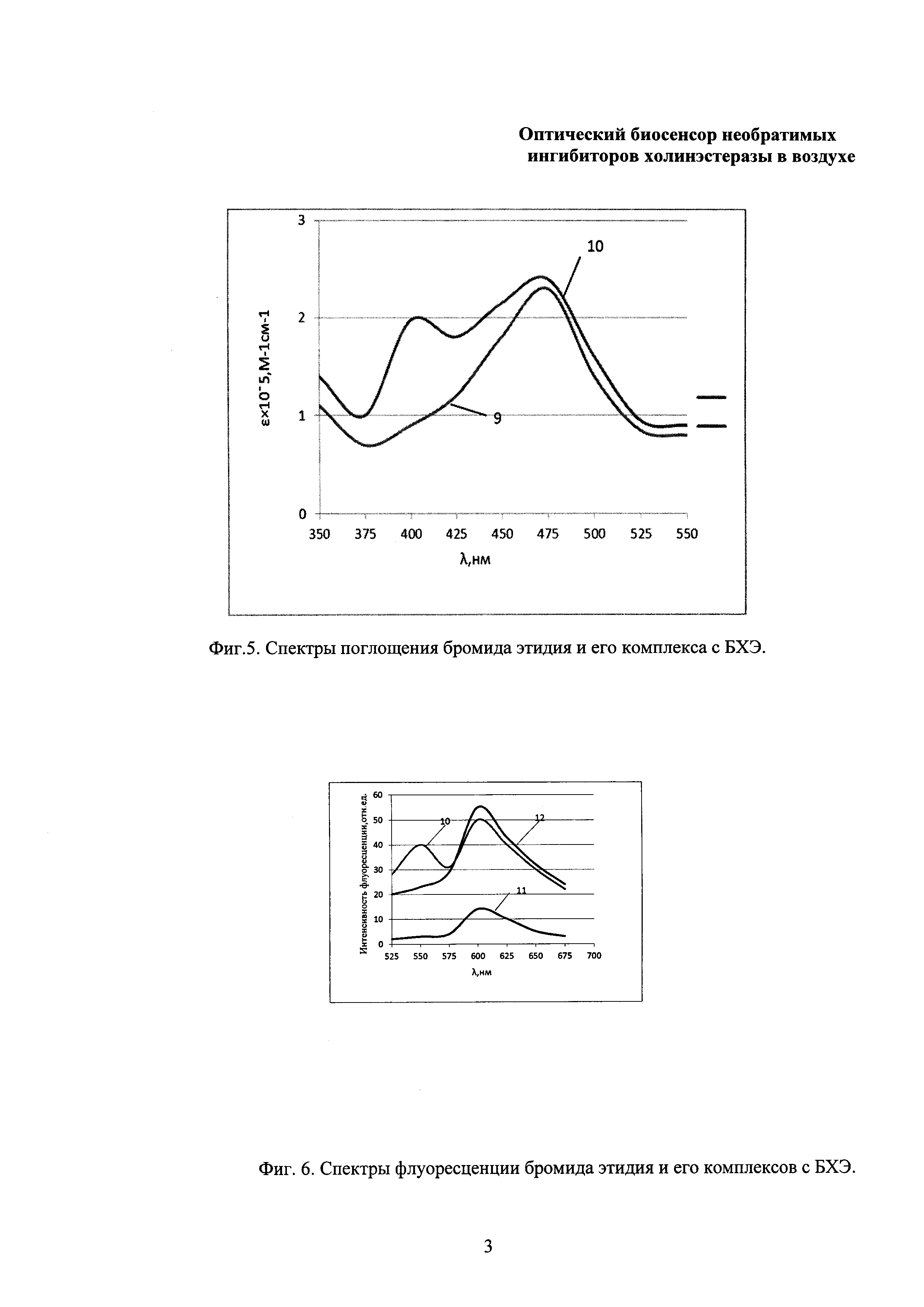
Конструкция оптической части ОБС представлена на фиг. 3 в виде блок-схемы, на которой: 1 - лазерный источник света, 2 - модулятор, 3 - активный компонент, 4 - фильтр, 5 - линза, 6 - фотоприемник, 7 - синхронный усилитель, 8 - регистрирующее устройство.
Наличие в оптической части ОБС лазерного источника света для возбуждения активного компонента, модулятора и синхронного усилителя позволяет увеличить чувствительность ОБС в целом.
Приведенные данные позволяют прогнозировать высокую чувствительность ОБС к ФОИ на основе обратимого ингибитора флуорогена - активатора, образующего с ХЭ флуоресцирующий комплекс с высоким квантовым выходом, а также высокую скорость формирования аналитического сигнала, учитывая огромную скорость образования комплекса фермента с необратимым ингибитором.
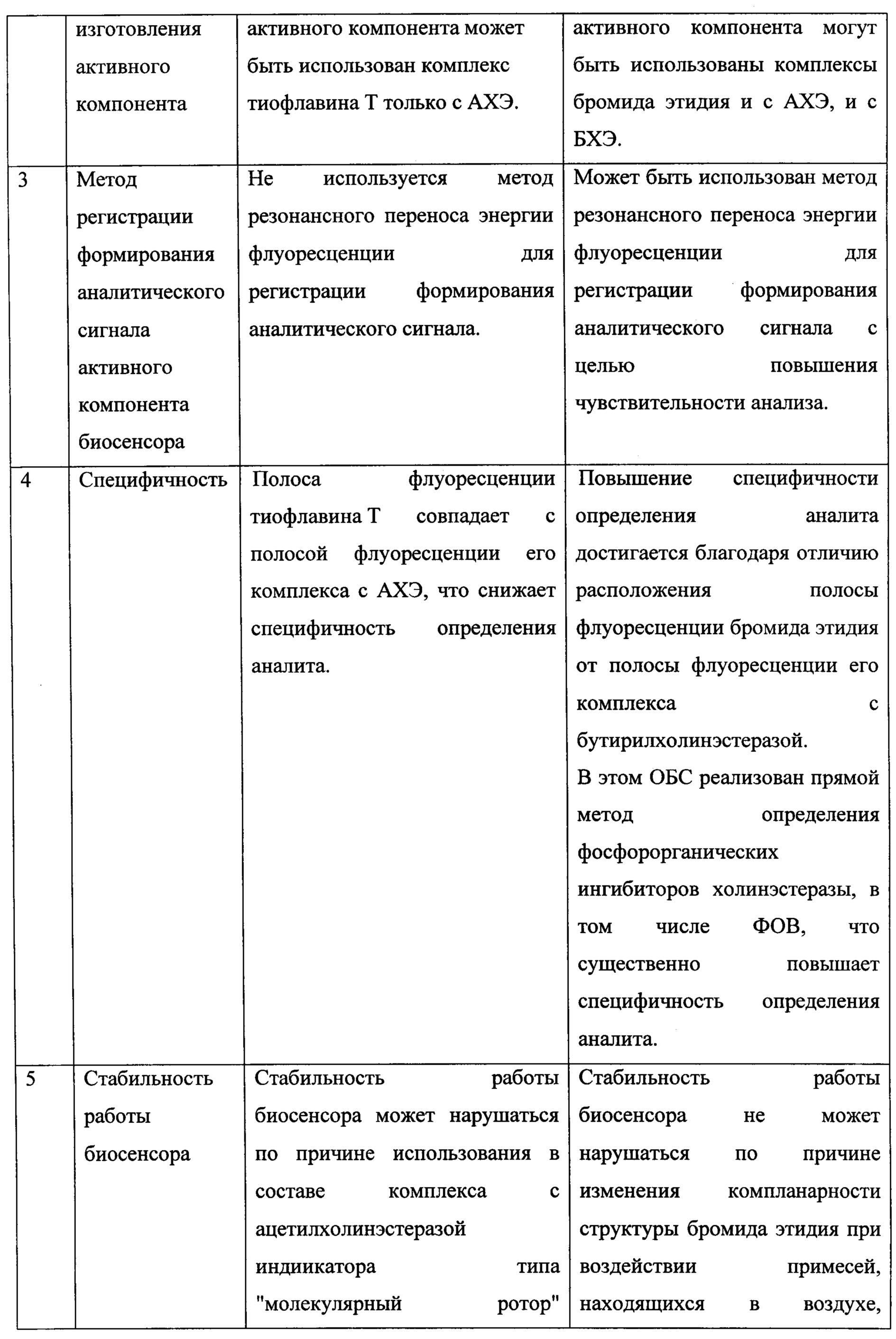
Недостатком данного ОБС является невысокая стабильность его работы при наличии в окружающей воздушной среде различных примесей, что обусловлено вхождением в состав аналитического реагента комплекса АХЭ с флуорогеном ТФ. ТФ относится к группе индикаторов типа "молекулярный ротор", на компланарность его структуры, а, следовательно, на интенсивность его флуоресценции влияет целый ряд факторов (температура, наличие в окружающем воздухе кислых и основных паров и других примесей). ТФ образует флуоресцирующие комплексы только с АХЭ.
Важно отметить: полоса флуоресценции ТФ и его комплекса с АХЭ совпадают (λ=490 нм), что снижает специфичность анализа.
Предлагаемое решение авторами заявляемого изобретения направлено на увеличение специфичности и чувствительности ОБС - прототипа к необратимым ингибиторам ХЭ, а также стабильности работы во времени. Технический результат достигается путем использования авторами в качестве аналитического реагента активного компонента ОБС комплекса бутирилхолинэстеразы (БХЭ) с обратимым ингибитором-флурогеном 3,8-диамино-5-этил-6-фенилфенантридиум бромидом (бромидом этидия), являющимся одновременно активатором фосфорилирования холинэстеразы. Формула бромида этидия представлена на фиг. 4.
Бромид этидия имеет ряд преимуществ, по сравнению с известными флуорогенами, образующими флуоресцирующие комплексы с ХЭ:
1) его полоса флуоресценции находится в красной области спектра (λмакс ~610 нм при возбуждении излучением с λ=470 нм), удаленной от полос флуоресценции триптофана и других ароматических аминокислот, что вносит вклад в повышение специфичности анализа;
2) образует интенсивно флуоресцирующие комплексы не только с АХЭ эритроцитов человека, но и с АХЭ эритроцитов быка, БХЭ человека и лошади, а также с пропионилхолинэстеразой зрительных ганглиев кальмара;
3) в составе комплекса с холинэстеразой флуоресцирует в условиях (pH, температура), оптимальных для ее ингибирования фосфорорганическими ингибиторами;
4) отсутствует концентрационное тушение флуоресценции бромида этидия и его комплексов с холинэстеразой в исследованном интервале концентраций реагентов;
5) образует с холинэстеразами комплексы, спектры поглощения (фиг. 5) и флуоресценции (фиг. 6) которых отличаются от соответствующих спектров самого бромида этидия, что обеспечивает прямой метод определения фосфорорганических ингибиторов ХЭ, в том числе ФОВ и существенно повышает специфичность анализа.
На фиг. 5 представлены спектры поглощения бромида этидия и его комплекса с БХЭ лошади: 9 - бромида этидия (7.5 мкМ), 10 - комплекса бромид этидия с БХЭ лошади (0.50 Е/мл).
Важной особенностью бромида этидия является образование с холинэстеразами комплексов, полосы флуоресценции которых отличаются от соответствующих полос самого бромида этидия (фиг. 6), что открывает перспективу использования для регистрации аналитического сигнала метода резонансного переноса энергии флуоресценции - одного из самых чувствительных методов измерения интенсивности флуоресценции (Higgins В. Chemical and biological sensor controls. The world of electronics, 2005. P. 1.
На фиг. 6 представлены спектры флуоресценции при возбуждении λ=470 нм: 11 - бромида этидия (0.6 мкмоль/л), 12 и 10 - комплексов бромида этидия с БХЭ лошади (0.36 Е/мл и 0,50 Е/мл, соответственно)
Зависимость интенсивности флуоресценции от активности БХЭ при возбуждении длиной волны
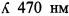
Дальнейшее повышение активности БХЭ ведет к появлению новой полосы флуоресценции на длине волны ~550 нм, соответствующей полосе флуоресценции комплекса бромида этидия с БХЭ, и постепенному снижению интенсивности флуоресценции на длине волны ~610 нм. Наблюдаемый эффект обусловлен уменьшением концентрации свободного бромида этидия по мере связывания в комплекс с БХЭ, что ведет к снижению интенсивности флуоресценции на длине волны ~610 нм и появлению новой полосы флуоресценции на длине волны 550 нм.
Зависимость интенсивности флуоресценции комплекса бромида этидия с БХЭ при λ ~550 нм по мере увеличения активности фермента (x) в исследованном интервале активности фермента (0.5-2,0. Е/мл) имеет линейный характер:
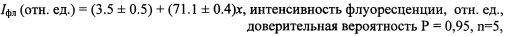
При воздействии фосфорорганического инсектицида параоксона интенсивность флуоресценции Iфл системы бромид этидия - БХЭ на длине волны 550 нм снижается в течение 10-15 с. Зависимость интенсивности флуоресценции системы бромид этидия - БХЭ от концентрации параоксона (x) в исследованном интервале концентраций носит линейный характер и может быть представлена в виде:
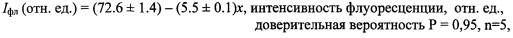
На основе приведенных выше данных авторами заявляемого изобретения разработан флуоресцентный ОБС для мониторинга окружающего воздуха на содержание необратимых ингибиторов ХЭ, характеризующийся высокой чувствительностью и быстродействием. Активный компонент ОБС представляет собой комплекс бромида этидия с БХЭ лошади, иммобилизованный золь-гель методом, размещенный на нейтральной полимерной пленке.
Технический результат предлагаемым ОБС достигается аналогично техническому результату ОБС - прототипа и также может быть представлен схемой на фиг. 2.
Исследования показали, что данный активный компонент в присутствии параоксона дает устойчивый сигнал за 10-15 с. В предлагаемым ОБС реализован прямой метод определения ФОИ, в том числе ФОВ, что существенно повышает специфичность определения.
Скорость формирования аналитического сигнала (в виде тушения флуоресценции) прямо пропорциональна концентрации необратимого ингибитора In, значению константы скорости образования фермент-ингибиторного комплекса EIn, концентрации комплекса EIf и значению его константы диссоциации.
Конструкция оптической части предлагаемого ОБС идентична конструкции оптической части ОБС - прототипа, представленной на фиг. 3 виде блок-схемы.
Пример 1. Изготовление активного компонента
Реагенты. Тетраэтоксисилан (TEOS) и бромид этидия фирмы Sigma. Бутирилхолинэстераза - фирмы «Биомед» (Россия).
Иммобилизация. Раствор геля был приготовлен перемешиванием 4,5 мл TEOS, 1,4 мл бидистиллята и 0,10 мл 0,1 М НС1 в стеклянном сосуде 5 часов до прозрачного состояния и оставлен на ночь при комнатной температуре.
Для получения активного компонента 3 мкл полученного прозрачного раствора геля и 10 мкл фосфатного буфера (pH 8) тщательно перемешивают (раствор №1). Затем 30 мкл раствора фермента в буфере (100 Е/мл) смешивают с 3 мкл раствора бромида этидия (0,02 мг/мл). Полученный таким образом раствор комплекса бромида этидия с бутирилхолинэстеразой добавляют к 3 мкл раствора №1 при очень интенсивном перемешивании. Смесь заливают в формочку диаметром 10 мм и толщиной 1 мм и оставляют на 5 дней в холодильнике при 4°C.
Пример 2. Результаты определения параоксона активным компонентом биосенсора прототипа и предлагаемого биосенсора на длине волны 610 нм.

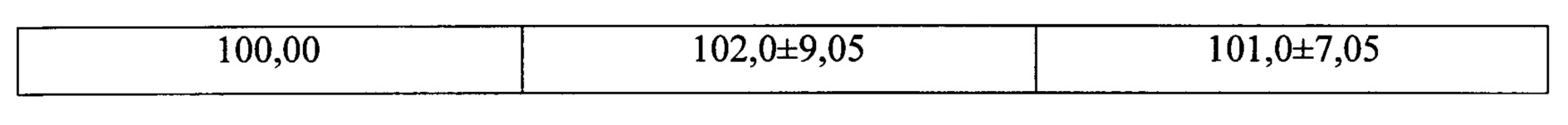
Из представленных в таблице данных следует, что чувствительность к параоксону предложенного оптического биосенсора существенно выше, чем прототипа.
Таким образом, использование в качестве активного компонента биосенсора активного компонента, состоящего из иммобилизованного флуоресцирующего комплекса бутирилхолинэстеразы с обратимым ингибитором - флуорогеном бромидом этидия позволяет сконструировать ОБС, более специфичный и чувствительный к необратимым ингибиторам холинэстеразы, по равнению с ОБС прототипом.
Авторы полагают, что успешное использование достижений в области нанотехнологий при создании уникальных конструкционных материалов, полупроводников, датчиков обнаружения химических веществ, компьютеров, производительность которых на несколько порядков выше, чем у существующих, открывает перспективу модификации предлагаемого авторами биосенсора для индивидуального назначения (Антипов В.Б., Завьялова Н.В., Ефременко Е.Н., Ковтун В.А., Носичков СП., Антипов А.Б., Завьялов В.В. Доклады академии военных наук. 2016. №4 (68). С 82-89).
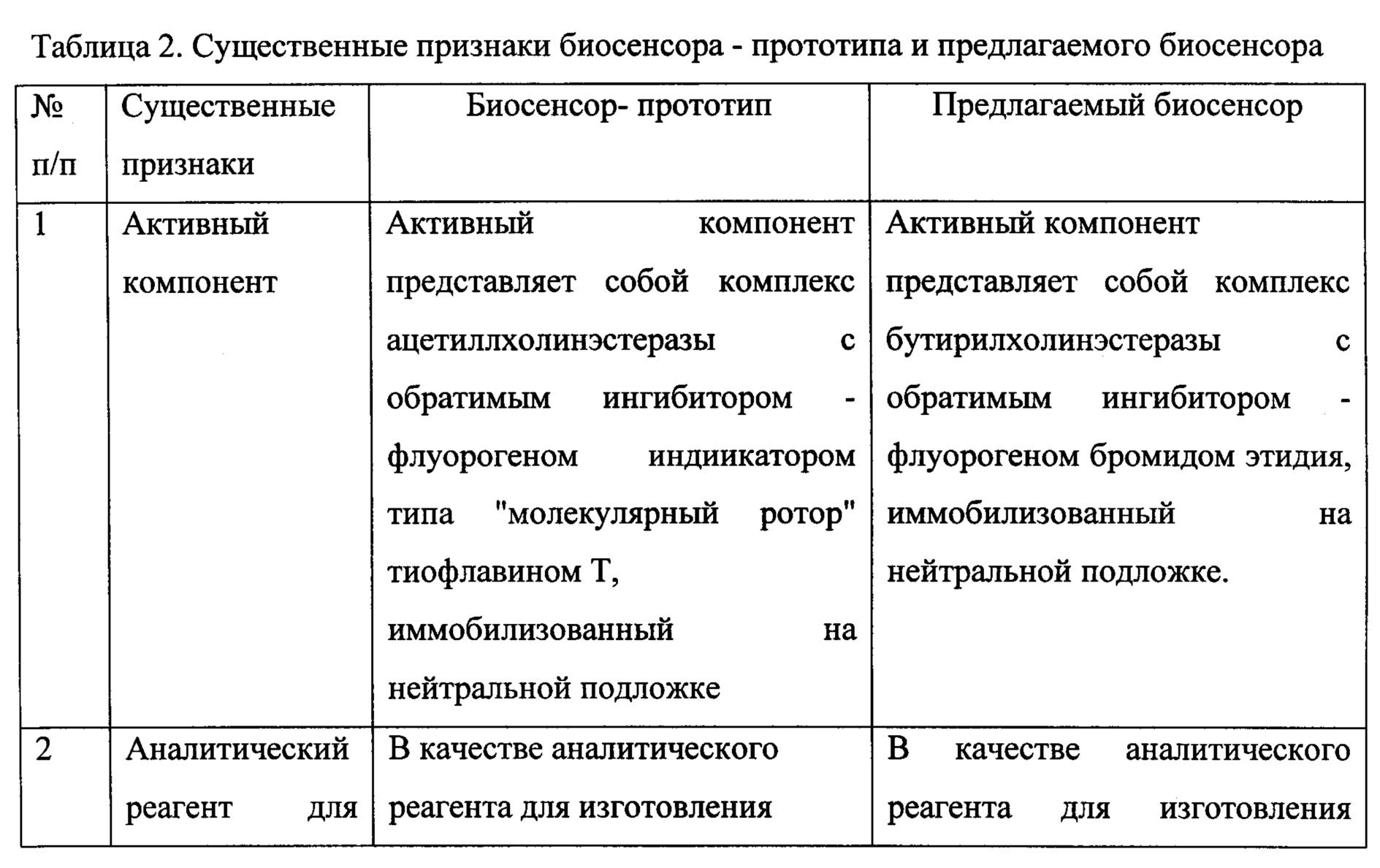
В таблице 2 сопоставлены существенные отличительные признаки ОБС прототипа и предлагаемого ОБС.

Литература
1. Антохин A.M., Гайнуллина Э.Т., Рыжиков С.Б., Таранченко В.Ф., Яваева Д.К. Бюл. эксперим. биол. и мед. 2009. Т. 147. С. 119.
2. Гайнуллина Э.Т., Еремин С.А., Рыбальченко И.В., Рыжиков С.Б., Таранченко В.Ф. Патент №2165458 РФ. Б.и., 2001, №4.
3. Антипов В.Б., Завьялова Н.В., Ефременко Е.Н., Ковтун В.А., Носичков С.П., Антипов А.Б., Завьялов В.В. Доклады академии военных наук. 2016. №4 (68). С 82-89.
4. Bauer D. Patent №7449299 USA. Б.и., 2008, №7.
5. Higgins В. Chemical and biological sensor controls. The world of electronics, 2005. P. 1.
6. Masson P., Rochu D. Acta Nature. 2009. №1. P. 68.
7. Radio Z, Taylor P. // Chemico-biological interac. 1999. №119-120. P. 111.
Реферат
Изобретение относится к контролю загрязнений окружающей воздушной среды. Оптический биосенсор в воздухе включает: оптический детектор и активный компонент, состоящий из иммобилизованного флуоресцирующего комплекса холинэстеразы с обратимым ингибитором - флуорогеном, интенсивность флуоресценции которого снижается в присутствии необратимого ингибитора с образованием аналитического сигнала - снижения интенсивности флуоресценции активного компонента биосенсора. Активный компонент оптического биосенсора состоит из комплекса холинэстеразы с обратимым ингибитором - флуорогеном бромидом этидия, иммобилизованного золь-гель методом. Технический результат заключается в увеличении чувствительности оптического биосенсора к необратимым ингибиторам холинэстеразы, а также в повышении скорости формирования аналитического сигнала. 2 з.п. ф-лы, 6 ил., 2 табл.

Комментарии