Изобретение относится к медицине, в частности к клинической химии.
Целью изобретения является повышение точности способа за счет стабилизации окраски реакционной смеси.
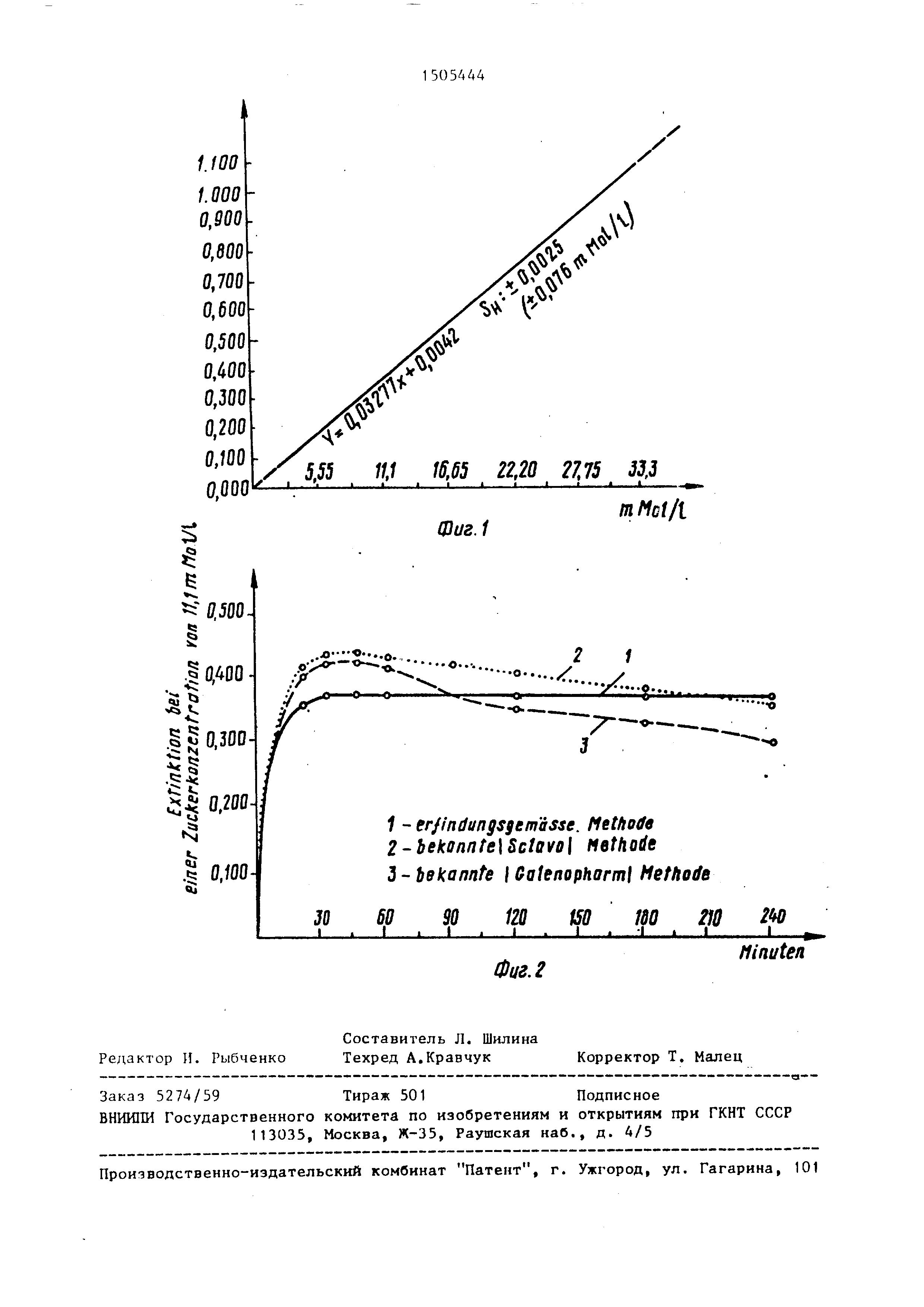
На Фиг. 1 поивепен гоабик, на ко- т.оОом показан линейньп хапактер кри-
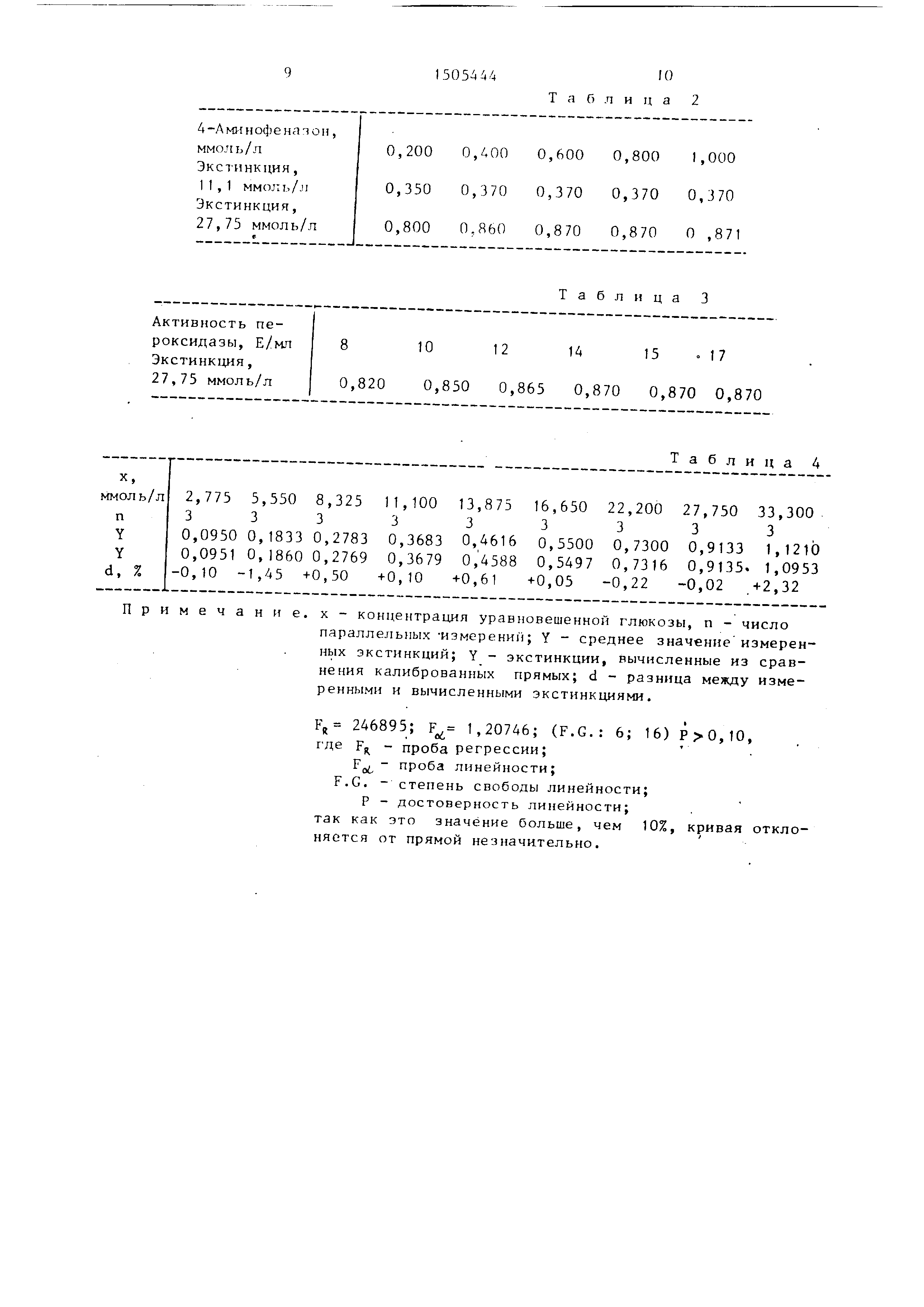
в ой пои изменении коццгнтоации глюкозы: на Лиг. 2 - крипые окоаски реакционной
смеси в соавнении с извест- нь1ми мстодаьш.
Способ осуществляют следующим об-
рязом.
Способ основан на том что, если пля обоазований кпасяшего вешества
использовать 4-аминоЛеназон и тимол, то ппи оптимальных УСЛОВИЯХ имеет
место XODOI4O реализуемая (стабильная линейная хапактеоистика, нечувстви-.
тельность к свету) фотометрическая реакция с высокой чувствительностью.
Согласно предпочтительному варианту способа тимол растворяют в низшем
спирте, предпочтительно в этаноле; другие химические вещества растворяют в дистиллированной воде, а
спиртовой и водны11 растворы смешивают друг с другом в соотношении
1:4, Полученный таким образом реактив содержит тимол в концентрации 2,5±0,2 ммоль/л.
Концентрация других химических веществ в реактиве слелующая:
сл
о
СП
4
СИ
0.08iO,02 0,8iO,2
9,85±0j 1
Фосфатный буфер,
миль/л
-Лмияофеиазои,
ммо.ль/л
Лзил натрияJ
ммпль/л
Этанол, мм(зль/л330.0+20
Тимол н 4-аминофеназол соединяют
с определяемыми субстанциями в необ- ходимых концентрациях в буферном веществе
. В результате вследствие специфических ферментативных реакций образуется перекись водорода. Из обра-,
эующейся перекиси водорода освобождается с помощью пероксидазы кислород,
который образует 4-(2 -изопролил-5 - -метил-1 ,4 -бензохи юнмоноимино)-фе-
иазон (т.е. красящее вещество).
Прс;и1агасмый способ отличается тем
что цветная реакция происходит в определенной рИ-области (рН 7,0-8,0,
предпочтительно 7,5), максимум поглэ- щоиия света полученного красящего вещества
па;1ает на волновой диапазон 465-480 им, поэтому целесообразно фо1ометрпчесмие измерения проводить
п этом диапазоне, в частности на вол- )ie 475 пм. Особенно важно, что оп-
рел,еляемый фoтoм -грически цвет об- разуется сраннителыш быстро. Установлено
, что стабильный цвет при комнатной температуре появляется в течение 25 ьс1н, а при 37 С - через
15 ми)1. Для установления оптимального значения рИ могут быть использованы
различные буфер) (трис-фосфат, - К1ЦРО , K,HPO,j - КНРО и борат натрпя - IlCi).
Растворять тимол необходимо в ме- таноле, этанате (предпочтительно) или
изопропаноле, Концентрации тимола приведепы в табл. 1.v
Очевидно, что в случае двух растворов глюкозы наивысшая, больше не возрастаю цая эксти1 кщ я (интенсив-
ность окраски) получается при концентрации тпмола 2,5 ммоль/л.
Концентрации 4-аминофеиазона нри- водятся Г табл. 2. Измерения в этом
случае также производят с раствором глюкозы и раствором тимола концент- раи.ией 2,5 ммоль/л.
Согласно даин.1м табл.2, максимальная , больше не изменяющаяся экстинк-
ция получается при концентращ 4- -аминофеназоиа 0,600 ммоль/л. Для больинм надежности в качестве опти-
малыкп принимается конценту)ация 0,800 ммо,ль/л.
KoIп eнтpaция перекиси, требуемая для измерения г.люкозы, также оптимизируется (см. табл. 3). Огггималь-
ной является концентрац11я 15 Е/мл (IS- международная единица - количество , которое заменяет 1 ммоль
субстрата в течение 1 мин). Использование пероксидаза не может содержать другие ферментные тримеси в
концентрациях, оказывающих вредное воздействие.
Из табл. 3 видно, что максимальная интенсивность (экстинкция) полу ченного с глюкозой цвета достигаетс
уже при ферментной активности 14 Е/мл; для большей надежности берется активность 15 Е/мл.
При опредзле1 ии холестерина применяется детерге)гг, чтобы повысить
рас гворимо(;ть. С этой целью может быть использован 9-лаурплэфирполи-
чеканол (Сигма, СШа), Тритон Х-100 (октилфенолполиэтиленгликольэфир,
LOBA, Австрия) или Бридж 35 (поли- оксиэтилеилаурилэфир, БЕ, Англия).
Диапазон оптимальных концентра1Д1Й вЬ1шеуказа1И1Ых веществ составляет 0,4-1,2%.
Пример 1, Определение глюки: ы в сыворотке крови.
Раствор А. В 0,1 моль/л раствора фос})атного буфера (рН 7,5; . и ) растворяют следующие
вещества:
Глюкозооксидаза,
Г:/мл 12,5
Пероксидаза, Е/мл 18,0
4-Аминофеназо11,
ммоль/л10,0
Азид натрия,
MMOJTb/л12,3
Раствор В.. 12.5 ммоль/л тимола в 96%-м этаноле (с дистиЛлирован- ной водой) .
Реактив приготовляют путем смешивания растворов А и В в соотношении 4:1.
Стандартизаг ия производится с помоьчыо 11,1 ммоль/л раствора глюко (
в насыщенпс й без нагревания бензойной кислоте).
В пробирных трубочках уравновешивают по 3,0 мл реактива, 0,02 мл стандарта и в друг-их трубочках 0,02
сыворотки крови. Вещества перемеши- пают и выдерживают при комнатной те5150
пературо 30 t-niH или при 37°С 15 мин. В последнем случае цвет, образовав-
иийся после 10-минутного охлажДення, фотометрически сранг1ивают с холостым
опытом (толи;ина кюветы 1 см, длина волны 475 нм).
Концентрация I сыворотки крови (в глюкозе, ммоль/л) рассчитывают по следующей формуле:
Экстинкция пробы
Стандартная экстинкция
11,1
Процесс характеризуется линейностью в диапазоне 0-30 ммоль/л.
.Пример 2. Для определения содержания глюкозы в сыворотке крови применяют реакционный раствор следу-
Ю1цего состава;
Фосфатный буфер
моль/л0,09
Глюкозооксидаза,
NE/л 8000
Пероксидаза,
NE/л15000
Тимол, ммоль/л2,5
4-Аминофеназон,
ммоль/л0,8
Азид натрия,
ммоль/л 12,3
Этанол, моль/л2,5
Детергент
(Brij-35), %2,5
Значение рН реакгц юнного раствоа составляет 7,5±0,2.
Смесь пробы сыворотки крови и рекционного раствора инкубируют, аос- е этого определяют концентрацию глю-
козы спектрофотометрически при длине волны 475-485 нм.
Пример 3. Дгш определения со- одержания глюкозы в спинномозговой идкости применяют реакционный растор
следующего состава:
Фосфатный буфер,
моль/л0,09
Глюкозооксидаза, NE/л
Пероксидаза,
NE/л
Азид натрия,
ммоль/л
4-Аминофеназон,
ммоль/л
Тимол, ммоль/л
Детергент
(Brij-35), %
12000
15000 12,3
0,8 2,5
2,5
10
15
20
25
30
5
0
5
0
5
6
Исследуемую пробу центрифугируют и после этого надосадочную жидкость
без разбавления смешивают с реакционным раствором (рП 7,5±0,2). Затем
концентрацию глюкозы определяют фотометрически при длине волны 475-485 нм.
Пример 4. Для определения содержания глюкозы в моче применяли реакционный раствор следующего
состава:
Фосфатный буфер, моль/л0,09
Глюкозооксидаза, NE/л12000
Пероксидаза,
NE/л15000
Тимол, ммоль/л2,5
4-Аминофеназон,
ммоль/л0,8
Азид натрия,
ммоль/л12,3
Этанол, моль/л2,5
Детергент
(Brij-35), %2,5
Значение рН реакционного раствора составляло 7,5±0,2.
Исследуемую пробу мочи рдзбавляли дистиллированной водой до 30-кратного
первоначального объема. Смесь разбавленной пробы и реакционного раствора
инкубировали и после этого определяли концентрацию глюкозы спектрофотометрически при длине волны
475-485 нм.
Пример 5. Для определения содержания глюкозы в цельной крови
применяли реакционный раствор следующего состава:j Фосфатный буфер,
моль/л 0,09 Глюкозооксидаза, NE/л 12000 Пероксидаза,
NE/л.15000
Тимол, ммоль/л2,5
4-Аминофеназон, ммоль/л0,8
Азид натрия,.
.ммоль/л12,3
Этанол, ммоль/л2,5
Детергент
(Brij-35), %2,5
Значение рН реакционного раствора
составляло 7,5tO,2.
Цельную кровь депротеинировали
известным способом при помощи раствора трихлоруксусной кислоты, затем
приготовили препарат крови в количестве , соответствующем десятикратному
количеству, указангюму в примере 1 , и смеш1вали с реакционным раствором в количестве, указанном в примере
1. Смесь инкубировали и после инкубации определяли концентрацию глюкозы спектрофотометрически при
длине волны 474-455 нм.
Определение наличия и количествен- Q для измерения других растворов, соные
измерения глюкозы производят в диапазоне концентраций 2,775- 33,300 ммапь/л. Данные частично сведены
в табл. 4 и частично представлены на фиг. 1 (в математическом выра- жении).
Из приведенных данных следует, что измерительная характеристика (в данном диапазоне) является линейной.
Цветная реакция проходит полностью и обеспечивает более точную возможность измерения глюкозы.
Предлагаемый способ сравнивают с эталонным методом, в качестве которого
служит известный метод ультра- фиолетовой пробы на гексокиназу Бё-
ринга, В качестве раствора, содержащего сахар, в этом случае используются
45 проб человеческой крови (без выбора). Из фиг. 2 видно, что между
результатами, полученными этими методами , нет никаких отличий так как коэффициент корреляции (г ,Ч971)
очень близок к теорети.ческому значению (tjO.QP) и крутизна кривой регрес- 35 м отличающийся тем,
сии отличается от теоретического значения лишь на 0,4%.
Чувствительность, воспроизводимость и погрешности метода определяются
на основании полученных результатов измерения. Такая статистическая обработка дает следующие результаты
(по отноше1п ю к глюкозе) : Чувствительность, ммоль/л10,17
Точность, ммоль/л±0,09
Погрешность, %±0,35
40
45
что, с целью повышения точности способа
за счет стабилизации окраски реак1и1опной смесиj в качестве вещества , дополнительно взаимодействующе
го с 4-аминофеназоном, используют ти мол н концентрации 2,3-2,7 ммоль/л
при этом раствор буферного вещества содержит 0,6-1,0 ммоль/л 4-аминофе-
назона, 12,1-12,5 /л азида нат рия, 10000-20000 NE/л пероксидазы,
8000-20000 NE/л глюкозооксвдазы,при рН 7,5±0,2, а измерение проводят при длине, волны 475-485 нм.
Пр)сдлагаемый реактив, кроме того пригоден для количественного определения
глюкозы в вьщелениях человека и жйиотных (например в крови, моче, ликворе) и для определения содержа-
1ШЯ глюкозы Б употребляемых человеком напитках (например алкогольных напитках
, соках, освежающих наиитках) или
держащих глюкозу, холестерин или мочевую
кислоту. .
Предлагаемый реактив превосходит
известные тесты. Из количественного сравнения следует, что при использовании предлагаемого метода цвет
вершенно не. меняется в течение по , мень1аей мере 240 мин, тогда как при
использовании известных методов непрерывное снижение интенсивности окраски
набл;одаотся уже через короткое вр ем 1 (45 мин, см. рис. 2).
Формула изобретения
Способ определения глюкозы в биологических
жидкостях путем помещения исследуемой пробы в раствор буферного вещества, дополнительно содержащего
глюкозооксидазу, пероксидазу, 4-аминофеназон, азид натрия и вещество
, взаимодействующее с 4-аг нвфе-, иазоном, инкубации полученной смеси
с последующим спектрофотометрйрова м отличающийся тем,
что, с целью повышения точности способа за счет стабилизации окраски
реак1и1опной смесиj в качестве вещества , дополнительно взаимодействующего
с 4-аминофеназоном, используют тимол н концентрации 2,3-2,7 ммоль/л
при этом раствор буферного вещества содержит 0,6-1,0 ммоль/л 4-аминофе-
назона, 12,1-12,5 /л азида натрия , 10000-20000 NE/л пероксидазы,
8000-20000 NE/л глюкозооксвдазы,при рН 7,5±0,2, а измерение проводят при длине, волны 475-485 нм.
А-Аминофеначон,
ммоль/л0,200 О,AGO 0,600 0,800 1,000
Экстинкция,
11,1 ммоль/л0,350 0,370 0,370 0,370 0,370
Экстинкция,
27,75 ммоль/л0,800 0,860 0,870 0,870 О ,871
Таблица 3
Активность пероксидазы
, Е/ип 8 10 12 14 15 17
Экстинкция,
27,75 ммоль/л0,820 0,850 0,865 0,870 0,870 0,870
Таблица 4
X,
ммоль/л 2,775 5,550 8,325 11,100 13,875 16,650 22,200 27,750 33,300
пЗЗЗЗЗЗЗЗЗ Y0,09500,18330,2783 0,3683 0,4616 0,5500 0,7300 0,9133 1,1210
Y0,0951 0,18600,2769 0,3679 0,4588 0,5497 0,7316 0,9135. 1,0953
d, % -0,10 -1,45 +0,50 +0,10 +0,61 +0,05 -0,22 -0,02 +2,32
Примечание, х- концентрация уравновешенной глюкозы, п - число
параллельных -измерений; Y - среднее значение измеренных экстинкций; Y - экстинкции, вычисленные из сравнения
калиброванных прямых; d - разница между измеренными и вычисленными экстинкциями.
F 246895; F 1,20746; (F.G. : 6; 16) ,10, где F - проба регрессии;
F - проба линейности; F.G. - степень свободы линейности;
Р - достоверность линейности;
так как это значение больше, чем 10%, кривая отклоняется
от прямой незначительно.
и 00
1.000 0,900
0,800 0,700
0,600
0.500 0,400 0,300
0,200
о.т
0,000
.
.
.x. АУ
. 5.55 11.1 Щ5 22.20 27.75 33,3
in Met/i Фиг. 1
./
. ......
1 - erfindungsgemasse. Metfiotfe
2-bekonnfe Sctavo Hettioile
3 - bBkannte Oalenopharml Mefltode
W 90 120 ISO т 210
60
/
.
.
.x. АУ
/ . ......
Фиг.







Комментарии