Устройство и способ для определения концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества в жидкой пробе - RU2305279C2
Код документа: RU2305279C2
Чертежи
Описание
Область техники
Изобретение относится к устройству и способу для определения концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества (аналита) в жидкой пробе с использованием электрохимической ячейки. В частности, оно относится к электрохимическому биосенсору для определения концентрации глюкозы в крови, но оно не ограничено этим частным применением и может быть использовано для других целей анализа.
Предпосылки создания изобретения
Электрохимические биосенсоры обычно содержат ячейку, имеющую рабочий электрод, противоэлектрод и электрод сравнения. Иногда функции и противоэлектрода, и электрода сравнения выполняются одним единственным электродом, называемым «противоэлектродом сравнения» или «псевдоэлектродом сравнения». Поэтому используемый в данном изобретении термин «электрод сравнения» охватывает также противоэлектрод сравнения, если контекст это допускает.
В такой ячейке содержащую аналит пробу приводят в контакт с реагентом, содержащим фермент и окислительно-восстановительный медиатор. При этом либо медиатор восстанавливается (принимает по меньшей мере один электрон), а аналит окисляется (отдает по меньшей мере один электрон), либо наоборот.Обычно именно аналит окисляется, а медиатор восстанавливается. Настоящее изобретение будет описываться далее именно в отношении такой системы, но оно также применимо и к системам, в которых аналит восстанавливается, а медиатор окисляется.
Электрохимические анализаторы глюкозы, такие как используемые диабетиками для контроля уровней содержания глюкозы в крови или же такие, которые используются в клиниках и больницах, обычно основываются на использовании фермента, такого как глюкозооксидаза-дегидрогеназа (GOD), и окислительно-восстановительного медиатора, такого как феррицианид или ферроцианид. В случае такой известной из уровня техники системы пробу (например, кровь), содержащую аналит (например, глюкозу), приводят в контакт с реагентами внутри ячейки. Глюкоза окисляется до глюконовой кислоты, при этом глюкозооксидаза восстанавливается. Затем медиатор повторно окисляет глюкозооксидазу и в ходе этого процесса сам восстанавливается. Восстановленный медиатор затем снова окисляют, при этом он передает электроны рабочему электроду. По истечении заданного времени, достаточного для получения точной оценки фарадеевского тока, оценивают концентрацию глюкозы, исходя из величины этого тока или измеренного сигнала напряжения.
Известные из уровня техники электрохимические ячейки состоят из двух (или трех) смежных электродов, отделенных друг от друга некоторым расстоянием на одной стороне изолятора и приспособленных для соединения с измерительным прибором. На этих электродах или между ними задается целевая область, на которую наносится проба крови.
В поданной тем же заявителем заявке №PCT/AU95/00207 (опубликованной 26.10.1995 г. под №WO 95/28364) описывается ячейка, в которой электроды расположены на противоположных сторонах пористой мембраны, причем один из этих электродов имеет проницаемую для жидкости целевую область.
Согласно уровню техники необходимо отделять рабочий электрод от противоэлектрода (или противоэлектрода сравнения) достаточно большим расстоянием с тем, чтобы избежать вмешательства продуктов электрохимической реакции на одном электроде в реакции на другом электроде. На практике для достижения приемлемой точности требуется разделение электродов расстоянием, большим чем 500 мкм.
Каждую партию ячеек необходимо предварительно калибровать, что приводит к неточностям во время эксплуатации из-за отклонений в пределах одной партии по составу пробы и по окружающим условиям.
Поэтому требуется улучшить точность и достоверность таких биосенсоров. Достижение этих целей затруднено в случае сенсоров, предназначенных для определения концентрации аналитов в крови, поскольку в состав крови входят растворенные газы, ионы, коллоиды, комплексные мицеллы, мелкоразмерные продукты распада клеток и компоненты живых клеток в преимущественно водной среде. Любые из перечисленных могут мешать определению. Существующие сенсоры также подвержены влиянию других мешающих веществ, которые могут присутствовать в пробе и которые могут быть окислены на рабочем электроде и ошибочно идентифицированы как интересующий аналит. Альтернативно, эти мешающие вещества могут восстанавливать окисленную форму окислительно-восстановительного медиатора. Эти явления будут давать искусственно завышенные оценки концентрации аналита. В дополнение к этому, всегда имеется немного восстановленного окислительно-восстановительного медиатора, присутствующего до того, как вводится аналит, и его концентрация должна быть известна и должна вычитаться из измеренного количества восстановленного медиатора для получения точной концентрации аналита. Более того, присутствующий в крови кислород может действовать в качестве окислительно-восстановительного медиатора для глюкозооксидазы-дегидрогеназы (GOD), конкурируя с ферроцианидом. Поэтому высокие концентрации кислорода могут приводить к низким оценочным значениям концентрации глюкозы. Помимо этого, такие измерения являются чувствительными к таким факторам, как изменения влажности, температуры, вязкости раствора и гематокритного числа.
Задачи изобретения
Задачей настоящего изобретения является создание способа и устройства, которые позволяют избежать или частично преодолеть по меньшей мере некоторые из недостатков предшествующего уровня техники. Задачей предпочтительных вариантов изобретения является создание биосенсора с улучшенной точностью и/или достоверностью, и/или скоростью и способа его применения.
Раскрытие изобретения
Описываемое здесь изобретение является усовершенствованием или модификацией изобретения, раскрытого в нашей совместно поданной заявке PCT/AU96/00365, содержание которой полностью включено в данную заявку.
Изобретение будет описываться ниже применительно к биосенсору, приспособленному для измерения концентрации глюкозы в крови, однако, при этом предполагается, что оно не ограничено этим частным применением и может быть использовано для других аналитических определений.
Как указывалось выше, известно измерение концентрации подлежащего анализу компонента (аналита) в водной жидкой пробе посредством помещения пробы в зону реакции электрохимической ячейки, содержащей два электрода, имеющих полное сопротивление (импеданс), которое позволяет их использовать для амперометрических измерений. Подлежащему анализу компоненту дают возможность прореагировать, непосредственно или опосредованно, с окислительно-восстановительным реагентом, при этом образуется способное к окислению (или способное к восстановлению) вещество в количестве, соответствующем концентрации подлежащего анализу компонента. Затем электрохимическим путем оценивают присутствующее количество способного к окислению (или способного к восстановлению) вещества. В целом, этот способ требует достаточного разделения электродов, так чтобы продукты электролиза на одном электроде не могли достигать другого электрода и влиять на процессы на этом другом электроде во время периода измерения.
В упомянутой совместно поданной заявке описан новый способ определения концентрации восстановленной (или окисленной) формы окислительно-восстановительного вещества в электрохимической ячейке того типа, что содержит рабочий электрод и противоэлектрод (или противоэлектрод сравнения), отделенный от этого рабочего электрода заданным расстоянием. Этот способ включает в себя приложение разности электрических потенциалов между электродами и выбор потенциала рабочего электрода таким, что скорость электроокисления восстановленной формы анализируемого вещества (или электровосстановления его окисленной формы) лимитируется диффузией. Расстояние между рабочим электродом и противоэлектродом выбирают так, что продукты реакции с противоэлектрода достигают рабочего электрода. Посредством определения тока как функции времени после приложения потенциала и перед достижением установившегося тока и затем оценки величины установившегося тока описанный ранее способ позволяет оценить коэффициент диффузии и/или концентрацию восстановленной (или окисленной) формы анализируемого вещества.
В упомянутой совместно поданной заявке этот способ проиллюстрирован на примере использования «тонкослойной электрохимической ячейки», в которой используется система GOD/ферроцианид. При этом под используемым здесь термином «тонкослойная электрохимическая ячейка» понимают ячейку, имеющую близко расположенные электроды, так что продукт реакции с противоэлектрода достигает рабочего электрода. На практике расстояние между электродами в такой ячейке для измерения глюкозы в крови будет составлять менее 500 мкм, а предпочтительно - менее 200 мкм.
В приведенной в качестве примера электрохимической ячейке используют следующие химические реакции:
глюкоза+GOD→глюконовая кислота+GOD* (реакция 1)
GOD*+2феррицианид→GOD+2ферроцианид (реакция 2),
где GOD является ферментом глюкозооксидазой, a GOD* является «активированным» ферментом.
Феррицианид ([Fe(CN)6]3-) является «медиатором» (посредником), который возвращает GOD* в его каталитическое состояние. GOD, т.е. ферментный катализатор, не расходуется во время реакции, пока в избытке присутствует медиатор. Ферроцианид ([Fe(CN)6]4-) является продуктом суммарной реакции. В идеальном случае вначале ферроцианид не присутствует, хотя на практике он часто присутствует в небольшом количестве. После того как реакция завершена концентрация ферроцианида (измеренная электрохимическим путем) указывает на первоначальную концентрацию глюкозы. Суммарная реакция является суммой реакций 1 и 2:
GOD
глюкоза+2феррицианид→глюконовая кислота+2ферроцианид (реакция 3).
Термин «глюкоза» относится, в частности, к β-D-глюкозе.
Однако описанный в упомянутой совместно поданной заявке способ также имеет ряд недостатков. Во-первых, требуемый размер пробы больше желательного размера. В целом, было бы предпочтительно иметь возможность проведения измерений на пробах уменьшенного объема, так как это позволяет, в свою очередь, использовать менее инвазивные методы получения проб.
Во-вторых, было бы желательно повысить точность измерений и исключить или сократить разброс измерений, обусловленных, например, асимметричностью ячейки или другими факторами, возникающими при массовом производстве микроячеек. Также желательно сократить эффекты «кромки» электродов.
В-третьих, так как ячейки после использования подлежат выбрасыванию (т.е. являются одноразовыми), желательна возможность их массового производства при относительно низких затратах.
Согласно одному аспекту изобретения предложен способ определения концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества в жидкой пробе, включающий в себя:
(a) обеспечение полой электрохимической ячейки, имеющей рабочий электрод и противоэлектрод или противоэлектрод сравнения, при этом рабочий электрод отделен от противоэлектрода или противоэлектрода сравнения расстоянием менее 500 мкм;
(b) приложение разности электрических потенциалов между электродами; и
(c) электрохимическое определение концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества в жидкой пробе, включающее в себя:
(i) определение изменения тока во времени после приложения разности электрических потенциалов и перед достижением установившегося тока;
(ii) оценку величины установившегося тока; и
(iii) получение, исходя из изменений тока во времени и величины установившегося тока, величины, являющейся показателем концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества.
В одном предпочтительном варианте этого способа ячейка дополнительно содержит гнездо, имеющее первую контактную площадку в электрическом соединении с рабочим электродом и вторую контактную площадку в электрическом соединении с противоэлектродом или противоэлектродом сравнения.
В другом предпочтительном варианте этого способа стадия (b) также включает в себя стадию (i) обеспечения автоматизированного прибора для приложения разности электрических потенциалов между электродами.
В еще одном предпочтительном варианте этого способа ячейка содержит по существу плоскую полоску, имеющую некоторую толщину, причем эта полоска имеет по меньшей мере две боковые кромки, и при этом через стенку электрохимической ячейки и через всю толщину полоски на по меньшей мере одной из ее боковых кромок проходит прорезь, посредством которой жидкая проба может быть введена в ячейку.
В еще одном предпочтительном варианте этого способа жидкая проба содержит кровь.
В еще одном предпочтительном варианте этого способа окислительно-восстановительное вещество содержит глюкозу.
При этом рабочий электрод и противоэлектрод могут быть образованы проводниками или полупроводниками и могут быть одинаковыми или различными. Предпочтительными являются электроды слои из благородных металлов.
Измеренная таким способом концентрация является по существу независимой от колебаний, если они есть, коэффициента диффузии восстановленной формы и поэтому скомпенсирована по колебаниям температуры и вязкости. Измеренная таким образом концентрация является независимой от колебаний гематокрита и других веществ, которые влияют на коэффициент диффузии восстановленной формы окислительно-восстановительного вещества.
Как будет очевидно, способ по изобретению применим равным образом и к определению концентрации восстановленной формы окислительно-восстановительного вещества или окисленной формы окислительно-восстановительного вещества в ячейке. В том случае, когда определению подлежит концентрация восстановленной формы, потенциал рабочего электрода должен поддерживаться таким, что на стадии (b) скорость электроокисления восстановленной формы лимитируется диффузией, и в результате на стадии (с) получают именно концентрацию восстановленной формы. В том случае, когда определению подлежит концентрация окисленной формы, потенциал рабочего электрода должен поддерживаться таким, что на стадии (b) скорость электровосстановления окисленной формы лимитируется диффузией, и в результате на стадии (с) получают именно концентрацию окисленной формы.
Окислительно-восстановительное вещество может быть аналитом или же может быть окислительно-восстановительным медиатором.
В предпочтительных вариантах реализации способа используют медиатор, и концентрация восстановленной (или окисленной) формы этого медиатора является, в свою очередь, показателем концентрации аналита, и при этом в качестве «предшественника» определению концентрации аналита определяют меру коэффициента диффузии восстановленной (или окисленной) формы этого медиатора.
Предпочтительно, ячейка содержит рабочий электрод и противоэлектрод сравнения. Если используется электрод сравнения, отдельный от противоэлектрода, то в этом случае электрод сравнения может находиться в любом удобном месте в этом датчике, где он находится в контакте с пробой.
В противоположность уровню техники, при проведении способа по изобретению электроды размещены достаточно близко для того, чтобы продукты электрохимической реакции на противоэлектроде мигрировали к рабочему электроду во время периода исследования. Например, в случае системы фермент-феррицианид, полученный на противоэлектроде феррицианид диффундирует к рабочему электроду.
Это обеспечивает возможность достижения установившегося профиля концентрации между электродами, приводя к достижению установившегося тока. Это, в свою очередь, обеспечивает возможность измерения коэффициента диффузии и концентрации окислительно-восстановительного вещества (медиатора) независимо от отклонений в пробе и поэтому сильно повышает точность и достоверность.
Этот способ также позволяет определять концентрацию гематокрита крови исходя из коэффициента диффузии путем использования справочных таблиц (или путем отделения красных кровяных телец от плазмы и измерения коэффициента диффузии фракции красных кровяных телец и фракции плазмы и их сравнения).
Согласно другому аспекту изобретения предложено устройство для определения концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества в жидкой пробе, содержащее:
(a) полую электрохимическую ячейку, имеющую рабочий электрод и противоэлектрод или противоэлектрод сравнения, при этом рабочий электрод отделен от противоэлектрода или противоэлектрода сравнения расстоянием менее 500 мкм;
(b) средство для приложения разности электрических потенциалов между электродами; и
(c) средство для электрохимического определения концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества в жидкой пробе, содержащее:
(i) средство для определения изменения тока во времени после приложения разности электрических потенциалов и перед достижением установившегося тока;
(ii) средство для оценки величины установившегося тока; и
(iii) средство для получения, исходя из изменения тока во времени и величины установившегося тока, величины, являющейся показателем концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества.
В предпочтительном варианте этого устройства ячейка дополнительно содержит гнездо, имеющее первую контактную площадку в электрическом соединении с рабочим электродом и вторую контактную площадку в электрическом соединении с противоэлектродом или противоэлектродом сравнения, посредством чего ячейка может быть электрически соединена с по меньшей мере одним из средства для приложения разности электрических потенциалов между электродами и средства для электрохимического определения концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества в жидкой пробе.
В другом предпочтительном варианте этого устройства по меньшей мере одно из средства для приложения разности электрических потенциалов между электродами и средства для электрохимического определения концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества в жидкой пробе содержит язычковый штекер.
В еще одном предпочтительном варианте этого устройства ячейка содержит по существу плоскую полоску, имеющую некоторую толщину, причем эта полоска имеет по меньшей мере две боковые кромки, и при этом через стенку электрохимической ячейки и через всю толщину полоски на по меньшей мере одной из ее боковых кромок проходит прорезь, посредством которой жидкая проба может быть введена в ячейку.
В еще одном предпочтительном варианте этого устройства жидкая проба содержит кровь.
В еще одном предпочтительном варианте этого устройства окислительно-восстановительное вещество содержит глюкозу.
В предпочтительных вариантах ячейка имеет эффективный (полезный) объем в 1,5 микролитра или менее. Устройство по изобретению может содержать пористую мембрану, рабочий электрод на одной стороне этой мембраны и противоэлектрод сравнения на другой ее стороне, причем эти электроды вместе с некоторой зоной мембраны между ними образуют электрохимическую ячейку, и при этом мембрана простирается вбок от ячейки до области нанесения пробы, отделенной от зоны ячейки расстоянием, большим, чем толщина мембраны.
Предпочтительно, пористую мембрану, расстояние целевой области от участка ячейки и толщину мембраны выбирают в комбинации так, что при помещении крови (содержащей плазму и красные кровяные тельца) на целевую область фронт плазмы диффундирует вбок к зоне электрохимической ячейки впереди красных кровяных телец.
Таким образом возможно заполнить тонкослойную электрохимическую ячейку плазмой, по существу свободной от гематокрита, который вызывал бы разброс в коэффициенте диффузии окислительно-восстановительного медиатора и который влиял бы на точность исследования, как будет пояснено далее.
В предпочтительных вариантах реализации биосенсора согласно изобретению задается зона мембраны со второй электрохимической ячейкой с помощью второго рабочего электрода и второго противоэлектрода сравнения на стороне мембраны, противоположной относительно этого второго рабочего электрода. Эта зона второй электрохимической ячейки располагается промежуточно между зоной первой ячейки и областью нанесения пробы или, иначе говоря, «целевой» областью или же располагается сбоку от целевой области, удаленной от зоны первой электрохимической ячейки. В этих вариантах реализации плазма приходит в контакт с ферментом в или по пути к первой электрохимической ячейке, в то время как достигающая второй ячейки плазма - нет. Таким образом, при применении первая ячейка измеряет концентрацию восстановленного медиатора в присутствии плазмы (включающей электрохимически мешающие вещества) и фермента, в то время как вторая ячейка измеряет ее в присутствии плазмы (включающей электрохимически мешающие вещества) и в отсутствие фермента. Это обеспечивает возможность определения концентрации восстановленных мешающих веществ во второй ячейке и концентрации восстановленных мешающих веществ плюс аналита в первой ячейке. Вычитание одного значения из другого дает абсолютную концентрацию аналита.
В очень предпочтительном варианте реализации изобретения используется полая ячейка, в которой рабочий электрод и электрод сравнения (противоэлектрод сравнения) отделены друг от друга расстоянием менее 500 мкм, а предпочтительно - от 20 до 200 мкм.
Описание чертежей
Изобретение раскрыто ниже на конкретных примерах со ссылками на соответствующие чертежи, на которых:
фиг.1 - продукт второй стадии производства, вид сверху;
фиг.2 - продукт по фиг.1, вид сбоку;
фиг.3 - продукт по фиг.1, вид с торца;
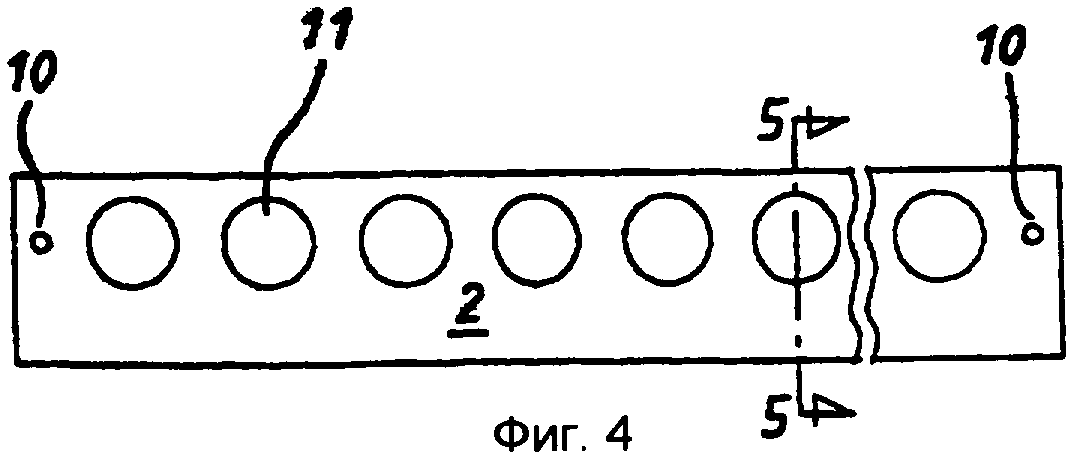
фиг.4 - продукт третьей стадии производства, вид сверху;
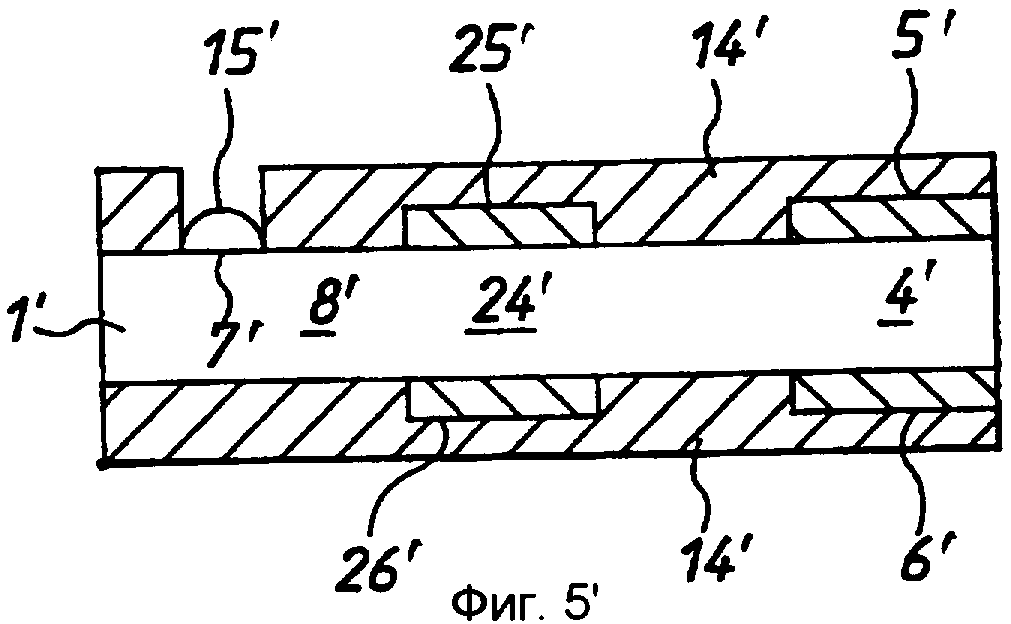
фиг.5 - продукт по фиг.4 в разрезе по линии 5-5 на фиг.4;
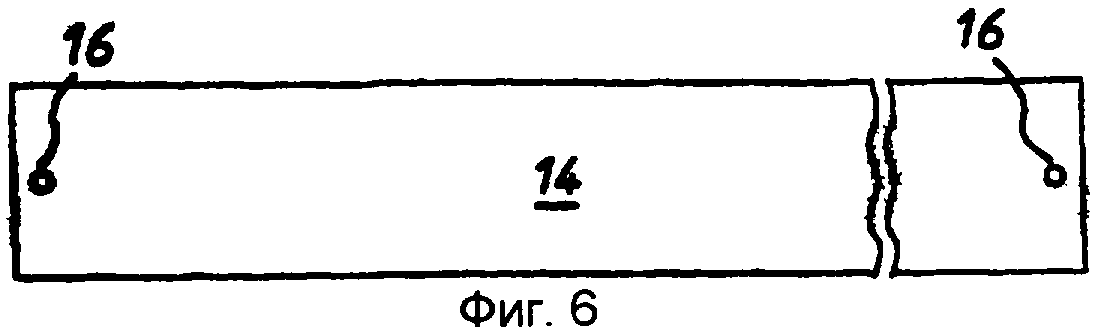
фиг.6 - продукт пятой стадии производства, вид сверху;
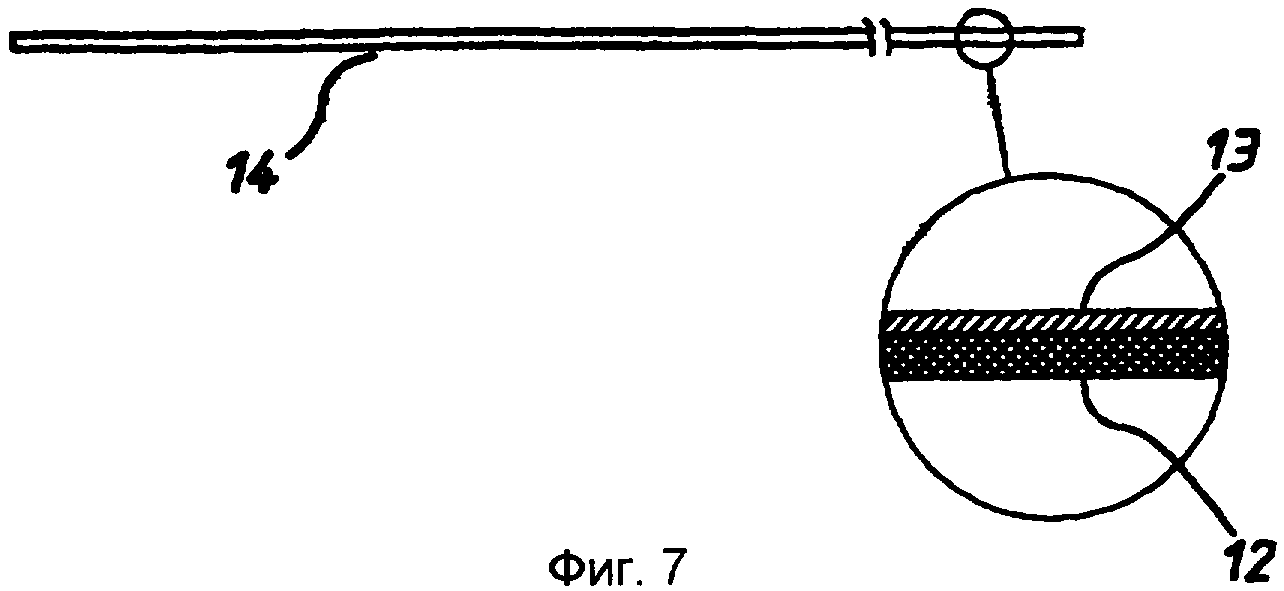
фиг.7 - продукт по фиг.6, вид сбоку;
фиг.8 - продукт по фиг.6, вид с торца;
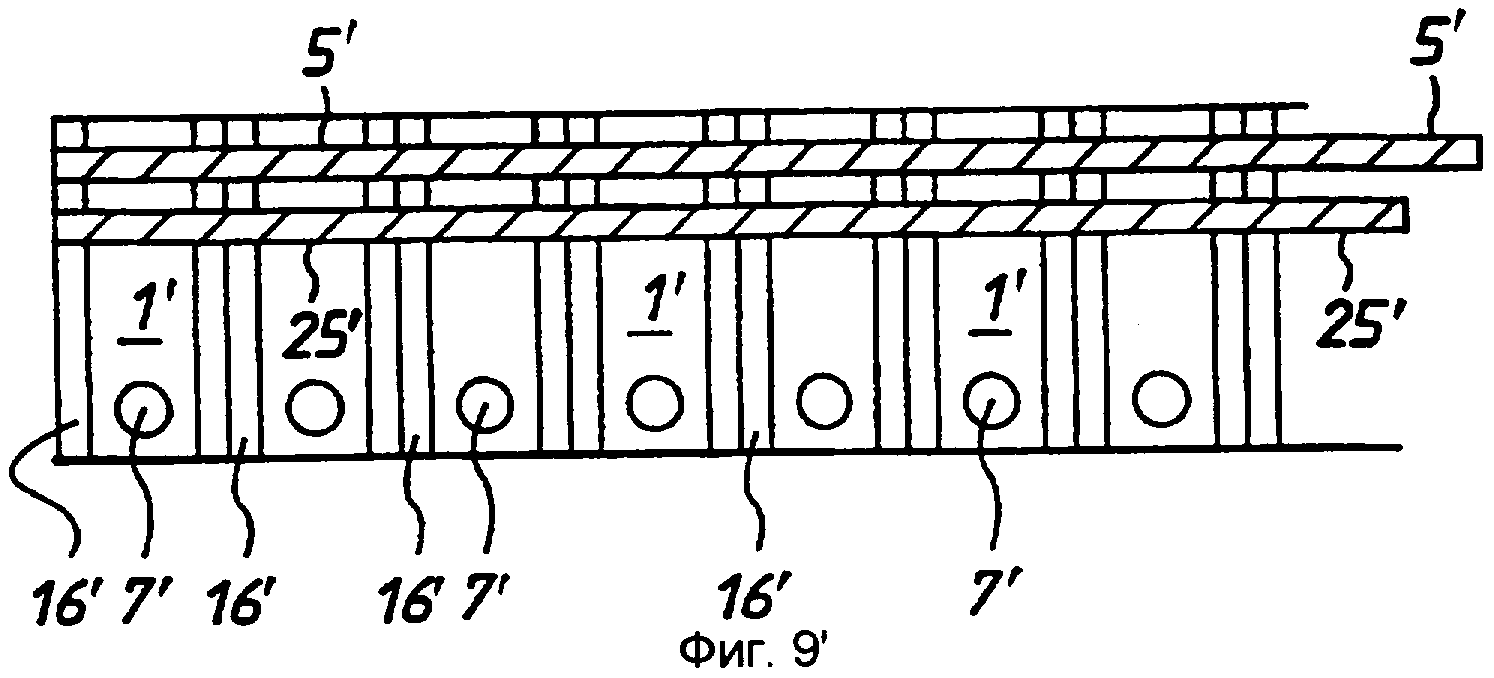
фиг.9 - продукт седьмой стадии производства, вид сверху;
фиг.10 - продукт по фиг.9 в разрезе по линии 10-10;
фиг.11 - продукт по фиг.9, вид с торца;
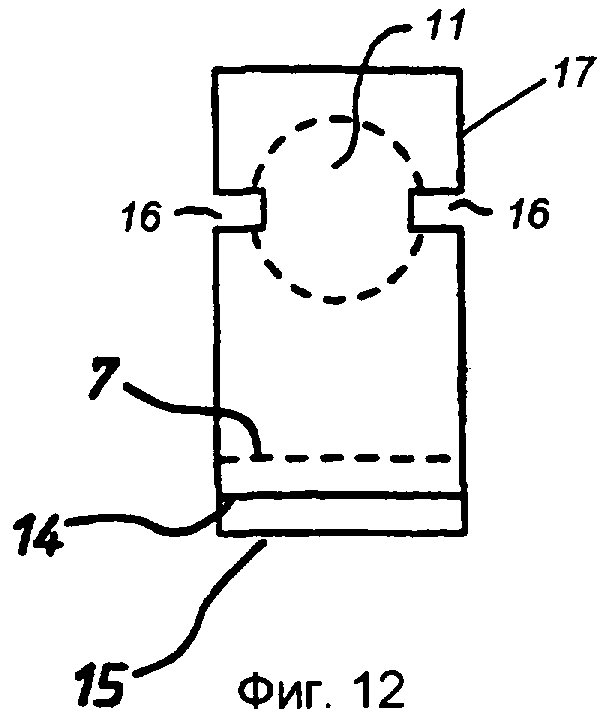
фиг.12 - ячейка согласно изобретению, вид сверху;
фиг.13 - ячейка по фиг.12, вид сбоку;
фиг.14 - ячейка по фиг.12, вид с торца;
фиг.15 - частичный разрез второго варианта реализации изобретения в увеличенном масштабе.
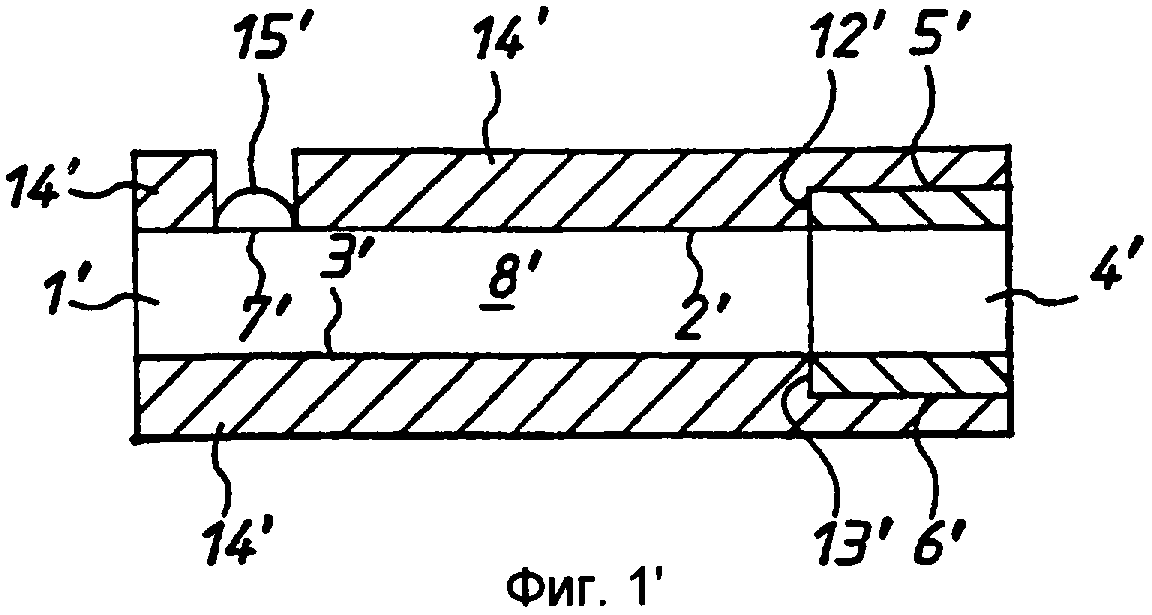
Фиг.1' - схематичный чертеж (не в масштабе) первого варианта реализации согласно изобретению на виде сбоку.
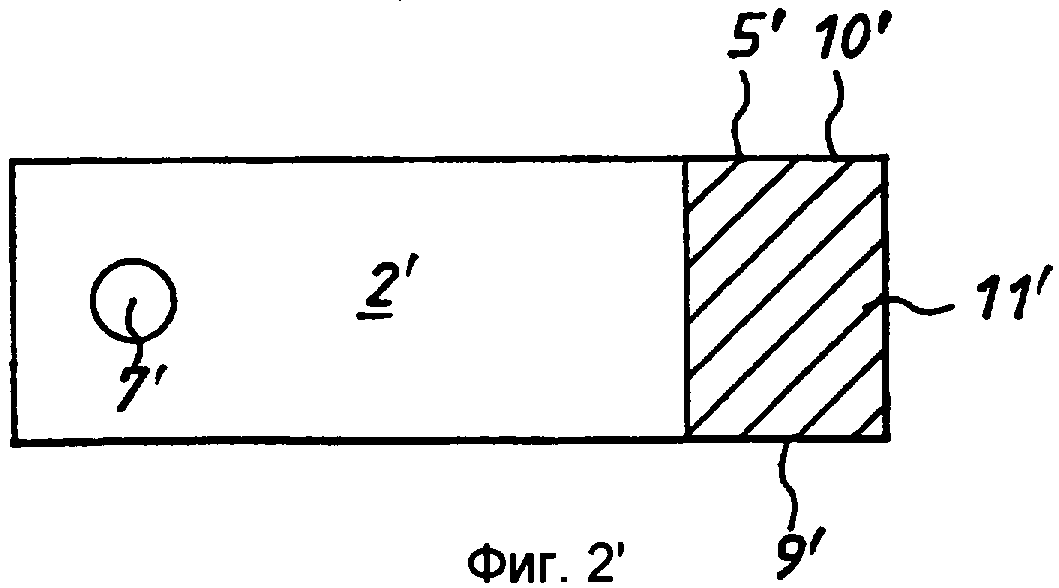
Фиг.2' - вариант реализации по фиг.1' на виде сверху.
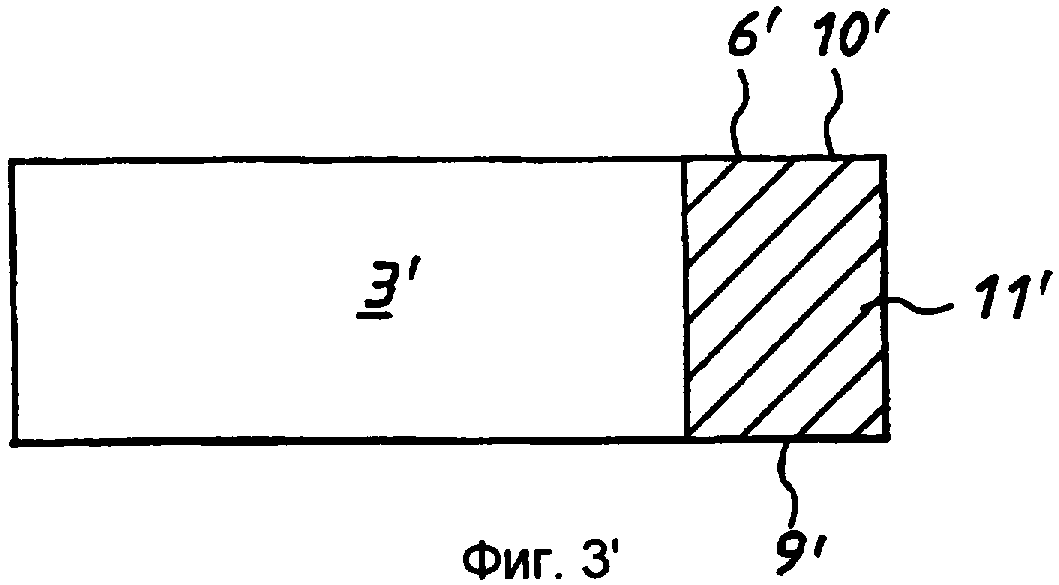
Фиг.3' - вариант реализации по фиг.1' на виде снизу.
Фиг.4' - вариант реализации по фиг.1' на виде с торца.
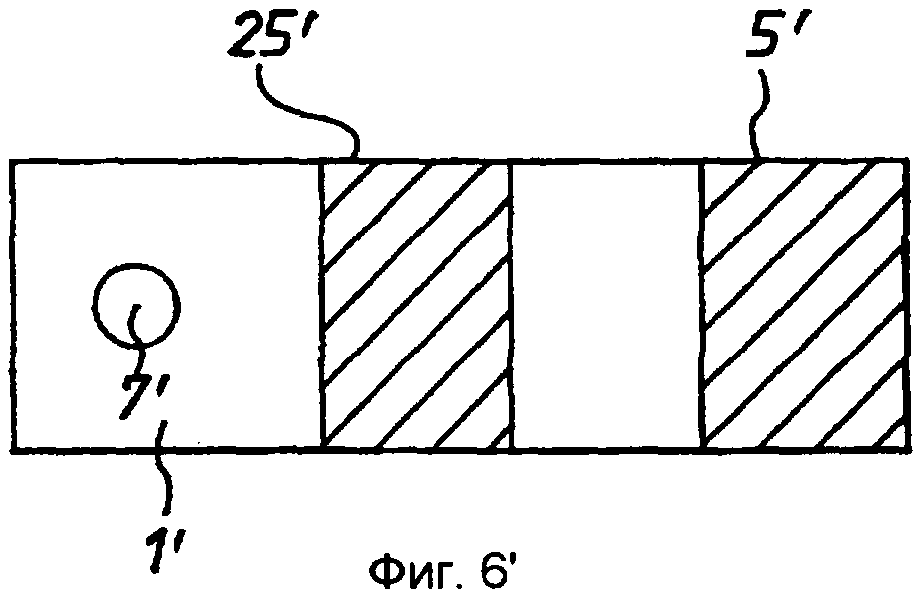
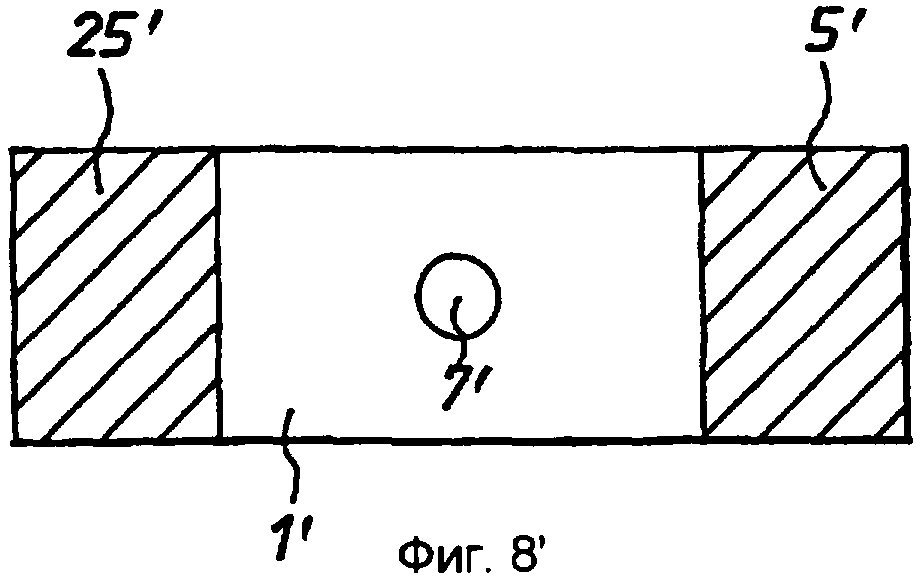
Фиг.5' - схематичный чертеж (не в масштабе) второго варианта реализации согласно изобретению на виде сбоку.
Фиг.6' - вариант реализации по фиг.5' на виде сверху.
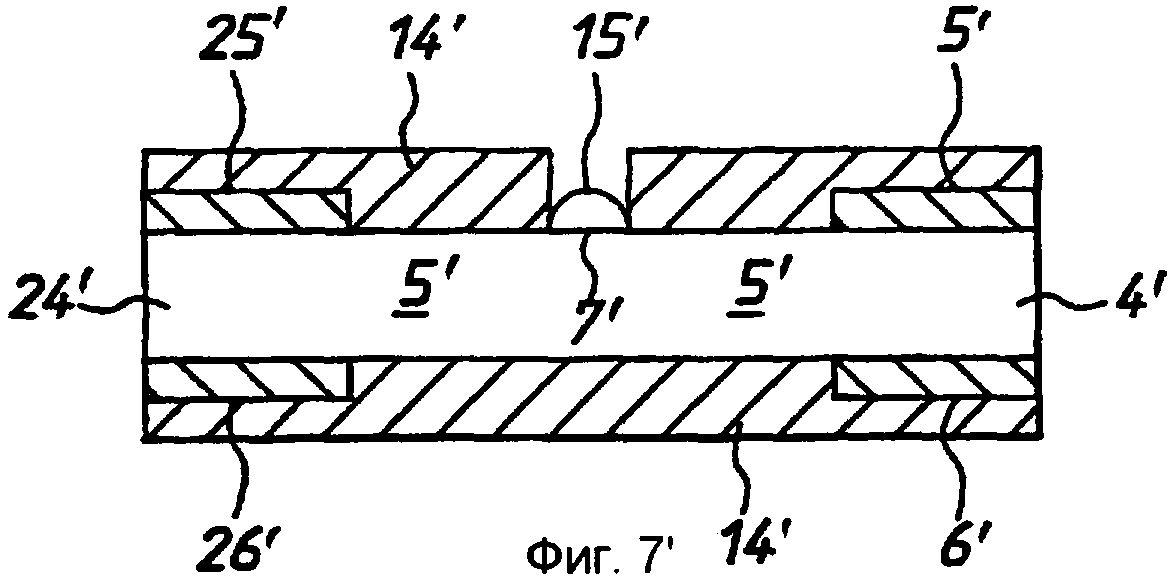
Фиг.7' - схематичный чертеж (не в масштабе) второго варианта реализации согласно изобретению на виде сбоку.
Фиг.8' - вариант реализации по фиг.7' на виде сверху.
Фиг.9' - схематичный чертеж (не в масштабе) согласно изобретению на виде сверху.
Фиг.10' - вариант реализации по фиг.9' на виде с торца.
Фиг.11' - вариант реализации по фиг.9' на виде сбоку.
Фиг.12' - схематичный чертеж (не в масштабе) варианта реализации полой ячейки согласно изобретению на виде в разрезе.
Фиг.13' - график, показывающий кривую тока (ось ординат) в зависимости от времени (ось абсцисс) во время выполнения способа согласно изобретению.
Фиг.14' - еще один график, используемый при пояснении способа по изобретению.
Следует отметить, что все элементы, показанные на фиг.1'-14', помечены символом «'» с целью обеспечения их отличия от элементов, показанных на фиг.1-15. Элементы на фиг.5'-12', соответствующие по своей функции элементам варианта реализации по фиг.1'-4', обозначены идентичными позициями или символами.
Описание предпочтительных вариантов реализации
Способ производства электрохимической ячейки
Ниже будет описана конструкция тонкослойной электрохимической ячейки на примере усовершенствованного способа ее производства.
Стадия 1: лист 1 мелинекса® (химически инертный и электрически резистивный полиэтилентерефталат [ПЭТФ]) с размерами примерно 13 см × 30 см и толщиной 100 мкм плоско накладывали на лист 2 разделительной бумаги и покрывали с использованием бруска MYLAR номер 2 до толщины 12 мкм во влажном состоянии (примерно 2-5 мкм в сухом виде) активируемым нагревом клеем 3 на водной основе (система ICI Novacoat с использованием катализатора: клея). Затем воду испаряли посредством сушилки горячим воздухом, получая контактную клеевую поверхность. Затем лист переворачивали на разделительную бумагу и покрывали аналогичным образом противоположную сторону тем же клеем 4, сушили и накладывали защитную разделительную бумагу 5 на открытую клеевую поверхность. Кромки подрезали для получения листа, равномерно покрытого с обеих сторон липким контактным клеем, защищенным разделительной бумагой.
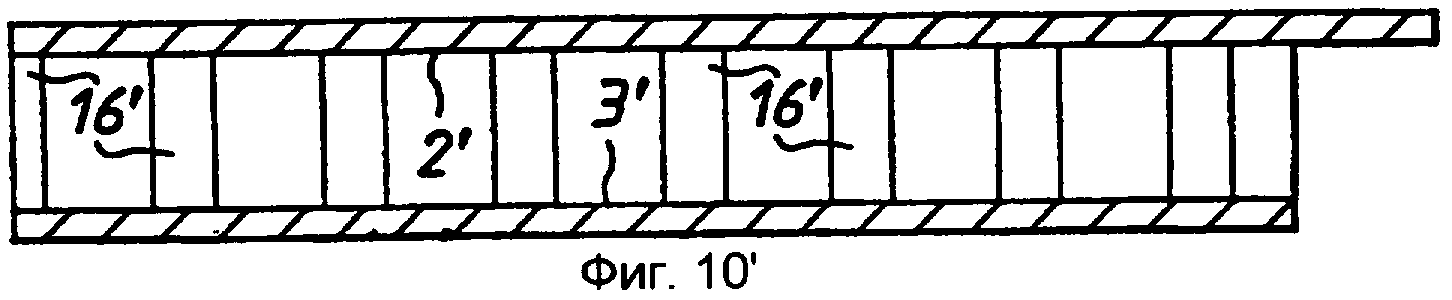
Стадия 2: лист с защитной разделительной бумагой разрезали на полоски 7 размером примерно 18 мм × 210 мм каждая (фиг.1-3).
Стадия 3: покрытую клеем полоску 7 из ПЭТФ со стадии 2 с разделительной бумагой 2, 5 на соответствующих сторонах помещали в матричную сборку (не показана) и закрепляли. Матричная сборка была выполнена с возможностью пробивания в полоске установочных отверстий 10 на каждом ее конце и, например, 37 круглых отверстий 11 с диаметром 3,4 мм каждое и расстоянием 5 мм между центрами, равномерно распределенных вдоль линии между установочными отверстиями 10. Площадь каждого отверстия 11 составляет примерно 9 квадратных миллиметров (мм2 ).
Стадия 4: лист милара® ПЭТФ площадью примерно 21 см2 и толщиной 135 мкм помещали в камеру металлизирования напылением для нанесения палладиевого покрытия 13. Напыление покрытия происходило в вакууме от 4 до 6 миллибар и в атмосфере газа аргона. Палладий наносили на ПЭТФ до толщины 100-1000 ангстрем (А). Таким образом получали лист 14 с напыленным на него палладиевым покрытием 13.
Стадия 5: затем покрытый палладием лист 14 ПЭТФ со стадии 4 разрезали на полоски 14 и 15 и с помощью штампа пробивали два установочных отверстия 16 по концам каждой полоски (фиг.6, 7 и 8). Полоски 14 и 15 отличаются только размерами: полоска 14 имеет размеры 25 мм × 210 мм, а полоска 15 - 23 мм × 210 мм.
Стадия 6: полоску-разделитель 7, подготовленную согласно стадии 3, помещали затем в зажимное приспособление (не показано), имеющее два установочных штифта (каждый соответствует установочному отверстию 10 полоски 7), и снимали верхнюю разделительную бумагу 2. Полоску 14 покрытого палладием ПЭТФ, подготовленную согласно стадии 5, накладывали затем на клеящий слой палладиевым покрытием вниз, используя штифты зажимного приспособления для совмещения установочных отверстий 16 с нижележащей полоской 7 ПЭТФ. Затем эту комбинацию пропускали через ламинатор, содержащий набор прижимных роликов, один из которых был выполнен с возможностью нагревания стороны, несущей покрытую палладием полоску 14 ПЭТФ. Ролик на противоположной стороне полоски 7 охлаждали. Благодаря этому активировали только клей между палладием полоски 14 и ПЭТФ полоски 7.
Стадия 7: полоску 7 ПЭТФ переворачивали и размещали в зажимном приспособлении разделительным покрытием вверх. Разделительное покрытие отслаивали и накладывали вторую покрытую палладием полоску 15 палладиевой стороной вниз на открытую клеящую поверхность с использованием установочных штифтов для выравнивания полосок. Затем эту сборочную единицу снова пропускали через ламинатор со стадии 6, при этом горячий ролик соприкасался с покрытым палладием миларом®, введенным на стадии 7, для того, чтобы активировать расположенный между ними клей (фиг.9, 10 и 11).
Стадия 8: полученную на стадии 7 сборочную единицу возвращали в матричную сборку и пробивали прорези 16, расположенные в таких местах, чтобы они проходили между пробитыми ранее в мелинексе® ПЭТФ круглыми отверстиями 11 и кромкой 17 полоски. Прорези 16 проходят так, что они прорезают окружность каждой круглой ячейки. Затем эту полоску разрезали для получения 37 индивидуальных «сенсорных полосок», при этом каждая полоска имела ширину примерно 5 мм и каждая содержала одну тонкослойную ячейку-полость (фиг.12, 13 и 14).
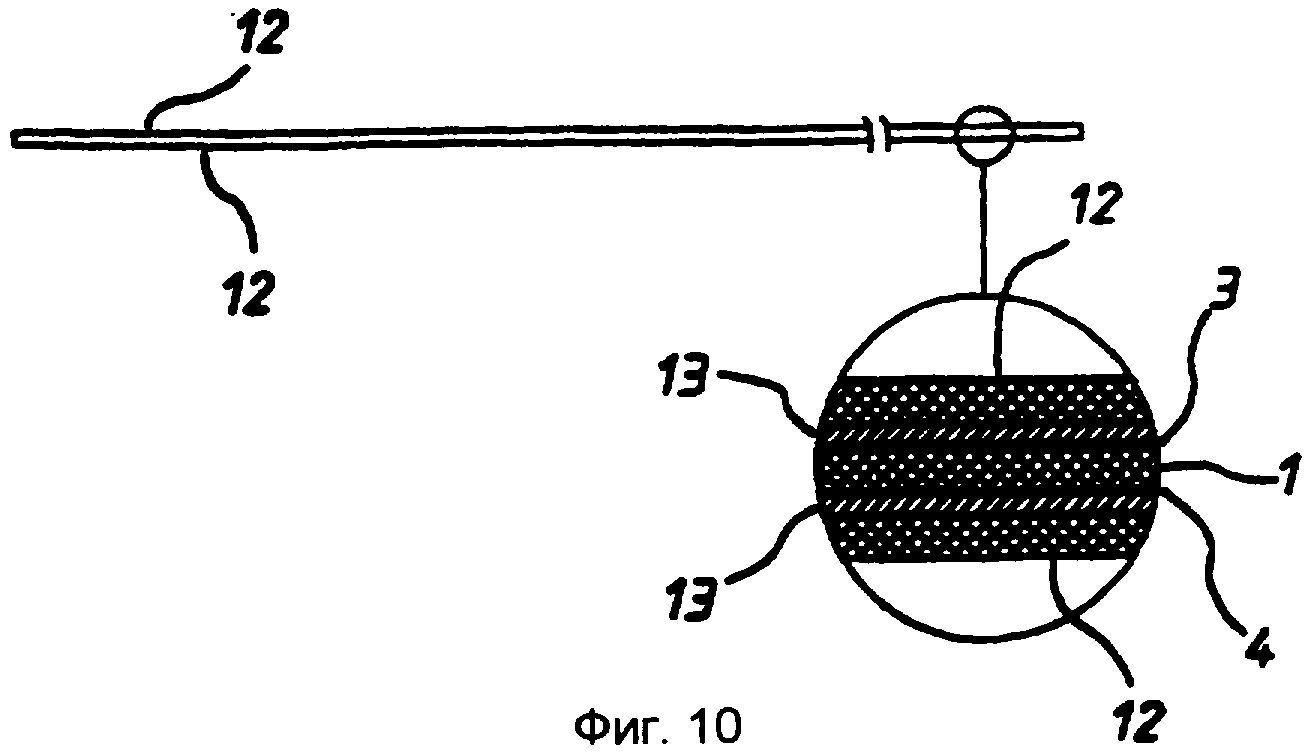
Таким образом получают ячейку, представленную на фиг.12, 13 или 14. Эта ячейка содержит первый электрод, состоящий из слоя 12 ПЭТФ, слоя 13 палладия, слоя 3 клея, листа 1 ПЭТФ и второго слоя 4 клея, и второй электрод, содержащий слой 13 палладия и слой 12 ПЭТФ. Лист 1 образует цилиндрическую ячейку 11, имеющую толщину в осевом направлении ячейки, соответствующую толщине листа 1 мелинекса® ПЭТФ вместе с толщиной слоев 3 и 4 клея. Ячейка имеет круглые палладиевые торцевые стенки. Доступ к ячейке обеспечивается на боковой кромке ячейки, где с ячейкой 11 пересекаются прорези 16.
В предпочтительных вариантах реализации изобретения подлежащую анализу пробу вводят в такую ячейку с помощью капиллярного эффекта. Пробу размещают в соприкосновении с прорезью 16, и она самостоятельно втягивается с помощью капиллярного эффекта в ячейку, а вытесненный из ячейки воздух выходит через противоположную прорезь 16. В капиллярном пространстве может быть помещено поверхностно-активное вещество (ПАВ) для способствования втягиванию пробы.
Сенсоры снабжены соединительными средствами, например краевыми соединителями, с помощью которых сенсоры могут быть включены в измерительную схему. В предпочтительном варианте реализации изобретения это достигается за счет выполнения разделителя 1 более коротким, чем несущие палладий листы 14, 15, выполнения одного листа 15 меньшим по длине, чем другой лист 14. Таким образом формируется гнездо 20, имеющее контактные площадки 21, 22, электрически соединенные, соответственно, с рабочим электродом и противоэлектродом. Таким образом, для обеспечения электрического соединения можно использовать простой язычковый штекер, с соответствующими зацепляющимися проводящими поверхностями. Могут быть разработаны соединители другой формы.
Химикалии, предназначенные для использования в такой ячейке, могут удерживаться на электродах или стенках ячейки, могут удерживаться на независимой опоре, размещенной внутри ячейки, или могут быть самоподдерживающимися.
В одном варианте реализации химикалии, предназначенные для использования в ячейке, отпечатывают на палладиевой поверхности электрода непосредственно после стадии 1, на которой свеженанесенный палладий является более гидрофильным. Например, на палладиевой поверхности можно отпечатать раствор, содержащий 0,2 моля феррицианида калия и 1 мас.% глюкозооксидазы-дегидрогеназы. Желательно, чтобы химикалии отпечатывали только на те области, которые будут образовывать стенку ячейки, и, предпочтительно, химикалии отпечатывают на этой поверхности с помощью струйного принтера. Таким образом можно точно управлять нанесением химикалий. При желании, химикалии, которые желательно держать раздельно до тех пор, пока они не потребуются для использования, могут быть отпечатаны, соответственно, на первый и второй электроды. Например, композиция GOD/ферроцианид может быть отпечатана на один электрод, а буфер - на другой. Хотя очень предпочтительным является нанесение химикалий на электроды перед сборкой их в ячейку, химикалии могут быть также введены в ячейку в виде раствора после стадии 6 или стадии 8 с помощью пипетки традиционным образом, а впоследствии растворитель удаляют с помощью испарения или сушки. Химикалии не обязательно должны быть отпечатаны на стенке ячейки или на электродах, а могут быть вместо этого введены пропитыванием марли, мембраны, нетканого материала или т.п., находящихся внутри полости или заполняющих эту полость (т.е. введенных в ячейку 11 перед стадией 6 или 7). В другом варианте реализации химикалии формуют в пористую массу, которая может быть введена в ячейку в виде таблетки или гранул. В альтернативном варианте химикалии могут быть введены в виде геля.
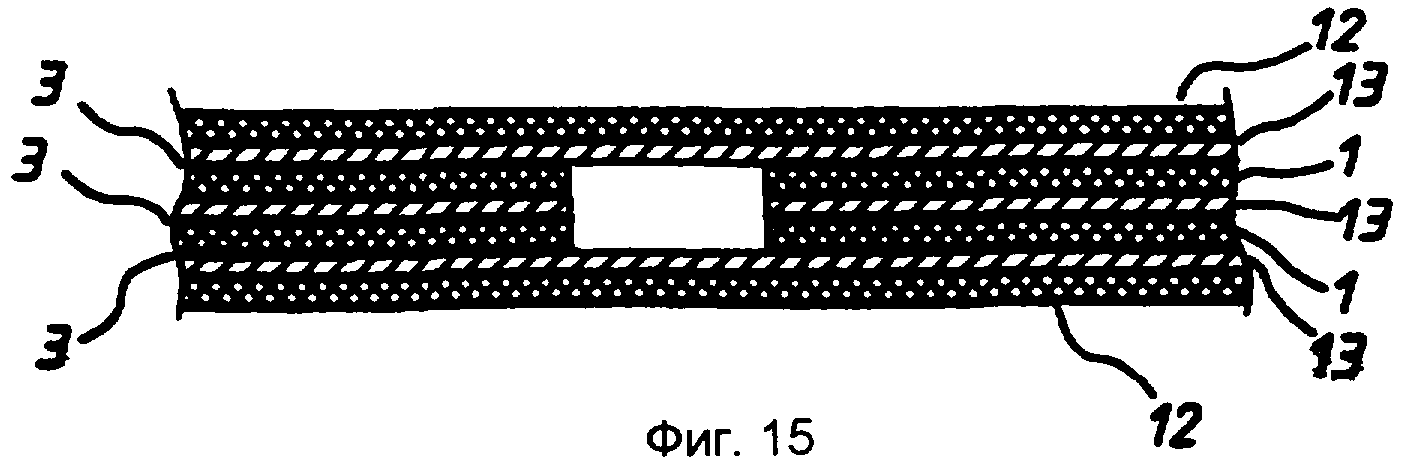
Во втором варианте реализации изобретения вначале изготавливают слоистую конструкцию 20 из полоски 14, полученной на стадии 5 и вклеенной между двумя полосками 7, полученными на стадии 3. Слоистой конструкцией 20 заменяют лист 1 на стадии 5 и собирают вместе с электродами согласно стадиям 6 и 7.
Таким образом получают ячейку, показанную на фиг.15, которая отличается от ячейки по фиг.9-11 тем, что имеет кольцевой электрод, расположенный между первым и вторым электродами. Этот электрод может быть использован, например, в качестве электрода сравнения.
Следует отметить, что при массовом производстве ячеек упомянутые части могут быть собраны в слоистую конструкцию на поточной производственной линии. Например, непрерывный лист 1 из ПЭТФ может быть сперва пробит, а затем на оставшемся листе может быть непрерывным образом отпечатан клей. Электроды (с предварительно отпечатанным и высушенным раствором химикалий) могут быть поданы непосредственно в виде слоистой конструкции на покрытую слоем клея сторону. Затем клей может быть нанесен на другую сторону пробитого среднего листа, и затем электроды могут быть поданы в виде слоистой конструкции на вторую сторону.
Клей можно наносить в виде расплавленной прокладочной пленки. В альтернативном варианте средний лист может быть сперва покрыт слоем клея и затем пробит.
С помощью сушки химикалий на каждом электроде перед стадией наклеивания поверхность электродов защищают от загрязнения.
Хотя была описана ячейка на основе милара® и мелинекса® ПЭТФ, можно использовать другие химически инертные и электрически резистивные материалы, а также выбрать другие размеры. Эти материалы, используемые для изготовления листа-разделителя 1 и для изготовления опоры электрода сравнения и противоэлектрода, могут быть одинаковыми или могут отличаться друг от друга. Хотя изобретение описано применительно к палладиевым электродам, можно использовать другие металлы, такие как платина, серебро, золото, медь или т.п., причем серебро может реагировать с хлоридом с образованием хлорсеребряного электрода (серебро/хлорид серебра) или с другими галогенидами. Электроды не обязательно должны быть выполнены из одинакового металла.
Хотя было описано использование активируемых нагревом клеев, упомянутые части могут быть собраны с использованием термоплавких клеев, сплавленных слоистых материалов или других способов.
Размеры сенсоров можно легко изменять в зависимости от требований.
Хотя в большинстве случаев предпочтительно, чтобы электроды закрывали торцевые отверстия ячейки, в других вариантах реализации (не изображены) электроды не полностью закрывают торцевые отверстия ячейки. В этом случае желательно, чтобы электроды находились в по существу совмещаемом при наложении друг на друга положении.
Предпочтительные варианты изобретения, в которых электроды закрывают отверстия 11 ячейки, имеют преимущества, заключающиеся в том, что площадь электродов точно задается просто путем пробивания отверстия 11. Кроме того, образованные таким образом электроды являются параллельными, перекрывающимися, имеют одинаковую площадь и по существу или полностью свободны от «краевых» эффектов.
Хотя в описанных вариантах реализации каждый сенсор имеет одну ячейку-полость, могут быть также предусмотрены сенсоры с двумя или более полостями. Например, может быть предусмотрена вторая полость с заданным количеством анализируемого вещества, которая может служить в качестве ячейки сравнения.
Для специалиста в данной области из приведенных здесь пояснений будет очевидно, что признак одного описанного здесь варианта реализации может быть скомбинирован с признаками других описанных здесь вариантов реализации или с другими вариантами реализации, раскрытыми в вышеупомянутой совместно поданной заявке и описанными ниже. Хотя сенсор был описан применительно к палладиевым электродам и к химической системе GOD/ферроцианид, специалистам в данной области будет очевидно, что могут быть использованы другие химические системы и конструкционные материалы без отклонения от вышеизложенных принципов.
Устройство и способ для определения концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества в жидкой пробе
Далее со ссылкой на фиг.1'-14' будут описаны устройство и способ для определения концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества в жидкой пробе согласно настоящему изобретению.
Вначале со ссылкой на фиг.1'-4' продемонстрирован первый вариант реализации устройства по изобретению в случае биосенсора для определения глюкозы в крови. Устройство согласно этому варианту реализации содержит тонкополосковую мембрану 1', имеющую верхнюю и нижнюю поверхности 2' и 3' и имеющую зону 4' ячейки, образованную между рабочим электродом 5', расположенным на верхней поверхности 2', и противоэлектродом 6', расположенным на нижней поверхности 3'. Толщина мембраны выбрана таким образом, что электроды отделены расстоянием «l», которое является достаточно небольшим, так что продукты реакции на противоэлектроде мигрируют к рабочему электроду во время исследования, и при этом по существу достигается установившийся диффузионный профиль. В типичном случае расстояние «l» будет составлять менее 500 мкм. «Целевая» область 7' нанесения пробы, образованная на верхней поверхности 2' мембраны 1', отделена от зоны 4' ячейки расстоянием, большим, чем толщина мембраны. Мембрана 1' имеет диффузионную область 8', простирающуюся между целевой областью 7' и зоной 4' ячейки. В пределах зоны 4' ячейки мембраны 1' и/или между этой зоной 4' ячейки и целевой областью 7' содержатся подходящие реагенты, включая оксилительно-восстановительный медиатор «М», фермент «Ф» и рН-буфер «Б». Реагенты могут также включать стабилизаторы и т.п.
В некоторых случаях предпочтительно размещать фермент и медиатор и/или буфер в различных зонах мембраны. Например, фермент может быть размещен в пределах зоны 4' электрохимической ячейки, в то время как фермент может быть расположен под целевой областью 7' или в диффузионной зоне 8'.
Гемоглобин выделяет кислород при низких значениях рН, а при высоких значениях рН он связывает кислород очень прочно. Кислород действует в качестве окислительно-восстановительного медиатора для глюкозооксидазы-дегидрогеназы (GOD). В сенсоре на глюкозу она конкурирует с этим окислительно-восстановительным медиатором, что приводит к низким оценкам концентрации глюкозы. Поэтому, если желательно, первый рН-буфер может содержаться поблизости от целевой области 7' для повышения рН до такого уровня, что весь кислород связывается с гемоглобином. Однако такой уровень рН был бы неоптимальным для кинетики системы GOD/глюкоза и, следовательно, оказывал бы отрицательное влияние на скорость проведения и чувствительность исследования. Поэтому в предпочтительном варианте реализации изобретения поблизости от рабочего электрода в качестве реагента содержится второй рН-буфер для восстановления рН до оптимальных с точки зрения кинетики уровней. Использование второго буфера не вызывает выделения кислорода из гемоглобина, поскольку гемоглобин содержится в красных кровяных тельцах (эритроцитах), которые задерживаются вблизи целевой области 7' нанесения пробы крови или диффузия которых замедлена по сравнению с плазмой, и поэтому второй буфер не оказывает на них никакого влияния. Таким образом, мешающее определению влияние кислорода может быть в значительной мере снижено или полностью устранено.
При применении такого сенсора на целевую область 7' помещают каплю крови, имеющей некоторую концентрацию глюкозы, которая подлежит определению. Компоненты крови просачиваются по направлению к зоне 4' ячейки, причем компонент плазмы диффундирует более быстро, чем красные кровяные тельца, так что фронт плазмы достигает зоны 4' ячейки с опережением относительно кровяных телец.
Когда плазма просачивается и вступает в контакте с реагентом, реагент растворяется и протекает реакция, в ходе которой аналит окисляется, а медиатор восстанавливается. По истечении заданного промежутка времени, предоставленного для завершения этой реакции, между рабочим электродом и противоэлектродом прикладывают разность электрических потенциалов. Потенциал рабочего электрода поддерживают в достаточной мере анодным, так что скорость электроокисления восстановленной формы медиатора на рабочем электроде определяется скоростью диффузии этой восстановленной формы медиатора к рабочему электроду, а не скоростью переноса электронов через границу раздела электрод/раствор.
В дополнение к этому, концентрация окисленной формы медиатора на противоэлектроде поддерживается на достаточно низком уровне для гарантирования того, что при протекании тока в электрохимической ячейке потенциал, а следовательно, и потенциал рабочего электрода не смещается настолько в катодном направлении, что потенциал рабочего электрода больше не находится в лимитируемой диффузией области. То есть концентрация окисленной формы на противоэлектроде должна быть достаточной для поддержания лимитируемого диффузией электроокисления восстановленной формы медиатора на рабочем электроде.
Поведение такой тонкослойной ячейки таково, что в том случае, если присутствуют и окисленная, и восстановленная формы окислительно-восстановительной пары, в конце концов устанавливается стационарный профиль концентрации от края до края ячейки. Это приводит в результате к установившемуся (стационарному) току. При этом было обнаружено, что путем сравнения меры установившегося тока с той скоростью, с которой ток варьируется в переходном (неустановившемся) токовом процессе перед тем, как достигнуто стационарное состояние, может быть измерен коэффициент диффузии окислительно-восстановительного медиатора, а также его концентрация.
Говоря более конкретно, в результате решения уравнений диффузии для этой ситуации может быть показано, что на протяжении ограниченного временного интервала график зависимости ln(i/i∞-1) от времени (измеренного в секундах) является линейным и имеет наклон (обозначенный как «S»), который равен -4π2D/l2, где «i» представляет собой ток в момент времени «t», «i∞» представляет собой установившийся ток, «D» представляет собой коэффициент диффузии в см2/с, «l» представляет собой расстояние между электродами в сантиметрах (см), а «π» составляет приблизительно 3,14159. Концентрация присутствующего восстановленного медиатора при приложении потенциала между электродами задается как 2π2i∞/FAlS, где «F» представляет собой константу Фарадея, «А» представляет собой площадь рабочего электрода, а прочие символы имеют вышеуказанное значение. Поскольку в этой последней формуле используется наклон S, в нее входит измеренное значение коэффициента диффузии.
Так как l является константой для данной ячейки, измерение i как функции времени и i∞ позволяет вычислять значение коэффициента диффузии окислительно-восстановительного медиатора и определять концентрацию аналита.
Более того, такое определение концентрации аналита скомпенсировано по отклонениям коэффициента диффузии того вещества, которое подвергается электроокислению или электровосстановлению на рабочем электроде. Изменения значения коэффициента диффузии могут происходить в результате изменений температуры или вязкости раствора или разброса в проницаемости мембраны. Могут оказаться необходимыми другие корректировки измеренного значения концентрации для того, чтобы учесть прочие факторы, такие как изменения геометрии ячейки, изменения химического состава фермента или иные факторы, которые могут оказывать влияние на измеряемую концентрацию. Если измерения выполняют на плазме, по существу свободной от гематокрита (который, если он присутствует, вызывает отклонения в коэффициенте диффузии окислительно-восстановительного медиатора), точность этого способа дополнительно улучшается.
Каждый из электродов 5', 6' имеет заранее заданную площадь. В вариантах реализации по фиг.1' -4' зона 4' ячейки ограничена кромками 9', 10', 11' мембраны, которые соответствуют кромкам электродов 5', 6', и передними (по отношению к целевой области 7') кромками 12', 13' электродов. В данном примере электроды имеют толщину в примерно 600 ангстрем и ширину от 1 до 5 мм.
В необязательном порядке обе стороны мембраны за исключением целевой области 7' закрыты ламинированными слоями 14' (не представленными на видах сверху и снизу), которые служат для предотвращения испарения воды из пробы и для придания устройству механической жесткости. Испарение воды является нежелательным, поскольку оно концентрирует пробу, дает возможность электродам высохнуть и дает возможность раствору охладиться, влияя на коэффициент диффузии и замедляя кинетику реакции фермента, хотя коэффициент диффузии может быть оценен согласно указанному выше.
Второй вариант реализации согласно изобретению, показанный на фиг.5' и 6', отличается от первого варианта реализации включением в состав устройства второго рабочего электрода 25' и противоэлектрода 26' сравнения, образующих между собой зону 24' второй ячейки. В данном примере эти два дополнительных электрода также отделены друг от друга расстоянием менее 500 мкм. Эти дополнительные электроды 25', 26' расположены промежуточно между зоной 4' первой ячейки и целевой областью 7'. В этом варианте реализации окислительно-восстановительный медиатор содержится в мембране под или рядом с целевой областью 7' или промежуточно между целевой областью 7' и зоной 4' первой ячейки. Фермент содержится в мембране в зоне 4' первой ячейки и зоне 24' второй ячейки. Фермент не простирается во вторую ячейку 24'. В этом случае при введении крови в целевую область она растворяет окислительно-восстановительный медиатор. Она просачивается вдоль мембраны, так что вторая электрохимическая ячейка 24' содержит окислительно-восстановительный медиатор, аналит и сыворотку, включающую электрохимически мешающие вещества. В первую электрохимическую ячейку поступают медиатор, аналит, содержащая электрохимически мешающие вещества сыворотка и фермент. В этом случае потенциал прикладывают между к обоим рабочим электродам и противоэлектроду или противоэлектродам, но изменение тока во времени измеряют отдельно для каждой пары. Это обеспечивает возможность определения концентрации восстановленного медиатора в отсутствие аналита плюс концентрации электрохимически мешающих веществ во второй электрохимической ячейке и концентрации этих веществ плюс аналита в первой электрохимической ячейке. Вычитание одного значения из другого дает абсолютную концентрацию аналита.
То же самое преимущество достигается и при другой геометрии в варианте реализации по фиг.7' и 8', на который второй рабочий электрод и второй противоэлектрод сравнения образуют вторую ячейку 24' со стороны от целевой области 7', противоположной первой электрохимической ячейке 4'. В этом случае фермент может содержаться в полоске мембраны между целевой областью и ячейкой 4'. Окислительно-восстановительный медиатор может находиться поблизости от целевой области или между целевой областью и каждой ячейкой. Коэффициент диффузии медиатора понижается при наличии нерастворенного фермента, и поэтому конфигурация по фиг.7' и 8' обладает преимуществом, заключающимся в удерживании фермента вне тонкослойных ячеек и обеспечении возможности быстрого исследования (так как установившийся ток достигается более быстро). Кроме того, коэффициент диффузии окислительно-восстановительного медиатора в этом случае является одинаковым для обоих тонкослойных ячеек, что делает возможным более точное вычитание вклада мешающих веществ.
Хотя варианты реализации по фиг.1'-8' относятся к единичным сенсорам, будет понятно, что на единственной мембране может быть сформировано множество сенсоров, как показано в вариантах реализации по фиг.9'-11'. В этом случае электроды одного сенсора соединены проводящей связью с электродами смежного сенсора. Сенсоры могут быть использованы последовательно и отделены от полоски после использования.
В варианте реализации по фиг.9'-11' размеры электродов определяются в направлении диффузии (указанном стрелкой) шириной электрода в этом направлении. Эффективный размер электрода в направлении, поперечном относительно направления диффузии, ограничен между сжатыми объемными участками 16 мембраны таким образом, который более полно описан в совместно поданной заявке PCT/AU96/00210, раскрытие которой включено сюда посредством ссылки во всей своей полноте. Для ясности необязательный ламинированный слой 14' по фиг.1' на фиг.9'-11' не представлен.
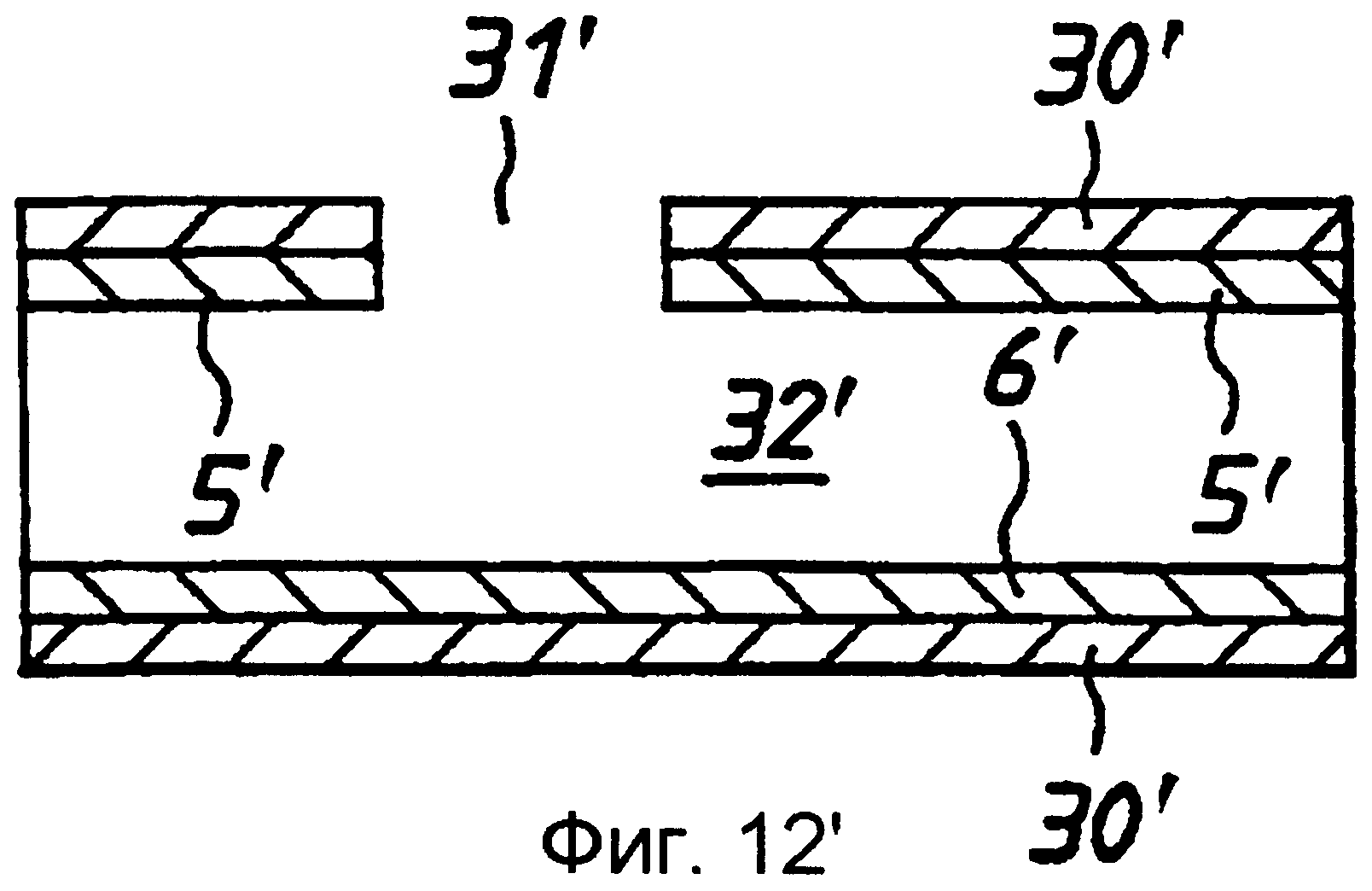
В варианте реализации по фиг.12 продемонстрирована полая ячейка согласно изобретению, в которой электроды 5', 6' поддерживаются отделенными друг от друга полимерными стенками 30' с образованием полой ячейки. На одной стороне этой ячейки предусмотрено отверстие 31', посредством которого в полость 32' может быть впущена проба. В этом варианте реализации мембрана не используется. Как и в предыдущих вариантах реализации, электроды отделены друг от друга расстоянием менее 500 мкм, предпочтительно - 20-400 мкм, а более предпочтительно - 20-200 мкм. Желательно, чтобы фактический объем ячейки составлял 1,5 микролитра или менее.
Как будет понятно, способ по изобретению может быть осуществлен с использованием ячейки, выполненной в соответствии с совместно поданной заявкой PCT/AU95/00207, или ячеек иной известной конструкции, при условии, что они модифицированы для обеспечения достаточно маленького расстояния между лицевыми поверхностями электродов.
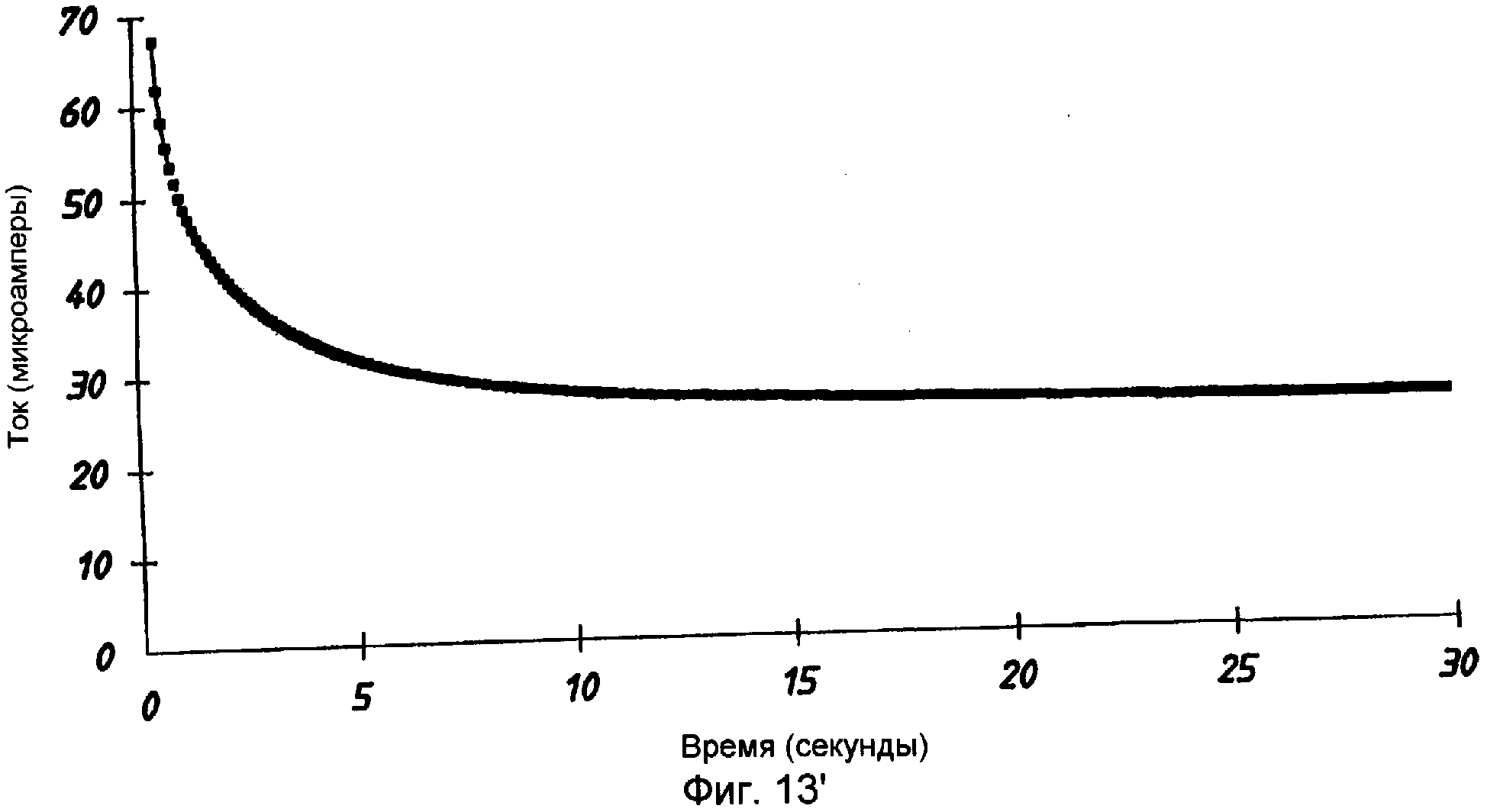
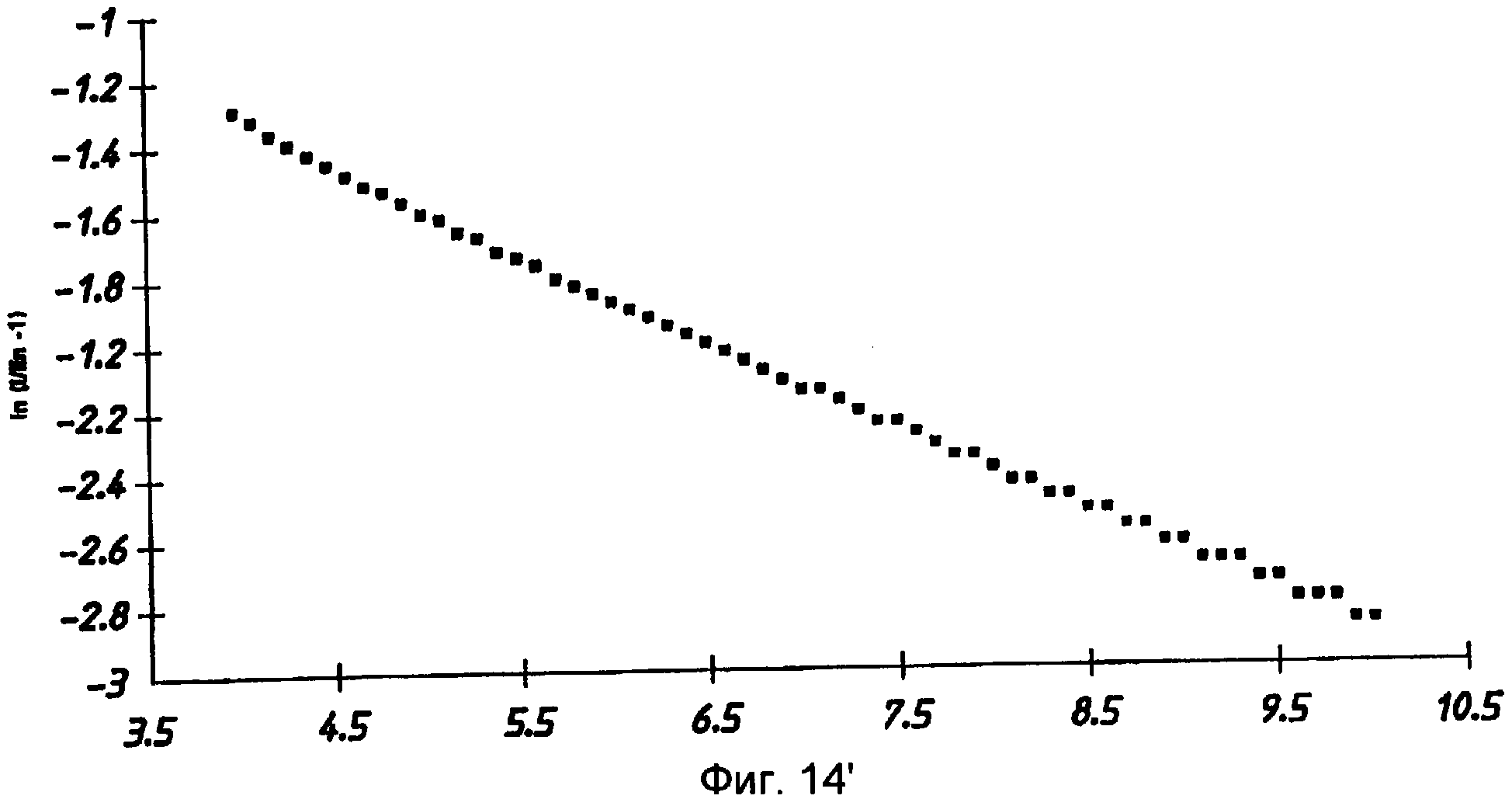
Далее на примере будет более подробно пояснен способ по изобретению со ссылкой на фиг.13' и 14'.
ПРИМЕР 1
Мембрану толщиной 130 микрон покрыли с обоих сторон слоем платины толщиной 60 нанометров. Ограничили область в 12,6 кв. мм путем сжатия мембраны. В эту ограниченную область ввели 1,5 микролитра раствора, содержавшего 0,2 моля феррицианида калия и 1% по массе глюкозооксидазы-дегидрогеназы, и дали возможность испариться воде.
Слои платины были затем подсоединены к потенциостату (регулятору напряжения) с тем, чтобы быть использованными в качестве рабочего электрода и противоэлектрода сравнения. На ограниченную область мембраны накапали 3,0 микролитра водного раствора, содержавшего 5 миллимолей D-глюкозы и 0,9 мас.% NaCl. По истечении 20 секунд между рабочим электродом и противоэлектродом сравнения приложили напряжение в 300 милливольт и регистрировали ток в течение следующих 30 секунд с интервалами в 0,1 секунды.
На фиг.13' показан график зависимости тока от времени, полученных в ходе указанных измерений. Используя значение установившегося тока в 26,9 миллиампера, вычислили функцию ln(i/26,9-1) и построили ее график в зависимости от времени. Наклон этого графика (фиг.14') составляет -0,342, что соответствует коэффициенту диффузии в 1,5×10-6 см2 в секунду и скорректированной (за вычетом фонового ферроцианида) концентрации глюкозы в 5,0 миллимоля.
Установившийся ток представляет собой ток, в значении которого во время исследования более не происходит никаких значительных изменений. Как будет понятно специалистам в данной области, может быть достигнут некоторый минимальный ток, после чего может иметь место некоторый дрейф из-за таких факторов, как боковая (поперечная) диффузия, испарение, мешающие электрохимические реакции или т.п. Однако на практике оценить этот «установившийся» ток (i∞) не представляет никакой сложности. Один из способов выполнения такой оценки подразумевает аппроксимацию начального значения на бесконечное время (i∞). Используя подгонку данных зависимости i от t к теоретической кривой, затем получают улучшенную оценку i∞. Эту процедуру повторяют методом реитераций до тех пор, пока измеренное значение и аппроксимированное значение не сойдутся до величины в пределах допустимого отклонения, таким образом получая оценочный ток i∞.
На практике измерения тока i с течением времени t выполняют между минимальным временем tмин и максимальным временем tмакс после того, как приложен потенциал. Минимальное и максимальное время определяются применимостью уравнений и могут быть легко определены с помощью эксперимента рутинного характера. Если желательно, исследование может быть повторено при выключении напряжения, когда профилям концентрации окислительно-восстановительного вещества дают возможностью возвратиться к их первоначальным состояниям.
Необходимо понимать, что анализ кривой ток-время с целью получения коэффициента диффузии и/или концентрации не ограничивается вышеизложенным способом и может быть осуществлен также другими способами.
Например, можно было бы проанализировать «раннюю» часть кривой ток-время согласно уравнению Коттрелла для получения значения D1/2 х С0 (С0=концентрации аналита) и проанализировать установившийся ток для получения значения D×С0. Эти два значения можно затем сравнить, с получением D и С0 по отдельности.
Будет понятно, что при практической реализации изобретения выдается электрический сигнал, который является показателем изменения тока во времени. Этот сигнал может быть аналоговым или цифровым или же может быть последовательностью сигналов, выдаваемых с заданными временными интервалами. Эти сигналы могут обрабатываться посредством микропроцессора или иной обычной схемы для выполнения необходимых вычислений в соответствии с «зашитыми» (хранимыми) алгоритмами с выдачей выходного сигнала, являющегося показателем соответственно коэффициента диффузии, концентрации аналита, концентрации гематокрита или т.п. Один или более таких выходных сигналов может отображаться посредством аналогового или цифрового устройства отображения (дисплея).
Также возможно при соответствующей конструкции ячейки эксплуатировать эту ячейку как ячейку истощения, измеряя ток, требуемый для расходования всего медиатора. Например, в случае варианта реализации по фиг.5' способ по изобретению может быть осуществлен с использованием электродов 5', 6', которые отделены друг от друга расстоянием менее 500 мкм. Амперометрическое или вольтамперометрическое измерение на истощение может быть выполнено с использованием электродов 5' и 26', которые отделены друг от друга расстоянием менее 500 мкм, и таким образом, что отсутствует мешающее влияние между окислительно-восстановительными веществами, определяемыми амперометрически на электродах 5' и 26'.
Измерение на истощение может быть выполнено до, во время или после измерения коэффициента диффузии способом по изобретению. Это позволяет получить существенное улучшение точности и воспроизводимости.
В описанных вариантах реализации мембрана предпочтительно представляет собой асимметричную пористую мембрану того типа, который описан в патентах США №4629563 и 4774039, которые оба включены сюда во всей их полноте посредством ссылки. Однако могут быть также применены симметричные пористые мембраны. Мембрана может быть выполнена в форме листа, трубки, полого волокна или иной подходящей форме.
В случае, если мембрана является асимметричной, целевая область предпочтительно находится на более открытой стороне такой асимметричной мембраны. Мембрана в несжатом состоянии желательным образом имеет толщину от 20 до 500 мкм. Минимальная толщина выбирается с учетом скорости, чувствительности, точности и стоимости. Если это желательно, может быть применен гель для отделения гематокрита от GOD. Этот гель может присутствовать между электродами и/или в пространстве между областью нанесения пробы и электродами.
Рабочий электрод выполняют из любого подходящего металла, например золота, серебра, платины, палладия, иридия, свинца, походящего сплава. Рабочий электрод может быть сформирован предварительно или же сформирован на месте (in situ) любым подходящим способом, например ионным распылением, испарением под частичным вакуумом, безэлектродным осаждением (нанесение покрытия методом химического восстановления), электроосаждением или т.п. Для выполнения электрода могут быть также использованы подходящие неметаллические проводники, например проводящие полимеры, такие как полипиррол, полианилин, порфириновые «провода», полиизопрен и допированный йодом поли-цис-бутадиен и «лестничные полимеры». Иные неметаллические электроды могут быть из графита, смешанного со связующим угля или карбопласта. Могут также использоваться неорганические электроды, такие как In2 О3или SnO2.
Противоэлектрод сравнения может быть, например, сходным по конструкции с рабочим электродом. Для формирования противоэлектрода сравнения могут быть также использованы гидроксид никеля или галогенид серебра. Может использоваться хлорид серебра, но будет понятно, что хлоридизация может оказаться необязательной в том случае, если хлорид-ионы присутствуют в пробе крови. Несмотря на то, что в описанных вариантах реализации рабочий электрод показан на верхней поверхности биосенсора, а противоэлектрод сравнения - на нижней поверхности, они могут быть расположены наоборот.
Является предпочтительным, чтобы рабочий электрод и противоэлектрод (или противоэлектрод сравнения) имели по существу одинаковую эффективную геометрическую площадь.
Если используются отдельные электрод сравнения и противоэлектрод, они могут иметь сходную конструкцию. Электрод сравнения может находиться в любом подходящем месте.
Будет понятно, что признаки одного описанного ранее варианта реализации могут быть скомбинированы с признаками другого варианта. Изобретение не ограничивается использованием какого-либо конкретного сочетания фермента и медиатора, и могут быть также использованы такие сочетания, как описанные в ЕР 0351892 или где-либо еще. Эта система может быть применена для определения иных аналитов, чем глюкоза (например, холестерина) путем соответствующей адаптации реагентов и путем выбора подходящей мембраны. Эта система может быть также приспособлена для применения с иными средами, чем кровь. Например, предложенный способ может быть применен для определения концентрации загрязнителей, таких как хлор, железо, свинец, кадмий, медь и т.д., в воде.
Хотя описанные здесь ячейки имеют в целом плоские и параллельные электроды, будет понятно, что могут использоваться и иные конфигурации, например один электрод может представлять собой стержень или иглу, а другой - концентрическую втулку.
Специалистам в данной области из приведенного изложения будет очевидно, что изобретение может быть реализовано в других формах без отклонения от раскрытого здесь изобретательского замысла.
Реферат
Устройство для определения концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества в жидкой пробе содержит полую электрохимическую ячейку, имеющую рабочий электрод и противоэлектрод или противоэлектрод сравнения, при этом рабочий электрод отделен от противоэлектрода или противоэлектрода сравнения расстоянием менее 500 мкм; средство для приложения разности электрических потенциалов между электродами; средство для электрохимического определения концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества в жидкой пробе. Средство для электрохимического определения концентрации восстановленной формы или окисленной формы содержит средство для определения изменения тока во времени после приложения разности электрических потенциалов и перед достижением установившегося тока; средство для оценки величины установившегося тока; и средство для получения, исходя из изменения тока во времени и величины установившегося тока, величины, являющейся показателем концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества. Также предложен способ для определения концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества в жидкой пробе. Предложенные устройство и способ обеспечивают повышенные точность и/или достоверность, и/или скорость. 2 н. и 10 з.п. ф-лы, 29 ил.

Комментарии