Стереоизбирательное микробное восстановление рацемического тетралона (его варианты) - RU2235784C2
Код документа: RU2235784C2
Описание
Данное изобретение относится к новым способам получения (4S)-энантиомера 4-(3,4-дихлорфенил)-3, 4-дигидро-1(2Н)-нафталенона (в дальнейшем также упоминаемого как "хиральный тетралон" или (4S)-тетралон") и, более специфично, относится к стереоизбирательному микробному восстановлению рацемического 4-(3,4-дихлорфенил)-3,4-дигидро-1(2Н) нафталенона (в дальнейшем упоминаемого как "рацемический тетралон") до хирального тетралона.
Хиральный тетралон, полученный согласно способам данного изобретения, в дальнейшем вступает в реакцию с образованием чистого цис-(1S)(4S)-N-метил-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамина, обычно называемого сертралин. Известно, что сертралин полезен, например, как антидерпессант и как анорексический агент, а также при лечении лекарственных зависимостей, связанных со страхом расстройств преждевременного семяизвержения, рака и состояния после инфаркта миокарда.
В данной области известны способы получения сертралина, такие, например, как способы, описанные в патентах США №4536518; 4777288; 4839104; 4855500; 4940731; 4962128; 5082970; 5130338; 5196607; 5248699; 5442116; 5463126; 5466880; 5597826 и 5750794 и в статье W.M. Welch, Jr. et аl., опубликованной в Journal of Medical Chemistry, Vol.27, №11, p.1508 (1984).
Некоторые из вышеупомянутых патентов относятся к синтезу смесей цис- и транс-изомеров рацемического N-метил-4-(3,4--дихлорфенил)-1,2, 3,4-тетрагидро-1-нафталинамина. Как описывают в этих патентах, цис- и транс-изомеры, также как и их (S)- и (R)-энантиомеры, разделяют с помощью способов, известных специалистам в данной области, включающих, например, дробную кристаллизацию или хроматографию.
Известно, что производят выбор в конечном счете требуемой хиральности в начале синтеза сертралина. Например, вышеупомянутый патент США №5750794 описывает способ получения хирального тетралона посредством реакции рацемического тетралона с асимметрическим кетонным восстанавливающим агентом, чтобы получить соответствующие цис- и транс-спирты в зависимости от хиральности употребляемого асимметрического реагента, а затем разделения спиртов и окисления (1S, 4R)-спиртов до (4S)-тетралона.
Также в данной области известно, что хиральные соединения синтезируют, используя микроорганизмы, такие как грибы, например дрожжи. Например, хорошо известно применение дрожжей для восстановления кетонов до хиральных спиртов. Однако, как понимают специалисты в данной области, химический и оптический выход, например, отдельных энантиомеров и их количества при таком микробном восстановлении обычно существенно варьирует в зависимости, например, от выбранного определенного микроорганизма, а также от заменителей исходного материала.
В патенте США №5049497 описан способ расщепления рацемического производного бицикло [4.2.0]октана при взаимодействии этого производного с пекарскими дрожжами в условиях, достаточных для получения смеси кетона и спирта высокой степени чистоты энантиомера. Как описывают, только один энантиомер представленного рацемического кетона восстанавливают до получения спирта.
В патенте США №5580764 описан способ асимметрического восстановления, в котором используют интактный микроорганизм или препарат его разрушенных клеток для превращения циклического кетона до соответствующего хирального спирта.
Патент США №5618707 описывает способ стереоизбирательного восстановления кетонных субстратов посредством добавления субстратов в культуральный бульон, либо Zygosaccharomyces bailii ATCC (American Type Culture Collection) №38924, либо Schizosaccharomyces octosporus ATCC №2479, инкубируя полученную смесь и изолируя гидрокси-соединение с помощью общепринятых способов, таких, например, как экстракция органическими растворителями, адсорбция на смолах или хроматография, для последующего применения в качестве промежуточного соединения при получении агента, снижающего холестерин сыворотки. Описанное в изобретении изолированное гидрокси-соединение анализируют посредством хиральной высокоэффективной жидкостной хроматографии (НРLС=ВЭЖХ), ВЭЖХ с обращенной фазой или обоими способами.
В соответствии с предположением одного из специалистов в данной области, которое описывают в изобретении, множество из большого числа микроорганизмов, которые исследуют в отношении их способности восстанавливать кетонную группу выбранного субстрата, не в состоянии восстанавливать кетонную группу с требуемой специфичностью и продуктивностью.
В настоящее время установлено, что ряд микроорганизмов, включая грибы, например дрожжи и актиномицеты, по существу, стереоизбирательно восстанавливает рацемический тетралон. Более специфично, представляемое стереоизбирательное микробное восстановление избирательно восстанавливает (4R)-тетралон рацемической смеси, в то же время оставляя по существу непрореагировавшим (4S)-тетралон. Поэтому ненужный (4R)-тетралол, полученный согласно осуществляемому способу, окисляют, а затем рацемизируют до рацемического тетралона и осуществляемый способ повторяют, чтобы получить еще больше (4S)-тетралона. Полученный в соответствии с данным способом (4S)-тетралон используют в синтезе сертралина.
Все документы, цитируемые в изобретении, включая предшествующие, цитируют во всей их полноте.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
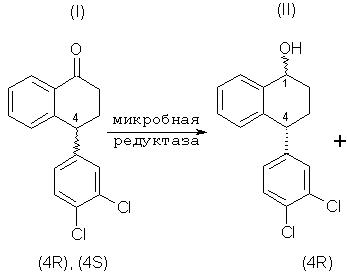
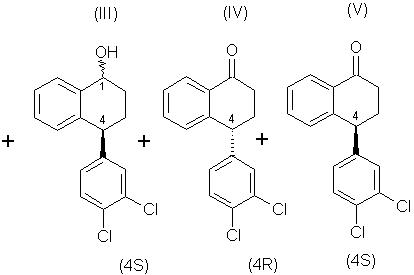
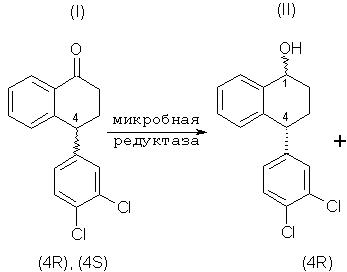
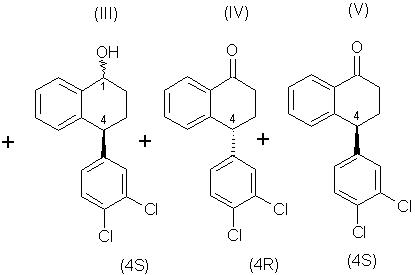
Данное изобретение относится к микробиологическому восстановлению карьонильных групп, которое включает в себя взаимодействие кетонного соединения, рацемического тетралона формулы (I), с микроорганизмом или ферментной системой восстановления, способной осуществлять требуемое восстановление, включающей фермент, полученный из указанного микроорганизма, и кофактор для указанного фермента, и инкубацию полученной смеси при соответствующих условиях, так что соединение, имеющее требуемую стереохимию, (4S)-тетралон формулы (V), ниже, остается по существу непрореагировавшим. (4S)-тетралон формулы (V), ниже, то есть хиральный тетралон, можно затем изолировать с помощью любого соответствующего способа, например хроматографии или кристаллизации. Кроме того, (4R)-тетралол формулы (II) может быть отделен от соединений формул (III)-(V), окислен и рацемизирован до рацемического тетралона, и проводимое стереоизбирательное микробное восстановление повторяют, чтобы получить в результате еще больше требуемого хирального кетона.
Соответственно, данное изобретение обеспечивает способы осуществления следующего стереоспецифического микробного восстановления:
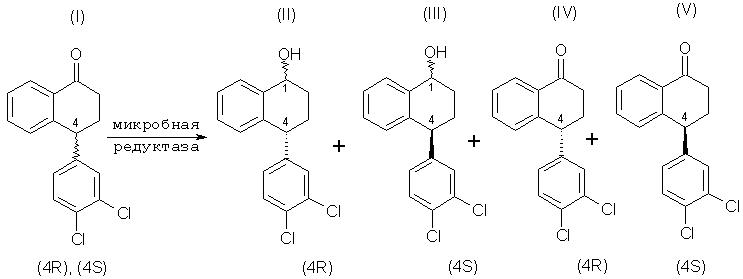
которое включает в себя взаимодействие соединения формулы (I) с микроорганизмом или ферментной системой восстановления, способной осуществить представляемое восстановление и включающей в себя фермент, полученный из вышеназванного микроорганизма, и кофактор для указанного фермента, и инкубацию полученной смеси в условиях, удовлетворительных для получения больше соединения формулы (II), чем соединения формулы (III), таким образом, в результате остается больше непрореагировавшего соединения формулы (V), чем непрореагировавшего соединения формулы (IV).
Проводимое стереоспецифическое восстановление также представляют в виде

что включает в себя взаимодействие соединения формулы (I) с микроорганизмом или ферментной системой восстановления, способной осуществить представляемое восстановление, состоящей из фермента, извлеченного из вышеупомянутого микроорганизма, и кофактора для вышеназванного фермента, и инкубацию полученной смеси в условиях, удовлетворительных для получения (4R)-тетралола формулы (II) и оставления, по существу, непрореагировавшего (4S)-тетралона формулы (V).
Стереоизбирательное восстановление, далее, необязательно включает отделение (4S)-тетралона формулы (V) от (4R)-тетралола формулы (II). (4R)-тетралол затем окисляют до получения (4R)-тетралона, который потом реагирует, например, с основанием с образованием рацемического тетралона формулы (I), а представляемое стереоизбирательное микробное восстановление повторяют, чтобы получить в результате еще больше требуемого (4S)-тетралона формулы (II), то есть (4S)-энантиомера рацемического тетралона формулы (I).
Данное изобретение предлагает способы, которые включают в себя стереоизбирательное микробное восстановление соединения формулы (I) до соединения формулы (II) посредством: взаимодействия соединения формулы (I) с микроорганизмом или ферментной системой восстановления, способной осуществить представляемое восстановление, состоящей из фермента, изолированного из вышеназванного микроорганизма, и кофактора для вышеупомянутого фермента, и инкубации полученной смеси в условиях, удовлетворительных для получения соединения формулы (II), при этом существенно больше остается непрореагировавшего соединения формулы (V), чем соединения формулы (IV), и получают значительно больше соединения формулы (II), чем соединения формулы (III).
В предпочтительном аспекте взаимодействие соединения формулы (I) происходит с ферментной системой восстановления. В другом предпочтительном аспекте изобретения взаимодействие соединения формулы (I) происходит с ферментной системой восстановления, где фермент иммобилизован. В особенно предпочтительном аспекте взаимодействие соединения (I) происходит с ферментной системой восстановления, полученной из Hansenula polymorpha ATCC №26012.
В следующем предпочтительном аспекте изобретения микроорганизм представляет собой препарат в виде разрушенных клеток. В еще одном предпочтительном аспекте микроорганизм представляет собой ацетоновый порошок его ферментного препарата.
В особенно предпочтительном аспекте данного изобретения используют интактный микроорганизм. В предпочтительном аспекте, в котором микроорганизм представляет собой интактный микроорганизм, соединение формулы (I) взаимодействует со средой ферментации, бульонной культурой или растворителем, содержащим микроорганизм. В другом предпочтительном аспекте, в котором микроорганизм представляет собой интактный микроорганизм, соединение формулы (I) взаимодействует с отмытым интактным микроорганизмом. В еще одном предпочтительном аспекте, в котором микроорганизм является интактным, соединение формулы (I) взаимодействует с иммобилизованным интактным микроорганизмом.
В особо предпочтительном аспекте данного изобретения микроорганизм представляет собой интактный микроорганизм, который выращивают в ферментационной среде, а взаимодействие происходит при добавлении в среду соединения формулы (I).
В другом особенно предпочтительном аспекте данного изобретения микроорганизм является интактным микроорганизмом, который выращивают в культивационной среде в течение приблизительно сорока восьми часов, и взаимодействие происходит в такой культивационной среде при добавлении в нее соединения формулы (I), а инкубацию проводят приблизительно в течение пяти дней.
В еще одном предпочтительном аспекте данного изобретения микроорганизм представляет собой или грибы, например дрожжи, или актиномицеты, или их мутанты, которые осуществляют стереоизбирательное восстановление.
В другом предпочтительном аспекте данного изобретения микроорганизм представляет собой грибы. В еще одном предпочтительном аспекте, в котором микроорганизм представляет собой грибы, грибы являются Absidia coerulea АТСС №20137.
В наиболее предпочтительном аспекте данного изобретения микроорганизм представляет собой дрожжи. В особенно предпочтительном аспекте данного изобретения, в котором микроорганизм представляет собой дрожжи, дрожжи являются Hansenula polymorpha ATCC №26012, также депонированные как АТСС №74449.
Когда Hansenula polymorpha ATCC №26012, также депонированные как АТСС №74449, употребляют в качестве микроорганизма, проводимое стереоизбирательное микробное восстановление существенно восстанавливает только один энантиомер соединения формулы (I) до получения соответствующего спирта, то есть соединения формулы (II), оставляя в то же время энантиомер соединения формулы (I), то есть соединение формулы (V), по существу, непрореагировавшим.
Как обсуждалось ранее, способы данного изобретения далее необязательно включают отделение, например, с использованием кристаллизации или хроматографии соединения формулы (V) от соединений формул (II)-(IV) и применение такого отделенного соединения формулы (V) в синтезе сертралина, используя любые известные способы синтеза.
Как также обсуждалось ранее, предпочтительно окисляют изолированный (4R)-тетралол формулы (II) до (4R)-тетралона формулы (IV). Затем далее предпочитают рацемизировать, предпочтительно посредством реакции (4R)-тетралона с основанием, (4R)-тетралона формулы (IV) до рацемического тетралона формулы (I). Окисление и рацемизация возвращают в повторный цикл нежелательный (4R)-тетралол для другого цикла стереоизбирательного микробного восстановления согласно способам данного изобретения. Рециркуляция нежелательного (4R)-тетралола увеличивает количество требуемого (4S)-тетралона и уменьшает количество отбрасываемого ненужного (4R)-тетралола. Окисление и рацемизацию окисленного продукта проводят, используя для этого любые соответствующие известные способы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для специалистов в данной области совершенно понятны термины, используемые для описания данного изобретения; тем не менее ниже приводятся термины, применяемые в описании настоящего изобретения.
“Кофактор” означает любой приемлемый кофактор, содержащий ферментную систему восстановления, такую, например, как NADH, NADPH, FADH, FMNH и/или PQQ, или любой соответствующий кофактор, который имеется с ферментом в микроорганизме.
“Ферментная система восстановления” подразумевает приемлемый микробный фермент оксидоредуктазу и восстановленную форму кофактора для оксидоредуктазного фермента, где кофактор или получают из выбранного микроорганизма, или из любого соответствующего источника. Фермент, включающий ферментную систему восстановления, находится или в свободной, или в иммобилизованной форме, например, на колонке или присоединен к гранулам.
“Микробное восстановление” означает стереоизбирательное восстановление данного изобретения, которого достигают с помощью ферментной системы восстановления, микробной редуктазы, содержащей ферментную систему восстановления, интактного микроорганизма или любого его препарата, и им подобное.
“Микроорганизм” включает в себя любой интактный микроорганизм или его препарат, включающий в себя, например, препарат разрушенных клеток организма; обезвоженный препарат микроорганизма; например, ацетоновый порошок ферментного препарата; микроорганизм, отмытый, например, от ферментной среды, культурального бульона и подобного; микроорганизм, иммобилизованный, например, на колонке, присоединенный к гранулам, и им подобное.
Представляемые данным изобретением способы включают в себя стереоизбирательное микробное восстановление соединения формулы (I) до соединения формулы (II):
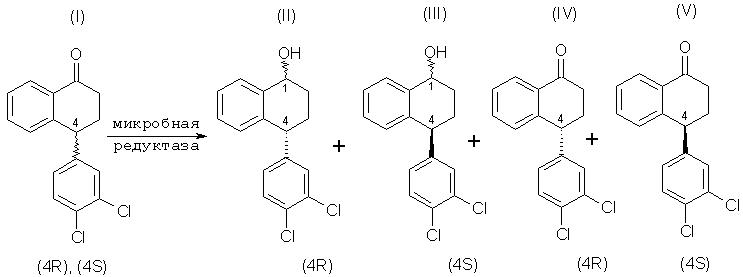
Посредством взаимодействия соединения формулы (I) с микроорганизмом или ферментной системой восстановления, осуществляющей представляемое восстановление, содержащей фермент, полученный из указанного микроорганизма, и кофактор для указанного фермента, и инкубации полученной смеси в условиях, приемлемых для образования соединения формулы (II), существенно больше остается невосстановленным соединение формулы (V), чем соединение формулы (IV), и существенно больше образуется соединения формулы (II), чем соединения формулы (III).
Специалистам в данной области ясно, что соединение формулы (I), рацемический тетралон, является смесью (4S)-тетралона и (4R)-тетралона, что показано ниже:
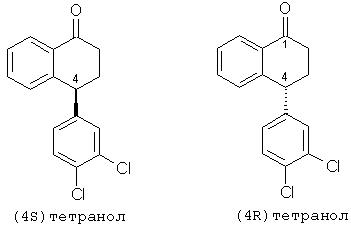
Соединения, или более определенно, тетралолы формулы (II) представляют собой

Соединения, или более определенно, тетралолы формулы (III) представляют собой

Соединения формул (II) и (III) описаны и заявлены в формуле изобретения в вышеупомянутом патенте США №5750794.
Требуемое соединение формулы (V) отделяют, как описано ниже, от нежелательных соединений формулы (II) и любого из соединений формул (III) или (IV), которые или вступают в реакцию, или остаются непрореагировавшими, соответственно, в зависимости, например, от выбранного микроорганизма и условий инкубации.
Соединения формулы (II) можно превратить в соединение формулы (I), например, окислением и рацемизацией и подвергнуть стереоизбирательному микробному восстановлению, чтобы получить в результате еще некоторое количество (4S)-тетралона формулы (V).
Способ данного изобретения легко осуществим. Так, микроорганизм или подвергают брожению (интактный микроорганизм), или инкубируют (препарат разрушенных клеток, дегидратированный препарат или любой другой соответствующий препарат микроорганизма) в присутствии рацемического тетралона, представленного формулой (I), чтобы модифицировать рацемический тетралон, и более специфично, чтобы восстановить нежелательный (4R)-энантиомер рацемического кетона до его соответствующего спирта, представленного формулой (II), при этом оставляя требуемый (4S)-энантиомер, представленный формулой (V), по существу непрореагировавшим, и в результате в одну стадию получают оптически обогащенный (4S)-энантиомер. Затем (4S)-энантиомер может быть далее введен в реакцию согласно способам, хорошо известным специалистам в данной области, таким, какие описаны, например, в вышеупомянутых патентах США №4536518; 4777288; 4839104; 4855500; 4940731; 4962128; 5082970; 5130338; 5196607; 5248699; 5442116; 5463126; 5466880; 5597826 и 5750794 и в вышеупомянутой статье W.M. Welch, Jr.et al., с получением в конечном счете сертралина.
Активность, способы определения активности, дозировки, дозированные формы, способы введения и предшествующая информация относительно сертралина изложены, например, в вышеупомянутых патентах США №4536518; 4777288 и 4839104 и в вышеназванной статье W.M. Welch, Jr. et al.
В способе данного изобретения используют любые приемлемые микроорганизмы. Как описано, используемый в представляемом способе микроорганизм может быть интактным или любым приемлемым препаратом, например препаратом разрушенных клеток, обезвоженным препаратом, и может быть либо свободным, либо иммобилизованным. Однако, когда в данном изобретении употребляют неинтактный микроорганизм, такой, например, как препарат разрушенных клеток, к примеру, клеточный экстракт, ацетоновый порошок ферментного препарата или фермент, полученный из микроорганизма, специалистам в данной области очевидно, что сюда входит также кофактор для фермента.
Из описаний, представленных в изобретении, и собственных данных специалисты в данной области понимают, как получают соответствующий препарат разрушенных клеток, такой, как описан, например, R.N. Patel et al. в статье “Oxidation of Secondary Alcohols to Methyl Ketones by Yeasts”, опубликованной в Applied and Environmental Microbiology, 38(2): 219-223 (1979).
Специалисты в данной области из описания, представленного в изобретении, и собственных подобных сведений понимают, как получают ацетоновый порошок ферментного препарата, такой, как описан, например, К. Nakamura et al. в статье “Asymmetric Reduction of Ketones by the Acetone Powder of Geotrichum candidum”, опубликованной в Tetrahedron Letters, 37(10): 1629-1632 (1996).
Кроме того, в представляемых способах может быть также использован фермент (например, оксидоредуктаза) из любого приемлемого микроорганизма, и этот фермент выделяют из микроорганизма с помощью любого приемлемого способа, известного специалистам в данной области, а что касается интактного микроорганизма, то он используется в представляемом способе либо в свободной, либо в иммобилизованной форме. Из описания, представленного в изобретении, и из собственных данных специалисты в данной области понимают, как выделить и очистить фермент из соответствующего микроорганизма, например, как описано в статьях: М. Wada et al., "Purification and Characterization of NADPH-Dependent Carbonyl Reductase, Involved in Stereoselective Reduction of Ethyl 4-Chloro-3-oxobutanoate, from Candida magnoliae", опубликованной в Biosci. Biotechnol. Biochem, 62(2): 280-285 (1998), P. Trost et al., "Purification and Properties of NAP(P)H: (quinone-acceptor) oxidoreductase of sugarbeet cells", опубликованной в Eur. J. Biochem., 234: 452-458 (1995), К.М. Madyastha and T.L. Gururaja, "Purification and Some of the Properties of a Novel Secondary Alcohol Dehydrogenase from Alcaligenes eutrophus", опубликованной в Biochemical and Biophysical Research Communications, 211(2): 540-546 (1995), O. Bortolini et al., "Kinetic resolution of vic-diols by Bacillus stearothermophilus diacetyl reductase", опубликованной в Tetrahedron Asymmetry, 9: 647-651 (1998); R.N. Patel et al. "Stereospecific microbial reduction of 4, 5-dihydro-4-(4-methoxyphenyl)-6-(trifluromethyl-lH-1)-benzazepin-2-onе", опубликованной в Enzyme Microb Technol., 3: 906-912 (1991) и R.N. Patel et al. "Stereoselective microbial/enzymatic oxidation of (exo, exo)-7-oxabicyclo [2.2.1] heptane-2,3-dimethanol to the corresponding chiral lactol and lactone", опубликованной в Enzyme Microb Technol. 14: 778-784 (1992) и в патенте США №5523223 и вышеупомянутом №580764.
Приемлемые микроорганизмы включают в себя Hansenula polymorpha ATCC №26012, Hansenula polymorpha ATCC №74449, Absidia coerulea ATCC №20137, Geotrichum candidum ATCC №34614, Geotrichum candidum ATCC №62401, Mortierella isabellina ATCC №42613, Mortierella isabellina ATCC №38063, Mortierella vinacea ATCC №09515, Penicillium notatum ATCC №36740, Blastoschizomyces capitatus ATCC №28575, Monosporium olivaceum v. major ATCC №36300, Aureobasidium pullulans ATCC №16623, Debaryomyces polymorphus ATCC №20280, Saccharomyces cerevisiae ATCC №15248, Candida schataii ATCC №24409, Pichia fabianii ATCC №16755 и Streptomyces rimosus ss. rimosus ATCC №10970 и их мутанты, которые известны или другим образом доступны специалистам в данной области, и, несмотря на такую мутацию, осуществляют стереоизбирательное микробное восстановление, описанное в изобретении.
Предпочтительными интактными микроорганизмами являются такие, которые в основном восстанавливают (4R)-тетралон, оставляя по существу неппрореагировавшим (4R)-тетралон, под реакцией подразумевается восстановление или любая другая собственная активность, которая может способствовать деградации или иным способом негативно воздействовать на требуемый (4R)-тетралон на любой стадии представляемого способа. Как понимают специалисты в данной области из приведенного в изобретении объяснения, такую нежелательную реакцию (4R)-тетралона, по существу, предотвращают, например, используя фермент, выделенный из выбранного микроорганизма, вместо интактного микроорганизма.
Микроорганизмы, приемлемые для применения в представляемом стереоспецифическом микробном восстановлении, получают любым приемлемым способом, известным специалистам в данной области.
Пример приемлемого способа получения микроорганизма из коммерчески приобретенного штамма представлен ниже. Представленный ниже способ применяют для любого микроорганизма, приемлемого для использования в способе данного изобретения, а специалистам в данной области из предлагаемого в изобретении описания должно быть понятно, как модифицировать любую часть процедуры, например способ получения микроорганизма интактного или препарата, например разрушенную или обезвоженную клетку, свободную или иммобилизованную; способ получения соответствующего фермента, извлеченного из таких микроорганизмов; способ взаимодействия рацемического тетралона с микроорганизмом или ферментом, содержащим ферментную систему восстановления, изолированную из микроорганизма; компоненты среды для выращивания и условия, например температуру, рН и им подобное; или условия инкубации; для достижения требуемого результата посредством любого из способов.
Специалисты в данной области из описания, представленного в изобретении, и собственных знаний понимают, как получить приемлемый иммобилизованный интактный микроорганим, такой, как описан, например, A. Bfuer et al. в статье "Polyvinyl alcohol-immobilized whole-cell preparations for biotransormation of nitrites", опубликованной в Biotechnology Letters, 18 (3): 343-348 (март 1996).
В данном изобретении используют любой приемлемый способ взаимодействия соединения формулы (I) с микроорганизмом или ферментной системой восстановления. Соединение формулы (I) взаимодействует с микроорганизмом или ферментной системой восстановления в любой приемлемой последовательности.
Например, соединение формулы (I) добавляют в среду, такую как культивированный бульон, содержащую микроорганизм, свободный или иммобилизованный, или их некое сочетание; или среда содержит соединение формулы (I), а затем в такую среду добавляют микроорганизм; или соединение формулы (I) и микроорганизм добавляют вместе в такую среду; или соединение формулы (I) добавляют к препарату разрушенных клеток микроорганизма; или соединение формулы (I) добавляют к обезвоженному препарату микроорганизма; или либо соединение формулы (I), либо микроорганизм, либо ферментную систему восстановления добавляют в приемлемый растворитель, содержащий другие компоненты; и тому подобное. Из представленного в изобретении описания специалисты в данной области понимают, как в соответствии с необходимостью модифицировать любую часть предлагаемого способа.
В данном изобретении особенно предпочтительно получение микроорганизма или ферментной системы восстановления из Hansenula polymorpha ATCC 26012. Лиофилизированный образец Hansenula polymorpha ATCC 26012 (первоначально предоставленный D.W. Levine) депонирован в ATCC, находящийся в США, 10801 University Boulevard, Manassas, Virginia, 20110-2209, по условиям Будапештского договора от 26 июня 1998. Эта вновь депонированная культура получила новый депозитный номер ATCC №74449. Следовательно, в данном изобретении особенно предпочтительным является то, что микроорганизм оказывается Hansenula polymorpha ATCC №74449. Все ограничения на возможность публикации этой депонированной культуры микроорганизма будут окончательно сняты.
Культуры Hansenula polymorpha ATCC №26012 могут быть получены из ATCC, и пример соответствующего способа их приготовления из такого коммерчески приобретенного штамма представлен непосредственно ниже.
Полученную культуру добавляют в приемлемую среду для выращивания и, пока происходит рост, инкубируют при встряхивании; обе эти стадии могут быть оценены специалистами в данной области. Полученную таким образом культуру используют для высевания на скошенных агарах с замораживанием порций этих скошенных агаров в качестве исходных линий. Альтернативно, готовят жидкие культуры, к которым добавляют глицерин приблизительно от 10% до 20%, которые затем замораживают приблизительно при -80° С предпочтительно в небольших пробирках для замораживания.
Как ясно специалистам в данной области, для любого выбранного микроорганизма, и в особенности как предусматривается в дальнейшем в примерах, для Absidia coeruela ATCC №20137 и особенно предпочтитеьно для Hansenula polymorpha ATCC №26012 или ATCC №74449 приемлемый способ получения микроорганизма заключается в следующем: микрорганизм из культуры замороженного образца высевают, как описано выше (приблизительно 17% глицеринового образца), в колбу или стеклянную пробирку с металлической перегородкой, содержащей среду для выращивания (содержащую аликвоту из стерильного раствора, который содержит Твин ® 80, глицерин и дистиллированную воду), состав которой описан ниже более подробно. Ферментацию проводят при температурах, колеблющихся приблизительно от 22° С до 32° С и предпочтительно приблизительно при 29° С, при соответствующем встряхивании предпочтительно приблизительно от 200 оборотов в минуту и наиболее предпочтительно при 210 оборотах в минуту. В случае необходимости поддерживают рН среды для выращивания, используя соотетствующие буферы, включенные в среду ферментации, и/или периодически регулируют добавлением основания или кислоты в соответствии с необходимостью.
Любую приемлемую продолжительность роста микроорганизма, взаимодействия микроорганизма с соединением формулы (I) и инкубации соединения формулы (I) с микроорганизмом применяют в данном изобретении. Соответствующего роста микроорганизма достигают, например, в течение приблизительно 24 часов - время, в течение которого в культуру можно добавить приемлемую аликвоту раствора рацемического тетралона в соответствующем растворителе, предпочтительно в этаноле. Ферментацию затем можно продолжить, например, приблизительно от двух до шести дней, а предпочтительно, например, в течение приблизительно пяти дней, во время которых ферментационный бульон может быть экстрагирован при использовании любого приемлемого способа экстракции, при этом приемлемый растворитель, такой, например, как этилацетат, метилизобутилкетон, метилэтилкетон, хлористый метилен и подобные, предпочтительно этилацетат, удаляет органические компоненты из ферментационного бульона. После экстракции ферментационного бульона и разделения органической и водной фаз определяют соединения, содержащие органический остаток, используя любой подходящий способ, такой, например, как хроматографию, предпочтительно хиральную ВЭЖХ.
В способе данного изобретения используют любую приемлемую среду для выращивания, а приемлемая среда для выращивания содержит источник или источники усвояемого углерода, усвояемого азота и неорганические соли, содержащие незаменимые минералы. Обычно большинство углеводов, таких, например, как глюкоза, мальтоза, манноза, сахароза, крахмал, глицерин, желе семян проса, меласса, бобы сои и им подобные, используют в качестве источника усвояемого углерода. Источники усвояемого азота включают в себя, например, такие материалы, как дрожжи и гидролизаты казеина, первичные дрожжи, дрожжевые экстракты, муку семян хлопка, сухой остаток бобов сои, зародыши пшеницы, мясные экстракты, пептоны, жидкость для замачивания кукурузы и соли аммония. Приемлемые неорганические солевые вещества для применения в культуральной среде данного изобретения включают в себя, например, обычные соли, содержащие натрий, железо, магний, калий, кобальт, фосфат и подобное. Более подробно, приемлемые для применения в данном изобретении среды выращивания включают в себя, например,
а) декстрозу (приблизительно 20 грамм (г)), экстракт дрожжей (приблизительно 5 г), муку сои (приблизительно 5 г), NaCl (приблизительно 5 г), К2НРO4 (приблизительно 5 г) и дистиллированную Н2О (приблизительно 2 литра (л)), рН устанавливают с помощью H2SO4 (водной) приблизительно около 7,0;
(b) декстрин (приблизительно 10 г), мясной экстракт (приблизительно 3 г), ардамин рН (приблизительно 6 г), NZ амин типа Е (приблизительно 5 г), МgSO4·7Н2О (приблизительно 0,5 г), КН2РO4 (приблизительно 0,37 г), СаСО3 (приблизительно 0,5 г) и дистиллированную Н2О (приблизительно 1 л), рН устанавливают с помощью НСl (водной) приблизительно около 7,1; с последующей второй стадией глюкозы (приблизительно 10 г), Hy-Case SF® (приблизительно 2 г), мясной экстракт (приблизительно 1 г), жидкость для замачивания кукурузы (приблизительно 3 г) и дистиллированную воду (приблизительно 1 л), рН доводят приблизительно до 7,0;
с) глюкозу (приблизительно 10 г), жидкость для замачивания кукурузы (приблизительно 6 г), КН2РO4 (приблизительно 3 г), СаСО3 (приблизительно 3,5 г), соевое масло (неочищеное, приблизительно 2,2 миллилитра (мл), экстракт дрожжей (приблизительно 2,5 г) и дистиллированную Н2О (приблизительно 1 л), рН доводят с помощью НС1 (водной) до значений приблизительно от 7,0 до 7,3;
d) патоку солода (приблизительно 20 г), соевую муку (приблизительно 5 г), казеин (приблизительно 1 г), высушенные дрожжи (приблизительно 1 г), NaCl (приблизительно 5 г) и дистиллированную воду (приблизительно 1 л);
e) лактозу (приблизительно 75 г), Pharmamedia ® (заместитель экстракта дрожжей, приблизительно 40 г), СаСО3 (приблизительно 10 г), Na2 SO4 (приблизительно 4 г) и дистиллированную воду (приблизительно 1 л);
f) ISP #2 (см. пример на стр.460 Handbook of Microbial Media by R.M. Atlas, edited by L.C. Parks, CRC Press, Inc., 1993, "Handbook"));
g) ISP #3 (см. стр.460 в Handbook);
h) ISP #4 (см. стр.461, Handbook);
i) ISP #5 (см. стр.461-462 Handbook) и подобное.
Особенно предпочтительной средой для выращивания является 2× (а), представленная выше.
Перечисление данных буферных растворов, сред, реагентов, условий взаимодействия культивирования или им подобных не предполагает ограничение этим, а должно рассматриваться как возможность включения всех соответствующих материалов, которые специалисты в данной области рассматривают как интересные или ценные в том контексте, в котором представлено обсуждение изобретения. Например, часто возможно замещение одной буферной системы на другую или культуральной среды на другую, такую, которая отличается, но приемлема для достижения тех же целей, на которые направлено применение предлагаемого способа, материала или композиции. Поэтому понятно, что данное изобретение предполагает применение предоставляемого способа для коммерческих целей.
Следовательно, специалисты в данной области понимают, что разновидности сред для выращивания, условий ферментации и/или количество рацемического тетралона изменяют, чтобы контролировать выход получаемых соединений и относительные скорости их образования. Обычно употребляемые в данном изобретении способы выбирают, учитывая промышленную эффективность. Среды для выращивания, условия ферментации и относительные количества микроорганизма или ферментной системы восстановления и рацемического тетралона, описанные в изобретении, только иллюстрируют широкое разнообразие сред, условий ферментации и количеств исходных материалов, которые могут быть использованы в данном изобретении; все это оценивается специалистами в данной области и не предполагает каких-либо ограничений.
Любые приемлемые методы для выделения и/или очистки любого из продуктов представляемого способа используют в данном изобретении, включая фильтрацию, экстракцию, кристаллизацию, хроматографию на колонке, тонкослойную хроматографию, препаративную жидкостную хроматографию низкого давления или ВЭЖХ, или любое приемлемое сочетание этих способов.
Далее, специалисты в данной области оценят, что нежелательный соответствующий спирт (4R)-тетралона, соединение формулы (II), полученный согласно описанным в изобретении способам, может быть возвращен в повторный цикл, например окислен и рацемизирован, как описано ранее в заявке, посредством любого приемлемого известного метода до рацемического тетралона формулы (I), а способы данного изобретения повторены, что дает в результате еще дополнительный требуемый (4S)-тетралон формулы (V). Окисление (4R)-тетралола до (4R)-кетона может быть осуществлено по методам, известным специалистам в данной области. Реакцию рацемизации осуществляют с помощью любого приемлемого метода, но обычно проводят при температуре приблизительно от 0° С до 100° С, предпочтительно приблизительно от 25° С до 65° С. (4R)-тетралон реагирует с основанием при температуре приблизительно от 25° С до 85° С, предпочтительно приблизительно от 50° С до 65° С. Приемлемые основания для реакции рацемизации включают в себя калий t-бутоксид, гидроокись натрия, натрий метоксид и гидроокись калия. Предпочтительным основанием является калий t-бутоксид.
Подробные примеры, представленные ниже, показывают, что ряд микроорганизмов, включающий в себя грибы, например дрожжи и актиномицеты, стереоизбирательно восстанавливает рацемический тетралон с образованием требуемого (4S)-тетралона формулы (V), то есть хирального тетралона, который затем отделяют от ненужных соединений и в дальнейшем вводят в реакцию согласно способам, хорошо известным в данной области, чтобы получить сертралин.
Данное изобретение иллюстрируется следующими примерами. Предшествующее и последующее описание данного изобретения и различные его аспекты не ограничивают изобретение, а скорее иллюстрируют его. Следовательно, ясно, что специфические детали этих примеров не ограничивают изобретение.
ПРИМЕР I
ВОССТАНОВЛЕНИЕ РАЦЕМИЧЕСКОГО ТЕТРАЛОНА С ИСПОЛЬЗОВАНИЕМ Hansenula polymorpha ATCC №26012
А. Ферментация дрожжей Hansenula polymorpha ATCC №26012
Готовят одну "контрольную" культуру (С1) и одну "опытную" культуру (Т1) следующим образом: приблизительно 2,5 мл стерильной среды для выращивания (приблизительно 40 г/л декстрозы, приблизительно 10 г/л муки пищевой сои, приблизительно 10 г/л экстракта дрожжей, приблизительно 10 г/л NaCl и приблизительно 10 г/л К2НРO4 с рН, приведенным H2SO4 к 7,0) добавляют в каждую из двух 16× 125 мм стеклянных пробирок, каждая из которых имеет металлическую перегородку (С1, Т1), с последующим добавлением приблизительно 0,2 мл раствора А (приблизительно 25 г Твина® 80, приблизительно 100 г глицерина и приблизительно 250 мл дистиллированной воды, стерилизованной фильтрацией) к каждой из двух культур.
В Т1 вводят приблизительно 25 мкл приблизительно 17% замороженного глицеринового образца Hansenula polymorpha ATCC №26012. Культуры двух пробирок инкубируют приблизительно при 29° С при качании приблизительно при 210 оборотах в минуту. Через приблизительно 24 часа образцы раствора приблизительно по 50 мкл (приблизительно 5 мг/мл в приблизительно 100% этаноле, конечная концентрация приблизительно 100 мг/мл) рацемического тетрадона ( соединение формулы (I), содержащее соединения формул (IV) и (V) приблизительно при 5 мг/мл в этаноле) добавляют к С1 и Т1.
Приблизительно через пять дней один мл NaCl (насыщен.) добавляют к каждой из двух культур в пробирках, ферментационный бульон из каждой пробирки с культурой (приблизительно 3,6 мл) экстрагируют равным объемом этилацетата (чистым): добавляют этилацетат, культуры в пробирках перемешивают вращением, а затем центрифугируют приблизительно при 2000 оборотах в минуту (IEC® центрифуга, 300 Second Avenue, Needham Heights, Massachusetts 02194). Удаляют слой этилацетата, а водный слой эксрагируют во второй раз. Объединенные органические экстракты высушивают под азотом в водяной бане приблизительно при 50° С.
В. Конфигурация остаточного кетона: соединения формул (IV) и (V)
Каждый из экстрактов, полученных как описаано выше, повторно суспендируют приблизительно в одном мл этанола, и приблизительно 20 мкл каждого ресуспендированного экстракта анализируют на колонке ВЭЖХ: Chiralcel OK guard колонка (4,6× 50 мм, Daicel Chemical Industries, LTD., 730 Springdale Drive, P.O.Box 564, Exton, Pennsylvania 19341), соединенная с Cchiralcel OK колонкой (4,6× 250 мм, Daicel). Соединения, содержащиеся в каждом введенном ресуспендированном экстракте, разделяют изократно при приблизительно 0,8 мл за минуту в подвижной фазе (этанол:этилацетат 85:15), а соединения, содержащие экстракты, определяют, используя 996 РДА детектор (Waters®. 34 Maple Street, Milford, Massachusets 01757), установленный при 254 нм.
Как показывают данные для С1 и Т1 в таблице 1, анализ посредством хиральной ВЭЖХ демонстрирует, что включение микроорганизма, то есть Hansenula polymorpha ATCC №26012, дает в результате соотношение 16:1 (непрореагировавший (4S)-тетралон формулы (V):против непрореагировавшего (4S)-тетралона формулы (IV)), что далее иллюстрирует стереоспецифичность представляемого микробного способа восстановления. Описанные ниже результаты базируются на известном количестве каждого добавленного энантиомера (приблизительно 50 мкг/мл каждого из соединений формул (IV) и (V). Как упоминают выше, концентрация каждого рацемического тетралона формулы (I) составляет приблизительно 100 мкг/мл.

Результаты хирального анализа показывают, что культура Hansenula polymorpha ATCC №26012 (Tl) существенно восстанавливает (4R)-тетралон, оставляя по существу непрореагировавшим (4S)-тетралон (приблизительно 4,7% (4R)-тетралона остается против приблизительно 76% (4S)-тетралона). С помощью хиральной ВЭЖХ устанавливают, что (4S)-тетралон присутствует приблизительно в 88%, исключая ошибки ("процентное количество энантиомерного избытка"). Данные таблицы 1, в особенности соотношение (4S) (4R), то есть 16, показывают, что существенно больше (4S)-тетралона остается непрореагировавшим, чем (4R)-тетралона.
Соответственно, включение интактного микроорганизма, то есть Hansenula polymorpha ATCC №26012, приводит в результате к стереоспецифическому восстановлению значительно большего исходного (4R)-тетралона формулы (IV), чем исходного (4S)-тетралона формулы (V) ((4S):(4R)), и получают главным образом (4R)-тетралол формулы (II) против (4S)-тетралола формулы (III) (данные не представлены). Большую часть полученного (4R)-тетралола составляет (1S, 4R)-тетралол, а большую часть полученного небольшого количества (4S)-тетралола составляет (1S, 4S)-тетралол.
ПРИМЕР II
ВОССТАНОВЛЕНИЕ РАЦЕМИЧЕСКОГО ТЕТРАЛОНА С ИСПОЛЬЗОВАНИЕМ Absidia coerulea ATCC №20137
А. Ферментация гриба Absidia coerulea ATCC №20137
Готовят одну "контрольную" культуру (С2) и одну "опытную" культуру (Т2) следующим образом: приблизительно 2,5 мл стерильной среды для выращивания (приблизительно 20 г/л декстрозы, приблизительно 5 г/л муки пищевой сои, приблизительно 5 г/л NaCl, приблизительно 5 г/л экстракта дрожжей и приблизительно 5 г/л К2НРO4 с рН, доведенным Н2SO4 приблизительно до 7,0) добавляют в каждую из двух стеклянных пробирок 16× 125 мм, каждая из которых имеет металлическую перегородку (С2, Т2).
Приблизительно через 5 дней один мл NaCl (насыщн.) добавляют к каждой из двух культур в пробирках. Ферментационный бульон каждой культуры (приблизительно 3,6 мл) экстрагируют приблизительно 3 мл этилацетата (чистого): добавляют этилацетат, культуры в пробирках перемешивают вращением, а затем центрифугируют приблизительно при 2000 обороте в минуту (IEC центрифуга). Удаляют слой этилацетата, а водный слой экстрагируют второй раз. Объединенные органические экстракты высушивают под азотом в водяной бане приблизительно при 50° С.
В. Конфигурация остаточного кетона: соединения формул (IV) и (V)
Каждый из экстрактов, полученных как описывают выше, повторно суспендируют приблизительно в одном мл этанола, и приблизительно 20 мкл каждого ресуспендированного экстракта анализируют посредством внесения в колонку ВЭЖХ: Chiralcel OK guard колонка (4,6× 50 мм), соединенная с Chiralcel OK колонкой (4,6× 250 мм). Соединения, содержащиеся в каждом введенном в колонку ресуспендированном экстракте, разделяют изократно приблизительно при 0,8 мл за минуту для подвижной фазы (этанол:этилацетат 85:15), а соединения, включающие экстракты, определяют, используя 996 PDA детектор (Waters), установленный на 254 нм.
Как показывают представленные ниже данные ВЭЖХ для С2 и Т2, введение микроорганизма, то есть Absidia coerulea ATCC №20137, приводит к стереоспецифическому восстановлению в большей степени исходного (4R)-тетралона формулы (IV), чем исходного (4S)-тетралона формулы (V).
Более специфично, результаты хирального анализа показывают, что культура Absidia coerulea ATCC №20137 восстанавливает (4R)-тетралон, при этом оставляя, по существу, непрореагировавшим (4S)-тетралон (приблизительно 13,6% (4R)-тетралона остается против приблизительно 40,5% (4S)-тетралона).
С помощью хиральной ВЭЖХ устанавливают, что (4S)-тетралон присутствует приблизительно в 50%, исключая ошибки.
Как показывают представленные в таблице 2 данные для С2 и Т2, хиральный ВЭЖХ-анализ иллюстрирует, что введение микроорганизма, то есть Absidia coerulea ATCC №20137, приводит в результате к соотношению, по которому, по крайней мере, вдвое больше (4S)-тетралона остается невосстановленным против невосстановленного (4R)-тетралона, далее доказывая стереоспецифичность представляемого микробного способа восстановления. Описанные ниже результаты базируются на известном количестве каждого добавленного энантиомера (приблизительно 50 мкг/мл каждого, как описано в примере I настоящего изобретения). Как отмечается выше, концентрация исходного рацемического тетралона составляет приблизительно 100 мкг/мл.

ПРИМЕР III
ВОССТАНОВЛЕНИЕ РАЦЕМИЧЕСКОГО ТЕТРАЛОНА С ИСПОЛЬЗОВАНИЕМ ДРОЖЖЕЙ И АКТИНОМИЦЕТОВ
Специалистам в данной области ясно, что перечисленные в таблице 3 микроорганизмы, которые применяют для представляемого восстановления, Geotrichum ATCC №62401, Mortierella isabelina ATCC №38063, Mortierella vinacea АТСС №09515, Penicilium notatum ATCC №36740, Blastoschizomyces capitatus ATCC №28575, Monosporium olivaceum v. Major ATCC №36300, Aerobacterium pullulans ATCC №16623, Pichia fabianii ATCC №16755 и Streptomyces rimosus ss. Rimosus ATCC №10970 получают как описано в примере II; Geotrichum candidum ATCC №34614, Mortierella isabellina ATCC №42613, Debaryomyces polymorphus ATCC №20280 и Saccharomyces cerevisiae ATCC №15248 получают как описано в примере II, за исключением того, что повторяют экстракцию; и Candida schatavii ATCC №24409 получают как предлагается ниже.
Candida schatavii ATCC №24409 получают и применяют согласно данному изобретению следующим образом: приблизительно 2,5 мл стерильной среды для выращивания (приблизительно 20 г/л декстрозы, приблизительно 5 г/л муки пищевой сои, приблизительно 5 г/л экстракта дрожжей, приблизительно 5 г/л NaCl и приблизительно 5 г/л К2НРO4 с рН, доведенным H2SO4 приблизительно до 7,0) добавляют в 16× 125 мм стеклянные пробирки, имеющие металлическую перегородку, с последующим добавлением в культуру приблизительно 0,1 мл простерилизованного фильтрацией раствора: приблизительно 25 г Твина® 80, приблизительно 100 г глицерина и приблизительно 250 мл дистиллированной воды. Затем в культуру вводят приблизительно 25 мкл приблизительно 17% замороженного глицеринового образца Candida schatavii ATCC №24409.
Культуру выращивают приблизительно при 29° С при перемешивании качанием приблизительно при 210 оборотах в минуту. Приблизительно через 48 часов в культуру добавляют приблизительно 50 мкл раствора образца (приблизительно 5 мг/мл приблизительно в 100% этаноле, конечная концентрация приблизительно 100 мкг/мл) рацемического тетралона (соединение формулы (I), содержащее соединения формул (IV) и (V), приблизительно при 5 мг/мл приблизительно в 100% этаноле).
Через дополнительные четыре дня ферментационный бульон культуры (приблизительно 2,6 мл) экстрагируют равным объемом этилацетата (чистого), культуру перемешивают встряхиванием, а затем центрифугируют приблизительно при 2000 оборотах в минуту (IEC®-центрифуга). Экстракцию повторяют. Экстракты высушивают под азотом в водяной бане приблизительно при 50° С. Затем экстракт повторно суспендируют в приблизительно одном мл этанола, и приблизительно 5 мкл ресуспендированного экстракта анализируют, вводя в колонку ВЭЖХ: Сhirаlсеl ОД guard колонка (4,6× 50 мм, Diacel Chemical Industries, LTD), соединенная с Chiralcel ОД колонкой (4,6× 250 мм, Daicel). Соединения, содержащиеся во введенном ресуспендированном экстракте, разделяют изократно при приблизительно 0,9 мл за минуту для подвижной фазы (гексан:изопропанол 95:5), а соединения, содержащие экстракт, определяют, используя 996 РДА детектор (Waters®), установленный при 210 нм.
Как показывают результаты хиральной ВЭЖХ (проводят, как в примерах I и II), представленные в таблице 3, каждый из микроорганизмов, перечисленных в таблице 3, стереоспецифически восстанавливает больше (4R)-тетралона, чем (4S)-тетралона, и дает в результате соотношение, в котором по меньшей мере приблизительно вдвое больше остается непрореагировавшего (43)-тетралона против непрореагировавшего (4R)-тетралона.
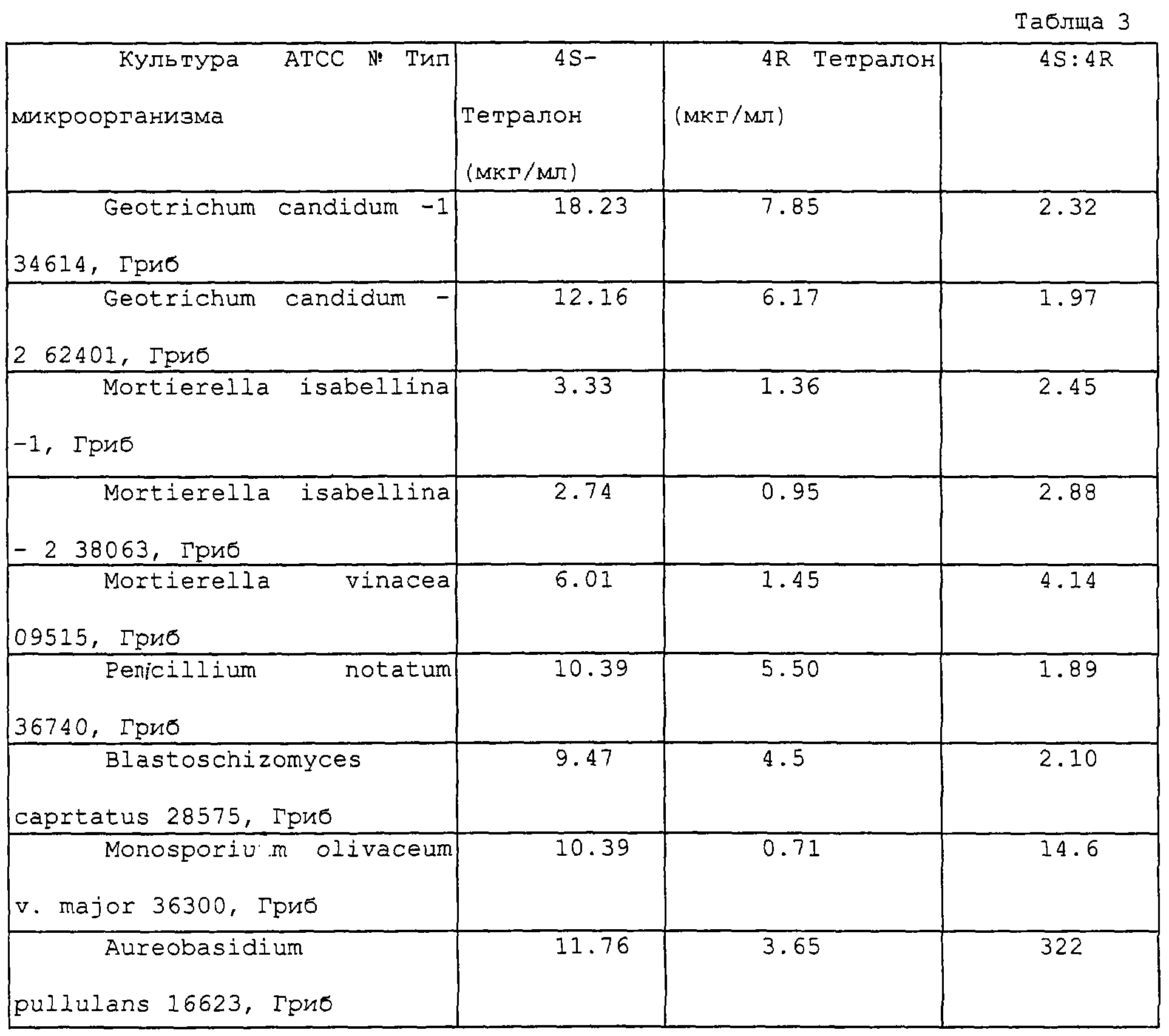

Следует отметить, что, как свидетельствуют данные, представленные в таблице 3, тогда как интактный Monosporium olivaceum v. Major ATCC №36300 восстанавливает значительно больше (4S)-тетралона по сравнению с (4R)-тетралоном и как таковой является предпочтительным микроорганизмом в предлагаемом способе, тем не менее описывают нежелательную деградацию как (4R)-тетралона, так и (4S)-тетралона для этой культуры. Нежелательную деградацию обуславливают, например, другие ферменты и подобные, содержащие интактный микроорганизм. Поэтому как понимают специалисты в данной области из описания, представляемого в заявке, предпочтительно использовать фермент, изолированный из Monosporium olivaceum v. major ATCC №36300, а не интактный Monosporium olivaceum v. major ATCC №36300.
Реферат
Изобретение относится к биотехнологии. Способ стереоизбирательного восстановления рацемического 4-(3, 4-дихлорфенил)-3,4-дигидро-1 (2Н)-нафталеона включает взаимодействие указанного тетралона с микроорганизмом или ферментом. В способе используют микроорганизм, выбранный из группы, состоящей из Hansenula polymorpha ATCC №26012, Hansenula polymorpha ATCC №74449, Absidia coerulea ATCC №20137, Geotrichum candidum ATCC №34614, Geotrichum candidum ATCC №62401, Mortierella isabellina ATCC №42613, Mortierella isabellina ATCC №38063, Mortierella vinacea ATCC №09515, Penicillium notatum ATCC №36740, Blastoschizomyces capitatus ATCC №28575, Monosporium olivaceum v. major ATCC №36300, Aureobasidium pullulans ATCC №16623, Debaryomyces polymorphus ATCC №20280, Saccharomyces cerevisiae ATCC №15248, Candida schatavii ATCC №24409, Pichia fabianii ATCC №16755 и Streptomyces rimosus ss. rimosus ATCC №10970. Способ обладает стереоизбирательностью и обеспечивает высокий выход продукта, использование которого возможно в синтезе сертралина. 3 с. и 32 з.п.ф-лы, 3 табл.
Формула



Комментарии