Композиции для реакции обратной транскрипции с горячим стартом или для полимеразной цепной реакции с обратной транскрипцией с горячим стартом - RU2630999C2
Код документа: RU2630999C2
Чертежи


Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции для реакции обратной транскрипции с горячим стартом или для полимеразной цепной реакции с обратной транскрипцией и горячим стартом.
Предшествующий уровень техники
Реакции обратной транскрипции делятся на реакции, в которых используются случайные праймеры, и реакции, в которых используются мишень-специфичные праймеры. В реакциях обратной транскрипции для детекции специфической мишени, таких как диагностические наборы для детекции PHK-вируса или чего-нибудь подобного, мишень-специфичные праймеры, в общем, используются из-за того, что они демонстрируют более высокую чувствительность. В таких реакциях обратной транскрипции специфичность и чувствительность определяются более высокой селективностью праймеров, которые специфически связываются с целевой последовательностью PHK. Однако из-за того, чтобы все компоненты необходимые для реакции обратной транскрипции смешивались при комнатной температуре, неспецифическая реакция обратной транскрипции обуславливается неспецифическим праймированием в этих условиях. Даже при комнатной температуре из-за высокой активности обратной транскриптазы происходит неспецифическое праймирование с получением ряда неспецифических кДНК, и таким образом этот процесс является основным фактором, который повышает уровень неспецифических реакций амплификации. Из-за таких неспецифических реакций обратной транскрипции потребляются праймеры, необходимые для последующих реакций ПЦР, и ограниченные концентрации других основных компонентов, и по этой причине неспецифические реакции обратной транскрипции действуют как конкурентные ингибиторы. Неспецифические реакции обратной транскрипции являются проблематичными при детекции PHK в низкой концентрации, и, в частности, мешают детекции целевой PHK, которая присутствует в очень малом количестве в растворе, который содержит большие количества PHK, экстрагированных из клеток или биологических жидкостей и имеют высокую сложность нуклеотидной последовательности. Таким образом, неспецифические реакции обратной транскрипции усложняют детекцию вируса или гена, присутствующего в низкой концентрации. Также в мультиплексных реакциях обратной транскрипции, которые осуществляют одновременно с использованием различных праймеров, неспецифические реакции обратной транскрипции снижают специфичность, усложняя множественную детекцию. На эту неспецифическую амплификацию более сильное влияние оказывают относительные количества целевой нуклеиновой кислоты и других нуклеиновых кислот, полученных из биологического образца, чем абсолютное количество целевой нуклеиновой кислоты. Это происходит из-за того, что неспецифическая гибридизация праймеров повышает уровень неспецифических реакций, когда в реакционной смеси присутствует множество PHK, отличных от искомой мишени.
Для снижения уровня таких неспецифических реакций и амплификаций были предприняты различные попытки. В частности, была попытка повысить порог обнаружения специфической мишени с помощью более сильно гибридизующихся с мишенью праймеров. Например, сообщалось о способе, в котором 5'-конец праймеров замещен LNA, так что праймер может более сильно гибридизоваться с мишенью, тем самым снижая неспецифическую амплификацию (Malgoyre A. et al., Biochem Biophys Res Commun. Mar 2, 2007; 354(1): 246-52). В качестве другого способа решения проблем с помощью структуры праймеров, также был разработан способ предотвращения образования димеров праймеров. Когда реакция обратной транскрипции осуществляется при низких температурах, полимеризация может протекать путем частичной гибридизации между праймерами с образованием димера, важный фактор, который быстро снижает чувствительность в реакции обратной транскрипции. Для решения этой проблемы было предложено использовать праймеры, образованные путем удлинения комплементарных нуклеотидных последовательностей, так чтобы пять нуклеотидов 5' концевой нуклеотидной последовательности праймеров могли образовать шпилечную структуру при низкой температуре (Ji Young Hong et al., Virol J. 2011; 8: 330. Опубликовано онлайн в 2011 году; Патент Республики Корея No. 10-0987352). Однако этот способ блокировки праймеров имеет недостатки, которые заключаются в том, что из-за того, что праймеры имеют высокую температуру гибридизации из-за нуклеотидной последовательности, добавленной к 5' концу, может индуцироваться неспецифическая гибридизация праймеров с неспецифическими мишенями, имеющими нуклеотидные последовательности, схожие с мишенями, в последующей реакции ПЦР, а эффективность гибридизации в стадии гибридизации снижается из-за шпилечной структуры праймеров.
Для решения таких проблем был разработан способ, в котором используются блокированные праймеры, которые частично комплементарны праймерам, и которые блокируются на 3'-конце. Быстрая ПЦР с обратной транскрипцией может быть осуществлена, поскольку такие блокированные праймеры имеют преимущество из-за того, что они блокированы на 3'-конце и не выполняют функцию праймеров в реакции полимеризации нуклеиновой кислоты, и из-за того, что они короткие и гибридизуются с праймерами только при комнатной температуре, предотвращая образования димеров праймеров, и из-за того, что они мгновенно отсоединяются от праймеров и не функционируют при повышении температуры в последующей реакции (Патентная Заявка Республики Корея No. 10-2011-0017226).
Кроме того, был разработан способ проведения реакции обратной транскрипции при высокой температуре для более специфической гибридизации целевой PHK. Сообщалось, что если кДНК синтезируется при высокой температуре, например, при 70°С, при использовании праймеров, которые гибридизуются при высокой температуре, и обратной транскриптазы, которая функционирует даже при высокой температуре, кДНК может быть амплифицирована более специфично (Fuchs В, Mol Biotechnol, 1999 Oct; 12(3): 237-40).
В мультиплексных ПЦР с обратной транскрипцией специфичность является более важной. Это является следствием того, что в реакциях используются несколько праймеров, и из-за неспецифической реакции в стадии реакции обратной транскрипции в последующей ПЦР может идти неспецифическая реакция. Для того чтобы избежать неспецифической реакции в мультиплексных ПЦР с обратной транскрипцией, вначале осуществляется реакция обратной транскрипции, а затем осуществляется реакция ПЦР, для осуществления более специфичной реакции. Однако в данном случае процесс открытия реакционной пробирки и добавления реакционного раствора в открытую реакционную пробирку является затруднительным, и вероятность контаминации в процессе открытия и взаимодействия с реакционной пробиркой является выше. По этой причине, как правило, предпочтительней последовательно осуществить реакцию обратной транскрипции и ПЦР в одной пробирке. Поэтому был разработан способ физически отдельных друг от друга реакций, при осуществлении ПЦР с обратной транскрипцией в одной пробирке без открытия пробирки, в котором реакционная смесь для обратной транскрипции находится в нижней части пробирки в ходе реакции, а реакционная смесь ПЦР подвешена на крышку. В данном способе, когда в пробирке идет реакция обратной транскрипции, реакционная смесь ПЦР подвешена на крышке и не реагирует, а после окончания реакции обратной транскрипции реакционную пробирку центрифугируют для того, чтобы раствор ПЦР подвешенный на крышке реакционной пробирки смешался с продуктом реакции обратной транскрипции, после чего осуществляется реакция ПЦР (Rodney Mark Ratcliff, et al., 2002 November; 40(11): 40914099. doi: 10.1128/JCM.40.11.4091-4099.2002).
В результате усилий, предпринятых для решения вышеописанных проблем, возникающих в обычных реакциях обратной транскрипции, была разработана «реакция обратной транскрипции с горячим стартом». Реакция обратной транскрипции с горячим стартом является способом детекции очень малого количества целевой PHK, в котором реакция обратной транскрипции может быть инициирована высокой температурой при которой праймирование может произойти только с PHK, имеющей нуклеотидную последовательность, полностью комплементарную праймерам, тем самым предотвращая неспецифическое праймирование, которое происходит при комнатной температуре, и предотвращая неспецифическую олигомеризацию праймеров, тем самым повышая специфичность реакции обратной транскрипции. Для реализации этого способа был разработан и в настоящее время используется способ, в котором используются термостойкая полимераза и аптамер. Набор «Light cycler RNA master kit» (Roche) является способом, в котором используется ДНК-полимераза Tth и аптамер. ДНК-полимераза Tth сочетает в себе функцию полимеризации ДНК с использованием PHK в качестве матрицы и функцию полимеризации ДНК с использованием ДНК в качестве матрицы. Аптамер, используемый в данном случае, прикреплен к реактивному сайту ДНК-полимеразы Tth, которая таким образом является неактивной при комнатной температуре. При повышении температуры реакционного раствора до высокой температуры, трехмерная структура аптамера модифицируется так, что аптамер отделяется от ДНК-полимеразы Tth, которая становится активной, после чего может быть осуществлена реакция обратной транскрипции специфически праймированной мишени PHK, а затем может быть проведена ПЦР. Кроме того, в наборе «GeneAmp AccuRT Hot Start RNA PCR kit» (Applied Biosystems) используется термоустойчивая полимераза, полученная из разновидности Thermus Z05, и с помощью этого набора может быть проведена реакция обратной транскрипции и ПЦР с использованием одного фермента, подобного ДНК-полимеразе Tth. Реакция также осуществляется с использованием аптамера, специфичного к ферменту. Такие продукты могут понизить неспецифическую амплификацию в ПЦР с обратной транскрипцией путем ингибирования ферментативной активности при комнатной температуре при использовании аптамера для снижения уровня неспецифических реакций обратной транскрипции. При этом при повышении температуры до высокой, трехмерная структура аптамера модифицируется, а при снижении температуры аптамер восстанавливает исходную структуру, ингибирующую ДНК-полимеразы. Другими словами с аптамерами связана проблема обратимого ингибирования ДНК-полимераз. Для набора «GeneAmp AccuRT Hot Start RNA PCR kit» указано, что аптамер остается все еще прикрепленным к ДНК-полимеразе даже при 55°С и полностью отделяется когда температура достигает 65°С. Таким образом в реакциях, в которых температура отжига праймеров, как правило, равна 55°С или ниже, существует проблема, которая заключается в ингибировании активности ДНК-полимеразы, что снижает эффективность ПЦР. По этой причине используется термоустойчивая ДНК-полимераза, такая как ДНК-полимераза Tth, которая обладает функцией обратной транскрипции. С такой термоустойчивой ДНК-полимеразой связана проблема, которая заключается в том, что полимераза осуществляет обратную транскрипцию в ходе последующего процесса ПЦР, в котором поддерживается ферментативная активность, и это вызывает непрерывную неспецифическую реакцию обратной транскрипции, которая приводит к неспецифической амплификации.
Способ реакции ПЦР с горячим стартом, в котором используются антитела, применим только к Taq ДНК-полимеразе (Enneth, G. et al., 1994, Biotechnology, 12; 506-509). Для проведения реакций обратной транскрипции с горячим стартом с использованием других типов обратных транскриптаз, должна быть использована термоустойчивая обратная транскриптаза, которая устойчива при высоких температурах, а для ПЦР с обратной транскрипцией требуются специфичное к обратной транскриптазе антитело, которое отделается при низкой температуре, и антитело, специфичное к ДНК-полимеразе, которое отделяется при высокой температуре. По этой причине должны быть разработаны антитела, специфичные к соответствующим термоустойчивым полимеразам, и, таким образом, есть техническое ограничение таких реакций обратной транскрипции с горячим стартом.
Авторы разработали способ ПЦР с горячим стартом, в котором используются пирофосфат (PPi) и термоустойчивая пирофосфатаза (PPase) (Патент Республики Корея No. 10-0292883). Данный способ основан на принципе, согласно которому PPi, который сильно связывается с ионами магния, необходимым для полимеризации ДНК, добавляется для ингибирования полимеразной реакции при комнатной температуре, а затем PPase вступает в реакцию при высокой температуре удаляя PPi. Обратная транскриптаза не может быть использована в способе с горячим стартом, в котором используется антитело, из-за ее низкотемпературной активации. Обычный способ ПЦР с горячим стартом, в котором используется антитело, представляет собой способ, в котором активность фермента ингибируется при связывании фермента с антителом при низкой температуре, и антитело теряет связывание с ферментом из-за снижения стабильности при достижении высокой температуры, в результате чего проходит реакция ПЦР. Обратная транскриптаза не обладает термоустойчивостью при высокой температуре, в отличие от ДНК-полимеразы. Когда антитело при достижении высокой температуры теряет связь с обратной транскриптазой, активность обратной транскриптазы ингибируется. Для решения данной проблемы был предложен способ реакции обратной транскрипции с горячим стартом, в котором используется PPi и PPase, обладающий преимуществами, которые заключаются в том, что данный способ, в общем, может быть применен вне зависимости от типа ДНК-полимеразы, и в том, что реакционную способность можно непрерывно поддерживать непрерывным удалением PPi, образующимся из dNTP в ходе ПЦР. Однако если изготовить мастер-микс раствор для ПЦР с горячим стартом с использованием данного способа, PPase будет медленно отделять PPi от ионов Mg2+, так что активность ДНК-полимеразы будет проявляться и в конечном счете искомый эффект реакции ПЦР с горячим стартом будет утрачен. Кроме того, у мастер-микс раствора реакции для обратной транскрипции, содержащего PPase, имеется недостаток, который заключается в том, что активность PPase при комнатной температуре или 4°С сохраняется только в течение коротких периодов времени, потому что PPase очень нестабильна. Поэтому была разработана смесь в сухой форме, имеющая повышенную стабильность (Патент Республики Корея No. 10-1098764). Поэтому для решения вышеуказанных проблем реакций обратной транскрипции с горячим стартом необходима технология для высокочувствительных обратной транскрипции с горячим стартом и ПЦР с обратной транскрипцией.
Область техники, к которой относится изобретение
Задача настоящего изобретения заключается в обеспечении композиции для реакции обратной транскрипции с горячим стартом или ПЦР с обратной транскрипцией и горячим стартом, которая содержит пирофосфат (PPi) и пирофосфататазу (PPase).
Для решения вышеуказанной задачи в настоящем изобретении предлагается композиция для реакции обратной транскрипции с горячим стартом, которая содержит ион Mg2+, четыре типа dNTP, обратную транскриптазу, пирофосфат (PPi) и пирофосфатазу (PPase).
В настоящем изобретении также предлагается композиция для ПЦР с обратной транскрипцией и горячим стартом, которая содержит ион Mg2+, четыре типа dNTP, обратную транскриптазу, пирофосфат (PPi) и пирофосфатазу (PPase), а также включает ДНК-полимеразу.
В настоящем изобретении также предлагается способ получения композиции для реакции обратной транскрипции с горячим стартом, который включает внесение вышеуказанной композиции для реакции обратной транскрипции с горячим стартом в отдельную реакционную пробирку.
В настоящем изобретении также предлагается набор для реакции обратной транскрипции с горячим стартом, которая включает вышеописанную композицию для реакции обратной транскрипции с горячим стартом.
В настоящем изобретении также предлагается способ амплификации нуклеиновой кислоты, который включает стадии: смешивания вышеописанной композиции для ПЦР с обратной транскрипцией и горячим стартом с образцом, содержащим PHK-матрицу, для получения реакционной смеси; проведения реакции для того, чтобы амплифицировать реакционную смесь с получением посредством этого продукта амплификации; и анализа продукта амплификации.
Краткое описание чертежей
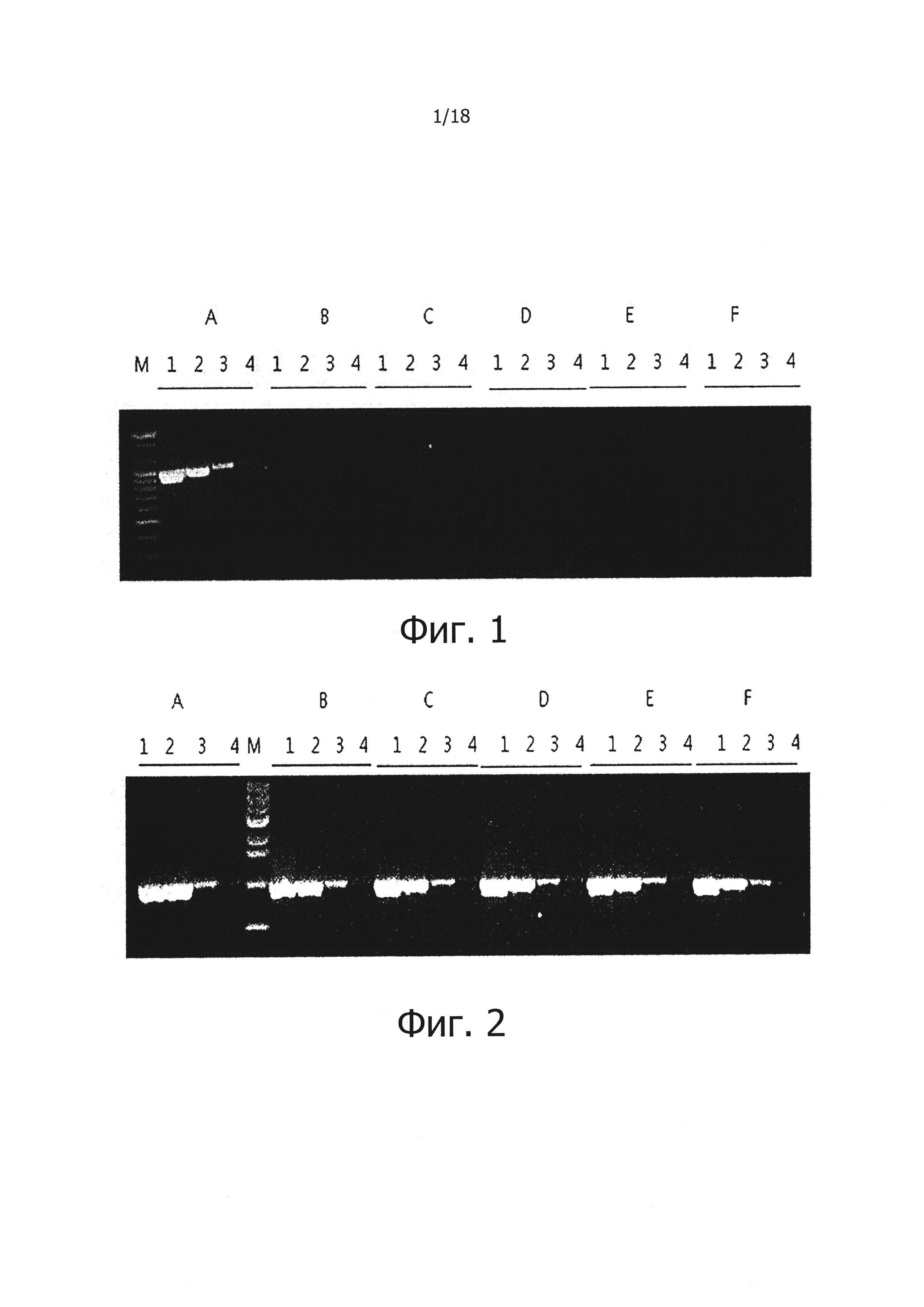
На фиг. 1 продемонстрировано влияние пирофосфата (PPi) на ингибирование реакций обратной транскрипции:
Дорожки 1, 2, 3 и 4: результаты проведения реакций обратной транскрипции на 100 нг, 10 нг, 1 нг и 100 пг PHK, соответственно;
А: результаты положительного контроля, полученные при проведении реакции обратной транскрипции в отсутствие PPi, с последующей реакцией ПЦР;
В, С, D, Ε и F: результаты проведения реакций обратной транскрипции в присутствии различных концентраций PPi, с последующими реакциями ПЦР; и
Дорожка М: 100 п.о. маркер длин фрагментов ДНК (Bioneer, Корея) для определения размеров продуктов ПЦР.
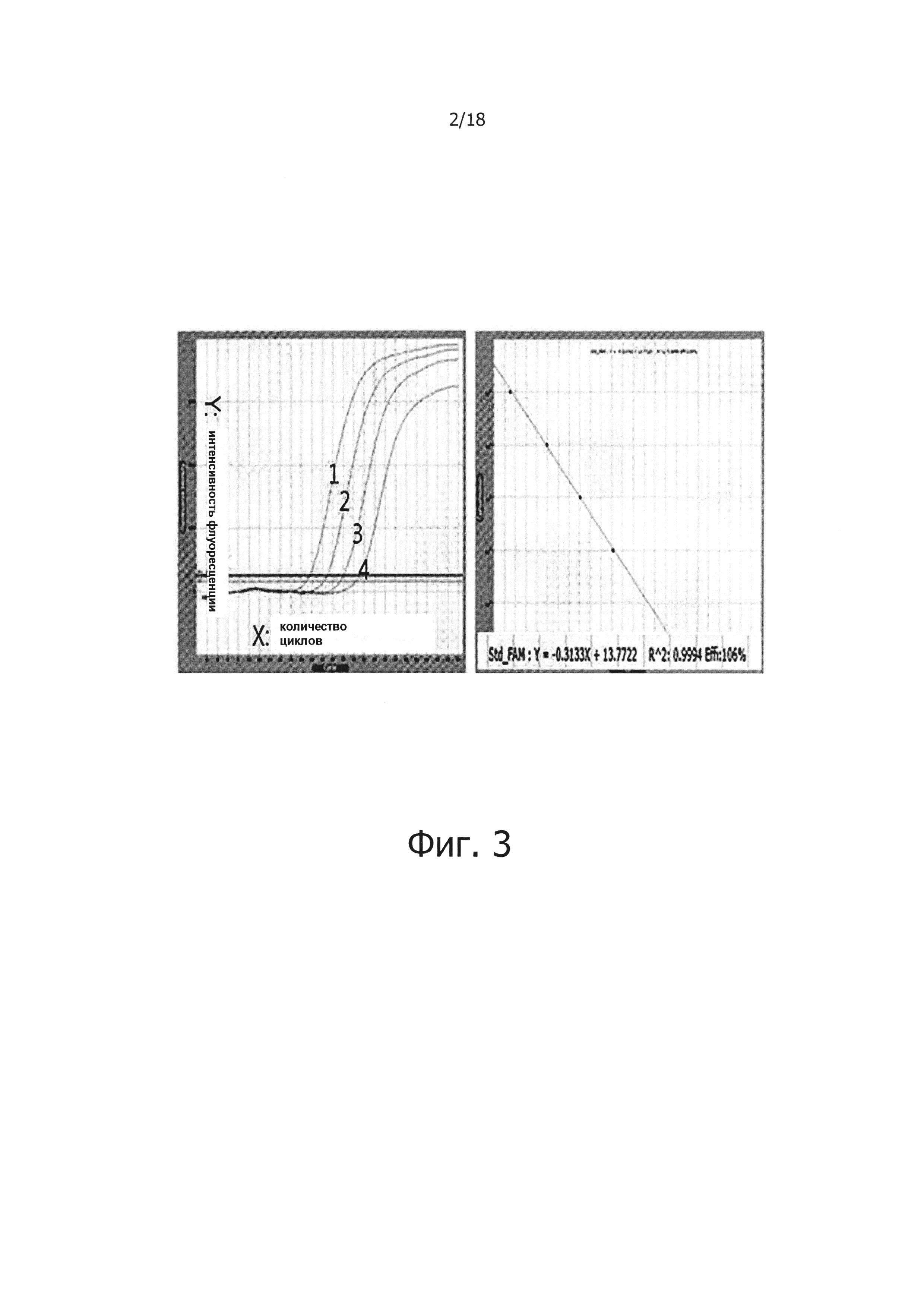
На фиг. 2 продемонстрировано, что реакции обратной транскрипции активируются снова при добавлении пирофосфатазы (PPase), которая гидролизует PPi на два фосфата:
Дорожки 1, 2, 3 и 4: результаты проведения реакций обратной транскрипции на 100 нг, 10 нг, 1 нг и 100 пг PHK, соответственно;
А: результаты положительного контроля, полученные при проведении реакции обратной транскрипции в отсутствие PPi, с последующей реакцией ПЦР;
В, С, D, Ε и F: результаты, полученные добавлением различных концентраций PPi;
В-1, С-1, D-1, Е-1 и F-1: результаты проведения реакций обратной транскрипции в присутствии PPase, с последующим проведением реакций ПЦР;
Дорожка M: 1 т.н. маркер длин фрагментов ДНК.
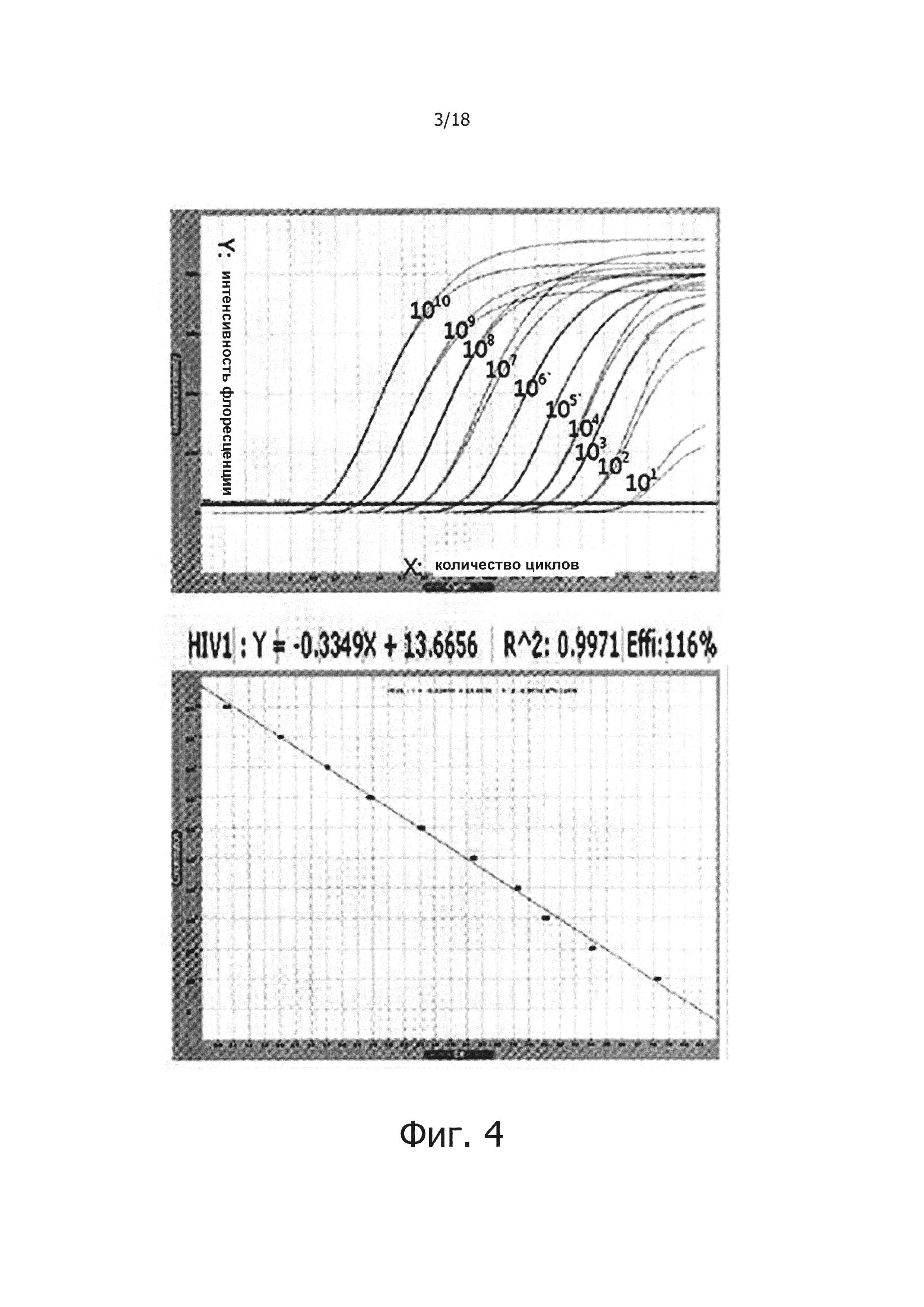
На фиг. 3 продемонстрировано влияние добавления PPi и PPase на ПЦР в режиме реального времени с обратной транскрипцией:
Дорожки 1, 2, 3 и 4: результаты ПЦР в режиме реального времени с обратной транскрипцией с использованием 100 нг, 10 нг, 1 нг и 100 мкг общей PHK человека.
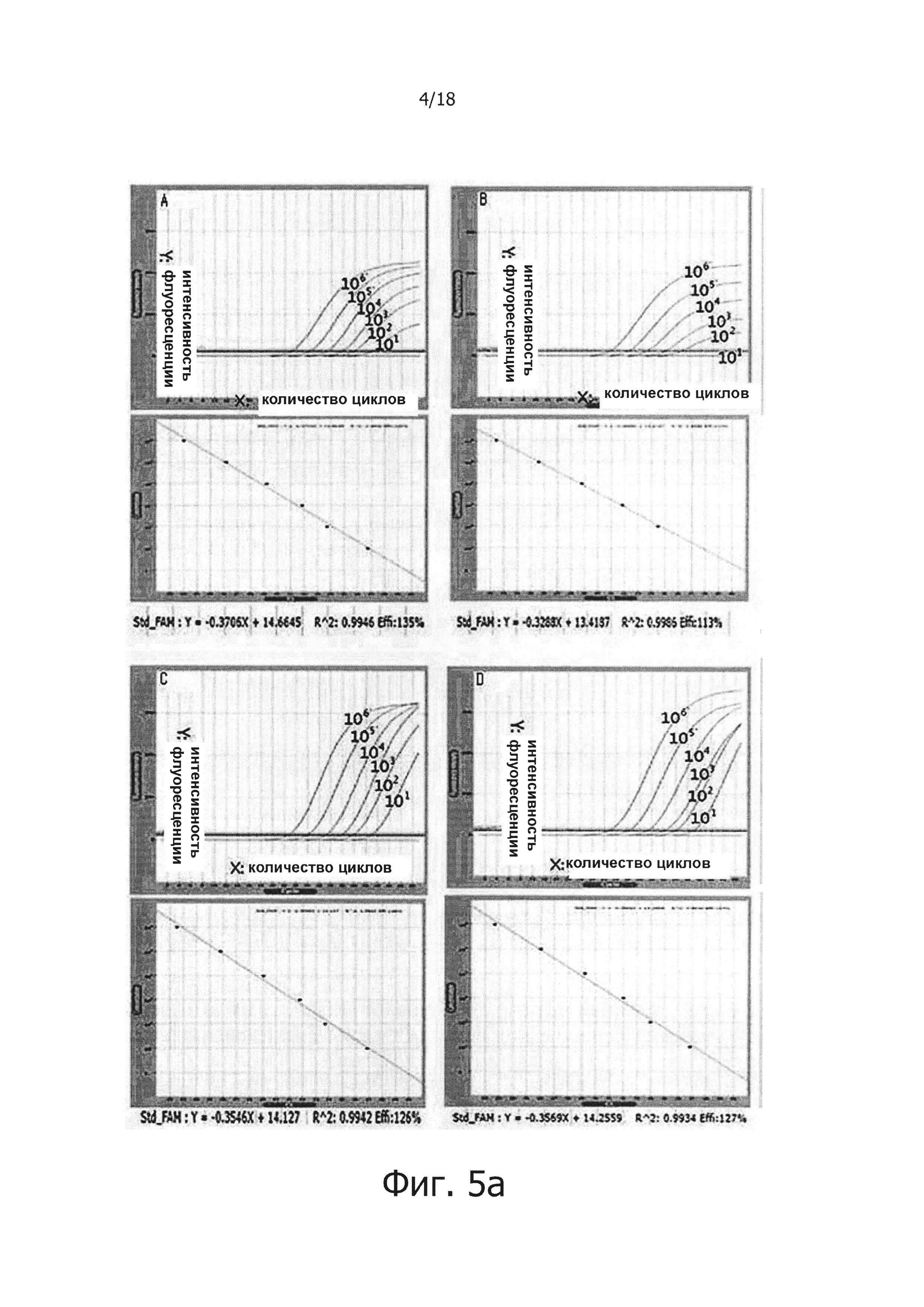
На фиг. 4 продемонстрированы результаты детекции PHK вируса гепатита С с помощью реакции обратной транскрипции с горячим стартом.
На фиг. 5а продемонстрировано влияние PPi и PPase на ингибирование неспецифических реакций в ПЦР в режиме реального времени с обратной транскрипцией:
А: результаты, полученные при использовании реакционного раствора, не обладающего функцией обратной транскрипции с горячим стартом;
В: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «А»;
С: Результаты, полученные с использованием реакционного раствора для обратной транскрипции с горячим стартом, включающим PPi и PPase; и
D: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «С».
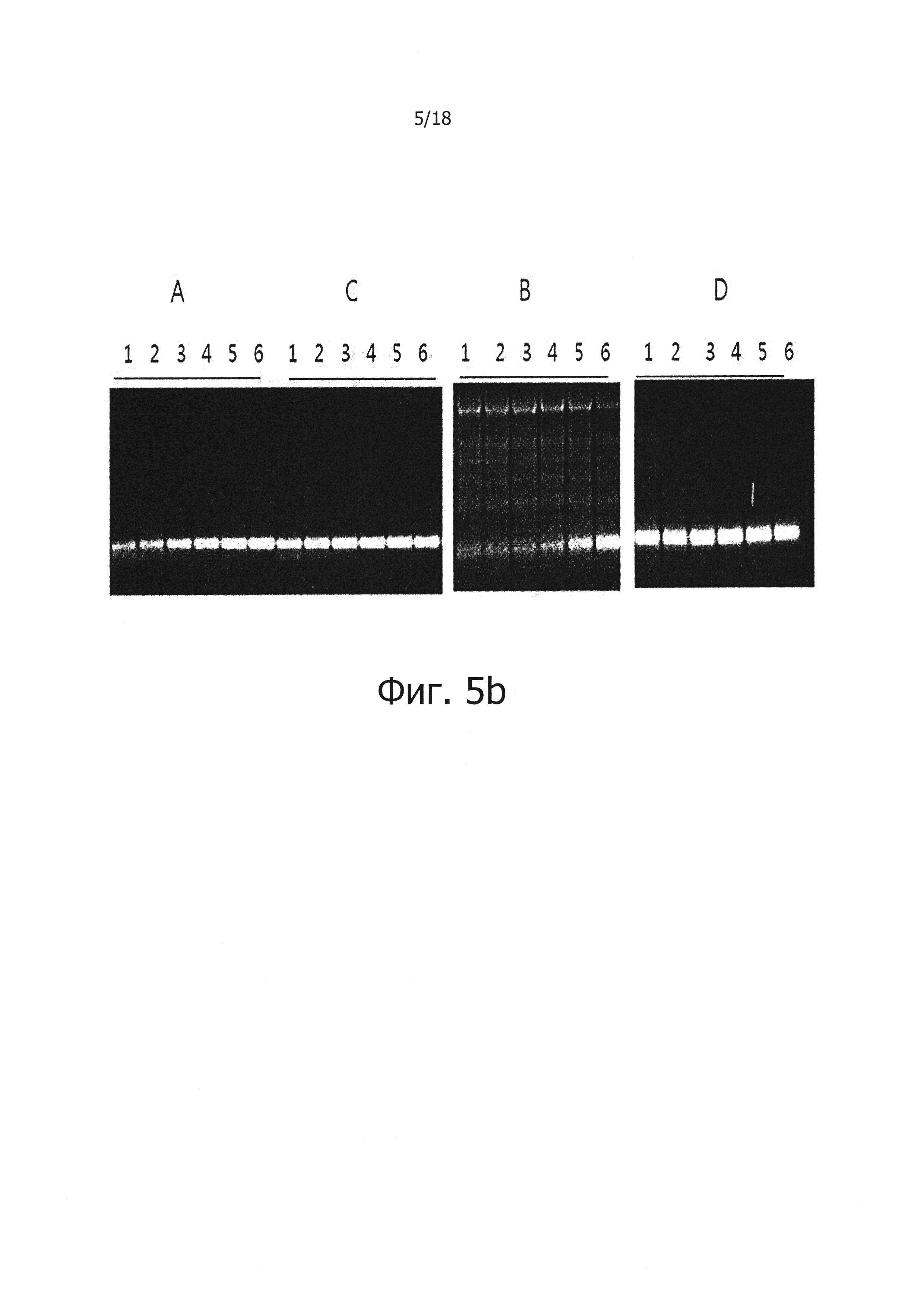
На фиг. 5b продемонстрированы результаты электрофореза продуктов ПЦР с обратной транскрипцией в реальном времени на 2% агарозном геле:
Дорожки 1, 2, 3, 4, 5 и 6: продукты, полученные из матричной PHK вируса гепатита С, имеющей число копий 106, 105, 104, 103, 102 и 10;
А: результаты, полученные при использовании реакционного раствора, не обладающего функцией обратной транскрипции с горячим стартом;
В: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «А»;
С: Результаты, полученные с использованием реакционного раствора для обратной транскрипции с горячим стартом, включающим PPi и PPase; и
D: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «С».
На фиг. 6а приведено сравнение ингибирования неспецифических реакций в ПЦР с обратной транскрипцией в реальном времени между применением реакционного раствора для обратной транскрипции с горячим стартом и Taq-антителом:
А: результаты, полученные при использовании реакционного раствора, не обладающего функцией обратной транскрипции с горячим стартом, который содержит Taq-антитело, вместе с реакционным раствором для ПЦР с горячим стартом;
В: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «А»;
С: результаты, полученные при использовании реакционного раствора для обратной транскрипции с горячим стартом, который содержит PPi и PPase, вместе с реакционным раствором для ПЦР с горячим стартом; и
D: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток, в реакционный раствор «С».
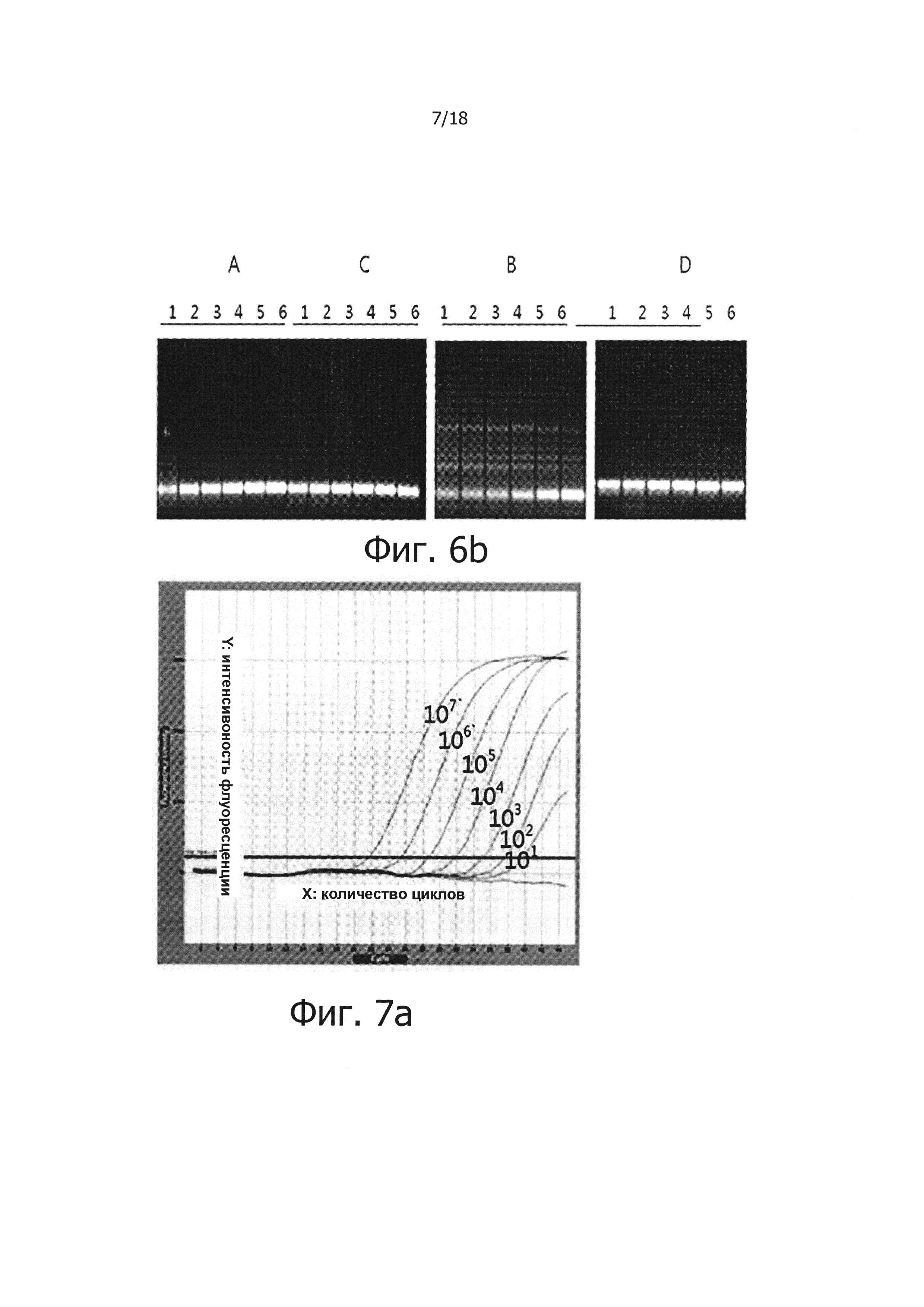
На фиг. 6b приведены результаты электрофореза продуктов ПЦР в режиме реального времени с обратной транскрипцией на 2% агарозном геле:
Дорожки 1, 2, 3, 4, 5 и 6: продукты, полученные из матричной PHK вируса гепатита С, имеющей число копий 106, 105, 104, 103, 102 и 10;
А: результаты, полученные при использовании реакционного раствора, не обладающего функцией обратной транскрипции с горячим стартом, который содержит Taq-антитело, вместе с реакционным раствором для ПЦР с горячим стартом;
В: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «А»;
С: результаты, полученные при использовании реакционного раствора для обратной транскрипции с горячим стартом, который содержит PPi и PPase, вместе с реакционным раствором для ПЦР с горячим стартом;
D: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «С».
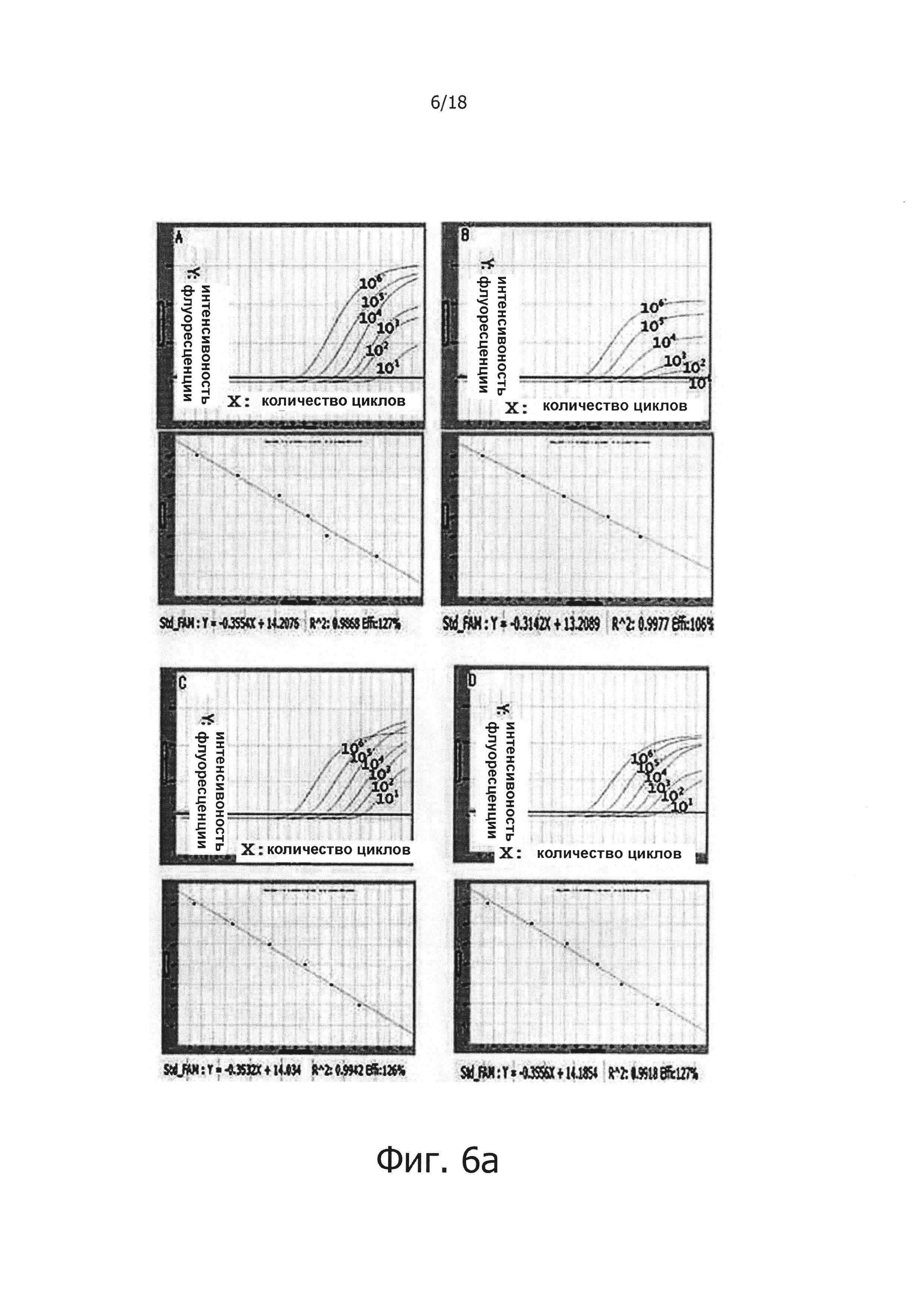
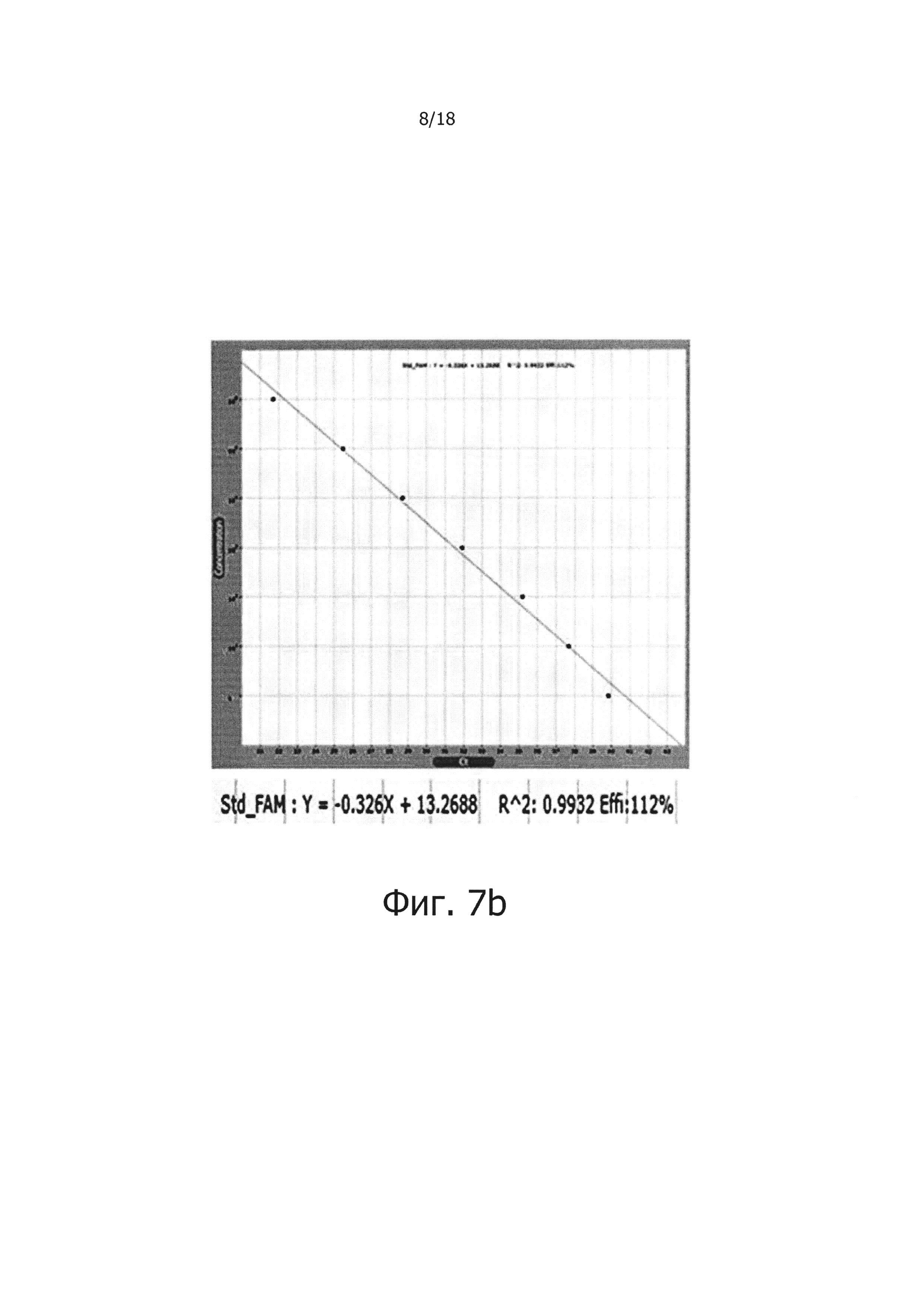
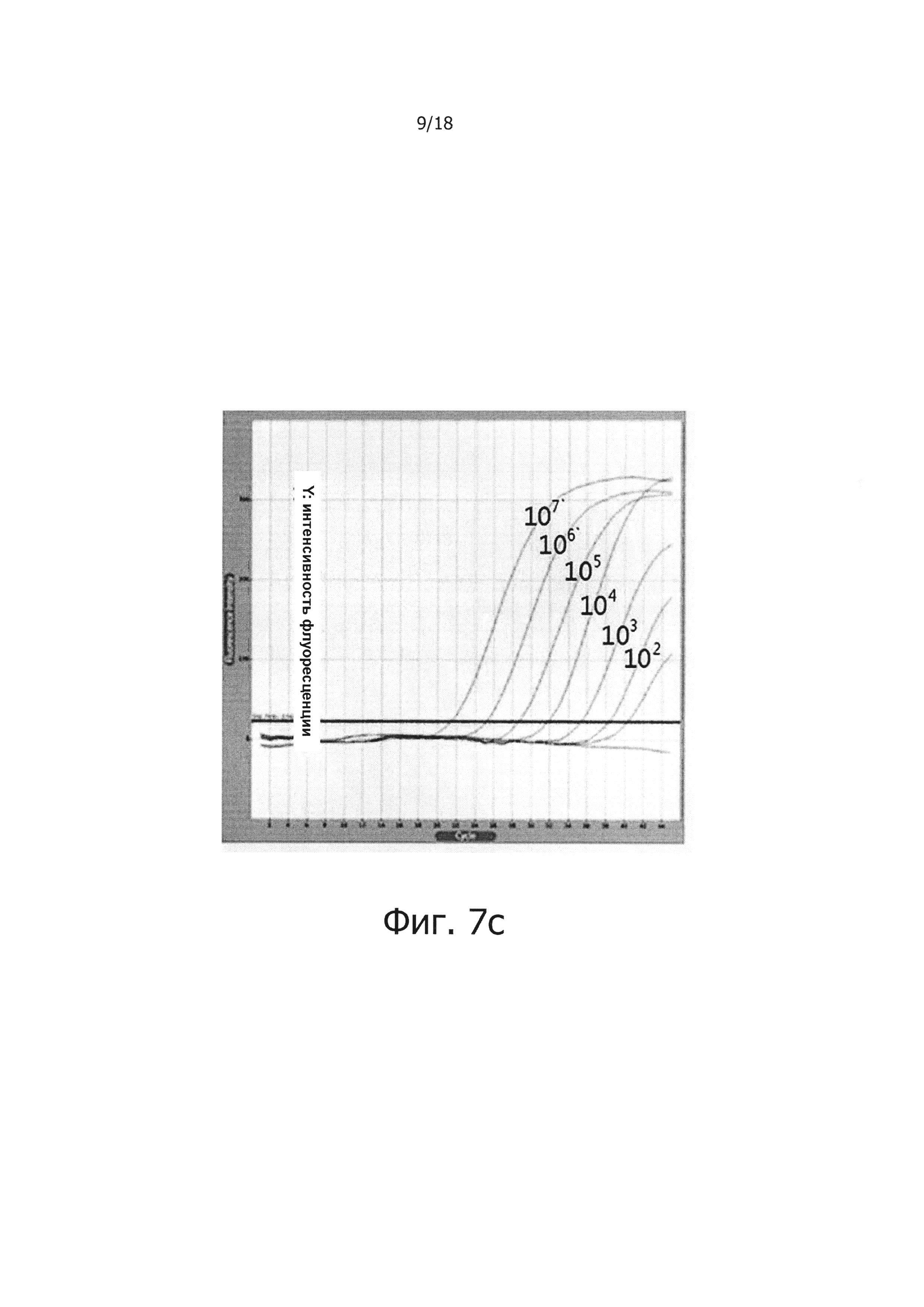
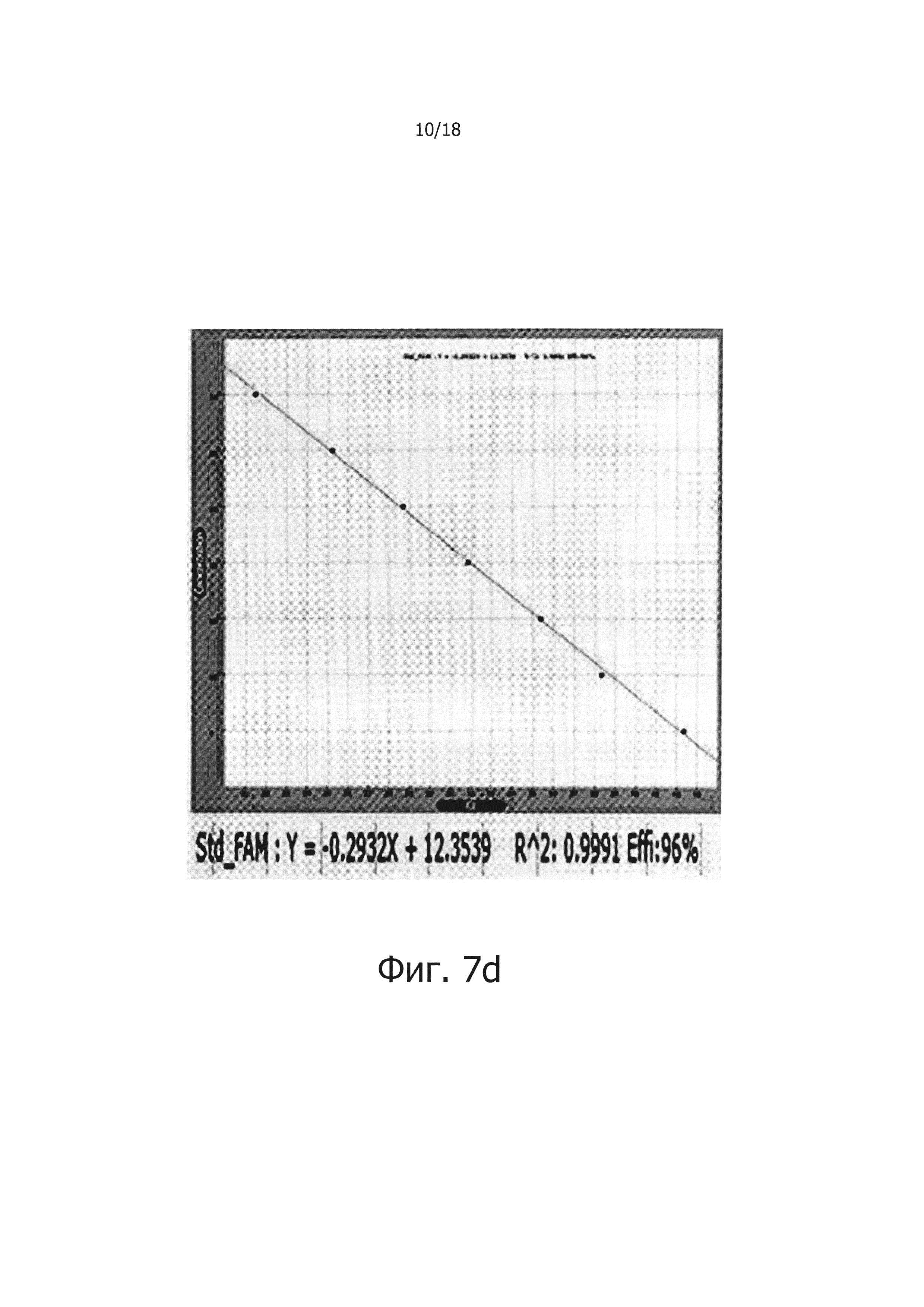
Фиг. 7а и 7с являются диаграммами ПЦР в режиме реального времени с обратной транскрипцией, которые являются демонстрацией того, что композиция обратной транскрипции/ПЦР в виде раствора и композиция обратной транскрипции/ПЦР в сухом виде демонстрируют равную эффективность в ПЦР в режиме реального времени с обратной транскрипцией (фиг. 7а: твердое состояние; фиг. 7с: сухое состояние).
Фиг. 7b и 7d являются стандартными диаграммами ПЦР в режиме реального времени с обратной транскрипцией, которые являются демонстрацией того, что композиция обратной транскрипции/ПЦР в виде раствора и композиция обратной транскрипции/ПЦР в сухом виде демонстрируют равную эффективность в ПЦР в режиме реального времени с обратной транскрипцией (фиг. 7b: твердое состояние; фиг. 7d: сухое состояние).
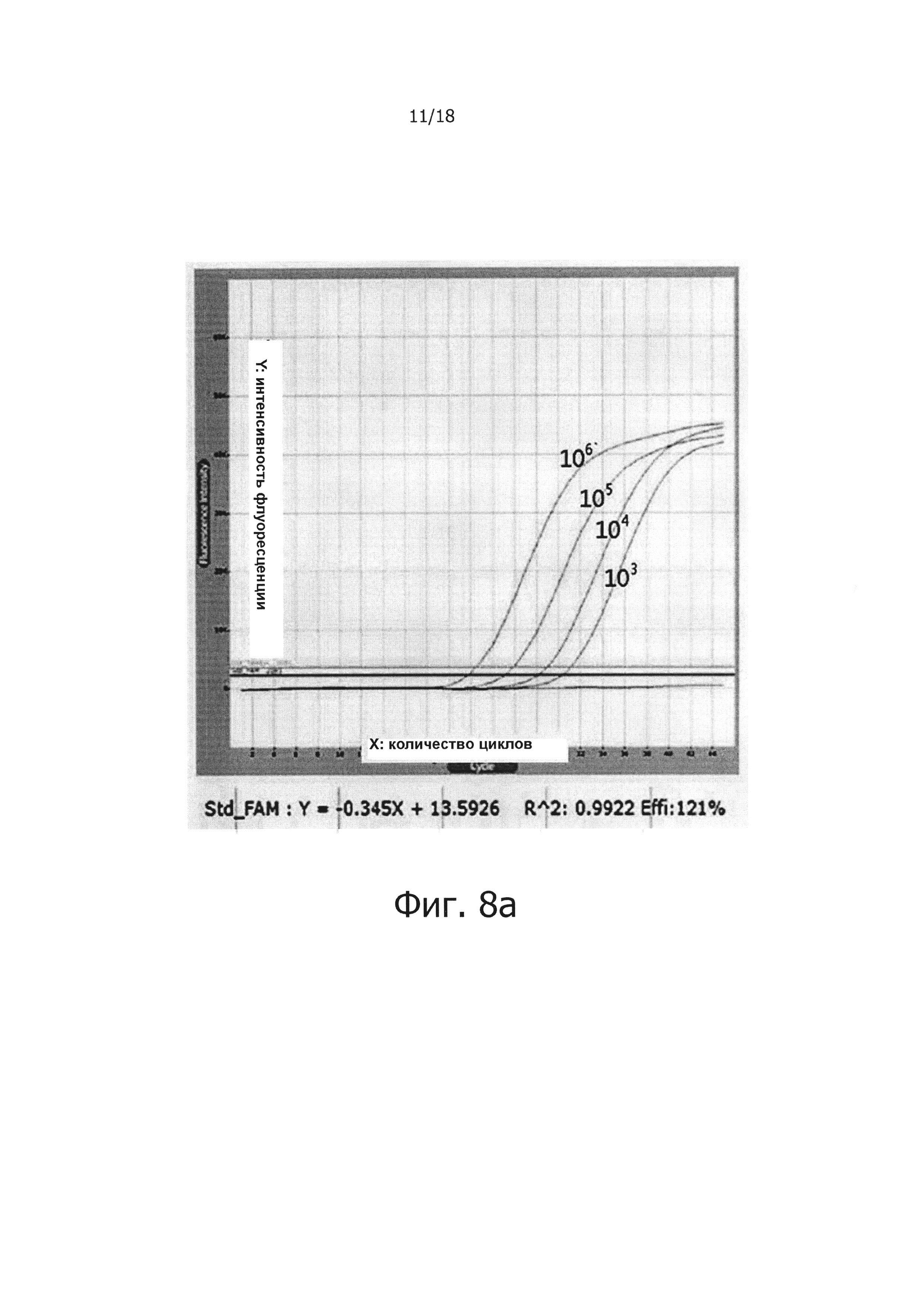
Фиг. 8а представляет собой графическую диаграмму, демонстрирующую результаты проведения ПЦР в режиме реального времени с обратной транскрипцией с использованием смеси в жидком виде в качестве контроля для тестирования стабильности сухой композиции обратной транскрипции/ПЦР как функции периода хранения.
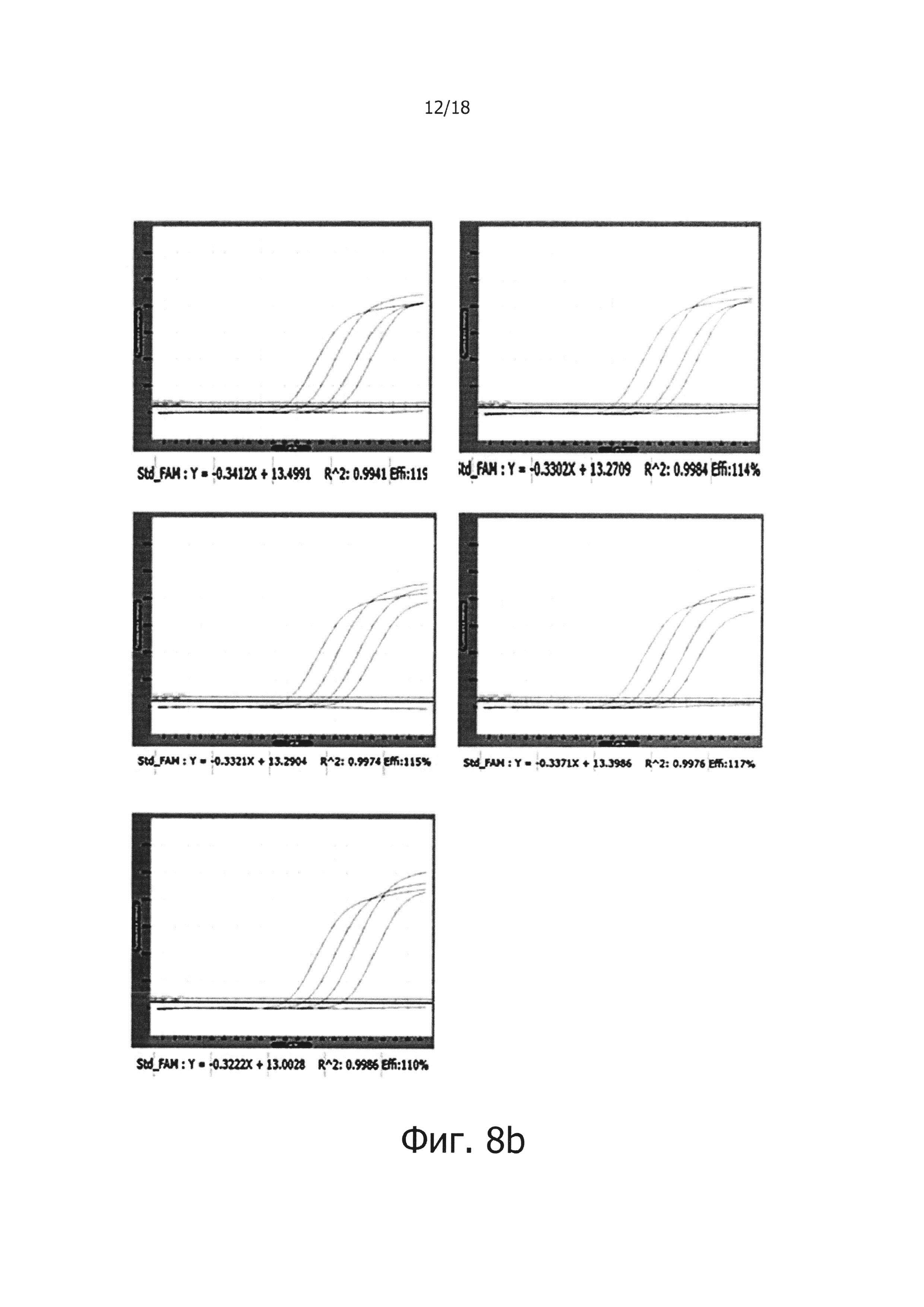
Фиг. 8b представляет собой графическую диаграмму, демонстрирующую результаты проведения ПЦР в режиме реального времени с обратной транскрипцией, с использованием сухой смеси с однодневными интервалами для периода хранения в общей сложности 5 дней после хранения при 50°С для тестирования стабильности сухой смеси при хранении:
от 1 дня по 5 день: количество дней, в течение которых сухую смесь хранили при 50°С.
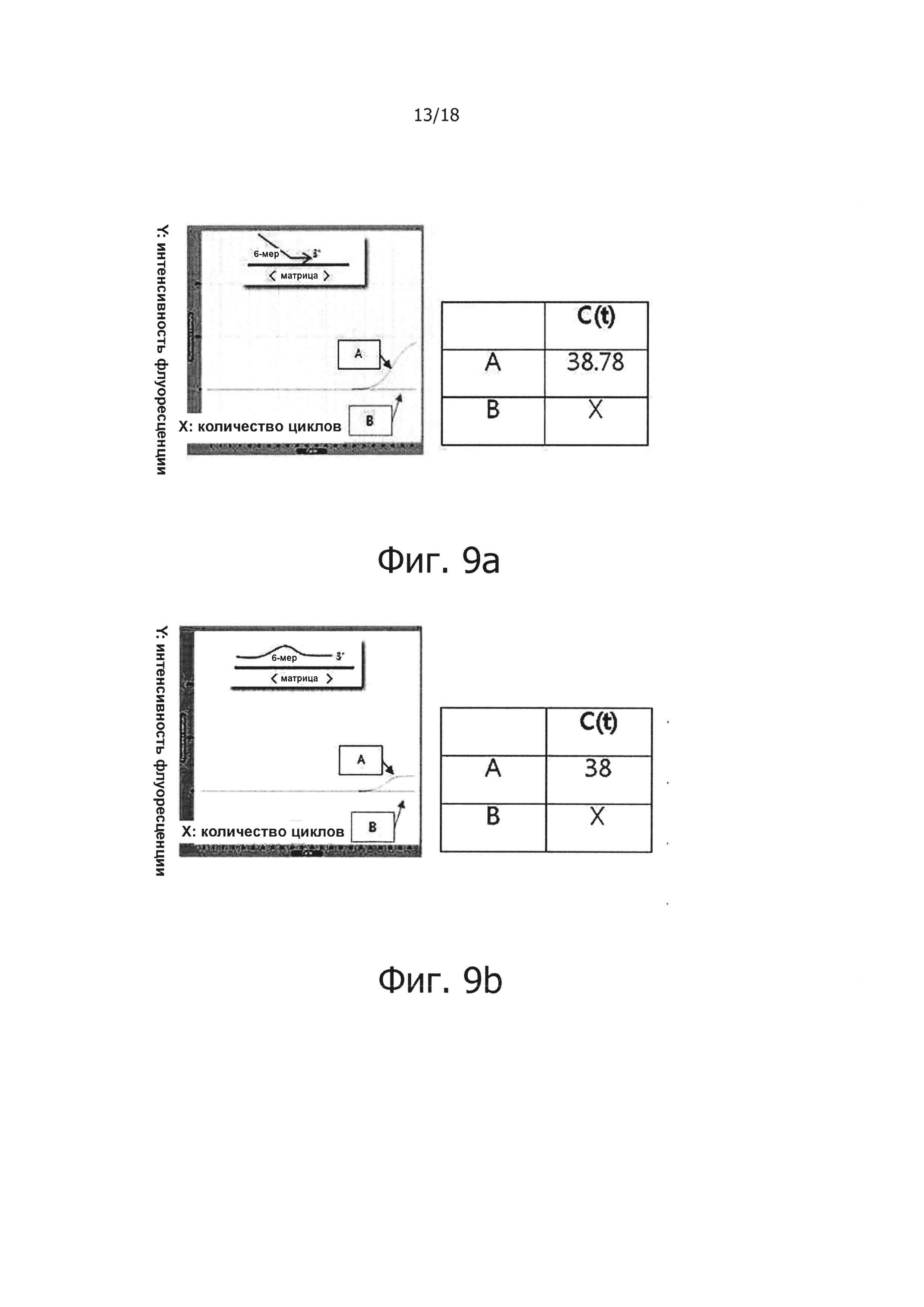
На фиг. 9а приведены результаты проведения ПЦР в режиме реального времени с обратной транскрипцией с использованием праймера, имеющего 6 несовпадающих нуклеотидов на 5' конце, а на фиг. 9b представлены результаты проведения ПЦР в режиме реального времени с обратной транскрипцией с использованием праймера, имеющего 6 несовпадающих нуклеотидов в середине. Также на фиг. 9а и 9b графически продемонстрированы результаты проведения обратной транскрипции в режиме реального времени для подтверждения ингибирования неспецифического связывания праймера с матрицей в реакционной смеси для ПЦР с обратной транскрипцией и горячим стартом.
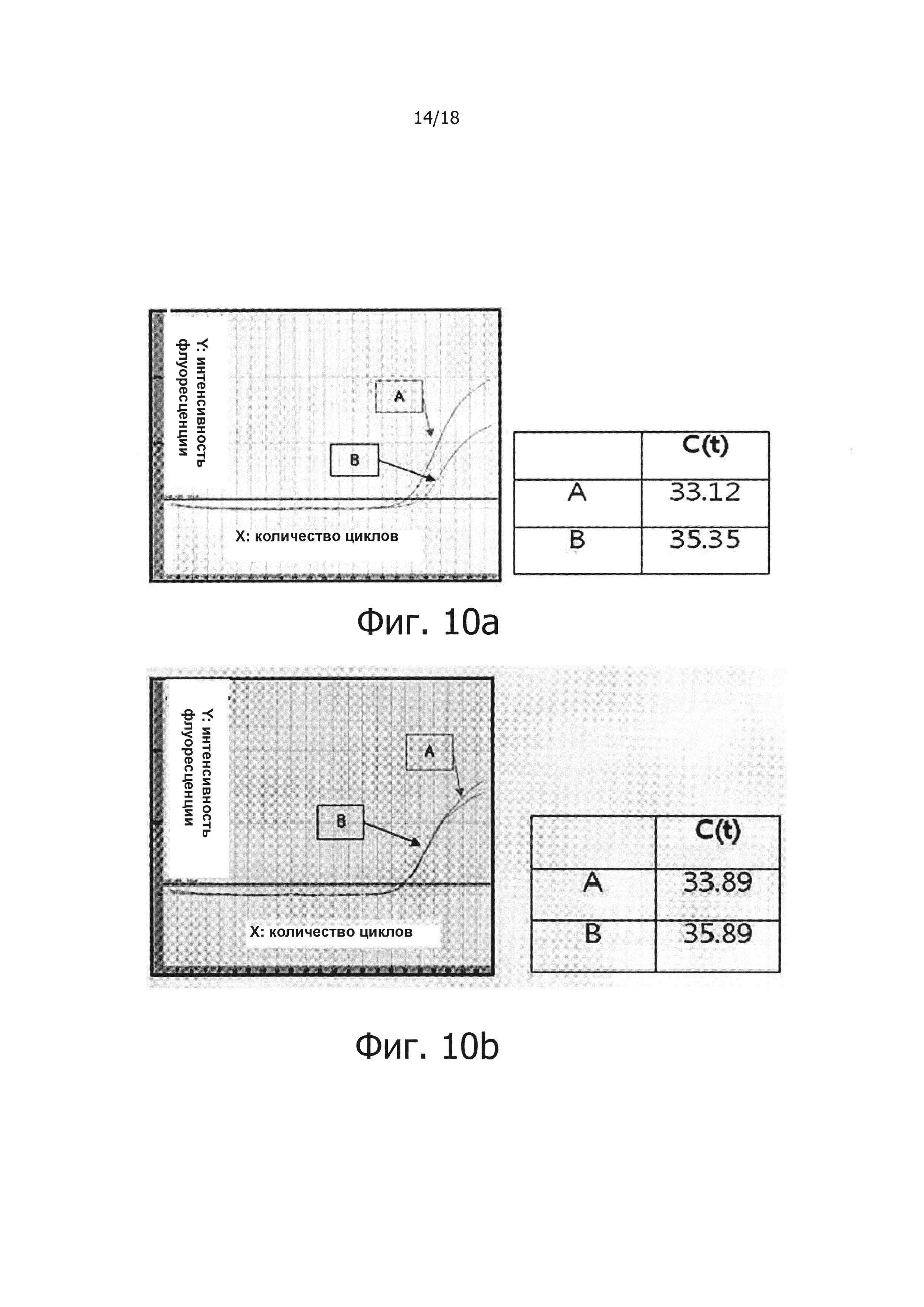
Фиг. 10а и 10b являются графиками, демонстрирующими результаты проведения ПЦР в режиме реального времени с обратной транскрипцией для анализа однонуклеотидного полиморфизма PHK с помощью ПЦР с обратной транскрипцией и горячим стартом:
«А» обозначает результат, полученный с помощью праймера, имеющего точно совпадающую нуклеоитидную последовательность, а «В» обозначает результат, полученный с помощью праймера, имеющего один несовпадающий нуклеотид.
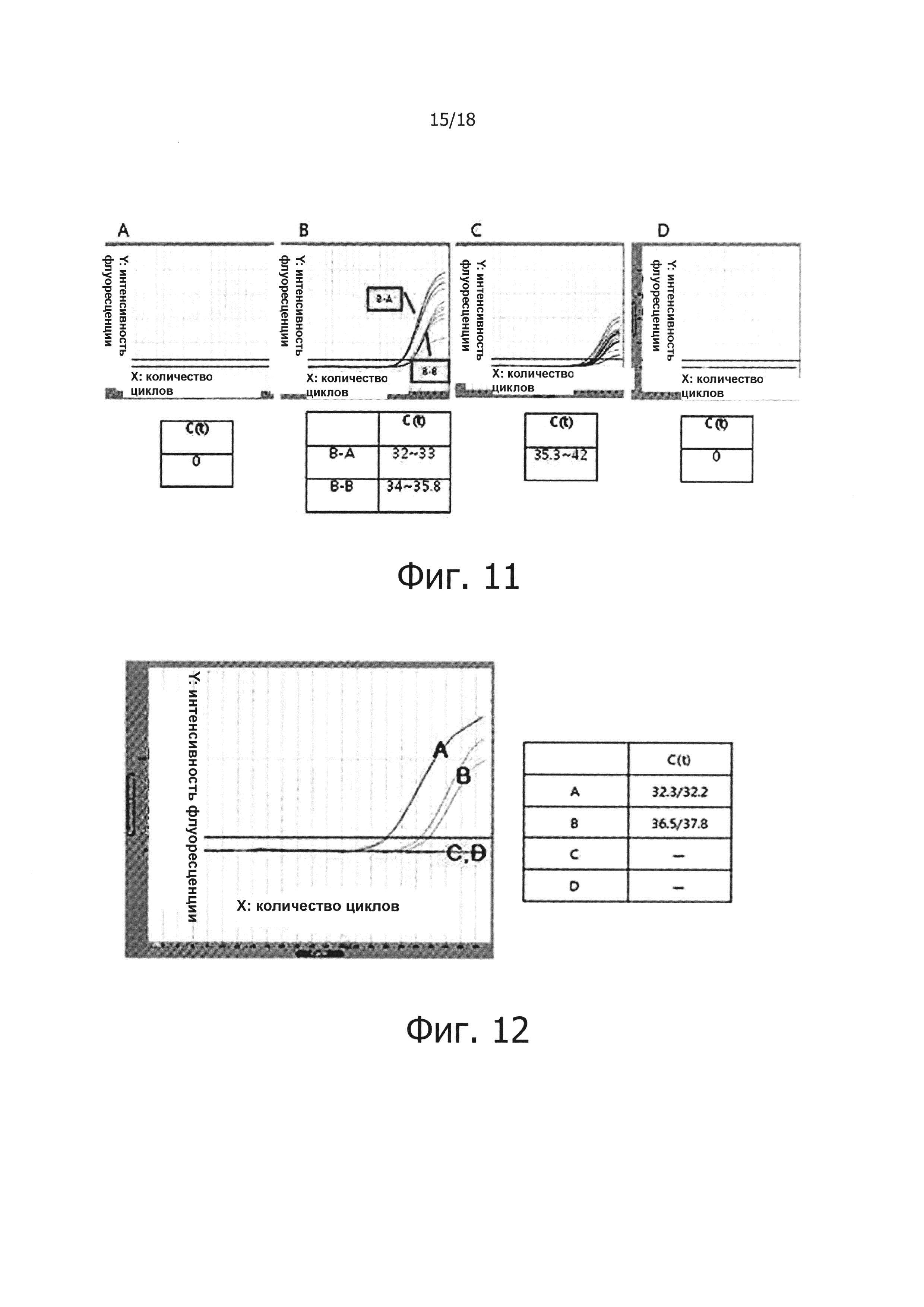
Фиг. 11 графически демонстрирует результаты проведения обратной транскрипции в режиме реального времени для проверки ингибирования неспецифических реакций, являющиеся результатом самопраймирования PHK-PHK, обратной транскрипцией с горячим стартом:
«А» на фиг. 11 демонстрирует результаты проведения ПЦР в режиме реального времени с использованием PHK отдельно без реакции обратной транскрипции; а «В» демонстрирует результаты проведения реакции обратной транскрипции с использованием праймера, с последующим проведением ПЦР в режиме реального времени. «В-А» обозначает результат, полученный путем проведения реакции обратной транскрипции с использованием реакционного раствора для обратной транскрипции с горячим стартом, а «В-В» демонстрирует результат, полученный путем проведения реакции обратной транскрипции с использованием реакционного раствора, не обладающего функцией обратной транскрипции с горячим стартом. «С» демонстрирует результаты осуществления реакции обратной транскрипции с использованием PHK отдельно в реакционном растворе, не обладающем функцией обратной транскрипции с горячим стартом, с последующим проведением ПЦР в режиме реального времени. «D» демонстрирует результаты проведения реакции обратной транскрипции с использованием PHK отдельно в реакционном растворе для обратной транскрипции с горячим стартом, с последующим проведением ПЦР в режиме реального времени.
Фиг. 12 представляет собой графическую диаграмму, демонстрирующую результаты проведения ПЦР в режиме реального времени с обратной транскрипцией для проверки, будет ли ингибироваться терминацией PHK самопраймирование PHK-PHK в реакции обратной транскрипции. «А» и «В» демонстрируют результат, полученный с помощью нетерминированной PHK, а «С» и «D» демонстрируют результаты, полученные с помощью терминированной PHK. Для «А» и «С», была проведена простая реакция обратной транскрипции, а для «В» и «D», была проведена реакция обратной транскрипции с горячим стартом.
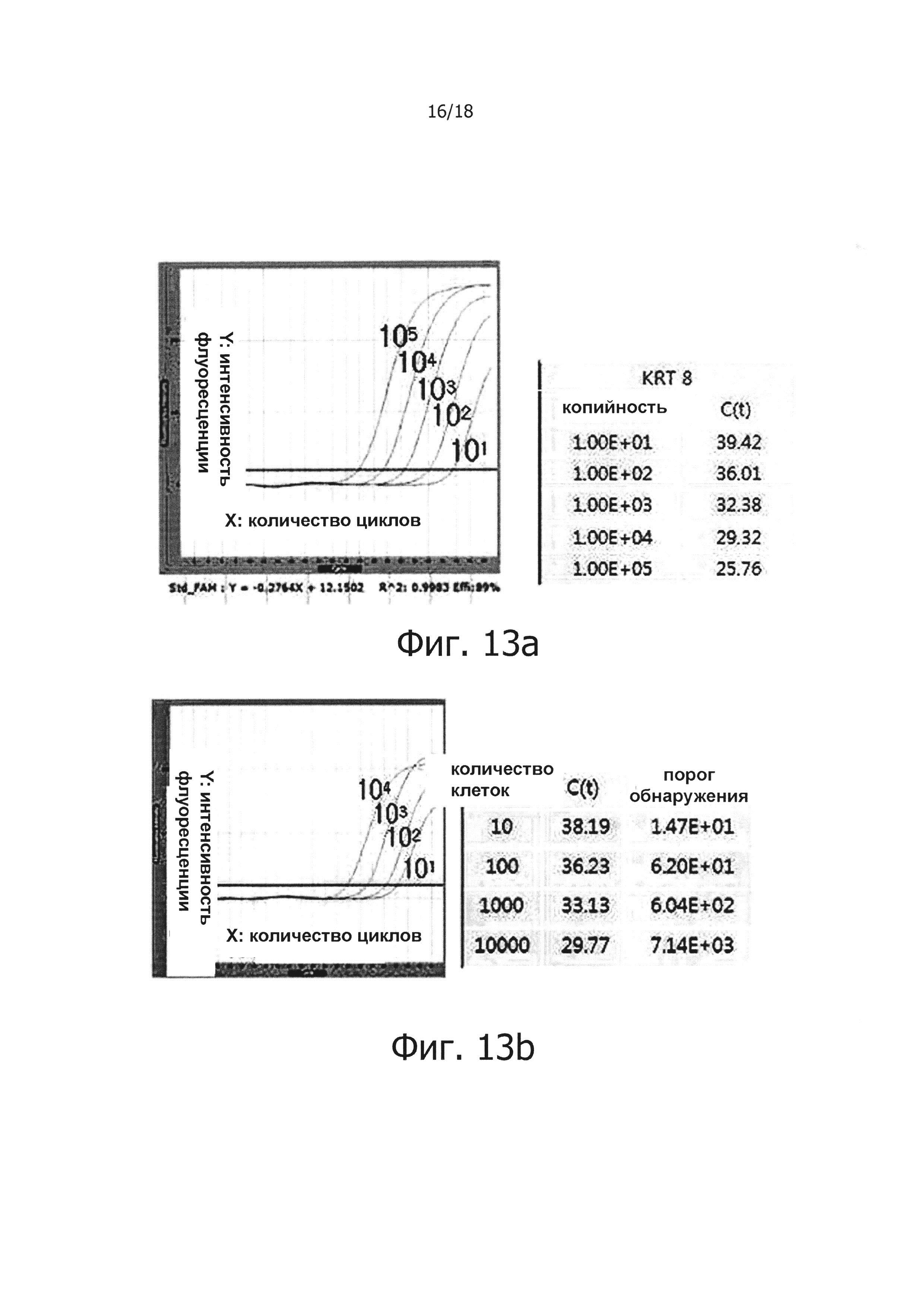
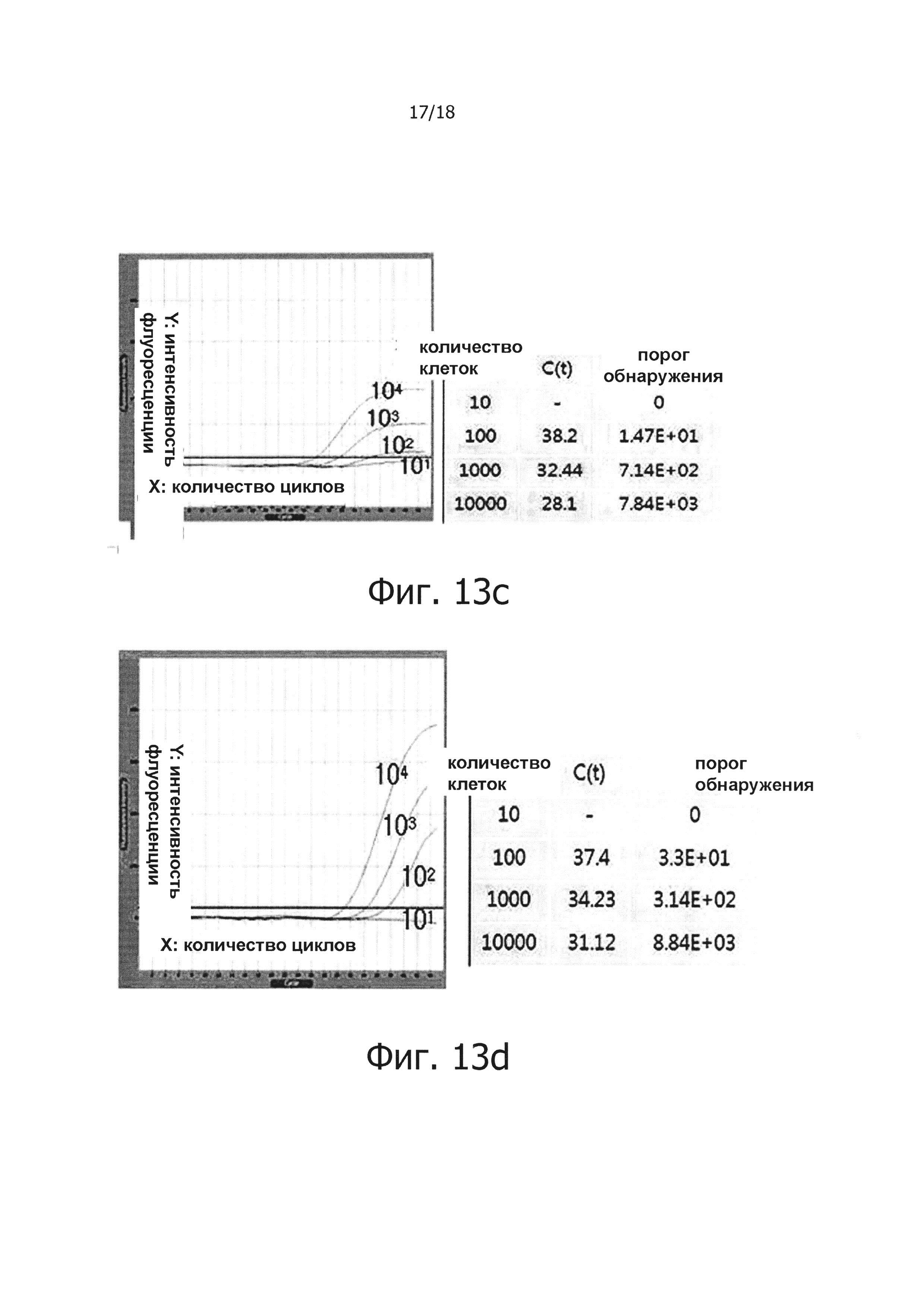
На фиг. 13а приведены результаты снижения маркера злокачественных опухолей кератина-8 с использованием PHK, экстрагированной из клеток Hela. Для количественного анализа, экстрагированную PHK серийно 10-кратно разводили и подвергали ПЦР в режиме реального времени с обратной транскрипцией для получения стандартной кривой. Фиг. 13b, 13с, 13d и 13е представляют собой графики, демонстрирующие результаты проведения ПЦР в режиме реального времени с обратной транскрипцией для проверки, улучшает ли терминация PHK и ПЦР с обратной транскрипцией и горячим стартом порог обнаружения маркера злокачественной опухоли.
Лучший вариант осуществления изобретения
В одном аспекте настоящее изобретение направлено на композицию для реакции обратной транскрипции с горячим стартом, которая содержит ион Mg, четыре типа dNTP, обратную транскриптазу, пирофосфат (PPi), и пирофосфатазу (PPase).
Обратная транскриптаза, используемая в настоящем изобретении, может быть любой известной обратной транскриптазой. В частности, могут быть использованы коммерчески доступные AMV или MMLV.
В качестве пирофосфатазы (PPase) в настоящем изобретении может быть использована коммерчески доступная PPase без каких-либо ограничений. В частности, PPase, которая используется в настоящем изобретении предпочтительно может быть Tte-неорганической пирофосфотазой (SibEnzyme Ltd.) полученной из Е.coli, в которые клонировали ген неорганической пирофосфатазы, полученной из Thermus thermophilics В35, или Pto-неорганической пирофосфатазой (Bioneer corporation, Корея), полученной Е.coli, в которые клонировали неорганическую пирофосфатазу, полученную из Picrophilus torridus. 1 единица Pto-неорганической пирофосфатазы определяется как количество фермента, требуемое для выработки 40 ммоль фосфата из пирофосфата в течение 1 минуты. Реакцию проводят с использованием Tris-HCl (рН 7,5), 5 мМ MgCl2, и 2,0 мМ PPi с общим объемом реакции 0,5 мл при 70°С в течение 10 минут.
PPi, который содержится в композиции, может быть добавлен в концентрации 0,1-5,0 мМ, предпочтительно 0,2-3,0 мМ исходя из конечного реакционного раствора. Если концентрация PPi выше, чем 5,0 мМ, концентрацию используемой PPase необходимо пропорционально повысить, и в данном случае количество продукта реакции обратной транскрипции может снизится. Если концентрация PPi ниже, чем 0,1 мМ, способность захватывать ионы Mg в композиции для реакции обратной транскрипции будет снижена, и, таким образом, не может быть достигнут эффект ингибирования выработки неспецифических продуктов, вызванных неспецифическим праймированием (нецелевое праймирование). Когда концентрация PPi составляет 0,1-5 мМ, предпочтительно в реакционной смеси для обратной транскрипции содержится 0,005-0,25 Ед. PPase. PPase используется в количестве 0,005-0,25 Ед. на 0,1 мМ PPi. Если PPase используется в концентрации выше, чем 0,25 Ед. на 0,1 мМ PPi, результат может быть подтвержден при более высокой концентрации, когда используется матрица с более высоким числом копий, по сравнению с тем, когда используется матрица с низким числом копий, а реактивность обратной транскрипции может быть снижена, что приводит к значимому снижению количества реакционного продукта. Если концентрация PPase ниже, чем 0,005 Ед. на 0,1 мМ PPi, реакция обратной транскрипции может ингибироваться.
Раствор реакционного буфера, который используется в настоящем изобретении, предпочтительно является буфером (рН 9,0) содержащим 10 мМ Tris HCl и 40 мМ KCl, и четыре типа dNTP, а именно dATP, dTTP, dGTP и dCTP. При необходимости композиция может дополнительно включать вещества, необходимые для реакции обратной транскрипции, включая праймеры, нуклеотидную матрицу и т.п. Праймеры предпочтительно могут быть случайными праймерами, или праймерами, специфичными к нуклеотидной матрице, и нуклеотидная матрица предпочтительно является PHK, необходимой для реакции обратной транскрипции. Кроме того, композиция может содержать флуоресцентный краситель, который может быть выбран из группы, состоящей из SyBr Green, EtBr и HRdye.
Композиция для реакции обратной транскрипции по настоящему изобретению может дополнительно содержать праймеры для обратной транскрипции. Праймеры для обратной транскрипции, которые используются в настоящем изобретении, могут быть любыми праймерами, которые отжигаются на PHK-матрице для осуществления обратной транскрипции PHK. В частности, праймеры для обратной транскрипции могут быть поли-А праймерами, или праймерами, специфичными для PHK-матрицы.
При этом композиция для реакции обратной транскрипции по настоящему изобретению может включать краситель и/или полиол, который не реагирует с нуклеиновой кислотой, для удобства проведения экспериментов, предотвращения контаминации продуктами ПЦР, стабилизации ДНК-полимеразы и dNTP и улучшения реакционной способности.
«Инертный краситель» должен быть выбран из веществ, которые не оказывают влияния на реакции обратной транскрипции, и используется для анализа или идентификации реакций ПЦР с помощью продуктов реакции обратной транскрипции. Примеры веществ, которые удовлетворяют таким условиям, включают водорастворимый краситель, такой как родамин, тамра, лаке, бромфеноловьш синий, ксилен цианол, бромкрезоловый красный, и крезоловый красный. Из их числа предпочтительно используется ксиленцианол. Инертный краситель может содержаться в количестве 0,0001-0,01 масс.%, предпочтительно 0,001-0,005 масс.%, а более предпочтительно 0,001-0,003 масс.%, исходя из общей массы композиции. Если содержание инертного красителя в композиции меньше, чем 0,0001 масс.%, то из-за низкой концентрации красителя будет сложно визуально наблюдать миграцию образца в ходе гель-электрофореза в агарозе для анализа после реакции обратной транскрипции. Если содержание инертного красителя в композиции выше, чем 0,01 масс.%, то высокая концентрация водорастворимого красителя может действовать как ингибитор реакции в ходе реакции обратной транскрипции. Кроме того, этот краситель может мешать миграции образца в ходе гель-электрофореза в агарозе.
Также как вспомогательный стабилизатор для дополнительной стабилизации композиции настоящего изобретения может быть использован полиол, который может быть одним или несколькими соединениями, выбранными из группы, состоящей из глюкозы, глицерина, маннитола, галактитола, глюцитола и сорбитола. Содержание полиола в композиции может составлять 10-500 мМ, а предпочтительно 50-300 мМ. При содержании полиола выше, чем 500 мМ из-за растворимости водорастворимого полимера его может быть трудно растворить в водном растворе, из-за высокой вязкости его будет сложно смешать в достаточной степени, полиол будет повышать объем композиции до объема больше, чем требуется, и полиол будет с трудом растворяться в стерильной дисстиллированной воде и растворе гена перед реакцией обратной транскрипции. Кроме того, высокая концентрация водорастворимого полимера может действовать как реакционный ингибитор в ходе реакции обратной транскрипции. С другой стороны, если содержание полиолов в композиции меньше, чем 10 мМ, целевой фермент и поверхностные молекулы воды не могут быть в достаточной степени покрытыми, так что они не будут защищены, и, таким образом, эффект рационально стабилизированного фермента не может быть достигнут.Кроме того, раствор может быть размазан по всему дну пробирки из-за его низкой вязкости и не может быть высушен в идеальной форме, а фермент не может быть в достаточной степени защищен. В настоящем изобретении в дополнение к полиолу в качестве стабилизатора могут быть использованы желатин, бычий сывороточный альбумин, Thesit или PEG-8000.
Композиция настоящего изобретения предпочтительно является лиофилизированной или высушенной для повышения стабильности, удобства хранения и стабильности в ходе длительного хранения. Сушка может быть осуществлена известным способом сушки, таким как сушка при комнатной температуре, сушка при повышенной температуре, например, 40-60°С, лиофилизация или сушка при пониженном давлении. Кроме того, любой способ сушки может быть использован, при условии, что компонент композиции не будет утерян. Метод сушки, как описано выше, может быть применен в зависимости от типа и количества используемого фермента. В настоящем изобретении предпочтительно могут быть использованы способ замораживания-высушивания или способ с пониженным давлением, в котором используется вакуумное центрифугирование.
Композиция для ПЦР с обратной транскрипцией и горячим стартом может быть получена в стабильной форме путем введения реакционной смеси в отдельную реакционную пробирку, с последующим немедленным замораживанием и сушкой реакционной смеси.
При необходимости реакционная смесь может дополнительно включать праймер, зонд, нуклеотидную матрицу, флуоресцентный краситель, инертный краситель и/или полиол.
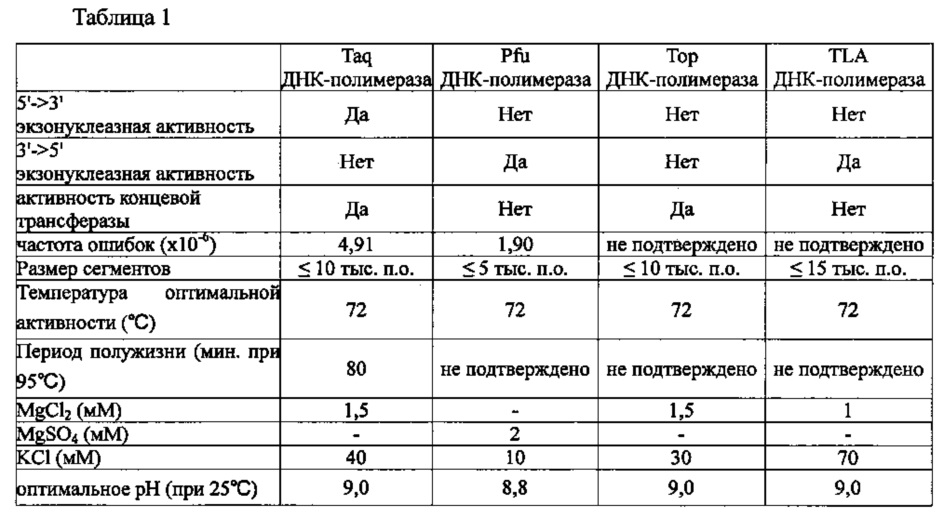
В качестве ДНК-полимеразы в настоящем изобретении можно использовать любую известную ДНК-полимеразу без каких-либо конкретных ограничений. Из числа этих полимераз могут быть использованы отдельно или в комбинации полимераза, обладающая 5'->3' экзонуклеазной активностью, полимераза, обладающая 3'->5' экзонуклеазной активностью, и полимераза, которая не обладает ни 5'->3' экзонуклеазной активностью, ни 3'->5' экзонуклеазной активностью. Примеры полимеразы, обладающей 5'->3' экзонуклеазной активностью, включают Taq ДНК-полимеразу, примеры полимеразы, обладающей 3'->5' экзонуклеазной активностью, включают Pfu ДНК-полимеразу или TLA ДНК-полимеразу (Bioneer), а примеры полимеразы, которая не обладает ни 5'->3' экзонуклеазной активностью, ни 3'->5' экзонуклеазной активностью, включают Тор ДНК-полимеразу (Bioneer). ДНК-полимераза может содержаться в композиции для ПЦР с обратной транскрипцией в концентрации 0,1-10 Ед. (единиц), предпочтительно, 0,5-2 Ед., а наиболее предпочтительно 1 Ед. Taq, Pfu, Тор и TLA ДНК-полимеразы обладают характеристиками, представленными в таблице 1 ниже.
Кроме того, композиция для ПЦР с обратной транскрипцией может быть использована, в дополнение к ПЦР с обратной транскрипцией, в любой реакции амплификации нуклеиновых кислот, такой как мультиплексные ПЦР с обратной транскрипцией, ПЦР в режиме реального времени с обратной транскрипцией, количественная ПЦР в режиме реального времени, или множественные ПЦР в режиме реального времени с обратной транскрипцией.
В настоящем изобретении композиция для ПЦР с обратной транскрипцией может дополнительно содержать вещество, которое демонстрирует эффект ПЦР с горячим стартом путем связывания ДНК-полимеразы или регуляции действия ДНК-полимеразы. Это вещество может быть выбрано из группы, состоящей из антитела, аптамера и аффитела, которое связывает ДНК-полимеразу.
В настоящем изобретении ДНК-полимераза может быть в модифицированной форме и может иметь эффект ПЦР с горячим стартом, примеры такого фермента включают, без ограничения указанным, полимеразу Tth.
PPase предпочтительно является термостабильным ферментом, который термически стабилен даже при температуре 70°С или выше. Она термически стабильна в ходе процессов обратной транскрипции и ПЦР. В частности, PPase демонстрирует ферментативную активность при температуре схожей с температурой, при которой действуют обратная транскриптаза и ДНК-полимераза. По этой причине предотвращаются реакции обратной транскрипции и ПЦР в процессе смешивания, а поскольку PPase действует, расщепляя PPi при температуре, равной или выше температуры, при которой специфически гибридизуются праймеры, то обратная транскриптаза может быть активирована и реакция обратной транскрипции может быть инициирована при температуре гибридизации праймеров, что приводит к устраненению неспецифического синтеза кДНК. Кроме того, неспецифическая амплификация нуклеиновых кислот может быть предотвращена при гибридизации ДНК-полимеразы. В результате значительно может быть повышена селективность по сравнению с селективностью обычной обратной транскрипции/ПЦР, и успешно может быть обнаружено очень малое количество целевой нуклеиновой кислоты. Таким образом, оригинальная композиция для реакции обратной транскрипции с горячим стартом или ПЦР с обратной транскрипцией, содержащая PPi и PPase, является стабильной композицией, которая может решить проблемы неспецифических реакций обратной транскрипции, идущих в обычной реакции обратной транскрипции, и дальнейшей неспецифической амплификации в ПЦР, и которая может специфически амплифицировать искомый целевой продукт без проблем с получением точного результата амплификации.
В частности, композиция для реакции обратной транскрипции с горячим стартом по настоящему изобретению обладает следующими преимуществами по сравнению с различными композициями для реакции обратной транскрипции, о которых сообщалось на предшествующем уровне техники, и которые использовались коммерчески:
1) Даже когда целевая PHK содержится в очень малом количестве в общей PHK реакционного раствора, с помощью композиции для ПЦР с обратной транскрипцией и горячим стартом по настоящему изобретению можно осуществить селективную обратную транскрипцию целевой PHK для осуществления амплификации ПЦР способом, специфичным для целевой PHK. Таким образом, композиция настоящего изобретения позволяет детектировать очень малое количество вируса PHK и анализировать PHK генов, связанных со злокачественными опухолями.
2) с помощью композиции настоящего изобретения можно предотвращать выработку продуктов амплификации, вызванных неспецифическим праймированием, и, таким образом, можно одновременно детектировать различные мишени в мультиплексных ПЦР с обратной транскрипцией, в который реакции ПЦР с обратной транскрипцией для различных мишеней проводятся одновременно.
3) Поскольку все компоненты реакционной смеси для ПЦР с обратной транскрипцией, которые использовались в настоящем изобретении, получают в виде единой смеси, при проведении ПЦР с обратной транскрипцией не требуется отдельный процесс смешивания, и, таким образом, можно предотвратить возникновение ошибки, вызванной смешиванием в ходе реакции. Кроме того, можно предотвратить возникновение неспецифических продуктов ПЦР, можно удобно провести эксперимент, можно предотвратить контаминацию продуктами реакции ПЦР с обратной транскрипцией, и может быть повышена стабильность и реакционная способность обратной транскриптазы, ДНК-полимеразы и dNTP.
4) При использовании нуклеиновой кислоты в смеси со стабилизатором, растет стабильность, что приводит к легкому использованию и удобному хранению.
В предпочтительном воплощении настоящего изобретения для решения проблемы неспецифических реакций обратной транскрипции, имеющих место в предшествующем уровне техники, и для проведения реакции обратной транскрипции с горячим стартом мишень-специфичным образом, в кДНК синтезируется только искомая PHK, a PPi и PPase используют в реакции обратной транскрипции для осуществления реакции ПЦР, специфичным для синтезированной кДНК образом, для того, чтобы посредством этого амплифицировать искомую PHK с высокой чувствительностью. В частности, 0,5 мМ - 2,0 мМ (предпочтительно 2,0 мМ) PPi и 0,005 Ед. - 0,25 Ед., предпочтительно 0,1 Ед. PPase добавляли в реакционную смесь для обратной транскрипции, содержащей обратную транскриптазу, после чего проводили реакцию обратной транскрипции с использованием реакционной смеси при 42°С в течение 60 минут. В результате, было показано, что когда добавляли PPase, реакции обратной транскрипции ингибировались PPi (см. фиг. 1), но когда добавляли PPi и PPase, реакции обратной транскрипции и ПЦР активировались с увеличением количества продукта реакции (см. фиг. 2 и 3). Кроме того, было показано, что при амплификации гена вируса гепатита С с помощью PPi и PPase, можно обнаружить PHK-матрицу, с числом копий 1010 - 10 (см. фиг. 4), а при добавлении общей PHK, экстрагированной из человеческих клеток, в дополнение к PHK-матрице из вируса гепатита С, ингибировались неспецифические реакции, вызванные человеческой PHK, и PHK, отличная от целевой PHK, не приводила к снижению эффективности реакции и изменениям в чувствительности и способности к детекции. Однако в отсутствие PPi и PPase неспецифические реакции были вызваны добавлением человеческой PHK (см. фиг. 5а и 5b). Более того, было показано, что в способе ПЦР с обратной транскрипцией и горячим стартом неспецифические реакции значительно снижались по сравнению с неспецифическими реакциями в обычных способах ПЦР с горячим стартом, в которых используется Taq-антитело, и, таким образом, селективно детектировалась с высокой чувствительностью целевая PHK даже с числом копий 10 (см. фиг. 6а и 6b). Кроме того, композицию для ПЦР с обратной транскрипцией и горячим стартом по настоящему изобретению сушили для увеличения стабильности и стабильности при хранении, и было обнаружено, что сухая композиция стабильно демонстрирует результаты реактивной способности и амплификации схожие с теми, что были для композиции, которую не подвергали сушке (см. фиг. 7 и 8).
Соответственно, композиция для реакции обратной транскрипции с горячим стартом и композиция для ПЦР с обратной транскрипцией могут быть использованы для проведения высокочувствительной реакции обратной транскрипции и ПЦР, и таким образом, могут быть преимущественно использованы в технологиях амплификации PHK для проверки различных вирусов и проверки экспрессии генов злокачественных новообразований.
В настоящем изобретении для предотвращения неспецифического самопраймирования и амплификации нуклеотидной матрицы в реакциях амплификации нуклеиновых кислот, таких как реакция ПЦР или реакция количественной ПЦР в режиме реального времени для обнаружения целевой нуклеиновой кислоты, дополнительно может быть использован способ, в котором к нуклеотидной матрице для осуществления реакции терминации добавляются вещество для реакции терминации полимеризации и полимераза нуклеиновых кислот, чтобы нуклеотидная матрица не могла выполнять роль праймера, и таким образом, чтобы только целевая нуклеиновая кислота могла быть амплифицирована и обнаружена с высокой чувствительностью.
Таким образом, композиция настоящего изобретения может быть охарактеризована тем, что дополнительно содержит нуклеотидную матрицу, с 3'-концом которой связан терминатор полимеризации нуклеиновых кислот для предотвращения неспецифической полимеризации нуклеиновых кислот. Терминатор полимеризации нуклеиновых кислот может быть соединением, схожим с нуклеиновыми кислотами, которое активен в форме трифосфата, способного действовать на полимеразу нуклеиновых кислот и имеет группы, отличные от гидроксильной группы на 3'-конце.
В настоящем изобретении нуклеотидную матрицу с терминатором полимеризации, который присоединен для предотвращения неспецифической полимеризации нуклеиновой кислоты, получают представленным ниже способом получения нуклеиновых кислот, включающим стадии: 1) терминации 3'-конца нуклеотидной матрицы с помощью реакционной смеси, содержащей полимеразу нуклеиновых кислот, буфер для ферментативной реакции и терминатор полимеризации нуклеиновых кислот; и 2) инактивации или удаления терминатора полимеризации нуклеиновых кислот из реакционной смеси.
Более конкретно, способ получения нуклеиновых кислот может включать стадии: 1) отделения и очистки нуклеиновой кислоты от биологического образца, содержащего нуклеиновую кислоту; 2) терминации 3'-конца выделенной и очищенной нуклеиновой кислоты матрицы стадии 1) с помощью реакционной смеси, содержащей полимеразу нуклеиновых кислот, буфер для ферментативной реакции и терминатор полимеризации нуклеиновых кислот; и 3) инактивации или удаления терминатора полимеризации нуклеиновых кислот из реакционной смеси, содержащей нуклеиновую кислоту, терминированную на 3'-конце.
Способ получения нуклеиновых кислот, описанный в настоящем изобретении, может быть осуществлен с помощью известного обычного устройства для экстракции нуклеиновых кислот, например, устройства, описанного в патенте Республики Корея No. 10-0148239, US 5702590, US 5647994, ЕР 0691541, US 5336760, US 5897783, US 6187270, или патентной заявке Республики Корея No. 10-2008-0032904. Кроме того, в настоящем изобретении предпочтительно в качестве устройства для автоматической экстракции нуклеиновых кислот может использоваться система «ExiPrep™ 16» - полностью автоматизированная система для очистки ДНК/PHK/белков (Bioneer, Корея).
В настоящем изобретении образец может быть образцом, который содержит нуклеиновую кислоту (полинуклеотид) и который получен из любого растения, животного, бактерии или вируса.
В настоящем изобретении нуклеиновой кислотой является PHK или ДНК, а полимераза нуклеиновых кислот включает любую полимеразу нуклеиновых кислот, которая позволяет прикрепить терминатор к 3'-концу ДНК или PHK для терминации полимеризации.
Более конкретно, полимераза нуклеиновых кислот, которая используется в настоящем изобретении, предпочтительно является полимеразой, которая не обладает 3' → 5' экзонуклеазной активностью, чтобы не гидролизовать терминатор. Более предпочтительным является полимер, который теряет свою ферментативную активность при температуре 90°С или выше. Полимераза нуклеиновых кислот может включать, по меньшей мере, одну, выбранную из числа PHK-зависимой PHK-полимеразы, PHK-зависимой ДНК-полимеразы, ДНК-полимеразы и PHK-полимеразы.
При использовании в данном документе термин «терминатор полимеризации нуклеиновых кислот» относится к веществу, которое терминирует полимеризацию всех фрагментов нуклеотидной матрицы, так что нуклеиновая кислота уже не удлиняется. Термин также относится к веществу, которое связывает конец фрагмента нуклеотидной матрицы, так что удлинение цепи нуклеиновой кислоты не может больше произойти.
При использовании в данном документе термин «терминация» означает, что «терминатор полимеризации нуклеиновых кислот» ковалентно связан с 3'-концом нуклеиновой кислоты для терминации полимеризации нуклеиновой кислоты, а вещество, которое используется для терминации, определяется как терминатор.
Более конкретно, термин «терминация» при упоминании в данном документе, означает, что вещество, не имеющие гидроксильной группы на 3'-конце или имеющее химическую группу, которая терминирует реакцию полимеризации, вызываемую полимеразой, ковалентно связано с 3'-концом нуклеиновой кислоты для терминации полимеризации нуклеиновой кислоты, а вещество, которое используется для терминации, определяется как терминатор.
В настоящем изобретении терминатор нуклеиновых кислот является соединением, подобным нуклеиновой кислоте, активированным в форме трифосфата, способным воздействовать на полимеразу нуклеиновых кислот, и может быть выбран из числа различных нуклеотид трифосфатов, которые утратили 3' гидроксильную группу, с которой связывается нуклеиновая кислота, или которая замещена другими группами. Это может быть терминатор нуклеиновой кислоты, имеющий хорошую реакционную способность с полимеразой нуклеиновых кислот.
Соединение, подобное нуклеиновой кислоте, которое может быть использовано в настоящем изобретении, может включать, по меньшей мере, одно из числа 2'3'-дидезоксинуклеозид 5'-трифосфата 3'-деоксиаденозин 5'-трифосфата, 3'-азидо-3'-деокситимидин 5-трифосфата, 1-β-d-арабинофуранозилнуклеозид-5' трифосфата, ацикло-гуанозинтрифосфата, 3'-амино-2'-деоксинуклеозид 5'-трифосфата и 3'-фтор-3'-деоксинуклеозид 5'-трифосфата.
Более конкретно, ДНК-полимераза, полученная из Е.coli или термически устойчивой бактерии, может быть 2'3'-дидезоксинуклеотид трифосфатом (ddNTP), который часто использовался в способе дидезокси-секвенирования, разработанном Сенгером.
В настоящем изобретении, дидезоксинуклеотид трифосфат (ddNTP) может включать, по меньшей мере, один, выбранный из числа дидезоксигуанозин трифосфата (ddGTP), дидезоксиаденозин трифосфата (ddATP), дидезокситимидин трифосфата (ddTTP) и дидезоксицитидин трифосфата (ddCTP).
Дезоксинуклеотид трифосфат (dNTP) может включать, по меньшей мере, один, выбранный из числа гуанозина, аденозина, тимидина, уридина и цитидина.
Например, для терминации реакции с использованием ДНК-полимеразы могут быть использованы различные терминаторы полимеризации нуклеиновых кислот. Когда используется ДНК-полимераза, полученная из млекопитающих, возможно применение 5'-трифосфат 1-β-D-арабинофуранозилцитозина или 5'-трифосфат 9-β-D-арабинофуранозиладенина, которые имеют высокую реакционную способность с этим ферментом (Inhibition of Mammalian DNA Polymerase by the 5'-Triphosphate of 1-β-d-Arabmofuranosylcytosine and the 5'-Triphosphate of 9-β-d-Arabmofuranosyladenine, J. J. Furth, and Seymour S. Cohen, Cancer Res October 1968 28; 2061).
Кроме того, ациклонуклеозид трифосфат, который часто использовался в качестве противовирусного агента для ингибирования вирусных ДНК-полимераз, также может быть использован в качестве терминатора полимеризации нуклеиновых кислот (Inhibition of herpes simplex virus-induced DNA polymerase activity and viral DNA replication by 9-(2-hydroxyethoxymethyl)guanine and its triphosphate. Ρ A Furman, M Η St Clair, J A Fyfe, J L Rideout, Ρ M Keller and G В Elion, J. Virol. October 1979 vol. 32 no. 1 72-77).
Также поли-А полимераза, то есть PHK-полимераза, представляющая собой фермент, который используется для прикрепления аденозина к 3'-концу PHK, подходит для терминации полимеризации нуклеиновой кислоты, как описано в настоящем изобретении. При использовании этого фермента можно использовать 3'-дезоксиаденозин трифосфат (3'-dATP; кордицепин), известный как ингибитор поли-А полимеразы.
В настоящем изобретении стадия 2) является процессом инактивации или удаления непрореагировавшего терминатора полимеризации нуклеиновых кислот после стадии 1), в которой инактивация терминатора полимеризации нуклеиновых кислот может быть осуществлена с помощью любого фермента, способного гидролизовать трифосфатную связь различных терминаторов полимеризации нуклеиновых кислот, которые используются при полимеризации.
В частности, терминатор нуклеиновых кислот предпочтительно легко инактивируется тепловой обработкой, потому что теряет свою ферментативную функции после того, как инактивирует терминаторы полимеризации нуклеиновых кислот гидролизом. Это происходит из-за того, что он не деградирует нуклеотид трифосфат в последующей реакции обратной транскрипции или реакции ПЦР.
Например, фосфататаза может быть ВАР (бактериальная щелочная фосфатаза) или CIP (телячья кишечная фосфатаза), которые обладают способностью деградации трифосфата. Предпочтительно используется CIP, которая легко инактивируется нагреванием.
Кроме того, может быть использована щелочная фосфатаза (Autotaxin) (Clair Τ, Lee HY, Liotta LA, Stracke ML (1997). «Autotaxin is an exoenzyme possessing 5'-nucleotide phosphodiesterase/ATP pyrophosphatase and ATPase activities". J. Biol. Chem. 272 (2): 996-1001. doi:10.1074/jbc.272.2.996. PMID 8995394.), которая гидролизует пирофосфат и ATP и которую получают из различных организмов, включая Е.coli, бычий тонкий кишечник и креветки. Также может быть использована аденозинсинтаза из Staphylococcus aureus (AdsA), которая неспецифически деградирует нуклеотид трифосфат.
В способе получения нуклеиновых кислот по настоящему изобретению, в результате отделения нуклеиновых кислот/процесса очистки, полимераза нуклеиновых кислот и терминатор полимеризации нуклеиновых кислот может быть добавлен к экстрагированной нуклеиновой кислоте для терминации полимеризации нуклеиновой кислоты посредством предотвращения неспецифического праймирования нуклеотидной матрицы. После реакции требуется стадия удаления непрореагировавших терминаторов полимеризации нуклеиновых кислот, потому что непрореагировавпше терминаторы полимеризации нуклеиновых кислот действуют в качестве ингибиторов последующей полимеразной цепной реакции или других реакций ПЦР.
Удаление терминатора полимеризации нуклеиновой кислоты может быть осуществлено с помощью гель-фильтрации, их с хаотропного агента и кремниевых микросфер, без ограничения вышеуказанным.
Способ получения нуклеиновых кислот по настоящему изобретению может быть осуществлен с помощью известного анализатора нуклеиновых кислот, включающего известную систему экстракции нуклеиновых кислот и систему генной амплификации. Предпочтительно может быть использован «Exiprep 16 DX» (Bioneer, Корея) описанный выше, без ограничения вышеуказанным.
В частности, после разделения нуклеиновых кислот/процесса очистки, полимераза нуклеиновых кислот и терминатор нуклеиновых кислот могут быть добавлены к экстрагированной нуклеиновой кислоте для терминации реакции полимеризации нуклеиновой кислоты и инактивации функции праймирования всех нуклеиновых кислот. Терминатор оставшийся после терминации, действует в качестве ингибитора последующей реакции обратной транскрипции или реакции ПЦР, и по этой причине, для удаления оставшегося терминатора могут быть использованы два способа: способ повторной очистки PHK с использованием системы «Exiprep 16 DX» (Bioneer); и способ деградации терминатора полимеризации нуклеиновых кислот для того, чтобы он больше не вступал в реакцию.
Способ очистки PHK с помощью системы «Exiprep 16 DX» является способом, в котором PHK прикрепляется к магнитным кремниевым частицам в присутствии хаотропного агента, отмывается и элюируется. У этого способа имеются недостатки, которые заключаются в его времязатратности, поскольку проводится несколько стадий, и в потерях очищенной PHK. С другой стороны способ инактивации активированного терминатора полимеризации нуклеиновых кислот (нуклеотид трифосфата) путем деградации в ди- или моно-трифосфаты имеет множество преимуществ, которые связаны со его скоростью и отсутствием потерь на выходе.
В частности, в способе инактивации терминатора полимизации нуклеиновых кислот с использованием фермента, лунки «Exiprep 16 DX», которые содержат магнитные частицы и которые используются в стадии элюции, являются лунками с контролируемой температурой. Таким образом, после элюции буфером для элюции, терминатор полимеризации нуклеиновых кислот может быть легко удален добавлением трифосфатгидролазы, такой как щелочная фосфатаза, аутоксин или аденозинсинтаза из Staphylococcus aureus (AdsA), в лунки и проведением реакции при 37°С.
В другом аспекте настоящее изобретение также относится к способу получения композиции для реакции обратной траскрипции с горячим стартом или ПЦР с обратной траскрипцией и горячим стартом.
В частности, способ получения включает введение реакционной смеси, которая содержит реакционный буферный раствор, MgCl2, четыре типа dNTP, полимеразу обратной транскрипции, PPi и PPase, в одной реакционной пробирке. В частности в препарате композиции для ПЦР с обратной транскрипцией и горячим стартом, реакционная смесь дополнительно содержит ДНК-полимеразу.
ДНК-полимераза может быть одной или несколькими, выбранными из группы, состоящей из полимеразы, обладающей 5'->3' экзонуклеазной активностью, полимеразы, обладающей 3'->5' экзонуклеазной активностью, и полимеразы, которая не обладает ни 5'->3' экзонуклеазной активностью, ни 3'->5' экзонуклеазной активностью.
Предпочтительно, если вышеуказанный способ получения дополнительно содержит стадию заморозки или сушки реакционной смеси для образования сухой композиции, имеющей повышенную стабильность и стабильность при длительном хранении, без ограничения перечисленным.
Пирофосфат (PPi) предпочтительно содержится в концентрации 0,1-5 мМ, а предпочтительно 0,5-2,0 мМ, а пирофосфатаза предпочтительно содержится количестве 0,005-0,25 Ед. на 0,1 мМ PPi, без ограничения перечисленным.
Кроме того, реакционная смесь может содержать по меньшей мере, одно выбранное из группы, состоящей из одного или нескольких праймеров или зондов, флуоресцентного красителя, который связывается с ДНК, нуклеотидной матрицы, красителя, инертного по отношению к нуклеиновой кислоте, полиол, желатин, бычий сывороточный альбумин, Thesit и PEG-8000. В данном документе флуоресцентный краситель может быть выбран из группы, состоящей из SyBr Green, EtBr и HRdye, и краситель может быть одним или несколькими, выбранными из группы, состоящей из родамина, тамра, лаке, бромфеноловый синий, ксилен пианол, бромкрезоловый красный, и крезоловый красный.
В еще одном аспекте настоящее изобретение направлено на набор для реакции обратной транскрипции с горячим стартом, который включает вышеуказанную композицию для реакции обратной транскрипции с горячим стартом.
Настоящее изобретение также направлено на набор для ПНР с обратной транскрипцией и горячим стартом, который содержит вышеописанную композицию для ПЦР с обратной транскрипцией и горячим стартом.
Набор может быть приготовлен согласно обычному способу получения набора для реакции обратной транскрипции или набора для ПЦР с обратной транскрипцией.
Настоящее изобретение также направлено на способ обратной транскрипции PHK-матрицы, который включает стадии: смешивания композиции для реакции обратной транскрипции с горячим стартом с образцом, содержащим матрицу-PHK для получения реакционной смеси; и осуществления реакции так, чтобы реакционная смесь могла быть обратной транскрибирована.
В настоящем изобретении также предлагается способ амплификации нуклеиновой кислоты, который включает стадии: смешивания композиции для ПЦР с обратной транскрипцией и горячим стартом с образцом, содержащим матрицу-PHK для получения реакционной смеси; проведения реакции с тем, чтобы амплифицировать реакционную смесь с получением посредством этого продукта амплификации; и анализа продукта амплификации.
Здесь реакция ПЦР с обратной транскрипцией может быть любой или несколькими из числа мультиплексных ПЦР с обратной транскрипцией, ПЦР с обратной транскрипцией в режиме реального времени, и количественной ПЦР в режиме реального времени с обратной транскрипцией.
В предпочтительном воплощении настоящего изобретения нуклеотидная матрица предпочтительно является PHK, которая может быть амплифицирована обратной транскрипцией и ПЦР.
Оригинальная композиция для реакции обратной транскрипции с горячим стартом и оригинальной композиции для ПЦР с обратной транскрипцией включают, в дополнение к реакционной смеси для обратной транскрипции, содержащей раствор реакционного буфера, MgCl2, четыре типа dNTP и обратную транскриптазу, PPi и PPase, которые могут предотвратить реакцию обратной транскрипции в процессе смешивания при комнатной температуре. Кроме того, для активации обратной транскриптазы PPi может разрушаться PPase при температуре равной или выше чем температура, при которой специфически гибридизуются праймеры, и, таким образом, реакция обратной транскрипции может быть инициирована при температуре гибридизации так, что может быть устранен неспецифический синтез кДНК. Таким образом, селективность может быть сильно повышена по сравнению с селективностью обычных реакций обратной транскрипции, и может быть успешно обнаружено даже очень малое количество целевой PHK. Кроме того, когда композиция заморожена или высушена в смеси со стабилизатором, она может быть использована в стабильной и обычной манере по сравнению с обычными композициями, и, таким образом, является полезной как более стабильная композиция для реакции обратной транскрипции с горячим стартом.
В воплощении настоящего изобретения обратная транскрипция с горячим стартом была осуществлена в присутствии PPi и PPase, с использованием обратного праймера точно совпадающего с PHK-матрицей и с использованием праймера, имеющего несовпадающую относительно PHK-матрицы нуклеотидную последовательность. В результате продукт амплификации был обнаружен в случае обратного праймера точно совпадающего с PHK-матрицей, но не был обнаружен, когда обратный праймер имел несовпадающую с PHK-матрицей нуклеотидную последовательность. Напротив, было установлено, что когда реакция обратной транскрипции с горячим стартом была проведена без PPi и PPase, продукт амплификации был обнаружен даже в случае обратного праймера, имеющего несовпадающую нуклеотидную последовательность.
В другом воплощении настоящего изобретения однонуклеотидный полиморфизм целевой PHK анализировали с помощью реакции ПЦР с обратной транскрипцией и горячим стартом. В результате было обнаружено, что когда реакция обратной транскрипции с горячим стартом была проведена в присутствии PPi и PPase, результаты, полученные с использованием праймера, точно совпадающего с PHK-матрицей, отличались по эффективности от результатов, полученных с помощью обратного праймера, имеющего один несовпадающий нуклеотид. При этом реакция обратной транскрипции без PPi и PPase детектировалась в одном и том же цикле без различий между совпадающим обратным праймером и несовпадающим обратным праймером. Это подтверждает, что реакция обратной транскрипции с горячим стартом по настоящему изобретению позволяет анализировать однонуклеотидные полиморфизмы с использованием способа ПЦР в режиме реального времени, но в реакционном растворе, не обладающем функцией обратной транскрипции с горячим стартом, трудно анализировать однонуклеотидные полиморфизмы.
В другом воплощении настоящего изобретения был проверено влияние реакции ПЦР с обратной транскрипцией и горячим стартом настоящего изобретения на ингибирование неспецифических реакций, являющихся результатом самопраймирования одноцепочечных нуклеиновых кислот, содержащихся в экстрагированных нуклеиновых кислотах. В результате было установлено, что реакция обратной транскрипции с горячим стартом ингибирует неспецифические реакции, являющиеся результатом самопраймирования, по сравнению с реакционным раствором, не обладающим функцией горячего старта (то есть без PPi и PPase).
В другом воплощении настоящего изобретения было проверено влияние терминации PHK на ингибирование неспецифических реакций ПЦР с обратной транскрипцией, являющихся результатом самопраймирования PHK. Было показано, что когда в качестве матрицы была использована экстрагированная PHK, терминированная на 3'-конце с помощью поли(А) полимеразы и 3'-дезоксиаденозин 5'-трифосфата (3'-dATP), кДНК синтезировалась из нетерминированной кДНК даже без добавления какого-либо праймера. Другими словами, кДНК синтезировалась путем самопраймирования и амплификации в ПЦР. Также амплификация ПЦР, являющаяся результатом неспецифического синтеза кДНК, не могла быть идеально предотвращена даже реакцией ПЦР с обратной транскрипцией и горячим стартом, а реакция ПЦР с обратной транскрипцией могла быть частично ингибирована самопраймированием PHK, и, таким образом, значение Ct было снижено на 5, что указывает на то, что неспецифическая реакция могла быть ингибирована на около 1/30.
Однако было показано, что в образце, содержащем PHK, терминированную по 3'-концу, кДНК не амплифицировалась вплоть до 45 циклов во всех реакциях ПЦР с обратной транскрипцией, что указывает на то, что кДНК не была синтезирована. Эти результаты подтверждают, что в ходе смешивания смеси для реакции ПЦР с обратной транскрипцией происходит множество неспецифических реакций обратной транскрипции, и по этой причине образуется множество неспецифичных кДНК. Также из вышеуказанных результатов видно, что нежелательные реакции не могут быть ингибированы только ПЦР с обратной транскрипцией и горячим стартом. В результате можно видеть, что такие неспецифические реакции ПЦР с обратной транскрипцией, являющиеся результатом самопраймирования PHK, идеально могут ингибироваться терминацией PHK с помощью реакции терминации настоящего изобретения.
В другом воплощении настоящего изобретения было установлено, что когда используется ПЦР с горячим стартом настоящего изобретения, положительно изменяется порог обнаружения маркера злокачественных опухолей.
Информация о нуклеотидной последовательности Кератина 8 Homo sapiens (KRT8), как маркера злокачественной опухоли, была получена из Национального центра биотехнологической информации (NCBI, США), PHK экстрагировали из человеческих клеток Hela С и подвергали процессу терминации PHK. В результате в случае образцов, подвергнутых терминации PHK, маркер злокачественной опухоли детектировали в образце реакции обратной транскрипции с горячим стартом, содержащим 10 или более клеток Hela добавленных к 1 мл человеческой сыворотки. В случае реакций, не обладающих функцией обратной транскрипции с горячим стартом, маркер злокачественной опухоли детектировали в образце, содержащем 100 или более клеток Hela. В случае образцов, содержащих нетерминированную PHK, маркер злокачественных опухолей детектировали в образцах реакции обратной транскрипции с горячим стартом, содержащих 100 или более клеток Hela. В случае реакционных растворов, не обладающих функцией обратной транскрипции с горячим стартом, маркер злокачественной опухоли детектировали образцах, содержащих 1000 или более клеток Hela.
Таким образом видно, что порог обнаружения положительно изменился даже только из-за реакции обратной транскрипции с горячим стартом, но лучший эффект может быть получен, когда реакцию обратной транскрипции с горячим стартом осуществляли вместе с терминацией PHK.
Хотя настоящее изобретение подробно описано со ссылкой на специфические особенности, для специалиста в данной области будет очевидно, что это описание является всего лишь предпочтительным воплощением и не ограничивает сферу применения настоящего изобретения. Таким образом, реальная сфера применения настоящего изобретения будет определяться приложенной формулой изобретения или ее эквивалентами.
ПРИМЕРЫ
Далее по тексту настоящее изобретение будет описано более подробно со ссылкой на примеры. Следует понимать, однако, что эти примеры приведены только для иллюстративных целей и не предназначены для ограничения объема настоящего изобретения.
Пример 1: Проверка влияния PPi на ингибирование реакций обратной транскрипции
Для проверки условий, при которых реакция обратной транскрипции ингибируется PPi, реакцию обратной транскрипции осуществляли с использованием 1,5 мМ иона магния и различных концентраций PPi, а продукт реакции использовали для проведения ПЦР. В частности, 0,5-2 мМ PPi добавляли в смесь «Accupower RT Premix» (Bioneer, Корея), и проводили реакцию обратной транскрипции и ПЦР. Реакцию обратной транскрипции проводили с использованием 100 нг, 10 нг, 1 нг или 100 пг PHK, экстрагированной из человеческих клеток Hela, в присутствии PPi, добавленного в концентрации 0, 0,5, 1, 1,5 или 2,5 мМ. Реакцию обратной транскрипции проводили один раз при 42°С (оптимальная температура для предварительно сделанной смеси «Accupower RT Premix» (Bioneer, Корея) в течение 60 минут, и один раз - при 95°С для инактивации обратной транскриптазы. 5 мкл из 20 мкл продукта реакции обратной транскрипции добавляли в предварительно сделанную смесь «Accupower RT Premix» (Bioneer, Корея) и подвергли реакции ПЦР с использованием прямого праймера GAPDH 5'-GGAAGGTGAAGGTCGGAGTC-3' (SEQ ID NO: 1) и обратного праймера GAPDH 5'-GCCAAATTCGTTGTCATACC-3' (SEQ ID NO: 2), который нацелены на нуклеотидные последовательности человеческих праймеров GADPH. Реакцию ПЦР проводили в следующих условиях: преденатурация при 95°С в течение 5 минут, а затем 30 циклов с 95°С в течение 20 секунд, 55°С в течение 40 секунд и 72°С в течение 60 секунд в одном цикле с последующим финальным удлинением при 72°С в течение 5 минут. Продукт реакции ПЦР разделяли электрофорезом на агарозном геле вместе с маркером масс ДНК а затем окрашивали бромистым этидием, и полосу ДНК, амплифицированную реакцией ПЦР фотографировали с помощью камеры Polaroid. В качестве положительного контроля использовали смесь RT PreMix (Bioneer, Корея) не содержащую PPi, и подвергали продукт реакции ПЦР.
В результате было видно, что в экспериментальной группе, содержащей PPi, реакция обратной транскрипции ингибировалась от концентрации PPi 0,5 мМ и была полностью ингибирована при добавлении 2 мМ PPi (фиг. 1).
Пример 2: Исследование обратной транскрипции с помощью PPase, которая гидролизует PPi на два фосфата
Результаты примера 1 указывают на то, что реакции обратной транскрипции ингибировались добавлением PPi. Для реакции обратной транскрипции, описанной выше, для исследования активации реакции обратной транскрипции добавляли PPase, которая деградирует PPi на два фосфата. В частности, в условиях, при которых PPi добавляли также как описано в примере 1, добавляли 0,1 Ед. PPase, и проводили реакцию PPi фермент и реакцию обратной транскрипции одновременно при 42°С в течение 60 минут. Затем продукт реакции оставляли при 95°С в течение 5 минут для инактивации обратной транскриптазы, после чего проводили ПЦР.
В результате было обнаружено, что при добавлении PPase в ПЦР максимально увеличивалось количество продукта ПЦР (фиг. 2).
Пример 3: Исследование ПЦР в режиме реального времени с обратной транскрипцией в присутствие PPi и PPase
Для исследования реакции ПЦР в режиме реального времени с обратной транскрипцией с помощью композиции, содержащей PPi и PPase, к раствору «2Х PCR PreMix» (содержащему 10 мМ Tris HCl, рН 9,0, 50 мМ KCl, 1.5 мМ MgCl2, четыре типа dNTP (каждый по 250 мкМ), 1 Ед. taq ДНК-полимеразы, 200 Ед. обратной транскриптазы, 1 мМ DTT, 0.01% Tween 20, и стабилизатор), добавляли 2 мМ PPi и 0,1 Ед. PPase, и проводили реакцию с использованием 25 мкл раствора «PCR PreMix». Синтезировали прямой праймер 5'-CGTGGAAGGACTCATGACCACA-3' (SEQ ID NO: 3), обратный праймер GCCTTGGCAGCGCCAGTAGA-3' (SEQ ID NO: 4) зонд GAPDH 5'-CTGTGGATGGCCCCTCCGGGAAA-3' (SEQ ID NO: 5), нацеленные на человеческий ген GAPDH, и каждый добавляли в концентрации 10 нМ. Общую PHK экстрагированную из клеток Hela использовали в качестве PHK-матрицы в количестве 100 нг, 10 нг, 1 нг или 100 пг. Затем добавляли дистиллированную воду к смеси до конечного объема 50 мкл. ПЦР в режиме реального времени с обратной транскрипцией проводили с использованием «Exicycler 96 Real-Time Quantitative Thermal Block» (Bioneer, Корея) в следующих условиях: обратная транскрипция при 50°С в течение 15 минут, затем преденатурация при 95°С в течение 5 минут, после чего 45 циклов, каждый цикл, состоящий из денатурации при 95°С течение 5 секунд, отжиг при 60°С в течение 5 секунд, удлинение при 72°С в течение 6 секунд, и сканирование для обнаружения флуоресценции.
В результате было показано, что PPi и PPase не оказывают влияние на ПЦР в режиме реального времени с обратной транскрипцией, и был построен стандартный график имеющий угловой коэффициент -3,1 и линейное значение R2 0,9994 (фиг. 3).
Пример 4: Детекция PHK вируса гепатита С с помощью реакции обратной транскрипции с горячим стартом
Для осуществления ПЦР в режиме реального времени с обратной транскрипцией, была подготовлена PHK-матрица. В частности, ген вируса гепатита С синтезировали способом синтеза генов (см. Biochem. Biophys, Res. Commun 1998, 248, 200-203), и его часть клонировали в вектор pGEM-T-Easy (каталожный номер A1360, Promega, США). В частности, 5 мкл 2Х буфера для быстрого лигирования (Promega, США), 1 мкл вектора T-easy (Promega, США), 1 мкл Т4 ДНК-лигазы (Promega, США), и 3 мкл (8 нг) синтезированного гена помещали и смешивали в одной пробирке, а затем инкубировали в подставке при 37°С в течение 1 часа. Затем 5 мкл инкубированного реакционного раствора добавляли к 50 мкл компетентных клеток Е.coli, выдерживали на льду в течение 40 минут, инкубировали при 42°С в течение 40 секунд, а затем выдерживали на льду в течение 2 минут. Реакционный раствор рассевали на чашках с LB, содержащих ампициллин, изопропил 1-галактозид (IPTG) и X-gal, а затем инкубировали при 37°С в течение 16 часов.
После инкубации отбирали белые колонии, инкубировали в жидкой среде LB в течение 16 часов, а затем центрифугировали. Надосадочную жидкость удаляли, и экстрагировали из осадка плазмидную ДНК с помощью набора «AccuPrep Plasmid Prep kit» (Bioneer, Корея). Если плазмидная ДНК, имела чистоту 1,8-2,0, согласно измерению с помощью УФ-спектрофотометра (Shimazu, Япония), то ее транскрибировали в PHK с помощью набора «MAXIscript In vitro transcription kit» (Ambion, США). После транскрипции если PHK имела чистоту 1,8-2,0, согласно измерению УФ-спектрофотометра, то ее использовали в качестве PHK-матрицы с последующей ПЦР с обратной транскрипцией в режиме реального времени. Число копий PHK рассчитывали с использованием следующего уравнения 1:
Уравнение 1
6.02×1023× концентрация (г/мл, измеренная с помощью УФ-спектрофотометра)/(3015+150)×340,
где 3015 - размер Т-вектора (3015 п.о.), а 150 - размер матричной PHK вируса гепатита С (150 п.о.). После расчета количество копий матричной PHK ее серийно разводили в 10 раз с помощью 1х ТЕ буфера (10 мМ Tris-HCl, рН 8.0, 0.1 мМ EDTA) и хранили при -70°С до использования. Используя сконструированную PHK в качестве матрицы осуществляли ПЦР с обратной транскрипцией в реальном времени с использованием 30 нМ прямого праймера на вирус гепатита С 5'-ACCGGGTCCTTTCTTGGAT-3' (SEQ ID NO: 6), обратного праймера 5'-CCCTATCAGGCAGTACCACA-3' (SEQ ID NO: 7) и зонда [5'TAM]-CGTGCCCCCGCRAGACTGCT-[3'BHQ1] (SEQ ID NO: 8). Реагенты, используемые в ПЦР с обратной транскрипцией в реальном времени были теми же, что и описанные в примере 3 и была добавлена матричная PHK с числом копий 1010, 109, 108, 107, 106, 105, 104, 103, 102 или 10. Реакцию осуществляли так же, как описано в примере 3, за исключением праймеров, зонда и матричной PHK.
Как показывают результаты, возможно обнаружение матричной PHK с числом копий в диапазоне от 1010 до 10, а стандартный график ПЦР с обратной транскрипцией в реальном времени на стандартной матрице, повторенной дважды, демонстрирует угловой коэффициент от -3,21 до -3,73 и линейное значение R2 0,995-0,998 (фиг. 4). Здесь, R2 является correlation ship, которое указывает на линейность нанесенной стандартной кривой ПЦР в режиме реального времени, а значение R2 около к 1 (ближе к прямой линии) указывает на то, что ПЦР был осуществлен более точно.
Пример 5: Исследование влияния PPi и PPase на ингибирование неспецифической реакции в ПЦР с обратной транскрипцией в реальном времени
Для исследования влияния PPi и PPase на неспецифическую реакцию очищенной PHK в реальном клиническом образце 1 мкг общей PHK, экстрагированной из клеток Hela в дополнение к целевой матричной PHK добавляли к тем же самым праймерам, зонду и раствору для ПЦР с обратной транскрипцией в реальном времени, как описано в примере 4. В качестве контроля использовали реакционный раствор, не обладающий функцией обратной транскрипции с горячим стартом (то есть, не содержащий PPi и PPase). Для исследования ингибирования неспецифических реакций 1 мкг общей PHK, эктрагированной из человеческих клеток, добавляли к реакционному раствору для обратной транскрипции с горячим стартом и реакционному раствору, не имеющему функции обратной транскрипции с горячим стартом, и проводили реакцию. Этот пример был осуществлен также, как описано в примере 4, за исключением того, что была добавлена экстрагированная PHK.
В результате было обнаружено, что когда реакция обратной транскрипции с горячим стартом осуществлялась в присутствии PPi и PPase, неспецифические реакции PHK, отличной от целевой PHK, ингибировались, и PHK отличная от целевой PHK не приводила к снижению эффективности реакции и изменению чувствительности и способности к детекции. Однако было показано, что в обратной транскрипции с горячим стартом, которая была осуществлена в отсутствие PPi и PPase, неспецифические реакции были вызваны добавлением PHK из человеческих клеток, и реакционная эффективность, способность к детекции и чувствительность значительно снизились (фиг. 5а). Продукт ПЦР с обратной транскрипцией в реальном времени анализировали электрофорезом на 2% агарозном геле, и в результате было обнаружено, что в случае, когда продукт не подвергался реакции обратной транскрипции с горячим стартом, неспецифические более активно происходили общей PHK, экстрагированной из человеческих клеток (фиг. 5b). Таким образом, видно, что проблемы, такие как снижение реакционной эффективности в неспецифических реакциях в реакциях ПЦР с обратной транскрипцией, могут быть решены реакцией обратной транскрипции с горячим стартом в присутствии PPi и PPase.
Пример 6: Сравнение ингибирования неспецифических реакций между применением реакции обратной транскрипции с горячим стартом и применением ПЦР с горячим стартом в ПЦР в режиме реального времени с обратной транскрипцией
Для выяснения того, какая из реакций обратной транскрипции с горячим стартом и ПЦР с горячим стартом является более эффективной по специфичности реакции и чувствительности в ПЦР с обратной транскрипцией в реальном времени, был проведен следующий эксперимент. В дополнение к тем же праймерам, зонду и реакционному раствору для ПЦР с обратной транскрипцией в реальном времени, что и описанный в примере 5, использовали целевую матричную PHK и 1 мкг общей PHK, экстрагированной из человеческих клеток. Реакционный раствор, не обладающий функцией обратной транскрипции с горячим стартом (то есть не содержащий PPi и PPase), использовали в реакционной смеси для ПЦР с горячим стартом, содержащей Taq-антитело. Для исследования влияния реакции обратной транскрипции с горячим стартом на ингибирование неспецифических реакций, добавляли PPi и PPase в реакционную смесь для ПЦР с горячим стартом, содержащую Taq-антитело, и единовременно проводили реакцию обратной транскрипции с горячим стартом и ПЦР с горячим стартом.
В результате было установлено, что при проведении обратной транскрипции и ПЦР неспецифические реакции не могут ингибироваться только реакцией ПЦР с горячим стартом, и что когда реакцию обратной транскрипции с горячим стартом проводили в присутствии PPi и PPase, то возможно ингибирование неспецифической реакции для большего количества PHK. Также было показано, что Taq-антитело, используемое в реакции ПЦР с горячим стартом, ингибирует неспецифические реакции ПЦР при низкой температуре, но не ингибирует неспецифические реакции в реакции обратной транскрипции. Таким образом, видно, что для удаления неспецифических реакций требуется реакция обратной транскрипции с горячим стартом в реакции обратной транскрипции и реакции ПЦР. Как в реакции обратной транскрипции, так и в реакции ПЦР, уровень неспецифических продуктов реакции снижается в реакции ПЦР, осуществленной с помощью Taq-антитела (В на фиг. 2b) по сравнению уровнем неспецифических продуктов в реакции, не обладающей функцией горячего старта (В на фиг. 5b),но неспецифические реакции все еще идут, и, таким образом, сложно детектировать вызывающий заболевание вирус, например, целевую ДНК вируса гепатита С, имеющую число копий 100 или меньше в образцах, содержащих большие количества человеческой PHK, полученной из человеческих клеток (В на фиг. 6а). С другой стороны, в реакции, содержащей PPi и PPase, неспецифические реакции PHK, полученной из человеческих клеток, не идут (D на фиг. 6b), и целевая ДНК вируса гепатита С с числом копий 10 или больше может детектироваться с высокой плотностью (D на фиг. 6а).
Пример 7: Исследование ПЦР в режиме реального времени с обратной транскрипцией на стандартной матрице с использованием композиции сухого типа для обратной транскрипции/ППР
Для проверки термической стабильности сухого материала раствора смеси для обратной транскрипции/ПЦР, получали, а затем сушили, раствор смеси для ПЦР, содержащий PPi и PPase, как описано в примере 4, после чего с помощью высушенной смеси проводили ПЦР в режиме реального времени с обратной транскрипцией в «Exicycler Quantitative Thermal Block» (Bioneer, Корея). В частности, 5 мкл 10х буфера, 3 Ед. Taq ДНК-полимеразы, 5 мкл dNTP 20 мМ, PPi, PPase, стабилизатор и т.п. вносили в отдельную пробирку, и добавляли дистиллированную воду до общего объема 25 мкл. Раствор смеси переносили в пробирку для «Exicycler Quantitative Thermal Block» (Bioneer, Корея) и сушили с помощью «SuperCentra» (Bioneer, Корея) в течение 50-60 минут. Затем праймеры и зонд, использованные в примере 4, смешивали друг с другом до общего объема 5 мкл и добавляли к сухой смеси, с последующей сушкой в течение 30 минут. К сухой смеси добавляли PHK-матрицу, как в примере 6, а также добавляли дистиллированную воду до конечного объема 50 мкл, и полученный раствор перемешивали в достаточной степени, так чтобы сухой материал был полностью растворен. ПЦР в режиме реального времени с обратной транскрипцией проводили также, как описано в примере 4, за исключением того, что был использован «Exicycler Quantitative Thermal Block» (Bioneer, Корея), также проводили реакцию с отрицательным контролем (пустым образцом без PHK-матрицы), и использовали PHK-матрицу с числом копий 106, 105, 104, 103, 102 или 10.
В результате, также как и в примере 4, было возможно обнаружить PHK-матрицу с числом копий 10 или больше, а построенная стандартная кривая для ПЦР в режиме реального времени с обратной транскрипцией для стандартной матрицы продемонстрировала угловой коэффициент -0,2932 и значение R2 0,9991. Вышеуказанные результаты подтверждают, что сухая смесь демонстрирует такую же эффективность что и смесь в виде раствора для ПЦР в режиме реального времени с обратной транскрипцией (фиг. 7).
Пример 8: Тест стабильности сухой композиции для реакции обратной транскрипции/ПНР в течение различных периодов хранения
Используя такую же композицию и способ, что и описанный в примере 7, готовили смесь ПЦР, содержащую PPi и PPase, которую затем хранили при 50°С с 1 дневными интервалами в течение 8 дней. Затем сухую композицию ПЦР для каждого периода хранения обрабатывали с помощью «Exicycler96 Quantitative Thermal Block», и использовали PHK-матрицу с числом копий 106, 105, 104 или 103, после чего проводили ПЦР в режиме реального времени с обратной транскрипцией в тех же самых условиях, что и описанные в примере 7. Этот способ позволяет прогнозировать период сохранения эффективности высушенной композиции при -20°С (актуальная рекомендованная температура хранения) с помощью ускоренного теста. Когда композицию хранили при 40°С в течение 1 дня, это рассматривалось как хранение при -20°С в течение около 128 дней. В частности, высушенную композицию получали в количестве, соответствующем 6 тестам, и сушили. Сразу после сушки, часть сухой смеси готовили в количестве, в соответствии с 5 тестами в тех же условиях, что и описанные в примере 7. Затем проводили ПЦР в режиме реального времени с обратной транскрипцией так же, как и в примере 4, за исключением того, что была использована PHK-матрица с числом копий 106, 105, 104 или 103, для получения контрольных результатов. Сухую композиции хранили в инкубаторе при 50°С, и количество, требуемое для реакции, отбирали с однодневными интервалами и подвергали ПЦР в режиме реального времени с обратной транскрипцией. При этом осуществляли реакцию с использованием четырех копийностей PHK (в диапазоне от 103-106). Сухую композицию для каждого периода подвергали реакции ПЦР в режиме реального времени с обратной транскрипцией с использованием «Exicycler96 Quantitative Thermal Block» (Bioneer, Корея), и для результатов реакции с сухими смесями, классифицированными по дням хранения, значение углового коэффициента и значение R2 сравнивали со значениями для контрольной группы, тем самым сравнивая эффективность сухой смеси сразу после получения с эффективностью сухой смеси, которую хранили при 50°С в течение каждого из периодов.
В результате жидкая смесь (контрольная группа), которая хранилась при 50°С с 1 дневными интервалами в течение 5 дней, продемонстрировала угловой коэффициент -0,345 и значение R2 0,9922, а сухая композиция, хранимая при 50°С, продемонстрировала угловой коэффициент -0,31 - -0,34 и значение R2 0,995-0,998. Другими словами, результаты после 5 дней хранения при 50°С были сравнимыми с результатами сразу после сушки, и такие результаты фактически схожи с результатами, полученными после хранения в течение около 640 дней при -20°С (фиг. 8а и 8b).
Пример 9: Ингибирование неспецифического связывания праймеров реакцией ПЦР с обратной транскрипцией и горячим стартом
Для индукции неспецифического связывания праймеров, синтезировали нуклеотидную последовательность обратного праймера в числе праймеров и зонда, использованных в примере 4, как показано в таблице 4 ниже.
Обратный праймер 5'-CCCTATCAGGCAGTACCACA-3' (SEQ ID NO: 7)


Для изучения влияния неспецифических праймеров, использовали обратный праймер, точно совпадающий с целевой PHK-матрицей, обратный праймер (SEQ ID NO: 9), имеющий 6 несовпадающих нуклеотидов на 5' конце, и праймер (SEQ ID NO: 10), имеющий 6 несовпадающих нуклеотидов в середине нуклеотидной последовательности. В качестве контроля использовали реакционный раствор, не обладающий функцией обратной транскрипции с горячим стартом (то есть, не содержащий PPi и PPase). Для оценки того, вызывают ли неспецифические праймеры ложноположительные результаты, и вызывает ли каждый обратный праймер неспецифические реакции, была проведено исследование раствора для реакции обратной транскрипции с горячим стартом и реакционного раствора, не имеющего функции обратной транскрипции с горячим стартом. Процедура примера 4 был повторена, за исключением того, что были использованы несовпадающий обратный праймер и PHK-матрица только с копийностью 104.
Фиг. 9а демонстрирует результаты проведения ПЦР в режиме реального времени с обратной транскрипцией, с помощью праймера, имеющего 6 несовпадающих нуклеотидов на 5' конце, а фиг. 9b демонстрирует результаты проведения ПЦР в режиме реального времени с обратной транскрипцией, с помощью праймера, имеющего 6 несовпадающих нуклеотидов в нуклеотидной последовательности. На фиг. 9, «А» служит для обозначения результатов проведения реакции с использованием реакционного раствора, не имеющего функции обратной транскрипции с горячим стартом, а «В» служит для обозначения результатов проведения реакции с использованием реакционной смеси для ПЦР с обратной транскрипцией и горячим стартом.
В результате в случае обратной транскрипции с горячим стартом, осуществленной в присутствии PPi и PPase, продукт амплификации был обнаружен в случае обратного праймера, точно совпадающего с PHK-матрицей, но не был обнаружен в случае обратного праймера, имеющего несовпадающие нуклеотиды. Однако в случае обратной транскрипции с горячим стартом, осуществленной в отсутствие PPi и PPase, продукт амплификации был обнаружен даже в случае обратного праймера, имеющего несовпадающие нуклеотиды. Это подтверждает, что ферментативные реакции идут из-за неспецифической реакции обратного праймера при температуре, ниже, чем реакционная температура (фиг. 9а и 9b). Таким образом, видно, что проблемы, такие как ложноположительные результаты, вызванные неспецифическими реакциями в реакции ПЦР с обратной транскрипцией, могут быть решены реакцией обратной транскрипции с горячим стартом в присутствии PPi и PPase.
Пример 10: Анализ однонуклеотидного полиморфизма с помощью реакции ПЦР с обратной транскрипцией и горячим стартом
Для анализа однонуклеотидного полиморфизма целевой PHK, с помощью реакции ПЦР с обратной транскрипцией и горячим стартом настоящего изобретения, обратный праймер был разработан таким образом, чтобы он содержат точечную мутацию. Нуклеотидная последовательность обратного праймера в числе праймеров и зонда, использованных в примере 4, была синтезирована как показано в таблице 3 ниже.
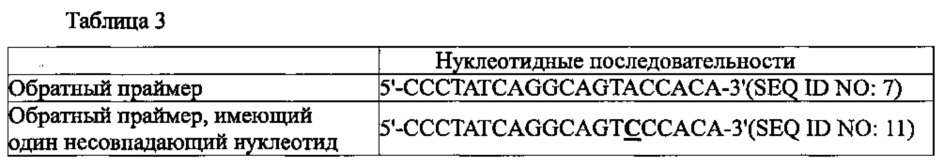
Для анализа однонуклеотидного полиморфизма были использованы обратный праймер точно совпадающий с PHK-матрицей и обратный праймер, имеющий однонуклеотидное несовпадение. В качестве контроля использовали реакционный раствор, не обладающий функцией обратной транскрипции с горячим стартом (то есть, не содержащий PPi и PPase). Для оценки возможности анализа однонуклеотидного полиморфизма, реакция для каждого обратного праймера была проанализирована с использованием реакционного раствора для обратной транскрипции с горячим стартом и реакционного раствора, не обладающего функцией обратной транскрипции с горячим стартом. Анализ провели также, как описано в примере 4, за исключением того, что был использован обратный праймер, имеющий несовпадающий нуклеотид и PHK-матрица с копийностью 104. Фиг. 10а демонстрирует результаты реакции ПЦР с обратной транскрипцией и горячим стартом, а фиг. 10b демонстрирует результаты проведения реакции с использованием реакционного раствора, не обладающего функцией обратной транскрипции с горячим стартом. На фиг. 10 «А» обозначает результаты, полученные с помощью праймера, имеющего точно совпадающую нуклеотидную последовательность, а «В» демонстрирует результаты, полученные с помощью праймера, имеющего один несовпадающий нуклеотид.
В результате было обнаружено, что когда реакция обратной транскрипции с горячим стартом была проведена в присутствии PPi и PPase, результаты, полученные с помощью праймера, точно совпадающего с PHK-матрицей, отличались по эффективности от результатов, полученных с помощью обратного праймера, имеющего один несовпадающий нуклеотид. Однако реакция обратной транскрипции с горячим стартом, осуществленная в отсутствии PPi и PPase была детектирована на том же цикле без различия между точно совпадающим обратным праймером и несовпадающим обратным праймером. Это подтверждает, что реакция обратной транскрипции с горячим стартом позволяет анализировать однонуклеотидный полиморфизм с использованием способа ПЦР в режиме реального времени, а в реакции, осуществленной в отсутствие реакционной смеси для обратной транскрипции с горячим стартом трудно анализировать однонуклеотидный полиморфизм (фиг. 10а и 10b). Таким образом, было обнаружено, что реакция обратной транскрипции с горячим стартом позволяет осуществить однонуклеотидный анализ PHK-матрицы и может быть использована в различных областях.
Пример 11: Ингибирование самопраймирования PHK-PHK реакцией обратной транскрипции с горячим стартом
Был исследовано влияние реакции ПЦР с обратной транскрипцией и горячим стартом по настоящему изобретению на ингибирование неспецифических реакций, являющихся результатом самопраймирования одноцепочечной нуклеиновой кислоты, содержащейся в экстрагированной нуклеиновой кислоте.
Общую PHK экстрагировали из 106 клеток Hela с помощью раствора для экстракции общей PHK «AccuZole» (Bioneer, Корея), а конечный объем 50 мкл доводили дистиллированной водой, обработанной DEPC.
Экстрагированную PHK количественно оценивали с помощью «NanoDrop 2000» (Thermo Scientific, США), и далее использовали 2 μг PHK. В качестве контроля осуществляли реакцию обратной транскрипции с использованием реакционного раствора, не имеющего функцию обратной транскрипции с горячим стартом (то есть без PPi и PPase). Реакцию ПЦР в режиме реального времени осуществляли с помощью набора «AccuPower Dualstar qPCR Premix kit» (Bioneer, Корея). Реакцию ПЦР в режиме реального времени осуществляли с помощью прямого и обратного праймеров и зонда, использованных в примере 3. Реакцию обратной транскрипции осуществляли с помощью праймера 5'-TTTTTTTTTTTTTTTTTT-3', (SEQ ID NO: 12).
Для оценки наличия геномной ДНК в экстрагированной PHK, в качестве контроля была проведена реакция обратной транскрипции с использованием реакционного раствора, не обладающего функцией обратной транскрипции с горячим стартом (то есть без PPi и PPase), а на экстрагированной общей PHK в качестве матрицы, была проведена ПЦР в режиме реального времени с использованием смеси «AccuPower Dualstar qPCR Premix» (Bioneer, Корея) без реакции обратной транскрипции.
На фиг. 11 в А показаны результаты проведения реакции ПЦР в режиме реального времени с использованием PHK отдельно без реакции обратной транскрипции; а в В показаны результаты проведения реакции обратной транскрипции с использованием праймера с последующим проведением реакции ПЦР в режиме реального времени. В-А в фиг. 11 указывают на результат проведения реакции обратной транскрипции с горячим стартом, а В-В указывает на результат проведения реакции с использованием реакционного раствора, не обладающего функцией обратной транскрипцией с горячим стартом.
Фиг. 11С демонстрирует результаты проведения реакции обратной транскрипции с использование PHK отдельно в реакционном растворе, не обладающем функцией обратной транскрипции с горячим стартом, с последующим проведением реакции ПЦР в режиме реального времени. Фиг. 11D демонстрирует результаты проведения реакции обратной транскрипции с использование PHK отдельно в реакционной смеси для обратной транскрипции с горячим стартом с последующим проведением реакции ПЦР в режиме реального времени.
В результате было обнаружено, что в отсутствие реакции обратной транскрипции детекция не была выявлена, что подтверждает, что экстрагированная общая PHK не содержит геномной ДНК.
Реакционный раствор без функции горячего старта (то есть без PPi и PPase), в качестве контроля, и реакция обратной транскрипции была проведена с использованием общей PHK отдельно в реакционном растворе без праймера. Реакцию обратной транскрипции проводили при 50°С в течение 1 часа и 95°С в течение 5 минут. Реакцию ПЦР в режиме реального времени проводили с 5 мкл продукта реакции обратной транскрипции в качестве матрицы.
В результате в реакционном растворе, не обладающем функцией горячего старта (то есть, без PPi и PPase), детекция была выявлена при 37 C(t) путем самопраймирования, а в реакционном растворе для обратной транскрипции с горячим стартом, детекция была выявлена при 41 C(t) (фиг. 11). Таким образом, было установлено, что неспецифические реакции самопраймирования сильнее ингибировались в реакционном растворе для обратной транскрипции с горячим стартом по сравнению с реакционным раствором, не обладающим функцией горячего старта (то есть, не без PPi и PPase).
Пример 12: Влияние терминации PHK на ингибирование неспецифического ПЦР с обратной транскрипцией, вызванного самопраймированием PHK
(1) Реакция терминации фрагмента PHK с помощью поли(А) полимеразы и 3'-дезоксиаденозин 5'-трифосфата (3'-dATP)
Используя набор для экстракции PHK, как описано в примере 11, PHK экстрагировали из человеческих клеток Hela С. 3'-Конец экстрагированной PHK терминировали с помощью поли(А) полимеразы и 3'-дезоксиаденозин 5'-трифосфата (3'-dATP) (С и D).
Для удаления оставшегося 3'-дезоксиаденозин 5'-трифосфата (3'-dATP), терминированную PHK очищали с помощью набора «AccuPrep PCR Purification kit» (Bioneer, Корея). Для сравнения PHK (А и В), которые не терминировалась на 3'-конце, была очищена также, как указано выше. Для исследования влияния ПЦР с обратной транскрипцией и горячим стартом, была проведена реакция ПЦР в реакционном растворе для ПЦР с обратной транскрипцией и горячим стартом (В и D) и реакционном растворе для ПЦР без функции горячего старта (А и С).
В каждой реакции ПЦР использовали 5 μг PHK. Общая реакция ПЦР была осуществлена с использованием премикса «AccuPower RocketScript RT Premix» (Bioneer, Корея), a реакция ПЦР с горячим стартом была проведена с использованием премикса «AccuPower RocketScript RT Premix» (Bioneer, Корея), который содержит пирофосфат и пирофосфатазу, а также дистиллированную воду до конечного объема 20 мкл. Для проверки самопраймирования PHK не добавляли любой из праймеров, необходимых для ПЦР с обратной транскрипцией.
ПЦР с обратной транскрипцией осуществляли с помощью термоблока «Mygenie 96 Gradient Thermal Block» (Bioneer, Корея), и для изучения влияния самопраймирования PHK в ходе смешивания реагентов, реакционную смесь для ПЦР инкубировали при 25°С в течение 20 минут.
Для изучения возможности ПЦР с обратной транскрипцией в результате самопраймирования PHK, проводили ПЦР в режиме реального времени с обратной транскрипцией, с использованием реакционной смеси для ПЦР с обратной транскрипцией в качестве матрицы, премикса «AccuPower Dualstar qPCR Premix» (Bioneer, Корея), праймеров на человеческий GADH и зонда, использованных в примере 3.
ПЦР в режиме реального времени проводили с использованием термоблока «Exicycler 96 Real-Time Quantitative Thermal Block» (Bioneer, Корея) в следующих условиях: предварительная денатурация при 95°С в течение 5 минут, и затем 45 циклов, каждый цикл состоящий из денатурации при 95°С в течение 5 секунд, отжига и удлинения при 60°С в течение 5 секунд, и сканирования для детекции флуоресценции.
Результаты представлены на Фиг. 12. Как можно видеть на фигуре, в случае нетерминированных PHK (А и В) детектировался человеческий ген GADPH, что подтверждает, что кДНК синтезировалась даже без добавления праймеров. Этот результат говорит о том, что кДНК была синтезирована самопраймированием и амплификацией в ПЦР.
Также следует отметить, что амплификация ПЦР, являющаяся результатом неспецифического синтеза кДНК, не могла быть идеально предотвращена только реакцией ПЦР с обратной транскрипцией и горячим стартом, и что реакция ПЦР с обратной транскрипцией, вызванная самопраймированием PHK, может быть частично ингибирована, и таким образом значение Ct было снижено на 5, что указывает на то, что неспецифическая реакция могла быть ингибирована на около 1/30.
При этом было показано, что в образцах, содержащих PHK, терминированную по 3'-концу (С и D), кДНК не амплифицировалась вплоть до 45 циклов во всех реакциях ПЦР с обратной транскрипции, что указывает на то, что кДНК не синтезировалась. Вышеуказанные результаты подтверждают, что в ходе смешивания смеси для реакции ПЦР с обратной транскрипцией происходит множество неспецифических реакций обратной транскрипции, и по этой причине создается множество неспецифичных кДНК. Из вышеуказанных результатом видно, что нежелательные реакции не могут быть ингибированы только ПЦР с обратной транскрипцией и горячим стартом. В результате можно видеть, что такие неспецифические реакции ПЦР с обратной транскрипцией, являющиеся результатом самопраймирования PHK идеально могут ингибироваться терминацией PHK с помощью реакции терминации настоящего изобретения.
Фиг. 12 «А» и «В» демонстрируют результаты, полученные с помощью нетерминированной PHK, а «С» и «D» демонстрируют результаты, полученные с помощью терминированной PHK. Также для «А» и «С», была проведена простая реакция обратной транскрипции, а для «В» и «D», была проведена реакция обратной транскрипции с горячим стартом.
Пример 13: Повышение порога обнаружения маркера злокачественных опухолей с помощью терминации PHK и ПЦР с обратной транскрипцией и горячим стартом
Информация о нуклеотидной последовательности Кератина 8 Homo sapiens (KRT8; учетный No. NM_00125693) как о маркере злокачественных опухолей, была получена из Национального центра биотехнологической информации (NCBI, США). Используя набор для экстракции PHK, как описано в примере 11, PHK экстрагировали из человеческих клеток Hela С. ПЦР в режиме реального времени с обратной транскрипцией проводили с использованием 850 нг, 85 нг, 8,5 нг, нг 0,85 или 0,085 нг экстрагированной PHK в качестве матрицы, 30 нМ прямого праймера 5'-GGAGCAGATCAAGACCCTCA-3' (SEQ ID NO: 13), обратного праймера 5'-TTGTCCATGTTGCTTCGAGC-3' (SEQ ID NO: 14) и зонда [5'FAM]-TGCTGCTCCAGGAACCGTACCTTGT- [3'BHQ1] (SEQ ID NO: 15), для получения стандартной кривой для осуществления количественного анализа с использованием реакции горячего старта обратной транскрипции ПЦР. Результаты показаны на фиг. 13а.
В целях проверки порога обнаружения, 10000, 1000, 100 или 10 клеток Hela добавляли к 1 мл человеческой сыворотки, и экстракцию PHK и количественную оценку осуществляли как описано в примере 11.
В результате было установлено, что концентрации PHK составили 57,5 нг/μл, 53,8 нг/μл, 52,5 нг/μл и 52,1 нг/μл. 500 нг каждой экстрагированной PHK терминировали согласно способу примера 12, а затем оценивали количественно. Для исследования влияния терминации PHK на порог обнаружения, в качестве контроля использовали нетерминированную PHK. ПЦР в режиме реального времени с обратной транскрипцией проводили с использованием 100 нг PHK в каждом из числа реакционного раствора без функции обратной транскрипции с горячим стартом (то есть без PPi и PPase) и реакционного раствора для ПЦР с обратной транскрипцией и горячим стартом. ПЦР в режиме реального времени с обратной транскрипцией проводили с использованием термоблока «Exicycler 96 Real-Time Quantitative Thermal Block» (Bioneer, Korea) в следующих условиях: обратная транскрипция при 50°С в течение 15 минут, затем преденатурация при 95°С в течение 5 минут, после чего 45 циклов, каждый цикл состоящий из 95°С течение 5 секунд, отжиг при 60°С в течение 5 секунд, удлинение при 72°С в течение 6 секунд, и сканирование для обнаружения флуоресценции.
Результаты показали, что в случае образцов, содержащих терминированную PHK, реакционный раствор для обратной транскрипции с горячим стартом позволил детектировать образцы, содержащие 10 или большее количество клеток Hela, добавленных к 1 мл человеческой сыворотки (см. фиг. 13b). Реакционные растворы, не обладающие функцией обратной транскрипции с горячим стартом, позволили детектировать только образец, содержащий 100 или более клеток Hela (фиг. 13с). В случае образцов, не содержащих терминированную PHK, реакционный раствор для обратной транскрипции с горячим стартом позволил детектировать образцы, содержащие 100 или большее количество клеток Hela (см. фиг. 13d). Кроме того, реакция без функции обратной транскрипции с горячим стартом детектировала образцы, содержащие 1000 или больше клеток Hela (фиг. 13е).
Таким образом, видно, что порог обнаружения положительно изменился даже только посредством реакции обратной транскрипции с горячим стартом, но лучший эффект может быть получен, когда реакцию обратной транскрипции с горячим стартом осуществляли вместе с терминацией PHK.
Промышленная применимость
Как описано выше, композиция для реакции обратной транскрипции с горячим стартом и композиция для ПЦР с обратной транскрипцией и горячим стартом по настоящему изобретению могут помочь решить различные проблемы, имеющие место при проведении обычных реакций обратной транскрипции с горячим стартом и помогут специфически детектировать целевую PHK с высокой чувствительностью при проведения реакции обратной траскрипции с PPi и PPase. Таким образом, композиции настоящего изобретения могут стать основой постоянного набора, связанного с технологиями обратной транскрипции с горячим стартом/ПЦР с обратной транскрипцией и горячим стартом, который может быть эффективно использован в качестве диагностического набора для высокочувствительной детекции PHK.
Реферат
Изобретение относится к области биохимии. Описана группа изобретений, включающая композицию для реакции обратной транскрипции с горячим стартом, способ подготовки вышеуказанной композиции, композицию для ПЦР с обратной транскрипцией и горячим стартом, способ подготовки вышеуказанной композиции, набор для реакции обратной транскрипции с горячим стартом, который включает в себя композицию для реакции обратной транскрипции с горячим стартом и реакционную пробирку, набор для ПЦР с обратной транскрипцией и горячим стартом, способ обратной транскрипции РНК-матрицы, способ амплификации нуклеиновой кислоты, композицию ПЦР с обратной транскрипцией для диагностики злокачественного новообразования. Композиция для реакции обратной транскрипции содержит в своем составе ион Mg, четыре типа dNTP, обратную транскриптазу, пирофосфат и пирофосфатазу. Композиция для ПЦР помимо вышесказанного включает в себя ДНК-полимеразу. Изобретение расширяет арсенал средств, позволяющих проводить реакцию обратной транскрипции. 9 н. и 28 з.п. ф-лы, 13 ил., 3 табл., 13 пр.

Комментарии