Способ амплификации кольцевой днк - RU2748736C2
Код документа: RU2748736C2
Чертежи













Описание
Область техники
[0001] Настоящее изобретение относится к способу амплификации кольцевой ДНК. Более конкретно, настоящее изобретение относится к способу, который позволяет осуществлять экспоненциальную амплификацию кольцевой ДНК в бесклеточной системе.
Предшествующий уровень техники
[0002] Технология клонирования ДНК, на которой основано развитие биотехнологии, представляет собой метод амплификации кольцевой ДНК, которая была получена путем разрезания и лигирования фрагментов ДНК в виде плазмиды в клетках E. coli и т.п. Применение технологии клонирования ДНК, в которой используются клетки для амплификации кольцевой ДНК, требует проведения трудоемких процедур, таких как культивирование клеток, экстракция/очистка амплифицированных продуктов и т.п. Кроме того, проведение экспериментов по такому клонированию ДНК ограничено условиями окружающей среды для, поскольку для осуществления клонирования ДНК с использованием клеток необходимо получить генетически модифицированные организмы.
[0003] Наиболее распространенным методом, применяемым для амплификации ДНК in vitro, является полимеразная цепная реакция (ПЦР). Однако, амплификации ДНК in vitro с помощью ПЦР не позволяет осуществлять амплификацию кольцевой ДНК. Методы амплификации кольцевой ДНК in vitro включают амплификацию по типу «катящегося кольца» (RCA) (NPL 1, PTL 1, PTL 2, PTL 3). Однако, при амплификации кольцевой ДНК посредством амплификации по типу «катящегося кольца» каждый раз необходимо конструирование праймера, специфичного к ДНК-мишени. Кроме того, продуктом амплификации, который образуется непосредственно в результате амплификации по типу «катящегося кольца», является линейная ДНК, а поэтому необходимо проводить дополнительную стадию циклизации в целях получения кольцевого продукта амплификации, такую как инкубирование с ферментом, осуществляющим рекомбинацию. Другим описанным в литературе методом является метод получения мономерного продукта репликации путем выделения минихромосомы E. coli (кольцевой ДНК oriC), а затем их разделения с получением мономерного продукта кольцевой репликации (NPL 2-5). Однако, что касается условий проведения реакций, описанных в этих публикациях, то было экспериментально продемонстрировано, что эффективность репликации молекул кольцевой ДНК при добавлении матричной ДНК составляет лишь приблизительно 15-40%, и таким образом, амплифицируемое количество не достигает даже двухкратного увеличения (NPL 3-6). Кроме того, размер кольцевой ДНК, используемой в качестве матрицы, как описано в этих публикациях, составляет лишь менее, чем 10 т.п.о.
[0004] Как показано выше, амплификация кольцевой ДНК посредством стандартной амплификации ДНК in vitro имеет те недостатки, что она требует конструирования праймеров, связанных с матричной ДНК, продуцирования линейной ДНК в качестве продукта амплификации и ограничения размера амплифицируемой ДНК несколькими т.п.о. Кроме того, существует проблема, заключающаяся в том, что при продуцировании кольцевого продукта амплификации с использованием системы репликации минихромосомы Escherichia coli, матричная кольцевая ДНК не может амплифицироваться даже с двухкратным увеличением.
Список цитируемых документов
Патентные документы
PTL 1: Публикация нерассмотренной заявки на патент Японии No. 2005-229950
PTL 1: Публикация нерассмотренной заявки на патент Японии No. 2008-161182
PTL 3: Публикация нерассмотренной заявки на патент Японии No. 2012-501173
Патентная литература
[0006] NPL 1: Fakruddin M et al., J Pharm Bioallied Sci. 2013, 5: 245-252
NPL 2: Peng H & Marians KJ. PNAS. 1993, 90: 8571-8575
NPL 3: Hiasa H & Marians KJ. J Biol Chem. 1994, 269: 32655-32659
NPL 4: Funnell B et al., J Biol Chem. 1986, 261: 5616-5624
NPL 5: Hiasa H et al., J Biol Chem. 1994, 269: 2093-2099
NPL 6: Hiasa H & Marians KJ. J Biol Chem. 1994, 269: 26959-26968
Сущность изобретения
Техническая проблема
[0007] Целью настоящего изобретения является разработка способа простой и экспоненциальной амплификации кольцевой ДНК, а в частности, длинноцепочечной кольцевой ДНК в бесклеточной системе.
Решение проблемы
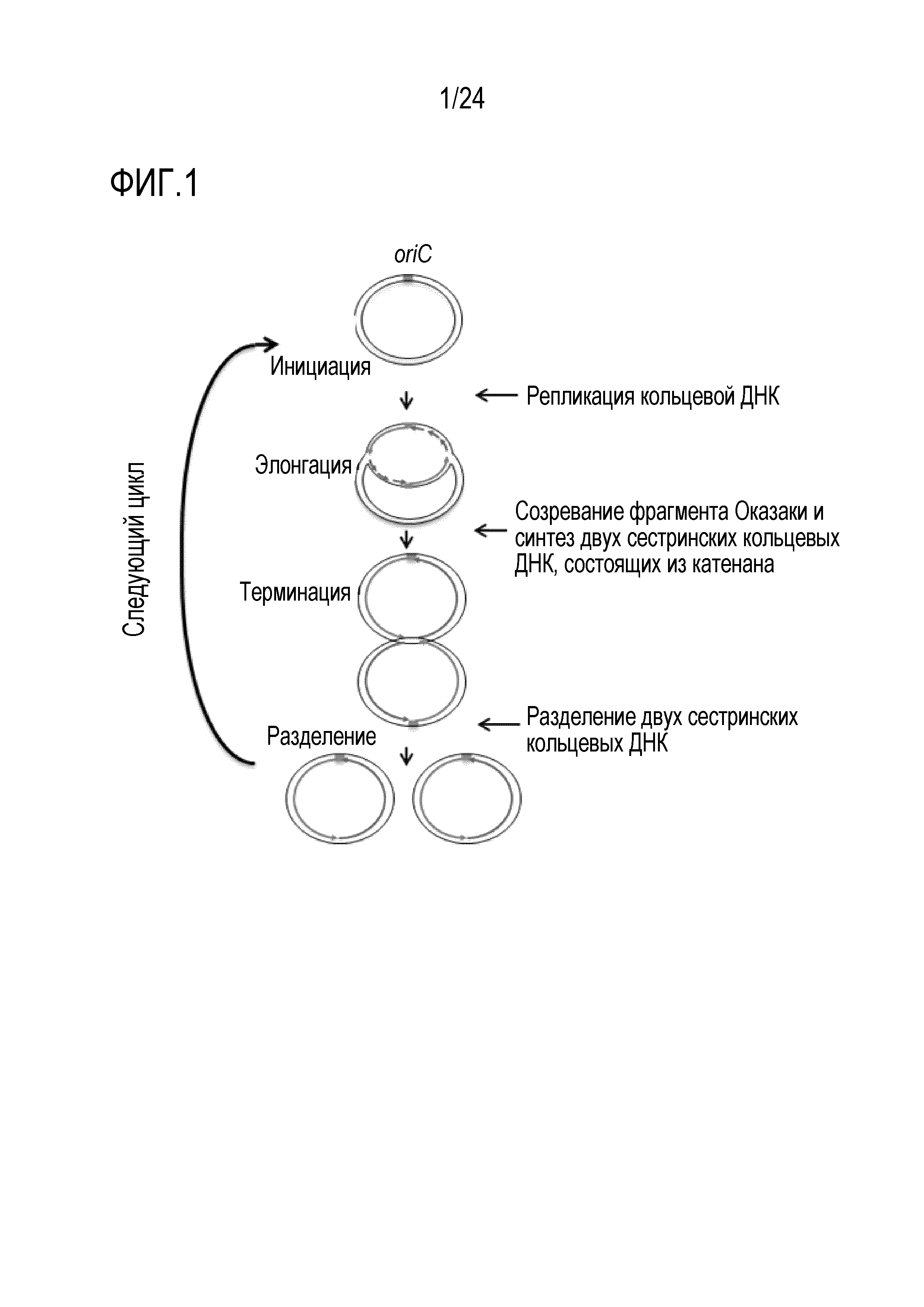
[0008] Авторами настоящего изобретения были проведены интенсивные исследования для решения вышеуказанной проблемы, и было обнаружено, что цикл «инициации репликации (расплетания двухцепочечной ДНК)/удлинения (образования репликативной вилки)/отделения реплицированных сестринских ДНК (прекращения образования цепи)» повторяется, и экспоненциальная амплификация кольцевой ДНК достигается при смешивании кольцевой ДНК, имеющей последовательность ориджина репликации (ориджина хромосомы (oriC)), с реакционным раствором, содержащим:
первую группу ферментов, которые катализируют репликацию кольцевой ДНК;
вторую группу ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана;
третью группу ферментов, которые катализируют разделение двух сестринских кольцевых ДНК;
буфер;
ATP;
GTP, CTP и UTP;
dNTP;
источник иона магния; и
источник иона щелочного металла, для образования реакционной смеси;
с получением реакционной смеси, которую затем подвергают реакции взаимодействия.
[0009] Другими словами, настоящее изобретение охватывает нижеследующие аспекты, которые включают, но не ограничиваются ими:
[0010] [1] Способ амплификации кольцевой ДНК, включающий следующие стадии:
(1) образования реакционной смеси кольцевой ДНК в качестве матрицы с реакционным раствором, содержащим:
первую группу ферментов, которые катализируют репликацию кольцевой ДНК;
вторую группу ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана;
третью группу ферментов, которые катализируют разделение двух сестринских кольцевых ДНК;
буфер;
ATP;
GTP, CTP и UTP;
dNTP;
источник иона магния; и
источник иона щелочного металла,
где кольцевая ДНК включает последовательность ориджина репликации (ориджина хромосомы (oriC)), которая может связываться с ферментом, обладающим DnaA-активностью; и
(2) поддерживания температуры реакционной смеси, полученной в (1) в изотермических условиях.
[0011] [2] Способ амплификации кольцевой ДНК, включающий следующие стадии:
(1) образования реакционной смеси кольцевой ДНК в качестве матрицы с реакционным раствором, содержащим:
первую группу ферментов, которые катализируют репликацию кольцевой ДНК;
вторую группу ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана;
третью группу ферментов, которые катализируют разделение двух сестринских кольцевых ДНК;
буфер;
ATP;
GTP, CTP и UTP;
dNTP;
источник иона магния; и
источник иона щелочного металла,
где кольцевая ДНК включает последовательность ориджина репликации (ориджина хромосомы (oriC)), которая может связываться с ферментом, обладающим DnaA-активностью; и
(2) инкубирования реакционной смеси, полученной в стадии (1), в термическом цикле с повторением инкубирования при 30°C или выше и инкубирования при 27°C или ниже.
[0012] [3] Способ в соответствии с вышеуказанными [1] или [2], где реакционный раствор также содержит неспецифический ингибитор адсорбции белка и/или неспецифический ингибитор адсорбции нуклеиновой кислоты.
[0013] [4] Способ в соответствии с вышеуказанными [1] или [2], где реакционный раствор также содержит экзонуклеазу, специфичную к линейной ДНК, и/или геликазу RecG-типа.
[0014] [5] Способ в соответствии с вышеуказанными [1] или [2], где реакционный раствор также содержит соль аммония.
[0015] [6] Способ в соответствии с вышеуказанными [1] или [2], где
первая группа ферментов содержит комбинацию фермента, обладающего DnaA-активностью; нуклеоидного белка одного или более типов; фермента или группы ферментов, обладающих ДНК-гиразной активностью; белка, связывающегося с одноцепочечной ДНК (SSB); фермента, обладающего геликазной активностью DnaB-типа; фермента, обладающего ДНК-геликазной загрузочной активностью; фермента, обладающего ДНК-примазной активностью; фермента, обладающего ДНК-захватывающей активностью; и фермента или группы ферментов, обладающих активностью ДНК-полимеразы III*;
вторая группа ферментов содержит комбинацию фермента, обладающего активностью ДНК-полимеразы I, и фермента, обладающего ДНК-лигазной активностью; а
третья группа ферментов содержит фермент, обладающий активностью топоизомеразы III, и/или фермент, обладающий активностью топоизомеразы IV.
[0016] [7] Способ в соответствии с вышеуказанным [6], где вторая группа ферментов также включает фермент, обладающий активностью РНКазы Н.
[0017] [8] Способ в соответствии с вышеуказанным [6], где третья группа ферментов также включает фермент, обладающий геликазной активностью RecQ-типа.
[0018] [9] Способ в соответствии с вышеуказанным [6], где
в первой группе ферментов:
один или более нуклеоидных белков представляют собой IHF или HU,
ферментом или группой ферментов, обладающих ДНК-гиразной активностью, является комплекс GyrA и GyrB,
ферментом, обладающим геликазной активностью DnaB-типа, является DnaB-геликаза,
ферментом, обладающим ДНК-геликазной загрузочной активностью, является загрузочный фермент DnaC-геликаза,
ферментом, обладающим ДНК-примазной активностью, является DnaG-примаза,
ферментом, обладающим ДНК-захватывающей активностью, является фермент, захватывающий DnaN,
ферментом или группой ферментов, обладающих активностью ДНК-полимеразы III*, являются фермент или группа ферментов, содержащих любые из DnaX, HolA, HolB, HolC, HolD, DnaE, DnaQ и HolE.
[0019] [10] Способ в соответствии с вышеуказанным [1], где изотермическим условием в стадии (2) является постоянная температура в пределах от 25°C до 50°C.
[0020] [11] Способ в соответствии с вышеуказанными [1] или [2], где реакционный раствор также содержит геликазу RecG-типа и/или экзонуклеазу, специфичную к одноцепочечной ДНК.
[0021] [12] Способ в соответствии с вышеуказанными [1] или [2], где реакционный раствор также содержит экзонуклеазу, специфичную к линейной ДНК, и/или экзонуклеазу, специфичную к одноцепочечной ДНК.
[0022] [13] Способ в соответствии с вышеуказанными [1] или [2], где реакционный раствор также содержит ДНК-стабилизирующий фактор.
[0023] [14] Способ в соответствии с вышеуказанными [1] или [2], где:
стадия (1) включает:
(1-1) предварительное инкубирование реакционного раствора, содержащего:
первую группу ферментов, которые катализируют репликацию кольцевой ДНК;
вторую группу ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана;
третью группу ферментов, которые катализируют разделение двух сестринских кольцевых ДНК;
буфер;
ATP;
GTP, CTP и UTP;
dNTP;
источник иона магния; и
источник иона щелочного металла; и
(1-2) образование реакционной смеси реакционного раствора с кольцевой ДНК в качестве матрицы.
[0024] [15] Способ в соответствии с вышеуказанными [1] или [2], где: стадию (2) осуществляют в эмульсии типа «вода в масле».
[0025] [16] Способ в соответствии с вышеуказанными [1] или [2], где после проведения стадии (2), указанный способ также включает:
(3) обработку после реакции, где
обработкой после реакции является:
(i) обработка путем разведения реакционной смеси пять или более раз реакционным раствором, который не содержит ферментов 1-3 групп, с последующим повторным нагреванием полученного соединения;
(ii) обработка экзонуклеазой, специфичной к линейной ДНК, и/или обработка экзонуклеазой, специфичной к одноцепочечной ДНК; и/или
(iii) обработка ферментом для репарации гэпов.
[0026] [17] Композиция для амплификации кольцевой ДНК, включающая:
первую группу ферментов, которые катализируют репликацию кольцевой ДНК;
вторую группу ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана;
третью группу ферментов, которые катализируют разделение двух сестринских кольцевых ДНК;
буфер;
ATP;
GTP, CTP и UTP;
dNTP;
источник иона магния; и
источник иона щелочного металла.
[0027] [18] Композиция в соответствии с вышеуказанным [17], также содержащая неспецифический ингибитор адсорбции белка и/или неспецифический ингибитор адсорбции нуклеиновой кислоты.
[0028] [19] Композиция в соответствии с вышеуказанным [17], также содержащая экзонуклеазу, специфичную к линейной ДНК, и/или геликазу RecG-типа.
[0029] [20] Композиция в соответствии с вышеуказанным [17], также содержащая геликазу RecG-типа и/или экзонуклеазу, специфичную к одноцепочечной ДНК.
[0030] [21] Композиция в соответствии с вышеуказанным [17], также содержащая экзонуклеазу, специфичную к линейной ДНК, и/или экзонуклеазу, специфичную к одноцепочечной ДНК.
[0031] [22] Композиция в соответствии с вышеуказанным [17], также содержащая ДНК-стабилизирующий фактор.
[0032] [23] Набор для амплификации кольцевой ДНК, включающий комбинацию:
первой группы ферментов, которые катализируют репликацию кольцевой ДНК;
второй группы ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана;
третьей группы ферментов, которые катализируют разделение двух сестринских кольцевых ДНК;
буфера;
ATP;
GTP, CTP и UTP;
dNTP;
источника иона магния; и
источника иона щелочного металла.
[0033] [24] Набор в соответствии с вышеуказанным [23], также включающий комбинацию с неспецифическим ингибитором адсорбции белка и/или неспецифическим ингибитором адсорбции нуклеиновой кислоты.
[0034] [25] Набор в соответствии с вышеуказанным [23], также включающий комбинацию с экзонуклеазой, специфичной к линейной ДНК, и/или геликазой RecG-типа.
[0035] [26] Набор в соответствии с вышеуказанным [23], также включающий геликазу RecG-типа и/или экзонуклеазу, специфичную к одноцепочечной ДНК.
[0036] [27] Набор в соответствии с вышеуказанным [23], также включающий экзонуклеазу, специфичную к линейной ДНК, и/или экзонуклеазу, специфичную к одноцепочечной ДНК.
[0037] [28] Набор в соответствии с вышеуказанным [23], также включающий ДНК-стабилизирующий фактор.
[0038] [29] Набор в соответствии с вышеуказанным [23], также включающий фермент для репарации гэпов.
[0039] [30] Способ экспоненциальной амплификации кольцевой ДНК путем повторения репликативного цикла, где указанный способ включает стадию образования реакционной смеси реакционного раствора, содержащего:
первую группу ферментов, которые катализируют репликацию кольцевой ДНК;
вторую группу ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана;
третью группу ферментов, которые катализируют разделение двух сестринских кольцевых ДНК;
буфер;
ATP;
GTP, CTP и UTP;
dNTP;
источник иона магния; и
источник иона щелочного металла.
где кольцевая ДНК включает последовательность ориджина репликации (ориджина хромосомы (oriC)), которая может связываться с ферментом, обладающим DnaA-активностью.
[0040] [31] Способ амплификации кольцевой ДНК, включающий следующие стадии:
(1) образования реакционной смеси кольцевой ДНК в качестве матрицы с реакционным раствором, содержащим:
первую группу ферментов, которые катализируют репликацию кольцевой ДНК;
вторую группу ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана;
третью группу ферментов, которые катализируют разделение двух сестринских кольцевых ДНК;
буфер;
ATP;
GTP, CTP и UTP;
dNTP;
источник иона магния; и
источник иона щелочного металла, где
где кольцевая ДНК включает последовательность ориджина репликации (ориджина хромосомы (oriC)), которая может связываться с ферментом, обладающим DnaA-активностью; и
(2) поддерживания температуры реакционной смеси, полученной в (1) в предварительно заданных интервалах.
[0041] [32] Набор для амплификации кольцевой ДНК, включающий:
комбинацию:
первой группы ферментов, которые катализируют репликацию кольцевой ДНК;
второй группы ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана;
третьей группы ферментов, которые катализируют разделение двух сестринских кольцевых ДНК;
буфера;
ATP;
GTP, CTP и UTP;
dNTP;
источника иона магния; и
источника иона щелочного металла, и
руководство, включающее инструкции по проведению способа экспоненциальной амплификации кольцевой ДНК путем повторения репликативного цикла с использованием реакционной смеси реакционного раствора, содержащего вышеописанную комбинацию и кольцевую ДНК, служащую в качестве матрицы.
[0042] [33] Способ в соответствии с любым из вышеописанных [1], [2], [30] и [31], где реакционный раствор также содержит тРНК.
[0043] [34] Композиция в соответствии с вышеописанным [17], где где реакционный раствор также содержит тРНК.
[0044] [35] Набор в соответствии с вышеописанными [23] или [32], где реакционный раствор также содержит тРНК.
[0045] [36] Способ в соответствии с любым из вышеописанных [1], [2], [30] и [31], где реакционный раствор также содержит 100 мМ или более источника иона щелочного металла.
[0046] [37] Композиция в соответствии с вышеописанным [17], где реакционный раствор также содержит 100 мМ или более источника иона щелочного металла.
[0047] [38] Набор в соответствии с вышеописанными [23] или [32], где реакционный раствор также содержит 100 мМ или более источника иона щелочного металла.
[0048] [39] Способ в соответствии с вышеописанными [1], [2], [30] и [31], где кольцевую ДНК амплифицируют по меньшей мере 10 раз.
Предпочтительные эффекты изобретения
[0049] Настоящее изобретение относится к способу простой и экспоненциальной амплификации кольцевой ДНК, а в частности, длинноцепочечной кольцевой ДНК без использования клеток E. coli или плазмидных векторов. Настоящее изобретение позволяет осуществлять амплификацию кольцевой ДНК без использования праймеров и позволяет амплифицировать длинноцепочечную кольцевую ДНК размером выше 200 т.п.о. В соответствии со способом согласно изобретению, кольцевая ДНК может быть амплифицирована даже из одной молекулы матричной кольцевой ДНК. Кроме того, продукт амплификации, полученный в настоящем изобретении, представляет собой копию, которая сохраняет кольцевую структуру исходной матрицы. В соответствии с настоящим изобретением, добавление фрагментов ДНК к реакционной системе после лигирования этих фрагментов ДНК, также позволяет осуществлять специфическую амплификацию только той ДНК, которая была циклизована путем лигирования.
Краткое описание чертежей
[0050] На фигуре 1 показана модель репликативного цикла согласно изобретению.
На фигуре 2 показана структура ДНК, циклизованной посредством лигирования in vitro методом сборки Гибсона.
На фигуре 3 показан результат детектирования продукта амплификации в каждый период времени реакции, где в качестве матрицы была использована кольцевая ДНК размером 9,6 т.п.о., и результат детектирования, полученный с использованием зеленого SYBR после электрофореза продукта в агарозе.
На фигуре 4 показаны результаты детектирования продукта амплификации в случае, когда в качестве матрицы использовали длинноцепочечные кольцевые ДНК размером 200 т.п.о. и 80 т.п.о., и результат детектирования, полученный с использованием зеленого SYBR после электрофореза продукта в агарозе. На фигуре 4a показан результат детектирования продукта амплификации в каждый период проведения реакции в случае, когда в качестве матрицы использовали длинноцепочечную кольцевую ДНК размером 200 т.п.о. (15 пМ, 20 нг). На фигуре 4b показан результат для продукта амплификации через 3 часа после проведения реакции в случае, когда в качестве матрицы использовали длинноцепочечные кольцевые ДНК размером 80 т.п.о. (15 пМ, 8 нг) и 200 т.п.о. (5 пМ, 6,7 нг).
На фигуре 5 показан результат детектирования продукта амплификации в случае, когда в качестве матрицы использовали ДНК, циклизованную посредством лигирования in vitro методом сборки Гибсона, и результат детектирования, полученный с использованием зеленого SYBR, после электрофореза продукта в агарозе.
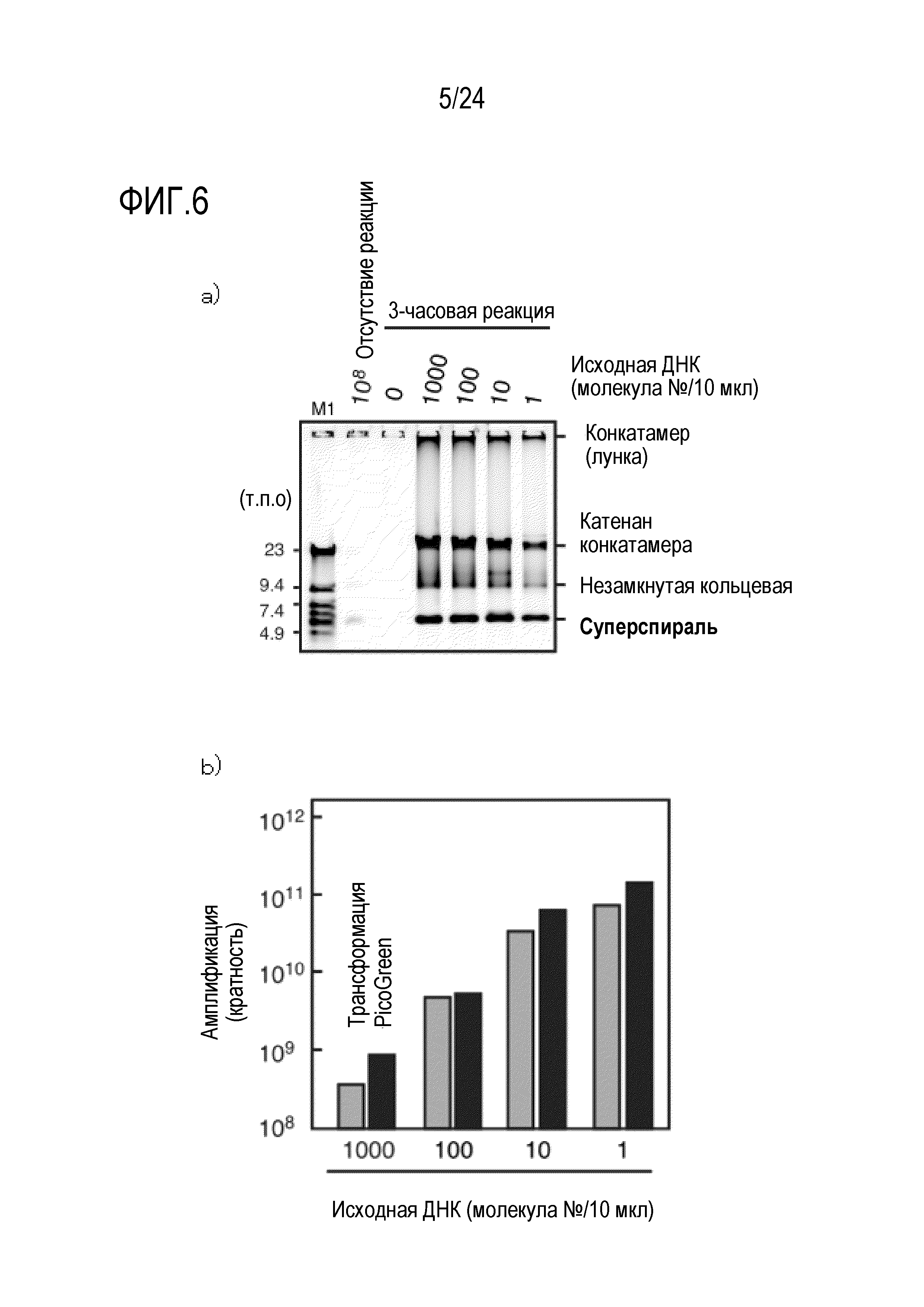
На фигуре 6 показан результат эксперимента по амплификации, в котором в качестве матрицы использовали кольцевую ДНК размером 9,6 т.п.о. в небольшом количестве (на уровне одной молекулы). На фигуре 6a показан результат детектирования продукта амплификации в случае, когда в качестве матрицы использовали кольцевую ДНК размером 9,6 т.п.о., и результат детектирования, полученный с использованием зеленого SYBR, после электрофореза продукта в агарозе. На фигуре 6b представлен график, на котором показан результат уровня амплификации, полученный путем количественной оценки ДНК продукта амплификации с применением метода PicoGreen или путем трансформации E.coli.
На фигуре 7 представлен график, на котором показано число амплифицированных молекул кольцевой ДНК, соответствующее времени амплификации в случае, когда в качестве матрица использовали кольцевую ДНК размером 9,6 т.п.о.
На фигуре 8 представлена диаграмма, иллюстрирующая результат теста на амплификацию клона одной кольцевой ДНК в смеси. На фигуре 8a представлена схема разведения смеси кольцевой ДНК. На фигуре 8b показан результат детектирования продукта амплификации в случае, когда амплифицировали разведенную смесь кольцевой ДНК, и результат детектирования, полученный с использованием зеленого SYBR после электрофореза продукта в агарозе.
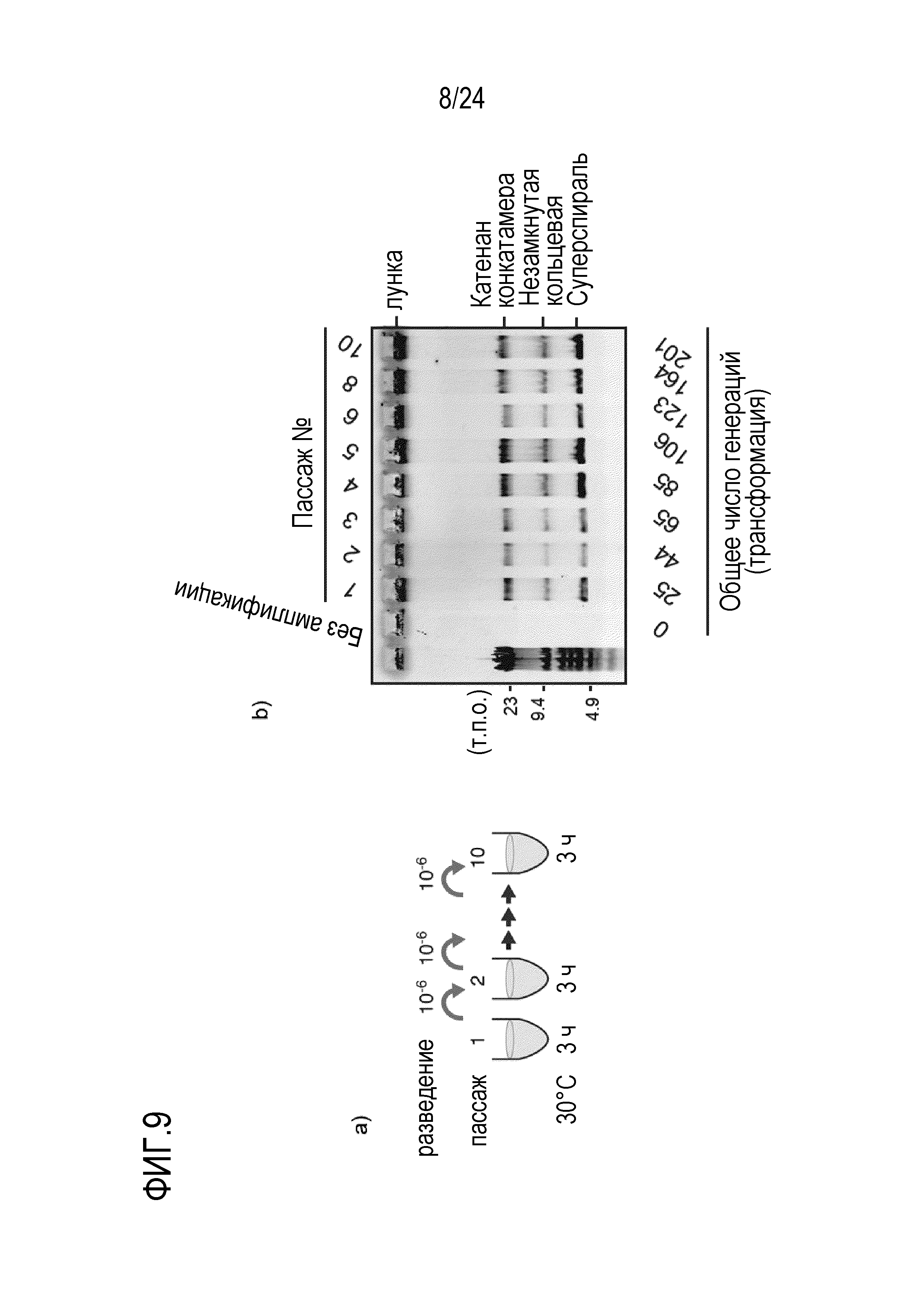
На фигуре 9 представлена диаграмма, иллюстрирующая результат теста на амплификацию пассажей кольцевой ДНК. На фигуре 9a представлена схема проведения эксперимента. На фигуре 9b показан результат, когда пассажи амплификации повторяли 10 раз путем разведения ДНК-продукта после амплификации с образованием нового реакционного раствора с последующей повторной амплификацией этого раствора.
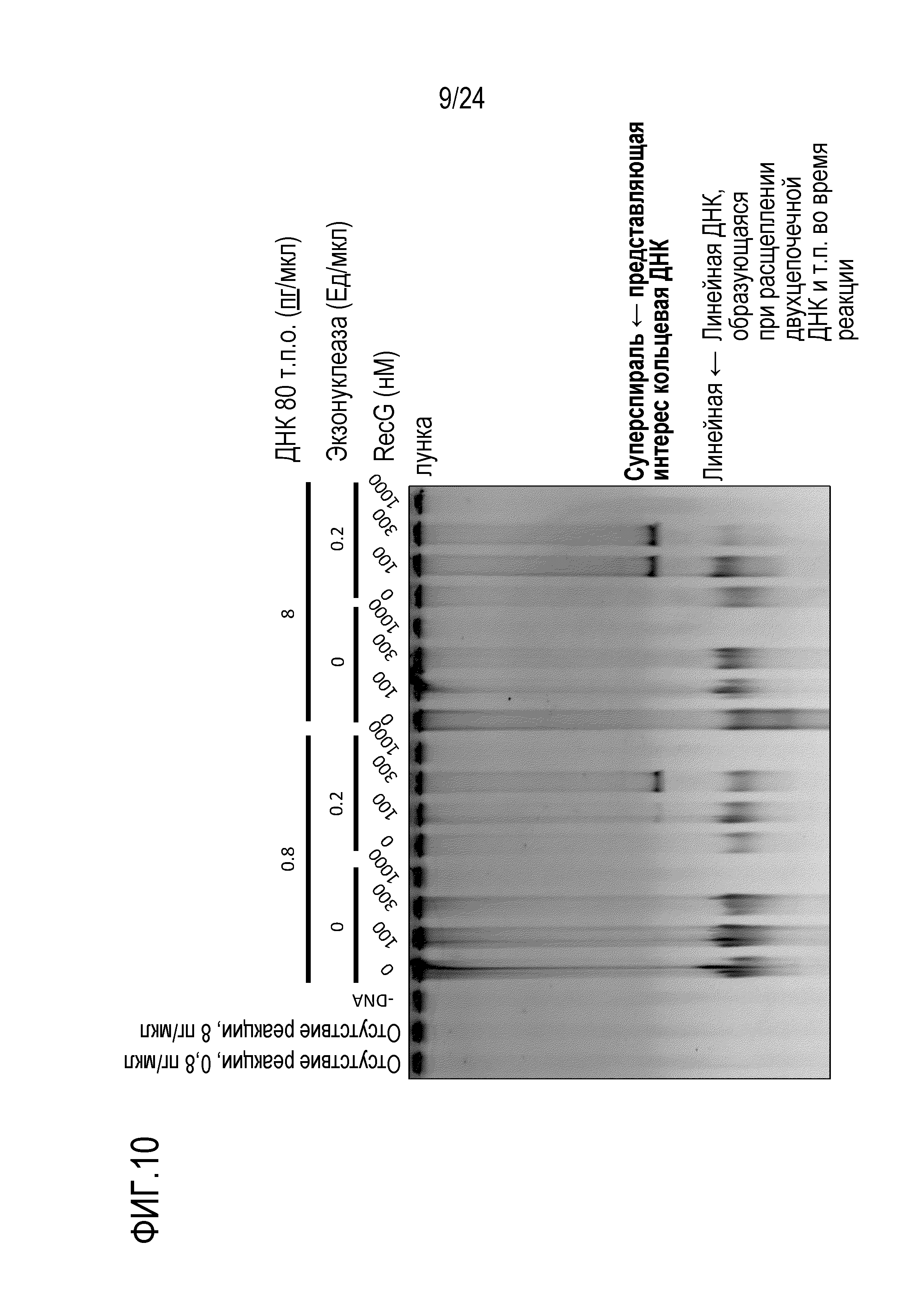
На фигуре 10 показаны результаты, полученные после проведения электрофореза в агарозном геле для продукта амплификации, который был получен с использованием кольцевой ДНК размером 80 т.п.о. в качестве матрицы и добавлением RecG и экзонуклеазы, специфичной к линейной ДНК, с последующим детектированием этого продукта с использованием зеленого SYBR.
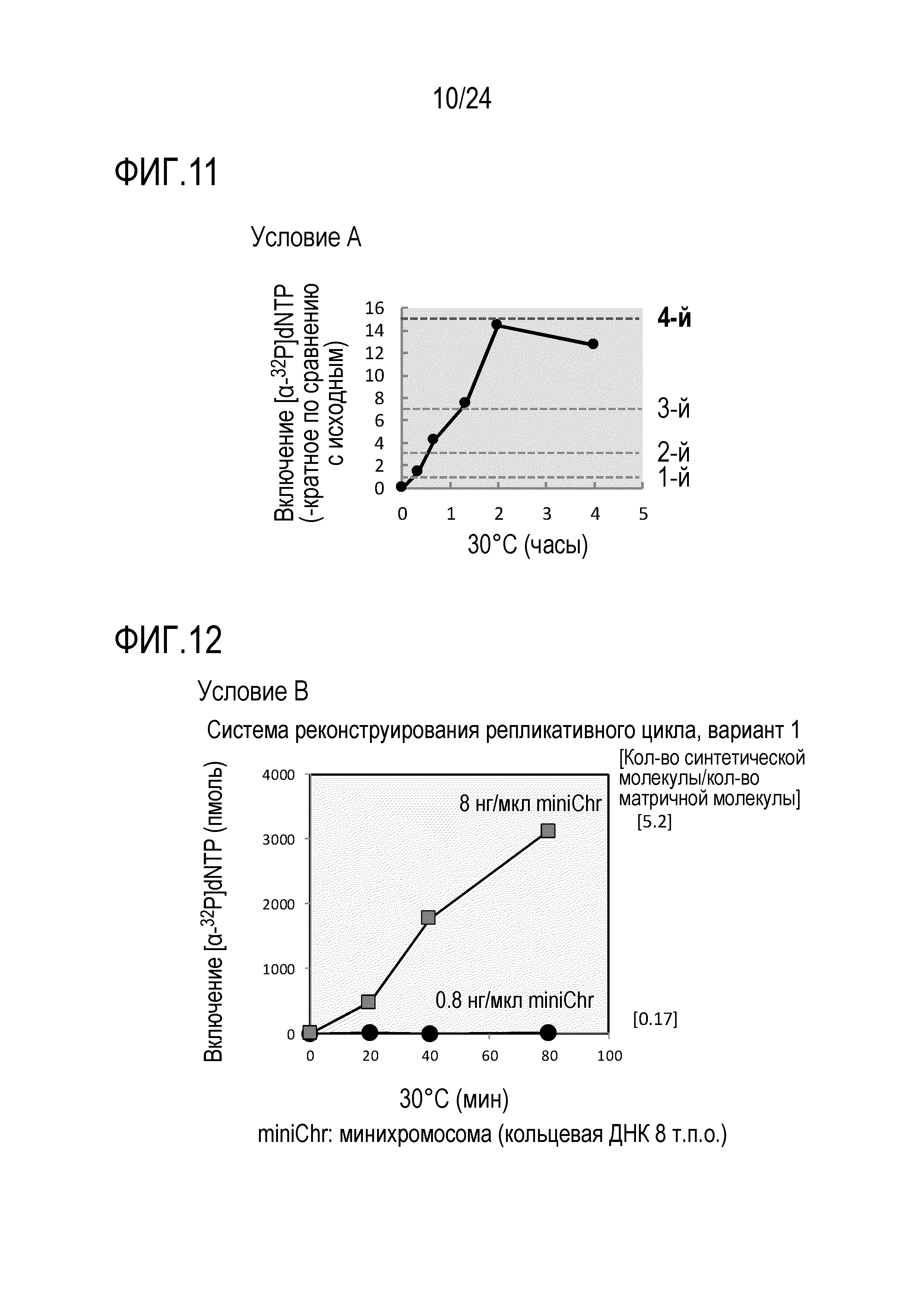
На фигуре 11 представлен график, иллюстрирующий результаты в условиях А в Примере 7.
На фигуре 12 представлен график, иллюстрирующий результаты в условиях В в Примере 7.
На фигуре 13 представлен график, иллюстрирующий результаты в условиях С (исследований по оценке количеств GTP, CTP и UTP) и, гель-электрофореграмма, полученная в Примере 7.
На фигуре 14 представлен график, иллюстрирующий результаты в условиях D (исследований по оценке количеств IHF) в Примере 7.
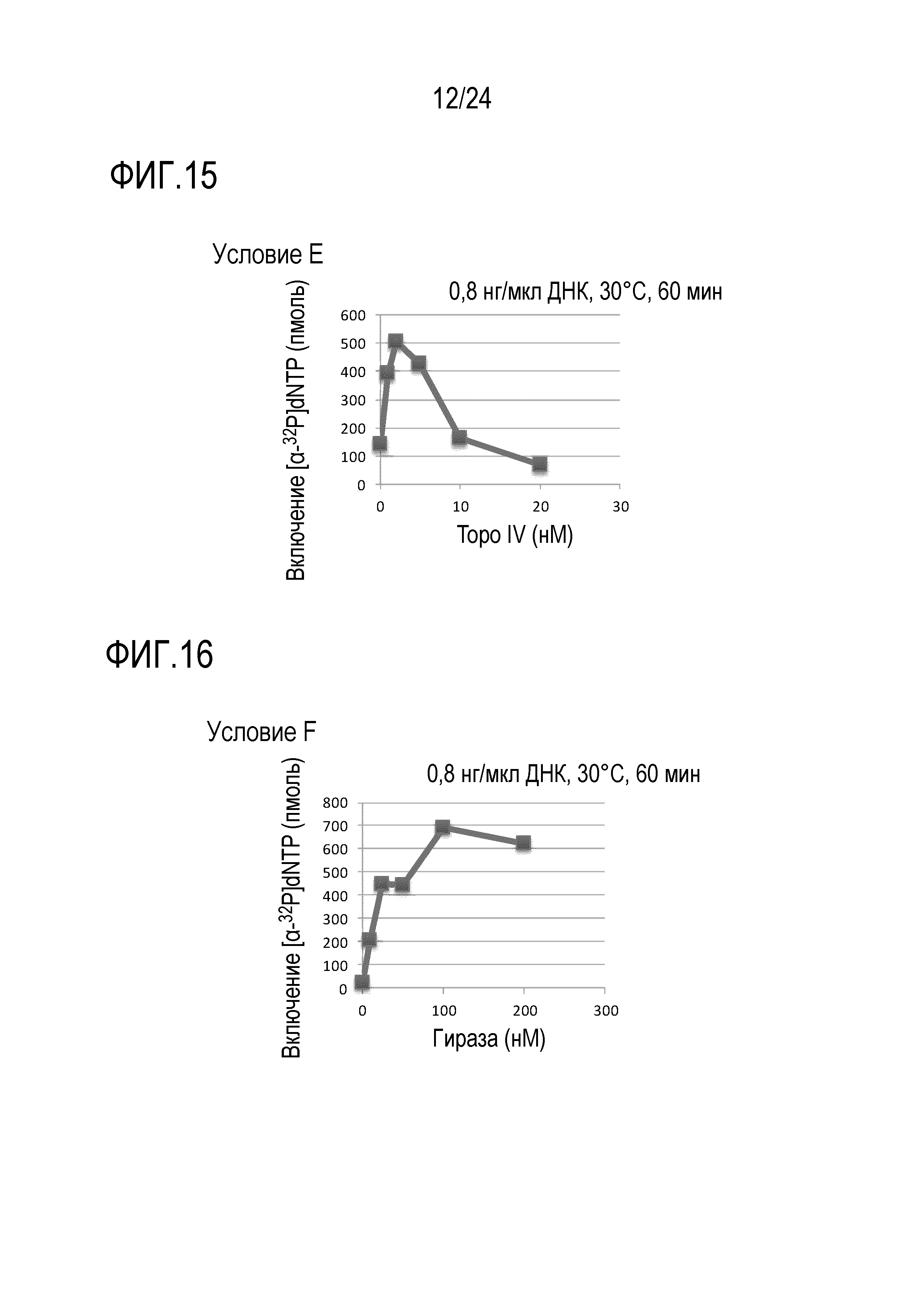
На фигуре 15 представлен график, иллюстрирующий результаты в условиях Е (исследований по оценке количеств Topo IV) в Примере 7.
На фигуре 16 представлен график, иллюстрирующий результаты в условиях F (исследований по оценке количества ДНК-гиразы) в Примере 7.
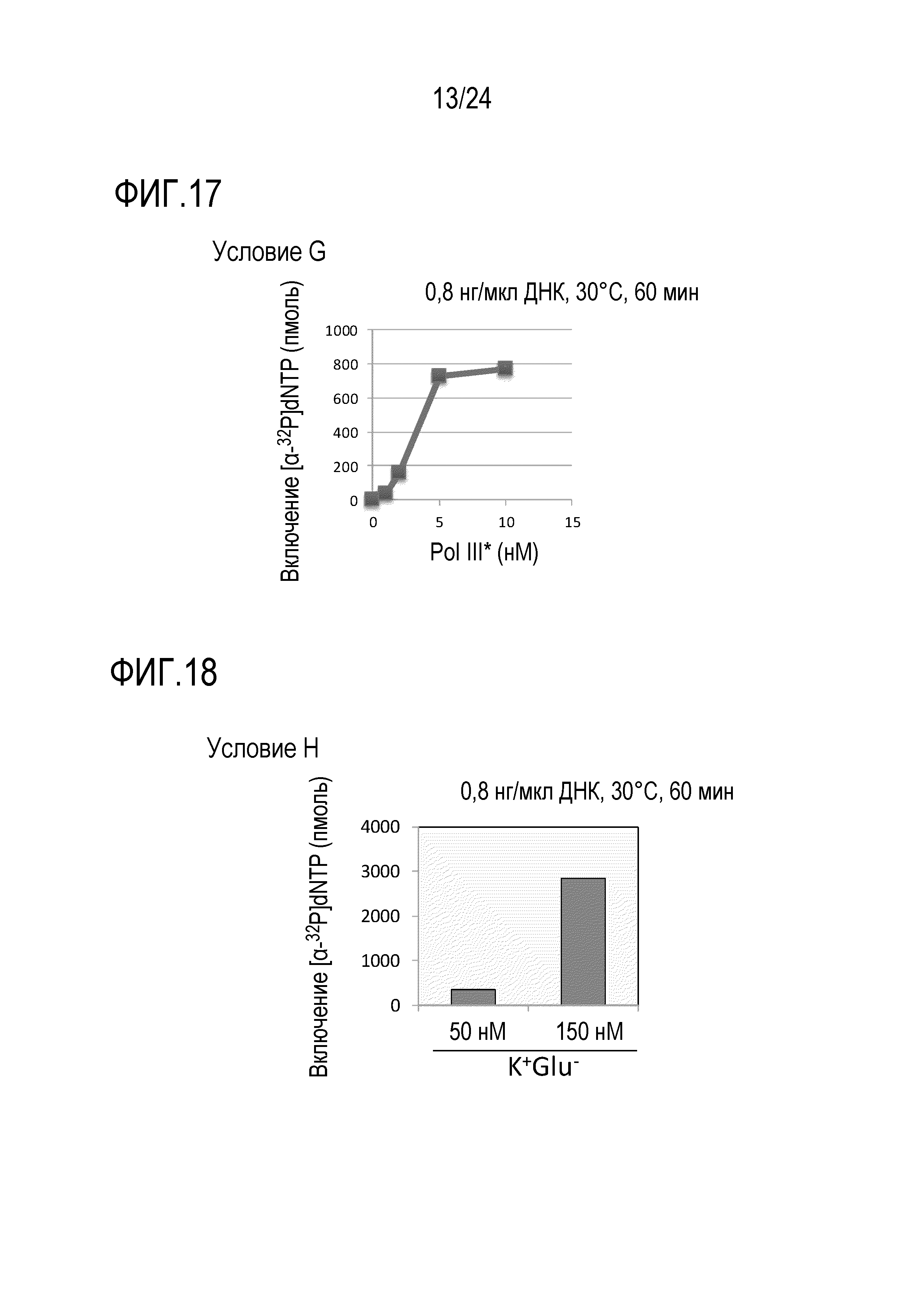
На фигуре 17 представлен график, иллюстрирующий результаты в условиях G (исследований по оценке количества ДНК-полимеразы III*) в Примере 7.
На фигуре 18 представлен график, иллюстрирующий результаты в условиях H (исследований по оценке количества источника иона щелочного металла) в Примере 7.
На фигуре 19 представлен график, иллюстрирующий результаты в условиях I (исследований по оценке количеств неспецифического ингибитора адсорбции белка и/или неспецифического ингибитора адсорбции нуклеиновой кислоты) в Примере 7.
На фигуре 20 представлен график, иллюстрирующий результаты в условиях J (исследований по оценке количества фермента, обладающего DnaA-активностью) в Примере 7.
На фигуре 21 представлен график, иллюстрирующий результаты в условиях K (исследований по оценке количества фермента, обладающего ДНК-лигазной активностью) в Примере 7.
На фигуре 22 представлен график, иллюстрирующий результаты в условиях L (исследований по оценке количества SSB) и, гель-электрофореграмма, полученная в Примере 7.
На фигуре 23 представлен график, иллюстрирующий результаты в условиях M (исследований по оценке количества фермента, обладающего активностью ДНК-полимеразы I) в Примере 7.
На фигуре 24 представлен график, иллюстрирующий результаты в условиях N (исследований по оценке количеств фермента, обладающего геликазной активностью DnaB-типа, и фермента, обладающего ДНК-геликазной загрузочной активностью) в Примере 7.
На фигуре 25 представлен график, иллюстрирующий результаты в условиях O (исследований по оценке количества фермента, обладающего активностью РНКазы H) в Примере 7.
На фигуре 26 представлен график, иллюстрирующий результаты в условиях P в Примере 7.
На фигуре 27 представлена гель-электрофореграмма и графики, иллюстрирующие результаты в условиях Q (исследований по оценке композиций и количеств ферментов, принадлежащих к группе из трех ферментов) в Примере 7.
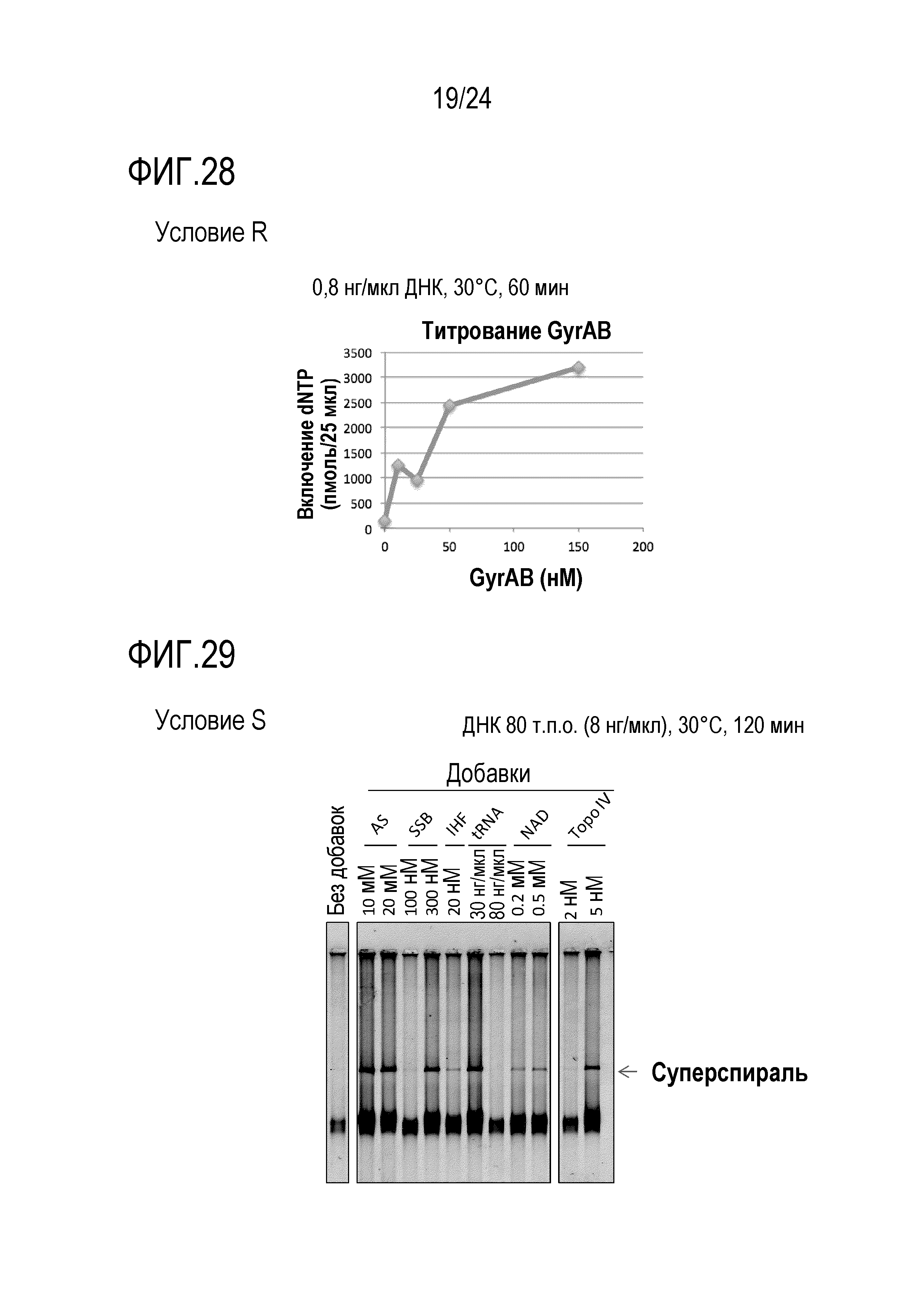
На фигуре 28 представлен график, иллюстрирующий результаты в условиях R в Примере 7.
На фигуре 29 представлен график, иллюстрирующий результаты в условиях S в Примере 7.
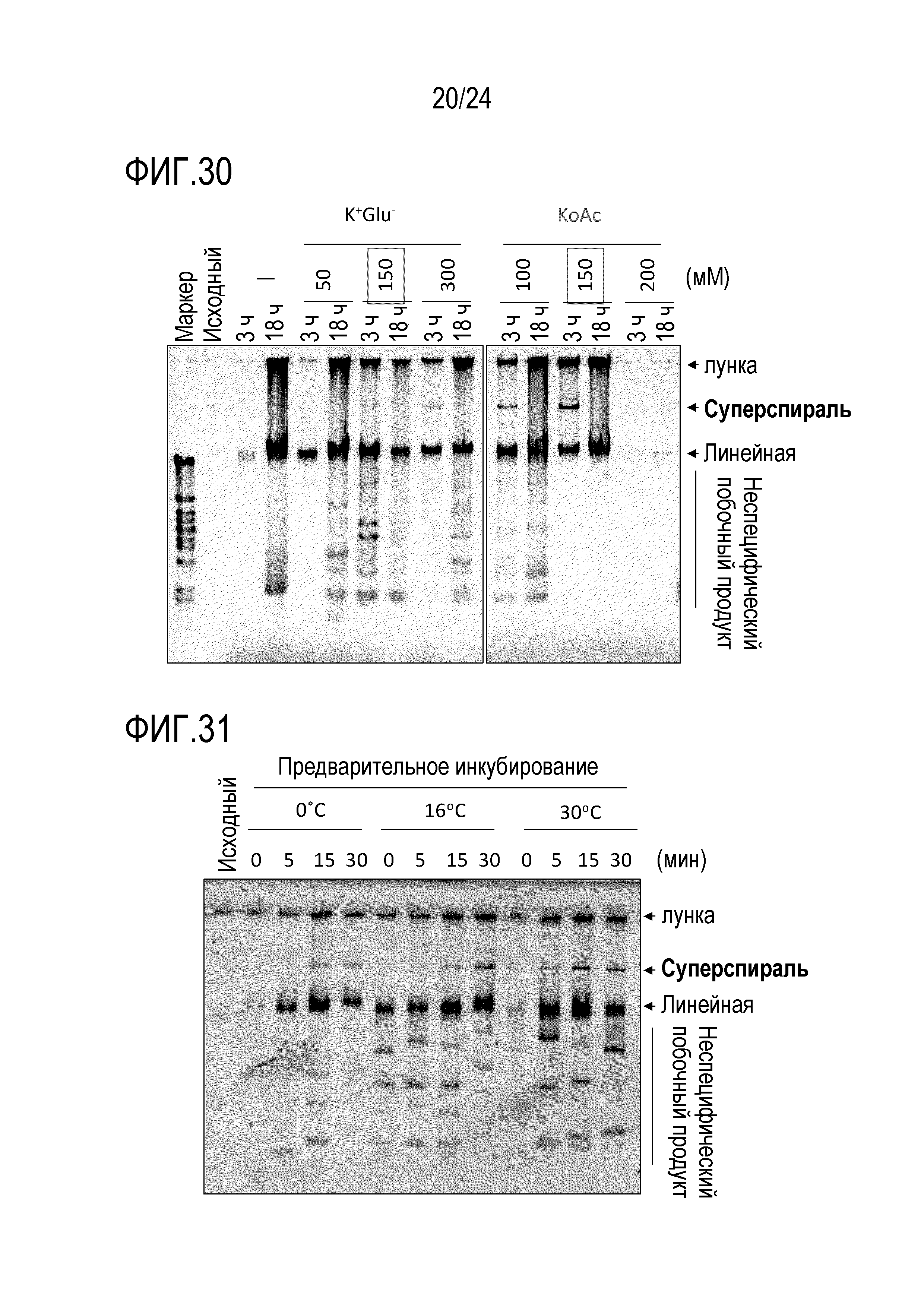
На фигуре 30 представлена гель-электрофореграмма, иллюстрирующая результаты, полученные при исследовании влияния добавления источника иона щелочного металла.
На фигуре 31 представлена гель-электрофореграмма, иллюстрирующая результаты, полученные при исследовании эффективности реакции амплификации путем предварительного инкубирования.
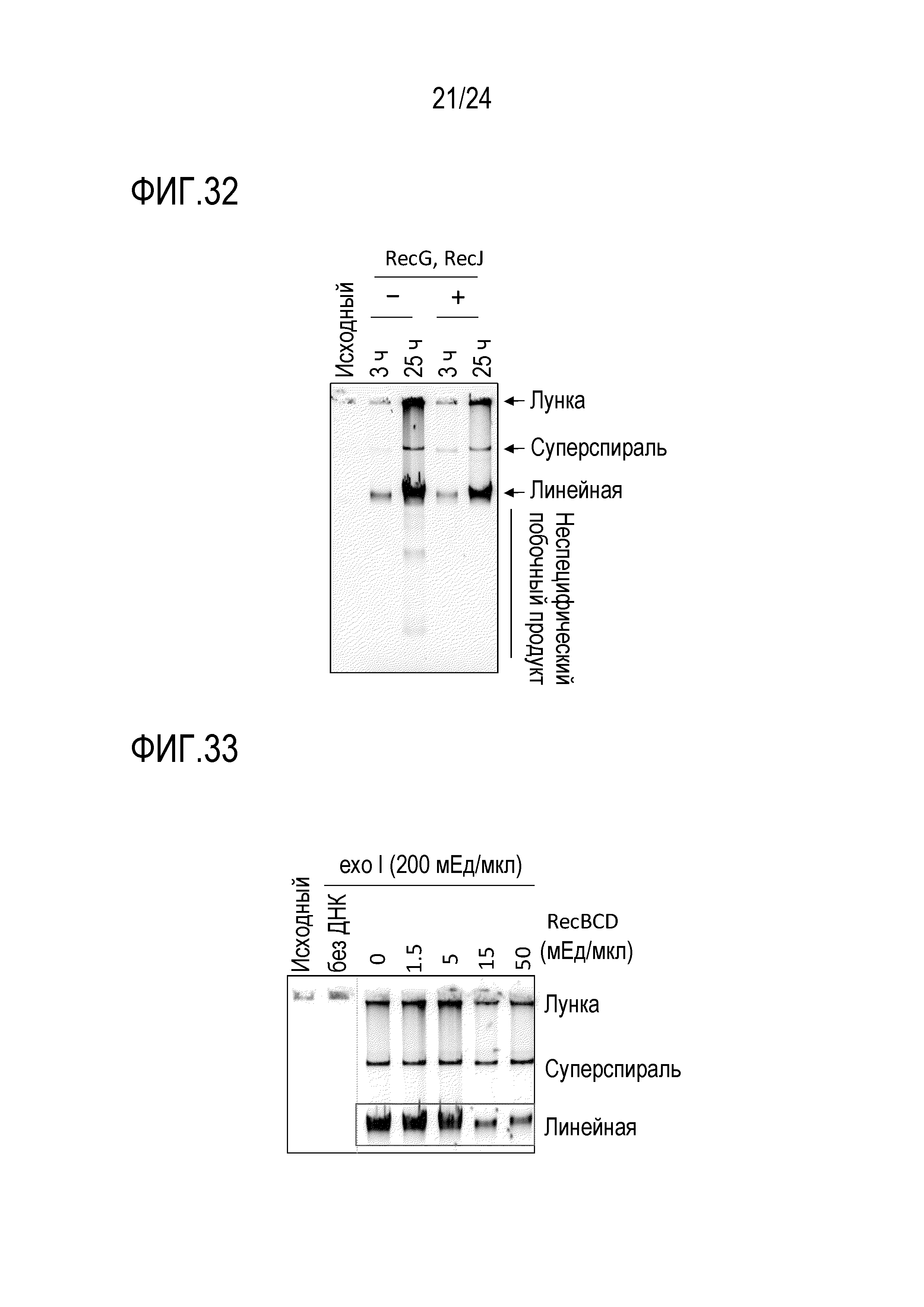
На фигуре 32 представлена гель-электрофореграмма, иллюстрирующая результаты детектирования продуктов амплификации в случае добавления RecG и RecJ.
На фигуре 33 представлена гель-электрофореграмма, иллюстрирующая результаты детектирования продуктов амплификации в случае добавления RecBCD и exo I.
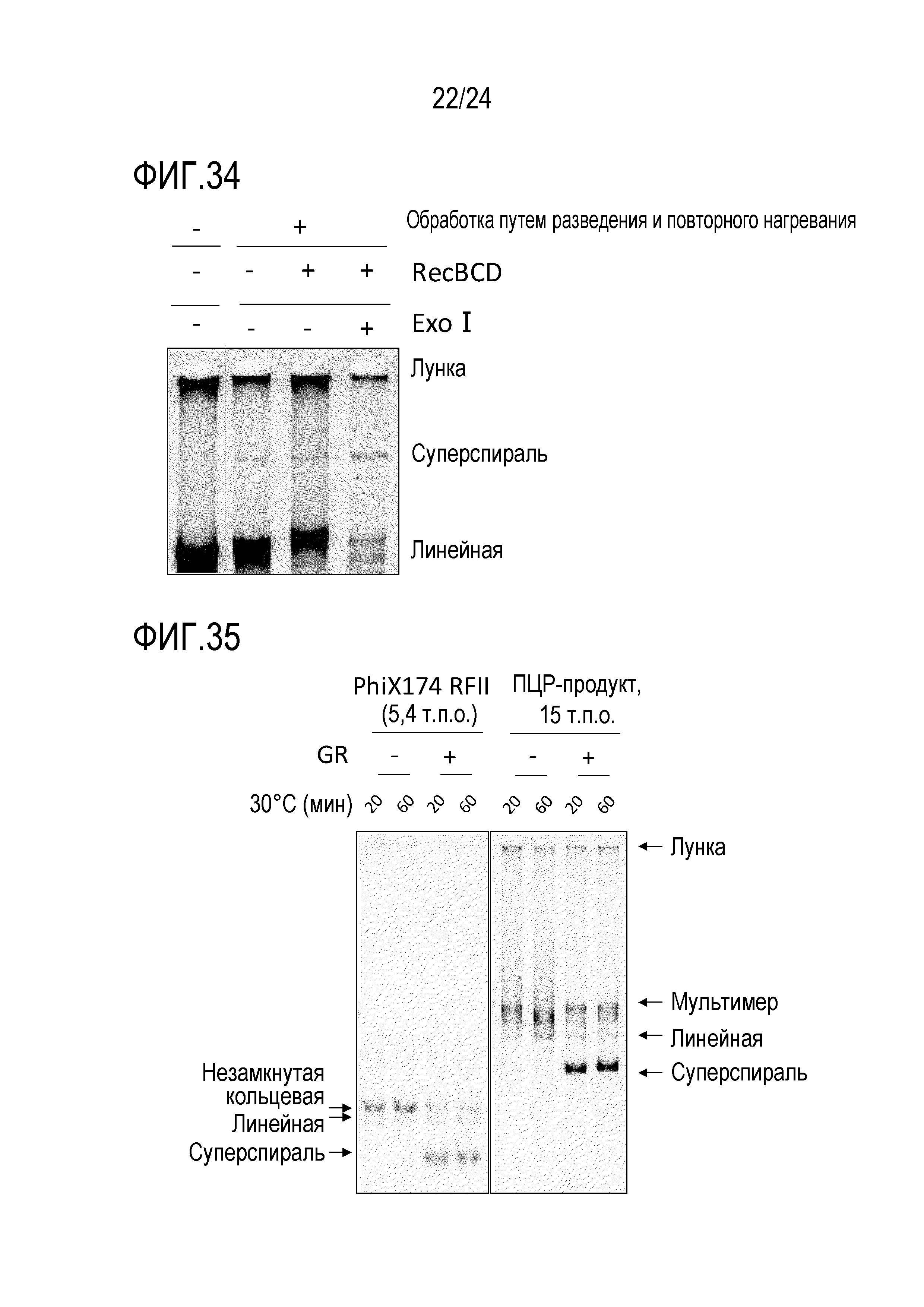
На фигуре 34 представлена гель-электрофореграмма, иллюстрирующая результаты детектирования продуктов амплификации в случае обработки продуктов реакции ферментами RecBCD и exo I после завершения реакции амплификации.
На фигуре 35 представлена гель-электрофореграмма, иллюстрирующая результаты детектирования продуктов амплификации в случае обработки продуктов реакции ферментом для репарации гэпов после завершения реакции амплификации.
На фигуре 36 представлена гель-электрофореграмма, иллюстрирующая результаты, полученные при исследовании эффективности реакции амплификации в случае использования фактора, стабилизирующего длинноцепочечную кольцевую ДНК.
На фигуре 37 представлена гель-электрофореграмма, иллюстрирующая результаты, полученные при исследовании реакции амплификации кольцевой ДНК в эмульсии типа «вода в масле».
На фигуре 38 представлена гель-электрофореграмма, иллюстрирующая результаты детектирования продуктов амплификации, полученных после реакции амплификации кольцевой ДНК в термическом цикле.
Описание вариантов осуществления изобретения
[0051] Далее приводится подробное описание настоящего изобретения. Однако, настоящее изобретение не ограничивается таким описанием. Научные и технические термины, используемые в настоящем изобретении, имеют свои общепринятые значения, понятные специалистам в данной области, если это не оговорено особо.
[0052] <Кольцевая ДНК>
Кольцевая ДНК, используемая в качестве матрицы, предпочтительно, является двухцепочечной. Кольцевая ДНК, используемая в качестве матрицы, не имеет конкретных ограничений при условии, что она включает последовательность ориджина репликации (ориджина хромосомы (oriC)), которая может связываться с ферментом, обладающим DnaA-активностью, и примерами таких ДНК являются природная кольцевая ДНК, такая как кольцевая хромосома микроорганизмов; кольцевая ДНК, полученная путем лигирования природной кольцевой ДНК, которая была расщеплена посредством ферментативного процессинга и т.п., с другим фрагментом ДНК и с последующей циклизацией лигированного продукта; и кольцевая ДНК, которая была получена искусственно путем синтеза. Что касается последовательностей ориджина репликации (ориджина хромосомы (oriC)), которые могут связываться с ферментом, обладающим DnaA-активностью (эта последовательность может далее называться просто «последовательностью ориджина репликации»), то общеизвестные последовательности ориджина репликации, присутствующие в бактериях, таких как E. coli, Bacillus subtilis и т.п., могут быть взяты из общедоступной базы данных, такой как NCBI (http://www.ncbi.nlm.nih.gov/). Кроме того, последовательность ориджина репликации может быть получена путем клонирования фрагмента ДНК, который может связываться с ферментом, обладающим DnaA-активностью, с последующим анализом этой последовательности оснований.
[0053] Кольцевая ДНК, используемая в настоящем изобретении в качестве матрицы, может представлять собой кольцевую ДНК, которая изначально содержит последовательность ориджина репликации или кольцевую ДНК, которая по своей природе не содержит последовательности ориджина репликации, но в которую она может быть впоследствии введена.
[0054] Кольцевая ДНК, используемая в настоящем изобретении в качестве матрицы, может включать последовательности маркерных генов резистентности к лекарственным средствам, таким как канамицин, ампициллин, тетрациклин и т.п., в зависимости от цели их применения.
[0055] Кроме того, кольцевая ДНК, используемая в настоящем изобретении в качестве матрицы, может быть получена в очищенной форме, либо она может быть получена в форме суспензии после экстракции из плодового тела гриба, включающего кольцевую ДНК. В качестве матрицы может быть использована кольцевая ДНК одного типа, но в качестве матрицы может быть также использована смесь кольцевых ДНК нескольких типов, такая как библиотека ДНК в одной тест-пробирке.
[0056] Длина кольцевой ДНК, используемой в настоящем изобретении в качестве матрицы, не имеет конкретных ограничений и может составлять 1 т.п.о. (длиной 1000 оснований) или более, 5 т.п.о. (длиной 5000 оснований) или более, 8 т.п.о. (длиной 8000 оснований) или более, 10 т.п.о. (длиной 10000 оснований) или более, 50 т.п.о. (длиной 50000 оснований) или более, 100 т.п.о. (длиной 100000 оснований) или более, 200 т.п.о. (длиной 200000 оснований) или более, 500 т.п.о. (длиной 500000 оснований) или более, 1000 т.п.о. (длиной 1000000 оснований) или более или 2000 т.п.о. (длиной 2000000 оснований) или более.
[0057] <Первая, вторая и третья группы ферментов>
1. Первая группа ферментов
В настоящем описании, первая группа ферментов означает группу ферментов, которые катализируют репликацию кольцевой ДНК.
[0058] Примером первой группы ферментов, которые катализируют репликацию кольцевой ДНК, является группа ферментов, описанная Kaguni JM & Kornberg A. Cell. 1984, 38:183-90. В частности, примерами первой группы ферментов являются один или более ферментов или групп ферментов, выбранных из группы, состоящей из фермента, обладающего DnaA-активностью; нуклеоидного белка одного или более типов; фермента или группы ферментов, обладающих ДНК-гиразной активностью; белка, связывающегося с одноцепочечной ДНК (SSB); фермента, обладающего геликазной активностью DnaB-типа; фермента, обладающего ДНК-геликазной загрузочной активностью; фермента, обладающего ДНК-примазной активностью; фермента, обладающего ДНК-захватывающей активностью; и фермента или группы ферментов, обладающих активностью ДНК-полимеразы III*; и комбинаций всех вышеупомянутых ферментов или групп ферментов.
[0059] Фермент, обладающий DnaA-активностью, конкретно не ограничивается биологическим происхождением, при условии, что он обладает инициирующей активностью, аналогичной активности DnaA, который представляет собой инициирующий белок E. coli, при этом, предпочтительно, использовать DnaA, происходящий от E. coli. DnaA происходящий от Escherichia coli, может содержаться в качестве мономера в реакционном растворе в количестве от 1 нМ до 10 мкМ, а предпочтительно, в количестве от 1 нМ до 5 мкМ, от 1 нМ до 3 мкМ, от 1 нМ до 1,5 мкМ, от 1 нМ до 1,0 мкМ, от 1 нМ до 500 нМ, от 50 нМ до 200 нМ или от 50 нМ до 150 нМ, но такое количество не ограничивается указанными значениями.
[0060] Нуклеоидным белком является белок в нуклеоиде. Нуклеоидный белок одного или более типов, используемый в настоящем изобретении, конкретно не ограничивается биологическим происхождением, при условии, что он обладает активностью, аналогичной активности нуклеоидного белка E. coli. Так, например, предпочтительно использовать IHF, происходящий от Escherichia coli, а именно, комплекс IhfA и/или IhfB (гетеродимер или гомодимер) или HU, происходящий от Escherichia coli, а именно, комплекс hupA и hupB. IHF, происходящий от Escherichia coli, может содержаться в виде гетеро/гомодимера в реакционном растворе в концентрации в пределах от 5 нМ до 400 нМ. Предпочтительно, IHF, происходящий от Escherichia coli, может содержаться в реакционном растворе в концентрации в пределах от 5 нМ до 200 нМ, от 5 нМ до 100 нМ, от 5 нМ до 50 нМ, от 10 нМ до 50 нМ, от 10 нМ до 40 нМ или от 10 нМ до 30 нМ, но такая концентрация не ограничивается указанными пределами. HU, происходящий от Escherichia coli, может содержаться в реакционном растворе в концентрации в пределах от 1 нМ до 50 нМ, а предпочтительно, он может содержаться в концентрации в пределах от 5 нМ до 50 нМ или от 5 нМ до 25 нМ, но такая концентрация не ограничивается указанными пределами.
[0061] Фермент или группа ферментов, обладающих ДНК-гиразной активностью, конкретно не ограничиваются биологическим происхождением, при условии, что они обладают активностью, аналогичной активности ДНК-гиразы E. coli. Так, например, предпочтительно, использовать комплекс GyrA и GyrB, происходящих от Escherichia coli. Такой комплекс GyrA и GyrB, происходящих от Escherichia coli, может содержаться в виде гетеротетрамера в реакционном растворе в концентрации в пределах от 20 нМ до 500 нМ, а предпочтительно, он может содержаться в концентрации в пределах от 20 нМ до 400 нМ, от 20 нМ до 300 нМ, от 20 нМ до 200 нМ, от 50 нМ до 200 нМ или от 100 нМ до 200 нМ, но такая концентрация не ограничивается указанными пределами.
[0062] Белок, связывающийся с одноцепочечной ДНК (SSB), конкретно не ограничивается биологическим происхождением, при условии, что он обладает активностью, аналогичной активности белка, связывающегося с одноцепочечной ДНК E. coli. Так, например, предпочтительно, использовать SSB, происходящий от Escherichia coli. Такой SSB, происходящий от Escherichia coli, может содержаться в виде гомотетрамера в реакционном растворе в концентрации в пределах от 20 нМ до 1000 нМ, а предпочтительно, он может содержаться в концентрации в пределах от 20 нМ до 500 нМ, от 20 нМ до 300 нМ, от 20 нМ до 200 нМ, от 50 нМ до 500 нМ, от 50 нМ до 400 нМ, от 50 нМ до 300 нМ, от 50 нМ до 200 нМ, от 50 нМ до 150 нМ, от 100 нМ до 500 нМ или от 100 нМ до 400 нМ, но такая концентрация не ограничивается указанными пределами.
[0063] Фермент, обладающий геликазной активностью DnaB-типа, конкретно не ограничивается биологическим происхождением, при условии, что он обладает активностью, аналогичной активности DnaB E. coli. Так, например, предпочтительно, использовать DnaB, происходящий от Escherichia coli. Такой DnaB, происходящий от Escherichia coli, может содержаться в виде гомогексамера в реакционном растворе в концентрации в пределах от 5 нМ до 200 нМ, а предпочтительно, он может содержаться в концентрации в пределах от 5 нМ до 100 нМ, от 5 нМ до 50 нМ или от 5 нМ до 30 нМ, но такая концентрация не ограничивается указанными пределами.
[0064] Фермент, обладающий ДНК-геликазной загрузочной активностью, конкретно не ограничивается биологическим происхождением, при условии, что он обладает активностью, аналогичной активности DnaС E. coli. Так, например, предпочтительно, использовать DnaС, происходящий от Escherichia coli. Такой DnaС, происходящий от Escherichia coli, может содержаться в виде гомогексамера в реакционном растворе в концентрации в пределах от 5 нМ до 200 нМ, а предпочтительно, он может содержаться в концентрации в пределах от 5 нМ до 100 нМ, от 5 нМ до 50 нМ или от 5 нМ до 30 нМ, но такая концентрация не ограничивается указанными пределами.
[0065] Фермент, обладающий ДНК-примазной активностью, конкретно не ограничивается биологическим происхождением, при условии, что он обладает активностью, аналогичной активности DnaG E. coli. Так, например, предпочтительно, использовать DnaG, происходящий от Escherichia coli. Такой DnaG, происходящий от Escherichia coli, может содержаться в виде мономера в реакционном растворе в концентрации в пределах от 20 нМ до 1000 нМ, а предпочтительно, он может содержаться в концентрации в пределах от 20 нМ до 800 нМ, от 50 нМ до 800 нМ, от 100 нМ до 800 нМ, от 200 нМ до 800 нМ, от 250 нМ до 800 нМ, от 250 нМ до 500 нМ или от 300 нМ до 500 нМ, но такая концентрация не ограничивается указанными пределами.
[0066] Фермент, обладающий ДНК-захватывающей активностью, конкретно не ограничивается биологическим происхождением, при условии, что он обладает активностью, аналогичной активности DnaN E. coli. Так, например, предпочтительно, использовать DnaN, происходящий от Escherichia coli. Такой DnaN, происходящий от Escherichia coli, может содержаться в виде гомодимера в реакционном растворе в концентрации в пределах от 10 нМ до 1000 нМ, а предпочтительно, он может содержаться в концентрации в пределах от 10 нМ до 800 нМ, от10 нМ до 500 нМ, от 20 нМ до 500 нМ, от 20 нМ до 200 нМ, от 30 нМ до 200 нМ или от 30 нМ до 100 нМ, но такая концентрация не ограничивается указанными пределами.
[0067] Фермент или группа ферментов, обладающих активностью ДНК-полимеразы III*, конкретно не ограничиваются биологическим происхождением, при условии, что они обладают активностью, аналогичной активности комплекса ДНК-полимеразы III* E. coli. Так, например, предпочтительно, использовать группу ферментов, содержащих любые из DnaX, HolA, HolB, HolC, HolD, DnaE, DnaQ и HolE, происходящих от Escherichia coli; предпочтительно, группу ферментов, содержащих комплекс DnaX, HolA, HolB и DnaE, происходящих от Escherichia coli; а более предпочтительно, фермент, содержащий комплекс DnaX, HolA, HolB, HolC, HolD, DnaE, DnaQ и HolE, происходящих от Escherichia coli. Такой комплекс ДНК-полимеразы III*, происходящий от Escherichia coli, может содержаться в виде гетеромультимера в реакционном растворе в концентрации в пределах от 2 нМ до 50 нМ, а предпочтительно, он может содержаться в концентрации в пределах от 2 нМ до 40 нМ, от 2 нМ до 30 нМ, от 2 нМ до 20 нМ, от 5 нМ до 40 нМ, от 5 нМ до 30 нМ или от 5 нМ до 20 нМ, но такая концентрация не ограничивается указанными пределами.
[0068] 2. Вторая группа ферментов
В настоящем описании, вторая группа ферментов означает группу ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана.
[0069] В настоящем изобретении, две сестринских кольцевых ДНК, состоящих из катенана, представляют собой две кольцевых ДНК, синтезированных посредством репликации ДНК с их последующим присоединением.
[0070] Примерами второй группы ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана, могут быть, например, один или более ферментов, выбранных из группы, состоящей из фермента, обладающего активностью ДНК-полимеразы I; фермента, обладающего ДНК-лигазной активностью; фермента, обладающего активностью РНКазы Н или комбинации этих ферментов.
[0071] Фермент, обладающий активностью ДНК-полимеразы I, конкретно не ограничивается биологическим происхождением, при условии, что он обладает активностью, аналогичной активности ДНК-полимеразы I E. coli. Так, например, предпочтительно, использовать ДНК-полимеразу I, происходящую от Escherichia coli. Такая ДНК-полимераза I, происходящая от Escherichia coli, может содержаться в виде мономера в реакционном растворе в концентрации в пределах от 10 нМ до 200 нМ, а предпочтительно, она может содержаться в концентрации в пределах от 20 нМ до 200 нМ, от 20 нМ до 150 нМ, от 20 нМ до 100 нМ, от 40 нМ до 150 нМ, от 40 нМ до 100 нМ или от 40 нМ до 80 нМ, но такая концентрация не ограничивается указанными пределами.
[0072] Фермент, обладающий ДНК-лигазной активностью, конкретно не ограничивается биологическим происхождением, при условии, что он обладает активностью, аналогичной активности ДНК-лигазы E. coli. Так, например, предпочтительно, использовать ДНК-лигазу, происходящую от Escherichia coli или ДНК-лигазу фага Т4. Такая ДНК-лигаза, происходящая от Escherichia coli, может содержаться в виде мономера в реакционном растворе в концентрации в пределах от 10 нМ до 200 нМ, а предпочтительно, она может содержаться в концентрации в пределах от 15 нМ до 200 нМ, от 20 нМ до 200 нМ, от 20 нМ до 150 нМ, от 20 нМ до 100 нМ или от 20 нМ до 80 нМ, но такая концентрация не ограничивается указанными пределами.
[0073] Фермент, обладающий активностью РНКазы Н, конкретно не ограничивается биологическим происхождением, при условии, что он обладает активностью в разложении цепи РНК гибрида РНК-ДНК. Так, например, предпочтительно, использовать РНКазу Н, происходящую от Escherichia coli. Такая РНКаза Н, происходящая от Escherichia coli, может содержаться в виде мономера в реакционном растворе в концентрации в пределах от 0,2 нМ до 200 нМ, а предпочтительно, она может содержаться в концентрации в пределах от 0,2 нМ до 200 нМ, от 0,2 нМ до 100 нМ, от 0,2 нМ до 50 нМ, от 1 нМ до 200 нМ, от 1 нМ до 100 нМ, от 1 нМ до 50 нМ или от 10 нМ до 50 нМ, но такая концентрация не ограничивается указанными пределами.
[0074] 3. Третья группа ферментов
В настоящем описании, третья группа ферментов означает группу ферментов, которые катализируют разделение двух сестринских кольцевых ДНК.
[0075] Примером третьей группы ферментов, которые катализируют разделение двух сестринских кольцевых ДНК, является группа ферментов, представленная, например, как группа ферментов, описанная Peng H & Marians KJ. PNAS. 1993, 90: 8571-8575. В частности, примерами третьей группы ферментов являются один или более ферментов, выбранных из группы, состоящей из фермента, обладающего активностью топоизомеразы IV; фермента, обладающего активностью топоизомеразы III; и фермента, обладающего геликазной активностью RecQ-типа или комбинации вышеупомянутых ферментов.
[0076] Фермент, обладающий активностью топоизомеразы III, конкретно не ограничивается биологическим происхождением, при условии, что он обладает активностью, аналогичной активности топоизомеразы III Escherichia coli. Так, например, предпочтительно, использовать топоизомеразу III, происходящую от Escherichia coli. Такая топоизомераза III, происходящая от Escherichia coli, может содержаться в виде мономера в реакционном растворе в концентрации в пределах от 20 нМ до 500 нМ, а предпочтительно, она может содержаться в концентрации в пределах от 20 нМ до 400 нМ, от 20 нМ до 300 нМ, от 20 нМ до 200 нМ, от 20 нМ до 100 нМ или от 30 нМ до 80 нМ, но такая концентрация не ограничивается указанными пределами.
[0077] Фермент, обладающий геликазной активностью RecQ-типа, конкретно не ограничивается биологическим происхождением, при условии, что он обладает активностью, аналогичной активности RecQ Escherichia coli. Так, например, предпочтительно, использовать RecQ, происходящий от Escherichia coli. Такой RecQ, происходящий от Escherichia coli, может содержаться в виде мономера в реакционном растворе в концентрации в пределах от 20 нМ до 500 нМ, а предпочтительно, он может содержаться в концентрации в пределах от 20 нМ до 400 нМ, от 20 нМ до 300 нМ, от 20 нМ до 200 нМ, от 20 нМ до 100 нМ или от 30 нМ до 80 нМ, но такая концентрация не ограничивается указанными пределами.
[0078] Фермент, обладающий активностью топоизомеразы IV, конкретно не ограничивается биологическим происхождением, при условии, что он обладает активностью, аналогичной активности топоизомеразы IV E. coli. Так, например, предпочтительно, использовать топоизомеразу IV, происходящую от Escherichia coli, то есть, комплекс ParC и ParE. Такая топоизомераза IV, происходящая от Escherichia coli, может содержаться в виде гетеротетрамера в реакционном растворе в концентрации в пределах от от 0,1 нМ до 50 нM, а предпочтительно, она может содержаться в концентрации в пределах от 0,1 нМ до 40 нМ, от 0,1 нМ до 30 нМ, от 0,1 нМ до 20 нМ, от 1 нМ до 40 нМ, от 1 нМ до 30 нМ, от 1 нМ до 20 нМ, от 1 нМ до 10 нМ или от 1 нМ до 5 нМ, но такая концентрация не ограничивается указанными пределами.
[0079] Первая, вторая и третья группы ферментов, описанных выше, могут представлять собой группу ферментов, которые являются коммерчески доступными или могут быть экстрагированы из микроорганизмов и очищены, если это необходимо. Экстракция и очистка ферментов из микроорганизмов могут быть осуществлены, если это необходимо, с применением методов, известных специалистам.
[0080] Если в качестве первой, второй и третей групп ферментов используются ферменты, не являющиеся вышеописанными ферментами, происходящими от Escherichia coli, то каждый из этих ферментов может использоваться как единица активности фермента в концентрации в пределах, соответствующих концентрации, определенной для вышеописанного фермента, происходящего от Escherichia coli.
[0081] Реакционный раствор, содержащий бесклеточные системы экспрессии вышеупомянутых ферментов, может быть смешан с кольцевой ДНК, содержащей матрицу, с образованием реакционной смеси для амплификации кольцевой ДНК. Бесклеточная система экспрессии белка может представлять собой бесклеточную систему трансляции, которая включает общую РНК, содержащую РНК, состоящую из последовательности, которая комплементарна последовательности оснований генов, кодирующих вышеуказанные ферменты, мРНК или продукт трансляции in vitro в виде матричной РНК, либо она может представлять собой бесклеточную систему транскрипции/трансляции, которая содержит гены, кодирующие различные ферменты, или экспрессионные векторы, включающие гены, которые кодируют различные ферменты в виде матричной ДНК.
[0082] <Способ амплификации кольцевой ДНК>
Настоящее изобретение относится к способу амплификации кольцевой ДНК, включающий следующую стадию:
(1) образования реакционной смеси кольцевой ДНК в качестве матрицы с реакционным раствором, содержащим:
первую группу ферментов, которые катализируют репликацию кольцевой ДНК;
вторую группу ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана;
третью группу ферментов, которые катализируют разделение двух сестринских кольцевых ДНК;
буфер;
ATP;
GTP, CTP и UTP;
dNTP;
источник иона магния; и
источник иона щелочного металла,
где кольцевая ДНК включает последовательность ориджина репликации (ориджина хромосомы (oriC)), которая может связываться с ферментом, обладающим DnaA-активностью.
[0083] В другом варианте осуществления изобретения, способ согласно изобретению может также включать стадию предварительного инкубирования реакционного раствора перед проведением вышеописанной стадии (1). То есть, можно сказать, что способ согласно изобретению может представлять собой способ амплификации кольцевой ДНК, включающий следующие стадии:
(1-1) предварительного инкубирования реакционного раствора, содержащего:
первую группу ферментов, которые катализируют репликацию кольцевой ДНК;
вторую группу ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана;
третью группу ферментов, которые катализируют разделение двух сестринских кольцевых ДНК;
буфер;
ATP;
GTP, CTP и UTP;
dNTP;
источник иона магния; и
источник иона щелочного металла; и
(1-2) образования реакционной смеси реакционного раствора с кольцевой ДНК в качестве матрицы,
где кольцевая ДНК включает последовательность ориджина репликации (ориджина хромосомы (oriC)), которая может связываться с ферментом, обладающим DnaA-активностью. Предварительное инкубирование может быть осуществлено при поддержании температуры реакционного раствора, например, в пределах от 0 до 40°C, от 10 до 40°C, от 15 до 37°C или от 16 до 30°C, в течение периода времени от 5 до 60 минут, от 5 до 45 минут, от 5 до 30 минут, от 15 до 60 минут, от 15 до 45 минут или от 15 до 30 минут. При предварительном инкубировании, температура реакционного раствора может несколько варьироваться, если ее поддерживают в вышеуказанных пределах.
[0084] Не ограничиваясь какой-либо конкретной теорией, авторы настоящего изобретения лишь отмечают, что репликативный цикл повторяют как показано на фигуре 1, так, чтобы это могло приводить к экспоненциальной амплификации кольцевой ДНК. В настоящем изобретении, в качестве матрицы используется вышеупомянутая кольцевая ДНК, и эта ДНК может быть амплифицирована по меньшей мере в 10 раз, 50 раз, 100 раз, 200 раз, 500 раз, 1000 раз, 2000 раз, 3000 раз, 4000 раз, 5000 раз или в 10000 раз.
[0085] Кольцевая ДНК, смешиваемая с реакционным раствором, описана выше в разделе «Кольцевая ДНК». Количество матричной ДНК, используемой в одной реакции, не имеет конкретных ограничений. Так, например, при инициации реакции, кольцевая ДНК может присутствовать в реакционном растворе в концентрации 10 нг/мкл или менее, 5 нг/мкл или менее, 1 нг/мкл или менее, 0,8 нг/мкл или менее, 0,5 нг/мкл или менее или 0,3 нг/мкл или менее. Кроме того, при инициации реакции, одна молекула кольцевой ДНК в одной реакции может присутствовать в качестве матрицы, а поэтому она может быть использована для амплификации.
[0086] Буфер, содержащийся в реакционном растворе, не имеет конкретных ограничений, при условии, что он используется при pH в пределах от pH 7 до 9, а предпочтительно, при pH 8. Примерами буфера могут быть Трис-HCl, Трис-OAc, Hepes-KOH, фосфатный буфер, MOPS-NaOH и трицин-HCl. Предпочтительным буфером является Трис-HCl или Трис-OAc. Концентрация буфера может быть выбрана самим специалистом в данной области, и таким образом, не имеет конкретных ограничений. В случае Трис-HCl или Трис-OAc, выбранная концентрация может составлять, например, от 10 мМ до 100 мМ, от 10 мМ до 50 мМ или 20 мМ.
[0087] ATP означает аденозин-трифосфат. При инициации реакции, концентрация ATP, содержащегося в реакционном растворе, может составлять, например, в пределах от 0,1 мМ до 3 мМ, а предпочтительно, в пределах от 0,1 мМ до 2 мМ, от 0,1 мМ до 1,5 мМ или от 0,5 мМ до 1,5 мМ.
[0088] GTP, CTP и UTP означают гуанозин-трифосфат, цитидин-трифосфат и уридин-трифосфат, соответственно. При инициации реакции, концентрации GTP, CTP и UTP, содержащихся в реакционном растворе, могут независимо составлять, например в пределах от 0,1 мМ до 3,0 мМ, а предпочтительно, в пределах от 0,5 мМ до 3,0 мМ или от 0,5 мМ до 2,0 мМ.
[0089] dNTP представляет собой общий термин, означающий дезоксиаденозин-трифосфат (dATP), дезоксигуанозин-трифосфат (dGTP), дезоксицитидин-трифосфат (dCTP) и дезокситимидин-трифосфат (dTTP). При инициации реакции, концентрация dNTP, содержащегося в реакционном растворе, может составлять, например в пределах от 0,01 до 1 мМ, а предпочтительно, в пределах от 0,05 мМ до 1 мМ или от 0,1 мМ до 1 мМ.
[0090] Источник иона магния представляет собой вещество, которое вводит ионы магния (Mg2+) в реакционный раствор. Примерами источника иона магния могут быть Mg(OAc)2, MgCl2 и MgSO4. Предпочтительным источником иона магния является Mg(OAc)2. При инициации реакции, концентрация источника иона магния, содержащегося в реакционном растворе, может представлять собой, например, концентрацию, необходимую для введения 5-50 мМ ионов магния в реакционный раствор.
[0091] Источник иона щелочного металла представляет собой вещество, которое вводит ионы щелочного металла в реакционный раствор. Примерами иона щелочного металла могут быть ионы натрия (Na+) и ионы калия (K+). Примерами источника иона щелочного металла могут быть глутамат калия, аспартат калия, хлорид калия, ацетат калия, глутамат натрия, аспартат натрия, хлорид натрия и ацетат натрия. Предпочтительным источником иона щелочного металла являются глутамат калия или ацетат калия. При инициации реакции, концентрация источника иона щелочного металла, содержащегося в реакционном растворе, может представлять собой концентрацию, необходимую для введения ионов щелочного металла в реакционный раствор в пределах 100 мМ или более, а предпочтительно, от 100 мМ до 300 мМ, но эта концентрация не ограничивается указанными значениями. Как описано ранее, для достижения нужного баланса, концентрация 150 мМ может быть вычтена из концентрации вышеописанного источника иона щелочного металла.
[0092] Реакционный раствор, используемый в способе согласно изобретению, может также включать неспецифический ингибитор адсорбции белка или неспецифический ингибитор адсорбции нуклеиновой кислоты. Предпочтительно, реакционный раствор может также включать неспецифический ингибитор адсорбции белка и неспецифический ингибитор адсорбции нуклеиновой кислоты. Эффективность реакции повышается благодаря присутствию в реакционном растворе такого неспецифического ингибитора адсорбции белка и/или неспецифического ингибитора адсорбции нуклеиновой кислоты. Считается, что неспецифический ингибитор адсорбции белка и/или неспецифический ингибитор адсорбции нуклеиновой кислоты подавляют неспецифическую адсорбцию между белками и/или между белком и кольцевой ДНК или адгезию белка и кольцевой ДНК на поверхности сосуда, что может повышать эффективность реакции.
[0093] Неспецифический ингибитор адсорбции белка представляет собой белок, который является не подходящим для реакции амплификации в способе согласно изобретению. Примерами такого белка могут быть альбумин бычьей сыворотки (BSA), лизозим, желатин, гепарин и казеин. Неспецифический ингибитор адсорбции белка может содержаться в реакционном растворе в концентрации в пределах от 0,02 до 2,0 мг/мл, а предпочтительно, от 0,1 до 2,0 мг/мл, от 0,2 до 2,0 мг/мл или от 0,5 до 2,0 мг/мл, но такая концентрация не ограничивается вышеуказанными пределами.
[0094] Неспецифический ингибитор адсорбции нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты или фактор, подобный нуклеиновой кислоте, которые являются не подходящими для реакции амплификации в способе согласно изобретению. Примерами такой молекулы нуклеиновой кислоты или фактора, подобного нуклеиновой кислоте, могут быть тРНК (транспортная РНК), рРНК (рибосомная РНК), мРНК (матричная РНК), гликоген, гепарин, олиго-ДНК, поли(I-C) (полиинозин-полицитидин), поли(dI-dC) (полидезоксиинозин-полидезоксицитидин), поли(A) (полиаденин) и поли(dA) (полидезоксиаденин). Неспецифический ингибитор адсорбции нуклеиновой кислоты может содержаться в реакционном растворе в концентрации в пределах от 1 до 500 нг/мкл, а предпочтительно, от 10 до 500 нг/мкл, от 10 до 200 нг/мкл или от 10 до 100 нг/мкл, но такая концентрация не ограничивается вышеуказанными пределами. Как было описано ранее, если тРНК была выбрана в качестве неспецифического ингибитора адсорбции нуклеиновой кислоты, то для достижения нужного баланса, концентрация 50 нг/мкл может быть вычтена из концентрации тРНК.
[0095] Реакционный раствор, используемый в способе согласно изобретению, может также содержать ДНК-стабилизирующий фактор. Считается, что благодаря присутствию такого ДНК-стабилизирующего фактора в реакционном растворе, расщепление ДНК может ингибироваться, а матричная ДНК и продукт амплификации могут быть защищены. Добавление ДНК-стабилизирующего фактора приводит к повышению выхода представляющего интерес продукта. В частности, если матричной ДНК является длинноцепочечная кольцевая ДНК, то добавление ДНК-стабилизирующего фактора является предпочтительным, поскольку матричная ДНК и продукт амплификации легко разлагаются. ДНК-стабилизирующий фактор не имеет конкретных ограничений. ДНК-стабилизирующий фактор может быть выбран из группы, состоящей из глюкозы, сахарозы, диметилсульфоксида (ДМСО), альбумина бычьей сыворотки (BSA), этиленгликоль-тетрауксусной кислоты (EGTA), динатриевой соли батокупроиндисульфоновой кислоты (BDA), пеницилламина, Тирона (1,2-дигидроксибензол-3,5-сульфоната), диэтилентриаминпентауксусной кислоты (DTPA), этилентриаминпентауксусной кислоты (EDTA), белка Dps (происходящего от Escherichia coli), и белка металлотионеина (человеческого). Из этих факторов, DTPA, Тирон, BDA, белок Dps и BSA являются особенно предпочтительными, поскольку они стимулируют реакцию амплификации кольцевой ДНК. DTPA или Тирон могут содержаться в реакционном растворе в концентрации в пределах от 0,01 мМ до 0,3 мМ, а предпочтительно, в пределах от 0,05 до 0,15 мМ, но такая концентрация не ограничивается вышеуказанными пределами. BDA может содержаться в реакционном растворе в концентрации в пределах от 0,01 до 0,5 мМ, а предпочтительно, в пределах от 0,05 до 0,3 мМ, но такая концентрация не ограничивается вышеуказанными пределами. Белок Dps может содержаться в реакционном растворе в концентрации в пределах от 0,3 до 3,0 мкM, а предпочтительно, в пределах от 0,3 до 1,5 мкM, но такая концентрация не ограничивается вышеуказанными пределами. BSA может содержаться в реакционном растворе в концентрации в пределах от 0,02 до 2,0 мг/мл, а предпочтительно, в пределах от 0,1 до 2,0 мг/мл, от 0,2 до 2,0 мг/мл или от 0,5 до 2,0 мг/мл, но такая концентрация не ограничивается вышеуказанными пределами.
[0096] Реакционный раствор, используемый в способе согласно изобретению, может также содержать экзонуклеазу, специфичную к линейной ДНК, или геликазу RecG-типа. Предпочтительно, реакционный раствор может также содержать экзонуклеазу, специфичную к линейной ДНК, или геликазу RecG-типа. Благодаря присутствию в реакционном растворе экзонуклеазы, специфичной к линейной ДНК, или геликазы RecG-типа, эти ферменты снижают количество линейной ДНК, образующейся в результате расщепления дуплекса или т.п. в процессе реакции амплификации, что приводит к увеличению выхода представляющего интерес суперспирализованного продукта.
[0097] Реакционный раствор, используемый в способе согласно изобретению, может также содержать геликазу RecG-типа или экзонуклеазу, специфичную к одноцепочечной ДНК. Предпочтительно, реакционный раствор может также содержать геликазу RecG-типа и экзонуклеазу, специфичную к одноцепочечной ДНК. Благодаря присутствию в реакционном растворе геликазы RecG-типа и/или экзонуклеазы, специфичной к одноцепочечной ДНК, эти ферменты снижают количество низмолекулярного продукта амплификации, образующегося как побочный продукт в процессе реакции амплификации, что приводит к увеличению выхода представляющего интерес суперспирализованного продукта.
[0098] Реакционный раствор, используемый в способе согласно изобретению, может также содержать экзонуклеазу, специфичную к линейной ДНК, или экзонуклеазу, специфичную к одноцепочечной ДНК. Предпочтительно, реакционный раствор может также содержать экзонуклеазу, специфичную к линейной ДНК, и экзонуклеазу, специфичную к одноцепочечной ДНК. Благодаря присутствию в реакционном растворе экзонуклеазы, специфичной к линейной ДНК, и/или экзонуклеазы, специфичной к одноцепочечной ДНК, эти ферменты снижают количество линейной ДНК, образующейся в результате расщепления дуплекса или т.п. в процессе реакции амплификации, что приводит к увеличению выхода представляющего интерес суперспирализованного продукта.
[0099] Экзонуклеазой, специфичной к линейной ДНК, является фермент, который успешно гидролизует линейную ДНК у 5'-конца или 3'-конца. Экзонуклеаза, специфичная к линейной ДНК, конкретно не ограничивается типом или биологическим происхождением, при условии, что она обладает активностью, способствующей успешному гидролизу линейной ДНК у 5'-конца или 3'-конца. Так, например, могут быть использованы RecBCD, экзонуклеаза λ, экзонуклеаза III, экзонуклеаза VIII, экзонуклеаза T5, экзонуклеаза T7 и ATP-зависимая ДНКаза Plasmid-Safe™ (Epicentre). Предпочтительной экзонуклеазой, специфичной к линейной ДНК, является RecBCD. Экзонуклеаза, специфичная к линейной ДНК, может содержаться в реакционном растворе в концентрации в пределах от 0,001 до 1,0 ед/мкл, а предпочтительно, в пределах от 0,005 до 1,0 ед/мкл, от 0,01 до 1,0 ед/мкл, от 0,05 до 1,0 ед/мкл или от 0,1 до 1,0 ед/мкл, но такая концентрация не ограничивается вышеуказанными пределами. Единицей ферментативной активности (ед.) экзонуклеазы, специфичной к линейной ДНК, является единица величины, достигаемой в том случае, когда количество фермента, необходимое для превращения 1 нмоль дезоксирибонеклеотида линейной ДНК в растворимую в кислоте ДНК в процессе реакции при 37°C в течение 30 минут было принято за 1 единицу.
[0100] Геликаза RecG-типа представляет собой фермент, который рассматривается как геликаза, разрушающая структуру ДНК, образующуюся как побочный продукт в результате взаимодействия между репликативными вилками по оконачании реакции элонгации. Геликаза RecG-типа конкретно не ограничивается биологическим происхождением, при условии, что она обладает такой же активностью, как и RecG, происходящая от Escherichia coli. Так, например, предпочтительно использовать RecG, происходящую от Escherichia coli. RecG, происходящая от Escherichia coli, может содержаться в реакционном растворе в концентрации в пределах от 100 нМ до 800 нМ, а предпочтительно, в пределах от 100 нМ до 500 нМ, от 100 нМ до 400 нМ или от 100 нМ до 300 нМ, но такая концентрация не ограничивается вышеуказанными пределами. Геликаза RecG-типа, как единица ферментативной активности, может быть использована в концентрации в пределах, соответствующих пределам для вышеописанной RecG, происходящей от Escherichia coli.
[0101] Экзонуклеазой, специфичной к одноцепочечной ДНК, является фермент, который успешно гидролизует нуклеотиды у 5'-конца или 3'-конца одноцепочечной ДНК. Экзонуклеаза, специфичная к одноцепочечной ДНК, конкретно не ограничивается типом или биологическим происхождением, при условии, что она обладает активностью, способствующей успешному гидролизу нуклеотидов у 5'-конца или 3'-конца одноцепочечной ДНК. Так, например, могут быть использованы экзонуклеаза 1 (exo I), RecJ и экзонуклеаза Т. Предпочтительной экзонуклеазой, специфичной к одноцепочечной ДНК, является exo I. Экзонуклеаза, специфичная к одноцепочечной ДНК, может содержаться в реакционном растворе в концентрации в пределах от 0,1 до 1,0 ед/мкл, а предпочтительно, в пределах от 0,15 до 1,0 ед/мкл, от 0,2 до 1,0 ед/мкл или от 0,2 до 0,5 ед/мкл, но такая концентрация не ограничивается вышеуказанными пределами. Единицей ферментативной активности (ед.) exo I является единица величины, достигаемой в случае, когда количество фермента, необходимое для превращения 10 нмоль дезоксирибонеклеотида одноцепочечной ДНК в растворимую в кислоте ДНК в процессе реакции при 37°C в течение 30 минут, было принято за 1 единицу. Единицей ферментативной активности (ед.) RecJ является единица величины, достигаемой в случае, когда количество фермента, необходимое для превращения 0,05 нмоль дезоксирибонеклеотида одноцепочечной ДНК в растворимую в кислоте ДНК в процессе реакции при 37°C в течение 30 минут, было принято за 1 единицу.
[0102] Реакционный раствор, используемый в способе согласно изобретению, может также содержать соль аммония. Примерами соли аммония могут быть сульфат аммония, хлорид аммония и ацетат аммония. Особенно предпочтительной солью аммония является сульфат аммония или ацетат аммония. Соль аммония может содержаться в реакционном растворе в концентрации в пределах от 0,1 мМ до 100 мМ, а предпочтительно, в пределах от 0,1 мМ до 50 мМ, от 1 мМ до 50 мМ или от 1 мМ до 20 мМ, но такая концентрация не ограничивается вышеуказанными пределами.
[0103] Если ДНК-лигаза, происходящая от Escherichia coli, которая представляет собой фермент, обладающий ДНК-лигазной активностью, используется в качестве фермента, принадлежащего ко второй группе ферментов, то в реакционном растворе содержится его кофактор NAD (никотинамид-аденин-динуклеотид). NAD может содержаться в реакционном растворе в концентрации в пределах от 0,01 мМ до 1,0 мМ, а предпочтительно, в пределах от 0,1 мМ до 1,0 мМ или от 0,1 мМ до 0,5 мМ, но такая концентрация не ограничивается вышеуказанными пределами.
[0104] Реакционный раствор, используемый в способе согласно изобретению, может также содержать восстановитель. Предпочтительными примерами восстановителя могут быть DTT, β-меркаптоэтанол (2-меркаптоэтанол), трис(2-карбоксиэтил)фосфин (TCEP) и глутатион. Предпочтительным восстановителем является DTT. Восстановитель может содержаться в реакционном растворе в концентрации в пределах от 1,0 мМ до 15,0 мМ, а предпочтительно, в пределах от 2,0 мМ до 10,0 мМ или от 4,0 мМ до 8,0 мМ.
[0105] Реакционный раствор, используемый в способе согласно изобретению, может также содержать фермент и субстрат, которые используются для регенерации ATP. Примерами комбинации фермента и субстрата в ATP-регенерирующей системе могут быть креатин-киназа и фосфат креатина, и пируват-киназа и фосфоенолпируват. Ферментом в ATP-регенерирующей системе является, например, миокиназа. Предпочтительной комбинацией фермента и субстрата в ATP-регенерирующей системе являются креатин-киназа и фосфат креатина.
[0106] Первая, вторая и третья группы ферментов, содержащихся в реакционном растворе, описаны выше в разделе «Первая, вторая и третья группы ферментов».
[0107] В некоторых вариантах осуществления изобретения, первая группа ферментов, используемых в способе согласно изобретению, может включать комбинацию фермента, обладающего DnaA-активностью; одного или более нуклеоидных белков; фермента или группы ферментов, обладающих ДНК-гиразной активностью; белка, связывающегося с одноцепочечной ДНК (SSB); фермента, обладающего геликазной активностью DnaB-типа; фермента, обладающего ДНК-геликазной загрузочной активностью; фермента, обладающего ДНК-примазной активностью; фермента, обладающего ДНК-захватывающей активностью; и фермента или группы ферментов, обладающих активностью ДНК-полимеразы III*. В данном случае, один или более нуклеоидных белков могут представлять собой IHF или HU; фермент или группа ферментов, обладающих ДНК-гиразной активностью, могут представлять собой комплекс GyrA и GyrB; фермент, обладающий геликазной активностью DnaB-типа, может представлять собой геликазу DnaB; фермент, обладающий ДНК-геликазной загрузочной активностью, может представлять собой геликазный загрузочный фермент DnaC; фермент, обладающий ДНК-примазной активностью, может представлять собой примазу DnaG; фермент, обладающий ДНК-захватывающей активностью, может представлять собой ДНК-захватывающий фермент DnaN, а фермент или группа ферментов, обладающих активностью ДНК-полимеразы III*, могут представлять собой фермент или группу ферментов, содержащих любые из DnaX, HolA, HolB, HolC, HolD, DnaE, DnaQ и HolE.
[0108] В другом варианте осуществления изобретения, вторая группа ферментов, используемых в способе согласно изобретению, может включать комбинацию фермента, обладающего активностью ДНК-полимеразы I, и фермента, обладающего ДНК-лигазной активностью. Альтернативно, вторая группа ферментов может включать комбинацию фермента, обладающего активностью ДНК-полимеразы I, фермента, обладающего ДНК-лигазной активностью, и фермента, обладающего активностью РНКазы Н.
[0109] В другом варианте осуществления изобретения, третья группа ферментов, используемых в способе согласно изобретению, может включать фермент, обладающий активностью топоизомеразы III, и/или фермент, обладающий активностью топоизомеразы IV. Альтернативно, третья группа ферментов может включать комбинацию фермента, обладающего активностью топоизомеразы III, и фермента, обладающего геликазной активностью RecQ-типа. Альтернативно, третья группа ферментов может представлять собой комбинацию фермента, обладающего активностью топоизомеразы III, фермента, обладающего геликазной активностью RecQ-типа, и фермента, обладающего активностью топоизомеразы IV.
[0110] Способ согласно изобретению может также включать, в качестве стадии (2), стадию поддержания температуры вышеописанный реакционной смеси в предварительно заданных пределах. Такие предварительно заданные пределы температур не имеют конкретных ограничений, при условии, что они будут подходящими для прохождения реакции репликации ДНК. Так, например, предварительно заданные пределы температур могут составлять от 20°C до 80°C, от 25°C до 50°C или от 25°C до 40°C, которые являются оптимальными температурами для ДНК-полимеразы. Поддержание температуры в предварительно заданных пределах допускает изменение температуры или ее флуктуацию в процессе реакции в предварительно заданных пределах. В предпочтительном варианте осуществления изобретения, вышеописанная стадия (2) может представлять собой стадию поддержания температуры вышеописанный реакционной смеси в изотермических условиях. Такие изотермические условия не имеют конкретных ограничений, при условии, что они будут подходящими для прохождения реакции репликации ДНК. Так, например, изотермическими условиями могут быть постоянная температура в пределах от 20°C до 80°C, или в пределах от 25°C до 50°C, или в пределах от 25°C до 40°C, или приблизительно 30°C, которые являются оптимальными температурами для ДНК-полимеразы. В настоящем описании, термины «поддержание в изотермических условиях» и «реакция в изотермических условиях» означают что температура во время реакции поддерживается в пределах ±7°C, ±5°C, ±3°C или ±1°C, по сравнению с температурой, необходимой для прохождения такой реакции. Время поддержания температуры может быть определено, если это необходимо, в зависимости от количества продукта амплификации представляющей интерес кольцевой ДНК. Время поддержания температуры может составлять, например, 1-24 часа.
[0111] Альтернативно, способ согласно изобретению может также включать, в качестве стадии (2), стадию инкубирования вышеописанной реакционной смеси в термическом цикле повторения инкубирования при 30°C или выше и инкубирования при 27°C или ниже. Инкубирование при 30°C или выше не имеет конкретных ограничений, при условии, что температура будет составлять в пределах, подходящих для инициации репликации кольцевой ДНК, содержащей oriC. Так, например, температура может составлять от 30 до 80°C, от 30 до 50°C, от 30 до 40°C или 37°C. Инкубирование при 30°C или выше может быть проведено в течение периода времени от 10 секунд до 10 минут на цикл, хотя такое время не имеет конкретных ограничений. Инкубирование при 27°C или ниже не имеет конкретных ограничений, при условии, что такая температура будет подходящей для подавления инициации репликации и для прохождения реакции элонгации ДНК. Так, например, температура может составлять 10-27°C, 16-25°C или 24°C. Инкубирование при 27°C или ниже может быть, предпочтительно, проведено в зависимости от длины амплифицируемой кольцевой ДНК, но такая температура не имеет конкретных ограничений. Так, например, инкубирование может быть осуществлено в течение периода времени от 1 до 10 секунд на 1000 оснований за один цикл. Число термических циклов не имеет конкретных ограничений, но может составлять от 10 до 50 циклов, от 20 до 40 циклов, от 25 до 35 циклов или 30 циклов.
[0112] В некоторых вариантах осуществления изобретения, стадия (2) может быть проведена в эмульсии типа «вода в масле». Эмульсия типа «вода в масле» может быть получена путем смешивания минерального масла и поверхностно-активного вещества с образованием реакционной смеси, полученной в стадии (1). Тип и количество минерального масла и поверхностно-активного вещества могут быть определены, если это необходимо, самим специалистом в данной области.
[0113] Способ согласно изобретению может также включать, после завершения стадии (2), стадию разведения реакционной смеси пять или более раз реакционным раствором, не содержащим ферментов 1-3 групп, а затем повторное нагревание полученного продукта. Инициацию новой репликации ингибируют путем разведения группами ферментов, и в это же самое время, элонгация репликации, образование катенана и реакция разделения, которые происходят одновременно, постоянно продолжаются под действием остаточных ферментов. Кроме того, побочные продукты, которые генерируются одноцепочечными разрывами и т.п. в процессе реакции, могут репарироваться под действием отсаточной лигазы и т.п. в этой реакции. Следовательно, будет происходить специфическое индуцирование транзиции промежуточных продуктов амплификации или побочных продуктов с образованием конечных продуктов, в результате чего можно повысить выход кольцевой ДНК, имеющей представляющую интерес суперспирализованную структуру.
[0114] Способ согласно изобретению может также включать, после завершения стадии (2), стадию обработки реакционной смеси экзонуклеазой, специфичной к линейной ДНК, и/или экзонуклеазой, специфичной к одноцепочечной ДНК. При обработке реакционной смеси экзонуклеазой, специфичной к линейной ДНК, и/или экзонуклеазой, специфичной к одноцепочечной ДНК, линейная ДНК, образующаяся как побочный продукт в процессе реакции амплификации, может разлагаться и удаляться. Тип и используемое количество экзонуклеазы, специфичной к линейной ДНК, и/или экзонуклеазы, специфичной к одноцепочечной ДНК, могут быть такими, как они упоминаются выше. Обработка экзонуклеазой, специфичной к линейной ДНК, и/или экзонуклеазой, специфичной к одноцепочечной ДНК, может быть осуществлена, например, при 25°C-40°C в течение периода времени от 30 минут до 3 часов.
[0115] Способ согласно изобретению может также включать, после завершения стадии (2), стадию обработки реакционной смеси ферментом для репарации гэпов. Ферменты для репарации гэпов представляют собой группу ферментов, которые репарируют гэп, представляющий собой потерю одного или более смежных нуклеотидов в двухцепочечной ДНК, или репарируют одноцепочечный разрыв, который представляет собой расщепление фосфодиэфирной связи между соседними нуклеотидами в двухцепочечной ДНК, с образованием полноразмерной двухцепочечной суперспирализованной ДНК. При обработке реакционной смеси ферментом для репарации гэпов, ДНК, содержащая гэп или одноцепочечный разрыв и образующаяся как побочный продукт в процессе реакции амплификации, репарируется, что может приводить к увеличению выхода представляющего интерес суперспирализованного продукта.
[0116] Фермент для репарации гэпов конкретно не ограничивается типом или биологическим происхождением, при условии, что он входит в группу ферментов, способных репарировать гэп или одноцепочечный разрыв двухцепочечной ДНК. Так, например, может быть использована комбинация экзонуклеазы III, ДНК-полимеразы I, ДНК-лигазы и фермента или группы ферментов, обладающих ДНК-гиразной активностью. Фермент, обладающий активностью экзонуклеазы III, может быть использован в концентрации от 5 до 100 мЕд/мкл, но такая концентрация не ограничивается указанным значением. Единицей ферментативной активности (ед.) экзонуклеазы III является единица величины, достигаемой в том случае, когда количество фермента, необходимое для превращения 1 нмоль дезоксирибонеклеотида двухцепочечной ДНК в растворимую в кислоте ДНК в процессе реакции при 37°C в течение 30 минут, было принято за 1 единицу. Каждый из ферментов, таких как ДНК-полимераза I, ДНК-лигаза и фермент или группа ферментов, обладающих ДНК-гиразной активностью, может быть использован в концентрации, определенной для вышеупомянутой первой или второй группы ферментов, и такая концентрация не ограничивается указанными значениями. Обработка ферментом для репарации гэпов может быть проведена, например, при 25-40°C в течение 5-120 минут, а предпочтительно, в течение 10-60 минут.
[0117] Способ согласно изобретению может также включать, после завершения стадии (2), стадию очистки продукта амплификации кольцевой ДНК в соответствии с целями изобретения. Очистка кольцевой ДНК может быть осуществлена, если это необходимо, методами, известными специалистам.
[0118] Кольцевая ДНК, которая была амплифицирована с применением способа согласно изобретению, может быть использована для последующих целей, таких как трансформация, в форме реакционной смеси после реакции или в очищенной форме реакционной смеси.
[0119] <Композиция и набор для амплификации кольцевой ДНК>
Настоящее изобретение также относится к композиции для амплификации кольцевой ДНК, включающей:
первую группу ферментов, которые катализируют репликацию кольцевой ДНК;
вторую группу ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана;
третью группу ферментов, которые катализируют разделение двух сестринских кольцевых ДНК;
буфер;
ATP;
GTP, CTP и UTP;
dNTP;
источник иона магния; и
источник иона щелочного металла.
[0120] Композиция согласно изобретению может также содержать один или более компонентов, выбранных из неспецифического ингибитора адсорбции белка; неспецифического ингибитора адсорбции нуклеиновой кислоты; экзонуклеазы, специфичной к линейной ДНК; геликазы RecG-типа, экзонуклеазой, специфичной к одноцепочечной ДНК; соли аммония; NAD; восстановителя; ДНК-стабилизирующего фактора; и комбинации фермента и субстрата в ATP-регенерирующей системе.
[0121] Конкретные типы и концентрации компонентов, содержащихся в композиции согласно изобретению, описаны выше в разделах «Кольцевая ДНК», «Первая, вторая и третья группы ферментов» и «Способ амплификации кольцевой ДНК».
[0122] Кроме того, настоящее изобретение также относится к набору для амплификации кольцевой ДНК, включающему комбинацию:
первой группы ферментов, которые катализируют репликацию кольцевой ДНК;
второй группы ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринских кольцевых ДНК, состоящих из катенана;
третьей группы ферментов, которые катализируют разделение двух сестринских кольцевых ДНК;
буфера;
ATP;
GTP, CTP и UTP;
dNTP;
источника иона магния; и
источника иона щелочного металла.
[0123] Набором согласно изобретению может быть набор, содержащий все вышеописанные необходимые компоненты. Альтернативно, если набором согласно изобретению является набор, применяемый в способе согласно изобретению, то он может и не содержать некоторых вышеописанных необходимых компонентов. Если набором согласно изобретению является набор, который не содержит некоторых вышеописанных необходимых компонентов, то специалист может добавить необходимые компоненты в набор для амплификации при осуществлении способа амплификации согласно изобретению.
[0124] Набор согласно изобретению может также содержать дополнительные необходимые компоненты композиции, включая один или более компонентов, выбранных из неспецифического ингибитора адсорбции белка; неспецифического ингибитора адсорбции нуклеиновой кислоты; экзонуклеазы, специфичной к линейной ДНК; геликазы RecG-типа, экзонуклеазы, специфичной к одноцепочечной ДНК; соли аммония; NAD; восстановителя; ДНК-стабилизирующего фактора; и комбинации фермента и субстрата в ATP-регенерирующей системе. Кроме того, для обработки после реакции амплификации, набор согласно изобретению может также содержать дополнительные необходимые компоненты, включая один или более компонентов, выбранных из экзонуклеазы, специфичной к линейной ДНК; экзонуклеазы, специфичной к одноцепочечной ДНК, и фермента для репарации гэпов. Такие дополнительные необходимые компоненты могут быть включены в виде одного набора в наборе согласно изобретению, либо они могут поставляться в виде другого набора, который впоследствии может быть использован вместе с набром согласно изобретению.
[0125] Конкретные компоненты и концентрации каждого необходимого компонента, включенного в набор согласно изобретению, описаны выше в разделах «Кольцевая ДНК», «Первая, вторая и третья группы ферментов» и «Способ амплификации кольцевой ДНК».
[0126] Набор согласно изобретению может включать смесь вышеописанных необходимых компонентов, которая упакована в виде одного продукта. В другом случае, набор согласно изобретению может включать вышеописанные необходимые компоненты, каждый из которых упакован по отдельности, либо набор согласно изобретению может также включать необходимые компоненты нескольких типов, которые объединяют или смешивают, а затем упаковывают.
[0127] Кроме того, набор согласно изобретению может включать руководство, содержащее инструкции по осуществлению способа амплификации кольцевой ДНК согласно изобретению. В этом руководстве, материалы, описанные выше в разделах «Кольцевая ДНК», «Первая, вторая и третья группы ферментов» и «Способ амплификации кольцевой ДНК» могут рассматриваться как инструкции.
Примеры
[0128] Конкретное объяснение настоящего изобретения приводится в Примерах. Следует отметить, что настоящее изобретение не ограничивается вариантами, представленными в нижеследующих Примерах.
[0129] Пример 1: Амплификация кольцевой ДНК
<Ингредиент и метод>
После добавления матричной ДНК к реакционному раствору, состав которого представлен в Таблице 1, и их смешивания на льду, температуру поддержавали при 30°C в течение 1 часа, 2 часов или 3 часов в инкубаторе. Смесь получали так, чтобы общий объем каждой реакционной смеси составлял 10 микролитров. После осуществления реакции при 30°C, продукт реакции подвергали электрофорезу в агарозе (0,5% 1 × TAE, 150 В, 100 минут, 14°C), а затем ДНК детектировали с использованием зеленого SYBR (Takara Bio Inc.).
[0130] [Таблица 1]
[0131] В этой таблице, SSB означает SSB, происходящий от E. coli; IHF означает комплекс IhfA и IhfB, происходящих от E. coli; DnaG означает DnaG, происходящий от E. coli; DnaN означает DnaN, происходящий от E. coli; PolIII* означает комплекс ДНК-полимеразы III*, состоящий из DnaX, HolA, HolB, HolC, HolD, DnaE, DnaQ и HolE; DnaB означает DnaB, происходящий от E. coli; DnaC означает DnaC, происходящий от E. coli; DnaA означает РНКазу H, происходящую от E. coli; лигаза представляет собой ДНК-лигазу, происходящую от E. coli; PolI означает ДНК-полимеразу I, происходящую от E. coli; GyrA означает GyrA происходящую от E. coli; GyrB означает GyrB, происходящую от E. coli; Topo IV означает комплекс ParC и ParE, происходящие от E. coli; Topo III означает топоизомеразу III, происходящую от E. coli; а RecQ означает RecQ, происходящую от E. coli.
[0132] SSB получали путем очистки штамма E. coli, экспрессирующего SSB, в стадиях, включающих преципитацию сульфатом аммония и ионообменную колоночную хроматографию.
[0133] IHF получали путем очистки штамма E. coli, коэкспрессирующего IhfA и IhfB, в стадиях, включающих преципитацию сульфатом аммония и аффинную колоночную хроматографию.
[0134] DnaG путем очистки штамма E. coli, экспрессирующего DnaG, в стадиях, которые включают преципитацию сульфатом аммония, анионообменную колоночную хроматографию и колоночную хроматографию методом гель-фильтрации.
[0135] DnaN путем очистки штамма E. coli, экспрессирующего DnaN, в стадиях, которые включают преципитацию сульфатом аммония и анионообменную колоночную хроматографию.
[0136] PolIII* получали путем очистки штамма E. coli, коэкспрессирующего DnaX, HolA, HolB, HolC, HolD, DnaE, DnaQ и HolE, в стадиях, которые включают преципитацию сульфатом аммония, аффинную колоночную хроматографию и колоночную хроматографию методом гель-фильтрации.
[0137] DnaB и DnaC получали путем очистки штамма E. coli, коэкспрессирующего DnaB и DnaC, в стадиях, которые включают преципитацию сульфатом аммония, аффинную колоночную хроматографию и колоночную хроматографию методом гель-фильтрации.
[0138] DnaA получали путем очистки штамма E. coli, экспрессирующего DnaA, в стадиях, которые включают преципитацию сульфатом аммония, преципитацию путем диализа и колоночную хроматографию методом гель-фильтрации.
[0139] GyrA и GyrB получали путем очистки смеси штамма E. coli, экспрессирующего GyrА, и штамма E. coli, экспрессирующего GyrB, в стадиях, которые включают преципитацию сульфатом аммония, аффинную колоночную хроматографию и колоночную хроматографию методом гель-фильтрации.
[0140] Topo IV получали путем очистки смеси штамма E. coli, экспрессирующего ParC, и штамма E. coli, экспрессирующего ParE, в стадиях, которые включают преципитацию сульфатом аммония, аффинную колоночную хроматографию и колоночную хроматографию методом гель-фильтрации.
[0141] Topo III получали путем очистки штамма E. coli, экспрессирующего Topo III, в стадиях, которые включают преципитацию сульфатом аммония и аффинную колоночную хроматографию.
[0142] RecQ получали путем очистки штамма E. coli, экспрессирующего RecQ, в стадиях, которые включают преципитацию сульфатом аммония, аффинную колоночную хроматографию и колоночную хроматографию методом гель-фильтрации.
[0143] Ферменты РНКаза H, лигаза и PolI были использованы в виде коммерчески доступных ферментов, происходящих от E. coli (Takara Bio Inc.).
[0144] В качестве матричной ДНК использовали кольцевую ДНК размером 9,6 т.п.о. (кольцевую ДНК, имеющую последовательность ориджина репликации oriC с резистентностью к канамицину (Km)), длинноцепочечную кольцевую ДНК размером 80 т.п.о. (кольцевую ДНК, имеющую последовательность ориджина репликации oriC с резистентностью к канамицину (Km)), длинноцепочечную кольцевую ДНК размером 200 т.п.о. (кольцевую ДНК, имеющую последовательность ориджина репликации oriC с резистентностью к канамицину (Km)) или ДНК, циклизованную посредством лигирования in vitro.
[0145] Кольцевую ДНК размером 9,6 т.п.о. и длинноцепочечные кольцевые ДНК размером 80 т.п.о. и 200 т.п.о. получали посредством рекомбинации in vivo в клетках E. coli. В частности, рекомбинацию in vivo осуществляли с использованием E. coli, экспрессирующей группу белков рекомбинации фага λ с получением кольцевой ДНК нужной длины, включающей кластер резистентности к канамицину и область в хромосоме E. coli, содержащую oriC.
[0146] Способ получения кольцевой ДНК посредством лигирования in vitro представлен на фигуре 2. В частности, ПЦР-фрагмент (2,3 т.п.о.), имеющий последовательность ориджина репликации oriC и область резистентности к канамицину (Km), лигировали с ПЦР-фрагментом, имеющим последовательности гена dnaA и гена dnaN (далее называемой фрагментом dnaA-dnaN) (2,6 т.п.о.), посредством реакции методом сборки Гибсона. Два ПЦР-фрагмента лигировали с гомологичными последовательностями из 20 оснований (обозначаемыми H1, H2), присоединенными к обоим концам с образованием кольцевой структуры. Реакцию осуществляли путем смешивания вышеуказанных двух ПЦР-фрагментов со смесью для сборки Гибсона Master Mix (NEB), и эту смесь оставляли при 50°C на 15 минут для реакции. После завершения реакции, 0,1 микролитра реакционного раствора (1 микролитр реакционного раствора с 10-кратным разведением) использовали в качестве матричной ДНК, которую затем непосредственно добавляли к 10 микролитрам системы реакции амплификации (состав показан в таблице 1), и смесь оставляли на 1 час для реакции при 30°C.
[0147] <Результат 1> Пример использования 9,6 т.п.о. кольцевой ДНК (0,08 нг, приблизительно 107 кольцевых молекул) в качестве матрицы
На фигуре 3 показаы результаты детектирования продукта амплификации с использованием зеленого SYBR.
[0148] Продукт амплификации кольцевой ДНК, имеющей суперспирализованную структуру (показано черным прямоугольником), был подтвержден как побочный продукт (промежуточной реакции).
[0149] Этот продукт амплификации кольцевой ДНК был получен путем трансформации штамма E. coli DH5α с использованием раствора после реакции в том виде, в котором он был получен; культивирования штамма в агаре, содержащем канамицин; и подсчета числа колоний, результат которого представлен в Таблице 2. Реакционный раствор, температуру которого поддерживали 0 часов, использовали в качестве контроля.
[0150] [Таблица 2]
(Число колоний)
[0151] Способ согласно изобретению позволяет кольцевую ДНК размером 9,6 т.п.о. амплифицировать 6000 раз.
[0152] <Результат 2> Пример использования длинноцепочечных кольцевых ДНК размером 80 т.п.о. и 200 т.п.о. в качестве матриц
На фигуре 4 показан результат детектирования продукта амплификации с использованием зеленого SYBR.
[0153] Был подтвержден продукт амплификации кольцевой ДНК, имеющий суперспирализованную структуру (показано черным прямоугольником или стрелкой).
[0154] Этот способ согласно изобретению показал, что нужный продукт амплификации может быть получен даже при использовании длинных кольцевых ДНК размером 80 т.п.о. или 200 т.п.о. в качестве матриц.
[0155] <Результат 3> Пример использования ДНК, циклизованной посредством лигирования in vitro в качестве матрицы.
На фигуре 5 показан результат детектирования продукта амплификации с использованием зеленого SYBR.
[0156] Этот способ согласно изобретению показал, что нужный продукт амплификации может быть получен даже при использовании ДНК, циклизованной посредством лигирования in vitro в качестве матрицы.
[0157] Этот продукт амплификации кольцевой ДНК был получен путем трансформации штамма E. coli DH5α с использованием раствора после реакции в том виде, в котором он был получен; культивирования штамма в агаре, содержащем канамицин; и подсчета числа колоний, результат которого представлен в Таблице 3. Образец, который не подвергали амплификации, использовали в качестве контроля.
[0158] [Таблица 3]
[0159] Способ согласно изобретению позволяет ДНК, циклизованную методом сборки Гибсона, амплифицировать 2000 раз.
[0160] Пример 2: Амплификация кольцевой ДНК из нескольких матричных молекул
Кольцевую ДНК размером 9.6 т.п.о., представленную в Примере 1, использовали для осуществления амплификации, как описано в Примере 1.
[0161] (2-1) Анализ на эффективность амплификации
К 10 мкл реакционного раствора для амплификации (Пример 1, Таблица 2) добавляли кольцевую ДНК размером 9.6 т.п.о. так, чтобы раствор содержал 1-1000 кольцевых молекул, после чего раствор поддерживали при 30°C в течение 3 часов для инициации реакции амплификации. Продукт реакции подвергали электрофорезу в 0,5% агарозе и окрашивали SybrGreen (Takara Bio Inc.) для детектирования амплифицированной ДНК (Фигура 6a). Кроме того, общее количество ДНК продукта амплификации вычисляли с использованием набора для детектирования PicoGreen (ThermoFisher) (Фигура 6b: метод PicoGreen). Количество продукта амплификации кольцевой ДНК вычисляли путем прямой трансформации продукта амплификации в E. coli, и подсчета числа колоний, резистентных к канамицину (Фигура 6b: Трансформация). Результат вычисления использовали для определения уровня амплификации по сравнению с количеством исходной ДНК (амплификация), и результат был представлен на графике.
[0162] Вышеуказанный результат показал, что одна молекула кольцевой ДНК, состоящей из матричной ДНК, может быть амплифицирована приблизительно до 1011 молекул лишь за 3 часа проведения изотермической реакции (амплификациия приблизительно в 100 миллиардов раз).
[0163] (2-2) Анализ на время удвоения
К 80 мкл реакционного раствора для амплификации (Пример 1, Таблица 1) добавляли вышеуказанную кольцевую ДНК, и температуру раствора поддреживали при 30°C для инициации реакции амплификации. Кольцевую ДНК добавляли так, чтобы каждый 1 мкл реакционного раствора содержал 105 молекул. Число амплифицированных кольцевых ДНК подсчитывали путем взятия образцов раствора в каждый период времени с последующей трансформацией образца в E. coli и подсчетом колоний, резистентных к канамицину (Фигура 7).
[0164]Вышеуказанный результат подтвердил, что время удвоения кольцевых молекул ДНК размером 9.6 т.п.о. составляло приблизительно 5 минут.
[0165] Пример 3: Амплификация одного клона кольцевой ДНК из смеси
Амплификацию одного клона кольцевой ДНК осуществляли из смеси кольцевой ДНК размером 9,6 т.п.о. и кольцевой ДНК размером 12,0 т.п.о. как показано в Примере 1 (кольцевой ДНК, имеющей последовательность ориджина репликации oriC с резистентностью к канамицину (Km)).
[0166] Кольцевую ДНК размером 12,0 т.п.о. получали путем рекомбинации in vivo в клетках E. coli. В частности, рекомбинацию in vivo осуществляли с использованием E. coli, экспрессирующей группу белков для рекомбинации фага λ с получением кольцевой ДНК нужной длины, включающей oriC и кластер, состоящий из гена резистентности к канамицину и определенной области в хромосоме E. coli.
[0167] К 10 мкл реакционного раствора для амплификации (Пример 1, Таблица 1) добавляли смесь кольцевых ДНК двух вышеуказанных типов так, чтобы реакционный раствор содержал кольцевую ДНК каждого типа в количестве 15 молекул или в разведении до 1,5 молекул, а затем температуру поддерживали при 30°C в течение 6 часов для инициации реакции амплификации. Продукт реакции амплификации ДНК детектировали путем электрофореза продукта в 0,5% агарозе с последующим окрашиванием SybrGreen (Takara Bio Inc.) (Фигура 8).
[0168] В результате, клон только одного из двух типов кольцевых ДНК амплифицировали для каждого образца реакции в реакционном растворе, разведенном до 1,5 молекул кольцевой ДНК. Этот результат показал, что даже, если матричной ДНК является смесь, то можно амплифицировать один клон кольцевой ДНК путем разведения смеси до уровня в 1 молекулу в реакционном растворе.
[0169] Пример 4: Амплификация пассажей
Амплификацию пассажей кольцевой ДНК тестировали с использованием кольцевой ДНК lacZ.
[0170] Кольцевую ДНК lacZ (9,0 т.п.о.) получали путем лигирования фрагмента двухцепочечной ДНК, включающего oriC (1,0 т.п.о.); фрагмента двухцепочечной ДНК, включающего ген резистентности к канамицину (Km) (4,6 т.п.о.); и фрагмента двухцепочечной ДНК, включающего ген lacZ (β-галактозидазы) (3,4 т.п.о.). К 10 мкл реакционного раствора для амплификации (Пример 1, Таблица 1) добавляли кольцевую ДНК lacZ так, чтобы раствор содержал 1000 молекул ДНК, а затем температуру поддерживали при 30°C в течение 3 часов для инициации реакции амплификации. Эта процедура включает один пассаж. Продукт реакции амплификации от ряда предыдущих пассажей разводили в 105 раз, и 1 мкл этого продукта добавляли к новому раствору для реакции амплификации для индуцирования аналогичной реакции амплификации следующего пассажа. Амплификацию пассажей повторяли 10 раз. Продукт реакции амплификации каждого пассажа детектировали путем электрофореза продукта в 0,5% агарозе с последующим окрашиванием SybrGreen (Takara Bio Inc.) (Фигура 9). Часть продукта амплификации трансформировали в E. coli и определяли уровнь амплификации ДНК по числу колоний, резистентных к канамицину, а затем по этому числу вычисляли число генераций повторяющихся экспоненциальных амплификаций, включающих общее число генераций.
[0171] Впоследствии было обнаружено, что реакция амплификации кольцевой ДНК эффективно осуществляется даже после 10 пассажей. Результат, полученный в Примере 2 (Фигура 7), показал, что по мере прохождения реакции амплификации кольцевой ДНК до определенного уровня, скорость амплификации снижается из-за истощения субстрата или фермента. Тем не менее, результат, полученный в этом примере показал, что можно осуществлять полуперманентный повтор экспоненциальной амплификации кольцевой ДНК путем пересева части продукта реакции амплификации в новый реакционный раствор. Другими словами, способом согласно изобретению является способ, позволяющий амплифицировать кольцевую ДНК, аналогично способу амплификации пассажей клеток.
[0172] Пример 5: Вероятность ошибки репликации при амплификации
Поскольку матричная кольцевая ДНК Примера 4 включает гены lacZ, то, колония, которая соответствующим образом экспрессирует гены lacZ (lacZ+), окрашивается в синий цвет, поскольку она может разлагать X-gal, а колония, в которой ген lacZ не обладает нужной функцией из-за мутации, введенной в результате ошибки репликации (lacZ-), остается белой, поскольку она не может разлагать X-gal в случае, когда E. coli, которая была трансформирована вышеописанными кольцевыми генами, культивировали в планшете с X-gal. Другими словами, ошибку репликации в амплифицированной кольцевой ДНК можно выявить по окрашиванию E. coli, которая была трансформирована вышеупомянутыми кольцевыми генами, экспрессирующимися в планшете с X-gal.
[0173] Продукт реакции амплификации образца каждого пассажа непосредственно трансформировали в E. coli и культивировали на планшете с X-gal для оценки вероятности ошибки (lacZ-). Вероятность lacZ- и общее число генераций, полученных в Примере 4, использовали для определения вероятности ошибки в одной из генераций репликативного цикла методом Барнса (Barnes WM Gene. 1992, 112, 29-35). Результат показан ниже в Таблице 4.
[0174] [Таблица 4]
[0175] Вышеуказанный результат показал, что ошибки репликации встречаются приблизительно в одном положении на 100 миллионов оснований (в среднем 1,4×10-8 ошибок на основание). Этот результат приблизительно соответствует результату встречаемости мутации в клетке (в штаммах без системы коррекции ошибочного спаривания), и является приблизительно в 10 тысяч раз более точным, чем результат, полученный для полимеразы Taq.
[0176] Пример 6: Добавление экзонуклеазы и RecG
Были исследованы эффекты, полученные при использовании кольцевой ДНК размером 80 т.п.о., описанной в Примере 1, и эффекты, полученные при добавлении геликазы RecG-типа и экзонуклеазы, специфичной к линейной ДНК, к реакционному раствору для осуществления реакции амплификации.
Кольцевую ДНК размером 80 т.п.о. получали как описано в Примере 1.
RecG использовали как геликазу RecG-типа. RecG получали путем очистки из штамма Escherichia coli, экспрессирующего RecG, в стадии, включающей преципитацию сульфатом аммония и аффинную колоночную хроматографию.
[0177] В качестве экзонуклеазы, специфичной к линейной ДНК, использовали ATP-зависимую ДНКазу Plasmid-Safe™ (Epicentre),которая представляет собой коммерчески доступную экзонуклеазу. Число единиц было установлено в соответствии с инструкциями производителя.
[0178] Реакционный раствор для амплификации (10 мкл) получали путем добавления кольцевой ДНК размером 80 т.п.о. (0,8 пг/мкл или 8 пг/мкл), RecG (0 нМ, 100 нМ, 300 нМ или 1000 нМ) и экзонуклеазы, специфичной к линейной ДНК (0 ед/мкл или 0,2 ед/мкл), к реакционной композиции, представленной в Таблице 1 Примера 1. Реакцию амплификации осуществляли путем выдерживания полученного таким образом реакционного раствора для амплификации (10 мкл) при 30°C в течение 24 часов. Продукт реакции подвергали электрофорезу в 0,5% агарозном геле (буфер 1 × TAE, 150 В, 100 минут), а затем окрашивали SybrGreen (Takara Bio, Inc.) для детектирования амплифицированной ДНК.
[0179] В результате этого, генерирование линейной ДНК как побочного продукта, образующегося при расщеплении ДНК и т.п., снижалось при добавлении RecG и экзонуклеазы, специфичной к линейной ДНК, и наблюдалось увеличение количества генерированного продукта амплификации кольцевой ДНК, имеющего представляющую интерес суперспирализованную структуру (Фигура 10).
[0180] Пример 7: Исследование условий различных типов
Ниже представлены результаты, полученные при исследовании условий для отдельных компонентов, содержащихся в реакционном растворе.
[0181] 1. Методы
В качестве матричной кольцевой ДНК использовали кольцевую ДНК размером 8,0 т.п.о. Кольцевую ДНК размером 8,0 т.п.о. получали путем инсерции фрагмента oriC в плазмидный вектор M13mp18.
[0182] В условиях A-R, кольцевую ДНК размером 8,0 т.п.о. добавляли к реакционному раствору для амплификации, представленному в Таблице 5, до конечной концентрации 8,0 нг/мкл или 0,8 нг/мкл, а затем полученную смесь оставляли на 1 час для реакции при 30°C. К реакционному раствору предварительно добавляли [α-32P]dATP, и после завершения реакции репликации ДНК, количество dNTP, включенного в матричную ДНК, измеряли в жидкостном сцинтилляционном счетчике. Количество включенного dNTP вычисляли как количество на 25 мкл реакционного раствора. С использованием кольцевой ДНК в качестве матрицы, имеющей конечную концентрацию 8,0 нг/мкл, при прохождении реакции репликации на 100% (один раунд репликации), в матричную ДНК было включено 600 пмоль dNTP. После электрофореза аликвоты реакционного раствора в агарозном геле, продукт, в который был включен32P, детектировали на визуализирующем планшете BAS Imaging Plate, и подтверждали получение представляющей интерес суперспирализованной структуры.
[0183] В Условии S, кольцевую ДНК размером 8,0 т.п.о. добавляли к реакционному раствору для амплификации, представленному в Таблице 5, до конечной концентрации 8,0 нг/мкл или 0,8 нг/мкл, а затем полученную смесь оставляли на 2 часа для реакции при 30°C. Продукт реакции подвергали электрофорезу в 0,5% агарозном геле (буфер 1 × TAE, 150 В, 100 минут), а затем окрашивали SybrGreen (Takara Bio, Inc.) для детектирования амплифицированной ДНК.
[0184] Таблица 5
[Таблица 5-1]
(8 т,п.о.)
(8 т.п.о.)
(8 т.п.о.)
(8 т.п.о.)
(8 т.п.о.)
(8 т.п.о.)
(8 т.п.о.)
[0185] [Таблица 5-2] Продолжение 1
(8 т.п.о.)
(8 т.п.о.)
(8 т.п.о.)
(8 т.п.о.)
(8 т.п.о.)
(8 т.п.о.)
(8 т.п.о.)
[0186] [Таблица 5-3] Продолжение 2
[0187] 2. Результаты
(1) Условие A
Было обнаружено, что несколько раундов репликативных циклов могут быть осуществлены повторно путем добавления первой, второй и третьей групп ферментов в реакционную систему с последующим проведением реакции. Однако, было также обнаружено, что так как белки-субстраты, используемые в реакции, восстанавливаются по мере повторения репликативных циклов, то наблюдается стагнация репликативных циклов на 4 раунде (Фигура 11).
[0188] (2) Условие B
Было проведено исследование для того, чтобы определить, может ли число репликативных циклов увеличиваться при снижении количества матричной ДНК во время инициации реакции. Исходное количество матричной ДНК во время инициации реакции перед исследованием составляло 8 нг/мкл и 0,8 нг/мкл.
[0189] В результате, если количество матричной ДНК во время инициации реакции составляло 8 нг/мкл, то наблюдалась реакция репликации, а если количество матричной ДНК снижалось до 0,8 нг/мкл, то эффективность репликации значительно ингибировалась, и амплификации ДНК не наблюдалось (Фигура 12). Эти результаты показали, что для увеличения числа репликативных циклов, необходимо не только снижение количества матричной ДНК, но также может оказаться необходимым исследование условий, включая количество компонентов различных типов в реакционной композиции.
[0190] (3) Условие C
Было проведено исследование количеств GTP, CTP и UTP в реакционной композиции. Концентрации GTP, CTP и UTP при инициации реакции составляли 0,2 мМ, 0,5 мМ, 1,0 мМ и 2,0 мМ.
Результаты представлены на Фигуре 13.
[0191] (4) Условие D
Было проведено исследование количества IHF в реакционной композиции. Концентрация IHF при инициации реакции составляла 0 нМ, 10 нМ, 20 нМ, 40 нМ, 100 нМ и 200 нМ.
Результаты представлены на Фигуре 14.
[0192] (5) Условие E
Было проведено исследование количества Topo IV в реакционной композиции. Концентрация Topo IV при инициации реакции составляла 0 нМ, 1 нМ, 2 нМ, 5 нМ, 10 нМ и 20 нМ.
Результаты представлены на Фигуре 15.
[0193] (6) Условие F
Было проведено исследование количества ДНК-гиразы в реакционной композиции. Концентрация комплекса GyrA-GyrB при инициации реакции составляла 0 нМ, 10 нМ, 25 нМ, 50 нМ, 100 нМ и 200 нМ.
Результаты представлены на Фигуре 16.
[0194] (7) Условие G
Было проведено исследование количества ДНК-полимеразы III* в реакционной композиции. Концентрация Pol III* при инициации реакции составляла 0 нМ, 1 нМ, 2 нМ, 5 нМ и 10 нМ.
Результаты представлены на Фигуре 17.
[0195] (8) Условие H
Было проведено исследование количества источника иона щелочного металла в реакционной композиции. Концентрация глутамата калия при инициации реакции составляла 50 мМ и 150 мМ.
Результаты представлены на Фигуре 18.
[0196](9) Условие I
Было проведено исследование количества неспецифического ингибитора адсорбции белка и/или неспецифического ингибитора адсорбции нуклеиновой кислоты в реакционной композиции. Были исследованы условия, при которых в реакционной композиции тРНК отсутствует, а BSA присутствует в количестве 0,1 мг/мл; условия, при которых в реакционной композиции тРНК присутствует в количестве 20 нг/мкл, а BSA присутствует в количестве 0,1 мг/мл; и условия, при которых в реакционной композиции тРНК отсутствует, а BSA присутствует в количестве 0,5 мг/мл.
Результаты представлены на Фигуре 19.
[0197] (10) Условие J
Было проведено исследование количества фермента DnaA, обладающего DnaA-активностью в реакционной композиции. Концентрация DnaA при инициации реакции составляла 0 нМ, 5 нМ, 10 нМ, 20 нМ, 40 нМ, 100 нМ и 200 нМ.
Результаты представлены на Фигуре 20.
[0198] (11) Условие K
Было проведено исследование количества фермента, обладающего ДНК-лигазной активностью в реакционной композиции. Концентрация лигазы при инициации реакции составляла 0 нМ, 2 нМ, 5 нМ, 10 нМ, 20 нМ и 50 нМ.
Результаты представлены на Фигуре 21.
[0199] (12) Условие L
Было проведено исследование количества белка, связывающегося с двухцепочечной ДНК (SSB) в реакционной композиции. Концентрация SSB при инициации реакции составляла 0 нМ, 10 нМ, 20 нМ, 50 нМ, 100 нМ, 200 нМ и 500 нМ.
Результаты представлены на Фигуре 22.
[0200] (13) Условие M
Было проведено исследование количества фермента, обладающего активностью ДНК-полимеразы I в реакционной композиции. Концентрация Pol I при инициации реакции составляла 0 нМ, 2 нМ, 5 нМ, 10 нМ, 20 нМ и 50 нМ.
Результаты представлены на Фигуре 23.
[0201] (14) Условие N
Было проведено исследование количества фермента, обладающего геликазной активностью DnaB-типа, и фермента, обладающего ДНК-геликазной звгрузочной активностью в реакционной композиции. Концентрация комплекса DnaB-DnaC при инициации реакции составляла 0 нМ, 5 нМ, 10 нМ, 20 нМ и 40 нМ.
Результаты представлены на Фигуре 24.
[0202] (15) Условие O
Было проведено исследование количества фермента, обладающего активностью РНКазы H в реакционной композиции. Концентрация РНКазы H при инициации реакции составляла 1 нМ, 3 нМ и 10 нМ.
Результаты представлены на Фигуре 25.
[0203] (16) Условие P
В условии P, количество матричной ДНК при инициации реакции составляло 8 нг/мкл, 0,8 нг/мкл и 0,27 нг/мкл, и это количество было исследовано в реакции амплификации.
Результаты представлены на Фигуре 26. В условии P, амплификация могла эффективно осуществляться даже в том случае, когда количество матричной ДНК составляло 0,8 нг/мкл. Кроме того, амплификация могла эффективно осуществляться даже в том случае, когда количество матричной ДНК снижалось до 0,27 нг/мкл. Было подтверждено, что матричная ДНК амплифицировалась в 100 раз или более по сравнению с количеством синтезированной ДНК.
[0204] (17) Условие Q
Ферменты, принадлежащие к третьей группе ферментов, исследовали на их количество и состав в реакционной композиции. В качестве ферментов третьей группы использовали Topo IV, Topo III и RecQ. Исследованные концентрации отдельных ферментов представлены на Фигуре 27.
Результаты представлены на Фигуре 27.
[0205] (18) Условие R
В Условии R исследовали количество ДНК-гиразы. Концентрация комплекса GyrA-GyrB при инициации реакции составляла 0 нМ, 10 нМ, 25 нМ, 50 нМ и 150 нМ.
Результаты представлены на Фигуре 28.
[0206] (19) Условие S
В Условии S, концентрации тРНК, NAD, сульфата аммония (AS), IHF, SSB и TopoIV заменяли, а затем исследовали амплификацию кольцевой ДНК. Исследованные концентрации отдельных компонентов представлены на Фигуре 29.
Результаты представлены на Фигуре 29.
[0207] Пример 8: Модификация буферной композиции
Были дополнительно исследованы условия для композиции реакционного буфера, представленной в Таблице 1.
В частности, реакцию амплификации осуществляли также, как описано в Примере 1, за исключением того, что кольцевую ДНК размером 200 т.п.о., описанную в Примере 1, использовали в концентрации 0,5 пМ, а состав реакционного буфера изменяли.
[0208] (1) Модификация количества дитиотреитола (DTT)
Концентрацию DTT, которая в Премере 1 составляла 8 мМ, снижали до 4 мМ, а затем проводили реакцию амплификации. В результате было подтверждено, что реакция амплификации кольцевой ДНК проходила даже при уменьшении количества DTT наполовину.
[0209] (2) Исследование источника иона щелочного металла
Что касается композиции реакционного буфера, представленной в Таблице 1, то концентрацию DTT снижали до 4 мМ и в это же самое время использовали реакционный буфер, не содержащий источников иона щелочного металла, и реакционный буфер, содержащий в качестве источника иона щелочного металла 150 мМ ацетата калия вместо глутамата калия. Затем проводили реакцию амплификации кольцевой ДНК.
[0210] Результаты представлены на Фигуре 30. Амплификация длинноцепочечной кольцевой ДНК, имеющей низкую концентрацию, составляющую 0,5 пМ или менее, является проблематичной из-за амплификации низкомолекулярного побочного продукта, а поэтому образование суперспирали как представляющего интерес продукта амплификации не могло быть подтверждено. Однако, при добавлении к реакицонному буферу источника иона щелочного металла, такого как глутамат калия или ацетат калия даже в том случае, когда амплифицировалась длинноцепочечная кольцевая ДНК с низкой концентрацией 0,5 пМ, могла быть подтверждена успешная амплификация суперспирали как представляющего интерес продукта.
[0211] В последующих экспериментах был использован реакционный буфер, имеющий следующий состав.
[0212] [Таблица 6]
[0213] (3) Исследование буфера
Что касается состава буфера, представленного в Таблице 6, то 20 мМ Трис-HCl (pH 8,0) заменяли на 20 мМ Трис-OAc (pH 8,0), а затем проводили реакцию амплификации кольцевой ДНК. В результате было обнаружено, что даже при использовании 20 мМ Трис-OAc (pH 8,0), продукт амплификации наблюдался на том же уровне, как и в случае использования 20 мМ Трис-HCl (pH 8,0).
[0214] (4) Исследование альтернативы дитиотреитолу (DTT)
Что касается состава буфера, представленного в Таблице 6, то 4 мМ DTT заменяли на 4 мМ 2-меркаптоэтанола (2-Me) или 4 мМ трис(2-карбоксиэтил)фосфина (TCEP), а затем проводили реакцию амплификации кольцевой ДНК. В результате было обнаружено, что даже при использовании 2-Me или TCEP, продукт амплификации наблюдался на том же уровне, как и в случае использования DTT.
[0215] (5) Исследование альтернативы сульфату аммония
Что касается состава буфера, представленного в Таблице 6, то 10 мМ сульфата аммония заменяли на 10 мМ ацетата аммония, а затем проводили реакцию амплификации кольцевой ДНК. В результате было обнаружено, что даже при использовании ацетата аммония, продукт амплификации наблюдался на том же уровне, как и в случае использования сульфата аммония.
[0216] Пример 9: Эффективность амплификации, достигаемая путем предварительного инкубирования реакционного раствора
Были исследованы эффекты, достигаемые путем предварительного инкубирования до реакции амплификации.
[0217] В качестве матричной ДНК использовали кольцевую ДНК размером 200 т.п.о., описанную в Примере 1. Реакционный раствор, содержащий реакционный буфер, состав которого представлен в Таблице 6, и группу ферментов, состав которых представлен в Таблице 1, приготавливали на льду. Предварительное инкубирование проводили при 0°C, 16°C или 30°C, в течение 0, 5, 15 или 30 минут. Затем, к реакционному раствору добавляли матричную ДНК до конечной концентрации 0,05 пМ, и полученную смесь поддерживали при температуре 30°C в инкубаторе в течение 3 часов. После завершения реакции, продукт реакции подвергали электрофорезу в агарозном геле как описано в Примере 1, а затем детектировали ДНК.
[0218] Результаты представлены на Фигуре 31. Было подтверждено, что при проведении предварительного инкубирования при 16°C или 30°C наблюдалось повышение уровня продуцирования суперспирали как представляющего интерес продукта. Предварительное инкубирование, осуществляемое до реакции амплификации, является предпочтительным, поскольку повышение уровня продуцирования суперспирали как представляющего интерес продукта амплификации наблюдалось даже при амплификации длинноцепочечной кольцевой ДНК, имеющей низкую концентрацию.
[0219] Пример 10: Добавление RecG и RecJ
К реакционному раствору для амплификации также добавляли геликазу RecG-типа и экзонуклеазу, специфичную к одноцепочечной ДНК, и оценивали влияние добавления RecG и RecJ на реакцию амплификации.
В качестве матричной ДНК использовали кольцевую ДНК размером 200 т.п.о., описанную в Примере 1.
В качестве геликазы RecG-типа использовали RecG. RecG получали и использовали как описано в Примере 6.
В качестве экзонуклеазы, специфичной к одноцепочечной ДНК, использовали RecJ. Такую RecJ получали от NEB.
[0220] К реакционному раствору, содержащему реакционный буфер, состав которого представлен в Таблице 6, и группу ферментов, состав которых представлен в Таблице 1, добавляли кольцевую ДНК размером 200 т.п.о., RecG и RecJ до конечных концентраций 0,5 пМ (67 пг/мкл), 0 нМ или 100 нМ, и 0 ед/мкл или 0,5 ед /мкл, соответственно. Температуру полученного реакционного раствора для амплификации (10 мкл) поддерживали при 30°C в течение 3 часов или 25 часов для проведения реакции амплификации. После завершения реакции, продукт реакции подвергали электрофорезу в агарозном геле, как описано в Примере 1, а затем детектировали ДНК.
[0221] Результаты представлены на Фигуре 32. При добавлении RecG и RecJ снижалось продуцирование низкомолекулярного продукта амплификации и наблюдалось увеличение количества продуцированного продукта амплификации кольцевой ДНК, имеющего представляющую интерес суперспирализованную структуру. В частности, при амплификации длинноцепочечной кольцевой ДНК, имеющей низкую концентрацию, добавление геликазы RecG-типа и экзонуклеазы, специфичной к одноцепочечной ДНК, к реакционному раствору для амплификации, является эффективным средством решения проблемы амплификации низкомолекулярного побочного продукта.
[0222] Пример 11: Добавление RecBCD и exo I
К реакционному раствору для амплификации также добавляли экзонуклеазу, специфичную к линейной ДНК, и экзонуклеазу, специфичную к одноцепочечной ДНК, а затем исследовали эффекты, достигаемые при добавлении экзонуклеазы, специфичной к линейной ДНК, и экзонуклеазы, специфичной к одноцепочечной ДНК.
В качестве матричной ДНК использовали кольцевую ДНК размером 200 т.п.о., описанную в Примере 1.
В качестве экзонуклеазы, специфичной к линейной ДНК, использовали RecBCD. Такую RecBCD получали от NEB.
В качестве экзонуклеазы, специфичной к одноцепочечной ДНК, использовали exo I. Такую exo I получали от NEB.
[0223] К реакционному раствору, содержащему реакционный буфер, состав которого представлен в Таблице 6, и группу ферментов, состав которых представлен в Таблице 1, добавляли кольцевую ДНК размером 200 т.п.о., RecBCD и exo I до концентраций 0,5 пМ (67 пг/мкл), 0, 1,5, 5,0, 15,0 или 50,0 мЕд/мкл и 200 мЕд/мкл, соответственно. Температуру полученного реакционного раствора для амплификации (10 мкл) поддерживали при 30°C в течение 20 часов для проведения реакции амплификации. После завершения реакции, продукт реакции подвергали электрофорезу в агарозном геле, как описано в Примере 1, а затем детектировали ДНК.
[0224] Результаты представлены на Фигуре 33. При добавлении RecBCD и exo I наблюдалось снижение уровня продуцирования линейной ДНК как побочного продукта расщепления ДНК и т.п. и увеличение количества продукта амплификации кольцевой ДНК, имеющего представляющую интерес суперспирализованную структуру. В частности, при амплификации длинноцепочечной кольцевой ДНК, имеющей низкую концентрацию, добавление экзонуклеазы, специфичной к линейной ДНК, и экзонуклеазы, специфичной к одноцепочечной ДНК, к реакционному раствору для амплификации является эффективным средством решения проблемы амплификации линейной ДНК, продуцируемой как побочный продукт.
[0225] Пример 12: Постреакционная обработка - увеличение уровня конечного продукта при разведении и повторном нагревании и удаление линейной ДНК под действием RecBCD и exo I после повторного нагревания
Было проведено исследование для того, чтобы определить, может ли побочный продукт удаляться при разведении и повторном нагревании после проведения реакции амплификации. Кроме того, было проведено исследование для того, чтобы определить, может ли побочный продукт удаляться при обработке продукта реакции экзонуклеазой, специфичной к линейной ДНК, и/или экзонуклеазой, специфичной к одноцепочечной ДНК, после завершения реакции амплификации.
В качестве матричной ДНК использовали кольцевую ДНК размером 200 т.п.о., описанную в Примере 1.
В качестве экзонуклеазы, специфичной к линейной ДНК, использовали RecBCD, а в качестве экзонуклеазы, специфичной к одноцепочечной ДНК, использовали exo I. Такие RecBCD и exo I получали как описано в Примере 10.
[0226] К реакционному раствору, содержащему реакционный буфер, состав которого представлен в Таблице 6, и группу ферментов, состав которых представлен в Таблице 1, добавляли кольцевую ДНК размером 200 т.п.о. до концентрации 0,5 пМ (67 пг/мкл). Температуру полученного реакционного раствора для амплификации (10 мкл) поддерживали при 30°C в течение 23 часов для проведения реакции амплификации.
[0227] Реакционный раствор, полученный после завершения реакции амплификации, разводили до 1/5 реакционным буфером, имеющим состав, описанный в примере 6, за исключением креатинкиназы и альбумина бычьей сыворотки, а затем (i) разведенный раствор сразу повторно нагревали при 30°C в течение 1 часа, (ii) 200 мЕд/мкл RecBCD добавляли к разведенному раствору, а затем полученную смесь снова нагревали при 30°C в течение 1 часа, или (iii) 200 мЕд/мкл RecBCD и 200 мЕд/мкл exo I добавляли к разведенному раствору, а затем полученную смесь снова нагревали при 30°C в течение 1 часа. После этого, продукт реакции, вместе с продуктом, полученным до разведения и повторного нагревания, подвергали электрофорезу в агарозном геле как описано в Примере 1, и детектировали ДНК.
[0228] Результаты представлены на Фигуре 34. Кольцевая ДНК, имеющая представляющую интерес суперспирализованную структуру, могла детектироваться только при разведении и повторном нагревании реакционного раствора, полученного после завершения реакции амплификации. Кроме того, линейная ДНК как побочный продукт могла удаляться в присутствии экзонуклеазы, специфичной к линейной ДНК, и/или экзонуклеазы, специфичной к одноцепочечной ДНК.
[0229] Обработка путем разведения и повторного нагревания представляет собой эффективное средство для стимуляции репликации и элонгации амплифицированного промежуточного продукта или для реакции разделения, а также для увеличения количества продуцируемого конечного продукта в виде суперспирализованной ДНК. Кроме того, обработка продукта реакции экзонуклеазой, специфичной к линейной ДНК, и экзонуклеазой, специфичной к одноцепочечной ДНК, после повторного нагревания представляет собой эффективное средство для удаления линейной ДНК, продуцируемой как побочный продукт, а в частности, при амплификации длинноцепочечной кольцевой ДНК, имеющей низкую концентрацию.
[0230] Пример 13: Постреакционная обработка - репарация одноцепочечного гэпа под действием фермента для репарации гэпов (GR)
Было проведено исследование для того, чтобы определить, может ли кольцевая ДНК, имеющая представляющую интерес суперспирализованную структуру, детектироваться при ее обработке ферментов для репарации гэпов (GR) после завершения реакции амплификации.
[0231] К реакционному раствору, содержащему реакционный буфер, состав которого представлен в Таблице 6, и группу ферментов, состав которых представлен в Таблице 1, добавляли кольцевую ДНК размером 15 т.п.о. до концентрации 0,5 пМ (5 пг/мкл). Температуру полученного реакционного раствора для амплификации (10 мкл) поддерживали при 30°C в течение 20 часов для проведения реакции амплификации. Кольцевую ДНК размером 15 т.п.о., используемую в качестве матричной ДНК, получали путем связывания и циклизации области размером 15 т.п.о. на геноме Escherichia coli вместе с фрагментом oriC (0,4 т.п.о.), с последующим клонированием полученного продукта с использованием Escherichia coli и его очисткой.
[0232] Продукт, полученный после завершения реакции амплификации, диализовали против 20 мл 10 мМ Трис-HCl (pH 8,0) в течение 2 часов, а затем 0,5 мкл полученного раствора добавляли к 5 мкл реакционного буфера, содержащего фермент GR, после чего проводили инкубирование при 30°C в течение 20 минут или 60 минут. В качестве фермента GR использовали комбинацию Exo III, ДНК-полимеразы I, лигазы и гиразы, и эти ферменты добавляли в концентрациях 20 мЕд/мкл, 50 нМ, 50 нМ и 50 нМ, соответственно. В качестве реакционного буфера использовали буфер, состав которого представлен в Таблице 6.
[0233] В качестве позитивного контроля для обработки ферментом GR использовали PhiX174 RFII (NEB), которая представляет собой ДНК, имеющую одноцепочечный разрыв, а затем проводили реакцию репарации гэпов. При правильном осуществлении репарации гэпов происходит репарация одноцепочечного разрыва, а поэтому может детектироваться кольцевая ДНК, имеющая суперспирализованную структуру.
Продукт реакции подвергали электрофорезу в агарозном геле как описано в Примере 1, и детектировали ДНК.
[0234] Результаты представлены на Фигуре 35. В настоящем эксперименте, поскольку реакцию осуществляли в течение длительного периода времени, которое превышало оптимальное время амплификации кольцевой ДНК размером 15 т.п.о. (приблизительно 3 часа), то суперспирализованные продукты почти не детектировались. Кольцевая ДНК, имеющая суперспирализованную структуру, могла детектироваться путем обработки этого продукта ферментом GR. Эти результаты продемонстрировали, что кольцевая ДНК, имеющая представляющую интерес суперспирализованную структуру, может быть получена путем репарации гэпов на побочном продукте, полученном после реакции амплификации.
[0235] Пример 14: Фактор, стабилизирующий длинноцепочечную кольцевую ДНК, и стимуляция эффективной реакции амплификации с использованием этого фактора
(1) Исследование фактора, стабилизирующего длинноцепочечную ДНК
При инкубировании длинноцепочечной кольцевой ДНК при 37°C с использованием реакционного буфера, состав которого представлен в Примере 6, за исключением креатинкиназы и альбумина бычьей сыворотки, наблюдалось индуцирование повреждения ДНК и снижение уровня кольцевой ДНК, имеющей суперспирализованную структуру. Был исследован реагент, способствующий стабилизации длинноцепочечной кольцевой ДНК.
[0236] В результате исследований было обнаружено, что глюкоза, сахароза, диметилсульфоксид (ДМСО), альбумин бычьей сыворотки (BSA), этиленгликоль-тетрауксусная кислота (EGTA), динатриевая соль батокупроиндисульфоновой кислоты (BDA), пеницилламин, Тирон (1,2-дигидроксибензол-3,5-сульфоната), диэтилентриаминпентауксусная кислота (DTPA), этилендиаминтетрауксусная кислота (EDTA), белок Dps (происходящий от Escherichia coli) и белок металлотионеина (человеческий) влияют на стабилизацию ДНК при поддержании температуры с использованием реакционного буфера.
[0237] (2) Стимуляция эффективной реакции амплификации кольцевой ДНК с использованием ДНК-стабилизирующего фактора
К реакционному раствору, содержащему реакционный буфер, состав которого представлен в Таблице 6, и группу ферментов, состав которых представлен в Таблице 1, добавляли кольцевую ДНК размером 200 т.п.о., DTPA или Тирон, BDA и Dps до концентраций 0,5 пМ (67 пг/мкл)(кольцевая ДНК), 0,05, 0,1 или 0,3 мМ (DTPA или Тирон), 0,1, 0,3 или 1 мМ (BDA), и 0,3, 1 или 3 мкМ (Dps). Температуру полученного таким образом реакционного раствора для амплификации (10 мкл) поддерживали при 30°C в течение 20 часов для проведения реакции амплификации. После завершения реакции амплификации, продукт реакции разводили и снова нагревали при 30°C в течение 1 часа как описано в Примере 11, а затем продукт реакции подвергали электрофорезу в агарозном геле, как описано в Примере 1, и детектировали ДНК.
[0238] Результаты представлены на Фигуре 36. Совершенно очевидно, что в продуктах реакции амплификации, в которые, помимо ДНК-стабилизирующего фактора, описанного выше в (1), добавляли DTPA, Тирон, BDA, белок Dps и BSA, количество продуцированной кольцевой ДНК, имеющей суперспирализованную структуру, увеличивалась, что указывало на то, что эти ДНК-стабилизирующие факторы стимулируют эффективную реакцию амплификации кольцевой ДНК.
[0239] Пример 15: Реакция амплификации длинноцепочечной кольцевой ДНК с использованием эмульсии
Была исследована реакция амплификации кольцевой ДНК, осуществляемая в эмульсии типа «вода в масле».
В качестве матричной ДНК использовали кольцевую ДНК размером 200 т.п.о., описанную в Примере 1.
[0240] К реакционному раствору, содержащему реакционный буфер, состав которого представлен в Таблице 6, и группу ферментов, состав которых представлен в Таблице 1, добавляли кольцевую ДНК размером 200 т.п.о. до концентрации 0,5 пМ (67 пг/мкл) и получали раствор реакции для амплификации (5 мкл). К полученному реакционному раствору для амплификации добавляли 100 мкл минерального масла, содержащего поверхностно-активное вещество (2% ABIL EM90 и 0,05% Тритон-X100), а затем полученную смесь смешивали путем вихревого перемешивания в течение 60 секунд. Температуру полученной таким образом смеси поддерживали при 30°C в течение 3 часов или 18 часов для проведения реакции амплификации (с использованием эмульсии). С другой стоорны, в качестве контроля, вышеописанный реакционный раствор для амплификации сразу инкубировали при 30°C в течение 3 часов или 18 часов для проведения реакции амплификации (общей). Затем продукт реакции подвергали электрофорезу в агарозном геле, как описано в Примере 1, и детектировали ДНК.
[0241] Результаты представлены на Фигуре 37. В общей системе наблюдалось продуцирование низкомолекулярного побочного продукта, и при увеличении времени реакции, не обнаруживалась ДНК, имеющая представляющую интерес суперспирализованную структуру. В эмульсионной системе, продуцирование низкомолекулярного побочного продукта ингибировалось, и при увеличении времени реакции наблюдалось повышение уровня продуцирования ДНК, имеющей представляющую интерес суперспирализованную структуру.
[0242] Пример 16: Стимуляция эффективной амплификации в термическом цикле
Поскольку репликация кольцевой ДНК происходит непосредственно в реакционном растворе для амплификации кольцевой ДНК, то молекулярная масса кольцевой ДНК снижается. Таким образом, при продуцировании низкомолекулярной кольцевой ДНК в виде побочного продукта, этот побочный продукт амплифицируется быстрее, чем кольцевая ДНК, служащая в качестве мишени. Амплификациия длинноцепочечной ДНК является проблематичной, поскольку в соответствии с этим феноменом, уровень амплификации побочного продукта становится выше, чем уровень амплификации длинноцепочечной ДНК, а поэтому амплификация длинноцепочечной ДНК, как представляющго интерес продукта, блокируется. Для эффективной амплификации длинноцепочечной ДНК необходимо подавлять избыточную амплификацию низкомолекулярной ДНК.
[0243] В таких случаях, авторы настоящего изобретения обратили внимание на то, что при инициации репликации кольцевой ДНК, содержащей oriC, оптимальной температурой является температура 30°C или выше, однако, реакции элонгации и/или разделения протекают даже и при более низкой температуре. Таким образом, авторами настоящего изобретения была предпринята попытка унифицировать цикл при инициации репликации путем добавления термического цикла для реакции амплификации кольцевой ДНК в целях подавления избыточной амплификации низкомолекулярной ДНК.
[0244] Реакционный раствор, содержащий реакционный буфер, состав которого представлен в Таблице 6, и группу ферментов, состав которых представлен в Таблице 1, предварительно инкубировали при 30°C в течение 30 минут, как описано в Примере 8, и к реакционной смеси добавляли кольцевую ДНК размером 200 т.п.о. (Пример 1) до концентрации 0,5 пМ (67 пг/мкл) с получением реакционного раствора для амплификации (10 мкл). Термический цикл: 37°C, 5 минут ® 16°C или 24°C, 30 минут, проводили 30 раз в полученном реакционном растворе для амплификации (2-стадийные циклы). С другой стороны, в случае образца, используемого в качестве контроля, температуру вышеописанного реакционного раствора для амплификации поддерживали при 30°C в течение 21 часа. Продукт реакции подвергали электрофорезу в агарозном геле, как описано в Примере 1, и детектировали ДНК.
[0245] Результаты представлены на Фигуре 38. В случае проведения реакции в 2-стадийных циклах наблюдалось ингибирование продуцирования низкомолекулярного побочного продукта, и в то же самое время наблюдалось увеличение количества продуцированной ДНК, имеющей представляющую интерес суперспирализованную структуру.
Промышленное применение
[0246] В соответствии с настоящим изобретением может быть разработан способ простой и экспоненциальной амплификации кольцевой ДНК, а в частности, длинноцепочечной кольцевой ДНК без использования клеток Escherichia coli или плазмидных векторов.
Реферат
Изобретение относится к биотехнологии, в частности к способу амплификации кольцевой ДНК, а в частности длинноцепочечной кольцевой ДНК в бесклеточной системе. Более конкретно, настоящее изобретение относится к способу амплификации кольцевой ДНК, который включает смешивание кольцевой ДНК, имеющей последовательность ориджина репликации (ориджина хромосомы (oriC)), с реакционным раствором, содержащим первую группу ферментов, которые катализируют репликацию кольцевой ДНК; вторую группу ферментов, которые катализируют созревание фрагмента Оказаки и синтезируют две сестринские кольцевые ДНК, состоящие из катенана; третью группу ферментов, которые катализируют разделение двух сестринских кольцевых ДНК; а также буфер, NTP, dNTP, источник иона магния и источник иона щелочного металла, с получением реакционной смеси, которую затем подвергают реакции взаимодействия. 3 н. и 23 з.п. ф-лы, 38 ил., 6 табл., 16 пр.

Комментарии