Штамм бактерий corynebacterium ammoniagenes - продуцент уридин-5'-монофосфата (варианты), способ получения уридин-5'- монофосфата - RU2203948C2
Код документа: RU2203948C2
Чертежи




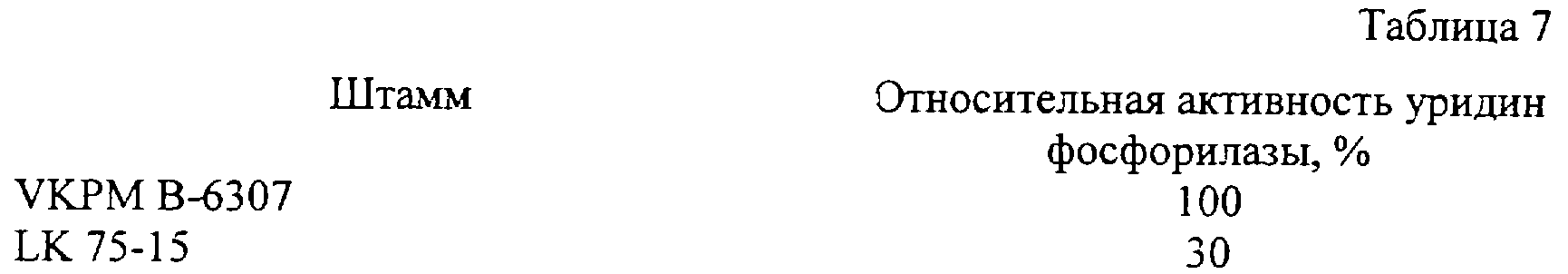




Описание
Область техники, к которой относится изобретение
Настоящее изобретение
относится к области биотехнологии и касается коринеформных бактерий и способа получения уридин-5 '-монофосфата путем ферментации с использованием указанных бактерий.
Уридин-5'-монофосфат применяется в качестве биохимического реагента, а также как исходное соединение для синтеза лекарственных препаратов (WO 95/16785, ЕР Patent Specification 0149775 Bl, US Patent 5422343; Clin. Exp. Pharmacol. Phisiol, 1987, v. 14, 3, p. 253; Хим.-фарм. журнал, 1993, т.27, 7, с. 27).
Уровень техники
Известен способ ферментативного получения
уридин-5'-монофосфата с использованием урацила и оротовой кислоты в качестве предшественников (Agr. Biol. Chem., 1971, v. 35, р. 518; Biosci. Biotech. Biochem., 1997, v. 61, 6, р. 956).
Ранее известный способ получения уридин-5'-монофосфата путем прямой ферментации включает способ с использованием различных штаммов, принадлежащих к роду Streptomyces [Japanese Patent Laid - open publication 49-031117] и Micromonosporum [Japanese Patent laid - open publication 57-018873], резистентных к аналогам урацила, их рибозидов или рибонуклеотидов.
Более поздний способ, в котором используются штаммы рода Brevibacterium, резистентные к пуриновым аналогам, описан в японском патенте (Japanese Patent laid - open publication 57-30476).
Способ получения уридин-5'-монофосфата, в котором используются штаммы Brevibacterium ammoniagenes (впоследствии отнесенные к Corynebacterium ammoniagenes), обладающие резистентностью к пиримидиновым аналогам, предложен в авт. св. СССР 923186. Еще один более поздний способ, использующий штаммы Corynebacterium ammoniagenes, которым придана резистентность к пиримидиновым аналогам, описан в японском патенте (Japanese Patent laid - open publication 4-158792).
В авт. св. СССР 1446927 предложен способ, использующий штаммы Corynebacterium ammoniagenes, полученные из продуцента инозин-5'-монофосфата, которые обнаружили способность накапливать значительные количества уридин-5'-монофосфата вследствие приобретения чувствительности к бактериостатическому действию аденина. Эти штаммы характеризуются высокой резистентностью к пиримидиновым аналогам.
В дальнейшем были предприняты попытки увеличить продуктивность штаммов, накапливающих уридин-5'-монофосфат, за счет придания им дополнительных свойств. Например, было обнаружено, что продуктивность штаммов Corynebacterium ammoniagenes, накапливающих уридин-5'-монофосфат, может быть в значительной мере увеличена путем дополнительного введения в геном аденин-чувствительных мутантов резистентности к сульфагуанидину (авт. св. СССР 1782028; Заявка на изобретение в РФ 95112366, "Официальный Бюллетень Российского агентства по патентам и товарным знакам", 20, ч.1, 20.07.1997) или к арсенату (авт. св. СССР 1832127). Самый высокий уровень накопления уридин-5' -монофосфата (22,0 г/л) был достигнут при использовании штамма VKPM В-6307, описанного в Заявке на изобретение в РФ 95112366.
Хотя описанные способы позволяют достичь достаточно высокого уровня накопления уридин-5'-монофосфата, их продуктивность, тем не менее, сравнительно низка с точки зрения промышленного использования. Поэтому существует необходимость разработки более экономичного способа продукции уридин-5'-монофосфата, обеспечивающего высокий уровень накопления этого соединения при низкой цене.
Известен способ получения уридина с использованием микроорганизма, который принадлежит к роду Bacillus и который обладает сниженной уридинфосфорилазной активностью и является устойчивым к пиримидиновым аналогам (US Patent 4880736). Однако до сих пор не было известно, чтобы коринеформные бактерии, обладающие такими же свойствами, что и вышеупомянутый микроорганизм, могли эффективно продуцировать уридин-5'-монофосфат.
Сущность изобретения
В основу изобретения поставлена
задача создать более эффективный способ продукции уридин-5'-монофосфата с высоким, с промышленной точки зрения, выходом и предложить микроорганизмы, которые могут быть использованы в этом способе.
В конечном итоге авторы настоящего изобретения в результате многочисленных исследований бактерии, продуцирующей уридин-5'-монофосфат, обнаружили, что микроорганизм, принадлежащий к Corynebacterium ammoniagenes и обладающий резистентностью к пиримидиновым аналогам, продуцирует и накапливает значительное количество уридин-5'-монофосфата в среде. При изучении серии мутантов была обнаружена прямая зависимость между резистентностью к пиримидиновым аналогам и накоплением уридин-5'-монофосфата, а именно: чем выше уровень резистентности, тем выше выход уридин-5'-монофосфата. Более того, в настоящее время обнаружено, что некоторые из новых мутантов, которые резистентны, по крайней мере, к одному из пиримидиновых аналогов и которые дефектны по способности к деградации уридина, по сравнению с ранее известными штаммами, характеризуются более высокой продукцией уридин-5'-монофосфата и сниженным уровнем накопления побочного продукта урацила.
До сих пор никогда не сообщалось о том, что продуктивность уридин-5'-монофосфата может быть увеличена путем придания таких свойств микроорганизму, продуцирующему уридин-5'-монофосфат.
Поэтому на основе новых данных работа была продолжена и завершилась настоящим изобретением.
Таким образом, настоящее изобретение состоит в том, что предложены:
- коринеформные бактерии, которые
резистентны к ингибированию роста пиримидиновыми аналогами в минимальной среде, содержащей гуанин, аргинин и казаминовые кислоты, и обладают способностью к продукции уридин-5'-монофосфата,
- при этом, предпочтительны бактерии, в которых пиримидиновый аналог выбран из группы, состоящей из 6-азаурацила, 2-тиоурацила, 5-фторурацила, их рибозидов или рибонуклеотидов,
- наиболее
предпочтительны бактерии, в которых пиримидиновым аналогом является 5-фторуридин,
- упомянутые бактерии, которые принадлежат к Corynebacterium ammoniagenes,
- в предпочтительном
варианте бактерии, которые являются штаммом Corynebacterium ammoniagenes LK-40-2 (VKPM B-7811).
Существо изобретения также состоит в том, что предложены:
- коринеформные
бактерии, которые проявляют резистентность к ингибирующим рост пиримидиновым аналогам, дефектны по уридин-деградирующей активности и обладают способностью к продукции уридин-5'-монофосфата,
- при этом предпочтительны бактерии, в которых пнримидиновый аналог выбран из группы, состоящей из 6-азаурацила, 2-тиоурацила, 5-фторурацила, их рибозидов или рибонуклеотидов,
- наиболее
предпочтительны бактерии, в которых пиримидиновым аналогом является 5-фторуридин,
- упомянутые бактерии, которые принадлежат к Corynebacterium ammoniagenes,
- в предпочтительном
варианте бактерии, которые являются штаммами Corynebacterium ammoniagenes LK75-15 (VKPM В-7812) или LK 75-66 (VKPM B-7813).
Наконец, существо изобретения состоит в том, что предложен способ получения уридин-5'-монофосфата путем ферментации, включающий стадии культивирования вышеупомянутых бактерий в среде, обеспечивающей продукцию и накопление уридин-5'-монофосфата в культуральной жидкости, и отбор указанного уридин-5'-монофосфата.
Ниже представлено детальное объяснение настоящего изобретения.
Микроорганизмы, используемые в настоящем изобретении, могут быть получены из микроорганизмов, которые уже обладают способностью продуцировать уридин-5'-монофосфат, путем введения в них специфической резистентности или ослабления уридин-деградирующей активности.
Термин "микроорганизм, который является резистентным к пиримидиновым аналогам" означает микроорганизм, полученный от штамма бактерии, принадлежащей к коринебактериям в качестве родительского штамма и измененный по генетическим свойствам таким образом, что этот микроорганизм приобретает способность к росту в присутствии пиримидиновых аналогов. Термин "пиримидиновый аналог" означает соединение, сходное по структуре с пиримидиновыми основаниями, такими как урацил, например, 6-азаурацил, 2-тиоурацил, 5-гидроксиурацил, 5-фторурацил, а также их рибозиды или рибонуклеотиды. Достаточно того, что микроорганизм, резистентный к пиримидиновому аналогу, имеет резистентность хотя бы к одному из аналогов. Обычно мутант, резистентный к одному из пиримидиновых аналогов, является резистентным, по крайней мере, к еще одному из пиримидиновых аналогов.
Таким образом, используемый здесь термин "резистентный к ингибированию роста пиримидиновым аналогом" означает, что мутант способен к росту в питательной среде, содержащей в качестве ингибитора пиримидиновый аналог в количестве, которое будет ингибировать рост родительских штаммов. Количество ингибитора, которое в основном использовалось, было более 100 мкг/мл, однако предпочтительно использовать концентрации более 500 мкг/мл.
Аналогично, использованный выше термин "ослабленная уридин-деградирующая активность" означает, что мутант не может использовать уридин в качестве единственного источника углерода (мутант, не утилизирующий уридин, URnu) в противоположность штамму дикого типа. Например, штамм, у которого уридинфосфорилазная активность на клетку составляет 1/2 или менее, предпочтительно, 1/3 или менее чем активность родительского штамма, другими словами, штамм, у которого удельная активность уридинфосфорилазы, которая измерялась по методу С. Е. Carter (J. Am. Chem. Soc., v.73, pp.1508-1510, 1951), составляет менее чем 50 нМ • мин-1 • мг-1 клеточного белка, имеет ослабленную уридин-деградирующую активность.
"Коринеформные бактерии" или "коринебактерии", упоминаемые в настоящем
изобретении, включают бактерии, ранее классифицируемые как род Brevibacterium, но в настоящее время отнесенные к роду Corynebacterium (Int. J. Syst. Bacteriol, v. 41, p. 255, 1981), и включают
бактерии, принадлежащие к роду Brevibacterium, близко родственные роду Corynebacterium. Примеры таких коринеформных бактерий, продуцирующих L-глютаминовую кислоту, включают следующие виды:
Corynebacterium ammoniagenes (Brevibacterium ammoniagenes)
Corynebacterium acetoacidophilum
Corynebacterium acetoglutamicum
Corynebacterium alkanolyticum
Corynebacterium callunae
Corynebacterium glutamicum
Corynebacterium lilium (Corynebacterium glutamicum)
Corynebacterium melassecola
Corynebacterium
thermoaminogenes
Corynebacterium herculis
Brevibacterium divaricatum (Corynebacterium glutamicum)
Brevibacterium flavum (Corynebacterium glutamicum)
Brevibacterium
immariophilum
Brevibacterium lactofermentum (Corynebacterium glutamicum)
Brevibacterium roseum
Brevibacterium saccharolyticum
Brevibacterium thiogenitalis
Brevibacterium album
Brevibacterium cerinum
Microbacterium ammoniaphilum
Следующие штаммы коринеформных бактерий представляют особый интерес:
Corynebacterium
ammoniagenes (Brevibacterium ammoniagenes) ATCC 6871, ATCC 6872, VKPM B-6307
Corynebacterium acetoacidophilum ATCC 13870
Corynebacterium acetoglutamicum ATCC 15806
Corynebacterium alkanolyticum ATCC 21511
Corynebacterium callunae ATCC 15991
Corynebacterium glutamicum ATCC 13020, 13032, 13060
Corynebacterium lilium (Corynebacterium
glutamicum)
Corynebacterium melassecola ATCC 15990
Corynebacterium thermoaminogenes AJ12340 (FERM BP-1539)
Corynebacterium herculis ATCC 13868
Brevibacterium
divaricatum (Corynebacterium glutamicum) ATCC 14020
Brevibacterium flavum (Corynebacterium glutamicum) ATCC 13826, ATCC 14067
Brevibacterium immariophilum ATCC 14068
Brevibacterium lactofermentum (Corynebacterium glutamicum) ATCC 13665, ATCC 13869
Brevibacterium roseum ATCC 13825
Brevibacterium saccharolyticum ATCC 14066
Brevibacterium
thiogenitalis ATCC 19240
Brevibacterium album ATCC 15111
Brevibacterium cerinum ATCC 15112
Microbacterium ammoniaphilum ATCC 15354
Помимо уже упомянутых свойств,
мутантные штаммы, используемые в настоящем изобретении, могут обладать другими специфическими свойствами, такими как различные питательные потребности, резистентность к ядам, чувствительность к ядам и
зависимость от них, не выходя за рамки настоящего изобретения.
Мутантные микроорганизмы, которые пригодны для использования в настоящем исследовании, могут быть получены в результате традиционной мутагенной обработки, такой как УФ-облучение, рентгеновское облучение, радиоактивное облучение и обработка химическими мутагенами с последующим отбором мутантов методом "реплик". Наиболее предпочтительным мутагеном является N-нитро-N'-метил-N-нитрозогуанидин (далее обозначенный как НТГ).
Таким образом, можно подвергнуть какой-либо из известных штаммов, принадлежащих к
коринебактериям, таким как Corynebacterium ammoniagenes, уже обладающим способностью продуцировать уридин-5'-монофосфат, одной из вышеперечисленных мутационной обработке для получения мутантного
штамма, а далее исследовать мутантный штамм на предмет, удовлетворяет ли он вышеупомянутым требованиям, касающимся устойчивости к пиримидиновым аналогам и уровня уридин-деградирующей активности, и,
следовательно, пригоден ли он для использования в настоящем изобретении
Штаммы, полученные вышеупомянутым образом, проверяют путем культивирования в питательной среде, и штамм, обладающий
способностью продуцировать уридин-5'-монофосфат с более высоким выходом, чем родительский штамм, отбирают и используют в настоящем изобретении. Штаммы, удовлетворяющие требованиям настоящего
изобретения, могут быть также получены широко известными методами генетической рекомбинации.
Примерами штаммов, которые используются в настоящем изобретении, служат штаммы Corynebacterium ammoniagenes LK 40-2 (VKPM B-7811), LK 75-15 (VKGM B-7812) и LK 75-66 (VKPM B-7813). Коринебактерии, которые используются при получении уридин-5'-монофосфата в соответствии с изобретением, имеют те же бактериологические свойства, что и родительский штамм, за исключением более высокой резистентности к пиримидиновому аналогу, ослабленной уридин-деградирующей активности, повышенной способности продуцировать уридин-5'-монофосфата и сниженным образованием побочного продукта урацила. Приведенные номера штаммов соответствуют их депозитным номерам в коллекции Государственного Научно-Исследовательского Института Генетики и Селекции Промышленных Микроорганизмов (VKPM или ВКПМ), образованной согласно Будапештскому соглашению.
Эти штаммы были получены от штамма VKPM B-6307 Corynebacterium ammoniagenes (Заявка на изобретение в РФ 95112366), который является для них родительским.
Ранее штамм VKPM B-6307, продуцирующий уридин-5'-монофосфат, был получен из штамма Corynebacterium ammoniagenes 225-5 (VKPM В-1073), продуцирующего инозин-5'-монофосфат (авт. св. СССР 515783) путем последовательного введения в геном штамма 225-5 серии мутаций: чувствительности к аденину, реверсии к прототрофности по аденину, устойчивости к сульфагуанидину и арсенату.
Как показано в табл. 1, родительский штамм VKPM B-6307 проявляет полную резистентность ко всем испытанным аналогам пиримидинов даже при их высокой концентрации, в отличие от штамма дикого типа Corynebacterium ammoniagenes ATCC 6872, если культивирование проводится на основной агаризованной среде А, представленной в табл.2.
Эта резистентность штамма VKPM В-6307, вероятно, связана с дефицитом нуклеотидов гуанина, присущей всем продуцентам уридин-5 "-монофосфата, полученным как аденин-чувствительные штаммы, поскольку гуаниловые нуклеотиды необходимы для превращения аналогов пиримидина в токсичные нуклеотиды.
Сейчас обнаружено, что штамм VKPM В-6307, не чувствительный к пиримидиновым аналогам в отсутствие гуанина, становится чувствительным к ним после добавки гуанина, гуанозина или гипоксантина (Биотехнология, 1994, 7, стр.5; J. Bacteriol. , 1979, v.138, 3, р. 731). Помимо этого, для повышения чувствительности штамма полезно подавить синтез уридин-5'-монофосфата, который может нейтрализовать ингибирующее действие аналогов. Для этого необходимо добавить к среде аргинин, так как он принимает участие в негативном контроле биосинтеза пиримидинов. Кроме того, добавка к среде аминокислот снижает накопление гуанозинтетрафосфата (ppGpp), который, как известно, подавляет урацилфосфорибозилтрансферазу и поэтому также уменьшает ингибируюший эффект аналогов.
Учитывая все вышеупомянутые моменты, авторы настоящего изобретения разработали метод селекции мутантов, резистентных к аналогам урацила, на основе штамма VKPM В-6307, используя с этой целью специальную среду В, приготовленную путем добавок гуанина (100 мкг/мл), аргинина (500 мкг/мл) и казаминовых кислот (200 мкг/мл) к основной среде А из табл.2, а также дополненную аналогами пиримидинов.
Как показано в табл.3, штамм VKPM В-6307 является резистентным к 5-фторурацилу и 5-фторуридину вплоть до концентрации 1000 мкг/мл при культивировании на основной агаризованной среде А из табл.2. Однако, дополнение этой среды гуанином, аргинином и казаминовыми кислотами (среда В) приводит к утрате резистентности и восстановлению чувствительности штамма VKPM В-6307 к пиримидиновым аналогам.
Родительский штамм VKPM В-6307 расходует почти половину своей потенциальной биосинтетической активности (в молярном выражении) на образование урацила (продукт деградации уридин-5'-монофосфата). Это означает, что ферменты этого штамма, участвующие в последовательной двухэтапной деградации уридин-5' -монофосфата до урацила, проявляют очень высокую активность. Авторы настоящего изобретения обнаружили, что мутанты с ослабленной уридиндеградирующей активностью образуют повышенное количество уридин-5'-монофосфата и сниженное количество побочного продукта урацила.
В конечном счете, пригодный мутант может быть получен путем использования метода слияния протопластов, что может привести к дальнейшему увеличению продукции уридин-5'-монофосфата за счет объединения упомянутых выше полезных мутаций в одном штамме.
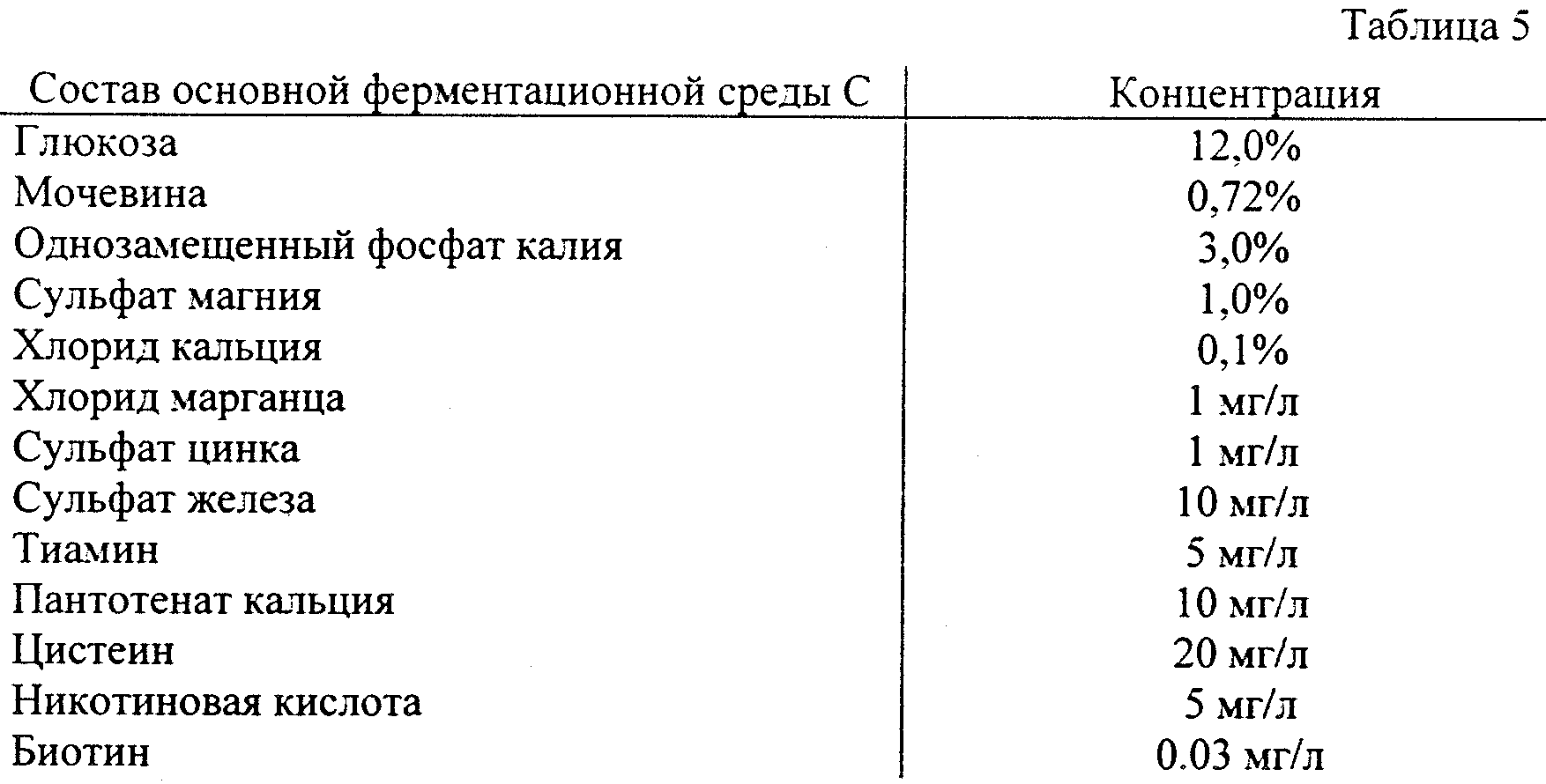
Продуцирующие уридин-5'-монофосфат микроорганизмы, полученные описанным выше методом, культивируются способом, аналогичным обычному культивированию микроорганизмов. Следовательно, в качестве среды может быть использована жидкая среда для культивирования, содержащая источник или источники углерода, источник или источники азота и ионы металлов и при необходимости другие питательные добавки, такие как аминокислоты, производные нуклеиновых кислот и витамины. В качестве источника углерода, к примеру, может быть использована глюкоза, фруктоза, рибоза, мальтоза, манноза, сахароза, крахмал, гидролизат крахмала, меласса и прочее. В качестве источника азота могут быть использованы органические источники азота, такие как пептон, кукурузный экстракт, соевый экстракт, дрожжевой экстракт и мочевина, а также неорганические источники азота, такие как аммонийные соли серной, азотной, хлорной, угольной и других кислот, газообразный аммиак, водный аммоний, либо сами по себе, либо в сочетании. В качестве других питательных добавок используются необходимые для роста бактерий неорганические соли, аминокислоты, витамины и т.д., либо по отдельности, либо в сочетании.
Культивирование обычно осуществляется в аэробных условиях. Предпочтительный рН среды колеблется от 5 до 9. Температура культивирования обычно варьируется в интервале от 25 до 40oС таким образом, чтобы она была приемлема для роста используемого микроорганизма и накопления уридин-5'-монофосфата. Культивирование предпочтительно проводится до того времени, когда накопление уридин-5'-монофосфата по существу достигает максимума. Обычно, длительность культивирования составляет от 3 до 6 сут.
Для выделения и очистки урндин-5' -монофосфата из конечной культуральной жидкости могут быть использованы обычные широко известные методы.
Способ получения уридин-5'-монофосфата, описанный в настоящем изобретении, является выгодным с промышленной точки зрения, поскольку он позволяет накапливать большое количество уридин-5'-монофосфата при незначительном накоплении побочного продукта урацила.
Наилучший способ реализации настоящего изобретения.
Следующие примеры предназначены для более конкретной иллюстрации настоящего изобретения.
Пример 1
Штамм Corynebacterium ammoniagenes VKPM В-6307 был обработан 50 мкг/мл НТГ в течение 20 мин, после чего была проведена процедура ампициллинового
обогащения для получения мутантов, которые не способны эффективно использовать уридин в качестве единственного источника углерода (уридин добавлен вместо глюкозы к жидкой среде А из табл.2). Затем
полученные мутантные клетки высевались на чашки с агаризованной средой В из табл.2, содержащей гуанин (100 мкг/мл), аргинин (500 мкг/мл), казаминовые кислоты (200 мкг/мл) и 100 мкг/мл
5-фторуридина.
Засеянные чашки инкубировались при 30oС в течение 3 дней. Среди появившихся колоний был отобран штамм Corynebacterium ammoniagenes LK 40-2 (VKPM B-7811) как штамм, способный к росту на среде, дополненной 5-фторуридином, на которой родительский штамм не может расти.
Степень резистентности этого штамма к различным пиримидиновым аналогам, а также резистентность родительского штамма VKPM В-6307 представлены в табл. 4.
Штамм Corynebacterium ammoniagenes LK 40-2 был затем посеян в 20 мл основной ферментационной среды С, представленной в табл. 5, содержащейся в колбе емкостью 250 мл. Культивирование проводилось на качалке (220 об/мин) при температуре 34oС в течение 5 дней.
Результаты представлены в табл. 6.
Пример 2
Штамм Corynebacterium ammoniagenes VKPM B-6307 был обработан НТГ, после чего была проведена процедура ампициллинового обогащения тем же
способом, что и в примере 1. После такой обработки клетки были высеяны на среду А (табл.2).
Инкубация проводилась при 34oС в течение 4 дней. Среди появившихся колоний методом реплик был отобран мутантный штамм, который не мог эффективно использовать уридин как единственный источник углерода (т.е. был неспособен к росту на чашках с добавлением 2% уридина вместо глюкозы). Так был получен штамм Corynebacterium ammoniagenes LK 75-15 (VKPM B-7812), неспособный расти на этой среде (уридин-не-утилизирующий мутант, URnu).
Родительский штамм и мутантный штамм (LK 75-15) сравнивались в отношении уридинфосфорилазной активности. Активность уридинфосфорилазы, которая определялась по методу C.E.Carter (J. Am. Chem. Soc., 1951, v.73, p. 1508-1510), представлена в табл. 7.
Уровень резистентности штамма LK 75-15 к различным пиримидиновым аналогам в сравнении с уровнем резистентности штамма В-6307 показан в табл. 8.
Культивирование полученного таким образом штамма Corynebacterium ammoniagenes LK 75-15 в тех же условиях, что были использованы в примере 1, приводит к накоплению 24,0 мг/мл уридин-5'-монофосфата и 2,8 мг/мл урацила (табл. 9).
Пример 3
Штаммы, которые были получены в приведенных выше примерах 1 и 2, Corynebacterium ammoniagenes LK 40-2 (VKPM
B-7811) и LK 75-15 (VKPM B-7812) были использованы в качестве родительских штаммов для получения рекомбинантов путем слияния протопластов. Предварительно были получены генетически маркированные
производные этих штаммов.
Штамм LK 40-2 был высеян на основную среду А (табл. 2), приготовленную с добавкой 100 мкг/мл стрептомицина. Инкубация проводилась при 34oС в течение 4 дней. Среди колоний, спонтанно появившихся на среде, был отобран мутант LK 40-2 Strr, резистентный к стрептомицину.
Штамм LK 75-15 был высеян на основную среду А (табл. 2), приготовленную с добавкой 50 мкг/мл рифампицина. Засеянные чашки инкубировались при 34oС в течение 5 сут. Резистентный к рифампицину мутант LK 75-15 Rifr был отобран среди спонтанно возникающих колоний. Отобранные мутанты, резистентные к стрептомицину или рифампицину, заметно не отличались от родительских штаммов по основным своим свойствам.
Генетически маркированные производные, LK 40-2 Strr и LK 75-15 Rifr, были использованы для слияния протопластов. После получения протопластов проведено их слияние по методу, описанному Лившицем с соавт. (Биологические науки, 1982, 11, с. 9-14).
Все полученные фузанты были проверены на их продуктивность. В результате был отобран штамм Corynebacterium ammoniagenes LK 75-66 (VKPM В-7813) как рекомбинантный штамм, обладающий более высокой продуктивностью и объединяющий различные полезные свойства обоих родительских штаммов.
Штамм LK 75-66 культивировался точно в таких же условиях, что и в примере 1, и при этом накопление уридин-5'-монофосфата достигало 26,0 мг/мл (табл. 10).
Уровень резистентности этого штамма к различным пиримидиновым аналогам в сравнении с уровнем резистентности родительских штаммов LK 40-2 и LK 75-15 представлены в табл. 11.
Пример 4
Штамм Corynebacterium
ammoniagenes LK 75-66 культивировался при встряхивании в посевной среде следующего состава: глюкоза - 2%, дрожжевой экстракт - 2%, пептон - 1%, хлористый натрий - 0,25%. Засеянную среду инкубировали в
течение 1 сут, затем полученный посевной материал был перенесен в лабораторный ферментер емкостью 1,2 л, который содержал 0,7 л ферментационной среды следующего состава: глюкоза - 5%, сульфат аммония
- 0,5%, однозамещенный фосфат калия - 3,0%, сульфат магния - 1,0%, хлорид кальция - 0,02%, сульфат железа - 20 мг/л, сульфат цинка - 2 мг/л, сульфат марганца - 2 мг/л, тиамин - 5 мг/л, пантотенат
кальция - 10 мг/л, никотиновая кислота - 5 мг/л и биотин - 0,03 мг/л. Количество посевного материала составляло 10% от объема среды. В течение периода культивирования для поддержания рН среды на
уровне 7,0 в ферментер автоматически вводили 25% (об./об.) раствор водного аммиака. Чтобы поддержать концентрацию глюкозы в пределах 1-4%, в ферментер подавался насосом 70% раствор глюкозы. Через 120
ч культивирования количество уридин-5'-монофосфата, накопленного штаммом LK 75-66, составляло 28,4 мг/мл, а количество урацила составляло 3,1 мг/мл.
Реферат
Изобретение относится к области биотехнологии, а именно к получению уридин-5'-монофосфата путем ферментации с использованием коринеформных бактерий. Новые штаммы коринеформных бактерий характеризуются резистентностью к ингибированию роста пиримидиновыми аналогами, или дефицитом уридин-деградирующей активности, или объединением указанных свойств. Предложенный способ получения уридин-5'-монофосфата с использованием новых штаммов коринеформных бактерий позволяет повысить выход целевого продукта, а также снизить побочное накопление урацила. 4 с.п. ф-лы, 11 табл.

Комментарии